FCNM_QUIMICA GENERAL I ICQ00018
Anuncio

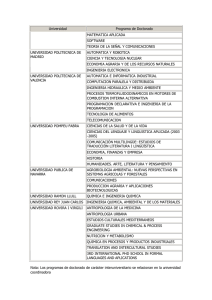
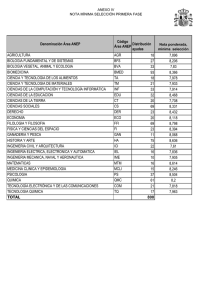
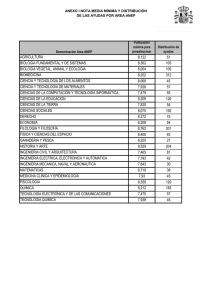
ESCUELA SUPERIOR POLITtCNICA DEL LITORAL Facultad de Ciencias Naturales y Matematicas SYLLABUS DEL CURSO Quimica General I 1. CODIGO Y NUMERO DE CREDITOS CoDIGO NUMERO DE CREDITOS ICQ00018 Teoricos: 3 I Practices: 2 2. DESCRIPCIoN DEL CURSO Los contenidos del curso se imparten en relation a las leyes, principios y conceptos fundamentales de la Quimica General, dando enfoque hacia Ia solucion de los problemas contemporaneos en una estrecha y sana relation con el medio ambience y la bilsqueda de soluciones creativas. 3. PRERREQUISITOS Y CORREQUISITOS PRERREQUISITO APROBACION DE EXAMEN DE EXONERACION 0 CURSO DE NIVELACION DE CARRERA CORREQUISITO 4. TEXTO GU1A Y OTRAS REFERENCIAS REQUERIDAS PARA EL DICTADO DEL CURSO TEXTO GUfA 1. 2. REFERENCIAS 1. Quimica Ia Ciencia Central (2009) Autor: Brown, LeMay, Bursten, Decimo primera Edicion. Editorial Pearson Educacion, Mexico. Qufmica General (2007) Autor: Chang R., Decima Edicion. Editorial MacGraw Hill. Quimica General (1997) Autor: Petrucd R.H., Harwood W.S., Herring F.G., Septima Edicion. Editorial Pearson Educacion, Madrid, Espana. 5. RESULTADOS DE APRENDIZAJE DEL CURSO El estudiante al finalizar el curso estarS en capacidad de: 1. 2. 3. 4. 5. IG1002-3 Reconocer, interpretar y relacionar las leyes, principios y conceptos relacionados a la composicion, estructura, propiedades de Ia materia, los cambios a la que Ia misma este sometida y sus equilibrios pertinentes Ejercer y hacer practicar las normas basicas de seguridad en los Laboratorios y en asuntos productivos y ambientales. Identificar, organizar y analizar criticamente los problemas quimicos relacionados a los contenidos del programa Reconocer, identiflcar y relacionar las variables que influyen en las investigacion de las propiedades, comportamientos, transformaciones y equilibrio de Ia materia Desarrollar habilidades basicas de investigaciOn tanto para su vida profesional y personal. Pagina 1 de 6 SYLLABUS DEL CURSO Quimica General I 6. PROGRAMA DEL CURSO TEMATICA I. IL IG1002-3 NUMERO DE HORAS Estructura Atomica El atomo: teoria antigua y moderna. • • Particulas subatomicas. El electron; los rayos catodicos; la relation elm (Thompson). • • El proton y el neutron. • El n6cleo del atomo (Rutherford). • Los simbolos del atomo; ntimero atomic° (protones) y nOmero de masa (nucleones). Isotopos e isobaros. El espectrografo de masas. • Pesos atornicos: la unidad de masa atOmica (u.m.a.) y el carbono 12. • Pesos de los nuclidos y pesos de los elementos. • La radiation electromagnetica y la luz visible. • • Teoria de los cuantos de luz o fotones (Planck). Espectros de raya de los elementos (espectros discontinuos). • • Modelo de Bohr para el atomo de hidrOgeno. • Teoria de Bohr en relation con otros atomos. Naturaleza dual del electron (particulas y onda). • La ecuaciOn de Broglie y el principio de incertidumbre de Heisenberg. • La ecuacion de Schrodinger. • • N6meros cuanticos. • El principio de exclusion de Pauli. Configuration de electrones en el atomo. • La regla de maxima multiplicidad de Hund. • Momento magnetic°, paramagnetismo, diamagnetismo y • ferromagnetismo. 3 Ley Perindica • La moderna ley periodica y el n6mero atomic°. La estructura electronica de los atomos y la ley periodica. • • La table periodica. • Metales y no metales. • Radio atomic°. • Radio ionic°. • Potential de ionization. • Afinidad electronica. • Electronegatividad. • La valencia. Reglas del octeto. 3 Enlace quimico y geometria molecular La electronegatividad y el enlace. • • El enlace ionic°. • El enlace covalente. • Las estructuras Lewis (formulas de electron, punto y linea). • El enlace covalente coordinado.- El enlace covalente multiple. • Polaridad del enlace y el porcentaje del caracter ionic° de un enlace • Propiedades de compuestos ionicos y covalentes. • Resonancia. • Repulsion electrostatica. • Geometria molecular y polaridad de as moleculas. • Teoria del enlace.- Hibridacion y geometria molecular.-Polaridad de las moleculas. • Teoria de los orbitales moleculares y su grado relativo de energia (diagrama de energia). • Notation de estructuras electrOnicas (segon orden aufbau y desviaciones) iones y moleculas de los dos primeros periodos y su magnetismo. • El enlace hidrogeno (puente de hidrogeno).- Otras interacciones de especie quimicas. 3 Pagina 2 de 6 SYLLABUS DEL CURSO Quimica General I IV. Ecuaciones quimicas y relaciones cuantitativas (Estequiometria) Molecula, formula, peso molecular, peso formula. • El n6mero de Avogadro y el concepto de mol. • La ecuacion quimica: los simbolos usados. • Estequiometria (cuantificacion en reacciones quimicas) • Reacciones de oxido-reduccion: Su naturaleza (agente oxidante y • agente reductor). N6mero de oxidacion (reglas). • Ajuste de ecuaciones Redox. Metodo de namero de oxidacion. Metodo • de ion — electron (medias reacciones) en medio acido y en medio basic°. El equivalente gramo y su aplicacion en Estequiometria. • V. Liquidos viscosidad, tension superficial, accion capilar. El estado • Diagrama de fases: reglas de las fases, condiciones criticas. • La evaporation y la presiOn de vapor en estado de equilibrio. • Cambios de estado y comparacion de los tres estados de la materia. • Los solidos no cristalinos o liquidos inmoviles. • VI. S6lidos Naturaleza del estado solido. Propiedades de los solidos. • An6lisis por difraccion de rayos X (ecuacion de Bragg). • Conceptos estructurales de los solidos. • Red cristalina. La celda unitaria. • • Cristales ctibicos. Tipos de solid° cristalinos. Tipos covalentes (diamante). • Cristales ionicos. • Energia de la red cristalina. ado de Born — Haber • 3 3 3 VIL Soluciones y sus propiedades Tipos de soluciones: gaseosas, liquidas y solidas • Naturaleza de las soluciones: solvente y soluto; soluciones • moleculares, soluciones ionicas, dispersiones coloidales y las suspensiones. Clases de soluciones: saturadas, insaturadas y sobresaturadas; • diluidas y concentradas. Solubilidad: Efecto de Ia temperatura y presion • Formas de expresiOn de Ia concentracion: tanto por ciento, molaridad, • normalidad, molalidad, fraccion-mol, partes por millon (p.p.m): calculos de concentraciones. Metodo de preparacion: Solutions solido-fiquidas. • Metodos de determinacion de la concentracion de soluciones. • Propiedades coligativas; presion de vapor, Osmosis y la ores& • osmotica, descenso del punto de congelacion, elevaciOn del punto de ebullicion. Soluciones de liquidos en liquidos. La ley de Raoult. • Solucion gas liquido. Ley de Henry. • Coloides: tipos de coloides, coagulacion, asociacion coloidal. • 6 VIII. Cinetica quimica La teoria de las colisiones. • La velocidad de reaccion y el mecanismo de Ia reaccion. • Factores que afectan la velocidad de reaccion, concentracion (ley de • action de masas), temperatura, catalizador y naturaleza del reactivo. Reacciones de primer orden. • Reacciones de segundo orden. • Reacciones de orden cero. • Ecuaciones de Arrhenius. • 6 Equilibrio quimico El estado de equilibrio. • La constante de equilibrio. • La constante de equilibrio en terminos de presiones parciales. • Regla para expresar Ia constante de equilibrio. • Desplazamiento del equilibrio de Le Chatelier. • Calculos de Ia constante de equilibrio. • 5 IX. IG1002-3 Pagina 3 de 6 SYLLABUS DEL CURSO Quimica General I X. XI. Acidos y Bases Conceptos de acidos y bases de Arrhenius. • Conceptos de Brdnsted- Lowry de acidos y bases. • Conceptos de Lewis de acidos y bases. • Fuerza relativa de los acidos. • 5 Equilibrio ionic° La ionizacion del agua, pH y pOH. • Los indicadores de color y pH. • El efecto del ion cormln y las soluciones amortiguadoras • (reg uladoras). HidrOlisis de las sales. • El producto de solubilidad y la Kps. • Titulaciones acido-basicas. • 2 COMPONENTE PRACTICO 1. Orientacion, asesoria e induccion general a las sesiones de laboratorio 2. Tecnicas elementales de laboratorio y politicas del curso. Densidad: Determinacion, propiedades intensivas y extensivas 3. DeterminaciOn de las propiedades ffsicas: punto de ebulliciOn y Ia presiOn de vapor 4. Propiedades quimicas de los elementos. (ley periOdica y la tabla periodica) 5. DeterminaciOn de las propiedades ffsicas: la solubilidad de los sOlidos 6. Determinacion de la composicion de un hidrato 7. Descomposicion termica de sales y determinacion Estequiometrica (Estequiometria) 8. Determinacion de la masa de un equivalente-gramo de aluminio 9. Comportamiento de los metales con acidos 10. Determinacion del peso molecular de acido mediante el a-volumetrico (titulacion) 11. Indicadores y ph 12. Efecto del ion comOn, ph y soluciones buffer 13. Evaluacion final de informes de laboratorio 14. Evaluation por presentaciOn y exposicion del proyecto 28 7. CARGA HORARIA: TEORIA/PRACTICA 1. 2. Numero de sesiones de clases por semana: 2 sesiones de clases teoricas / 1 sesion de clase practica Duracian de cada sesion: 2 y 1 hora teoria / 2 horas practica 8. CONTRIBUCION DEL CURSO EN LA FORMACION DEL ESTUDIANTE Adquirir conocimientos basicos de Quimica General para las diferentes carreras de ingenieria. Comprender, entender y aplicar los fundamentos y modelos basicos de Ia Quinnica General en relaciOn a los que rigen los diferentes procesos fundamentales de Ia Ingenieria. FORMACION BASICA X IG1002-3 FORMACION PROFESIONAL Pagina 4 de 6 FORMACION HUMANA SYLLABUS DEL CURSO Quimica General I 9. RELACI6N DE LOS OBJETIVOS DE APRENDIZAJE DEL CURSO CON LOS RESULTADOS DE APRENDIZAJE DE LA CARRERA RESULTADOS DE APRENDIZAJE DE LA CARRERA a) b) c) CONTRIBUCION (ALTA, MEDIA, BMA) Aplicar conocimientos en maternaticas, ciencia e ingenieria RESULTADOS DE APRENDIZAJE DEL CURSO 1, 2, 3 y 4 MEDIA 2, 4 y 5 BAJA 2y5 Presentation de productos, muestras y servicios en el CSECT. Debe trabajar en equipos tanto multidisciplinarios entre pares de la misma materia como de otras materias basicas y trabajar con pares dentro del CSECT. d) Trabajar como un equipo multidisciplinario ALTA 3y5 e) Identificar, formular y resolver problemas de ingenieria BAJA 1, 3 y 4 f) Comprender responsabilidad profesional etica la y g) Comunicarse efectivamente h) Entender el impacto de Ia ingenieria en el contexto social, medio ambiental, economic° y global i) IG1002-3 Comprometerse con aprendizaje continuo el conceptos, Aplicar principios, propiedades, leyes generales a la Cinetica y Equilibrio de Reacciones Quimicas, de Exposiciones experimentos de Laboratorios de Quimica y realizacion de productos y servicios dentro del Concurso de Emprendimiento, Ciencia y Tecnologia (CSECT). ALTA conducir Disefiar, experimentos, analizar e interpreter datos sistemas, Disefiar componentes o procesos restrictions bajo realistas. EL ESTUDIANTE DEBE: BAJA 2y5 MEDIA 5 BAJA 5 ALTA 3 Pagina 5 de 6 Identificar carencias necesidades y los conocer Debe reglamentos y politicas de la reglas de ESPOL, las seguridad en Laboratorios y brindar garantia a sus muestras y productos, servicios en el CSECT. Debe redactor reportes e informes de Laboratorio, presentaciones hacer efectivas en clases y apoyar a sus pares en el proceso de ensefianza, aprendizaje y en la elaboracion de reportes en el CPQG I y en el CSECT. Debe conocer aplicaciones teoricas, experimentales y el de los (uso) alcance de los resultados preparar experimentos; reportes tanto en el CPQG I como en el CSECT Iniciar su navegacion en el aprendizaje de por vida fomentando su formacion autodidacta y como las aprovechar oportunidades que da la elaboracion de reportes del CPQG I y el CSECT para dar pasos hacia Ia investigation por propia iniciativa. SYLLABUS DEL CURSO Quimica General I j) k) I) Conocer contemporaneos temas MEDIA 5 Usar tecnicas, habilidades y herramientas para la prktica de ingenieria ALTA 1y2 Capaddad para liderar y emprender ALTA 5 Informarse de temas actuales relacionados con los temas tratados, especialmente en relacion al medio ambiente y la Ingenieria. Realizar experimentos de Laboratono de Quimica, implementan herramientas para linealizar dates, obtener patrones y determi nar magnitudes Fisicas Quirnicas, incluyendo el CSECT. Sentir el compromiso de aplicar su formacion para buscar maneras de contribuir a la sociedad. CSECT 10. EVALUACION DEL CURSO Actividades de Evaluacion X X X X X Examenes Lecciones Tareas Proyectos Laboratorio/Experimental Participacion en Clase Visitas Otras - X 11. RESPONSABLE DE LA ELABORACION DEL SYLLABUS Y FECHA DE ELABORACION Elaborado por Fecha Mariano Montano Armijos Judio 2013 12. VISADO SECRETARIA ACADEMICA DE LA UNIDAD ACADEMICA NOMBRE: DIRECTOR DE LA SECRETARIA TECNICA ACADEMICA NOMBRE: Sonia Roman Valdez Ing. Marcos Mendoza 61 FIRMA: -T.EVEMA &TEM — 5Lia_ gs1144:t V, _., + 144;I ioII ,,,,;■ , 1TORAL 41 0ilf 1 - . . ..,—,..—... l -7---, 2 V. ...0,...„,.,... c.tru ,. .m. en,d.t..14 Resolucion y Fecha de aprobacion en e Consejo Directive: Dihk.:(;:TC.* it.. LA. SECRETAR A TECNICA ACADEMICA CD — FCNM — 13 — 082 17 de junio de 2013 13. VIGENCIA DEL SYLLABUS RESOLUCION DEL CONSEJO POLITECNICO: FECHA: IG1002-3 4 3- -7 Pagina 6 de 6 il /1 - 30 7 NOV 2013, SYLLABUS DEL CURSO Quimica General I