EQUILIBRIO QUIMICO
Anuncio

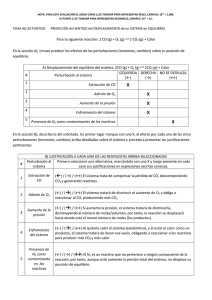
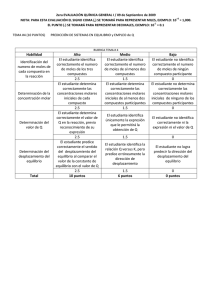
1 EQUILIBRIO QUIMICO Cuando se está en presencia de una reacción química reversible, los reactivos se combinan para formar productos a una determinada velocidad y los productos también se combinan para formar reactivos. Es decir, la reacción toma también el sentido inverso. Este doble sentido en las reacciones que es muy común en química. En estas reacciones se llega a un punto de equilibrio dinámico cuando ambas velocidades se igualan. Equilibrio dinámico se refiere a que las moléculas no cesan en su movimiento, sino que las sustancias siguen combinándose formando tanto productos como reactivos. El equilibrio químico se representa a través de una expresión matemática llamada constante de equilibrio. CONSTANTE DE EQUILIBRIO En una reacción hipotética: a A + b B<——–> c C + d D La constante de equilibrio esta dado por: Kc = [D] d. [C]c **Kc= constante hallada con la masa n [A] a. [B]b a,b,c,d = constantes de equilibrio. Está dado en moles. [ ] = significa concentración molar. Relacionada con la Molaridad. La constante de equilibrio químico es igual: al producto de las concentraciones de los productos elevados a sus coeficientes estequiométricos (c y d) dividido por el producto de las concentraciones de los reactivos elevados a sus coeficientes estequiométricos (a y b). Estos coeficientes son los números que equilibran a las reacciones químicas. La constante no varía, por eso es constante. Solo depende de la temperatura. A cada temperatura distinta habrá valores diferentes de constantes para la misma reacción. Con respecto a las unidades de Ke, estas dependerán de la expresión matemática de cada caso en particular. Según el valor que tenga la K de equilibrio, se tendrá una idea certera de lo completa que puede llegar a ser una reacción. Si la constante K es grande, mucho mayor que 1, K>>1 la reacción tiende a completarse bastante a favor de los productos. Caso contrario sucede si la K<<1 es muy pequeña. Nota: La constante NO tiene unidades. 2 Análisis gráfico: Note que en el eje Y de la variable dependiente que grafica la concentración, es medida en unidad de moles por litro es decir Molaridad. En el tiempo “t=0” cuando inicia la reacción química, no hay moles de productos pero si de reactivos. A medida que transcurre el tiempo, disminuye la concentración molar de reactivos y aumenta la concentración molar de productos. Finalmente se llega al equilibrio (de la raya punteada a la derecha), cuando se estabiliza la cantidad molar de reactivos y productos. Gráfica No.2 La gráfica cuantifica la velocidad de la reacción con la variación del tiempo. (V vs T). Vd : Los reactivos A y B , reacciona a la velocidad d, la cual va disminuyendo en el tiempo hasta formar producto C y alcanza el equilibrio luego de la raya punteada. Vi: El producto C representa la velocidad de reacción de los productos que en un inicio es de ceo “0”, pero que se incrementa en el tiempo. Finalmente ambas velocidades se hacen iguales en el tiempo, dando lugar al equilibrio químico. Gráfica No.3 Una vez alcanzado el equilibrio, subsisten simultáneamente los reactivos A y B con el producto C. 3 Ejemplo No.1: Variación de la masa (n) Figura 1 Figura 2 Figura 1: Erlenmeyer izquierdo: Reactivos. El hidrógeno gaseoso H2 (en bolas blancas), reacciona con el Yodo gaseoso I2 (bolas oscuras), Erlenmeyer derecho: productos se produce ácido yodhídrico, una bola oscura y una blanca, el cual coexiste con los reactivos mencionados. Figura 2: El tetraóxido de di nitrógeno poco coloreado, se descompone dando como producto 2 moles de dióxido de nitrógeno color café. Al aumentar las moles de tetraóxido N2O4, se observa un aumento de los productos indicado por el cambio de color oscuro. PRINCIPIO DE LE CHATELIER: Cuando se habla de equilibrio aplicado a sistemas químicos, siempre se hace hincapié en el Principio de Le Chatelier, que se enuncia así: Cuando una reacción química se somete a una modificación de temperatura, de presión o concentración, el equilibrio se desplaza de manera que compense esa modificación. En otras palabras, si se aumenta la concentración de una de las sustancias en equilibrio, lo que hará es disminuir esa concentración, igual pasa si se aumenta la temperatura o la presión. 4 Temperatura: En el dibujo al aumentar la temperatura de tetraóxido N2O4, se observa un aumento de los productos indicado por el cambio de color oscuro. Otro ejemplo lo tenemos en las reacciones exotérmicas o endotérmicas, las que generan calor o absorben respectivamente. La reacción siempre virará del sitio de mayor al de menor calor, a fin de disminuir esta variable. Si una reacción gaseosa se aumenta el volumen en los productos, invertirá su sentido con la finalidad de disminuir ese volumen. En resumen ANALIZAR EJEMPLOS DE PROBLEMAS: 1. Según la siguiente reacción: A + 2 B <———> C Kc = 45 Si tenemos en un comienzo de reacción 0,2 moles de A, 0,4 moles de B y 0,6 moles de C en un volumen de 4 litros. Averiguar hacia donde se direcciona la reacción. Para esto debemos calcular el cociente de reacción (Ke): Kc = [C] [A] . [B]2 Primero calculamos las molaridades de cada especie: [C] = 0,6moles/4lts. = 0,15M [B] = 0,4moles/4lts. = 0,10M 5 [A] = 0,2moles/4lts- = 0,05M Kc= 0,15 M / [0,05 M . (0,10 M)2] Kc = 300 Concluimos que este valor es muy superior a 1. Por lo tanto la reacción tenderá fuertemente hacia la izquierda. O sea, hacia la formación de los reactivos. 2. Para la siguiente reacción: H2(g) + Br2(g) <———> 2 HBr(g) Kc es 2,18.106 Averiguar las concentraciones molares de las tres especies en el equilibrio si partimos con una [HBr] de 0.4M. Debemos plantear la condición de inicio y de equilibrio para establecer los cambios y calcular las concentraciones de las distintas especies en el equilibrio. Reacción: H2(g) + Br2(g) <———> 2 HBr(g) Inicio 0 + 0 <———-> 0,4M Equilibrio x + x <———-> 0,4 – 2x En el inicio las concentraciones de H2 y de Br2 son cero, porque aún no se han formado nada de estas especies. Pero a medida que transcurre el tiempo se generaran cantidades desconocidas de ambas a expensas de la concentración de HBr. Estas cantidades desconocidas llamadas “x” serán iguales entre si estequiométricamente ya que según la reacción, a partir de 2 moles de HBr se forman un mol de cada especie de la izquierda. Por esta misma razón en el equilibrio a la concentración de HBr habrá que restarle una cantidad “2x”. Ahora con estas nuevas expresiones de equilibrio iremos a la expresión de la K de equilibrio para calcular la cantidad “x”. Kc = [ 0,4 M – 2X ] 2 / [X]2 La resolución de esta ecuación es cuadrática. Despejamos X y desarrollamos el cuadrado de binomio que aparece en el numerador. K.[X]2 = [0,4M – 2X]2 K.[X]2 = (0,4)2 + 2.(0,4).(-2X) + (-2X)2 6 K.[X]2 = 0,16 – 1,6x + 4X2 2,18.106 X2 = 0,16 – 1,6x + 4X2 Reordenamos términos e igualamos a cero quedando una ecuación cuadrática. El termino 4X2 pasa a la izquierda para ser restado a 2,18.106 X2. Obviamente es muy pequeño como para producirle una modificación. Por ende la ecuación quedara: 2,18x106. X2 + 1,6 X – 0,16 = 0 La resolución de esta ecuación de segundo grado nos da: X1 = 2,7.10-4 X2 = – 2,7x10-4 Elegiremos al valor positivo ya que no existen concentraciones negativas. Por lo tanto las concentraciones de las especies son: [Br2] = 2,7.10-4 M [H2] = 2,7.10-4M [HBr] = 0,4M – 2. (2,7.10-4M) [HBr] = 0,399M EVALUACIÓN 1. ¿Qué significa equilibrio dinámico de un sistema químico? 2. ¿Por qué se presenta el equilibrio químico? 3. ¿Cómo se haya la constante Kc de un sistema en equilibrio? 4. ¿Según el principio de Le Chatelier, qué variables hacen que la reacción química se desplace hacia un lado de la ecuación? 5. ¿Por qué si el valor de la constante es “Kc>>1” e puede afirmar que la ecuación tiende hacia los reactivos? 6. Enuncie el principio de Le Chatelier. 7. La ecuación para el siguiente caso es: CO + H2O _________________CO2 + H2 7 a. Analice la tabla y escriba un enunciado para el problema. b. Explique cada una de las filas de la tabla. c. ¿Cómo se halla Kc? d. ¿Cuánto da? e. ¿Hacia dónde se desplaza la reacción? 8. Para cada una de las siguientes ecuaciones químicas escriba la ecuación para hallar Kc. a. El amoníaco en agua se ioniza produciendo ión amonio y ión hidronio NH3(ac) NH4+ + OHKc= 1.86 x 10-5 b. El ácido acético se descompone en equilibrio een ión acetato y ión hidronio. CH3COOH + H2O c. HI CH3COO - I2 + H2 d. Mg(OH)2 9. Utilice el close caption, en Mg+2 + OH- cc y analice el video: https://www.youtube.com/watch?v=7zuUV455zFs + H3O+