ÍNDICE PRESENTACIÓN RESUMEN
Anuncio

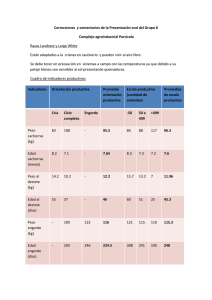
ÍNDICE PRESENTACIÓN RESUMEN - SUMMARY INTRODUCCIÓN MATERIAL Y MÉTODOS • • • Reproducción Cultivo de paralarvas Engorde o Peso Inicial o Crecimiento por sexos o Densidad inicial de carga RESULTADOS Y DISCUSIÓN • • • • Captura y transporte de ejemplares Fase de reproducción Fase de cultivo de paralarvas Fase de engorde de juveniles o Crecimiento en función del peso inicial o Crecimiento en función del sexo o Engorde a distintas densidades CONCLUSIONES SITUACIÓN INDUSTRIAL BIBLIOGRAFÍA AGRADECIMIENTOS 1 PRESENTACIÓN DEL TRABAJO El pulpo común (Octopus vulgaris) es uno de los cefalópodos mejor conocidos y estudiados. Existen más de 500 trabajos científicos referidos a su biología, fisiología, comportamiento, reproducción, crecimiento, etc. Las principales características que presenta el pulpo para ser cultivado son las siguientes: Elevada conversión del alimento, incorporando a su propio peso el 40-60% del alimento ingerido. Rápido crecimiento, alcanzando mayores tallas los machos. Alto contenido proteico en su composición corporal, representando del 70 al 90% del peso seco. Elevada fecundidad, produciendo de 100 a 500 mil huevos por hembra. Elevado precio y amplitud de mercado internacional. Estas características previas representaron un excelente punto de partida para que el IEO de Vigo decidiese en 1995 analizar la viabilidad del cultivo de esta especie como nuevo recurso en acuicultura. Tras las primeras publicaciones del equipo del IEO de Vigo sobre el proceso de engorde (Iglesias et al. 1996), en las que se comprobó que los juveniles de 750 gr. alcanzaban el tamaño comercial de 2.5-3 Kg. tan solo en un periodo de 4 meses, se inician en Galicia las primeras experiencias engorde en jaulas flotantes. Para ello la C. A. Gallega concede 5 permisos de explotación pioneras en España ubicadas en las Rías Bajas gallegas. El cultivo del pulpo adquiere interés a nivel nacional en las diferentes Comunidades Autónomas por un trabajo presentado en el VI Congreso Nacional de Acuicultura celebrado en Cartagena en julio de 1997, por el Instituto Español de Oceanografía (Iglesias et al. 1997). En él destacan los buenos resultados relativos a la obtención de puestas bajo condiciones de cautividad y a las altas tasas de crecimiento obtenidas con ejemplares juveniles confinados en tanques y jaulas (incrementos en peso húmedo de 0.5 a 1 kg. / mes). Posteriormente el equipo del IEO se centra en investigar la fase del cultivo más crítica, el cultivo larvario, puesto que de esa forma se podría completar el ciclo de cultivo a escala industrial. Durante todo este periodo de 1997 a 2000, se intensifican esfuerzos con otras instituciones nacionales (Universidades, CSIC, SGPM, JACUMAR, CYTMAR y Xunta de Galicia) e 2 internacionales (Italia, Grecia, Acción Concertada a la Unión Europea, y Latinoamérica: Perú, Ecuador, Cuba, Chile y México). Este trabajo constituye una recopilación técnica de las investigaciones llevadas a cabo durante el periodo de cinco años (1995-2000), por el equipo de investigación dirigido por el Dr. J.Iglesias del Instituto Español de Oceanografía deVigo. Se ha publicado por los autores Iglesias J., F.J.Sánchez, J.J. Otero y C. Moxica en inglés con el título “Culture of octopus (Octopus vulgaris, Cuvier): Present knowledge, problems and perspectives” en la revista “Cahiers Options Méditerranéennes. Volumen 47, Páginas: 313-321, en el año 2000. Además, se ha presentado como comunicación oral por invitación de los organizadores en los siguientes Congresos, Talleres y Seminarios: • Foro Internacional de la Conservación de Productos de la Pesca de Galicia: “Tradición y Modernidad”. 50 Aniversario de la creación del departamento de ANFACO. Vigo 1999. • Seminar on Mediterranean Marine Aquaculture Finfish Species Diversification. TECAMFAO. Zaragoza 1999. • Workshop on Sustainable Aquaculture, Development and Trade. Ministerio de Pesquería. Lima (Perú). Junio 1999. • I Seminario Internacional de Acuicultura: Proyecciones para el nuevo milenio. FONDEPES. Lima (Perú). Septiembre 1999. • Workshop on new species for aquaculture. Universidade do Algarve. Faro (Portugal). Noviembre 2000. • Ciclo de conferencias del C.I.M.A. (Centro de Investigacións Mariñas). Vilaxoán. Xunta de Galicia. Diciembre 2000. • V Congreso de Ciencias del Mar: MARCUBA2000. La Habana (Cuba). Diciembre 2000. 3 EL CULTIVO DEL PULPO (Octopus vulgaris, Cuvier) J. Iglesias, F.J. Sánchez, J.J. Otero and C. Moxica Instituto Español de Oceanografía Centro Oceanográfico de Vigo. Apartado 1552. 36280 Vigo, España E-mail: [email protected] RESUMEN - En este trabajo se realiza una revisión de los resultados obtenidos a lo largo de cuatro años (1995-1999) de investigación desarrollada en el Instituto Español de Oceanografía de Vigo, sobre la reproducción, el cultivo de paralarvas y el engorde del pulpo. Se analizan las condiciones óptimas del transporte, estabulación, alimentación e inducción a la puesta con temperaturas de 13 a 20ºC y salinidades de 32 a 35o/oo. Se citan también las características biométricas de los racimos y huevos, la fecundidad, el desarrollo embrionario y el proceso de eclosión, así como una descripción de la forma de alimentarse, crecimiento y supervivencia de las paralarvas recién nacidas. Se exponen y analizan los resultados del cultivo larvario realizado con más de 1.5 millones de paralarvas utilizando diferentes tipos de presas: zooplancton de cultivo (Artemia salina), huevos de peces, zooplancton natural capturado en la Ría de Vigo (copépodos, cirrípedos, misidáceos y eufasiáceos) y zoeas de crustáceos comerciales (cangrejo, nécora y camarón) obtenidas a partir de hembras ovadas. Se discuten en base a los resultados obtenidos, las mejores condiciones necesarias para el engorde de juveniles, relativas a la alimentación, ingestión diaria, densidad de estabulación y separación previa por tamaños y sexos, tratando de optimizar los índices de crecimiento y conversión del alimento. Finalmente se describen algunas de las primeras experiencias de cultivo a nivel industrial desarrolladas en Galicia en jaulas flotantes. Palabras clave: Octopus vulgaris, cultivo, reproducción, paralarvas, engorde. SUMMARY - This article reviews the results obtained over a four year period of research (19951999) at the Instituto Español de Oceanografía, Vigo, on the reproduction, rearing of paralarvae and ongrowing of octopus. Optimum conditions for transport, stabling, feeding and induction to spawning with temperatures of 13 to 20ºC are analysed, with salinity levels of 32 to 35o/oo. The biometric characteristics of the strings and eggs, fecundity, embryonic development, hatching and the rearing of 1.5 million of paralarvae are also noted, with a description of the form of feeding, growth and survival of the newly born paralarvae, using different types of prey: reared 4 zooplankton (Artemia salina), fish eggs, wild zooplankton (copepods, cirripedes, mysidaceans and euphausiaceans), and zoeae of commercial crustaceans (crab, swimming crab and prawn) obtained from ovate females. In terms of the results obtained, there is discussion of the best conditions required for ongrowing juveniles, regarding feed, daily ingestion, density of stabling and prior separation according to size and sex, attempting to optimise growth rates and feed conversion. Finally, some of the first experiences on ongrowing at industrial level in Galicia in floating cages are described. Key words: Octopus vulgaris, culture, reproduction, paralarvae, ongrowing. INTRODUCCIÓN El cultivo de los cefalópodos se encuentra aún en fase de desarrollo (Boletzky y Hanlon, 1983). El pulpo común (Octopus vulgaris) reúne unas características que lo sitúan como candidato al cultivo comercial: se adapta fácilmente a la cautividad, tiene unas tasas de crecimiento y reproducción muy altas (Nixon, 1969; Mangold, 1983), acepta alimento congelado, y un alto precio de mercado. No obstante, en estos últimos años solo se han llevado a cabo unos pocos experimentos de cultivo larvario y siempre en pequeños volúmenes, a escala experimental (Itami et al., 1963; Villanueva, 1994). La demanda creciente de pulpo en países asiáticos y mediterráneos movió al Instituto Español de Oceanografía de Vigo y a la Universidad de Santiago de Compostela a realizar, durante el período 1995-1999, una serie de experimentos para evaluar la posibilidad de cultivo de esta especie a escala comercial. Los principales objetivos planteados fueron: conocer la tasa de crecimiento de juveniles, obtener paralarvas a partir de reproductores mantenidos en cautividad y finalmente llevar a cabo el cultivo larvario. En este trabajo se exponen los resultados obtenidos en cada uno de estos experimentos y se analizan los principales problemas asociados al futuro cultivo comercial de la especie. Finalmente se describen las experiencias más recientes de engorde en tanques (Iglesias et al., 1997; Sánchez et al., 1998; Otero et al., 1999 ) y jaulas flotantes (RamaVillar et al., 1997), las cuales han impulsado al sector industrial a iniciar esta fase de cultivo con fines comerciales en aguas gallegas. 5 MATERIAL Y MÉTODOS Reproducción El stock de reproductores estaba formado por machos y hembras en una relación 1:1 estabulados en tanques rectangulares con una capacidad de 5 a 10 m3. La temperatura varió entre 13 y 20ºC, la salinidad entre 32 y 35 o/oo y los tanques se mantuvieron con escasa luz para obtener puestas lo más rápido posible. Para que las hembras pudieran depositar las puestas se diseñaron habitáculos de dos tipos: tubos de PVC (largo = 40 cm, diámetro = 20 cm) y cajas de PVC (60 x 40 x 30 cm) abiertas por uno de sus extremos y con la tapa provista de bisagras con el fin de poder observar su interior. Reproductores Una vez obtenidas las puestas, se contabilizaron el número de racimos, su longitud media y el número de huevos por racimo. También se controló el desarrollo embrionario en determinadas puestas. Finalmente se estimó la fecundidad y tasa de eclosión de los huevos. Con el propósito de obtener puestas con un alto grado de viabilidad, se le suministro una dieta consistente en crustáceos congelados (80%), peces (15%) y moluscos bivalvos (5%). Cultivo de paralarvas A lo largo de los cuatro años del proyecto, el mayor esfuerzo de investigación se dirigió a este objetivo, puesto que es el verdadero cuello de botella que impide, de momento, el cultivo integral de la especie. Las paralarvas son planctónicas las primeras semanas de vida. Al nacer miden 3 mm Puesta Racimos (detalle) Paralarva 6 Paralarva de longitud total y necesitan como dieta organismos vivos que cubran las necesidades nutricionales de esa etapa. En el medio natural, durante esta fase se alimentan de zoeas de crustáceos. Posteriormente, en su nuevo hábitat bentónico, su alimentación es más variada. En los cuatro años de investigación se realizaron diversas experiencias de cultivo con 1.5 millones de paralarvas nacidas en cautividad, utilizando diferentes presas vivas: zooplancton del medio natural (copépodos, zoeas de crustáceos y misidáceos), zooplancton cultivado (Artemia salina), ictioplancton y finalmente zoeas de crustáceos obtenidas en laboratorio a partir de un stock de reproductores de cangrejo (Carcinus maenas), nécora (Necora puber) y camarón (Palaemon serratus). Paralarvas en cultivo Con el fin de realizar las experiencias de cultivo de paralarvas a una escala de futura aplicación industrial, se utilizaron tanques de 2000 l con unas densidades iniciales de siembra de 10 paralarvas por litro y 24 horas de luz. Cada 4 días se realizó una limpieza del fondo del tanque y se renovó la cuarta parte del volumen. La temperatura osciló entre 18 y 20º C. Diariamente se midieron los niveles de oxígeno, nitritos y de amonio. En los tanques de cultivo se introdujeron microalgas (Isochrysis galbana y Tetraselmis suecica), ajustando la concentración a 150.000 cel/ml. Teniendo en cuenta la gran cantidad de presas vivas requeridas diariamente, se decidió utilizar como única dieta Artemia: nauplius (0.5 mm) durante la primera semana y a continuación metanauplius de 1 a 4 mm cultivados a 20ºC durante 7 días con las microalgas citadas. 7 Las paralarvas se sembraron en los tanques de cultivo el mismo de la eclosión (día 0). Periódicamente se registró su peso seco, muestreando 30 paralarvas que, después de pasarse por agua destilada, fueron secadas a 55ºC durante 24 horas y pesadas individualmente en una microbalanza con precisión de 0.1 microgramos. También se realizaron mediciones periódicas de las longitudes del manto y total. Engorde Con el objetivo de conocer las tasas de crecimiento de la especie en relación con su peso inicial, sexo y densidad de cultivo, se realizaron entre 1995 y 1999 las siguientes experiencias: Peso inicial de engorde A lo largo del segundo semestre del año 1995 se capturaron 41 ejemplares en la zona costera próxima al Centro Oceanográfico. Los ejemplares se dividieron en tres grupos de pesos medios: 1340.0 gr (grupo 1), 580.0 gr (grupo 2) y 330.0 gr (grupo 3), con 10, 18 y 13 individuos respectivamente. Se utilizaron tanques de cultivo rectangulares, de 5 y 10 m3, con 1 m de altura de agua y circuito abierto. La temperatura del agua osciló durante todo el periodo de engorde (agosto 1995 a junio 1996) de13 a 19.5º C, la salinidad entre 32 y 35 o/oo y el flujo de agua se mantuvo a 1.2 m3 / h. El alimento se suministró una vez al día, consistiendo en: 80% de crustáceos (Polybius henslowi, Macropipus corrugatus, Carcinus maenas), 15% de peces (Micromesistius poutassou) y 5% de moluscos (Mytilus sp.) congelados. Una vez al mes se realizaron muestreos de peso individual de todos los ejemplares. Crecimiento por sexos El objetivo de esta experiencia fue mejorar el proceso de engorde cultivando a los machos y a las hembras por separado, evitando de esa forma la fertilización de las hembras y su consiguiente mortalidad natural que se produce después de la eclosión de los huevos. Cincuenta y siete pulpos fueron separados por sexos y transferidos a dos tanques de cultivo rectangulares de 8 m3 en unas condiciones similares a las de la experiencia anterior donde fueron mantenidos durante cinco meses (diciembre de 1997 a abril de 1998). Los pesos medios iniciales para machos y hembras fueron 637.0 gr y 657.9 gr, respectivamente. Se realizaron muestreos mensuales para registrar su peso. 8 Tercer brazo derecho o hectocotilo La separación por sexos se hizo mediante la observación y palpación del extremo del tercer brazo derecho. La dieta consistió en crustáceos decápodos congelados. La ración diaria se calculó como un porcentaje de la biomasa del tanque. Las curvas de crecimiento para ambos sexos se sometieron a un test-t de comparación de pendientes. La intensidad de luz fue alta con el objetivo de retrasar la maduración de las hembras y conseguir de esa forma un mayor crecimiento somático. Se mantuvo un fotoperíodo de 12 L:12 D. Densidad inicial de carga Esta experiencia fue llevada a cabo para conocer el efecto de la densidad inicial de carga en la tasa de crecimiento. Para ello se separaron cincuenta y cinco ejemplares en dos lotes y se transfirieron a dos tanques de cultivo de 1600 litros provistos de circuito abierto con un flujo de 0.02 m3/kg/hora. El rango de temperatura en el período estudiado (noviembre de 1998 a marzo de 1999) fue de 13 a 16ºC y el de salinidad de 32 a 35 o/oo. El primer lote (grupo 1), constituido por 37 pulpos, tenía un peso medio de 872.9 gr dando una densidad inicial de cultivo de 20 kg/m3, mientras que el segundo lote (grupo 2) lo formaban 18 pulpos con un peso medio de 883.1 gr y una densidad inicial de cultivo de 10 kg/m3. En las paredes de los tanques se colocaron piezas cilíndricas (diámetro = 25 cm) de material plástico en número suficiente para albergar a todos los ejemplares. El periodo de engorde fue de cuatro meses, durante los cuales se realizaron muestreos quincenales para registrar su peso. También se midió regularmente el nivel de oxígeno disuelto. El alimento, compuesto de cangrejo (Carcinus maenas) y lirio (Micromesistius poutassou) en una proporción 80:20, se suministró una vez al día, pesándose los restos no ingeridos. 9 Tanque de engorde La ración diaria se ajustó al 7% de la biomasa total del tanque. Se calculó el índice de conversión IC = AI / IP, siendo AI el alimento ingerido y IP el incremento en peso, y la tasa de crecimiento especifico G = LnWf –LnWi / (tf-ti) * 100, siendo Wi el peso inicial, Wf el peso final y t el tiempo. Finalmente se compararon los resultados de crecimiento mediante un test-t de comparación de pendientes. Como en la experiencia anterior se mantuvo un fotoperíodo 12 L:12 D y una intensidad de luz alta. RESULTADOS Y DISCUSIÓN Captura y transporte de ejemplares La captura de ejemplares se llevó a cabo sin dificultad contactando directamente con las pesquerías artesanales de diversos puertos de la Ría de Vigo. El transporte se efectuó de dos formas: cuando las densidades de ejemplares fueron bajas (<10 kg/m3) y el tiempo de traslado no superó los 45 minutos, los pulpos se introdujeron en cajas plásticas con agua salada y sin aireación. Para densidades más altas (de hasta 50 kg/m3) se estabularon en tanques plásticos de mayor volumen con aporte de oxígeno. En este caso, los pulpos se introdujeron individualmente en bolsas de malla plástica (foto), evitando de esta forma el ataque entre los ejemplares. 10 Una vez en el laboratorio se realizó la separación por sexos, observando la terminación diferenciada del tercer brazo derecho, que en los machos es más corto y con el extremo redondeado. Otra diferencia externa es la presencia de dos o tres ventosas grandes en el 2º y 3º par de brazos derecho e izquierdo, muy patente sobre todo en los machos adultos. Fase de reproducción El comportamiento reproductor se manifestó por la actividad copulatoria de los machos, que introducen el hectocotilo en la cavidad interna de las hembras. Cuando éstas se disponen a depositar la puesta, se esconden en las guaridas, colocando los racimos en las paredes o techos de los tubos o cajas. El 100% de las hembras estabuladas realizaron la puesta. Es aconsejable separar de los tanques de reproductores a las hembras que ya han depositado los racimos, puesto que están mucho más tranquilas y se puede de esta forma realizar un seguimiento individual de cada puesta. Durante todo el tiempo comprendido entre la puesta y la eclosión de los huevos las hembras dejaron de alimentarse, perdiendo entre 30 y 65% de peso (Fig. 1). Durante ese período no abandonaron su guarida, limpiando y oxigenando los racimos y protegiendo la puesta. % PÉRDIDA 70 60 50 40 30 20 10 0 0 1000 2000 3000 4000 5000 PESO INICIAL(gr) Fig. 1. Pérdida de peso de las hembras de pulpo desde el comienzo de la puesta hasta la eclosión de las paralarvas. 11 Según Mangold (1983), el número de huevos que puede depositar una hembra es de cien mil a quinientos mil. El máximo numero de huevos que se han obtenido en nuestras experiencias de reproducción fue de 605 000 (Iglesias et al., 1997). Las características generales de la reproducción del pulpo observadas en nuestro trabajo, así como los parámetros biométricos de los racimos, huevos y paralarvas se exponen en la Tabla 1. TABLA 1: Características y datos biométricos de la reproducción del pulpo en condiciones de cultivo. Número total de hembras 20 Número total de puestas 20: 12 (en tubos), 8 (en cajas) Peso de las hembras 2.7 - 8.3 kg Período de puesta febrero - noviembre Duración del desarrollo embrionario 80-135 días Número de racimos/ puesta 180-550 Longitud de los racimos 7.5-10.8 cm Número de huevos/racimo 700-1100 Long. del huevo al comienzo del d.e. 2.51 ± 0.05 mm Longitud del huevo al eclosionar 2.90 ± 0.18 mm Longitud total de la paralarva (0 días) 2.95 ± 0.19 mm Longitud del manto 1.49 ± 0.22 mm Peso seco de la paralarva (0 días) 0.46 ± 0.03 µg DESARROLLO EMBRIONARIO Embrión: día 1 Estado XIII Estado XVIII Paralarva eclosionando 12 Fase de cultivo de paralarvas Los mejores resultados se obtuvieron al utilizar como presa durante la primera semana de vida nauplius de Artemia y a continuación metanauplius de 1 a 4 mm cultivados a 20ºC durante una semana con microalgas (Iglesias et al., 1996). En estas condiciones las paralarvas triplicaron su peso seco en un período de 30 días, pasando de 0.46 a 1.40 miligramos con una supervivencia del 10% (Fig. 2). 1,8 PESO SECO (mg) 1,6 1,4 0.0356x y = 0.44e 1,2 2 R = 0.9774 1 0,8 0,6 0,4 0,2 0 0 4 8 12 16 20 24 28 32 EDAD (días) Fig. 2. Crecimiento en peso seco de paralarvas de Octopus vulgaris alimentadas con Artemia durante el primer mes de vida. Al finalizar la experiencia la mortalidad fue del 100%. Los cultivos realizados con otro tipo de dietas vivas tuvieron un 100% de mortalidad a los pocos días (Tabla 2). Itami et al. (1963) y Villanueva (1994), utilizando como presas zoeas de camarón (Palaemon serrifer) y de cangrejo ermitaño (Pagurus prideaux) respectivamente, alcanzan supervivencias del 5% y 0.8% a los dos meses de vida. 13 Tabla 2. Cultivo de paralarvas: descripción de los diferentes experimentos. Exp. Nº. Vol. Tanque (litros) Num. inicial Presa Tipo 1 2 3 4 5 6 7 8 9 10 100 100 100 100 100 100 100 2000 2000 2000 500 500 500 500 500 500 500 20000 20000 20000 rotíferos huevos peces micropellets copépodos Artemia1 camarón2 cangrejo3 1+2+3 Artemia1 Artemia4 Presa: aceptabilidad Edad final (días) Superviv. % Ind/ml 2 1 0.2 0.5 0.5 0.5 0.5 0.5 0.5 + + ++ +++ +++ +++ ++ +++ 4 3 4 4 8 6 8 11 22 32 0 0 0 0 0 0 0 0 1 10 Artemia1 = nauplios camarón2 = zoeas de Palaemon serratus cangrejo3 = zoeas de Carcinus maenas y Necora puber Artemia4 = metanauplios y adultos En experiencias de cultivo de paralarvas realizadas con posterioridad a las descritas en la Tabla 2 (Iglesias et al., 2002) se ha logrado mejorar notablemente los índices de crecimiento y supervivencia, introduciendo unos cambios en la metodología del cultivo. Concretamente, se aumentó la temperatura del medio (22.5ºC) y se utilizó como dieta complementaria de Artemia, zoeas de centolla (Maja squinado), durante las primeras semanas del cultivo larvario. De esta forma, en el año 2001 se logró alcanzar una supervivencia larvaria del 30% y un peso medio de 9.5 mg los 45 días de vida (Figura 3). 14 PESO SECO (mg) 12 0,0745x y = 0,3563e 2 R = 0,986 10 8 6 4 2 0 0 10 20 30 40 50 EDAD (días) Figura 3. Crecimiento en peso seco de paralarvas alimentadas con Artemia y zoeas de centolla. 14 Los supervivientes de estas experiencias se sometieron a un proceso de engorde hasta que alcanzaron a los 8 meses de vida un peso medio de 1.6 kg, lográndose de esta forma, por primera vez en el mundo, obtener pulpos adultos del citado peso, bajo condiciones de cultivo. No obstante, la baja supervivencia obtenida (< 1%) junto a la complejidad de la técnica utilizada, no permiten por el momento trasladar dicha tecnología al sector industrial. Fase de engorde de juveniles Crecimiento en función del peso inicial El objetivo fundamental de la experiencia llevada a cabo con el grupo 1, que poseían el peso inicial de engorde más elevado, fue conocer el tamaño máximo que se podría obtener en cautividad. El resultado fue que alcanzaron un peso medio de 12300 gr en 10 meses de engorde. Los de peso inicial más bajo (grupo 3) necesitaron solo 4 meses para llegar a una talla comercial de 2200 gr. En el grupo intermedio (grupo 2) se obtuvo un peso final de 5400 gr en ocho meses. En la figura 4 se representa el crecimiento de los tres grupos de pulpo cultivados. La ración diaria osciló del 10 % en los más pequeños al 3% del peso total estabulado en los más grandes. Solamente se registro un 3% de mortalidad en los ejemplares más jóvenes del grupo 3, coincidiendo con las primeras semanas de su aclimatación a la cautividad (Iglesias et al., 1997). PESO (Kg) 16 14 12 10 8 6 4 2 0 0 2 4 6 TIEMPO (meses) 8 10 Figura 4. Crecimiento en tres grupos de pulpo con diferente peso medio inicial 15 Crecimiento en función del sexo Las tasas de crecimiento de los machos resultaron ser significativamente más altas (p<0.05) que las de las hembras, alcanzando después de cinco meses un peso medio de 3624.0 gr, mientras que las hembras llegaron a 2780.0 gr (Fig. 5). PESO (g) 7000 6000 5000 4000 3000 2000 1000 0 0 1 2 3 4 5 TIEMPO (meses) Fig. 5. Crecimiento de machos ( diamantes) y hembras (cuadros) de Octopus vulgaris en tanques separados. El crecimiento se ajustó a las siguientes ecuaciones exponenciales: Machos: y = 544.11 e0.3327 x (r2 = 0.75) Hembras: y = 632.47 e0.2704 x (r2 = 0.69) La ración diaria fue del 7% al comienzo de la experiencia, ajustándola mensualmente hasta llegar al 3.5% al final. La tasa de mortalidad durante los primeros cuatro meses fue de 4% en los machos y del 6.7% en las hembras. En el quinto mes dicha tasa aumentó en ambos grupos (13 y 10.7% respectivamente). Analizando estos resultados se concluyó por una parte que la separación por sexos mejoró el rendimiento del cultivo, ya que las hembras no fecundadas siguieron creciendo hasta alcanzar el tamaño comercial. Por otra parte, teniendo en cuenta el incremento de mortalidad observado al final del proceso, se concluyó que para conseguir el máximo rendimiento no conviene alargar el proceso de engorde más allá de 3 kg para los machos y 2.5 kg para las hembras (Sánchez et al., 1998). Aunque no se pudo demostrar experimentalmente, la alta luminosidad empleada podría haber influido en la 16 buena tasa de crecimiento registrada en el tanque de hembras. Este hecho (la influencia de la intensidad de luz en la maduración y puesta) ya ha sido puesto de manifiesto por Mangold (1987). Engorde a distintas densidades En esta experiencia, los pesos finales alcanzados fueron 2205.0 gr y 2746.5 gr para el grupo 1 y 2 respectivamente. Las pendientes resultaron ser significativamente diferentes (p< 0.05), siendo superior el crecimiento en el tanque con menor densidad inicial (Fig. 6). El índice de conversión del alimento fue mejor en el grupo de menor carga inicial. Las densidades finales de carga fueron 45.5 y 29.2 kg/m3 en el grupo 1 y 2. La mortalidad a lo largo de los cuatro meses fue inferior en el grupo 2. Las tasas de crecimiento especifico e índices de conversión se muestran en la Tabla 3. Analizando estos resultados se concluyó que el rendimiento del proceso de engorde mejoró empleando una densidad inicial de carga de 10 kg/m3 (Otero et al., 1999). 3000 PESO (g) 2500 2000 1500 1000 500 0 0 20 40 60 TIEMPO (días) 80 100 120 Figura 6. Crecimiento de dos grupos de pulpos a diferentes densidades iniciales de estabulación: Grupo 1 (cuadros) a 20 kg/m3 y Grupo 2 (triángulos) a 10 kg/m3. 17 Tabla 3. Tasa de crecimiento específico (G), índice de conversión (CI), mortalidad mensual (MM) y densidad de estabulación (DE) de los dos grupos de pulpo. G (% d-1) CI MM (%) DE (kg/m3) 0 1 2 3 4 TOTAL 1.14 0.79 0.71 0.48 0.77 2.5 2.1 2.7 3.7 2.7 5.4 2.9 2.9 0.0 10.8 20.2 26.6 32.5 39.5 45.5 - 0 1 2 3 4 TOTAL 1.47 1.01 0.79 0.57 0.95 1.8 1.9 2.3 3.3 2.2 5.6 0.0 0.0 0.0 5.6 9.9 14.4 19.2 24.8 29.2 - Meses Grupo 1 Grupo 2 Basándonos en las experiencias descritas, podemos concluir que para obtener unos resultados óptimos en el engorde del pulpo se deberán seguir unas recomendaciones, definidas en el apartado siguiente, referidas a la densidad inicial, la dieta, la separación por sexos y tamaños y la naturaleza y número de guaridas. Bajo estas condiciones no se observan problemas importantes de canibalismo ni de competencia por el alimento. Teniendo en cuenta que la alimentación se basa en crustáceos y peces de bajo valor comercial y que partiendo de ejemplares de 750 gr (peso mínimo legal de captura en Galicia) se puede alcanzar el tamaño comercial de 2.5 a 3 kg en un periodo de tres a cuatro meses con una tasa de mortalidad que no supera el 10-15%, podemos concluir que el engorde de esta especie es muy interesante desde el punto de vista de su aplicación industrial. 18 CONCLUSIONES La conclusión general del trabajo presentado se resume diciendo que el pulpo común (Octopus vulgaris) constituye un candidato importante para diversificar el área de la Acuicultura Marina en España. Con respecto al proceso de reproducción y obtención de puestas, se han definido las técnicas de transporte y aclimatación de reproductores, así como la densidad de estabulación, porcentaje de sexos, alimentación y características de las guaridas para la inducción a la maduración sexual. Teniendo en cuenta las condiciones descritas en esta memoria, se puede conseguir un 100% de éxito en la fase de obtención de puestas y paralarvas viables bajo condiciones de cautividad. Con relación al cultivo larvario se ha constatado que es la fase más crítica del cultivo de la especie y que constituye el cuello de botella fundamental que impide el cultivo integral del pulpo a escala industrial. Durante el periodo de investigación de cinco años descrito en la memoria, se han definido una serie de parámetros y desarrollado tecnologías que han supuesto avances importantes dirigidos a solucionar los problemas de mortalidad de las paralarvas en esta fase: Este es el caso del tipo y tamaño de la presa viva adecuada (Artemia adulta y zoeas de crustáceos), metodología de obtención de presas (engorde de Artemia hasta 1-4 mm, zoeas y megalopas) y los parámetros de cultivo más adecuados (temperatura: 22ºC, aireación: moderada, circuito de agua y sistema de cultivo: green water). Como futuro de la investigación en esta fase de cultivo larvario se recomienda por un lado, continuar con la optimización de las técnicas de cultivo larvario utilizando Artemia adulta complementada con zoeas de crustáceos y por otro, en intensificar los esfuerzos en la elaboración de un enriquecedor de Artemia sobre la base de materia prima procedente de zooplancton natural ó zoeas de crustáceos, que cubran los requerimientos nutricionales de las paralarvas del pulpo. Con relación al engorde se han definido las características básicas para realizar el proceso a escala industrial, estableciéndose los siguientes parámetros: Tamaño de arranque (750gr.) Densidad inicial de estabulación (10kg/m3) Separación por tamaños y sexos (aconsejable) Dieta congelada preferente (75% de crustáceos y 25% de peces ó moluscos) 19 Duración del proceso hasta alcanzar el tamaño comercial (4-5 meses) Mortalidad estimada (15-30%) SITUACIÓN INDUSTRIAL A parte de las investigaciones realizadas en el cultivo del pulpo por el I.E.O., el Dr. Manuel Rey Méndez, de la Universidad de Santiago de Compostela y su equipo, llevó a cabo una experiencia de engorde en jaulas flotantes en la Ría de Muros. En las fotos se muestran dos modelos de jaulas utilizadas por la empresa ARRECIFES DEL ATLÁNTICO S.L., en Muxía (A Coruña) Jaula de engorde cilíndrica Jaula de engorde rectangular Utilizando como alimento peces congelados tales como sardina (Sardina pilchardus), jurel (Trachurus trachurus), lirio (Micromesistius poutassou), boga (Boops boops), caballa (Scomber scombrus) y moluscos (Mytilus sp.) obtiene resultados de engorde semejantes con tasas de crecimiento de 0.3 a 0.8 kg /mes, y una mortalidad del 5.7 % (Rama-Villar et al., 1997). En la actualidad el pulpo está considerado como una especie de interés prioritario cara a su potenciación en España dentro del área de la acuicultura, existiendo un gran interés en varias Comunidades Autónomas para desarrollar proyectos de engorde, tanto en estructuras flotantes como en tanques. Particularmente, en Galicia ya existen varias empresas que realizan el engorde de pulpo en jaulas flotantes (Tabla 4) . 20 El esquema general de explotación de una empresa de las que están en funcionamiento consiste en jaulas cilíndricas o cuadradas con guaridas individuales (en las paredes o en el centro) con capacidad para 150 pulpos. Estas jaulas pueden ser unidades individuales con sistema de flotación propio o disponerse en una plataforma flotante común. El proceso de engorde tiene una duración de 4 meses y se pueden realizar durante el año tres ciclos de engorde hasta tamaño comercial (2.5 3 kg) por lo que una empresa con 25 jaulas puede engordar unos 11 000 pulpos al año. En consecuencia, en esta fase inicial de desarrollo industrial, la producción total en Galicia (NW de España) es de aproximadamente 50 Tm y el precio medio de mercado es de 6 dólares/kilo. Tabla 4.- Concesiones para engorde de pulpo (1999)1. Empresa Polígono de ubicación Modalidad de cultivo autorizada Producción máxima autor. (Tm/año) Ameixa de Carril, S.A. Cambados-A 2 bateas con jaulas 90 Arrecifes del Atlántico, S.L. Camariñas-A 50 jaulas independientes 45 Asociación profesional de naseiros “Samertolomeu” Cangas-C 1 vivero con 10 jaulas 17 Blanco Míguez, Mª Begoña Grove-C 1 batea con 63 jaulas 55 Marfrío Marín, S.A. Cangas-B 3 plataformas con jaulas 68 Noia-A 1 vivero para investigación No destinado a producción Universidade de Santiago de Compostela 1 Datos suministrados por la Xunta de Galicia La producción global aproximada durante los años 1997, 1998 y 1999 en estos sistemas a flote fue de 12, 32.3 y 34 toneladas respectivamente, lo cual, respecto a las 275 toneladas anuales autorizadas, pone de manifiesto que todavía es una actividad incipiente. Respecto a las concesiones para instalaciones terrestres, diremos que una de ellas, "Granxa Marina Nastos, S.L.", se encuentra en Muro (Porto do Son) y dispone de una capacidad de producción anual autorizada de 40 Tm, la otra, situada en Aguiño (Ribeira), actualmente está tramitando su expediente de caducidad. 21 BIBLIOGRAFÍA Boletzky, S. and Hanlon, R.T. (1983). A review of the laboratory maintenance, rearing and culture of cephalopod molluscs. Mem. Nat. Mus. Vic., 44: 147-187. Iglesias, J., Sánchez, F.J. and Otero, J.J. (1996). The octopus (Octopus vulgaris Cuvier): A candidate for aquaculture?. ICES C.M. 1996/F:10. Iglesias, J., Sánchez, F.J. and Otero, J.J. (1997). Primeras experiencias sobre el cultivo integral del pulpo (Octopus vulgaris) en el Instituto Español de Oceanografía. In Actas del VI Cong. Nac. de Acuicultura, Cartagena, 1997, Costa, J., Abellán, E., García, B., Ortega, A. and Zamora, S. (eds). ISBN: 84-491-0323-1, pp. 221-226. Iglesias, J., Otero, J.J., Moxica, C. and Sánchez, F.J. (2002). Paralarvae culture of octopus (Octopus vulgaris Cuvier) using Artemia and zoeas, and first data on juvenile growth up to eight months of age. European Aquaculture Society, Special Publication No. 32: 268-269. Itami, K., Izawa, Y., Maeda, S. and Nakay, K. (1963). Notes on the laboratory culture of octopus larvae. Bull. Jpn. Soc. Fish., 29: 514-520. Mangold, K. (1983). Octopus vulgaris. In Cephalopod life cycles. Vol. I. P.R. Boyle (ed.). Academic Press, London, pp. 335-364. Mangold, K. (1987). Reproduction. In Cephalopod life cycles. Vol. II. P.R. Boyle (ed.). Academic Press, London, pp. 157-200. Nixon, M. (1969). The lifespan of Octopus vulgaris. Proc. Malac. Soc. Lond., 38: 529-540. Otero, J.J., Moxica, C., Sánchez, F.J. and Iglesias, J. (1999). Engorde de pulpo (Octopus vulgaris Cuvier) a diferentes densidades de estabulación. In Press. Rama – Villar, A., Faya – Angueira, V., Moxica, C. and Rey – Méndez, M. (1997). Engorde de pulpo (Octopus vulgaris) en batea. In Actas del VI Cong. Nac. de Acuicultura, Cartagena, 1997, 22 Costa, J., Abellán, E., García, B., Ortega, A. and Zamora, S. (eds). ISBN: 84-491-0323-1, pp. 245-250. Sánchez, F.J., Iglesias, J., Moxica, C. and Otero, J.J. (1998). Growth of octopus (Octopus vulgaris) males and females under culture conditions. E.A.S. Special Publication, 26: 244-245. Villanueva, R. (1994). Decapod crab zoeae as food for rearing cephalopod paralarvae. Aquaculture, 128: 143-152. AGRADECIMIENTOS Este trabajo fue desarrollado con una subvención de la CICYT (Comisión interministerial de Ciencia y Tecnología) y del IEO (Instituto Español de Oceanografía), dentro del proyecto CYTMAR95- 1932-02. 23