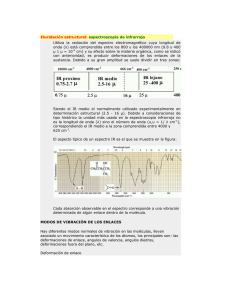
ivan dario castro miller -20655500
Anuncio

MÉTODO DE MEDICIÓN DE GLUCOSA EN SANGRE MEDIANTE LUZ INFRARROJA IVÁN DARÍO CASTRO MILLER UNIVERSIDAD AUTÓNOMA DE OCCIDENTE FACULTAD DE INGENIERÍA DEPARTAMENTO DE AUTOMÁTICA Y ELECTRÓNICA PROGRAMA DE INGENIERÍA BIOMÉDICA SANTIAGO DE CALI 2011 1 MÉTODO DE MEDICIÓN DE GLUCOSA EN SANGRE MEDIANTE LUZ INFRARROJA IVÁN DARÍO CASTRO MILLER Pasantía de Investigación para optar al título de Ingeniero Biomédico Director FARUK FONTHAL RICO Ingeniero Electrónico, Magíster en Tecnología electrónica y Doctor en Ingeniería Electrónica. UNIVERSIDAD AUTÓNOMA DE OCCIDENTE FACULTAD DE INGENIERÍA DEPARTAMENTO DE AUTOMÁTICA Y ELECTRÓNICA PROGRAMA DE INGENIERÍA BIOMÉDICA SANTIAGO DE CALI 2011 2 Nota de aceptación: Aprobado por el Comité de Grado en cumplimiento de los requisitos exigidos por la Universidad Autónoma de Occidente para optar al título de Ingeniero Biomédico FARUK FONTHAL RICO ______________________________ Director Santiago de Cali, 25 de Julio de 2011 3 CONTENIDO RESUMEN 13 INTRODUCCIÓN 14 1. OBJETIVOS 16 1.1. OBJETIVO GENERAL ................................................................................. 16 1.2. OBJETIVOS ESPECÍFICOS ........................................................................ 16 2. ANTECEDENTES 17 3. MARCO TEÓRICO 22 3.1. METABOLISMO DE LA GLUCOSA Y SUS COMPLICACIONES ............... 22 3.2. LA LUZ Y SU INTERACCIÓN CON LA MATERIA ...................................... 27 4. METODOLOGÍA 30 4.1. OPERACIONALIZACION DE VARIABLES ................................................. 30 4.2. ETAPAS DEL PROYECTO .......................................................................... 32 4.3. DISEÑO EXPERIMENTAL ........................................................................... 34 4.3.1. Espectroscopía IR para D-glucosa diluida en agua ultrapura. 34 4.3.2. Espectroscopía IR para D-glucosa en matriz de plasma. 36 4.3.3. Espectroscopía IR para D-glucosa en matriz de sangre entera. 38 4.3.4. Barrido espectroscópico. 40 4.4. PROCESAMIENTO Y RESUMEN DE DATOS ............................................. 43 4.4.1. Suavizado de la señal cruda mediante filtros digitales. 43 4.4.2. Promediado de espectros. 44 3 4.4.3. 4.5. Corrección de la línea base de la señal filtrada. 45 IDENTIFICACIÓN DE REGIONES Y LONGITUDES DE ONDA .................. 47 4.5.1. Criterio de la varianza y Factor de Mérito (FM). 47 4.5.2. Aproximación indirecta, métrica de la Información Mutua (IM). 48 4.5.3. Combinación entre variables individuales y set de variables. 49 4.6. REGRESIÓN Y VALIDACIÓN DE LOS MODELOS..................................... 52 4.6.1. Regresión lineal simple. 52 4.6.2. Regresión de de componentes principales (PCR). 53 4.6.3. Regresión por Mínimos Cuadrados Parciales (PLSR). 53 5. RESULTADOS 54 5.1. ESPECTROSCOPÍA IR EN MUESTRAS DE D-GLUCOSA DILUIDA EN AGUA ULTRAPURA.......................................................................................................... 54 5.1.1. Espectros NIR. 54 5.1.2. Espectros MIR. 56 5.2. ESPECTROSCOPÍA IR EN MUESTRAS DE PLASMA ............................... 58 5.2.1. Espectros NIR. 58 5.2.2. Espectros MIR. 58 5.3. 5.3.1. ESPECTROSCOPÍA IR EN MUESTRAS DE SANGRE ............................... 59 Espectros NIR. 59 5.4. PROCESAMIENTO DE DATOS ................................................................... 60 5.5. MODELOS DE PREDICCIÓN....................................................................... 61 4 5.5.1. Construcción de los modelos. 61 5.5.2. Validación de los modelos. 65 6. CONCLUSIONES 71 7. RECOMENDACIONES 73 BIBLIOGRAFÍA 74 ANEXOS 78 5 LISTA DE CUADROS pág. Cuadro 1. Operacionalización de variables 31 Cuadro 2. Etapas del proyecto 32 Cuadro 3. Etapas del proyecto (Continuación) 33 Cuadro 4. Volúmenes Vi para la preparación de las mezclas DGA. 36 Cuadro 5. Volúmenes Vi para la preparación de las mezclas DGP (plasma) 38 Cuadro 6. Volúmenes Vi para la preparación de las mezclas DGS (sangre) Cuadro 7. Parámetros a configurar para el barrido espectroscópico 40 41 Cuadro 8. Algoritmo de cálculo del factor de mérito de un set de espectros. 48 Cuadro 9. Selección de modelos con mejores resultados para la región MIR 68 Cuadro 10. Selección de modelos con mejores resultados para la región NIR 69 Cuadro 11. Estadísticas Espectro DGA NIR 89 Cuadro 12. Estadísticas Espectro DGA MIR 1 89 Cuadro 13. Estadísticas Espectro DGA MIR 2 90 Cuadro 14. Estadísticas Espectro Plasma MIR Sujeto A 90 6 Cuadro 15. Estadísticas Espectro Plasma MIR Sujeto B 91 Cuadro 16. Estadísticas Espectro Plasma NIR Sujeto A 91 Cuadro 17. Estadísticas Espectro Plasma NIR Sujeto B 92 Cuadro 18. Estadísticas Espectro Sangre MIR Sujeto A 92 Cuadro 19. Estadísticas Espectro Sangre MIR Sujeto B 93 Cuadro 20. Estadísticas Espectro Sangre NIR Sujeto A 93 Cuadro 21. Estadísticas Espectro Sangre NIR Sujeto B 94 7 LISTA DE TABLAS pág. Tabla 1. Niveles diagnósticos de la DM 8 25 LISTA DE FIGURAS pág. Figura 1. Proceso de generación y consumo de glucosa en el cuerpo humano. 23 Figura 2. Interacción de la luz con la materia. 28 Figura 3. Filtrado Savitzky-Golay para espectroscopía. 44 Figura 4. Procedimiento para el ranking de variables utilizando la Información Mutua. 50 Figura 5. Procedimiento para la selección de variables utilizando la Información Mutua. 51 Figura 6. Espectros de referencia de muestras de agua pura en la región NIR. 55 Figura 7. Espectros de estabilidad en la región NIR. 56 Figura 8. Señales de referencia en la región MIR. 57 Figura 9. Pruebas de estabilidad y alta concentración en la región MIR. 58 Figura 10. Espectros de sangre en la región NIR para diferentes caminos ópticos. 59 Figura 11. Información Mutua para un set de datos en la región NIR. 60 Figura 12. Factor de Mérito para un set de datos en la región NIR. 61 Figura 13. 62 9 Selección de longitudes de onda principales de acuerdo a la Información Mutua. Figura 14. Selección de regiones a partir de las longitudes de onda con mayor Información Mutua. 63 Figura 15. Selección de regiones a partir de las longitudes de onda con mayor Factor de Mérito. 64 Figura 16. Respuesta del modelo de regresión PLS, a partir de regiones de señales de plasma con corrección de modelado lineal LDT. 66 Figura 17. Espectro DGA NIR 78 Figura 18. Espectro DGA MIR 1 79 Figura 19. Espectro DGA MIR 2 80 Figura 20. Espectro Plasma MIR Sujeto A 81 Figura 21. Espectro Plasma MIR Sujeto B 82 Figura 22. Espectro Plasma NIR Sujeto A 83 Figura 23. Espectro Plasma NIR Sujeto B 84 Figura 24. Espectro Sangre MIR Sujeto A 85 Figura 25. Espectro Sangre MIR Sujeto B 86 Figura 26. Espectro Sangre NIR Sujeto A 87 Figura 27. Espectro Sangre NIR Sujeto B 88 Figura 28. Identificación de regiones DGA MIR 95 Figura 29. Identificación de regiones PSM MIR 96 Figura 30. Identificación de regiones SNG MIR 97 Figura 31. Identificación de regiones DGA NIR 98 10 Figura 32. Identificación de regiones PSM NIR 99 Figura 33. Identificación de regiones SNG NIR 100 11 LISTA DE ANEXOS Pag. Anexo A. Espectros filtrados y sin outliers 78 Anexo B. Cuadros de validación de los modelos de predicción 89 Anexo C. Identificación de regiones a partir de modelos con menor RMSECV 95 12 RESUMEN En la actualidad existen más de 40 dispositivos para medición de glucosa de forma portable. Sin embargo, estos son de carácter invasivo, e implican una punción para la extracción de pequeñas muestras de sangre, lo cual además de ser doloroso puede desencadenar infecciones y otras complicaciones de las patologías que involucran este tipo de medida. En la búsqueda de dispositivos menos invasivos, se ha trabajado en el desarrollo de prototipos como el GlucoWatch G2 Biographer, el cual hace uso de principios de iontoforesis reversa, y otros de monitoreo continuo como el Minimed Medtronic y el GluCatch, siendo estos últimos implantados en diferentes áreas del cuerpo. Diferentes estudios han identificado la espectroscopía IR como potencial técnica de medición no invasiva de glucosa. A nivel nacional, los estudios de Vargas y colaboradores han identificado longitudes de onda en las regiones NIR y MIR del espectro que pueden estar relacionadas con la concentración de la molécula. En este documento se presenta un análisis cuantitativo de la medición de glucosa en muestras de diferente complejidad con el fin de identificar las características de procesamiento y regresión óptimas para la medición de glucosa en sangre. Se realizan barridos espectroscópicos de las regiones NIR y MIR, en muestras de Dglucosa en matrices de agua, plasma y sangre entera. Se utilizan técnicas de filtrado y corrección de línea base como procesamiento inicial de los espectros. Para la identificación de longitudes de onda y regiones óptimas, se hace uso de la Información Mutua y el Factor de Mérito; dos índices que permiten estimar la importancia de cada una de las variables de predicción en relación a las concentraciones de las muestras. Mediante la utilización de regresión lineal, regresión de mínimos cuadrados (PLS) y regresión de componentes principales (PCA) se obtienen modelos de calibración. Se calculan los errores cuadráticos medios de calibración (RMSEC), de predicción (RMSEP), y de validación cruzada (RMSECV). Se hace uso de este último para la identificación de los mejores modelos y técnicas, y se identifican las regiones que contienen longitudes de onda comunes para los modelos con menor RMSECV. 13 INTRODUCCIÓN La glucosa es el principal carbohidrato presente en el cuerpo humano; este monosacárido cumple diversas funciones, participa en muchas de las reacciones químicas que se llevan a cabo en el proceso metabólico, y es por lo tanto la principal fuente de energía para los procesos biológicos. La alta importancia de la D-glucosa en el metabolismo, en la salud y vida de los seres humanos, exige que las patologías e irregularidades que la involucren tengan una atención importante por parte de investigaciones biomédicas, con el fin de mejorar la calidad de vida de personas con estas condiciones. Uno de los aspectos importantes radica en conocer los niveles de glucosa en sangre; parámetro principal que indica la disponibilidad de la molécula para su uso en las reacciones y sistemas de producción de proteínas. Las personas con alteraciones de los niveles de glucosa necesitan de una constante medición de los mismos, con el fin de conocer su estado actual, prevenir posibles alteraciones mayores, y realizar un control mediante la ingesta o inyección de medicamentos, suplementos, o simplemente un cambio en la alimentación. Estas alteraciones incluyen diabetes mellitus, hipoglucemia e hiperglucemia, y pueden implicar riesgo coronario e hipertensión arterial. La diabetes mellitus es la patología de mayor cuidado y necesidad de una medición continua de glucosa en sangre, para su control mediante inyección de insulina y una dieta adecuada. Los pacientes que padecen diabetes mellitus, se ven obligados en la actualidad a realizar chequeos periódicos de sus niveles de glucosa en sangre con una periodicidad mínima de entre 3 y 5 veces al día. Esto mediante la utilización de glucómetros convencionales que utilizan una muestra de sangre, para lo cual deben realizar molestas punciones en la yema de los dedos; práctica dolorosa e incómoda que daña los tejidos y aumenta los riesgos de infección en estas personas. Esta problemática de la utilización de técnicas invasivas junto con la necesidad de la obtención de estas mediciones en personas con alteraciones en glicemia, han llevado a realizar estudios acerca de diferentes técnicas para mediciones no invasivas, indoloras, cómodas y prácticas para el usuario. 14 En la actualidad, la más aceptada científicamente es la espectroscopia, que analiza la absorción de la luz por las moléculas, y busca predecir compuestos de la solución analizada. La viabilidad de esta técnica parte de las características de los enlaces de la molécula, los cuales responden a las vibraciones de longitudes de onda específicas en el espectro IR. Esta técnica óptica ha sido ampliamente estudiada con el fin de determinar la respuesta de la D-glucosa a diferentes emisiones en el espectro electromagnético, obteniendo como conclusión la posibilidad de mejorar este tipo de métodos para su aplicación clínica. Sin embargo, las investigaciones discrepan en el protocolo técnico a ser utilizado, y en la región del espectro infrarrojo más adecuada. Se identifican longitudes de onda diferentes para obtener una respuesta significativa que pueda indicar los niveles de glucosa en sangre, y procedimientos que tienen variaciones significativas para aplicaciones prácticas de una medición no invasiva. Estas diferencias técnicas y metodológicas entre los resultados de las diferentes investigaciones no han permitido el desarrollo de un dispositivo completamente no invasivo mediante técnicas de espectrofotometría en la región infrarroja. Esto hace necesario llevar a cabo estudios in-vitro que incluyan diferentes técnicas de procesamiento de señales, para que una vez establecidas las características del sistema de medida se realicen pruebas similares utilizando potenciales interferentes, y pruebas in-vivo en sujetos sanos y con diabetes mellitus. La presente investigación determina algunas características para un método de medición mediante técnicas ópticas que utilicen luz infrarroja, lo cual permitirá el posterior diseño y construcción de dispositivos que lo utilicen. Esto con el fin de iniciar pruebas que proporcionen herramientas para un diseño más confiable que permita una lectura de los niveles de glucosa en sangre sin necesidad de la extracción de una muestra. Los resultados de esta investigación serán un aporte a los estudios realizados hasta ahora a cerca de las longitudes de onda óptimas a ser utilizadas en el infrarrojo y el protocolo utilizado para obtener mediciones de este tipo. De esta forma se aclararán aspectos necesarios y se brindarán herramientas útiles que serán utilizadas por investigadores que decidan trabajar en el campo del diseño de dispositivos de medición de ésta molécula en la sangre humana de forma no invasiva. 15 1. OBJETIVOS 1.1. OBJETIVO GENERAL Determinar las características de un método que permita la medición de glucosa en sangre mediante luz infrarroja y que pueda ser utilizado en posteriores investigaciones orientadas hacia el diseño de dispositivos no invasivos. 1.2. OBJETIVOS ESPECÍFICOS • Realizar una revisión bibliográfica de los estudios de métodos no invasivos basados en Infrarrojo Medio (MIR), e infrarrojo cercano (NIR) para la determinación de glucosa en sangre. • Diseñar el protocolo experimental para estructurar los modelos de calibración, y la metodología de validación a utilizar. • Construir modelos de calibración a partir de la selección de las longitudes de onda óptimas dentro del espectro infrarrojo para la medición de glucosa en sangre. • Validar los modelos de calibración e identificar las características del método óptico optimo para la medición no invasiva de glucosa. 16 2. ANTECEDENTES Los esfuerzos científicos para la medición de glucosa en sangre de los pacientes con diabetes mellitus permitieron el desarrollo de sensores y dispositivos de medición que fueron mejorados hasta llegar a los equipos portables que se comercializan en la actualidad. Inicialmente las mediciones se realizaban mediante reacciones químicas con la orina, la cual es una medida viable, pero no sustituye las medidas en sangre debido a sus numerosas limitaciones. Mediciones más acertadas se realizaban a partir de bandas colorimétricas que cambiaban de tonalidad al contacto con la sangre. Sin embargo, estas requerían de equipos adicionales de detección de color que hacían el proceso más largo y no permitían la portabilidad de los sistemas de medida. El desarrollo de biosensores entre 1956 y 1975 permitió realizar mediciones a partir de la oxidación de la glucosa. Éste método consiste en la utilización de una muestra de sangre, para que la molécula sea oxidada y el peróxido de hidrógeno producido en la reacción sea medido de forma amperométrica. En la actualidad existen más de 40 dispositivos invasivos para medición de glucosa de forma portable, comercializados en su mayoría por 4 laboratorios. Estos equipos tienen variaciones orientadas hacia la practicidad de las mediciones y la comodidad de los pacientes; pero se basan en métodos electroquímicos muy similares que fueron inspirados por el desarrollo de los primeros biosensores. Las investigaciones para mejorar la calidad de vida de las personas que sufren de diabetes mellitus, han llevado al desarrollo y comercialización de dispositivos integrados, que incluyen la lanceta de punción y las tiras de análisis en el mismo equipo portable. Esto permite una punción que no alcanza los nervios del dedo, y evita la manipulación de accesorios adicionales presentes en la mayoría de las versiones comerciales, realizando toda la operación mediante un botón. Otros desarrollos más avanzados han iniciado la construcción de prototipos mínimamente invasivos, como el GlucoWatch G2 Biographer. Este dispositivo en forma reloj utiliza principios de iontoforesis reversa para obtener muestras de glucosa del fluido intersticial y realizar una estimación de la glucosa en sangre. 17 Revisiones a cerca del tema indican que a pesar de la aproximación que brinda este dispositivo mínimamente invasivo, necesita de un periodo de precalentamiento de 3 horas y es posible obtener mediciones únicamente cada 20 minutos. De igual forma es necesaria una calibración mediante punción cada 12 horas y presenta algunas fallas debido a cambios de temperatura, sudoración o campos electromagnéticos, generando en ocasiones irritaciones en la piel. Algunos acercamientos a mediciones de monitoreo continuo (CGM) son el Minimed Medtronic y el GluCatch, los cuales son insertados en el área abdominal para medición en el fluido intersticial, y en un vaso sanguíneo para medición directa en sangre respectivamente. El GluCatch hace uso de espectrofotometría para detectar los cambios en el color de un hidrogel fluorescente que responde a las concentraciones de ésta molécula. Por su parte, el Minimed Medtronic utiliza las técnicas electroquímicas estándar de detección de glucosa; sin embargo, realiza un registro continuo durante 3 días sin posibilidad de visualización de los datos, y debe ser calibrado con técnicas estándar después de este periodo. En la actualidad se está desarrollando un sensor para ser implantado basado en mediciones espectroscópicas en la región infrarroja, que serían enviadas a un dispositivo externo y cuya duración de funcionamiento sería de 5 años. Este desarrollo ha identificado algunos inconvenientes en la medición espectroscópica como la intervención de otras sustancias en la medición y la pérdida de energía lumínica en los tejidos. A partir de estos desarrollos, y de las investigaciones adelantadas por los diferentes laboratorios se han realizado múltiples estudios. Estos han indicado que de las diferentes técnicas no invasivas, la más aceptada en el ambiente científico es la espectroscopia. Teniendo en cuenta diferentes conceptos de la interacción entre la luz y la materia, como lo son la absorbancia, la reflectancia, la transmitancia y la dispersión; se han sugerido medidas de estos parámetros. Los tres primeros índices de interacción con una mayor participación en las mediciones, debido a su relación matemática establecida. Se han sugerido mediciones de dispersión de la luz incidente, sin indicar longitudes de onda en particular, y estableciendo mediante pruebas en la región 18 abdominal de pacientes, que el coeficiente de dispersión en las regiones visible y NIR del espectro, tiene una relación inversa con la concentración de glucosa en fluidos extracelulares. Otros estudios han sugerido diversas técnicas y regiones en el espectro infrarrojo para realizar la medición de forma no invasiva. Modelos de calibración y teoría estadística han sido herramientas claves para obtener una predicción con la mayor precisión y exactitud posible. De forma particular se identifican las bandas de absorción de la glucosa en las regiones 2801 nm - 3205 nm (Enlace O-H), 3241 nm - 3311 nm (Enlace C-H), 8130 nm - 10000 nm (Enlace C-O), y 7843 nm - 12500 nm (Enlace C-O-C). Estudios experimentales indican que los mayores picos de absorción de la glucosa se encuentran en la región MIR, y es esta la razón para que sea la región utilizada en análisis clínicos. Sin embargo, también es conocido que ésta región es altamente absorbida por los tejidos y el agua presente en los mismos; lo cual hace que penetre solamente unos pocos micrómetros en el medio biológico, e implica un limitante para las mediciones no invasivas en esta región del espectro. A pesar de esto, algunos de los acercamientos han persistido en la utilización de longitudes de onda en la región MIR, con resultados que indican la existencia de una correlación entre la concentración de glucosa y la señal obtenida. En el año 1999, el Dr. Petibois y colaboradores realizaron una exploración de la región MIR entre 7692 nm y 10928 nm, en la que muestras secas de plasma sanguíneo de 32 sujetos fueron analizadas para validar una calibración realizada a partir de un set de soluciones de glucosa en agua, y otro que incluía adiciones de plasma. Esta investigación permitió identificar que los cambios en la concentración de glucosa de las muestras del set de validación tenían una mayor respuesta en la región que responde al enlace C-O (8130 nm -10000 nm). Además, que la diferencia más alta que no se veía influenciada por otras hexosas que fueron analizadas en esta región se encontraba en el pico de los 9680 nm. Se identificó una alta correlación (0,997) en los modelos de calibración, y al utilizar el pico identificado para la predicción, la validación arrojó una correlación de 0,998. A pesar de los acertados resultados en mediciones en plasma seco, se identifica que las medidas de transmitancia en sangre entera o plasma en estado líquido presentan dificultades en la región MIR debido a la absorción de agua en las matrices con estas características. 19 Por otro lado, estudios en la región NIR han encontrado que a pesar de la disminución de los coeficientes de absorción de la glucosa para estas longitudes de onda, las interferencias que se presentaban en MIR disminuyen considerablemente. Esto debido a una menor absorción por parte de los tejidos y el agua, que permite una mayor penetración del haz incidente y la obtención de mayor información de los niveles de glucosa en sangre. El Dr. Araujo y colaboradores, utilizaron medidas de reflectancia en 3 pacientes realizando un barrido en el espectro NIR para obtener respectivamente el modelo de calibración y validar las predicciones de los niveles de glucosa. En este estudio se obtuvieron resultados satisfactorios, con un coeficiente de correlación de 0,74 y un error cuadrático medio (ECM) de 16 mg/dl. A pesar de que se concluyó que estos resultados aun no permitían mediciones clínicas, el ECM fue inferior a reportes anteriores. Otras aproximaciones como las del Dr. Pulenta y colaboradores sugieren la identificación de una longitud de onda particular para realizar el estudio, considerando el armónico de la vibración C-H a 1688 nm. En este estudio se desarrolla el sistema de emisión y detección, y se evalúan diferentes configuraciones electrónicas que indican que el camino óptico para la medida de la transmitancia puede ser modificado configurando adecuadamente la potencia del sistema de emisión. A pesar de que no se realiza un procedimiento de calibración ni validación respecto a medidas estándar, este estudio se encuentra orientado a identificar las configuraciones óptimas que brinden una mayor precisión en medidas repetitivas, y utiliza una solución simuladora de tejido que se acerca más a lo que sería una medición in vivo. Aproximaciones más avanzadas han realizado el estudio de sus prototipos in vivo con cantidades considerables de sujetos de estudio. El Dr. Gabriely y colaboradores realizaron un análisis en el espectro NIR de la respuesta de transmitancia del dedo de 10 sujetos sanos y 2 con diabetes mellitus, obteniendo unos coeficientes de correlación entre 0,94 y 0,96, con errores entre 2 y 4 mg/dl. En un intento por determinar la influencia de otros componentes sanguíneos en el espectro infrarrojo tanto en las regiones MIR como NIR, se realizó un completo estudio que identificó los picos de absorción de la glucosa en MIR (7153, 7656, 8643, 9049, 9242 y 10070) nm y la hemoglobina en la misma región (7142, 7668 y 9049) nm. Al validar diferentes sets de calibración que consideraban los picos anteriores, se obtuvo un menor error para los modelos obtenidos a partir de la región comprendida entre 8936 nm y 9784 nm, correspondiente a un SEC de 10,8 mg/dl y un r de calibración de 0,9967. 20 Para el análisis en la región NIR, se evidenció una alta correlación entre el espectro obtenido y los niveles de hemoglobina en sangre. Ellos obtuvieron un menor error para la calibración obtenida en la región entre 1390 nm - 1888 nm y 2044 nm -2392 nm, correspondiente a un SEC de 21,6 mg/dl y un r de calibración de 0,9847. La sangre está compuesta en un 40% por hemoglobina; por lo tanto este estudio realizó sets de calibración con diferentes composiciones de esta proteína. Se dividieron muestras para este proceso con niveles bajos, medios y altos de la misma y uno adicional que comprendía el rango completo de su concentración. El resultado tanto para la región NIR como para la MIR, arrojó que el error de predicción aumentaba si el modelo se realizaba con un set de calibración con concentraciones en rangos diferentes que el set de validación. Esto les permitió concluir que el set de calibración debería comprender todo el rango de concentración de la proteína para reducir los errores que variaciones en las muestras de validación pudieran ocasionar. Las diferentes técnicas presentadas por las aproximaciones científicas, indican que es necesario realizar estudios que permitan finalmente identificar las regiones a ser utilizadas en una medición no invasiva, y evaluar muestras de sujetos que permitan tener el rango fisiológico de la glucosa en sangre. De igual forma se indica que los modelos de calibración deben incluir cada vez más variables de confusión, y que las reacciones de la piel con la radiación deben ser ampliamente estudiadas, para garantizar una medida adecuada. El presente proyecto de investigación propone por lo tanto un estudio en las regiones MIR y NIR, que permita evidenciar las características de un método de medición de glucosa en sangre mediante luz infrarroja. Este podrá ser utilizado por los investigadores para iniciar diseños posteriores de dispositivos de medición no invasiva que podrían ser evaluados in vivo. 21 3. MARCO TEÓRICO 3.1. METABOLISMO DE LA GLUCOSA Y SUS COMPLICACIONES La importancia de la D-glucosa presente en el cuerpo humano radica en sus múltiples funciones para el proceso de soporte de la vida. Este monosacárido es la forma de transporte de los carbohidratos que utiliza el cuerpo para la producción de energía, y cumple un papel importante en la síntesis de proteínas y en el metabolismo a nivel general. Debido a su papel fundamental en el metabolismo humano, existe un completo sistema de regulación de la glucosa en sangre que permite a las células de todo el cuerpo recibir esta molécula para generar energía de acuerdo a las necesidades particulares. Existen tres fuentes principales de glucosa en el cuerpo humano: la absorción intestinal (consumo de alimentos), la glicogenolisis, y la gluconeogenesis. Estas últimas dos fuentes son producto de procesos hepáticos, y son denominadas producción endógena de glucosa; la primera de ellas corresponde al rompimiento del glucógeno (forma de almacenamiento de la glucosa). Por su parte, la gluconeogenesis es la producción de glucosa desde el hígado a partir de aminoácidos, glicerol, y algunos residuos de la oxidación de la glucosa como el lactato y el piruvato. Estas fuentes endógenas de glucosa en sangre se encuentran reguladas por la hormona Glucagon, sintetizada por células alfa presentes en el páncreas. El consumo de glucosa por parte de los tejidos se da gracias a los transportadores de esta molécula, los cuales permiten su paso a través de la membrana celular a favor o en contra de un gradiente de concentración, dependiendo del tipo de transportador, según sea dependiente de Na+ (SGLT: En contra del gradiente), o independiente del mismo (GLUT: A favor del gradiente). Los transportadores GLUT, existen en diversas configuraciones, de acuerdo a su funcionamiento particular y ubicación en el cuerpo. Sin embargo, la mayoría de los transportadores de glucosa cambian su habilidad de ingresar glucosa a la célula en respuesta a la concentración de la hormona insulina, secretada por las 22 células beta presentes en el páncreas. Se indica que la insulina tiene efectos opuestos a los del glucagon. El consumo corporal de glucosa comprende en un 55 % la oxidación de la misma por parte de los diferentes tejidos para la producción de energía; un 20 % resulta en glucolisis, y el restante 25 % es utilizado en almacenamiento por el hígado y otros tejidos. Los procesos de consumo como la oxidación y la glucolisis son la fuente principal de lactato y piruvato para el proceso de gluconeogenesis en situaciones de hipoglicemia. En la figura 1 se ilustra el proceso de generación y consumo de esta importante molécula. Figura 1. Proceso de generación y consumo de glucosa en el cuerpo humano Fuente: WEBSTER, Jhon G, RITENOUR E. Russel, TABAKOV Slavik y NG Kwan-Hoong. Handbook of Optical Sensing of Glucose in Fluids and Tissues Los niveles de glucosa en sangre se encuentran regulados alrededor de los 80 mg/dl, pudiendo tener oscilaciones entre 60 mg/dl y 110 mg/dl. Esta regulación se da mediante la secreción de hormonas como la insulina y el glucagon, entre otras como la amilina, epinefrina, cortisol y la hormona del crecimiento. Estudios han demostrado que las altas concentraciones de ácidos grasos bloquean la glucolisis, disminuyen la producción de insulina en respuesta a la glucosa y generan apoptosis celular; por lo tanto aumentan los riesgos de sufrir alteraciones de la glucosa en sangre como la diabetes. Este factor, junto con el efecto que tiene la actividad física en el aumento de los transportadores de 23 glucosa y la sensibilidad de los mismos a la insulina, hace que esta práctica sea una gran ayuda para este sistema de regulación. Este sistema de regulación, responde por lo tanto a las condiciones internas y externas del cuerpo humano, estando también sujeto a la disponibilidad de oxígeno. En condiciones de hipoxia, el consumo de glucosa del musculo esquelético es estimulado, y se aumenta la barrera entre la sangre y el cerebro para el transporte de esta molécula a nivel de las microvesiculas cerebrales. La insulina, hormona encargada de estimular el consumo de glucosa de los tejidos, cumple también la función de promover los procesos de glicogénesis (almacenamiento de glucosa en forma de glicógeno) en el hígado e inhibe la secreción de glucagon por parte de las células alfa del páncreas y la producción endógena de glucosa que se lleva a cabo en el hígado. De igual forma cumple funciones de aumento del flujo sanguíneo, y estimula la producción de Oxido Nitroso en el endotelio, el cual a su vez puede actuar como regulador del consumo de glucosa en el musculo esquelético. La liberación de esta hormona se encuentra directamente relacionada con los niveles de glucosa en sangre, limitando toda producción de la misma para niveles por debajo de 59,5 mg/dl. Existen de igual forma otros factores asociados a su producción, relacionados con compuestos secretados al ingerir alimentos como lo son los péptidos. Los niveles de glucosa en sangre, y su regulación a partir de la secreción de insulina para estimular su transporte a las células de diferentes tejidos en el cuerpo, juegan un papel fundamental en las características y el funcionamiento del endotelio. Este tejido cumple diversas funciones, dentro de las cuales se encuentra un metabolismo activo de la glucosa, y un límite en el transporte desde el espacio vascular al intersticial. Las patologías que involucran variaciones de la glucosa en sangre en el cuerpo humano se deben a alteraciones en el metabolismo y las vías regulatorias y de absorción. La Diabetes Mellitus (DM) es una de las principales patologías con estas características, y cobra gran atención debido a su alta prevalencia e incidencia a nivel mundial. En ella, la secreción de insulina y la sensibilidad de la misma por los transportadores de glucosa se ven disminuidas, lo cual genera condiciones de hiperglucemia. Sin embargo, algunos estudios indican que no solamente las cantidades de esta hormona se ven disminuidas, sino que también 24 se presenta un aumento del glucagón, que inhibe los procesos estimulados por la insulina. La medición de glucosa es uno de los principales diagnósticos de la DM. De acuerdo a lo que se indica en la tabla 1, se identifican niveles que indican una regulación anormal de la glucosa en sangre (IGR) o la existencia de la patología descrita. A pesar de las características generales de esta violación del metabolismo normal de la glucosa, existen dos tipos principales de DM: La tipo 1, o dependiente de insulina; y la tipo 2, o no dependiente de insulina. Tabla 1. Niveles diagnósticos de la DM Fuente: WEBSTER, Jhon G, RITENOUR E. Russel, TABAKOV Slavik y NG KwanHoong. Handbook of Optical Sensing of Glucose in Fluids and Tissues La principal diferencia entre estos tipos de DM radica en que el primero implica una deficiencia en la producción de insulina debido a la muerte de las células beta del páncreas, mientras que el segundo se encuentra relacionado con una resistencia de los mecanismos de transporte de la glucosa a la insulina, en combinación con una disminución de producción de la misma. Esto genera que el tratamiento para cada una de ellas presente algunas diferencias. La DM tipo 1 debe ser tratada estrictamente mediante inyección de insulina de tal forma que esta pueda ser absorbida por la sangre. Por su parte, la DM tipo 2, más abundante entre los pacientes con esta patología, debe tratarse mediante una dieta balanceada y medicamentos orales, considerando la posibilidad de insulina inyectada sin que esta sea una necesidad prioritaria. La falta de tratamiento de pacientes con DM puede generar complicaciones como hipertensión, micro trombos arteriales, y efectos inflamatorios que afectan la regulación vascular. De igual forma pueden desencadenarse retinopatías, catarata, nefropatía diabética, neuropatía, enfermedades vasculares (arterioesclerosis, enfermedad coronaria arterial, etc.), daño en el ADN de las células endoteliales, y disfunciones de carácter inmune. 25 Los tratamientos de la diabetes deben encontrarse acompañados de un monitoreo continuo de los niveles de glucosa en sangre, con el fin de garantizar dosis y estilos de vida adecuados y reducir estas complicaciones. Estas mediciones pueden realizarse en diferentes fluidos biológicos como sangre, plasma, suero, liquido intestinal, fluido cerebroespinal, liquido sinovial, saliva, semen, entre otros. Sin embargo, la medición estandarizada en investigaciones de laboratorio clínico se realiza en plasma sanguíneo, o en su defecto en sangre entera o capilar. A pesar de esto, algunas aproximaciones matemáticas permiten estimar los niveles en sangre a partir de mediciones no tan invasivas como lo son las del fluido intersticial. Existen diferentes exámenes que permiten conocer estos valores, que van desde los de laboratorio hasta los de equipos portables, pasando por los test funcionales que indican las interacciones reales de los componentes del sistema regulatorio en el organismo, como lo son los exámenes de carga de glucosa. A pesar de esto, los exámenes de laboratorio necesitan de muestras de sangre y no permiten una obtención de los resultados de forma práctica y rápida. Por su parte, los equipos portables permiten un fácil uso por parte de los usuarios; sin embargo, siguen siendo técnicas invasivas de medición. Algunos estudios para el desarrollo de medidores mínimamente invasivos y no invasivos de glucosa en sangre han propuesto técnicas de iontoforesis reversa, medición directa en fluido intersticial, medición directa en sangre, y espectroscopia en diferentes regiones del infrarrojo. Sin embargo, se han identificado inconvenientes en estas aproximaciones que no han permitido el desarrollo de un dispositivo confiable de carácter no invasivo. La utilización de espectroscopia infrarroja y espectroscopia fotoacústica han demostrado ser las más aceptadas en el ambiente científico para la medición de glucosa en sangre de forma no invasiva. A pesar de esto, limitantes como variaciones espectrales no relacionadas con la glucosa, y asociadas al flujo sanguíneo, temperatura, dispersión de la luz y absorción por metabolitos no relacionados con la glucosa como el agua, han limitado los desarrollos mediante esta técnica. 26 3.2. LA LUZ Y SU INTERACCIÓN CON LA MATERIA La interacción de luz con la materia, y más específicamente con el tejido biológico y sus componentes es parte fundamental de los estudios que buscan superar los inconvenientes existentes en este tipo de medidas. Los principios de transmitancia, absorbancia y dispersión de la luz al incidir en el medio biológico e interactuar con la totalidad de sus componentes son la base conceptual de este tipo de investigaciones. Las características de la luz incidente en un tejido, que dependen principalmente de la longitud de onda incidente (distancia entre las crestas de la onda electromagnética que conforma la luz), determinan el tipo de interacción de esta con el medio biológico. La transmitancia de una muestra se encuentra determinada por cada una de las interacciones que se presentan: reflexión, absorción y dispersión, las cuales son consideradas como pérdidas de intensidad. Debido a esto, este parámetro es definido como la relación entre las intensidades de luz transmitida e incidente. La reflexión se presenta como la devolución de la radiación electromagnética por la superficie en la que esta incide. Este fenómeno se debe a la transición de los fotones entre dos medios con diferentes índices de refracción, y establece una relación geométrica entre el ángulo de la luz incidente reflejada y refractada (cambio de orientación de la luz que no es reflejada). Sin embargo, esta relación se encuentra establecida únicamente para superficies lisas en las que se presenta reflexión especular como la que se indica en la figura 2, y no para materiales rugosos como lo es la piel humana, en la cual se presenta una reflexión dispersa que devuelve parte de la intensidad en diferentes direcciones de forma aleatoria. 27 Figura 2. Interacción de la luz con la materia Fuente: NIEMZ, Markolf H. Laser-Tissue Interactions: Fundamentals and Applications Es posible identificar las características de reflexión de un tejido mediante dos parámetros principales: la reflectividad, que se determina como la relación entre las amplitudes del campo magnético reflejado e incidente; y la reflectancia, definida como la relación entre la intensidad reflejada e incidente. Ambos parámetros dependen del ángulo de incidencia, la polarización de la radiación, y los índices de refracción del material. La relación entre estos se encuentra determinada mediante las leyes de Fresnel. A pesar de lo que se pueda pensar, las medidas de intensidad reflejada y refractada no son complementarias. En la ecuación 1 se observa que la se define como la cantidad de flujo radiantei (F) por unidad de intensidad ii ángulo sólido (Ω). Esto indica que la energía total es la que se conserva al realizar la suma de los diferentes fenómenos de interacción, y que la reflectancia se encuentra definida por la ecuación 2, como el cuadrado de la reflectividad. (1) i El flujo radiante es la medida de la cantidad de energía electromagnética que emite una fuente por unidad de tiempo, y su unidad de medida es el Watt (W). ii El ángulo solido es el ángulo espacial que abarca un objeto visto desde un punto dado, que se corresponde con la zona del espacio limitada por una superficie cónica. Esta medida indica el tamaño aparente del objeto. Su unidad de medida es el estereorradián (sr). 28 (2) Donde E’ representa la intensidad reflejada, y E representa la intensidad incidente. Por su parte, la absorción se debe a la conversión de la energía lumínica en calor, movimiento, o vibración de las moléculas del material. Esta condición se presenta gracias a una igualdad entre la frecuencia de radiación que se absorbe y la frecuencia de vibración molecular de compuestos específicos en la muestra irradiada. La absorbancia de una muestra al recibir un haz de luz se define como la relación entre la intensidad absorbida y la intensidad incidente. Este parámetro depende de diferentes factores como la temperatura, el grosor de la muestra y la concentración de las diferentes moléculas de la misma. Estos dos últimos se encuentran descritos mediante la ley de Beer-Lambert, y son la razón por la cual las técnicas espectroscópicas son ampliamente utilizadas para la determinación de la concentración de diferentes moléculas en muestras. En contraste al fenómeno de absorción que se hace presente al existir una resonancia entre las frecuencias vibracionales de una molécula y la frecuencia de la onda electromagnética, la dispersión se presenta cuando estas frecuencias no corresponden. Esta diferencia de frecuencias genera una vibración forzada de magnitud menor a la presente en resonancia, lo cual desencadena una disminución de la velocidad de los fotones y un cambio en la orientación de parte de la intensidad incidente. 29 4. METODOLOGÍA 4.1. OPERACIONALIZACIÓN DE VARIABLES Con el fin de identificar las variables a ser tratadas, y conocer su manejo durante la investigación, se realiza la operacionalización de las mismas que se indica en el cuadro 1. Se incluye en este una definición, sus características de clasificación así como otros aspectos de importancia para su obtención y procesamiento. 30 Cuadro 1. Operacionalización de variables Variable Tipo de variable OperacionaUnidad de Valor Fuente Técnica de lización medida recolección Distancia entre • nm Infrarrojo Emisor de Equipo de dos crestas de • cm-1 Cercano (NIR):780 luz (integrado espectroscopia una onda nm–2500 nm a un equipo en IR Factor de electromagné- Conversión: Infrarrojo Medio de espectrotica. Variable (MIR): 2500 nm – scopia.) asociada a la 5000 nm frecuencia de la Infrarrojo Lejano: onda. 50 µm – 1000 µm Longitud de onda Interviniente Atributiva ContinuaCuantitativa Controlada Concentración de glucosa Independiente Atributiva ContinuaCuantitativa Controlada Cantidad proporcional masa/volumen de glucosa en una muestra determinada. Absorbancia Dependiente Atributiva ContinuaCuantitativa No controlada Relación entre la intensidad absorbida y la emitida. % Transmitancia Dependiente Atributiva ContinuaCuantitativa No controlada Relación entre la intensidad transmitida y la emitida. % • mg/dl • mmol/L Conv.: 31 Normal: 60 – 110 mg/dl Muestras analizadas 0 – 100%. 0: Para Cálculos a material partir de la “transparente” luz 100: Para transmitida material “Opaco” y/o reflectada en las muestras. 0 – 100%. 0: Para Luz material “opaco” transmitida a 100: Para través de las material muestras. “transparente” Técnica estándar (Glucómetro). Preparación de muestras con concentración conocida. Equipo de espectroscopia en IR Equipo de espectroscopia en IR 4.2. ETAPAS DEL PROYECTO Cuadro 2. Etapas del proyecto Objetivos Actividades Realizar una revisión bibliográfica de los estudios de métodos no invasivos basados en Infrarrojo Medio (MIR), e 0. Revisión infrarrojo cercano (NIR) para Bibliográfica la determinación de glucosa en sangre. Periodo de Tiempo Resultados Esperados • • 17/01/11 - 12/02/11 • • • • • Diseñar el protocolo experimental para estructurar los modelos de calibración, y 1. Diseño la metodología de validación a experimental utilizar. • 30/01/11 - 12/03/11 • • • • • • • Revisión bibliográfica de los estudios de medición no invasiva de glucosa en sangre mediante métodos ópticos. Identificación de metodologías y análisis de resultados de los estudios que utilizan cada una de las regiones del espectro infrarrojo (NIR y MIR). Estudio de la respuesta teórica de la molécula de glucosa al estímulo del espectro infrarrojo. Evaluación de las debilidades y fortalezas de las mediciones en los espectros MIR y NIR con el fin de tener herramientas de selección para el rango de medición del método a desarrollar. Selección de las regiones del espectro a evaluar a partir de la revisión bibliográfica. Selección de las técnicas de medición a utilizar en el estudio, considerando la región del infrarrojo escogida y las características de la misma. Evaluación de la disponibilidad de equipos con las técnicas seleccionadas en la Universidad Autónoma de Occidente y las instituciones asociadas a la misma. Identificación de las restricciones de la aplicación de espectroscopia infrarroja en la medición no invasiva de glucosa. Propuesta de simuladores de interferencia para utilizar en el estudio espectroscópico. Selección del set de calibración. Determinación de las técnicas de calibración a utilizar. Selección del set de validación. Determinación del protocolo de validación y la técnica patrón a utilizar. Determinación del protocolo para la extracción, almacenamiento, mezcla y transporte de las muestras presentes en los set de calibración y validación. Plasmar el proceso detallado a realizar incluyendo los protocolos, procedimientos, técnicas y características de la fase experimental. 32 Cuadro 3. Etapas del proyecto (Continuación) Objetivos Actividades Periodo de Tiempo Resultados Esperados • Construir modelos de calibración a partir de la selección de las longitudes de onda óptimas 2. Construcción dentro del espectro infrarrojo para de modelos de la medición de glucosa en sangre. calibración • 13/03/11 9/04/11 • • • • Validar los modelos calibración construidos. de 3. Validación de los modelos de calibración 4. Selección de Identificar las características del las características método óptico óptimo para la del método de medición no invasiva de glucosa. medición. • 10/04/11 19/05/11 • • • 20/05/11 20/06/11 • 33 Obtención y preparación de las muestras del set de calibración según lo establecido en el diseño experimental. Obtención de los espectros de las muestras del set de calibración. Selección de diferentes longitudes de onda y/o regiones para la construcción de los modelos de calibración. Construcción de los diferentes modelos de calibración utilizando las técnicas seleccionadas previamente. Obtención de los diferentes modelos de calibración a ser evaluados y validados. Obtención y preparación de las muestras del set de validación según lo establecido en el diseño experimental. Obtención de los espectros de las muestras del set de validación. Medición de los niveles de glucosa de las muestras del set de validación con la técnica patrón establecida. Validación estadística de los modelos de calibración. Análisis de los resultados y selección de las longitudes de onda y/o regiones más acertadas asociadas a los modelos de calibración. Descripción del método de medición de glucosa en sangre propuesto a partir de los resultados del estudio espectroscópico. 4.3. DISEÑO EXPERIMENTAL 4.3.1. Espectroscopia IR para D-glucosa diluida en agua ultra pura. Se considera el rango fisiológico de la concentración de glucosa para el experimento (20 mg/dl -260 mg/dl) de acuerdo a los niveles estándar de hipoglucemia y a los límites de diagnóstico de la Diabetes Mellitus, por lo cual se prepara una mezcla de alta concentración de 400 mg/dl a ser diluida para la obtención de las muestras restantes. De igual forma se obtiene una mezcla con una concentración de 2700 mg/dl con el fin de evidenciar diferencias marcadas a causa de la presencia de la D-glucosa en agua ultra pura. Se obtienen 19 muestras de agua ultra pura con D-glucosa en polvo en las siguientes concentraciones: (0, 20, 40, 60, 70, 80, 90, 100, 110, 120, 140, 160, 180, 200, 220, 240, 260, 400, 2700) mg/dl. Se aclara que en la etapa de procesamiento de datos, las mezclas de 400 mg/dl y 2700 mg/dl se excluyen de los modelos de calibración y son empleadas con el fin de identificar de forma más clara regiones de interés en los espectros seleccionados. Cada una de las muestras se obtiene por triplicado, para un total de 57 tubos de ensayo. • Se rotulan 19 tubos de ensayo de la siguiente manera: (0-d, 20-d, 40-d, 60d, 70-d, 80-d, 90-d, 100-d, 110-d, 120-d, 140-d, 160-d, 180-d, 200-d, 220-d, 240d, 260-d, 400-d, 2700-d) mg/dl, con la variable d indicando el número de dilución (1 a 3). • Se prepara la mezcla de 2700 mg/dl: o Se pesan 2,7 g de D-glucosa utilizando la balanza analítica o Se disuelven los 2,7 g en 70 ml de agua ultra pura en una probeta de 100 ml o Se enrazan los 100 ml con agua ultra pura y se agita por inversión y utilizando el agitador magnético. • Se prepara la mezcla de 400 mg/dl: o Se pesan 4 g de D-glucosa utilizando la balanza analítica o Se disuelven los 4 g en 150 ml de agua ultra pura en el matraz aforado de 250 ml o Se enrazan los 250 ml, se agita por inversión y se vierte la mezcla en un recipiente de 1 L o Se realizan tres mediciones adicionales de 250 ml de agua ultra pura en el matraz aforado y se vierten en el recipiente de 1 L o Se realiza agitado por inversión y con agitador magnético del recipiente de 1 L, obteniendo la mezcla de 400 mg/dl a ser diluida 34 Haciendo uso de la ecuación 3 se calcularon los volúmenes Vi de la solución base con concentración de 400 mg/dl. Estos volúmenes registrados en el cuadro 4 se utilizan en cada preparación en un orden aleatorio obtenido por la función randsample del software MatLab como se indica: (80, 40, 240, 140, 90, 260, 200, 100, 70, 220, 0, 20, 60, 180, 110, 120, 160) mg/dl La dilución se realiza de la siguiente manera: • Utilizando una pipeta volumétrica se vierte el volumen Vi de la solución base en una probeta de 100 ml y se enraza con agua ultra pura hasta completar los 100 ml. • Se agita por inversión, y se llevan de 10 a 15 ml de la mezcla al tubo de ensayo correspondiente. • Se almacenan las muestras a temperatura ambiente. Se repite todo el procedimiento de preparación para obtener las muestras por triplicado, con el fin de analizar espectros de diferentes preparaciones, detectar posibles errores en las diluciones y disminuir el error aleatorio. Las dos preparaciones adicionales se realizan de igual forma, incluyendo la preparación de dos muestras adicionales de solución base a 400 mg/dl y de solución de alta concentración a 2700 mg/dl. Se utiliza el orden aleatorio indicado para las diluciones: Dilución 2: (180, 40, 220, 240, 140, 200, 110, 120, 20, 80, 160, 100, 90, 260, 60, 70, 0) mg/dl Dilución 3: (60, 110, 220, 20, 80, 70, 140, 120, 160, 260, 240, 0, 180, 200, 90, 100, 40) mg/dl (3) 35 Cuadro 4. Volúmenes Vi para la preparación de las mezclas DGA. Concentración Volumen Vi a de las mezclas utilizar de la solución (mg/dl) base de 400 mg/dl (ml) 0 0 20 5 40 10 60 15 70 17.5 80 20 90 22.5 100 25 110 27.5 120 30 140 35 160 40 180 45 200 50 220 55 240 60 260 65 400 100 4.3.2. Espectroscopia IR para D-glucosa en matriz de plasma. La preparación de las muestras por este método pretende utilizar plasma de sangre entera extraída en ayunas, con el fin de tener un bajo nivel de glicemia en la misma y realizar posteriormente el procedimiento de adición estándar. • Se explica el procedimiento y se solicita firmar el consentimiento informado a dos sujetos sanos en ayunas. • Se utiliza el sistema BD Vacutainer con el equipo alado Safety Lock, el adaptador Luer para toma múltiple y los tubos de tapa verde para la extracción de las muestras. • Se registra el tiempo de ayuno de los sujetos. • Se extraen 12 tubos de 10 ml de sangre a cada sujeto sano. 36 • Posteriormente a cada extracción se debe invertir el tubo cinco veces para su mezcla con la heparina que actúa como anticoagulante. • Se realiza medición de la muestra No. 6 dos veces utilizando el glucómetro para medición en sangre venosa. • Cada muestra se lleva a una centrifuga por 10 minutos a 2400rpm para la obtención del plasma. • Se repite la medición de glucosa dos veces con glucómetro en los 2 tubos de ensayo seleccionados (uno para cada sujeto) utilizando únicamente el plasma obtenido, y se registran los resultados. Se consideran los niveles normales de glucosa en sangre entre 60 mg/dl y 110 mg/dl, a ser diluidos para la preparación de las mezclas con una composición de plasma de 80%, se obtienen concentraciones estimadas entre 48 mg/dl y 88 mg/dl. Debido a esto se realizan 10 adiciones aumentando la concentración en 20 mg/dl por vez, llegando una muestra de concentración máxima entre 248 mg/dl y 288 mg/dl. Suponiendo una muestra de plasma inicial con una concentración de 80 mg/dl se obtienen las siguientes muestras para cada sujeto: (64, 84, 104, 124, 144, 164, 184, 204, 224, 244, 264) mg/dl La preparación de las muestras por el método de adición estándar se realiza de la siguiente manera: Nota: Este procedimiento debe realizarse al interior de la cabina de flujo laminar. • Se preparan soluciones base de 400 mg/dl, 800 mg/dl, y 1000 mg/dl mezclando agua ultra pura con 400 mg, 800 mg y 1 g respectivamente en los matraces aforados de 100 ml, enrazando hasta la marca, y etiquetando cada una de las soluciones. • Se etiquetan 26 tubos de ensayo de la siguiente manera: (+0x, +20x, +40x, +60x, +80x, +100x, +120x, +140x, +160x, +180x, +200x, PSMx, H2O-1, H2O-2), reemplazando la x por A o B, para identificar las muestras de uno u otro sujeto • Utilizando la micropipeta se extraen 4 ml de plasma de cada uno de los tubos Vacutainer en los cuales fue centrifugada la muestra de sangre entera, y se vierten en un tubo de ensayo estéril de 15 ml debidamente etiquetado. 37 • De la solución base correspondiente se agrega un volumen Vi al tubo de ensayo de 15 ml dependiendo de la concentración a adicionar. Todo esto de acuerdo al cuadro 5. • Completar 5 ml de volumen en el tubo de ensayo de 15 ml con la cantidad de agua ultra pura indicada en el cuadro 5. • Mezclar la solución cinco veces por inversión. • Llenar los tubos etiquetados como H2O-1 y H2O-2 con agua ultra pura, y los etiquetados como PSMx con 4 ml de plasma puro extraídos de dos tubos vacutainer. • Se almacenan todas las muestras en los tubos de ensayo a una temperatura de 4°C Cuadro 5. Volúmenes Vi para la preparación de las mezclas DGP (plasma). Concentración Concentración Solución Volumen Vi a Volumen a adicionar final estimada Base utilizar de la de agua (mg/dl) (mg/dl) (mg/dl) solución base ultra pura (ml) (ml) 0 20 40 60 80 100 120 140 160 180 200 57 77 97 117 137 157 177 197 217 237 257 400 400 400 400 400 400 800 800 800 800 800 0 0,2 0,4 0,6 0,8 1 0,6 0,7 0,8 0,9 1 1 0,8 0,6 0,4 0,2 0 0,4 0,3 0,2 0,1 0 4.3.3. Espectroscopia IR para D-glucosa en matriz de sangre entera. Se utiliza sangre entera extraída en ayunas para obtener un bajo nivel de glicemia en la misma y realizar la adición estándar. 38 • Se explica el procedimiento y se solicita firmar el consentimiento informado a dos sujetos sanos en ayunas. • Se utiliza el sistema BD Vacutainer con el equipo alado Safety Lock, el adaptador Luer para toma múltiple y los tubos de tapa gris para la extracción de las muestras. • Se registra el tiempo de ayuno de los sujetos. • Se extraen 12 tubos de 6 ml de sangre a cada sujeto sano. • Posteriormente a cada extracción se debe invertir el tubo cinco veces para su mezcla con el Oxalato de Potasio y el Fluoruro de Sodio. • Se realiza medición de la muestra No. 6 dos veces utilizando el glucómetro para medición en sangre venosa. A partir de los niveles normales de glucosa en sangre entre 60 mg/dl y 110 mg/dl, a ser diluidos para la preparación de las mezclas con una composición de sangre de 71,42%, se obtienen concentraciones estimadas entre 42,8 mg/dl y 78,6 mg/dl. Debido a esto se realizan 10 adiciones aumentando la concentración en 20 mg/dl por vez, llegando una muestra de concentración máxima entre 242,8 mg/dl y 278,6 mg/dl. Suponiendo una muestra de sangre inicial con una concentración de 80 mg/dl se obtienen las siguientes muestras: (57, 77, 97, 117, 137, 157, 177, 197, 217, 237, 257) mg/dl La preparación de las muestras por el método de adición estándar se realiza de la siguiente manera: Nota: Este procedimiento debe realizarse al interior de la cabina de flujo laminar. • Se prepara una solución base de 400 mg/dl y otra de 700 mg/dl, mezclando agua ultra pura con 400 mg y 700 mg respectivamente en los matraces aforados de 100 ml enrazando hasta la marca, y etiquetando cada una de las soluciones. • Se etiquetan 26 tubos de ensayo de la siguiente manera: (+0x, +20x, +40x, +60x, +80x, +100x, +120x, +140x, +160x, +180x, +200x, SNGx, H2O-1, H2O-2), reemplazando la x por A o B, para identificar las muestras de uno u otro sujeto • Utilizando la micropipeta se extraen 5 ml de sangre entera, y se vierten en un tubo de ensayo estéril debidamente etiquetado. • De la solución base correspondiente se agrega un volumen Vi al tubo de ensayo dependiendo de la concentración a adicionar. Todo esto de acuerdo a la tabla 6. • Completar 7 ml de volumen en el tubo de ensayo con la cantidad de agua ultra pura indicada en el cuadro 6. 39 • Mezclar la solución cinco veces por inversión. • Llenar los tubos etiquetados como H2Ox con agua ultra pura, y los etiquetados como SNGx con 6 ml de sangre entera pura. • Se almacenan todas las muestras en los tubos de ensayo a una temperatura de 4°C Cuadro 6. Volúmenes Vi para la preparación de las mezclas DGS (sangre). Concentración Concentración Solución Volumen Vi a Volumen a adicionar final estimada Base (mg/dl) utilizar de la de agua (mg/dl) (mg/dl) solución base ultra pura (ml) (ml) 0 20 40 60 80 100 120 140 160 180 200 57 77 97 117 137 157 177 197 217 237 257 400 400 400 400 400 400 700 700 700 700 700 0 0,35 0,7 1,05 1,4 1,75 1,2 1,4 1,6 1,8 2 2 1,65 1,3 0,95 0,6 0,25 0,8 0,6 0,4 0,2 0 4.3.4. Barrido espectroscópico. La obtención de los espectros de cada una de las muestras preparadas (Set DGA, PSM y SNG) se realiza mediante el espectrofotómetro Shimadzu Prestige IR-21 y la utilización del software IRSolution. Para la utilización del equipo se hace necesario configurar diferentes parámetros. Las características para el procedimiento a realizar se indican en el cuadro 7. Previo al inicio de los registros de cada región, se realiza una prueba de estabilidad que consiste en verificar el adecuado funcionamiento de la fuente de luz y del sistema de recolección mediante la obtención de tres espectros idénticos a la referencia, en los cuales se debe observar como resultado una línea recta horizontal. 40 Cuadro 7. Parámetros a configurar para el barrido espectroscópico Parámetro a configurar Apodización Sensibilidad # barridos Configuración HAPP-GENZEL 4 cm-1 25 Para la obtención de los espectros se debe utilizar un espectro de referencia, el cual puede variar entre el recipiente de medición vacío, o el recipiente con agua ultra pura. Este procedimiento se realiza con el fin de que la señal final obtenida corresponda únicamente a la muestra al interior del recipiente ó a los componentes de la misma diferentes de la referencia. Para cada una de las regiones y técnicas utilizadas se realiza una medición del espectro del accesorio vacío y con agua ultra pura, tomando como referencia el equipo en su estado inicial, con el fin de identificar posibles inconvenientes del sistema utilizado en cada configuración. Posteriormente se utiliza como referencia agua ultra pura y se procede a realizar las mediciones de las diferentes mezclas preparadas. 4.3.4.1. Cercano infrarrojo (NIR). Para la medición en esta región se configura el equipo para trabajar entre 4000 cm-1 y 12000 cm-1, haciendo uso de una placa de CaF2 recubierta en silicio como divisor del haz de luz que emite la lámpara de tungsteno utilizada por el equipo en esta región, y un detector de InGaAs. Se realizan medidas de transmitancia directa utilizando el accesorio “Demountable Liquid Cell” con ventanas de ZnSe, y ajustando el camino óptico con diferentes espaciadores. • Se realizan los 3 registros correspondientes a la prueba de estabilidad. • Se realiza el espectro de referencia como el equipo vacío. • Se ubica el accesorio Demountable Liquid Cell utilizando las ventanas de ZnSe, que permiten trabajar espectros entre 461 cm-1 y 15000 cm-1. Se utiliza un espaciador para un camino óptico inicial de 1 mm, el cual se disminuye en caso de observar saturación de la señal. Disponibles: (0,015; 0,025; 0,050; 0,100; 0,200; 0,500; 1) mm • Se registran los espectros de la celda de líquidos sola y la celda con agua ultra pura. 41 • Para las mediciones PSM y SNG se realiza un tercer espectro de la muestras de plasma puro (PSM) y sangre pura (SNG) para verificar el camino óptico. • Se verifica que la señal no esté saturada, de lo contrario se selecciona un espaciador que brinde un menor camino óptico. • Se realiza el espectro de referencia como la celda con agua ultra pura. • Se ingresan muestras y se obtienen los espectros de cada una de las mezclas en orden aleatorio definido por el software MatLab. • Se almacenan todos los datos en formato txt para su posterior procesamiento en MatLab como se indica: DGA: DGANIRLCxx-D-M. Donde ‘xx’ corresponde a la concentración, ‘D’ al número de dilución correspondiente a las muestras por triplicado, y M el número de medida. PSM: PSMNIRLCxx-M. Donde ‘xx’ corresponde a la concentración adicionad, y M el número de medida. SNG: SNGNIRLCxx-M. Donde ‘xx’ corresponde a la concentración adicionada, y M el número de medida. 4.3.4.2. Medio infrarrojo (MIR). Para la medición en esta región se configura el equipo para trabajar entre 200 cm-1 y 4000 cm-1, haciendo uso de una placa de KBr revestida en Germanio como divisor del haz de luz de la Fuente cerámica refrigerada por aire que el equipo utiliza en esta región, y un detector DLATGS de alta sensibilidad con temperatura controlada. Se realizan medidas utilizando el accesorio ATRMax II con cristal de ZnSe a 45°, ideal en esta región del infrarrojo debido a su poca penetración en la muestra. • Se realizan los 3 registros correspondientes a la prueba de estabilidad. • Se registra un espectro de referencia como el equipo sin ningún accesorio. • Se ubica el accesorio ATRMax II con cristal de ZnSe a 45°, que permite trabajar espectros entre 461 cm-1 y 15000 cm-1. • Se registran los espectros del accesorio ATR II solo y con 750 µl de agua ultra pura. • Para las mediciones PSM y SNG se realiza un tercer espectro de la muestras de plasma puro (PSM) y sangre pura (SNG) para verificar el camino óptico. • Se verifica que la señal no esté saturada. • Se realiza el espectro de referencia como el accesorio ATR II con 750 µl de agua ultra pura. • Se ingresan 750 µl de muestra de cada una de las mezclas y se obtienen los espectros en el orden aleatorio establecido anteriormente. 42 • Se almacenan todos los datos en formato .txt para su posterior procesamiento con el software MatLab como se indica: DGA: DGAMIRATRxxD-M. Donde ‘xx’ corresponde a la concentración, ‘D’ al número de dilución correspondiente a las muestras por triplicado, y M el número de medida. PSM: PSMMIRATRxxD-M. Donde ‘xx’ corresponde a la concentración adicionada, y M el número de medida. SNG: SNGMIRATRxx-M. Donde ‘xx’ corresponde a la concentración adicionada, y M el número de medida. 4.4. PROCESAMIENTO Y RESUMEN DE DATOS 4.4.1. Suavizado de la señal cruda mediante filtros digitales. Con el fin de tener una señal con la menor distorsión posible para la posterior extracción de información analítica, es necesario aplicar una técnica disminución de ruido que permita posteriores análisis estadísticos de una señal con un mayor SNR. Debido a la presencia de picos de alta frecuencia que son de interés, se realizó una selección cuidadosa de los métodos a ser empleados. La función “Smooth” de MatLab permite realizar diferentes configuraciones para el suavizado mediante un filtro de media móvil. Este ofrece 6 métodos diferentes, cada uno con características particulares. El método Savitzky-Golay es comúnmente utilizado en señales de espectroscopía o con información de altas frecuencias, debido a que se conserva la información con estas características. En la figura 3 se evidencia este comportamiento para un filtrado con polinomios de aproximación cuadráticos y cuarticos. Debido a estas consideraciones, éste será el método a utilizar para la reducción de ruido de las señales obtenidas. 43 Figura 3. Filtrado Savitzky-Golay para espectroscopía Fuente: Filtering and Smoothing. [En línea]. R2011a Documentation: MatLab, 2011 [consultado 30 de Abril de 2011]. http://www.mathworks.com/help/toolbox/curvefit/bq_6yqb.html#top_of_page 4.4.2. Promediado de espectros. El promediado de espectros es una técnica ampliamente utilizada en el área de quimiometría con el fin de reducir el ruido presente en las señales obtenidas e identificar los denominados “outliers” dentro del set de medición. De acuerdo a esto, y considerando que para las muestras DGA preparadas por triplicado, se tienen tres espectros para trabajar. Estos espectros son evaluados con el fin de identificar posibles errores en alguna de las mediciones y omitir los espectros denominados como “outliers”. Una vez realizada esta selección se realiza el promediado de los espectros restantes, obteniendo como resultado un espectro final para cada concentración con el que se trabajaría en las transformaciones siguientes. 44 4.4.3. Corrección de la línea base de la señal filtrada. Con el fin de disminuir los efectos de la variación de la línea base, diferentes algoritmos y aproximaciones de corrección han sido estudiados, intentando evitar al máximo la pérdida de la información de interés. 4.4.3.1. Modelado y sustracción (Detrending). El método de modelado y sustracción es ampliamente utilizado en espectroscopía, y se encuentra denominado como detrending,,. Para llevarlo a cabo se realiza una estimación simple (lineal), o polinomial del comportamiento de la señal espectroscópica, generando una función característica que es sustraída de la señal original para obtener la corrección deseada. Aunque en ocasiones se sugiere la aplicación de esta técnica en espectroscopía MIR más que en datos recolectados en la región NIR, es necesario observar los resultados en ambas regiones con el fin de tener mejores argumentos para una selección particular. Se realiza la corrección a los espectros NIR y MIR para evaluar su desempeño en cada una de las regiones. De acuerdo a las técnicas más utilizadas para este método, se lleva a cabo una corrección con un modelado lineal, y otra con un polinomio de orden superior como se indica: • Ajuste lineal de la variación de línea base utilizando la función ‘detrend’ del software MatLab. • Ajuste y truncamiento iterativo de curvas, con un polinomio de orden superior, el cual se determina de acuerdo a la respuesta obtenida al modelar diferentes valores. El truncado permite que la línea base modelada no responda a los picos característicos de la señal espectroscópica, sino al comportamiento general de la misma. 4.4.3.2. Derivadas de la señal. Los métodos derivativos aplicados a señales de espectroscopía han sido utilizados no solamente para correcciones de línea base, sino también como técnica de extracción de información de los espectros. Esta técnica utiliza la primera derivada de la señal para desplazamientos uniformes de la línea base, mientras que utiliza la segunda derivada para eliminar efectos aditivos y multiplicativos sobre la misma, teniendo como resultado reducción en cambios de pendiente de la línea base y mejoramiento de la resolución de las bandas que se encuentran solapadas entre ellas. 45 A pesar de que algunas aproximaciones realizan derivadas de orden superior, las dos primeras derivadas son generalmente las más útiles en este tipo de análisis. Sin embargo, es necesario que sean llevadas a cabo posterior al proceso de filtrado debido a que generan un aumento en el ruido presente en los datos. De acuerdo a lo anterior, se llevan a cabo tanto la primera como la segunda derivada de la señal, con el fin de evaluar la información que puede ser extraída de las señales resultantes. 4.4.3.3. Variable normal estándar (SNV). La técnica SNV busca corregir efectos del tamaño de las partículas, dispersión y variaciones de pendiente en espectroscopia NIR, pero puede ser aplicada a la totalidad del espectro trabajado en la presente investigación (MIR+NIR). Éste método es muy similar al denominado “corrección de efecto multiplicativo de dispersión” (MSC), el cual también busca realizar una reducción de los efectos multiplicativos de dispersión, de diferencias en los tamaños de las partículas, temperaturas, entre otros. Diferentes estudios han demostrado que ambos métodos son equivalentes, y que se obtienen resultados muy similares en cuanto a capacidad de predicción. La diferencia entre el SNV y el MSC radica en que este último utiliza como referencia el espectro medio de las señales a tratar, por lo que los parámetros cambian con cada variación en los datos de entrada, mientras que el SNV es aplicado de forma individual sin depender de ningún espectro de referencia, y obteniendo por lo tanto una escala común a todos los espectros. A pesar de que algunos estudios realizan combinaciones de éste método con el denominado ‘detrending, otros sugieren que no deben realizarse combinaciones de técnicas de preprocesamiento que busquen realizar correcciones de línea base y efectos similares ya que pueden eliminar información útil. Debido a esto, se llevan a cabo los procesamientos de forma independiente y se analizan los resultados para determinar si es necesario realizar alguna combinación de los mismos. La transformación se lleva a cabo de la siguiente manera: (4) 46 Donde: Xi,m: Absorbancia del espectro i a la longitud de onda m. /Xi: Absorbancia media del espectro i. Si: Desviación estándar de los valores de absorbancia de cada muestra. 4.5. IDENTIFICACIÓN DE REGIONES Y LONGITUDES DE ONDA Con el fin de omitir posibles errores inducidos por los algoritmos de corrección de línea base, los diferentes métodos de selección indicados se aplican tanto a los espectros filtrados como a los resultados de las 5 correcciones. 4.5.1. Criterio de la varianza y Factor de Mérito (FM). El cálculo del Factor de Mérito (FM) se lleva a cabo considerando la varianza de los espectros obtenidos para cada longitud de onda. El método realiza una comparación entre varianza interclase e intraclase, para lo que se agrupan espectros definiendo rangos de concentraciones de la muestra a analizar. Varianza intraclase: Promedio de las varianzas al interior de cada clase por longitud de onda. Varianza interclase: Varianza del promedio de los datos de cada clase por longitud de onda. Factor de mérito: Relación entre la varianza interclase y la varianza intraclase (Ecuación 5) (5) Un valor alto de FM a una longitud de onda particular implica que la distancia media entre cada medida de una clase y la posición del centroide de la misma es menor a la distancia media entre las centroides de todas las clases. Éste índice determina si la variabilidad observada corresponde al azar, o si existen diferencias significativas de la señal para cada una de las muestras, y permite realizar una selección de las variables con mayor FM. 47 Este factor puede ser calculado mediante el software MatLab utilizando la función fmerito creada por los investigadores, y que obedece al algoritmo indicado en el cuadro 8. Cuadro 8. Algoritmo de cálculo del factor de mérito de un set de espectros. Fuente: GONZÁLEZ VÁSQUEZ, Francisco Manuel. Desarrollo de un método de selección de variables para datos espectroscópicos en el infrarrojo cercano. Trabajo de grado Ingeniero Electrónico. Tarragona: Universitat Rovira I Virgili. Departamento de Ingeniería Electrónica, Eléctrica y Automática, 2004. 128 p. 4.5.2. Aproximación indirecta, métrica de la Información Mutua (IM). Dentro de las técnicas de selección de variables que se plantean como solución al problema Feature Subset Selection (FSS) se encuentran las aproximaciones indirectas o filter, y las directas o wrapper. A pesar de que estas últimas realizan un análisis más exhaustivo al evaluar cada posible subconjunto de variables con un modelo de regresión, no son muy utilizadas debido a sus altos requerimientos computacionales y sus rendimientos similares a las técnicas de aproximación indirecta. Uno de los métodos más utilizados dentro de las aproximaciones filter es el ranking de variables, el cual utiliza heurísticos basados en medidas de divergencia entre funciones de distribución para ponderar las variables. Dentro de este método, la métrica más utilizada y contrastada en análisis espectroscópicos es la de información mutua (IM). 48 Ésta realiza un cálculo de relación entre dos variables, como la diferencia entre la entropía (medida de la incertidumbre) de la variable X: H(X), y la entropía de la misma variable cuando se conoce el valor de la variable Y: H(X/Y) (Ecuación 6). (6) En esta métrica que tiene como rango [0-1], valores cercanos a cero indican independencia entre las variables, mientras que valores cercanos a uno marcan una alta correlación entre ellas. Este índice puede ser utilizado de diferentes formas y combinado con otras técnicas de selección y diferentes modelos predictivos,. Debido a esto se indican las características de procesamiento seleccionadas para la presente investigación de acuerdo a los resultados reportados por las investigaciones de teoría de la información relacionadas con la métrica. 4.5.3. Combinación entre variables individuales y set de variables. En esta combinación se realizan dos selecciones independientes de variables. El primer método consiste en la obtención de un ranking de las variables con base en el índice IM individual entre cada longitud de onda y la concentración de glucosa, como se muestra en el diagrama de la figura 4. 49 Figura 4. Procedimiento para el ranking de variables utilizando la Información Mutua. Inicio Ciclo i=1 IM λi vs [] NO i=λf i++ S Ubicación IM individual máx: sel (S1) Ciclo n=1 n++ IM= IM ≠ sel Ubicación IM máximo Selección de máximo local: sel NO n=λf S Ranking de variables según su IM El segundo selecciona la primera variable como aquella con mayor IM, y tiene en cuenta esta selección para el proceso siguiente. Debido a esto, para la segunda variable se busca maximizar el índice de información mutua entre un set que involucra tanto la variable previamente seleccionada como la nueva variable a incluir, con respecto a la concentración de glucosa. Posteriormente se incluyen de forma sucesiva todas las variables que al hacer parte del set generen un mayor índice de la métrica, como se muestra en el diagrama de la figura 5. 50 Figura 5. Procedimiento para la selección de variables utilizando la Información Mutua Inicio Ciclo i=1 IM λi vs [] NO i=λf i++ SI Ubicación IM individual máx: sel (S1) Ciclo x=1 x++ Ciclo n=1 SI λn ε sel? n++ NO Setp: [sel , λn ] IM Setp vs [] NO n=λf SI Ubicación máximo local de IM NO max(x) > maxT SI Selección de variable adicional: sel Procedimiento ‘Backward’ 51 Fin Una vez realizados los dos procedimientos anteriores, el método sugiere realizar una unión entre el set de variables seleccionado mediante el algoritmo de la figura 4 y las primeras variables del ranking obtenido en el algoritmo de la figura 5. La cantidad de variables seleccionadas en este último paso es determinada de tal forma que el set total de variables no implique un aumento muy significativo en los tiempos de ejecución de los algoritmos a llevar a cabo (un máximo total de 20 variables). 4.6. REGRESIÓN Y VALIDACIÓN DE LOS MODELOS. Una vez realizado el procesamiento correspondiente indicado en los apartados anteriores, se hace necesario realizar modelos de regresión con el fin de generar las curvas de calibración correspondientes que permitan realizar la predicción de los niveles de glucosa. Teniendo en cuenta las diferentes opciones de procesamiento a llevar a cabo, y considerando que cada una puede ser ajustada de una mejor forma con modelos de regresión diferentes, se deben realizar procesamientos paralelos con el fin de realizar una comparación del rendimiento de las técnicas de procesamiento al ser sometidas a modelos de regresión con características particulares. Para cada uno de los modelos generados se realiza el cálculo del error cuadrático medio de calibración (RMSEC), el cual brinda información acerca de los errores de predicción del modelo para cada una de las señales que fueron parte de la construcción del mismo. Con el fin de validar cada uno de los modelos con datos diferentes a los utilizados en la construcción del modelo, se llevan a cabo procedimientos de validación cruzada “Leave One Out”, obteniendo el error cuadrático medio respectivo (RMSECV). De igual forma se dejan tres de los espectros por fuera de la construcción del modelo, y se realiza el cálculo del error cuadrático medio de predicción (RMSEP) a partir de la estimación de los mismos. 4.6.1. Regresión lineal simple. A partir de los componentes o variables que cada uno de los procesamientos anteriores genera se realiza una regresión lineal simple para la obtención de las concentraciones de cada una de las muestras. Ésta regresión se lleva a cabo en el software MatLab utilizando la función “regress”, que realiza la regresión por el método de mínimos cuadrados como se indica. 52 4.6.2. Regresión de de componentes principales (PCR). Este análisis es muy útil en la reducción de variables, ya que disminuye la cantidad de variables sin eliminar información, generando nuevos atributos llamados componentes principales. En el caso de la presente investigación, los componentes principales corresponden a una combinación lineal de las longitudes de onda presentes en los espectros a analizar. Posterior a la conversión de las longitudes de onda seleccionadas en términos de los componentes principales mencionados, se realiza la regresión lineal para generar el modelo de predicción de concentraciones. 4.6.3. Regresión por Mínimos Cuadrados Parciales (PLSR). El análisis PLS es ampliamente utilizado en sets de información que contienen variables altamente correlacionadas, y tiene características comunes al PCA, ya que realiza el cálculo de nuevas variables o componentes a partir de una combinación lineal de las variables originales. Sin embargo, el PLS tiene en cuenta los valores “Y” observados de la variable a predecir. Debido a esto, brinda un mayor poder predictivo que el PCA, en el cual este cálculo se encuentra únicamente basado en la varianza de cada variable original con el fin de reducir la correlación entre los componentes generados. Los cálculos relacionados a esta transformación se realizan en el software MatLab mediante la función ‘plsregress’. Este comando realiza no solamente el cálculo de los nuevos componentes, sino también la regresión lineal multivariable correspondiente, debido al conocimiento del vector Y de respuestas y a la utilización del mismo en el cálculo de los nuevos componentes. 53 5. RESULTADOS 5.1. ESPECTROSCOPÍA IR EN MUESTRAS DE D-GLUCOSA DILUIDA EN AGUA ULTRA PURA Una vez preparadas las muestras de D-glucosa en agua a diferentes concentraciones como se indica en el diseño experimental, se realizaron los barridos espectroscópicos utilizando el espectrofotómetro Shimadzu Prestige IR21 y el software IRSolution. 5.1.1. Espectros NIR. Las pruebas correspondientes para determinar el camino óptico adecuado a utilizar en la región NIR con la celda de líquidos y las ventanas de ZnSe identifican regiones del espectro saturadas (con absorción total) al utilizar espaciadores de 1 mm y 0,5 mm, por lo que se determina que los espectros de las muestras de D-glucosa diluida en agua, se realizarían para un camino óptico de 0,2 mm. En la figura 6 se muestran los espectros de referencia de muestras de agua pura tomados por el espectrofotómetro para diferentes caminos ópticos, al igual que las señales correspondientes para el equipo vacío y con las ventanas de ZnSe. Se evidencia la saturación de las señales de 1 mm y 0,5 mm alrededor de 5000 cm-1. 54 Figura 6. Espectros de referencia de muestras de agua pura en la región NIR De igual forma, las mediciones de transmitancia para evaluar la estabilidad del equipo que se muestran en la figura 7 evidencian los errores que la medida presentaría al utilizar caminos ópticos mayores a 0,2 mm. Esto debido a que al realizar una medición con la misma muestra utilizada como referencia, la señal debería ser una línea recta indicando un 100% de transmitancia como sucede con el espaciador de 0,2 mm de espesor. 55 Figura 7. Espectros de estabilidad en la región NIR. Al realizar medidas de transmitancia de una muestra con alta concentración de glucosa (2700 mg/dl) utilizando aire como señal de referencia, se identifica que tampoco existe saturación de la señal, por lo que se determina continuar los espectros con el camino óptico seleccionado. De forma adicional, se selecciona tomar como señal de referencia el aire debido a que mediciones iniciales utilizando agua pura como referencia mostraron variaciones considerables para la misma medida. 5.1.2. Espectros MIR. Para la región MIR del espectro se obtuvieron las señales de referencia correspondientes a agua y aire mostradas en la figura 8, utilizando el accesorio ATRMAX II. Al igual que en la región NIR, se realizaron pruebas de estabilidad (figura 9) obteniendo espectros de la misma muestra utilizada como referencia (H2O), y de una alta concentración de glucosa (2700 mg/dl), con el fin de verificar el funcionamiento adecuado del accesorio y la obtención de la señal. 56 Figura 8. Señales de referencia en la región MIR Las señales de estabilidad utilizando agua ultra pura evidencian un pico negativo entre 2000 cm-1 y 2500 cm-1, correspondiente a la variación de CO2 desde la toma de la muestra de referencia, por lo cual se identificó como potencial interferente para los análisis posteriores. 57 Figura 9. Pruebas de estabilidad y alta concentración en la región MIR Se obtuvieron señales en la región MIR con diferentes características para dos momentos de medición. Sin embargo, cada uno de los sets contiene los espectros de todas las concentraciones, por lo que se decide procesarlos por separado, considerando que las diferencias pueden obedecer a las características del entorno de medición en el momento y a las condiciones del espectrofotómetro. 5.2. ESPECTROSCOPÍA IR EN MUESTRAS DE PLASMA 5.2.1. Espectros NIR. Las pruebas de saturación y de estabilidad al utilizar plasma como muestra objetivo no indicaron variaciones considerables que implicaran algún cambio en las técnicas de medición en comparación a la recolección de espectros de las muestras de agua ultra pura. 5.2.2. Espectros MIR. De igual forma se obtuvieron los espectros de las muestras de plasma para cada uno de los sujetos utilizando la técnica ATR para la región MIR. Se evidenció un comportamiento muy similar al de la última medición MIR en muestras de agua, por lo que se determinó que la primera medida correspondiente a las mismas muestras pudo haber sido la afectada por factores ambientales y de condiciones de equipo. 58 5.3. ESPECTROSCOPÍA IR EN MUESTRAS DE SANGRE 5.3.1. Espectros NIR. Las pruebas en la región NIR de las muestras de sangre hicieron evidente la absorción por parte de este fluido, ya que al utilizar un camino óptico de 0,2 mm, el espectro oscilaba entre 0,5 % y 2 % de transmitancia. Debido a esto, se adoptó el espaciador de 0,1 mm. De esta forma se obtuvo una señal un poco mayor que podría ser más fácilmente procesada y comparada estadísticamente (figura 10). Figura 10. Espectros de sangre en la región NIR para diferentes caminos ópticos 5.3.2. Espectros MIR. De igual forma se realizaron los barridos espectroscópicos para la región MIR para cada uno de los sujetos y se obtuvieron los espectros correspondientes. 59 5.4. PROCESAMIENTO DE DATOS Cada uno de los espectros crudos obtenidos fue filtrado mediante la función “Smooth” de Matlab utilizando el método Savitzky-Golay descrito en la metodología. Se obtuvieron las señales suavizadas, a partir de las cuales se realizó una identificación gráfica de outliers. Estos fueron eliminados de cada uno de los set de datos, teniendo como resultado final los espectros para realizar las correcciones correspondientes establecidas anteriormente (Anexo A). Se llevaron a cabo los 5 tipos de corrección de línea base, teniendo como resultado 6 sets por cada grupo de espectros (al incluir las señales originales) en las regiones MIR y NIR para las muestras de agua, plasma y sangre. A cada uno de los sets de espectros resultado de las correcciones de línea base se aplicaron técnicas de selección de Información Mutua y Factor de Mérito, obteniendo las gráficas correspondientes a estos índices como las que se muestran en las figuras 11 y 12 correspondientemente. Figura 11. Información Mutua para un set de datos en la región NIR 60 Figura 12. Factor de Mérito para un set de datos en la región NIR 5.5. MODELOS DE PREDICCIÓN 5.5.1. Construcción de los modelos. Para la construcción de los modelos se realizaron tres tipos de selección. En la primera se incluyeron en el modelo únicamente las longitudes de onda que en conjunto maximizan la información mutua, y que fueron identificadas a partir del algoritmo iterativo descrito en la metodología. En la figura 13 se muestra un ejemplo de la selección; en rojo se resaltan las longitudes de onda del set seleccionado, mientras que en azul se muestran las primeras 15 longitudes de onda con mayor Información Mutua individual. 61 Figura 13. Selección de longitudes de onda principales de acuerdo a la Información Mutua En el segundo tipo de selección se incluyeron las longitudes de onda del set anterior, además de las primeras 20 longitudes de onda con mayor Información Mutua individual, y las primeras 20 con mayor Factor de Mérito. Esto permitió realizar modelos con un número mayor de longitudes de onda seleccionadas por técnicas diferentes. El tercer tipo de selección incluyó regiones con altos índices de Información Mutua o Factor de Mérito de forma gráfica. Para esto se mostró el 10% de las longitudes de onda de la totalidad del espectro con mayor Información Mutua en un gráfico, y el 10% correspondiente a las longitudes con mayor Factor de Mérito en otro, como se evidencia en las Figuras 14 y 15 correspondientemente. 62 Figura 14. Selección de regiones a partir de las longitudes de onda con mayor Información Mutua 63 Figura 15. Selección de regiones a partir de las longitudes de onda con mayor Factor de Mérito A partir de este tipo de gráficos se identificaron las regiones del espectro con una mayor densidad de variables con un alto índice, y fueron estas las seleccionadas para la construcción de los modelos correspondientes. Estas técnicas de selección fueron aplicadas a cada uno de los 12 sets de datos (6 en la región MIR y 6 en la región NIR) de cada una de las muestras analizadas (agua, plasma y sangre). Cada grupo de longitudes de onda seleccionadas fue ingresado en los tres tipos de modelos de regresión: regresión lineal simple (RL), regresión de componentes principales (PCR), y regresión de mínimos cuadrados (PLSR). 64 5.5.2. Validación de los modelos. Con el fin de identificar los procesamientos más adecuados para la predicción de las concentraciones de glucosa, las técnicas de selección más acertadas, y los modelos de regresión óptimos, se realizó el cálculo de tres tipos de error cuadrático medio (MSE), y se realizaron comparaciones de la raíz del mismo (RMSE), para manejar información que pudiera ser comparada en las unidades del estudio (mg/dl). Como primera medida se obtuvo el error cuadrático medio de calibración (RMSEC). En éste, el modelo es construido con todas las concentraciones disponibles en el rango especificado, y el error es calculado a partir de las desviaciones de estas mismas muestras. Este cálculo, al partir de los mismos espectros con los que se construye el modelo, es generalmente muy optimista. Esto debido a que está indicando el error del modelo, sin evaluar su habilidad de predicción para muestras no incluidas en el set de calibración. Con el fin de evaluar de forma real dicha habilidad, se realizó el cálculo del error cuadrático medio de predicción (RMSEP). Para esto, se seleccionaron tres muestras de forma aleatoria en cada modelo, las cuales fueron utilizadas como muestras de validación. En la figura 16 se observa la respuesta de uno de los modelos en la cual se incluyen en rojo las tres muestras de validación que no fueron parte de la regresión. 65 Figura 16. Respuesta del modelo de regresión PLS, a partir de regiones de señales de plasma con corrección de modelado lineal LDT. A pesar de que el RMSEP proporciona un índice relacionado con la predicción de muestras nuevas, su cálculo implica dejar de utilizar algunas de las muestras disponibles en el set de calibración para incluirlas en el de validación. En estudios como el presente, en los que la obtención de las muestras necesita de un proceso detallado y no es posible obtener un alto número de las mismas, este tipo de validación implica sacrificar de forma significativa el contenido del modelo. Debido a lo anterior, se utiliza una técnica más avanzada denominada validación cruzada “Leave One Out”, que proporciona el error cuadrático medio de validación cruzada (RMSECV). En esta técnica se realiza una construcción iterativa de modelos en los cuales se extraen de forma individual muestras para realizar la validación. 66 Esto permite obtener un error real de la predicción del modelo construido con todas las muestras exceptuando una, y garantiza que cada una de las concentraciones disponibles en el rango fue evaluada como muestra de validación. En el Anexo B se incluyen los cuadros correspondientes a los errores RMSEC, RMSEP y RMSECV. Esta información permite realizar una comparación de cada tipo de error para los modelos generados. Sin embargo, debido a la gran cantidad de datos para ser analizados, se determina como criterio de selección el RMSECV, que evalúa modelos más completos y lo hace en todo el rango de concentraciones determinado para el estudio. De cada uno de los 11 cuadros del anexo B se seleccionaron los 15 modelos con menor RMSECV. A partir de esta clasificación inicial, se identificaron las técnicas de procesamiento que coincidían en estas 11 listas, y se determinó su porcentaje de aparición en las mismas, el error promedio para muestras de agua (DGA), el error promedio para muestras de plasma (PSM), el error promedio para muestras de sangre (SNG), y el promedio total de los errores de cada combinación de técnicas (Cuadros 9 y 10). En estos cuadros se realizó para cada región la selección de los cinco modelos con mayor frecuencia entre los listados anteriores (subrayados en amarillo), los cinco con un menor promedio total (en letras rojas), y se identificó de forma adicional los modelos con menor RMSECV para las muestras DGA, PSM y SNG de forma individual (subrayados en verde). 67 Cuadro 9. Selección de modelos con mejores resultados para la región MIR 68 Cuadro 10. Selección de modelos con mejores resultados para la región NIR Esta selección permitió concluir que tanto la primera como la segunda derivada permiten realizar una mejor identificación de las longitudes de onda que se relacionan con la concentración de glucosa, y brindan una alta información acerca de la misma. De los 17 modelos seleccionados que incluyen las regiones MIR y NIR, 15 correspondían al procesamiento derivativo, mientras que otros 2 correspondían a procesamiento de corrección polinomial de línea base y cálculo de variable normal estándar respectivamente. De igual forma se identificó que 12 de los modelos seleccionados utilizaron las principales longitudes de onda teniendo en cuenta los criterios de Información Mutua y Factor de Mérito en conjunto, 4 utilizaron la selección exclusiva del set de datos que maximiza la Información Mutua, y tan solo 1 utilizó una región como fuente de datos. A partir las longitudes de onda que fueron utilizadas en la creación de los modelos seleccionados en los cuadros 9 y 10, se identificaron las coincidencias de selección entre modelos tanto para la región MIR como para la región NIR. 69 En la región MIR, se identificó una marcada selección de longitudes de onda entre 648 cm-1 y 1250 cm-1 y entre 3000 cm-1 y 3870cm-1, común tanto para las muestras de agua, como para las de plasma y sangre. Con poca aparición en las muestras de agua, pero con presencia significativa en muestras de plasma y sangre, se identificaron longitudes de onda entre 1850 cm-1 y 2210 cm-1, y entre 2350 cm-1 y 2565 cm-1. De igual forma se identifican, aunque con menor repetición, algunas longitudes entre 1380 cm-1 y 1726 cm-1 para dichas muestras. Por otro lado, en la región NIR se identifican longitudes de onda entre 11100 cm-1 y 11950 cm-1, y entre 5190 cm-1 y 5700 cm-1 en la mayoría de los modelos seleccionados, tanto para las muestras de agua, como para las de plasma y sangre. Uno de los modelos que utilizan la selección del set principal seleccionado a partir de la Información Mutua, presenta de forma aislada longitudes de 5958 y 5890, cercanas a la región anterior. Se identifica la presencia de longitudes entre 8790 cm-1 y 9265 cm-1 en una mayor proporción para muestras de plasma y sangre que para muestras de agua, mientras que longitudes entre 4700 cm-1 y 4900 cm-1 se presentan de forma significativa en varios de los modelos de agua, y en menor proporción en las muestras de plasma. Longitudes entre 6000 cm-1 y 6760 cm-1 se identifican exclusivamente en las muestras de plasma de varios de los modelos, y se evidencia una menor cantidad de longitudes entre 10400 cm-1 y 10900 cm-1 tanto en muestras de plasma como de sangre. Con el fin de identificar de forma gráfica las regiones en las cuales se concentran las longitudes de onda que fueron repetitivas en los modelos con un menor RMSECV, se incluyen en el anexo C figuras en las cuales se muestran los espectros originales NIR y MIR, y se señalan las longitudes identificadas en muestras de sangre, plasma, y agua para cada una de las regiones. Es importante considerar que, aunque estas regiones se señalan en espectros originales filtrados, fueron identificadas en su mayoría en las derivadas de los mismos, y es necesario realizar modelos de las señales con diferentes procesamientos, ya que la derivada pudo haber sido una adecuada herramienta de identificación que lleve a errores menores al utilizar las longitudes de onda indicadas en señales con procesamientos diferentes. 70 6. CONCLUSIONES La aplicación de técnicas de dilución y de adición estándar permitió obtener muestras de diferente complejidad que cubrieran el rango de concentración de glucosa para la obtención de los espectros correspondientes. A partir de técnicas estadísticas novedosas para esta aplicación, fue posible identificar longitudes de onda y regiones con una mayor tendencia a predecir la concentración de glucosa en las muestras e incluirlas en modelos de regresión. La obtención de dos espectros por región al trabajar con dos sujetos sanos, permitió recopilar una mayor cantidad de datos y realizar 11 cuadros de combinación de técnicas de procesamiento, selección, y regresión. El contraste general de los errores de cada uno de los modelos generados permitió identificar opciones de procesamiento más acertadas, y longitudes de onda que predicen de una mejor manera la concentración de glucosa en las muestras. Las regiones en las que se encontraban las longitudes de onda repetitivas para los modelos con un menor RMSECV fueron identificadas. Las longitudes de onda significativamente relevantes encontradas en la región MIR entre 648 cm-1 y 1250 cm-1 para todas las muestras (agua, plasma y sangre), coinciden con la región entre 1000 cm-1 y 1230 cm-1 indicada por el Dr. Petibois y colaboradores en sus trabajos como correspondiente a la absorción del enlace C-O, y ratifican sus hallazgos en el pico de 1033 cm-1. Esta identificación coincide de igual forma con la región entre 1022 cm-1 y 1119 cm-1 indicada por Webster y colaboradores en su libro “Handbook of Optical Senging of Glucose in Biological Fluids and Tissues”, con los picos en 1032 cm-1, 1042 cm-1, y 993 cm-1 encontrados por Vargas y colaboradores en el año 2009 y 2011, y con la absorción teórica del enlace C-O-C entre 800 cm-1 y 1275 cm-1. De igual forma, las longitudes encontradas en la región entre 3000 cm-1 y 3870 cm-1 corresponden a la absorción teórica entre 3120 cm-1 y 3570 cm-1 del enlace O-H y entre 3020 cm-1 y 3085 cm-1 del enlace C-H. Para las regiones entre 1850 cm-1 y 2210 cm-1, entre 2350 cm-1 y 2565 cm-1, y entre 1380 cm-1 y 1726 cm-1 encontradas exclusivamente en muestras de plasma y sangre, no se identificaron antecedentes que coincidieran con los hallazgos. 71 Por otro lado, en la región NIR, las longitudes de onda encontradas entre 11100 cm-1 y 11950 cm-1 no se evidencian referenciadas en estudios anteriores. Sin embargo, con respecto a la región entre 5190 cm-1 y 5700 cm-1, Webster y colaboradores muestran en su libro estudios hallazgos entre 5296 cm-1 y 7194 cm-1, y el Dr. Pulenta considera el armónico de la vibración C-H en 5924 cm-1, longitud de onda que coincide con los hallazgos puntuales de 5958 cm-1 y 5890 cm-1 del presente estudio. Webster y colaboradores reportan de igual forma en su libro longitudes de onda entre 4180 cm-1 y 4892 cm-1, que coinciden con la región comprendida entre 4700 cm-1 y 4900 cm-1 encontrada en la presente investigación. Para las longitudes de onda entre 8790 cm-1 y 9265 cm-1, entre 6000 cm-1 y 6760 cm-1, y entre 10400 cm-1 y 10900 cm-1, no se encuentra bibliografía relacionada. Algunas de las variaciones presentes en los espectros, y la obtención de outliers para cada uno de los set recolectados, permitió identificar la alta importancia de las condiciones de laboratorio para este tipo de análisis, al igual que los protocolos de limpieza de los accesorios, ya que una mala limpieza puede interferir en espectros posteriores. 72 7. RECOMENDACIONES Los resultados de la presente investigación se prestan para realizar diferentes análisis y contrastes estadísticos debido a las combinaciones de técnicas aplicadas. Esto puede conllevar a estudios enfocados en alguna de las regiones utilizadas para la construcción de los modelos, y una validación más exhaustiva de los mismos. De igual forma, la información permite realizar comparaciones entre las técnicas de selección utilizadas, evidenciando su validez no solamente para esta aplicación en particular, sino como identificadores de variables de predicción en diferentes análisis cuantitativos. Una vez se analicen en detalle las regiones y longitudes de onda utilizadas en los modelos con menor error, es necesario iniciar procesos de diseño de equipos portables en las diferentes regiones del espectro IR, con el fin de realizar pruebas clínicas y acercarse aun mas a la posibilidad de una medición no invasiva y portable. Para estudios posteriores enfocados a las diferentes regiones identificadas como significativas por el presente estudio, algunas de las cuales se encuentran confirmadas por estudios anteriores, se propone realizar mediciones de matrices más complejas como lo son simuladores de tejido y tejidos reales. La inclusión de estos simuladores puede darse de forma digital en el procesamiento de los datos, o de forma física en la obtención de los espectros correspondientes. La primera de ellas con ayuda de paquetes de programas de simulación óptica como el OptoIQ, mientras que la segunda puede hacer uso de polímeros denominados “optical phantoms”, desarrollados para simular la respuesta del tejido en diferentes regiones del espectro, investigados y comercializados por la compañía Biomimic. 73 BIBLIOGRAFÍA ARONOFF, S.L. BERKOWITZ, B. SHEINER, B. WANT, L. Glucose metabolism and regulation: beyond insulin and glucagon En: Diabetes Spectrum. 2004, vol 17, p 183-190. Citado por: Handbook of Optical Sensing of Glucose in Biological Fluids and Tissues: : Glucose: Physiological Norm and Pathology. Boca Ratón, FL: CRC Press, 2009. P 1-40. BUDINOVA, G. SALVA, J. VOKA, K. Application of molecular spectroscopy in the mid-infrared región to the determination of glucose and colesterol in whole blood and in blood serum. En: App Spectrosc. 1997, p. 51-631. Citado por: Determination of Glucose in Dried Serum Samples by Fourier - Transform Infrared Spectroscopy. En: Clinical Chemistry. Septiembre. 1999, vol. 45, no. 9, p 1530 1535 DUARTE GARDEA, Maria. MUÑOZ, Guadalupe. RODRIGUEZ SALDAÑA, Joel. ESCORZA DOMINGUEZ, Arcelia. Prevalencia, detección y tratamiento de la diabetes gestacional. En: Revista Salud Pública y Nutrición. Enero-Marzo, 2004, vol.5, no. 1. DUNN, T.C. EASTMAN, R.C. TAMADA, J.A. Rates of glucose change measured by blood glucose meter and the GlucoWatch Biographer during day, night and around mealtimes. En: Diabetes care, 2004, vol 27, p2161-2165. Citado por: Handbook of Optical Sensing of Glucose in Biological Fluids and Tissues: Commercial biosensors for diabetes. Boca Ratón, FL: CRC Press, 2009. P 41-64 GABRIELY, Ilan. Transcutaneous Glucose Measurement Using Near-Infrared Spectroscopy During Hypo glycemia. En: Diabetes Care. Diciembre, 1999, vol. 22, no. 12, p 2026 - 2032. GERRITSEN, M.E. BURKE, T.M. Insulin binding and effects of insulin on glucose uptake and metabolism in cultured rabbit coronary microvessel endothelium. En: Proc. Soc. Exp. Biol. Med. 1985, vol 180, p 17-23. Citado por: Handbook of Optical Sensing of Glucose in Biological Fluids and Tissues: : Glucose: Physiological Norm and Pathology. Boca Ratón, FL: CRC Press, 2009. P 1-40. GONZÁLEZ, Amparo. ROSENZWEIG, James L. UMPIERREZ, Guillermo. Autocontrol de la glucosa en sangre. En: Journal of Clinical Endocrinology and Metabolism. 2007, vol. 92. 74 HARIK, S.I. BEHMAND, R.A. LAMANNA, J.C. Hypoxia increases glucose transport at blood-brain barrier in rats. En: Journal of applied Physiology. 1994, vol 77, p. 896-901. Citado por: Handbook of Optical Sensing of Glucose in Biological Fluids and Tissues: : Glucose: Physiological Norm and Pathology. Boca Ratón, FL: CRC Press, 2009. P 1-40. HEINEMANN, L. Non-Invasive continuous glucose monitoring in Type I diabetic patients with optical glucose sensors. En: Diabetología. Junio, 1998, vol. 41, no. 7, p 848 - 854. HEISE, H.M. Non-invasive monitoring of metabolites using near infrared spectroscopy: state of the art. En: Horm Metab Res. 1996, vol 28, p. 527-534. Citado por: Non-Invasive continuous glucose monitoring in Type I diabetic patients with optical glucose sensors. En: Diabetología. Junio, 1998, vol. 41, no. 7, p 848 854. JACQMAIN, Olivier. Diabetes Atlas. 3 ed. International Diabetes Federation, 2006. 381 p. NAES, Tormod. ISAKSSON, Tomas. FEARN, Tom. DAVIES, Tony. A user-friendly guide to Multivariate Calibration and Classification. Chichester, UK: NIR Publications, 2004. 344 p. NEWMAN, Jeffrey. TURNER, Anthony. Home Blood glucose Biosensors: A Commercial Perspective. En: Biosensors and Bioelectronics. Junio, 2005, vol. 20, no. 12. P 2435-2453. NIEMZ, Markolf H. Laser-Tissue Interactions: Fundamentals and Applications. 3 ed. Alemania: Springer-Verlag, 2007. 305 p. PETIBOIS, Cyril. Determination of Glucose in Dried Serum Samples by Fourier Transform Infrared Spectroscopy. En: Clinical Chemistry. Septiembre, 1999, vol. 45, no. 9, p 1530 - 1535 PICKUP, J. McCARTNEY, L. ROLINSKI, O. BIRCH, D. In vivo glucose sensing for diabetes management: progress towards non-invasive monitoring. En: BMJ. 1999, vol 319, p. 1289. Citado por: Handbook of Optical Sensing of Glucose in Biological Fluids and Tissues: : Glucose: Physiological Norm and Pathology. Boca Ratón, FL: CRC Press, 2009. P 1-40. 75 PULENTA, Luis. AVILA, Eenrique M. Medición No Invasiva de Glucosa por Infrarrojo Cercano. XV Congreso Argentino de Bioingenieria: 047EI. Universidad de Entreríos, Argentina 2005 RANDLE, P. SMITH, G.H. Regulation of glucose uptake by muscle. The effects of insulin, anaerobiosis and cell pisons on uptake of glucose and release of potassium by isolated rat diaphragm. En: Biochem. Journal. 1958, Vol 70, p. 490508. Citado por: Handbook of Optical Sensing of Glucose in Biological Fluids and Tissues: : Glucose: Physiological Norm and Pathology. Boca Ratón, FL: CRC Press, 2009. P 1-40. RENALD, E. Monitoring glycemic control: the importance of self-monitoring of blod glucose. En: Amer. J. Med. 2005, vol 118, p. 2-19. Citado por: Handbook of Optical Sensing of Glucose in Biological Fluids and Tissues: Commercial biosensors for diabetes. Boca Ratón, FL: CRC Press, 2009. P 41-64 RESTREPO HERNANDEZ, Paola Andrea. Glucómetro no invasivo. En: Revista de la Facultad de Medicina, Universidad el Bosque. Diciembre, 2005, vol. 10, no. 2, p22-27. Sacherer, Storage container for analytical devices, US patent no 6,497,845. Citado por: Handbook of Optical Sensing of Glucose in Biological Fluids and Tissues: Commercial biosensors for diabetes. Boca Ratón, FL: CRC Press, 2009. P 41-64 SHIMABUKURO, M. ZHOU, Y.T. LEVI, M. UNGER, R.H. Fatty acid-induced betacell apoptosis: a link between obesity and diabetes. En: Proc. Natl. Acad. Sci. USA. 1998, vol 95, p 2498-2502. Citado por: Handbook of Optical Sensing of Glucose in Biological Fluids and Tissues: : Glucose: Physiological Norm and Pathology. Boca Ratón, FL: CRC Press, 2009. P 1-40. SKOOG, Douglas. Principios de Análisis Instrumental. 5 ed. Madrid: McGRAW Hill, 2001. p. 409. The Diabetes Research in Children Network Study Group. Accuracy of the Gluco Watch G2 Biographer and the continuous glucose monitoring system during hypoglycemia. En: Diabetes care, 2004, vol 27, p. 722-726. Citado por: Handbook of Optical Sensing of Glucose in Biological Fluids and Tissues: Commercial biosensors for diabetes. Boca Ratón, FL: CRC Press, 2009. P 41-64 TURA, Andrea. MARAN, Alberto. PACINI, Giovanni. Non-invasive glucose monitoring: Assesment of technologies and devices according to quantitative criteria. En: Diabetes Research and Clinical Practice. 2006, vol. 77, p 16-40. 76 TURNER, A.P.F. PILETSKY, S. Biosensors and Biomimetic Sensors for the Detection of Drugs, Toxins and Biological agents. En: Defense Against Bioterror, NATO STS Series, Springer, The Netherlands, 2005. P 261-272,. Citado por: Handbook of Optical Sensing of Glucose in Biological Fluids and Tissues: Commercial biosensors for diabetes. Boca Ratón, FL: CRC Press, 2009. P 41-64 VARGAS VASQUEZ, Jhon E. CASTRO MILLER. Iván D. FONTHAL RICO, Faruk. Identificación Espectroscópica en la Región Media y Cercana del Infrarrojo para su Aplicación en Mediciones No Invasivas de Glucosa En: V Latin American Congress on Biomedical Engineering CLAIB 2011, IFMBE Proceedings 33. VARGAS VASQUEZ, Jhon Edward. MONTAÑO AGUDELO, David. Estudio sobre la utilización de espectroscopía infrarrojo para medir la concentración de glucosa en sangre. Trabajo de Grado Ingeniero Biomédico. Santiago de Cali: Universidad Autónoma de Occidente. Facultad de Ingeniería, 2009. 104 P. WEBSTER, Jhon G, RITENOUR E. Russel, TABAKOV Slavik and NG KwanHoong. Handbook of Optical Sensing of Glucose in Biological Fluids and Tissues: Chapter 1 Glucose: Physiological Norm and Pathology. Boca Raton, FL: CRC Press, 2009. 692 p. P 1-40 WEBSTER, Jhon G, RITENOUR E. Russel, TABAKOV Slavik and NG KwanHoong. Handbook of Optical Sensing of Glucose in Biological Fluids and Tissues: Commercial biosensors for diabetes. Boca Ratón, FL: CRC Press, 2009. P 41-64 WEBSTER, Jhon G. RITENOUR E. Russel. TABAKOV, Slavik. NG Kwan-Hoong. Handbook of Optical Sensing of Glucose in Biological Fluids and Tissues: Glucose: Physiological Norm and Pathology. Boca Ratón, FL: CRC Press, 2009. P 1-40. WEBSTER, Jhon G. RITENOUR E. Russel. TABAKOV, Slavik. NG Kwan-Hoong. Handbook of Optical Sensing of Glucose in Biological Fluids and Tissues: Statistical Analysis for glucose Prediction in Blood Samples by Infrared spectroscopy. Boca Ratón, FL: CRC Press, 2009. P 97-114 ZHOU, Y.P. GRILL, V.E. Long term exoposure of rat pancreatic islets to fatty acids inhibits glucose-induced insulin secretion and biosynthesis through a glucose fatty acid cycle. En: J. Clin. Invest. 1994, vol 93, p 870-876. Citado por: Handbook of Optical Sensing of Glucose in Biological Fluids and Tissues: : Glucose: Physiological Norm and Pathology. Boca Ratón, FL: CRC Press, 2009. P 1-40. 77 ANEXOS Anexo A. Espectros filtrados y sin outliers Figura 17. Espectro DGA NIR 78 Figura 18. Espectro DGA MIR 1 79 Figura 19. Espectro DGA MIR 2 80 Figura 20. Espectro Plasma MIR Sujeto A 81 Figura 21. Espectro Plasma MIR Sujeto B 82 Figura 22. Espectro Plasma NIR Sujeto A 83 Figura 23. Espectro Plasma NIR Sujeto B 84 Figura 24. Espectro Sangre MIR Sujeto A 85 Figura 25. Espectro Sangre MIR Sujeto B 86 Figura 26. Espectro Sangre NIR Sujeto A 87 Figura 27. Espectro Sangre NIR Sujeto B 88 Anexo B. Cuadros de validación de los modelos de predicción Cuadro 11. Estadísticas Espectro DGA NIR Cuadro 12. Estadísticas Espectro DGA MIR 1 89 Cuadro 13. Estadísticas Espectro DGA MIR 2 Cuadro 14. Estadísticas Espectro Plasma MIR Sujeto A 90 Cuadro 15. Estadísticas Espectro Plasma MIR Sujeto B Cuadro 16. Estadísticas Espectro Plasma NIR Sujeto A 91 Cuadro 17. Estadísticas Espectro Plasma NIR Sujeto B Cuadro 18. Estadísticas Espectro Sangre MIR Sujeto A 92 Cuadro 19. Estadísticas Espectro Sangre MIR Sujeto B Cuadro 20. Estadísticas Espectro Sangre NIR Sujeto A 93 Cuadro 21. Estadísticas Espectro Sangre NIR Sujeto B 94 Anexo C. Identificación de regiones a partir de modelos con menor RMSECV Figura 28. Identificación de regiones DGA MIR 95 Figura 29. Identificación de regiones PSM MIR 96 Figura 30. Identificación de regiones SNG MIR 97 Figura 31. Identificación de regiones DGA NIR 98 Figura 32. Identificación de regiones PSM NIR 99 Figura 33. Identificación de regiones SNG NIR 100