Recuperación de compuestos de cianuro de aguas residuales
Anuncio

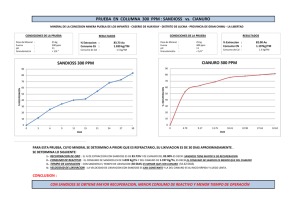
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS CARRERA DE QUÍMICA DE ALIMENTOS Recuperación de compuestos de cianuro de aguas residuales proveniente de la extracción del oro utilizadas como aguas de riego en la zona minera Zaruma - Portovelo Autora: Andrea Pamela Cazar Almeida [email protected] Tesis para optar por el Título Profesional de QUÍMICA DE ALIMENTOS Tutor: Dr. Eduardo Mayorga [email protected] Quito, Diciembre 2015 Andrea Pamela Cazar Almeida (2015). Recuperación de compuestos de cianuro de aguas residuales provenientes de la extracción del oro utilizadas como aguas de riego en la zona minera Zaruma – Portovelo. Trabajo de investigación para optar por el grado de Química de Alimentos. Carrera de Química de Alimentos. Quito: UCE. 55p. ii DEDICATORIA Dedico la presente investigación a Dios por siempre estar a mi lado guiar mi camino y llenar mi vida de bendiciones. A mis padres y hermana que con su ejemplo de responsabilidad y perseverancia han sabido guiarme por el buen camino. A mi hermano que desde el cielo ilumina mi camino y a mis amigos que siempre han estado a mi lado. iii AGRADECIMIENTO A Dios por permitirme ver hecho realidad este sueño de culminar con éxito el primer peldaño de mi vida profesional. A mis Padres por brindarme todo su apoyo y por darme la oportunidad de prepararme en tan honorable institución. A mis amig@s Carla, Jhoanna, Paul, Christian y Rubén que me han dado ánimos en los momentos difíciles. A mis colegas del laboratorio ambiental OSP Diego, Darwin y Salomón por bríndame su apoyo, ayuda y conocimientos para poder realizar el presente trabajo de investigación A los maestros de la facultad por brindarme sus conocimientos y de manera muy especial al Dr. Eduardo Mayorga por su paciencia y dedicación como director de la presente tesis, por guiarme debidamente hacia la consecución de mi trabajo. Andrea Pamela Cazar Almeida iv v vi vii CONTENIDO CAPÍTULO I .................................................................................................................................1 1 INTRODUCCIÓN ..........................................................................................................1 1.1 Planteamiento del problema ............................................................................................1 1.2 Formulación del Problema...............................................................................................2 1.3 Objetivo General .............................................................................................................2 1.4 Objetivos Específicos .....................................................................................................2 1.5 Justificación e Importancia ..............................................................................................2 CAPÍTULO II ................................................................................................................................4 2 MARCO TEÓRICO ........................................................................................................4 2.1 Antecedentes ...................................................................................................................4 2.2 Fundamento Teórico .......................................................................................................5 2.3 Características del cianuro ...............................................................................................6 2.4 Propiedades toxicológicas del cianuro .............................................................................8 2.5 Usos industriales del cianuro ...........................................................................................8 2.6 Uso del cianuro en la minería del oro...............................................................................9 2.7 Método de cianuración de minas con oro y plata ............................................................11 2.8 Técnicas de recuperación y destrucción del cianuro de residuos sólidos y líquidos ......... 11 2.8.1 Degradación natural ......................................................................................................12 2.8.2 Proceso INCO, SO2 /Aire para la destrucción del cianuro. ..............................................12 2.8.3 El Proceso de peróxido de hidrógeno H 2 O 2 ...................................................................13 2.8.4 Proceso de recuperación del cianuro con ácido sulfúrico (AVR). ...................................14 2.9 Minería en el Ecuador ...................................................................................................17 2.10 Métodos analíticos ........................................................................................................21 2.11 Marco legal ...................................................................................................................23 2.11.1 Norma de calidad ambiental y de descarga de efluentes: recurso agua ............................23 2.11.2 Criterios de calidad de aguas de uso agrícola o de riego .................................................23 viii CAPÍTULO III ............................................................................................................................24 3 Metodología ..................................................................................................................24 3.1 Tipo de investigación ....................................................................................................24 3.2 Población y muestra ......................................................................................................24 3.3 Diseño experimental......................................................................................................24 3.3.1 Análisis de Varianza (ANOVA) para el método de recuperación de cianuros en aguas residuales de la industria minera ....................................................................................25 3.4 Materiales y métodos ....................................................................................................27 CAPITULO IV ............................................................................................................................29 4 Resultados y discusión ..................................................................................................29 4.1 Análisis y discusión de resultados..................................................................................29 CAPITULO V .............................................................................................................................37 5 Conclusiones y Recomendaciones .................................................................................37 5.1 Conclusiones .................................................................................................................37 5.2 Recomendaciones..........................................................................................................38 BIBLIOGRAFÍA .........................................................................................................................39 ANEXOS.....................................................................................................................................42 LISTA DE TABLA Tabla 1. Niveles del factor A y B de diseño ..................................................................................25 Tabla 2 Análisis de Varianza (ANOVA) para el método de recuperación de cianuros en aguas residuales de la industria minera ..........................................................................26 Tabla 3 Concentración de cianuros en la solución estándar ..........................................................29 Tabla 4. Recuperación de cianuros solución estándar....................................................................30 Tabla 5. Concentración de cianuros en la muestra de agua residual ..............................................30 Tabla 6. Promedio de las concentraciones de cianuro de sodio (ppm) en agua residual.................. 34 Tabla 7. Resumen del Análisis de Varianza (ANOVA) para el método de recuperación de cianuros en agua residual...............................................................................................34 Tabla 8. Medias de los tratamientos del factor B...........................................................................35 ix Tabla 9. Comparación múltiple entre medias para el factor B ......................................................36 LISTA DE FIGURA Figura 1 Concentración de cianuros de la solución estándar tratada con una solución acida (1:1) vs el tiempo ..........................................................................................................31 Figura 2 Concentración de Cianuros de la solución estándar tratada con una solución acida (1:3) vs el tiempo ..........................................................................................................31 Figura 3. Concentración de Cianuros en la solución estándar tratados con una solución ácida (1:5) vs el tiempo. ................................................................................................32 Figura 4. Concentración de Cianuros en la muestra tratados con una solución ácida (1:1) vs el tiempo. ......................................................................................................................32 Figura 5. Concentración de Cianuros en la muestra tratados con una solución ácida (1:3) vs el tiempo. ......................................................................................................................33 Figura 6. Concentración de Cianuros en la muestra tratados con una solución ácida (1:5) vs el tiempo. ......................................................................................................................33 x LUGAR DONDE SE REALIZÓ LA INVESTIGACIÓN El presente tema RECUPERACIÓN DE COMPUESTOS DE CIANUROS PROVENIENTES DE LA EXTRACCIÓN DEL ORO UTILIZADAS COMO AGUAS DE RIEGO EN LA ZONA MINERA ZARUMA – PORTOVELO se realizó en la provincia de EL ORO como sitio de toma de muestras, los análisis se realizaron en la ciudad de Quito, en las instalaciones de los laboratorios OSP de la Facultad de Ciencias Químicas de la Universidad Central del Ecuador. xi RESUMEN DOCUMENTAL En la zona minera de Zaruma-Portovelo en la provincia de El Oro la mayor parte de la minería es de pequeña escala y artesanal, por lo que el uso de tecnologías inapropiadas tanto en el proceso de extracción del oro como en el tratamiento de agua residuales provenientes de las descargas liquidas de dicha actividad. El presente estudio tiene como objetivo recuperar compuesto de cianuros provenientes de la extracción del oro, generando un método de extracción óptimo de eliminación de compuestos de cianuro en muestras acuosas. La muestra residual fue sometida al método de recuperación de cianuros (Acidificación, Volatilización y Reneutralización), sometiendo la muestra a dos variables de extracción, el tiempo de extracción de 1, 2 y 4 horas y la solución ácida en relación (1:1), (1:3) y (1:5). Previo al análisis con la muestra de agua residual se realiza un análisis de extracción con una solución estándar para verificar la efectividad de extracción del método. Obteniendo como resultados que el tratamiento de mayor porcentaje de recuperación de cianuros es a 4 horas, en cuanto a la solución ácida no existe una diferencia significativa, por lo tanto se recomienda el uso de una solución ácida de proporciones (1:1) ya que el costo y uso es menor y se obtienen los mismos resultados. Finalmente se recomienda fomentar este tipo de procesos de recuperación de cianuros mejorando el método de extracción aumentado la solución acida o por efecto del tiempo la minería generará explotaciones más amigables con el ambiente. PALABRAS CLAVE: CIANURO, RECUPERACION, EXTRACCION MINERA DE ORO xii ABSTRACT In the mining area of Zaruma-Portovelo in the province of El Oro most of the mining is small-scale and artisanal, which by the use of inappropriate technologies of both the process of gold extraction and treatment of water Waste discharges from Liquid Such activity. The present study aims to recover cyanide compound from gold mining, UN Generating Optimal Extraction Method Elimination cyanide compounds in aqueous samples. The residual sample was subjected to the method of recovering cyanide (acidification, volatilization and reneutralization), subjecting the sample to two variables of extraction, the extraction time of 1, 2 and 4 hours and the acid solution in ratio (1: 1) (1: 3) and (1: 5). Before analyzing the scam UN wastewater sample extraction analysis with a standard solution para verify Effectiveness Removing the method is performed. Data analysis showed that treatment Mayor percent recovery of cyanides is 4 hours as to the acidic solution without significant difference exists, here's the both the use of an acidic solution ratios (1: 1) Recommends Since the cost of the USO and is lower and the same results are obtained. Finally it is recommended to encourage this type of cyanide recovery processes Improving Extraction Method Solution Increased acid or weather effect mining operations generate more environmentally friendly. KEYWORDS: Cyanide recovery GOLD MINING xiii CAPÍTULO I 1 1.1 INTRODUCCIÓN Planteamiento del problema La minería es la obtención selectiva de los minerales y otros materiales de la corteza terrestre; también se denomina así a la actividad económica primaria relacionada con la extracción de elementos de los cuales se puede obtener un beneficio económico. Dependiendo del tipo de material a extraer, la minería se divide en metálica y no metálica, los métodos de explotación pueden ser a cielo abierto o subterráneo. Los factores que lo determinarán serán entre otros la geología y geometría del yacimiento y la característica geomecánica del mineral y el estéril. Según (Yupari, 2003) desde el siglo XVI se ha venido desarrollando la minería metálica en el Ecuador, las viejas prácticas mineras y el manejo inadecuado de los residuos, sumados a la inexistencia de normas precisas que regulen el cierre de minas, ha generado la acumulación de pasivos ambientales, que contaminan los recursos naturales, cuyos usos pueden poner en riesgo la salud pública y del ambiente. En la actualidad, las posibilidades de un desarrollo minero a escala industrial plantea serios retos al país, pues si bien podría existir un importante potencial minero, al mismo tiempo su extracción significaría una alta conflictividad social, ambiental, económica y política. (INIGEMM, 2010) En la industria minera, el cianuro se utiliza para la disolución o lixiviación de metales preciosos, específicamente el oro su alto grado de toxicidad lo convierte en un compuesto de gran peligrosidad si no es manipulado de manera adecuada, puede originar considerables problemas ambientales. (INIGEMM, 2010) 1.2 Formulación del Problema ¿Se puede recuperar el cianuro proveniente de las descargas líquidas de la industria minera utilizadas para el riego? 1.3 Objetivo General Recuperar compuestos de cianuro de aguas residuales provenientes de la extracción del oro utilizadas como aguas de riego en la zona minera Zaruma – Portovelo 1.4 Objetivos Específicos • Generar un método de extracción óptimo de eliminación de compuestos de cianuro de muestras acuosas. • Aplicar el método de eliminación de compuestos de cianuros en muestras reales provenientes de la industria minera ubicadas en el sector de Zaruma – Portovelo en la provincia de El Oro. 1.5 Justificación e Importancia Aunque los procesos de extracción de oro no han cambiado fundamentalmente desde la introducción de las técnicas de cianuración, de esto ya hace cerca de un siglo, los últimos 50 años se han visto grandes cambios en los métodos utilizados. El cianuro es un veneno de acción rápida capaz de matar a una persona en cuestión de minutos si está expuesta a una dosis suficientemente elevada de cianuro, impide a las células utilizar el oxígeno, lo cual causa hipoxia de los tejidos y “cianosis” (decoloración azulada de la piel) el sistema respiratorio deja de nutrir a las células con oxígeno, un estado que, si no se trata, causa respiración rápida y profunda seguida por convulsiones, pérdida del conocimiento y asfixia. La toxicidad depende de que el cianuro se encuentre en forma libre (gas o líquido) o compleja (acuoso o sólida) intoxicación aguda en el ser humano resulta en convulsiones, vómitos, coma y la muerte. 2 El cianuro se debe manejar con mucho cuidado con soluciones diluidas entre 0.01% a 0.05% de (100 a 500 ppm) y mantener un pH entre 10.5 a 11.5 para conservar alcalina la solución y así evitar la formación de cianuro de hidrógeno (ácido cianhídrico), que es altamente tóxico. Después de haber extraído el oro por medio del proceso hidrometalúrgico, el cianuro puede estar presente como cianuro libre, cianuro débilmente complejado y fuertemente complejado. Ambientalmente las formas de cianuro libre (HCN y CN-) no son generalmente detectables en efluentes mineros, la preocupación por la contaminación de los efluentes radica en las formas complejas de cianuro y de romperse generan cianuro libre en los efluentes mineros de descarga. 3 CAPÍTULO II 2 2.1 MARCO TEÓRICO Antecedentes Según (Pillajo, 2011) las prácticas mineras actualmente utilizadas en el Ecuador, tiene sus orígenes en las operaciones que se han realizado desde el siglo XVI en el área Portovelo – Zaruma. Según (Sandoval, 2001)la minería en Ecuador se halla encasillada en la pequeña minería y minería artesanal, con poca supervisión gubernamental que a pesar de generar fuentes de empleo, en su mayoría produce afectaciones al entorno por la falta de procedimientos técnicos. Según (Opinion, 2010) en Zaruma y Portovelo es evidente que la actividad minera sigue sin control. El deterioro de la calidad de aguas es notorio. Hay contaminación no solo de los ríos y quebradas sino que se advierte en los últimos años pérdidas de vertientes de agua causados por la minería, La industria minera utiliza el método de cianuro para la extracción de oro a pesar de los problemas ambientales que presenta su uso debido a su bajo costo y a su simplicidad. El análisis químico es fundamental para el control y seguimiento del proceso de obtención del oro y la plata por cianuración. Por un lado, desde el punto de vista de operación de la planta de cianuración: consumo de reactivos y eficiencia del proceso; y, por otro lado, desde el punto de vista ambiental: toxicología daños al medio ambiente. (Sandoval, 2001) En Zaruma y Portovelo la actividad minera se realiza sin un control riguroso, existe contaminación de ríos, quebradas y perdida de vertientes por causa de la minería. Según (Opinion, 2010), no se debe permitir ninguna actividad minera en los nacimientos de agua que son utilizados para riego, en centros poblados y en las cuencas hidrográficas 4 donde existen zonas de producción para el consumo local y nacional. Se debe obligar a los mineros a cumplir el título VII, referente a la preservación del medio ambiente. La prohibición del uso del mercurio y la alternativa de cianuro son reflejo de una política nacional consecuente con la tendencia mundial de esa industria. Según (AZD, 2013) Respecto del cianuro, se explicó que este químico es utilizado en diversos países del mundo, en circuitos cerrados por lo que no hay riesgo de contaminación de ríos o fuentes de agua, y que en caso de que se devuelva el líquido a las quebradas o ríos, se lo hace luego de un tratamiento apropiado que permite neutralizar a esta sustancia química de tal manera que no sea nociva contra el medio ambiente. 2.2 Fundamento Teórico ¿Qué es el cianuro? El término cianuro sirve para designar una familia de compuestos químicos inorgánicos que se caracterizan por la presencia de un átomo de carbono enlazado a un átomo de nitrógeno mediante un enlace triple. (García, 2005) Existen más de 2,000 fuentes naturales de cianuro, entre ellos, distintas especies de artrópodos, insectos, bacterias, algas, hongos y plantas superiores. Las principales formas de cianuro producidas por el hombre son el cianuro de hidrógeno gaseoso y el cianuro sólido de sodio y de potasio. (Mark, Hagelstein, & Mudder, Abril 2001) Según (CAEM, 2013), puede extraerse en laboratorio, pero no industrialmente, de bacterias insectos, algas, hongos y diversas especies vegetales. Se encuentra en frutas y verduras de uso común como lentejas, papa, soya, espinaca, ciruelas, manzanas, peras y almendras. De manera industrial se comercializa de diferentes formas cianuro de hidrógeno como gas, cianuro de sodio o potasio ambas son sales. 5 2.3 Características del cianuro Se describe con un olor fuerte a almendras amargas, pero no siempre emana olor y no todas las personas pueden detectarlo. Además, el límite de detección del olor es muy cercano a la concentración donde comienza a ser tóxico. (Ospino, 2013) El cianuro puede formar moléculas de gas como el cianuro de hidrógeno (HCN) en solución el ácido cianhídrico y en complejos cristalinos como el cianuro de sodio (NaCN) o el cianuro de potasio (KCN). El cianuro se usa en un sinnúmero de productos industriales de uso masivo debido a sus propiedades únicas. Según (Jimenez, 2015), el cianuro es una de las sustancias más usadas en la extracción de oro, principalmente porque es fácil obtenerlo y tiene mayor efectividad en la recuperación de este metal; Sin embargo tiene altos niveles de toxicidad por lo que su uso debe ser controlado para evitar fugas, teniendo que ser reutilizado la mayor cantidad de veces antes de ser eliminado. Química del Cianuro Básicamente el cianuro (CN- o (C≡N)-) se presenta como cianuro de hidrógeno (HCN), que es un gas, o en forma de cristales como el cianuro de sodio (NaCN) o el cianuro de potasio (KCN). Se presenta generalmente en dos formas: cianuro libre y complejos de cianuro o metalocianuros. (Campos, Diagnóstico Ambiental de las descargas mineras líquidas y sólidas, en los recursos hídricos superficiales y subterraneos del canton Portovelo, 2013) La siguiente información fue tomada textualmente de (Campos, Diagnóstico Ambiental de las descargas mineras líquidas y sólidas, en los recursos hídricos superficiales y subterraneos del canton Portovelo, 2013) • Ión cianuro: este término se refiere solo al anión libre CN- en solución • HCN molecular: el HCN molecular es una molécula neutra que se denomina ácido cianhídrico o cianuro de hidrogeno. 6 • Compuestos simples de cianuro: compuestos iónicos que se disocian en el agua liberando un catión y un ion cianuro. Son sales que surgen de reacciones ácidobase. • Compuestos complejos de cianuro: compuestos que se disocian en el agua liberando un catión y un anión que contiene ion cianuro. El anión, denominado complejo, puede • seguir disociándose. Organocianuros: Compuestos orgánicos que contiene el grupo C≡N se lo denomina nitrilos o cianuros. Las cianhidrinas y glucósidos cianógenos son nitrilos que pueden liberar iones cianuro en condiciones apropiadas es por esto que presentan un comportamiento similar a compuestos de cianuros simples. • Cianuro libre: se denomina cianuro libre al HCN molecular o al ion cianuro. • Cianuro total (TCN): se denomina a los compuestos de cianuros que se encuentran en una solución acuosa. Termino que se emplea en procedimientos analíticos. • Cianuro disociable con ácido débil (WAD CN): término analítico que se usa para designar a los compuestos de cianuro que se disocian bajo reflujo, con un ácido débil. • Reacción con el CO 2 • En presencia de CO 2 , el cianuro forma HCN de acuerdo con: 2NaCN + H 2 O + CO 2 2HCN + Na 2 CO 3 Por consiguiente, la alcalinidad libre debe estar presente para reaccionar con el ácido carbónico y mantener la disociación del HCN. Si se utiliza cal, formaría CaCO 3 , el cual precipitará. En ausencia de álcalis, el HCN puede formar polímeros que precipitan en la forma de decoloraciones pardas o puede irse como gas a la fase de vapor. (Bermeo, 2001) • Oxidación Desde el punto de vista de oxidación, el ion cianuro puede ser rápidamente oxidado con el hipoclorito, el peróxido, el ozono, mezclas de dióxido de azufre/aire o por electrolisis. El oxígeno atmosférico reacciona lentamente con el cianuro a menos que sea catalizado. (Bermeo, 2001) 7 2.4 Propiedades toxicológicas del cianuro El cianuro es letal, el anión cianuro es altamente tóxico al igual que el ácido cianhídrico o HCN, bloquea la respiración celular en los organismos vivos. Los seres humanos pueden estar expuestos al cianuro mediante inhalación, ingestión o absorción a través de la piel. El cianuro impide a las células utilizar el oxígeno, lo cual causa hipoxia de los tejidos y “cianosis” (decoloración azulada de la piel. (Mark, Hagelstein, & Mudder, Abril 2001) Según (Linares, 2008), la dosis letal del HCN para humanos es de 1 a 2 g/l. Si se administra por vía oral. La forma más toxica del cianuro es el gas HCN en concentraciones de 20 a 40 ppm se puede observar problemas respiratorios después de varias horas de exposición. La exposición a concentraciones superiores a los 250 ppm de HCN en el aire, es letal la muerte ocurre en pocos segundos. Según (Mark, Hagelstein, & Mudder, Abril 2001) el grado de toxicidad del cianuro de hidrógeno (HCN) para los humanos depende del tipo de exposición. Dependiendo de ello se presentarán síntomas como respiración rápida, náusea, dolor de cabeza, presión sanguínea baja convulsiones, pérdida de la conciencia, entre otros. La polémica generada en torno a la minería se ha centrado en la utilización del cianuro para la extracción del oro; Si el cianuro se utiliza de una manera irresponsable puede ser tóxico para los seres humanos y la flora y fauna. 2.5 Usos industriales del cianuro El cianuro es uno de los principales compuestos utilizados por la industria química debido a su composición de carbono y nitrógeno, ambos elementos comunes, y a la facilidad con la cual reacciona con otras sustancias. (Perez, 2007) 8 En el mundo se producen cerca de 1,27 millones de toneladas de cianuro al año, cerca del 87% es utilizado en varias industrias para la producción de papel, pinturas, textiles, plásticos aditivos para alimentos, cosméticos fármacos y fotografía entre otros. En la industria farmacéutica el cianuro se utiliza para la producción del laetril, una sustancia para combatir el cáncer, y el nitroprusiato para reducir la presión arterial. También se utiliza en vendas quirúrgicas. El gas de cianuro se utiliza para exterminar plagas (ratas, ratones, lauchas, zarigüeyas etc.) e insectos en barcos, edificios y demás lugares que lo necesiten. (Oyola, 2015) La industria minera utiliza compuestos de cianuro para la extracción del oro. Según (Ambiente, 2013), este compuesto permite, en la mayoría de casos, obtener un proceso más eficiente y más rendidor de recuperación de oro y tiene la gran ventaja de no ser bioacumulable y es degradable de forma natural o artificial. Los compuestos de cianuro poseen un gran número de propiedades beneficiosas, lo que ha dado lugar a su producción comercial y aplicación industrial. El cianuro de sodio es el compuesto de cianuro que se utiliza con mayor frecuencia en la industria minera, seguido del cianuro de calcio. El cianuro de sodio se obtiene por reacción del hidróxido de sodio con el cianuro de hidrógeno 2.6 Uso del cianuro en la minería del oro El cianuro se utiliza en la industria minera para la extracción de oro porque permite de manera efectiva y eficiente la extracción del oro. Este proceso se denomina cianuración que actualmente sustituye al método de amalgado con mercurio, que es potencialmente contaminante pues carece la asimilación natural en el ecosistema, esta es una característica del cianuro. El uso de soluciones a base de agua para extraer y recuperar metales como el oro se denomina hidrometalurgia. Las operaciones de minería del oro utilizan soluciones muy diluidas de cianuro de sodio (NaCN), típicamente 9 entre 0.01% y 0.05% de cianuro (100 a 500 partes por millón). (Mark, Hagelstein, & Mudder, Abril 2001) Las técnicas de uso son las siguientes: • Lixiviación por agitación. Es la disolución selectiva de los metales, presentes en las especies mineralógicas de cualquier naturaleza, desde los sólidos que los contienen, mediante una solución disolvente acuoso. (DIAZ INOCENTE & CONDORI CCOILLO, 2009) La concentración de la solución cianurada está en el rango de 200 a 800 ppm (partes por millón equivale a gramos de cianuro por metro cúbico de solución). (Textos Cietificos.com, 2006). • Lixiviación in situ Método que consiste en la aplicación directa de soluciones al mineral que está ubicado en el lugar del yacimiento, sin someterlo a labores de extracción minera. • Lixiviación por percolación Consiste en una estructura con forma de paralelepípedo de hormigón, protegido interiormente con asfalto antiácido o resina epóxica, provisto de un fondo falso de madera y una tela filtrante, que se llena hasta arriba de mineral y que se inundan con las soluciones de lixiviación. (DIAZ INOCENTE & CONDORI CCOILLO, 2009) • Lixiviación del oro y plata En la industria minera se utiliza con frecuencia el cianuro de sodio (NaCN) por su mayor contenido de cianuro activo por su unidad de peso: 53%. 10 Según (DIAZ INOCENTE & CONDORI CCOILLO, 2009), la reacción de disolución que tiene lugar durante la lixiviación de estos elementos con soluciones de NaCN, son de tipo electroquímico. La reacción global del oro es: 4Au+(ac) + 8CN-(ac) + O2(g) 2.7 4Au(CN)-2(ac) + 4OH-(ac) (1) Método de cianuración de minas con oro y plata Las reacciones entre el cianuro y los metales preciosos han sido propuestas por muchos investigadores. Las más importantes de estas reacciones son (Bermeo, 2001). 1. Ecuación de Elsner (2) 2. Ecuación de McArthur- Forrest (3) 3. Ecuación de Bodlander (4) (5) 2.8 Técnicas de recuperación y destrucción del cianuro de residuos sólidos y líquidos Según (Gomez, 2015), después de llevadas a cabo las prácticas y pruebas de cianuración y recuperado el oro o en galvanoplastia, después de terminado el proceso de recubrimiento, la solución queda desprovista de oro y plata, pero sigue conteniendo cianuro en una concentración que está por encima de niveles permisibles. Según (Ambiente, 2013), el tratar de optimizar la economía del proceso forma parte de la rutina de operación de la planta. Este objetivo puede coincidir con el objetivo de minimizar el impacto del cianuro sobre el medio ambiente y optimizar el consumo del mismo. Los procesos disponibles de destrucción del cianuro se muestran a continuación: 11 Procesos de degradación natural: Volatilización Biodegradación Degradación solar/biológica Procesos de oxidación: SO 2 /aire Peróxido de hidrógeno Proceso Acidificación/Volatilización/Reutilización – AVR Ácido sulfúrico A continuación se describen algunos de los más importantes y más utilizados procesos de destrucción del cianuro o de su recuperación, cada proceso de tratamiento tiene ventajas y desventajas, y no siempre resulta económico. (Gomez, 2015). 2.8.1 Degradación natural Según (Mark, Hagelstein, & Mudder, Abril 2001), el principal mecanismo de degradación natural es la volatilización con posteriores transformaciones atmosféricas a sustancias químicas menos tóxicas; otros factores como la oxidación biológica, la precipitación y los efectos de la luz solar también contribuyen a la degradación del cianuro. Las mayores ventajas del proceso de degradación natural son los costos de capital y operación bajos, no se conoce de formación de productos tóxicos, y se le puede usar como un pre-tratamiento. (Linares, 2008) 2.8.2 Proceso INCO, SO2/Aire para la destrucción del cianuro. El Proceso INCO elimina las distintas formas de cianuro por procesos diferentes. 12 Las reacciones fundamentales que están involucradas en el proceso INCO, SO 2 /Aire, para la destrucción del cianuro y sus etapas de oxidación, neutralización y precipitación se describen a continuación. (Gomez, 2015) (6) (7) Donde n= 3 ó 4 2.8.3 El Proceso de peróxido de hidrógeno H2O2 Se han desarrollado dos procesos que utilizan el peróxido de hidrógeno para la destrucción oxidante del cianuro libre y los complejos de cianuro. (Linares, 2008) 1. Proceso conocido como Proceso Kastone, este proceso utiliza una solución de peróxido de hidrógeno al 41 % con unos pocos mg/l de formaldehído y cobre. 2. Proceso desarrollado por Degussa Corporation, empleando una solución de peróxido de hidrógeno y sulfato de cobre en varias concentraciones, aunque es común no emplear las sales de cobre, debido a la presencia de este metal dentro de los minerales tratados; la reacción fundamental es: (8) Ventajas y desventajas del proceso. Texto tomado de (Campos, Diagnóstico Ambiental de las descargas mineras líquidas y sólidas, en los recursos hídricos superficiales y subterraneos del canton Portovelo, 2013) Las ventajas son: 1. Los costes de capital son iguales o menores que los correspondientes a otros procesos de tratamiento químico. 2. El proceso es relativamente sencillo de diseño y funcionamiento. 13 3. Pueden reducirse a contenidos ambientalmente aceptables todas las formas de cianuro, incluidos los complejos que contienen hierro. 4. Los metales pesados se reducen apreciablemente por precipitación. 5. El proceso es adaptable a operaciones de tratamiento de tipo continuo y discontinuo. 6. El proceso se ha empleado en el tratamiento de pulpas, disoluciones de proceso clarificadas y soluciones de lavado de lixiviación en pila. 7. El proceso ha demostrado ser eficaz en laboratorio, en instalación experimental y en funcionamiento a escala industrial. 8. No hace falta una regulación muy estricta del pH. 9. No es necesaria la automatización, pero sí es recomendable para optimizarlo. 10. El proceso no produce cantidades grandes de lodo residual y no introduce cantidades apreciables de sólidos disueltos. 11. No es preciso abonar derechos de licencia. Las desventajas son: 1. El costo y consumo de sulfato de cobre y de peróxido de hidrógeno como reactivos pueden ser excesivos. 2. El proceso no elimina el amoniaco ni el tiocionato. 3. Puede ser preciso un tratamiento suplementario si las concentraciones de amoniaco, tiocionato y metales en el efluente residual sobrepasan los niveles ambientalmente aceptables. 4. El cianuro no se recupera. 2.8.4 Proceso de recuperación del cianuro con ácido sulfúrico (AVR). Según (SGS, 2015), el proceso ha estado en uso durante más de 50 años. En la utilización del cianuro el pH se controla cuidadosamente. Según(AGUIRRE, 2013) este método está concebido no solo para eliminar el cianuro de los efluentes líquidos, sino también para realizar una recuperación y reciclado del cianuro. 14 Utilizando ácido sulfúrico para favorecer de este modo la formación de ácido cianhídrico que, una vez en estado gaseoso, es absorbido en una solución de hidróxido de sodio en contracorriente. (Villar, 2013) Ventajas del proceso • Porcentajes altos de extracción del cianuro Durante todo el proceso se extreman las precauciones para asegurar que, en todo momento, el pH de la solución esté en el rango alcalino, de forma que el ácido cianhídrico no se escape hacia la atmósfera. (Gomez, 2015) Las reacciones que tienen lugar son: Acidificación (9) Volatilización (10) Reneutralización (11) Así, el cianuro de sodio formado según la reacción (11) puede ser recirculado al proceso de cianuración, lo que queda reflejado en la economía del mismo. Este proceso remueve el cianuro de la solución estéril como gas cianuro de hidrógeno y retorna en solución como un concentrado de cianuro de sodio (NaCN) respectivamente (Bermeo, 2001) 15 Según (Villar, 2013), la gran ventaja del proceso, sobre todo en minas remotas, es que el reactivo es reciclado y los costos de operación reducidos; Además, se evita el problema de toxicidad en la solución residual debida a los productos de oxidación del cianuro El NaCN recuperado de la etapa de reneutralización del proceso AVR puede realimentarse al proceso de lixiviación- Según (Dreisinger, 2000), el método AVR tiene una serie de inconvenientes potencialmente importantes, incluida la volatilización de gas HCN, que es peligroso, y las pérdidas de eficacia que pueden suponer un aumento de los costes. Este proceso requiere de equipos muy grandes que demandan un control constante, implicando además potenciales riesgos, como fugas, esto es particularmente delicado ya que puede afectar a los trabajadores y al ambiente si no se maneja con adecuada precaución. (Jimenez, 2015) • Metodología de recuperación de cianuros Para recuperar el cianuro de los efluentes líquidos, se aplica el tratamiento AVR (Acidificación, Volatilización y Reneutralización) que consta de tres etapas: 1. Acidificación: La muestra es acidificada mediante el uso de acido sulfúrico hasta llegar a un pH de 1 a 2, una vez acidificada la muestra se logra transformar CN- en ácido cianhídrico (HCN). (12) 2. Volatilización: El ácido cianhídrico obtenido en el paso anterior, por su elevada presión de vapor y temperatura es volatilizado hacia una cama de neutralización. 16 (13) 3. Reneutralización El ácido cianhídrico volatilizado es absorbido en una solución de NaOH para su neutralización y transformación en cianuro de sodio, la cual es una sal inorgánica estable. (14) El cianuro de sodio formado puede ser recirculado al proceso de cianuración, lo que queda reflejado como un aprovechamiento de este recurso, disminuyendo costos en la industria de refinación de oro. 2.9 Minería en el Ecuador En los últimos años se ha hablado mucho de la minería en el Ecuador, actualmente la técnica de explotación minera es muy antigua y artesanal. Ciertas actividades de la minería antigua aún se mantienen en la actualidad, usando aun recursos naturales para su extracción como es el agua, logrando así una contaminación exhaustiva de este recurso natural. Según (ALFATECLIMIN, 2007) actualmente, la mayor empresa de extracción y recuperación de oro es BIRA, de capital nacional, instalada en la zona de Zaruma y Portovelo. Otro grupo de empresas realiza otras actividades relacionadas con la minería como la recuperación por cianuración. Debido al gran crecimiento de la actividad minera en el Ecuador el estado ha realizado grandes reformas, ya que hasta antes de la ley minera del 2009 no existía regulación por parte del estado, por lo tanto existía la minería ilegal, que solo era aprovechado por 17 grandes grupos de poder con recursos suficientes para realizar esta actividad minera sin ninguna regulación, tecnología y estudio del impacto ambiental. Según (Campoverde, 2013)Desde la creación de la ley minera en enero del 2009, las autoridades tuvieron las armas suficientes para combatir la minería ilegal y esto sumado a medidas efectivas han minimizado rotundamente esta actividad, ya que esta ley contempla el cierre de minas, la confiscación de las máquinas de actividades mineras ilegales. Tipo de actividad minera en Ecuador Según el Plan Nacional de Desarrollo 2007- 2010 del sector minero en el Ecuador no existe una diferencia clara entre la minería a gran y pequeña escala pero de acuerdo a las actividades mineras que se realizan en el país podemos concluir los siguientes tipos de minería: (Loyola, 2010) 1. Minería a gran escala 2. Minería a pequeña escala Minería a gran escala Entramos en una nueva era, el comienzo de la explotación de la minería a gran escala y a cielo abierto, la minería a cielo abierto corresponde a la apertura de inmensos cráteres en forma de bancos o escalones gigantes para extraer minerales en la zona que se verificado la existencia de estos, dichas aperturas afectan a grandes superficies de terreno con la consiguiente pérdida de suelo. Minería a pequeña escala Este tipo de minería se caracteriza como una actividad de subsistencia y se lleva a cabo por los estratos más pobres, sin tierra excluidos de la economía formal. (Loyola, 2010) La minería a pequeña escala utiliza principalmente instrumentos manuales, se asienta en el trabajo familiar y obtiene volúmenes muy bajos de mineral, que utilizan para sostener a su economía familiar. 18 Producción de oro Mientras la minería avanza es riesgosa en general, la producción de oro puede ser tóxica Los mineros pueden separar fácilmente el oro del mineral, ellos mismos o a través de un intermediario que son plantas procesadoras de oro. Para realizar este proceso siempre se usa un método antiguo, barato y eficaz pero tan peligroso para la salud y el medio ambiente. Ecuador es un país con alto potencial minero Según (Encalada, 2009), el potencial minero de un país no se puede definir por indicios y depósitos de minerales menos de deducciones, si no en base de reservas de yacimientos, o sea de disponibilidad de recursos minerales cuya extracción es rentable y en minería metálica el Ecuador tiene un balance nacional de reservas insignificante. Asumir potencial como equivalente de posibilidad, no sirve para la planificación económica del país. Minería artesanal en el Ecuador Según (Miranda, 2013), la pequeña minería y minería artesanal como se le conoce nace en la zona sur del país a finales de los años 70, a raíz de la quiebra de la compañía industrial minera asociadas CIMA, que explotaba en las zonas de Zaruma y Portovelo y por el alza de precios del metal el desajuste de la administración minera del estado, que originaron el aparecimiento de actividades mineras informales o artesanales. La minería en el Ecuador no ha dejado su nivel de desarrollo a pesar del apoyo del gobierno. La minería existente en el país es la relacionada con la minería artesanal realizada por grupos familiares u organizaciones ubicadas en las provincias del sur del Ecuador. Según (López, 2010), los principales asentamientos mineros, varios de ellos caracterizados por las pésimas condiciones de vida de las poblaciones que no siempre se dedican a la actividad minera a tiempo completo y que la combinan con otras actividades de subsistencia, implican graves peligros. 19 Las principales zonas mineras artesanales se encuentran en Portovelo, Zaruma, Nambija y Ponce Enríquez. Según el ministerio de Energía y Minas el mayor impacto ambiental es el producido por 80 plantas de beneficio que trabajan sin autorización legal, que buscan exclusivamente los beneficios de la extracción sin medir daños que provocan al ambiente, a la sociedad y al estado. (EFE, 2014). Impacto ambiental Según (Consulting, 2009), los problemas vinculados con las actividades mineras son muy complejos y los seres humanos interactúan con su medio ambiente de diversas maneras. Entre los impactos ambientales producidos por la minería artesanal se mencionan 400.000 toneladas de relaves arrojadas directamente y sin ningún tratamiento previo en los ríos. En estos relaves existen productos peligrosos y metales pesados en proporciones superiores a las permitidas por la normativa vigente. (López, 2010) Esta situación se agrava en temporada de lluvias ya que los contaminantes se trasladan a mayor distancia y en grandes cantidades, desde el año 1996 la situación ha empeorado haciendo que el agua pierda su función principal de fuente de vida, otros tipos de usos y aprovechamiento de carácter público o productivo. Según (Consulting, 2009), el grado de exposición de la población es muy alto, principalmente por contacto directo Esta contaminación no afecta solamente la salud de los residentes más cercanos, sino que también está deteriorando las condiciones de vida de los agricultores de subsistencia en comunidades remotas cerca de la frontera peruana. Para evitar la contaminación del ambiente por actividades mineras se debería: 20 1. Apoyar a la tecnificación de la pequeña minería, enfatizando en la tecnología apropiada, minimizando los impactos ambientales, con una sistemática y permanente capacitación. 2. Impulsar el arranque de los proyectos mineros industriales con estudios avanzados dentro de conceptos amigables con el medio ambiente. 2.10 Métodos analíticos Técnicas de análisis químico Según (Nava-Alonso, Rodriguez, Salas, & Pérez, 2007), la elección de una técnica de análisis químico depende de varios factores: el tipo de cianuro que se quiere analizar, la concentración de cianuro, la precisión requerida, la claridad de la solución y, principalmente, la presencia de substancias que pueden interferir con el método de análisis. Las técnicas de análisis químico más utilizadas para determinar compuestos de cianuro son: 1. Volumetría 2. Cianuro libre por electrodo especifico de cianuro 3. Cianuro total por destilación Volumetría Se utiliza este método para concentraciones de cianuro mayores de 5 mg/l (ppm) y en soluciones claras; el método es rápido y fácil. La técnica se basa en la reacción del nitrato de plata con el ión cianuro en solución alcalina para formar el complejo soluble Ag(CN) 2 – según la reacción: (15) Cuando no queda más cianuro en la solución, el exceso de plata precipita como AgCN o reacciona con el indicador. El punto final de la titulación lo proporciona la aparición de una turbidez permanente. 21 Se recomienda realizar tres repeticiones y sacar un promedio del resultado. Materiales y procedimiento del método se encuentran descritos en: (APHA, 4500-CN-D Titrimetric Method, 1992) Cianuro libre por electrodo especifico de cianuro Este método se aplica para concentraciones bajas de cianuro. La técnica permite medir cantidades mínimas de cianuro. El electrodo para medir cianuro tiene una membrana de sulfuro de plata y yoduro de plata que reacciona con el cianuro de la solución y libera una cantidad proporcional de ion yoduro, según la siguiente reacción: (Nava-Alonso, Rodriguez, Salas, & Pérez, 2007) (16) El yoduro que se libera es detectado por el electrodo. Es necesario realizar una curva de calibración de concentración de soluciones estándar contra voltaje del potenciómetro. Materiales y procedimiento del método se encuentran descritos en: (APHA, Standard Methods 4500-CN-F, 1992) Cianuro total por destilación Este método cuantifica el cianuro libre, los cianuros simples y la mayoría de los complejos metálicos de cianuro. La variante más utilizada de este método para el análisis de cianuro total es una destilación ácida a reflujo que utiliza cloruro de magnesio como catalizador para descomponer los complejos metálicos. En esta técnica se genera ácido cianhídrico que es absorbido en una solución alcalina en la cual se cuantifica el cianuro libre. 22 El límite de detección es de 0,005 mg/l. El inconveniente principal de este método es la interferencia de ciertos elementos presentes en la solución. (Nava-Alonso, Rodriguez, Salas, & Pérez, 2007) Los materiales y procedimiento del método se encuentran descritos en: (APHA, Standard Methods 4500-CN-C, 1992) 2.11 Marco legal 2.11.1 Norma de calidad ambiental y de descarga de efluentes: recurso agua Texto tomado de la norma de Calidad Ambiental y de descarga de efluentes: recurso agua Definición Aguas Residuales Las aguas de composición variada provenientes de las descargas de usos municipales, industriales, comerciales, de servicios agrícolas, pecuarios, domésticos, incluyendo fraccionamientos y en general de cualquier otro uso, que hayan sufrido degradación en su calidad original 2.11.2 Criterios de calidad de aguas de uso agrícola o de riego Se entiende por agua de uso agrícola aquella empleada para la irrigación de cultivos y otras actividades conexas o complementarias que establezcan los organismos competentes. Se prohíbe el uso de aguas servidas para riego, exceptuándose las aguas servidas tratadas y que cumplan con los niveles de calidad establecidos en esta Norma. Los criterios de calidad admisibles para las aguas destinadas a uso agrícola se presentan a en la tabla 1 Anexo 1. 23 CAPÍTULO III 3 3.1 Metodología Tipo de investigación Esta es una investigación experimental destinada a la recuperación de cianuro proveniente de efluentes de aguas residuales de la industria minera y que posteriormente son utilizados como agua de riego en cultivos. Mediante el método AVR (Acidificación, Volatilización y Reneutralización) este proceso se basa en el equilibrio del HCN/CN- dependiendo del pH a menor valor se presenta mayor concentración de HCN en la solución y por consiguiente mayor posibilidades de volatilización. Con este método tras la acidificación la solución requiere ser neutralizada para su descarga. 3.2 Población y muestra Efluentes líquidos provenientes de la industria minera de la zona Zaruma- Portovelo en la Provincia de El Oro en Ecuador en las siguientes coordenadas UTM (Universal Transversal Mercator): X: 651.000 Y: 9´588.000 La muestra obtenida tiene un volumen de 4 litros proveniente de las descargas liquidas de la industria minero metalúrgica, 3.3 Diseño experimental Se analizó la influencia de dos variables: • Concentración de ácido solución (A) • Tiempo de extracción en horas (B) En la tabla 1 se identifica los niveles que se manejaron en el factor A y B 24 Tabla 1. Niveles del factor A y B de diseño Factor A Factor B Solución Acida (ml) Tiempo (horas) B 1 =1 hora A 1 = 1:1 B 2 =2 horas A 2 = 1:3 B 3 =4 horas A 3 =1:5 Se efectuó tres repeticiones a cada uno de los tratamientos, en total se utilizaron 27 unidades experimentales en las cuales se determinó la concentración de cianuros en las soluciones obtenidas utilizando el método rápido de MERCK 4.35 APHA 4500-CN-B y MERCK a) Hipótesis nula Ho: A1B1=A1B2 = A1B3= A2B1 = A2B2 = A2B3 = A3B1 = A3B2 = A3B3 = 0 b) Hipótesis Alternativa Ha: A1B1≠A1B2 ≠A1B3≠A2B1≠ A2B2 ≠A2B3 ≠A3B1 ≠ A3B2 ≠ A3B3 ≠ 0 3.3.1 Análisis de Varianza (ANOVA) para el método de recuperación de cianuros en aguas residuales de la industria minera Con este análisis se estudió la relación entre la variable dependiente y las dos variables independientes mostradas en la tabla VI, el principal objetivo es recuperar la mayor cantidad de cianuros. A continuación se presenta el esquema del análisis donde se elaboró una tabla de varianza, donde el conjunto de respuestas experimentales se consideró como una matriz de doble entrada. Aquí las combinaciones de los tratamientos están dispuestas en filas y las replicaciones en columnas, hecho esto, se calculó la sumatoria total y el promedio de las combinaciones En el cálculo del diseño experimental, es importante realizar una matriz que contenga los totales de los tratamientos, así se facilita el cálculo de las sumas de los cuadrados del factor A, B y la interacción AxB. A continuación calcularemos los siguientes parámetros para realizar el análisis de Varianza: 25 • Suma de cuadrados del factor A • Suma de cuadrados tota del factor B • Suma de cuadrados de la interacción AxB Con los valores calculados de la suma de cuadrados se elaboró la tabla 3 de análisis de varianza siguiente: Tabla 2 Análisis de Varianza (ANOVA) para el método de recuperación de cianuros en aguas residuales de la industria minera • FV SC GL Total Factor A SCT SC FA abn – 1 a–1 Factor B SC FB b–1 Interacción AB Error SCI AB (a – 1 )(b – 1) SCEE ab ( n – 1 ) Diferencia Cuadrados Medios F.cal Prueba de comparación múltiple Diferencia Mínima Significativa (DMS) Es el método de comparación múltiple posiblemente más utilizado, debido quizás a su fácil manera de aplicar. Es usualmente usado para comparar una pareja de medias de tratamientos, pero puede ser utilizado para comparaciones de más de dos medias de tratamientos. 26 Esta prueba determina el valor mínimo necesario para considerar diferentes dos tratamientos y lo utiliza para comparar los diferentes pares de medias que se deseen evaluar. (Montgomery, 2003) Obtenido el valor se agrupa en una tabla con el objeto de comparar la eficiencia, considerando el orden de sensibilidad y la exigencia. 3.4 Materiales y métodos El cianuro de hidrógeno (HCN) se libera a partir de una muestra acidificada por destilación y se purga con aire. El gas de HCN se recogió pasándola a través de una solución de lavado de NaOH. Concentración de cianuro en la solución de lavado se determina por método colorimétrico Equipos y materiales 1. Matraz de ebullición de 1 litro con tubo de entrada y un adaptador para el condensador enfriado por agua. 2. Absorbente del gas, con un tubo de dispersión de gas dotado de salida sinterizada de porosidad media. 3. Elemento calefactor, ajustable 4. Juntas de vidrio molido, con vidrio esmerilado o un lubricante apropiado para el matraz de ebullición y el condensador. (puede usarse también tampón de neopreno y juntas de plástico tejido. Reactivos 1. Solución ácido sulfúrico: agua 2. Reactivo de cloruro de magnesio 3. Carbonato de plomo, PbCO 3 en polvo 4. Ácido Sulfámico 5. Solución hidróxido de sodio 27 Preparación de solución estándar Pesar aproximadamente 0,3g de cianuro de sodio en un balón aforado de 1000 ml aforar con agua destilada, tomar una alícuota de 1 ml y llevar a un balón aforado de 1000 ml aforar con agua destilada. Preparación de la muestra 1. Añadir 250 ml de la muestra en el matraz de ebullición. Añadir 10 ml de solución de hidróxido de sodio al depurador de gas y diluir, si fuera necesario, con agua destilada hasta obtener una profundidad de líquido adecuada en el absorbente. No utilizar más de 225 ml de volumen total de la solución absorbente. Cuando se prevea una producción de sulfuros en el matraz de destilación, añádase 50 mg o más de PbCO 3 en polvo a la solución absorbente para precipitar sulfuros. Conéctese el equipo que consta de entrada de aire al matraz de ebullición, condensador, lavador de gas, sifón del matraz de succión y aspirador. 2. Añadir 2 g de ácido sulfámico a través del tubo de entrada de aire y lavar con agua destilada. 3. Añadir 50 ml de la solución de ácido sulfúrico: agua a través del tubo de entrada. Aclárese el tubo con agua destilada y deje que el aire mezcle el contenido del matraz durante 3 minutos. Añadir 20 ml del reactivo de MgCl2 por la entrada del aire y lavar con agua destilada, al calentar un posible precipitado se disolverá. 4. Calentar con ebullición rápida, pero sin inundar la entrada del condensador ni permitir que los vapores suban por encima de su mitad. Una tasa de reflujo de 50 a 40 gotas/min desde la salida del condensador indica que el reflujo es adecuado. Mantener el reflujo durante una hora. Interrumpir el calentamiento pero manteniendo el flujo de aire. Enfriar durante 15 min y vaciar el contenido del lavador del gas en un recipiente aparte. Aclarar el tubo de conexión entre el condensador y el lavador de gas con agua destilada, añadir el agua de aclarado al líquido vaciado, regular el pH goteando solución diluida de NaOH o de H 2 SO 4 hasta lograr un intervalo previsto de 2-8 donde optimo es 7; y, diluir hasta 250 ml en un matraz aforado. 5. Determinar el contenido de cianuro por el método de colorímetro con el Fotómetro SQ 118 MERCK. 28 CAPITULO IV 4 4.1 Resultados y discusión Análisis y discusión de resultados Los resultados tabulados para cada uno de las variantes factor A (solución ácida) y factor B (tiempo en horas), se encuentran expresados en ppm de NaCN Tabla 3 Concentración de cianuros en la solución estándar Tiempo (horas) 1 hora 2 horas 4 horas Promedio (ppm) Des. Est C.V(%) • 1:1 Concentración de NaCN (ppm) 0,223 0,254 0,241 0,258 0,245 0,236 0,251 0,249 0,252 Solución ácida en diferentes proporciones 1:3 1:5 Concentración Concentración Promedio de NaCN de NaCN (ppm) (ppm) (ppm) 0,215 0,232 0,236 0,215 0,229 0,221 0,222 0,245 0,224 0,221 0,235 0,234 0,223 0,223 0,241 0,267 0,258 0,261 0,255 0,256 0,259 0,245 0,235 0,238 0,01 4,1 0,02 8,5 0,02 8,4 Des. Est C.V (%) 0,01 5,7 0.01 5,5 0,01 3,0 De acuerdo a los resultados obtenidos de la solución estándar expresados en la tabla 4, el promedio de cianuros durante 1 hora de extracción y a diferentes soluciones acidas en relación (1:1), (1:2) y (1:3) es de 0,229 ppm a dos horas de extracción el promedio es 0,234 ppm y a 4 horas de extracción el promedio es de 0,225 ppm. • Los resultados expresados en la tabla 3 el promedio de las solución estándar tratada con una solución ácida en relación (1:1) y durante 1, 2 y 4 horas de tiempo de extracción el promedio es de 0,245 ppm, el promedio con una solución ácida (1:3) durante 1, 2 y 4 horas de extracción es de 0,235 ppm, con una solución ácida (1:5) durante 1,2 y 4 horas de extracción el promedio es 0,238ppm. 29 Tabla 4. Recuperación de cianuros solución estándar Tiempo (horas) 1 hora 2 horas 4 horas Promedio (%) • 1:1 Recuperación de cianuro (%) 79.8 82,1 83,6 Solución ácida en diferentes proporciones 1:3 1:5 Recuperación Recuperación Promedio de cianuro de cianuro recuperación de (%) (%) cianuro (%) 74,7 74.3 76,3 76,6 75,8 78,2 83,9 87,4 85,0 81,8 78,4 79,2 Porcentajes de recuperación obtenidos de la solución estándar se encuentran expresados en la tabla 5 a una, dos y cuatro horas de extracción con las soluciones ácidas (1:1), (1:3) y (1:5) se obtiene 76,3%, 78,2% y 85,0% de recuperación de cianuro respectivamente. Tabla 5. Concentración de cianuros en la muestra de agua residual Solución ácida en diferentes proporciones Tiempo (horas) 1 hora 2 horas 4 horas Promedio Des. Est (%) C.V. (%) • 1:1 Concentración de NaCN (ppm) 0,235 0,261 0,242 0,356 0,385 0,361 0,420 0,470 0,452 0,354 0,09 25,3 1:3 Concentración de NaCN (ppm) 0,230 0,256 0,242 0,371 0,402 0,365 0,432 0,459 0,482 0,360 0,10 26,6 1:5 Concentración de NaCN (ppm) 0,262 0,245 0,238 0,355 0,390 0,374 0,455 0,436 0,442 0,355 0,09 24,4 Promedio (ppm) Des. Estd (%) C.V. (%) 0,246 0,01 4,7 0,373 0,02 4,3 0,450 0,02 4,3 El análisis estadístico descriptivo expresado en la tabla 6 se somete a la muestra a diferentes variables de tiempo y solución ácida en diferentes relaciones (1:1), (1:3) y (1:5) a una, dos y cuatro horas el promedio de recuperación es 0,246 ppm, 0,373 ppm y 0,450 ppm respectivamente. • El tratamiento realizado a la muestra con una solución acida (1:1) a 1, 2, y 4 horas respectivamente obtenemos un promedio de 0,345 ppm, con una solución ácida de (1:3) a 1,2, y 4 horas es de 0,360 ppm y con una solución acida (1:5) a 1,2 y 4 horas de extracción de la muestra es de 0,355 ppm. 30 Figura 1 Concentración de cianuros de la solución estándar tratada con una solución acida (1:1) vs el tiempo Concentración de cianuros (ppm) Solc. Estándar: Concentración de cianuros 0,252 Tiempo:Solc. Ácida (1:1) 0,250 0,248 Lineal (Tiempo:Solc. Ácida (1:1)) 0,246 0,244 0,242 y = 0,0035x + 0,2372 R² = 0,898 0,240 0,238 0 1 2 3 4 5 Tiempo (horas) Figura 2 Concentración de Cianuros de la solución estándar tratada con una solución acida (1:3) vs el tiempo Solc. Estándar: Concentración de cianuros Concentración de cianuros (ppm) 0,255 Tiempo:Solc. Ácida (1:3) 0,250 0,245 Lineal (Tiempo:Solc. Ácida (1:3)) 0,240 0,235 0,230 y = 0,0095x + 0,213 R² = 0,981 0,225 0,220 0 1 2 3 Tiempo (horas) 31 4 5 Figura 3. Concentración de Cianuros en la solución estándar tratados con una solución ácida (1:5) vs el tiempo. Solc. Estándar: Concentración de cianuros Concentración de Cianuros (ppm) 0,264 Tiempo:Solc. Ácida (1:5) 0,262 0,260 0,258 Lineal (Tiempo:Solc. Ácida (1:5)) 0,256 0,254 0,252 y = 0,0041x + 0,2453 R² = 0,9358 0,250 0,248 0 1 2 3 5 4 Tiempo (horas) Figura 4. Concentración de Cianuros en la muestra tratados con una solución ácida (1:1) vs el tiempo. Concentración de cianuros (ppm) Solc. Muestra:Concentración de cianuros 0,480 Solc. Muestra:Trat. Solc. Ácida (1:1) 0,430 0,380 Lineal (Solc. Muestra:Trat. Solc. Ácida (1:1)) 0,330 0,280 y = 0,0632x + 0,206 R² = 0,908 0,230 0 1 2 3 4 Tíempo (horas) 32 5 Figura 5. Concentración de Cianuros en la muestra tratados con una solución ácida (1:3) vs el tiempo. Solc. Muestra:Concentración de cianuros Concentración de cianuros (ppm) 0,530 Solc. Muestra:Trat. Solc. Ácida (1:3) 0,480 0,430 Lineal (Solc. Muestra:Trat. Solc. Ácida (1:3)) 0,380 0,330 0,280 y = 0,067x + 0,2035 R² = 0,8853 0,230 0 1 2 3 4 5 Tiempo (horas) Figura 6. Concentración de Cianuros en la muestra tratados con una solución ácida (1:5) vs el tiempo. Solc. Muestra:Concentración de cianuros Concentración de cianuros (ppm) 0,480 Solc. Muestra:Trat. Solc ácida (1:5) 0,430 Lineal (Solc. Muestra:Trat. Solc ácida (1:5)) 0,380 0,330 y = 0,0611x + 0,2127 R² = 0,885 0,280 0,230 0 1 2 3 Tiempo (horas) 33 4 5 Análisis de la Varianza (ANOVA) para la recuperación de cianuros en aguas residuales provenientes de la industria minera Tabla 6. Promedio de las concentraciones de cianuro de sodio (ppm) en agua residual Factor A Factor B Concentración de Cianuros (ppm) Sumatoria (horas (1:1) (1:3) (1:5) 1 hora 0,738 0,728 0,745 2,211 2 horas 1,102 1,138 1,119 3,359 4 horas 1,342 1,373 1,333 4,051 Sumatoria 3,182 3,239 3,197 9,618 Análisis de la Varianza (ANOVA) realizado con los resultados obtenidos en la tabla 5 se presentan en la tabla 8 Tabla 7. Resumen del Análisis de Varianza (ANOVA) para el método de recuperación de cianuros en agua residual Factor de Suma de Grados de Diferencia de Variación Cuadrados Libertad Cuadrados Medios Factor A 0,000194 2 Factor B 0,1941 F. Cal F. Tab 95% 9,7x10-5 1,81ns 3,55 2 0,09705 3781,39* 3,55 0,00234 4 5,85x10-4 11,21ns 2,93 Error 0,00094 18 5,22x10-5 Total 0,19754 26 7,59x10-3 Interacción AxB ns: no significativo, * Significativo Los resultados de la tabla está sustentada en la hipótesis donde: Factor A H o : El factor de concentración de la solución ácida no influye en la recuperación de cianuros H a : El factor de concentración de la solución ácida si influye en la recuperación de cianuros 34 Factor B H o : El factor tiempo no influye en la recuperación de cianuros H a : El factor tiempo si influye en la recuperación de cianuros Factor AxB H o : La interacción tiempo vs Concentración de solución acida no influye en la recuperación de cianuros. H a : La interacción tiempo vs concentración de la solución acida si influye en la recuperación de cianuros. Decisión F.calculada es > F.Tabulada se acepta la hipótesis alternativa del factor B, la cual expresa que el factor B el tiempo si influye en la recuperación de cianuros. Prueba de comparación múltiple Diferencia Mínima Significativa (DMS) Al existir una diferencia significativa en el factor B (Tiempo) realizamos una prueba de comparación múltiple Tabla 8. Medias de los tratamientos del factor B Tratamiento Medias (ppm) T1 (1 hora) 0,246 T2 (2 horas) 0,273 T3 (4 horas) 0,450 35 Cálculo del valor DMS (Pulido, 2008) Tabla 9. Comparación múltiple entre medias para el factor B Comparaciones Diferencias 0,246-0,273 = 0,027 T1vsT2 0,246 – 0,450 = 0,204 T1 vs T3 0,273 – 0,450 = 0,177 T2 vs T3 NS: no significativo, * Significativo Valor DMS Significancia 0,00715 0,00715 0,00715 * * * Decisión El tiempo influye de manera significativa en la recuperación de cianuros de acuerdo al análisis estadístico realizado, por lo tanto el mejor tratamiento es el T3 el cual se somete a la muestra a un tiempo de extracción de 4 horas. 36 CAPITULO V 5 5.1 CONCLUSIONES Y RECOMENDACIONES Conclusiones • El método de recuperación no genera compuestos tóxicos como el amonio. • El tiempo influye de manera significativa en la recuperación de cianuros la diferencia entre tratamientos es significativa. • El tiempo influye de manera significativa en la recuperación de cianuros de acuerdo al análisis estadístico realizado, por lo tanto el mejor tratamiento es el T3 el cual se somete a la muestra a un tiempo de extracción de 4 horas. • Las soluciones alcalinas con las cuales se realizó el método de extracción no tienen impacto en el método de extracción de cianuros en aguas residuales, el tratamiento se puede realizar con los tres tipos de soluciones alcalinas planteadas en dicho trabajo de investigación. • El cianuro de sodio formado puede ser recirculado al proceso de cianuración para la obtención de oro en la industria minera de Zaruma - Portovelo lo que queda reflejado en la economía del mismo. • Este proceso remueve el cianuro de la solución esteril como gas de cianuro de hidrogeno y retorna en una solución como concentrado de cianuro de sodio (NaCN) respectivamente. • Existen procesos de extracción de cianuros como la degradación natural en el proceso de minería los cuales deben poner en práctica para así evitar la contaminación ambiental en ríos cercanos a las minas del sector de ZarumaPortovelo. 37 5.2 Recomendaciones • Se recomienda tomar en cuenta el tiempo de extracción de la muestra para obtener mayor recuperación de cianuros • Es recomendable usar la solución ácida de en relación 1:1 (agua: ácido) ya que se observa que la recuperación de cianuro es similar a diferentes soluciones acidas. • Se recomienda que durante todo el proceso se tome precauciones para asegurar que el pH de la solución esté en el rango alcalino, de forma que el ácido cianhídrico no se escapa a la atmosfera ya que es toxico. • Se recomienda dar a conocer la posibilidad de recuperar el cianuro mediante procesos de extracción en aguas residuales, con el fin de evitar el impacto de este compuesto en el ambiente sobre todo en aguas residuales cuyo destino son ríos. • Fomentar este tipo de procesos de recuperación de cianuros para generar explotaciones más amigables con el ambiente en la zona minera de ZarumaPotovelo. 38 BIBLIOGRAFÍA Textos Cietificos.com. (08 de julio de 2006). Obtenido de Textos Cietificos.com: http://www.textoscientificos.com/mineria/lixiviacion-oro/cianuracion AGUIRRE, F. A. (21 de enero de 2013). Procesos de destruccion de complejos cianurados. Procesos de destruccion de complejos cianurados. ALFATECLIMIN. (2007). Tecnologias limpias en la industria técnica minero metalurgica . Obtenido de http://www.tecnologiaslimpias.cl/ecuador/ecuador_indextramin.html Ambiente, M. d. (14 de Junio de 2013). Ministerio del Ambiente . Obtenido de Ministerio del Ambiente : http://www.ambiente.gob.ec/uso-de-cianuro-un-alternativa-ambiental-viablepara-actividades-mineras/ APHA. (1992). 4500-CN-D Titrimetric Method. Washington, EE.UU. APHA. (1992). Standard Methods 4500-CN-C. Washintong, EE.UU. APHA. (1992). Standard Methods 4500-CN-F. Washington, EE.UU. AZD. (11 de Junio de 2013). El debate por la minería continúa. El Mercurio. Bermeo, C. (2001). Tesis Algunos elementos para Mejorar la Gestion Ambiental y la Operación Sustentable de la Actividad Minera Aurifera de pequeña escala en el Ecuador. Quito: EPN. CAEM, C. A. (2013). Mineria Argentina TODAS LAS RESPUESTAS CIANURO. Argentina. Campos, D. I. (Marzo de 2013). Diagnóstico Ambiental de las descargas mineras líquidas y sólidas, en los recursos hídricos superficiales y subterraneos del canton Portovelo. Quito, Pichincha, Ecuador. Camposxxx, D. I. (Marzo 2013). Diagnóstico ambiental de las descargas mineras líquidas y sólidas, en los recursos hidirocos superficiales y subterraneos del canton Portovelo. Quito. Campoverde, C. (27 de marzo de 2013). Sociedad Ecuatoriana para la Defensa del Patrimonio Geologico y Minero . Obtenido de http://sedpgym-ecuador.blogspot.com/2013/03/zonasmineros-del-ecuador.html Clesceri, L. (2012). Standard Methods. Washington: Board. Consulting, A. (2009). Minería y Contaminación en Ecuador. Salud Enfoque Ecosistématico. Deshenes G, G. H. (2005). Cyanidation of gold corse notes, Minig and Mineral Sciencies Laboratories. Ontario, Canada. DIAZ INOCENTE, D. K., & CONDORI CCOILLO, I. (2009). PROCESO DE DETOXIFICACION DE SOLUCIONES CIANURADAS USANDO EL METODO INCO EN EFLUENTES MINEROS. LIMA PERU. Dreisinger, D. B. (2000). Patente nº ES 2 200 814 T3 . España. EFE, A. (26 de abril de 2014). Ecuador, Colombia y Perú impulsaran mineria artesanal y combatiran la ilegal. El telegrafo. 39 Encalada, I. V. (2009). Apuntes para una politica minera en el Ecuador . Geologia y Recursos Ecuador . Fagerberg, B., & Valencia, J. (2000). Proceso de Menas Auriferas en el sur del Ecuador. Quito: PRODEMINCA. García, R. A. (2005). Aplicación de Sistemas Pasivos para el Tratamiento de Soluciones residuales de procesos de cianuración en mineria de oro. Oviedo. Gomez, P. L. (06 de Marzo de 2015). SCRIB. Obtenido de SCRIB: https://es.scribd.com/doc/257821527/58521679-Efluentes-de-La-Lixiviacion-de-Oro-pdf# INIGEMM. (2010). Proyecto de investigacion Hidrogeologiae Hidrogeoquimicaen zonas mineras del Ecuador. Quito, Pichincha, Ecuador. Jhonn, Y. (1994). La Metalurgia Extractiva del Oro. Jimenez, L. (11 de Marzo de 2015). Diseñan proceso más seguro para absorcion y reutiilización de cianuro utilizado en minería del oro. Santiago de Chile, Chile. Linares, N. M. (2008). Manejo Ambiental de Residuos de cianuración de oro en el laboratorio metalurgico de la facultad de ingeniería metalurgica de la Universidad Nacional Jorge Basadre Grohmann. Tacna- Perú. López, E. I. (2010). Los daños de la actual actividad mineras a las fuentes de agua. periodico Opción . Loyola, A. B. (2010). Politicas Públicas, como herramientas de control socio-ambiental en las actividades de explotación minera de la Provincia de ZAmora Chinchipe. Loja, Loja, Ecuador. Mark, L., Hagelstein, K., & Mudder, T. (Abril 2001). El Manejo del Cianuro en la extracción del Oro. Otawa, Ontario. Miranda, S. M. (2013). La Minería y pequeña minería en el cantón Yacumbi, provincia de Zamora Chinchipe: Analisis Socioeconomico y ambiental, periodo 2001-2013. Loja, Loja, Ecuador. Montgomery. (2003). Diseño y análisis de experiementos. México D.F: Willey. Nava-Alonso, F., Rodriguez, E., Salas, U., & Pérez, G. (2007). Analisis Químico de cianuro en el Proceso de cianuración: revisión de los principales métodos . Revista de Metalurgia. Opinion, D. (20 de ago de 2010). Preocupacion por perdida de recursos hidricos: El Oro. Opinion Diario Moderno y Profesional. Ospino, E. L. (7 de Septiembre de 2013). Prezi. Obtenido de Prezi: https://prezi.com/2ewm6ku9r2fj/nitrilos-y-cianuros/ Oyola, O. S. (4 de Junio de 2015). El Cianuro. El Cianuro. Machala, El Oro, Ecuador. Perez, B. F. (2007). Desarrollo de un nuevo método para la eliminación de cianuro en aguas residuales de mina. Pillajo, E. (2011). Mineria al servicio de los Ecuatorianos . Quito: FUNGEOMINE. Priester, M. (s.f.). Costos y beneficios de la peueña mineria en los paises en vías de desarrollo. 40 PRODEMINCA. (1999). Monitoreo ambiental del las areas Mineras en el sur del Ecuador 19961998. Ecuador. Pulido, H. G. (2008). Analisis y Diseño de experimentos . Mexico: Mac Graw Hill. Sandoval, F. (2001). La Pequeña Minería en el Ecuador. SGS. (2015). SGS. Obtenido de SGS: http://www.sgs.cl/es-ES/Mining/Metallurgy-and-ProcessDesign/Cyanidation-Technologies/Cyanide-Recovery.aspx Skoog, H. C. (2008). Principios de Analisis Insrumental (Sexta ed.). Mexico D.F: Cengage Learning Inc. Skoog, W. H. (1997). Fundamentos de Química Analítica. Barcelona: Reverté S.A. T., Y. C. (1995). Cyanide remediation: current and post technologies 10th Annual coference on Hazards Waste Research. Villar, M. R. (2013). ESTUDIO SOBRE LA CINÉTICA DE REACCIÓN DEL GAS OZONO (O3) CON IONES DE CIANATO (CNO-) EN AGUAS RESIDUALES DEL PROCESO MACARTHUR-FORREST. Guatemala. Wikipedia. (19 de Abril de 2015). Cianuro. Yupari, A. (2003). Pasivos ambientales mineros en sudamerica. Chile: SERNAGEOMIN. 41 ANEXOS Anexo 1. Criterios de calidad de aguas de uso agrícola o de riego Parámetro Expresado como Aluminio Arsénico(total) Bario Berilio Boro (total) Cadmio Al As Ba Be B Cd concentración total de Carbamatos CNCo Cu mg/ml mg/ml mg/ml mg/ml mg/ml mg/ml Carbatos Totales Cianuro (total) Cobalto Cobre Cromo hexavalente Flúor Hierro Litio Material Flotante Manganeso Molibdeno Mercurio (total) Níquel Organofosforados (total) Unidad Límite máximo permisible 5,0 0,1 1,0 0,1 1,0 0,0 mg/ml 0,1 mg/ml mg/ml mg/ml 0,2 0,1 2,0 Cr+6 mg/ml 0,1 F mg/ml mg/ml mg/ml mg/ml mg/ml mg/ml mg/ml mg/ml 1,0 5,0 2,5 Ausencia 0,2 0,01 0,001 0,2 mg/ml 0,1 Li visible Mn Mo Hg Ni Concentración de organofosforados totales Concentración de organoclorados totales Ag Organoclorados mg/ml 0,2 (total) Plata mg/ml 0,05 Potencial de pH mg/ml 6-9 hidrógeno Plomo Pb mg/ml 0,05 Selenio Se mg/ml 0,02 Fuente: Norma de Calidad Ambiental y de descarga de efluentes: Recurso Agua 42