Descargar - Química I
Anuncio

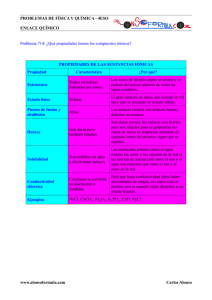
Departamento de Ciencia y Tecnología Departamento de Ciencia y Tecnología QUIMICA 1 QUIMICA 1 Comisión B Comisión B Lunes 10 am – 1 pm Miércoles 12 am – 2 pm Dra. Silvia Alonso ([email protected]) Lic. Evelina Maranzana ([email protected]) Dra. Silvia Alonso ([email protected]) Lic. Evelina Maranzana ([email protected]) LAS SUSTANCIAS Y LOS ENLACES CLASIFICACION DE LAS SUSTANCIAS • Para poder estudiar a las sustancias, tratando de acercarnos a ellas e intentar conocerlas parece apropiado tratar de clasificarlas en algunas pocas categorías, para así dedicar nuestros esfuerzos a tratar de comprender cada una de ellas a la vez • Una primera aproximación es clasificarlas por su estado de agregación: sólidos, líquidos y gases, y veremos qué puede aportar el análisis de los estados de agregación de la materia a la naturaleza del enlace que se presenta en un compuesto DIAGRAMAS DE FASES Es un gráfico que muestra las fases de una sustancia, que existe a diferentes temperaturas y presiones H2O CO2 PROPIEDADES DE LOS SOLIDOS Tipos de Sólidos Tipo Unidad Estructural Iónico Iones Metálico Atomos métalicos Molecular Fuerzas Uniones Iónicas Uniones metálicas Ejemplos NaCl & MgO Moléculas Dispersión, Dipolo/Dipo lo Unión-H H2O & CO2 RED Atomos ordenados Unión Covalente Diamante & Grafito Amorfo Atomos desordenados Unión Covalente Vidrio & Plásticos Hierro & Cobre CLASIFICACION SEGÚN ESTADO DE AGREGACION • Sea que la materia esté compuesta de átomos no enlazados (como en los gases nobles), moléculas (como en el agua) u otros agregados de átomos cargados eléctricamente (como en la sal común), por simplicidad, llamaremos genéricamente a cualquiera de estas partículas constituyentes de la materia como entidades • Ya saben que la materia se presenta en tres estados de agregación: sólido, líquido y gaseoso. En un gas la densidad es muy baja, comparada con la de un líquido o un sólido • También, los gases son compresibles, mientras que los otros estados no lo son • Estas propiedades se pueden explicar porque las entidades que forman el gas están muy separadas unas de las otras y tienen más movilidad que en los otros estados. Es decir, en líquidos y sólidos la distancia entre las entidades es menor, lo mismo que la movilidad Serie de compuestos sólidos, con muy altos puntos de fusión • Tabla 1. Sólidos con elevados puntos de fusión Estado de agregación Sólidos con temperatura de fusión alta Compuestos Punto de fusión (0C) Cloruro de sodio (NaCl) 800 Diamante [C diamante)] 3550 Hidroxiapatita, forma parte de huesos [Ca5(PO4)3OH] 1600 Hierro (Fe) 1528 • Si la temperatura de fusión es aquélla a la cual un sólido pasa al estado líquido, podemos suponer que la mayor o menor temperatura de fusión de un sólido es un reflejo de la intensidad de las fuerzas de atracción entre las entidades que lo forman. Es decir, un alto punto de fusión nos sugiere que las entidades que conforman esa sustancia se encuentran unidas por interacciones muy fuertes • Esto puede asociarse con la posibilidad de que cada una de las entidades que constituye al sólido esté unida con la misma intensidad a cada una de las entidades vecinas, y éstas a su vez se encuentren unidas con la misma intensidad a cada una de sus vecinas, formando una red tridimensional muy rígida, a la que hay que aplicar mucha energía para romper. A este tipo de interacciones se les llama “multidireccionales” • En los sólidos con temperatura de fusión alta, las interacciones entre las entidades que los constituyen son multidireccionales • Cuando hay interacciones de este tipo, las sustancias NO se presentan como líquidos o gases, ya que se forma una red infinita de entidades fuertemente unidas entre sí PROPIEDADES DE LOS SOLIDOS A. Red Cristalina y Celda Unidad • Estructura de los sólidos pueden describirse como redes tridimensionales de átomos, iones, o moléculas Red BiDimensional Celda Unidad –La unidad más pequeña que se repite y que conserva todas las propiedades de simetría del arreglo atómico, iónico o molecular Punto de red - Las esquinas de una celda unidad en una red cristalina Red Cristalina - Colección de celdas unidad que se repiten en las tres dimensiones (x, y, z). PROPIEDADES DE LOS SOLIDOS Red Cristalina en las tres dimensiones PROPIEDADES DE LOS SOLIDOS En la naturaleza hay ocho diferentes celdas unidades que difieren en la longitud del lado y en los ángulos PROPIEDADES DE LOS SOLIDOS Celdas Unidad Cúbicas PROPIEDADES DE LOS SOLIDOS B. Metales • Atomos están en arreglos de disposición regular unidos unos a otros por uniones metálicas • Las Uniones Metálicas semejan uniones iónicas sumergidas en un “mar de electrones” • Caracteristicas: 1) Maleables & dúctiles 2) Buenos conductores del calor y la electricidad 3) Amplio rango de dureza y puntos de fusión ENLACE METALICO • Lo forman los metales • Es un enlace bastante fuerte • Los átomos de los metales con pocos e− en su última capa no forman enlaces covalentes, ya que compartiendo electrones no adquieren la estructura de gas noble • Se comparten los e− de valencia colectivamente • Una nube electrónica rodea a todo el conjunto de iones positivos, empaquetados ordenadamente, formando una estructura cristalina de alto índice de coordinación • Existen dos modelos que lo explican: – Modelo del mar de electrones – Modelo de bandas ENLACE METALICO Modelo de bandas • Se basa en la Teoría de Orbitales Moleculares (TOM) (bandas en el espectro de emisión) • Se combinan infinidad de orbitales atómicos con lo que se producen bandas de orbitales moleculares • Los e– ocupan los O.M. enlazantes de menor energía (banda de vlencia) • Quedan los orbitales antienlazantes de mayor energía libres formando la PROPIEDADES DE LOS COMPUESTOS METALICOS • Son dúctiles y maleables debido a que no existen enlaces con una dirección determinada. Si se distorsiona la estructura los e– vuelven a estabilizarla interponiéndose entre los cationes • Son buenos conductores debido a la deslocalización de los e–. Si se aplica el modelo de bandas, puede suponerse que la banda vacía (de conducción está muy próxima a la banda en donde se encuentran los e– de forma que con una mínima energía éstos saltan y se encuentran con una banda de conducción libre PROPIEDADES DE LOS COMPUESTOS METALICOS • Conducen el calor debido a la compacidad de los átomos que hace que las vibraciones en unos se transmitan con facilidad a los de al lado • Tienen, en general, altos Puntos de Fusión y Puntos de Ebullición dependiendo de la estructura de la red. La mayoría son sólidos • Tienen un brillo característico debido a la gran cantidad de niveles muy próximos de energía que hace que prácticamente absorban energía de cualquier “λ” que inmediatamente emiten (reflejo y brillo) Maleabilidad de un metal presión © Grupo ANAYA. Química 2º Bachillerato. Comparación con estructura de un cristal iónico Ejemplo: La configuración electrónica de un elemento: a) ¿Permite conocer cuál es su situación en el sistema periódico? b) ¿Indica qué clase de enlaces puede formar con otros elementos? c) ¿Es suficiente información para saber si el elemento es sólido, líquido o gas? d) ¿Sirve para conocer si el elemento es o no molecular? Justifique las respuestas. a) Sí b) Sí c) No d) Sí. Si acaba en “s” o d” se tratará de un elemento metálico y el compuesto no será molecular. Igualmente, los gases nobles (p6) se encuentran como átomo aislados. Son moleculares los elementos no metálicos (p2 - p5). Ejercicio: Rellenar el siguiente cuadro poniendo en cada casilla la fórmula del elemento o de un compuesto que formen entre ellos, el tipo de enlace (C = covalente, I = iónico, M = metálico) y el estado de agregación (S = sólido, L = líquido, G= gas), tal como aparece en el ejemplo. Cl Cl Cl C G 2 H O Ca H HCl C H2 C O G G Cl2O C H2O C O2 C Ca G CaCl2 I S CaH2 I S L G CaO I S Ca M S PROPIEDADES DE LOS SOLIDOS C. Compuestos Iónicos • Las fuerzas de atracción que mantienen unidos a los átomos se llaman enlaces químicos ¿Por qué se unen los átomos? • Los átomos, moléculas e iones y se unen entre sí porque al hacerlo se llega a una situación de mínima energía, lo que equivale a decir de máxima estabilidad • Son los electrones más externos, los también llamados electrones de valencia los responsables de esta unión, al igual que de la estequiometría y geometría de las sustancias químicas Diagrama de energía frente a distancia interatómica R a d r eco .. . o nd Tipos de enlaces • Intramoleculares: – Iónico – Covalente • Intermoleculares: – Fuerzas de Van de Waals – Enlaces de hidrógeno • Metálico R a d r eco .. . o nd ENLACE IÓNICO • Se da entre un metal que pierde uno o varios electrones y un no metal que los captura • Resultan iones positivos y negativos que se mantienen unidos por atracciones electrostáticas, formando redes cristalinas. • Las reacciones de pérdida o ganancia de e– se llaman reacciones de ionización: • Ejemplo: Na – 1 e– → Na+ O + 2e– → O2– Reac. global: O + 2 Na → O2– + 2 Na+ • Fórmula del compuesto (empírica): Na2O ENLACE IONICO + + + → → → 2 Na ( s ) + Cl 2 + + + [ → (g) ]− + + 2 ClNa [ [ + ] ] I ( Na) = 496kJ / mol − − ∆E(Cl) = −349kJ / mol ∆H = − 822 kJ Na+ estructura del NaCl sólido Cl- E ∝ Q 1QQ Q E∝ 1 22 dd Propiedades de los compuestos iónicos Energía de red • Duros • Quebradizos • Altos pf y pe • Conducen la corriente cuando están fundidos Energía de red (reticular) en los compuestos iónicos (∆Hret o U) • Es la energía desprendida en la formación de un compuesto iónico sólido a partir de sus iones en estado gaseoso • Ejemplo: En el caso de la formación de NaCl la Er corresponde a la reacción: • Na+ (g) + Cl– (g) → NaCl (s)(∆Hret < 0) • Es difícil de calcular por lo que se recurre a métodos indirectos aplicando la ley de Hess Es lo que se conoce como ciclo de Born y Haber Factores de los que depende la Energía reticular • Al ser siempre negativa consideraremos siempre valores absolutos • A mayor carga de los iones mayor “U”. Ejemplo: Así el CaO (Ca2+ y O2–) tendrá “U” mayor que el NaCl (Na+ y Cl–) • A menor tamaño de los iones menor “U”. Ejemplo: Así el NaCl (Na+ y Cl–) tendrá “U” mayor que el KBr (K+ y Br–) Ciclo de Born y Haber • La reacción global de formación de NaCl es: • Na (s) + ½ Cl2 (g) → NaCl (s) (∆Hf = –411’1 kJ) • que puede considerarse suma de las siguientes reacciones: • Na (s) → Na (g) (∆Hsubl = +107’8 kJ) • ½ Cl2 (g) → Cl (g) (½ ∆Hdis= +121’3 kJ) • Cl (g) → Cl– (g) (AHAE = –348’8 kJ) • Na (g) → Na+ (g) (AHEI = +495’4 kJ) • Na+ (g) + Cl– (g) → NaCl (s) (∆Hret = ?) Ciclo de Born y Haber Na (s) + ½ Cl2 (g) → NaCl (s) (∆Hf = – 411’1 kJ). Na (s) → Na (g) (∆Hsubl = +107’8 kJ) ½ Cl2 (g) → Cl (g) (½ ∆Hdis= +121’3 kJ) Cl (g) → Cl– (g) (AHAE = –348’8 kJ) Na (g) → Na+ (g) (AHEI = +495’4 kJ) Na+ (g) + Cl– (g) → NaCl (s) (∆Hret = ?) De donde puede deducirse que: ∆Hret = ∆Hf – (∆Hsubl + ½ ∆Hdis + AHAE + AHEI) • ∆Hret = –411’1 kJ – (107’8 kJ + 121’3 kJ –348’8 kJ + 495’4 kJ) = –786’8 kJ • • • • • • • Estructura cristalina • Los iones en los compuestos iónicos se ordenan regularmente en el espacio de la manera más compacta posible • Cada ión se rodea de iones de signo contrario dando lugar a celdas o unidades que se repiten en las tres direcciones del espacio Índice de coordinación • “Es el número de iones de signo opuesto que rodean a un ion dado” • Cuanto mayor es un ión con respecto al otro mayor es su índice de coordinación Principales tipos de estructura cristalina • NaCl (cúbica centrada en las caras para ambos iones) – Índice de coord. para ambos iones = 6 • CsCl (cúbica para ambos iones) – Índice de coord. para ambos iones = 8 • CaF2 (cúbica centrada en las caras para el Ca2+ y tetraédrica para el F– ) – Índice de coord. para el F– = 4 – Índice de coord. para el Ca2+ = 8 Molecula.fli F− Ca2+ ESTRUCTURA CRISTALINA Factores de los que depende • El tamaño de los iones • La estequeometría que viene dada por la carga de los iones de forma que el cristal sea neutro • Para calcular el nº de átomos por celda se toma una celda unidad y: – Se divide por 8 el nº de iones de los vértices. – Se divide por 4 el nº de iones de las aristas. – Se divide por 2 el nº de iones centrales de las caras – Se suman todos y se añaden los iones del interior de la celda Ejemplo: Calcular el nº de cationes y aniones que hay en las celdas de NaCl, CsCl y CaF2 • NaCl: – Cl– : 1 ión en cada vértice (8/8 = 1) + 1 ión en el centro de cada cara (6/2 = 3). En total, 1 + 3 = 4 – Na+: 1 ión en el centro de cada arista (12/4 = 3) + 1 ion en el centro del cubo (1). En total, 3 + 1 = 4 • CsCl: – Cl– : 1 ión en cada vértice (8/8 = 1). En total, 1 – Cs+ : 1ión en el centro del cubo (1). En total, 1 • CaF2: – Ca2+ : 1 ión en cada vértice (8/8 = 1) + 1 ion en el centro cada cara (6/2 = 3). En total, 1 + 3 = 4 – F– : 8 iones en el interior de cada celda (8). En total, 8 – Hay por tanto el doble F– que Ca2+ F − C a 2 + R O S EPA PROPIEDADES DE LOS COMPUESTOS IÓNICOS • Puntos de fusión y ebullición elevados (tanto más cuanto mayor ∆HU) ya que para fundirlos es necesario romper la red cristalina tan estable por la cantidad de uniones atracciones electrostáticas entre iones de distinto signo Son sólidos a temperatura ambiente • Gran dureza.(por la misma razón) • Solubilidad en disolventes polares (tanto más cuanto menor U) e insolubilidad en disolventes apolares • Conductividad en estado disuelto o fundido. Sin embargo, en estado sólido no conducen la electricidad • Son frágiles Disolución de un cristal iónico en un disolvente polar RE PA SO Solubilidad de un cristal iónico © Grupo ANAYA. Química 2º Bachillerato. R O S EPA Fragilidad en un cristal iónico presión © Grupo ANAYA. Química 2º Bachillerato. PROPIEDADES DE LOS SOLIDOS C. Compuestos Iónicos • Normalmente los cationes ocupan huecos en celdas unidad de los aniones • Iones Cesio ocupan huecos cúbicos en una celda unidad cúbica simple de iones sodio PROPIEDADES DE LOS SOLIDOS C. Compuestos Iónicos • Normalmente los cationes ocuparán huecos en celdas aniónicas unidad • Iones Sodio ocupan huecos octaédricos en celda unidad cúbica centrada en las caras de iones cloruros PROPIEDADES DE LOS SOLIDOS C. Compuestos Iónicos • Cristales de NaCl se cortarán en cristales más pequeños que duplican el cristal grande (estructura macromolecular) PROPIEDADES DE LOS SOLIDOS C. Compuestos Iónicos • Normalmente los cationes ocupan huecos en celdas unidad aniónicas • Iones Zinc ocupan huecos tetraédricos en una celda unidad cúbica centrada en caras de iones sulfuro Sustancias cuyas entidades forman redes tridimensionales con interacciones multidireccionales • En la Figura 1 mostramos dos ejemplos típicos: el cloruro de sodio y el diamante. PROPIEDADES DE SOLIDOS C. Compuestos Iónicos • Resumen: 1) Iones Mn+ ocupan huecos cúbicos en celdas cúbicas simples de Xn- iones (ejemplo: CsCl) 2) Iones Mn+ ions ocupan huecos octaedricos en celdas cúbicas centradas en cara 3) Iones Mn+ ions ocupan huecos tetraedricos en celdas unidad centradas en caras de iones Xn(ejemplo: ZnS) • Caracteristicas: 1) Duros & quebradizos 2) Pobres conductores de la electricidad como sólidos, buenos conductores al estado líquido 3) Altos puntos de fusión 4) Generalmente solubles en agua Evidencia de las reacciones químicas • Cambio físico – la composición química de una sustancia permanece constante – Fundir hielo • Cambio químico – la composición química de una sustancia cambia – Oxidación del hierro • Reacción química – a la sustancia le ocurre un cambio químico y forma una nueva sustancia • Un cambio químico se lleva a cabo cuando: – Se produce un gas – Se produce un sólido insoluble – Se observa un cambio de color permanentemente – Se observa un cambio de calor • Exotérmico – se libera calor • Endotérmico – se absorbe calor Escribiendo ecuaciones químicas • Ecuación química: Flecha: produce coeficiente reactivos catalítico condiciones productos subíndic e 2A + B2 Temperatura, presión, solventes 2AB • La flecha: indica produce • Catalítico – sustancia que acelera la velocidad de reacción sin consumirse o alterarse permamentemente • Coeficientes: son los números a la derecha de la fórmula • Subíndice: son los números pequeños que indican el número de átomos de cada clase que hay en la fórmula química Estado físico • N2(g) + H2(g) NH3(g) El estado físico se indica de la siguiente manera: - (g) gas o con una flecha hacia arriba – (l) líquido – (s) sólido o con una flecha hacia abajo sólido – (ac) acuoso LEY DE CONSERVACIÓN DE LA MASA Balanceo de una ecuación • N2 + H2 NH3 • Los coeficientes son usados para balancear la ecuación y esto permitirá que el número de átomos sea igual en ambos lados • Hay 2 N en la izquierda. Para que hayan 2 N en el lado derecho, colocar el coeficiente 2 al NH3: • N2 + 3H2 2NH3 • Ahora hay dos moléculas de NH3 y 2x3 = 6 H del lado derecho • Poner coeficiente 3 al H2 • La ecuación quedó balanceada Conteo de los átomos • N2 + 3H2 átomo 2NH3 izquierda derecha N 1x2=2 2x1=2 H 3x2=6 2x3=6 Izquierda derecha ¿Qué significa esta ecuación? N2 1 molécula de nitrógeno (con 2 átomos) reacciona con 1 mol de nitrógeno (N2) reacciona con + 3H2 3 moléculas de hidrógeno (con 2 átomos) para formar: 3 moles de hidrógeno (H2) para formar: 2NH3 2 moléculas de amóníaco ( Cada molécula contiene 1 N y 3 átomos de H) 2 moles de amoníaco (NH3) Moléculas diatómicas • Siete elementos existen naturalmente como moléculas diatómicas: H2, N2, O2, F2, Cl2, Br2, y I2 Balanceo de ecuaciones (tanteo) Monóxido de nitrógeno + oxígeno → dióxido de nitrógeno Paso 1: Escriba la reacción usando símbolos químicos. Paso 2: Balancee la ecuación química. 2 NO + 1O2 → 2NO2 Representación molecular NO NO2 O2 NO NO2 • No introduzca átomos extraños para balancear: NO + O2 → NO2 + O • No cambie una fórmula con el propósito de balancear la ecuación: NO + O2 → NO3 Recomendaciones para balancear • Balancee primeramente, los elementos que aparecen en sólo un compuesto en cada lado de la ecuación • Balancee los elementos libres por último. • Balancee los grupo poliatómicos sin cambiarlos • Se pueden utilizar coeficientes fraccionarios que al final del proceso son convertidos en enteros por una simple multiplicación Ejemplo El hidrógeno gaseoso reacciona con oxígeno gaseoso para producir agua. Paso 1: hidrógeno + oxígeno agua Paso 2: H2 + O2 H2O Paso 3: 2 H2 + O2 2 H2O