Trombosis en vena cava inferior tras cirugía correctora de atresia
Anuncio

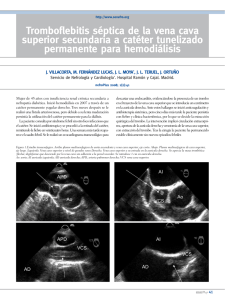
(Rev. Esp. Anestesiol. Reanim. 2003; 50: 472-476) NOTA CLÍNICA Trombosis en vena cava inferior tras cirugía correctora de atresia tricuspídea (Técnica de Fontán) en paciente pediátrico J. C. De Vicente Sánchez*, A. Pérez Ferrer*, M.I. García Vega*, E. Gredilla Díaz*, F. Reinoso Barbero* Servicio de Anestesiología, Reanimación y Tratamiento del Dolor. Hospital Universitario Infantil La Paz. Madrid. Resumen Un varón de 13 años de edad y 35 Kg de peso fue intervenido de corrección de atresia de la válvula pulmonar mediante conexión cavo-pulmonar total (técnica de Fontán). Durante el periodo intraoperatorio y postoperatorio inmediato no hubo ninguna incidencia reseñable. A partir del tercer día de la cirugía, desarrolló un cuadro de bajo gasto cardiaco, fracaso renal y fracaso de ventrículo derecho. A pesar de que el paciente tenía pautado tratamiento antitrombótico con heparina sódica (10 UI/Kg/h), se detectaron dos trombos en vena cava inferior, que comprometían el retorno venoso. La trombolisis con urokinasa fue ineficaz. La trombectomía quirúrgica tan sólo tuvo éxito parcialmente. Finalmente fue una pauta de heparina sódica intravenosa a altas dosis (25 UI/Kg/h) la que consiguió la resolución de los trombos. Es necesario insistir en la importancia de la profilaxis antitrombótica en el postoperatorio de las cirugías correctoras de cardiopatías congénitas. La realización de ecografías de control en estos pacientes, aún en ausencia de manifestaciones clínicas, se ha demostrado como una técnica muy sensible y eficaz para la detección precoz de este tipo de fenómenos trombóticos. Palabras clave: Cirugía cardiaca: técnica de Fontán. Patología asociada: atresia tricuspídea. Complicaciones: trombosis vena cava. Introducción La atresia de la válvula tricúspide es una malformación cardiaca que representa el 1,5 - 3% de todos los casos de cardiopatías congénitas1. Se caracteriza por hipoxemia arterial, existencia de un ventrículo derecho hipoplásico o inexistente, un ventrículo izquierdo hipertrófico, y una *Facultativo Especialista de Área. Correspondencia: Dr. Jesús C. De Vicente Sánchez Servicio de Anestesiología, Reanimación y Tratamiento del Dolor. Hospital Universitario La Paz. Hospital Infantil Paseo de la Castellana 261. 28046 MADRID E-mail: [email protected] Aceptado para su publicación en julio de 2003. 472 Inferior vena cava thrombosis after pediatric Fontan surgery to correct tricuspid atresia Summary A 13-year-old boy weighing 35 Kg underwent surgery to correct pulmonary valve atresia by total caval-pulmonary anastomosis (Fontan procedure). During surgery and recovery, no adverse events were observed. On the third day after surgery, the patient developed signs of low cardiac output, renal failure, and right ventricular insufficiency. In spite of an antithrombotic treatment protocol with sodium heparin (10 IU/Kg/h), venous return was found to be impeded by 2 thrombi in the inferior vena cava. Thrombolysis with urokinase was ineffective, and surgical thrombectomy was only partially successful. Finally, a high dose of intravenous heparin was prescribed (25 IU/Kg/h) and the thrombi were dissolved. The importance of prophylactic antithromboembolic therapy following corrective surgery for congential heart disease must be emphasized. Ultrasound monitoring of these patients, even in the absence of clinical signs, has proven effective for early detection of the thrombotic events described in this report. Key words: Cardiac surgery: Fontan procedure. Associated disease: tricuspid atresia. Complications: vena cava thrombosis. marcada disminución del flujo sanguíneo pulmonar, con signos de cianosis en el 90% de los niños. La sangre pobremente oxigenada de la aurícula derecha pasa a través de una comunicación interauricular a la aurícula izquierda, allí se mezcla con la sangre oxigenada y entra en el ventrículo izquierdo, desde donde es bombeada a la circulación sistémica. El flujo sanguíneo pulmonar se mantiene a través de una comunicación interventricular, un ductus arterioso persistente o los vasos bronquiales2,3. Su tratamiento quirúrgico se realiza mediante la técnica de Fontán, que consiste en el aislamiento y anastomosis de la aurícula derecha a la arteria pulmonar derecha. A continuación se anastomosan la vena cava superior a la arteria pulmonar derecha, permaneciendo ambas arterias pulmonares en continuidad. Finalmente el flujo de la vena cava inferior se canaliza a las arterias pulmonares mediante un conducto de Gore-Tex® (habitualmente 50 J.C. DE VICENTE SÁNCHEZ ET AL.– Trombosis en vena cava inferior tras cirugía correctora de atresia tricuspídea (Técnica de Fontán) en paciente pediátrico Fig. 1. Trombo filiforme de 5 cm de largo y 0,8 cm de ancho en la vena cava inferior. Imagen del tercer día del postoperatorio de la cirugía correctora de atresia tricuspídea (técnica de Fontán). fenestrado), proporcionando así una conexión cavopulmonar total4-6. Entre las complicaciones postoperatorias más frecuentes de esta técnica quirúrgica se encuentran los fenómenos trombóticos (20-33%), habitualmente en múltiples localizaciones. Sin embargo, la presencia de trombos aislados en vena cava inferior no había sido descrita previamente en la literatura médica. Caso clínico Varón de 13 años de edad y 35 Kg de peso, sin alergias medicamentosas conocidas y con antecedentes personales de atresia pulmonar con septo íntegro y ventrículo derecho hipoplásico, trombosis de arteria pulmonar izquierda, y paresia diafragmática izquierda, intervenido previamente para realización de una fístula sistémico-pulmonar (en el periodo neonatal), derivación cavo-pulmonar tipo Glenn (hacía 10 años) y fístula arterio-venosa antecubital izquierda (hacía 3 años). Se programó en el momento actual para llevar a a cabo la cirugía correctora mediante la técnica de Fontán. En el estudio preoperatorio destacaban los siguientes datos analíticos: hematocrito: 62,7%, hemoglobina: 18,7 g/dl, actividad protrombina: 68%, INR: 1,4 y el resto de los parámetros estaban dentro de los límites de la normalidad. La radiografía de tórax evidenciaba una cardiomegalia moderada, a expensas de cavidades izquierdas. La saturación periférica de oxígeno (SpO2) en condiciones basales era del 82%. A la exploración física mostraba una acrocianosis importante. El ECG era normal y la ecocardiografía confirmaba los diagnósticos cardiológicos previos. El periodo intraoperatorio transcurrió bajo anestesia general balanceada sin incidencias. El tiempo de circulación extracorpórea (CEC) fue de 1 hora y 45 minutos y no se utilizó cardioplejia ni pinzamiento aórtico. A la salida de CEC se produ51 Fig. 2. Trombo residual en la vena cava inferior a nivel infrahepático después de la trombectomía quirúrgica parcial. jo un episodio de oliguria que respondió a la reposición volémica con cristaloides. Salió de CEC en ritmo sinusal, con SpO2 =100%, hemodinámicamente inestable (tensión arterial: 68/40 mmHg, frecuencia cardiaca: 126 latidos/min), precisando soporte con fármacos inotrópicos: dopamina 10 µg/Kg/min, dobutamina 5 µg/Kg/min y milrinona 0,4 µg/Kg/min. En las primeras 24 horas del postoperatorio el paciente continuó inestable, necesitando un aporte de 1.300 ml de cristaloides, y adrenalina a una dosis de 1,3 µg/Kg/min para el mantenimiento de tensiones arteriales de perfusión adecuadas. En el segundo día, se estabilizó la hemodinámica del paciente de forma progresiva, lo cual permitió su extubación y la disminución de los fármacos simpáticomiméticos, aunque apareció una hepatomegalia a 3 cm del reborde costal, y una disminución de la SpO2 hasta el 92%. El día siguiente se detectó un discreto aumento de los valores de creatinina séricos (1,4 mg/dl), por lo que se realizó una ecografía renal y abdominal, que resultaron ser normales. Asimismo, se inició pauta de anticoagulación con heparina sódica intravenosa (10 UI/Kg/h). La SpO2 continuó disminuyendo, llegando al 77%, por lo que se administró óxido nítrico con mascarilla facial, a una concentración de 20 ppm, lo que hizo mejorar la SpO2 hasta el 83–85%. Durante las horas siguientes (tercer día postoperatorio), se instauró progresivamente un cuadro clínico de bajo gasto cardiaco, con fracaso renal (prerrenal), y disfunción del ventrículo derecho, manifestado clínicamente por aparición de ascitis, marcado aumento de la hepatomegalia (8-10 cm) y edemas importantes, de predominio en miembros inferiores, que precisó aumentar el soporte inotrópico. El fracaso renal cursó con oligoanuria, aumento de la urea (168 mg/dl) y creatinina séricas (2 mg/dl), disminución del aclaramiento de creatinina calculado (17,5 ml/min/m2), y fracción excretada de sodio del 2,4%, parámetros todos ellos compatibles con una necrosis túbulo intersticial aguda, previsiblemente secundaria a la situación de bajo gasto cardiaco. Este fracaso renal agudo con insuficiencia/shock car473 Rev. Esp. Anestesiol. Reanim. Vol. 50, Núm. 9, 2003 diogénico condicionó la colocación de un catéter para la realización de diálisis perito-neal, así como el aumento de las dosis de diuréticos de asa intravenosos. Se realizó una ecocardiografía y ecografía abdominal, y se detectaron dos trombos a nivel de vena cava inferior, uno de 2 cm de largo adherido a la pared vascular, y otro filiforme, de 5 cm de largo y 0,8 cm de ancho, próximo a la punta del catéter femoral, y que comprometían parcialmente el retorno venoso (Figura 1). Se desestimó el tratamiento trombolítico, debido a la cirugía muy reciente (5 días antes), y se decidió aumentar la dosis de anticoagulación con heparina sódica (fijando como objetivo mantener un tiempo de coagulación 2-2,5 veces superior al control), administrada por el orificio distal del catéter femoral, aprovechando su proximidad a los trombos, y realizar ecografías seriadas para ver la evolución de los mismos. Para ello se administró una dosis bolo de 1500 UI (~40 UI/Kg) de heparina sódica, seguido de una perfusión continua de 20 UI/kg/h. A las 12 horas se realizó una nueva ecografía, que demostró que persistían los trombos en vena cava inferior. Dado el riesgo que suponía para el paciente que se liberasen dichos trombos y ocluyesen la rama pulmonar derecha, lo cual podría tener fatales consecuencias puesto que el niño ya tenía trombosada la rama pulmonar izquierda, se procedió a realizar tratamiento fibrinolítico con urokinasa. Se administró un bolo de 140.000 UI (4.000 UI/Kg) de urokinasa en 10 minutos, y se instauró una perfusión continua de 140.000 UI/Kg/h (4.000 UI/Kg/h) durante 6 horas. Posteriormente se volvió a practicar otra ecografía, que seguía evidenciando trombos de características similares al control previo. Por ello, se decidió realizar una trombectomía quirúrgica en quirófano, bajo CEC (de 41 minutos de duración), sin pinzamiento aórtico. Posteriormente se hizo una nueva ecografía, y se vio un trombo residual en la vena cava inferior, a nivel infrahepático, de 2 cm de largo y 1 cm de ancho (Figura 2). Ante la imposibilidad de extraer quirúrgicamente el trombo residual, se administró una infusión continua de heparina a dosis altas (25 UI/Kg/h). La evolución de los valores de los parámetros de la coagulación durante los siete días posteriores a la cirugía se muestra en la tabla I. Durante los 2-3 días siguientes, el tamaño del trombo fue disminuyendo progresivamente. A medida que disminuía el trombo, mejoró notable, aunque lentamente, el retorno venoso, el cuadro de shock cardiogénico y el fracaso ventrícular derecho (disminuyó la hepatomegalia, desapareció la ascitis, etc.), se recuperó el cuadro de insuficiencia renal, y se fueron normalizando los parámetros analíticos. El paciente fue dado de alta de la Unidad de Reanimación 18 días después de ser intervenido, sin secuelas y con una pauta de anticoagulación oral con acenocumarol. Discusión A pesar de ser una técnica quirúrgica ampliamente reconocida y utilizada, la cirugía correctora de la atresia 474 de la válvula tricúspide mediante derivación cavo-pulmonar total presenta una serie de complicaciones asociadas, tales como la aparición de fístula venosa de vena cava superior a vena pulmonar7, bronquitis plástica8, alteraciones neurológicas9, arritmias (especialmente supraventriculares)10 e infartos11, que deben ser tenidos en cuenta. Sin embargo, son los fenómenos trombóticos, con bastante diferencia, la complicación más frecuente, llegando incluso a alcanzar el 20-33% de los pacientes sometidos a este tipo de cirugía12. No obstante, la aparición de trombos aislados en la vena cava inferior no habían sido descritos previamente en la literatura médica, sino que se describen como parte de episodios de trombosis más extensa (incluso masivos), que abarcan otras localizaciones además de la vena cava inferior, como puede ser la vena cava superior, aurícula derecha y arteria pulmonar13,14. Su aparición tiene un pico de máxima incidencia durante el primer año de postoperatorio y otro pico después del décimo año15. Se ha mencionado como causa de su frecuente formación, un estado de hipercoagulabilidad, debido a un déficit de proteína C, factor II, factor V, factor VII, factor IX, factor X, plasminógeno, fibrinógeno y antitrombina III, e incluso un aumento de la reactividad plaquetaria16, en este tipo de pacientes17- 21. También se proponen factores mecánicos, como la presencia de un flujo sanguíneo lento y no laminar22- 24, o la presencia de alteraciones de la función hepática (manifestadas clínicamente por elevación de los valores de aspartato amino transferasa, alanina amino transferasa y gamma glutaril transpeptidasa), o la existencia de alteraciones hemodinámicas inespecíficas, como aumento de la presión media en aurícula izquierda o disminución del índice cardiaco25, como causa responsable de estas alteraciones trombogénicas. Podemos por tanto resumir diciendo que en los pacientes sometidos a la técnica quirúrgica de Fontán, se produciría una disminución de la síntesis de factores procoagulantes y anticoagulantes, que supondría un factor de riesgo tanto para trombosis como para sangrado. Las alteraciones hemodinámicas, en ausencia de la función de bomba de la aurícula derecha, predispondrían a una disfunción hepática subclínica o no, que conduciría a alteraciones selectivas de la síntesis de proteínas. Sin embargo, no se han encontrado diferencias regionales en estas alteraciones de la coagulación, mientras que la aparición de trombos sí parece ser selectiva en determinadas localizaciones, como ya hemos comentado13, 14. Por lo tanto, los mecanismos y causas de las anomalías de la coagulación en este tipo de pacientes permanece incierto. El paciente que describimos estuvo siempre (durante los 3 días que transcurrieron desde el momento de la cirugía, hasta la detección de los trombos) en rangos analíticos de anticoagulación, con valores de actividad de pro52 J.C. DE VICENTE SÁNCHEZ ET AL.– Trombosis en vena cava inferior tras cirugía correctora de atresia tricuspídea (Técnica de Fontán) en paciente pediátrico TABLA I Valores de los parámetros de coagulación del paciente durante los 7 días posteriores a la cirugía Horas tras la cirugía 0 12 24 (1 día) 36 48 (2 días) 60 72 (3 días) 84 96 (4 días) 108 120 (5 días) 132 144 (6 días) 156 168 (7 días) Actividad de protrombina (%) Tiempo de cefalina (s) Ratio tiempo cefalina Fibrinógeno (mg/dl) 37 38 37 41 34 58 50 50 45 58 60 60 58 59 66 43,3 50,9 37,4 36,8 40,1 32,9 34 35 35,3 31,7 50,9 43,5 37,9 63,6 33,7 1,37 1,61 1,18 1,16 1,27 1,06 1,08 1,11 1,12 1,01 1,61 1,38 1,21 2,01 1,07 263 250 302 333 321 318 294 263 282 365 381 411 451 454 289 trombina que oscilaron entre el 37% y el 60%, valores de antitrombina III y fibrinógeno normales, y cifras de tiempo de cefalina entre 31,7 segundos y 50,9 segundos, todos ellos valorados de forma periódica cada 6-12 horas (Tabla I). La estrategia de terapia antitrombótica en pacientes pediátricos sometidos a cirugías correctoras de cardiopatías congénitas no ha sido bien definida26, 27, a pesar de ello, y dada la frecuencia de aparición de fenómenos trombóticos en este tipo de pacientes, consideramos de especial importancia la introducción precoz de pautas de anticoagulación (ya sea con heparina sódica o heparinas de bajo peso molecular28) así como la estricta monitorización de su eficacia, desde periodos tan tempranos como puede ser el segundo día después de la cirugía15. Una vez establecida la presencia de trombos, tanto la cirugía, como la anticoagulación (con warfarina o heparina) o la trombolisis con estreptokinasa, se han revelado como técnicas útiles para su eliminación13, 29. Por todo ello debemos concluir que, dada la frecuencia de aparición de fenómenos trombóticos, de especial incidencia en el periodo postoperatorio inmediato de la cirugía de derivación cavo pulmonar total en niños13, de localización preferente en vena cava superior, aurícula derecha, anastomosis cavo pulmonar, arteria pulmonar, e incluso en vena cava inferior, sería conveniente la realización de ecografías de control en estos pacientes para detectar de forma precoz la existencia de trombos, tratarlos de forma adecuada, y prevenir complicaciones, que en algunos casos pueden ser muy graves, antes de que comiencen a dar sintomatología clínica. La ecocardiografía transesofágica se ha revelado como una técnica más sensible y útil que la ecocardiografía convencional para la detección de este tipo de fenómenos trombóticos13. 53 Datos clínicos Heparina 10 UI/Kg/h Heparina 10 UI/Kg/h Heparina 10 UI/Kg/h Heparina 10 UI/Kg/h Heparina 20 UI/Kg/h Heparina 20 UI/Kg/h Urokinasa 140.000 UI Trombectomía quirúrgica Heparina 25 UI/Kg/h BIBLIOGRAFÍA 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. Waldman JD, Wernly JA. Cyanotic congenital heart disease with decreased pulmonary blood flow in children. Pediatr Clin North Am 1999; 46: 385-404. Anderson RH, Ho SY, Rigby ML. The morphologic variability in atrioventricular valvar atresia. Cardiol Young 2000; 10: 32-41. Rao PS. A unified classification for tricuspid atresia. Am Heart J 1980; 99: 799-804. Rosenkranz ER. Surgery for congenital heart disease. Curr Opin Cardiol 1994;9:200-215. Sade RM, Fyfe DA. Tricuspid atresia: current concepts in diagnosis and treatment. Pediatr Clin North Am 1990; 37: 151-169. Freedom RM, Hamilton R, Yoo SJ, Mikailian H, Benson L, McCrindle B, et al. The Fontan procedure: analysis of cohorts and late complications. Cardiol Young 2000; 10: 307-331. Clapp S, Morrow WR. Development of superior vena cava to pulmonary vein fistulae following modified Fontan operation: case report of a rare anomaly and embolization theraphy. Pediatr Cardiol 1998; 19: 363-365. Costello JM, Steinhorn D, McColley S, Gerber ME, Kumar SP. Treatment of plastic bronchitis in a Fontan patient with tissue plasminogen activator: a case report and review of the literature. Pediatrics 2002; 109: 67. Kirham FJ. Recognition and prevention of neurological complications in pediatric cardiac surgery. Pediatr Cardiol 1998; 19: 331-345. Porter CJ, Garson A. Incidence and management of dysrhythmias after Fontan procedure. Herz 1993; 18: 318-327. Day RW, Boyer RS, Tait VF, Ruttenberg HD. Factors associated with stroke following the Fontan procedure. Pediatr Cardiol 1995; 16: 270275. Odegard KC, McGowan FX Jr, DiNardo JA, Castro RA, Zurakowsk D, Connor CM, et al. Coagulation abnormalities in patients with single-ventricle physiology precede the Fontan procedure. J Thorac Cardiovasc Surg 2002; 123: 459-465. Fyfe DA, Kline CH, Sade RM, Gillette PC. Transesophageal echocardiography detects thrombus formation not identified by transthoracic echocardiography after the Fontan operation. J Am Coll Cardiol 1991; 18: 1733-1737. Okita Y, Miki S, Kusuhara K, Ueda Y, Tahata T, Komeda M et al. Massive systemic venous thrombosis after Fontan operation: report of a case. Thorac Cardiovasc Surg 1988; 36: 234-236. Seipelt RG, Franke A, Vazquez-Jimenez JF, Hanrath P, von Bernuth G, Messmer BJ, et al. Thromboembolic complications after Fontan pro- 475 Rev. Esp. Anestesiol. Reanim. Vol. 50, Núm. 9, 2003 16. 17. 18. 19. 20. 21. 22. cedures: comparison of different therapeutic approaches. Ann Thorac Surg 2002; 74: 556-562. Ravn HB, Hjortdal VE, Stenbog EV, Emmertsen K, Kromann O Pedersen J, et al. Increased platelet reactivity and significant changes in coagulation markers after cavopulmonary connection. Heart 2001; 85: 61-65. Odegard KC, McGowan FX Jr, Zurakowski D, DiNardo JA, Castro RA, del Nido PJ, et al. Coagulation factor abnormalities in patients with single-ventricle physiology immediately prior to the Fontan procedure. Ann Thorac Surg 2002; 73: 1770-1777. Bull K. The Fontan procedure: lessons from the past. Heart 1998; 79: 213-214. van Nieuwenhuizen RC, Peters M, Lubbers LJ, Trip MD, Tijssen Jg, Mulder BJ. Abnormalities in liver function and coagulation profile following the Fontan procedure. Heart 1999; 82: 40-46. Sluysmans T, Ovaert C, d’Udekem Y, Barrea C. Coagulation factor abnormalities after the Fontan procedure and its modifications. J Thorac Cardiovasc Surg 1999; 117: 1038. Monagle P, Andrew M. Coagulation abnormalities after Fontan procedures. J Thorac Cardiovasc Surg 1998; 115. 732-733. Jahangiri M, Kreutzer J, Zurakowski D, Bacha E, Jonas RA. Evaluation of hemostatic and coagulation factor abnormalities in patients undergoing the Fontan operation. J Thorac Cardiovasc Surg 2000; 120: 778-782. 476 23. Rauch R, Ries M, Hofbeck M, Buheitel G, Singer H, Klinge J. Hemostatic changes following the modified Fontan operation (total cavopulmonary connection). Thromb Haemost 2000; 83: 678-682. 24. Cromme-Dijkhuis AH, Henkens CM, Bijleveld CM, Hillege HL, Bom VJ, van der Meer J. Coagulation factor abnormalities as possible thrombotic risk factors after Fontan operations. Lancet 1990; 336: 1087-1090. 25. Tomita H, Yamada O, Ohuchi H, Ono Y, Arakaki Y, Yagihara T, et al. Coagulation profile, hepatic function, and hemodynamics following Fontan-type operations. Cardiol Young 2001; 11: 62-66. 26. Reller MD. Congenital heart disease: current indications for antithrombotic theraphy in pediatric patients. Curr Cardiol Rep 2001; 3: 9095. 27. Kurosawa H. Current strategies of the Fontan operation. Ann Thorac Cardiovasc Surg 1998; 4: 171-177. 28. Geggel RL. Update on the modified Fontan procedure. Curr Opin Cardiol 1997; 12: 51-62. 29. Dajee H, Deutsch LS, Benson LN, Perloff JK, Laks H. Thrombolytic theraphy for superior vena caval thrombosis following superior vena cava-pulmonary artery anastomosis. Ann Thorac Surg 1984; 38: 637639. 54