LABORATORIO DE QUÍMICA ANALÍTICA 1. FECHA DE ENTREGA
Anuncio
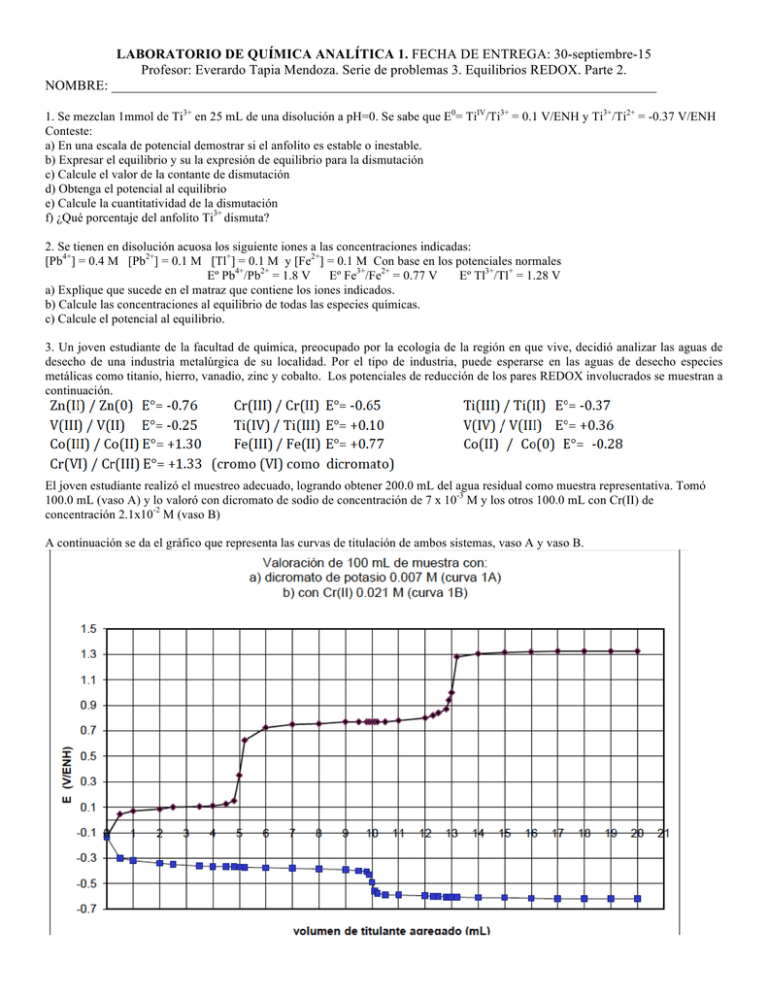
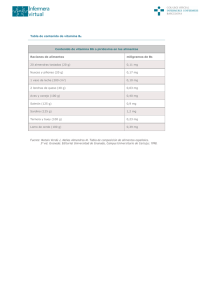
LABORATORIO DE QUÍMICA ANALÍTICA 1. FECHA DE ENTREGA: 30-septiembre-15 Profesor: Everardo Tapia Mendoza. Serie de problemas 3. Equilibrios REDOX. Parte 2. NOMBRE: _______________________________________________________________________________ 1. Se mezclan 1mmol de Ti3+ en 25 mL de una disolución a pH=0. Se sabe que E0= TiIV/Ti3+ = 0.1 V/ENH y Ti3+/Ti2+ = -0.37 V/ENH Conteste: a) En una escala de potencial demostrar si el anfolito es estable o inestable. b) Expresar el equilibrio y su la expresión de equilibrio para la dismutación c) Calcule el valor de la contante de dismutación d) Obtenga el potencial al equilibrio e) Calcule la cuantitatividad de la dismutación f) ¿Qué porcentaje del anfolito Ti3+ dismuta? 2. Se tienen en disolución acuosa los siguiente iones a las concentraciones indicadas: [Pb4+] = 0.4 M [Pb2+] = 0.1 M [Tl+] = 0.1 M y [Fe2+] = 0.1 M Con base en los potenciales normales Eº Pb4+/Pb2+ = 1.8 V Eº Fe3+/Fe2+ = 0.77 V Eº Tl3+/Tl+ = 1.28 V a) Explique que sucede en el matraz que contiene los iones indicados. b) Calcule las concentraciones al equilibrio de todas las especies químicas. c) Calcule el potencial al equilibrio. 3. Un joven estudiante de la facultad de química, preocupado por la ecología de la región en que vive, decidió analizar las aguas de desecho de una industria metalúrgica de su localidad. Por el tipo de industria, puede esperarse en las aguas de desecho especies metálicas como titanio, hierro, vanadio, zinc y cobalto. Los potenciales de reducción de los pares REDOX involucrados se muestran a continuación. El joven estudiante realizó el muestreo adecuado, logrando obtener 200.0 mL del agua residual como muestra representativa. Tomó 100.0 mL (vaso A) y lo valoró con dicromato de sodio de concentración de 7 x 10-3 M y los otros 100.0 mL con Cr(II) de concentración 2.1x10-2 M (vaso B) A continuación se da el gráfico que representa las curvas de titulación de ambos sistemas, vaso A y vaso B. a) ¿Qué especies están en las aguas residuales? b) ¿Qué concentración presentan dichas especies? c) Busca las respectivas normas donde se especifiquen los límites máximos permisibles para cada especie metálica encontrada en la muestra y diga si dichos efluentes, cumplen o no cumplen con las especificaciones. 4. La vitamina C (ácido ascórbico), simbolizada como Cred, con un peso molecular de 176.13 g/mol, puede ser oxidada a ácido dehidroascórbico (Cox), esta característica ha inducido a utilizar la vitamina C como antioxidante. Las frutas secas, especialmente las frutas cítricas, y las verduras son fuentes de vitamina C. Por otro lado, algunos complementos de vitamina C contienen vitamina K, sin embargo ésta última no debe sobrepasar el 25% en peso de la tableta para aprobar las normas de calidad. Se sabe que la vitamina K (4-amino-2-metil-1-naftol, que puede simbolizarse como Kred y cuyo peso molecular 257.12 g/mol) es un alcohol que puede oxidarse a la cetona correspondiente (2-metil-1,4-naftoquinoleina, que puede simbolizarse como Kox). Con la información anterior, es posible considerar la determinación cuantitativa tanto de la vitamina C como de la vitamina K, ya que ambas pueden ser oxidadas, cada una de ellas consume dos electrones por mol en su reacción. VALORACIÓN DE VITAMINA C Y VITAMINA K EN UN COMPLEJO VITAMÍNICO La disolución “A” se preparó con 1.00 g de una tableta que contenía ambas vitaminas y otras sustancias no valorables que no interfieren en la reacción, como el excipiente. El gramo de tableta fue tratado de tal forma que quedaron disueltas ambas vitaminas en 100.0 mL. En la gráfica anexa, se encuentra el resultado de la valoración de 20.0 mL de una disolución A con una disolución de Cu(II) 0.05 M. Donde los valores de potencial se midieron con un electrodo de cobre. a) Calcule la constante de equilibrio para la reacción de valoración de Cu(II) con vitamina C y K? b) Indique sobre la gráfica las especies responsables del valor de potencial de equilibrio para cada etapa de la concentración c) Obtenga la concentración de vitamina C en la disolución A d) Calcule el porcentaje de vitamina K en la tableta. e) ¿Cumple la tableta con las normas de calidad establecidas? 5. Suponga que usted transporta varias sales inorgánicas de uso común, porque su laboratorio se está cambiando de ciudad y el acumulador de su automóvil se descarga en medio desierto porque se detuvo a echar una siesta de media noche, con las luces, el aire y la radio encendidas. NO HAY POSIBILIDAD DE QUE ALGUIEN LE PASE CORRIENTE A 100 Km A LA REDONDA. Describa lo que podría hacer para reactivar la batería y echar a andar de nuevo el transporte, sin usar ningún tipo de otra energía (mecánica, como empujarlo, eléctrica, calorífica, etc). Puede utilizar cualquiera de las sustancias de su carga. AYUDOTA: Identifique el reactivo limitante de las reacciones en un acumulador y base su razonamiento en función de la constante de equilibrio. 6. Se quiere cuantificar adrenalina en la orina de una mujer que se tiene la sospecha de que fue VIOLADA, es sabido que una persona tras sufrir una impresión DEMASIADO fuerte, se llega a producir demasiada adrenalina la cual es eliminada por la orina. Además cuando una persona sufre violación, el propio mecanismo humano hace que la adrenalina se libere mediante la orina durante los 15 minutos ocurridos en el acto, es decir, si la presunta víctima sufrió de violación se encontrará adrenalina (epinefrina Eº = 0.38 V) en la muestra por arriba de 20 pppm. Usted en su laboratorio de químicos forenses y legalistas, recibe la muestra de orina de la presunta paciente. El color que presenta la muestra es un color calificado como normal, no presenta precipitados. El análisis lo va a realizar mediante una titulometría redox, utilizando como agente titulante permanganato de potasio (Eº = 1.58 V). PLANEACIÓN DEL EXPERIMENTO Considere concentraciones equivalentes de epinefrina y permanganato de potasio para un ensayo con estándares. La adrenalina se oxida a adrenocromo, para ello pierde dos equivalentes de electrones. Analice y conteste: a) Diga si la reacción es cuantitativa y puede ser empleada para análisis químico. Para ello calcule la constante de equilibrio y la cuantitatividad. b) Calcule el potencial al equilibrio c) Trace la curva de valoración teórica, es decir, realice E = f(fracción añadida) d) Cómo monitorea la reacción. ¿Cómo determinaría el punto final de la equivalencia? e) ¿Es importante tener control en la acidez o basicidad del medio? Sí o No ¿Por qué? TRATAMIENTO DE MUESTRA Los principales componentes de la orina es el color y la urea. Indique a) ¿Cómo eliminaría el color amarillo de la orina? b) ¿Cómo eliminaría el interferente de la urea de su muestra? ANÁLISIS DE DATOS Si de la muestra de orina, se tomó una alícuota de 25.0 mL y se gastó 15 mL de permanganato de sodio de 0.05 M de una bureta de 50.0 mL. Indique si la mujer X fue violada, emita su firma y este documento se irá a un juicio legal, en caso de que exista un error, el Químico encargado tendrá que ir a la cárcel. ____________________________________________ Firma de Químico responsable del análisis