Quimica
Anuncio

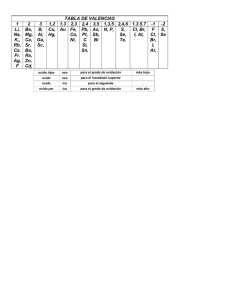
IDEPUNP/ CICLO REGULAR/ ABRIL – JULIO 2016 QUÍMICA 1 SEMANA Nº 05 TEMA: NOMENCLATURA INORGÁNICA COORDINADOR: ING. ROYVELI CARHUACHIN GUTIERREZ RESPONSABLE: ING. JESENIA ANCAJIMA RUIZ 1. Valencia.-Es la capacidad de combinación que poseen los átomos cuando forman un compuesto. Siempre es un número natural que carece de signo. También se define como: El numero de electrones un átomo puede dar, recibir o compartir con otro átomo. 2. NÚMERO O ESTADO DE OXIDACION: es la carga real (compuesto iónico) o aparente (compuesto covalente) que presenta un átomo al unirse con otro átomo. Puede ser un numero, positivo, negativo, e incluso, fraccionario. 3. REGLAS BASICAS DEL NUMERO DE OXIDACION (N.O) o ESTADO DE OXIDACION (E.O) (Función Química) de (Nombre del (Sufijo elemento) E.O Cuando el elemento tiene un solo E.O se puede obviar el número romano. 4.3. Nomenclatura IUPAC, lee la formula del compuesto indicando mediante prefijos (mono=1, di=2, tri=3, etc) el numero de átomos de cada elemento que forma la molécula. Se recomienda para compuestos covalentes. (Prefijo) (Nombre Función Química) de prefijo (Nombre elemento) a) Todo elemento al estado libre tiene N.O igual a cero. Por ejemplo: Al, Au, Sn, Na, etc; o moléculas como el H2, Cl2, S8, etc. b) El hidrogeno actúa generalmente con N.O= a+1 salvo en los hidruros metálicos, en donde actúa con N.O =-1 c) d) El oxigeno actúa generalmente con N-O= 2; salvo en los peróxidos, en donde actúa con N.O= -1 y en el compuesto OF2 en donde actúa con N.O= +2 5. FUNCION QUIMICA.- Son los conjuntos de sustancias que presentan propiedades químicas semejantes porque poseen composición similar. Así tenemos: óxidos, ácidos, anhídridos, sales, etc. PRINCIPALES INORGANICAS: a) Óxidos Básicos. Resultan de la combinación del oxigeno con un elemento metálico. Se denominan así, porque al reaccionar con el agua originan bases o hidróxidos. Metal + Oxigeno N.O ión = carga del ión 4.1. Nomenclatura Clásica o Antigua Aquella que hace uso de un conjunto de prefijos y sufijos de acuerdo al numero de Estados de oxidación que tenga el elemento es: SUFIJO Hipo oso N° DE VALORES DE E.O 1 2 3 4 oso Ico Per Ico * X Oxido Básico M2Ox Donde M= símbolo del metal; x=estado de oxidación del metal. Si los subíndices son pares, se pueden simplificar. SISTEMA DE NOMENCLATURA PREFIJO Se les representa, mediante la formula general: Mientras que en un ión es igual a la carga del ión. 4. QUIMICAS 5.1. FUNCION OXIDO.- Son compuestos binarios formados por un elemento con el oxigeno. El todo compuesto la suma algebraica de sus N.O es igual a cero. N .O.compuesto 0 FUNCIONES X x X X x X X X x (*) generalmente se obvia. b) Óxidos ácidos.- Llamados también ANHIDRIDOS, resultan de la combinación del oxigeno con un no metal. Se llaman así porque al reaccionar con el agua producen ácidos oxácidos. No Metal + Oxigeno Oxido Acido Se les representa mediante la formula general: NM2Ox Donde NM=símbolo del no metal; x= estado de oxidación del no metal. Si los subíndices son pares se pueden simplificar. c) Oxidación Compuestos.- Se obtienen sumando los óxidos OSO el ICO de un elemento metálico. Los mas simples tienen por formula general M3O4 Ejemplo: Fe3O4 Oxido ferroso – férrico Minióxido de hierro. (Función Química) (Prefijo) (Nombre del (Sufijo elemento) 4.2. Nomenclatura Stock.- Cuando se indica el estado de oxidación del elemento en números romanos. d) Peróxido.- Son sustancias inestables, sus formulas no se aplican. Resultan de: Oxido Básico (ICO) + O Ejemplo: Na2O + O Peroxido de Sodio Peroxido IDEPUNP/ CICLO REGULAR/ ABRIL – JULIO 2016 5.2. FUNCION HIDROXIDOS.- Son compuestos ternarios que resultan de la combinación de un oxido básico con el agua. Esto es: Oxido Básico + O QUÍMICA 2 Hidróxido b) Sales oxídales.- Resultan de reemplazar los hidrógenos de un acido oxácido. Tiene la terminación “ito” (si proviene de un acido con terminación ico) Ejemplos: NaClO Hipoclorito de sodio BaSO4 Sulfato de bario Se les representa mediante la formula general: Las sales a su vez pueden ser: sales acidas, sales básicas, sales neutras, sales mixtas, sales hidratadas. M(OH)x Donde: x= estado de oxidación del metal. 5.3. FUNCION HIDRUROS.- Son compuestos binarios formados por un elemento y el Hidrogeno, donde el elemento actúa con su estado de oxidación principal. Se clasifican en: a) Hidruro Metálico.- Su formula general es EHx donde x=E.O. del metal, y el hidrogeno actúa con su E.O=1 b) Hidruro no metálico.- Su formula general es EHx donde x=E.O del no metal, y el hidrogeno actúa con su E.O=+1 Ejemplos: 5.4. CaH2 Hidruro de calcio AlH3 Hidruro de aluminio SiH4 Silano HCl(g) Cloruro de Hidrogeno FUNCION ACIDOS.caracterizan por: Son compuestos que se Tener sabor agrio Enrojecen el papel tomasal, decoloran la solución de fenoltalenia Neutralizan a los hidróxidos, corroen a los metales activos. Poseen un o mas hidrógenos sustituibles por metales o radicales electropositivos para la formación de sales. Se clasifican en ácidos oxácidos y ácidos hidrácidos. a) Ácidos Oxácidos.- Son compuestos tenarios que resultan de la combinación de un oxido con agua. Esto es: Oxido Acido + Agua Acido oxácido b. ACIDOS HIDRACIDOS: Son los hidruros de hidrogeno del grupo VI y VII A. pero en solución acuosa. Tienen la terminación HIDRICO. Ejemplo: HCl (ac) acido clorhídrico H2S(ac) acido sulfhídrico 5.5. FUNCION SALES.- Son compuestos que se obtienen de la reacción de un acido con un hidróxido o al reemplazar el hidrogeno de un acido por uno o mas cationes Acido + Base Sal + Agua Metal Activo +Acido Sal + Agua En forma general se clasifican en: a) Sales haloideas.- Resultan de reemplazar los hidrógenos de un acido hidracido. Tiene la terminación “uro” Ejemplos: KCl Cloruro de potasio PbS Sulfato de bario KHS04 Bisulfato de potasio Ca(OH)(NO3) Nitrato básico de calcio NaPaPO4 Fosfato doble de sodio y calcio NaCO310H2O Carbonato de sodio decahidratado.