Uso seguro de amiodarona
Anuncio

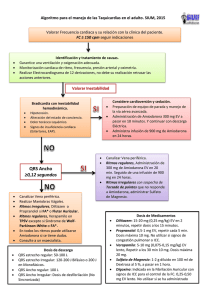
Año 2005, Volumen 21 nº 1 EN ESTE NÚMERO … Redacción: CADIME Escuela Andaluza de Salud Pública. Cuesta del Observatorio, n.º 4 Aptdo. 2070. 18080 Granada. España. Tfno. 958 027 400, Fax 958 027 505 www.easp.es e-mail: [email protected] 1 • Utilización de medicamentos Uso seguro de amiodarona El Boletín Terapéutico Andaluz (BTA) es una publicación bimestral, que de forma gratuita se destina a los sanitarios de Andalucía con el fin de informar y contribuir a promover el uso racional de los medicamentos. Este boletín es miembro de la Sociedad Internacional de Boletines Independientes de Medicamentos (I.S.D.B.). 1 Utilización de medicamentos Uso seguro de amiodarona RESUMEN ANDALUZ Boletín Terapéutico Depósito Legal: GR–356–1984. ISSN 0212–9450. Año XX, n.º 147 Enero-Febrero 2005, Franqueo Concertado 18/30 Las manifestaciones de toxicidad pulmonar constituyen el efecto adverso potencialmente más grave asociado al uso de amiodarona. Se manifiesta con sintomatología subaguda y disnea progresiva, con signos de infiltrados intersticiales irregulares en la radiografía de tórax y reducción de la capacidad de difusión en las pruebas de función pulmonar. La amiodarona (AM) es un fármaco antiarrítmico, de la clase III, frecuentemente utilizado en nuestro medio que, a pesar de su elevada eficacia, no se considera de primera elección, por la frecuente aparición de reacciones adversas. Éstas son más frecuentes con la administración de dosis altas de AM; si bien, también pueden presentarse con dosis bajas. Los efectos adversos asociados a la administración de AM pueden ser de carácter idiosincrásico o bien dosis-dependientes; y, pueden tardar en desaparecer debido a la prolongada vida media de AM. Las reacciones potencialmente graves, afectan a: pulmón, tiroides, hígado, corazón, ojos, piel y sistema nervioso; mientras que, suelen ser leves y transitorias cuando afectan al aparato digestivo. Es importante reconocer precozmente las manifestaciones de toxicidad de la AM, para lo cual se debería realizar una exploración clínica exhaustiva del paciente previa al inicio del tratamiento seguida de exploraciones periódicas semestrales durante el mismo. INTRODUCCIÓN La amiodarona (AM) es un fármaco antiarrítmico de uso muy común en nuestro medio que está encuadrado en la clase III de la clasificación de antiarrítmicos. Pese a haber mostrado una elevada eficacia, la frecuente aparición de reacciones adversas graves hace que no se considere como agente de primera elección en el tratamiento de las arritmias (1). Siendo sus indicaciones autorizadas el tratamiento de las arritmias graves –taquiarritmias asociadas con el síndrome de Wolf-Parkinson-White; prevención de la recidiva de la fibrilación y flutter auricular; y todos los tipos de taquiarrítmias de naturaleza paroxística– que no responden a otros antiarrítmicos o cuando los fármacos alternativos no se toleran (2). AM se puede administrar por vía oral para el tratamiento prolongado y la estabilización inicial; y, por vía intravenosa cuando sea necesaria una respuesta rápida (en unidades con medios adecuados para la monitorización cardiaca y reanimación cardiopulmonar). Se recomienda utilizar una dosis inicial de 600 a 1000 mg/día –durante 8-10 días– reduciendo la dosificación paulatinamente en función de la respuesta del paciente hasta alcanzar la dosis de mantenimiento que oscila entre 100-400 mg/día. La AM presenta una vida media de eliminación prolongada (26 a 107 días), debido a que su principal metabolito –la desetilamiodarona– se acumula en tejidos periféricos, que se comportan como reservorios (1-4). Como ya se ha señalado, el principal inconveniente para su empleo viene dado por su perfil de toxicidad, pudiendo causar reacciones adversas de carácter idiosincrásico o bien dosis-dependientes, relacionadas con la exposición total al fármaco: dosis administrada y duración del tratamiento. En diversos ensayos clínicos la incidencia de efectos adversos tras la administración de dosis de mantenimiento ≤400 mg/día fue mucho menor que cuando se emplean dosis mayores (5); no obstante, la utilización de REACCIONES ADVERSAS ASOCIADAS CON AMIODARONA (*) Reacción adversa Método de diagnóstico Tratamiento Toxicidad pulmonar Radiografía de tórax, pruebas de función pulmonar, DLCO Suspender amiodarona; iniciar tratamiento con corticoesteroides Hipertiroidismo Nivel de T4 libre y de TSH Considerar suspender amiodarona, si no es posible, asociar tratamiento antitiroideo Hipotiroidismo Nivel de T4 libre y de TSH Considerar suspender amiodarona, si no es posible, asociar suplementos de hormona tiroidea Toxicidad hepática Elevación de enzimas hepáticas tres veces por encima del límite superior normal Considerar suspender amiodarona Neuropatía óptica Examen oftalmológico Considerar suspender amiodarona Proarritmia ECG Suspender amiodarona Bradicardia Examen físico y ECG Si es grave suspender amiodarona o implantar marcapasos Náuseas, anorexia Historia clínica, examen físico Reducir la dosis Microdepósitos corneales Biomicroscopía (Examen con lámpara de hendidura) Ninguno Fotosensibilidad Historia clínica, examen físico Utilizar protector solar total Color azulado de la piel Examen físico Reducir la dosis Reacciones adversas graves Reacciones adversas leves (*) Para evitar la aparición de reacciones adversas se recomienda realizar una exploración clínica exhaustiva del paciente previa al inicio del tratamiento seguida de exploraciones periódicas semestrales durante el mismo. DLCO: capacidad de difusión del monóxido de carbono T4: tiroxina TSH: hormona estimulante del tiroides ECG: electrocardiograma. Tabla 1. Modificada de (1) dosis bajas de AM no está libre de efectos adversos (6). En la medida de lo posible se recomienda administrarla a dosis bajas y suspender el tratamiento en caso de que aparezcan efectos adversos (1). Estas reacciones, que en ocasiones pueden ser potencialmente graves, afectan a: pulmón, tiroides, hígado, corazón, ojos, piel y sistema nervioso; mientras que, suelen ser leves y transitorias cuando afectan al aparato digestivo (Ver tabla 1) (1,5,7). REACCIONES ADVERSAS PULMONARES Dentro del perfil de toxicidad de la AM, las reacciones adversas pulmonares son las más graves (1,8,9). De los 31 casos de sospecha de muerte asociados a AM que se notificaron al ADRAC (Adverse Drug Reactions Advisory Committee) en Australia desde 1981, 17 fueron por toxicidad pulmonar (7). Las reacciones adversas pulmonares aparecen como resultado de una fosfolipidosis directamente inducida por el fármaco o como una reacción inmune de hipersensibilidad (8,10). Se ha observado que la edad avanzada de los pacientes y los antecedentes de alteraciones pulmonares pueden ser factores de riesgo para el desarrollo de la misma (5). Asimismo, a pesar de que su aparición se relaciona con el grado de exposición al fármaco (dosis y duración del 2 Bol Ter ANDAL 2005; 21 (1) tratamiento) (11), también se han descrito manifestaciones de toxicidad pulmonar en pacientes tratados con dosis bajas de AM (6,12). En un meta-análisis que incluía cuatro ensayos clínicos, realizados en un total de 1465 pacientes, tratados con AM a dosis bajas (152 a 330 mg/día) durante 12 a 54 meses, se han descrito reacciones adversas pulmonares con una incidencia de 1,9% (frente a 0,7% con placebo, p=0,073) (6). La toxicidad pulmonar suele presentar un inicio lento, aunque también puede aparecer rápidamente en los primeros meses de tratamiento (5,7,13). Asimismo, también puede aparecer unas semanas o incluso meses después de interrumpir el tratamiento, lo que viene motivado por la larga vida media de la AM en los tejidos pulmonares (11). El diagnóstico de toxicidad pulmonar se realiza a partir de las manifestaciones clínicas y radiológicas y mediante la exclusión de otras causas. Resulta de importancia su diagnóstico precoz, ya que si se retira pronto el fármaco, las lesiones pueden ser reversibles. No obstante, en ocasiones, y en pacientes con insuficiencia cardiaca, el diagnóstico puede retrasarse al enmascararse los síntomas (5). Frecuentemente se manifiesta, como: neumonitis crónica intersticial, bronquiolitis obliterante y neumonía; y, con menor frecuencia, como un síndrome de distress respiratorio agudo del adulto. La neumonitis intersticial constituye probablemente el efecto adverso más grave asociado a AM. Los síntomas que aparecen son tos subaguda y disnea progresiva, asociadas a infiltrados intersticiales irregulares en la radiografía de tórax y a la reducción de la capacidad de difusión en las pruebas de función pulmonar. Tras la retirada de AM, la sintomatología desaparece en 3 o 4 semanas, mientras que las alteraciones radiológicas y funcionales pueden permanecer varios meses más (1,2,5,8-10). REACCIONES ADVERSAS TIROIDEAS La AM, que contiene dos átomos de yodo en su molécula, se ha asociado a manifestaciones de toxicidad tiroidea (hipertiroidismo o hipotiroidismo) en más del 10% de los pacientes tratados durante periodos prolongados de tiempo; constituyendo la reacción adversa asociada a AM que precisa con más frecuencia de atención médica (1,5,9). Se han descrito manifestaciones de hipotiroismo hasta en un 32% de los pacientes, considerándose factores de riesgo para su desarrollo la existencia de alteraciones tiroideas preexistentes, edad avanzada y género femenino. La interrupción del tratamiento con AM suele originar el cese de los síntomas y la normalización de las pruebas de laboratorio. En los casos en los que no se considere indicada la retirada del fármaco, puede reducirse la dosis y/o admi- nistrar un tratamiento con suplementos de tiroxina, de acuerdo con la sintomatología y los niveles de T3, T4 y TSH (1,4,5). Se han descrito manifestaciones de hipertiroidismo, hasta en el 23% de los pacientes tratados con AM. Suele tener un inicio brusco, pudiendo aparecer en cualquier momento del tratamiento o incluso meses después de retirarlo. Su aparición obliga a suspender el tratamiento con AM; si bien, su resolución resulta más difícil que en el caso del hipotiroidismo (4,5), provocando a menudo la interrupción del tratamiento (5). Se han descrito dos posibles mecanismos fisiopatológicos para explicar el desarrollo de tiroiditis. Así, el tipo I, aparecería en pacientes con alteraciones tiroideas previas como consecuencia de un aumento de la síntesis hormonal, inducido por la exposición a dosis altas de yodo; mientras que el tipo II está causado por una tiroiditis destructiva, con liberación de grandes cantidades de hormonas presintetizadas (14,15). El tipo I suele tratarse con carbimazol o propiltiouracilo; y, el tipo II con corticoesteroides (prednisolona, 40-60 mg/día). En la práctica, resulta difícil su diferenciación, siendo necesario en algunos pacientes administrar fármacos antitiroideos junto a los corticoesteroides (4,5,14,15). REACCIONES ADVERSAS HEPÁTICAS La hepatotoxicidad por AM puede manifestarse en forma de hepatitis aguda, hepatitis crónica o hepatopatía crónica (hepatitis pseudoalcohólica) (16). La elevación persistente de los niveles de transaminasas hepáticas resulta frecuente entre los pacientes (hasta un 40%) tratados crónicamente con AM. Aunque normalmente no es sintomática (1,4), se han descrito algunos casos de fallo hepático fulminante (17). La hepatitis aguda puede ser precoz, apareciendo antes del tercer mes tras el inicio del tratamiento (16). La hepatotoxicidad de la AM puede variar en función de la vía de administración. Siendo las alteraciones de la bioquímica hepática más frecuentes cuando se administra por vía oral que cuando se administra por vía intravenosa. El mecanismo de la hepatotoxicidad de la AM intravenosa no está claro; si bien, parece ser distinto al de la toxicidad por vía oral. Al parecer, el hígado es más sensible al fármaco cuando presenta una afectación hemodinámica o hipoxia, habiéndose atribuido su toxicidad a distintos mecanismos, como: citotoxicidad directa, colestasis, inmunoalérgicos e incluso al disolvente que se utiliza para la administración intravenosa. Así, no se puede excluir que la toxicidad se deba al disolvente que vehiculiza la AM en su forma intravenosa para man- tenerla estable en lugar de al propio medicamento, ya que han sido descritos casos similares con preparados de vitamina E, que utilizan el mismo disolvente (polisorbato 80) (16). En caso de que las alteraciones de la función hepática sean graves, persistentes o que las enzimas hepáticas se eleven tres veces por encima del límite superior normal, se recomienda, en la medida de lo posible, suspender el tratamiento (1). REACCIONES ADVERSAS CARDIACAS La AM se asocia muy raramente a la aparición de alteraciones del ritmo, siendo la frecuencia de aparición de torsade de pointes inferior a 1,0%; no obstante casi todos los pacientes presentan un alargamiento del espacio QT (18). Según los resultados de un metaanálisis, la AM (a dosis de 100-400 mg/día) produjo bradicardia y alteraciones de la conducción cardiaca en el 3,3% de los pacientes, (frente a un 1,4% con placebo) (6). Su uso está contraindicado en pacientes con alteraciones graves de la conducción cardiaca que no tengan implantado marcapasos. Administrada por vía intravenosa, causa bloqueo cardiaco o bradicardia en el 4,9% de los pacientes, e hipotensión en el 16% (1). REACCIONES ADVERSAS OCULARES La aparición de microdepósitos cornéales ocurre en prácticamente todos (70-100%) los pacientes y normalmente se desarrolla en el primer mes tras iniciar el tratamiento con AM. Suelen remitir tras la interrupción del fármaco; si bien, solamente se precisa la retirada de AM en pacientes que han presentado síntomas visuales molestos tales como visión de halos o visión borrosa (1,5% de los pacientes tratados con 100-400 mg/d de AM frente a un 0,1% con placebo) (5). La neuropatía y neuritis óptica en ocasiones pueden evolucionar hacia la ceguera total, habiéndose descrito en un reducido número de pacientes, aunque no se ha establecido la relación causal. Se reco- mienda remitir al oftalmólogo a los pacientes tratados con AM en los que se perciban cambios en la agudeza visual y/o en la visión periférica (1,5,8,9,19). REACCIONES ADVERSAS NEUROLÓGICAS La aparición de temblor, ataxia y el desarrollo de neuropatía periférica constituyen efectos adversos asociados al tratamiento con dosis elevadas de AM (5). El índice de abandono del tratamiento por esta causa en pacientes tratados durante largos periodos de tiempo con este fármaco (dosis de 100-400 mg/día) es de un 4’6%, frente a un 1,9% en los pacientes tratados con placebo (6). Al ser generalmente dependientes de la dosis administrada, mejoran cuando se reduce ésta (1,5). REACCIONES ADVERSAS DERMATOLÓGICAS Entre los pacientes tratados con AM a dosis bajas, se han presentado reacciones cutáneas (fotosensibilidad, coloración azulada de la piel) en el 2,3% de los pacientes, frente a un 0,7% en los que recibieron placebo (6). Se recomienda que los pacientes tratados con este fármaco utilicen, siempre que sea posible, protectores solares y se cubran las partes expuestas al sol. La fotosensibilidad puede persistir meses después de suspender el tratamiento; mientras que, la coloración azulada de la piel suele resolverse tras la suspensión del mismo, aunque en ocasiones no desaparece completamente (1,5,9). INTERACCIONES La AM puede interaccionar con abundantes fármacos, al metabolizarse en el hígado a través del isoenzima 3A4 del citocromo P450, puede ocasionar interacciones con los fármacos que inhiben o inducen esta enzima. Las interacciones pueden manifestarse clínicamente varias semanas tras iniciar el tratamiento y desaparecer tras la suspensión del mismo (1,4,5). PRINCIPALES INTERACCIONES MEDICAMENTOSAS DE AMIODARONA Medicamento Digoxina Warfarina Simvastatina Sildenafilo Ciclosporina Antiarrímicos Quinolonas Antidepresivos Tabla 2. Resultado de la interacción Elevación de los niveles plasmáticos de digoxina Elevación del tiempo de protrombina Incremento de la incidencia de miopatía cuando la dosis de simvastatina es >20 mg/día Incremento de los niveles plasmáticos de sildenafilo Incremento de los niveles plasmáticos de ciclosporina Efectos aditivos: posible elevación de los niveles plasmáticos de disopiramida, flecainida, propafenona Efecto aditivo QT: posible incremento del riesgo de proarritmia Incremento de los niveles plasmáticos de los medicamentos que presentan metabolización hepática: posible incremento del riego de proarritmia Tomada de (1). Bol Ter ANDAL 2004; 21 (1) 3 SEGUIMIENTO DE LOS PACIENTES TRATADOS CON AMIODARONA Evaluación inicial Historia clínica completa y examen físico con especial atención en cuanto a insuficiencia cardiaca congestiva, síntomas de arritmia, y medicamentos concomitantes. Radiografía de tórax. Estudio del tiroides y niveles de enzimas hepáticas. Niveles de digoxina, INR y tiempo de protrombina, cuando sean apropiados. Pruebas de función pulmonar, incluyendo DLCO. Examen oftalmológico (si hay alteración visual preexistente). Paciente ambulatorio Control de la frecuencia cardiaca, especialmente durante la primera semana de tratamiento Historia clínica completa y examen físico dirigidos a la detección precoz de efectos adversos Cada seis meses: – Estudio del tiroides y niveles de enzimas hepáticas. – Nivel de digoxina, cuando sea apropiado. – Historia clínica completa y examen físico dirigida a la detección precoz de efectos adversos. Sospecha de toxicidad pulmonar Radiografía de tórax. Pruebas de función pulmonar. Síntomas visuales Examen oftalmológico En caso de terapia anticoagulante oral (acenocumarol, Warfarina). Control del INR y tiempo de protrombina (al menos 1 vez por semana durante las primeras 6 semanas de tratamiento). Sospecha de toxicidad de digoxina Nivel de digoxina INR=International normalized ratio (valor normalizado internacional de coagulación) DLCO: Capacidad de difusión pulmonar para el monóxido de carbono. Tabla 3 (Tomada de 1). En los pacientes en tratamiento crónico con un fármaco inductor del enzima (carbamazepina, rifampicina), la dosis de AM debe incrementarse. A su vez, la AM inhibe al isoenzima 3A4 del citocromo P450, aumentando los niveles plasmáticos de medicamentos, como: ciclosporina, fenitoina, verapamilo y warfarina. AM también incrementa las concentraciones plasmáticas de digoxina; por lo que, en pacientes tratados con ambos medicamentos, se precisa reducir la dosis de digoxina. En pacientes tratados con AM, el especialista sería el indicado para prescribirla junto a fármacos que prolongan el espacio QT (p. ej.: sotalol) (4,5). En la tabla 2 se relacionan los principales medicamentos que pueden interaccionar con AM y el resultado de la misma. CONTROL DE LA TOXICIDAD Resulta de importancia informar a los pacientes sobre los posibles efectos adversos que pueden asociarse a AM, advirtiéndoles acerca de los síntomas que se pueden presentar, animándoles a que lo comuniquen a su médico lo más precozmente posible. Antes de iniciar el tratamiento se recomienda realizar una exploración clínica completa: determinaciones de la función tiroidea (T3, T4 y TSH), enzimas hepáticas, niveles plasmáticos de potasio; una radiografía de tórax y un ECG (5). Una vez que el tratamiento se ha iniciado, se recomienda controlar la función tiroidea y la hepática cada seis meses; asimismo, se controlarán deçeses en pacientes tratados con diuréticos); y, se realizará pruebas de función pulmonar, radiografía de tórax, y ECG, si aparece sintomatología o hay empeoramiento. Realizándose una revisión oftalmológica si aparecen alteraciones visuales (1,5). CONCLUSIÓN AM es utilizada con frecuencia para el mantenimiento del ritmo sinusal en pacientes con fibrilación atrial o paroxística; si bien, su valor está mejor establecido en la prevención de las arritmias ventriculares. Los efectos adversos que puede ocasionar la AM pueden ser graves y, en ocasiones, mortales. Aparecen con menor frecuencia con dosis bajas del fármaco (100-200 mg/día) que con dosis altas (400 mg/día). Es importante reconocer precozmente las manifestaciones de toxicidad de la AM, ya que suelen resolverse tras la supresión del fármaco; si bien, debido su la larga vida media, los efectos adversos pueden tardar en desaparecer. Es importante –antes de iniciar el tratamiento con AM y cada seis meses– realizar una exhaustiva exploración clínica del paciente, incluyendo: determinaciones de la función tiroidea, de la función hepática y de los niveles plasmáticos de potasio; así como una radiografía de tórax y un ECG. Debiendo realizar revisiones oftalmológicas en los pacientes que presenten alteraciones visuales. BIBLIOGRAFÍA 1- Siddoway LA. Amiodarone: guidelines for use and monitoring. Am Fam Phys 2003; 68(11): 218996. 2- Ficha Técnica de Trangorex comprimidos. Sanofi-Synthelabo (2003). 3- Ficha Técnica de Trangorex inyectable. Sanofi-Synthelabo (2003). 4- Bunch CH et al. Amiodarone (Drug Evaluations). In: Klasko RK, editor. Drugdex® System. Micromedex, Greenwood Village, Colorado (Vol. 124. Edition expires [06/2005]). 5- Using oral amiodarone safely. Drug Ther Bull 2003; 41(2). 9. 6- Vorperian VR et al. Adverse effects of low dose amiodarone: a meta-analysis. J Am Coll Cardiol. 1997 Sep; 30(3): 791-8. 7- Amiodarone and pulmonary toxicity. Aust Adv React Bull 2002; 21(1): 2. 8- Pollak PT. Clinical organ toxicity of antiarrhythmic compounds: ocular and pulmonary manifestations. Am J Cardiol 1999; 84(S9A): 37R-45R. 9- Lip GY et al. Adverse reactions of drugs used to treat arrhythmia. Adv Drug React Bull 2000; (201): 767-70. 10- Jessurun GA et al. Amiodarone induced pulmonary toxicity: predisposing factors, clinical symptoms and treatment. Drug Saf 1998; 18: 339-44. 11- Pneumotox on line: Medicamentos responsables de afectación del aparato respiratorio. Disponible en URL: http://www.pneumotox.com/indexf.php?fich=dru gs &lg=sp&nf= [consultado el 15-11-2004]. 12- Ott MC et al. Pulmonary toxicity in patients receiving low-dose amiodarone. Chest 2003; 123(2): 646-51. 13- Amiodarone and pulmonary toxicity. WHO Drug Info 2002; 16(1): 14. 14- Saad A et al. Amiodarone-induced thyrotoxicosis and thyroid cancer. Arch Pathol Lab Med 2004; 128: 807-10. 15- Isidro ML et al. Tirotoxicosis por amiodarona ¿Está todo dicho? Endocrinol Nutr 2001; 48(8): 249-51. 16- Pérez Benito L et al. Hepatitis tóxica por amiodarona intravenosa. Rev Lat Cardiol 2002; 23(6): 188-9. 17- González Galilea A et al. Hepatitis tóxica aguda de instauración precoz por amiodarona intravenosa. Gastroenterol Hepatol 2002; 25(6): 392-4. 18- Hohnloser SH et al. Amiodarone-associated proarrhythmic effects: a review with special reference to torsade de pointes tachycardia. Ann Intern Med 1994; 121(7): 529-35. 19- Nagra PK et al. Amiodarone induced optic neuropathy. Br J Ophthalmol 2003; 87(4): 420-2. Centro Andaluz de Información de Medicamentos. CADIME Programa de la Consejería de Salud dirigido por la Escuela Andaluza de Salud Pública CONSEJO DE REDACCION REDACTOR JEFE: José Ma Recalde Manrique. S ECRET . R EDACCION : Antonio Matas Hoces. Redacción CADIME: Victoria Jiménez Espinola, María del Mar Láinez Sánchez, Estrella Martínez Sáez, Antonio Matas Hoces, María Teresa Nieto Rodríguez, José María Recalde Manrique. 4 Bol Ter ANDAL 2005; 21 (1) CONSEJO DE REDACCION: Víctor Bolívar Galiano, Juan R. Castillo Ferrando, Marina de Cueto López, José A. Durán Quintana, Javier Galiana Martínez, Fernando Gamboa Antiñolo, Pablo García López, Gonzalo García Molina, M.ª Isabel Lucena González, Miguel Marqués de Torres, M.ª Dolores Murillo Fernández, Julio Romero González, José Sánchez Morcillo, Javier Sepúlveda García de la Torre, Juan Tormo Molina, Concepción Verdú Camarasa. DISEÑO GRAFICO: Pablo Gallego. Córdoba. FOTOCOMPOSICION: Portada, S.L. Granada. IMPRESION: Copartgraf, S.Coop And. Granada.