Velocidad de las reacciones químicas
Anuncio
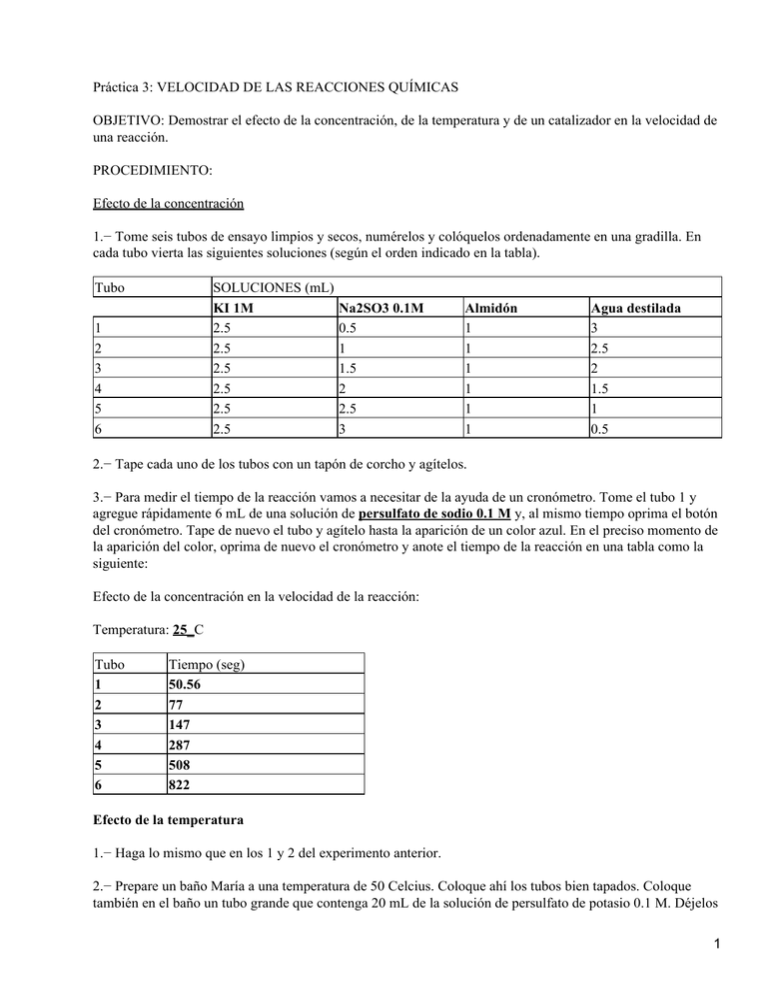
Práctica 3: VELOCIDAD DE LAS REACCIONES QUÍMICAS OBJETIVO: Demostrar el efecto de la concentración, de la temperatura y de un catalizador en la velocidad de una reacción. PROCEDIMIENTO: Efecto de la concentración 1.− Tome seis tubos de ensayo limpios y secos, numérelos y colóquelos ordenadamente en una gradilla. En cada tubo vierta las siguientes soluciones (según el orden indicado en la tabla). Tubo SOLUCIONES (mL) KI 1M 2.5 2.5 2.5 2.5 2.5 2.5 1 2 3 4 5 6 Na2SO3 0.1M 0.5 1 1.5 2 2.5 3 Almidón 1 1 1 1 1 1 Agua destilada 3 2.5 2 1.5 1 0.5 2.− Tape cada uno de los tubos con un tapón de corcho y agítelos. 3.− Para medir el tiempo de la reacción vamos a necesitar de la ayuda de un cronómetro. Tome el tubo 1 y agregue rápidamente 6 mL de una solución de persulfato de sodio 0.1 M y, al mismo tiempo oprima el botón del cronómetro. Tape de nuevo el tubo y agítelo hasta la aparición de un color azul. En el preciso momento de la aparición del color, oprima de nuevo el cronómetro y anote el tiempo de la reacción en una tabla como la siguiente: Efecto de la concentración en la velocidad de la reacción: Temperatura: 25_C Tubo 1 2 3 4 5 6 Tiempo (seg) 50.56 77 147 287 508 822 Efecto de la temperatura 1.− Haga lo mismo que en los 1 y 2 del experimento anterior. 2.− Prepare un baño María a una temperatura de 50 Celcius. Coloque ahí los tubos bien tapados. Coloque también en el baño un tubo grande que contenga 20 mL de la solución de persulfato de potasio 0.1 M. Déjelos 1 durante 10 minutos, evitando fluctuaciones de temperatura en el baño. 3.− Sin sacar los tubos del baño, realice lo mismo que en el apartado 3 del experimento anterior y registre los resultados en una nueva tabla. 4.− Repita el experimento empleando ahora un baño con hielo. Tubo 1 2 3 4 5 6 Tiempo (seg) 7.07 31.02 46.3 74.13 177.5 241.48 Efecto de un catalizador 1.− Haga lo mismo que en los apartados 1 y 2 del primer experimento, pero sustituya el agua por una solución de sulfato ferroso 0.0001 M. 2.− Realice lo mismo que en el apartado 3 del primer experimento y registre los resultados en una tabla como la siguiente: Efecto del catalizador en la velocidad de la reacción Temperatura:_______________C Tubo 1 2 3 4 5 6 Tiempo (seg) 31.5 45 61 99 121 186 PREGUNTAS: 1.− A partir de los datos obtenidos elabore gráficas de tiempo (eje de las X) contra el volumen de la solución de sulfito (eje de las Y). Puede hacerlas todas en una misma siempre y cuando haga notar de qué se trata de una (temperatura, con o sin catalizador, etc.)). Interprete las gráficas. 2.− Escriba la reacción. Considerando que es una reacción de primer orden en función del sulfito determine K (emplee los datos del primer experimento). RESPUESTAS: La k en función de la concentración es: 1.843 x 10−3 La k en función de la temperatura es: 6.068 x 10−3 2 La k en función del catalizador es: 0.01012 Nota: La constante de velocidad de la reacción (k) se obtiene con regresión exponencial con los datos de las gráficas. INTERPRETACIÓN: La constante de velocidad de la reacción nos indica el número de moles consumidos en un intervalo de tiempo, la cual se altera al incrementar la temperatura o cuando se utiliza un catalizador con el fin de acelerar el proceso de la reacción. Cuanto mayor sea la constante de velocidad más rápido tendrá lugar la reacción. Es por eso que en los 3 experimentos realizados: a) k en función de la concentración: es la menor, porque la reacción es muy lenta. b) k en función de la temperatura: cuando incrementamos la temperatura la reacción es más rápida, y por lo tanto su constante de velocidad se incrementa. c) k en función del catalizador: este experimento tiene el valor más grande de la constante de velocidad, porque la reacción en presencia de un catalizador es mucho más rápida. 3.− ¿Cuál es la función de la solución de almidón? (COMPLETAR) MATERIAL: • 2 matraces Erlenmeyer • Hielera • Termómetro • Gradilla • Vaso de Precipitado • Pipeta PRACTICA I: PROPIEDADES COLIGATIVAS Material: • 2 matraces Erlenmeyer • Hielera y CO2 • Solución salina 3

