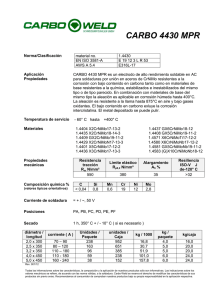
alcasa 3003 con temples h14, h16 y h18
Anuncio

REPÚBLICA BOLIVARIANA DE VENEZUELA
UNIVERSIDAD NACIONAL EXPERIMENTAL DE GUAYANA
VICERRECTORADO ACADÉMICO
COORDINACIÓN GENERAL DE INVESTIGACIÓN Y POSTGRADO
MAESTRÍA EN CIENCIA DE LOS MATERIALES
CORROSIÓN EN MEDIO AMBIENTE SALINO DE LA ALEACIÓN
COMERCIAL DE ALUMINIO CVG – ALCASA 3003 CON
TEMPLES H14, H16 Y H18
Trabajo de grado para optar al título de Magíster Scientiarum en
Ciencia de los Materiales
Autor: Lic. Solange Y. Paredes Dugarte
Tutor: Benjamín Hidalgo-Prada, Ph.D.
Puerto Ordaz, Noviembre de 2005
DEDICATORIA
A mis padres Neptalí y Oliva por su gran amor e incalculable fe.
A mi hija Samantha Carolina y a mi nieta Paola Rebecca que son mis motivos de existir.
A mis hermanos y sobrinos por su amor.
A mis amigos de ayer, hoy y de siempre quienes en todo momento me brindaron su
apoyo.
ii
AGRADECIMIENTO
Gracias a Dios por haber abrigado mi sueño de culminar esta Maestría.
Al encomiable profesor y amigo Dr. Benjamín Hidalgo-Prada fragua de grandes
hombres y proyectos quien con su sabiduría y humildad me condujo en todo momento
en la realización de este trabajo, enseñándome y fortaleciendo mis conocimientos en el
que hacer científico.
A la Gerencia Técnica CVG-ALCASA por haberme permitido llevar a cabo uno de sus
proyectos de investigación.
Al Ing. Roger González de la Superintendencia de Calidad y Proceso Laminación
Fundición por su colaboración en la recolección de muestras y a todo el personal del
Laboratorio Analítico de CVG-ALCASA, especialmente a los T.S.U.: Ambard Theira,
Ines Apiscope y José Aray, por su valiosa colaboración y apoyo en la realización de
algunas de las actividades pertinentes a la investigación.
A mi amiga M.Sc. Maritza Matta por apoyarme incondicionalmente en el logro de este
proyecto.
Al Laboratorio de Análisis Químico y Estructural de Materiales de la Facultad de
Ciencias de la ULA por su colaboración en los análisis de Microscopia Electrónica de
Barrido.
A la Profesora Denisse Paredes, a la M.Sc. Maria A. Paredes y a la Dra. Rosario Ávila
por su ayuda incondicional e intercambio de conocimientos.
Al Instituto de Investigaciones en Biomedicina y Ciencias Aplicada de la UDO por
apoyarme en la realización de esta Maestría.
Y a todas aquellas personas que de alguna manera colaboraron en la realización de este
trabajo.
iii
ÍNDICE GENERAL
Pág.
INDICE DE FIGURAS
ix
INDICE DE TABLAS
xv
RESUMEN
xvi
INTRODUCCIÓN
1
CAPITULO 1
5
EL PROBLEMA
5
Planteamiento del problema
5
Justificación
6
Objetivos
8
Objetivo General
8
Objetivos Específicos
8
Limitaciones
9
CAPÍTULO 2
10
MARCO TEORICO
10
2.1. El aluminio y sus aleaciones
10
2.2. Aleación Aluminio-Manganeso (3003)
14
2.3. Descripción del proceso de fabricación de la aleación comercial de
aluminio CVG-ALCASA 3003
18
2.4. Aspectos electroquímicos de la corrosión
21
2.5. La corrosión del aluminio
24
2.6. Potenciales de solución
27
2.7. Corrosión por picadura
28
2.8. Mecanismos de la corrosión por picadura en AA
31
2.8.1.
Iniciación de la picadura
32
2.8.2.
Propagación de la picadura en aluminio
34
2.9. Método de evaluación de la corrosión por picadura
36
2.10. Factores que influyen en el comportamiento de la corrosión del
aluminio y sus aleaciones
37
2.10.1. Naturaleza de la película de óxido
v
37
2.10.2. Efecto general de los elementos aleantes sobre la corrosión en
AA
40
2.10.3. Efecto general de las trazas e impurezas sobre la corrosión en
AA
42
2.10.4. Efecto general de los intermetálicos sobre la corrosión en AA
43
2.10.4.1. Formas en las cuales los intermetálicos participan en el
proceso de corrosión en AA
48
2.10.5. Efecto de los tratamientos térmicos de relajación sobre el
proceso de corrosión en AA
53
2.10.6. Efecto del trabajo en frío sobre el proceso de corrosión en
AA
57
2.10.7. Medio ambiente salino: Agua de mar
59
CAPÍTULO 3
62
TÉCNICAS DE CARACTERIZACIÓN
62
3.1. Pruebas de corrosión acelerada: atomización salina (Salt sprayASTM B117)
62
3.2.
67
Interferometría Óptica
3.3. Análisis de Imagen
70
3.4.
Microscopía Electrónica de Barrido
74
3.5.
Microscopía Electrónica de Transmisión
78
3.6. Microanálisis de rayos-X. Espectroscopia de rayos-X de energía
dispersiva
79
CAPÍTULO 4
83
CONDICIONES EXPERIMENTALES
83
4.1. Aleación Utilizada
84
4.2. Recolección de Muestras
84
4.2.1. Proceso de Laminación en Frío (Realizado en Planta)
84
4.3. Corte y Selección de Muestras
85
4.4. Preparación de Probetas
86
4.4.1. Metalografía cuantitativa
86
4.4.2. Microscopía Electrónica de Barrido
87
4.4.3. Microscopía Electrónica de Transmisión
88
4.4.4. Ensayo de Corrosión Acelerada
89
vi
4.4.5. Ensayo de Dureza Rockwell /Wilson
90
4.4.6. Bandas de Deformación
91
4.4.7. Ensayos de Tracción
91
4.5. Análisis de Imagen
93
4.6. Estudio de Corrosión
95
4.6.1. Prueba de atomización salina (SALT Spray Testing)
95
4.6.2. Limpieza de las probetas antes del ensayo
96
4.6.3. Preparación de la solución salina
97
4.6.4. Ubicación de la probetas
97
4.6.5. Condiciones del ensayo
98
4.6.6. Limpieza de las probetas después del ensayo
99
4.7. Técnicas utilizadas para examinar y evaluar la corrosión por picadura
4.7.1. Interferometría óptica
99
99
4.7.2. Microscopía Electrónica Analítica
102
4.8. Equipos utilizados
102
4.9. Referencias Normas ASTM
104
CAPÍTULO 5
106
RESULTADOS Y DISCUSIÓN
106
5.1. Caracterización de la aleación Al-Mn previo al ensayo de corrosión
106
5.1.1. Microanálisis por MEB
106
5.1.2. Microanálisis por EDX
110
5.1.3. Microanálisis por MET
112
5.2. Efecto de los tratamientos térmicos de relajación sobre las propiedades
mecánicas, macro y microestructurales de la aleación Al-Mn
118
5.2.1 Medidas de Dureza Rockwell
118
5.2.2 Resistencia máxima a la tracción (σuts)
122
5.3. Efecto de los tratamientos térmicos de relajación sobre la
macroestructura
123
5.4. Efecto de los tratamientos térmicos de relajación sobre la fracción
volumétrica de partículas de segunda fase.
131
5.5. Caracterización de la aleación Al-Mn después del proceso de corrosión
137
5.5.1. Observaciones Generales
137
vii
5.5.2. Evaluación de las picaduras por interferometría óptica
140
5.5.3. Medidas de los valores promedio de la profundidad de las
picaduras (Pp)promedio
142
5.5.4. Distribución de la profundidad de las picaduras (Pp)
145
5.5.5. Determinación del factor de picadura (Fp)
148
5.5.6. Morfología de las picaduras
160
5.5.7. Corrosión localizada asistida por partículas de segunda fase en la
AA
176
5.6. Efectos de la corrosión sobre las propiedades mecánicas
189
CAPÍTULO 6
192
CONCLUSIONES Y RECOMENDACIONES
192
RECOMENDACIONES
196
CAPÍTULO 7
197
REFERENCIAS BIBLIOGRÁFICAS
197
viii
INDICE DE FIGURAS
Pag.
Figura 2.1
Porción del diagrama de fase del sistema Al-Mn
16
Figura 2.2
Diagrama de equilibrio del sistema Al-Mn.
17
Figura 2.3
Micrografías por MEB ilustrando la formación y ruptura de las
burbujas (blisters).
35
Figura 2.4
Diagrama de Pourbaix para el sistema Al/H2O a 25 ºC
40
Figura 2.5
Esquema del mecanismo de la corrosión por picadura por efecto
de las partículas intermetálicas en el aluminio.
44
Figura 2.6
Esquema de la clasificación para el proceso de nucleación de la
picadura en inclusiones en los aceros.
50
Figura 2.7
Micrografías por MEB mostrando la superficie de la aleación AlFe
antes y después de la prueba de corrosión.
51
Figura 2.8
Micrografía por MEB de la partícula intermetálica Mg-Si en una
picadura en la AA 6056-T6.
51
Figura 2.9
Micrografía por MEB de la partícula intermetálica Al- Cu-Fe-Mn
en la corrosión por picadura de la AA 2024.
52
Figura 2.10
Micrografía por MEB de la fase Al2CuMg de la aleación de Al
2024-T3.
52
Figura 3.1
Esquema de la Cámara Salina
66
Figura 3.2
Diagrama esquemático del interferómetro Óptico
69
Figura 3.3
Perfiles en 3D generados por el software del Interferómetro Óptico
70
Figura 3.4
Diagrama de flujo típico del proceso de análisis de imágenes
73
Figura 3.5
Ilustración esquemática de las principales interacciones del haz de
electrones con la muestra
76
Figura 3.6
Diagrama esquemático representando el concepto de microscopía
electrónica analítica
77
Figura 3.7
Diagrama esquemático ilustrando el área donde se producen los
rayos-X característicos
82
Figura 4.1
Probeta rectangular para ensayo de tracción
92
Figura 4.2
Programa a partir del software del analizador de imágenes para el
análisis de las partículas de segunda fase
94
Figura 4.3
Ventana suministrada por el software del analizador de imágenes
mostrando la superficie analizada en tonalidades de grises.
94
ix
Figura 4.4
Ventana suministrada por el software del analizador de imágenes
mostrando las partículas de segunda fase sombreadas de color
rojo.
95
Figura 4.5
Cámara salina Erichsen Modelo 606
96
Figura 4.6
Ubicación de los portamuestras con las probetas dentro del
gabinete de la cámara salina.
98
Figura 4.7
Interferómetro óptico Zygo New 200
102
Figura 5.1
Micrografías por MEB obtenidas de muestras de la AA3003
mostrando la distribución de partículas de segunda fase. a) Temple
H14, b) Temple H16 y c) Temple H18. Mag. 300X.
108
Figura 5.2
Micrografías por MEB mostrando diferentes morfologías y
tamaños de partículas de segunda fase. En a), b) y c) se ilustra la
tendencia a la formación de aglomerados. En a), c) y d) se
observan partículas fracturadas. Mag.: 8 KX
109
Figura 5.3
Micrografías por MEB mostrando pequeñas cavidades en la matriz
de la aleación. Mag. (a): 2500X; Mag. (b): 4000X
110
Figura 5.4
Espectro por EDX de la fase Al-Fe-Mn
111
Figura 5.5
Espectro por EDX de la fase Al-Fe-Mn-Si
111
Figura 5.6
Micrografías por MET mostrando: a) distribución de pequeños
precipitados, (b-f) diferentes formas y tamaños de precipitados.
117
Figura 5.7
Gráfica Dureza Rockwell E versus Temperatura de relajación para
los temples H14, H16 y H18 y medio de enfriamiento en agua fría.
119
Figura 5.8
Dureza Rockwell E en función del medio de enfriamiento y las
tres temperaturas de recocido para el temple H14.
120
Figura 5.9
Dureza Rockwell E en función del medio de enfriamiento y las
tres temperaturas de recocido para el temple H16.
120
Figura 5.10
Dureza Rockwell E en función del medio de enfriamiento y las
tres temperaturas de recocido para el temple H18.
121
Figura 5.11
Gráfica de Resistencia a la tracción en función de la Temperatura
de relajación para los temples H14, H16 y H18 con ruta de
enfriamiento apagado en agua fría.
123
Figura 5.12
Micrografía óptica mostrando la microestructura de bandas de la
aleación AA3003 resultantes del proceso de laminación en frío: a)
temple H14, b) temple H16 y c) temple H18.
127
Figura 5.13
Micrografías ópticas mostrando las bandas de deformación del
plano normal a la dirección de la laminación de secciones de la
aleación comercial de aluminio 3003 de temple H14 sometidas a
128
x
diferentes condiciones de temperatura y medios de enfriamiento:
a) en estado de entrega; (b-d) T = 150 ºC/1h; (e-g) T = 200 ºC/1h;
(h-j) T = 250 ºC/1h.
Figura 5.14
Micrografías ópticas mostrando las bandas de deformación del
plano normal a la dirección de la laminación de secciones de la
aleación comercial de aluminio 3003 de temple H16 sometidas a
diferentes condiciones de temperatura y medios de enfriamiento:
a) en estado de entrega; (b-d) T = 150 ºC/1h; (e-g) T = 200 ºC/1h;
(h-j) T = 250 ºC/1h.
129
Figura 5.15
Micrografías ópticas mostrando las bandas de deformación del
plano normal a la dirección de la laminación de secciones de la
aleación comercial de aluminio 3003 de temple H18 sometidas a
diferentes condiciones de temperatura y medios de enfriamiento:
a) en estado de entrega; (b-d) T = 150 ºC/1h; (e-g) T = 200 ºC/1h;
(h-j) T = 250 ºC/1h.
130
Figura 5.16
Fracción Volumétrica de las partículas (α+β) en función de la
temperatura de relajación para el Temple H14.
134
Figura 5.17
Fracción Volumétrica de las partículas (α+β) en función de la
temperatura de relajación para el Temple H16.
134
Figura 5.18
Fracción Volumétrica de las partículas (α+β) en función de la
temperatura de relajación para el Temple H18.
135
Figura 5.19
Fracción Volumétrica de las partículas (α+β) en función de los
temples. T = 150 ºC.
135
Figura 5.20
Fracción Volumétrica de las partículas (α+β) en función de los
temples. T = 200 ºC.
136
Figura 5.21
Fracción Volumétrica de las partículas (α+β) en función de los
temples. T = 250 ºC.
136
Figura 5.22
Fotografía de una probeta de la AA3003 (a) antes y (b) después de
exponerla al rocío salino durante 288 horas.
137
Figura 5.23
Micrografías por MEB mostrando: (a) resquebrajamiento de la
capa de corrosión; (b) resquebrajamiento y presencia de orificios;
(c) aglomerado de productos de color blanco.
139
Figura 5.24
Perfiles de superficie generados por el software del Interferómetro
Óptico utilizados en la caracterización de las superficies corroídas
de la AA3003
142
Figura 5.25
Comportamiento de los valores promedio de profundidad de
picaduras con respecto al tiempo de exposición del grupo de
probetas de la aleación 3003 de temple H14.
150
xi
Figura 5.26
Comportamiento de los valores promedio de profundidad de
picaduras con respecto al tiempo de exposición del grupo de
probetas de la aleación 3003 de temple H16.
150
Figura 5.27
Comportamiento de los valores promedio de profundidad de
picaduras con respecto al tiempo de exposición del grupo de
probetas de la aleación 3003 de temple H18.
151
Figura 5.28
Distribución de la profundidad de las picaduras de probetas del
temple H14 expuestas al rocío salino por: (a) 72, (b) 144, (c) 216,
(d) 288 y (e) 360 horas.
153
Figura 5.29
Distribución de la profundidad de las picaduras de probetas del
temple H16 expuestas al rocío salino por: (a) 72, (b) 144, (c) 216,
(d) 288 y (e) 360 horas.
155
Figura 5.30
Distribución de la profundidad de las picaduras de probetas del
temple H18 expuestas al rocío salino por: (a) 72, (b) 144, (c) 216,
(d) 288 y (e) 360 horas.
157
Figura 5.31
Comportamiento del factor de picaduras con respecto al tiempo de
exposición del grupo de probetas de la aleación 3003 de temple
H14.
158
Figura 5.32
Comportamiento del factor de picaduras con respecto al tiempo de
exposición del grupo de probetas de la aleación 3003 de temple
H16.
158
Figura 5.33
Comportamiento del factor de picaduras con respecto al tiempo de
exposición del grupo de probetas de la aleación 3003 de temple
H18.
159
Figura 5.34
Micrografías ópticas mostrando: (a) la morfología del ataque
producido sobre la superficie de la aleación 3003, (b) picadura de
~200 µm de longitud, (c) picadura de ~700 µm de longitud y (d)
picadura de ~400 µm de longitud.
161
Figura 5.35
Perfiles de Interferometría Óptica mostrando los detalles
topográficos típicos de la superficie de la aleación 3003 después
de expuesta al rocío salino.
162
Figura 5.36
Micrografía por MEB mostrando la morfología de la corrosión de
la aleación 3003.
162
Figura 5.37
Formas de secciones transversales de picaduras según norma
ASTM G 46.
163
Figura 5.38
Análisis por interferometría óptica de una picadura de sección
transversal tipo a (angosta y profunda): (a) perfil de la superficie
donde se encuentra ubicada la picadura, (b) perfil de máximo
contraste resaltando las características de la superficie, (c) perfil
165
xii
tridimensional donde se detalla la morfología de la picadura y (d)
perfil de la sección transversal de la picadura.
Figura 5.39
Análisis por interferometría óptica de una picadura de sección
transversal tipo b (elíptica y profunda): (a) perfil de la superficie
donde se encuentra ubicada la picadura, (b) perfil de máximo
contraste resaltando las características de la superficie, (c) perfil
tridimensional donde se detalla la morfología de la picadura y (d)
perfil de la sección transversal de la picadura.
166
Figura 5.40
Análisis por interferometría óptica de una picadura de sección
transversal tipo c (ancha y superficial): (a) perfil de la superficie
donde se encuentra ubicada la picadura, (b) perfil de máximo
contraste resaltando las características de la superficie, (c) perfil
tridimensional donde se detalla la morfología de la picadura y (d)
perfil de la sección transversal de la picadura.
167
Figura 5.41
Análisis por interferometría óptica de una picadura de sección
transversal tipo e (socavada): (a) perfil de la superficie donde se
encuentra ubicada la picadura, (b) perfil de máximo contraste
resaltando las características de la superficie, (c) perfil
tridimensional donde se detalla la morfología de la picadura y (d)
perfil de la sección transversal de la picadura.
168
Figura 5.42
Análisis por interferometría óptica de una picadura de sección
transversal tipo f (orientación microestructural vertical): (a) perfil
de la superficie donde se encuentra ubicada la picadura, (b) perfil
de máximo contraste resaltando las características de la superficie,
(c) perfil tridimensional donde se detalla la morfología de la
picadura y (d) perfil de la sección transversal de la picadura.
169
Figura 5.43
Micrografía por MEB y perfiles por interferometría óptica de una
de las picaduras de forma redonda encontradas en las superficies
corroídas: (a) Micrografía por MEB, (b) perfil bidimensional de la
picadura, (c) perfil en 3D de la picadura y (c) perfil mostrando la
sección transversal elíptica de la picadura.
170
Figura 5.44
Perfiles de Interferometría Óptica de picaduras de formas
irregulares encontradas en la superficie de la aleación 3003.
171
Figura 5.45
(a-b): Perfiles de Interferometría Óptica mostrando la formación
de cavidades redondeadas por coalescencia de pequeñas picaduras.
172
Figura 5.46
Perfiles de Interferometría Óptica mostrando la formación de
cavidades alargadas por coalescencia de pequeñas picaduras.
173
Figura 5.47
Perfiles de Interferometría Óptica de picaduras en forma de
canales
174
Figura 5.48
(a-c):
175
Micrografías
por
MEB
xiii
de
una
picadura
de
aproximadamente 100 µm de longitud, (c) detalle del interior de la
picadura.
Figura 5.49
Micrografía por MEB mostrando la participación de las partículas
de segunda fase en el proceso de corrosión.
180
Figura 5.50
(a) Imagen obtenida por MEB mostrando corrosión localizada en
la matriz que rodea el intermetálico catódico Al-Fe-Mn-Si, (b)
espectro por EDX adquirido sobre la partícula.
181
Figura 5.51
(a) Imagen por MEB mostrando detalle del área corroída por
alcalinización local, (b) espectro por EDX adquirido sobre la
partícula Al-Fe-Mn-Si.
182
Figura 5.52
Micrografía por MEB mostrando disolución alcalina alrededor de
un aglomerado de partículas Al-Fe-Mn-Si, (b) y (c) espectros por
EDX adquiridos sobre partículas Al-Fe-Mn-Si.
183
Figura 5.53
(a) Micrografía por MEB mostrando disolución de la matriz
alrededor de partículas Al-Fe-Mn, (b) espectro por EDX adquirido
sobre la partícula Al-Fe-Mn.
184
Figura 5.54
(a) Imagen por MEB mostrando lo extenso de la disolución de la
matriz ocasionada por las partículas Al-Fe-Mn, (b) espectro por
EDX de partículas Al-Fe-Mn.
185
Figura 5.55
(a)–(b) Micrografías por MEB mostrando el comportamiento
inerte de la partícula Al-Fe-Mn, (c) espectro por EDX típico
adquirido de partículas Al-Fe-Mn.
186
Figura 5.56
Imagen por MEB ilustrando el carácter inerte de la partícula AlFe-Mn y el comportamiento catódico de la fase Al-Fe-Mn-Si.
187
Figura 5.57
(a) Imagen por MEB mostrando una picadura de ~200 µm de
longitud, (b) detalle del interior de la picadura donde se observan
partículas Al-Fe-Mn corroborando el carácter inerte de esta fase,
(c) espectro por EDX típico adquirido de partículas Al-Fe-Mn.
188
Figura 5.58
Resistencia a la tracción (σuts) obtenida del grupo de probetas sin
corroer y corroídas del temple H14 en función de la temperatura
de relajación.
190
Figura 5.59
Resistencia a la tracción (σuts) obtenida del grupo de probetas sin
corroer y corroídas del temple H16 en función de la temperatura
de relajación.
190
Figura 5.60
Resistencia a la tracción (σuts) obtenida del grupo de probetas sin
corroer y corroídas del temple H18 en función de la temperatura
de relajación.
191
xiv
INDICE DE TABLAS
Pag.
Tabla 2.1
Familias de aleaciones de conformado de aluminio
11
Tabla 2.2
Grupos de aleaciones de fundición de aluminio
12
Tabla 2.3
Propiedades mecánicas de aleaciones típicas de conformado no
tratables térmicamente
13
Tabla 2.4
Composición, símbolo Pearson y grupo espacial de las distintas
17
fases del sistema Al-Mn.
Tabla 2.5
Potenciales de Solución de aleaciones de aluminio conformadas
NNT
28
Tabla 2.6
Potenciales de solución de algunos constituyentes de segunda
fase en aleaciones de aluminio
28
Tabla 2.7
Potenciales de corrosión determinados sobre el aluminio a 25°C
(77 F)
31
Tabla 3.1
Relaciones estereológicas básicas utilizadas en el análisis de
imágenes
72
Tabla 4.1
Composición química de la aleación de aluminio 3003
84
Tabla 4.2
Tratamientos térmicos de relajación aplicados a la aleación de
aluminio 3003
90
Tabla 5.1
Composición elemental de las partículas de segunda fase Al6(Fe
Mn) encontradas en la aleación 3003.
114
Tabla 5.2
Composición elemental de las partículas de segunda fase Al12(Fe
Mn)3Si encontradas en la aleación 3003.
116
Tabla 5.3
Valores de Dureza Rockwell E obtenidos de probetas de la
aleación 3003 de temples H14, H16 y H18 en estado de entrega
y recocidas a diferentes temperaturas
121
xv
REPÚBLICA BOLIVARIANA DE VENEZUELA
UNIVERSIDAD NACIONAL EXPERIMENTAL DE GUAYANA
COORDINACIÓN GENERAL DE INVESTIGACIÓN Y POSTGRADO
MAESTRÍA EN CIENCIAS DE LOS MATERIALES
CORROSIÓN EN MEDIO AMBIENTE SALINO DE LA ALEACIÓN
COMERCIAL DE ALUMINIO CVG –ALCASA 3003 CON
TEMPLES H14, H16 Y H18
Autor: Lic. Solange Y. Paredes D.
Tutor: Dr. Benjamín Hidalgo-Prada
Fecha: Noviembre de 2005
RESUMEN
El propósito de este trabajo consistió en estudiar el comportamiento de la aleación
comercial de aluminio CVG - ALCASA 3003 en medio ambiente salino. Para ello se
hicieron ensayos de corrosión acelerada en cámara salina según norma ASTM B117 en
probetas de aluminio 3003 de temples H14, H16 y H18 en condición de recibidas de
planta y en probetas tratadas térmicamente a las temperaturas de relajación de 150, 200 y
250 ºC seguidas por diferentes rutas de enfriamiento: apagadas en agua fría, enfriadas en
aire y en horno. La caracterización microestructural previa a los ensayos de corrosión
mostró que la aleación 3003 está compuesta fundamentalmente por partículas
intermetálicas gruesas: β-Al(Fe,Mn) y α-Al(Fe,Mn,Si), de diferentes relaciones
estequeométricas y partículas intermetálicas finas o dispersoides; ambas distribuidas
heterogéneamente en el volumen del material. Se utilizaron tratamientos térmicos de
relajación (TTR) y diferentes rutas de enfriamiento como único proceso modificador
posterior a la laminación para estudiar su posible efecto sobre la corrosión en la
AA3003. Los TTR y los métodos de enfriamientos produjeron un incremento mesurable
en la fracción volumétrica de las partículas (Vf)α+β en todos los temples (H14, H16 y
H18), sin afectar en forma significativa las propiedades mecánicas del material. Los
resultados de las observaciones por MEB sobre probetas corroídas mostraron que desde
las primeras horas de exposición al rocío salino la aleación estuvo afectada por ataque
localizado por picaduras básicamente relacionado con partículas intermetálicas. El
análisis de EDX realizado en varias de estas partículas asociadas con picaduras mostró
que los dos tipos de intermetálicos no presentaron la misma susceptibilidad a la
corrosión. La fase α-Al(Fe,Mn,Si) evidenció comportamiento catódico con respecto a la
matriz de aluminio y promovió disolución de la matriz en la periferia de la partícula. La
fase β-Al(Fe,Mn) presentó un comportamiento dual en el proceso de corrosión de la
aleación 3003. Por un lado, esta fase β parece no promover ningún tipo de actividad ni
catódica ni anódica, es decir se comporta de manera inerte y por otro lado, es altamente
catódica y causa disolución selectiva de la matriz que la rodea. Las medidas de
xvi
profundidad de picadura realizadas en los diferentes temples por interferometría óptica
en el grupo de probetas corroídas sin tratar y tratadas térmicamente, presentaron un alto
grado de dispersión en los valores del promedio de la profundidad de penetración de las
picaduras con respecto al tiempo de exposición (72, 144, 216, 288 y 360 horas). Se
consideró que la fluctuación de los valores obtenidos puede ser debida a diferencias en
la densidad de partículas intermetálicas de segunda fase presentes en la superficie de las
distintas probetas. De las medidas de máxima profundidad de las picaduras y de los
valores del promedio de la profundidad de las picaduras se obtuvieron factores de
picaduras entre 1 y 4 para el conjunto de probetas corroídas indicando el alto grado de
susceptibilidad de la aleación 3003 a la corrosión localizada cuando es expuesta al rocío
salino.
Descriptores: Aleación Al-Mn, Corrosión por picadura, Ensayo de niebla salina, Fases
intermetálicas, Tratamientos térmicos de relajación, Interferometría óptica, Microscopía
electrónica, Análisis de imágenes.
xvii
INTRODUCCIÓN
La aleación comercial de aluminio 3003 (Al-Mn) estudiada es desarrollada en forma de
lámina por la empresa Aluminio del Caroní, S.A. (CVG-ALCASA). Pertenece al grupo
de las aleaciones no endurecibles por precipitación, en cambio derivan su dureza de la
deformación acumulada durante el proceso de laminación en frío. Sus excelentes
propiedades mecánicas y su alta resistencia a la corrosión en la mayoría de los
ambientes, hacen que esta aleación pueda ser utilizada en un amplio rango de
aplicaciones, las cuales incluyen desde la elaboración de piezas en la industria
automotriz, hasta la fabricación de utensilios de cocina. Sin embargo, es susceptible a
corroerse por picadura cuando es expuesta en algunos ambientes agresivos
particularmente aquellos que contienen iones cloruros [1-5]. A pesar de que existe
abundante información sobre la corrosión por picadura de las aleaciones de aluminio en
soluciones de cloruro de sodio, particularmente aleaciones de la serie 2XXX [6-13], muy
pocas investigaciones se han realizado sobre el comportamiento de la aleación 3003 en
este medio. Por otra parte, existen algunos aspectos relevantes para entender los
mecanismos de la corrosión en aleaciones de aluminio que no han sido suficientemente
explorados, entre ellos el efecto de las inclusiones y la formación de picaduras en
intermetálicos catódicos [14-18].
La corrosión por picaduras en las aleaciones de aluminio ha sido atribuida a varios
factores como son:
9 El acoplamiento micro galvánico entre la matriz de aluminio y las partículas
intermetálicas e inclusiones propias del material, lo cual en las aleaciones
comerciales con significantes niveles de aleantes e impurezas es un mecanismo
bastante complejo debido a la existencia de una gran variedad de composiciones
y distribución de tamaños de los intermetálicos e inclusiones presentes en el
volumen del material [16-17,19-20].
9 A la variación local en la microestructura que resulta de los tratamientos
térmicos utilizados durante el proceso de producción o impartidos para mejorar
las propiedades mecánicas de la aleación. Esas variaciones pueden influir sobre
la naturaleza y distribución de las reacciones electroquímicas que controlan los
procesos de corrosión localizada [21-23].
9 A la disolución de la película de oxido en ciertas zonas debido a la interacción
con los iones agresivos (cloruros). El mecanismo por el cual esto ocurre ha sido
estudiado extensamente en los últimos años y aun no ha sido establecido con
suficiente claridad [24-27].
Basados en esas consideraciones, en este trabajo se propuso identificar factores
responsables de la perdida de la resistencia a la corrosión por picadura de la aleación
comercial CVG -ALCASA 3003 en medio ambiente salino. Para este propósito, se
llevaron a cabo ensayos de corrosión acelerada en niebla salina según norma ASTM
2
B117 en muestras de aluminio con las siguientes características: (a) en muestras de
temples H14, H16 y H18 en condición de recibida de planta y (b) en muestras de los
mismos temples tratadas térmicamente por una hora a temperaturas de relajación de 150,
200 y 250 ºC, seguidas por diferentes métodos de enfriamiento: apagadas en agua fría,
enfriadas en aire y en horno. Particular énfasis se hizo en la caracterización cuantitativa
de los cambios microestructurales inducidos por los tratamientos térmicos de relajación,
en un intento por correlacionar esas observaciones microestructurales con las medidas de
corrosión o en todo caso, determinar su efecto sobre la resistencia de la aleación a la
corrosión por picaduras en ambiente salino. Se utilizó la microscopía electrónica de
barrido (MEB) para investigar la asociación de las partículas intermetálicas de segunda
fase con picaduras y se usó la interferometría óptica para obtener información
cuantitativa sobre la profundidad y morfología de las picaduras, lo cual proporcionó la
base para interpretar los datos de los ensayos de corrosión acelerada llevados a cabo.
Este trabajo está ordenado por capítulos de la siguiente manera:
En el capítulo 1 se plantea el problema y se hace una descripción de la situación
existente, la justificación de la investigación, así como de los alcances y limitaciones de
la misma. En el capítulo 2 se hace referencia a los fundamentos teóricos más relevantes
de cada una de las técnicas experimentales y analíticas utilizadas en la investigación. En
el capítulo 3 se presenta una revisión bibliográfica y se describe el marco teórico
conceptual básico de la corrosión por picaduras en las aleaciones de aluminio, con
énfasis en las aleaciones comerciales Al-Mn. En el capítulo 4 se muestran en detalle el
procedimiento y las condiciones experimentales utilizadas para llevar a cabo la
3
investigación. En el capítulo 5 se presentan y discuten los resultados obtenidos de la
investigación de la corrosión en la aleación comercial de Al-Mn 3003 antes y después de
someterla a ensayos de corrosión acelerada en cámara salina. En el capítulo 6 se
presentan las conclusiones y recomendaciones generales del trabajo de investigación. En
el capítulo 7 se citan las referencias señaladas en cada una de las secciones en las cuales
esta estructurado este trabajo de investigación.
El trabajo de investigación se desarrolló en diferentes centros: La toma de muestras se
hizo en el sector de laminación en frío de la empresa CVG-ALCASA. Los ensayos de
corrosión acelerada en cámara salina, el estudio microestructural por análisis de
imágenes así como los ensayos mecánicos se realizaron en el Laboratorio Analítico de
CVG-ALCASA en la Zona Industrial Matanzas en Puerto Ordaz. El estudio por
interferometría óptica se llevó a cabo en el Laboratorio Nacional de Ensayos Mecánicos,
Tribología y Corrosión de Materiales de la Universidad Central de Venezuela. Las
observaciones por microscopía electrónica de barrido (MEB) y los microanálisis
químicos por energía dispersiva de rayos X (EDX) fueron realizados en el Laboratorio
de Análisis Químico y Estructural de Materiales (LAQUEM) de la Universidad de los
Andes. La microscopía electrónica de transmisión así como la preparación de las
probetas para cada uno de los análisis mencionados se llevaron a cabo en el Laboratorio
de Caracterización de Materiales del Instituto de Investigaciones de Biomedicina y
Ciencias Aplicadas de la Universidad de Oriente.
4
CAPÍTULO 1
EL PROBLEMA
Planteamiento del problema
La empresa C.V.G. Aluminio del Caroní, S. A. (ALCASA) produce una variedad de
aleaciones de aluminio por colada semicontinua. Generalmente las propiedades
definitivas de esas aleaciones dependen de los requerimientos del cliente.
Dentro de esas aleaciones se encuentra la aleación comercial 3003 (Al-Mn) la cual se
caracteriza por presentar excelentes propiedades mecánicas y una alta resistencia a la
corrosión en la mayoría de los ambientes y a una gran variedad de agentes químicos.
Estas propiedades hacen que esta aleación pueda ser utilizada principalmente para la
fabricación de utensilios de cocina y recipientes para la industria alimenticia. Sin
embargo, cuando esta aleación es expuesta en medios agresivos que contienen
particularmente iones cloruros presenta corrosión por picadura.
La corrosión por picadura en aleaciones de aluminio puede causar más daño en este
material que cualquier otro tipo de corrosión, produciendo perdidas del material en áreas
localizadas más que sobre la superficie total, llegando a ocasionar la destrucción de la
superficie y la pérdida de las propiedades estructurales del material. La susceptibilidad a
El Problema
la corrosión por picadura ha impedido utilizar la aleación 3003 en la industria naval,
donde se requiere una elevada resistencia al medio salino.
Ante la demanda de una aleación de alta resistencia mecánica y que a su vez garantice
protección efectiva al medio marino, la empresa venezolana del aluminio dentro de sus
planes de desarrollo propone proyectos de investigación que contemplan evaluar y
optimizar la aleación 3003 de manera de hacerla más resistente a los ataque agresivos de
los iones cloruros. Con la finalidad de llevar a cabo estas propuestas la empresa adquirió
una cámara salina para realizar ensayos de corrosión controlados en atmósfera salina que
ayuden a comprender el comportamiento de la aleación en este medio, sin introducir
procesos previos que modificaran en forma significativa las propiedades mecánicas de la
aleación.
Basándose en las consideraciones anteriores, en ésta investigación se propone realizar
ensayos de corrosión controlados en laminas de aluminio 3003 de temples H14, H16 y
H18 en condición de recibidas de planta y tratadas térmicamente con el fin de estudiar la
influencia de tratamientos térmicos de relajación (TTR) y varios medios de enfriamiento
sobre la resistencia de la aleación 3003 a la corrosión por picadura en medio ambiente
salino.
Justificación
La corrosión por picadura en el aluminio y sus aleaciones es un problema
frecuentemente encontrado en medios acuosos que contienen particularmente iones
cloruros. El proceso de corrosión por picadura en este tipo de aleaciones esta
6
El Problema
relacionado con varios factores, tales como: presencia de irregularidades en la película
de oxido que protege el material, existencia de heterogeneidades (inclusiones,
precipitados, fases diferentes) y defectos estructurales en el material.
Igualmente importante como factor que favorece la corrosión en aleaciones de aluminio
es el efecto del laminado sobre la estructura del material. El proceso de deformación por
laminación en frío modifica la estructura del metal e introduce distintos estados de
tensión, los cuales hacen que unas zonas sean más fácilmente atacadas que otras. Por lo
tanto, es importante poder remover los efectos del laminado modificando la estructura
del material final, como forma de disminuir la susceptibilidad del material a la corrosión.
Los cambios estructurales deseables en estas aleaciones son hechos generalmente a
través de tratamientos térmicos, utilizando temperaturas y tasas de enfriamiento a las
cuales la estructura resultante de la laminación pueda ser alterada mediante temples
adecuados, o induciendo la modificación de la densidad y tamaño de partículas
intermetálicas de segunda fase. Sin embargo, cuando se trata de investigaciones en
aleaciones comerciales, se impone la necesidad de mantener las propiedades
estructurales del material sin variaciones significativas, a objeto de no alterar los costos
de fabricación.
El presente estudio de corrosión en cámara salina utilizando la norma ASTM B-117, se
realizó como respuesta a la necesidad expresada por la empresa CVG-ALCASA de
disponer de una metodología que permitiera la evaluación de los posibles factores que
7
El Problema
condicionan la resistencia a la corrosión de la aleación comercial de aluminio 3003 en
medio acuoso salino.
Objetivos
Objetivo General
Evaluar el comportamiento y factores que condicionan la corrosión en medio ambiente
salino de la aleación comercial de aluminio CVG – ALCASA 3003 con temples H14,
H16 y H18.
Objetivos Específicos
1. Someter las muestras a tratamientos térmicos y diferentes medios de enfriamiento,
como forma de trasformar la fracción volumétrica de partículas intermetálicas de
segunda fase presentes en la aleación.
2. Realizar tratamientos térmicos de relajación para disminuir el nivel de deformación
acumulada resultante del proceso de laminación.
3. Realizar ensayos de corrosión acelerada en una cámara salina con tiempos de
exposición de 72, 144, 216, 288 y 360 horas y a una temperatura de 35 ºC en
muestras testigos (sin tratamiento térmico) y en muestras tratadas térmicamente.
4. Caracterizar por microanálisis de rayos-X los productos de corrosión depositados
sobre la superficie de las muestras corroídas.
5. Determinar, mediante interferometría óptica, el grado de ataque y correlacionarlo
con la tasa de corrosión de las muestras después de los ensayos en la cámara salina.
8
El Problema
6. Establecer la correlación entre la velocidad de corrosión y las características
estructurales de las muestras sometidas a los ensayos en cámara salina.
7. Realizar ensayos de tracción para determinar las propiedades mecánicas de las
muestras sin tratar, de las tratadas térmicamente y de las muestras corroídas.
Limitaciones
La principal limitación en el desarrollos del presente proyecto la constituye el hecho de
que se utilizará una aleación comercial de aluminio laminada en planta, lo cual restringe
en parte la naturaleza y profundidad de algunos análisis, ya que estaba planteado no
modificar las condiciones ni parámetros de laminación, para controlar variables
experimentales del proceso. La idea era analizar el comportamiento frente a la corrosión
de la AA 3003 en la condición más cercana posible a la de fabricación de la misma.
9
CAPÍTULO 2
MARCO TEÓRICO
2.1. El aluminio y sus aleaciones
El
aluminio
y
sus
aleaciones
presentan
innumerables
aplicaciones tecnológicas debido a sus excelentes propiedades
físicas y mecánicas, tales como baja densidad, alto esfuerzo
específico (relación esfuerzo/peso), alta conductividad térmica y
eléctrica, alta resistencia a la corrosión y cualidades higiénicas y no tóxicas. De igual
manera la diversidad de formas en que se puede procesar (láminas, secciones extruídas,
tubos inducidos, entre otros) aumenta su utilidad [6,7].
Las aleaciones de aluminio se dividen en dos grandes categorías, cuya diferencia está
basada propiamente en la fabricación del producto; aleaciones de conformado y
aleaciones de fundición. Las aleaciones, tanto de conformado como de fundición que
responden a tratamientos térmicos basados en la solubilidad de fases, se les conoce
como tratables térmicamente (TT), mientras que a las aleaciones de conformado que son
endurecidas por trabajo a través de reducción mecánica, generalmente en combinación
con varios procesos de recocido, se les denomina no tratables térmicamente (NTT) [28].
Marco Teórico
La designación de cada una de estas aleaciones ha sido estandarizada por la Asociación
del Aluminio (EE.UU) [28,29]. Para identificar las aleaciones de conformado se utiliza
un sistema de cuatro dígitos. El primer dígito indica el grupo de la aleación, el segundo
indica una modificación de los límites de impureza para la aleación del grupo 1xxx y
una modificación de la aleación original para los grupos restantes. Los dos últimos
dígitos son utilizados para indicar la pureza del aluminio y especificar las aleaciones de
los otros grupos. Las familias de las aleaciones de conformado se listan en la Tabla 2.1.
Tabla 2.1. Familias de aleaciones de conformado de aluminio
1XXX aluminio comercialmente puro
2xxx cobre (Cu)
NTT
TT
3xxx manganeso (Mn)
NTT
4xxx silicio (Si)
NTT
5xxx magnesio (Mg)
NTT
6xxx silicio-magnesio (Si-Mg)
TT
7xxx zinc (Zn)
TT
8xxx otros elementos
NTT (Al-Fe-Ni) ;
TT (Al-Li-Cu-Mg)
poco usuales
9xxx
En cuanto a las aleaciones de fundición, éstas son descritas por un sistema de tres dígitos
seguidos por un valor decimal. El primer dígito indica el grupo de la aleación, los dos
siguientes identifican las aleaciones específicas y el último, el cual es separado de los
otros por un punto decimal, indica la forma del producto, es decir, si es fundición o
11
Marco Teórico
lingote. Las aleaciones de fundición no pueden se endurecidas por trabajo y son usadas
en la condición de fundición o tratadas térmicamente. Este grupo de aleaciones se
muestra en la Tabla 2.2.
Tabla 2.2 Grupo de aleaciones de fundición de aluminio
1XX.X aluminio comercialmente puro
2xx.x cobre (Cu)
TT
3xx.x silicio-cobre-magnesio (Si-Cu-Mg)
TT
4xx.x silicio (Si)
5xx.x magnesio (Mg)
6xx.x
poco usuales
7xx.x zinc (Zn)
TT
8xx.x estaño (Sn)
9xx.x otros elementos
Seguido del nombramiento de las aleaciones tanto de conformado como de fundición,
excepto para los lingotes, se utiliza el Sistema de Designación de Temple para indicar
las características específicas del proceso de fabricación, como son:
F
Producto bruto de fabricación
O
Recocido
W
Tratamiento térmico en solución
H
Endurecimiento por deformación
En el caso de aleaciones con variaciones en la secuencia del proceso de fabricación se
añaden dígitos al Sistema anterior para denotarlas. Por ejemplo, los productos
12
Marco Teórico
conformados que son endurecidos por deformación se le añade a la letra H uno o más
dígitos. El primer dígito indica la secuencia de operaciones básicas, como sigue:
H1 Endurecimiento por deformación
H2 Endurecimiento por deformación y recocido parcial
H3 Endurecimiento por deformación y estabilización
El segundo dígito indica el grado de endurecimiento por deformación y el grado de
dureza se denota con un número fraccionario:
H12, H22, H33
→ 1/4 de dureza
H14, H24, H34
→ 1/2 de dureza
H16, H26, H36
→ 3/4 de dureza
H18, H28, H38 Totalmente duro (∼ 75% de reducción después de recocido)
H19 Extra duro (limitado a ciertas aleaciones y/o a la forma del producto)
Las propiedades mecánicas de algunas de las aleaciones de conformado en condición de
recocido, 1/2 de dureza y totalmente duro, se indican en la Tabla 2.3. Se incluyen los
valores del aluminio de alta pureza a modo de comparación [6].
Tabla 2.3: Propiedades mecánicas de aleaciones típicas de conformado no tratables
térmicamente
ALEACIÓN
COMPOSICIÓN
NOMINAL
1100
99 + % Al
3003
1.2 %Mn
5052
2.5 Mg
TEMPLE
O
H14
H18
O
H14
H18
O
H34
H38
ESFUERZO
TENSIL
MPa
90
124
165
110
152
200
193
262
290
13
Ksi
13
18
24
16
22
29
28
38
42
ESFUERZO
INGENIERIL
MPa
Ksi
34
5
117
17
152
22
41
6
145
21
186
27
90
13
214
31
255
37
ELONGACIÓN
50 mm (2in),
%
DUREZA
HB
35
9
5
30
8
4
25
10
7
23
32
44
28
40
55
47
68
77
Marco Teórico
2.2. Aleación Aluminio-Manganeso (3003)
La aleación aluminio-Manganeso es la aleación más popular de
la serie 3000. Ella reemplaza al aluminio primario (1xxx)
siempre que se necesite un ligero aumento de las propiedades
mecánicas como se aprecia en la Tabla 2.1. Pertenece al grupo de aleaciones que
endurecen por deformación y de acuerdo con la Aluminium Association, sus principales
elementos aleantes son el manganeso, el cual puede oscilar en un rango desde 1 hasta 1.7
% Mn en peso; el cobre entre 0.05 y 0.20 %Cu; el hierro y el silicio pueden ser
tolerados en el rango de 0.6 y 0.7%, mientras que los límites de las impurezas y de otros
elementos aleantes no son críticos.
Desde el punto de vista comercial la AA 3003 se sitúa como una aleación de uso general
por su excelente maleabilidad y capacidad para soldarse. Sus aplicaciones incluyen
tanques para gasolina, utensilios de cocina, refrigeradores, recipientes para altas
presiones, contenedores, intercambiadores de calor, recipientes para sustancias químicas,
construcción de hardware, en la agricultura y arquitectura y a una gran variedad de
productos que requieran alta resistencia a la corrosión [6].
La Figura 2.1 muestra una porción del diagrama de equilibrio del sistema binario Al-Mn,
donde se ilustra que el eutéctico se forma con 1.95 % Mn y el punto de fusión se alcanza
a los 660 ºC. También se indica que la máxima solubilidad sólida del Mn en el aluminio
es 1.82 % y ocurre a la temperatura de 658.5 °C [30]. En el diagrama de equilibrio de la
Figura 2.2 se muestra el campo completo de fases que se forman desde el aluminio puro
14
Marco Teórico
hasta 100% Mn. Por ejemplo, a concentraciones menores de 25 % Mn se forma
predominantemente la fase Al6Mn la cual ocurre por la reacción eutéctica a los 658.5 ºC
[31]. La composición, el símbolo Pearson y el grupo espacial de las distintas fases del
sistema Al-Mn se indican en la Tabla 2.4 [32].
En la producción de las aleaciones comerciales de aluminio Al-Mn el hierro y el silicio
están invariablemente presentes como impurezas mientras que el cobre, magnesio y zinc
son añadidos en forma de aleantes minoritarios. A diferencia de estos elementos el
hierro tiene muy poca solubilidad sólida en el aluminio y durante la solidificación éste es
arrojado a la fase líquida donde es incorporado dentro de los intermetálicos que tienden
a formarse. El primer intermetálico en solidificar es el Al6(Mn,Fe) seguido por αAl(Fe,Mn)Si [33,34]. El compuesto Al6(Mn,Fe) corresponde a la fase binaria Al6Mn
que se observa en el diagrama de fase a bajas concentraciones (Figura 2.2), en la cual
átomos de Mn han sido sustituidos por átomos de hierro. De acuerdo con trabajos
realizados [35], los lingotes de colada presentan un 85% de la fase Al6(Mn,Fe) y un 15%
de α-Al(Fe,Mn)Si. Después de aplicar el tratamiento térmico de homogeneización a
620°C por 16 horas, en los lingotes de colada la cantidad de la Al6(Mn,Fe) disminuye de
85% a 35% con un aumento de la fase α. Esta transformación Al6(FeMn)
→ α-
Al(Fe,Mn)Si es crucial para el laminado debido a que la dureza de la fase-α, la cual es
presumiblemente mayor en comparación a la fase Al6(Mn,Fe), incrementa la presión de
contacto crítica por arriba de la cual ocurre la laminación [36].
15
Marco Teórico
Durante el proceso de deformación tanto en caliente como en frío, ambas fases o
compuestos intermetálicos se fracturan y la microestructura final de las láminas de
aluminio Al-Mn consisten de hileras de intermetálicos o partículas de segunda fase,
tendidas en planos paralelos a la dirección de la laminación.
T, ºC
Figura 2.1: Porción del diagrama de fase del sistema Al-Mn [2]
16
Marco Teórico
Figura 2.2: Diagrama de equilibrio del sistema Al-Mn
Tabla 2.4: Composición, símbolo Pearson y grupo espacial de las distintas fases
del sistema Al-Mn.
Fase
Composición
% en peso Mn
Símbolo Pearson
Grupo Espacial
(Al)
0 a 1.25
cF4
Fm 3 m
Al6 Mn
25.2
oC28
Cmcm
λ(“Al4Mn”)(c)
~ 29.4 a ~32
(d)
…
µ
~32 a 34.8
(d)
…
Al10Mn3(Φ)
(b)
hP28
P63 /mmc
Al11Mn4(LT)(e)
43
aP30
PI
Al11Mn4(HT)(e)
40 a 45.0
oP160
Pnma
γ1
47 a 55.7
(f)
…
γ 2(g)
48.2 a 64
hR26
R3m
γ
51.8 a 68.2
(f)
…
ε
69.8 a 75
hP2
P63 /mmc
τ
(b)
tP2
P4/mmm
(δMn)
76.5 a 100
cI2
Im 3 m
(γMn)
95.3 a 100
cF4
Fm 3 m
(βMn)
75.0 a 100
cP20
P4132
(αMn)
~99 a 100
cI58
I 4 3m
(b) Fase metaestable. (c) estructura ortorrómbica simple reportada en una aleación del tipo Al4Mn. (d) hexagonal.
(e) Variantes de esta estructura son descritas como complejas secuencias de apilamiento a lo largo del eje b. (f)
Desconocido. (g) La estructura ha sido descrita como tipo γ-latón distorsionada, cúbica (bcc o fcc) y romboédrica.
Tomado de: A. J. McAlister and J. L. Murray, 1987
17
Marco Teórico
2.3. Descripción del proceso de fabricación de la aleación comercial de aluminio
CVG-ALCASA 3003
La aleación 3003 se produce a nivel industrial fundiendo carga sólida
(chatarra) y carga líquida (crisoles provenientes de las celdas de
reducción del aluminio), previamente pesadas, en un horno de fusiónretención a una temperatura de 760 °C y por un periodo de 6 a 7
horas. Generalmente, la chatarra es la misma aleación o una aleación compatible como
por ejemplo la aleación 1050 o la aleación 1100.
Una vez fundido el material sólido, se agita el horno por ambas puertas durante cinco
minutos, luego la escoria que se produce sobre la mezcla metálica se recoge en unos
moldes y se pesa. Al valor obtenido se le sustrae el valor del peso de ambas cargas
(sólida y líquida) para determinar el peso total de carga.
Después de escorificar la mezcla se toma de ésta una muestra y se envía al laboratorio
químico con el fin de obtener información del porcentaje de los elementos presentes,
provenientes de la chatarra y de los crisoles, y determinar la cantidad (en kilogramos) de
los elementos que se deben agregar para obtener la aleación dentro de los límites
establecidos. La incorporación de los aleantes se hace en cantidades iguales por ambas
puertas del horno de fusión-retención.
Al cabo de 30 minutos se agita nuevamente el horno por un periodo de
aproximadamente cinco minutos y se extrae otra muestra que se envía al laboratorio
químico para verificar el nuevo porcentaje de aleantes. En caso de que el baño metálico
18
Marco Teórico
esté fuera del rango establecido, se procede nuevamente a calcular los kilogramos de
aleantes necesarios y se repite el proceso hasta obtener los porcentajes exigidos por la
aleación y así poder dar inicio a la colada.
En CVG-ALCASA el método más utilizado para la solidificación es el de colada
semicontiua o colada vertical. Éste permite la elaboración de cilindros y planchones para
extrusión y laminación, respectivamente. Previo a la colada, los moldes o falsos fondos
son lubricados con una capa de grasa a base de cobre y se controlan parámetros tales
como la posición de la mesa de colada, temperatura del canal de colada, los flotadores,
la malla tamiz de inclusiones, óxidos o cualquier impureza ajena a la aleación, el flujo y
la temperatura del agua refrigerante.
Cuando se obtienen las condiciones apropiadas, se da inicio al flujo del material líquido
desde el horno de fusión-retención a través del canal de colada con sus respectivas
bocinas distribuidoras que llegan hasta los moldes. A su vez se añade en forma continua
al canal de colada el refinador de grano, generalmente titanio boro, en una relación de
porcentaje en peso de 5:1. Simultáneamente se hace fluir agua refrigerada a través del
sistema con la finalidad de ir solidificando bruscamente el material. En el caso de la
colada de la AA 3003, a medida que ocurre la solidificación el falso fondo o cabezote,
acoplado a un pistón hidráulico, va descendiendo hasta alcanzar la longitud nominal del
planchón (148-192 de largo x 18-22 de espesor x 51 de ancho) (pulg). Se estiman dos
horas para el proceso de colada.
19
Marco Teórico
Los planchones a laminar son transportados hasta el patio de almacenaje de la sección de
laminación, luego se pasan por la fresadora KNOEVENAGEL para desbastar
aproximadamente 6.35 mm de cada lado del planchón, con el fin de obtener una
superficie completamente lisa, libre de defectos superficiales o segregaciones
indeseables que pudieran ocasionar roturas o acumulación de defectos en la lámina
durante el proceso de laminación.
Posteriormente, estos planchones son sometidos a un tratamiento térmico de
homogeneización para controlar las propiedades mecánicas y las características finales
de la aleación. El homogeneizado se realiza en los hornos de GUINEA I y II ubicados en
la planta de laminación. Las prácticas operativas establecen una temperatura de 600 °C y
un tiempo de permanencia de 12 horas distribuidas de la siguiente manera: se carga el
horno a una temperatura de 500 °C y al cabo de cuatro horas (tiempo de absorción)
alcanza la temperatura de 600 °C, a esta temperatura se mantiene el horno por ocho
horas (tiempo de calentamiento). Luego sigue una fase de enfriamiento por una hora
para disminuir la temperatura del horno desde 600 hasta 500 °C, la cual es considerada
la óptima para que los planchones adquieran la máxima fluencia de laminación. Con esta
temperatura (500 °C) los planchones pasan al laminador en caliente CLECIM COSIN
donde reciben entre 15 y 18 pases de reducción, según programa de laminación, hasta
obtener una lámina entre 4 a 6 mm de espesor, la cual es recogida en forma de bobina.
De este proceso las bobinas salen con una temperatura de 300 ± 10 °C, luego son
almacenadas en el patio central por 72 horas hasta que alcancen la temperatura ambiente.
Después las bobinas son pesadas (tienen ∼10000 Kg/bobina) y transferidas mediante
20
Marco Teórico
grúas hasta los laminadores en frío Davy McKee, United y Bliss, dependiendo de la
disponibilidad de los equipos, programación de la producción y del inventario del
material.
En el laminador Davy McKee las láminas de 6 mm de espesor, provenientes del sector
de laminación en caliente, se reducen a espesores entre 4 a 0.27 mm. En el United se
obtienen láminas con espesores finales que llegan a 0.18 mm mientras que en el
laminador Bliss se reducen láminas hasta un espesor de salida de 0.10 mm. Para lograr
estos espesores bajos, se hace un recocido intermedio en las bobinas en los hornos de
recocido Guinea I y II donde permanecen por 21 horas a 380 ºC. Generalmente, se
producen en el laminador David Mckeen láminas de temples H14, H16 y H18 de 4.0, 3.0
y 1.5 mm de espesor, respectivamente, directamente de las láminas de 6.00 mm de
espesor. De este proceso las bobinas salen con una temperatura de 80 ±10 ºC, luego son
almacenadas en el patio central por 24 horas hasta que alcancen la temperatura ambiente.
Posteriormente son transportadas a la niveladora de tensión para eliminar las
ondulaciones formadas durante el proceso de laminación en frío para finalmente ser
enviadas a la línea de empaque.
2.4. Aspectos electroquímicos de la corrosión
La corrosión de metales en medios habituales (aguas
superficiales, agua de mar, humedad atmosférica) es un
fenómeno electroquímico, donde el proceso de corrosión
ocurre por reacciones de electrodos (anódicas y catódicas) siendo el medio corrosivo la
21
Marco Teórico
solución electrolítica. La reacción anódica corresponde a la disolución del metal y al
mismo tiempo ocurre un proceso catódico en el cual el agente corrosivo, generalmente
oxígeno atmosférico y algunas veces hidrógeno, se consume o reduce [7].
En general, cualquier reacción de corrosión en soluciones acuosas involucra oxidación
(reacción anódica) del metal y reducción (reacción catódica) de un espécimen en
solución con transferencia de electrones entre los dos reactantes. Estas dos reacciones
son complementarias, ocurren simultáneamente y a la misma velocidad y en algunos
casos, como en la corrosión generalizada y por picaduras, sobre la misma superficie del
metal, quedando ésta cargada eléctricamente, por lo cual la tasa de oxidación es igual a
la tasa de reducción [37]. Puesto que en todo proceso corrosivo ocurren dos
semireacciones, la anódica de oxidación metálica y la catódica de reducción del
oxidante, y siendo que cada una de ellas presenta un mecanismo individual complejo, es
posible determinar la velocidad de corrosión por una de ellas o por ambas.
Las semireacciones químicas que caracterizan cada electrodo pueden ser escritas de la
siguiente manera [38]:
Reacción anódica
Me + ze − = Me z +
Reacción catódica
Ox = Ox
y−
+ ye−
donde :
Me z + y Ox son las especies que se oxidan
Me y Ox y − son las especies que se reducen
Z y y representan el número de electrones involucrados en cada semireacción
22
(1)
(2)
Marco Teórico
Estas reacciones se producen en la zona de unión entre el líquido y el metal
estableciéndose un equilibrio entre la disolución del metal en la solución y la reacción
inversa del depósito del metal a partir de los iones en solución. De este modo, las
sustancias que participan toman de la solución un potencial E que depende de la
concentración o actividad de sus iones en solución.
Este potencial llamado de equilibrio se obtiene aplicando la ecuación de Nernst a las
expresiones anteriores. La ecuación de Nernst está expresada de la siguiente manera
[39]:
E = E° +
RT
[Ox ]
log
nF
[red]
(3)
Donde:
E° = Potencial obtenido en las condiciones normales de 101,3 kPa, 298 K y actividad
unitaria de los iones en solución.
Los valores [Ox] y [red] representan el producto de las actividades de las diferentes
especies que constituyen la forma oxidada y la forma reducida elevadas a sus respectivos
coeficientes estequiométricos.
n = cambio de carga iónica en un proceso de electrodos
R = Constante de los Gases = 1,987cal / mol-(K)
F = Número de Faraday = 9,64870x107 cal / Kg-equiv.
De este modo el potencial de equilibrio para la reacción anódica a temperatura ambiente
(T = 298 K) puede ser expresado mediante la relación:
23
Marco Teórico
⎡
⎤
⎢a
z + ⎥⎦
0.059
Me
⎣
o
log
E
=E
+
z
Me z +
Me z +
a
Me
[
Para la reacción catódica:
E
= Eo +
Ox
Ox
(4)
]
[ ]
a
0.059
Ox
log
y
⎡
⎤
⎢a y − ⎥
⎣ Ox
⎦
(5)
2.5. La corrosión del aluminio
La corrosión del aluminio en presencia de agua puede representarse mediante las
siguientes semireacciones [7]:
Reacción anódica
Al → Al + 3 + 3e
Reacción catódica
3H + + 3e → 3/2 H
(6)
2
(7 )
Donde la reacción total es la suma de las expresiones (6) y (7):
Al + 3 H O → Al(OH) + 3 / 2H ↑
2
3
2
(8)
De acuerdo con la ecuación (4) el potencial de equilibrio de la Reacción anódica queda
expresado de la siguiente forma [40]:
24
Marco Teórico
⎤
⎡
⎢a + 3 ⎥
0.059
log ⎣ Al ⎦
E = Eo
+
3
Al + 3
a
Al
(9)
[ ]
Considerando el potencial normal para el aluminio E o + 3 = − 1.67 V y la actividad de
Al
sus iones en solución [a Al ] = 1, se obtiene:
E = − 1.67 V +
⎡
⎢
⎢
⎢
⎣
a
+3
0.059
log Al
3
⎤
⎥
⎥
⎥
⎦
(10)
Por lo tanto la reacción anódica depende solamente de la concentración de los iones de
aluminio.
El potencial de la reacción catódica para el electrodo de Hidrógeno según la ecuación (5)
para la forma 2H + + 2e − = H 2 es [39]:
0.059
+
log
2
+
H
E = Eo
⎡
⎢
⎢
⎢
⎣
a
⎡
⎢
⎢
⎢
⎢
⎢
⎢⎣
H+
⎤
⎥
⎥
⎥
⎦
a
H
2
(11)
2
⎤
⎥
⎥
⎥
⎥
⎥
⎥⎦
⎤
⎛
⎞ ⎡
Siendo ⎜⎜ E o
= 0 ⎟⎟ , ⎢a
⎥ =1 , y si como ocurre frecuentemente el gas de hidrogeno
⎝ H+
⎠ ⎢⎣ H 2 ⎦⎥
se desprende contra la presión atmosférica normal, entonces, el potencial del electrodo
de hidrógeno es exclusivamente función del pH para una temperatura dada. Entonces la
ecuación anterior toma la forma:
25
Marco Teórico
(12)
E = 0.000 − 0.059 pH
Calculada para pH = 14
E = 0.000 – 14 x 0.059
E = -0.83V
(13)
Por analogía, la reacción catódica para el electrodo de Oxígeno es de la forma,
O 2 + 4H + + 4e − = 2H 2 O y el potencial viene expresado por:
⎤
⎡
P ⎢a
O ⎣ H + ⎥⎦
0.059
o
E=E
log 2
+
O
2
4
2
⎡
⎤
⎢a H O ⎥
⎢⎣ 2 ⎥⎦
4
(14)
Donde el potencial normal para el oxígeno E o = 1.23 V , PO 2 la presión parcial del
O2
oxigeno y la actividad del agua puede considerarse unitaria. Entonces el potencial del
electrodo de oxígeno en función del pH viene expresado por:
(15)
E = 1.23 − 0.059 pH
Calculada para pH = 14
E = -0.40V
(16)
Los potenciales para los electrodos de hidrógeno y oxígeno dependen del pH
(concentración del ión hidrógeno), de la cantidad de oxígeno disuelto en solución, y de
la presión parcial de ambos. En condiciones de potencial de circuito abierto, donde no
hay flujo de corriente, y bajo concentraciones fijas de iones hidrógeno, oxígeno e iones
aluminio, existe una diferencia de potencial entre las reacciones anódicas y catódicas.
Esta diferencia de potencial es la fuerza electromotriz (fem) necesaria para dar inicio al
26
Marco Teórico
proceso de corrosión [40]. La fuerza electromotriz teórica para las celdas de corrosión
locales es solamente aplicable antes de iniciarse el proceso de corrosión en el medio
corrosivo. Una vez que comienza a fluir la corriente procede la corrosión y la diferencia
de potencial disminuye cuando uno o ambos potenciales del circuito abierto cambian
uno con respecto al otro. La velocidad de cambio, con el incremento del flujo de
corriente, es una medida de la polarización de esas reacciones. La intercepción de las
curvas de polarización anódica y catódica define el potencial de corrosión y la tasa de
corrosión del metal bajo ciertas condiciones.
2.6. Potenciales de solución
Los potenciales de solución o de corrosión (Ecorr) son los medidos sobre metales y
aleaciones en soluciones acuosas. Estos potenciales son mixtos en los que intervienen las
reacciones electroquímicas correspondientes al metal y las reacciones del electrolito.
Además, relacionan la forma como los constituyentes microestructurales de una aleación
afectan su comportamiento frente a la corrosión [6].
El potencial de solución (Ecorr) del aluminio y sus aleaciones depende principalmente de
la composición de la solución sólida rica en aluminio, la cual constituye la fracción
volumétrica mayoritaria de la microestructura de la aleación y ésta a su vez, de la
cantidad de elementos retenidos en solución.
Algunas valores representativos de potenciales de solución para aleaciones de aluminio
no tratables térmicamente (NNT) y de algunas de las fases constitutivas se presentan en
las Tablas 2.5 y 2.6, respectivamente. Estos valores han sido tomados con respecto al
27
Marco Teórico
electrodo de calomel medido en una solución acuosa de 53 g/l NaCl y 3 g/l H2O2 a 25 °C
[6].
Tabla 2.5: Potenciales de Solución de aleaciones de aluminio conformadas NNT
ALEACIÓN
POTENCIAL, V
ALEACIÓN
POTENCIAL, V
1060
-0.84
5154
-0.86
1100
-0.83
5454
-0.86
3003
-0.83
5056
-0.87
3004
-0.84
5456
-0.87
5052
-0.85
7072
-0.96
Tabla 2.6: Potenciales de solución de algunos constituyentes de segunda fase en
aleaciones de aluminio
FASE
POTENCIAL, V
Si
-0.26
Al3Ni
-0.52
Al3Fe
-0.56
Al2Cu
-0.73
Al6Mn
-0.85
Al2CuMg
-1.00
Al8Mg5
-1.24
2.7. Corrosión por picadura
La corrosión por picadura puede ser definida como un caso
particular de ataque localizado que procede debido a la acción
de celdas locales que producen cavidades en la superficie, las
cuales comienzan a llenarse de productos de corrosión y por su
naturaleza autocatalítica causan la destrucción del metal. De las distintas formas de
corrosión que sufren los metales, la picadura es una de las más destructivas e insidiosas.
28
Marco Teórico
Las estructuras fallan por perforación con solamente un pequeño porcentaje de pérdida
de peso del área total de la misma, ocasionando daños irreparables en las estructuras
metálicas.
Las características de la corrosión por picadura pueden resumirse de la siguiente manera
[41]:
1. Difícil de detectar
¾ pequeñas en tamaño
¾ cubiertas por productos de corrosión
2. Difícil de medir/comparar
¾ profundidad de las picaduras varía
¾ número de picaduras varía
3. Difícil de predecir
¾ requiere largos periodos de tiempo para iniciarse
4. Defectos
¾ altamente localizada
¾ ataque intenso
¾ equipos fallan inesperadamente
5. Formas de picaduras
¾ cavidades profundas
¾ superficie rugosa, picaduras cercanas
¾ líneas en la dirección de la gravedad
6. Crecimiento de picaduras
¾ requieren de 0.5-1 año para iniciarse
¾ una vez que se inician penetran en el metal rápidamente
En el aluminio y otros metales susceptibles a corroerse por picadura en presencia de
soluciones acuosas que contienen iones agresivos como Cl-, Br- o I-, la corrosión ocurre
29
Marco Teórico
por arriba de cierto potencial (EP). Este potencial depende de la composición del
material y tiende a variar en forma logarítmica con la concentración de las especies
agresivas. En presencia de iones Cl- este potencial queda representado de la siguiente
manera [42-44]:
[ ]
E P = a + b log a Cl-
(17)
[ Cl ] es la concentración de los iones cloruros. El valor de
donde a y b son constantes. a
-
b también depende de la técnica electroquímica utilizada.
En el caso de la corrosión del aluminio en presencia de iones cloruro, algunos autores
reportan la siguiente relación para el potencial de picadura [45]:
[ ]
E P = − 0.0504 − 0.124 log a Cl-
(18)
Una recopilación de potenciales de corrosión obtenidos del aluminio de alta pureza y de
ciertas aleaciones de aluminio en diferentes ambientes agresivos se presenta en la Tabla
2.7 [6].
De acuerdo con Rama et al. [46] el potencial de picadura en el aluminio puede
incrementarse adicionándole ciertos elementos como W, Ta, Mo y Cr. Esta característica
ha sido correlacionada con la baja solubilidad que presentan los óxidos de los elementos
aleantes (WO3, Ta2O5, MoO3, Cr2O3.nH2O) en soluciones ácidas, los cuales pueden ser
estables dentro de la picadura al potencial correspondiente del aluminio. Por lo tanto, es
necesaria una alta fuerza electromotriz para disminuir el pH y producir la disolución de
30
Marco Teórico
estos óxidos ya que el sitio activo de la picadura es cubierto por una capa de óxido cuya
velocidad de disolución determina el potencial de picadura.
Tabla 2.7: Potenciales de corrosión determinados sobre el aluminio a 25 °C.
ELECTROLITO
POTENCIAL DE
PICADURA, V vs SHE (a)
Aluminio de alta pureza
0.1 M NaCl
-0.40
0.5 M NaCl
-0.50
1 M NaCl
-0.48
1 M NaBr
-0.29
1 M KBr
-0.42
1 M KI
-0.26
99.4 Al (b)
0.1 M NaCl
-0.41
Al-2.4 Mg
0.1 M NaCl
-0.44
Al-0.2 Cu
0.1 M NaCl
-0.46
Al-4 Cu
0.1 M NaCl
-0.36
(a) Electrodo de hidrogeno estándar; (b) 0.48% Fe
2.8. Mecanismos de la corrosión por picadura en AA
El entendimiento del mecanismo exacto del fenómeno de la corrosión por picadura, aun
no se ha establecido, sin embargo, se acepta que puede ser dividido en dos fases;
iniciación y propagación de la picadura. Varios modelos se han propuesto para describir
la iniciación y propagación de la picadura sobre el aluminio y sus aleaciones en
diferentes medios [11-14, 26-27, 47-49].
31
Marco Teórico
2.8.1. Iniciación de la picadura
La iniciación de la picadura es el mecanismo menos entendido y probablemente
depende de la estructura metalúrgica. McCafferty [24-25] por ejemplo, plantea el inicio
de la corrosión por picadura en AA por medio de un modelo cinético de electrodos,
tomando en consideración: (i) la adsorción de los iones cloruros por la superficie de la
película de óxido, (ii) penetración de los iones cloruros a través de la película de óxido y
(iii) disolución asistida por Cl- por debajo de la película de óxido, es decir, en la
interfase óxido/matriz.
(i) Adsorción de los iones cloruros
Cuando un anión, como el ión cloruro, interactúa con una superficie iónica, tal como un
óxido, se producen fuerzas atractivas como: (a) fuerzas coulombicas, (b) inducción
electrostática del sustrato por el ión, (c) polarización electrostática del ión y (d) fuerzas
de Van der Waals. De esas fuerzas,
las dos primeras son las que ejercen mayor
atracción, por su naturaleza iónica. En soluciones neutras la película de óxido tiende a
cargarse positivamente, favoreciendo la adsorción de los iones cloruros.
Actualmente, existen evidencias experimentales que demuestran que los iones cloruros
son adsorbidos sobre la película de aluminio antes de la formación de la picadura.
Berzins et al. [50], citados por McCafferty, por ejemplo, usando la técnica de autoradiografía han reportado que la adsorción de cloruros en el aluminio es altamente
localizada y puede corresponder con la ubicación de sitios de picaduras.
32
Marco Teórico
(ii) Penetración de la película de óxido por iones cloruros
McCafferty, considera varios mecanismos de penetración de los iones cloruros en la
película de óxido, tales como: (a) transporte de los iones cloruros a través de la película
de óxido por medio de vacancias de oxígeno, (b) transporte de iones cloruros a través de
la película de óxido mediante canales de agua y (c) disolución localizada o
adelgazamiento de la película.
La primera consideración la establece en base al tamaño de los radios atómicos, donde el
radio del ión Cl- es levemente mayor que el radio de un ión de óxido de aluminio (1.81
vs 1.40 Å, respectivamente) de manera que la migración a través de vacancias de
oxígeno es un mecanismo posible de penetración de los iones cloruros a la película de
óxido. La segunda propuesta aún no ha sido corroborada, debido a la inexistencia de
fibrillas sobre la película de óxido que sirvan de canales localizados que transporten los
iones cloruros al sustrato del metal. Por último, el mecanismo por adelgazamiento de la
película de óxido considera que sí la película es desbastada localmente aún queda un
remante de óxido a través del cual los iones Cl- pueden penetrar por alguno de los dos
mecanismos mencionados anteriormente.
Por otra parte, McCafferty cita el trabajo de Brown et al. [51], quienes utilizando la
técnica de Backscattering Rutherford demostraron que los iones Cl- entran en la película
pasiva del aluminio bajo un potencial aplicado. De igual manera, Natishan et al [52] y
Yu et al [53] por espectroscopia de absorción de rayos-X (XAS) encontraron que
muestras de aluminio polarizadas por debajo del potencial de picadura exhiben un borde
33
Marco Teórico
de rayos-X a 2823 eV, atribuido al ión Cl- por su cercanía al NaCl estándar. De acuerdo
con Kolies et al [54] a un pH cercano a 9.5 la concentración de iones cloruros que
penetran la superficie es mínima. Por otra parte, Natishan et al [52] y Yu et al [53]
empleando la técnica de XPS mostraron que la concentración de cloruros incorporados
en la superficie se incrementa con un potencial por arriba del potencial de picadura y
luego disminuye con la iniciación de la picadura. Tomesanyi et al [55] atribuyeron esta
disminución de la concentración de iones cloruros a las reacciones químicas que ocurren
cuando se inicia la picadura.
(iii) Disolución asistida por ClUna vez que los iones cloruros penetran la película pasiva hasta el sustrato del metal, la
iniciación de la picadura procede a través de reacciones de disolución asistida por Cl-,
las cuales ocurren debajo de la película de óxido en la interfase óxido/metal. Para que
esas reacciones de disolución ocurran, moléculas de agua también deben entran en el
óxido y estar presentes en la base de la película de óxido de manera de proporcionar el
electrolito requerido para la disolución localizada. El agua molecular puede penetrar la
película de óxido a través de defectos estructurales o poros.
2.8.2. Propagación de la picadura en aluminio
De acuerdo con McCafferty [25], una vez que la picadura sobrevive a la etapa de
iniciación se desarrolla sobre la superficie del metal una formación radial o burbuja
(blister). El desarrollo de este mecanismo contempla varias fases: (i) formación de la
burbuja debajo de la película de óxido, debido a las reacciones electroquímicas que
34
Marco Teórico
ocurren en la interfase óxido/metal (Figura 2.3.a), (ii) crecimiento de la burbuja debido a
las continuas reacciones y cambios en el electrolito local dentro de la misma (Figura
2.3.b) y (iii) ruptura debido a la presión de hidrógeno creada en el interior de la misma
(Figura 2.3.c). Las formas semejantes a estas burbujas han sido observadas por otros
autores [56].
Luego del rompimiento de la burbuja ocurre disolución anódica en las cercanías de la
misma, los iones de aluminio disueltos localmente se hidrolizan y producen un ambiente
ácido haciendo que los iones Cl- migren hacia la celda que se ha formado, manteniendo
la neutralidad de las cargas. Así, la propagación de la picadura es debida a la disolución
anódica en los alrededores de la picadura ocluida.
a
b
c
Figura 2.3: Micrografías por MEB ilustrando la formación y ruptura de las burbujas
(blisters). [25]
35
Marco Teórico
2.9. Método de evaluación de la corrosión por picadura
Usualmente se requieren medidas cuantitativas de corrosión para comparar aleaciones,
ambientes o en la estimación de la eficiencia de materiales en un ambiente dado. Los
métodos de medida comúnmente utilizados son: pérdida en esfuerzo tensil, profundidad
de picadura y pérdida de peso. La pérdida de esfuerzo tensil con el tiempo de exposición
es de gran relevancia en el área de la ingeniería. Sin embargo, el espesor original del
material debe ser tomado en consideración al momento de interpretar los daños por
corrosión. La profundidad de corrosión es una de las medidas más importante, pero su
exactitud es influenciada por la técnica de medición y el factor de probabilidad en
determinar la máxima profundidad de la picadura [38].
La corrosión por picadura se evalúa según tres criterios: su densidad, es decir, el número
de picaduras por unidad de superficie; su promedio, su máxima profundidad, y su
velocidad de penetración. Este último, es el dato más importante en este mecanismo,
puesto que de él dependerá la duración de la vida útil del material. Por lo que se ha
definido el factor de picadura (Fp) como el cociente entre la profundidad máxima
designada por P, y el promedio de la penetración p.
FP =
P
p
(19)
Un factor de picadura de 1 representa corrosión uniforme; mientras mayor es el factor,
mayor es la profundidad de penetración. Este factor no se aplica en aquellos casos donde
la picadura o corrosión general es muy pequeña debido a que valores de cero o infinito
pueden obtenerse en la relación anterior.
36
Marco Teórico
2.10. Factores que influyen en el comportamiento de la corrosión del aluminio y sus
aleaciones
2.10.1. Naturaleza de la película de óxido
Aunque el aluminio es un metal reactivo con elevada afinidad por el oxígeno, es
altamente resistente a la corrosión permaneciendo inalterable por largos periodos de
tiempo en atmósferas naturales, aguas frescas, agua de mar y en una gran variedad de
suelos y agentes químicos. Este comportamiento se debe al carácter inerte y protector de
la película de óxido que se forma sobre la superficie del metal inmediatamente después
de producido [45].
Esta película de óxido se forma mediante la reacción de los iones Al+3 con el oxígeno del
aire o del ambiente, controlando los intercambios entre el metal y el medio en que se
encuentre. Es anhídrida, transparente, adherente, compacta y su espesor varía entre 40 y
100 Å. Está compuesta de dos capas: una capa interna amorfa, no porosa, en contacto
directo con la superficie del metal cuyo espesor (entre 20 y 25 Å) está determinado por
la temperatura del medio; y una capa externa más permeable que se forma por la
reacción de la anterior con el medio ambiente, particularmente con la humedad del aire y
cuyo espesor y propiedades también dependen de las condiciones en las que se ha
desarrollado [7].
En las aleaciones comerciales de aluminio el espesor y continuidad de esta película varía
considerablemente dependiendo de los tratamientos térmicos y mecánicos que recibe
durante la fabricación. En la manufactura de láminas, por ejemplo, la película que cubre
37
Marco Teórico
el lingote se quiebra debido a que ésta es bastante frágil y no puede elongarse con el
material. Así, durante el laminado se forman y se quiebran continuamente películas
ocasionando que la película de óxido final de la superficie laminada varíe
considerablemente en espesor y características de punto a punto [40].
Entre los otros factores por los cuales la continuidad de la película de óxido se ve
afectada, está la existencia de defectos en la superficie del metal tales como poros,
grietas e imperfecciones. Así como por su microestructura, en particular por la presencia
y fracción volumétrica de partículas de constituyentes metálicos. Estos defectos pueden
constituirse como sitios activos y promover el rompimiento de la película de óxido
cuando el metal es expuesto en ambientes agresivos particularmente aquellos que
contienen iones Cl-, Br- e I- [57].
Al igual que otros materiales protegidos por una capa delgada de óxido, los cambios en
la composición, estructura y propiedades determinan la resistencia a la corrosión, así
como su capacidad de repasivación [58].
En el aluminio y sus aleaciones, la estabilidad de la película de óxido depende también
del rango de pH del electrolito con el que puede estar en contacto sin producir su
destrucción. En el rango 4 - 8.5, la película es estable, es decir; el aluminio está
protegido. Por arriba ó por debajo de esos valores, ocurre disolución anódica
produciéndose iones Al+3 y disolución alcalina, respectivamente. En esta última etapa se
forman iones AlO-2 (aluminatos), debido a la solubilidad de la película en muchos
ácidos y bases [6].
38
Marco Teórico
Sin embargo, los límites de ese rango, pueden variar hacia valores de pH bajos (∼2.5)
por la temperatura, por la forma específica de la película de óxido presente, y por la
presencia de sustancias que puedan formar complejos solubles o sales insolubles con el
aluminio. Por ejemplo, aniones SO4-2 pueden ser incorporados en soluciones neutras y
formar una variedad de sales básicas y complejos. Así la película de óxido también
puede proteger en atmósferas urbanas con contenidos de SO2 [59].
Las condiciones de estabilidad termodinámica de la película de óxido para el sistema
Al/H2O a 25°C son expresadas en el diagrama de Pourbaix mostrado en la Figura 2.4. Si
las condiciones son de pasivación, el óxido, según sea el caso, puede proteger al
aluminio totalmente contra la corrosión (pasivación perfecta) o puede protegerlo
parcialmente en cuyo caso el metal sufre corrosión localizada o por picadura. Si las
condiciones son de corrosión (izquierda–derecha) el metal puede ser disuelto y sufre
corrosión generalizada [60].
Los procesos de corrosión en el aluminio también han sido interpretados en base a las
propiedades químicas de la película de óxido que se forma sobre la superficie del metal.
A bajas temperaturas (70 ºC) la forma predominante producida por corrosión es la
bayerita y el trióxido de aluminio Al(OH)3, mientras que a altas temperaturas (de 70
hasta 300 ºC) es la bohemita AlO(OH), también puede formarse gibsita o hidragelita
Al2O3.3H2O si están presentes iones de metales alcalinos durante la corrosión [6].
39
Marco Teórico
Figura 2.4: Diagrama de Pourbaix para el sistema Al/H2O a 25 ºC [45]
2.10.2. Efecto general de los elementos aleantes sobre la corrosión en AA
Las aleaciones comerciales de aluminio contienen elementos que le proporcionan, aparte
de sus propiedades físicas finales (densidad, rango de temperatura de fusión,
conductividad térmica y eléctrica), resistencia a la corrosión. Dentro de estos elementos
tenemos, entre otros, el cromo, cobre, silicio, manganeso, magnesio y zinc. De estos, son
el cobre, el magnesio y el zinc los de mayor importancia comercial, los cuales tienen
una apreciable solubilidad que afecta la naturaleza electroquímica de la solución sólida
del aluminio [29,61-62]. A continuación se presenta una descripción general del efecto
de algunos elementos aleantes sobre la resistencia de las aleaciones de aluminio a la
corrosión:
40
Marco Teórico
Cobre: reduce la resistencia a la corrosión de aluminio más que cualquier otro elemento
aleante. Bajos niveles de cobre (alrededor de 0.15%), disminuye la resistencia a la
picadura, especialmente en agua de mar. Los elevados contenidos de cobre favorecen la
corrosión intergranular y la corrosión bajo tensión. En la aleación Al-Li los iones Cu2+
son los activadores de corrosión más agresivos en solución de HCl a pH 2.0, seguido por
el ión Li+ [63].
Cromo: cuando es añadido a las aleaciones aluminio-magnesio o aluminio-magnesiozinc en proporciones entre 0.1 a 0.3% tiene un efecto benéfico sobre la resistencia a la
corrosión. El cromo mejora la resistencia a la corrosión bajo tensión en aleaciones
altamente deformadas, pero en el aluminio de alta pureza incrementa el potencial de
picadura en presencia de agua.
Hierro: aunque no es añadido intencionalmente en las aleaciones, es el principal
causante de corrosión por picadura en las aleaciones de aluminio. Su efecto puede ser
mitigado adicionando otros elementos.
Manganeso: Posee una limitada solubilidad sólida en el aluminio pero en
concentraciones de alrededor 1% forman series importantes de aleación de conformado
no tratables térmicamente (3xxx). Se emplea ampliamente como aditivo suplementario
tanto en aleaciones tratadas y no tratadas térmicamente y proporciona un importante
fortalecimiento. En las aleaciones binarias Al-Mn se forma la fase MnAl6, la cual
presenta un potencial de electrodo similar al aluminio puro. Debido a esto, el MnAl6
tiene poco o ningún efecto sobre la corrosión del aluminio en la mayoría de los
41
Marco Teórico
ambientes y puede ser beneficioso en las aleaciones de aluminio porque tiende a
combinarse con fases electronegativas como FeAl3 para formar (Mn,Fe)Al6, que
presenta un potencial de electrodo similar al aluminio [6].
Magnesio: las aleaciones magnesio-silicio ofrecen excelente resistencia a la corrosión
acuosa mientras que en las aleaciones de las series 2xxx y 7xxx hace que éstas sean
menos resistentes. En superficies deformadas de aluminio Al-0.2% Mg se observa la
presencia de cationes magnesio sobre la película de óxido e impurezas de cobre en la
interfase aleación/película. La posición de estos elementos define los sitios catódicos en
la aleación con disolución de la matriz adyacente [64].
Silicio: en pequeñas cantidades (0.1%) tiene poco efecto sobre la corrosión por picadura
mientras que en mayores cantidades reduce la resistencia a la corrosión. Es
frecuentemente catódico y puede promover corrosión intergranular en la serie 6xxx
debido a que el exceso de Si requerido para formar la fase Mg2Si, se distribuye
selectivamente en los límites de granos [40].
Zinc: permite reducir la resistencia del aluminio en medio ácido y mejora la resistencia
en soluciones alcalinas. Las aleaciones con alto contenido de zinc pueden ser
susceptibles a corrosión intergranular, bajo tensión y exfoliación.
2.10.3. Efecto general de las trazas e impurezas sobre la corrosión en AA
El efecto de las trazas e impurezas de los elementos aleantes en el aluminio son
igualmente importante en el comportamiento de la corrosión. De acuerdo con Khedr et
42
Marco Teórico
al. [65] el porcentaje de la concentración de cationes pesados y de transición (K+, Mg2+,
Ba2+, Cu2+, Zn2+, Hg2+, Cd2+, Co2+, Ni2+ y Fe3+) influyen en el comportamiento del
aluminio frente a la corrosión generalizada y por picadura en medios ácidos y neutros.
Bajas concentraciones de cationes ayudan a inhibir la corrosión, en caso contrario se
acelera la velocidad de corrosión.
Introduciendo
impurezas
de
indio/plomo
en
el
aluminio
o
depositándolas
intencionalmente sobre la superficie a través de un proceso reducción-inmersión en
soluciones de In(NO3) y Pb(NO3)2, respectivamente, se puede mejorar, en cierto modo,
el ataque electroquímico utilizado para incrementar el área de la superficie del electrodo
de aluminio en la fabricación de capacitores [66-68].
Según Gundersen et al. [69-70], los tratamientos térmicos a altas temperaturas hacen que
las aleaciones binarias Al-Pb y Al-Bi sean electroquímicamente más activas que las
aleaciones Al-In, Al-Sn en presencia de iones cloruros. La activación de la aleación AlPb la atribuyen al enriquecimiento de Pb presente en el material en trazas, en la interfase
oxido-metal por segregación y difusión a lo largo de los límites de grano durante el
tratamiento térmico. Este comportamiento sugiere que el Pb puede causar repasivación
y proteger la superficie contra la corrosión por picadura.
2.10.4. Efecto general de los intermetálicos sobre la corrosión en AA
Los elementos aleante como el silicio, hierro, manganeso, cromo, zirconio, vanadio,
titanio y níquel están presentes en concentraciones bajas en el aluminio, y forman
compuestos intermetálicos dispersos en la matriz. El efecto de estos intermetálicos sobre
43
Marco Teórico
la resistencia a la corrosión del aluminio en diferentes medios ha sido atribuido a la
diferencia de potencial entre las partículas y la matriz en solución. Las fases, las cuales
son electroquímicamente más nobles que la matriz, juegan el papel de cátodos mientras
que la matriz experimenta disolución anódica. Este tipo de ataque conduce a la
formación de numerosas picaduras hemisféricas, las cuales cubren totalmente el área de
la superficie expuesta en prolongados periodos de exposición [9].
La Figura 2.5, esquematiza la corrosión por picadura por efecto de las partículas
intermetálicas en el aluminio [71]. En ella se observa un proceso microgalvánico entre
las fases y la matriz en presencia de iones cloruros. Este mecanismo involucra la
propagación de las picaduras de acuerdo a las siguientes reacciones:
Figura 2.5: Esquema del mecanismo de la corrosión por picadura por efecto
de las partículas intermetálicas en el aluminio.
44
Marco Teórico
Al → Al +3 + 3e −
(20)
Al +3 + 3H 2 O → Al (OH )3 + 3H +
(21)
Mientras que en los cátodos intermetálicos ocurre la evolución del hidrógeno y la
reducción del oxígeno expresadas de la siguiente manera:
2H + + 2e − → H 2
(22)
O 2 + 2H 2 O + 4e − → 4OH −
(23)
Estas reacciones de reducción producen alcalinización local alrededor de la partícula
catódica, promoviendo que el aluminio que rodea las partículas se disuelva, así como el
componente activo de aluminio que contienen las partículas.
Algunos ejemplos de intermetálicos que participan en el proceso de corrosión se
presentan a continuación:
En las aleaciones de aluminio de la serie 6XXX las partículas intermetálicas gruesas
enriquecidas con Si (Al-Si-Mg) favorecen la corrosión por picadura en solución de 1M
NaCl y consecuentemente la corrosión intergranular [40].
En las aleaciones Al-Fe expuestas en soluciones concentradas de NaCl (>3.0 M NaCl)
los compuestos intermetálicos Al3Fe proporcionan sitios catódicos en los que ocurren
reacciones de reducción del oxígeno. En soluciones de NaCl (< 0.1 M NaCl) el hierro de
45
Marco Teórico
los intermetálicos se disuelve en iones ferrosos, los cuales se depositan como hierro
metálico dentro de las cavidades de las picaduras promoviendo sitios catódicos efectivos
en donde ocurre reacción de evolución del hidrógeno. Los iones ferrosos fuera de las
cavidades se oxidan en hidróxido ferroso y finalmente en hidróxido férrico [8,72].
En las aleaciones de aluminio de la serie 2XXX los precipitados Al2CuMg y los
enriquecidos con Al-Cu-Mn-Fe promueven corrosión por picadura e intergranular
[9,15]. Buchheit et al. [18], determinaron la composición química de las partículas
presentes en la aleación 2024-T3 y estudiaron su comportamiento en solución 0.1 M
NaCl, encontrando que aproximadamente un 60% de las partículas presentes fueron
Al2CuMg (fase S). Partículas como Al (Cu,Fe,Mn), AlCuFe y (AlCu)Mn se encontraron
en menores porcentajes. La fase S resultó más activa que la matriz, propiciando
picaduras en el sitio en el cual estaban presentes. Otros trabajos confirmaron estos
resultados, resaltando que las fases Al-Cu-Fe-Mn son más nobles con respecto a la
matriz y podrían actuar como cátodos, mientras que las inclusiones Al2CuMg pueden ser
más activas que la matriz y comportarse como sitios de iniciación preferenciales a la
corrosión localizada [20].
En la elaboración de litografías el aluminio es utilizado para producir superficies picadas
uniformemente, las cuales se consiguen aplicando voltaje o corriente a la aleación
sumergida en ácido nítrico o hidroclorhídrico. En este proceso la densidad de partículas
interviene en el inicio de la transformación de la matriz [73-74]. Normalmente se
utilizan las aleaciones aluminio 1050 y 3100 para esta aplicación, en las cuales las
superficies con una baja densidad de población de partículas promueven una rápida
46
Marco Teórico
transformación de la matriz, en cambio el tamaño de las partículas influye directamente
sobre la topografía final de la superficie. Grandes partículas intermetálicas AlFe3 y
AlxFeMn aumentan la profundidad de las picaduras mientras que partículas de menor
tamaño enriquecidas con Si producen una superficie con acabado uniforme [75]. Es
claro, que el tamaño, composición y densidad de población de partículas de segunda fase
influyen en la velocidad de disolución de la aleación.
De acuerdo con Aballe et al. [16], el comportamiento de la corrosión en la aleación
AA5083 en solución de NaCl es controlada por la densidad de precipitados catódicos
Al(Mn,Fe,Cr) presentes en la matriz.
En las aleaciones de la serie del tipo 1050 y 3103 las partículas con o sin silicio
determinan la velocidad de disolución de la aleación en solución de hidróxido de sodio.
Superficies con una alta población de fases enriquecidas con silicio {Al12FeSi,
Al15(FeMn)3Si2} incrementan el porcentaje de evolución del hidrógeno ocasionando un
incremento en la velocidad de disolución de la aleación durante un ataque prolongado.
Las partículas libres de silicio {Al3Fe, Al6(FeMn)} afectan en un menor grado la
disolución de la matriz [19].
El rol del Mn en el comportamiento a la corrosión en las aleaciones Al-Mn ha sido
interpretado por Zamin [1], en base a la disminución de la diferencia de potencial
electroquímico entre la matriz y los intermetálicos que se forman en este tipo de
aleaciones, (Al6(Fe,Mn) y α-Al(Fe,Mn)Si.). Este investigador ha propuesto que esta
disminución de potencial podría conseguirse incrementando el contenido de Mn en
47
Marco Teórico
solución y/o incrementando la concentración de Mn (esencialmente la razón Mn/Fe) en
los intermetálicos. El primer efecto ajusta el potencial de la matriz en la dirección
catódica mientras que el incremento de Mn en los precipitados de segunda fase (los
cuales son más nobles que la matriz y podrían actuar como cátodos) tiende ajustar su
potencial en la dirección anódica. Debido a que el ajuste de potencial como resultado de
retener Mn en solución es significativamente menor al obtenido por enriquecimiento de
Mn en los intermetálicos, cualquier proceso (como velocidades lentas de enfriamiento
durante la solidificación, laminación a altas temperaturas, recocido, homogeneizado,
entre otros) que puedan incrementar el contenido de Mn en los intermetálicos, mejoraría
efectivamente las propiedades de corrosión en la aleación.
En general, el comportamiento de los intermetálicos frente a la corrosión en AA depende
principalmente de la diferencia de potencial entre las partículas y la matriz en solución.
Las fases que son electroquímicamente más nobles que la matriz, juegan el rol de
cátodos mientras que la matriz experimenta disolución anódica.
2.10.4.1.
Formas en las cuales los intermetálicos participan en el proceso de
corrosión en AA
Ives [76], ha clasificado las distintas formas en las cuales una inclusión puede iniciar
ataque localizado en los aceros, las cuales se encuentran representadas en la Figura 2.6.
En el Tipo I el ataque ocurre cuando la inclusión es soluble y la matriz no es reactiva o
está protegida. El Tipo II solamente cierta(s) fase(s) son solubles y se disuelven
preferencialmente. Ambos tipos I y II representan situaciones donde toda o parte de las
inclusiones están actuando anódicamente con respecto a la matriz. En el Tipo III ocurre
48
Marco Teórico
disolución preferencial de la matriz en la vecindad de la inclusión, y finalmente en el
Tipo IV ocurre desprendimiento en la interfase entre la matriz y la inclusión.
Mecanismos de corrosión semejantes a los anteriores también se manifiestan en las
aleaciones comerciales de aluminio. El comportamiento de los compuestos
intermetálicos Al3Fe presentes en la aleación Al-Fe sirven de ejemplo del Tipo I. La
Figura 2.7.a muestra la superficie de la aleación antes de la prueba de corrosión
constituida de intermetálicos dispersos de Al3Fe alargados y rectangulares. Después de
10 min de inmersión en una solución de AlCl3 la forma redonda de las partículas sugiere
disolución de las mismas (Figura 2.7.b). Después de 200 min de exposición (Figura 2.7.
c) se observa una disolución completa de un gran número de intermetálicos [72].
La disolución preferencial de ciertas fases (Tipo II) ocurre en la aleación de aluminio
6056 en solución 0.1 M Na2SO4 donde las partículas enriquecidas con Al-Mg-Si, el Al y
el Mg se disuelve antes que el Si. Figura 2.8 [77].
El ataque preferencial de la matriz alrededor de las inclusiones (Tipo III) se presenta en
la aleación 2024, en este caso, la picadura comienza en la interfase del intermetálico AlCu-Fe-Mn y luego se propaga desde la partícula hacia la matriz (Figura 2.9) [78].
La aleación 2024-T3 también sirve de ejemplo del Tipo IV, donde ocurre disolución
preferencial en el borde de la fase Al2CuMg después de exponer la aleación en una
solución de NaCl de pH 4 (Figura 2.10) [18].
49
Marco Teórico
Fenómeno
Figura 2.6: Esquema de la clasificación de la nucleación de picaduras en
inclusiones para los aceros. [76]
50
Marco Teórico
Figura 2.7: Micrografías por MEB mostrando la superficie de la aleación
Al-Fe antes y después de la prueba de corrosión. [72]
Figura 2.8: Micrografía por MEB de la partícula intermetálica Mg-Si en
una picadura en la AA 6056-T6. [77]
51
Marco Teórico
Fig. 2.9: Micrografía por MEB de la partícula intermetálica
Al- Cu-Fe-Mn en la corrosión por picadura de la AA 2024.
[78]
Fig. 2.10: Micrografía por MEB de la fase Al2CuMg de la
AA 2024-T3. [18]
52
Marco Teórico
2.10.5.
Efecto de los tratamientos térmicos de relajación sobre el proceso de
corrosión en AA
Las propiedades de corrosión están estrechamente relacionadas con el proceso
metalúrgico y con la aplicación de tratamientos térmicos utilizados para transformar la
estructura del material. La mayoría de los tratamientos térmicos afectan fuertemente la
química local del material y por consiguiente pueden afectar también la resistencia a la
corrosión de las aleaciones comerciales ferrosas [79-80] y no ferrosas [81-82]. Dentro de
estos tratamientos para las AA tenemos, entre otros, el tratamiento térmico de solución,
el envejecimiento artificial y el recocido [6].
El tratamiento térmico de solución consiste en calentar la aleación de aluminio a una
temperatura adecuada para producir que uno o más de los constituyentes entren en
solución sólida, excepto cuando éstos exceden los límites de solubilidad o cuando los
elementos son conocidos a no disolver a elevadas temperaturas de solución; luego se
enfrían lo suficientemente rápido de manera de mantener los elementos en solución [83].
Sin embargo, el enfriamiento rápido no se obtiene frecuentemente, debido a las
limitaciones físicas del enfriamiento y/o a la necesidad de enfriar lentamente para
reducir el esfuerzo residual y la distorsión. Tanto el tiempo como el control de la
temperatura son parte importante del tratamiento de solución. Durante el calentamiento
la aleación debe aproximarse, al punto de fusión, sin alcanzarlo, para evitar la
posibilidad de una fusión localizada [84].
Una de las características más importantes del tratamiento térmico de solución es que
puede incrementar notoriamente el esfuerzo debido al fenómeno de endurecimiento por
53
Marco Teórico
precipitación o endurecimiento por envejecimiento. En algunas aleaciones de aluminio
el envejecimiento comienza casi inmediatamente después que éstas son enfriadas, al
cabo de unos pocos días las aleaciones son considerablemente más fuertes. Este tipo de
tratamiento se conoce como envejecimiento natural. Cuando se induce calentando a
elevadas temperaturas se le conoce como envejecimiento artificial. En ambos procesos
ocurren cambios similares en la estructura del metal; los elementos constituyentes
comienzan a formar precipitados submicroscopicos desde la matriz en la cual se
encuentran disueltos, distribuyéndose a lo largo de la estructura granular del material
[85]. El tamaño y morfología de estos precipitados dependen de la temperatura del
envejecimiento, tiempo y ruta del procesamiento específico. Además de su efecto sobre
las propiedades mecánicas y como hemos visto anteriormente, en ambientes agresivos
estas pequeñas partículas pueden actuar como cátodos o construir una barrera efectiva a
la corrosión. Como en la aleación 6056 T6 (tratada por solución y luego envejecida
artificialmente, sin trabajo en frío) donde las partículas finas que precipitan en los
límites de grano debido al tratamiento térmico actúan como cátodos en comparación con
el resto del cuerpo del límite del grano, estimulando el ataque por picadura. Estas
picaduras a su vez ayudan a desarrollar la corrosión intergranular, ya que ésta nuclea
sobre las paredes de las picadura [10].
Por otra parte, los tratamientos térmicos de precipitación también pueden inhibir o
disminuir la formación de ciertas fases que pudieran ser más reactivas en ambientes
electroquímicos o pueden favorecer la formación al azar de precipitados incoherentes en
54
Marco Teórico
la matriz disminuyendo el efecto adverso de precipitación altamente localizada en los
límites de grano [6].
En general, los tratamientos térmicos de solución se aplican con el fin de mejorar la
resistencia a las distintas formas de corrosión a las que son susceptibles las aleaciones
endurecidas por precipitación [6].
En cuanto a los recocidos es conocido que el recocido de homogeneización elimina o
reduce las heterogeneidades químicas en las aleaciones de conformado y fundición
como resultado del rápido enfriamiento de la solidificación [86-87]. La homogeneidad
química se consigue por difusión, es decir, por el movimiento de átomos en estado
sólido y la velocidad de cambios estructurales es normalmente controlada por la razón a
la cual los átomos en la red cambian de posición [28]. Para obtener la velocidad máxima
de difusión se utilizan temperaturas lo más cercanas posibles al punto de fusión. De
manera que el tiempo de homogeneización puede variar desde pocos minutos hasta
varios días, dependiendo del material y de la inhomogeneidad de la estructura, así como
del factor económico involucrado
En algunas aleaciones de conformado de aluminio este tratamiento de homogeneización
conduce a transformaciones de las fases intermetálicas que se han formado alrededor de
celdas de aluminio durante la solidificación [88-89]. Como es el caso de las aleaciones
1XXX y 3XXX donde ocurre la transformación de la fase ortorrómbica Al6(Fe,Mn) a la
fase cúbica α-Al(Fe,Mn)Si a una temperatura de homogeneización de 500-600 °C. Esta
transición requiere de la difusión de Si y Mn desde la matriz a la fase Al6(Fe,Mn). La
55
Marco Teórico
velocidad a la que ocurre esta transformación depende de la tasa de difusión de estos
elementos. El Mn difunde lentamente en ambas fases debido a su bajo coeficiente de
difusión (1x10-16 m2/seg) en comparación al del Si (1.4x10-13 m2/seg). Durante el
tratamiento térmico la difusión del Mn puede cambiar la estequeometría de la fase-α, es
decir, puede variar la razón Fe/Mn, o puede aumentar el tamaño de las partículas, auque
esta última tendencia aun no ha sido confirmada [36].
Estas partículas α tienden a incrementar la frecuencia de las picaduras pero tienen poco
efecto sobre la profundidad de las mismas [40]. En aleaciones de Al-Mn obtenidas con
diferentes contenidos de Fe y Mn, es decir, de diferentes relaciones Fe/Mn se observa
una tendencia general de la profundidad de las picaduras a disminuir con el incremento
de la razón Fe/Mn [1].
Por otra parte, en las aleaciones trabajadas en frío, el recocido ayuda a liberar las
tensiones internas acumuladas a causa de la deformación; el estado deformado es
transformado a un estado de baja energía. Para realizar este recocido, denominado
también recuperación o relajamiento, se escoge la temperatura y duración de tal modo
que no se produzca una modificación de estructura, es decir, la recuperación se realiza a
temperaturas inferiores al límite de recristalización. La temperatura a elegir dependerá
del material y de las condiciones de elaboración [90].
Cortos tiempos de recocido o bajas temperaturas producen cambios estructurales más o
menos simultáneos a través de la matriz sin la formación y crecimiento de nuevas fases,
la densidad de dislocaciones disminuye y se libera energía almacenada. En esta etapa la
56
Marco Teórico
dureza permanece constante o se incrementa levemente [91]. De este modo, el recocido
en metales deformados en frío puede resultar en una disminución en las dislocaciones y
pudiera resultar también en una importante mejoría en la resistencia a la corrosión.
Recocidos a periodos de tiempo mayores o altas temperaturas hacen que la estructura
experimente cambios más radicales, produciéndose recristalización, y el crecimiento de
nuevos granos a expensas de la matriz deformada y recuperada. Durante este periodo la
dureza y el esfuerzo disminuyen drásticamente [91]. Ambas condiciones pueden mejorar
el nivel de la deformación acumulada. Sin embargo, pueden aumentar o disminuir la
susceptibilidad del material a la corrosión. Como en el caso de la aleación Al-1.5%Li0.1%Zr donde los cambios microestructurales introducidos por el recocido a la
temperatura de 180 °C durante 6 horas producen una disminución en la tasa de corrosión
mientras que recocidos a mayores periodos de tiempo provocan un efecto contrario [22].
En otras aleaciones, como la aleación 3005 los tratamientos térmicos a temperaturas
superiores de 350ºC durante 2 horas reducen severamente la resistencia a la corrosión
filiforme, mientras que en la aleación 5754 las propiedades de corrosión se ven afectadas
moderadamente [23,92-93].
2.10.6. Efecto del trabajo en frío sobre el proceso de corrosión en AA
Cuando un metal o aleación es deformado por trabajo en frío, la dureza y el esfuerzo
incrementan pero la capacidad de seguirse deformando disminuye. Este proceso influye
considerablemente en la estructura del material. La morfología del grano y la
distribución de las partículas varían apreciablemente [30,94]. A medida que aumenta la
deformación acumulada los granos se hacen progresivamente más elongados y altamente
57
Marco Teórico
distorsionados, tiene lugar la subdivisión de los granos [95-97] y se producen numerosas
bandas de deformación, las cuales ocurren a una gran variedad de ángulos, entre 20 y
40º, con respecto al plano de laminación, siendo el valor promedio de aproximadamente
35º [98-102].
A escala microscópica un gran número de inhomogeneidades caracterizan el estado
deformado, por ejemplo, enmarañamiento de dislocaciones las cuales evolucionan a
estructuras consistentes de celdas y subgranos a medida que aumenta la deformación,
formación de paredes densas de dislocaciones, microbandas, bandas en transición,
bandas de deformación y bloques de celdas [103].
Tanto las zonas deformadas producidas por el enmarañamiento de las dislocaciones
como la alta direccionalidad en la estructura granular pueden presentar reactividades
electroquímicas diferentes en ambientes agresivos trayendo como consecuencia una
disminución en las propiedades de corrosión de la aleación [21].
Por ejemplo, en las AA de elevada dureza (series 2xxx y 7xxx) altamente deformadas, la
direccionalidad del grano afecta la resistencia a la corrosión bajo tensión y exfoliación.
Esta dependencia ha sido interpretada por Shantanu [104] en base a dos factores. El
primer factor está relacionado al esfuerzo localizado creado por apilamiento de
dislocaciones en los límites de los granos. El segundo es referido a la magnitud de la
componente normal del esfuerzo aplicado en las fronteras de granos. Como es el caso de
las aleaciones de aluminio con apropiado temple donde la susceptibilidad a la corrosión
bajo tensión es máxima en muestras deformadas en la dirección transversal y mínima en
58
Marco Teórico
aquellas deformadas en la dirección longitudinal. Un comportamiento similar se observa
en muestras de aluminio AA2024-T3 donde la cinética de crecimiento de corrosión
localizada también resulta ser mucho menor en la dirección transversal corta. Aunque, el
potencial de picadura resulta prácticamente independiente de la orientación de la
dirección de la laminación [105]. Así, la dirección y magnitud del esfuerzo anticipado
bajo condiciones de servicio ayudan a seleccionar la aleación y los temples adecuados.
Muchos de los factores que contribuyen a la pérdida de la resistencia a la corrosión
filiforme en las aleaciones de aluminio están relacionados con la micro capa deformada
de ∼ 1 µm que se forma en la superficie del material durante el proceso de laminación.
En ambientes corrosivos esta capa se corroe preferencialmente comparada con el resto
del material, produciendo un ataque superficial rápido y una disminución a la resistencia
a la corrosión filiforme [92,106-107].
2.10.7. Medio ambiente salino: Agua de mar
La influencia del medio sobre el comportamiento de la corrosión del aluminio y sus
aleaciones constituye un factor importante debido a que muchas de las aplicaciones en
las cuales el aluminio es utilizado dependen de su buena resistencia a la corrosión.
Ambientes agresivos incluyen condiciones marina y atmósferas industriales,
particularmente las que contienen altas concentraciones de gases ácidos como el dióxido
de sulfuro [45].
El agua de mar es, por lo general, mucho más corrosiva que las aguas naturales o
“dulces” debido a que es un electrolito fuerte que contiene una concentración de sales
59
Marco Teórico
del orden de 30 a 35 g/l, una alta conductividad específica entre 2 y 3x10-2 Ω-1 cm-1 y su
pH oscila entre 7 y 8. La mayor parte de este contenido salino está constituido por
cloruros, siendo los de sodio (NaCl) y magnesio (MgCl2) los predominantes. Además, se
encuentran sulfatos, bicarbonatos, gases disueltos, de los cuales 5 a 6 ppm son de
oxígeno, materias orgánicas vivientes y material orgánico en descomposición [7].
Todas las formas de corrosión son posibles en el agua de mar, por la fuerte agresividad
de este medio rico en cloruros, y por la elevada conductividad eléctrica del mar, que
hace fáciles la mayoría de las reacciones electroquímicas. En el aluminio y sus
aleaciones la forma de corrosión más frecuente en este medio es la corrosión por
picadura, en la zona de los pH sensibles a esta forma de corrosión.
El comportamiento de las aleaciones de aluminio en agua de mar profunda es
generalmente la misma que en la superficie excepto que a mayor profundidad la taza de
penetración de la picadura y la velocidad de corrosión son más altas, lo cual se debe a la
combinación de bajo pH y baja temperatura [108-109].
En el caso de estructuras expuestas a la atmósfera marina, como estructuras metálicas
empotradas dentro de un buque o instaladas fuera del mar, el material está expuesto a los
vientos marinos más o menos cargados de sal, a la fuerte humedad marina y a los
emolientes eventuales que pudieran desarrollarse sobre el metal. Estudios realizados en
estos medios han determinado que la velocidad de corrosión por picadura disminuye
rápidamente al igual que en presencia de atmósferas industriales, urbanas y rurales [38].
60
Marco Teórico
Cuando la estructura metálica está parcialmente sumergida se presenta un fenómeno
aparentemente contradictorio, pues el ataque mayor se presenta alrededor de la
superficie del agua, y a profundidades mayores no se observa prácticamente ningún
ataque.
61
CAPÍTULO 3
TÉCNICAS DE CARACTERIZACIÓN
3.1. Pruebas de corrosión acelerada: atomización salina (Salt spray- ASTM B117)
Mediante estas pruebas, generalmente, estandarizadas [American Society for Testing of
Materials (ASTM), International Standards Organization (ISO)] se determina la
susceptibilidad de los materiales y aleaciones a formas específicas de corrosión como
picadura, intergranular, filiforme y bajo tensión. Por otra parte, estas pruebas pueden ser
realizadas en el laboratorio, en plantas piloto o exclusivamente en planta. En las dos
primeras
modalidades
las
variables
pueden
ser
controladas
o
modificadas
deliberadamente, mientras que las pruebas en planta son realizadas bajo condiciones de
operaciones reales y pueden evaluar más certeramente el material para aplicaciones
específicas [39].
Las pruebas de laboratorio pueden ser subdivididas en: (i) Pruebas de corto tiempo sin
aceleración, en las cuales las condiciones de servicio en planta son simuladas en un
pequeño aparato modelo y (ii) Pruebas aceleradas de corto tiempo, donde uno o mas
factores son intensificados de manera que los procesos de corrosión tomen lugar
Técnicas de Caracterización
rápidamente, es decir, los resultados pueden ser obtenidos en semanas, días, horas o
minutos.
Normalmente no es posible, sobre las bases de estas pruebas aceleradas de corto tiempo,
hacer una predicción con respecto a la vida útil del material o recubrimiento, pero
pueden ser capaces de predecir la eficiencia de un metal particular, cómo este reacciona
bajo un conjunto de condiciones dadas y cómo su eficiencia puede ser mejorada.
Uno de los tipos de ambiente más comunes en las pruebas de corrosión aceleradas es la
atomización salina (dispersed fog spray). En este ambiente, en algunos casos, las
muestras son expuestas a una atomización continua; en otros, la atomización se hace de
manera intermitentemente. Las variaciones principales de esta prueba son la
composición del líquido para hacer la atomización y la temperatura. Algunas pruebas se
realizan a temperatura ambiente pero la mayoría de las veces se trabaja entre 90-120 ºF
(35-50°C) [110].
Las soluciones mas comúnmente utilizadas son:
o Agua pura
o 3 ½ , 5 y 20% NaCl
o Soluciones de NaCl adicidificadas a un pH especifico.
Básicamente, la prueba involucra atomizar una solución salina, típicamente al 5%, sobre
las muestras a ser probadas dentro de un gabinete bajo temperatura constante. En las
pruebas continuas las muestras están constantemente húmedas, y así, constantemente
63
Técnicas de Caracterización
sujetas a corrosión. La duración puede ser de 24 a 1000 horas o mayores en algunos
casos.
El propósito de la prueba es duplicar, en el laboratorio, el comportamiento de la
corrosión de un producto en el campo. Esto ha permitido desarrollar nuevos productos
en una manera rápida, de hecho hoy en día se requiere que el producto especifique el
número de horas de falla en la prueba de atomización salina [111].
Se utilizan ampliamente en la industria automotriz para evaluar el comportamiento a la
corrosión de los intercambiadores de calor de aluminio, como por ejemplo, radiadores,
evaporadores y condensadores en ambientes agresivos [112]. Sin embargo, su uso
principal es comparar la resistencia a la corrosión de muestras pintadas o protegidas por
recubrimientos metálicos. Esto significa que es una buena forma de comparar cambios
en sistemas recubiertos ya existentes variando algunos parámetros como la secuencia del
proceso del recubrimiento, el sellador, el espesor del recubrimiento, etc. A su vez
permite evaluar la uniformidad del espesor y el grado de porosidad de los recubrimientos
metálicos y no metálicos [111].
Sin embargo, esta prueba no es capaz de correlacionar cuantitativamente las horas de
exposición con el tiempo de exposición atmosférica sino que solamente permite
pronosticar resultados en el mundo real o dar una indicación de la tasa de corrosión en
una solución de NaCl al 5% o alguna forma de corrosión general. Por otra parte, es
importante conocer que ambiente se quiere intentar comparar con esta prueba.
64
Técnicas de Caracterización
Naturalmente, 100 horas en la atomización salina puede resultar 15 años en el desierto
[110].
Las cámaras salinas consisten básicamente de un gabinete, un tanque para la solución
salina, boquillas para la atomización, humidificador, soportes para colocar las probetas
y adecuados controles para mantener la temperatura deseada, entre otros. El esquema de
una cámara salina se muestra en la Figura 3.1. Para llevar a cabo un ensayo continuo se
coloca la solución salina en el reservorio, la temperatura del humidificador (por ej. 70
ºC), la temperatura a la cual se realizará el ensayo (por ej. 35 ºC), la duración del ensayo
y la presión de la atomización (1 bar), de acuerdo con los requerimientos de presión y
temperatura establecidos en la norma ASTM B117. El gabinete permanece cerrado salvo
los breves periodos de tiempos necesarios para la inspección y remoción de probetas.
65
Técnicas de Caracterización
1 Bóveda, operada hidráulicamente
7 Tanque para la solución
2 Portamuestras para sujetar las probetas
8 Válvula de agua
3 Ducto para la neblina
9 Válvula de aire
4 Boquilla para la atomización
10 Válvula de aire
5 Sensor de temperatura
11 Humidificador
6 Válvula de ventilación
12 Panel de control
Figura 3.1: Esquema de la Cámara Salina
66
Técnicas de Caracterización
3.2. Interferometría Óptica
Uno de los métodos ópticos de no contacto, como la interferometría de superficie de
barrido, ha sido desarrollado para inspeccionar sin distorsión y daño en el modo semi o
automático, superficies aparentemente planas. Esta técnica proporciona un modo fácil y
eficiente para caracterizar directamente la superficie en estudio. Así mismo posee la
capacidad de observar largas áreas del material. Se utiliza en tribología, en el análisis de
textura, en estudios de recubrimientos por termorociado, para la realización de perfiles
de profundidad y evaluación de fenómenos de corrosión, entre otros [17,113-114].
El esquema de un perfilómetro de superficie se muestra en la Figura 3.2. El principio de
esta técnica se basa en que el haz que emerge de la fuente de luz visible se divide en dos,
uno se dirige hacia la superficie de referencia interna (perfectamente plana) y el otro
hacia la muestra en estudio. Después de la reflexión los dos haces se recombinan dentro
del interferómetro produciendo el fenómeno de interferencia constructiva y destructiva,
el cual genera un patrón de franjas brillantes y oscuras, que dan cuenta de una imagen
punto a punto de la muestra. La intensidad de luz de cada punto depende de la diferencia
de trayectoria entre los dos haces. El patrón es registrado digitalmente por un arreglo de
fotodiodos conectados a un microprocesador. Pequeños desplazamientos de la superficie
de referencia producen cambios en el patrón de franjas lo que hace posible registrar y
computarizar la variación de las diferentes alturas presentes en la superficie. Los
interferogramas almacenados en el computador, son individualmente procesados para
obtener los perfiles de la superficie a través de un software basado en una eficiente
67
Técnicas de Caracterización
implementación computarizada de la transformada de Fourier, y es capaz de desarrollar
altas velocidades de análisis [115].
Un perfilómetro de este tipo incluye una platina de traslación horizontal en dos
dimensiones (x,y), sobre la cual el objeto a ser inspeccionado es colocado con la cara de
la superficie de interés hacia el cabezal óptico estacionario. Este cabezal contiene un
diodo láser que produce un haz de luz y lo proyecta perpendicular a la superficie bajo
estudio. La altura del cabezal se coloca a una distancia vertical nominal de 0.25 in (6.35
mm) por arriba de la superficie en los perfilómetros prototipo [116]. Cuando la distancia
vertical entre el cabezal óptico y la superficie se iguala a la distancia nominal, el punto
de luz formado sobre la superficie por el haz se encuentra a una posición horizontal
nominal. En caso contrario el punto de luz se forma a una posición horizontal diferente.
Bajo control del computador, el cabezal óptico repasa la superficie de interés y por cada
incremento de la posición horizontal (x,y), el cabezal genera una fotocorriente indicando
la desviación local de la superficie desde la distancia vertical nominal. Este mecanismo
permite generar un gran número de perfiles transversales del área analizada y crear
mapas en 3D de la misma, así como se muestra en la Figura 3.3. Una resolución vertical
de 0.1 nm puede ser alcanzada con este tipo de instrumento. Sin embargo, la máxima
altura medible esta limitada a pocos micrones por la profundidad de foco.
Existen una gran variedad de parámetros que permiten describir la textura del material,
tales como: de altura, de longitud de onda, de forma y combinación de ellos, conocidos
como parámetros híbridos. Los parámetros de altura son ampliamente utilizados, entre
ellos se encuentran el promedio de la rugosidad (Ra) y la rugosidad (Rms) los cuales
68
Técnicas de Caracterización
estiman la altura promedio y la profundidad en los perfiles de superficie. Los parámetros
de longitud de onda son utilizados para caracterizar el espaciamiento de los picos y
valles de la superficie y los parámetros híbridos consideran las desviaciones de la altura
y desplazamientos laterales en los perfiles [117]. Por lo tanto, es posible optimizar la
eficiencia de las superficies ingenieriles combinando las especificaciones de los
parámetros de superficie, el material y el proceso de manufactura.
CCD Cámara
Fuente de Luz
Figura 3.2: Diagrama esquemático del interferómetro Óptico
69
Técnicas de Caracterización
Figura 3.3: Perfiles en 3D generados por el software del Interferómetro Óptico
3.3. Análisis de Imagen
El análisis de imagen consiste en extraer datos morfológicos cuantitativos de una imagen
de una muestra pulida o sección de un material para caracterizar la estructura por medio
de valores numéricos. Toda la secuencia de operación y análisis de datos es controlada
por un computador y cada paso debe ser manejado correctamente para obtener
resultados exactos y reproducibles. La combinación del instrumento de imagen más el
analizador de imágenes es lo que se conoce como sistema de análisis de imagen.
La técnica de análisis de imagen posee varios campos de aplicación. En ciencia de los
materiales se utiliza para i) medir características microestructurales con el fin de evaluar
los procesos de producción, esto es, control de calidad, ii) cuantificar parámetros para
entender cómo los cambios en el proceso afectan a la microestructura, y iii) cuantificar
parámetros para relacionar la microestructura con las propiedades o comportamientos
[118]. El análisis involucra los siguientes pasos [119-121]:
70
Técnicas de Caracterización
•
Producir una imagen con un instrumento de imagen como microscopio
óptico, microscopio electrónico de barrido o microscopio electrónico de
transmisión.
•
Transferir la imagen a un analizador de imágenes vía interfase
•
Digitalizar la imagen
•
Procesar la imagen digitalizada y prepararla para las medidas
•
Medir los parámetros apropiados y
•
Resumir los datos y presentarlos en tablas simples y gráficos
La Figura 3.4 muestra un diagrama de flujo típico del proceso de análisis de imagen. El
objetivo del proceso de adquisición de la imagen es proporcionar una o varias imágenes
binarias, que luego son usadas como datos de entrada en el procedimiento de medición.
El modo primario de detección está basado sobre diferencias de niveles de gris, donde el
blanco y el negro son los extremos de la escala disponible.
Las medidas se efectúan en base al número y distribución de puntos de la imagen
detectada (píxeles) con respecto al la línea base y al número total de puntos en la
imagen. Por ejemplo, la fracción de área, AA, es simplemente la razón entre el número
de píxeles detectados en la imagen y el número total de píxeles en el campo medido, esto
es, el área de interés detectada dividida entre el área medida.
A su vez, existen relaciones estereológicas entre los valores promedios de las medidas
básicas en una o dos dimensiones realizadas sobre secciones del material y las medidas
correspondientes para la microestructura en dos o tres dimensiones como se resumen en
la Tabla 3.1. En el espacio bidimensional los parámetros básicos son: Área A(X),
71
Técnicas de Caracterización
Perímetro L(X) y Número de objetos N(X). Para estructuras en tres dimensiones, los
parámetros correspondientes son: Volumen V(X), Área S(X) y curvatura total M(X)
[122].
Las principales ventajas del sistema de análisis de imagen son: alta velocidad de análisis
a través de programas almacenados en el computador, capacidad para obtener datos
exactos, alta versatilidad y capacidad para reportar datos en tablas resumidas
apropiadamente.
Por otra parte, el proceso automatizado elimina la fatiga del operador, reduce el tiempo
del análisis, realiza medidas específicas que no pueden ser obtenidas por otros métodos
y puede ejecutar varias medidas sobre cada campo en milisegundos, proporcionando
una completa descripción de la microestructura.
Tabla 3.1: Relaciones estereológicas básicas utilizadas en el análisis de imágenes
estructuras en r3
medidas en secciones en 2-D
Estructuras en R2
VV
MV
VV = AA SV = (4/π) LA MV = 2π NA
AA
Medidas en secciones en 1-D AA = LL
Estructura en R
SV
LL
72
LA
LA = π NL
NL
NA
Técnicas de Caracterización
Imagen
Adquisición de la Imagen
Imagen en escala
de grises
Procesamiento
de la Imagen
Descriminación
Imagen Binaria
Diseños
Computarizados
Segmentación
Objetos
Graficos
Computarizados
Edición de la
Imagen
Selección
Medición
Datos
Análisis
Estadistico
Interpretación Estereologica
Estructura
Figura 3.4: Diagrama de flujo típico del proceso de análisis de imágenes
73
Técnicas de Caracterización
3.4. Microscopía Electrónica de Barrido
La microscopía electrónica de barrido - MEB es quizás la técnica analítica más utilizada
en la caracterización superficial de aleaciones comerciales, debido a que ofrece alta
resolución y facilidad de uso e interpretación de los datos. Por ejemplo, en el estudio de
las aleaciones clásicas la técnica es aplicable en la identificación de partículas de
segunda fase presentes en las aleaciones, en la determinación de parámetros de
composición (a través de detectores especiales), morfología, fracción volumétrica y su
tamaño.
En la microscopía electrónica analítica las señales se producen por la interacción del haz
de electrones con la superficie de la muestra. De dicha interacción se produce reflexión,
absorción y transmisión de electrones, así como emisión de rayos-X característicos de
los elementos que componen el material y emisión de luz visible como se ilustra en el
diagrama de la Figura 3.5 [123-125]. La mayoría de estas radiaciones pueden ser
recogidas por diferentes módulos para luego ser procesadas como señales de imágenes
en un microscopio analítico (Figura 3.6)
La MEB utiliza aquellas radiaciones que se producen en el volumen de interacción y que
luego son expulsadas de la superficie de la muestra, como los rayos-X característicos,
los electrones retrodispersados y los electrones secundarios. En el caso de que el haz de
electrones interactué con un electrón de la muestra, éste es expulsado con la misma
cantidad de energía cinética. Si éste electrón se encontraba enlazado débilmente emerge
de la superficie con una energía de solamente unos pocos electrón voltios (<50 eVs) y es
74
Técnicas de Caracterización
llamado “electrón secundario”. Debido a su poca energía, los electrones secundarios
pueden escapar de la muestra y ser detectados solamente si ellos son creados cerca de la
superficie. Su alta resolución espacial y su sensibilidad topográfica hacen que estos
electrones sean los frecuentemente escogidos para la captación de imágenes. Esta
imagen topográfica se utiliza para indagar acerca de la microestructura y morfología del
material a ser analizado.
Por el contrario, si el electrón primario interactúa con el núcleo de un átomo de la
muestra, éste puede ser dispersado en cualquier dirección con poca pérdida de energía y
algunos de ellos pueden emergen de la superficie, frecuentemente después de más de un
evento de dispersión, permitiendo que estos sean detectados. A estos electrones se les da
el nombre de “electrones primarios” o “electrones retrodispersados” (Backscattered
electrons – BSE). Los electrones retrodispersados son mucho más energéticos que los
electrones secundarios y pueden escapar de mayor profundidad dentro de la muestra. La
intensidad de la señal de BSE depende del número atómico de la muestra y del ángulo
entre el haz incidente y la superficie de la muestra. Por lo tanto, estos electrones llevan
cierta información acerca de la composición de la muestra. A si mismo, el excelente
contraste que produce esta señal permite ejecutar sobre las micrografías obtenidas un
análisis de imágenes, el cual puede se utilizado para cuantificar algunos aspectos de la
microestructura, como por ejemplo, obtener la distribución del tamaño de las partículas.
En términos generales, el MEB obtiene las imágenes estructurales de la siguiente
manera: Una pequeña sonda electrónica (~ 1µm de diámetro) es pasada repetida veces
sobre el área de la superficie de la muestra. Leves variaciones en la topografía de la
75
Técnicas de Caracterización
superficie produce marcadas variaciones en la intensidad del haz de electrones
secundarios que emerge de la superficie de la muestra. La señal del haz de electrones
secundarios es exhibida sobre una pantalla de televisión en modo de barrido, el cual está
sincronizado con el haz de electrones que barre la muestra.
La magnificación posible con el MEB está limitada por el tamaño de la punta del haz y
es considerablemente mucho mejor que la obtenida con el microscopio óptico pero
menor que las obtenidas por microscopia electrónica de transmisión.
Figura 3.5: Ilustración esquemática de las principales interacciones
del haz de electrones con la muestra
76
Técnicas de Caracterización
Figura 3.6: Diagrama esquemático representando el concepto de
microscopía electrónica analítica
77
Técnicas de Caracterización
3.5. Microscopía Electrónica de Transmisión
Al igual que la microscopía electrónica de barrido, la microscopía electrónica de
transmisión (MET) es una técnica analítica capaz de dar información estructural. La
información la proporcionan aquellos electrones que atraviesan una muestra sólida muy
delgada sobre la que se ha hecho incidir un haz electrónico coherente y a gran velocidad,
como se ilustra en la Figura 3.5.
La imagen obtenida en el MET es el resultado de un contraste de fase. La muestra es
orientada de manera que parte del haz que la atraviesa sea transmitido y parte sea
difractado. Cualquier variación local, producto de regularidades cristalinas, desviará
parte del haz que será difractado produciendo una variedad de imágenes oscuras que
adecuadamente interpretadas, revelarán las características morfológicas y estructurales
de la muestra en estudio [125].
Hoy en día se considera indispensable la microscopía electrónica de transmisión en el
estudio de estructuras de materiales tecnológicos. Por ejemplo, en los estudios de
microestructuras de cristales deformados, la MET se erige como una técnica
indispensable en el análisis debido a que es más apropiado discutir la microestructura en
términos de dislocaciones o estructuras de celdas. En la caracterización de precipitados,
por ejemplo, es posible obtener información directamente del tamaño y de la morfología
de los mismos.
Otro aspecto importante de la MET es que ésta proporciona información espectroscópica
y de difracción de las regiones que son examinadas. Con el uso de la espectroscopia de
78
Técnicas de Caracterización
energía dispersiva de rayos-X (energy dispersive spectroscopy - EDS) y la
espectroscopía de pérdida de energía de electrones (electron energy loss spectroscopy EELS) es posible obtener información cuantitativa o cualitativa de la composición para
todos aquellos elementos por arriba de Z=5. Así mismo, la microdifracción y la
difracción de haz convergente proveen un amplio rango de información estructural. La
completa determinación de la estructura cristalina (incluyendo grupo espacial,
parámetros de red y posiciones atómicas) puede ser encontrada por indexación de los
patrones de difracción de electrones y con ayuda de las tablas cristalográficas. Por otra
parte, las micrografías obtenidas en campo oscuro pueden ser utilizadas para hacer
análisis de imagen ya que esta señal proporciona mejor contraste.
Finalmente, se ha de resaltar que los microscopios electrónicos de transmisión modernos
están diseñados para hacer uso de todas las señales provenientes del haz transmitido,
/como se ilustra en la Figura 3.5, de manera que la información obtenida sea mucho más
que una simple imagen.
3.6. Microanálisis de rayos-X - Espectroscopia de rayos-X de energía dispersiva
El microanálisis utilizando un haz de electrones forma parte integral de la microscopía
electrónica tanto en el modo de barrido como de transmisión y es capaz de ejecutar un
análisis elemental cualitativo o cuantitativo en pequeños volúmenes del material,
típicamente del orden de pocos micrómetros cúbicos en muestras gruesas y mucho
menor en secciones delgadas [126].
79
Técnicas de Caracterización
El concepto básico de la técnica es simple, como se ha mencionado anteriormente un haz
de electrones de adecuada energía golpea la superficie de la muestra, interactúa con los
átomos de la muestra para producir rayos-X, cuyas energías y relativa abundancia
dependen de la composición del material en estudio.
El análisis de los rayos-X emitidos de una muestra puede llevarse a cabo por un
espectrómetro de longitud de onda dispersiva (wavelength dispersive spectrometer WDS) el cual utiliza un cristal difractor para seleccionar la longitud de onda de interés, o
por un espectrómetro energía dispersiva (energy dispersive spectrometer - EDS) que
trabaja por discriminación de las energías de los rayos-X [124].
El WDS es el más antiguo de los dos métodos y el único empleado como modo primario
de detección en microsondas electrónicas, mientras que el EDS es el método más
escogido debido a su alta resolución espacial en el microanálisis de rayos-X, lo que lo
hace el más dominante en la mayoría de las columnas electrónicas.
En el microanálisis de rayos-X la resolución espacial es función del volumen de
interacción del haz incidente en la muestra. Generalmente, se asume que este volumen
está determinado por la dispersión elástica que se produce cuando el haz de electrones
atraviesa la muestra, y en las condiciones bajo las cuales esta aproximación es correcta
un haz de mayor energía y/o una muestra de mucho menor espesor proporcionará mejor
resultado.
La Figura 3.7 muestra el volumen del material que participa en la emisión de rayos-X
bajo el haz de electrones. En el caso del aluminio este volumen es de aproximadamente
80
Técnicas de Caracterización
1µm de diámetro bajo condiciones de operación estándar (20 KV en microscopía
electrónica de barrido).
El sistema de EDS consiste de un detector, un preamplificador y un analizador
multicanal el cual reúne la información la información contenida en la señal de los
rayos-X y la convierte en un espectro conveniente. Este espectro es de forma bien
definida y consiste de picos gaussianos sobre una línea base lineal, donde el eje
horizontal se representa en unidades de energía y el eje vertical en número de cuentas o
intensidad.
Dentro de los aspectos importantes del microanálisis de rayos-X se encuentran: i) su
sensibilidad a la masa absoluta, es posible detectar menos de 10-19 gramos de un
elemento en una muestra delgada y menos de 10-13 gramos en micro volúmenes de una
muestra gruesa; ii) es una técnica no destructiva en la mayoría de los casos; y iii) los
requerimientos para la preparación de muestras son mínimos.
Las aplicaciones del microanálisis de rayos-X son bastantes amplias. Se utiliza para
estudiar fenómenos de segregación, especialmente en solidificación; para medir perfiles
de composición en estudios de cinética en estado-sólido; para identificar inclusiones o
precipitados, determinando los elementos presentes; en problemas de corrosión, para
determinar el rango de compuestos químicos, particularmente óxidos, que se forman
sobre la superficie del metal como resultado del proceso de corrosión.
81
Técnicas de Caracterización
Figura 3.7: Diagrama esquemático ilustrando el área donde
se producen los rayos-X característicos
82
CAPÍTULO 4
CONDICIONES EXPERIMENTALES
En esta investigación se propuso estudiar el comportamiento y factores que condicionan
la corrosión en medio ambiente salino de la aleación comercial de aluminio CVG –
ALCASA 3003 con temples H14, H16 y H18, utilizando tratamientos térmicos de
relajación para evaluar su posible efecto sobre la resistencia a la corrosión por picadura.
Para ello se estructuró la siguiente metodología:
MET
Análisis de Imagen
MEB/EDX
Tratamientos
Térmicos
Microsc. Óptica
Análisis de Imagen
MEB/EDX
ENSAYOS DE
CORROSIÓN
Propiedades
Mecánicas
Interferometría
Óptica
ANÁLISIS DE LOS
RESULTADOS
MEB /
EDX
Condiciones Experimentales
NOTA: Las referencias utilizadas en este capítulo se encuentran al final del mismo.
4.1. Aleación Utilizada
Para la realización de este trabajo se utilizó la aleación comercial Al-Mn (3003),
producida por la empresa CVG Aluminio del Caroní, S.A. (ALCASA), localizada en la
Zona Industrial Matanzas de Puerto Ordaz, Estado Bolívar, Venezuela.
La composición nominal en porcentaje de peso de la aleación Al-Mn se determinó a
través de espectrometría de emisión de chispa. La Tabla 4.1, muestra los diferentes
elementos presentes.
Tabla 4.1: Composición química de la aleación de aluminio 3003
Elementos
% en peso
Si
0.20
Ni
0.0028
Fe
0.65
Zn
0.0075
Cu
0.128
Ti
0.013
Mn
1.042
B
0.0022
Mg
0.003
Pb
0.0033
Cr
0.0007
Al
Balance
4.2. Recolección de Muestras
4.2.1. Proceso de Laminación en Frío (Realizado en Planta)
Las muestras de aluminio 3003 (Al-Mn) se recolectaron de una bobina de espesor de
lamina de 6.00 mm (Ruta 41342, Nº de Rollo 3936) proveniente del proceso de
laminación en caliente y se transportó al laminador en frío Davy McKee donde se
obtuvieron los temples H14, H16 y H18.
En el primer pase del proceso de laminación en frío se redujo el espesor del material
desde 6.00 mm hasta 4.00 mm correspondiendo a una reducción de área de un 33% y
84
Condiciones Experimentales
equivalente al temple H14. Se laminó cierta cantidad de la bobina con ese temple y se
tomó una muestra de 1.30 m de ancho x 1.36 m de largo.
Utilizando la misma la bobina y controlando en el laminador Davy Mckee los
parámetros fuerza de laminación, tracción y retención, se redujo la lámina de 6.00 mm a
3.00 mm de espesor, obteniéndose de este modo el segundo temple H16, equivalente a
una reducción de área de un 50%. Se seleccionó una muestra de 1.30 m de ancho x 1.60
m de largo.
De manera similar se obtuvo el temple H18 correspondiente a una reducción de área de
un 75%, en este caso el proceso de laminación fue de mayor intensidad, la lámina se
redujo desde 6.00 mm hasta 1.5 mm de espesor. La muestra seleccionada fue de 1.30 m
de ancho x 1.26 m de largo.
El porcentaje de elongación de área se determinó mediante la expresión:
%R =
E ent - E s
x100
E ent
(1)
Donde :
E ent = espesor de entrada
E s = espesor de salida
4.3. Corte y Selección de Muestras
Las láminas de los temples H14, H16 y H18 de la aleación Al-Mn fueron llevadas al
Laboratorio Analítico de ALCASA para realizar los cortes empleando la sierra
85
Condiciones Experimentales
JAESPAN. La composición química de la aleación se determinó utilizando el
espectrómetro de emisión óptica o de chispa.
Para los ensayos de corrosión acelerada en la cámara salina se cortaron, de cada lámina
recolectada, 50 probetas de 12 x 10 cm de tamaño (norma ASTM G-50 [1]) para un total
de 150 probetas. Las grandes dimensiones de las probetas se deben a que la corrosión
por picadura es un fenómeno estadístico y la incidencia de la picadura está relacionada
con el área del metal expuesto.
La caracterización de esta aleación tanto por microscopia óptica, metalografía
cuantitativa por análisis de imágenes, microscopia electrónica de barrido como por
microscopia electrónica de transmisión, requirió de muestras de diferentes dimensiones,
según la técnica de caracterización.
4.4. Preparación de Probetas
4.4.1. Metalografía cuantitativa
El procedimiento de preparación de muestras utilizadas en la técnica de metalografía
cuantitativa involucró tres fases: i) desbaste grueso, ii) pulido intermedio y iii) pulido
final. El propósito de la primera fase consistió en producir una superficie plana y la
remoción de cualquier imperfección gruesa de la superficie de las muestras. El pulido
intermedio y final permitió eliminar de la superficie los daños introducidos por el pulido
grueso y, a su vez, obtener una superficie completamente lisa, libre de artefactos
(defecto tipo cola de cometa, rayas profundas no uniforme y picaduras) y apariencia tipo
espejo.
86
Condiciones Experimentales
El pulido grueso se llevó a cabo con una pulidora manual DS-20 LECO, desbastando en
forma secuencial la superficie de las muestras con lijas abrasivas de carburo de silicio de
granos gruesos y finos en el rango de 100 a 1200.
En el pulido intermedio se usaron paños de nylon y abrasivos de diamante en pasta de 6
y 1 micras. El pulido se realizó con una pulidora automática VP-50 LECO a 120 rpm y
ejerciendo una presión moderada entre el medio abrasivo y la superficie.
El pulido final realzó la apariencia y reflectividad de la superficie pulida. En esta fase se
utilizó la pulidora automática a 100 rpm, paños de gamuza, solución de leche de
magnesia aplicando una leve presión de la muestra contra el paño.
En todas las fases las muestras fueron lavadas con una solución limpiadora LECO y
enjuagadas con abundante agua para remover completamente los residuos de los
abrasivos y contaminantes, los cuales pueden influir en la adquisición de datos para las
medidas cuantitativas.
Las muestras se analizaron sin atacar la superficie a fin de evitar remover o alterar la
morfología de las partículas, de acuerdo con las normas ASTM E-1245 [2] y ASTM E768 [3]. El análisis cuantitativo se hizo en un microscopio metalográfico NIKON en
interfase con un analizador de imágenes LECO IA-3001
4.4.2. Microscopía Electrónica de Barrido
La morfología y la composición de las partículas presentes en la aleación 3003 se
estudiaron utilizando la microscopia electrónica de barrido y el microanálisis de rayosX. Para esto se cortaron muestras de ~ 2 cm2 y se pulieron hasta obtener una superficie
87
Condiciones Experimentales
especular de acuerdo con el procedimiento descrito anteriormente. Luego se atacaron
con una mezcla de Bromo y Metanol al 10% por aproximadamente 15 s. Este reactivo
resaltó las partículas presentes en la superficie sin modificar su forma y su tamaño.
Posteriormente las muestras fueron montadas en el portamuestras del microscopio
electrónico de barrido utilizando cinta adhesiva de carbono de doble cara asegurándose
que estuvieran completamente libres de grasa, debido a la manipulación y/o
contaminantes los cuales pudieran tener un efecto adverso sobre la emisión de electrones
secundarios. El análisis microestructural se obtuvo en un microscopio electrónico de
barrido - MEB Hitachi S-2500 equipado con un espectrómetro de rayos-X de energía
dispersiva- EDX Thermo NORAN.
4.4.3. Microscopía Electrónica de Transmisión
Esta técnica exige la utilización de muestras muy delgadas de manera que el haz de
electrones atraviese el material. Espesores del orden de ∼2500Å suelen utilizarse en
columnas electrónicas de 100 KV a fin de obtener imágenes que revelen los detalles
morfológicos esperados. Por lo tanto, la preparación de las muestras constituye una
etapa esencial en la microscopía electrónica de transmisión.
Los métodos más comunes para desbastar muestras metálicas hasta estos espesores son
los métodos químicos y los electroquímicos. En esta experiencia se utilizó el método
electroquímico de electropulido de doble chorro (jet polishing), el cual requiere
preparar discos metálicos de 3 mm de diámetro y aproximadamente 0.13 mm de espesor.
El desbastado se consigue en una celda electroquímica, en donde la muestra de forma
88
Condiciones Experimentales
circular es el ánodo, al cual se le hacer incidir simultáneamente sobre ambas caras el
electrolito en forma de chorro líquido, hasta lograr la perforación de la parte central del
disco. La región alrededor del orificio queda lo suficientemente delgada como para ser
atravesada por el haz de electrones, mientras que los bordes del disco mantienen el
espesor original.
Las muestras fueron desbastadas en la celda de doble chorro Tenupol-2 marca Struers
bajo las siguientes condiciones:
Electrolito
25 % ácido nítrico
75 % metanol
Temperatura del
Electrolito (°C)
-20
Voltaje (V)
10
Las observaciones microestructurales se hicieron en el modo campo claro utilizando el
microscopio electrónico de transmisión - MET Hitachi H-600 operado a 100 kV.
4.4.4. Ensayo de Corrosión Acelerada
Para el ensayo de corrosión acelerada en cámara salina se utilizaron 150 probetas de
12x10 cm (120 cm2) pulidas por un solo lado con acabado uniforme. El pulido se obtuvo
empleando cintas abrasivas de carburo de silicio de tamaño de granos de 320, 400 y 600,
con el objeto de mantener las mismas condiciones de superficie en todas las probetas
durante el ensayo. Estas muestras se guardaron en el refrigerador durante un mes
aproximadamente, previo a la realización de los ensayos en la cámara salina.
Posteriormente se realizaron tratamientos térmicos de relajación (TTR) a temperaturas
de 150 °C, 200 °C y 250 °C por una hora, seguidos por tres métodos diferentes de
89
Condiciones Experimentales
enfriamiento. Esto es, para una misma TTR se enfriaron muestras en agua a una
temperatura de 0 °C (Quenching), al aire y en el horno. La realización de los
tratamientos térmicos se llevo a cabo utilizando tanto el horno Thermolyne 47900 como
el horno programable Nabertherm, ambos con una precisión de ± 1°C. Las probetas se
identificaron con los códigos indicados en la Tabla 4.2.
Tabla 4.2: Tratamientos térmicos de relajación aplicados a la aleación de aluminio 3003
CÓDIGO
TRATAMIENTO
TÉRMICO
MÉTODO DE
ENFRIAMIENTO
A/R
Sin tratamiento
B
T = 150°C
t = 1 hora
C
T = 200°C
t = 1 hora
D
T = 250°C
t = 1 hora
---Quenching
Aire
Horno
Quenching
Aire
Horno
Quenching
Aire
Horno
CÓDIGOS MUESTRAS
TEMPLE
TEMPLE
TEMPLE
H16
H18
H14
4 A/R
4BQ
4BA
4BH
4CQ
4CA
4CH
4DQ
4DA
4DH
3 A/R
3 BQ
3 BA
3 BH
3 CQ
3 CA
3 CH
3 DQ
3 DA
3 DH
A/R
BQ
BA
BH
CQ
CA
CH
DQ
DA
DH
4.4.5. Ensayo de Dureza Rockwell /Wilson
Se realizaron ensayos de dureza Rockwell / Wilson para verificar la dureza del material
y determinar el efecto de los tratamientos térmicos de relajación sobre la resistencia
mecánica de la aleación.
Las medidas de dureza se hicieron sobre probetas planas, utilizando el durómetro
Rockwell/Wilson 5JR en la escala E con un penetrador de bola de acero 1/8” y una
carga de 100 Kg. Las probetas fueron sometidas a una limpieza cuidadosa ya que el
90
Condiciones Experimentales
contacto del penetrador con impurezas o sobre capas de oxido podría influir en la
adquisición de las medidas (ASTM E-18) [4]. Se realizaron cinco identaciones en cada
una de las muestras, las cuales fueron promediadas.
4.4.6. Bandas de Deformación
Con el fin de revelar las bandas de deformación producidas sobre la superficie del
material durante el proceso de laminación se cortaron muestras de 9 cm2 a las cuales se
les realizó un electropulido por 30 segundos en la celda electrolítica BUELHER modelo
Electromet III, empleando un voltaje de 30V, una corriente de 2 A y un electrolito
compuesto de: 450 ml metanol, 15 ml de ácido nítrico concentrado, 50 ml de ácido
perclórico. Seguidamente se sometieron a un ataque químico por 4 minutos con el
siguiente reactivo y se lavaron con abundante agua destilada:
50 ml de reactivo Poulton
25 ml de ácido nítrico concentrado
40 ml de solución de 3 gramos de ácido crómico por 10 ml de agua
Se revelaron las bandas de deformación de muestras en estado de entrega de los temples
H14, H16 y H18 y de muestras tratadas térmicamente a las temperaturas de 150, 200 y
250ºC enfriadas en agua a una temperatura de 0ºC, al aire y al horno.
4.4.7. Ensayos de Tracción
Para llevar a cabo el ensayo de tracción se prepararon probetas con la geometría y
dimensiones que se esquematizan en la Figura 4.1. Las medidas se hicieron siguiendo el
procedimiento descrito en las normas ASTM E-8 [5] y ASTM B-557 [6] utilizando una
maquina universal INSTRON con las siguientes características: precisión de ± 0.5%,
lectura mínima de 5 lbs y lectura máxima de 30.000 lbs.
91
Condiciones Experimentales
Después de realizado el ensayo se obtuvo a través del software del equipo la resistencia
a la tracción (psi). Se midió este parámetro en probetas en estado de entrega (temples
H14, H16 y H18) y en probetas tratadas térmicamente a las temperaturas de 150, 200 y
250ºC enfriadas en agua a una temperatura de 0ºC, al aire y al horno sin exponer y
expuestas por 216 horas al rocío salino.
Dirección del
Laminado
Dimensiones
Probeta de ¼ in. de
ancho
Parámetros
L = Longitud total
A = Longitud de la sección reducida
W = Ancho
G = Longitud calibrada
R = Radio de curvatura
C = Ancho de la sección de la mordaza
B = Longitud de la sección de la mordaza
T = espesor del material
(in)
4
1¼
0.250 ± 0.005
1.000 ± 0.003
¼
3/8
1¼
Espesor de los temples
H14, H16 y H18
Figura 4.1: Probeta rectangular para ensayo de tracción
92
Condiciones Experimentales
4.5. Análisis de Imagen
Se utilizó la técnica de análisis de imagen para cuantificar parámetros estereológicos
básicos de las partículas de segunda fase presentes en la aleación 3003, y determinar si
los tratamientos térmicos de relajación influyen directamente sobre la fracción
superficial y volumétrica de estos intermetálicos.
El análisis consistió en colocar la muestra metalográfica en un microscopio invertido
NIKON y transferir la imagen binaria, obtenida con luz polarizada, al analizador de
imágenes LECO AI-3001. Las imágenes binarias fueron analizadas mediante un
programa construido a partir del software existente del equipo (Figura 4.2), el cual
permitió discriminar, sobre la base de niveles de gris, las partículas intermetálicas de
segunda fase de la matriz, tal y como se muestra en la Figura 4.3.
Siguiendo las instrucciones del programa, las partículas fueron sombreadas de color rojo
indicando que fueron detectadas y que serían medidas (Figura 4.4). Seguidamente se
realizó automáticamente una serie de medidas como el porcentaje de área de las
partículas para indicar la fracción volumétrica, de acuerdo con la norma ASTM E1245.
Una vez concluido el análisis estadístico de un campo de observación se ubicó
aleatoriamente un nuevo campo y se repitió el proceso. Se observaron veinte (20)
campos en cada muestra utilizando una magnificación de 200X. Los datos adquiridos en
los veinte campos fueron utilizados para calcular el mínimo, máximo, promedio y
desviación estándar de los parámetros medidos.
93
Condiciones Experimentales
Las medidas se realizaron sobre 301.910 píxeles cada uno con un área de 0,9524 µm2
para un tamaño de campo de 287.540 µm2 (0,287 mm2); estas condiciones generaron un
área de análisis de 57.508.000 µm2 (5,7 mm2).
Figura 4.2: Programa a partir del software del analizador de
imágenes para el análisis de las partículas de segunda fase
Figura 4.3: Ventana suministrada por el software del analizador de
imágenes mostrando la superficie analizada en tonalidades de grises.
94
Condiciones Experimentales
Figura 4.4: Ventana suministrada por el software del
analizador de imágenes mostrando las partículas de segunda
fase sombreadas de color rojo.
4.6. Estudio de Corrosión
4.6.1. Prueba de Atomización Salina (Salt Spray Testing)
Se seleccionó el ensayo de corrosión acelerado de niebla salina ya que éste simula un
ambiente corrosivo en áreas costeras. En esta prueba los cupones son restringidos a un
ambiente cerrado donde una mezcla de niebla salina y una pequeña fracción de aire
circulan dentro de la cámara de acuerdo con la norma ASTM B-117 [7]. Bajo estas
circunstancias se crea, en relativamente un corto periodo de tiempo, un proceso de
corrosión por picadura sobre la superficie de las probetas expuestas a esta atmósfera.
Se utilizó la cámara salina Erichsen modelo 606 (Figura 4.5) y el ensayo se hizo en
forma continua las 24 horas del día, exceptuando los breves períodos de inspección y
95
Condiciones Experimentales
remoción de las probetas y para el reajuste del nivel de la solución salina en el tanque de
la cámara.
Figura. 4.5: Cámara salina Erichsen Modelo 606
4.6.2. Limpieza de las Probetas Antes del Ensayo
Previo al ensayo de corrosión las probetas fueron lavadas con solución limpiadora
LECO y enjuagadas con agua. Posteriormente, se sumergieron en acetona por varios
minutos, se lavaron con abundante agua destilada y se secaron con aire comprimido.
Finalmente se colocaron en los portamuestras de la cámara salina, cuidando de no
recontaminarlas por excesiva manipulación, y así dar comienzo al estudio.
96
Condiciones Experimentales
4.6.3. Preparación de la Solución Salina
La solución salina se preparó por disolución manteniendo la relación de 5 partes por
peso de sal en 95 partes de agua destilada. Se disolvieron 4,727 Kg de cloruro de sodio
(NaCl) grado analítico, en 90 litros de agua destilada mediante un agitador eléctrico.
Luego se fueron agregando gotas de HNO3 o NaOH para ajustar el pH entre 6.5 a 7.2.
Para ello se tomó una alícuota de 50 ml de la solución preparada, se hirvió por
aproximadamente 30 seg, se dejo enfriar y se determinó el pH. Este procedimiento se
repitió hasta obtener un valor de pH entre el rango señalado. Posteriormente se vertió la
solución en el tanque de la cámara salina utilizando un filtro de tela para prevenir que
los residuos sólidos obstruyan la boquilla de la atomización. Esta cantidad de solución se
preparó dos veces por semana para mantener el nivel del tanque
4.6.4. Ubicación de las Probetas
La cámara salina Erichsen modelo 606 contiene 3 portamuestras inclinados 30° respecto
a la horizontal, de tal manera que al colocar los probetas, éstas quedan sostenidas con
ese ángulo de inclinación y paralelas a la dirección principal del flujo de la neblina que
sale a través de la boquilla dispensadora. A su vez, quedan lo suficientemente
distanciadas una de la otra sin hacer contacto entre si de tal manera que la neblina de sal
puede circular libremente entre ellas, como lo exige la norma ASTM B-117.
Las probetas de los distintos temples tratadas a las diferentes condiciones de temperatura
y tipo de enfriamiento se colocaron aleatoriamente en los portamuestras, los cuales
pueden sostener veinte (20) probetas como se muestra en la Figura 4.6.
97
Condiciones Experimentales
Figura 4.6: Ubicación de los portamuestras con las
probetas dentro del gabinete de la cámara salina.
4.6.5. Condiciones del Ensayo
Después de haber revisado la parte eléctrica del equipo y las instalaciones de agua y
presión, se procedió a llenar el tanque con la solución salina y a colocar dentro del
gabinete de la cámara dos recolectores junto a los portamuestras con las probetas, luego
se fijaron las siguientes condiciones de operación: temperatura del humidificador = 70
ºC, temperatura de exposición = 35 ºC, presión del atomizado = 1,2 bar según el manual
del equipo [8].
Los recolectores o cilindros graduados con embudos de 10 cm de diámetro (ver Figura
4.6) sirvieron para recoger solución atomizada cada 24 horas, la cual se utilizó para
98
Condiciones Experimentales
controlar el flujo de la atomización, el pH y la concentración de la solución salina,
siguiendo el procedimiento descrito en la norma ASTM B-117.
El ensayo se estructuró en forma continua para un periodo de quince (15) días (360
horas), con retiro de probetas cada tres (3) días (72 horas) con el fin de determinar y
comparar la velocidad de corrosión en este medio de las probetas tratadas y no-tratadas
térmicamente de la aleación comercial 3003.
4.6.6. Limpieza de las Probetas Después del Ensayo
Después del ensayo de corrosión controlado las probetas corroídas fueron decapadas
utilizando el método descrito en la norma ASTM-G1 [9] sumergiéndolas en ácido nítrico
(HNO3) concentrado por 5 minutos a temperatura ambiente haciendo uso del
ultrasonido, luego se lavaron con abundante agua y se secaron en una corriente de aire
comprimido. Este procedimiento de limpieza permitió eliminar los productos de
corrosión depositados en la superficie de las láminas con mínima remoción del material
sano. Todas las probetas se sometieron al mismo procedimiento de limpieza para
asegurar un acabado de superficie comparativo.
4.7. Técnicas Utilizadas para Examinar y Evaluar la Corrosión por Picadura
4.7.1. Interferometría Óptica
La superficie de las probetas corroídas, después de decapadas, fueron analizadas
mediante Interferometría de luz blanca utilizando el interferómetro Zygo New View 200
(Figura 4.7), el cual realiza un barrido optoelectrónico sobre el área seleccionada
99
Condiciones Experimentales
detectando las irregularidades superficiales, presentes en el material capaces de reflejar
luz visible.
El programa METROPRO base del equipo, controla la operación y el análisis
superficial. Para efectuar las medidas se coloca la probeta en la platina motorizada, se
selecciona el área de interés y se ejecuta la rutina del programa a través de la instrucción
ADVTEXT. Luego de realizado el barrido óptico sobre cada campo de observación se
midieron parámetros tales como: Ra el cual proporciona información del acabado de la
superficie, PV y V utilizados para determinar la máxima profundidad de las picaduras
en cada una de las áreas seleccionadas, siendo esta última medida uno de los parámetros
mas importantes para evaluar la corrosión por picadura (ASTM G-16 [10], ASTM G46
[11]). De acuerdo con el manual del equipo estos parámetros son definidos de la
siguiente manera:
Ra = desviación aritmética promedio de la altura de la superficie desde la línea central a
través del perfil. La línea central se considera como el mejor ajuste del área seleccionada
y es definida de modo que queden áreas iguales del perfil por arriba y por debajo de ella.
Línea central
Línea central
Longitud total del perfil
100
Condiciones Experimentales
PV = La máxima distancia entre el punto más alto (pico) y el punto más bajo (valle) de
todos los picos/valles barrido en el campo de observación.
Longitud total del perfil
V = La máxima distancia entre la línea central y el punto más bajo (valle) dentro del
campo de observación.
Línea central
Valle
Longitud total del perfil
Se analizaron 12 campos por probeta con un objetivo de 10X el cual produce una
magnificación de 150X de la imagen de la superficie en el monitor de video. El campo
de observación para este objetivo fue de 0.70 x 0.52 mm y los parámetros Ra, PV y V
fueron obtenidos con una con una resolución de 1 nm y una profundidad de foco de 100
µm (Manual del Equipo [12]).
101
Condiciones Experimentales
Platina
Motorizada
Figura 4.7: Interferómetro óptico Zygo New 200
4.7.2. Microscopía Electrónica Analítica
Otra de las técnicas utilizadas para examinar la superficie de las probetas corroídas fue
la microscopía electrónica de barrido y la espectroscopia de energía dispersiva de rayosX (EDX). Se observaron muestras con los productos de corrosión y muestras decapadas
con el fin de caracterizar la morfología de las picaduras y de alguna manera relacionar
las características superficiales con el mecanismo de corrosión.
4.8. Equipos Utilizados
ª Cámara Salina Erichsen Modelo 606
ª Sierra Jaespan
ª Cizalla de metales
ª Horno Thermolyne 47900
ª Horno Nabertherm
ª Cortadora Leco VC-50
102
Condiciones Experimentales
ª Pulidora Manual Leco DS-20
ª Pulidora Automática Leco VP-50
ª Agitador Eléctrico
ª Balanza Analítica
ª Celda Electrolítica
ª pHmetro Marca Orión
ª Analizador de Imágenes Leco IA-3001
ª Electro Pulidora de doble chorro, Struers
Tenupol-2 conectada a unidad Struers Polipower
ª Durómetro Rockwell/Wilson 5JR
ª Microscopio Metalográfico Versamet-2
ª Microscopio Metalográfico Nikon
ª Microscopio Electrónico de Transmisión Hitachi
H600 – 100 KV
ª Microscopio Electrónico de Barrido Hitachi S2500 equipado con un espectrómetro de rayos-X
de energía dispersiva (EDX). Thermo NORAN
ª Maquina Universal INSTRON
ª Perfilómetro Óptico Zygo 200
103
Condiciones Experimentales
4.9. Referencias de Normas ASTM y Manuales Operativos utilizados
1.
“Standard Practice for Conducting Atmospheric Corrosion Test on Metals”, G
50, Annual Book of ASTM Standards, Vol 03.02, ASTM, Philadelphia 1992, p
194-198.
2.
“Standard Practice for Determining Inclusion Content of Steel and Other Metals
by Automatic Image Analysis”, E1245, Annual Book of ASTM Standards, Vol
03.01, ASTM, Philadelphia 1992, p 905-911.
3.
“Standard Practice for Preparing and Evaluating Specimens for Automatic
Inclusion Assessment of Steel”, E 768, Annual Book of ASTM Standards, Vol
03.01, ASTM, Philadelphia 1992, p 720-721.
4.
“Standard Practice for Conducting Atmospheric Corrosion Test on Metals”,
E
18, Annual Book of ASTM Standards, Vol 03.01, ASTM, Philadelphia 1992, p
184 -197.
5.
“Standard Test Method of Tension Testing of Metallic Materials”, E 8 Annual
Book of ASTM Standards, Vol 03.01, ASTM, Philadelphia 1992, p 130-168.
6.
“Standard Methods of Tension Testing Wrought and Cast Aluminum – and
Magnesium- Alloy Products”, B 557, Annual Book of ASTM Standards, Vol
03.01, ASTM, Philadelphia 1992, p 49-59.
7.
“Standard Test Method of Salt Spray (Fog) Testing”, B 117, Annual Book of
ASTM Standards, Vol 03.02, ASTM, Philadelphia 1992, p 20-26.
8.
Operating instructions 606/E Corrosion Test Instrument for Salt Spray Test.
Erichsen Model 606.
9.
“Standard Practice for Cleaning, and Evaluating Corrosion Test Specimens”,
G 1, Annual Book of ASTM Standards, Vol 03.02, ASTM, Philadelphia 1992,
p 35-41.
104
Condiciones Experimentales
10. “Standard Guide for Applying Statistics to Analysis of Corrosion Data”, G 16,
Annual Book of ASTM Standards, Vol 03.02, ASTM, Philadelphia 1992, p 8490.
11. “Standard Practice for Examination and Evaluation of Pitting Corrosion”, G 46,
Annual Book of ASTM Standards, Vol 03.02, ASTM, Philadelphia 1992, p
174-180.
12. New View 200, Operation Manual, Zygo Corporation, Middlefield,
Connecticut, EEUU, 1997.
105
CAPÍTULO 5
RESULTADOS EXPERIMENTALES Y DISCUSIÓN
5.1. Caracterización de la aleación Al-Mn previo al ensayo de corrosión
Previo a los ensayos de corrosión acelerada en cámara salina, se caracterizó la
microestructura de la aleación comercial de aluminio 3003 de temples H14, H16 y H18,
utilizando técnicas analíticas de microscopia electrónica de barrido (MEB),
espectroscopia de energía dispersiva de rayos-X (EDX) y microscopía electrónica de
transmisión (MET). Esto con el propósito de establecer los detalles microestructurales
más representativos de la aleación, particularmente aquellos que pudieran influir en su
comportamiento frente a la corrosión en medio ambiente salino.
5.1.1. Microanálisis por MEB
Las observaciones por MEB realizadas mostraron la existencia de una elevada densidad
de partículas de segunda fase de diferentes formas y tamaños comprendidos entre 1-10
µm, distribuidas en toda la matriz. Sin embargo, en todos los temples se observó una
tendencia hacia orientación preferencial de las partículas en lo que pudiera ser la
dirección de laminación, tal como puede apreciarse en micrografías por MEB tomadas a
baja magnificación (300X) de la Figura 5.1 (a-c).
Resultados y Discusión
En la Figura 5.2, se muestran algunas de las morfologías típicas de bastones y globulares
de las partículas de segunda fase observadas, características del material, donde se
aprecia como factor predominante la tendencia de estas partículas a formar aglomerados
(Figura 5.2 (a-c), que muestran claras orientaciones preferenciales (Figuras 5.2a y 5.2c)
las cuales, como se mencionó anteriormente, estarían asociadas a la dirección de
laminación y a segregaciones preferenciales. Algunas de estas partículas se encuentran
fracturadas, tal como se aprecia en las Figuras 5.2c y 5.2d, lo cual pudiera explicarse
por los efectos de corte resultantes del proceso de laminación en frío.
En algunos casos, como se ilustra en la Figura 5.3, se observaron cavidades de tamaños
comparables con los de las partículas de segunda fase, lo cual lleva a considerar la
ocurrencia de desprendimientos de las mismas, bien durante el proceso de laminación en
planta o durante la preparación por pulido mecánico de la superficie de la probeta. En
ambos casos, estos detalles superficiales son importantes debido a su papel como
potenciales sitios para la nucleación de las picaduras, de acuerdo al mecanismo que
considera los defectos en la película pasiva como una condición necesaria para la
iniciación de la picadura [43].
107
Resultados y Discusión
a
b
c
Figura 5.1: Micrografías por MEB obtenidas de muestras de la
AA3003 mostrando la distribución de partículas de segunda fase.
a) Temple H14, b) Temple H16 y c) Temple H18. Mag. 300X.
108
Resultados y Discusión
a
b
c
d
Figura 5.2: Micrografías por MEB mostrando diferentes morfologías y
tamaños de partículas de segunda fase. En a), b) y c) se ilustra la
tendencia a la formación de aglomerados. En a), c) y d) se observan
partículas fracturadas. Mag.: 8 KX
109
Resultados y Discusión
a
b
Figura 5.3: Micrografías por MEB mostrando pequeñas cavidades en
la matriz de la aleación. Mag. (a): 2500X; Mag. (b): 4000X
En resumen, los resultados del macro y microanálisis realizados evidencian la compleja
y heterogénea microestructura interna y algunos de los defectos superficiales más
resaltantes de la aleación comercial Al-Mn en todos los temples estudiados y sin
tratamiento, excepto el pulido mecánico de uniformidad superficial.
5.1.2. Microanálisis por EDX
El análisis cualitativo por espectroscopia de rayos-X de energía dispersiva (EDX)
llevado a cabo en forma aleatoria sobre diferentes partículas de la misma muestra y en
varias muestras del mismo material, permitió distinguir dos tipos de partículas de
segunda fase como intermetálicos: uno constituido de Al-Fe-Mn y otro compuesto de
Al-Fe-Mn-Si, ambos observados por otros investigadores en la aleación Al-Mn [35-36],
110
Resultados y Discusión
los
cuales
resultaron
tener
estequeometrías
Al6(FeMn)
y
α-Al12(FeMn)3Si,
respectivamente. Ningún otro elemento fue detectado en los dos tipos de precipitados,
como se indica en los espectrogramas de las Figuras 5.4 y 5.5.
Figura 5.4: Espectro por EDX de la fase Al-Fe-Mn
Figura 5.5: Espectro por EDX de la fase Al-Fe-Mn-Si
111
Resultados y Discusión
Una estadística comparativa de la población relativa de estos dos tipos de partículas en
las muestras observadas, permitió establecer que aproximadamente el 61% correspondía
a la fase Al-Fe-Mn (ver Tabla 5.1), mientras que el remanente (39%) estaba constituido
por partículas de la fase enriquecida con Si (Al-Fe-Mn-Si) (ver Tabla 5.2). En estas
Tablas también se incluyen los porcentajes en peso así como las relaciones
estequeométricas de cada una de las partículas analizadas. La variación en las
proporciones estequeométricas de las fases que se observa, puede ser atribuida a que el
volumen del material que participa en la emisión de rayos-X es de alrededor de 1 µm3
por debajo de la superficie, por lo que no es posible determinar con precisión cuánta
señal proviene de las partículas y cuánta se origina de la matriz.
5.1.3. Microanálisis por MET
Para explorar detalles microestructurales más pequeños, se realizaron observaciones por
MET, los cuales se presentan en la Figura 5.6. De los resultados obtenidos puede
apreciarse la subestructura de bandas y celdas de dislocaciones, así como de subgranos,
característicos del estado de deformación del material, ilustrados en las Figuras 5.6a y
5.6b. Por otra parte, además de los compuestos intermetálicos descritos anteriormente y
observados por MEB, la MET permite definir mejor las morfologías de las partículas de
segunda fase tipo-bastón con tamaños > 2 µm, como se aprecia en la Figura 5.6c y 5.6d.
Las observaciones por MET permitieron determinar también que la aleación comercial
de aluminio 3003 contiene una alta población de pequeñas partículas dispersas
(dispersoides) en el volumen del material, con tamaños comprendidos entre 0.1 a 0.7
112
Resultados y Discusión
µm, tal como se aprecia en las micrografías de las Figuras 5.6a, 5.6b, 5.6e y 5.6f, donde
es posible observar precipitados más o menos globulares con tamaños de ∼0.1 µm,
algunos dispersos en la matriz (Figura 5.6a), otros segregados en las paredes de las
celdas de dislocaciones (Figura 5.6b). Igualmente se observan partículas con tamaños un
poco mayores, de hasta ∼0.7 µm, interactuando con las dislocaciones y creando débiles
campos de esfuerzo, como se aprecia en las Figuras 5.6e y 5.6f. Algunas de estas
partículas submicrométricas (∼0.3 µm) presentaron formas geométricas bien definidas,
(hexagonales y romboides) como se aprecia en la Figura 5.6f.
A diferencia de las partículas de segunda fase con morfologías tipo bastón y con
tamaños > 2 µm que presentaron muy poca o ninguna interacción con la subestructura de
dislocaciones, las partículas con tamaños <1 µm aparecen generalmente segregadas en
la subestructura y aunque en algunos casos interactúan con ésta, la naturaleza de los
campos de esfuerzo débiles observados, sugiere que éstas no constituyen una barrera
efectiva al movimiento de las mismas durante el proceso de laminación en frío. Este
comportamiento se corresponde con el hecho que la aleación de aluminio 3003
pertenece al grupo de las no tratables térmicamente.
En resumen, la macroestructura de la muestra original previo a los ensayos de corrosión
evidencia una superficie con diversos tipos de defectos, que constituyen sitios probables
para nucleación de las picaduras. Por otra parte, la microestructura original está
compuesta fundamentalmente por partículas intermetálicas gruesas: Al(Fe,Mn) y αAl(Fe,Mn,Si), de diferentes relaciones estequeométricas y partículas intermetálicas finas
113
Resultados y Discusión
o dispersoides; ambas distribuidas heterogéneamente en el volumen del material. Estos
dispersoides, por su tamaño, no se consideran sitios importantes para la nucleación de
las picaduras.
Tabla 5.1: Composición elemental de las partículas de segunda fase Al-Fe-Mn
encontradas en la aleación 3003.
Partículas
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
Porcentaje en peso
Al27
Mn55
Fe56
73.57
9.93
16.50
92.46
3.54
4.00
91.34
3.99
4.67
75.35
11.15
13.51
77.00
11.88
11.13
77.35
9.88
12.77
86.81
5.40
7.79
73.08
10.16
16.76
83.42
7.76
8.82
95.26
2.43
1.76
95.31
2.26
1.85
82.19
7.05
10.20
97.98
1.03
0.39
89.70
5.20
4.50
96.22
1.77
1.14
90.82
4.45
4.19
98.52
0.80
0.22
98.54
0.64
0.04
91.56
4.37
3.62
88.29
4.08
5.98
114
Fase reportada Al6(Fe Mn)
Fase calculada Alx (FeyMnz)
x
y
z
19.86
9.24
5.46
24.96
2.24
1.94
24.66
2.61
2.19
20.34
7.56
6.13
20.79
6.23
6.53
20.88
7.15
5.43
23.43
4.36
2.97
19.73
9.38
5.58
22.52
4.93
4.26
25.72
0.98
1.33
25.73
1.03
1.24
22.19
5.71
3.87
26.45
0.21
0.56
24.21
2.52
2.86
25.97
0.63
0.97
24.52
2.34
2.44
26.60
0.12
0.44
26.60
0.02
0.35
24.72
2.02
2.40
23.83
3.34
2.24
Resultados y Discusión
Tabla 5.1: Continuación
Partículas
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
Porcentaje en peso
Al27
Mn55
Fe56
91.72
3.58
2.83
77.20
8.28
12.69
82.58
7.01
8.80
80.38
8.71
8.09
75.14
9.06
13.60
88.36
5.00
5.57
91.46
3.50
3.80
97.36
1.06
0.56
86.15
5.85
6.27
91.89
3.35
3.50
97.13
1.14
0.68
94.99
2.29
1.81
93.36
2.65
2.32
87.15
5.70
5.81
86.74
6.23
5.74
80.42
7.92
10.04
98.34
0.59
0.12
115
Fase reportada Al6(Fe Mn)
fase calculada Alx (FeyMnz)
x
y
z
24.76
1.58
1.96
20.84
7.10
4.55
22.29
4.92
3.85
21.70
4.53
4.79
20.28
7.61
4.98
23.85
3.11
2.75
24.69
2.12
1.92
26.28
0.31
0.58
23.26
3.51
3.21
24.81
1.96
1.84
26.22
0.38
0.62
25.64
1.01
1.25
25.20
1.29
1.45
23.53
3.25
3.13
23.41
3.21
3.42
21.71
5.62
4.35
26.55
0.06
0.32
Resultados y Discusión
Tabla 5.2: Composición elemental de las partículas de segunda fase Al-Fe-Mn-Si
encontradas en la aleación 3003.
Partículas
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
Porcentaje en peso
Al27
Si28
Mn55
Fe56
71.75 3.27 10.22 14.76
65.23 5.08 14.48 15.21
66.53 4.76 15.30 13.41
75.56 4.11
8.50
11.83
75.54 3.81
8.52
12.14
69.61 3.60 12.41 14.37
86.49 1.78
5.72
6.01
66.38 4.54 12.05 17.03
66.29 4.82 11.52 17.37
66.98 4.39 10.41 18.22
82.91 2.65
5.96
8.47
80.84 2.34
6.88
9.94
64.23 4.46 11.48 19.83
78.50 0.72
8.45
12.33
90.40 2.17
3.24
3.65
71.90 4.02
6.72
15.12
77.28 4.19
8.30
9.74
69.88 4.43 10.53 14.56
85.75 2.99
5.23
5.46
83.60 2.94
7.75
5.27
95.84 1.15
1.57
0.85
81.21 2.79
7.37
7.93
67.16 5.29
9.54
16.12
75.95 4.05
8.22
9.97
116
Fase reportada Al12(Fe Mn)3Si
Fase calculada Alx (FeyMnz)Sip
x
y
z
p
19.37
8.26
5.62
0.91
17.61
8.51
7.96
1.42
17.96
7.50
8.41
1.33
20.40
6.62
4.67
1.15
20.39
6.79
4.68
1.06
18.79
8.04
6.82
1.00
23.35
3.36
3.14
0.49
17.92
9.53
6.62
1.27
17.89
9.72
6.33
1.34
18.08
10.20
5.72
1.22
22.38
4.74
3.27
0.74
21.82
5.56
3.78
0.65
17.34
11.10
6.31
1.24
21.19
6.90
4.64
0.20
24.40
2.04
1.78
0.60
19.41
8.46
3.69
1.12
20.86
5.45
4.56
1.17
18.86
8.15
5.79
1.24
23.15
3.05
2.87
0.83
22.57
2.95
4.26
0.82
25.87
0.47
0.86
0.32
21.92
4.44
4.05
0.78
18.13
9.02
5.24
1.48
20.50
5.58
4.52
2.30
Resultados y Discusión
a
a
b
c
d
e
f
Figura 5.6: Micrografías por MET mostrando: a) distribución de
pequeños precipitados, (b-f) diferentes formas y tamaños de
precipitados.
117
Resultados y Discusión
5.2.
Efecto de los tratamientos térmicos de relajación sobre las propiedades
mecánicas, macro y microestructurales de la aleación Al-Mn.
5.2.1 Medidas de Dureza Rockwell
Los recocidos a las temperaturas de 150ºC, 200ºC y 250ºC durante 60 minutos de los
tres temples (H14, H16 y H18) de la aleación de Al-Mn recibida de planta, se realizaron
para determinar el efecto de tratamientos térmicos de relajación sobre la macro y micro
estructura del material, cuidando de no afectar de manera significativa sus propiedades
mecánicas. De igual manera, se efectuaron tres medios de enfriamiento posterior al
recocido: (1) en el horno, (2) en aire y (3) y enfriado en agua fría. Esto con el fin de
establecer aquel medio que, sin variar significativamente las propiedades mecánicas,
retuviera cualquier detalle estructural que pudiera estar relacionado con la
susceptibilidad de la aleación a la corrosión en medio ambiente salino, incluyendo
posibles transformaciones de la fase ortorrómbica metaestable β-Al6(FeMn) → αAl12(FeMn)3Si (fase cúbica estable), aún a bajas temperaturas debido al elevado
coeficiente de difusión en aluminio del Si [9000 x 10-8 (µm2s-1)] en relación con el Mn
[104 x 10-8 (µm2s-1)].
Como puede observarse en la Figura 5.7 y en la Tabla 5.3, en general el valor de la
dureza, obtenido del promedio de 5 identaciones, de probetas correspondientes a los
temples H14, H16 y H18, disminuye levemente con los tratamientos térmicos de
relajación, en comparación con la dureza del material recibido de planta, reflejando el
efecto del recocido. La mayor variación se aprecia en la curva correspondiente al temple
118
Resultados y Discusión
H18 para T = 250 ºC, lo cual puede explicarse porque a esa temperatura puede existir
recristalización parcial de la estructura de bandas características de la aleación laminada.
Sin embargo, esta disminución se encuentra en el rango de dureza establecido para los
respectivos temples de la aleación comercial Al-Mn.
Por su parte, los medios de enfriamiento en horno, en aire y en agua fría (quenching)
para los tres temples estudiados que se muestran en las Figuras 5.8, 5.9 y 5.10, sugieren
la existencia de poco o ningún cambio en los valores de dureza, para cada una de las
temperaturas de los tratamientos térmicos. No obstante, la dispersión en los valores de
dureza observados en las figuras anteriores, señalan el nivel de recuperación de la
microestructura de aleación original en función de la temperatura de recocido, siendo
mayor para T = 250ºC, como era de esperarse.
80
75
DUREZA ROCKWELL E
70
65
60
55
50
45
40
35
30
ST
150 ºC
200 ºC
250 ºC
TEMPERATURA
TEMPLE H14
TEMPLE H16
TEMPLE H18
Figura 5.7. Dureza Rockwell E versus Temperatura de relajación para los
temples H14, H16 y H18 y medio de enfriamiento en agua fría.
119
Resultados y Discusión
60
DUREZA ROCKWELL E
TEMPLE H14
55
50
45
AGUA
AIRE
HORNO
MÉTODOS DE ENFRIAMIENTO
T = 150 ºC
T = 200 ºC
T = 250 ºC
Figura 5.8: Dureza Rockwell E en función del medio de enfriamiento
y las tres temperaturas de recocido para el temple H14.
70
TEMPLE H16
DUREZA ROCKWELL E
65
60
55
50
45
AGUA
AIRE
HORNO
MÉTODOS DE ENFRIAMIENTO
T = 150 ºC
T = 200 ºC
T = 250 ºC
Figura 5.9: Dureza Rockwell E en función del medio de enfriamiento y
las tres temperaturas de recocido para el temple H16.
120
Resultados y Discusión
80
TEMPLE H18
DUREZA ROCKWELL E
75
70
65
60
55
50
AGUA
AIRE
HORNO
MÉTODOS DE ENFRIAMIENTO
T = 150 ºC
T = 200 ºC
T = 250 ºC
Figura 5.10: Dureza Rockwell E en función del medio de enfriamiento y las
temperaturas de recocido para el temple H18.
Tabla 5.3. Valores de Dureza promedio Rockwell E obtenidos de probetas de la aleación
3003 de temples H14, H16 y H18 en estado de entrega y recocidas a diferentes
temperaturas.
Muestra
Recibida de
Planta
T = 150 °C
t = 1 hora
T = 200 °C
t = 1 hora
T = 250 °C
t = 1 hora
Medio de
Enfriamiento
-------Enfriado en agua
Aire
Horno
Enfriado en agua
Aire
Horno
Enfriado en agua
Aire
Horno
Dureza promedio Rockwell E
Temple H14
Temple H16 Temple H18
55.32
54.46
54.68
54.10
52.50
52.63
52.80
50.00
50.00
50.55
121
61.12
60.20
60.56
60.70
59.34
58.88
58.70
55.05
55.90
55.90
69.32
68.20
68.36
68.40
66.94
66.20
67.04
59.60
60.56
60.62
Resultados y Discusión
5.2.2 Resistencia a la tracción (σuts)
En la Figura 5.11 se muestra la influencia de la temperatura de recocido y del medio de
enfriamiento utilizado en la resistencia a la tracción obtenida del ensayo de tracción de
probetas pertenecientes a los temples H14, H16 y H18, en estado de entrega y tratadas
térmicamente a las temperaturas de relajación de 150, 200 y 250 ºC, seguidos por
enfriamiento rápido (quenching). Como se observa en la Figura 5.11, las tres gráficas
exhiben aproximadamente la misma tendencia que la obtenida de las medidas de dureza,
como era de esperarse, mostrando leve variación de la pendiente, excepto en el caso del
tratamiento térmico para 250 ºC, donde se aprecia un ablandamiento por efecto de la
recristalización parcial de la microestructura, sobre todo en el de mayor endurecimiento
por deformación (H18) y por lo tanto mayor energía acumulada.
En resumen, los resultados obtenidos y discutidos en el aparte anterior indican que tanto
los valores de resistencia a la tracción (σuts) como los de dureza, varían solo levemente
con los tratamientos térmicos aplicados, lo cual se debe a que las temperaturas
seleccionadas tenían como objetivo producir relajación en la aleación sin cambiar
significativamente la resistencia mecánica del material.
122
Resultados y Discusión
RESISTENCIA A LA TRACCIÓN (σUTS) (psi)
40000
35000
30000
25000
20000
15000
ST
150 ºC
200 ºC
250 ºC
TEMPERATURA
TEMPLE H14
TEMPLE H16
TEMPLE H18
Figura 5.11: Gráfica de Resistencia a la tracción (σuts) en función de la
Temperatura de relajación para los temples H14, H16 y H18 y medio de
enfriamiento en agua fría.
5.3. Efecto de los tratamientos térmicos de relajación sobre la macroestructura
Los resultados presentados y discutidos en la sección anterior muestran que los
tratamientos térmicos realizados a los tres temples de la aleación Al-Mn produjeron
efectos de recuperación en las propiedades mecánicas (dureza), lo cual debe reflejarse en
detalles de la macro y microestructura del material. El propósito de los tratamientos
térmicos de recuperación (TTR) por tiempos relativamente cortos (1 hora), fue liberar
las tensiones internas del material sin causar cambios significativos en la
microestructura. Sin embargo, en el caso de las aleaciones de aluminio las temperaturas
de recocido utilizadas son suficientemente altas para producir movilidad atómica lo cual
afecta la concentración de defectos puntuales favoreciendo la difusión, mientras que por
otra parte puede facilitar el movimiento de las dislocaciones hacia posiciones de menor
123
Resultados y Discusión
energía causando, en el caso de la temperatura T = 250 ºC, inicio de recristalización
estática.
Estos efectos se estudiaron observando la evolución de la macroestructura a nivel de
bandas de deformación para cada temple y tratamiento térmico, contrastándola además
con el medio de enfriamiento para determinar el estado inicial de las muestras que serían
utilizadas en los ensayos de corrosión acelerada. Los resultados se presentan en los
bloques macrográficos de las Figuras 5.12, 5.13, 5.14 y 5.15.
En la secuencia de macrografías de luz de la Figura 5.12 (a-c) se presentan las bandas de
deformación de cada uno de los temples de la muestra de Al-Mn recibida de planta,
observándose un evidente efecto en las características de las bandas en función de la
deformación acumulada, como era de esperarse. La Figura 5.12a muestra la
macroestructura para una reducción de espesor de 33 % (temple H14) resultando en
bandas de tamaños moderados y discontinuas, indicando el grado de menor elongación
de los granos originales resultantes de la etapa previa de deformación en caliente. Para
reducciones de espesor intermedias de 50% (temple H16), las bandas se presentaron más
alargadas y con texturas mucho más continuas en comparación con el temple H14, como
se ilustra en la Figura 5.12b. Finalmente, la Figura 5.12c ilustra la macroestructura de
bandas para el temple H18 (75% de reducción de espesor), apreciándose cambios que
resultaron en la formación de bandas más anchas y más extensas (continuas) en
comparación con los temples anteriores, consecuencia del mayor grado de deformación
de los granos originales de la aleación. En resumen, las macrografías de la Figura 5.12
ilustran un evidente efecto de la deformación acumulada sobre la evolución de la textura
124
Resultados y Discusión
de las bandas de deslizamiento, como corresponde a un proceso de laminación en frío de
una aleación que endurece por deformación.
El efecto de los tratamientos térmicos de recuperación a las temperaturas de 150 ºC, 200
ºC y 250 ºC sobre la microestructura inicial de los temples H14, H16 y H18 reflejado en
la macrobandas de deformación, se presenta en las Figuras 5.13, 5.14 y 5.15,
respectivamente. De igual manera y para contraste se presentan en las mismas figuras
los efectos de los tres medios de enfriamiento utilizados (enfriado en agua a 0 ºC,
enfriado en aire y en el horno). Puede apreciarse que, en general, tanto los tratamientos
térmicos de relajación como los medios de enfriamientos reflejan el grado de
recuperación de la microestructura en función de la deformación acumulada, la
temperatura del recocido y la cinética que resulta del medio de enfriamiento.
Para el temple H14, el de menor energía acumulada, las temperaturas de recocido de 150
ºC, 200 ºC y 250 ºC durante el tiempo de 1 hora, no parecen ser suficientemente
elevadas para acelerar la cinética de recuperación por lo cual ésta es lenta y las
macrobandas obtenidas después de los tratamientos térmicos, para todas los medios de
enfriamiento, no son significativamente diferentes de la macroestructura de la aleación
original (Figura 5.13a, sin tratamiento de relajación), como puede apreciarse en las
Figuras 5.13b a 5.13j.
Para el temple intermedio H16 aunque existe una mayor deformación acumulada, las
temperaturas de relajación de 150 ºC, 200 ºC y 250 ºC durante el tiempo de 1 hora no
producen un efecto significativo de recuperación de la estructura, como puede apreciarse
125
Resultados y Discusión
al comparar la Figura 5.14a correspondiente a la macroestructura de la aleación sin
tratamiento, con las macrobandas observadas en las Figuras 5.14b b a 5.14j.
Finalmente, para el temple H18 donde se tiene la mayor deformación acumulada, las
temperaturas de recocido de 150 ºC, 200 ºC y 250 ºC son suficientes para producir una
cinética de recuperación rápida de la estructura de la aleación recibida de planta (Figura
5.15a), tal
como puede apreciarse en la secuencia de macrobandas y medios de
enfriamiento de las Figuras 5.15b a 5.15j. De hecho, en el caso del recocido a 250 ºC
con enfriamiento en el horno, los valores mayores de tiempo relativo de enfriamiento y
temperatura, son suficientes para dar inicio a la recristalización estática, resultado que se
aprecia en la macrografía de la Figura 5.15j.
126
Resultados y Discusión
a
b
c
Figura 5.12: Micrografía óptica mostrando la microestructura de
bandas de la aleación de AA 3003 resultantes del proceso de
laminación en frío: a) temple H14, b) temple H16 y c) temple H18.
127
Resultados y Discusión
a
Recibida de planta
b
c
d
e
f
g
h
i
j
Enfriadas en agua fría
Enfriadas en aire
Enfriadas en horno
Figura 5.13: Micrografías ópticas mostrando las bandas de deformación del
plano normal a la dirección de la laminación de secciones de la aleación
comercial de aluminio 3003 de temple H14 sometidas a diferentes
condiciones de temperatura y medios de enfriamiento: a) en estado de
entrega; (b-d) T = 150 ºC/1h; (e-g) T = 200 ºC/1h; (h-j) T = 250 ºC/1h.
128
Resultados y Discusión
a
Recibida de planta
b
c
d
e
f
g
j
i
h
Enfriadas en agua fría
Enfriadas en aire
Enfriadas en horno
Figura 5.14: Micrografías ópticas mostrando las bandas de deformación del
plano normal a la dirección de la laminación de secciones de la aleación
comercial de aluminio 3003 de temple H16 sometidas a diferentes
condiciones de temperatura y medios de enfriamiento: a) en estado de
entrega; (b-d) T = 150 ºC/1h; (e-g) T = 200 ºC/1h; (h-j) T = 250 ºC/1h.
129
Resultados y Discusión
a
Recibido de planta
b
c
d
e
f
g
h
i
j
Enfriadas en agua fría
Enfriadas en aire
Enfriadas en horno
Figura 5.15: Micrografías ópticas mostrando las bandas de deformación del
plano normal a la dirección de la laminación de secciones de la aleación
comercial de aluminio 3003 de temple H18 sometidas a diferentes
condiciones de temperatura y medios de enfriamiento: a) en estado de
entrega; (b-d) T = 150 ºC/1h; (e-g) T = 200 ºC/1h; (h-j) T = 250 ºC/1h.
130
Resultados y Discusión
5.4. Efecto de los tratamientos térmicos de relajación sobre la fracción volumétrica
de partículas de segunda fase.
Como se ha estableció en la sección 5.1, las partículas de segunda fase β-Al(Fe,Mn) y αAl(Fe,Mn,Si), presentes en la aleación Al-Mn se encuentran distribuidas de manera
bastante irregular en el material, con tendencia a orientaciones preferenciales y
aglomerados. No obstante, debido a su importante rol en la conformación de micropilas
galvánicas durante el proceso de corrosión de la aleación bajo estudio, se procedió a
determinar la fracción volumétrica global (Vf)α+β de estas partículas en un área de 5.7
mm2, utilizando para ello metalografía cuantitativa por análisis de imágenes.
En este nivel de la investigación realizada y debido a la variedad de morfologías que
presentan ambas fases ( α y β) no se discriminó una fase de la otra. Sin embargo, la fase
β es considerada estable a temperatura ambiente en la aleación de colada Al-Mn,
mientras que la fase metaestable α tiene (Vf)α ≈ 5% [36]. Es por lo tanto razonable
suponer que cualquier variación, aunque pequeña, en la (Vf)α+β de las partículas como
resultado de los tratamientos térmicos de relajación (TTR), debe resultar de la
transformación β-Al6(FeMn) → α-Al12(FeMn)3Si, sobre todo si se tiene en cuenta el
elevado coeficiente de difusión D0 del Si en Al sólido, comparado con el de Fe y el de
Mn en el mismo metal. Por otra parte, aunque la mayor transformación β → α tiene
lugar entre 400 y 500 ºC, estudios por calorimetría diferencial de barrido (DSC)
evidencian la presencia de cambios exotérmicos e incrementos en la conductividad entre
131
Resultados y Discusión
100 y 250 ºC como resultado de transformación de fase β → α en la aleación Al-Mn.
[127].
Como puede apreciarse en la secuencia de Figuras 5.16-18 y 5.19-21, la fracción
volumétrica (Vf)α+β se incrementa levemente para todas las temperaturas de relajación
utilizadas (150 ºC, 200 ºC y 250 ºC), independientemente del medio de enfriamiento (en
agua, aire y horno) y los temples ensayados (H14, H16 y H18).
En el caso de las Figuras 5.16, 5.17 y 5.18 donde se grafica (Vf)α+β como función de la
temperatura y se contrastan los medios de enfriamiento, los resultados obtenidos para
cada temperatura están todos por encima del valor (Vf)α+β para la muestra sin
tratamiento (línea punteada) con una tendencia hacia el incremento de (Vf)α+β con la
temperatura de relajación utilizada, como era de esperarse en un proceso térmicamente
activado.
En las Figuras 5.19, 5.20 y 5.21 se grafica la fracción volumétrica (Vf)α+β para cada
temperatura de recuperación, en función de los temples y los medios de enfriamiento
utilizados. Se aprecia que como en el grupo de figuras anteriores, los valores obtenidos
para (Vf)α+β como resultado de los TTR están por encima de los valores de la muestra
sin tratamiento térmico de cada temple, lo cual sugiere un efecto definitivo de las
temperaturas de relajación sobre la transformación de fases β-Al6(FeMn) → αAl12(FeMn)3Si en cada uno de los temples de interés.
132
Resultados y Discusión
Por otra parte se observa en estas mismas figuras (Figuras 5.19, 5.20 y 5.21) el efecto
del medio de enfriamiento, apreciándose que los valores para las fracciones volumétricas
varían en la relación [(Vf)α+β]EH > [(Vf)α+β]EA > [(Vf)α+β]EQ, lo cual está de acuerdo con
la idea de la trasformación β → α entre 100-250 ºC sobre un proceso de difusión que,
además de depender de la temperatura, también depende del tiempo que permanece la
muestra a temperaturas por encima del ambiente. (EH = enfriada en horno; EA =
enfriada en aire; EQ = enfriada en agua fría)
En resumen, los resultados de la metalografía cuantitativa indican que, [(Vf)α+β]TTR >
[(Vf)α+β]ST evidenciando que, como se esperaba, los TTR no modificaron de manera
apreciable las propiedades mecánicas del material como se explicó anteriormente, (uno
de los objetivos de esta investigación), pero sin embargo produjeron un incremento
mesurable en la fracción volumétrica (Vf)α de la fase metaestable α-Al12(FeMn)3Si, lo
cual debe incidir sobre el comportamiento de la aleación Al-Mn frente a la corrosión por
picadura en medio ambiente salino.
133
Resultados y Discusión
6
TEMPLE H14
Fracción Volumétrica, (Vf)α + β,%
5
4
3
2
1
0
ST
0
50
100
150
200
250
300
TRATAMIENTOS TÉRMICOS
ENFRIADA EN AGUA
ENFRIADA EN AIRE
ENFRIADA EN HORNO
SIN TRATAMIENTO
Figura 5.16: Fracción Volumétrica de las partículas (α+β) en función
de la temperatura de relajación para el Temple H14.
6
TEMPLE H16
Fracción Volumétrica. (Vf)α + β, %
5
4
3
2
1
0
0
ST
50
100
150
200
250
300
TRATAMIENTOS TÉRMICOS
ENFRIADA EN AGUA
ENFRIADA EN HORNO
ENFRIADA EN AIRE
SIN TRATAMIENTO
Figura 5.17: Fracción Volumétrica de las partículas (α+β) en función
de la temperatura de relajación para el Temple H16.
134
Resultados y Discusión
6
TEMPLE H18
Fracción Volumétrica, (Vf)α + β, %
5
4
3
2
1
0
0
ST
50
100
150
200
250
300
TRATAMIENTOS TÉRMICOS
ENFRIADA EN AGUA
ENFRIADA EN HORNO
ENFRIADA EN AIRE
SIN TRATAMIENTO
Figura 5.18: Fracción Volumétrica de las partículas (α+β) en
función de la temperatura de relajación para el Temple H18.
6
T = 150 ºC
Fracción Volumétrica, (Vf)α + β, %
5
4
3
2
1
0
13
H14
14
15
H16
16
17
H18
18
TEMPLES
SIN TRATAMIENTO
ENFRIADA EN AGUA
ENFRIADA EN AIRE
ENFRIADA EN HORNO
Figura 5.19: Fracción Volumétrica de las partículas (α+β) en
función de los temples. T = 150 ºC.
135
19
Resultados y Discusión
6
T = 200 ºC
Fracción Volumétrica, (Vf)α + β, %
5
4
3
2
1
0
13
H14
14
15
H16
16
17
18
H18
19
TEMPLES
SIN TRATAMIENTO
ENFRIADA EN AGUA
ENFRIADA EN AIRE
ENFRIADA EN HORNO
Figura 5.20: Fracción Volumétrica de las partículas (α+β) en
función de los Temples. T = 200 ºC.
6
T = 250 ºC
Fracción Volumétrica (Vf)α + β, %
5
4
3
2
1
0
13
14
H14
15
16
H16
17
H18
18
TEMPLES
SIN TRATAMIENTO
ENFRIADA EN AIRE
ENFRIADA EN AGUA
ENFRIADA EN HORNO
Figura 5.21: Fracción Volumétrica de las partículas (α+β) en
función de los temples. T = 250 ºC.
136
19
Resultados y Discusión
5.5. Caracterización de la aleación Al-Mn después del proceso de corrosión
5.5.1. Observaciones Generales
Las Figura 5.22a y 5.22b muestran macrografías tomadas de probetas de la aleación AA
3003 antes y después someterlas al ensayo de niebla salina por 288 horas,
respectivamente. En la Figura 5.22a se aprecia el pulido realizado en la superficie de las
probetas previo a los ensayos de corrosión, el cual se hizo con el fin de mantener el
mismo acabado superficial en las probetas. De la Figura 5.22b pueden hacerse varias
observaciones con respecto a la corrosión de la aleación: bajo las condiciones
experimentales el aluminio se cubrió completamente de una capa de corrosión de color
gris oscuro, perdiendo su apariencia lustrosa como puede apreciarse en la Figura 5.22b.
Adicionalmente, se formaron apreciables manchas blancas a lo largo de la superficie, las
cuales siguieron la trayectoria vertical del movimiento de la solución salina. Estas zonas
blancas fueron más extensas en los bordes de la placa (Figura 5.22b), por lo cual se
asumen que están constituidas por residuos salinos.
a
b
Figura 5.22: Fotografía de una probeta de la AA3003 (a) antes y (b) después
de exponerla al rocío salino.
137
Resultados y Discusión
Bajo el microscopio electrónico de barrido esta capa de corrosión no es totalmente
homogénea. En ciertas zonas se observa resquebrajamiento de la película de óxido, lo
cual pudiera esta asociado con el mecanismo de penetración de los iones cloruros en la
superficie desprotegida del material. Este resquebrajamiento se presentó en forma de
laminillas (Figura 5.23a) y en algunos casos se presentaron orificios de diversos tamaños
semejantes al de la Figura (Figura 5.23b), el cual tiene un diámetro de aproximadamente
50 micras. Por otra parte, la superficie de las muestras sometidas al proceso de corrosión
muestran, a escala macro, aglomerados de pequeños volúmenes de productos blancos,
presumiblemente compuestos de cloruro de sodio u óxido de aluminio hidratado [128]
(Figura 5.23c). En terminos generales, las superficies de todas las probetas después del
ataque corrosivo presentaron apariencias similares independientemente de su estado (en
condición de recibidas de planta y recocidas a las temperaturas de 150, 200 y 250 ºC
seguidas por los diferentes medios de enfriamiento: en agua fría, aire y horno) y del
tiempo de exposición (72, 144, 216, 288 y 360 horas).
138
Resultados y Discusión
a
b
c
Figura 5.23: Micrografías por MEB mostrando: (a) resquebrajamiento
de la capa de corrosión; (b) resquebrajamiento y presencia de
orificios; (c) aglomerado de productos de color blanco.
139
Resultados y Discusión
5.5.2. Evaluación de las picaduras por interferometría óptica
La susceptibilidad a la corrosión por picadura de la AA 3003 fue evaluada mediante la
determinación del factor de picadura (Fp), el cual se expresa por medio de la relación
existente entre la máxima profundidad de las picaduras [(Pp)máxima] y el promedio de la
profundidad de las picaduras (Pp)promedio, tal que : Fp = [(Pp)máxima] / (Pp)promedio. Un
factor Fp mayor de 1 representa ataque localizado severo de acuerdo con la norma
ASTM G-46.
Con el fin de obtener medidas cuantitativas precisas de las profundidades de las
picaduras se utilizó la interferometría óptica (microscopía de interferencia de luz
blanca). Como se mencionó en el capitulo 3 esta técnica proporciona suficiente
resolución lateral y una alta resolución vertical (1 nm), proporcionando un análisis
cuantitativo completo a través de la generación de perfiles en 2 y 3D del área en estudio.
Los perfiles tridimensionales permiten obtener información adicional de la rugosidad de
la superficie y del contorno y morfología de las picaduras.
En la Figura 5.24 (a-d) se ilustra la secuencia del análisis utilizado para adquirir las
medidas. La Figura 5.24a es un perfil bidimensional de máximo contraste que acentúa
las características superficiales del área en observación que se muestra en la Figura
5.24b. La escala de colores ubicada a la derecha de la Figura 5.24a indica las distintas
profundidades de las picaduras, mientras que el triángulo resalta la ubicación de la
picadura mas profunda. Los valores obtenidos se presentan en la ventana ubicada debajo
del perfil de la Figura 5.24a. En este caso el parámetro “Valley” proporciona el tamaño
140
Resultados y Discusión
de la picadura más profunda del campo analizado, siendo esta picadura de 18.256
micras. La barra horizontal que se observa en la Figura 5.24a se usa en conjunto con el
perfil de la Figura 5.24c, el cual presenta una sección transversal de la superficie en la
dirección X, a la vez que indica la altura de las picaduras. La opción de poder desplazar
esta barra a lo largo del perfil permite obtener una sección transversal de cualquier
posición de la superficie analizada. Del perfil de la Figura 5.24c se puede determinar con
exactitud el diámetro o el ancho de la picadura, presentando esta picadura 0.40 mm de
ancho. La Figura 5.24d es un perfil en 3D de la superficie de la Figura 5.24b, el cual
exhibe la rugosidad (rms = 3.759 micras) de la superficie y el contorno irregular de la
picadura presente.
141
Resultados y Discusión
a
b
c
d
Figura 5.24: Perfiles de superficie generados por el software del
Interferómetro Óptico utilizados en la caracterización de las superficies
corroídas de la AA3003
5.5.3. Medidas de los valores promedio de la profundidad de las picaduras
(Pp)promedio
Para evaluar la posible influencia de los tratamientos térmicos de relajación sobre el
comportamiento de la aleación 3003 frente al medio salino se analizaron probetas con
las siguientes condiciones: (a) recibida de planta, (b) recocidas por una hora a las
temperaturas de 150 y 200 ºC enfriadas en agua fría y (c) recocidas por una hora a la
temperatura de 250 ºC enfriadas en agua fría, enfriadas en aire y horno, las cuales fueron
142
Resultados y Discusión
expuestas al rocío salino por 72, 144, 216, 288 y 360 horas; teniendo presente que para
cada condición de temperatura-medio de enfriamiento-tiempo de exposición se utilizó
una probeta. Del análisis realizado por interferometría óptica se determinó el valor
promedio de la profundidad de las picaduras de cada una de estas probetas.
En las Figuras 5.25 a la 5.27 se muestra la variación del promedio de la profundidad de
picaduras del conjunto de probetas sin tratar y tratadas térmicamente de los temples
H14, H16 y H18, respectivamente. Como puede apreciarse en estas Figuras, los datos
obtenidos presentaron un alto grado de dispersión en todos los periodos de exposición a
la atmósfera salina. Ninguna de las condiciones temperatura-medio de enfriamiento
produjo un patrón sistemático de variación que permitiera relacionar la profundidad
promedio de las picaduras con el tiempo de exposición. En cambio se observaron
amplias fluctuaciones en ambos conjuntos de muestras, las tratadas y las no tratadas
térmicamente, lo cual puede ser atribuido al hecho de que se utilizó una probeta para
cada tiempo de exposición, como se resaltó anteriormente; de manera que debido a la
naturaleza altamente localizada del proceso de corrosión por picadura en aleaciones
comerciales de aluminio de esta serie, cada una de las probetas pudo haberse
comportado diferente frente al medio agresivo a pesar de que se utilizaron iguales
condiciones experimentales y el mismo nivel de acabado superficial. Adicionalmente, es
posible que las probetas no presentaran la misma población de heterogeneidades
superficiales
y/o
microestructurales
que
incubación/iniciación de las picaduras.
143
pudieran
actuar
como
sitios
de
Resultados y Discusión
Investigaciones anteriores han establecido que en las aleaciones de aluminio las
partículas intermetálicas de segunda fase son los sitios más propensos para la nucleación
de las picaduras en soluciones de NaCl, ya que éstas pueden actuar como singularidades
eléctricas y atraer iones cloruros durante el proceso de corrosión [76]. Por lo tanto, la
fluctuación observada en la profundidad de las picaduras pudiera estar relacionada con
diferencias en el número y distribución de los intermetálicos presentes en la superficie
promotores, en cierta forma, de sitios preferenciales para la nucleación de picaduras. La
influencia de la morfología de estas partículas pudiera explicar así mismo que en ciertas
probetas las picaduras hayan crecido más en diámetro que en profundidad,
independientemente del tiempo de exposición.
Por otra parte, aunque se obtuvieron ligeros incrementos en la fracción volumétrica de
las partículas de segunda fase como resultado de los tratamientos térmicos de relajación
(sección 5.4), el efecto sobre la profundidad promedio de las picaduras es relativamente
menor que el efecto producido por la segregación preferencial de los intermetálicos,
responsables del carácter altamente localizado observado en la corrosión por picadura en
esta aleación.
El efecto de los tratamientos térmicos de relajación (TTR) sobre la profundidad
promedio de las picaduras, no parece ser determinante para influenciar este parámetro
en el tiempo, tal como se ilustra en las Figuras 5.25-5.27, donde se aprecia que los
valores obtenidos para todos los temples y tiempos de ensayo en medio ambiente salino,
fluctúan dentro de un rango sin ningún patrón específico. Como se observa en esas
Figuras, no se obtuvieron relaciones definidas de temperatura / medio de enfriamiento
144
Resultados y Discusión
para los tres temples (H14, H16 y H18) que presentaran valores promedios de
profundidad de picaduras menores en comparación con las probetas en estado de
entrega, aunque en el caso del temple H14, por ejemplo, las probetas recocidas a las
temperaturas de 150 y 200 ºC enfriadas en agua fría, presentan en casi todos los tiempos
de exposición valores promedio de profundidad de picaduras menores, en comparación
con las probetas sin ningún tipo de tratamiento térmico (Figura 5.25). Por contraste, en
los temples H16 y H18 se presentaron las mayores fluctuaciones en los valores promedio
de la profundidad de las picaduras haciéndose difícil seleccionar condiciones de
temperatura-medio de enfriamiento que presentaran cierta tendencia de incrementar la
resistencia a la corrosión de la aleación 3003 en este medio como se aprecia en la Figura
5.26 para el temple H16 y en la Figura 5.27 para el temple H18.
Esta aleatoriedad en los valores del promedio de la profundidad de las picaduras sugiere
que las temperaturas de relajación utilizadas no son suficientemente elevadas para
introducir cambios significativos en la microestructura del material, sobre todo en
aquellos parámetros como la fracción volumétrica de partículas intermetálicas que
afecten de manera específica las propiedades de corrosión en esta aleación.
5.5.4. Distribución de la profundidad de las picaduras (Pp)
Otro de los parámetros utilizados para evaluar el comportamiento de la aleación frente a
la corrosión en medio ambiente salino, fue la variación de la profundidad de las
picaduras en el área total analizada en la probeta (4,368 mm2) por el método de
interferometría óptica. Este comportamiento se ilustra en las Figuras 5.28-5.30 en las
145
Resultados y Discusión
cuales se ha graficado, para cada tiempo de exposición al rocío salino, la distribución de
las profundidades de penetración en micras, obtenidas del conjunto de probetas de los
temples H14, H16 y H18, para los diferentes TTR y medios de enfriamiento utilizados.
Igualmente se analizaron probetas de cada temple sin TTR.
En las Figuras se aprecia claramente que en todas las probetas se presentan diversos
valores de profundidad de picaduras que van desde las 5 µm hasta las 90 µm. Por otra
parte, la máxima profundidad de picadura se encuentra casi en un rango parecido, pues
este parámetro va desde las 10 µm hasta las 90 µm. Sin embargo, no se encontró una
correlación consistente entre la temperatura de los TTR y el medio de enfriamiento y
estos valores para la máxima profundidad de picadura. Este comportamiento corrobora
la naturaleza del ataque altamente localizado el cual, como se ha discutido
anteriormente, parece ser independiente del tiempo de exposición y del temple y
depende solo de la configuración de las partículas de segunda fase presentes en cada
probeta.
En algunos ensayos se obtuvieron valores de profundidad de picadura casi constantes o
con muy leve tendencia al incremento en toda el área analizada, como es el caso de la
probeta del temple H14 recocida a 200 ºC enfriada en agua fría y expuesta al rocío salino
por 288 horas (Figura 5.28a). Este comportamiento pudiera explicarse considerando que,
tal como se discutió en la sección 5.1, la distribución de partículas en las probetas
presentó dos características resaltantes: por una parte la tendencia a formar aglomerados
y por el otro, orientación preferencial en la dirección del laminado, con ciertas áreas de
baja densidad comparativa de partículas. Esta característica microestructural es
146
Resultados y Discusión
independiente de los valores de fracción volumétrica medidos, los cuales están
relacionados con toda la probeta y caen básicamente bajo el mismo rango de valores, no
así la distribución de intermetálicos.
Estas graficas también revelan el comportamiento de las probetas tratadas térmicamente
en relación con la probeta en condición de recibida de planta para cada uno de los
tiempos de exposición. Los resultados reafirman el carácter altamente localizado en
partículas de segunda fase ya que en todos los casos ilustrados, excepto en la Figura
5.29d (Temple H16 y texposición = 288 horas) y en la Figura 5.30a (Temple H18 y texposición
= 72 horas) se encontraron condiciones en las cuales la distribución de profundidades de
picadura correspondientes a la muestra sin TTR, estaban por debajo de la distribución de
Pp para las probetas sometidas a TTR. En la mayoría de los ensayos realizados, la
distribución de los valores para la profundidad de picadura de la probeta sin TTR, ocupó
un rango intermedio en relación con las distribuciones de Pp para las muestras con TTR.
Sin embargo, nuevamente encontramos que el comportamiento observado no permite
realizar una correlación sistemática entre los valores de Pp ni el tiempo de ensayo ni con
el temple o con el medio de enfriamiento, lo cual nos lleva a considerar nuevamente el
efecto dominante de las partículas de segunda fase como causa de esta dispersión
aparentemente anómala de la profundidad de las picaduras como parámetro indicador de
la resistencia a la corrosión de la aleación comercial de aluminio CVG-ALCASA 3003.
Igual resultado, aunque no graficado, se obtiene cuando se consideran los valores para la
máxima profundidad de picadura, cuyo rango de dispersión es muy parecido al de la
147
Resultados y Discusión
distribución de los valores para Pp, con similar independencia de los parámetros de los
ensayos (Temple, temperatura y medio del TTR y tiempo de exposición).
5.5.5. Determinación del factor de picadura (Fp)
Los resultados presentados y discutidos anteriormente muestran que tanto los valores
promedios de la profundidad de las picaduras [(Pp)medio] como los de la distribución de
los valores Pp e incluso los valores para (Pp)máxima no presentaron una correlación
sistemática con los parámetros experimentales utilizados. Se argumentó que este
comportamiento es debido a la naturaleza altamente localizada de la corrosión por
picadura en la aleación utilizada, debido a una distribución no uniforme de partículas de
segunda fase.
Debido a lo anterior y al hecho de que la medición de la profundidad de las picaduras
por interferometría óptica representa un método discreto en el cual se analiza cada
picadura individualmente, se consideró conveniente utilizar un parámetro global más
representativo del comportamiento de toda la probeta frente a la corrosión. En ese
sentido se utilizó el factor de picadura (Fp) el cual fue calculado a partir de la relación
existente entre la máxima profundidad de las picaduras [(Pp)máxima] y el promedio de la
profundidad de las picaduras (Pp)promedio, tal que Fp = [(Pp)máxima] / (Pp)promedio, como se
mencionó en la sección 5.5.2.
Este Factor de picadura fue calculado para cada una de las probetas corroídas y
graficado en función del tiempo de exposición, para cada uno de los otros parámetros de
prueba (Temperatura y medio del TTR y temples) a fin de establecer el rango en el cual
148
Resultados y Discusión
se encuentra, tal como se ilustra en las Figuras 5.31, 5.32 y 5.33 correspondientes a los
temples H14, H16 y H18 respectivamente. Comparando los valores calculados para Fp
que se ilustran en las figuras anteriores, apreciamos que este Factor se encuentra en el
rango de 1-4. Se debe puntualizar que un valor de Fp > 1 indica elevado nivel de
localización de la corrosión por picadura.
Si promediamos los valores obtenidos para cada uno de los temples en función de todos
los parámetros de prueba,
resulta un factor de picadura promedio para todos los
temples, del orden de 2.5, lo cual reflejaría un mejor acuerdo con el proceso de corrosión
que sufre la aleación estudiada, independientemente del efecto particular que pudiera
tener cada parámetro en una probeta en particular, causa de la dispersión observada en
los valores asociados con la profundidad de las picaduras.
Por otra parte, el parámetro Fp puede asociarse al efecto global del factor determinante
de la corrosión por picadura en la aleación que, como hemos establecido, está
relacionado con la presencia y naturaleza de las partículas de segunda fase presentes en
la aleación. Finalmente, el factor de picadura promedio Fp ≈ 2.5 esta de acuerdo con el
valor reportado para el aluminio [129].
149
Resultados y Discusión
35
PROMEDIO PROFUNDIDAD DE PICADURAS, µm
TEMPLE H14
30
25
20
15
10
5
0
0
72
144
216
288
360
432
TIEMPO DE EXPOSICIÓN (Horas)
Sin Tratamiento
T = 250 ºC. E = Agua
T = 150 ºC. E = Agua
T = 250 ºC. E = Aire
T = 200 ºC. E = Agua
T = 250 ºC. E = Horno
Figura 5.25: Comportamiento de los valores promedio de profundidad de
picaduras con respecto al tiempo de exposición del grupo de probetas de
la aleación 3003 de temple H14.
35
PROMEDIO PROFUNDIDAD DE PICADURAS, µm
TEMPLE H16
30
25
20
15
10
5
0
0
72
144
216
288
360
432
TIEMPO DE EXPOSICIÓN (Horas)
Sin Tratamiento
T = 250 ºC. E = Agua
T = 150 ºC. E = Agua
T = 250 ºC. E = Aire
T = 200 ºC. E = Agua
T = 250 ºC. E = Horno
Figura 5.26: Comportamiento de los valores promedio de
profundidad de picaduras con respecto al tiempo de exposición del
grupo de probetas de la aleación 3003 de temple H16.
150
Resultados y Discusión
35
PROMEDIO PROFUNDIDAD DE PICADURAS, µm
TEMPLE H18
30
25
20
15
10
5
0
0
72
144
216
288
360
432
TIEMPO DE EXPOSICIÓN (Horas)
Sin Tratamiento
T = 250 ºC. E = Agua
T = 150 ºC. E = Agua
T = 250 ºC. E = Aire
T = 200 ºC. E = Agua
T = 250 ºC. E = Horno
Figura 5.27: Comportamiento de los valores promedio de profundidad
de picaduras con respecto al tiempo de exposición del grupo de
probetas de la aleación 3003 de temple H18.
151
Resultados y Discusión
Profundidad de Picaduras (Pp), µm
80
TEMPLE H14
72 HORAS
70
(a)
60
50
40
30
20
10
0
0
Distribución de Pp en los campos analizados
(Area Total = 4,368 mm2)
1
2
3
Sin Tratamiento
T = 250 ºC. E = Agua
4
5
T = 150 ºC. E = Agua
T = 250 ºC. E = Aire
6
7
T = 200 ºC. E = Agua
T = 250 ºC. E = Horno
Profundidad de Picaduras (Pp), µm
80
(b)
TEMPLE H14
144 HORAS
70
60
50
40
30
20
10
0
0
Distribución de Pp en los campos analizados
(Area Total = 4,368 mm2)
1
2
3
Sin Tratamientol
T = 250 ºC. E = Agua
4
5
T = 150 ºC. E = Agua
T = 250 ºC. E = Aire
6
7
T = 200 ºC. E = Agua
T = 250 ºC. E = Horno
Profundidad de Picadura (Pp), µm
100
90
(c)
TEMPLE H14
216 HORAS
80
70
60
50
40
30
20
10
0
0
1
Distribución de Pp en los campos analizados
(Area Total = 4.368 mm2)
2
Sin Tratamiento
T = 250 ºC. E = Agua
3
4
T = 150 ºC. E = Agua
T = 250 ºC. E = Aire
5
6
7
T = 200 ºC. E = Agua
T = 250 ºC. E = Horno
Figura 5.28. Distribución de la profundidad de las picaduras de
probetas del temple H14 expuestas al rocío salino por: (a) 72, (b)
144 y (c) 216 horas.
152
Resultados y Discusión
Profundidad de picadura (Pp), µm
80
(d)
TEMPLE H14
288 HORAS
70
60
50
40
30
20
10
0
0
1
Distribución de Pp en los campos analizados
(Area Total = 4,368 mm2)
2
Sin Tratamiento
T = 250 ºC. E = Agua
3
4
5
T = 150 ºC. E = Agua
T = 250 ºC. E = Aire
6
7
T = 200 ºC. E = Agua
T = 250 ºC. E = Horno
Profunididad de Picadura (Pp), µm
80
(e)
TEMPLE H14
360 HORAS
70
60
50
40
30
20
10
0
0
1
Distribución de Pp en los campos analizados
(Area Total = 4368 mm2)
2
Sin Tratamiento
T = 250 ºC. E = Agua
3
4
T = 150 ºC. E = Agua
T = 250 ºC. E = Aire
5
6
T = 200 ºC. E = Agua
T = 250 ºC. E = Horno
Figura 5.28. Distribución de la profundidad de las picaduras de
probetas del temple H14 expuestas al rocío salino por: (d) 288 y
(e) 360 horas.
153
7
Resultados y Discusión
Profundidad de picadura (Pp), µm
80
(a)
TEMPLE H16
72 HORAS
70
60
50
40
30
20
10
0
0
1
Distribución de Pp en los campos analizados
(Area Total = 4,368 mm2)
2
3
Sin Tratamiento
T = 250 ºC. E = Agua
4
5
T = 150 ºC. E = Agua
T = 250 ºC. E = Aire
6
7
T = 200 ºC. E = Agua
T = 250 ºC. E = Horno
Profundidad de picadura (Pp), µm
80
(b)
TEMPLE H16
144 HORAS
70
60
50
40
30
20
10
0
0
Distribución de Pp en los campos analizados
(Area Total = 4,368 mm2)
1
2
3
Sin Tratamiento
T = 250 ºC. E = Agua
4
5
T = 150 ºC. E = Agua
T = 250 ºC. E = Aire
6
7
8
T = 200 ºC. E = Agua
T = 250 ºC. E = Horno
Profundidad de picadura (Pp), µm
80
(c)
TEMPLE H16
216 HORAS
70
60
50
40
30
20
10
0
0
1
Distribución de Pp en los campos analizados
(Area Total = 4,368 mm2)
2
Sin Tratamiento
T = 250 ºC. E = Agua
3
4
T = 150 ºC. E = Agua
T = 250 ºC. E = Aire
5
6
7
T = 200 ºC. E = Agua
T = 250 ºC. E = Horno
Figura 5.29. Distribución de la profundidad de las picaduras de
probetas del temple H16 expuestas al rocío salino por: (a) 72, (b)
144 y (c) 216 horas.
154
Resultados y Discusión
Profundidad de picadura (Pp), µm
80
(d)
TEMPLE H16
288 HORAS
70
60
50
40
30
20
10
0
0
1
Distribución de Pp en los campos analizados
(Area Total = 4,368 mm2)
2
Sin Tratamiento
T = 250 ºC. E = Agua
3
4
T = 150 ºC. E = Agua
T = 250 ºC. E = Aire
5
6
7
T = 200 ºC. E = Agua
T = 250 ºC. E = Horno
Profundidad de picadura (Pp), µm
100
(e)
TEMPLE H16
360 HORAS
90
80
70
60
50
40
30
20
10
0
0
1
Distribución de Pp en los campos analizados
(Area Total = 4,368 mm2)
2
Sin Tratamiento
T = 250 ºC. E = Agua
3
4
T = 150 ºC. E = Agua
T = 250 ºC. E = Aire
5
6
T = 200 ºC. E = Agua
T = 250 ºC. E = Horno
Figura 5.29. Distribución de la profundidad de las picaduras de
probetas del temple H16 expuestas al rocío salino por: (d) 288 y (e)
360 horas.
155
7
Resultados y Discusión
Profundidad de picadura (Pp), µm
80
(a)
TEMPLE H18
72 HORAS
70
60
50
40
30
20
10
0
0
1
Distribución de Pp en los campos analizados
(Area Total = 4,368 mm2)
2
Sin Tratamiento
T = 250 ºC. E = Agua
3
4
5
T = 150 ºC. E = Agua
T = 250 ºC. E = Aire
6
7
T = 200 ºC. E = Agua
T = 250 ºC. E = Horno
Profundidad de picadura (Pp), µm
80
(b)
TEMPLE H18
144 HORAS
70
60
50
40
30
20
10
0
0
1
Distribución de Pp en los campos analizados
(Area Total = 4,368 mm2)
2
Sin Tratamiento
T = 250 ºC. E = Agua
3
4
T = 150 ºC. E = Agua
T = 250 ºC. E = Aire
5
6
7
T = 200 ºC. E = Agua
T = 250 ºC. E = Horno
Profundidad de picadura (Pp), µm
80
(c)
TEMPLE H18
216 HORAS
70
60
50
40
30
20
10
0
0
1
Distribución de Pp en los campos analizados
(Area Total = 4,368 mm2)
2
Sin Tratamiento
T = 250 ºC. E = Agua
3
4
T = 150 ºC. E = Agua
T = 250 ºC. E = Aire
5
6
7
T = 200 ºC. E = Agua
T = 250 ºC. E = Horno
Figura 5.30. Distribución de la profundidad de las picaduras en el
área analizada de probetas del temple H18 expuestas al rocío
salino por: (a) 72, (b) 144 y (c) 216 horas.
156
Resultados y Discusión
Profundidad de picadura (Pp), µm
80
(d)
TEMPLE H18
288 HORAS
70
60
50
40
30
20
10
0
0
1
Distribución de Pp en los campos analizados (
Area Total = 4,368 mm2)
2
Sin Tratamiento
T = 250 ºC. E = Agua
3
4
5
T = 150 ºC. E = Agua
T = 250 ºC. E = Aire
6
7
T = 200 ºC. E = Agua
T = 250 ºC. E = Horno
Profundidad de picadura (Pp), µm
80
(e)
TEMPLE H18
360 HORAS
70
60
50
40
30
20
10
0
0
1
Distribución de Pp en los campos analizados
(Area Total = 4,368 mm2)
2
Sin Tratamiento
T = 250 ºC. E = Agua
3
4
T = 150 ºC. E = Agua
T = 250 ºC. E = Aire
5
6
T = 200 ºC. E = Agua
T = 250 ºC. E = Horno
Figura 5.30. Distribución de la profundidad de las picaduras en el
área analizada de probetas del temple H18 expuestas al rocío
salino por: (d) 288 y (e) 360 horas.
157
7
Resultados y Discusión
4,5
TEMPLE H14
4
FACTOR DE PICADURA
3,5
3
2,5
2
1,5
1
0,5
0
0
72
144
216
288
TIEMPO DE EXPOSICIÓN (Horas)
Sin Tratamiento
T = 250 ºC. E = Agua
T = 150 ºC. E = Agua
T = 250 ºC. E = Aire
360
432
T = 200 ºC. E = Agua
T = 250 ºC. E = Horno
Figura 5.31: Comportamiento del factor de picaduras con respecto
al tiempo de exposición del grupo de probetas de la aleación 3003
de temple H14.
4,5
TEMPLE H16
4
FACTOR DE PICADURAS
3,5
3
2,5
2
1,5
1
0,5
0
0
72
144
216
288
360
TIEMPO DE EXPOSICIÓN (Horas)
Sin Tratamiento
T = 250 ºC. E = Agua
T = 150 ºC. E = Agua
T = 250 ºC. E = Aire
T = 200 ºC. E = Agua
T = 250 ºC. E = Horno
Figura 5.32: Comportamiento del factor de picaduras con respecto
al tiempo de exposición del grupo de probetas de la aleación 3003
de temple H16.
158
432
Resultados y Discusión
4,5
TEMPLE H18
4
FACTOR DE PICADURA
3,5
3
2,5
2
1,5
1
0,5
0
0
72
144
216
288
360
TIEMPO DE EXPOSICIÓN (Horas)
Sin Tratamiento
T = 250 ºC. E = Agua
T = 150 ºC. E = Agua
T = 250 ºC. E = Aire
T = 200 ºC. E = Agua
T = 250 ºC. E = Horno
Figura 5.33: Comportamiento del factor de picaduras con respecto
al tiempo de exposición del grupo de probetas de la aleación 3003
de temple H18.
159
432
Resultados y Discusión
5.5.6. Morfología de las picaduras
Debido a la naturaleza de la presente investigación en la cual se realizó un análisis que
permitió el estudio de los parámetros individuales relacionados con las picaduras en
cada probeta, se consideró importante complementar las medidas anteriores con un
estudio detallado de la morfología lineal (1D), bi-dimensional (2D) y tri-dimensional
(3D) de las picaduras, independientemente de los parámetros de prueba.
En la Figura 5.34a se muestra una micrografía obtenida por microscopía óptica de la
superficie típica de las probetas corroídas, en la cual se observa la elevada densidad de
pequeñas picaduras que se formaron y cubrieron toda el área de las superficies de las
probetas. En ciertas zonas de las superficies donde el ataque fue más severo, se
observaron picaduras de mayor diámetro y profundidad con formas irregulares, llegando
alcanzar valores por encima de 700 µm como puede apreciarse en las Figuras 5.34 (b-d)
donde se muestran picaduras con diámetros entre 200 y 700 µm.
160
Resultados y Discusión
b
a
200x
100
c
d
100
200
Figura 5.34 (a-d): Micrografías ópticas mostrando: (a) la morfología del
ataque producido sobre la superficie de la aleación 3003, (b) picadura
de ~200 µm de longitud, (c) picadura de ~700 µm de longitud y (d)
picadura de ~400 µm de longitud.
La microscopía óptica permite visualizar la morfología de las picaduras, sin embargo no
es capaz de proporcionar información de la forma de crecimiento de las picaduras. En
consecuencia, se escogió la interferometría óptica debido a que esta técnica ofrece la
posibilidad de obtener gráficos y perfiles en 1D, así como en 2D y 3D que permiten
resaltar las características más relevantes de las superficies corroídas así como obtener
una sección transversal de la picadura que refleje su forma de crecimiento. Igualmente
se utilizó la microscopía electrónica de barrido (MEB) para comparar cualitativamente
161
Resultados y Discusión
las características superficiales con aquellas mostradas por los perfiles obtenidos por
interferometría óptica.
La Figura 5.35 muestra perfiles en 2 y 3 dimensiones de la superficie corroída donde se
resalta la alta rugosidad ocasionada en la superficie por las picaduras, mientras que la
Figura 5.36 es un micrografía por MEB tomada a baja magnificación, en la cual se
detallan con mas precisión las picaduras y su distribución en la superficie de la muestra.
Figura 5.35: Perfiles de Interferometría Óptica mostrando los detalles
topográficos típicos de la superficie de la aleación 3003 después de expuesta
al rocío salino.
Figura 5.36: Micrografía por MEB mostrando la morfología
de la corrosión de la aleación 3003.
162
Resultados y Discusión
De acuerdo con la literatura las picaduras crecen y se desarrollan por debajo de la
superficie en distintas formas, las cuales han sido clasificadas en seis categorías, y
recopiladas en la norma ASTM G46 como se ilustran en la Figura 5.37.
.
Figura 5.37. Formas de secciones transversales de picaduras
según norma ASTM G 46.
Las Figuras 5.38-42 corresponden a una serie de perfiles obtenidos por interferometría
óptica de ejemplos de algunas de las más importantes formas de picaduras encontradas
en probetas de los temples H14, H16 y H18, para los diferentes TTR y medios de
enfriamiento utilizados, cuyas formas de crecimiento se asemejan a las de la Figura 5.37.
163
Resultados y Discusión
En la Figura 5.38 se muestra los perfiles de una picadura de 32.998 micras de
profundidad y de aproximadamente 0.12 mm de diámetro rodeada de pequeñas e
individuales picaduras. El perfil transversal de la picadura la clasifica como una picadura
angosta y profunda (Figura 5.37 a). La picadura de la Figura 5.39 es una picadura más
profunda (56.19 micras) de mayor diámetro (~0.24 mm) e irregular, su forma de
crecimiento se cataloga como elíptica de acuerdo con la Figura 5.37 b. También se
observaron picaduras más extensas y menos profundas como la que se presenta en la
Figura 5.40 cuya profundidad es de 12.27 micras; este tipo de picaduras presenta un
perfil bastante ancho semejante al de la Figura 5.37c. Igualmente se identificaron,
aunque en menor población, picaduras del tipo c (Figura 5.37c) y picaduras de secciones
transversales verticales (Figura 5.37f) como se aprecia en las Figuras 5.41 y 5.42,
respectivamente.
164
165
(d)
(b)
Figura 5.38. Análisis por interferometría óptica de una picadura de sección transversal tipo a (angosta
y profunda): (a) perfil de la superficie donde se encuentra ubicada la picadura, (b) perfil de máximo
contraste resaltando las características de la superficie, (c) perfil tridimensional donde se detalla la
morfología de la picadura y (d) perfil de la sección transversal de la picadura.
(c)
(a)
Resultados y Discusión
166
(d)
(b)
Figura 5.39. Análisis por interferometría óptica de una picadura de sección transversal tipo b
(elíptica y profunda): (a) perfil de la superficie donde se encuentra ubicada la picadura, (b) perfil de
máximo contraste resaltando las características de la superficie, (c) perfil tridimensional donde se
detalla la morfología de la picadura y (d) perfil de la sección transversal de la picadura.
(c)
(a)
Resultados y Discusión
167
(d)
(b)
Figura 5.40. Análisis por interferometría óptica de una picadura de sección transversal tipo c (ancha y
superficial): (a) perfil de la superficie donde se encuentra ubicada la picadura, (b) perfil de máximo contraste
resaltando las características de la superficie, (c) perfil tridimensional donde se detalla la morfología de la
picadura y (d) perfil de la sección transversal de la picadura.
(c)
(a)
Resultados y Discusión
168
(d)
(b)
Figura 5.41. Análisis por interferometría óptica de una picadura de sección transversal tipo e (socavada):
(a) perfil de la superficie donde se encuentra ubicada la picadura, (b) perfil de máximo contraste
resaltando las características de la superficie, (c) perfil tridimensional donde se detalla la morfología de
la picadura y (d) perfil de la sección transversal de la picadura.
(c)
(a)
Resultados y Discusión
169
(b)
(d)
Figura 5.42. Análisis por interferometría óptica de una picadura de sección transversal tipo f (orientación
microestructural vertical): (a) perfil de la superficie donde se encuentra ubicada la picadura, (b) perfil de
máximo contraste resaltando las características de la superficie, (c) perfil tridimensional donde se detalla
la morfología de la picadura y (d) perfil de la sección transversal de la picadura.
(c)
(a)
Resultados y Discusión
Resultados y Discusión
La Figura 5.43(a-d) muestra una micrografía electrónica de barrido y perfiles de
interferometría óptica de una de las formas de picaduras más predominantes en las
superficies corroídas. Estas picaduras de forma redonda presentaron secciones
transversales elípticas (Figura 5.43d) y diferentes profundidades llegando alcanzar los 50
micrones (Figura 5.43c). En la micrografía por MEB (Figura 5.43a) también se observó
el deterioro ocurrido en la matriz de aluminio debido al proceso de corrosión. La
comparación de estas dos técnicas permite apreciar que mientras que la interferometría
provee valores precisos de las dimensiones de la picadura, la MEB ofrece detalles
morfológicos que hacen posible obtener mayores detalles microestructurales de la
picadura.
(b)
(a)
(c)
(d)
Figura 5.43. Micrografía por MEB y perfiles por interferometría óptica de una de
las picaduras de forma redonda encontradas en las superficies corroídas: (a)
Micrografía por MEB, (b) perfil bidimensional de la picadura, (c) perfil en 3D de
la picadura y (c) perfil mostrando la sección transversal elíptica de la picadura.
170
Resultados y Discusión
Además de este tipo de picaduras también se observaron picaduras más irregulares,
como las que se presentan en la Figura 5.44(a-d), algunas de ellas menos extensas
promovidas quizás por el efecto del pulido o por la forma de la partícula de segunda fase
que favoreció su formación durante el proceso de corrosión (Figura 5.44d).
a
b
c
d
Figura 5.44: Perfiles de Interferometría Óptica de picaduras de formas
irregulares encontradas en la superficie de la aleación 3003.
171
Resultados y Discusión
Las Figuras 5.45 (a-b) y 5.46 (a-b) muestran ejemplos de lo que aparenta ser
coalescencia de picaduras. En las Figuras 5.45 a y 5.46 a se observa como el crecimiento
de picaduras comienza a consumir dos o mas pequeñas picaduras y su volumen
incrementa como se observa en las Figuras 5.45 b y 5.46 b.
a
b
Figura 5.45 (a-b): Perfiles de Interferometría Óptica mostrando la formación
de cavidades redondeadas por coalescencia de pequeñas picaduras.
172
Resultados y Discusión
a
b
Figura 5.46 (a-b): Perfiles de Interferometría Óptica mostrando la formación
de cavidades alargadas por coalescencia de pequeñas picaduras.
Otra de las características morfológicas observadas en los tres temples la constituyó la
presencia de picaduras en forma de canales relativamente superficiales (entre 6 y 12
micras) como los que se presentan en las Figuras 5.47 (a-c), los cuales parecieran
resultar de la nucleación de picaduras en partículas de segunda fase de composición,
morfología y tamaños semejantes que se encuentran dispuestas en hileras en la
superficie del material. Esta forma de picaduras se observó particularmente en las
probetas del temple H18, lo cual pudiera explicarse por ser éstas las muestras que han
sufrido el mayor trabajo mecánico por deformación.
173
Resultados y Discusión
a
b
c
Figura 5.47: Perfiles de Interferometría Óptica de picaduras en forma de canales.
La Figura 5.48 (a-c) es una micrografía por MEB que ilustra una picadura de forma muy
irregular de aproximadamente 100 µm de longitud, la cual de acuerdo con trabajos
anteriores [9], presenta cierta tendencia a crecer siguiendo ciertos planos cristalográficos
como se observa en las terrazas que pueden apreciarse en la Figura 5.48c. Este modelo
174
Resultados y Discusión
de picaduras ha sido descrito como túneles cristalográficos microscópicos formados al
azar sobre las paredes de la picadura, los cuales penetran completamente el metal
conduciendo a la formación de picaduras hemisféricas [10]. La ocurrencia y tamaño de
los túneles durante la corrosión del aluminio en medio ambiente salino, parece depender
de la concentración local de cloro y del potencial del crecimiento de la picadura [10].
a
b
c
Figura 5.48 (a-c): Micrografías por MEB de una
picadura de aproximadamente 100 µm de longitud, (c)
detalle del interior de la picadura.
175
Resultados y Discusión
5.5.7. Corrosión localizada asistida por partículas de segunda fase en la AA
El rol de los intermetálicos en el comportamiento de las aleaciones de aluminio en
medio ambiente salino ha sido planteado por varios autores, los cuales han establecido
que la nucleación de la picadura es afectada frecuentemente por la población, tipo y
tamaño de las partículas intermetálicas presentes en las aleaciones de aluminio [1920,75-76].
Con el fin de corroborar estos resultados y, habiendo considerado el efecto de las
partículas de segunda fase presentes en la aleación como la causa fundamental de la
dispersión de los valores experimentales obtenidos en las secciones 5.1 – 5.5, se realizó
un análisis detallado combinando la microscopía electrónica de barrido y el
microanálisis de rayos-X por dispersión de energía (MEB/EDX) en probetas de aluminio
recibidas de planta sin TTR y sometidas al TTR, después de removerlas del rocío salino.
Los resultados permitieron establecer que para cualquier tiempo de exposición las
probetas estuvieron afectadas de corrosión por picaduras, las cuales se encontraron
relacionadas con las partículas de segunda fase presentes en la aleación, tal como se
muestra en la Figura 5.49. Esta partículas habían sido previamente caracterizadas como
intermetálicos constituidos de Al-Fe-Mn-Si (fase α) y Al-Fe-Mn (fase β) como se
estableció en la sección 5.1.
El análisis por MEB/EDX realizado en forma aleatoria en partículas asociadas con las
picaduras, mostró que los dos tipos de partículas presentes en la aleación de aluminio
3003, no parecen tener el mismo comportamiento frente a la corrosión. La fase α-(Al176
Resultados y Discusión
Fe-Mn-Si) es más noble que la matriz de aluminio y puede actuar como cátodo activo
conduciendo a la alcalinización interfacial entre la matriz y la partícula con evidente
iniciación de picadura en la zona donde la partícula se encuentra localizada, tal como se
ilustra en las micrografías por MEB de las Figuras 5.50 y 5.51. En la parte b de ambas
figuras se presenta un espectrograma de dispersión de energía que evidencia la
composición elemental de estas partículas, corroborando que en efecto son
intermetálicos Al-Fe-Mn-Si.
En el proceso de corrosión altamente localizada asistida por partículas de segunda fase
de naturaleza catódica con respecto a la matriz, la picadura se forma alrededor de la
partícula hasta que el orificio es demasiado grande y la partícula se desprende del
mismo, pero la picadura continua ya que la matriz metálica que forma el borde de la
misma, sigue actuando como cátodo.
En la Figura 5.52 se ilustra la presencia de un grupo de pequeñas partículas de la fase α,
las cuales pueden provenir bien sea de la fractura de una partícula de mayor tamaño o
ser ellas misma partículas segregadas en cierta zona de la muestra, generando un
microcátodo que induce la nucleación y crecimiento de la picadura por el mecanismo
explicado anteriormente.
Un segundo tipo de proceso de corrosión se produce en la zona de influencia de las
partículas de segunda fase constituidas por intermetálicos Al-Fe-Mn. (partículas β). En
este caso, la presencia de la partícula induce corrosión por picadura mediante un ataque
por disolución selectiva de la matriz que rodea las partículas, como se observa en la
177
Resultados y Discusión
Figura 5.53. La picadura comienza en la interfase y se propaga desde la partícula hacia
la matriz. Esto evidencia que las partículas Al-Fe-Mn son regiones catódicas efectivas y
pueden conducir reacciones de corrosión en la matriz. Como en el caso anterior, en la
Figura 5.53b se presenta un espectrograma de dispersión de energía donde se aprecia
que la partícula considerada es un intermetálico Al-Fe-Mn (partícula β).
La Figura 5.54 es una micrografía por MEB que muestra claramente la extensa
disolución de la matriz producida por las fases Al-Fe-Mn. En esa misma micrografía se
observan picaduras sin la presencia de partículas, lo cual se debe a que, como se explicó
anteriormente, cuando la picadura se hace demasiado grande, la partícula se desprende
por la acción del electrolito y es sacada fuera de la picadura, aunque ésta continúa por
ser autocatalítica.
Paralelo al comportamiento explicado anteriormente, en algunos casos las partículas de
la fase Al-Fe-Mn parecen no promover ningún tipo de actividad corrosiva, ni catódica ni
anódica, tal como se ilustra en las Figuras 5.55 y 5.56. Este comportamiento fue
observado en las probetas ensayadas para los diferentes tiempos de exposición. La
naturaleza inerte de la fase Al-Fe-Mn frente a la corrosión, se pudo corroborar por la
presencia de algunos intermetálicos en el interior de las cavidades, la mayoría de las
cuales fueron analizados como compuestos Al-Fe-Mn, tal se ilustra en la Figura 5.57b.
El comportamiento catódico de las partículas de segunda fase Al-Fe-Mn y Al-Fe-Mn-Si
en la AA 3003 pudiera explicarse por analogía con el comportamiento de las partículas
que contienen Al(Mn,Fe,Cr) en la aleación 5058, las cuales se ha determinado [16] que
178
Resultados y Discusión
actúan como cátodos en relación a la matriz y promueven disolución de ésta en la
vecindad de la partícula. Igualmente se ha encontrado [16] que el comportamiento
catódico de esas partículas con respecto a la matriz, promueve que la reacción del O2
tenga lugar en la parte superior de las partículas con la consecuente formación de grupos
OH-. Esto a su vez produce un incremento local en el pH, el cual aumenta la disolución
de la capa de oxido en el área que rodea las partícula. Una vez que esta capa de oxido ha
sido disuelta, la alcalinización local produce un intenso ataque sobre la interfase entre la
matriz y la partícula, favoereciendo el crecimiento de la picadura.
Por otra parte, el carácter inerte de la fase Al-Fe-Mn puede estar relacionado con la
relación Mn/Fe presentes en estos intermetálicos. Algunos investigadores han
encontrado que elevadas relaciones Mn/Fe en los intermetálicos, polarizan el potencial
de los mismos en la dirección anódica disminuyendo la diferencia de potencial matrizpartícula y suprimiendo la reacción catódica O2 + 2 H 2 O + 4e − → 4OH − [1].
Aunque no se hizo un estudio exhaustivo, aparentemente el proceso de corrosión
alcalina localizada es la que se produce con mayor intensidad. Por lo tanto, como este
proceso esta relacionado con la presencia de las partículas intermetálicas Al-Fe-Mn y
Al-Fe-Mn-Si, la distribución de este tipo de compuestos en la superficie puede ser un
factor determinante en el comportamiento de la aleación 3003 en medio ambiente salino
como lo sugieren investigaciones previas [16, 130,131].
Por otra parte, los resultados de esta investigación parecen indicar que el
comportamiento frente a la corrosión de ambos tipos de partículas intermetálicas, parece
179
Resultados y Discusión
no depender del tiempo de permanencia de la AA 3003 al rocío salino. Igualmente
parece ser independiente del Temple pero puede ser afectada por el TTR y el mdio de
enfriamiento en la medida que estos cambien la fracción volumétrica de las partículas de
segunda fase, debido a la significativa trasformación de β en α que tiene lugar en esta
aleación a elevadas temperaturas (T > 400 ºC). Sin embargo, en el presente trabajo las
temperaturas de relajación utilizadas fueron muy bajas para afectar de manera
significativa la fracción volumétrica de la fase α y, con ello, el efecto de los
intermetálicos sobre la tasa de corrosión por picadura.
Figura 5.49: Micrografía por MEB mostrando la
participación de las partículas de segunda fase en el
proceso de corrosión.
180
Resultados y Discusión
(a)
(b)
Figura 5.50: (a) Imagen obtenida por MEB mostrando
corrosión localizada en la matriz que rodea el
intermetálico catódico Al-Fe-Mn-Si, (b) espectro por
EDX adquirido sobre la partícula.
181
Resultados y Discusión
(a)
(b)
Figura 5.51: (a) Imagen por MEB mostrando detalle del
área corroída por alcalinización local, (b) espectro por
EDX adquirido sobre la partícula Al-Fe-Mn-Si.
182
Resultados y Discusión
(a)
(b)
(c)
Figura 5.52.: Micrografía por MEB mostrando
disolución alcalina alrededor de un aglomerado de
partículas Al-Fe-Mn-Si, (b) y (c) espectros por EDX
adquiridos sobre partículas Al-Fe-Mn-Si.
183
Resultados y Discusión
(a)
(b)
Figura 5.53: (a) Micrografía por MEB mostrando disolución de
la matriz alrededor de partículas Al-Fe-Mn, (b) espectro por
EDX adquirido sobre la partícula Al-Fe-Mn.
184
Resultados y Discusión
(a)
(b)
Figura 5.54: (a) Imagen por MEB mostrando lo
extenso de la disolución de la matriz ocasionada por
las partículas Al-Fe-Mn, (b) espectro por EDX de
partículas Al-Fe-Mn.
185
Resultados y Discusión
(a
(
(c
Figura 5.55: (a)–(b) Micrografías por MEB mostrando el
comportamiento inerte de la partícula Al-Fe-Mn, (c) espectro
por EDX típico adquirido de partículas Al-Fe-Mn.
186
Resultados y Discusión
Al-Fe-Mn
Al-Fe-Mn-Si
Figura 5.56: Imagen por MEB ilustrando el carácter
inerte de la partícula Al-Fe-Mn y el comportamiento
catódico de la fase Al-Fe-Mn-Si.
187
Resultados y Discusión
(a)
(b)
(c)
Figura 5.57: (a) Imagen por MEB mostrando una
picadura de ~200 µm de longitud, (b) detalle del interior
de la picadura donde se observan partículas Al-Fe-Mn
corroborando el carácter inerte de esta fase, (c) espectro
por EDX típico adquirido de partículas Al-Fe-Mn.
188
Resultados y Discusión
5.6. Efectos de la corrosión sobre las propiedades mecánicas
El efecto de la corrosión por picadura sobre las propiedades mecánicas de los temples
H14, H16 y H18 de la AA 3003 se presenta en las Figuras 5.58-5.60, respectivamente.
En la Figuras se muestran las gráficas de la resistencia a la tracción (σuts) en función de
las temperaturas de relajación obtenidas de probetas expuestas por 216 horas al rocío
salino con las siguientes características: en condición de recibida de planta, tratadas
térmicamente a las temperaturas de 150 y 200 ºC enfriadas en agua fría y tratadas
térmicamente a la temperatura de 250 ºC enfriada en agua fría, en aire y en horno. Se
incluye la gráfica obtenida de probetas sin exponer al rocío salino a modo de
comparación.
Como puede verse en las Figuras el ataque corrosivo produjo perdida de la resistencia a
la tracción en todos temples (H14, H16 y H18) de la AA3003. En el temple H14 las
probetas tratadas a las temperaturas de 200 y 250 ºC enfriadas en agua fría presentaron
la mayor perdida de (σuts) mientras que en el temple H16 la variación fue menor. Las
disminuciones en los valores medidos de σUTS pudiera estar asociados con la perdida
de la integridad estructural del material, resultado de las microgrietas constituidas por las
picaduras. En el temple H18 se observó la mayor perdida de las propiedades mecánicas,
lo cual puede estar relacionado con el hecho de que este temple es el que presenta el
menor espesor de lámina de (1,5 mm) de manera que el promedio de las profundidades
de picaduras producidas en este temple ocasionan una mayor disminución en la sección
transversal de la lámina y el efecto sobre la resistencia a la tracción es notable.
189
Resultados y Discusión
RESISTENCIA A LA TRACCIÓN (σuts) (psi)
25000
t = 216 horas
TEMPLE H14
24000
23000
22000
21000
20000
ST
150 ºC
200 ºC
TEMPERATURA
250 ºC
Probetas sin tratar y tratadas térmicamente enfriadas en agua fría. Sin corroer
Probetas sin tratar y tratadas térmicamente enfriadas en agua fría. Corroídas
Probetas sin tratar y tratadas térmicamente enfriadas en aire. Corroídas
Probetas sin tratar y tratadas térmicamente enfriadas en horno. Corroídas
Figura 5.58. Resistencia a la tracción (σuts) obtenida del grupo de probetas sin
corroer y corroídas del temple H14 en función de la temperatura de relajación.
RESISTENCIA A LA TRACCIÓN (σuts) (psi)
28000
27000
t = 216 horas
TEMPLE H16
26000
25000
24000
23000
22000
21000
20000
ST
150 ºC
200 ºC
250 ºC
TEMPERATURA
Probetas sin tratar y tratadas térmicamente enfriadas en agua fría. Sin corroer
Probetas sin tratar y tratadas térmicamente enfriadas en agua fría. Corroídas
Probetas sin tratar y tratadas térmicamente enfriadas en aire. Corroídas
Probetas sin tratar y tratadas térmicamente enfriadas en horno. Corroídas
Figura 5.59 Resistencia a la tracción (σuts) obtenida del grupo de probetas sin
corroer y corroídas del temple H16 en función de la temperatura de relajación.
190
Resultados y Discusión
35000
RESISTENCIA A LA TRACCIÓN (σuts) (psi)
34000
33000
t = 216 horas
TEMPLE H18
32000
31000
30000
29000
28000
27000
26000
25000
24000
23000
22000
ST
150 ºC
200 ºC
TEMPERATURA
250 ºC
Probetas sin tratar y tratadas térmicamente enfriadas en agua fría. Sin Corroer
Probetas sin tratar y tratadas térmicamente enfriadas en agua fría. Corroídas
Probetas sin tratar y tratadas térmicamente enfriadas en aire. Corroídas
Probetas sin tratar y tratadas térmicamente enfriadas en horno. Corroídas
Figura 5.60. Resistencia a la tracción (σuts) obtenida del grupo de
probetas sin corroer y corroídas del temple H18 en función de la
temperatura de relajación.
191
Conclusiones y Recomendaciones
CAPÍTULO 6
CONCLUSIONES Y RECOMENDACIONES
1.
Los ensayos de corrosión en cámara salina y las técnicas de análisis y
caracterización macro y microestructurales utilizadas, permitieron determinar los
principales factores que condicionan el proceso de corrosión localizada sobre la
superficie de aleación comercial Al-Mn CVG-ALCASA 3003 en medio ambiente
salino.
2.
La aleación comercial Al-Mn CVG-ALCASA 3003 contiene una elevada densidad
de partículas de segunda fase de diferentes formas y tamaños que van desde (1
hasta 10 micras). Estas partículas están distribuidas en forma no uniforme con
tendencia a la formación de clusters y orientaciones en la dirección de la
laminación.
3.
La microscopía electrónica de transmisión mostró la presencia de dispersoides de
tamaños comprendidos entre 0.1 – 0.7 micras interactuando con la microestructura
del material. Durante el recocido estos dispersoides anclan los bordes de los granos
y producen granos alongados.
Conclusiones y Recomendaciones
4.
El análisis por espectroscopia de energía dispersiva de rayos-X permitió distinguir
dos tipos de partículas en esta aleación: la fase α-Al(Fe-Mn)Si y la fase βAl(FeMn).
5.
Los tratamientos térmicos de relajación por una hora a las temperaturas de 150,
200 y 250 ºC modificaron muy levemente la dureza y la resistencia máxima a la
tracción de los temples H14, H16 y H18 de la aleación comercial 3003, comparado
con los valores nominales exigidos para el uso comercial de las mismas.
6.
El análisis de imágenes mostró que cuando la aleación comercial CVG-ALCASA
3003 es tratada térmicamente a las temperaturas de 150, 200 y 250 ºC, la fracción
volumétrica
global
de
las
partículas
(Vf)α+β
se
modifica
levemente
independientemente del medio de enfriamiento (enfriado en agua, aire y horno) y
los temples ensayados (H14, H16 y H18).
7.
El medio de enfriamiento en horno produjo la mayor variación en la fracción
volumétrica en comparación con los medios de enfriamiento: en agua fría y en aire.
La variación de la fracción volumétrica (Vf)α+β sugiere la transformación de la fase
β en α.
8.
La técnica de interferometría óptica permitió determinar con exactitud la
profundidad de las picaduras y obtener información de la morfología de las
mismas.
193
Conclusiones y Recomendaciones
9.
Los resultados obtenidos de la máxima profundidad como del promedio de la
profundidad de las picaduras presentaron un alto grado de dispersión en todos los
temples, reflejando un ataque de corrosión por picaduras altamente localizado.
10. La fluctuación observada en la profundidad de las picaduras, así como el carácter
altamente localizado de la corrosión, pudiera estar relacionadas con diferencias en
el número y distribución no uniforme de los intermetálicos presentes en la
superficie de las probetas.
11. Los tratamientos térmicos de relajación no contribuyen en forma sistemática y
significativa a mejorar la resistencia de la aleación 3003 a la corrosión por
picadura, debido al carácter altamente localizado del mecanismo dominante.
12. La mejor correlación entre la profundidad de las picaduras y los parámetros de los
ensayos, se obtuvo a través del factor de picadura como medida de la
susceptibilidad de la aleación a la corrosión en el medio considerado. Se determinó
un factor de picadura promedio para todos los temples del orden de 2.5,
evidenciado el carácter altamente localizado del proceso corrosivo en la aleación.
13. La caracterización microestructural por MEB/EDX mostró claramente que la
nucleación y crecimiento de las picaduras en la aleación comercial Al-Mn 3003
está asociada con las partículas intermetálicas de segunda fase α-Al(Fe-Mn)Si y
β-Al(Fe-Mn) presentes en la aleación.
194
Conclusiones y Recomendaciones
14. El análisis por MEB/EDX mostró igualmente que los dos tipos de partículas
presentes en la aleación comercial de Al-Mn 3003, no parecen tener el mismo
comportamiento frente a la corrosión.
15. La fase α-(Al-Fe-Mn-Si) es más noble que la matriz de aluminio y puede actuar
como cátodo activo conduciendo a la alcalinización interfacial entre la matriz y la
partícula, con evidente iniciación y crecimiento de la picadura en la zona donde la
partícula se encuentra localizada.
16. La fase β-Al-Fe-Mn induce corrosión por picadura mediante un ataque por
disolución selectiva de la matriz que la rodea, en cuyo caso actúa como cátodo y en
otros casos parece no promover ningún tipo de actividad corrosiva, por lo cual su
comportamiento es de naturaleza catódica/pasiva.
17. Este comportamiento dual se atribuyó a la variación de la relación Mn/Fe, lo cual
afecta su estequeometría y por lo tanto la diferencia de potencial entre ésta y la
matriz de Al.
18. La resistencia máxima a la tracción en los temples H14, H16 y H18 de la aleación
3003, como medida del comportamiento mecánico de ésta, disminuyó
apreciablemente como consecuencia de la corrosión por picadura, con el temple
H18 presentando la mayor disminución.
195
Conclusiones y Recomendaciones
RECOMENDACIONES
1.
Optimizar el proceso de filtrado de partículas de segunda fase durante la etapa de
fabricación de la aleación, a fin de controlar mejor la población de intermetálicos
de tamaños entre 10 – 15 µm como una forma de disminuir la susceptibilidad de la
AA 3003 a la corrosión por picadura en medio ambiente salino.
2.
Realizar tratamientos térmicos a temperaturas mayores de 250 ºC a fin de
modificar en mayor grado la fracción volumétrica de las partículas de segunda fase
y evaluar por medidas potenciostáticas el comportamiento de la aleación a la
corrosión por picadura en función de la fracción volumétrica de las partículas
catódicas.
3.
Realizar una caracterización detallada del comportamiento electroquímico de las
fases intermetálicas presentes en la AA 3003, utilizando una microcelda capaz de
realizar ensayos electroquímicos sobre electrodos de superficie en el rango de las
µm2, a fin de establecer la naturaleza catódica/inerte/anódica de cada partícula
frente a la matriz, en función de la variación estequeométrica.
196
CAPÍTULO 7
REFERENCIAS BIBLIOGRÁFICAS
1.
M. Zamin, The role of Mn in the corrosion behaviour of Al-Mn alloys, Corrosion, 37 (11),
627-632 (1981).
2.
J. Mariño, Corrosión en las aleaciones de aluminio 3003 y 5052 en medio ambiente
salino. Trabajo de grado, Ingeniería Metalúrgica, Universidad Nacional Experimental
Politécnica “Antonio José de Sucre”, Ciudad Guayana (1996).
3.
B. Voth y S. Hoyos. Cuantificación de la velocidad de corrosión atmosférica del Al
utilizando la técnica de análisis de imágenes. Trabajo de grado, Ingeniería Química,
Universidad del Zulia, Maracaibo (2001).
4.
Corrosion in aluminium alloys 3003 and 3103. [En línea] www.finishing.com/76/69.shtml.
5.
L. A. Moros y T. E. Ríos. Estudio de la corrosión del aluminio en atmósferas marinas.
Trabajo de grado. Ingeniería Química. Universidad del Zulia, Maracaibo (1999).
6.
J. R. Davis, Corrosion of Aluminium and Aluminium Alloys. Ohio: American Society for
Metals (1999).
7.
S. A. Asel, Aluminio de Galicia, S. A. España: Tordesillas, Organización Gráfica, S. A.
(Original en francés, 1979) (1981).
8.
O. Seri. The effect of NaCl concentration on the corrosion behaviour of aluminium
containing iron, Corrosion Science, 36 (10), 1789-1803 (1994).
9.
V. Guillaumin, G. Mankowski, Localized corrosion of 2024 T351 aluminium alloy in
chloride media, Corrosion Science, 41, 421438 (1999).
10.
V. Guillaumin, G. Mankowski, Localized corrosion of 6056 T6 aluminium alloy in
chloride media, Corrosion Science, 42, 105-125 (2000).
11.
G. S. Frankel, Pitting corrosion of metals; a summary of the critical factors, Journal of
Electrochemical Society, 145, 2186 (1998).
12.
M. Elboujdaini, E. Ghali, R.G. Barradas and M. Girgis, An electrochemical investigation
of the behaviour of aluminum alloys in different electrolytes, Corrosion Science, 30 (8/9),
855-867 (1990).
13.
R. D. Armstrong and V. J. Braham, The mechanism of aluminium corrosion in alkaline
solutions, Corrosion Science, 38 (9), 1463-1471 (1996).
14.
Z. Szklarska-Smialowska, Pitting corrosion of aluminum, Corrosion Science, 41, 17431767 (1999).
Referencias
15.
C. Blanc, B. Lavelle and G. Mankowski, The role of precipitates enriched with copper on
the susceptibility to pitting corrosion of the 2024 aluminium alloy, Corrosion Science,
39(3), 495-510 (1997).
16.
A. Aballe, M. Bethencourt, F. J. Botana, M. J. Cano and M. Marcos, Influence of the
cathodic intermetallics distribution on the reproducibility of the electrochemical
measurements on AA5083 alloy in NaCl solutions, Corrosion Science, 45, 161-180 (2003).
17.
Ch. Blanc, Y. Roques and G. Mankowski, Application of phase shifting interferometric
microscopy to studies of the behaviour of coarse intermetallic particles in 6056 aluminium
alloy, Corrosion Science, 40 (6), 1019-1035 (1998).
18.
R. G. Buchheit, R. P. Grant, P. F. Hava, B. Mckenzie, G. L. Zender, Local dissolution
phenomena associated with S phase (Al2CuMg) particles in aluminium alloy 2024-T3,
Journal of Electrochemical Society, 144, 2621-2628 (1997).
19.
E. V. Koroleva, G. E. Thompson, G. Hollrigl, M. Bloeck, Surface morphological changes
of aluminium alloys in alkaline solution: effect of second phase material. Corrosion
Science, 41, 1475-1495 (1999).
20.
P. Leblanc and G. S. Frankel, A study of corrosion and pitting initiation of AA2024-T3
using atomic force microscopy, Journal of the Electrochemical Society, 149 (6), B239B247 (2002).
21.
R. F. Hochman, Metallurgical Factors Affecting Corrosion. En NACE Basic Corrosion
Course (11.1-11.20) (Vol. 2). Texas: National Association of Corrosion Engineers (1975).
22.
R. Ambat, R. Krishna Prasad and E. S. Dwarakadasa , The influence of aging at 180°C on
the corrosion behaviour of a ternary Al-Li-Zr alloy, Corrosion Science, 37 (8), 1253-1265
(1995).
23.
A. Afseth, J. H. Nordlien, G. M. Scamans, K. Nisancioglu, Effect of heat treatment on
electrochemical behaviour of aluminium alloy AA3005, Corrosion Science, 44, 145-162
(2002).
24.
E. McCafferty, The electrode kinetics of pit initiation on aluminum, Corrosion Science, 37
(3), 481-492 (1995).
25.
E. McCafferty, Sequence of steps in the pitting of aluminum by chloride ions, Corrosion
Science, 45, 1421-1438 (2003).
26.
Z. Szklarska-Smialowska, Mechanism of pit nucleation by electrical breakdown of the
passive film, Corrosion Science, 44, 1143-1149 (2002).
27.
Z. Szklarska-Smialowska, Insight into the pitting corrosion behaviour of aluminum alloys,
Corrosion Science, 33 (8), 1193-1202 (1992).
28.
H. E. Boyer and T. L Gall, Metals Handbook (Desk Edition). Ohio: American Society for
Metals (1985).
29.
J. W. Bray, Aluminum Mill and Engineered Wrought Products. En ASM Handbook.
Properties and Selection: Nonferrous Alloys and Special-Purpose Materials (29-60), (tenth
Edition) (Vol. 2). Ohio: American Society for Metals (1985).
30.
S. H. Avner, Introducción a la Metalurgia Física (Segunda Edición). México: McGrawHill. (1988).
31.
T. B. Massalski, Binary Alloy Phase Diagram (2nd Edition) (Vol.1). Ohio: The American
Society for Metal (1996).
32.
J. L. McAliester and J. L. Murray, Bulletin of Alloy Phase Diagrams (1987).
198
Referencias
33.
G. Davignon, A. Serneels, B. Verlinden, L. Delaey, An isothermal section at 550 ºC in the
Al-rich corner of the Al-Fe-Mn-Si system, Metallurgical and Materials Transactions A,
Physical Metallurgy and Materials Science, 27 (11), 3357-3361 (1996).
34.
A. G. Malgorzata, Processes of the formation of the Fe(Mn)-bearing intermetallic phases
in the Al-Fe-(Mn)-Si alloys, Advances in Materials Science, 4 (2), 81-90 (2003).
35.
F. C. Pimenta, Jr., W. A. Monteiro, A. F. Padilla, Microestructura de chapas laminadas a
quente da liga de aluminio 3003, Revista Latinoamericana de Metalurgia y Materiales, 6
(1/2), 19-23 (1986).
36.
D. T. L. Alexander, A. L. Greer, Solid-state intermetallic phase transformations in 3XXX
aluminium alloys, Acta Materialia, 50, 2571-2583 (2002).
37.
Aluminium and Corrosion, [En línea] www.alfed.org.uk/content/default.asp?PageId=112
38.
J. A. Dominguez, D. M. Castro, R. Matos y R. Hing, Introducción a la Corrosión y
Protección de Metales. La Habana: ENPES (1987).
39.
G. Wranglén, An Introduction to Corrosion and Protection of Metals. Stockholm: Institut
för Metallskydd (1972).
40.
T. J. Summerson and D. O. Sprowls. Corrosion behavior of aluminium alloys. En
Aluminum Alloys Their Physical and Mechanical Properties (1575-1663) (Vol. III).
Engineering Materials Advisory Services LTD. Viriginia: EMAS (1986).
41.
MS402 -Corrosion. [En línea] www.ntu.edu.sg/home/asjqiu/me/ME303.HTM
42.
M. Ergun and A.Y. Turan, Pitting potential and protection potential of carbon steel for
chloride ion and the effectiveness of different inhibiting anions, Corrosion Science, 32
(10), 1137-1142 (1991).
43.
A. K. Vijh, The dependence of the pitting potentials of aluminum alloys on the solid-state
cohesion of the alloying metals, Corrosion Science, 36 (9), 1615-1623 (1994).
44.
G. T. Burstein and R. J. Cinderey, Evolution of the corrosion potential of repassivating
aluminium surfaces, Corrosion Science, 33 (3), 475-492 (1992).
45.
L. L. Shreir, Corrosion (Vol. L).London: Newnes - Butterworths (1976).
46.
R. B. Inturi and Z. Szklarska-Smialowska, Dependence of the pitting potential of Al alloys
on solubility of alloying element oxides, Corrosion Science, 34 (4), 705-710 (1993).
47.
A. G. Muñoz, J. B. Bessone, Pitting of aluminium in non-aqueous chloride media,
Corrosion Science, 41, 1447-1463 (1999).
48.
J. C. Walton, Mathematical modelling of mass transport and chemical reaction in crevice
and pitting corrosion, Corrosion Science, Vol. 30 (8/9), 915-928 (1990).
49.
Pitting Control. [En línea] www.ntu.edu.sg/home/asjqiu/me/ME303.HTM
50.
Berzins, R. T. Lowson, K. J. Mirams, Aus. J. Chem. , 30, 1891 (1977).
51.
F. Brown, W. D. Mackintosh, Journal of Electrochemical Society, 120, 1096 (1973).
52.
P. M. Natishan, W. E. O`Grrady, En Application of Surface Analysis Methods to
Environmental/Materials Interactions (421). The Electrochemical Society Pennington,
NJ:(1991).
53.
S. Yu, W. E. O’Grady, D. E. Ramaker, P. M. Natishan, Journal of Electrochemical
Society, 147, 2952 (2000).
199
Referencias
54.
A. Kolies, A. S. Besing, P. Baradlai, R. Haaseh, A. Weickwski, Journal of Electrochemical
Society, 148, B251 (2001).
55.
L. Tomesanyi, K. Varga, I. Bartik, G. Horanyi, E. Maleezki, Electrochemical Acta, 34,
855 (1989).
56.
C. B. Bargeron and R. B. Givens, Precursive blistering in the localized corrosion of
aluminum, Corrosion, 36 (11), 618-625 (1980).
57.
T. Shibata and Y. C. Zhu, The effect of film formation temperature on the stochastic
processes of pit generation on anodized titanium, Corrosion Science, 38 (10), 1735 –1749
(1994).
58.
R. M. Carranza and M. G. Alvarez, The effect of temperature on the passive film
properties and pitting behavior of a Fe-Cr-Ni alloy, Corrosion Science, 38 (6), 909-925
(1996).
59.
S. K. Coburn, Corrosion, Source Book. Ohio: American Society for Metals (1984).
60.
J. Elustondo, El aluminio y sus aleaciones frente a la corrosión. Primera parte.
Estabilidad del aluminio, Revista Iberoamericana de Corrosión y Protección X (4), 5-18
(1979).
61.
Aluminum Alloys – Effects of Alloying Element. Key to Metals (2000). [En línea]
<www.key-to-metals.com/Article55.htm>.
62.
B. D. Craig, D. S. Anderson, Corrosion Resistant
Alloys and the Influence of Alloy
Elements. En Handbook of Corrosion Data (2nd Edition). Ohio: American Society for
Metals International (1995), [En línea]
http://www.corrosionsource.com/events/intercorr/techsess/asm/asm2.htm
63.
K. S. N. Murthy, R. Ambat and E. S. Dwarakadasa, The role of metal cations on the
corrosion behavior of 8090-T851 alloy in a pH 2.0 solution, Corrosion Science, 36 (10),
1765-1775 (1994).
64.
C. E. Caicedo-Martinez, E. V. Koroleva, G. E. Thompson, P. Skeldon, K. Shimizu, G.
Hoellrigl, C. Campbell and E. McAlpine, Influence of impurities in aluminium on surface
treatment, Corrosion Science, 44 (11), 2611-2620 (2002).
65.
M. G. A. Khedr and A. M. S. Lashien, The role of metal cations in the corrosion and
corrosion inhibitions of aluminium in aqueous solutions, Corrosion Science, 33 (1), 137151 (1992).
66.
W. Lin, G. C. Tu, C. F. Lin and Y. M. Peng, The effect of lead impurity on the dc-etching
behaviour of aluminium foil for electrolytic capacitor usage, Corrosion Science, 38 (6),
889-907 (1996).
67.
W. Lin. G. C. Tu, C. F. Lin and Y. M. Peng, The effect of indium impurity on the dcetching behaviour of aluminium foil for electrolytic capacitor usage, Corrosion Science,
39 (9), 1531-1543 (1997).
68.
J. Scherer, O. M. Magnussen, T. Ebel, R.J. Behm, Initial stages of the anodic etching of
aluminium foils studied by atomic force microscopy, Corrosion Science, 41, 35-55 (1999).
69.
J. T. B. Gundersen, A. Aytaç, J. H. Nordlien and K. Nisancloglu, Effect of heat treatment
on electrochemical behavior of binary aluminium model alloys, Corrosion Science, 46 (2),
265-283 (2004).
70.
J. T. B. Gundersen, A. Aytaç, S. Ono, J. H. Nordlien and K. Nisancloglu, Effect of trace
elements on electrochemical properties and corrosion of aluminium alloy AA31002,
Corrosion Science, 46 (3), 697-714 (2004).
200
Referencias
71.
G. Svenningsen, Corrosion of aluminium alloys, Departament o Materials Technologly,
7491 Trondheim, Norway.
72.
O. Seri and M. Imaizumi, The dissolution of FeAl3 intermetallic compound and deposition
on aluminium in AlCl3 solution, Corrosion Science, 30 (11), 1121-1133 (1990).
73.
H. Terryn, J. Vereecken y G. E. Thompson, The electrograining of aluminium in
hydrochloric acid- I. Morphological appearance, Corrosion Science, 32 (11), 1159-1172
(1991).
74.
H. Terryn, J. Vereecken y G. E. Thompson, The electrograining of aluminium in
hydrochloric Acid-II. Formation of etch products, Corrosion Science, 32 (11), 1173-1188
(1991).
75.
E. V. Koroleva, G.E. Thompson, G. Hollrigl, M. Bloeck, Role of the second phase
particles of aluminium alloy in a. c. electrograiningin nitric and hydrochloric, Aluminium
Surface Science and Technology, Antwerp, Belgium (1997).
76.
M. B. Ives, Metallography of pitting corrosion, Materials Characterization, 28, 257-270
(1992).
77.
Ch. Blanc, Y. Roques and G. Mankowski, Application of phase shifting interferometric
microscopy to studies of the behaviour of coarse intermetallic particles in 6056 aluminium
alloy, Corrosion Science, 40 (6), 1019-1035 (1998).
78.
M. C. Leiro y B. M. Rosales, Factores metalúrgicos que controlan la corrosión por
picado de aleaciones aeronáuticas de Al, LatinAmerican Journal of Metalurgy and
Materials, 4 (1), 8-15 (1984)
79.
J. A. Carew and A. Abdullah, The influence of heat treatment on the corrosion behaviour
of ferritic stainless steel solar panels in hot municipal water, Corrosion Science, 34, (2),
217-231 (1993).
80.
P. Chung and S. Szklarska-Smialowska, The effect of heat treatment on the degree of
sensitization of type 304 stainless steel, National Association of Corrosion Engineers, 37
(1), 39-50 (1981).
81.
M. Ch. Trai, W. T. Tsai and J. T. Lee, The effect and applied potential on the stress
corrosion cracking of alloy in thiosulfate solution, Corrosion Science, 34 (5), 741-757
(1993).
82.
N. N. Aung and W. Zhou, Effect of heat treatment on corrosion and electrochemical
behaviour of AZ91D magnesium alloy, Journal of Applied Electrochemistry 32, 13971401 (2002).
83.
Ch. R. Brooks, Heat Treatment, Structure and Properties of Nonferrous Alloys, American
Society for Metals. Ohio: American Society for Metals (1982).
84.
Metals – Aluminum, [En línea] <www.bikepro.com/products/metals/alum.html>
85.
N. C. Parson, H. L. Yiu, The effect of heat treatment on the microstructure and properties
of 6000 series alloy extrusion ingots, Light Metals, 713-724 (1989).
86.
K. Buxmann and E. Gold, Solidification conditions and microstructure in continuously
cast aluminum, Journal of Metals, 28-34 (1982).
87.
D. A. Granger, Microstructure control in ingots of aluminum alloys with an emphasis on
grain refinement, Light Metals, 941-952 (1998).
88.
X. G. Chen, Growth mechanisms of intermetallic phases in DC cast AA1XXX alloys, Light
Metals, 1071-1076 (1998).
201
Referencias
89.
P. V. Evans, J. Worth, A. Bosland and S. C. Flood,
Intermetallic phase selection in
AA1XXX aluminium alloys. En Proceedings of the 4th Decennial International Conference
on Solidification Processing. Sheffield, 531-535 (1997).
90.
C. S. de Mangarola y J. Beltrán, Manual del Aluminio: Principios y Procedimientos
Modernos de Fabricación (11 ed.). Barcelona: Editorial Reverté, S. A. (1959).
91.
H. Hu, Recovery, recrystallization and grain growth. En Metallurgical Treatises. New
York: The Metallurgical Society of AIME (1981).
92.
A. Afseth, J. H. Nordlien, G. M. Scamans and K. Nisancioglu, Effect of heat treatment on
filiform corrosion of aluminium alloys AA3005, Corrosion Science, 43, 2093-2109 (2001).
93.
Afseth, J. H. Nordlien, G. M. Scamans and K. Nisancioglu, Influence of heat treatment
and surface conditioning on filiform corrosion of aluminium alloys AA3005 and AA5754,
Corrosion Science, 43 (12), 2359-2377 (2001).
94.
R. A. Vandermeer, D. J. Jensen, Recrystallization in hot vs cold deformed commercial
aluminum: a microstructure path comparison, Acta Materialia, 51, 3005-3018 (2003).
95.
L. Delannay, O. V. Mishin, D. Juul Jensen and P. Van Houtte, Quantitative analysis of
grain subdivision in cold rolled aluminium, Acta Materialia, 49, 2441-2451 (2001).
96.
A. Duckham, R. D. Knutsen and O. Englers, Influence of deformation variables on the
formation of copper-type shear bands in Al-1Mg, Acta Materialia, 49, 2739-2749 (2001).
97.
P.J. Hurley, F. J. Humphreys, The application of EBSD to the study of substructural
development in a cold rolled single-phase aluminium alloy, Acta Materialia, 51, 10871102 (2003).
98.
Bay, N. Hansen, D. A. Hughes and D. Kuhlmann-Wilsdorf, Evolution of f.c.c. deformation
structure in polyslip. Acta Materialia, 40 (2), 205-219 (1992).
99.
P. L. Orsetti, Caracterización de aleaciones de aluminio de ALCASA. Revisión de
Literatura, C.V.G. Venalum (1997).
100. O. V. Mishin, B. Bay, G. Winther and D. J.Jensen, The effect of roll gap geometry on
microstructure in cold-rolled aluminum. Acta Materialia, 52 (20), 5761 (2004).
101. M. Dündar, O. Keles, B. Kerti and N. Dogan, Crystallographic texture development of
twin-roll cast aluminum strips. Light Metals, 723-727 (2004).
102. E. S. Puchi, M. Staia, M. Escorche and Y. Pérez, Cold- Rolling and annealing of a
commercial twin roll cast 3003 aluminum alloy, Light Metals, 1183-1186 (1995).
103. T. Minoda and H. Yoshida, Effect of grain boundary characteristics on intergranular
corrosion resistance of 6061 aluminum alloy extrusion. Metallurgical and Materials
Transactions A, 2891-2898 (2002).
104. S. Maitra, Grain morphology dependence of Stress corrosion Cracking in 2124 Aluminum
alloy plate, National Association of Corrosion Engineers, 37 (3), 125-130 (1981).
105. W. Zhang and G. S. Frankel, Anisotropy of localized corrosion in AA2024-T3,
Electrochemical and Solid-State Letters, 3, 268-275 (2000).
106. R. Ambat, A. Davenport, A. Afseth and G. Scamans, Electrochemical behavior of the
active surface layer on rolled aluminum alloy sheet, Proceeding of the Electrochemical
Society, 22, 921 (2001).
107. R. Ambat, A. Davenport, A. Afseth and G. Scamans, Electrochemical behavior of the
active surface layer on rolled aluminum alloy sheet, Journal of Electrochemical Society,
151 (2), B53-B58 (2004).
202
Referencias
108. H. T. Rowland and S. C. Dexter, Effect of sea water carbon dioxide system on the
corrosion of aluminum, Corrosion, 36 (9), 458-467 (1980).
109. S. C. Dexter, Effect of variations in sea water upon the corrosion of aluminum, Corrosion,
36 (8), 423-432 (1980).
110. B. W. Lifka and F. L.McGeary, Corrosion Testing. En NACE Basic Corrosion Course
(15.1-15.35) (Vol. 2). Texas: National Association of Corrosion Engineers (1975).
111. GalvInfoNote 15, The Salt Spray Test, [En línea],
www.galvinfo.com/GINotes/G_Note15.PDF
112. D. P. Doyle, D. C. Lauzon and F. N. Smith, Corrosion behavior of aluminum brazing
sheet used in automotive heat exchangers. En Image Analysis and Metallography (265273) (Vol. 17). Ohio: American Society for Metals and the International Metallographic
Society (1989).
113. J. M. Guilemany, J. M. Miguel, S. Armada, S. Vizcaino, F. Climent, Use of sacnning
white light interferometry in the characterization of wear mechanisms in termal-spayed
coatings, Materials Characterization, 47, 307-314 (2001).
114. K. Habib, Detection of crevice corrosion by optical interferometry, Corrosion Science, 42,
455-467 (2000).
115. I. M. Hutchings, Tribology: Friction and Wear of Engineering Materials. Londres: Arnold
(1992).
116. J. A. Hooker and S. M. Simmons, Noncontact Scanning Surface Profilometers, [En línea]
www.nasatech.com/Briefs/Oct02/KSC11759.html
117. A. W. Ruff, Introduction to Laboratory Characterization Techniques. En ASM Handbook.
Friction, Lubrication, and Wear Technology (332-345) (Vol. 18). Ohio: American Society
for Metals (1992).
118. G. F. Vander Voort, C. Image Analysis. En ASM Handbook. Materials Characterization
(309-322) (Vol. 10). Ohio: American Society for Metals (1986).
119. W. Petruk, The capabilities of the microprobe kontron image analysis system: Application
to mineral beneficiation, Scanning Microscopy, 2 (3), 1247-1256 (1988).
120. P. Smart and X. Leng, Present developments in image analysis, Scanning Microscopy, 7
(1), 5-16 (1993).
121. G. W. Jenkinson, Application developments for quantitative image analysis in metallurgy.
En Image Analysis and Metallography (3-21) (Vol. 17). Ohio: American Society for
Metals and The International Metallographic Society (1989).
122. D. Jeulin, Mathematical morphology and materials image analysis, Scanning Microscopy
Supplement, 2, 165-183 (1988).
123. G. Lawes, Scanning Electron Microscopy and X-Ray Microanalysis. New York: John
Wiley & Sons (1987).
124. D. Vaughan, Energy Dispersive X-Ray Microanalysis, An Introduction. Canada: Kevex
Instruments, Inc. (1989).
125. D. Chescoe and P. J. Goodhew, The operation of Transmission and Scanning Electron
Microscopes. Oxford: Oxford University Press (1990).
126. J. J. Friel, N. C. Barbi, X-Ray Microanalysis and Computer-Aided Imaging. USA:
Princeton Gamma Technology (1992).
203
Referencias
127. J. M. Howe, Metallographic and differential scanning calorimetry analyses of
precipitation and recrystallization in an Al-Mn alloy. Metallurgical Transactions A, 17A,
593-605 (1986).
128. M. J. Bozack and R. D. Beshears, The effects of exposure temperature on 2219 Al-Cu
alloy surface immersed in natural seawater. Corrosion Science, 43 (4), 631-653 (1993).
129. N. Grossman, The effect of shot peening on damage caused by cavitation. ASTM Bulletin,
6166 (1952).
130. A. Aballe, M. Bethencourt, F. J. Botana, M. Marcos and J. M. Sánchez-Amaya, Influence
of the degree of polishing of alloy AA 5083 on its behaviour against localized alkaline
corrosion. Corrosion Science, 46, (8), 1909-1920 (2004).
131. N. Birbilis and R. G. Buchheit, Electrochemical characteristics of intermetallic phases in
aluminum alloys, Journal of The Electrochemical Society, 152 (4), B140-B151 (2005)
204