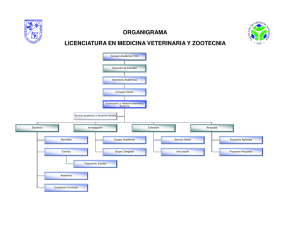
manual de prácticas de laboratorio de patología general
Anuncio

Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal MANUAL DE PRÁCTICAS DE LABORATORIO DE PATOLOGÍA GENERAL 1/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal CONTENIDO Introducción…………………………………………………………………………………. 3 Presentación………………………………………………………………………………… 4 Unidad I Práctica 1: Historia clínica…………………………………………………………………. Práctica 2: Sacrificio humanitario (eutanasia)…………………………………………... Práctica 3: Técnicas de necropsia……………………………………………………….. Práctica 4: Toma, conservación y envío de muestras al laboratorio…………………. 8 11 14 24 Prácticas de la unidad II Práctica 5: Degeneración, necrosis, apoptosis y autolisis…………………………….. Práctica 6: Gangrena, infiltraciones, pigmentos y cristales……………………………. Práctica 7: Anormalidades en el crecimiento celular (neoplasia)………………...…… 32 36 39 Prácticas de la unidad III Práctica 8 Trastornos circulatorios……………………………………………………….. Práctica 9: Inflamación y reparación tisular……………………………………………... 43 49 Práctica de la unidad IV Práctica10: Práctica de integración de diagnóstico…………………………………….. 55 Anexo 1. Norma Oficial Mexicana NOM-051-Z00-1995. Trato humanitario en la movilización de animales………………………………………………………………….. 58 Anexo 2. Norma Oficial Mexicana NOM-033-ZOO-1995. Sacrificio humanitario de los animales domésticos y silvestres…………………………………………………….. 89 2/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal INTRODUCCIÓN La patología estudia la naturaleza esencial de las enfermedades, especialmente incide en conocer las alteraciones morfológicas y funcionales que de ella se derivan; por ello, el estudio de la patología en el área médica es fundamental para conocer los niveles de salud del individuo o el nivel de salud en una población animal. Las diversas enfermedades ocasionan alteraciones en los tejidos, órganos, aparatos y sistemas. La patología general estudia los mecanismos por los que se producen las diversas lesiones. La identificación de lesiones macroscópicas y microscópicas es importante para establecer el diagnóstico de enfermedad. La patología constituye el puente con las asignaturas clínicas para conocer sobre la enfermedad, y llevar acciones de prevención, control y tratamiento. La herramienta fundamental de la patología es la necropsia, que es la disección anatómica sistemática del cadáver para exponer las lesiones macroscópicas por aparatos y sistemas; con ello se podrá emitir el diagnóstico presuntivo de la causa de muerte. A través de la histopatología se profundiza sobre la naturaleza de la enfermedad y se podrá emitir un diagnóstico más certero de la causa de muerte. Con la toma de muestras y el estudio de ellas con otras técnicas de laboratorio se elabora el diagnóstico integral; lo cual constituye el punto importante de la patología. La formación del estudiante en la Unidad de Aprendizaje de Patología General para la identificación de lesiones y los mecanismos de patogénesis, le será de gran utilidad en asignaturas consecuentes como patología por sistemas, las diversas asignaturas clínicas. 3/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal PRESENTACIÓN La evolución del conocimiento en Patología podría esquemáticamente ser dividido en cuatro períodos a) humoral; b) tisular; c) celular y d) subcelular y molecular. La época humoral se extiende desde el comienzo del conocimiento médico hasta el Renacimiento en el que la nueva mentalidad predominante en el mundo occidental se atrevió a poner en orden las enseñanzas, hasta entonces dogmáticas, provenientes de Egipto, India y Grecia. Dentro de este periodo se destaca la medicina griega con Hipócrates y Galeno. La época orgánica comienza fundamentalmente con el Renacimiento en el que surgieron una serie de figuras, especialmente en Italia, que dieron un gran impulso a la Patología por intermedio de disecciones en cadáveres y de la correlación clínico-patológica en las autopsias. Dentro de estas personalidades merecen ser destacados los nombres de Beniviene (1440-1502), considerado por algunos como el padre de la Anatomía Patológica Vesalio (1514-1564), al que se debe en gran parte poner en duda los dogmas de Galeno, Morgagni (1682-1771), quien estudió unas 700 autopsias tratando de establecer una correlación clínico-patológica. En los escritos de Morgagni "La historia de la vida del paciente, así como la de su enfermedad son narradas en detalle. El estado de los órganos en la necropsia es descripto cuidadosamente y se realiza un intento de correlacionar los síntomas con las alteraciones morfológicas encontradas. Se dice con justicia que Morgagni introdujo el "concepto anatómico en Medicina. Este concepto es uno de los principales elementos en el diagnóstico moderno, y un médico de nuestros días, en la consideración de un paciente, piensa primero si él es capaz de expresar los síntomas en términos de la lesión". Hacia fines del siglo XVIII la Anatomía Patológica macroscópica está bien establecida como una rama de las ciencias médicas. La figura fundamental del período que se puede considerar como patología tisular es el francés Bichat (1771-1802) quien puede ser considerado uno de los fundadores de la patología moderna. Estableció el concepto que los órganos están formados por tejidos (es curioso que para llegar a este concepto no empleó el microscopio) y dividió la anatomía mórbida 5 partes: a) alteraciones comunes a cualquier sistema, independientemente de su localización (patología general) y b) enfermedades peculiares de los distintos órganos (patología especial). Aunque observaciones microscópicas habían sido ya efectuadas por Malpighi (1628-1694) y por van Leeuwenhock (1632-1723), no fue hasta el siglo XIX que el mejoramiento en la construcción de los microscopios, especialmente el desarrollo de lentes acromáticas, permitió que el uso de dicho instrumento diese un nuevo y fundamental impulso a la patología que entró en lo que podría denominarse período de la patología celular. 4/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Los estudios de Virchow (1821-1905) abrieron las puertas a la idea de que los cambios fundamentales inducidos por la enfermedad pueden ser interpretados como alteraciones de las células constitutivas del organismo. En 1858 publicó "Patología celular basada en histología fisiológica y patológica" que estableció los principios para la investigación y la práctica de la Patología durante casi un siglo. Por la importancia que tiene Virchow y su escuela en la historia y evolución de la Patología en todo el mundo, es importante que nos detengamos un poco sobre su figura. Las teorías de la enfermedad de acuerdo con Virchow, descansa en seis proposiciones 1) Las células son las unidades de la vida; 2) Los tejidos de los seres vivos están constituidos por células y a su vez los órganos por tejidos. Pero el organismo es, esencialmente, un estado celular. 3) Las células reciben su nutrición a través de los vasos sanguíneos; 4) Las células también son la unidad de la enfermedad. Las células enfermas tienen alterada su capacidad nutricional y eliminan productos tóxicos a la sangre produciendo así discrasias y enfermedades a distancia; 5) Las células poseen irritabilidad en tanto están vivas. La respuesta a la irritación puede ser funcional, nutritiva o formativa; 6) Los disturbios en la función pueden terminar en agotamiento, fatiga; trastornos en la nutrición se muestran como hipertrofia, tumefacción turbia, inflamación o cambios pasivos tales como degeneraciones y necrobiosis. Las displasias formativas dan hiperplasias, formación de pus, tuberculosis y neoplasias. De acuerdo con el concepto de Virchow la Medicina no era solamente una de las ciencias naturales, sino también la principal de las ciencias humanísticas. Por tal razón, a sus ojos no era disparatado su interés por la medicina, salud pública, etnología, antropología y política. De él son las siguientes palabras "Finalmente, recordemos las palabras de Descartes que dijo que si de alguna manera fuese posible ennoblecer la raza humana, los medios para esto solamente podrían ser hallados en la medicina. En realidad, si la medicina es la ciencia del hombre sano así como del enfermo (que él lo que debería ser), que otra ciencia está mejor dotada para proponer leyes para bases de la estructura social, con el propósito de hacer efectivas aquellas que son inherentes al hombre mismo. Una vez se establece la medicina como antropología, y una vez que los intereses de los privilegiados no determinan más el curso de los acontecimientos públicos, el fisiólogo y el médico práctico, estarán entre los más viejos hombres de estado que sostienen la estructura social. La medicina es una ciencia social en su esencia, como Neumann con su aguda lógica lo destaca en su ensayo sobre las relaciones entre la salud pública y la propiedad. Ningún fisiólogo o médico práctico debería jamás olvidar que la medicina une en si misma todo el conocimiento de las leyes aplicables al cuerpo y al pensamiento. Schlosser está equivocado cuando intenta mostrar en su historia del siglo XVIII que solamente la literatura y la literatura histórica cambian su fisonomía con los cambios políticos; es también equivocado creer que, en contraste con las ciencias políticas y religiosas las ciencias naturales pueden contemplar en lo más profundo de su conocimiento sin tener el deseo de aplicar lo que ellas conocen. Recordemos el refrán de Lord Bacon de que el conocimiento es poder, y no nos satisfagamos con nada menos de nuestra grande y prometedora ciencia de la que Hipócrates una vez dijo: Quae ad sapientiam reguiruntur, in medicina insuntomnia." 5/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Ya veremos cómo estos conceptos se grabaron profundamente en uno de sus alumnos argentinos, el Dr. Telémaco Susini. El siglo XIX vio el desarrollo completo de la Anatomía Patológica mórbida tanto macro como microscópica. Esto se debió en gran parte a los adelantos técnico de los microscopios así como también en las técnicas de inclusión, corte y coloración de los tejidos. Aunque Galeno y otros ya habían llevado a cabo algunos experimentos, era necesario un cambio de mentalidad y de actitud frente a la enfermedad para que se creasen las condiciones necesarias para el desarrollo de la patología experimental, lo que explica que los primeros intentos serios de buscar la explicación para distintos fenómenos biológicos ocurrieran en el Renacimiento, y así van surgiendo una serie de fisiólogos experimentales que servirán de base a los patólogos en los años subsiguientes. Merecen ser citadas las siguientes palabras de Claudio Bernard "La mente humana durante los diversos períodos de su evolución, ha pasado sucesivamente por el sentimiento, la razón y el experimento". Primero el sentimiento, imponiéndose a la razón, creó las verdades de la fe, es decir la teología. La razón o filosofía, señora inmediata de la ruta, originó la escolástica. Por fin, el experimento, es decir el estudio de los fenómenos naturales enseñó al hombre que las verdades del mundo exterior no se hallan ni en el sentimiento ni en la razón. Estos son solamente guías indispensables pero, para obtener estas verdades es necesario ir a la realidad objetiva de las cosas donde ellas se encuentran escondidas en su forma fenomenológica. Es así que por el progreso natural de los hechos aparece el método experimental que resume todo y que se apoya sucesivamente sobre el sentimiento, la razón y el experimento. En la búsqueda de la verdad, por este método, el sentimiento tiene siempre la iniciativa, engendra la idea a priori o intuición; La razón o el razonamiento desarrolla enseguida la idea y deduce sus consecuencias lógicas. Pero, así corno el sentimiento debe ser aclarado por la razón, la razón a su vez debe ser guiada por el experimento. Dentro de las figuras pioneras de la Biología experimental merecen ser destacados Harvey (1578-1657), Magendie (maestro de Claudio Bernard) y muy especialmente Claudio Bernard (1813-1878), considerado con justeza como el fundador de la Medicina Experimental. Sus conceptos sobre experimentación aparecen en su "Introducción al estudio de la Medicina Experimental" publicado en 1865, de la que Henry Bergson ha dicho que fue comparable en su tiempo, por la influencia que ejerció, a la que había tenido dos siglos antes el "Discurso del Método" de Descartes. Aunque la mayoría de los patólogos del siglo XIX estudiaron fundamentalmente la patología de autopsias (Rokitansky, etc.), capaces experimentados surgieron tales como Conheim (1839-1884). Por otra parte, es necesario destacar que Virchow fue un propulsor de la patología experimental. 6/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal En el siglo XX se perfeccionan las técnicas de estudio anteriores y aparecen nuevos métodos tales corno la histoquímica enzimática. autoradiografía, microscopía electrónica, etc. que permiten importantes y rápidos progresos en el estudio de la enfermedad. Por otra parte, además de continuarse profundizando el estudio de las autopsias y su correlación clínico -patológica, cobra auge la biopsia, quirúrgica y aparecen métodos biópsicos para el estudio de diversas vísceras tales como riñón, hígado, intestino, etc. que permiten un gran adelanto a la patología. Surge además como un importante centro en el estudio de la Patología hasta entonces afincado fundamentalmente en Europa, Estados Unidos de Norte América que le da un nuevo, poderoso y distinto enfoque a la Patología. Dentro de las figuras más importantes de la Patología mundial de las últimas décadas, y que contribuyeron ya sea directamente a través de la formación de discípulos o indirectamente por intermedio de sus libros y publicaciones en el desarrollo de la patología latinoamericana podemos mencionar algunos nombres tales como Letulle, Cajal, Aschoff, Borst, Rössle, Roussy, Cameron, Willis, Pearse en Europa y a Nallory, Moore Ackerman, Hartroft, Pirani, en EE.UU. y Canadá. 7/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal UNIDAD I Práctica 1: historia clínica. Introducción: La historia clínica es el conjunto de documentos surgidos de la relación entre el médico y el dueño del paciente; recoge los datos clínico-patológicos y zootécnicos referentes a la salud o enfermedad del animal o del rebaño. Es un documento privado con características: legales, éticas, docentes, estadísticas, médicas o clínicas. Los datos deben ser consignados en términos adecuados y en forma lógica, ordenada o secuencial ya que debe convertirse en una narración escrita, clara, precisa, detallada y ordenada de todos los datos y conocimientos, remotos y actuales, relativos al paciente, que sirven como base para el conocimiento de la enfermedad. La historia general es para obtener información objetiva y subjetiva. Los datos objetivos consisten en la reseña, el ambiente, la dieta y la historia médica. Los datos subjetivos incluyen una descripción de la anormalidad clínica y un panorama histórico de la salud general del paciente; el dueño del paciente a menudo no se da cuenta que una observación aparentemente sin importancia puede estar relacionada con un problema primario. Objetivo: Elaborar la historia clínica de una animal para establecer el diagnóstico clínico presuntivo. Duración de la sesión: 2 horas. Material: Animal vivo o cadáver de un animal doméstico o silvestre. Formato de historia clínica. Técnica: Método para la obtención de la historia clínica. La historia clínica está compuesta por dos partes fundamentales: Anamnesis y revisión por aparatos y sistemas. Anamnesis: Es el conjunto de datos o la información que aporta el interrogatorio. Es la forma en que se inicia la relación Médico Veterinario y el dueño del paciente; además obliga al Médico Veterinario Zootecnista a comprender las características del paciente. 8/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Identificación del paciente. En esta parte se identifica al paciente en cuanto a su especie, raza, sexo, edad, fin zootécnico y marcas particulares. Cabe la posibilidad de agregar más información como: nombre, teléfono y dirección de su propietario. Problema principal o motivo de consulta. Esta sección es sólo una mención muy corta del motivo por el que se remite al paciente. Por ejemplo: "El motivo de la consulta es por llevar 5 días con fiebre", "el paciente presenta diarrea acuosa”. Esta sección puede ser una ayuda adicional para entender más rápido cuál va a ser el problema principal del que tratará el diagnóstico final (Birchard y Shering, 1994). El comportamiento antes de morir y el tiempo transcurrido entre los primeros signos de la enfermedad y la muerte constituyen fuentes importantes de información (Blood y Radostitis, 1992). Se deben señalar los signos y manifestaciones de enfermedad que él paciente ha presentado, como han evolucionado en el tiempo, y en la práctica, que ha ocurrido. Inmunizaciones, desparasitaciones y/o medicaciones. Según el cuadro clínico que presente el paciente puede ser importante señalar las inmunizaciones, desparasitaciones y medicaciones que el paciente ha recibido. Ambiente.Tomar información del ambiente como parte sistemática de la historia clínica del paciente; bajo muchas circunstancias saber dónde se mantiene al paciente es un dato importante en el diagnóstico. Historia clínica sobre la alimentación. Siempre debe incluirse información de la alimentación. Se pregunta al propietario acerca del apetito del paciente y sobre pérdida o ganancia de peso. Se debe determinar los siguientes datos: Tipo de dieta, Nombre comercial del alimento, Método de alimentación y Cantidad de alimento. Revisión por aparatos y sistemas. A pesar de toda la información que se ha recogido en la anamnesis y los antecedentes, conviene tener algún método para evitar que se escape algo importante. Una breve revisión de los sistemas que todavía no se han explorado da más seguridad que la información está completa. Esta revisión no debe ser muy larga ya que los principales problemas ya fueron identificados en la anamnesis. Si al hacer este ejercicio aparecen signos que resultan ser importantes y que todavía no habían sido explorados, es posible que el conjunto de estas nuevas manifestaciones deban ser incorporadas a la anamnesis. Una forma de ordenar esta revisión es llevarla a cabo por aparatos y sistemas y en cada uno de ellos se investigan manifestaciones que podrían darse: Signos generales: Sistema respiratorio, Sistema cardiovascular, Aparato gastrointestinal o digestivo, Aparato reproductor, aparato urinario, Sistema endocrino, Sistema 9/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal neurológico. Es importante anotar en la historia clínica aspectos como: Impresiones diagnósticas, exámenes complementarios y diagnósticos definitivos. Interpretación u observaciones: El alumno llenará el formato de historia clínica disponible en la Sala de necropsias del Centro de Investigación y Estudios Avanzados en Salud Animal (CIESA) de la FMVZ. UAEM. Preguntas para discusión: ¿Qué importancia tiene la historia clínica para el diagnóstico de la causa de muerte? ¿En base a qué aspectos de la historia clínica puede fundamentar el diagnóstico presuntivo? ¿Qué utilidad tiene conocer si se han realizado exámenes complementarios? Evaluación: Se verificará el cumplimiento de la práctica mediante lista de cotejo. Lugar donde se llevará a cabo: La práctica podrá llevarse a cabo en la posta zootécnica o en la Sala de necropsias del CIESA de la FMVZ. UAEM. Bibliografía Aluja, Aline. (2002). Técnicas de necropsia en animales domésticos. 2ª ed. Ed. El manual moderno. México. Balcells, A. (1990). La clínica y el laboratorio. 15ª ed. Ed. Salvat. México. Balows, Albert; Hauster, Willian J.; Herrman, Kenneth. Isemberg, Henry d.; Shadomy, Jean. (1991) Manual of Clinical Microbiology 5ª ED. Library of Congress., U.S.A. Blood, D. C. y Radostitis, O. M. (1992). Medicina Veterinaria. 7ª ed. McGraw-Hill interamericana. México. Ettinger J., Stephen, Feldman. (1998). Tratado de medicina interna veterinaria. Enfermedades del perro y gato. Intermédica. Argentina. Lorenz, D. Michael. (1990). Diagnóstico médico de los pequeños animales. Ed. Acribia. Zaragoza, España. Taylor, F. G. R. (1999). Técnicas diagnósticas en medicina equina. Ed. Acribia. Zaragoza. España. 10/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal PRÁCTICA 2: Sacrificio humanitario (eutanasia) Introducción: La palabra eutanasia tiene un origen griego “Ew” que significa bueno, y “thanatos”, se refiere a la muerte, por lo tanto es la técnica empleada para el sacrificio de los animales sin causarles dolor ni estrés o reducirlo al máximo. Debido a situaciones con motivos médicos, económicas u otras, los propietarios y Médicos Veterinarios se ven imposibilitados para hacer otra cosa por la salud o bienestar del animal, por esta razón el único recurso que tienen es brindarle una muerte tranquila y sin dolor al animal, cumpliendo con lo señalado en la norma oficial que establece los métodos para la realización de la eutanasia. Todos los animales deben ser tratados humanitariamente según lo establecido en la NOM que establece que el trato humanitario es un conjunto de medidas para disminuir la tensión, sufrimiento, traumatismos y dolor de los animales durante su captura, movilización, exhibición, cuarentena, comercialización, aprovechamiento, entrenamiento y sacrificio (NOM-ZOO-051, 1995, anexo 1). El sacrificio humanitario que se realice en los animales que no sean destinados para el consumo humano, solamente podrá realizarse con los métodos autorizados para la especie de que se trate y en razón del sufrimiento que le cause un accidente, enfermedad, incapacidad física o vejez extrema, imposibilidad para su manutención, riesgo zoosanitario o por exceso en el número de los de su especie, cuando signifiquen un peligro comprobado para la salud pública (NOM-ZOO-033-1995, anexo 2). Si no se realiza adecuadamente el método de sacrificio humanitario en los animales se puede provocar dolor y por lo tanto estrés, lo que conlleva a provocar cambios fisiológicos en los animales, al suceder lo anterior se ve reflejado en las condiciones del cadáver al momento de realizar la necropsia, ya que algunos cambios post-mortem se modifican y pueden provocar errores en el diagnóstico. Objetivo: Realizar el sacrificio de los animales destinados para la necropsia de acuerdo a las normas NOM-ZOO-051, 1995 y NOM-ZOO-033, 1995. Duración de la sesión: 2 horas. Material: Solo se realizará la eutanasia en animales que realmente requieren ser eutanasiados; de preferencia se trabajará con animales muertos por causas naturales o de enfermedad que 11/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal sean remitidos al CIESA. Pentobarbital sódico. Jeringas de 10 o 20 ml. Ligadura de caucho. Pistolete con perno Oculto (disponible en el CIESA). Técnica: Técnica de eutanasia para perros y gatos: Sobre dosis de pentobarbital sódico: Inyectado por vía intravenosa, este agente proporciona eutanasia rápida y humanitaria. Las vías de inyección intracardiaca e intrapulmonar no se deben utilizar ya que son extremadamente dolorosas, a menos que se haga bajo anestesia profunda. Todo el personal debe estar entrenado en estas técnicas. Técnica de eutanasia para grandes especies. Insensibilización de razas europeas y becerros cebuinos: Se debe utilizar una pistola de perno cautivo de penetración. El punto de aplicación se calcula trazando dos líneas imaginarias a partir de la base inferior de los cuernos, que se dirijan cada una de la comisura externa del ojo opuesto; donde se cruzan las líneas se hará el disparo, colocando el cañón del pistolete en posición perpendicular al hueso frontal. Insensibilización para ganado cebú adulto: Se debe utilizar una pistola de perno cautivo de penetración, cuyo punto de aplicación en la línea mediana será de 2 a 3 cm abajo y detrás de la cresta nucal. El cañón del pistolete será dirigido hacia la cavidad bucal. La potencia de los cartuchos dependerá del tipo de equipo utilizado y de la recomendación del fabricante. Sacrificio humanitario: Desangrado por corte de yugular. Se deberá realizar dentro de los 30 segundos después de la insensibilización. Técnica de eutanasia para ovinos Insensibilización: Se debe utilizar una pistola de perno cautivo de penetración de calibre utilizado para ganado bovino pequeño. El disparo se realizara 4cm arriba de la línea mediana de la cabeza entre los 2 ojos, colocando el cañón de la pistola apuntando hacia el hueso frontal. La potencia de los cartuchos que se deban elegir dependerá del equipo utilizado y de las recomendaciones del fabricante. Interpretación u observaciones: El cese de la respiración, del latido cardiaco y la pérdida de reflejos son buenos indicadores de la muerte. Antes del proceso de necropsia se debe confirmar la muerte del animal y en especies mayores realizar la exanguinación. Preguntas para discusión ¿Qué es eutanasia? ¿Qué es dolor? ¿Cuáles son los inconvenientes de emplear el método químico? 12/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal ¿En anatomía patológica, cual es el inconveniente del empleo del uso de pistolete con perno oculto? Evaluación: Lista de cotejo. Lugar donde se llevará a cabo: Sala de necropsia del CIESA Bibliografía: Aluja, Aline. (2002). Técnicas de necropsia en animales domésticos. 2ª ed. Ed. El manual moderno. México. Gazquez, O. A. (1988). La necropsia en los mamíferos domésticos. Interamericana. España. Lorgue, et al. (1997). Toxicología clínica veterinaria. Ed. Acribia. Zaragoza. España. Medway, W.; Prier, J.E.; Wilkinson, J.S. (1986). Patología Clínica Veterinaria. UTEHA, México. Norma Oficial Mexicana NOM-033-ZOO-1995. Sacrificio humanitario de los animales domésticos y silvestres. Sumano, López Héctor. (1997). Farmacología veterinaria. 2da ed. Ed. McGraw-Hill Interamericana. México. Thomson, R. G. (1986). Anatomía patológica general veterinaria. Ed. Acribia. Zaragoza, España. 13/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal PRÁCTICA 3: Técnicas de Necropsia Introducción: La necropsia o estudio postmortem es el estudio médico de un cadáver, incluidos los tejidos y órganos internos, con el objeto de determinar la causa de muerte mediante el análisis de los cambios patológicos. Un médico veterinario especialista en patología es quien realiza la necropsia; después de analizar el exterior del cadáver se practican las incisiones para observar los órganos internos, se extraen para su análisis visual y estudio microscópico. La necropsia se suele practicar inmediatamente después de la muerte, y para realizarla es necesaria la autorización del dueño del animal. Para el caso de la práctica, los alumnos realizarán la necropsia bajo la supervisión del profesor. Objetivo: Realizar la necropsia con el objeto de poner en evidencia lesiones macroscópicas que le permitan al alumno con la ayuda del profesor emitir un diagnóstico de la causa de muerte, tomar muestras y remitirlas al laboratorio y realizar el diagnóstico integral. Duración de la sesión: 2 horas. Material: Material y equipo de protección personal: La bata u overol son básicos para la protección de la vestimenta de calle del prosector, y limita el contacto directo con material infectocontagioso, sangre y alimento. Se debe de portar un mandil de plástico tipo “carnicero” este asegura una mayor protección contra los líquidos derivados del proceso de necropsia. Debe ser largo, que cubra preferentemente hasta el tobillo, de material suave, resistente y fácilmente lavable. El empleo del cubre bocas, permite proteger las vías respiratoria y digestiva, las cuales se exponen de forma importante cuando se trabaja con un cadáver con un padecimiento sugestivo de constituir una enfermedad zoonótica y de fácil contagio al ser humano. Los guantes de hule protegen las manos del operario, ya que son las que más están en contacto con el cadáver y residuos peligrosos biológicos infecciosos. Los guantes serán de hule flexible, pero lo suficientemente resistentes para realizar tracción, con áreas de superficie rugosa para una mayor fijación de los materiales y equipo que se manipula. El uso de lentes tipo industrial y careta de policarbonato son muy útiles para proteger la cara y los ojos del prosector de patógenos que tienen una importante diseminación, protegen del mal uso del formol y de material y residuos peligrosos biológico infecciosos que pueden impactar en la cara del patólogo. Botas de plástico que cubran perfectamente. Equipo y Materiales para la necropsia: Afilador de cuchillos, Sierra eléctrica, Cuchillos de acero inoxidable, Tijera recta de cirugía de punta roma, Tijera curva de cirugía de punta roma, Pinzas de disección, Pinzas de dientes de ratón, Serrucho, Costotomo, Ganchos, Estilete, Hacha, Hilo de cáñamo, Frascos de plástico de boca ancha, Medios de transporte 14/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal de Stuart, Tubos, Agujas vacutainer, Jeringas. Formol al 10%. Técnica: Por ser una técnica más sofisticada, se describe la técnica en bovinos. Examen físico: debe seguir el mismo patrón lógico de la historia clínica. Se hace un análisis consistente de manera que no se pase por alto ninguna parte del examen. Se debe iniciar explorando la cabeza del paciente y se procede en dirección caudal. Los datos más importantes a tener en cuenta son: Temperatura rectal Estado de las mucosas aparentes y aberturas naturales Estado de la piel, pelo o lana Condición corporal Estado de las articulaciones Reflejos Frecuencia cardiaca y respiratoria Antes de proceder a la apertura del cadáver, se debe examinar detenidamente la superficie corporal, los orificios naturales, buscando alguna alteración, presencia de parásitos, traumatismos, exudados, signos de diarrea, cambios de coloración, fracturas o lesiones en mucosas. Este examen se realiza durante la elaboración de la historia clínica. Observar sistemáticamente desde la cabeza hasta la cola incluyendo las extremidades. Pelo: observar su pigmentación, la textura y la presencia o no de parásitos. Piel: examinar su coloración, presencia de lesiones traumáticas o de cualquier otro tipo, parásitos. Mucosas: se observa principalmente su coloración, esta debe tener una coloración normal rosa, en casos específicos esta puede estar pálida. Inspección de orificios naturales externos Oído: examinar la parte interna y externa del oído, así como las áreas circundantes a este, en busca de parásitos o algún tipo de exudado o lesión. Ojos: examinar la zona periocular por si existen restos de exudados, así como la conjuntiva y globos oculares. Nariz: observar la coloración de la mucosa de los ollares; se puede comprimir desde la parte ósea a la cartilaginosa y detectar si hay algún tipo de contenido que salga por la presión. Boca: examinar la coloración de la mucosa bucal esta generalmente debe estar de un color rosa, la temperatura disminuye dependiendo el tiempo que tenga de muerto. Se revisa la posición y número de dientes. Ano: observar si está cerrado o abierto y si sus alrededores están sucios, por algún signo de diarrea, presencia de sangre o un proceso de prolapso rectal. Aparato reproductor: Macho: palpar los testículos y examinar la mucosa del pene y prepucio. Hembra: examinar tamaño y coloración de la mucosa vulvar, así como el tipo de secreción que esta tenga. Revisar la glándula mamaria externamente 15/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal (Winter, 1968). Posición del cadáver El cadáver de rumiantes adultos se coloca en decúbito lateral izquierdo con el abdomen hacia el prosector. Si se trata de animales jóvenes, estos se colocan en decúbito dorsal, con la cabeza del animal del lado derecho del operario. Incisión primaria Se comienza por la sínfisis mandibular en dirección caudal, sobre línea media hasta llegar a la sínfisis púbica. La línea de corte debe evitar las cicatrices operatorias, el pene, la glándula mamaria y en animales jóvenes el ombligo (Aluja, 2002). Desollado de piel Realizar una incisión en la línea media desde el periné pasando aún lado del pene o de la ubre hasta la sínfisis mandibular y separar piel hacia arriba hasta la línea dorsal sobre el lado derecho de las cavidades abdominal y torácica, cuello y cabeza. Observar estructuras expuestas, glándulas salivales y nódulos linfáticos. Para realizar la separación de la piel en animales adultos, se efectúan cortes en el costado superior cortando los músculos pectorales entre la extremidad derecha y el tórax. En el caso de animales jóvenes se hacen cortes perpendiculares a la línea media en las regiones axilar e inguinal y se comienza a debridar. Desarticulado de articulación coxofemoral y escapular Levantar la extremidad torácica derecha y realizar un corte a lo largo de la axila despegando la escápula y dejando el miembro unido al cuerpo solamente por la piel. Realizar la misma operación con el miembro pelviano derecho, desarticulando la articulación coxofemoral. Revisar la piel por su lado interno y evaluar la cantidad y el estado de la grasa subcutánea. Inspección de tejido subcutáneo Una vez quitada la piel total o parcialmente se examina el tejido subcutáneo, músculos y nódulos linfáticos. Se debe observar el aspecto microscópico de la sangre examinando la coloración y lo rápido que coagula. Inspección de nódulos linfáticos superficiales Revisar los nódulos linfáticos esternales craneales, mediastínicos craneales, intercostales, subilíaco y poplíteo examinando el tamaño, color, textura y se realiza un corte transversal, para revisar el interior del nódulo, en el animal vivo se revisa la temperatura, superficie y tamaño de los nódulos linfáticos superficiales. Inspección de músculos superficiales Se inspeccionan los músculos superficiales para detectar alguna marca que indique algún golpe. Cavidad ocular: Los cambios posmortem se establecen rápidamente en el globo ocular, cuando se requiere un estudio de ojos estos deben extraerse antes de iniciar los demás pasos de la necropsia. Enucleación del ojo Para la enucleación del globo ocular se debe separar la piel por medio de una incisión oval que se hace alrededor de los parpados, así se expone la órbita, con pinzas se fija la 16/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal conjuntiva y se corta hasta permitir la introducción de tijeras curvas de punta roma para separar los músculos y el nervio óptico, se extrae el globo con todas sus estructuras, posteriormente se separan y se examinan. Cavidad auricular: Inspección. Se observan los conductos externos en busca de parásitos, eritema, secreción y olor. Cavidad oral Encías Se revisa la coloración de las encías y si existe algún tipo de traumatismo. Lengua Para la extracción de la lengua se realiza un corte por la cara interna de las mandíbulas hacia la entrada del tórax (Winter, 1968). Se desarticulan los huesos hioides y disecar la tráquea a lo largo. Observar estructuras expuestas, glándulas salivales y nódulos linfáticos. Dientes Las características más destacadas de la dentición bovina son la ausencia de dientes incisivos y caninos en la arcada dentaria superior y la asimilación de los caninos a los incisivos en la arcada dentaria inferior. Como el primer diente premolar, tanto superior como inferior no se desarrolla. Paladar: En animales neonatos se examina el paladar duro en busca de hendiduras. Faringe y laringe: Se examinan la faringe y laringe, para cerciorarse de que estén libres de alguna secreción u objeto extraño. Revisar tiroides y nódulos linfáticos. Cavidad articular: Estas se examinan preferentemente antes de abrir las demás cavidades. Se incide la piel teniendo el miembro por examinar en flexión; deberá observarse su tamaño, aspecto externo y consistencia; posteriormente se practica un corte para examinar fascias y superficies óseas). Cápsula sinovial. Una vez realizado el corte de piel y separación de ligamentos se expone la membrana sinovial, examinando su color y textura. Liquido sinovial. Se realiza una incisión a la cápsula para examinar el líquido sinovial revisando la cantidad, viscosidad y color. Aparato respiratorio: Apertura de cavidad torácica Antes de realizar su abertura se introduce la punta de cuchillo en diafragma para verificar si se escucha el ruido que ocasiona cuando el pulmón colapsa, en caso contrario debemos tomar en cuenta la posibilidad de encontrar alguna alteración en pulmón o bien en cavidad torácica. Antes de la extracción de los órganos se deben observar las estructuras en su posición para verificar si corresponde a lo normal, después se procede a la extracción de los órganos para ser examinados. La cavidad torácica se abre separando el diafragma de su unión costal y luego cortando hacia adelante por las uniones costoesternales. Seguidamente separar las costillas entre sí cortando los músculos intercostales e ir rompiéndolas una a una a nivel de la unión 17/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal costovertebral, una vez descubierto el tórax se observa la posición de los órganos para verificar si corresponde a lo normal. Si se trata de un animal adulto las costillas se pueden retirar haciendo uso de un costotomo y se realiza un corte en la unión costoesternal y después lo más cerca de la unión costovertebral para retirar de tajo la pared costal. Tráquea. Despegar los pulmones, tráquea y corazón y cortar las estructuras cerca del diafragma, la única estructura que no se corta es el esófago. Abrir la tráquea a lo largo y examinarla. Si hay presencia de espuma se deben de tomar en cuenta cuatro posibles causas: 1. Debido al avanzado cambio posmortem 2. Método de eutanasia usado 3. Posible problema respiratorio 4. Posible problema cardiaco Pulmones. Palpar los pulmones, abrir la bifurcación bronquial y continuar cortando a lo largo de los bronquiolos. Examinar y cortar los pulmones en varias áreas. Revisar nódulos linfáticos mediastínicos. Arteria pulmonar. La arteria pulmonar se corta en el hilio del pulmón y se revisa el grosor de su pared. Venas pulmonares. Las venas pulmonares se cortan en el hilio del pulmón, revisar el grosor de su pared. Nódulos linfáticos. Se extraen los nódulos linfáticos cervicales mediastínicos medios, nódulos linfáticos mediastínicos caudales, los traqueobronquiales y se examinan. Diafragma. Una vez separado el diafragma se examina su coloración y textura, revisando cuidadosamente que no tenga alguna ruptura o perforación principalmente cuando se sospecha de retículo pericarditis traumática. Aparato digestivo: Apertura de cavidad abdominal. Para la exposición de las vísceras abdominales, se hace un corte, siguiendo la línea medía, desde la apófisis xifoide hasta la sínfisis púbica. Se separan todos los órganos digestivos de la cavidad y se extraen. Esófago. El esófago queda en cavidad torácica y solo se separa del diafragma, este se abre a lo largo para revisar su interior. Rumen. Se separa el epiplón y se expone el rumen en una superficie para examinar su contenido. Retículo. Se realiza un corte para revisar su contenido, especialmente este compartimiento sufre alteraciones por algún cuerpo extraño que puede causar la perforación del mismo (Retículo pericarditis traumática). Omaso. El omaso se abre y se inspecciona su interior. Abomaso. Se realiza una incisión para revisar interior y contenido en busca de parásitos. 18/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Intestino delgado. El intestino se separa a todo lo largo del mesenterio, para posteriormente abrirlo a lo largo, identificando y examinando sus porciones: duodeno, yeyuno e íleon. Ciego. Se revisa que su superficie sea lisa y se realiza una incisión para revisar contenido y la presencia de gas y parásitos. Válvula Ileocecal. Se revisa su coloración y textura. Intestino grueso. Se realiza el mismo procedimiento descrito para el intestino delgado en sus porciones: colon y recto. Hígado. Liberar el hígado de sus ligamentos falciforme, redondo, triangular derecho e izquierdo, coronario, hepatorrenal, hepatogátrico, hepatoduodenal; se corta la vena cava, se inspecciona su textura, tamaño, color y se realizan varios cortes para examinar el parénquima hepático. Se deja una porción de duodeno pegado al hígado para luego cortarlo longitudinalmente y verificar la permeabilidad del conducto colédoco. Se inspecciona inicialmente la cápsula fibrosa perivascular, ésta debe estar lisa, su color normal es de diferentes tipos de rojo. El tamaño es difícil de evaluar dado el tamaño del animal, pero cuando se encuentra aumentado de tamaño, por lo general los bordes se notan redondeados. Los conductos hepáticos se abren para la búsqueda de parásitos principalmente en rumiantes la presencia de Fasciola hepática. Se examinan los nódulos linfáticos portales. Vesícula biliar. La vesícula biliar se oprime un poco para revisar que la salida de bilis se dé hacia duodeno por el conducto colédoco, luego se procede a abrir y revisar su interior. Bazo. El bazo una vez separado del rumen se inspecciona su tamaño, color, textura y se secciona en varios cortes para revisar el parénquima. Páncreas. Este órgano esta junto con el duodeno y al separarlo se revisa alguna anormalidad. Este órgano es uno de los que sufren autolisis rápidamente, esto debe tenerse presente al interpretar los cambios encontrados. Nódulos linfáticos mesentéricos. Se revisa el mesenterio que fue separado del intestino delgado y del grueso ya que unido a este se encuentra la cadena de nódulos linfáticos mesentéricos yeyunales y se examinan su tamaño, consistencia y coloración. Aparato circulatorio: Pericardio. Abrir el saco pericárdico y examinar las superficies peri y epicárdicas, una vez abierto el pericardio se buscan adherencias del mismo con el epicardio. Miocardio. Para exponer las cavidades junto con sus orificios se procede a abrirla, con tijeras o cuchillo siguiendo la dirección de la corriente sanguínea. El estudio del miocardio se realiza mediante un corte en el septo interventricular, en donde se debe apreciar el color y la consistencia, que en caso de infarto se verá aumentada. Endocardio. Aquí se deben revisar las válvulas mitral o bicúspide y la tricúspide ó atrioventricular derecha; en las superficies se debe buscar cambios de color, grosor y consistencia. Revisar las cuerdas tendinosas. Aurículas. Las aurículas se inspeccionan externa e internamente. Ventrículos. Para el corazón derecho, se hace un corte longitudinal en vena cava y se entra a aurícula derecha, pasando por la válvula tricúspide se llega a ventrículo derecho y se corta a lo largo del borde que forma el miocardio derecho con el septo interventricular 19/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal hasta llegar al orificio de la arteria pulmonar. Para abrir el corazón izquierdo, se entra por venas pulmonares para llegar a aurícula y de ahí a ventrículo izquierdo, pasando por la válvula bicúspide. Válvula mitral o bicúspide. Si se sospecha de alguna alteración en las válvulas como lo es una estenosis la abertura del corazón debe ser diferente, este se realiza en la unión de la aurícula y el ventrículo y así quedaran expuestas y se verificara su buen cierre retirando todo el contenido de sangre y colocando agua simulando los movimientos de sístole y diástole, se debe examinar su textura y si están engrosadas. Válvula tricúspide. Para la revisión de esta válvula se hace siguiendo el mismo procedimiento que para la válvula mitral. Válvulas semilunares. Para la revisión de estas válvulas se hace siguiendo el mismo procedimiento que para la válvula mitral. Vena cava craneal y caudal. Se revisa su inserción con la aurícula derecha y se abre a lo largo para revisar su interior. Arteria aorta. Se inspecciona su diámetro, grosor de las paredes, el endotelio y las válvulas semilunares. Sistema nervioso: Desarticulación atlanto-occipital. La cabeza se separa del tronco del animal practicando un corte a nivel del agujero magno y separando el cráneo de las estructuras que lo unen con la vértebra atlas, se secciona la musculatura del cuello y la piel. Cerebro. Para abrir el cráneo óseo se desprende la piel y los planos musculares y tejidos blandos epicraneales, realizando cortes desde el agujero magno hasta la cresta temporal adyacente a la base de la oreja; un segundo corte se prolonga hasta las inmediaciones de la apófisis cigomática del frontal y por último, un tercer corte se lleva hasta la sutura interfrontal en dirección del ángulo lateral, haciendo esto en ambos lados del cráneo con una sierra circular. Se puede emplear una sierra de mano, haciendo un corte en la cabeza a través de los huesos frontales en un punto justo caudal a los arcos cigomáticos. Se pueden realizar cortes de los límites laterales del foramen occipital hasta la cara interna de la apófisis corneal. La evisceración del encéfalo se realiza mediante la abertura de la cavidad craneal, retirando los huesos planos y dejando al descubierto meninges, cerebro, epífisis. Realizada la craneotomía se pueden apreciar las meninges y sus adherencias con sus huesos craneales, en caso de que las hubiese; se realiza un corte longitudinal de las meninges para la observación del encéfalo y su evisceración, con un previo corte de los nervios craneales. El examen interno del encéfalo se realiza mediante cortes paralelos a la cisura longitudinal, a nivel del surco marginal, evidenciando las cavidades ventriculares y su contenido. Cerebelo. El cerebelo se separa del encéfalo y se realizan cortes en rodajas para su inspección microscópica. Médula espinal. El método elegido para extraer la médula espinal se determina por el tipo de la lesión de la que se sospeche, la experiencia del prosector y el equipo disponible. 20/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Para extraer la médula, se secciona la columna vertebral a lo largo de un plano vertical perpendicular a las apófisis transversas, a uno de los lados de la columna. Una sierra eléctrica es la que permite que los cortes sean más limpios y controlados. En cada segmento se extrae la médula espinal tomando la dura madre con pinzas y cortando a través de las raíces de los nervios espinales con un par de tijeras. Las secciones asociadas de vértebras se pueden volver a cortar longitudinalmente para examinar el canal medular y las articulaciones intervertebrales. Los cortes se realizan a distintos niveles: en las regiones cervicales, torácicas y abdominales. Nervios periféricos. Los cortes se deben dar a distintos niveles: en las regiones cervicales, torácicas y abdominales. Por regla general, nos referimos, como descripción macroscópica a la consistencia y coloración. Cavidad pélvica: Se abre una vez extraídas las vísceras abdominales, con el fin de tener una buena visibilidad, se recomienda hacer dos cortes con sierra o hacha a cada lado de la sínfisis púbica, atravesando el pubis y la arcada isquiática. Riñones. El riñón derecho se encuentra frecuentemente debajo de la última costilla y de las apófisis transversas de las dos o tres primeras vértebras lumbares, mientras que el izquierdo está situado más ventralmente y bajo la segunda y cuarta vértebras lumbares. Una vez abierta la cavidad pélvica se examinan los riñones que se encuentran adosados a la pared lumbar, se extraen desgarrando la grasa circundante sin separarlos de los uréteres. Se liberan junto con las adrenales, hasta llegar a la vejiga urinaria. Posteriormente se abren los riñones por la curvatura mayor a lo largo por el centro o mediante unos cortes en forma de rodaja, se retira la cápsula y se examina la superficie exterior. Uréteres. Los uréteres se inspeccionan introduciendo un estilete en su luz, con el fin de comprobar la continuidad de los conductos. Luego se cortan longitudinalmente para observar la mucosa. Vejiga. La vejiga se inspecciona practicando un corte desde el fondo de saco ciego hasta el cuello de la vejiga, se limpia la mucosa para apreciar su coloración, erosiones, cicatrices, ulcera y finalmente se estudia la pared, especialmente su grosor. Aparato reproductor de la hembra La inspección externa debe incluir la observación de la posición, especialmente en animales en estado de gravidez o con posibles patologías. Después de su inspección se retiran juntos los ovarios, cuernos uterinos, riñones, uréteres y vejiga. La evisceración del aparato genital en las hembras se realiza seccionando los ligamentos y adherencias con la cavidad pélvica (mesovario, mesosalpix y mesometrio) y extraemos todo el aparato genital en dirección cráneo caudal. Vulva. Se realiza la inspección de la mucosa así como su coloración textura y tipo de secreción. Vagina. Se revisa el color, grosor y aspecto de la mucosa. Ovarios. Después de su palpación se realizan cortes longitudinales para revisar el parénquima. 21/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Glándula mamaria. Al hacer una incisión primaria en la piel se separa la glándula con piel y nódulos mamarios o inguinales superficiales. Palpar y cortar ambos cuartos. Abrir los pezones y cisternas en caso de que se sospeche de mastitis. Aparato reproductor del macho: Se incide entre el escroto y el dartos y en dirección craneal se van separando los testículos, epidídimo y el cordón espermático. Posteriormente se separan las glándulas accesorias de la cavidad pélvica, previa sección del músculo isquiouretral y pliegue urogenital. Extraemos en bloque: testículos, conductos deferentes y glándulas sexuales accesorias. Escroto. Estos ya han sido examinados en el examen externo. Testículos. Los testículos se observan y se palpan examinando el grosor de las envolturas, registrando cambios en forma, tamaño y consistencia. Luego, se practican cortes longitudinales para buscar cambios en el parénquima. El examen del epidídimo debe incluir un corte de su cola para verificar la salida de líquido seminal, y también deben buscarse procesos inflamatorios. Hay que identificar las glándulas vesiculares, el conducto deferente y la próstata para observar cambios en ellos. Pene. Se examina al hacer una incisión primaria en la piel, se expone el pene y se revisa la mucosa. Sistema músculo-esquelético Las masas musculares también deberán ser palpadas y examinadas mediante cortes transversales y longitudinales. Inspección de senos nasales y frontales Se divide la cabeza longitudinalmente en dos partes con la ayuda de una sierra, se revisa el contenido. Interpretación u observaciones: Realizar el diagnóstico presuntivo. Llenar el formato de necropsias disponible en el CIESA. Preguntas para discusión: ¿Cuál es la posición del cadáver para la necropsia? ¿Qué procedimiento de implementará para evaluar al corazón? ¿En base a qué se establece el diagnóstico anatomopatológico? Evaluación: Se tomará lista de cotejo 22/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Lugar donde se llevará a cabo: La necropsia se realizará en la sala de necropsias del CIESA; se podrá realizar la necropsia en campo. Bibliografía: Aluja, Aline. (2002). Técnicas de necropsia en animales domésticos. 2ª ed. Ed. El manual moderno. México. Gazquez, O. A. (1988). La necropsia en los mamíferos domésticos. Interamericana. España. Lorgue, et al. (1997). Toxicología clínica veterinaria. Ed. Acribia. Zaragoza. España. Medway, W.; Prier, J.E.; Wilkinson, J.S. (1986). Patología Clínica Veterinaria. UTEHA, México. Norma Oficial Mexicana NOM-033-ZOO-1995. Sacrificio humanitario de los animales domésticos y silvestres. Sumano, López Héctor. (1997). Farmacología Veterinaria. 2da ed. Ed. Mcgraw-Hill Interamericana. México. Thomson, R. G. (1986). Anatomía patológica general veterinaria. Ed. Acribia. Zaragoza, España. 23/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Práctica 4: Toma, conservación y envío de muestras al laboratorio. Introducción: Muestra es todo aquel material biológico obtenido del individuo vivo o muerto, de la población susceptible o de su ambiente y representativa del problema de estudio. La consulta de laboratorios privados u oficiales para el control de enfermedades, a través del envío de muestras es una herramienta auxiliar para el Médico Veterinario en la solución de problemas. Con frecuencia este esfuerzo es inútil por una mala colección de la muestra o un manejo inadecuado de la misma. Para lograr los mejores beneficios en cuanto al apoyo de los laboratorios de diagnóstico, es necesario tener en cuenta los principios básicos sobre la correcta selección, empaquetado y envío de muestras. El procedimiento que se requiere para elegir el material a analizar a partir de la totalidad de los individuos u objeto de estudio, dependerá del tipo de producto y de la finalidad del examen. En procesos de enfermedad, la selección de la muestra debe recaer en el animal que se encuentre en etapa temprana de la fase aguda de la enfermedad y acorde a los datos de la historia clínica. Es preferible remitir varios especímenes de la población, sobre todo en brotes epizoóticos y en animales cuyo costo por unidad no sea tan elevado, deben elegirse animales recientemente muertos y varios en diversos estadios de la enfermedad. Es conveniente señalar que el envío de las muestras al laboratorio deberá realizarse tan rápido como sea posible, ya que se corre el riesgo de su inutilización por descomposición. Objetivo: Realizar la toma de muestras para los diferentes exámenes de laboratorio. Duración de la sesión: 2 horas. Material: Bolsas de plástico estériles. Frascos estériles. Etiquetas. Jeringas de 5, 10 y 20 ml. (desechables). Agujas para jeringa (desechables). Tubos de vacío tipo vacutainers, con EDTA, heparina, con o sin vacío. Agujas para tubos vacutainer. Hisopos bacteriológicos. Etiquetas para frascos. Marcadores a prueba de agua. Hielo natural. Hielo seco. 24/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Líquido refrigerante. Formalina al 10 %. Fenol al 0.5 %. Tolueno. Técnica: Toma y envío de muestras para estudio histopatológico Obtención: La obtención de muestras implica tener conocimiento de anatomía patológica macroscópica. Una vez que se identifica la muestra deseada, debe obtenerse de modo atraumático, ya que su morfología puede cambiar si se manipula excesivamente y mediante técnicas inadecuadas de obtención. La muestra debe ser representativa del tejido dañado, debe extraerse con rapidez y destreza, sobre todo, deben colocarse de inmediato en un buen fijador para inactivar las enzimas autolíticas. Fijación: La fijación química se usa en especímenes histológicos, con el fin principal de detener la autólisis postmortem. Los fijadores inactivan por desnaturalización de proteínas las enzimas autolíticas que causan los cambios postmortem. Los fijadores que se utilizan con más frecuencia son formaldehído, glutaraldehído, paraformaldehído, alcohol etílico, cloruro de mercurio o ácido crómico. Cada uno de ellos tiene propiedades específicas que a su vez confieren ventajas y desventajas. La proporción entre fijador y tejido deberá ser por lo menos de 10:1 en volumen. El tiempo para la fijación completa de los tejidos varía según las propiedades de difusión, la concentración del fijador, de acuerdo con la densidad del tejido, que por lo general se fija en 24 hrs. Toma y en envío de muestras al laboratorio para examen toxicológico La elección de la muestra es importante en la ejecución del análisis químico. Las muestras deberán obtenerse exentas de contaminación y residuos químicos, no deben ser lavadas para evitar la posibilidad de arrastrar residuos del agente químico o de contaminación con el agua. Debe considerarse que frecuentemente se trabajara con cantidades vestigiales de un determinado producto químico y que incluso la contaminación más ligera puede originar resultados erróneos. Entre los productos enviados para el análisis debe incluirse una muestra del material sospechoso, muestra de contenido del aparato gastrointestinal como prueba de que el material ha sido ingerido y otra de un tejido, casi siempre hígado, riñón, sangre y orina; por lo menos 250 gr. de cada órgano, que garantice que se ha producido la absorción del veneno. Cada órgano debe enviarse por separado en un recipiente claramente etiquetado. Los recipientes mejores son los bocales de polietileno con tapa roscada. Las bolsas de polietileno son útiles para órganos como el hígado y riñón. Si se efectúan diversas tomas de muestras; colocar obligatoriamente cada muestra en un envase diferente. En 25/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal circunstancias ideales, se ha de conservar material para duplicar los análisis o hacer otros alternativos, si es necesario. Las muestras deben conservarse en congelación a bajas temperaturas mientras esperan su envío al laboratorio, y es preferible no utilizar ningún conservador, antiséptico o fijador, aunque no siempre es posible debido a la temperatura ambiente y la distancia al laboratorio. Tomando en cuenta la Norma Oficial Mexicana NOM-004-ZOO-1994, Control de residuos tóxicos en carne, grasa, hígado y riñón de bovinos, equinos, porcinos y ovinos se hace mención de los requisitos a cumplir en la recolección y envió de muestras al laboratorio, siendo puntos importantes. Toma y en envío de muestras al laboratorio para el estudio virológico Con la aparición y reaparición de enfermedades virales en todo el mundo es indispensable garantizar la no presencia de estas en los animales que se comercializan en todo el mundo. El diagnóstico virológico en el laboratorio se realiza por medio de: Citología e histopatología: estás técnicas son utilizadas para examinar tejidos sospechosos infectados, con la finalidad de identificar lesiones resultado de la presencia viral o bien son utilizados para detectar virus presente en los tejidos a través de inmunofluorescencia. Aislamiento e identificación del agente viral. Demostración del incremento significativo del título de anticuerpos. Las muestras en animales muertos o sometidos a necropsia deben obtenerse en términos de pocas horas, ya que en caso contrario los virus pueden ser destruidos por desecación, inactivación térmica o descomposición bacteriana. La recomendación general para la colección de los especímenes para estudio virológico es que éstos deben ser colectados en la fase aguda de la enfermedad, es decir, los primeros días. La muestra se envía con la historia clínica y el diagnóstico presuntivo. Toma y en envío de muestras al laboratorio para micología. Micosis superficiales: Raspados cutáneos del borde de una lesión activa y pelo son las muestras preferidas para el aislamiento de dermatofitos. Deben ser enviados al laboratorio en un tubo estéril tapado con algodón, un vial o sobre de celofán. Los hongos saprofitos frecuentemente proliferan si las muestras son enviadas en medio de cultivo. Micosis profundas: Las muestras (tejidos y órganos) deben ser enviadas en condiciones semejantes a las de bacteriología. Muestras de alimentos: Granos forrajeros, balanceados o cama deben ser enviados en bolsas de papel al laboratorio, si existe demora para su envío debe refrigerarse. Toma y en envío de muestras al laboratorio de bacteriología 26/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal El éxito y valor final de examinar una muestra clínica en el laboratorio de bacteriología, depende inicialmente del cuidado ejercido en la selección, recolección y envío de la muestra. La muestra seleccionada debe ser la que sea más probable de contener el agente causal y se debe hacer un esfuerzo para evitar su contaminación con organismos del medio ambiente. Muestras para cultivo bacteriológico Sangre: Tomar la muestra de sangre (5 a 10 mL) y colocarla en un tubo con anticoagulante; se prefiere el polyanetosulfonato de sodio (SPS) al 0,05 - 0,25%. El oxalato, citrato y EDTA no se recomiendan por inhibir el crecimiento de microorganismos*. * Si se posee botella de hemocultivo, recolecta la sangre directamente en esta. Todos los procedimientos mencionados deben realizarse de manera aséptica y enviarse evitando contaminar la muestra. Tejidos y órganos: Su tamaño debe ser mínimo de 3 x 3 cm., colocadas en bolsas individuales de polietileno u otros recipientes estériles. También es posible esterilizar los frascos o tubos de ensayo, poniéndolos a hervir con sus tapas, por espacio de 30 minutos. En caso de porciones de intestino deberán enviarse con los extremos atados y empacados individualmente. Hisopos: Son la forma preferida para enviar muestras de secreciones (nasal, faríngea, ocular, cutánea, cervical, vaginal, etc.), exudados, contenido de abscesos, etc., introducidos en medio de transporte adecuado y enviados en refrigeración. Heces: Las muestras fecales deben ser recolectadas directamente del recto del animal para evitar contaminación, puestas en un envase hermético y enviadas en refrigeración. Se debe evitar el envío de excretas expuestas a medio ambiente. En caso de animales grandes, la muestra puede ser enviada dentro del mismo guante plástico que se utilice para su recolección. Leche: Las muestras se deben recolectar asépticamente en envases estériles con tapa de rosca. Se debe esperar resultados negativos si estas se toman durante el tratamiento. Las muestras se deben refrigerar inmediatamente y enviarlas al laboratorio lo antes posible. Orina: Se utiliza un recipiente estéril; el sondeo vesical es la forma ideal para evitar la contaminación, en su defecto, la micción espontánea es la técnica aconsejable. La muestra debe enviarse al laboratorio en refrigeración... 27/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Cerebro: Coloque la mitad del cerebro en una funda de polietileno y envíe al laboratorio en refrigeración. Hemocultivo: En la mayoría de infecciones, tres a cuatro muestras de sangre (2 a 5 mL) tomadas en un período de 24 horas, deben enviarse tanto para cultivo aerobio como anaerobio. El 90% de los cultivos positivos se obtendrán con este número de muestras; animales con infección severa y bajo quimioterapia pueden requerir más muestras. Estas deben ser recolectadas en botellas con 50 ml. de medio de cultivo y en animales pequeños 20 ml. son suficientes. Si la sangre se coloca inmediatamente en el medio de cultivo no debe usarse anticoagulante; en caso contrario, el uso de SPS en más recomendable (no se recomienda el uso de citrato y oxalato). Una vez recolectada la muestra, debe ser inoculada en la botella e incubada a 37°C. Nunca refrigere la muestra una vez inoculada en la botella. Análisis de agua: Una muestra de agua (50 mL aprox.) sin preservativos debe ser enviada al laboratorio en un frasco estéril en condiciones de refrigeración. Cultivos anaerobios: La muestra es obtenida aspirando con una jeringa sin introducir aire en ésta; el contenido de la jeringa es entonces transferido a un frasco con medio de transporte anaerobio. Toma y en envío de muestras al laboratorio para exámenes relacionados con patología clínica. La mayoría de estos se efectúan con muestras de sangre sin coagular, por lo que se recomienda agregar alguna sustancia anticoagulante que no disminuya o enmascare la confiabilidad del estudio. Consideraciones generales para la toma de muestras de sangre. Evitar colocar el bisel de la aguja hacia abajo pues imposibilita el paso de sangre. No usar agujas húmedas ya que se hemolizan los glóbulos rojos. Evitar usar el anticoagulante en solución pues se diluye la sangre. El no retirar la aguja de la jeringa antes de llenar el tubo donde se depositará la sangre, provoca la ruptura de los glóbulos rojos (hemólisis). El no mezclar en forma homogénea la sangre con el anticoagulante, ocasiona la formación de coágulos. Para la extracción de sangre puede utilizarse el sistema de tubos al vacío (tipo vacutainer), que presentan mayor facilidad de uso y garantía en cuanto a la asepsia y preservación de las muestras; este sistema manejado en forma adecuada presenta un menor riesgo de hemólisis de las muestras, con respecto al sistema de extracción con jeringa. La sangre para análisis puede obtenerse de las venas, las arterias o los capilares. La mayoría de las muestras de sangre se obtienen por punción venosa. 28/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal La orina. Se obtiene inmovilizando al animal, utilizando sonda o bien recolectarla en el momento de la micción, de acuerdo con el análisis que se va a realizar en ella. Debe señalarse que una correcta obtención de orina condicionará la adecuada interpretación de los datos obtenidos. En el pasado y hoy en día, se utilizan todo tipo de recipientes para su colección, lo que origina un gran número de errores, debido a las interferencias producidas por contaminantes contenidos en los recipientes. Para evitar estos problemas, conviene usar recipientes limpios de plástico desechable, de un solo uso. Las heces. Se recogen para diferentes tipos de análisis: determinación de sangre oculta, estudios de contenido de nitrógeno y grasas. El análisis de sangre oculta se realiza con pequeñas cantidades de heces, recogidas con una espátula. Las heces se aplican directamente sobre las películas reactivas y se llevan al laboratorio para su análisis. Los estudios microbiológicos (coprocultivo) requieren la recogida de las heces en condiciones estériles. Los recipientes de recogida suelen tener unido al tapón una pequeña cucharilla para extraer las heces en el laboratorio. Para los análisis parasitológicos deben llevarse las muestras lo más rápidamente posible al laboratorio, pues el examen conviene efectuarlo sobre heces frescas, recién emitidas. Cuando no pueda hacerse así, se debe utilizar un medio de conservación que fije y conserve los protozoos. El líquido cefalorraquídeo. Se obtiene normalmente por punción lumbar y en la cisterna Magna, que debe ser hecha siempre por un médico capacitado y con el animal inmovilizado. En caso de punción hemorrágica, la primera muestra es la más hemática, pero si ya existe hemorragia, las muestras son igualmente hemáticas. El LCR se utiliza, en parte, para el recuento de células y el resto se centrífuga y se hace una extensión del sedimento, que se tiñe con Wright o Giemsa para determinar la fórmula leucocitaria y con tinción de Gram para observar la presencia de microorganismos. El líquido también se emplea para los cultivos microbiológicos. El LCR debe cultivarse lo antes posible; cuando no pueda hacerse, debe mantenerse a 4ºC en refrigerador hasta que pueda realizarse el cultivo. Efusión o derrame. Es la acumulación patológica de líquido o gases en una cavidad, entre los que se incluyen el saco pericárdico, el espacio pleural, el espacio peritoneal y los espacios articulares. Los líquidos de estos espacios se denominan, respectivamente, líquido pericárdico, pleural, peritoneal (ascítico) y articular (sinovial). En condiciones normales, el volumen de estos líquidos es muy escaso, pero en situaciones patológicas puede acumularse en grandes cantidades. Los principales análisis que se realizan en las efusiones serosas son: examen físico, estudio bioquímico, estudio bacteriológico y estudio citológico. Los líquidos se obtienen en varios recipientes estériles, uno de los cuales debe llevar un anticoagulante para el recuento celular y el diferencial leucocitario. La técnica de obtención del líquido pericárdico se denomina pericardiocentesis; la del líquido pleural, toracocentesis; la del peritoneal, laparocentesis y la del articular, artrocentesis. 29/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal El líquido amniótico. Se obtiene por punción abdominal, mediante una técnica denominada amniocentesis. Hisopados. Las muestras de material de superficies o exudados para los análisis microbiológicos se recogen con un hisopo. Actualmente existe una gran cantidad de hisopos con medios de transporte adecuados. Los hisopos existentes en el mercado consisten en un recipiente cilíndrico, cerrado y esterilizado, que contiene el medio de transporte. Una vez usado el hisopo, se introduce en la cámara que contiene el medio, quedando la muestra sumergida en éste. De esta forma puede mantenerse durante varios días, aunque lo más adecuado es llevarlo cuanto antes al laboratorio para su análisis. Interpretación u observaciones: Llenar las distintas hojas para los estudios complementarios disponibles el CIESA. Preguntas para discusión: ¿Cuáles son las consideraciones generales y específicas para la toma de muestras para el estudio histopatológico? Si el formol viene a una concentración del 40%, ¿cómo debe de hacer la dilución para prepararlo al 10%? Durante la necropsia, ¿cuál es la muestra más adecuada para enviar al laboratorio en el caso de una intoxicación en donde la vía de entrada fue la digestiva? Evaluación: Se tomará lista de cotejo para verificar que se hayan tomado las distintas muestras. Lugar donde se llevará a cabo: Sala de necropsias del CIESA Bibliografía: Alamargot, Jacques. (1986). Manual de anatomía y de necropsia de las aves. Ed. CECSA. México. Aluja, Aline. (2002). Técnicas de necropsia en animales domésticos. 2ª ed. Ed. El manual moderno. México. Balcells, A. (1990). La clínica y el laboratorio. 15ª ed. Ed. Salvat. México. Balows, Albert; Hauster, Willian J.; Herrman, Kenneth. Isemberg, Henry d.; Shadomy, Jean. (1991) Manual of Clinical Microbiology 5ª ED. Library of Congress., U.S.A. Coffin, D.L. (1987). Laboratorio Clínico en Medicina Veterinaria. La Prensa Médica Mexicana, México. Coles. H, Embert. (1986). Diagnóstico y patología en veterinaria. 4ª ed. Ed. Interamericana. México. 30/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Couto, Jurado. (1989). Toxicología veterinaria. 2ª ed. Ed. Salvat. Barcelona. España. De Buen de Argüero, Nuria. (2001). Citología diagnóstica veterinaria. Ed. Manual Moderno. México. Doxey, D.L. (1987). Patología Clínica y procedimientos de Diagnóstico en Veterinaria. El Manual Moderno, México. Garner. R. J. (1970). Toxicología veterinaria. 3ª ed. Ed. Acribia. Zaragoza, España. Gazquez, O. A. (1988). La necropsia en los mamíferos domésticos. Interamericana. España. Kraft, H. (1998). Métodos de laboratorio clínico en medicina veterinaria de mamíferos domésticos. 3ª ed. Ed Acribia. Zaragoza, España. Lorenz, D. Michael. (1990). Diagnóstico médico de los pequeños animales. Ed. Acribia. Zaragoza, España. Thrusfield, M. (1990). Veterinary epidemiology. Butterworths, London. Tizard, Ian. (1992). Inmunología veterinaria. 4ª ed. Ed. McGraw-Hill Interamericana. USA. 31/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Unidad II Práctica 5: Degeneración, necrosis, apoptosis y autolisis Introducción: La identificación de lesiones macroscópicas y microscópicas es fundamental para entender el proceso patológico en los diferentes aparatos y sistemas; y así determinar la causa de muerte en los animales. La degeneración, la necrosis, la apoptosis y la autolisis son lesiones básicas que debe conocer el estudiante. Objetivo: Identificar las características macroscópicas y microscópicas de las degeneraciones, necrosis, apoptosis, autolisis en los tejidos animales. Duración de la sesión: 2 horas. Material: Piezas preservadas, cadáver y órganos de decomiso para identificar las lesiones macroscópicas. Laminillas obtenidas de la colección de patología y laminillas de los casos procesados por los estudiantes durante los procesos de necropsia. Microscopio óptico con sistema de pantalla para la discusión de lesiones microscópicas. Técnica: Los tipos de lesiones son poco numerosas y cada una de ellas presenta características por las que se les puede identificar; por ejemplo las características de la inflamación, que es la lesión más frecuentemente observada son: rubor, dolor, calor, aumento de volumen y pérdida de la función. Se les denomina lesiones macroscópicas, a las lesiones que pueden ser apreciadas a simple vista, son suficientemente grandes y se encuentran en las estructuras anatómicas superficiales o, por auscultación, percusión o radiografía si se encuentran en órganos internos. Se requiere una considerable experiencia y una observación cuidadosa para el reconocimiento de los aspectos macroscópicos en los diversos tejidos. En otros casos las lesiones son tan pequeñas que son apreciadas solo a través del estudio histológico de cortes titulares observándolos con un microscopio de luz, electrónico o con uno de barrido. El estudio de las lesiones microscópicas se puede realizar en muestras obtenidas durante la necropsia o a través de biopsias. La producción 32/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal de las lesiones no es un hecho estático, sino un proceso dinámico que se estudia a través de la patogenia la cual explica el cómo y por qué se dañan los tejidos. La comprensión de la patogenia de las lesiones es primordial para que el médico veterinario logre diagnosticar, tratar, prevenir e impedir el desarrollo de los padecimientos que aquejan a los animales. Desde el punto de vista clínico, el desarrollo de una enfermedad puede ser un proceso agudo cuando el animal sana completamente o muere en un lapso corto o bien, puede ser un proceso crónico cuando las lesiones se desarrollan durante un tiempo muy prolongado y las disfunciones que provocan son compensadas por los sistemas de homeostasis que las vuelven compatibles con la vida. Sin embargo en el estudio histológico, los conceptos de crónico y agudo varían un poco. Terminología de la inflamación El proceso inflamatorio se definirá en base a diversos criterios de clasificación en cuanto a: Órgano: se agrega la terminación itis al sufijo griego o latino con que se denomina al órgano (encefalitis, enteritis…). en algunos casos se utiliza un prefijo u otra palabra para denotar con mayor precisión el sitio anatómico afectado (bronconeumonía, otitis media etc.). Tipo de exudado o lesión: Los tipos de exudado califican al órgano que sufre la inflamación con información sobre las características del proceso que a su vez tiene implicaciones de duración, daños a vasos sanguíneos, etc. Se utilizan los términos de inflamación serosa, catarral o mucosa, fibrinosa, hemorrágica, purulenta, etc. Así como sus formas mixtas como por ejemplo: rinitis fibrinopurulenta. En algunas ocasiones en lugar del tipo de exudado se utiliza un término que denote el daño o alteración causada en el sitio de la inflamación, por ejemplo: enteritis ulcerativa, estomatitis necrótica, etc. Distribución: Aquí se intenta implicar la extensión del proceso inflamatorio en un órgano; los términos más utilizados son: - Focal, que denota un solo sitio afectado generalmente con bordes bien definidos en el órgano. - Multifocal, cuando son varios los sitios donde se desarrolla el proceso y que se encuentran separados por tejido normal. Cuando estas zonas crecen y llegan casi a juntarse puede agregarse el término coalescente. - Zonal, para implicar que un área del órgano está afectada. - Extensiva, cuando existe un aumento de tamaño de la lesión inicial, que pudo haber sido focal o zonal y que en sus bordes se evidencia actividad. - Difusa, cuando la totalidad del órgano está en mayor o menor grado afectado. Duración: La denominación de acuerdo con el tiempo o edad de una reacción inflamatoria se basa en los siguiente: - Aguda, que se caracteriza por cambios vasculares, principalmente congestión, trombosis, edema, hemorragia, además de fibrina y presencia de neutrófilos. La reacción aguda se considera de 4 a 6 horas hasta 3 días. 33/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal - Subaguda, donde no existe una separación drástica y precisa entre la inflamación aguda y subaguda, sin embargo en la subaguda existe la disminución de cambios vasculares y exudación de neutrófilos así como el predominio de células mononucleares. La duración de este proceso va de 3 días a pocas semanas. - Crónica, cuando ya existe evidencia de respuesta reparativa por parte del hospedador. En la mayoría de los casos, la inflamación crónica presenta las siguientes características: persistencia del estímulo dañino por incapacidad del organismo para destruirlo; generalmente el proceso se acompaña de una respuesta inmune; existe evidencia del proceso de reparación por parte del hospedador. Se toma como ejemplo la descripción macroscópica y microscópica de la necrosis. La muerte de los tejidos se conoce como necrosis, que es la muerte rápida de una porción limitada de un organismo, la cual incluye la subsiguiente degeneración del tejido muerto. El tejido muerto se denomina necrótico y al agente que promueve o causa el estado de necrosis se denomina necrotizante. La necrosis para el anatomopatólogo se entiende como una muerte de los tejidos que ocurre con anterioridad al momento de su sustitución normal en el organismo vivo, o al de la muerte del individuo: de ahí la definición de muerte rápida de una porción limitada de tejido. Las causas de la necrosis son: factores fisiológicos como ocurre en la desecación del cordón umbilical; agentes químicos exógenos como toxinas bacterianas, hongos, cáusticos o corrosivos; agentes químicos endógenos que son resultado de la elaboración por el propio organismo; la insuficiencia circulatoria y los agentes físicos como los rayos ultravioletas emitidos por el sol. Aspectos macroscópicos Los caracteres macroscópicos generales de la necrosis son: Pérdida de color o palidez: el tejido muerto es uniformemente más pálido que el tejido vivo, excepto cuando aún contiene sangre. Pérdida de resistencia. Olor: el olor es putrefacto, aunque puede deberse a otras causas. Aspectos microscópicos Se distinguen cuatro tipos de alteraciones nucleares: Picnosis. Condensación de la cromatina nuclear en una masa oscura, circular y homogénea, el núcleo se reduce de tamaño. Aunque no debe suponerse que toda célula muerta presentará picnosis. Cariorrexis. Es la dispersión del núcleo en varios fragmentos; el término se utiliza para designar al núcleo muerto que ha quedado reducido a delgados fragmentos, esta característica se observa ocasionalmente y es una de los pasos en el desarrollo de la necrosis caseosa. Cariolisis. La disolución de la cromatina nuclear, permaneciendo una sola sombra nuclear grande y circular y que se desarrolla tras la condensación previa de la 34/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal cromatina. Se utiliza cuando el núcleo se observa como una esfera vacía, donde solo queda la membrana nuclear. Cromatolisis. Es la disolución de la cromatina. En el citoplasma se puede observar incremento de la acidofilia en la mayoría de los casos, o bien la lisis del citoplasma, adquiriendo este un aspecto pálido y vacuolizado llamado citoplamolisis. Es importante señalar que todas estas modificaciones nucleares y citoplásmicas, pueden ocurrir también en la autolisis, por lo que, para reconocer una necrosis, resulta necesario disponer de una porción de tejido no necrótico, para establecer un diagnóstico por comparación. Interpretación u observaciones: El estudiante diferenciará los procesos de degeneración, necrosis, apoptosis y autolisis. Preguntas para discusión: ¿Qué diferencias macroscópicas y microscópicas existen entre los diferentes tipos de degeneración? ¿Qué diferencias macroscópicas y microscópicas existen entre los diferentes tipos de necrosis? ¿Qué diferencias microscópicas existen entre la necrosis y la apoptosis? ¿Qué diferencias macroscópicas y microscópicas existen entre los la autolisis y la necrosis? Evaluación: Se entregará reporte individual de la práctica. Lugar donde se llevará a cabo: Las lesiones macroscópicas serán identificadas en la sala de necropsia del CIESA; las lesiones microscópicas en los laboratorios de prácticas de la FMVZ. Bibliografía: Blood, D.C.; Henderson, J.A; Radostits, O.M.: (1986). Medicina Veterinaria. 6a. Ed. Interamericana México. Cheville, N.: (1988). Introduction to veterinary pathology. Iowa State U.P. U.S.A. Jones, C.T. And Hunt, D.R.: (1983). Veterinary pathology 5th Ed Lea Febiger U.S.A. Jubb. K.V.F.; Kennedy, P.C. And Palmer, N.: (1993). Pathology of Domestic Animals. 4th Ed Academic Press. U.S.A. Robbins, S.L.: (1975). Patología Estructural Y Funcional México. Trigo, T.F.J.: (1987). Patología Sistémica Veterinaria, Vol.1 Unam México. 35/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Práctica 6: Gangrena Introducción: La gangrena húmeda es un estado en el cual el tejido necrótico se ve invadido por bacterias saprófitas y putrefactivas. Esta invasión se presenta generalmente en los tejidos necróticos que tienen acceso a las bacterias del aire, y por ello rara vez hablamos de necrosis de los miembros, orejas, cola, pulmones, intestinos o ubre, sino que más bien hablamos de gangrena de los mismos. Microscópicamente la lesión se reconoce por la existencia de una mezcla de necrosis de coagulación y licuefacción donde, además, puede demostrarse la presencia de grandes bacilos. No es necesario que éstos sean numerosos. Con la tinción común de hematoxilina y eosina, las bacterias se colorean de azul, pero mucho menos intensamente que los núcleos, y su contorno es menos definido. Como muchas de las especies de bacterias saprófitas son formadoras de gas, el tejido gangrenoso puede contener burbujas del mismo, las cuales se reconocen como espacios vacíos de diversos tamaños, carentes de pared propia y con tendencia a ser esféricos, aunque pueden estar sujetos a distorsiones por la posible presión de las estructuras histológicas adyacentes. En la gangrena húmeda, sea ésta en un miembro o en una zona del pulmón o intestino, la porción afectada se presenta tumefacta, blanda, pastosa y en general de color oscuro o negro. Dependiendo de la clase de bacteria presente, puede existir un desagradable olor putrefacto. Durante la vida, la parte afectada carece del calor corporal y le falta la sensibilidad táctil y al dolor. Este tipo que es el más común, se produce en aquellos tejidos que presentan una buena irrigación sanguínea en el momento en que comienza el fenómeno de necrosis. La gangrena seca se produce en los tejidos con pobre irrigación sanguínea y poco contenido de líquido, o en aquéllos donde la necrosis se ha desarrollado lentamente produciendo un retardo de la circulación normal. Como el tejido seco no es un medio de cultivo favorable, la multiplicación y difusión de las bacterias es más lenta. Los tejidos se desnaturalizan o coagulan y la parte se torna fría, arrugada, descolorida y con aspecto de cuero. Todas las zonas de gangrena se encuentran separadas del tejido contiguo por una línea de demarcación, evidente macroscópicamente tanto durante la vida como después de la muerte; aparece como una zona tumefacta, rojiza o azulina de hiperemia e inflamación. Objetivo: Identificar las características macroscópicas y microscópicas de la gangrena en los tejidos animales. Duración de la sesión: 2 horas. Material: Piezas preservadas, cadáver y órganos de decomiso para identificar las lesiones macroscópicas. Laminillas obtenidas de la colección de patología y laminillas de los casos 36/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal procesados por los estudiantes durante la necropsia. Microscopio óptico con sistema de pantalla para la discusión de lesiones microscópicas. Técnica: Los alumnos examinarán las piezas preservadas, cadáveres y órganos de decomiso con la finalidad de identificar las lesiones macroscópicas presentes en los tejidos con gangrena. Con ayuda de laminillas de casos previamente seleccionados por el profesor, se realizará la explicación de los diferentes tipos de gangrena, con el uso del microscopio óptico con sistema de pantalla. Posteriormente los alumnos revisarán sus juegos de laminillas para identificar lesiones microscópicas de gangrena. Interpretación u observaciones: El discente describirá las lesiones presentes en la gangrena. Posteriormente los alumnos observarán en equipos las lesiones en órganos preservados y laminillas seleccionadas. Preguntas para discusión: ¿Cuál es la apariencia macroscópica de los tejidos con gangrena? ¿Qué elementos celulares están presentes a nivel microscópico en la gangrena seca? ¿Qué elementos celulares están presentes a nivel microscópico en la gangrena húmeda? Evaluación: La práctica será acreditada por asistencia, participación y entrega de reporte escrito. El reporte debe incluir portada de identificación, descripción de los diferentes tipos de gangrena, con su correspondiente imagen (consultar páginas web) y etiologías asociadas. Lugar donde se llevará a cabo: La sesión de lesiones macroscópicas será en la Sala de Necropsias del Centro de Investigación y Estudios Avanzados en Salud Animal, FMVZ, UAEM. La observación de lesiones microscópicas será en el Laboratorio de Prácticas de la FMVZ UAEM. Bibliografía: Blood, D.C.; Henderson, J.A; Radostits, O.M.: (1986). Medicina Veterinaria. 6a. Ed. Interamericana México. Cheville, N.: (1988). Introduction to veterinary pathology. Iowa State U.P. U.S.A. 37/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Jones, C.T. And Hunt, D.R.: (1983). Veterinary Pathology 5th Ed Lea Febiger U.S.A. Jubb. K.V.F.; Kennedy, P.C. And Palmer, N.: (1993). Pathology of domestic Animals. 4th Ed Academic Press. U.S.A. Robbins, S.L.: (1975). Patología Estructural Y Funcional México. Trigo, T.F.J.: (1987). Patología Sistémica Veterinaria, Vol.1 UNAM México. 38/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Práctica 7: Anomalias del crecimiento celular (Neoplasias) Introducción: Definición de neoplasia: es un crecimiento celular que prolifera sin control, guarda una considerable semejanza con las células sanas de las cuales se originó, pierde el ordenamiento estructural del tejido, no cumple ninguna función y por lo menos hasta el presente sus causas se desconocen con exactitud. Han existido muchas definiciones de neoplasia, pero la que se describe anteriormente cuyo autor es Mallory, es posible sea la más exacta para ilustrar sobre lo que se designa genéricamente como "cáncer". El término "tumor" es menos preciso, pero generalmente se utiliza como sinónimo; originalmente se empleaba para designar tumefacción, pero en la actualidad se reserva casi exclusivamente para designar los agrandamientos de naturaleza neoplásica. Los puntos claves en cualquier definición de neoplasia son la "proliferación incontrolada" y la "carencia de utilidad". En la mayoría de los procesos que hemos tratado en las unidades anteriores, los mecanismos que controlan las reacciones que tienen alguna finalidad, muchas veces destinada a salvaguardar al organismo, como por ejemplo, los abscesos, granulomas, hipertrofia e hiperplasia. Las células de la neoplasia son descendientes de células del tejido en que se origina, las que en algún momento expresan una alteración interna mediante la proliferación descontrolada. Si el aporte nutricional y de oxígeno son adecuados puede alcanzar varios kilos de peso, aunque esto es infrecuente. Aspecto macroscópico. El aspecto macroscópico de las neoplasias es mucho menos informativo de lo que se podría suponer, aunque algunas características pueden ser de utilidad. Cabe aplicar el concepto general de neoplasia como agrandamiento, pero existen excepciones. Algunos de los carcinomas más malignos y melanomas nunca alcanzan un tamaño considerable antes de matar al paciente como consecuencia de las metástasis o interfiriendo alguna de sus funciones vitales, como podría ser el pasaje de los alimentos a través del intestino. Estos conceptos son referidos a los tumores primarios u originales. Los tumores metastásicos originados por transferencias de células desde los tumores primarios, con frecuencia se designan como tumores secundarios. Los tumores de un tamaño considerable producen un abultamiento del órgano o parte comprometida; esto es especialmente evidente en aquéllos que se originan en la piel o inmediatamente por debajo de ella. Estas masas que hacen protrusión, eventualmente sufren necrosis por presión, ulcerándose su cubierta de piel o mucosa, y sangran. Algunos tumores malignos (carcinomas) suelen ulcerarse antes de alcanzar tamaños observables macroscópicamente. En tales casos, el único signo evidente será la úlcera. Los tumores epiteliales benignos (papilomas) hacen protrusión adoptando formas simples o más o menos complicadas. El corte transversal de la masa tumoral pone en evidencia que está constituida por tejido extraño, de distinto color y consistencia del que lo rodea. El color suele ser blanco o casi blanco. Los melanomas suelen ser típicamente negros, aunque los tipos "amelanómicos" son blancos. Unos pocos, como el caso de los tumores testiculares de células intersticiales, son amarillos. Respecto a la consistencia, ésta puede ser más dura o más blanda que la del tejido circundante; se aprende a reconocer el tejido de los linfomas por su carácter más bien blando, homogéneo y blanquecino. No es raro encontrar, al corte, hemorragias, quistes, otras 39/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal estructuras especiales y zonas de tejido necrótico. Los tejidos neoplásicos que se presentan como protrusiones ulceradas o con otras características deben diferenciarse de los granulomas tisulares inflamatorios, como los de la actinomicosis, tuberculosis y granulación exuberante de las heridas. En algunas oportunidades esto puede hacerse tomando como base la anamnesia, la localización, la presencia de abscesos, de "gránulos de azufre" u otras características especiales, pero en la mayoría de los casos la decisión final debe sustentarse en el examen microscópico. Aspecto microscópico. Las células neoplásicas son semejantes a las células de las cuales se originan, situación que proporciona la base para el sistema de clasificación y nomenclatura. En general, las células neoplásicas casi siempre son de un solo tipo. Sin embargo, aunque muy raramente, una neoplasia puede ser compuesta por dos o más tipos celulares neoplásicos, como por ejemplo los tumores mixtos de la glándula mamaria. En proporción directa a su malignidad, las células se parecen cada vez menos a sus precursoras, a un punto tal que puede no llegar a identificarse el tejido de origen. Esta cualidad de no conformar ningún prototipo histológico en los aspectos estructurales, de ordenamiento o de propiedades tintoriales, se denomina anaplasia. Dichas células se denominan anaplásicas o indiferenciadas. Las bandas fibrosas de un tumor fibroblástico corren desordenadamente en todas direcciones y el epitelio de un tumor epidérmico está rodeado por un estroma de tejido conectivo, todo ello en franca oposición con la arquitectura tisular normal. Esta "actitud disconformista" no queda restringida solamente a su aspecto físico, sino que se extiende también a todo su comportamiento y forma de vida, lo que se demuestra ampliamente por su crecimiento rápido e incontrolado y su poca ordenada manera de reproducirse. Puede suponerse también que dichas células son poco ortodoxas en muchos de sus procesos metabólicos; realmente, deben existir ciertas aberraciones metabólicas básicas que les permitan burlarse exitosamente de lo que para otras células son leyes básicas. Al respecto, los químicos encontraron muy pocas diferencias, dentro de las cuales se destaca como más importante la mayor capacidad de los tejidos neoplásicos para obtener energía a partir del metabolismo de la glucosa hacia ácido láctico (glucólisis). Esto aparentemente hace a dichos tejidos más o menos independientes de un adecuado aporte de oxígeno, el cual es esencial para los tejidos adultos comunes. Carecen también las células neoplásicas de la inhibición por contacto que presentan las células normales, tanto in vivo como in vitro, y se encuentran menos adheridas entre sí que las células normales. Estas situaciones están relacionadas con la disminución en el contenido de calcio en las membranas de las células neoplásicas, y con un incremento en la carga negativa de la superficie celular, lo que provocaría un mayor rechazo entre célula y célula. Sin embargo, la base bioquímica de la capacidad invasora permanece en la oscuridad. A la fecha, el único medio de evaluar el grado de malignidad o de diferenciar entre neoplasias benignas y malignas consiste en el examen microscópico. Objetivo: Identificar las características macroscópicas y microscópicas de las neoplasias en los tejidos animales. 40/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Duración de la sesión: 2 horas. Material: Piezas preservadas, cadáver y órganos de decomiso para identificar las lesiones macroscópicas. Laminillas obtenidas de la colección de patología y laminillas de los casos procesados por los estudiantes durante la necropsia. Microscopio óptico con sistema de pantalla para la discusión de lesiones microscópicas. Técnica: Los alumnos examinarán las piezas preservadas, cadáveres y órganos de decomiso con la finalidad de identificar las lesiones macroscópicas presentes en los tejidos con neoplasias. Con ayuda de laminillas de casos previamente seleccionados por el profesor, se realizará la explicación de los diferentes tipos de gangrena, con el uso del microscopio óptico con sistema de pantalla. Posteriormente los alumnos revisarán sus juegos de laminillas para identificar lesiones microscópicas de neoplasias. Interpretación u observaciones: El discente describirá las lesiones presentes en las neoplasias. Posteriormente los alumnos observarán en equipos las lesiones en órganos preservados y laminillas seleccionadas. Preguntas para discusión: ¿Cuál es la apariencia macroscópica de los tejidos con neoplasias? ¿Cuál es la apariencia microscópica de las neoplasias? ¿En caso de metástasis, en qué estructuras debemos buscar la migración de células neoplásicas? Evaluación: La práctica será acreditada por asistencia, participación y entrega de reporte escrito. El reporte debe incluir portada de identificación, descripción de los diferentes tipos de neoplasias, con su correspondiente imagen (consultar páginas web) y etiologías asociadas. Lugar donde se llevará a cabo: La sesión de lesiones macroscópicas será en la Sala de Necropsias del Centro de Investigación y Estudios Avanzados en Salud Animal, FMVZ, UAEM. 41/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal La observación de lesiones microscópicas será en el Laboratorio de Prácticas de la FMVZ UAEM. Bibliografía: Blood, D.C.; Henderson, J.A; Radostits, O.M.: (1986). Medicina Veterinaria. 6a. Ed. Interamericana México. Cheville, N.: (1988). Introduction to Veterinary Pathology. Iowa State U.P. U.S.A. Jones, C.T. And Hunt, D.R.: (1983). Veterinary Pathology 5th Ed Lea Febiger U.S.A. Jubb. K.V.F.; Kennedy, P.C. And Palmer, N.: (1993). Pathology of domestic animals. 4th Ed Academic Press. U.S.A. Robbins, S.L.: (1975). Patología estructural y funcional. Ed. Interamericana. México. Trigo, T.F.J.: (1987). Patología Sistémica Veterinaria, Vol.1 UNAM México. 42/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal UNIDAD TRES Práctica 8: Trastornos circulatorios Introducción: La interferencia de la circulación, y con ello del abastecimiento sanguíneo a los órganos vitales, puede originarse por una gran variedad de mecanismos. Las alteraciones hemodinámicas son trombosis, hemorragia, edema y shock. Las alteraciones circulatorias forman parte de entidades tales como insuficiencia cardíaca, enfermedad vascular primaria y anemia; las modificaciones circulatorias son también componentes del proceso inflamatorio. Coágulos post mortem. Salvo cuando la muerte se produce como resultado de ciertas septicemias o estados anóxicos, la mayor parte de la sangre coagula rápido en los vasos venosos ni bien se produce la muerte. Las arterias se contraen por el rigor mortis de tal forma que en ellas permanece muy poca sangre. Los coágulos formados de esta manera, al igual que los observados fuera de los canales vasculares, cuya naturaleza es obvia, deben diferenciarse de los trombos. Aspecto microscópico. Los componentes visibles de estos coágulos son los eritrocitos, leucocitos, fibrina y proteínas precipitadas, principalmente albúmina. En los coágulos post mortem, estos elementos pueden encontrarse uniformemente mezclados, o los eritrocitos pueden haber sedimentado por acción de la fuerza de gravedad hacia las partes más declives de los vasos, observándose superpuestos los leucocitos y las proteínas plasmáticas precipitadas. Sin embargo, no suele notarse la laminación que exhiben los trombos. Un carácter diferencial de utilidad es el tamaño de las fibrillas de fibrina, las cuales, en este tipo de coágulo, son uniformemente finas y escasamente visibles en forma individual a bajo aumento. Aspecto macroscópico. El coágulo post mortem es rojo oscuro, liso y brillante en su superficie, y moldeado al vaso en el cual se formó, como la jalea a su envase; a simple vista presenta una estructura homogénea y se encuentra completamente libre dentro del vaso. El coágulo en grasa de pollo es el resultado de la sedimentación y separación de los glóbulos rojos de la fase fluida de la sangre. Esta sedimentación no es distinta de la que ocurre en el tubo de ensayo. Este tipo de coágulo post mortem se observa con mayor frecuencia en las cámaras cardíacas y cuando la coagulación post mortem se encuentra retardada. Tiene la superficie lisa y lustrosa de la jalea de grosella de los coágulos post mortem, pero presenta el color amarillo del plasma. En realidad no se encuentra adherido a la cubierta vascular, pero sí inmovilizado por estar enredado en las válvulas y cuerdas tendinosas cardíacas. Coágulos ante mortem, trombosis. Los trombos son coágulos formados en la sangre circulante. Este proceso relativamente lento produce coágulos algo diferentes de los ya descritos. Aspecto microscópico. Además de los componentes mencionados para los coágulos post mortem, las plaquetas sanguíneas o trombocitos se acumulan en el lugar de la trombosis, constituyendo una porción importante de los coágulos de este tipo. Las plaquetas tienden adherirse fuertemente unas con otras y de la misma forma a la pared vascular, formando una masa más o menos amorfa de color rosado o gris constituida por capas 43/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal alternadas más o menos irregulares, donde predominan fibrina y leucocitos, fibrina y eritrocitos o fibrina sola. Por ello, una sección a través del trombo aparece como irregularmente laminada. Si la sección es adecuada puede observarse el punto de adherencia del trombo. Por otra parte, si la sección toma la parte posterior del trombo, puede aparecer como una isla dentro de la luz de un vaso. Las fibrillas de fibrina son relativamente gruesas y fuertes, una característica de gran importancia para la diferenciación entre trombos y coágulos post mortem. Aspecto macroscópico. Como se ve en la mesa de necropsia, el trombo es friable y presenta superficie opaca, irregularmente rugosa o fibrosa, en contraste con la característica lustrosa y de aspecto de jalea de grosella de los coágulos post mortem. El color generalmente es rojo y gris, formándose láminas o capas irregulares. Por lo menos en uno de los lados del trombo debe encontrarse la adhesión de la pared del vaso sanguíneo. Si el trombo obtura enteramente la luz del vaso, es el caso de un trombo oclusivo. Es mucho más raro que puede ocluir la luz, salvo por la existencia de una o varias pequeñas aberturas que permiten el pasaje de cierta cantidad de sangre. Esto constituye un trombo canalizado. Los canales se tapizan con endotelio, que es continuo con el del vaso sanguíneo adyacente. No es raro que el proceso de coagulación continúe en la parte distal del lugar de adherencia del trombo, sin presentar ningún tipo de conexión, con la pared vascular. Este extremo libre queda a merced de la corriente sanguínea y puede adquirir longitudes sorprendentes. Dicho tipo de trombo se designa como obturante. Coagulación intravascular diseminada. Una situación que pone en serio problema la vida, reconocida en el hombre y en forma cada vez más frecuente en los animales, es la coagulación simultánea dentro de varios vasos sanguíneos del organismo. Esta situación se asoció con complicaciones obstétricas, enfermedades neoplásicas malignas, infecciones sistémicas severas, preñez, lupus eritematoso sistémico, anemia hemolítica microangiopática trombótica y enfermedades granulomatosas. Las especies en las cuales se reconoció este estado incluyen la canina, porcina, equina, las ratas y el visón aleutiano. En general, los signos hemorrágicos son severos, con la presencia de grandes equimosis confluentes, hemorragia prolongada desde las mucosas, incisiones quirúrgicas y lugares de punción venosa. Las lesiones descritas semejan las observadas en la reacción de Schwartzman, que sigue a la repetida inyección de endotoxinas bacterianas. Además, se observó que el síndrome sigue a la inyección de trombina, tromboplastina y otras sustancias precoagulantes. Émbolos. Los émbolos son cuerpos extraños que flotan en la sangre y de los cuales existen varios tipos. Los émbolos simples o émbolos fibrinosos son pedazos de trombos que se han desprendido por la fuerza de la corriente sanguínea. Tanto en su aspecto macroscópico como en el microscópico, semejan a los trombos. Casi siempre se observan alojados en una bifurcación arterial o en algún otro punto donde la luz de la arteria se hace demasiado pequeña para permitir su pasaje. La causa es obvia. Cuando un émbolo de fibrina se detiene en un vaso, generalmente lleva consigo cierta cantidad de trombina, lo que permite que se inicie el proceso de trombosis, y por ello, si el émbolo mismo no obstruye enteramente el flujo de sangre en ese vaso, lo hará el trombo que se forma alrededor de éste. Hemorragia. La hemorragia es la salida de sangre desde un vaso, ya sea al exterior, a una cavidad orgánica o a los tejidos adyacentes. El flujo rápido de sangre o a través de un corte o solución de continuidad de un vaso se denomina hemorragia por rexis. Considerable 44/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal cantidad de sangre puede perderse también a través del leve escurrimiento de los fluidos y lento escape de las células sanguíneas, una a una, a través de imperceptibles imperfecciones de las paredes vasculares. Esta forma se denomina hemorragia por diapédesis. Las pequeñas hemorragias que dejan puntos de sangre no mayores que la cabeza de un alfiler se denominan petequias. Los puntos hemorrágicos algo más grandes sobre la superficie corporal o en la intimidad de los tejidos se denominan equimosis. Se habla de extravasamientos cuando la hemorragia en un tejido compromete áreas considerables. Cuando la sangre escapa hacia los tejidos y produce una deformación de tipo tumoral, dicha masa recibe el nombre de hematoma, aunque la denominación de hematoquiste es más apropiada. Hiperemia activa. Esta situación puede producirse en cualquier órgano o parte del cuerpo. Aspecto macroscópico. Dependiendo en mayor o menor grado de su color original, la parte toma el color rojo brillante de la sangre arterial. Durante la vida, dicha parte se presenta también más caliente pudiendo, en oportunidades, percibirse la pulsación arterial en lugares donde normalmente no es apreciable. Aspecto microscópico. Los capilares aparecen ingurgitados y repletos de sangre. Además se encuentra un mayor número de capilares, dado que en condiciones normales muchos de ellos permanecen vacíos y colapsados la mayor parte del tiempo. Las arterias y arteriolas también se presentan dilatadas, pero este dato es muy difícil de detectar luego de la muerte, porque la contracción post mortem de su musculatura las vacía, cerrando su luz. Congestión pasiva. La congestión pasiva puede producirse en cualquier parte del cuerpo y puede tener un curso agudo o crónico. Aspecto macroscópico. La parte congestionada se encuentra levemente tumefacta, tiende a adoptar un tinte rojo azulado. Durante la vida, la temperatura de esa parte puede estar claramente más baja que lo normal, dado que la sangre se renueva con dificultad. Luego de la muerte, y en la medida en que avanza la hemólisis, el color rojo azulado se oscurece. De la superficie de corte escurre una abundante cantidad de sangre; éste es un dato de importancia en órganos de las características del hígado y pulmón. Aspecto microscópico. Los capilares y las venas se observan dilatados y repletos de sangre. En el caso de la congestión del hígado o bazo, los espacios sinusoidales se encuentran también repletos de sangre. Si la congestión es crónica existe un incremento de leve a moderado del tejido fibroso en las paredes de las venas, lo que las engrosa y refuerza (un fenómeno de hipertrofia compensatoria). Con frecuencia la congestión aguda pasiva del hígado se evidencia por la conspicua dilatación de los capilares sinusoidales y venas centrales, aunque se observan vacías. Esto ocurre puesto que al realizar la fijación de la pieza en su preparación para realizar los cortes microscópicos, la sangre escurre hacia la solución fijadora, pero los espacios mantienen su dilatación y forma original. Además, las células centrales de los cordones hepáticos tienden a desaparecer, dejando un mar central de sangre. Edema. El edema es una alteración que se caracteriza por una excesiva acumulación de líquido (agua) en los espacios intercelulares, incluyendo las cavidades corporales. Ya se definió el incremento del líquido dentro como hidropesía o degeneración hidrópica, y esta definición se respetará aquí, a pesar de que existe cierta vaguedad en la distinción entre edema e hidropesía. El tema del edema se ha mantenido confuso durante mucho tiempo, y se propusieron muchas teorías conflictivas respecto de sus mecanismos de producción. 45/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Aspecto macroscópico. La parte edematosa se encuentra tumefacta. La tumefacción edematosa de la porción ventral del abdomen suele tener varios centímetros de espesor y su límite es bien definido por dos líneas longitudinales a cada lado. En los machos, la tumefacción comúnmente se difunde hacia la región prepucial y se borra paulatinamente hacia adelante, al llegar a la región esternal. Algunas veces el edema es importante externamente, solo por una protrusión de los tejidos submandibulares. Esto es muy notable en los ovinos que padecen de parasitosis gastrointestinales, enfermedad conocida entre los ganaderos como "mandíbula de botella". El tejido tumefacto tiene consistencia firme. Si se presiona con el dedo en el tejido edematoso, el líquido se desplaza hacia los tejidos vecinos y, cuando éste es retirado, queda una depresión que persiste por un tiempo (signo de Godet), el necesario para que el líquido eliminado vuelva a embeber el tejido a través de fibrillas y células. En los casos bien marcados, la superficie de corte muestra un líquido amarillo pálido que impregna los tejidos; puede presentar cierto grado de coagulabilidad, pero en la generalidad de los casos escurre por la superficie de corte. Si se aplica presión puede escurrirse del tejido una gran cantidad de líquido. Durante la vida, si la parte edematosa es externa, además de tumefacta está fría, y no presenta enrojecimiento ni signos de dolor. El edema de los pulmones, durante la necropsia, se observa mejor efectuando un corte a través de un lóbulo y escurriendo los bordes. Si exuda un líquido acuoso, levemente teñido con sangre, el tejido es de mayor consistencia y aparece distendido, padece edema. En cambio, si lo que escurre es un líquido decididamente sanguinolento, el pulmón estaba congestivo. Si aparecen gotas de pus, existía neumonía. En el edema de las cavidades peritoneal, pleural y otras cavidades serosas, éstas aparecen distendidas y llenas de un líquido acuoso claro. El edema cerebral se reconoce mejor por el aplanamiento de sus circunvoluciones a raíz de la presión sobre el cráneo, que por lo acuoso del tejido. La decisión respecto de si el edema es o no de origen inflamatorio solo puede adoptarse, en oportunidades tomando en consideración todas las circunstancias acompañantes. El líquido de los edemas no inflamatorios se denomina trasudado, debido a que se ha formado exclusivamente a partir de la alteración de un mecanismo fisiológico. El líquido de los edemas inflamatorios se denomina exudado, siendo uno de estos tipos de exudados (seroso) el que caracteriza la inflamación aguda. Si es accesible al examen físico, el trasudado puede diferenciarse del exudado mediante la determinación de la densidad. La densidad de un trasudado es casi invariablemente menor de 1.017 y casi siempre menor de 1.015, mientras que la de un exudado es de 1.017 o mayor. Esta diferencia se debe a la menor concentración de sales y coloides, especialmente albúmina, que contiene el trasudado. La determinación de la proteína total revela que los trasudados en general muestran menos del 3%, mientras que los exudados inflamatorios presentan porcentajes mucho más altos. Como puede esperarse, los exudados dejan un precipitado proteico mucho mayor, especialmente de albúmina, en los cortes microscópicos, lo que permite hacer el reconocimiento de los edemas inflamatorios tomando como base este hecho. Los exudados presentan también un número considerable de leucocitos y frecuentemente algo de fibrina, mientras que los trasudados a lo sumo presentan trazas de estos elementos. Macroscópicamente el exudado con frecuencia incluye algunos coágulos de fibrina, pudiendo observarse en ciertas superficies involucradas franca inflamación fibrinosa. Aspecto microscópico. Cuando el tejido está edematoso, los espacios entre las células adyacentes, 46/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal fibrillas u otras estructuras elementales se encuentran agrandados. Durante la vida sin duda se mantenían llenos de líquido, mientras que en los cortes microscópicos dicho líquido puede permanecer o no, tomando una suave coloración rosada debido a los residuos de albúmina precipitada; esto dependerá fundamentalmente de la cantidad de albúmina (u otras proteínas) que contenga el fluido edematoso. Si se sigue la técnica común para fijar el corte al portaobjetos con albúmina de huevo, el principiante deberá tener cuidado de no confundir la albúmina de fijación, que se hace visible cuando se coloca un leve exceso, con la correspondiendo a un residuo de líquido edematoso. En el caso de que se haya utilizado este fijador, el color rosado de la albúmina se observará también por fuera de los límites de corte. También se necesita mucho juicio para interpretar los espacios intercelulares vacíos. Una cantidad variable de espacio queda entre las células como consecuencia de la retracción que se produce durante los procedimientos de fijación con parafina o similares. Estos espacios artificiales tienden a ser menos numerosos, de tamaño menos uniforme y distribuidos más irregularmente que los producidos por el edema. La retracción sigue las líneas naturales del clivaje, las cuales generalmente se encuentran entre los distintos tejidos, aunque no separan al epitelio de su base de tejido conectivo. Pueden estar presentes unos pocos eritrocitos, leucocitos o fibrillas de fibrina, y una cantidad más abundante de estos dos últimos elementos indica inflamación. El edema cerebral se revela por la distensión de los espacios perivasculares y aun los perineurales, pero la excesiva retracción puede llevar a engaño. Los surcos son comprimidos y las circunvoluciones aplanadas contra la pared del cráneo debido a la presión, situación que se observa más fácilmente por el estudio macroscópico que al microscopio. Si existe edema en los pulmones, los alvéolos se encuentran llenos de líquido; hay habitualmente suficiente cantidad de residuo albuminoso como para que este estado se haga evidente al microscopio. Objetivo: Identificar las características macroscópicas y microscópicas de los trastornos circulatorios en los tejidos animales. Duración de la sesión: 2 horas. Material: Piezas preservadas, cadáver y órganos de decomiso para identificar las lesiones macroscópicas. Laminillas obtenidas de la colección de patología y laminillas de los casos procesados por los estudiantes durante la necropsia. Microscopio óptico con sistema de pantalla para la discusión de lesiones microscópicas. Técnica: Los alumnos examinarán las piezas preservadas, cadáveres y órganos de decomiso con la finalidad de identificar las lesiones macroscópicas presentes en los tejidos por los trastornos circulatorios. Con ayuda de laminillas de casos previamente seleccionados por 47/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal el profesor, se realizará la explicación de los diferentes tipos de gangrena, con el uso del microscopio óptico con sistema de pantalla. Posteriormente los alumnos revisarán sus juegos de laminillas para identificar lesiones microscópicas de los trastornos circulatorios Interpretación u observaciones: El discente describirá las lesiones presente en los trastornos circulatorios. Preguntas para discusión: ¿Cómo se deferencia macroscópicamente un trombo de un coágulo? ¿Cómo se diferencia microscópicamente un trombo de un coágulo? ¿Cómo se distingue macroscópica y microscópicamente la hiperemia de la congestión? Evaluación: La práctica será acreditada por asistencia, participación y entrega de reporte escrito. El reporte debe incluir portada de identificación, descripción de los diferentes trastornos circulatorios, con su correspondiente imagen (consultar páginas web) y etiologías asociadas. Lugar donde se llevará a cabo: La sesión de lesiones macroscópicas será en la Sala de Necropsias del Centro de Investigación y Estudios Avanzados en Salud Animal, FMVZ, UAEM. La observación de lesiones microscópicas será en el Laboratorio de Prácticas de la FMVZ UAEM. Bibliografía: Blood, D.C.; Henderson, J.A; Radostits, O.M.: (1986). Medicina Veterinaria. 6a. Ed. Interamericana México. Cheville, N.: (1988). Introduction to veterinary pathology. Iowa State U.P. U.S.A. Jones, C.T. And Hunt, D.R.: (1983). Veterinary pathology 5th Ed Lea Febiger U.S.A. Jubb. K.V.F.; Kennedy, P.C. And Palmer, N.: (1993). Pathology of domestic animals. 4th Ed Academic Press. U.S.A. Robbins, S.L.: (1975). Patología Estructural Y Funcional. Ed. Interamericana. México. Trigo, T.F.J.: (1987). Patología Sistémica Veterinaria, Vol.1 UNAM México. 48/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Práctica 9: Inflamación y reparación celular Introducción: Definición de inflamación: Es un proceso que comienza luego de la agresión subletal de tejidos y termina con la curación completa. Los signos clínicos que caracterizan la inflamación, según lo establecido por Celso son enrojecimiento, tumefacción, calor y dolor. Estos signos y síntomas se conocen como signos cardinales de la inflamación. El enrojecimiento se debe al incremento de sangre en la parte inflamada. La tumefacción ocurre también por el aumento de flujo sanguíneo y la presencia adicional de sustancias, que salieron de los vasos sanguíneos hacia los tejidos circundantes y se designan exudados. El calor asimismo resulta de la mayor afluencia de sangre que lleva a la superficie la temperatura más alta del interior del cuerpo. El dolor se atribuye al aumento de la presión sobre las terminaciones nerviosas, aunque es posible que el efecto tóxico de las sustancias irritantes sea de mayor importancia, dado que el grado de dolor que acompaña a inflamaciones de igual apariencia en extensión y severidad puede ser muy variable. Posteriormente el médico griego Galeno agregó la pérdida de función como quinto signo cardinal. El dolor, que inicia la inhibición refleja de los movimientos musculares, la tumefacción mecánica y la destrucción tisular, son elementos que contribuyen a la pérdida de función como quinto signo cardinal. La inflamación es un fenómeno beneficioso cuando evoluciona hacia la curación. La inflamación aguda puede seguir una de las siguientes evoluciones: Resolución completa, con recuperación normal de la zona inflamada; ésta es la evolución habitual cuando la lesión es leve, como en una quemadura superficial y cuando ha habido escasa destrucción tisular. Curación por cicatrización, que ocurre cuando ha habido una sustancial destrucción tisular, cuando la inflamación ha ocurrido en tejidos que no se regeneran y si ha habido una abundante exudación de fibrina. Abscedificación, que se produce principalmente en las infecciones por microorganismos piógenos. Progresión a la inflamación crónica. Las características histológicas de la inflamación crónica son: 1) infiltración de células mononucleadas, principalmente macrófagos, linfocitos y células plasmáticas; 2) proliferación de fibroblastos y en muchos casos, de pequeños vasos sanguíneos, 3) incremento del tejido conectivo (fibrosis), y 4) destrucción tisular. La infiltración de monocitos y macrófagos es un componente particularmente importante de la inflamación crónica. Los monocitos comienzan su emigración precozmente en el curso de la inflamación aguda, y a las 48 horas constituyen el tipo celular predominante. Cuando el monocito llega a los tejidos extravasculares se transforma en una célula mucho más grande, el macrófago, que puede ser “activado”. En la inflamación aguda de corta duración, si se elimina el agente irritante, los macrófagos terminan desapareciendo (porque se destruyen o porque pasan a los linfáticos y de allí a los ganglios linfáticos). Si el agente lesivo no es eliminado, como ocurre en la infección tuberculosa, en algunas 49/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal reacciones inmunitarias o cuando existe un irritante crónico, el cumulo de macrófagos puede persistir durante largo tiempo. Debido al gran número de sustancias con actividad biológica que produce, el macrófago es una figura central en la inflamación crónica. Algunos de estos productos son tóxicos para los tejidos (por ejemplo, los metabolitos del oxígeno, las proteasas), otros producen la entrada de otros tipos celulares (por ejemplo, linfocitos, fibroblastos), y otros producen proliferación fibroblástica y depósito de colágeno. Todos estos efectos contribuyen a una progresista lesión tisular con la consiguiente alteración funcional. En la inflamación crónica, los mecanismos de reclutamiento y proliferación de fibroblastos, proliferación vascular y depósito de colágeno y fibrosis, son similares a los que contribuyen a la curación de las heridas. Otros tipos celulares presentes en la inflamación crónica son los linfocitos, células plasmáticas, eosinófilos y células cebadas. Las células plasmáticas producen anticuerpos dirigidos directamente contra antígenos persistentes en el foco inflamatorio o contra componentes tisulares alterados. Los linfocitos son movilizados en las reacciones inmunitarias mediadas por anticuerpos o por células, y también por razones desconocidas, en reacciones no inmunitarias. Estas células tienen una exclusiva relación con los macrófagos en la inflamación crónica mediada inmunológicamente. Los linfocitos activados producen linfocinas y estas son importantes estimuladores de los monocitos y macrófagos; producen quimiotactismo sobre los monocitos y activación y diferenciación de los macrófagos. Los productos de los macrófagos activados a su vez, influyen sobre la función de las células T y B. Los eosinófilos son característicos de las reacciones inmunitarias mediadas por la IgE y de las infecciones parasitarias. Los eosinófilos responden a los agentes quimiotácticos derivados principalmente de las células cebadas. Aunque sus funciones precisas son aún especulativas, sus gránulos contienen proteína básica principal (MBP), una proteína altamente catiónica que es tóxica para los parásitos y también produce lisis de las células epiteliales. Por lo tanto, son beneficiosos en las infecciones parasitarias, pero contribuyen a la lesión tisular en los estados de hipersensibilidad. Aunque los leucocitos polimorfonucleares suelen ser considerados el rasgo característico de la inflamación aguda, muchas formas de inflamación crónica, que duran varios meses, continúan conteniendo grandes cantidades de neutrófilos y forman pus. En la inflamación crónica del hueso (osteomielitis), el exudado de neutrófilos puede persistir durante meses. En la actinomicosis, una infección por microorganismos con una particular capacidad para atraer a los neutrófilos, el centro de la lesión muestra abundantes neutrófilos meses y años después de la infección inicial. Por lo tanto, en este caso coexiste la respuesta aguda y crónica. Por el contrario, la presencia de linfocitos no siempre significa que la inflamación ha estado presente durante un largo período. Esto es especialmente cierto en las infecciones virales. En la hepatitis aguda o en las miocarditis virales, por ejemplo, predominan los linfocitos incluso en los primeros días de la enfermedad aguda. Inflamación serosa. Se caracteriza por la exudación de suero sanguíneo, un líquido albuminoso y claro. Esta es la forma equivalente al edema inflamatorio. Este tipo de inflamación es especialmente frecuente en las cavidades serosas, debido a las grandes áreas de superficie bien vascularizadas que las limitan y a la delgadez del mesotelio. La inflamación serosa también ocurre en los pulmones, en los estadios iniciales de ciertas 50/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal neumonías, como respuesta a la inhalación de químicos irritantes y como resultado de por lo menos un irritante, la alfanaftiltiurea que es ingerido y presumiblemente eliminado a través de los pulmones. Las ampollas y vesículas, como las que aparecen en la piel después de la picadura de abejas, quemaduras de segundo grado o que afectan las mucosas en enfermedades como fiebre aftosa, estomatitis vesicular y exantema vesicular, son ejemplos de inflamación serosa localizada. Aspecto macroscópico. El líquido acuoso llena las cavidades orgánicas o los espacios tisulares son muy semejantes al plasma sanguíneo y no se distingue con facilidad del líquido correspondiente al edema verdadero. La presencia de pequeñas cantidades de fibrina adherida a las superficies comprometidas y la opacidad debida a la presencia de escasos leucocitos, indica su origen inflamatorio. El tinte rojizo, proviene de un pequeño número de eritrocitos, también sugiere pero no prueba su origen inflamatorio. Aspecto microscópico. Se observa un precipitado homogéneo y teñido de rosa, los espacios naturales están distendidos por el mismo y, en otros casos dichos espacios son creados artificialmente, como en vesículas. En el precipitado existen diseminados algunos leucocitos de distintas clases y vestigios de fibrina. Hay además vasos hiperhémicos y congestivos. Inflamación fibrinosa. Se caracteriza por la formación de un exudado que contiene gran cantidad de fibrinógeno, que coagula de tal forma que el componente más importante es la fibrina, aunque en cierto grado están presentes los constituyentes de otros tipos de exudado. Afecta principalmente a las serosas y mucosas y es frecuente en el saco pericárdico. Las mucosas del tracto respiratorio, desde la faringe hasta los alvéolos pulmonares, la pleura y el peritoneo, las sinoviales y la mucosa de la porción más baja del intestino, son localizaciones donde puede también presentarse este tipo de inflamación. Aspecto macroscópico. Al comienzo lo que se observa es una superficie opaca y turbia en vez de lisa y brillante, a medida que el proceso avanza aparece una cubierta blanquecina y velluda de material filamentoso. A veces la fibrina se presenta enrojecida por la presencia de sangre, o densa y dura y se denomina seudomembranosa. Aspecto microscópico. La fibrina se observa adherida a la superficie que la produce. Algunas veces las fibrillas de fibrina pueden aparecer entre las células epiteliales o mesoepiteliales de la zona que la generan. Estas últimas sufren necrosis debido a la acción tóxica del irritante que promueve la aparición de fibrina. Con la fibrina existe una pequeña y variable cantidad de suero precipitado, leucocitos y aún eritrocitos. Inflamación fibrinosa. Se caracteriza por la formación de un exudado que contiene gran cantidad de fibrinógeno, que coagula de tal forma que el componente más importante es la fibrina, aunque en cierto grado están presentes los constituyentes de otros tipos de exudado. Afecta principalmente a las serosas y mucosas y es frecuente en el saco pericárdico. Las mucosas del tracto respiratorio, desde la faringe hasta los alvéolos pulmonares, la pleura y el peritoneo, las sinoviales y la mucosa de la porción más baja del intestino, son localizaciones donde puede también presentarse este tipo de inflamación. Aspecto macroscópico. Al comienzo lo que se observa es una superficie opaca y turbia en vez de lisa y brillante, a medida que el proceso avanza aparece una cubierta blanquecina y velluda de material filamentoso. A veces la fibrina se presenta enrojecida por la presencia de sangre, o densa y dura y se denomina seudomembranosa. Aspecto microscópico. La fibrina se observa adherida a la superficie que la produce. Algunas veces las fibrillas de fibrina pueden aparecer 51/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal entre las células epiteliales o mesoepiteliales de la zona que la generan. Estas últimas sufren necrosis debido a la acción tóxica del irritante que promueve la aparición de fibrina. Con la fibrina existe una pequeña y variable cantidad de suero precipitado, leucocitos y aún eritrocitos. Inflamación purulenta. Se caracteriza por la presencia de pus de color y consistencia cremosos. Su color amarillento cremoso varía al azulado o verdoso cuando entre las bacterias se encuentra Pseudomona aeruginosa y toma color negruzco si proviene del casco negro del equino, debido a los sulfuros. La característica definitoria del pus es la presencia de granulocitos polimorfonucleares netrófilos. Sus elementos constituyentes son neutrófilos vivos o necróticos junto con células muertas del tejido preexistente, más o menos licueificadas y en menos cantidad otros componentes del exudado inflamatorio, incluyendo el suero. El absceso se define como una colección de pus circunscrito. Cuando está bien desarrollado posee una cápsula o pared de tejido fibroso que lo separa de los tejidos vecinos. Aspecto microscópico. La presencia de un considerable número de leucocitos neutrófilos dentro o sobre un tejido justifica el diagnóstico de inflamación purulenta. Se observan en abundancia pero es necesario que sean más numerosos que los linfocitos acompañantes para aplicar la designación de purulento. Inflamación hemorrágica. Se caracteriza por la gran cantidad de eritrocitos que abandonaron sus canales normales por diapédesis para exudar a una superficie corporal o hacia tejidos cercanos. Con ellos se encuentran la mayoría de los componentes de los otros tipos de exudados de tal forma que el exudado en conjunto tiene cierta semejanza con la sangre coagulada o no. Este tipo de inflamación ocurre en la intimidad de los tejidos en enfermedades tales como carbunco, pasteurelosis y púrpura hemorrágica, también involucra superficies mucosas. Los pulmones la pueden presentar. Dentro de las manifestaciones más comunes de este tipo de exudado están la gastritis y enteritis hemorrágica. Aspecto macroscópico. Un material de coloración sanguínea, fluido o semisólido pero generalmente coagulado y de consistencia gelatinosa, se observa sobre una superficie o en la intimidad de los espacios tisulares. Aspecto microscópico. En el exudado los distintos elementos de la sangre no están presentes en proporciones normales y los constituyentes más característicos de un exudado, tal el caso de la fibrina, leucocitos o ambos son siempre más abundantes que en la sangre normal. El exudado presenta una distribución más difusa, proviene de una zona y no de uno o varios puntos como sería el caso de una simple hemorragia. Inflamación catarral o mucosa. El componente característico de este tipo de exudado es el mucus, el cual proviene más de las células que de la sangre. El mucus es producido por las células epiteliales, por eso es que la inflamación catarral o mucosa está limitada a las mucosas que se abren en las membranas o por las glándulas mucosas unicelulares. Aspecto macroscópico. Se reconoce por la presencia de un fluido claro y viscoso que contiene mucina. Aspecto microscópico. La cantidad de mucus es rápidamente visible como bandas de mucina azuladas o grisáceas adheridas a la mucosa que lo produce. El incremento de células caliciformes puede ser muy evidente. Inflamación linfocítica. Se presenta en numerosas infecciones del sistema nervioso central, en los islotes de Glisson (espacios portales) del hígado con o sin hepatitis y en el riñón, en infecciones tales como la leptospirosis aguda. Aspecto macroscópico. Cuando el único 52/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal componente es la infiltración linfocítica el proceso no puede reconocerse macroscópicamente. Aspecto microscópico. Los linfocitos se acumulan en los tejidos, en forma aislada o formando cúmulos, en otros aspectos estos tejidos son normales o muestran algo de hiperemia. Con frecuencia dichos linfocitos forman una corona más o menos completa alrededor de los vasos sanguíneos de los cuales migraron. Inflamación granulomatosa. Un granuloma es una reacción inflamatoria crónica que consiste principalmente en un cúmulo de macrófagos, que pueden clasificarse en dos tipos principales, los granulomas por cuerpo extraño (suturas de seda, astillas y aceite) y los granulomas por hipersensibilidad (Mycobacterium tuberculosis, hongos, helmintos y sus huevos).Histológicamente consisten en una colección de macrófagos, muchos de los cuales presentan abundante citoplasma eosinófilo y grandes núcleos pálidos que los asemejan con células epiteliales. Tejido de granulación. Un proceso importante dentro de la inflamación es la formación de tejido de granulación que no se debe confundir con el proceso de inflamación granulomatosa. El nombre deriva del aspecto macroscópico del tejido, su superficie a simple vista parece compuesta por muchos gránulos rojos, siendo en realidad los extremos romos de los ramilletes de nuevos capilares que crecen perpendicularmente a la superficie. Objetivo: Identificar las características macroscópicas y microscópicas de la inflamación y reparación tisular en animales. Duración de la sesión: 2 horas. Material: Piezas preservadas, cadáver y órganos de decomiso para identificar las lesiones macroscópicas. Laminillas obtenidas de la colección de patología y laminillas de los casos procesados por los estudiantes durante la necropsia. Microscopio óptico con sistema de pantalla para la discusión de lesiones microscópicas. Técnica: Los alumnos examinarán las piezas preservadas, cadáveres y órganos de decomiso con la finalidad de identificar las lesiones macroscópicas presentes en los tejidos con inflamación y en la reparación tisular. Con ayuda de laminillas de casos previamente seleccionados por el profesor, se realizará la explicación de los diferentes tipos de inflamación y en la reparación tisular, con el uso del microscopio óptico con sistema de pantalla. Posteriormente los alumnos revisarán sus juegos de laminillas para identificar las características microscópicas de inflamación y de reparación tisular. Interpretación u observaciones: 53/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal El discente describirá las lesiones presentes en inflamación y reparación tisular. Preguntas para discusión: ¿Cuál es la apariencia macroscópica de los tejidos inflamados? ¿Qué elementos celulares están presentes a nivel microscópico en la inflamación crónica? ¿Qué elementos celulares están presentes a nivel microscópico en la inflamación aguda? ¿Qué elementos celulares constituyen un granuloma? Evaluación: La práctica será acreditada por asistencia, participación y entrega de reporte escrito. El reporte debe incluir portada de identificación, descripción de los diferentes tipos de gangrena, con su correspondiente imagen (consultar páginas web) y etiologías probables. Lugar donde se llevará a cabo: La sesión de lesiones macroscópicas será en la Sala de Necropsias del Centro de Investigación y Estudios Avanzados en Salud Animal, FMVZ, UAEM. La observación de lesiones microscópicas será en el Laboratorio de Prácticas de la FMVZ UAEM. Bibliografía: Blood, D.C.; Henderson, J.A; Radostits, O.M.: (1986). Medicina Veterinaria. 6a. Ed. Interamericana México. Cheville, N.: (1988). Introduction to Veterinary pathology. Iowa State U.P. U.S.A. Jones, C.T. and Hunt, D.R.: (1983). Veterinary pathology 5th Ed Lea Febiger U.S.A. Jubb, K.V.F.; Kennedy, P.C. And Palmer, N.: (1993). Pathology of domestic Animals. 4th Ed Academic Press. U.S.A. Robbins, S.L.: (1975). Patología estructural y funcional. Ed. Interamericana. México. Trigo, T.F.J.: (1987). Patología sistémica veterinaria, Vol.1 UNAM México. 54/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal UNIDAD CUATRO Práctica 10: Integración del diagnóstico Por diagnóstico integral entendemos una formulación breve que hace el médico veterinario, a partir de: La información aportada por el encargado del paciente, obtenida en el proceso de entrevista, en la evaluación médica y la elaboración de la historia clínica. Del proceso de correlación y el análisis de los elementos más relevantes de la información obtenida en todas las áreas. Este diagnóstico da cuenta no sólo de la fisiopatología, sino de la condición de salud o enfermedad y las circunstancias relevantes de cada animal o grupo de animales en particular. El diagnóstico integral incluye: Ubicación de la edad y etapa de desarrollo del animal. Condición de su proceso de crecimiento y desarrollo. Presencia o no de factores de riesgo y protección. Hallazgos relevantes en lo físico, ambiental, función zootécnica, vacunaciones, desparasitaciones, alimentación, instalaciones y resultados de pruebas complementarias. Un buen diagnóstico integral permite, además, que otro profesional que lo lea, tenga una imagen clara e integrada de quién es el paciente que acudió o acude a la consulta y cuál es su condición de salud o enfermedad. El diagnóstico integral es el análisis final de: Historia Clínica, la enumeración de los hallazgos anatomopatológicos e histopatológicos, de los distintos diagnósticos diferenciales, del análisis de pruebas complementarias que permitan emitir un diagnóstico morfológico y en el mejor de los casos etiológico. Objetivo: Integrar un diagnóstico final, basados en la historia clínica y estudios complementarios. Duración de la sesión: 2 horas por caso clínico. 55/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Material: Historias clínicas con resultados de pruebas complementarias de casos de animales remitidos al CIESA para diagnóstico. Laminilla correspondientes a los casos. Técnica: El discente elaborará un diagnóstico morfológico a través de la historia clínica, resultados de estudios complementarios y la observación de lesiones microscópicas de las laminillas correspondientes al caso. Interpretación u observaciones: El alumno elaborará diagnósticos morfológicos, diferenciales y etiológicos previos a su diagnóstico integral de los casos estudiados Preguntas para discusión: ¿Qué elementos de la historia clínica fueron determinantes para solicitar las pruebas de diagnóstico complementarias? ¿Cuál de las pruebas complementarias empleadas fue la más importante para llegar al diagnóstico integral? ¿Qué pruebas faltaron, en caso de que no se lograra llegar al diagnóstico etiológico? Evaluación: La práctica será acreditada por asistencia, participación y entrega de reporte escrito. El reporte debe incluir portada de identificación y descripción de los diferentes diagnósticos elaborados para llegar al diagnóstico integral. Lugar donde se llevará a cabo: La sesión de lesiones macroscópicas será en la Sala de Necropsias del Centro de Investigación y Estudios Avanzados en Salud Animal, FMVZ, UAEM. La observación de lesiones microscópicas será en el Laboratorio de Prácticas de la FMVZ UAEM. Bibliografía: Blood, D.C.; Henderson, J.A; Radostits, O.M.: (1986). Medicina Veterinaria. 6a. Ed. Interamericana México. 56/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Cheville, N.: (1988). Introduction to veterinary pathology. Iowa State U.P. U.S.A. Jones, C.T. and Hunt, D.R.: (1983). Veterinary pathology 5th Ed Lea Febiger U.S.A. Jubb, K.V.F.; Kennedy, P.C. And Palmer, N.: (1993). Pathology of domestic animals. 4th Ed Academic Press. U.S.A. Robbins, S.L.: (1975). Patología estructural y funcional. Ed. Interamericana. México. Trigo, T.F.J.: (1987). Patología sistémica veterinaria, Vol.1 UNAM México. 57/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal ANEXO 1 SECRETARIA DE AGRICULTURA, GANADERIA Y DESARROLLO RURAL NORMA Oficial Mexicana NOM-051-ZOO-1995, Trato humanitario en la movilización de animales. Al margen un sello con el Escudo Nacional, que dice: Estados Unidos Mexicanos.- Secretaría de Agricultura, Ganadería y Desarrollo Rural. NORMA OFICIAL MEXICANA NOM-051-ZOO-1995, TRATO HUMANITARIO EN LA MOVILIZACION DE ANIMALES. La Dirección General Jurídica de la Secretaría de Agricultura, Ganadería y Desarrollo Rural, con fundamento en los artículos 35 fracción IV de la Ley Orgánica de la Administración Pública Federal; 4o. fracciones I y III, 12 fracción XIV, 17 y 47 de la Ley Federal de Sanidad Animal; 1o., 38 fracción II, 40 fracciones III y XI, 41 y 47 fracción IV de la Ley Federal sobre Metrología y Normalización; 12 fracciones XXIX y XXX del Reglamento Interior de esta Dependencia, y CONSIDERANDO Que es función de la Secretaría de Agricultura, Ganadería y Desarrollo Rural fomentar programas y elaborar normas oficiales de sanidad animal, así como atender, supervisar y fomentar el trato humanitario a los animales durante su aprovechamiento, movilización y sacrificio. Que los animales, cualquiera que sea su función (abasto, trabajo, compañía, exhibición u otra) o el motivo para su movilización (destino al sacrificio, cambio de instalaciones, traslado a exposiciones o atención médica), indistintamente de su edad, raza, sexo o condición física, se requieren movilizar bajo las mejores condiciones posibles que permitan su bienestar. Que cuando las maniobras para la movilización de animales (desde el arreo, embarque, traslado y desembarque) son adecuadas según el caso, se disminuyen los factores de estrés que los hacen susceptibles a contraer enfermedades infecciosas. Que los animales de abasto movilizados bajo condiciones mínimas de estrés y que favorezcan su bienestar, sufrirán menos traumatismos o golpes y habrá menos riesgo de muerte, y la calidad de sus productos y subproductos será mejor, evitándose pérdidas económicas por decomiso de canales provenientes de animales maltratados. Que el objeto de las disposiciones señaladas en esta Norma es la implantación de sistemas y diseños para equipos de arreo, rampas, contenedores vehículos especializados para movilización de animales, que permitan cumplir cada vez mejor con todos los propósitos aquí mencionados y los que se adicionen en el futuro. Que para alcanzar los objetivos señalados en los párrafos anteriores, con fecha 31 de octubre de 1996, se publicó en el Diario Oficial de la Federación el Proyecto de Norma Oficial Mexicana NOM-051-ZOO-1995, Trato humanitario en la movilización de animales, iniciando con ello el trámite a que se refieren los artículos 45, 46 y 47 de la Ley Federal sobre Metrología y Normalización, por lo que el 2 de enero de 1998, se publicaron las respuestas a los comentarios recibidos en relación a dicho Proyecto. 58/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Que en virtud del procedimiento legal antes indicado, se modificaron los diversos puntos del proyecto que resultaron procedentes, por lo que a petición del Presidente del Comité Consultivo Nacional de Normalización de Protección Zoosanitaria se expide la presente Norma Oficial Mexicana, NOM-051-ZOO-1995, Trato humanitario en la movilización de animales, para quedar de la siguiente manera: INDICE 1. Objetivo y campo de aplicación 2. Referencias 3. Definiciones 4. Requisitos generales para la movilización de animales domésticos 5. Requisitos particulares de movilización por especie 6. Requisitos para la movilización de fauna silvestre 7. Movilización de abejas productoras de miel (Apis mellifera l.) 8. Sanciones 9. Concordancia con normas internacionales 10. Bibliografía 11. Disposiciones transitorias Apéndices normativos 1. Objetivo y campo de aplicación 1.1. La presente Norma Oficial Mexicana tiene como objetivo primordial establecer los sistemas de movilización de animales que disminuyan su sufrimiento, evitándoles tensiones o reduciéndolas durante todo el proceso. 1.2. La presente Norma Oficial Mexicana es de observancia obligatoria en todo el territorio nacional y es aplicable a la movilización de animales. 1.3. Las responsabilidades derivadas de esta Norma recaerán sobre el propietario de los animales que se movilicen, así como en la persona o empresa comercializadora, el transportista, el encargado de los animales o cualquier persona responsable de su movilización, según sea el caso. 1.4. La vigilancia de esta Norma corresponde a la Secretaría de Agricultura, Ganadería y Desarrollo Rural y a los Gobiernos de los Estados, en el ámbito de sus respectivas atribuciones y circunscripciones territoriales, y de conformidad con los acuerdos de coordinación respectivos. 1.5. La aplicación de las disposiciones contenidas en esta Norma, compete a la Dirección General de Salud Animal, así como a las Delegaciones Estatales de la Secretaría de Agricultura, Ganadería y Desarrollo Rural y a los Gobiernos de los Estados, en el ámbito de sus respectivas atribuciones y circunscripciones territoriales. 59/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal 2. Referencias Para la correcta aplicación de esta Norma deben consultarse las siguientes normas oficiales mexicanas: NOM-024-Z00-1995, Especificaciones y características zoosanitarias para el transporte de animales, sus productos y subproductos, productos químicos, farmacéuticos, biológicos y alimenticios para uso en animales o consumo por éstos. NOM-033-Z00-1995, Sacrificio humanitario de los animales domésticos y silvestres. NOM-045-Z00-1995, Características zoosanitarias para la operación de establecimientos donde se concentren animales para ferias, exposiciones, subastas, tianguis y eventos similares. NOM-059-ECOL-1994, Que determina las especies y subespecies de flora y fauna silvestre, terrestre y acuática, amenazadas, raras y aquellas sujetas a protección especial y que establece especificaciones para su protección. NOM-011-SSA2-1993, Para la prevención y control de la rabia. 3. Definiciones Para efectos de la presente Norma, se entiende por: 3.1. Abeja: Insecto himenóptero, Apis mellifera l. 3.2. Acopio: Acción de reunir o juntar a los animales. 3.3. Animales: Seres orgánicos que viven, sienten y se mueven voluntariamente o por instinto. 3.3.1. Anfibios: Clase de vertebrados que pueden vivir en medio terrestre o acuático de manera indistinta. 3.3.2. Domesticado (amansado o adiestrado): Animal sacado de su medio ambiente natural y que requiere del hombre para su subsistencia. 3.3.3. Domésticos: Todas aquellas especies que están bajo el cuidado del hombre. 3.3.4. Invertebrados: Aquellos animales que carecen de columna vertebral. 3.3.5. Mamíferos: Vertebrados que tienen glándulas mamarias para criar a su prole. 3.3.6. Reptiles: Clase de los vertebrados de respiración pulmonar que se desplazan arrastrándose y que poseen escamas en el cuerpo. 3.3.7. Venenosos: Aquellos que por contacto, piquete o mordida ocasionan trastornos al hombre y hasta pueden causarle la muerte. 3.4. Amarre: Diferentes nudos que se realizan para sujetar animales. 3.5. Arreo: Procedimiento por medio del cual se moviliza a los animales de un sitio determinado a otro. 3.6. Aves: Clase de vertebrados que se reproducen por medio de huevos, con cuerpo recubierto de plumas y que en su mayoría se desplazan volando. 60/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal 3.6.1. Canoras: Las aves que se mantienen cautivas por lo melodioso de su canto. 3.6.2. De ornato: Aquellas aves que se mantienen cautivas por lo vistoso de su plumaje. 3.6.3. De presa: Especies de aves que poseen poderosas garras o picos para poder cazar su alimento; se incluyen todas las rapaces. 3.6.4. De corral: Aquellas aves que se crían para abasto, tales como gallinas, gansos, patos, guajolotes, entre otras. 3.7. Cama: Material que se pone en el suelo para que los animales pisen o se echen. 3.8. Certificado de salud: Documento en el que se asienta que un animal se encuentra clínicamente sano. Debe estar firmado por un médico veterinario que posea cédula profesional. 3.9. Certificado zoosanitario: Documento oficial expedido por la Secretaría de Agricultura, Ganadería y Desarrollo Rural o por quienes estén aprobados o acreditados para constatar el cumplimiento de las normas oficiales mexicanas. Tratándose de animales, será signado por un médico veterinario de la Secretaría o aprobado o acreditado. 3.10. Contenedores: Receptáculos con piso, paredes y techos sólidos, independientes del vehículo de transporte, diseñados para movilizar animales. 3.11. Corrales de descanso: Instalaciones bien acondicionadas para el reposo de los animales, con facilidades para alimentarlos y darles de beber y, en su caso, contar con los medios para realizar sacrificios de emergencia 3.12. Cuarentena: Medida zoosanitaria de control, basada en el aislamiento temporal, observación y restricción de la movilización de animales como medida profiláctica por sospecha o existencia de una enfermedad o plaga de los mismos. 3.13. Densidad de carga: Número de animales que se movilizan en condiciones óptimas en relación al volumen disponible del vehículo. 3.14. Duración del transporte: Tiempo total empleado en el traslado de los animales. 3.15. Embarcar: Acción de introducir a los animales en los vehículos o contenedores, para su movilización. 3.16. Embarcadero: Sitio destinado para embarcar. 3.17. Embarque: Número total de animales movilizados durante una maniobra de traslado. 3.18. Excreciones: Descarga o deposición de materia fecal, orina, vómito u otros. 3.19. Fauna silvestre: Todos aquellos animales que no son domésticos. 3.20. Fleje: Tira o banda de material resistente para sellar un contenedor. 3.21. Gestación: Tiempo que dura la preñez o embarazo. 3.22. Hacinamiento: Amontonamiento. 3.23. Haces luminosos: Conjunto de rayos emitidos o reflectados por una fuente luminosa. 3.24. Huella: Señal que deja un pie o pata o espacio para pisar. 61/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal 3.25. Insensibilización: Acción con la que se induce rápidamente a un animal a un estado en el que no sienta dolor. 3.26. Jareta: Dobladillo donde pasa una cinta que amarra un costal. 3.27. Jaula: Armazón de madera, mimbre, alambre o barras de metal que sirve para encerrar animales y poderlos movilizar. 3.28. Jaula de abejas a granel: Embalaje para transporte cubierto en dos de sus caras con malla mosquitera. 3.29. Lesión: Daño o alteración morbosa, orgánica o funcional de los tejidos. 3.30. Manejo: Actividades o manipulación de los animales desde el acopio, embarque, movilización, hasta el desembarque. 3.31. Movilización: Traslado de animales de un lugar a otro por medio de un vehículo destinado para este fin, ya sea por vía terrestre, marítima, aérea o a pie. 3.32. Núcleos de abejas: Conjunto de abejas en desarrollo que consta de 2 a 5 bastidores, cría, abejas adultas y reservas alimenticias. 3.33. Peralte: Altura en relación con el piso. 3.34. Perchas: Barras de madera o cualquier otro material que imite superficies naturales para que las aves posen sus patas y descansen sobre ellas. Deben atravesar de un lado a otro del contenedor o jaula y tener un diámetro que corresponda al tamaño de las patas de las aves movilizadas, para las aves que así lo requieran. 3.35. Periodo de descanso: Comprende desde el momento en que ha sido desembarcado el último animal, hasta el momento en que se embarca de nuevo al primero. Si los vehículos están construidos para fines de traslado, el descanso de los animales puede permitirse en el interior de los mismos. 3.36. Periodo de movilización: Tiempo de permanencia de los animales dentro del vehículo durante su movilización. 3.37. Persona o empresa comercializadora: Persona física o moral que realiza actividades de compra y venta de animales, que para lo cual tiene que movilizarlos. 3.38. Propietario: Dueño de un animal. 3.39. Punto de verificación: Sitio aprobado por la Secretaría de Agricultura, Ganadería y Desarrollo Rural, donde se constata el cumplimiento de las normas oficiales mexicanas vigentes en materia de salud animal a través de la inspección documental y/o física. 3.40. Sacrificio de emergencia: Sacrificio necesario con métodos humanitarios que se practica en cualquier animal que haya sufrido lesiones traumáticas o afecciones que le causen dolor y sufrimiento; o bien para aquellos animales que al estar fuera de control puedan causar algún daño o lesión al hombre u otros animales. 3.41. Salud: Estado normal de las funciones orgánicas de los animales. 3.42. Secretaría: La Secretaría de Agricultura, Ganadería y Desarrollo Rural. 3.43. Trato humanitario: Conjunto de medidas para disminuir la tensión, sufrimiento, traumatismos y dolor de los animales durante su captura, movilización, exhibición, cuarentena, comercialización, aprovechamiento, entrenamiento y sacrificio. 62/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal 3.44. Traumatismo: Acción violenta del exterior que produce una lesión local o general y que puede causar hasta la muerte. 3.45. Trayecto: Espacio a recorrer entre un punto y otro. 3.46. Toldo: Cubierta de lona o hule sostenida sobre un camión por medio de arcos para resguardar su contenido del sol o la lluvia. 4. Requisitos generales durante la movilización de animales 4.1. Referente a los animales. 4.1.1. Durante todas las maniobras de movilización, la seguridad y comodidad con que se manejen y viajen los animales, son factores de atención prioritaria. 4.1.2. Por lo general no se debe restringir a los animales el consumo de alimento y agua antes de su movilización, a excepción de los casos mencionados en los capítulos que tratan de cada especie. 4.1.3. No debe ser movilizado ningún animal que no pueda sostenerse en pie, que se encuentre enfermo, herido o fatigado, a menos que la movilización sea por una emergencia o para que los animales reciban tratamiento médico y siempre que su movilización no represente un riesgo zoosanitario. En caso de hembras no se movilizarán cuando se tenga la certeza de que el parto ocurrirá durante el trayecto. 4.1.4. No deben movilizarse crías de animales que para su alimentación y cuidados aún dependan de sus madres, a menos que viajen acompañadas por ellas. 4.1.5. Cuando los animales se movilicen en grupos no homogéneos se deben subdividir en lotes, ya sea según especie, sexo, edad, peso o tamaño, condición física, función zootécnica o temperamento, y si se alojan en el mismo vehículo se usarán divisiones en su interior. 4.1.6. En el caso de las especies ectotermas como invertebrados, anfibios y reptiles, se tomarán las precauciones necesarias para facilitar la ventilación y mantenimiento de los animales en temperaturas cercanas al rango óptimo para cada caso en particular. En el caso de las especies endotermas como las aves y mamíferos, no serán transportadas en condiciones climáticas extremas. 4.2. Referente al manejo. 4.2.1. El manejo comprende todas las maniobras necesarias para la movilización de los animales, que incluyen: el acopio, arreo, enjaulado, embarco, traslado y desembarco, que en todos los casos se realizarán con precaución y con calma. 4.2.2. El periodo de movilización comprende desde el momento en que se embarca al primer animal, hasta el momento en que se ha desembarcado al último. Los periodos máximos de confinamiento de los animales en vehículos equipados con bebederos o comederos, o que permitan el descanso en su interior, están recomendados en los capítulos de la especie que se trate. 4.2.3. En los puntos de inspección sanitaria los trámites de inspección deberán ser expeditos, ya que si hay aglomeración de vehículos, el periodo de espera afecta la condición de los animales. 4.2.4. De preferencia, los responsables del manejo serán cuidadores o vaqueros a los que estén acostumbrados los animales y los reconozcan fácilmente. 63/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal 4.2.5. Los responsables del manejo para la movilización de los animales, deben mantenerlos tranquilos en todo momento, actuando sin brusquedad, evitando hacer ruido excesivo o dar gritos o golpes, para que los animales no sufran tensión ni se lastimen, agredan o peleen. 4.2.6. Durante el arreo no debe golpearse a los animales con ningún objeto que pueda causarles traumatismos. 4.2.7. Las maniobras de embarco y desembarco de animales deberán hacerse bajo condiciones de buena iluminación, tanto dentro como fuera del vehículo. Se debe evitar durante estas maniobras el contraste brusco entre la luz y la oscuridad, o dirigir haces luminosos de luz directamente a los ojos de los animales. 4.2.8. Para la maniobra de embarco y desembarco de animales, el vehículo se debe retroceder lentamente, cuidando que no quede espacio entre su piso y la rampa, donde puedan quedar atrapadas las patas de los animales, evitando así que se caigan o fracturen. 4.2.9. No deben sobrecargarse con animales los vehículos de movilización, debiendo respetarse las densidades de carga indicadas para cada especie animal en el capítulo correspondiente. 4.2.10. Para movilizar en el mismo vehículo a uno o varios animales de diferente procedencia, tamaño, condición física, edad o sexo, se debe contar con suficientes divisiones que permitan separarlos dentro del vehículo, según sea el caso. 4.2.11. En caso de tener que amarrar a los animales para su movilización, nunca se sujetarán por las patas ni se utilizarán nudos corredizos que puedan causar su estrangulación. 4.2.12. Deben inspeccionarse los animales periódicamente a lo largo del recorrido, para detectar aquellos que estén echados o caídos, tratando de evitar que sean pisoteados o sufran mayores lesiones, como hematomas o fracturas. 4.2.13. Cuando se amerite un sacrificio de emergencia deberá procederse conforme a la Norma NOM-033-ZOO-1995, Sacrificio humanitario de los animales domésticos y silvestres, en los capítulos correspondientes. 4.2.14. Si el trayecto durante la movilización es largo, se recomiendan periodos de descanso, con o sin desembarco de los animales para que reciban agua o alimento periódicamente, según lo señalado en los capítulos correspondientes. 4.2.15. En el caso de vehículos equipados adecuadamente para abrevar y alimentar a los animales en su interior, los periodos de descanso durante el trayecto se deben cumplir siempre con el vehículo estacionado bajo la sombra. 4.2.16. Solamente se desembarcan a los animales para que descansen durante el trayecto cuando el certificado zoosanitario vigente para esa movilización así lo permita, y si además existen lugares apropiados o corrales de descanso a lo largo del camino, que estén aprobados por la Secretaría. 4.2.17. Los tiempos de espera de animales de abasto en los rastros, deberán cumplirse con los vehículos estacionados bajo la sombra, y para disminuir los tiempos de espera en los rastros: a) El arribo de los animales deberá programarse cada vez que sea posible. b) Los rastros deberán contar con suficientes corrales de desembarco. 4.2.18. Para movilizar ganado que recientemente haya sido sumergido en agua o baño garrapaticida, deberá dejarse escurrir a los animales antes de ser embarcados. No deben embarcarse nunca animales aún mojados cuando se vayan a movilizar bajo condiciones de clima frío. 4.2.19. Nunca se deben movilizar animales junto con sustancias en el mismo vehículo, y especialmente cuando éstas sean tóxicas o peligrosas. 64/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal 4.3. Referente a los vehículos, contenedores y jaulas. 4.3.1. La movilización de los animales, ya sea por vía terrestre carretera o ferrocarril, aérea o marítima, debe realizarse con vehículos y/o contenedores diseñados o adaptados para este fin. 4.3.2. La movilización aérea de cualquier especie animal se hará de acuerdo con las normas establecidas por la International Air Transport Association (IATA). 4.3.3. La selección del tamaño, diseño, material y resistencia del vehículo, contenedor o jaula más apropiado, debe hacerse con base en la especie, número, tamaño, edad, sexo, fin zootécnico o comportamiento de los animales que se vayan a movilizar, incluyendo un método seguro para mantenerlo cerrado para evitar escapes de los animales o accidentes a terceras personas. 4.3.4. Los contenedores o jaulas deberán sujetarse firmemente a los vehículos durante su movilización, para evitar: a) Que se muevan durante el viaje y se lesionen los animales ocupantes. b) Que cualquier objeto alrededor obstaculice su ventilación o caiga sobre ellos. Ejemplo: Jaulas de aves u otros animales que van sobre plataformas. 4.3.5. En el interior de vehículos, contenedores o jaulas no deben existir clavos, alambres, salientes, pasadores o cualquier objeto punzocortante que pueda lesionar a los animales durante el manejo. 4.3.6. Los vehículos para la movilización de animales deberán contar con mantenimiento adecuado para evitar descomposturas durante el trayecto. 4.3.7. Los vehículos o contenedores estarán diseñados y construidos de manera que: a) Los animales sean embarcados y desembarcados fácilmente. b) La ventilación sea de acuerdo con el clima y requerimientos de las especies animales de que se trate. c) Sean fáciles de limpiar. d) Estén equipados con rampas portátiles o dispositivos de emergencia que permitan el desalojo rápido de los animales. 4.3.8. El piso deberá ser antiderrapante y estar en buenas condiciones; si no permite el drenaje y para absorber las excreciones, antes de embarcar a los animales, se acondicionará cubriéndolo con un material de cama limpio y seco, como arena, paja o aserrín, cuya cantidad será proporcional a la duración del viaje para prevenir superficies húmedas o lodosas antes de concluirlo. 4.3.9. Si no tienen techo, deben contar con sistemas de cobertura como lonas o toldos, con la finalidad de proteger a los animales del sol, del frío y la lluvia, cuando se requiera. 4.3.10. Las separaciones físicas en el interior de los vehículos, para la movilización de lotes de animales, deben ser de material resistente y estar bien sujetas en el interior para evitar que se muevan o sean derribadas fácilmente por los propios animales. 4.3.11. Los interiores de los vehículos deberán tener la altura suficiente para prevenir golpes en la cabeza y el dorso de los animales que viajan, y además deben estar diseñados de tal forma que no haya escurrimientos de orina, estiércol, 65/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal vómitos u otras excreciones. En el caso de vehículos de 2 pisos, los animales más pesados se colocarán en el piso de abajo y los más ligeros en el piso superior. 4.4. Referente a las rampas y embarcaderos. 4.4.1. Los embarcaderos deben estar ubicados en lugar accesible en el corral de manejo o cerca de éste, para evitar arreos innecesarios y manejo excesivo. 4.4.2. En aquellos lugares donde no coincidan la altura del piso del vehículo y de las rampas fijas de embarcaderos, deberán existir rampas móviles. 4.4.3. Características de las rampas fijas: a) En el extremo más alto debe haber una plataforma de aproximadamente 2 metros de largo. b) La altura de los pisos de la rampa y del vehículo deben coincidir. c) Las paredes serán muy sólidas y el piso firme y antiderrapante. d) El ancho de la plataforma y las rampas, entre las paredes, será aproximadamente de 2.5 m para desembarcar y guiar al ganado cómodamente. e) Las rampas de concreto se recomienda que tengan escalones aproximadamente de 10 cm de altura o peralte y 30 cm de ancho o huella. Cada escalón debe tener algunas canaladuras profundas o el piso antiderrapante. f) Su inclinación no debe exceder los 20 grados. 4.5. Referente al transportista, el recorrido y la documentación. 4.5.1. El chofer debe contar con experiencia para manejar el vehículo y la carga que transporta, conduciendo con precaución, evitando arrancar y detenerse bruscamente y siempre deberá ir acompañado de un asistente. 4.5.2. Debe llevar consigo la siguiente documentación: a) Licencia de manejo vigente, que corresponde al tipo de vehículo que conduce y acorde al servicio prestado. b) Los datos y dirección completos del destinatario del embarque. c) Los datos y manera de comunicarse, ya sea con el propietario o el destinatario de los animales que moviliza, para avisar sobre cualquier emergencia. d) Todos los documentos o certificados correspondientes a los requisitos de la normatividad oficial vigente de la especie animal que se moviliza. e) Debe contar con un registro para el control de los tiempos de recorrido durante la movilización. 4.5.3. El chofer se debe cerciorar de que las chapas o pasadores de las puertas del vehículo sean seguros y estén bien cerrados antes de iniciar la marcha. 4.5.4. El transportista debe evitar las paradas innecesarias. En caso de que el vehículo se detenga por causas de fuerza mayor y el viaje no pueda reanudarse, se debe desembarcar a los animales o solicitar un reemplazo de vehículo, 66/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal siempre y cuando el certificado zoosanitario de movilización lo permita. Cuando las disposiciones zoosanitarias impidan el desembarco de los animales por viajar en un vehículo con fleje, se dará aviso a la autoridad de sanidad animal más próxima para observar las normas correspondientes. 4.6. Referente a las condiciones durante estancias de animales en terminales de viaje, puertos y aduanas. 4.6.1. En el caso de animales que sean retenidos por más de 12 horas durante el trayecto de su movilización o al arribar a su destino, ya sea por razones fortuitas de decomiso, administrativas o accidentales, se les debe proporcionar alojamiento amplio y ventilado, agua suficiente para beber y alimentación propia de su especie hasta que sea solucionado el problema y puedan proseguir su destino, o sean rescatados y devueltos, o bien entregados a instituciones autorizadas para su custodia y disposición. 4.6.2. Estos animales, en ningún caso deben alojarse junto a la carga general, debiendo habilitarse en los lugares mencionados un espacio previsto para su estancia, en el cual existan las condiciones arriba señaladas. 5. Requisitos particulares de movilización por especie En todos los casos que aplique, habrán de considerarse además los incisos correspondientes a los puntos 4.1., 4.2., 4.3., 4.4. y 4.5. de esta Norma. 5.1. Movilización de aves domésticas. 5.1.1. Para su manejo y movilización no se colgará nunca a las aves de sus alas, ni se les mantendrá amarradas de las patas. 5.1.2. Las jaulas o contenedores con aves no se deben arrojar ni azotar, evitando su excesiva manipulación, procurando manejarlas con sistemas mecánicos. 5.1.3. Cuando se movilicen grupos de aves en una misma jaula, deberá evitarse en todos los casos su hacinamiento dentro de la misma. a) La mayoría de las jaulas para movilizar aves tienen una altura en su interior que impide que viajen paradas, deberán contemplarse diseños más altos para permitir que puedan pararse sin que tope su cabeza con el techo de la jaula. b) Si el piso de la jaula cuenta con orificios, éstos tendrán una forma y tamaño que impida que los dedos y patas de las aves se atoren en ellos. 5.1.4. Pollos y gallinas: La mayor proporción de aves que se movilizan son los pollos y gallinas con destino al rastro. a) Previo al momento del sacrificio se deberá considerar un tiempo de ayuno de 10 horas en promedio, para disminuir la contaminación de las canales por el contenido de alimento aún presente en el aparato digestivo. b) El tiempo de ayuno incluye: - Periodo de restricción al acceso de alimento en la granja. - Tiempo que dure el acopio de las aves. - Enjaulado. - Traslado y tiempo de espera del vehículo en andén del rastro. 67/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal - Desembarco y periodo de sacrificio. c) El periodo de movilización para estas aves no debe ser mayor de 12 horas. No se recomiendan periodos de descanso durante la movilización de aves, ya que no se obtienen beneficios. d) Las jaulas para movilización de pollos y gallinas por lo general son de las siguientes dimensiones: 96 cm de largo, 57 cm de ancho y 23-26 cm de altura libre en el interior. En este tipo de jaulas no deberán introducirse más de 10 pollos o gallinas (con promedio de peso de 2.5 Kg). e) Las jaulas con pollos y gallinas se movilizarán siempre sobre plataformas planas y se acomodarán apiladas en columnas, ya que por su diseño se ensamblan unas con otras, lo que favorece que se mantengan fijas y se muevan menos durante el trayecto. f) Si se movilizan jaulas apiladas, éstas deberán tener un diseño con salientes a los lados, de manera que al ensamblarlas queden espacios de cerca de 4 cm a todo su alrededor para permitir el paso del aire entre ellas y hacia su interior. g) Para favorecer aún más la ventilación no se formarán columnas de más de 4 jaulas de ancho y entre cada columna se respetarán espacios por lo menos de 15 cm de separación. 5.1.5. Pollitos recién nacidos. Al salir de las plantas de incubación se movilizan gran cantidad de pollitos de 1 a 2 días de nacidos, en cajas que varían en tamaño y construcción. a) No deben movilizarse más de 100 pollitos/caja. b) El interior de cada caja contará con separadores fijos que permitan subdividirla al menos en cuatro compartimentos para evitar que se hacinen en las esquinas. c) Las dimensiones mínimas en centímetros para las cajas serán: 56 X 46 X 15. d) El fondo de las cajas se debe recubrir de un material inocuo y absorbente. e) La movilización más frecuente se hace en camiones y por vía terrestre, debiendo contar los vehículos, en todos los casos, con ventiladores especiales con tomas y salidas de aire, o con sistema de aire acondicionado, pudiendo requerirse en verano hasta sistemas de refrigeración para contrarrestar la generación de calor cuando el embarque es de miles de pollitos. f) No se recomienda movilizar pollitos recién nacidos por periodos más largos de 16 horas. g) Para movilización aérea de pollitos se usan las mismas cajas y solamente viajarán un máximo de 85 pollitos/caja. 5.1.6. Pavos, patos, gansos, codornices y otras aves de corral. Para su movilización se requieren jaulas con diseño y dimensiones de acuerdo al tamaño y número de aves a movilizar, evitando en todos los casos el hacinamiento. 5.2. Movilización de ganado bovino. 68/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal 5.2.1. El periodo de movilización para el ganado bovino no debe exceder de 18 horas sin descanso y sin darles agua de bebida. a) Los periodos de descanso sin desembarcar al ganado durante los viajes por vía terrestre, deben ser por lo menos de 3 horas y conforme a los incisos 4.2.13. y 4.2.14. de esta Norma. b) En el caso de movilizaciones más prolongadas de 24 horas, además de los descansos cada 18 horas, se les ofrece alimento a los animales. c) Las vacas en producción o recién paridas deben ser ordeñadas cada 12 horas. 5.2.2. En el caso de vacas gestantes dentro de los dos primeros tercios de la gestación y de becerros hasta de 6 meses de edad, no deben movilizarse por más de 8 horas sin descanso, y sin ofrecerles agua y alimento. 5.2.3. Los sementales deben movilizarse individualmente o separados del resto de los animales por medio de divisiones en el interior del vehículo. 5.2.4. En vehículos o contenedores con techo, el espacio mínimo entre el piso y techo será de aproximadamente un tercio más alto de la altura promedio a la cruz de los animales del embarque (ejemplo: altura promedio a la cruz: 1.50 m = 2.00 m espacio interior del piso al techo). 5.3. Movilización de ovinos y caprinos. 5.3.1. No debe usarse el bastón eléctrico para el arreo de ovinos y caprinos, y durante su manejo se evitará en todos los casos levantarlos tomándolos de la lana. 5.3.2. Las jaulas o contenedores para movilizarlos deben tener una altura mínima en el interior de 1.10 m. 5.3.3. Los ovinos machos o moruecos y los machos cabríos adultos, deben movilizarse individualmente y si corresponden al mismo hato pueden viajar en grupo. 5.3.4. Todas las maniobras de embarque de ovinos o caprinos deben hacerse utilizando rampas con las características señaladas en el inciso 4.4. de esta Norma. 5.3.5. El periodo de movilización no debe exceder de 18 horas sin periodos de descanso y sin dar de beber a los animales. a) Los periodos de descanso sin desembarcar al ganado durante los viajes por vía terrestre, deben ser por lo menos de 2 horas y conforme a los incisos 4.2.13 y 4.2.14 de esta Norma. b) Los corderos y cabritos deben recibir agua y alimento cada 8 horas durante los periodos de movilización. 5.4. Movilización de porcinos. 5.4.1. La mayoría de los cerdos que se movilizan son animales para pie de cría o de abasto con destino al rastro, si son adultos, toleran bastante bien las temperaturas frías, en cambio el calor resulta un inconveniente, y si es extremo, se recomienda darles un baño de aspersión durante viajes largos, y aquí la presencia de lluvia resultaría conveniente, como una excepción de lo recomendado en el inciso 4.1.5. 5.4.2. El periodo de movilización en cerdos no debe exceder de 20 horas. a) El periodo de movilización sin descanso no debe exceder de 8 horas. 69/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal b) Los periodos de descanso durante el trayecto se cumplirán por lo menos cada 8 horas con los animales dentro del vehículo, estacionándolo bajo la sombra por periodos que no excederán de 1 hora. 5.4.3. Los pisos de vehículos para movilización de cerdos se recomienda que cuenten con una serie de soleras o tiras de metal con bordes redondeados de 2-3 cm de alto bien fijas y que corran a lo ancho y largo del camión, con la finalidad de favorecer el apoyo de las patas para evitar que resbalen y para favorecer que se levanten, disminuyéndose así las pérdidas por fracturas y golpes. 5.4.4. El espacio mínimo recomendado para movilizar cerdos es de 0.45 m2 por cerdo con promedio de 100 Kg de peso vivo. 5.5. Movilización de equinos. 5.5.1. No se permite la utilización de vehículos de 2 pisos para su movilización. 5.5.2. Los vehículos o remolques deben ser lo suficientemente largos para que los animales quepan cómodamente. 5.5.3. El ancho y largo de las paredes de los remolques para la movilización de equinos será: Peso promedio del animal en kgs menos de 500 más de 500 Espacio entre las paredes en cm 67 81 Largo mínimo del remolque en cm 2.50 3.00 5.5.4. La altura mínima del techo de los vehículos para movilizar equinos será de 75 cm por encima de la cruz de los animales más altos. 5.5.5. La altura mínima de las paredes de vehículos sin techo debe ser suficiente para evitar en todos los casos que los animales puedan brincar. Se recomienda que las paredes lleguen a la altura del cuello. 5.5.6. Para arrear a los equinos nunca se debe usar el bastón eléctrico. 5.5.7. Los garañones deben ser movilizados en forma individual o separados por medio de divisiones del resto de los animales. 5.5.8. Los burros deben ser movilizados separadamente de los caballos y las mulas. 5.5.9. Los equinos deben ser movilizados por periodos máximos de 18 horas, seguidos de un periodo de descanso de 8 horas realizado de preferencia en instalaciones adecuadas. 5.5.10. Si la movilización es más prolongada, los equinos deben viajar por periodos hasta de 12 horas, permitiéndose paradas cada 6 horas, con duración de una hora, para proporcionarles agua y alimento. 5.5.11. Para la movilización de grupos de equinos sueltos, se dividirán en lotes homogéneos según el sexo, peso o alzada. 5.5.12. A los equinos movilizados en grupo para su venta y/o sacrificio, se les deben quitar las herraduras de los cuatro cascos antes de iniciar el viaje para que no se resbalen o evitar que se dañen unos a otros. 5.6. Movilización de perros y gatos. 70/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal 5.6.1. Todos los perros y gatos deben ser movilizados en jaulas adecuadas excepto cuando van acompañados de sus dueños en vehículo particular evitando movilizarlos en espacios muy reducidos o en posturas incómodas. 5.6.2. Es una práctica frecuente que los dueños dejen a sus perros y/o gatos en el interior de sus vehículos estacionados. En estos casos se sugiere lo siguiente: a) Procurar que el tiempo de permanencia del animal en el vehículo sea mínimo. b) Siempre que sea posible, estacionar el vehículo en la sombra. c) Abrir por lo menos dos ventanas del vehículo a una altura que permita la entrada de aire y a la vez evite que el animal escape. 5.6.3. Queda prohibido movilizar perros o gatos dentro de cajuelas, aun en trayectos muy cortos para evitar cualquier riesgo de asfixia o sobrecalentamiento. 5.6.4. El tamaño de las jaulas debe ser suficiente para que el animal pueda moverse libremente en su interior y recostarse en una posición natural. Tipo de animal Gatos chicos grandes Perros muy chicos chicos medianos grandes muy grandes Dimensión mínima establecida de la jaula Ancho Largo Altura 30 cm 50 cm 37 cm 42 cm 60 cm 30 cm 52 cm 75 cm 50 cm 57 cm 87 cm 65 cm 65 cm 1.10 m 75 cm 5.6.5. Las jaulas deben estar construidas con materiales resistentes e impermeables, provistas de orificios en las paredes y/o techo que permitan una suficiente ventilación, con una puerta de acceso fuerte y resistente, cerrada firmemente para evitar que el animal escape. 5.6.6. El piso debe cubrirse durante la movilización con varias capas de papel periódico que permitan la absorción de las excretas y su eliminación periódica. 5.6.7. Los perros y gatos no deberán permanecer más de 24 horas sin ingerir alimento durante los periodos de movilización. 5.6.8. En el caso de movilizaciones durante más de 6 horas, se debe fijar fuertemente al interior de la jaula un receptáculo que contenga agua potable. La forma y material del bebedero deben impedir que el agua se vacíe y que el animal se lastime. 5.6.9. En el caso de perros capturados en cercos epidemiológicos, su transporte se hará de acuerdo a los reglamentos que sobre los centros de control canino, expidan los servicios estatales de salud. 5.7. La jaula o contenedor debe contar siempre con una identificación o etiqueta visible y bien adherida que cuente con la siguiente información: * Datos del destinatario y del remitente. * Contenido: nombre común y científico del animal y número de ejemplares. 71/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal * Datos relevantes acerca de la temperatura o alimentación para el mantenimiento de los ejemplares durante el periodo de movilización. * Indicaciones especiales, como ejemplo: productos utilizados para sedación. * Documentación que se acompaña. * Flechas dibujadas que señalen la posición correcta de la jaula o contenedor. * Leyendas de importancia como: "Animales vivos", "Manejar con cuidado". 6. Movilización de fauna silvestre Se ubican dentro de la fauna silvestre los siguientes: Invertebrados: terrestres como tarántulas, alacranes, escarabajos, entre otros. Anfibios: como ranas, salamandras, ajolotes, entre otros. Reptiles: como víboras, cocodrilos, tortugas, saurios, entre otros. Aves: canoras y de ornato, de presa, palmípedas y corredoras. Mamíferos: carnívoros, herbívoros, insectívoros tanto terrestres como voladores. a) Para evitar que los animales escapen o produzcan lesiones al personal que los maneja, en todos los casos deberán tomarse las medidas de seguridad pertinentes. b) Cualquier contenedor donde se movilicen animales silvestres de preferencia se colocará en lugares oscuros o con poca luz para disminuir el estrés durante el viaje, pero siempre evitando los objetos que obstaculicen su ventilación o que pudieran caer sobre él. c) Cualquier caja, jaula o contenedor donde se movilicen animales silvestres debe permitir una abundante ventilación de los ocupantes en su interior; deben contar con orificios en la tapa y en las paredes, los cuales serán de un diámetro tal que impida la salida de la cabeza o de alguna extremidad. d) En todos los casos cuando se movilicen animales silvestres en grupo deberá evitarse el hacinamiento. e) La jaula o contenedor debe contar siempre con una identificación o etiqueta visible y bien adherida que cuente con la siguiente información: * Datos del destinatario y del remitente. * Contenido: nombre común y científico del animal y número de ejemplares. * Datos relevantes acerca de la temperatura o alimentación para el mantenimiento de los ejemplares durante el periodo de movilización. * Indicaciones especiales, como ejemplo: productos utilizados para sedación. * Documentación que se acompaña. 72/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal * Flechas dibujadas que señalen la posición correcta de la jaula o contenedor. * Leyendas de importancia como: "Animales vivos", "Manejar con cuidado" u otros. * Cuando se movilizan animales venenosos, debe incluirse una leyenda visible que diga: "Peligro Venenoso", como se indica en el Apéndice A (Normativo) * En su caso, incluir una leyenda de "animales peligrosos". * Incluir una leyenda de "fauna silvestre". 6.1. Invertebrados terrestres, como se indica en el Apéndice B (Normativo) a) Deben movilizarse en cajas con divisiones para cada uno de los individuos, ya que la mayoría de estas especies son de hábitos carnívoros. b) Si el viaje es prolongado de más de 24 horas, se debe colocar en una esquina de cada división de la caja una esponja con tamaño similar al del cuerpo del animal, embebida con agua potable colocada sobre una superficie impermeable para que puedan beber. c) En el caso de caracoles para consumo, se deben transportar en cajas con cama de salvado o aserrín debidamente ventiladas y permitiéndoles libertad de movimiento. 6.2. Anfibios de abasto (Ranas, ajolotes). 6.2.1. Pueden viajar en cajas de unicel o de madera que tengan en las paredes y la tapa un buen número de orificios para lograr la mayor ventilación posible. El piso debe ser de consistencia suave o lisa e impermeable cubierta la mitad de una capa de hule espuma húmedo para que los animales se posen en la parte seca o húmeda cuando deseen. Sólo se introducirá el número de animales que ocupe la mitad de la superficie del suelo. Los animales deben movilizarse con ayuno de 24 horas, para disminuir la cantidad de excretas. Las cajas deben estar firmemente cerradas, como se indica en el Apéndice C (Normativo). 6.3. Reptiles. Deben movilizarse con ayuno de 24 horas cumpliendo con lo indicado en el punto 4.1.6. de esta Norma. 6.3.1. Tortugas y saurios: Se colocan en cajas de unicel o madera con piso liso de textura suave. Si se movilizan animales muy grandes, de preferencia deben viajar en forma individual, la caja debe contar con varios orificios, como se indica en el Apéndice D (Normativo). 6.3.2. Serpientes y saurios venenosos: Deben colocarse primero en una caja de acrílico transparente con orificios más pequeños que el diámetro de su cabeza para una ventilación adecuada; esta caja se colocará dentro de otra caja de madera o unicel, también con numerosos orificios que permitan la ventilación de la primera. La utilización de doble caja es muy importante para evitar que escapen y por la seguridad del personal que los maneja. 6.3.3. Serpientes no venenosas: Pueden estar contenidas en cajas de madera, unicel o acrílico con orificios para su ventilación. También pueden estar contenidas en sacos de tela resistente y permeable que permita el intercambio de aire, manteniendo dichos sacos en ambiente ligeramente húmedo. Los ejemplares se colocan de preferencia individualmente en sacos con la parte superior cerrada firmemente a manera de jareta con un cordón y para evitar la salida del ejemplar se debe hacer un segundo nudo bajo la jareta; posteriormente se colocan los sacos en cajas que contengan en el techo y paredes suficientes orificios. Las cajas deben estar bien cerradas. 73/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal 6.3.4. Cocodrilos, lagartos, caimanes y gaviales: No deben movilizarse animales de diferentes especies en la misma caja. Los animales de gran tamaño deben viajar de manera individual; las cajas deben tener las dimensiones necesarias para que el animal permanezca ahí de manera estática, pero cómodo; evitándose al mismo tiempo que gire su cuerpo de modo circular o sobre su propio eje. La caja debe ser de madera o de otro material resistente, con orificios en paredes y tapa como se indica en el Apéndice E (Normativo). No se requiere alimentar animales adultos durante movilizaciones menores a 72 horas. El ayuno máximo para crías y animales en desarrollo deberá ser de 24 horas y se recomienda colocar cama de aserrín o viruta de madera en la caja. 6.4. Aves silvestres. Para estas especies debe referirse al punto 4.1.6. de esta Norma. - Punto 6.4.1. a) Canoras, de ornato y en general aves de talla pequeña como canarios, pinzones, palomas, periquitos y loros pequeños. Se les confina en cajas o jaulas que pueden contar o no con perchas de un diámetro adecuado para que posen sus patas cómodamente durante el viaje. Las cajas deben contar con bebederos y comederos adecuados, dispuestos de tal forma que no puedan vaciarse mojando la jaula o a los animales. La altura de la caja depende del tamaño de las aves, considerando siempre que tengan libertad para mantenerse erectas cuando existen perchas, como se indica en el Apéndice F (Normativo). Los barrotes de las jaulas o los orificios de las cajas cumplirán con las especificaciones del punto 6. inciso c). Cuando sea necesario se colocará en el piso una cama inocua y absorbente para que retenga la humedad de las deyecciones. El transporte de palomas debe realizarse en cestas o jaulas adecuadas para ellas, ya sean individuales o en grupo y podrá llevarse a cabo por particulares o por agrupaciones dedicadas a las competencias o exhibiciones de estos animales. Cuando se trate de agrupaciones, éstas realizarán el transporte de las palomas en vehículos con ventilación adecuada y se les proporcionará agua y alimento suficiente para el número de animales que transporta, cuando no se pueda realizar la suelta como el caso de las palomas mensajeras. b) Aves de talla grande, psitácidos como loros, guacamayas, cacatúas u otras. Cuando las aves son muy grandes deben viajar en forma individual o cuando mucho 2 o 3 animales de la misma especie por caja. Las cajas o jaulas pueden contar o no con perchas de un diámetro adecuado para las patas de los animales, con la finalidad de que se posen cómodos durante el viaje, como se indica en el Apéndice F (Normativo). Los barrotes de las jaulas o los orificios de las cajas cumplirán con las especificaciones marcadas en el punto 6. inciso c). Cuando sea necesario se colocará en el piso una cama inocua y absorbente para que retenga la humedad de las deyecciones. 6.4.2. Aves de presa, como halcones, búhos, zopilotes, águilas, entre otras: Deben viajar en cajas que tengan o no percha con el diámetro correspondiente a la medida de la pata del ave para que pueda viajar cómodamente posada sobre ella, como se indica en el Apéndice F Normativo. Las cajas contarán con las especificaciones del punto 6. inciso c) y según la longitud del trayecto contarán o no con bebedero en su interior. El piso debe ser liso y de una textura que no lesione las patas de los animales. Cuando sea necesario se colocará en el piso una cama inocua y absorbente para que retenga la humedad de las deyecciones. 6.4.3. Aves palmípedas como gansos, pelícanos, patos, garzas y otras: Para movilizarlas durante periodos no mayores de 8 horas, se recomiendan pisos lisos sobre los que se posen los animales, y en el caso de movilizaciones prolongadas se recomiendan pisos de rejilla, en cuyas separaciones no puedan atorarse las patas de los animales y para que a través de esa rejilla drenen las excretas, las cuales deben caer en una charola, para poderlas limpiar sin molestar a los animales. Las paredes y techo deben tener numerosos orificios como se indica en el Apéndice G Normativo. Se les debe colocar comedero y recipientes para agua, los cuales estarán fijos a una de las paredes. 74/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal 6.4.4. Aves grandes o corredoras como avestruz, emú, rhea, casuarios, entre otras: Deben movilizarse en cajas con muy buena ventilación, al igual que se menciona en incisos anteriores, y se recomienda que el interior esté oscuro para disminuir el estrés. El espacio por dentro debe ser suficiente para que el animal pueda moverse, no se deben colocar más de 2 aves por contenedor; o bien, pueden movilizarse en grupo, el piso será de un material suave y absorbente para evitar que se lastimen las patas, preferentemente no se utilizará material de cama ya que los animales pueden ingerirlo; si la movilización no es mayor de 24 horas, no se requiere darles alimento; si la movilización es más prolongada debe haber comedero y bebedero en el interior del contenedor para ofrecerles agua y comida. También pueden movilizarse en camiones para transporte de equinos, siempre y cuando tengan buena ventilación y el piso sea antiderrapante, como se indica en el Apéndice G (Normativo). 6.5. Mamíferos terrestres. 6.5.1. Primates no humanos: Deben movilizarse en cajas o jaulas con poca separación entre los barrotes, o bien, en cajas individuales de madera totalmente cerradas con orificios de acuerdo al punto 6. inciso c) de esta Norma, con abundante cama sin charola y con cerrojos seguros. La caja debe tener una pequeña puerta o ventana como se indica en el Apéndice H (Normativo), por la que se pueda observar al animal y darle agua y alimento con la frecuencia que se requiera, en viajes mayores de 8 horas generalmente es necesario. 6.5.2. Carnívoros: Las cajas para movilizarlos deben ser lo suficientemente amplias para que los animales se puedan mover y darse vuelta cómodamente. En su diseño se debe considerar una doble puerta de preferencia y los implementos necesarios para cargar o mover la caja en forma segura, como se indica en el Apéndice H (Normativo). El material de construcción debe ser lo suficientemente resistente y seguro, de acuerdo con el tamaño del animal que se desea movilizar, para que resista los movimientos bruscos del mismo, así como la acción de colmillos o garras que puedan dañar esos materiales. Cuando viajen hasta 24 horas no requieren de alimento ni agua, excepto para animales en crecimiento o especies de tamaño pequeño que por lo menos requieren agua, pero si la movilización es de mayor duración siempre se les ofrecerá comida y agua. 6.5.3. Animales de circos y espectáculos: Para su movilización se debe cumplir con los requisitos señalados en esta Norma para cada una de las especies que corresponda. Los osos entrenados pueden viajar en un contenedor resistente o en la caja del camión, siempre y cuando estén sujetos por el cuello con un collar, el cual se debe sujetar unido a una cadena que se debe fijar a una estructura interna firmemente, como se indica en el Apéndice J (Normativo). 6.5.4. Herbívoros pequeños y grandes como camélidos, cebras, cérvidos y antílopes, entre otros: El transporte puede ser individual o en grupo tomando en cuenta sexos y tamaño de los individuos, los contenedores deben ser resistentes, separados interiormente por divisiones, que ni los compriman ni les permitan moverse en grandes espacios, para evitar que se agrupen en las esquinas. El largo de la caja no debe exceder de 40 cm del largo del cuerpo del animal para sólo permitir que se coloque agua o alimento en caso necesario. Si se trata de cajas individuales se debe considerar el uso de puerta en ambos extremos. Debe colocarse abundante cama sobre el piso no derrapante en cualquiera de los casos, sin separaciones para evitar que los animales se atoren en ellas. A los cérvidos se les puede o no cortar las astas antes de movilizarlos. No se deben transportar durante la etapa en que las astas están cubiertas por terciopelo (velvet). En el caso de los antílopes se les deben proteger los cuernos para evitar que se fracturen. La altura de la caja será suficiente para que tengan libertad de enderezar la cabeza en forma cómoda, como se indica en el Apéndice J (Normativo). 6.5.5. Jirafas: Los contenedores pueden estar fabricados sin techo para animales adultos ya que así pueden ver a su alrededor y se estresan menos, deben tener una anchura ligeramente mayor a la del cuerpo del animal y una altura que permita que sólo quede libre la cabeza y un tercio del cuello de la jirafa; para crías o animales jóvenes se utilizan cajas o contenedores preferentemente con techo; como se indica en el Apéndice L (Normativo). Debe colocarse abundante cama en el piso no derrapante. Las maniobras de movilización se deben hacer con delicadeza para evitar cualquier riesgo de fracturas en las extremidades o cuellos tan largos. 75/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal 6.5.6. Rinocerontes, hipopótamos y elefantes: Para movilizar a estos animales se emplean cajas fuertemente construidas con materiales muy resistentes y preferentemente cerrados con puerta en ambos extremos, con piso antiderrapante y suficiente cama. Deben medir sólo un poco más del ancho del cuerpo de cada animal para evitar que puedan darse la vuelta adentro. La longitud de la caja solamente será cerca de medio metro más que el largo del cuerpo del animal para que en viajes largos se les pueda proporcionar alimento y agua. En el caso de la movilización de uno o varios elefantes a la vez, pueden viajar libres en la caja del contenedor siempre y cuando dos de sus patas, una delantera y la contraria trasera, se encuentren sujetas a una cadena sin lastimarlos, las cuales a su vez se fijen en argollas fuertemente sujetas al piso del vehículo como se indica en el Apéndice L Normativo. Cuando se transportan varios animales juntos, se debe considerar siempre la compatibilidad de carácter, talla y sexo. Los animales muy jóvenes y de talla pequeña pueden viajar en grupo y sin sujeción. 7. Movilización de abejas productoras de miel (Apis mellifera l) Las abejas productoras de miel son susceptibles de movilizarse en: colmenas pobladas para producción de miel, para polinización, núcleos de abejas, paquetes o jaulas con abejas a granel. Se deben movilizar con suficiente ventilación y proporcionarles agua limpia diariamente, en especial en climas cálidos. No se expondrán a productos tóxicos como pesticidas, substancias derivadas del petróleo y los gases del escape de los camiones de transporte de carga. En el caso de las colmenas pobladas, se pueden transportar con tapas de viaje y piqueras cerradas, también con piqueras abiertas sin tapas de viaje, en transportes con cajas refrigeradas con ventilación restringida o en camiones abiertos, en el que el conjunto de colmenas se cubran con una malla resistente que les impida salir. 8. Sanciones El incumplimiento a las disposiciones contenidas en la presente Norma, se sancionará conforme a lo establecido en la Ley Federal de Sanidad Animal y la Ley Federal sobre Metrología y Normalización. 9. Concordancia con normas internacionales Esta Norma Oficial Mexicana no es equivalente con ninguna norma internacional. 10. Bibliografía Animal and Plant Health Inspeccion Service (APHIS), USDA 9 CFR.CH.1 (1-1-92 edition). Australian National Code of Practice for Welfare of Animals. Land Transport of Horses-1995. Standing Committee on Agriculture and Resource Management. Arzave Barrera Alfonso. Miembro de la Asociación Mexicana de Médicos Veterinarios Especialistas en Equinos. Comunicación personal. Commission of the European Communities. Directorate General for Agriculture VI B11.2. Council of Europe, Committe of Ministers to Member States on the Transport of Horses-1987. Editorial El Manual Moderno S.A de C.V. Manual de Producción Avícola 1993. 76/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Grandin, T.; 1979. Understanding animal psychology facilitates handling livestock. Vet. Med. Small Anim. Clin. 74:697706. Grandin, T.; 1980a. The effect of stress on livestock and meat quality prior to and during slaughter. Int. J. Stud. Anim. Prob. 1:313-337. Grandin, T.; 1982b. Understanding hog psychology simplifies handling. Vet. Med. Small Anim. Clin. 77:267-271. Grandin, T.; Applied Animal Behaviour Science. 1990; 28:187-201. Animal Science Department, Colorado State University, Fort Collins, CO 80523, USA. González Orijel Antonio. Confederación Nacional Ganadera. Comunicación personal. Guideline for transport and preparation for shipment of live wild animals and plants. CITES. López Coello Carlos. Departamento de Producción Animal; Aves. FMVZ-UNAM. Comunicación personal. Nostrand van Reinhold. Commercial Chicken Production Manual ISBN 0-0442-31882-2. Report of the Scientific Veterinary Comitee.; Animal Welfare Section. On the Transport of Farm Aminals. VI/3404/92-EN Brussels, 18 May 1992. SAGAR.; Instituto Nacional de Investigaciones Forestales y Agropecuarias. División de Investigación Pecuaria. Recomendaciones para el acondicionamiento del ganado, su transportación y recepción. CENID Fisiología y Mejoramiento Animal-1996. Stephens, D.B.; Perry, G.C.; Applied Animal Behaviour Science, 1990;28: 1-2, 41-55-44. Royal Veterinary College, Hawskhead Lane, North Mymms, Hatfield, AL9 7TA.UK. 11. Disposiciones transitorias Las disposiciones contenidas en la presente Norma Oficial Mexicana entrará en vigor al día siguiente de su publicación en el Diario Oficial de la Federación, excepto los siguientes puntos que a continuación se indican: 11.1. Los puntos 4.3.10.; 4.4.2.; 4.4.3. inciso d) y 5.1.3. inciso a), entrarán en vigor un año después, contado a partir de la fecha de publicación en el Diario Oficial de la Federación. 11.2. Los puntos 4.3.7. inciso d); 4.6.1.; 5.3.4 y 5.4.3,: entrarán en vigor tres años después, contados a partir de la fecha de publicación en el Diario Oficial de la Federación. Sufragio Efectivo. No Reelección. México, D.F., a 24 de febrero de 1998.- Con fundamento en lo dispuesto por el artículo 65 del Reglamento Interior de esta Dependencia, el Director de Coordinación Jurídica, Sergio Guerra Beltrán.- Rúbrica. 77/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal 78/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal 79/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal 80/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal 81/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal 82/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal 83/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal 84/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal 85/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal 86/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal 87/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal 88/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal ANEXO 2 07-16-96 NORMA Oficial Mexicana NOM-033-ZOO-1995, Sacrificio humanitario de los animales domésticos y silvestres. Al margen un sello con el Escudo Nacional, que dice: Estados Unidos Mexicanos.- Secretaría de Agricultura, Ganadería y Desarrollo Rural. NORMA OFICIAL MEXICANA DOMESTICOS Y SILVESTRES. NOM-033-ZOO-1995, SACRIFICIO HUMANITARIO DE LOS ANIMALES ROBERTO ZAVALA ECHAVARRIA, Director General Jurídico de la Secretaría de Agricultura, Ganadería y Desarrollo Rural, con fundamento en los artículos 35 fracción IV de la Ley Orgánica de la Administración Pública Federal; 4o. fracciones I, III y V, 12, 16, 17 y 44 de la Ley Federal de Sanidad Animal; 1o., 38 fracción II, 40 fracciones III y XI, 41 y 47 fracción IV de la Ley Federal sobre Metrología y Normalización; 12, fracciones XXIX y XXX del Reglamento Interior de esta Dependencia, y CONSIDERANDO Que actualmente en México no existen normas que regulen las técnicas de sacrificio humanitario en los animales. Que se requiere una uniformidad en los métodos de insensibilización humanitaria que garanticen una muerte rápida, sin sufrimiento y dolor para los animales. Que en ocasiones es necesario aplicar el sacrificio de emergencia a animales que sufren lesiones u afecciones que les causen dolor y sufrimiento incompatibles con su vida y este sacrificio debe realizarse con métodos humanitarios. Que no solamente los animales de abasto se sacrifican en grandes cantidades, sino también todos aquéllos utilizados en pruebas de constatación, peletería y cualquier otro tipo de aprovechamiento, siendo en todos los casos necesario que el personal responsable de su manejo conozca perfectamente las técnicas, sustancias y su efecto, vías de administración y las dosis, así como métodos alternativos para la eutanasia. Que para alcanzar los objetivos señalados en los párrafos anteriores, con fecha 7 de julio de 1995, se publicó en el Diario Oficial de la Federación el Proyecto de Norma Oficial Mexicana NOM-033-ZOO-1995, Sacrificio humanitario de los animales domésticos y silvestres, iniciando con ello el trámite a que se refieren los artículos 45, 46 y 47 de la Ley Federal sobre Metrología y Normalización, por lo que con fecha 22 de mayo de 1996, se publicaron las respuestas a los comentarios recibidos en relación a dicho Proyecto, a través del mismo órgano informativo. Que en virtud del proceso legal señalado en el párrafo anterior, he tenido a bien expedir la Norma Oficial Mexicana NOM-033-ZOO-1995, SACRIFICIO HUMANITARIO DE LOS ANIMALES DOMESTICOS Y SILVESTRES. INDICE 1. OBJETIVO Y CAMPO DE APLICACION 2. REFERENCIAS 3. DEFINICIONES 4. DISPOSICIONES GENERALES 5. TRATO HUMANITARIO EN EL SACRIFICIO DE LOS ANIMALES DE ABASTO 6. TRATO HUMANITARIO PARA EL SACRIFICIO DE LOS ANIMALES DE COMPAÑIA 7. SACRIFICIO DE EMERGENCIA EN TODAS LAS ESPECIES 8. SACRIFICIO HUMANITARIO DE FAUNA SILVESTRE 89/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal 9. SANCIONES 10. CONCORDANCIA CON NORMAS INTERNACIONALES 11. BIBLIOGRAFIA 12. DISPOSICIONES TRANSITORIAS APENDICES NORMATIVOS 1. Objetivo y campo de aplicación 1.1. Esta Norma es de observancia obligatoria en todo el territorio nacional y tiene por objeto, establecer los métodos de insensibilización y sacrificio de los animales, con el propósito de disminuir su sufrimiento, evitando al máximo la tensión y el miedo durante este evento. 1.2. La vigilancia de esta Norma corresponde a la Secretaría de Agricultura, Ganadería y Desarrollo Rural, así como a los gobiernos de los estados en el ámbito de sus respectivas atribuciones y circunscripciones territoriales, de conformidad con los acuerdos de coordinación respectivos. 1.3. La aplicación de las disposiciones previstas en esta Norma compete a la Dirección General de Salud Animal, así como a las Delegaciones de la Secretaría de Agricultura, Ganadería y Desarrollo Rural, en el ámbito de sus respectivas atribuciones y circunscripciones territoriales. 2. Referencias Para la correcta aplicación de esta Norma deben consultarse las siguientes normas oficiales mexicanas: NOM-008-ZOO-1994, Especificaciones zoosanitarias para la construcción y equipamiento de establecimientos para el sacrificio de animales y los dedicados a la industrialización de productos cárnicos, publicada en el Diario Oficial de la Federación el 16 de noviembre de 1994. NOM-009-ZOO-1994, Proceso sanitario de la carne, publicada en el Diario Oficial de la Federación el 16 de noviembre de 1994. 3. Definiciones Para efectos de esta Norma, se entiende por: 3.1. Agresión: En biología, todo cuanto atenta contra el equilibrio o integridad orgánica. 3.2. Anfibio: Clase de vertebrado que puede vivir en medio terrestre o acuático de manera indistinta. 3.3. Animal: Conforme a su utilización o características se clasifican de la siguiente manera: 3.3.1. De abasto: Todo animal que de acuerdo a su función zootécnica produce un bien o sus derivados destinados a la alimentación humana y animal. 3.3.2. Invertebrados: Aquellos animales que carecen de columna vertebral. 3.3.3. De compañía: Aquél que es mantenido por el hombre para su disfrute y que vive bajo sus cuidados. 3.3.4. Venenosos: Aquellos que por contacto, piquete o mordida ocasionan graves transtornos al hombre, inclusive la muerte. 3.4. Aves: Se clasifican en: 3.4.1. De ornato: Aquellas aves que se mantienen cautivas por lo vistoso de su plumaje o lo melodioso de su canto. 3.4.2. De presa: Especie de aves que poseen poderosas garras o picos para poder cazar su alimento. 3.4.3. De corral: Tales como gallinas, patos o guajolotes. 3.5. Cajón de sacrificio: Espacio para un solo animal, donde se insensibiliza a los animales de abasto. 3.6. Corrales: Locales destinados a la recepción, alojamiento y mantenimiento de los animales de abasto dentro de un rastro. Estos se dividen en corrales de recepción, de estancia y de prematanza. 3.7. Decapitación: Separación de la cabeza del cuerpo por medio de un golpe certero. 3.6. Electroinsensibilización: Inducción de la pérdida de la conciencia por métodos eléctricos. 90/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal 3.7. Enfermedad: Ruptura del equilibrio en la interacción entre un animal, agente biológico y medio ambiente, que provoca alteraciones en las manifestaciones vitales del primero. 3.8. Especie: Unidad básica de clasificación taxonómica, formada por un conjunto de individuos que presentan similares características y que son capaces de reproducirse entre sí. 3.9. Eter etílico: Anestésico inhalado, líquido incoloro, altamente volátil y flamable, explosivo al mezclarse con el aire, oxígeno y óxido nitroso; tóxico e irritante al aparato respiratorio. Debe almacenarse a temperaturas de 10 a 15°C. 3.10. Etiología: Parte de la medicina que tiene por objeto el estudio de las causas de las enfermedades. 3.11. Etorfina: Es un derivado alcaloide semisintético del opio, mil o dos mil veces más potente que la morfina. 3.12. Fauna: Designa a las especies animales. 3.13. Fauna doméstica: Todas aquellas especies que se han logrado domesticar y están bajo el cuidado del hombre. 3.14. Fauna silvestre: Son todos aquellos animales no considerados domésticos. 3.15. Género: Unidad de categoría taxonómica superior a la especie. 3.16. Insensibilización: Acción por medio de la cual se induce rápidamente a un animal a un estado de inconciencia. 3.17. Ketamina: Hipnótico general de acción ultracorta derivado de la fenciclidina. 3.18. Lesión: Daño o alteración morbosa, orgánica o funcional de los tejidos. 3.19. Mamífero: Clase de vertebrado que tiene glándulas mamarias para criar a su prole. 3.20. Pentobarbital sódico: Derivado del ácido barbitúrico, pertenece al grupo de los anestésicos de acción corta. Su vía de administración es intravenosa y en sobredosis se utiliza para la eutanasia. 3.21. Pentotal sódico: Barbitúrico de acción ultracorta, su administración es por vía intravenosa. 3.22. Pistolete: Pistola de perno cautivo. 3.23. Rifle neumático: Detonador que funciona con aire comprimido para proyectar un émbolo penetrante o de percusión. 3.24. Reptiles: Clase de los vertebrados poiquilotermos de respiración pulmonar que se desplazan arrastrándose y poseen escamas en el cuerpo. 3.25. Sacrificio: Acto que provoca la muerte de los animales por medio de métodos físicos o químicos. 3.26. Sacrificio de emergencia: Sacrificio necesario que se realiza por métodos humanitarios para cualquier animal que haya sufrido recientemente lesiones traumáticas incompatibles con la vida o sufra una afección que le cause dolor y sufrimiento; o bien, para aquellos animales que al escapar, puedan causar algún daño al hombre u otros animales. 3.27. Sacrificio humanitario: Acto que provoca la muerte sin sufrimiento de los animales por métodos físicos o químicos. 3.28. Sacrificio zoosanitario: Sacrificio humanitario que se realiza en uno o varios animales como medida profiláctica. 3.29. Salud: Estado normal de las funciones orgánicas de los animales. 3.30. Secretaría: Secretaría de Agricultura, Ganadería y Desarrollo Rural. 3.31. Tranquilización: Efecto que se produce con la aplicación de un sedante por vía oral, intramuscular o intravenosa en un animal. 3.32. Trato humanitario: Conjunto de medidas para disminuir la tensión, sufrimiento, traumatismos y dolor a los animales durante su captura, traslado, exhibición, cuarentena, comercialización, aprovechamiento, entrenamiento y sacrificio. 3.33. Xilacina: Es un fármaco analgésico, tranquilizante, no narcótico y relajante muscular, que se administra por vías intramuscular o intravenosa. 4. Disposiciones generales 4.1. Durante el manejo de los animales, los responsables deberán mantenerlos tranquilos, evitando los gritos, ruidos excesivos y golpes que provoquen traumatismos. 91/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal 4.2. Para el arreo, nunca deberá golpearse a los animales con tubos, palos, varas con puntas de acero, látigos, instrumentos punzocortantes u objetos que produzcan traumatismos. 4.3. Los instrumentos, equipo e instalaciones para insensibilizar y sacrificar a los animales serán diseñados, construidos, mantenidos y usados de manera tal que se logre un rápido y efectivo resultado de su uso. Estos deberán ser inspeccionados por lo menos una vez antes de su uso, para asegurar su buen estado. 4.4. Los instrumentos y equipo adecuado para el sacrificio de emergencia, deberán estar siempre disponibles para su uso en cualquier momento. En el caso de no contar con estos instrumentos y equipo adecuado, ya sea en los sitios de producción, durante la movilización o en corrales, podrán utilizarse armas de fuego de suficiente calibre para provocar muerte inmediata, según el animal del que se trate como se indica en el punto 7. 4.5. La instalación, uso y mantenimiento de los instrumentos y equipo para el sacrificio humanitario, deberá realizarse de acuerdo a las recomendaciones del fabricante. 4.6. Ninguna persona intervendrá en el manejo, insensibilización y sacrificio de los animales, a menos que cuente con la capacitación específica. 4.7. Los métodos, sustancias y aparatos de insensibilización y sacrificio mencionados en la presente Norma, así como los métodos, sustancias y aparatos alternativos que en un futuro se recomienden, solamente podrán utilizarse cuando su efectividad esté demostrada con estudios avalados por instituciones científicas reconocidas y además cuando cuenten con una patente registrada y la autorización oficial de la Secretaría. 4.8. Ningún animal se sacrificará por envenenamiento, ahorcamiento, ahogándolo, por golpes o algún otro procedimiento que cause sufrimiento o prolongue su agonía. 4.9. Los requisitos zoosanitarios para instalaciones relacionadas con el manejo de los animales de abasto, se deberán cumplir conforme a lo establecido en la NOM-008-ZOO-1994, Especificaciones zoosanitarias para la construcción y equipamiento de establecimientos para el sacrificio de animales y los dedicados a la industrialización de productos cárnicos, publicada en el Diario Oficial de la Federación el 16 de noviembre de 1994. 4.10. El tiempo de descanso de los animales de abasto en los corrales después del transporte, será de acuerdo a lo establecido en la NOM-009-Z00-1994, Proceso sanitario de la carne, publicada en el Diario Oficial de la Federación el 16 de noviembre de 1994. 4.11. Los propietarios, transportistas, encargados, administradores o empleados de expendios de animales, deben sacrificar inmediatamente en forma humanitaria a los animales que por cualquier causa se hubiesen lesionado gravemente, utilizando los métodos descritos en esta Norma para cada caso, como se indica en el punto 7. 4.12. Se autorizará el aplazamiento del sacrificio: a) Si se sospecha que el animal de abasto sufre o padece una afección que lo hace temporalmente inadecuado para el consumo. b) Si existe la sospecha de que el animal presenta residuos o trazas de sustancias farmacológicamente activas en sus tejidos, que lo hagan inadecuado para el consumo humano. c) En ambos casos se mantendrá a los animales en locales y con los cuidados adecuados durante el tiempo requerido. 4.13. Todos los animales de abasto llevados al cajón de sacrificio deben ser sacrificados humanitariamente sin demora alguna, previa insensibilización. 4.14. No deberá permitirse que las operaciones de insensibilización y sacrificio de los animales se efectúe con más rapidez que aquella con la que pueden aceptarse las canales para las operaciones de faenado. 4.15. El sacrificio humanitario que se realice en animales que no sean destinados para el consumo humano, solamente podrá realizarse con los métodos autorizados en esta Norma, para la especie de que se trate y en razón del sufrimiento que le cause un accidente, enfermedad, incapacidad física o vejez extrema, imposibilidad para su manutención, riesgo zoosanitario o por exceso en el número de los de su especie, cuando signifiquen un peligro comprobado para la salud pública. Las escuelas de educación superior, institutos e instituciones científicas y de investigación nacionales, podrán realizar el sacrificio humanitario de animales de experimentación, exclusivamente con fines didáctico y de investigación para uso dentro del territorio nacional. 5. Trato humanitario en el sacrificio de los animales de abasto 92/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Métodos de insensibilización y sacrificio por especie. 5.1. Bovinos. a) Insensibilización de razas europeas y becerros cebuínos.- Se debe utilizar una pistola de perno cautivo de penetración. El punto de aplicación se calcula trazando dos líneas imaginarias a partir de la base inferior de los cuernos, que se dirijan cada una de la comisura externa del ojo opuesto; donde se cruzan las líneas se hará el disparo, colocando el cañón del pistolete en posición perpendicular al hueso frontal como se indica en el "APENDICE A" (Normativo). b) Insensibilización para ganado cebú adulto.- Se debe utilizar una pistola de perno cautivo de penetración, cuyo punto de aplicación en la línea mediana será 2 a 3 cm abajo y atrás de la cresta nucal. El cañón del pistolete será dirigido hacia la cavidad bucal como se indica en el "APENDICE B" (Normativo). c) La potencia de los cartuchos dependerá del tipo de equipo utilizado y de la recomendación del fabricante. d) Sacrificio humanitario.- Desangrado por corte de yugular. Se deberá realizar dentro de los 30 segundos después de practicada la insensibilización. 5.2. Equinos. a) Insensibilización.- Se debe utilizar una pistola de perno cautivo de penetración que se aplica 2 cm arriba del punto donde se cruzan dos líneas imaginarias, que parten del borde anterior de la base de la oreja y dirigidas cada una de ellas a la comisura posterior del ojo opuesto. El cañón del pistolete será colocado en posición perpendicular al hueso frontal como se indica en el "APENDICE C" (Normativo). La potencia de los cartuchos dependerá del tipo de equipo utilizado y de la recomendación del fabricante. b) Sacrificio humanitario.- Desangrado por corte de yugular. Este se debe realizar dentro de los 30 segundos después de la insensibilización. 5.3. Porcinos. a) Electroinsensibilización.- Se puede realizar en cuatro diferentes posiciones para los 2 electrodos, como se indica en el "Apéndice D" (Normativo), la aplicación de los electrodos no deberá hacerse colgando a los animales, se realizará dentro de un cajón de sacrificio con piso de material aislante para evitar la electrificación del piso. I.- Cada electrodo colocado atrás de la oreja. II.- Cada electrodo colocado debajo de cada oreja. III.- Cada electrodo colocado en el espacio entre ojo y oreja. IV.- Un electrodo entre los ojos y el otro atrás de una oreja. El voltaje aplicado deberá ser de acuerdo con las recomendaciones del fabricante. b) Sacrificio humanitario.- Desangrado por corte de vena cava anterior (vena cava craneal) introduciendo el cuchillo abajo del brazuelo izquierdo. Este se deberá realizar dentro de los 20 segundos después de la insensibilización. Debe asegurarse que el animal se encuentra muerto antes de introducirlo al escaldado. c) Sacrificio.- Desangrado por corte de vena cava anterior. Este se deberá realizar antes de 30 segundos después de la insensibilización. Debe asegurarse que el animal se encuentra muerto antes de ingresar al escaldado. 5.4. Ovinos, caprinos y venados de abasto. a) Insensibilización para ovinos, caprinos y venados.- Se debe utilizar una pistola de perno cautivo de penetración del calibre utilizado para ganado bovino pequeño. El disparo se realiza 4 cm arriba de la línea mediana de la cabeza entre los 2 ojos, colocando el cañón de la pistola perpendicular al hueso frontal, como se indica en el "APENDICE E" (NORMATIVO). La potencia de los cartuchos que se deban elegir dependerá del equipo utilizado y de las recomendaciones del fabricante. b) Electroinsensibilización para ovinos y caprinos.- La colocación de los electrodos será: cada uno de ellos debajo de la oreja respectiva o uno entre los ojos y el otro detrás de una oreja, como se indica en el "APENDICE F" (NORMATIVO) el tiempo de aplicación, el voltaje y amperaje dependerán del tipo de aparato utilizado y de la recomendación del fabricante. 93/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal c) Sacrificio humanitario.- Desangrado por corte de yugulares. Este se deberá realizar dentro de los 30 segundos después de aplicada la insensibilización. 5.5. Aves. a) Insensibilización.- Se deberá realizar por inmersión de la cabeza en baños electrificados o arcos eléctricos. El tiempo de aplicación, el voltaje y amperaje dependerán del tipo de aparato usado y de las recomendaciones del fabricante. b) Sacrificio humanitario.- Desangrado por corte de carótidas, a través de la cavidad bucal inmediatamente después de la insensibilización. Debe asegurarse que las aves se encuentren desangradas y muertas antes de introducirlas al escaldado. c) Decapitación.- Separación de la cabeza del cuerpo, por medio de un objeto cortante, a través de un solo movimiento firme y certero. 5.6. Conejos. a) Insensibilización.- Se deberá realizar por desnucamiento como se indica en el "APENDICE G" (NORMATIVO). b) Sacrificio humanitario.- Desangrado por corte de yugular dentro de los 30 segundos después de la insensibilización. 6. Trato humanitario para el sacrificio de los animales de compañía 6.1. Perros y gatos. a) Electrosensibilización y sacrificio para perros, a excepción de cachorros menores de cuatro meses.- Deberá utilizarse un aparato eléctrico especialmente concebido para el uso en esta especie. Se colocan las dos pinzas no traumatizantes que corresponden a cada uno de los electrodos: uno en la piel previamente humedecida a la altura de la base de la cola al final del lomo y el otro, en la piel previamente humedecida, que cubre la base de la nuca. La insensibilización se produce en el instante en que se hace pasar la descarga eléctrica y la muerte se provoca dejando de 30 a 40 segundos las pinzas conectadas en el animal, como se indica en el "APENDICE H" (NORMATIVO). b) Sacrificio humanitario para perros adultos y cachorros.- Se utilizará una sobredosis de barbitúrico vía intravenosa o cualquier otro anestésico fijo, que produzca primero inconsciencia y después paro respiratorio y cardíaco hasta la muerte del animal, sin causarle angustia, convulsiones o cualquier otro sufrimiento. c) Sacrificio humanitario para cachorros menores de cuatro meses y gatos.- Sobredosis de barbitúricos por vía intracardiaca, previa tranquilización profunda en todos los casos. 6.1.1. El sacrificio humanitario de perros y gatos entregados voluntariamente, recogidos en la vía pública y después de haber cumplido con un periodo de observación en centros de acopio o control canino, será efectuado con métodos autorizados y bajo la supervisión del médico veterinario responsable del centro. 7. Sacrificio de emergencia en todas las especies 7.1. En el caso de que los animales al ser transportados sufran un accidente que les ocasione lesiones graves, deben atenderse a la brevedad posible, dándoles tratamiento médico, si esto no es posible y el sufrimiento del animal es intenso, debe realizarse el sacrificio de emergencia. 7.2. Para el sacrificio de emergencia, se utilizará cualquiera de los métodos que se han descrito en esta Norma en cada uno de los puntos que corresponden a la especie de que se trata o podrán utilizarse los métodos que a continuación se indican y que como requisito produzcan insensibilización inmediata, para que sólo bajo inconsciencia sobrevenga la muerte. 7.2.1. Aves a) El sacrificio zoosanitario o de emergencia en parvadas de aves de postura o engorda, se realizará confinando a los animales en jaulas dentro de cámaras de gas o contenedores herméticos a los que se haga llegar monóxido de carbono proveniente de un motor de combustión interna, procurando el enfriamiento simultáneo de emanaciones que las aves deben respirar el tiempo necesario, hasta que pierdan la conciencia y mueran. b) Sacrificio de emergencia individual de aves.- Dependiendo del tamaño y de la especie se podrá aplicar decapitación, dislocación cervical o disparo de arma de fuego (abajo del ala izquierda). 7.2.2. Bovinos, ovinos y caprinos 94/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal a) Se utilizará el pistolete según indicaciones de incisos correspondientes para cada especie. b) Disparo de arma de fuego en la región frontal o atrás del codillo izquierdo en dirección del corazón. 7.2.3. Equinos. a) Se utilizará el pistolete según indicaciones de incisos correspondientes. b) Disparo de arma de fuego en la región frontal. 7.2.4. Cerdos a) Disparo de arma de fuego en la región frontal o atrás del codillo izquierdo en dirección del corazón. b) Se utilizará el pistolete según indicaciones de incisos correspondientes. 7.2.5. Perros y gatos a) Sobredosis de barbitúricos vía intravenosa o intracardiaca, previa tranquilización profunda. b) Disparo de arma de fuego en la línea media de la cabeza, sobre el hueso frontal. 7.2.6. Conejos y otros roedores. a) Insensibilización y muerte por desnucamiento. 8. Sacrificio humanitario de fauna silvestre Este punto es aplicable a fauna silvestre en cautiverio, específicamente bioterios, zoológicos y granjas cinegéticas. ESPECIE SUSTANCIAS Y/O DOSIS MEDICAMENTOS METODOS Y/O PROCEDIMIENTOS (VER APENDICES) AVES Ej: Canarios, Sobredosis Vía intramuscular pericos, Sobredosis Vía intramuscular palomas Xilacina Dislocación cervical patos, Ketamina o decapitación en garzas, aves pequeñas. búhos, "APENDICE J" águilas, (NORMATIVO), avestruces, etc. Utilización de armas de fuego en aves grandes, disparo. dirigido bajo el ala izquierda, apuntando al corazón CARNIVOROS Ej: Leones, tigres, pumas, Ketamina Sobredosis Vía intramuscular lobos, osos, Xilacina Sobredosis Vía Intramuscular 95/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal leopardos, Barbitúricos Sobredosis coyotes, etc. Vía intravenosa o intracardíaca previa tranquilización. Armas de fuego de calibre según especie. "APENDICE K" (NORMATIVO) Método electroinsensibilización (lobos y coyotes). "APENDICE H" (NORMATIVO) GRANDES Y MEDIANOS HERBIVOROS Ej. Jirafas, rinocerontes, elefantes, Xilacina Sobredosis Vía intramuscular. hipopótamos, Ketamina Sobredosis Vía intramuscular. antílopes, Barbitúricos Sobredosis Vía intravenosa o bisontes, etc. intracardíaca, previa tranquilización. Armas de fuego de alto calibre 380-9mm. "APENDICE L" (NORMATIVO) HERBIVOROS PEQUEÑOS Ej: Cabras, Xilacina Sobredosis Vía intramuscular. borregos y Ketamina Sobredosis Vía intramuscular. venado Barbitúricos Sobredosis Vía intravenosa o intracardíaca, previa tranquilización. 96/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Armas de fuego disparo en zona cardíaca. Electroinsensibilización. "APENDICE F" (NORMATIVO) PRIMATES NO HUMANOS Ej: Monos Barbitúricos Sobredosis Vía intravenosa o grandes y Ketamina Sobredosis intracardíaca, pequeños previa tranquilización. Armas de fuego de calibre .22 o .380 o 9 mm. Según tamaño del animal. En animales pequeños en la cabeza. En animales mayores zona cardíaca. REPTILES Ej: Víboras, Xilacina Sobredosis I.M. e I.C. cocodrilos, Ketamina Sobredosis I.M. e I.C. iguanas, Barbitúricos Sobredosis I.M. e I.C. camaleones y Doble descerebración, lagartijas pistolete émbolo oculto, arma de fuego. Vía intramuscular = I.M. Vía intracardíaca = I.C. INVERTEBRADOS Ej: 97/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Tarántulas, Eter etílico alacranes, Sobredosis En caso de animales de Dosis-efecto experimentación colocar escarabajos, compresas con éter caracoles, etc. dentro de un recipiente hermético, donde se introduce el animal. (Constatar la pérdida de los signos vitales). Golpe certero con objetos romos y pesados 9. Sanciones El incumplimiento a las disposiciones contenidas en la presente Norma, será sancionado conforme a lo establecido en la Ley Federal de Sanidad Animal y la Ley Federal sobre Metrología y Normalización. 10. Concordancia con normas internacionales Esta Norma Oficial Mexicana no es equivalente con ninguna norma internacional. 11. Bibliografía ALUJA ALINE S., NECROPSIAS EN ANIMALES DOMESTICOS. CECSA, 1985. ANIMAL AND PLANT HEALTH INSPECTION SERVICE, USDA, USA 1993. AYALA, F; PADILLA, G; URIBE, E. Y ALUJA, A.: SACRIFICIO HUMANITARIO DE PERROS POR MEDIO DE ENERGIA ELECTRICA. VET. MEX., 25:51-54 (1994). ag FOWLER, M.E.: RESTRAINT AND HANDLING OF WILD AND DOMETIC ANIMALS. AMES, IOWA, IOWA STATE UNIVERSITY PRESS 1978. FOWLER, M.E.: ZOO AND WILD ANIMAL MEDICINE. WB SAUNDERS COMPANY, 1989. INTERNATIONAL AIR TRANSPORT ASOCIATION LIVE ANIMAL REGULATION 1975. REPORT OF THE A.V.M.A. PANEL OF EUTHANASIA, JOURNAL OF THE AMERICAN VETERINARY MEDICAL ASSOCIATION, VOL. 202 No. 2 PP.229-249 JANUARY 15, (1993). 12. Disposiciones transitorias Esta Norma entrará en vigor al día siguiente de su publicación en el Diario Oficial de la Federación. Sufragio Efectivo. No Reelección. México, D.F., a 24 de junio de 1996.- El Director General Jurídico, Roberto Zavala Echavarría.- Rúbrica. 98/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Ver imagen (dar doble click con el ratón) 99/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Ver imagen (dar doble click con el ratón) 100/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Ver imagen (dar doble click con el ratón) 101/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Ver imagen (dar doble click con el ratón) 102/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Ver imagen (dar doble click con el ratón) 103/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Ver imagen (dar doble click con el ratón) 104/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Ver imagen (dar doble click con el ratón) 105/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Ver imagen (dar doble click con el ratón) 106/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Ver imagen (dar doble click con el ratón) Ver imagen (dar doble click con el ratón) Ver imagen (dar doble click con el ratón) 107/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal Ver imagen (dar doble click con el ratón) Ver imagen (dar doble click con el ratón) 108/109 Manual de Prácticas de Laboratorio Facultad de Medicina Veterinaria y Zootecnia Subdirección Académica Área de Docencia de Salud Animal ACTUALIZACIÓN Manual de Prácticas de Patología General. Facultad de Medicina Veterinaria y Zootecnia de la Universidad Autónoma del Estado de México. Toluca, México; 28 de octubre de 2011. Primera Edición FACULTAD DE MEDICINA VETERINARIA Y ZOOTECNIA Director: Dr. en C. José Mauro Victoria Mora Elaboró: Dra. en C. Adriana del Carmen Gutiérrez Castillo Dr. en C. Roberto Montes de Oca Jiménez Revisó: Dr. en C. Valente Velázquez Ordoñez Fecha de aprobación de los HH Consejos Académico y de Gobierno de la FMVZ UAEMEX: 28 de octubre de 2011. 109/109