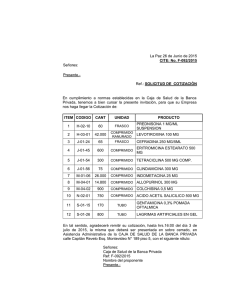
Manual de selección de medicamentos
Anuncio

MANUAL DE SELECCIÓN DE MEDICAMENTOS METODOLOGÍA PARA LA SELECCIÓN DE MEDICAMENTOS DEL FORMULARIO NACIONAL Y ARSENALES FARMACOTERAPÉUTICOS DE LOS ESTABLECIMIENTOS DE SALUD. DPTO. POLÍTICAS FARMACÉUTICAS Y PROFESIONES MÉDICAS DIVISIÓN DE POLÍTICAS PÚBLICAS SALUDABLES Y PROMOCIÓN - SUBSECRETARIA DE SALUD PÚBLICA 2010 MANUAL DE SELECCIÓN DE MEDICAMENTOS: METODOLOGÍA PARA LA SELECCIÓN DE MEDICAMENTOS DE FORMULARIOS Y ARSENALES FARMACOTERAPÉUTICOS DE LOS ESTABLECIMIENTOS DE SALUD MINISTERIO DE SALUD DE CHILE. SUBSECRETARIA DE SALUD PÚBLICA. DIVISIÓN DE POLÍTICAS PÚBLICAS SALUDABLES Y PROMOCIÓN DPTO. POLÍTICAS FARMACÉUTICAS Y PROFESIONES MÉDICAS. REALIZADO POR: GONZALO RAMOS N. – GUILLERMO OLIVARES J. DPTO. POLÍTICAS FARMACÉUTICAS Y PROFESIONES MÉDICAS. SUBSECRETARIA DE SALUD PÚBLICA – MINISTERIO DE SALUD EDITADO POR: QF SOLEDAD DEL CAMPO U. – SUBSECRETARIA DE REDES ASISTENCIALES - MINSAL QF MARCELA PEZZANI V. – HOSPITAL DEL SALVADOR. Este documento corresponde a una adaptación autorizada del “Manual de Selección de Medicamentos Esenciales: Principios para una selección racional de medicamentos” de la Dirección General de Medicamentos, Insumos y Drogas, 2001. Portada: Basada en Fotografía del Departamento de Salud Alicante – España http://www.dep19.san.gva.es PRIMERA EDICIÓN SANTIAGO DE CHILE, Febrero 2010 REDISEÑO PORTADA, SANTIAGO DE CHILE, Mayo 2010 ÍNDICE TEMÁTICO INTRODUCCIÓN LA SELECCIÓN DE MEDICAMENTOS EN EL CONTEXTO GLOBAL ASPECTOS GENERALES DE LA SELECCIÓN DE MEDICAMENTOS. Formulario Nacional de Medicamentos (FN) y los Medicamentos Esenciales. Los Medicamentos esenciales. Criterios técnicos para la formulación o revisión de un Formulario Nacional de Medicamentos Esenciales Comentarios y ejemplos de selección de medicamentos esenciales: Aspectos críticos de la formulación, revisión y aplicación de un Formulario Nacional de Medicamentos o un Arsenal farmacológico de establecimiento de salud: Criterios de valoración para las asociaciones de medicamentos a dosis fija: Criterios para la elaboración de formularios o arsenales farmacológicos por niveles de atención: EL MERCADO FARMACÉUTICO CHILENO. Características del mercado farmacéutico chileno: Algunos datos básicos generales de la industria farmacéutica chilena El mercado chileno en valores. Uso irracional y el mercado. Los productos registrados en Chile. La selección y el mercado. MEDICINA BASADA EN LA EVIDENCIA Y SELECCIÓN DE MEDICAMENTOS Evolución de la investigación y sus resultados Práctica de la medicina basada en evidencias Beneficios del empleo de la medicina basada en la evidencia. Evidencia y selección de medicamentos Necesidad de evidencia en el uso de fármacos BÚSQUEDA DE INFORMACIÓN Proceso de búsqueda de información Fuentes de información terciaria. Fuentes de información secundaria Fuentes de información primaria Internet y la información sobre medicamentos REPORTES DE ESTUDIOS CLÍNICOS Y METANÁLISIS: EVALUACIÓN DE SU CALIDAD Y RELEVANCIA Estudios clínicos 1. Evaluar los requisitos básicos 2. Evaluar la importancia clínica de los resultados del ECCA 3. Evaluar el grado de validez interna 4. Evaluar la magnitud y la precisión del efecto: resumen de medidas 5. Evaluación de la relación beneficio / riesgo: el impacto de la terapia 6. Evaluar su utilidad clínica: efectividad Listas de verificación (“checklist”) y sistemas de puntuación para la lectura crítica de los ensayos clínicos. Metanálisis PRINCIPIOS BÁSICOS DEL ANÁLISIS DEL FACTOR COSTO EN LA SELECCIÓN DE MEDICAMENTOS Análisis de Minimización de Costos (AMC) Análisis Costo – Efectividad (ACE) Análisis Costo – Utilidad (ACU) Análisis Costo – Beneficio (ACB) LOS NUEVOS MEDICAMENTOS Valor terapéutico de los nuevos medicamentos El proceso de desarrollo de nuevos medicamentos: Seguridad de los nuevos medicamentos: GUÍAS TERAPÉUTICAS Selección de medicamentos para las guías REVISIÓN Y ACTUALIZACIÓN DEL FORMULARIO NACIONAL DE MEDICAMENTOS BIBLIOGRAFIA ANEXOS 1. Modelo de solicitud para la inclusión de un medicamento en el Formulario Nacional. 2. Modelo de solicitud para la adquisición de un medicamento no considerado en el formulario nacional. 3. Modelo formato para la evaluación de los reportes de estudios clínicos farmacoterapéuticos. 4. Guía para una lectura crítica de la literatura médica y glosario de términos de interés. 5. Formulario Nacional de Medicamentos. Manual de Selección de Medicamentos INTRODUCCIÓN Los medicamentos son una herramienta fundamental en la terapéutica moderna, los que al utilizarse sobre la base de criterios científico-técnicos permiten la obtención de importantes beneficios sanitarios representados por la prevención, diagnóstico, curación, atenuación y tratamiento de las enfermedades y sus síntomas. Sin embargo, cuando los medicamentos se utilizan de manera inapropiada se convierten en una amenaza para la salud individual y colectiva. Las estadísticas internacionales muestran que “en el mundo más de la mitad de todos los medicamentos se prescriben, dispensan o venden indebidamente, y la mitad de los pacientes no los toman correctamente. Lo anterior revela la necesidad de establecer estrategias de Uso Racional, que permitan obtener un uso adecuado, propicio y eficiente de las alternativas farmacoterapéuticas disponibles, optimizando los resultados sanitarios y manejando eficientemente los recursos que se disponen. Las entidades sanitarias internacionales han definido que hay Uso Racional de Medicamentos: “cuando los pacientes reciben la medicación adecuada a sus necesidades clínicas, en las dosis correspondientes a sus requisitos individuales, durante un período de tiempo adecuado y al menor costo posible para ellos y para la comunidad” (OMS, Nairobi 1985). Estos preceptos han sido recogidos en la Política Nacional de Medicamentos, aprobada mediante la Resol. Ex. MINSAL Nº 512/2004, que establece las políticas relativas al acceso a medicamentos de eficacia, seguridad y calidad garantizada. En la Política Nacional de Medicamentos se han establecido las estrategias gubernamentales en torno a la racionalidad del uso de los medicamentos, que se expresan en una serie de líneas de acción destinadas a verificar procesos de selección, prescripción, dispensación y uso de medicamentos, que se desarrollen de manera técnica, independiente de intereses económicos y en la búsqueda de la mejor terapéutica posible. La irracionalidad en el uso de medicamentos puede estar presente en diferentes tipos de decisiones o conductas erróneas, tales como una incorrecta o inadecuada prescripción de medicamentos, en dosis y períodos subóptimos; una errada dispensación; uso de demasiados medicamentos (polifarmacia); la prescripción de medicamentos injustificadamente caros cuando existen alternativas más económicas e igualmente efectivas; la prescripción y dispensación de productos sin eficacia terapéutica comprobada o con una inaceptable relación riesgo/beneficio; uso inadecuado de antimicrobianos, a menudo en dosis incorrectas, para infecciones no bacterianas; uso excesivo de inyecciones en casos en los que serían más adecuadas las formulaciones orales; la autoprescripción y la automedicación desinformada e irresponsable, a menudo con medicamentos que requieren de receta médica. La irracionalidad en el uso de medicamentos ha alcanzado su máxima expresión en la inapropiada utilización de los antibióticos, cuyo impacto se ha calculado en aproximadamente USD 4000 a USD 5000 millones en los EEUU y € 9000 millones 1 en Europa . El Uso Racional de Medicamentos (URM), cuando se aplica de una forma sistémica al interior de los sistemas de salud, tanto públicos como privados, así como a nivel de la comunidad, logra importantes beneficios tanto para la salud individual como colectiva, ya que permite optimizar los resultados farmacoterapéuticos, sumado a otras estrategias como la contención de la resistencia bacteriana; además permite la disminución de la aparición y gravedad de los efectos adversos, con la subsecuente mejora en la calidad de vida de los pacientes y el ahorro para los sistemas de salud al no tener que tratar o contener estas reacciones; y finalmente, permite una reducción de los gastos asociados a medicamentos ya que permite un uso eficiente de los recursos destinados a medicamentos. 1. “Con los medicamentos no se juega: El uso inapropiado de medicamentos limita sus beneficios, aumenta los riesgos y malgasta recursos”, Acción para la Salud, Latinoamérica y el Caribe, Boletín Correo de Ais, Edición Nro. 92, marzo de 2009. (http://www.aislac.org/index.php?option=com_docman&Itemid=150 ) -1- Manual de Selección de Medicamentos A nivel nacional, la Comisión Asesora Permanente del Formulario Nacional, constituye la entidad técnica ministerial encargada de los procesos de selección de los fármacos que se incluirán en el Formulario Nacional de Medicamentos (FN), que se establece como la lista de los medicamentos indispensables en el país para una correcta terapéutica, debiendo el Ministerio de Salud arbitrar las medidas que sean necesarias para que la población y los servicios que prestan atención se encuentren debidamente abastecidos de los mismos. En este contexto, adquiere vital relevancia el proceso de selección de medicamentos, que permite la actualización del FN, debiendo realizarse los esfuerzos que sean necesarios para lograr la actualización permanente de dicho instrumento con criterios de eficacia, seguridad y buscando el mejor resultado terapéutico al menor costo posible. El documento que se presenta, aborda la Selección de Medicamentos desde la perspectiva del Uso Racional, una actividad realizada en la elaboración del Formulario Nacional de Medicamentos y, en forma local, en la determinación de los Arsenales Farmacoterapéuticos de los establecimientos de salud de la red y que está destinada no solo a resguardar la eficacia y seguridad de los medicamentos que se emplean, si no que también a buscar el mejor resultado terapéutico al costo más bajo, optimizando los recursos. El documento incorpora conceptos, procedimientos y técnicas para una evaluación racional de los medicamentos, enfatizando los principios de la medicina basada en la evidencia, el análisis crítico de los reportes de estudios clínicos y monografías, el desarrollo de la fármaco-economía; todo lo que en su aplicación facilitará la independencia de la evaluación y documentación con herramientas metodológicas, constituyendo a este Manual en una herramienta de utilidad a todos los profesionales de la salud. -2- Manual de Selección de Medicamentos LA SELECCIÓN DE MEDICAMENTOS EN EL CONTEXTO GLOBAL El número de medicamentos disponibles en el mercado farmacéutico se ha incrementado enormemente durante las últimas décadas, incorporando en algunas ocasiones verdaderas innovaciones, aunque también desafíos considerables para controlar la calidad y el uso racional de los mismos. En los países industrializados, como en aquellos en desarrollo, se están realizando esfuerzos significativos para proporcionar asistencia sanitaria, la que no solo incluye las prestaciones de salud, si no que conlleva la entrega, con distintos niveles de cobertura, de los medicamentos requeridos para el correcto tratamiento de las patologías e inclusive la atención farmacéutica asociada al medicamento prescrito. Por su parte, la globalización ha favorecido, por ejemplo, el comercio de productos y servicios, así como el reconocimiento de los grados y títulos académicos, también ha llevado a cambios rápidos en el entorno de la asistencia sanitaria, a nuevos problemas 2 debidos a un incremento de la movilidad y de la migración y a condiciones de mercado globales, en los cuales el mercado farmacéutico ha sufrido algunas variaciones, contribuyendo a la transformación del medicamento en un bien de mercado. A nivel mundial, el acceso a medicamentos con calidad asegurada sigue siendo una preocupación importante. Un tercio de la población mundial no tiene todavía acceso regular a los medicamentos 3 esenciales . Asimismo, para muchos pacientes o sus familiares el precio de los medicamentos es una limitación importante, coartando cualquier acción de salud que pueda ser emprendida al poner en riesgo el acceso a los fármacos. El golpe más duro es para los pacientes que se encuentran en economías de transición y en desarrollo, donde entre un 50-90% de los medicamentos que se 4 compran se los pagan de su bolsillo . La carga incide de forma más pesada en las personas de escasos recursos o en los grupos vulnerables, que no se encuentran adecuadamente protegidos. En dicho contexto, toma relevancia el establecimiento de procesos racionales respecto de la selección, adquisición, prescripción y uso de los medicamentos, priorizando no solo los recursos financieros si no que también la validez de las alternativas terapéuticas, especialmente de aquellas contra las cuales se presentan los fenómenos de resistencia. En reportes de la Organización Mundial de la Salud (OMS) se indica que entre las personas que toman medicamentos, más de la mitad de todas las prescripciones son incorrectas y más de la mitad de las personas implicadas las aplican incorrectamente. En un mismo orden de ideas, está aumentando la preocupación por el incremento en la extensión global de la resistencia antimicrobiana, un importante problema de salud pública, en donde los informes recientes revelan resultados de resistencia de hasta un 90% a los antibióticos de primera línea original, tales como ampicilina y cotrimoxazol (trimetoprima + sulfametoxazol) para la shigellosis; de hasta un 70% de resistencia a la penicilina para la neumonía y la meningitis bacteriana; de hasta un 98% de resistencia a la penicilina para la gonorrea, y de hasta un 70% tanto para penicilinas como para cefalosporinas, en las infecciones hospitalarias del Staphylococcus aureus. En dicho contexto, el planteamiento de la OMS ha sido seleccionar los medicamentos para garantizar su acceso, especialmente para los grupos más vulnerables. Dicha selección es un proceso metódico que conlleva a la mejor alternativa, evaluando no solo los recursos financieros sino que además la situación epidemiológica y las alternativas terapéuticas existentes en el mercado. En dicho proceso, deben converger las opiniones de diversos profesionales de la salud implicados no solo en la prescripción, si no que también aquellos a cargo del abastecimiento y dispensación de los mismos, así como aquellos que prestan o tienen algún tipo de interacción con los pacientes. 2 WHO policy perspectives on medicines. Globalization, TRIPS and access to pharmaceuticals. Geneva: World Health Organization; 2001. Disponible en: http://www.who.int/medicines/ citado en Desarrollo de la práctica de Farmacia centrada en la atención del paciente (WHO/PSM/PAR/2006.5 3 WHO policy perspectives on medicines. Equitable access to essential medicines: a framework for collective action. Geneva: World Health Organization; 2004. Disponible en: http://www.who.int/medicines/ citado en Desarrollo de la práctica de Farmacia centrada en la atención del paciente (WHO/PSM/PAR/2006.5 4 Desarrollo de la práctica de Farmacia centrada en la atención del paciente (WHO/PSM/PAR/2006.5 -3- Manual de Selección de Medicamentos Una evaluación efectuada en Italia, con médicos de familia y psiquiatras, evidenció que nadie utiliza las escalas de depresión para su diagnóstico. Estas escalas se utilizan en los estudios, pero cuando el médico ve al paciente no la emplea. ¿Cómo se hace entonces una transferencia de selectividad tan específica como la de un inhibidor selectivo a una inespecificidad total que permite, sin haberse expuesto al medicamento de elección, decir que se requiere de uno de segunda, cuando no se ha hecho el diagnóstico y ni siquiera la evaluación y para no equivocarse el médico le da enseguida el tratamiento de segunda generación? Entre los problemas de la globalización y la selección encontramos a un grupo de profesionales, que son los médicos, los farmacéuticos y los trabajadores de salud en general, que deberían tener un rol de puente entre la disponibilidad de medicamentos y los conocimientos globales, la universalidad del derecho a la salud y a la vida de la población. A través de la globalización de la información se tiene acceso al conocimiento, sin embargo, ésta tiene diferentes roles debido a que la aplicación de los conocimientos se dan en sectores y países distintos, que tienen características que no son globales. Además, existe el gran riesgo de que la globalización de la información pueda privar de la visión crítica y del juicio a los profesionales, de manera que no actúen como filtros inteligentes a la globalización, para orientar las informaciones disponibles a las necesidades específicas, sino que como vehículos de una globalización acrítica sin importar de que información se trate. Es importante saber que al efectuar el proceso de selección se encuentran medicamentos que no han sido evaluados a través de ensayos clínicos y otros que han sido probados en poblaciones de otros países. La selección de la información se hace cada vez más difícil en un mundo que garantiza el prestigio y la credibilidad de la información a través del número de veces que los artículos son citados en la literatura. Así, las cosas que más se repiten son las cosas que más éxito tienen y lo que sale al mercado de la información son las que más coinciden con los intereses del mercado, y quizás, no siempre coincidan con lo que se llama la pureza y la fiabilidad de la información científica. La selección no debe plantearse como un problema de restricción, sino como un proceso de participación de los profesionales de la salud en una evaluación objetiva y completa de los medicamentos. El proceso de selección se relaciona con el conocimiento epidemiológico, que no sólo sirve para definir en que nivel se encontrará un problema de salud e identificar los criterios de utilización para un determinado medicamento, sino que también debería servir para que los Comités de farmacia y terapéutica (CFT) constaten si efectivamente la población de la cual hablan los ensayos clínicos tiene características comparables con la población del país donde uno se encuentra. En la selección de medicamentos es importante acostumbrarse a definir cuales son los pacientes que necesitan los medicamentos. Un aspecto importante a tener en cuenta es que la selección de medicamentos es un punto de partida para el desarrollo de tareas tan importantes como la de garantizar la efectividad de los formularios o arsenales fármaco-terapéuticos. Sería interesante evaluar cuales podrían ser las implicancias económicas de una selección de medicamentos, es decir efectuar evaluaciones farmacoeconómicas del impacto de los mismos. La literatura sobre farmacoeconomía tiene grandes sesgos por ser una literatura que se relaciona mas con la probabilidad matemática de la economía de países con mercados bien desarrollados, con costos totalmente artificiales, con respecto a los países en vías de desarrollo, lo que hace imposible efectuar una extrapolación de los costos. -4- Manual de Selección de Medicamentos El proceso de selección de medicamentos no es un proceso administrativo, como lo consideran muchas veces los médicos, sino que es un proceso de investigación. A partir de la selección empieza el trabajo de la producción de nueva información. Es importante evitar el exceso de información que muchas veces llega a través de la promoción farmacéutica, que está interesada en presentar a los nuevos medicamentos como algo novedoso y no está interesada en los problemas de salud ni en las poblaciones. La selección de la información debe liberar la inteligencia de los médicos, para poder distinguir lo que es realmente novedoso y lo que es solamente una apariencia de novedad. El garantizar una selección de todos los ensayos y una evaluación de los mismos con el metanálisis, es parte de una disciplina que ahora se denomina Medicina Basada en la Evidencia. El problema es saber cuantos son los críticos que tienen acceso a estos datos y cuantos tienen un acceso crítico a estos datos. También se producen varios metanálisis que no son tan correctos. Por ejemplo, si en los hospitales o establecimientos de salud no hay una estrategia estructurada de control de infecciones de riesgo y no existe una epidemiología de las infecciones en terapia intensiva comparada con las infecciones en pacientes oncológicos o inmunodeprimidos, servirá de poco discutir la utilización de un medicamento como la teicoplanina comparándola con vancomicina. Se trata de pasar del concepto de eficacia (concepto vinculado con la Medicina Basada en la Evidencia) a la efectividad, es decir a la transferibilidad de la eficacia de los ensayos a la generalidad de las poblaciones. Es importante en este sentido, el papel que juegan los Comités de farmacia y terapéutica (CFT) y los ensayos que producen evidencia de eficacia, especialmente aquellos que van a documentar la eficacia en las poblaciones en que uno va a aplicar los medicamentos. Los Comités de Farmacia y Terapéutica (CFT), en cumplimiento de su rol en términos de la selección de medicamentos, deberán desarrollar estrategias para garantizar una colaboración interdisciplinaria de los diferentes especialistas y de los diferentes niveles de atención logrando una autonomía intelectual frente a la presión de consumir medicamentos y salvaguardar un enfoque orientado a los problemas de salud y a los pacientes, que es una característica de la profesión médica y farmacéutica responsable. Así, el verdadero desafío para los equipos técnicos del área de la salud, en tiempos de globalización, es garantizar una autonomía de la inteligencia, la independencia de la evaluación y documentar con herramientas epidemiológicas, cual o cuales son los medicamentos necesarios y adecuados para los pacientes. -5- Manual de Selección de Medicamentos ASPECTOS GENERALES DE LA SELECCIÓN DE MEDICAMENTOS. La creciente oferta farmacéutica mundial y nacional constituye un difícil reto para los sistemas de salud por sus implicancias económicas (presión hacia el incremento del gasto farmacéutico en el 5 sector público, que en nuestro país equivale casi a la mitad del gasto total en salud ) y por representar, junto a las intensas campañas de publicidad, un importante obstáculo en las iniciativas de promoción del uso racional de medicamentos. Existen reportes que revelan que la inmensa mayoría de productos nuevos introducidos en el mercado farmacéutico no constituyen avances terapéuticos significativos, lo que se ha conocido internacionalmente como pseudoinnovación, la que afecta enormemente los presupuestos del área pública de salud y los de las personas especialmente; dificultando el acceso a los beneficios del termino de una patente o de la presencia de mayor competencia en el mercado derivado de la existencia de versiones genéricas, derivado del mismo evento. Se hace necesario, en consecuencia, establecer el concepto de selección de medicamentos, en base a los criterios técnicos ya referidos: eficacia, seguridad y costo, así como necesidad. La selección de medicamentos se efectúa a tres niveles: a) Nacional: a través del proceso de evaluación y selección de los medicamentos que constituyen el Formulario Nacional de Medicamentos, que corresponden a aquellos medicamentos que permiten la atención de los problemas de salud de mayor prevalencia de la población y que son más costo-efectivos entre las alternativas disponibles en el país, incorporando así el elemento de racionalidad en la selección. Dicho Formulario Nacional de Medicamentos se establece como el listado primordial para la acción de los sistemas públicos de salud, representando aquellos medicamentos que deben ser cubiertos en el sistema público de salud, para los beneficiarios del mismo y sirviendo además como base para el estudio de arsenales individuales de fármacos en los distintos niveles de complejidad de los establecimientos de salud del sistema público y además, como referencia ineludible para los petitorios farmacéuticos exigidos para las farmacias comunitarias o comerciales. b) Institucional: Este proceso se refiere a la acción de selección que se realiza de manera individual en los establecimientos de alta o mediana complejidad, o la actividad que se realiza en red para los establecimientos de atención primaria de salud. Tanto para los procesos mencionados en el punto a), como para los señalados en éste, es que se presenta este documento, como guía técnica para los procesos de selección. c) Personal: Se aplica al prescriptor y se relaciona con los problemas presentados por cada paciente. La selección racional de medicamentos a nivel personal forma parte de las buenas prácticas de prescripción y debe enmarcarse en las guías clínicas de atención que se han establecido a nivel ministerial. Frente a la multiplicidad de productos existentes en el mercado farmacéutico, es muy difícil que los prescriptores y otros profesionales de la salud puedan estar permanentemente actualizados y en capacidad de efectuar comparaciones del beneficio, riesgo y costo de cada uno de ellos. Además, en cualquier sistema de salud, la mayoría de los problemas puede ser adecuadamente tratada con un conjunto limitado de fármacos cuidadosamente seleccionados. Por todo lo expuesto, la selección de medicamentos a nivel nacional e institucional llega a tener un impacto considerable sobre la calidad de la atención sanitaria y sobre los costos de los tratamientos. 5 Información desarrollada por el Equipo Técnico del Departamento Políticas Farmacéuticas y Profesiones Médicas de la Subsecretaria de Salud Pública. -6- Manual de Selección de Medicamentos De modo ideal, la selección de medicamentos debiera partir de las necesidades farmacológicas para el manejo de los problemas de salud de la población y guardar concordancia con las normas o pautas clínicas establecidas, o mejor aún, con protocolos de tratamiento de acuerdo a los principios de la medicina basada en la evidencia. Formulario Nacional de Medicamentos (FN) y los Medicamentos Esenciales. Los objetivos de formular y aplicar un formulario, petitorio o listado priorizado de medicamentos son: asegurar la disponibilidad de medicamentos en los servicios asistenciales públicos y el acceso de las personas a estos insumos sanitarios; contribuir al logro de la eficiencia en el gasto farmacéutico; y promover la racionalidad en el uso de los medicamentos (Cuadro N° 1). Así mismo cuando se generan estrategias de este tipo se favorece la difusión y utilización de un grupo reducido de medicamentos, lo que facilita el aprendizaje y prescripción por parte de los profesionales, al reducir el número de medicamentos que deben manejar al interior de los sistemas de salud. La autoridad sanitaria, basada en la potestad legal que se le confiere en el Art. 100º del Código Sanitario, establece al Formulario Nacional de medicamentos (FN) como la lista de los productos indispensables en el país para una correcta terapéutica y se le permite arbitrar las medidas que sean necesarias para que la población y los servicios que prestan atención de salud o alguna relacionada se encuentren debidamente abastecidos de los mismos. Así, el FN contiene una lista acotada de medicamentos, no obstando a la existencia de otros productos seguros y eficaces, pero que no forman parte del arsenal básico requerido por el país y que se establece como una garantía dentro del sistema público de salud, existiendo además la posibilidad de arbitrar medidas sanitarias para su disponibilidad en el sistema privado. En el ámbito de las farmacias comerciales, esta potestad se encuentra radicada en el DS 466/1984 en sus Arts. 92º y 93º y ha permitido la exigencia a estos establecimientos del Formulario Nacional con algunas eximiciones. Los Medicamentos esenciales. Según la Organización Mundial de la Salud (OMS), los medicamentos esenciales son aquellos medicamentos que satisfacen las necesidades de salud de la mayoría de la población; por lo tanto deben realizarse los esfuerzos que sean necesarios para que estén disponibles en cantidades adecuadas y en formas apropiadas de dosificación. El concepto de medicamentos esencial implica un elevado valor sanitario y no debe confundirse con el concepto de medicamento genérico (medicamento identificado por su nombre común o genérico y que suele comercializarse, luego de transcurrir el período de protección de patente del producto original de marca, a precios significativamente menores que éste). Un medicamento esencial puede, en consecuencia, comercializarse como producto genérico o como producto de marca. La OMS publicó en 1977 su primera Lista Modelo de Medicamentos Esenciales, documento que ha sido actualizado regularmente por un comité de expertos internacionales y recomienda a los países miembros la adopción de dicha lista de acuerdo a sus características demográficas y epidemiológicas. El concepto de medicamentos esenciales está basado en las siguientes observaciones y principios: La mayor parte de problemas de salud puede ser atendida con un número limitado de medicamentos. La mayoría de prescriptores utiliza, rutinariamente, menos de 200 medicamentos en su práctica profesional. El proceso de abastecimiento y las acciones para garantizar la calidad de los productos farmacéuticos se puede llevar a cabo más eficiente y económicamente con un conjunto limitado de fármacos. -7- Manual de Selección de Medicamentos Cuadro 1: VENTAJAS DE UN FORMULARIO O PETITORIO. SUMINISTRO DE MEDICAMENTOS Facilita la adquisición, almacenamiento y distribución Facilita la dispensación Reduce los inventarios PRESCRIPCIÓN Facilita la capacitación para los prescriptores Ayuda a una prescripción racional (mayor experiencia con un número limitado de fármacos) Se evitan los productos irracionales Contribuye a un mejor reconocimiento de las reacciones adversas Medicamentosas COSTO Mejores precios (mayor competencia) USO POR EL PACIENTE Facilita la accesibilidad de los pacientes a los medicamentos Permite focalizar los esfuerzos educativos En Chile, en términos legales y operativos, se ha acuñado el concepto de medicamentos indispensables, entendiéndose incorporado en este término el concepto de medicamentos esenciales, pero adicionando además aquellos medicamentos que derivado de situaciones de priorización sanitaria, tales como el criterio de enfermedades no atendidas, programas especiales de salud pública o impacto sanitario, son requeridos al interior de los sistemas de salud. Criterios técnicos para la formulación o revisión de un Formulario Nacional de Medicamentos: Las recomendaciones internacionales respecto de la elaboración de listados de medicamentos o también llamados Petitorios o Formularios, se resumen en los siguientes puntos: - Eficacia y seguridad (basadas en la evidencia). Necesidad (perfil de enfermedades prevalentes; aspectos demográficos, genéticos y ambientales). Costo (comparativo, relación beneficio-costo). Recursos humanos y facilidades existentes en los establecimientos de salud. Limitar el número de principios activos, formas farmacéuticas y concentraciones a lo estrictamente necesario. Restricción de las combinaciones a dosis fija. Conveniencia (ventajas en la administración o dosificación). Experiencia de uso (relativo). Disponibilidad del fármaco en el mercado nacional (relativo). Garantía de la calidad y autorización de registro sanitario. Empleo de nombres genéricos (preferentemente la DCI). Especificación, para los casos pertinentes, de la sal o éster. Restricciones de uso (niveles de atención, otras). -8- Manual de Selección de Medicamentos Comentarios y ejemplos de selección de medicamentos esenciales: a) Numero de principios activos en un grupo fármaco-terapéutico: Ejemplo: Ansiolíticos Si bien es cierto que existen particularidades en el perfil farmacocinético de las benzodiazepinas (vida media de eliminación, metabolitos activos, forma de biotransformación, etc.) y en su farmacodinamia (Ej. Predominancia clínica de uno de los cuatro efectos conocidos: ansiolítico, hipnótico, relajante muscular y anticonvulsivante; Mayor o menor alteración psicomotora), en la práctica general dichas características suelen tener una limitada relevancia clínica. Por ello, se suele recomendar el menor número posible de benzodiazepinas en el grupo de ansiolíticos. Ejemplo: Antihipertensivos Se aconseja escoger los principios activos de acuerdo a su mecanismo de acción y a su utilidad clínica (Ej. Un diurético, un betabloqueador, un inhibidor de enzima convertidora, un antagonista de calcio). A estos se suele añadir un agente para las crisis hipertensivas (ej. Nitroprusiato de sodio inyectable), la metildopa (simpaticolítico central para el manejo de la hipertensión en gestantes) y, eventualmente, un vasodilatador directo (ej. La hidralazina) como antihipertensivo complementario. b) Formas farmacéuticas y concentraciones: Ejemplo: Ampicilina v/s amoxicilina En razón a sus características farmacocinéticas más ventajosas (mejor biodisponibilidad por vía oral, no interferencia con alimentos y mayor excreción urinaria en forma intacta) la amoxicilina es preferida para formulaciones orales (comprimidos o cápsulas). Ejemplo: Amitriptilina Como antidepresivo muy pocas veces se justifica la amitriptilina en forma parenteral lo que determina la inclusión en los arsenales de sólo las formas farmacéuticas orales. En general, debe tratarse de establecer cuidadosamente el número mínimo necesario tanto de las formas farmacéuticas como de concentraciones disponibles para cada uno de los principios activos, de acuerdo a las necesidades de la mayoría de la población por atender. c) Requisitos especiales y restricciones de uso: Ejemplos: - Antimicrobianos de reserva (ej. Vancomicina, cefalosporinas de 3ra generación, etc): debieran ser usados previa evaluación por el especialista en infecciones. - Preparaciones tópicas oculares con corticosteroides (Ej. Prednisolona): se aconseja una evaluación oftalmológica previo al empleo de estos fármacos. Aspectos críticos de la formulación, revisión y aplicación de un Formulario Nacional de Medicamentos o un Arsenal farmacológico de establecimiento de salud: Lograr, dentro de cada grupo farmacoterapéutico, el número razonable de principios activos, formas farmacéuticas y concentraciones. Evaluar, en base a la evidencia disponible, el beneficio en función del costo de los nuevos medicamentos para su incorporación o no en el formulario o arsenal. Establecer y conseguir el cumplimiento de las restricciones de uso de ciertos medicamentos (ej. Antimicrobianos de reserva). Teniendo en cuenta que un formulario o arsenal no pretende cubrir el 100% de las necesidades de medicamentos, se debe establecer estrategias y procedimientos técnicos para atender las necesidades, debidamente justificadas, de medicamentos no considerados en la lista. -9- Manual de Selección de Medicamentos Criterios de valoración para las asociaciones de medicamentos a dosis fija: Los productos combinados debieran estar respaldados por trabajos científicos, en los que se demuestre la compatibilidad farmacéutica y farmacocinética de sus principios activos así como estudios clínicos que evalúen las ventajas de las asociaciones frente a las de cada uno de sus componentes. Con el propósito de establecer el valor de las asociaciones de fármacos a dosis fija se han propuesto las siguientes categorías: Asociación farmacológica racional: Cuando cumple los criterios que se señalan en la normativa vigente y que se indican a continuación (Art. 27º, DS 1876/1995) a) cada componente activo deberá contribuir al efecto terapéutico global del producto; b) la dosis de cada componente, así como la frecuencia de administración y duración del tratamiento, deberá conferir seguridad y eficacia a la combinación, sin que exista peligro de potenciar reacciones adversas; c) deberá haber compatibilidad entre sus ingredientes, incluyendo los excipientes que se utilicen en el conjunto, desde el punto de vista químico, farmacológico, farmacocinético y biofarmacéutico, in vitro e in vivo, según corresponda, y d) los efectos secundarios o colaterales o tóxicos deberán ser de igual o menor intensidad que los que puedan presentar normalmente cada uno de los componentes activos aislados. En general, la asociación debe mejorar el balance beneficio/riesgo/costo de la administración por separado de sus componentes. Ej. Sulfametoxazol + Trimetoprima Amoxicilina + Ácido clavulánico Asociación farmacológica de valor dudoso: Cuando frente a supuestos terapéuticos aceptables no se tiene demostración, mediante estudios apropiados, de las compatibilidades farmacéutica y farmacocinética, ni de las ventajas terapéuticas frente al empleo de sus componentes individuales. Asociación farmacológica irracional: Cuando se cuestiona el valor terapéutico del producto por las siguientes razones: - Estar indicadas para síntomas y signos que no representan entidades clínicas bien definidas. - Los componentes no suelen ser usados en combinación en la práctica clínica habitual. - Los principios activos se hallan en proporciones que no permiten ajustar la dosificación a la mayor parte de pacientes. - Pueden presentar incompatibilidades farmacéuticas o farmacocinéticas. - La asociación no ofrece ventajas claras en términos de eficacia o de seguridad, frente al empleo individual de sus componentes. Criterios para la elaboración de formularios o arsenales farmacológicos por niveles de atención: El Formulario Nacional de Medicamentos debe constituir el marco de referencia para la preparación de los arsenales farmacológicos de cada establecimiento de salud de la red de acuerdo a ciertas necesidades y criterios específicos de cada localidad y especialidad. - 10 - Manual de Selección de Medicamentos Así, se podrá adaptar o ajustar el FN para su aplicación a un determinado ámbito geográfico, debiéndose considerar, entre otros criterios, los perfiles de morbi-mortalidad de la región o para atender necesidades de medicamentos en situaciones de desastre, debiendo considerar un número limitado de fármacos, según la población afectada y los principales riesgos de daños a la salud. De igual modo, se recomienda preparar arsenales farmacológicos dependiendo del nivel de atención o grado de complejidad del establecimiento. Para la elaboración de estos arsenales específicos se debe tener en cuenta que más que las definiciones de los diferentes tipos de establecimientos, interesa aplicar criterios técnicos más específicos, como los que se presentan a continuación: Protocolos o Guías terapéuticas: si bien los protocolos terapéuticos debieran constituir la base para el manejo de los problemas médicos más importantes y frecuentes, ello resulta particularmente crítico cuando se evalúa la necesidad de inclusión de algunos medicamentos de alto riesgo (de toxicidad o de abuso) en el arsenal de establecimientos de salud cuyo personal tiene limitaciones en cuanto a capacitación y/o acceso a información actualizada. Disponibilidad de un servicio especializado: el manejo de procesos neoplásicos con agentes citotóxicos, por ejemplo, debiera efectuarse en hospitales que cuenten con las facilidades correspondientes (personal idóneo, laboratorio, banco de sangre). De igual modo, si un centro de salud cuenta con una sala de partos así como con personal profesional, podrían considerarse, en el arsenal para ese establecimiento, los fármacos necesarios para este tipo de atenciones. Facilidades para la realización de pruebas de laboratorio: por ejemplo: el empleo de los antimicrobianos de reserva debiera estar respaldado por estudios microbiológicos; el uso de los anticoagulantes requiere de un monitoreo del perfil de coagulación. Recursos humanos: con qué trabajadores de salud cuenta el establecimiento y si su permanencia en él es constante o periódica. Se requiere conocer si se dispone de algún profesional de la salud, especialmente prescriptores y dispensadores. Asimismo, es importante conocer qué tipo de especialistas trabajan en el establecimiento, puesto que puede ser riesgoso el empleo de algunos fármacos por los médicos generales (ej. antineoplásicos, anestésicos generales, ciertos agentes cardiovasculares, etc.). - 11 - Manual de Selección de Medicamentos EL MERCADO FARMACÉUTICO CHILENO. El acceso de la población a medicamentos esenciales es uno de los mayores desafíos de la salud pública y, considerando a la salud como un derecho fundamental (ONU-1948), los Estados tienen la responsabilidad de garantizarlo. Desde 1952, Chile inició un camino en este sentido, con la aprobación de la Ley N° 10.383 que reformó la seguridad social, extendiendo los beneficios sociales y económicos de los obreros a toda la familia del trabajador y estableciendo además la coordinación nacional de los consejos de beneficencia, sanidad y seguro obrero en una sola organización, fortaleciendo además la infraestructura médica y sanitaria. Actualmente la reforma sanitaria y el sistema AUGE/GES son la máxima expresión del esfuerzo gubernamental por garantizar el acceso a la salud y a los medicamentos. Actualmente, los países enfrentan múltiples desafíos para ampliar el acceso a los medicamentos. Entre los cuales se identifican: seleccionar productos de calidad y con la mejor relación costoefectividad; establecer de forma adecuada los financiamientos; adecuar los costos; reglamentar la propiedad intelectual, normalizar las gestiones de suministros y propiciar el uso racional. En el caso de Chile, además debe incluirse la forma de abordar una oferta de medicamentos en un mercado dirigido por entidades privadas. La oferta de medicamentos depende de varios factores: la situación sanitaria del país (perfiles epidemiológicos), la condición socieconómica y los patrones culturales de la población, el nivel de desarrollo del sector empresarial farmacéutico, las barreras arancelarias y para-arancelarias; y el sistema de registro sanitario; siendo este último, uno de los principales instrumentos de regulación del mercado farmacéutico. El registro sanitario de los medicamentos, otorgado por el Instituto de Salud Pública de Chile, permite su distribución para las indicaciones terapéuticas y condiciones de uso autorizadas, incorporando además autorizaciones respecto de la importación, licencias y distribución, entre otras. El mercado Una de las principales características del sector farmacéutico es la presencia de grandes corporaciones multinacionales, líderes en innovación y desarrollo de nuevos fármacos, derivada de los altos costos fijos de inversión destinados a investigación y desarrollo (I&D), así como de las exigencias regulatorias para su colocación en el mercado. Se estima en la actualidad, que el desarrollo de un nuevo fármaco desde su fase pre-clínica hasta su puesta en comercialización, implica una inversión cercana a los USD $ 1.000 millones. De ahí entonces, la conformación de grandes corporaciones farmacéuticas que compiten en innovación y calidad entre ellas, a través de productos diferenciados, liderando distintos segmentos terapéuticos del mercado. En términos de venta, la presencia de grandes conglomerados se manifiesta en el nivel de concentración que tienen dichas corporaciones en los diferentes mercados donde participan comercialmente de manera directa (ver más adelante “El mercado chileno en valores”). A nivel mundial, el mercado latinoamericano presenta un crecimiento dinámico y sostenido, con tasas muy superiores al promedio mundial, lo que lo hacen atractivo como una zona de expansión para los conglomerados farmacéuticos. El año 2006 se observó entre los mercados con las tasas más elevadas de crecimiento, en relación con el año previo, a Brasil con una facturación de USD $ 8.366 M y un incremento de 23,8%, Canadá (USD $ 13.719 M) con un alza del 14,4% y Argentina (USD $ 2.285 M) con un crecimiento de 12,2%. - 12 - Manual de Selección de Medicamentos Características del mercado farmacéutico chileno: Algunos datos básicos generales de la industria farmacéutica chilena. Alrededor del 1% de aporte al Producto Interno Bruto (PBI) industrial (2003). 70 laboratorios o Droguerías en actividad actualmente. La generación de nuevos empleos de la industria farmacéutica en Chile, es baja, presentando además un alto grado de rotación. La oferta de la Industria Farmacéutica Chilena está conformada principalmente por laboratorios nacionales, que se dedican a la producción de productos libres de patente, dejando la I&D a las grandes corporaciones internacionales. La industria farmacéutica mueve más de USD $ 600 millones. Si bien los Laboratorios Nacionales han alcanzado estándares de calidad y eficiencia en la región, permitiéndoles incursionar en mercados externos, las exportaciones de la industria posee aún una baja participación, concentrándose en más de un 80% en seis laboratorios nacionales. Al año 2003, las exportaciones de productos farmacéuticos representaron 1,8% de las exportaciones totales de la industria manufacturera (según ASEXMA). Los destinos más representativos son: Ecuador, Perú y Bolivia, acumulando alrededor del 34%. Más del 90% de las materias primas (principios activos) son de origen importado, principalmente de América del Norte y Europa. Además los laboratorios transnacionales importan la totalidad de sus productos, resultando en una balanza comercial negativa para el rubro. Las importaciones totales de productos farmacológicos sumaron al año 2003, USD $ 276 millones. El mercado chileno en valores. Valores y unidades totales. El consumo de medicamentos ha presentado altos y bajos durante la última década, pero con una clara tendencia al alza. El mercado farmacéutico entre los años 1995 y 1999 creció en valores desde USD $ 386 a 567 millones y en unidades desde 126 a 168 millones. Entre 1999 y 2002 se verificó una caída leve de USD $ 567 a 501 millones, manteniéndose una cifra cercana a las 168 millones de unidades. En el período 2002-2008 las cifras han incrementado ostensiblemente, llegando a un total de USD M $1.059 y 223 millones de unidades durante el año 2008. Valores por categorías de productos. Los estudios del mercado de los medicamentos, habitualmente se presentan en tres grupos: Genéricos: Corresponden a aquellos productos que se comercializan con denominación genérica Genéricos de Marca o Similares: Corresponden a aquellos productos que se comercializan con denominación o nombre de fantasía, y que no corresponden a productos innovadores. Marca: Aquellos productos que son comercializados por quienes han desarrollado la investigación clínica, que los respalda en su uso o por quienes los representan. El análisis por unidades de los grupos de productos durante el año 2008, revela que los genéricos representaron un 36% del mercado, los similares o genéricos de marca un 44.6 % y los de medicamentos de marca tan solo un 19.4%. Sin embargo, el análisis de los resultados en valores, revela que estos últimos representan el 40.98%, los similares un 53.06% y los genéricos tan sólo el 5.96% del mercado. (Cuadro 1) - 13 - Manual de Selección de Medicamentos Cuadro N° 1: Estructura de tipo de Productos según Unidades de Venta y Valores (%) 2008. Productos Unidades (%) Valores (%) Marca 19.44 40.98 Genérico de Marca 44.59 53.06 Genérico 35.97 5.96 La evolución de estos segmentos durante el período 2002-2008 se presenta en la Gráfica N°1 e indica una clara orientación al consumo de medicamentos de similares o genéricos de marca, tanto en unidades vendidas como en valores. Gráfica N° 1: Evolución del Mercado de Medicamentos en unidades Gráfica N° 2: Evolución del Mercado de Medicamentos en porcentajes Regulatoriamente, los productos similares (o genéricos de marca) son aprobados sanitariamente mediante su registro ante el Instituto de Salud Pública y son entendidos como aquellos que se eximen de la presentación de antecedentes clínicos que respalden su seguridad y eficacia, basándose en la existencia de otro producto ya registrado ante dicha entidad, que contenga el mismo principio, dosis y forma farmacéutica; siendo este un formato similar al de registro de un producto que se comercializa con su denominación genérica. En este sentido, no existiendo diferencia en los antecedentes de sustento de registro sanitario de los productos similares respecto de los medicamentos genéricos, la tendencia al alza de su consumo y participación en el mercado, mostradas en las graficas, solo se explica por la actividad de promoción y publicidad que impulsan sus fabricantes o distribuidores, estableciendo una diferenciación respecto de los medicamentos genéricos, no basada en evidencia científica. Gasto en medicamentos Con la implementación de la reforma en salud, los costos asociados a medicamentos por parte del Estado se han incrementado ostensiblemente, derivado de las garantías de cobertura y oportunidad de acceso de los productos contenidos en las canastas seleccionadas en el Plan AUGE/GES, además del aumento del valor promedio individual de los medicamentos. Entre los años 2004 y el 2007, periodo en que se inició la reforma de salud, el gasto público en medicamentos creció en un 37 %(de 93.5 a 128), mientras el sector privado lo hizo tan solo en un 17%. - 14 - Manual de Selección de Medicamentos Cuadro N°2: Estimaciones del gasto en medicamentos total, público y privado (Chile, 1993-2002) (cifras miles de millones de pesos corrientes) Grafica N° 3: Evolución del gasto en medicamentos total, público y privado (1993-2007) (cifras miles de millones de pesos corrientes, Fuente IMS Health) Año Total Publico Privado 1993 1994 1995 1996 1997 1998 1999 2000 2001 2002 2003 2004 2005 2006 2007 146.8 167 185.7 213.5 257.6 291.8 317.9 339.1 370.3 395.5 469.6 503.4 523.1 560.5 608.1 25.5 25.7 26.5 30.5 30.1 32.6 37.3 40.7 45.2 50.3 83.8 93.5 91.7 114.3 128 121.3 141.2 159.1 182.9 227.5 259.2 280.6 298.3 325.1 345 385.8 409.9 431.4 446.2 480.1 Precios de los medicamentos Durante el período 2002-2008 los precios de los medicamentos se han incrementado de manera importante. El valor de los productos de marca ha incrementado nominalmente en un 68%, conjuntamente con un incremento de 46% de los productos de similares y un 32% de los genéricos. Lo anterior, calculado en valores absolutos, ha generado un incremento del valor en todos los segmentos, pero especialmente impactante en el presupuesto familiar, especialmente en aquellos segmentos que consumen productos de marca o similares. Cuadro N° 3: Evolución del Precio Promedio de Medicamentos (Dólares) Segmento 6 Año 2002 2008 Precios 5.96 10 3.86 5.65 0.59 0.78 Marca Genérico de Marca Genérico Respecto a la evolución de precios al consumidor se observa un comportamiento diferenciado entre el IPC general y el IPC del precio de los medicamentos, siendo este último superior al primero. Además muestra una evolución incremental mayor a la relativa al índice general y a aquel evaluado para el sector salud, lo que demuestra una evolución de precios al alza en lo que respecta al segmento de medicamentos. 6 IMS Health - 15 - Manual de Selección de Medicamentos Grafica N° 4: Evolución del Precio Promedio unitario de Medicamentos (Fuente IMS Health) Grafica N°5: Evolución del IPC de medicamentos (INE) Precios actuales. Los valores de comercialización de los productos durante el último año han incrementado ostensiblemente alcanzando un 13.6 % de incremento en las ventas, con un incremento en unidades de tan solo un 0.3 %, lo que denota el aumento del valor medio de los medicamentos. Así mismo el valor individual promedio ha aumentado en cerca de un 20 % desde el año 2004 al 2008 (de 2063 a 2437). Grafica Nº 6: Mercado Farmacéutico a Diciembre de 2008 (Fuente IMS Health) Grafica Nº 7: Evolución del precio nominal de los medicamentos (2004-2008) (Fuente IMS Health) - 16 - Manual de Selección de Medicamentos Consumo de Medicamentos y Gasto per cápita anual El consumo anual se ha mantenido (en unidades), sin embargo el costo asociado a medicamentos ha incrementado en aproximadamente el doble. Gasto de bolsillo Este es un concepto moderno y representa el gasto que realizan directamente las personas en medicamentos, con prescindencia de las razones que lo llevan a esa elección, formando parte de la libre elección del consumidor. Este valor ha sido vigilado por FONASA mediante la encuesta CASEN 2006, determinando un incremento porcentual del orden del 6% entre los años 2000 y 2006 (de un 13 a un 19 %). Así mismo, al analizar el gasto destinado a salud, se verifica que en todos los quintiles, el gasto en medicamentos corresponde a un 40 a 50 % del gasto dedicado a salud de los presupuestos familiares. GASTO EN MEDICAMENTOS, INSUMOS Y HOMEOPATÍAS COMO % DEL GASTO EN SALUD POR QUINTIL GASTO DE CONSUMO DE HOGARES EN SALUD (NETO DE REEMBOLSOS) 12,2% 68,1% 10,9% 58,3% 9,1% 51,6% 7,4% 47,4% 42,8% 4,2% I II III IV V I II III IV V PESO DEL GASTO EN MEDICAMENTOS EN EL GASTO EN SALUD 14,0% 12,0% Fuente: Estudio Nacional sobre Satisfacción y Gasto en Salud, MINSAL (2007). 10,0% 5,7% 8,0% 4,0% 2,0% 7,0% 4,4% 6,0% 3,1% 1,3% 2,9% 4,3% 4,7% II III 5,2% 5,2% IV V 0,0% I Medicamentos - 17 - Otro Gasto en Salud Manual de Selección de Medicamentos Caracterización de los Canales de distribución. El mercado de la distribución al público de medicamentos esta concentrado en tres grandes empresas que aglomeran un 81.8% de venta en unidades de medicamentos correspondiente al 91.3 % del total de la ventas en valores. El mercado esta constituido por 1149 farmacias pertenecientes a las tres grandes cadenas y aproximadamente unas 600 farmacias independientes (Fuente IMS Health, 2008). Para su estudio, se ha segmentado el mercado en productos éticos, entendidos como aquellos que requieren receta médica para su dispensación y populares, como aquellos en que su condición de venta es directa. Así, el mercado durante el año 2008 se dividió en un 76.6 % de las ventas de productos éticos y un 23.4 % para los productos correspondiente al segmento de populares, lo cual representa un grupo reducido de medicamentos pero cuya venta representa gran parte de las ganancias de los establecimientos farmacéuticos. Dentro de los productos más vendidos, al clasificarlos por clases terapéuticas, se verifica que los analgésicos ocupan el primer lugar en ventas, seguidos de anticonceptivos, antirreumáticos y antidepresivos, los que se muestran en la tabla a continuación (Ver cuadro). Los productos más vendidos corresponden a analgésicos comercializados con nombre de fantasía y anticonceptivos, que se encuentran detallados en las siguientes tablas, los cuales presentan una gran diferencia con los valores de sus similares en versiones genéricas, distorsionando el valor por el hecho de la publicidad y promoción. De hecho en la recopilación de datos los primeros 23 productos rankeados por venta corresponden a productos de marca o genéricos de marca. - 18 - Manual de Selección de Medicamentos Empresas- Productores. Las empresas que participan del mercado de medicamentos, como productores o importadores también han visto un proceso de concentración en el cual 15 grandes corporaciones acumulan un 64.9 % del mercado en valores y en cuanto a unidades aglomeran un 78.5 del total (ver cuadro). Este mercado así concentrado, da cuenta que la competencia dista de ser perfecta ya que en la industria se presentan situaciones de oligopolio con diferenciación de productos (cuando existen moléculas alternativas para una misma patología y en cada opción hay más de un producto comercial, marcas y genéricos, con distintos niveles de precios) y también tendencias monopólicas (cuando la molécula tiene pocas o ninguna alternativa y no existen productos similares en el mercado). Uso irracional y el mercado. El Uso Racional de los Medicamentos (URM) requiere que el paciente reciba apropiada medicación a su necesidad clínica, en las dosis correspondientes con sus requerimientos individuales, por un 7 periodo adecuado de tiempo, y al menor costo para él y su comunidad . Por estos motivos, el acceso a los medicamentos sin uso racional, en lugar de mejorar la situación podría complicarla aún más, generando problemas que irían a repercutir directamente en los índices sanitarios de la población en cuestión. Una primera dimensión, radica en la prescripción. En la mayor parte de América Latina solo están habilitados a prescribir médicos y odontólogos, sin embargo la automedicación, se ha convertido en un proceso “habitual” en las poblaciones de los países de nuestra región. En nuestro país, se considera que existe un 50% de automedicación. Una segunda dimensión para definir el URM está en la aprobación y selección de los productos. Si son autorizados para ser comercializados medicamentos en presentaciones inadecuadas al tratamiento, se genera un vacío regulatorio que redunda en perjuicio de la adecuada utilización. En la medida que se avanza en la protocolización de los tratamientos se hace cada vez más posible y necesario incorporar normativas que reglamenten los envases de los medicamentos (en dosis y presentación). 7 Conferencia de Expertos en Uso Racional de Medicamentos convocada por la Organización Mundial de la Salud en Nairobi, 1985. - 19 - Manual de Selección de Medicamentos Los productos registrados en Chile. Actualmente existen cerca de 15.700 registros sanitarios vigentes, de los cuales solo una fracción se comercializa en el mercado local, no existiendo la obligación de las empresas de disponer en el mercado productos esenciales o prioritarios para la salud, caso en el cual el Ministerio de Salud ha debido asumir su abastecimiento, en virtud de las disposiciones que al efecto se establecen en el Código Sanitario. En un análisis de los productos registrados (2008) se verificó la existencia de 9.764 registros sanitarios correspondientes a productos monodrogas, los cuales estaban constituidos por 1024 principios activos. Al evaluar la distribución de los principios activos respecto de su registros, solo 79 principios activos (7.7%) se registraron con su DCI careciendo de nombre de fantasía y un total de 467 principios activos se registraron sin denominación genérica (45.6%). En forma paralela se constató que los principios activos más registrados son Diclofenaco (173); Paracetamol (157); Ibuprofeno (119), Amoxicilina (103); y Ciprofloxacino (89). La presencia de los productos de combinación a dosis fijas, es verificada mediante la existencia de un 22,2% de registros sanitarios constituidos por 2 o más principios activos. Al igual que lo visto en las estadísticas de mercado, los registros sanitarios también se concentran bajo la titularidad de grandes corporaciones, donde 3 empresas aglomeran el 17.8 % de los registros existentes al 2008, teniendo cada uno de ellos sobre los 1000 registros sanitarios. Un 18.6 % de los registros restantes se concentran en 6 empresas farmacéuticas cada una teniendo entre 500 a 1000 registros sanitarios a su nombre (Ver tabla). Cuadro Nº 4: Distribución del Número de Registros Farmacéuticos según titulares. Nº Registros Nº Titulares % Registros >1000 3 17,8 >500 y <1000 6 18,6 >100 y <500 39 51,6 >50 y <100 17 6,2 >10 y <50 39 4,9 <10 41 0,9 Total 145 100 La selección y el mercado. Como se ha mostrado en la evaluación de las cifras, los precios de los medicamentos se encuentran en permanente alza y existe un sector del mercado que no es atendido de manera convencional por los industriales, no existiendo productos en versiones genéricas, lo que en general reporta un mayor valor de los productos disponibles. El mercado público de medicamentos, conformado por la intermediación de CENABAST y las compras directas de los Servicios de Salud o de los establecimientos de salud, es de mayor complejidad en su estudio, dado la escasa organización de los registros. Pero, estimándolo como una proyección similar al mercado de las farmacias comunitarias, se prevén también incrementos de precios y baja disponibilidad de genéricos, lo que hace necesaria la implementación de procesos administrativos que delimiten las adquisiciones optimizando los recursos e impidiendo el despilfarro. En dicho contexto, la selección de medicamentos se convierte en un proceso obligatorio destinado a lograr los mayores beneficios terapéuticos al costo más apropiado, para lo cual se ha estipulado el presente Manual. - 20 - Manual de Selección de Medicamentos MEDICINA BASADA EN LA EVIDENCIA Y SELECCIÓN DE MEDICAMENTOS La Medicina Basada en Evidencia, en palabras de sus precursores “es la utilización concienzuda, juiciosa y explicita del mejor conocimiento disponible, para la toma de decisiones sobre la atención de los pacientes”, quitándose el énfasis a la intuición, la experiencia clínica no recogida en forma sistemática y el razonamiento fisiopatológico, como soportes de nuestra decisiones clínicas y mas bien apoyándolas en el mejor conocimiento logrado por algún análisis metodológicamente solidó. Así llamamos “evidencia” al conocimiento, que es resultado de la investigación científica. La medicina basada en evidencias es una aproximación a la práctica clínica en la que el profesional sanitario toma conciencia de la validez científica y de la relevancia clínica de la evidencia, constituyendo la base para tomar una decisión, llevándolo así a mejorar su práctica clínica sustancialmente. La medicina basada en evidencias, para muchos, es la integración de la experiencia clínica individual con la mejor información y metodología proveniente de la investigación científica, una vez realizada la revisión crítica y exhaustiva de ésta. Por experiencia clínica individual se entiende el juicio clínico que los médicos adquieren con la práctica y que se manifiesta sobre todo en la capacidad del clínico para hacer un diagnóstico más válido y eficiente y para identificar mejor las preferencias y deseos de los pacientes. Evolución de la investigación y sus resultados A mediados del siglo XX se desarrolla una nueva metodología para evaluar la eficacia y seguridad de los diversos medicamentos, la que es constituida por los Ensayos Clínicos. La metodología de este tipo de investigación clínica ha evolucionado tanto, que muchos investigadores que los realizan son altamente especializados, lo que ha traído como consecuencia que muchas veces el artículo sea difícil de entender en toda su extensión y apreciar en todas sus dimensiones. Entonces es necesario reconocer que, a partir de información que contiene la publicación original correspondiente a un ensayo clínico, puede ser difícil de traducirla en una regla clínica sencilla, ya que si solo tomamos algunos aspectos de los resultados de los ensayos clínicos podemos equivocarnos. En términos del acceso y manejo de la información, hace algunas décadas las fuentes de conocimiento residían en las bibliotecas y la búsqueda bibliográfica era realmente dificultosa. La información lograda en las investigaciones estaba en las revistas científicas, de difícil acceso y tardaba muchos años para que pudiese ser incorporada a los libros de texto o simplemente no llegaba a ellos. Actualmente la situación es diferente, ya que hay mayor acceso a las principales revistas médicas y podemos acceder a los artículos directamente. En forma adicional Internet ha ampliado aún más el acceso, pero aparecen nuevas dificultades. La mayor dificultad respecto de la información es su exceso, el que se expresa en reportes de experiencias con casos, editoriales, opiniones de expertos, ensayos clínicos, metanálisis, guías de manejo clínico, etc., siendo lo más dificultoso cuando muchas de ellas muestran resultados contrapuestos; presentando además disímiles niveles en su calidad. En este sentido, la dificultad es decidir cual es la evidencia y el grado de confianza que nos merece. Las estrategias de marketing de las diversas compañías farmacéuticas complican aun más el lograr tener un conocimiento completo, ya que sólo nos muestran un aspecto de los estudios. - 21 - Manual de Selección de Medicamentos Práctica de la medicina basada en evidencias Para llevar a la práctica la medicina basada en la evidencia se han establecido cuatro etapas: 1. Formular una pregunta clínica clara a partir de los problemas de un paciente; 2. Consultar la literatura para hallar los artículos clínicos más relevantes; 3. Evaluar críticamente la evidencia identificada acerca de su validez y utilidad; y 4. Aplicar los hallazgos apropiados en la práctica clínica La construcción de la evidencia comienza con la búsqueda y obtención de todos los estudios existentes sobre un tema concreto a partir de la literatura médica y de otras fuentes de información, extrayendo la información relevante para la atención del paciente. Una vez que las publicaciones están disponibles, es necesario su análisis para la extracción y la síntesis de la información clave de cada artículo individual, evaluando la calidad y aplicabilidad de sus hallazgos. La presentación de los resultados de este proceso en un formato estándar, utilizando resúmenes informativos estructurados, con información estadística homogénea (intervalos de confianza, número de pacientes necesarios a tratar (NNT), etc.) o recomendaciones claras, entre otros apartados, ayudan a hacer mucho más eficiente la consulta a la evidencia obtenida. Finalmente, la integración y divulgación de la evidencia requiere disponer de una interfase, que pueda traducir los resultados logrados en la investigación original en una acción clara que ayude efectivamente en la atención del paciente. Como es obvio, esta estrategia no va a establecer directamente cuáles son las decisiones clínicas que hay que adoptar, pero sí puede aportar una base útil a partir de la cual se puede decidir mejor, considerando todos los aspectos clínicos relevantes. La formulación de estrategias de intervención es un proceso complejo que consiste en decir qué intervenciones deben implantarse en una situación clínica concreta para asegurar la incorporación de la mejor evidencia a la práctica. Lógicamente este proceso debe tener en consideración, además de la mejor evidencia actualizada, las circunstancias del problema, incluidas la situación clínica del paciente y las peculiaridades de la organización asistencial de cada ámbito, así como los valores sociales y preferencias del paciente en cuestión. Es cierto que la evidencia científica no es más que un componente de este proceso, pero también es verdad que el peso de ésta será cada vez mayor en la toma de decisiones a medida que el conocimiento médico aumente. Una vez disponible y validada la evidencia, se puede utilizar no sólo en la atención a un paciente, sino también para desarrollar protocolos clínicos, guías de práctica médica o protocolos de auditoria. Asimismo, cualquier reforma del sistema sanitario y de educación médica que se propugne deberá incluir, necesariamente, nuevos mecanismos que fortalezcan y fundamenten el proceso de toma de decisiones clínicas. En muchos de los países occidentales, cada vez son más las voces que proponen el desarrollo de programas educativos específicamente dirigidos a cubrir las insuficiencias detectadas en la aplicación del método científico en la medicina y a reorientar las políticas científicas en materia sanitaria para hacerlas más congruentes con las necesidades de los pacientes y de los servicios de salud. Beneficios del empleo de la medicina basada en la evidencia. La práctica de la medicina basada en evidencia trae como ventajas para los médicos: actualizar sus conocimientos de forma rutinaria; mejorar su comprensión acerca de los métodos científicos y ser más críticos cuando utilicen datos; incrementar su confianza en las decisiones relacionadas con la gestión; aumentar su capacidad para utilizar las fuentes de información bibliográficas y sus hábitos de lectura; y reforzar la cohesión de los equipos clínicos al establecer un marco objetivo de funcionamiento. - 22 - Manual de Selección de Medicamentos Para los pacientes, la medicina basada en la evidencia les entrega un beneficio directo, al disminuir la variabilidad de las prácticas y así acceder a las prestaciones más eficaces. Además, les ofrece una oportunidad de comunicación adicional y operativa con sus médicos, al objetivar los pros y contras de cada opción terapéutica y canalizar así su participación real en la toma de decisiones que les afectan. Una parte importante para el ejercicio de la medicina basada en evidencia es entonces la apreciación crítica de la literatura médica; pudiendo calificar su pertinencia, calidad y fuerza para su uso como evidencia. Evidencia y selección de medicamentos Diversas son las razones que nos fuerzan a tener un formulario o arsenal farmacoterapéutico, que contenga medicamentos eficaces y seguros, que nos permitan resolver la necesidad de la mayoría de los pacientes. Diversos son los criterios que deben tenerse en cuenta para hacer la selección de medicamentosa incluir en un Formulario Nacional, entre ellos van a figurar: la eficacia, seguridad y eficiencia, entre otros. Para evaluar cada uno de estos criterios, se pueden consultar los textos de medicina, pero como se ha señalado, éstos pueden no incluir a nuevos medicamentos o el conocimiento sobre los mismos demora años antes de ser incluido en textos. Otra estrategia es consultar a un grupo de expertos, pero aquí se debe cuidar que las preferencias personales pueden afectar la independencia del proceso de evaluación. Otra forma sería hacer uso de la corriente llamada de medicina basada en evidencia, en esta propuesta el punto de selección estará soportado justamente por la “evidencia” o sea los estudios de investigación válidos. Es algo improbable que un médico pueda conocer todos los medicamentos disponibles en el mercado, además existe una excesiva oferta de los mismos con procesos de publicidad y promoción cada más agresivos y omnipresentes. Por lo tanto para lograr un uso apropiado de medicamentos la solución es que cada prescriptor conozca muy bien un grupo acotado de medicamentos que va a usar, que resuelva las enfermedades de mayor prevalencia y con ello atender un alto porcentaje de los problemas médicos que se le presentan. La selección de medicamentos para construir un formulario o arsenal, según corresponda, debe ser en base a evidencias que provengan de los estudios de investigación. La fuerza que tiene un estudio para demostrar la eficacia de un medicamento depende de su diseño, debiéndose dar alguna gradación a esa fuerza ya que no todos tendrán una misma fortaleza. El grupo de Mc Master promueve una escala y a partir de ésta se pueden derivar recomendaciones para diferentes fuerza (ver más adelante), lo que permite una mejor graduación de los resultados a partir de los estudios. Por otro lado los estudios nos permitirán saber si existe alguna investigación en la que se ha comparado un fármaco contra un placebo y de tal forma poder afirmar que ese fármaco es mejor que el placebo. Ante la aparición de un nuevo medicamento destinado a tratar una enfermedad que ya tiene algún fármaco de eficacia comprobada previamente, el primero deberá compararse con el antiguo, pudiendo mostrar que es mejor mediante un ensayo clínico impecable. Necesidad de evidencia en el uso de fármacos Una dificultad importante en los estudios clínicos es que la demostración de la superioridad del nuevo fármaco puede ser engañosa; por ejemplo si en vez de tener en cuenta un resultado final se toma en cuenta un intermedio y a partir de eso afirmar que es superior, puede pasar a nuestra vista como una demostración de superioridad y no serlo. Por ejemplo, el estudio 4S ha demostrado que la simvastatina disminuye la tasa de reinfartos en individuos hipercolesterolémicos; supongamos entonces que un fabricante produce otra estatina y nos muestra un estudio donde su producto disminuye las cifras de colesterol más que simvastatina, basados en ese estudio este fabricante afirma que su producto es mejor que simvastatina. - 23 - Manual de Selección de Medicamentos En el caso citado previamente, podemos concordar que el estudio del fabricante ha demostrado que su producto disminuye el colesterol más que simvastatina, pero no se puede afirmar que su producto va a disminuir la tasa de reinfartos, ya que su estudio no permite demostrar eso. Así, nada nos garantiza que la disminución del nivel de colesterol va de la mano con una disminución de las tasas de reinfarto. Puede apoyar su afirmación en diversas explicaciones fisiopatológicas y de mecanismos de acción muy sofisticados, sin embargo eso no constituye evidencia para afirmar que la otra estatina es mejor que simvastatina. Las deducciones lógicas y generalizaciones no constituyen evidencia. Otra dificultad con la que podemos encontrarnos es la siguiente, se trata de comparar la seguridad de dos productos, uno es antiguo con muchos estudios que soportan su seguridad y otro nuevo. Los fabricantes del producto nuevo refieren que es seguro ya que tienen diversos estudios en animales que muestran que no produce daño y además que sus estudios incluyen a cientos de pacientes que no muestran que haya efectos indeseables serios. Como comentario a esta información podemos preguntarnos ¿Qué sucede si su producto tiene un efecto muy serio, que solo aparece en humanos 1/10.000?. En este caso, los estudios en animales no los va ha detectar, ni tampoco con ensayos clínicos de cientos de individuos; solo se detectará con estudios que enrolen a miles de pacientes, solo en estas circunstancias se puede afirmar respecto a la seguridad. Los estudios en animales no constituyen evidencia, ni tampoco nos garantiza seguridad que no se presente un efecto indeseable en un grupo limitado de pacientes Otro soporte para incluir un fármaco puede ser la experiencia personal, pero es claro que constituye una fuerte fuente de sesgos. De tal manera que la experiencia personal no sistematizada no constituye evidencia. - 24 - Manual de Selección de Medicamentos BÚSQUEDA DE INFORMACIÓN En el ámbito de la salud, como en muchos otros campos, el contar con información confiable permite adoptar decisiones acertadas. Si bien, el sector privado genera cierta información de utilidad para el quehacer sanitario, ésta muchas veces responde más a un interés comercial que a los objetivos de la salud pública. Por lo anterior, debe ser una función fundamental de los organismos gubernamentales y regulatorios de salud, el promover y apoyar iniciativas para la recopilación, el análisis y la difusión de información sanitaria relevante, actualizada y de calidad. La implementación de centros o servicios de información en salud y, en específico, de medicamentos, constituye una inversión justificada pues el costo de adoptar decisiones desacertadas por falta de una adecuada información puede ser muy elevado. Por otro lado, debe tenerse en cuenta que hasta los mejores sistemas pueden resultar ineficaces o ineficientes si los profesionales de la salud no tienen los incentivos ni las oportunidades para usar la información disponible. Hay que tener en cuenta que no sólo la bibliografía sobre medicamentos constituye un vasto campo, sino también que la técnica y la tecnología de la búsqueda de información cambian constantemente, por lo que es necesario familiarizarse con las nuevas metodologías y formas de buscar información y, principalmente, saber como usarlas. Proceso de búsqueda de información Para aprovechar de manera óptima la bibliografía existente, la persona que requiere encontrar información debe emplear un sistema adecuado de búsqueda. Una búsqueda arbitraria y no planeada puede dar lugar a trabajo innecesario e inútil. Se debe tener claridad en lo que se busca, las presunciones básicas sobre la materia en estudio deben ser correctas, tanto en las definiciones como en otros datos pertinentes a la búsqueda. El saber para qué se va a utilizar la información ayuda a determinar las referencias que se requieren y aseguran un uso efectivo de las fuentes de información. Antes de recurrir a las referencias bibliográficas, es necesario que se prepare alguna forma registro. El uso de un sistema uniforme obliga a anotar todos los datos necesarios cuando encuentra por primera vez una referencia, eliminándose de esta manera pérdida de tiempo posteriores revisiones de una determinada fuente. La figura 1 muestra los datos básicos que deben considerar de una determinada fuente bibliográfica. Figura 1 Título…………………………………………………………………………………..……… Autor(es) Editor(es) …………………………………………………………………..…..... Editorial………………………. Ciudad…………………………. Año…………..………… Título de la revista o publicación periódica……………………………………..………... Volumen………………..Número……………… Pág.…………… Fecha……..………… Resumen o extracto: - 25 - de se en se Manual de Selección de Medicamentos En las Ciencias de la Salud el volumen de conocimientos crece con rapidez y ello es también cierto en lo que respecta a las publicaciones disponibles sobre medicamentos. La disponibilidad de recursos informativos de la literatura médica original y de trabajos de referencia es muy grande; sin embargo, no toda la información disponible es equilibrada y de igual valor. Existe información al día e información desactualizada, debiéndose tener en cuenta también, que el perfil de la información puede variar con el tiempo, en virtud de los nuevos datos que se produce a través de la investigación en salud. Con el fin de utilizar efectivamente la literatura médica, es importante conocer como está organizada. Algunos autores dividen los recursos de información en fuentes primarias, secundarias y terciarias. Fuentes de información terciaria.- Se usan generalmente como referencias rápidas, porque están fácilmente disponibles, su uso es sencillo y contienen información concisa. Todos nosotros estamos familiarizados con el uso de estas fuentes de información, sin embargo es muy probable que un solo texto no contenga toda la información necesaria, por esta razón hay que consultar más de un libro. Algunos de estos libros, actualmente se pueden encontrar en formato electrónico. Como ejemplo de este tipo de fuente de información tenemos: The Martindale, The Extra Phamacopea: Provee información concisa y objetiva sobre sustancias utilizadas en medicina y farmacia; contiene más de monografías que describen compuestos individuales o grupos relacionados de compuestos. Partes esenciales de la información que brinda es: fórmula del compuesto, sinónimos, efectos adversos y tratamiento, precauciones, absorción y eliminación, uso y administración, disponibilidad de medicamentos de marca y referencias seleccionadas. The United Status Pharnacopeia / The National Formulary. La Farmacopea de los Estados Unidos de Norteamérica brinda información sobre normas básicas, pruebas, valoraciones y otras especificaciones aplicadas a medicamentos, formas farmacéuticas y suplementos nutricionales. Se presenta actualmente en formato impreso y en versión electrónica (disco compacto). United Status Pharnacopeia – Drug Information For The Health Professional (USP – DI). Es una publicación complementaria a la Farmacopea de los Estados Unidos de Norteamérica, que brinda información para una adecuada prescripción y dispensación de los medicamentos que se comercializan en dicho país. Formularios internacionales y nacionales sobre medicamentos: British National Formulary (UK), Guía Farmacoterapéutica o Formulario Nacional de Medicamentos Esenciales (Perú) o Formulario Nacional de Medicamentos (Chile). Meyler`s Side Effects of Drug: Sirve para obtener información sobre las reacciones adversas de los medicamentos, es un libro con volúmenes anuales complementarios. Representa el principal medio para editores y autores de importantes compendios, para la identificación y cuantificación de los riesgos clínicos. La búsqueda de información se puede realizar ingresando por el medicamento o por la reacción adversa. Los medicamentos se presentan en grupos farmacológicos o bajo su campo principal de aplicación. En este grupo se consideran también a los libros de medicina interna, farmacología o farmacología clínica y de algunas especialidades médicas como pediatría, oncología ginecología y otros. Fuentes de información secundaria.- Es claramente imposible evaluar el contenido de cada una de las revistas médicas, por lo que se hace necesario utilizar índices y revistas resúmenes que orientan hacia los artículos fuente. Estos índices brindan información sobre el autor, tema, nombre de la revista y pueden incluir o no un resumen, pero tienen la desventaja de que existe un retardo entre la aparición del artículo y su inclusión en el índice, este tiempo puede ser de unas pocas semanas para algunos índices y de meses para otros. - 26 - Manual de Selección de Medicamentos Un ejemplo de este tipo de fuente de información es el Index Medicus, colección bibliográfica producida por la US National Library of Medicine cuyo proyecto se inició en los años 50 con el fin de consolidar la mayor cantidad de bibliografía médica. Con el avance de las telecomunicaciones es posible acceder a más de 300 bases y bancos de datos alrededor del mundo vía INTERNET y con el uso de soporte magnético el usuario final accede directamente a información sistematizada. Estos sistemas usan interfaces muy amigables y de fácil empleo. En relación a bibliografía en base de datos, la más famosa y ampliamente usada es el MEDLINE, base de datos biomédica producida por la National Library of Medicines EUA que permite la búsqueda de literatura sobre medicina clínica y pre-clínica. El MEDLINE es el resultado de la combinación del Index Medicus, Index Dental Literatura, Internacional Nursing Index y algunas fuentes menores. Tiene una actualización semanal y los artículos publicados en las revistas más importantes son incluidos al mes de su publicación; en el caso de otras revistas, toma entre 2 a 6 meses. Entre otras bases de datos se encuentran “Embase, The Excerpta Médica”, índice especializado en efectos farmacológicos de los medicamentos y sustancias químicas y “Toxline” publicado por la US National Library of Medicine que cubre información sobre efectos toxicológicos de los medicamentos, pesticidas y otras sustancias químicas. La literatura de América Latina es presentada en disco compacto por el Centro de Información en Ciencias de la Salud de América Latina y El Caribe – BIREME, incluye entre otras, las siguientes bases de datos: Ciencias de la Salud en General: Contiene a: LILACS, IBECS, MEDLINE, La Biblioteca Cochrane, SciELO o LILACS es un índice bibliográfico de la literatura en ciencias de la salud, publicada en los países de América Latina y el Caribe, desde 1982. Se trata de un producto cooperativo de la Red BVS. En 2009, LILACS contenía 500.000 registros bibliográficos de artículos publicados en cerca de 1.500 revistas sobre ciencias de la salud, de los cuales aproximadamente 800 están actualmente indexadas. LILACS también indexa otros tipos de literatura científica y técnica, tales como tesis, monografías, libros y capítulos de libros, documentos de conferencias y actas de congresos, informes, publicaciones gubernamentales y de organizaciones internacionales regionales. LILACS se puede acceder para búsqueda bibliográfica en el Portal Global de la BVS y los registros también están indexados en Google. o IBECS - Índice Bibliográfico Español en Ciencias de la Salud - contiene referencias de artículos de revistas científico sanitarias editadas en España e incluye contenidos de las diferentes ramas de las ciencias de la salud tales como Medicina (incluyendo Salud Pública, Epidemiología y Administración Sanitaria), Farmacia, Veterinaria, Psicología, Odontología y Enfermería. o La Biblioteca Cochrane consistente en una colección de fuentes de información actualizada sobre medicina basada en evidencia, incluyendo la Base de Datos Cochrane de Revisiones Sistemáticas - que son revisiones preparadas por los Grupos de la Colaboración Cochrane. El acceso a la Biblioteca Cochrane a través de BVS está disponible a los países de América Latina y el Caribe, exclusivamente. - 27 - Manual de Selección de Medicamentos o SciELO - Scientific Electronic Library Online es un proyecto consolidado de publicación electrónica de revistas científicas siguiendo el modelo de Open Access, qué proporciona de modo gratuito, en Internet, los textos completos de los artículos de más de 290 revistas científicas de Brasil, Chile, Cuba, España, Venezuela y otros países de América Latina. Además de la publicación electrónica de los artículos, SciELO provee enlaces de salida y llegada por medio de nombres de autores y de referencias bibliográficas. También publica informes e indicadores de uso e impacto de las revistas. Portal de Evidencias: Revisiones Sistemáticas, Ensayos Clínicos, Sumarios de la Evidencia, Evaluaciones Económicas en Salud, Evaluaciones de Tecnologías en Salud, Directrices para la Práctica Clínica o o o o o o Revisiones Sistemáticas: Revisiones Cochrane (CDSR), Revisiones avaliadas (DARE), LILACS Ensayos Clínicos: CENTRAL, LILACS, Estudios sobre las Dolencias de Espalda Sumarios de la Evidencia: Actualización en la práctica ambulatorial, Bandolier, Gestión clínica y sanitaria Evaluaciones Económicas en Salud: NHS-EED, LILACS Evaluaciones de Tecnologías en Salud: HTA-INAHTA, Agencias Iberoamericanas Directrices para la Práctica Clínica: National Guideline Clearinghouse (US). Áreas Especializadas: ADOLEC, BBO, BDENF, HOMEOINDEX, LEYES, MEDCARIB, REPIDISCA o o o o CidSaúde, DESASTRES, HISA, ADOLEC es una base de datos que contiene citas bibliográficas de la literatura internacional del área de salud de adolescentes y jóvenes. Contiene artículos de las revistas más conceptuadas del área de salud, y otros documentos tales como: tesis, libros, capítulos de libros, anales de congresos, relatos técnico-científicos y publicaciones gubernamentales. Las citas bibliográficas de ADOLEC son extraídas de las bases de datos MEDLINE y LILACS. BBO - Bibliografía Brasileña de Odontología, es una base de datos de la literatura brasileña en odontología publicada a partir de 1966. Su operación, manutención y actualización es coordinada por el Servicio de Documentación Odontológica (SDO) de la Facultad de Odontología de la USP, en colaboración con el Sistema de Información Especializado en Odontología (SIEO). Contiene libros, tesis, publicaciones periódicas, así como artículos de autores brasileños publicados en periódicos extranjeros y no especializados. Los periódicos indizados en la BBO son analizados por un Comité de Selección, según los criterios de selección definidos. Actualmente la base indiza artículos de 60 títulos de revistas BDENF - Base de Datos de Enfermería: Fuente de información compuesta por citas bibliográficas de la literatura técnico-científica brasileña en Enfermería. Su operación, manutención y actualización es coordinada por la Escuela de Enfermería de la Universidade Federal de Minas Gerais (UFMG) y Centros Cooperantes de la Red BVS Enfermería. Contiene artículos de las revistas más conceptuadas del área de salud y otros documentos tales como: tesis, libros, capítulos de libros, anales de congresos, relatos técnico-científicos y publicaciones gubernamentales. BIOÉTICA - Base de datos del Centro de Documentación de la Unidad de Bioética de la OPS/OMS. Contiene registros bibliográficos de la literatura latinoamericana relacionada con temas de bioética, ética médica y de salud pública. Incluye literatura de otros países del mundo, seleccionados de acuerdo con criterios definidos. - 28 - Manual de Selección de Medicamentos o o o o o o o CidSaúde es una base de datos de literatura acerca de la implantación y desarrollo del Proyecto Cidades Saudáveis em Municipios Brasileiros, así como textos teóricos y publicados en otros países, preferentemente en las Américas. Incluye documentos identificados con el tema de la salud urbana, promoción de la salud, la planificación y la acción intersectorial a nivel local / municipal. Es desarrollado por el Centro de Estudos, Pesquisa e Documentação em Cidades e Municípios Saudáveis - CEPEDOC Cidades Saudáveis, organización sin fines de lucro con sede en la Faculdade de Saúde Pública de la Univerdidade de São Paulo - USP en colaboración con la Biblioteca/CIR de FSP/USP DESASTRES es una base de datos producida por el Centro de Documentación de Desastres, del Programa de Preparativos para Situaciones de Emergencia y Coordinación de Socorro para Casos de Desastres de la Organización Panamericana de la Salud (OPS). Contiene referencias bibliográficas resultantes de análisis de publicaciones de la OPS u otras agencias de las Naciones Unidas, libros o capítulos de libros, literatura no convencional, como informes técnicos, presentaciones de congresos, tesis, planos de emergencia y artículos científicos extraídos de revistas especializadas. HISA – Historia de la Salud, es una base de datos bibliográfica desarrollada por la Biblioteca de la Casa Oswaldo Cruz (COC). HISA abarca temas relacionados con la historia de la medicina y de la salud pública, incluyendo eventos y procesos históricos: narrativas, recuerdos, reconstituciones, comparaciones. La dimensión geográfica de las colecciones es internacional, con énfasis en América Latina y el Caribe HOMEOINDEX es una base de datos de la literatura técnico-científica nacional e internacional en área de Medicina Homeopática. La operación, mantenimiento y actualización son coordinadas por la Biblioteca de la Asociación Paulista de Homeopatía (APH). Indexa artículos publicados en las principales revistas homeopáticas de todo el mundo. LEYES es una base de datos acerca de Legislación Básica del Sector de Salud en la América Latina y Caribe, coordinada por la Unidad de Desarrollo de Políticas y Sistemas de Salud (HSS/HP/OPAS) y por BIREME. Contiene referencias bibliográficas de la legislación en salud vigente en más de treinta países de América Latina y del Caribe, pudiendo también contener el texto completo o el enlace para él. MEDCARIB es una base de datos bibliográfica que reúne la literatura en Ciencias de la Salud generada principalmente en los países del Caribe de lengua inglesa. Producida por la Red Caribeña y coordinada por el Centro Coodenador da Rede MedCarib The Medical Library, University of the West Indies, Mona, Kingston – Jamaica, indexa documentos tales como libros, capítulos de libros, tesis, informes técnicos, anales de congresos y artículos de revistas. Contiene referencias de documentos desde el siglo 18 hasta el momento. REPIDISCA es una base de datos que contiene referencias bibliográficas de la literatura de Ingeniería Sanitaria y Ciencias del Ambiente, coordinada por CEPIS Centro Panamericano de Ingeniería Sanitaria y Ciencias del Ambiente. A partir de 1994 incorporó los registros de la base de datos ECO, sobre Ecología Humana y Salud. Abarca la literatura publicada en los países de América Latina y el Caribe. Organismos Internacionales: PAHO, WHOLIS o La OPS (PAHO) es una base de datos que contiene referencias bibliográficas y resúmenes del acervo de la Biblioteca de la sede de Organización Panamericana de la Salud (OPS). Abarca la documentación sobre temas en salud indexada por la Biblioteca de la OPS en Washington. La base OPS es una fuente de referencia sobre el trabajo de la Organización e incluye temas de salud de América Latina y el Caribe. - 29 - Manual de Selección de Medicamentos o WHOLIS es una base de datos bibliográfica que contiene publicaciones de la Organización Mundial de la Salud (OMS) y de las Representaciones Regionales. Indexa artículos de periódicos, documentos técnicos y políticos y publicaciones de OMS en colaboración con otros editores y organizaciones internacionales . LIS: Localizador de Información en Salud DeCS: Terminología en salud Acceso a documentos: SCAD- Servicio Cooperativo de Acceso a Documentos, Catálogo de revistas científicas o o SCAD - Servicio Cooperativo de Acceso a Documentos, provee el acceso a documentos del área de ciencias de la salud. Catálogo de revistas científicas Portal que dispone información sobre la descripción bibliográfica de los títulos de revistas científicas del área de salud, disponibilidad y forma de acceso a la formato electrónico y las colecciones de las bibliotecas que cooperan con el Catálogo Colectivo SeCS – Seriados en Ciencias de la Salud. Son más de 13 mil registros de revistas nacionales e internacionales indexadas en los principales índices bibliográficos del área de la salud. En relación a los bancos de datos, desde 1974 Micromedex (Sistema de información Computarizada para Medicina e Industria) ha publicado información sobre intoxicaciones, medicamentos y medicina ocupacional. La información es presentada en soporte magnético con una interfase simple y muy amigable, la información que presenta es revisada por un comité editorial de más de 350 expertos de 20 países y tiene una actualización trimestral. Actualmente se puede acceder a esta información vía INTERNET. Micromedex incluye entre otros: Drugdex, que ofrece información de monografías de medicamentos en texto completo, incluyendo las principales referencias y evaluaciones clínicas de la literatura médica y farmacéutica a nivel mundial. Martindale, The Extra Phamacopoeia. Drug Reax, provee información sobre interacciones medicamento–medicamento, medicamento–alimento, medicamento-enfermedad y medicamento-prueba de laboratorio. Drug Consult, que brinda información sobre consultas de casos. Poisindex, brinda información sobre protocolos de tratamiento e información de más de 750,000 sustancias farmacéuticas, biológicas y comerciales. Reprorisk, que provee información sobre riesgos en la reproducción. Una iniciativa de carácter internacional para promover y producir revisiones sistemáticas y periódicas de todos los ensayos clínicos relevantes, es la sumida por La Colaboración Cochrane como una contribución a la aplicación de la medicina basada en evidencias. Es su tarea preparar, mantener y diseminar revisiones sistemáticas y actualizadas de ensayos clínicos controlados sobre atención sanitaria, considerando cuando los ensayos clínicos no están disponibles, la revisión de las evidencias más fiables derivadas de otras fuentes. La información es editada como THE COCHRANE LIBRARY, en disco compacto con actualización trimestral e incluye aproximadamente 180,000 ensayos clínicos sobre todas las áreas de la terapéutica. Actualmente, vía INTERNET (http://cochrane.org/reviews/, también se puede acceder en http://www3.interscience.wiley.com/cgibin/mrwhome/106568753/HOME?CRETRY=1&SRETRY=0), se puede llegar gratuitamente a los archivos completos de la Colaboración Cochrane. - 30 - Manual de Selección de Medicamentos Fuentes de información primaria.- Las revistas se consideran como el principal vehículo de comunicación de la información científica, teniendo la ventaja de contener las publicaciones originales de los estudios científicos y de entregar la información más reciente, pero sus principales desventajas son su tamaño y la calidad variable de su contenido. Es imprescindible evaluar críticamente su contenido debido a que la evaluación de las publicaciones sobre investigación clínica ha demostrado que la frecuencia de estudios con diseños experimentales deficientes o con errores estadísticos ha crecido a través de los años. Se debe considerar también que el hecho de publicar, no importa qué ensayo, así como el sesgo intrínseco de la literatura que publica solamente ensayos positivos y no los negativos, aunado a la dificultad de tener acceso a todas las revistas disponibles debido principalmente al costo de las mismas, hace necesario que la selección de artículos se realice de manera cuidadosa. Así, algunos aspectos a considerar al momento de seleccionar las revistas incluyen, entre otros, el prestigio de la publicación, tipo de información que proporcionan, los especialistas que participan en ella y so es posible, los promotores de los estudios. Se presentan a continuación, algunas revistas y boletines de reconocido prestigio internacional, especializadas, algunas de ellas, en medicamentos: - The Medical Letter - Drug and Therapeutics Bulletin - The New England Journal of Medicine - Lancet - Annals of Internal Medicine - British Medical Journal - American Journal of Hospital Phamacy - Clinical Phamocology and Therapeutics - European Journal of Clinical Pharmacology - British Journal of Clinical Pharmacology - Trends in Pharmacological Sciences - Adverse Drug Reactions Bulletin Actualmente, se puede tener acceso a revistas vía INTERNET, sobre todo a los artículos recientemente publicados. El sistema IDIS (Iowa Drug Information Service, disponible en http://www.uiowa.edu/~idis/ ) es un sistema de información presentado en formato electrónico y editado por el Servicio de Información de Medicamentos de la Universidad de Iowa de los Estados Unidos, el que proporciona artículos completos sobre medicamentos y terapéutica procedentes de aproximadamente 200 revistas médicas desde el año 1966 a la fecha. Internet y la información sobre medicamentos La 51° Asamblea Mundial de la Salud, realizada en mayo de 1998 recomendó a la Dirección General de la Organización Mundial de la Salud (OMS), el desarrollo de una guía sobre productos médicos y el INTERNET, que debe servir de modelo a los países miembros, para la elaboración de una guía local para usuarios del INTERNET orientada a apoyar el acceso a información confiable e independiente. La Guía preparada por la OMS fue publicada en 1999, actualizada en el año 2001 y publicada en el Boletín de Medicamentos Esenciales Nº 30/2001 de la Organización Mundial de la Salud (http://apps.who.int/medicinedocs/en/d/Jh2976s/7.1.html), recomendando tener en cuenta lo siguiente: • Internet es una valiosa fuente de información, siempre que la fuente sea conocida y de confianza: Si se utiliza correctamente, Internet permite el acceso rápido y fácil a la información sanitaria. Proporciona valiosa información sobre temas tales como las enfermedades, los tratamientos, los productos médicos y las organizaciones relacionadas con la salud. - 31 - Manual de Selección de Medicamentos • La información obtenida de Internet puede ser útil al consultar a un médico o a otro proveedor de atención de la salud. Ahora bien, esta orientación debe complementar y no sustituir a la consulta con un proveedor de atención de la salud. • Aunque con frecuencia es difícil de determinar, es primordial comprobar la fuente de información disponible en Internet • Si la información parece demasiado buena para ser cierta, habitualmente es así. La información se debe verificar y evaluar con cuidado • La venta o adquisición de productos médicos por Internet es ilegal en algunos países y se aconseja firmemente a los usuarios que obtengan los productos médicos por canales de distribución legítimos, como son las farmacias • Los pacientes deben consultar a un médico o a otro profesional de atención de salud antes de iniciar un autotratamiento Para que la información sobre medicamentos vía INTERNET sea beneficiosa para la salud de la población, debe garantizarse su exactitud y autenticidad, y en este sentido se requiere de esfuerzos cooperativos de todos los interesados para formular normas de conducta responsable por parte de los operadores de INTERNET. El establecimiento de “Buenas prácticas de información” y “buenas prácticas de Internet” son la vía para salvaguardar el papel del INTERNET como fuente valiosa de información de medicamentos. A todos los profesionales de la salud les debería ser familiar el uso de las fuentes de información disponibles, incluyendo los de formato impreso como los de soporte magnético y las bases de datos disponibles vía INTERNET, así como contar con los lineamientos básicos para la evaluación de ella. - 32 - Manual de Selección de Medicamentos REPORTES DE ESTUDIOS CLÍNICOS Y METANÁLISIS: EVALUACIÓN DE SU CALIDAD Y RELEVANCIA ESTUDIOS CLÍNICOS El estudio o ensayo clínico es un experimento diseñado para evaluar la eficacia y seguridad de un tratamiento en seres humanos. Es considerado un tipo especial de estudio de cohorte en el que el investigador define las condiciones del estudio, llevándolo a cabo con el consentimiento de las personas que serán sometidas al experimento. Un estudio clínico ideal es aquel en el cual grupos de personas tan similares como sea posible en todos los aspectos, son sometidos a un proceso simultáneo de investigación con la particularidad de que uno de los grupos recibe el medicamento a estudiar y el otro se somete a un placebo o a un medicamento alternativo y que es empleado como grupo control. El estudio clínico controlado aleatorizado (ECCA) doble ciego es considerado el patrón de oro de la investigación científica para evaluar los efectos de un tratamiento (eficacia y seguridad de los fármacos) y constituye el soporte científico más importante (evidencia) para las guías clínicas en farmacoterapéutica. (Cuadros N° 1 al N° 4) El reporte de estos estudios debe ser adecuadamente estructurado para brindar a los lectores información precisa en relación a su diseño, metodología, análisis y aplicación, de modo tal que se pueda evaluar su validez interna y extrema. (Cuadro N° 5). En el Anexo N° 3 se presenta una guía práctica para evaluar de modo riguroso los reportes de estudios clínicos. La evaluación sistemática de los reportes de estos estudios debe incluir, en forma secuencial: 1. Los requisitos básicos. 2. La importancia clínica de los efectos a medir. 3. La validez interna. 4. La magnitud y la precisión del efecto. 5. La relación beneficio / riesgo. 6. La utilidad en la práctica clínica. A continuación se describen cada uno de las etapas (ver también Anexo N° 4) 1. EVALUAR LOS REQUISITOS BÁSICOS En un sentido estricto, un estudio clínico debe reunir los siguientes criterios en forma cabal. a. Ser planificado, con anticipación a su ejecución y nunca improvisado. b. Ser controlado, es decir que compare los resultados frente a un tratamiento diferente, asignado a un grupo de control (por ejemplo frente a un tratamiento convencional o placebo). c. Ser concurrente, es decir la selección de las personas para su inclusión al estudio (reclutamiento), el tratamiento y el seguimiento de los grupos a comparar, deben ser realizados durante el mismo período de tiempo (se excluyen por lo tanto, los estudios que utilizan un grupo de control histórico). 2. EVALUAR LA IMPORTANCIA CLÍNICA DE LOS RESULTADOS DEL ECCA En esta evaluación se busca verificar que los resultados del estudio midan apropiadamente el efecto clínico del tratamiento, es decir, establecer si el estudio mide resultados clínicos finales o intermedios. Un estudio clínico relevante debe medir, de preferencia, el impacto terapéutico mediante los resultados clínicos finales que ocurren como consecuencia directa de la enfermedad, como son la muerte o un evento clínico no fatal (anticipadamente definido en base a criterios clínicos), por ejemplo, un infarto cardíaco o un accidente cerebrovascular. - 33 - Manual de Selección de Medicamentos Los estudios que miden los eventos clínicos finales requiere con frecuencia contar con un gran número de pacientes para lograr su viabilidad (intentar que el tratamiento de interés produzca un resultado mejor que el tratamiento de control) y/o demandan un seguimiento a largo plazo; lo que, además de dificultar su realización, determinan un alto costo económico. Surge entonces como una alternativa práctica, la realización de la medición de los efectos intermedios o efectos intermedios, los cuales miden el resultado de una prueba de laboratorio o un signo clínico. Ellos son utilizados generalmente en las etapas iniciales de la evaluación de un medicamento (estudios fase II y fase III temprana). Estos efectos intermedios pueden ser variables fisiológicas, como por ejemplo el comparar la eficacia de dos o más estatinas únicamente en base a la disminución de los niveles de colesterol sérico o comparar la eficacia de un bifosfonato frente a un placebo considerando únicamente el incremento de la densidad mineral ósea por densitometría, en lugar de medir los desenlaces clínicos finales como podrían ser la reducción en la incidencia de infarto cardiaco o de fractura de cadera, respectivamente. Puede medirse igualmente, la ocurrencia de “enfermedades subclínicas” como la regresión de la aterosclerosis a través de la angiografía coronaria o la mejoría de la vasomotilidad coronaria en la evaluación del efecto de un tratamiento hipolipemiante en lugar de un evento clínico coronario como objetivo primario. Pero en estos casos, confiar únicamente en resultados intermedios para definir la eficacia de un medicamento tiene sus limitaciones, las que deben ser tomadas en cuenta en el momento de aplicar los resultados en la clínica. Por ejemplo, en un ensayo clínico efectuado en mujeres postmenopáusicas con osteoporosis, se observó que el fluoruro de sodio incrementaba la densidad mineral ósea a nivel vertebral en un 35%, sin embargo, ocurrieron más fracturas en el grupo tratado con relación al grupo placebo. En otro estudio con calcio y vitamina D, realizado en mayores de 65 años, prácticamente no se observaron variaciones en la densidad ósea pero hubo en cambio, una reducción en el riesgo de fractura de aproximadamente 50%. Por otro lado, confiar en dichos efectos intermedios como indicadores del efecto clínico principal, puede resultar riesgoso, ya que en lugar de obtener el beneficio esperado de un tratamiento se podría incrementar la morbilidad o mortalidad. Por ejemplo, es aceptado que la aparición precoz de arritmias ventriculares luego de un infarto cardiaco se asocia a un incremento en la mortalidad. Podría ser razonable, esperar que el uso de un medicamento que suprima eficazmente este tipo de arritmias (efecto intermedio), mejore la sobrevida (efecto clínico final). Basado en este argumento, se iniciaron los estudios con encainida, flecainida y moricizina en este tipo de pacientes. Sorprendentemente, se observó que la mortalidad era significativamente mayor en el grupo que recibía estos agentes antiarrítmicos comparados al grupo placebo, lo que obligó a los investigadores a suspender el estudio. Se ha comentado asimismo, que en la práctica clínica, mucho antes de que se contase con los resultados de estos estudios, se utilizaban frecuentemente algunos de estos antiarrítmicos, lo que hace suponer que decenas de miles de pacientes con infarto cardíaco podrían haber sido perjudicados con dicha medicación. A consecuencia de estos hechos, los investigadores clínicos y las autoridades de regulación de medicamentos, tomaron la decisión de demostrar obligatoriamente el no incremento de la mortalidad con el uso de nuevos antirrítmicos, como requisito previo para su aprobación. De igual manera, en los pacientes hipertensos no es conveniente considerar únicamente el grado de reducción de la presión arterial (efecto intermedio) como medida final de eficacia comparativa del tratamiento antihipertensivo. Existe una diversidad de medicamentos de conocida eficacia en la reducción de la presión arterial a niveles deseados. Sin embargo, no todos han demostrado disminuir la incidencia de eventos vasculares fatales y no fatales (resultados finales). - 34 - Manual de Selección de Medicamentos Por ejemplo, en la actualidad los diuréticos tiazidas son los únicos medicamentos antihipertensivos que han demostrado disminuir la mortalidad cardiovascular, cuando son utilizados como primera elección. Por otro lado, el uso del nifedipino de acción corta, eficaz en disminuir la presión arterial en hipertensos, ha sido relacionado con la precipitación de eventos isquémicos y el incremento de mortalidad coronaria en pacientes que han sufrido infarto cardiaco, lo que ha dado lugar a una serie de controversias en relación al uso de antagonistas de calcio y a no recomendar el uso rutinario de nifedipino de acción corta. En general, para poder validar los efectos intermedios, debe haberse demostrado previamente, mediante estudios observacionales, una asociación fuerte, independiente y consistente entre éstos y el efecto clínico principal, además de contar con otros estudios clínicos con medicamentos de la misma o diferente clase terapéutica que hayan demostrado que la mayoría en los efectos intermedios han conducido a la mejoría del efecto clínico principal. Con frecuencia se utiliza la medición de la “calidad de vida” como un resultado clínico final. En realidad esta cuantificación resulta poco precisa, considerando la complejidad en la base conceptual de los parámetros a utilizar en la medición de algo tan valioso y de máxima importancia, que hace referencia a valores y percepciones por parte de los pacientes y que varía ampliamente dependiendo de factores socioculturales, étnicos, económicos, geográficos, entre otros. Sin embargo, es aceptado por muchos investigadores como un elemento adicional de importancia, capaz de medir conjuntamente beneficios y riesgos en enfermedades de curso crónico como es el caso de los padecimientos oncológicos. Finalmente, considerando que los beneficios y los riesgos pueden variar a través del tiempo de seguimiento y más allá del mismo, es importante preguntarse, cuál es el momento óptimo (o momentos) para medir los resultados finales y si en el estudio se consiguió un efecto persistió durante un tiempo prolongado. 3. EVALUAR EL GRADO DE VALIDEZ INTERNA En esta evaluación se trata de identificar los sesgos (errores sistemáticos) que pueden influir de manera significativa en los resultados del estudio. La no conformidad de alguna de las características señaladas a continuación se considera un factor importante de sesgo y disminuye la credibilidad de los resultados: a) Asignación aleatoria; realizada mediante diversas técnicas establecidas de tal manera que cada participante tenga la misma probabilidad de integrar cualquiera de los grupos de tratamiento. b) Análisis “por intención a tratar”, con el fin de establecer las conclusiones, todos los pacientes que ingresaron al estudio deben considerarse en el análisis estadístico final dentro del grupo al cual fueron asignados, independientemente si hubo “pérdida durante el seguimiento” o incumplimiento parcial o total del tratamiento. c) Enmascaramiento; preferentemente doble ciego en el que tanto pacientes e investigadores desconocen el tratamiento impartido. Su contraparte es el estudio abierto. d) Características basales similares de los participantes; las cuales deben estar referidas al inicio del estudio en relación a todos los factores de riesgo o de pronóstico conocidos que podrían modificar los resultados. De existir diferencia sustancial, evaluar si se efectuaron técnicas estadísticas para ajustar los resultados en relación a las diferencias basales. e) Co-intervenciones similares; es decir, de someterse a otros tratamientos farmacológicos, no farmacológicos o cuidados especiales, ellos deben ser semejantes en los grupos de comparación. - 35 - Manual de Selección de Medicamentos 4. EVALUAR LA MAGNITUD Y LA PRECISIÓN DEL EFECTO: RESUMEN DE MEDIDAS Para la medición de la eficacia del tratamiento, podemos tomar el siguiente ejemplo: Un ensayo clínico demostró una significativa reducción del riesgo de muerte y/o infarto cardíaco sin ocasionar un incremento significativo en el riesgo de una hemorragia severa, cuando se comparó una terapia combinada de ácido acetilsalicílico y una heparina de bajo peso molecular (HBPM) contra ácido acetilsalicílico y un placebo en pacientes con síndrome coronario agudo. Posteriormente, se realizó un ensayo clínico multicéntrico aleatorizado y doble ciego en el que se comparó la eficacia y seguridad de una HBPM en relación a la heparina no fraccionada (HNF), la cual es convencionalmente utilizada para el tratamiento de angina inestable o infarto de miocardio sin onda Q. La duración del tratamiento de ambas heparinas estuvo en el rango de 2 a 8 días (media de 2.6 días). Todos los pacientes recibieron además ácido acetilsalicílico. La eficacia se midió considerando de manera combinada el riesgo de muerte, infarto de miocardio o angina recurrente. Los resultados medidos a los 30 días, los hemos resumido en el siguiente cuadro en términos de eficacia y seguridad. Eficacia Tratamiento Total de pacientes HBPM HNF Seguridad Muerte Infarto Hemorragia severa Hemorragia No severa A=1607 Muerte/infarto Angina recuente C=318 47 52 102 188 B=1564 D=364 57 64 107 110 En el resumen del artículo, se señaló que a los 30 días el riesgo combinado de muerte, infarto cardiaco o angina recurrente fue significativamente menor en el grupo que recibió HBPM en relación a los asignados a recibir HNF (19.8% vs 23.3%, P=0.016). Revisemos los resultados del cuadro (datos resaltados en cursiva). 4.1 Evaluar la magnitud: Puntos de estimación a) Riesgo absoluto (RA) Mide cuál es la probabilidad de que las personas que reciben uno de los tratamientos que estamos comparando pueda presentar el efecto no deseado en un determinado tiempo. En el ejemplo descrito: ¿Cuál es el riesgo absoluto en los pacientes asignados a recibir el tratamiento de interés (RAt) para morir, sufrir un infarto cardíaco o una angina recurrente en los 30 primeros días? Para muchos puede resultar más sencillo entenderlo primero en términos porcentuales: El total de pacientes asignados a recibir HBPM fue 1607, a pesar de ello 318 o bien murieron, sufriendo un infarto o tuvieron angina recurrente en los 30 primeros días. - 36 - Manual de Selección de Medicamentos ¿Qué porcentaje representa 318 del total de pacientes asignados a HBPM? 1607 318 es el será 100% X X = (318 x 100) / 1607 Es decir, el 19.8% de los asignados a la HBPM, fallecieron, sufriendo un infarto cardiaco no fatal o por lo menos tuvieron una angina recurrente. Esto mismo, expresado en términos de riesgo absoluto (RAt), será: 19.8 / 100 = 0.198 ¿Cuál es el riesgo absoluto (riesgo de “base”) en los pacientes asignados a recibir el tratamiento de control (RAc) para morir, sufrir un infarto cardíaco o una angina recurrente en los 30 primeros días? Si el total de pacientes asignados a recibir HNF fue 1564 y 364 sufrieron alguno de los eventos descritos, el RA será: 364 / 1564 = 0.233 Significa que el 23.3% de los expuestos a la HNF o bien fallecieron, sufrieron un infarto cardíaco no fatal o tuvieron una angina recurrente. El riesgo basal se refiere al riesgo sin tratamiento que tiene el grupo de pacientes (o un paciente) a los cuales queremos en la práctica ofrecer el tratamiento para disminuir este riesgo. Se requiere contar con estudios observacionales locales para conocerlo, información que generalmente no está disponible. Entonces, como “riesgo de base” muchas veces utilizamos el resultado obtenido en el grupo placebo de un ECCR. Sin embargo, es bueno recordar que existe también un “efecto placebo” que puede modificar el riesgo basal que buscamos. ¿Es suficiente con saber que los pacientes del grupo HBPM tuvieron un menor riesgo o menor porcentaje de presentar el efecto clínico que se desea evitar en comparación con el grupo HNF (0.198 o 19.8% vs 0.233 o 23.3%) tal como se menciona en el resumen del artículo, a fin de optar por HBPM para nuestros pacientes con angina inestable o infarto no Q? La respuesta es no. ¿Tenemos idea cuán significativo es 19.8% con HBPM en relación al 23.3% con HNF? Veamos cómo podemos comparar de mejor manera ambos resultados: b) Riesgo relativo (RR) o cociente de riesgos Confronta ambos RA, informándonos cuantas veces es probable obtener el efecto no deseado del tratamiento con el fármaco de interés (RA t) en comparación al placebo o fármaco de control (RA c), durante el mismo tiempo de exposición. - 37 - Manual de Selección de Medicamentos En el ejemplo descrito: El RR a los 30 días de iniciado el tratamiento es igual a RA t / RA c: 0.198 / 0.233 = 0.85 Es decir, la posibilidad bien sea de morir, sufrir un infarto cardíaco o una angina recurrente luego de los 30 primeros días de iniciado el tratamiento es 0.85 en el grupo que recibió HBPM, en relación al grupo que recibió HNF c) Reducción del riesgo relativo (RRR) Nos informa del porcentaje de reducción del riesgo del evento no deseado entre el tratamiento de interés y el tratamiento que sirve de control. Es el complemento del RR expresado en términos porcentuales. En el ejemplo descrito: La RR a los 30 días de iniciado el tratamiento es igual a (1- RR) x 100: (1 – 0.85) x 100= 15% Es decir, la HBPM disminuye en 15% el riesgo de morir o de sufrir un infarto cardíaco o en todo caso de padecer una angina recurrente en relación a HNF. Muchos estudios clínicos publicados en las revistas científicas utilizan como medida de resumen para sus resultados, el RR o la RRR. Sin embargo, como se habrá podido notar, estos valores por sí solos, nos brindan una información muy limitada, puesto que no nos dicen cuál es el riesgo de “base” sobre el cual parten. Incluso puede causar, a primera vista, un gran impacto el tratamiento en la práctica clínica siendo en realidad una impresión engañosa por tener en realidad, un mínimo beneficio. Una RRR de 50% nos sugiere, aparentemente, siempre un gran beneficio. Sin embargo, si tenemos un riesgo bajo de accidente cerebrovacular (ACV) en el grupo placebo (riesgo de “base”), por ejemplo de 2%, una reducción del riesgo relativo de 50% significa que en el grupo de tratamiento se ha logrado disminuir el riesgo a 1%. En otras palabras, de 100 pacientes sometidos a placebo, 2 tendrán ACV y si son tratados con el medicamento tendremos 1 ACV, es decir se evita solamente 1 ACV. En cambio, si este riesgo de “base” en lugar de 2% es 30% es decir, de 100 pacientes tienen ACV 30 y con el tratamiento de interés se evita que ocurran 15 muertes, la RRR a pesar de ser la misma (50%) es, en el segundo caso, más significativa. La desventaja principal de utilizar la RRR en la toma de decisiones radica en el hecho de que no refleja la magnitud del riesgo de “base”, pudiendo sobrestimar (estrategia muy utilizada para fines comerciales-promocionales) o subestimar al impacto absoluto del tratamiento, si el resultado clínico principal en el grupo de control del estudio o en la población a la cual queremos ofrecer el tratamiento, es infrecuente o muy frecuente respectivamente. Una forma práctica de expresar estos resultados es a través de la reducción del riesgo absoluto y el número necesario a tratar para lograr un beneficio. d) Reducción del riesgo absoluto (RRA), diferencia de riesgos o reducción del riesgo atribuible. Este cálculo permite interpretar el valor clínico de la intervención en términos de una diferencia absoluta. - 38 - Manual de Selección de Medicamentos En el ejemplo descrito: La RRA a los 30 días de iniciado el tratamiento es RA c – RA t: 0.233 – 0.198 = 0.035 De manera individual, podríamos decir que un paciente del estudio tiene un 3.5% de posibilidad de beneficiarse con HBPM en lugar de HNF. Considerando una población que tenga un riesgo basal similar al del estudio, diríamos que a los 30 días de tratamiento el 3.5% de pacientes se beneficiarían al no morir, sufrir un infarto en todo caso al no presentar una angina recurrente si reciben HBPM en lugar de HNF. En otras palabras, por cada 100 pacientes que tratemos con HBPM en lugar de HNF, evitaremos que muera, ocurra un infarto o una nueva angina, en 3.5 pacientes en los primeros 30 días de tratamiento (podríamos considerar en la práctica 4 pacientes o ser más exactos y decir que por cada 200 pacientes que trate, evito que ocurra alguno de los eventos en 7 pacientes). Debemos recordar que nos estamos refiriendo a pacientes con características similares a los pacientes del estudio (con igual riesgo basal) e) Número necesario a tratar para lograr un beneficio (NNTB) Se refiere a la cantidad de pacientes que se requiere tratar para evitar que ocurra un evento no deseado (por ejemplo a muerte). Para un cálculo matemático fácil de recordar, diremos que “el NNTB es la recíproca del RRA”. Otra manera sencilla que permite comprender el cálculo es mediante una “regla de tres simple”: Si 3.5 pacientes es a 100 pacientes, 1 paciente es a X (Cuadro N° 6 y N° 7). En el ejemplo, descrito fácilmente, lo podemos calcular. Si la RRA a los 30 días de iniciado el tratamiento es 0.035; el NNTB será: 1 / 0.035 = 28.57 (aprox. 29) Es decir, por cada 29 pacientes que se trate con HBPM en lugar de HNF, en 1 de ellos se evitará que ocurra alguno de los eventos descritos, dentro de los primeros 30 días de tratamiento. Utilidad de los cálculos. El NNTB (y la RRA) resultan expresiones muy útiles debido a que explica no sólo al médico sino también al paciente, en términos claros, cuanto representa el esfuerzo que se debe utilizar y cuanto es la probabilidad de prevenir que ocurra un evento no deseado. Es importante señalar, especialmente cuando evaluemos resultados en enfermedades de curso crónico, que el NNTB varía de acuerdo al momento (tiempo) en que realizamos su medición. Podría también permitirnos apreciar – por lo menos tentativamente – cuando es el costo incremental en pesos o dólares, que significa tratar 29 pacientes con HBPM en lugar de HNF (costo por tratar con HBPM menos costo por tratar con HNF multiplicado luego por 29) para evitar que ocurra un evento en los primeros 30 días. - 39 - Manual de Selección de Medicamentos 4.2. Precisión: intervalos de confianza de 95%(IC 95%) en lugar de valores “p” La precisión se refiere a la sensibilidad con que se puede detectar el efecto comparativo de tratamiento en relación con la variabilidad y el tamaño de la muestra. Denota el grado de dispersión del efecto que existe entre la mayor parte de sujetos del estudio. El intervalo de confianza (IC) de 95% (IC 95%), es descrito como rango de valores donde en algún punto entre su límite inferior y superior se encuentra el verdadero valor, de tal forma que la probabilidad que este valor real se encuentre por debajo o por encima de estos límites es solo de 2.5%, respectivamente. Podemos afirmar que existe un 95% de certeza que el verdadero valor está dentro de estos límites de confianza o que en 19 de 20 ensayos clínicos realizados de manera similar, el valor se ubicara dentro de este rango. El valor p está basado en la prueba de hipótesis (el rechazo de la hipótesis nula) y es utilizado comúnmente para evaluar el nivel de significancia estadística del 5%. Brinda en realidad poca información sobre la diferencia entre los grupos estudiados. Algunos autores mencionan que quizás la consecuencia más nociva de emplear la teoría estadística convencional en la ciencia clínica moderna ha sido la amplia difusión de la fantasía que una “diferencia estadísticamente significativa” es una diferencia clínicamente significativa. Por ejemplo, p < 0.05 o p > 0.05, sólo indican un “si” o un “no” estadísticamente significativo, respectivamente. Un valor p < 0.05 nos dice que es raro que el resultado obtenido ocurra únicamente por el azar (en menos del 5% de las veces). De otro lado, no debemos pensar que mientras menor sea el valor de p, esto signifique que el tratamiento sea mucho más efectivo. También tenemos el caso que pequeñas diferencias sin valor clínico pueden ser estadísticamente significativas si el tamaño de la muestra es grande y por otro lado, diferencias clínicas importantes pueden no ser estadísticamente significativos si el tamaño de la es pequeña. Un IC 95% brinda mayor información puesto que nos refiere el recorrido de los valores numéricos que podemos encontrar al comparar los grupos de tratamiento, lo cual posee un interés clínico. Además guarda una estrecha relación con el valor p, de tal manera que cuando se determine el IC 95%, es posible deducir también el significado estadístico de la prueba. Por otro lado, nos informa sobre el tamaño de la muestra (a mayor tamaño menor amplitud entre sus límites, por lo tanto mayor precisión). Continuando con el ejemplo descrito, vamos a calcular los siguientes ítems: a) El IC 95% del Riesgo Relativo (RR) b) El IC 95% de la Reducción del Riesgo Relativo (RRR) c) El IC 95% de la Reducción de Riesgo Absoluto (RRA) d) EL IC 95% del Número Necesario a Tratar para lograr un Beneficio (NNTB) Veamos el detalle. a) Calculando el IC 95% del Riesgo Relativo Como señalamos anteriormente, el RR a los 30 días de iniciado el tratamiento es 0.85 y podemos además decir que existe un 95% de posibilidad que su verdadero valor este entre 0.74 y 0.97. - 40 - Manual de Selección de Medicamentos Si entre los límites superior e inferior del intervalo de confianza se encuentra incluida la unidad (1), por ejemplo IC 95% del RR= 0.95 a 1.3 se considera al resultado “no estadísticamente significativo”. En el ejemplo que estamos desarrollando, como los límites de confianza no incluyen a la cifra 1, como valor numérico (0.74 a 0.97), se considera que el resultado es “estadísticamente significativo”. Además, por la cercanía entre sus límites inferior y superior pensamos que el tamaño de la muestra ha sido adecuado. Es difícil pronunciarse sobre la importancia clínica de estos valores si no conocemos cual es el riesgo basal (RAc), sin embargo es evidente que su limite superior está muy cerca de la unidad. b) Calculando el IC 95% de la Reducción del Riesgo Relativo Si el IC 95% del RR está entre 0.74 y 0.97 El límite inferior del IC 95% de la RRR es: 1 – 0.97 = 0.03; es decir 3%. El límite superior del IC 95% de la RRR es: 1 – 0.74 = 0.26; es decir 26%. Así, como hemos mencionado, la HBPM disminuye en 15% el riesgo en relación a HNF, agregando que los límites de su IC 95% están entre el 3% y 26%. Como entre los límites 0.03 y 0.26 no está incluido la cifra cero como valor numérico, se considera que una RRR de 15% es “estadísticamente significativa” (p<0.05). Al igual que para el RR, es difícil manifestarse sobre la importancia clínica de este 15%. c) Calculando el IC 95% de la Reducción del Riesgo Absoluto Primero calculamos el error estándar de la reducción del riesgo absoluto (EERRA) Luego calculamos el intervalo de confianza de 95% para la RRA IC 95% de la RRA IC 95% de la RRA IC 95% de la RRA = RRA ± = 0.035 ± = 0.00638 a 0.0636 (1.96 x EERRA) (1.96 x 0.0146) De acuerdo a lo mencionado anteriormente la RRA a los 30 días de iniciado el tratamiento es de 3.5% siendo su IC 95% de 0.638% a 6.36%. Como entre sus límites de confianza (0.00638 a 0.0636) no se incluye el cero como valor numérico, considerándose en este caso que una RRA del 3.5% es “estadísticamente significativa” (p<0.005). De incluir entre sus dos límites al cero, por ejemplo supongamos un IC 95% de la RRA entre (-1) a (1.3), el resultado se considera “estadísticamente no significativo”. - 41 - Manual de Selección de Medicamentos Nuevamente diremos que de manera individual, un paciente del estudio tiene aproximadamente entre un 0.6% a 6% de posibilidad de beneficiarse con HBPM en lugar de HNF, siendo su estimado puntual (RRA) de 3.5%; o si lo extrapolamos a una población con un riesgo basal similar al del estudio, diríamos que a los 30 días del tratamiento entre un 0.6% a 6% de pacientes (1 a 13 de 200 pacientes) se beneficiarían de no morir, sufrir un infarto o en todo caso de una angina recurrente si recibe HBPM en lugar de HNF. Observaremos que la expresión brinda una mayor información que un simple valor de p. En términos generales, si el estimador puntual (RRA) es “estadísticamente significativo” y si su valor ubicado en el límite inferior (en este caso, 0.6%) posee significado clínico, es decir la magnitud suficiente para ofrecer beneficios clínicos a los pacientes, el estudio puede considerarse positivo, siendo además el tamaño de la muestra adecuada. Sin embargo, si el valor ubicado en el límite inferior no representa una reducción del riesgo absoluto suficiente desde el punto de vista clínico, el estudio no puede considerarse concluyente, aún si es estadísticamente significativo. Por otro lado, si en el intervalo de confianza se incluye la cifra cero, el resultado se considera “estadísticamente no significativo” (P > 0.05), pero si el valor ubicado en el límite superior lo consideramos “clínicamente significativo”, podemos afirmar que si bien el estudio no ha podido demostrar que el tratamiento de interés fue mejor que el tratamiento de control, tampoco ha podido demostrar que no lo sea y por lo tanto el estudio no puede considerarse definitivo y posiblemente se requiera contar con un estudio con una muestra de mayor tamaño. d) Calculando el IC 95% del número necesario a tratar para lograr un beneficio IC 95% del NNTB = IC 95% del NNTB = IC 95% del NNTB = 1 / (los límites del IC 95% de la RRA) 1 / (0.0636) a 1/(0.00638) 16 a 157 pacientes Significa que existe el 95% de confianza de que el NNTB “verdadero” está entre 16 y 157 pacientes siendo el punto de estimación (NNTB) de 29 pacientes. ¿Cuánto debe ser esta diferencia para tener un significado clínico? Al respecto, Feinstein refiere que no existe una respuesta única y que se requiere de juicios arbitrarios que deben ser adaptados apropiadamente para cada situación. Una de las barreras científicas más importantes para la evaluación de la eficacia terapéutica es la ausencia de un método convencional para decidir que es bueno y que o cuanto es mejor. Una serie de principios estadísticos se han desarrollado para definir lo “estadísticamente significativo”, pero no se han establecido principios clínicos para señalar lo que es significativamente terapéutico. De las dos últimas mediciones hemos recogido las siguientes expresiones con igual significado: Entre 1 a 13 (estimado puntual de 7) de 200 pacientes que tienen características similares a los sujetos del estudio, se beneficiarían de no morir, sufrir un infarto o en todo caso de una angina recurrente si reciben HBPM en lugar de HNF, a los 30 días de tratamiento; o Para evitar que 1 paciente sufra alguno de los eventos descritos dentro de los primeros 30 días luego de iniciado el tratamiento, debemos tratar con HBPM entre 16 a 157 pacientes (estimado puntual de 29) en lugar de HNF. - 42 - Manual de Selección de Medicamentos Es importante resaltar en el ejemplo descrito, que la muerte (fundamentalmente la asociada al evento a tratar) y el infarto de miocardio constituyen dos resultados de incuestionable importancia clínica, sin embargo podríamos dudar el considerar la aparición de un nuevo episodio de angina como parte de este resultado principal final. Para salir de dudas, efectuemos con la ayuda del ejemplo desarrollado, un segundo ejercicio matemático (para efectuar los cálculos sin mucho esfuerzo puede recurrirse a http://www.hutchon.net/Calcmenu.htm) considerando como “puntos finales” únicamente a la muerte o infarto agudo de miocardio, dejando de lado a la angina recurrente (ver datos en el cuadro inicial). Planteado de esta manera se obtendrán resultados estadísticamente no significativos en ambos casos separada o conjuntamente. Como ven, el análisis clínico juega un papel fundamental para poder responder a la pregunta planteada. Los aspectos que vamos a mencionar a continuación pueden ayudarnos a obtener nuestra apreciación final. 5. EVALUACIÓN DE LA RELACIÓN BENEFICIO / RIESGO: EL IMPACTO DE LA TERAPIA Lo que buscamos evaluar es qué tan bien funciona el tratamiento. El número necesario a tratar para lograr un beneficio (NNTB) y el número necesario a tratar para ocasionar un daño (NNTD), son dos expresiones útiles para medir las consecuencias del tratamiento. El siguiente paso es evaluar la relación de los dos efectos del tratamiento: los beneficios y los riesgos. Para fines prácticos, estos conceptos deben ser expresados en términos operacionales que puedan compararse, para tratar de responder a la pregunta sobre cuánto de esta diferencia se debe considerar efectiva y segura para la toma de la decisión clínica. El beneficio, fue descrito mediante la RRA y el NNTB. Sin embargo, una de las desventajas es éstos que no brindan información sobre el destino final de todos los pacientes que recibieron el tratamiento de interés. Recordemos en el ejemplo, que el número necesario a tratar con HBPM en lugar de HNF para beneficiar a un solo paciente fue 29. Pero, ¿Qué sucedió con los otros 28 pacientes?. Debemos suponer que ellos en realidad no necesitaron de este tipo de HBPM o que no respondieron al beneficio buscado con esta heparina. Si el RA con HBPM fue 0.198, ello significa que de los 29 pacientes necesarios a tratar con HBPM, 6 (0.198 x 29) sufrirán a pesar del tratamiento alguno de los eventos que fueron medidos en conjunto (muerte, infarto o angina). Si bien existe la posibilidad de tener que tratar a un significativo número de pacientes para lograr que solamente uno de ellos obtenga un beneficio clave, ello podría tal vez ser aceptable si además ese tratamiento estuviese prácticamente libre de reacciones adversas importantes, fuese fácil de aplicar y cumplir y no fuese muy costoso en relación al tratamiento convencional. Sin embargo, en la realidad un tratamiento nuevo tiene el riesgo de producir efectos adversos (con frecuencia no bien conocidos) y es generalmente costoso. El mismo método que hemos mencionado para NNTB, puede ser utilizado para estimar la seguridad o los peligros del tratamiento, con el indicador correspondiente al número de pacientes necesarios a tratar para ocasionar un daño (NNTD): NNTD = 1 / (It – Ic) - 43 - Manual de Selección de Medicamentos Donde (It) es la incidencia de la reacción adversa ocasionada por el fármaco de interés; (Ic) la incidencia de la reacción adversa ocasionada por el fármaco de control o el placebo. Debe considerarse especialmente aquellas reacciones que obliguen a la suspensión del medicamento. Resumimos el ejemplo que utilizaron Andreas Laupacis y colaboradores para explicar este concepto. En un ensayo clínico randomizado de aproximadamente 5 años de duración (Medical Research Council), los pacientes fueron asignados aleatoriamente a recibir placebo, bendroflumetiazida o propranolol para ser evaluados en el tratamiento de la hipertensión arterial leve. Se encontró en el grupo de hombres un NNTB de 107 para el diurético bendroflumetiazida comparado con placebo (para prevenir un accidente cerebrovascular o un evento coronario). De otro lado, se reportaron los motivos por los cuales se retiró este tratamiento (con fines didácticos consideraremos la incidencia de estos efectos adversos igual a cero en el grupo placebo): Impotencia (4%); siendo el NNTD: 1 / (0.04 – 0) = 25 Gota (5%); siendo el NNTD: 1 / (0.5 – 0) = 20 Alteración en la glicemia (3%); siendo el NNTD: 1 / (0.03 – 0) = 33 Somnolencia (1%); siendo el NNTD: 1(0.01 – 0) = 100 Es decir comparado con placebo, se deberá tratar a 107 pacientes para prevenir un evento vascular relacionado con la hipertensión arterial pero se retirarán 13 pacientes: 4 por impotencia (107/25), 5 por gota (107/20), 3 por alteración en la glicemia (107/33) y uno por somnolencia (107/100). Este enfoque amplía nuestra visión puesto que nos ofrece información adicional de los otros 106 pacientes y contrasta (de manera aproximada) cuánto puede ser el beneficio en relación al riesgo. En nuestro ejemplo (ver cuadro inicial de datos), se evaluó la seguridad en base al riesgo de hemorragia severa, definida como aquella que causará muerte, la necesidad de por lo menos 2 unidades de sangre, una caída de hemoglobina de por lo menos 3 g/dl o hemorragia retroperitoneal, intracraneal o intraocular. También se evaluó el riesgo de hemorragia no severa, es decir aquella clínicamente importante no calificada como severa (por ejemplo, epistaxis, equimosis o hematoma, hematuria macroscópica). Del cuadro podemos calcular que la frecuencia de hemorragia severa en los primeros 30 días fue bastante similar: 6.35% y 6.84% en el grupo que recibió HBPM y HNF respectivamente. Es importante señalar que la mayoría de ellas ocurrieron después de finalizado el esquema terapéutico y en relación a cirugía de revascularización. Para hemorragia no severa se observó una diferencia: 11.69% y 7.03% para HBPM y HNF respectivamente, la cual fue estadísticamente significativa. Sin embargo, si observamos que la mayoría de ellas eran equimosis en el sitio de administración, la relevancia clínica también resulta poco significativa. No es habitual encontrar información sobre la incidencia de reacciones adversas en los diferentes grupos de riesgo teniendo muchas veces que generalizar los datos obtenidos, sin considerar que el grupo de mayor riesgo para el desenlace no deseado también puede tener un mayor riesgo para desarrollar reacciones adversas (edad avanzada, compromiso de la función de varios órganos, interacciones entre medicamentos, co-morbilidad, etc.) o ser la información incompleta por tratarse de un medicamento nuevo con escasa experiencia de uso y en fase IV inicial. - 44 - Manual de Selección de Medicamentos Los estudios clínicos randomizados, son rara vez, realizados para evaluar los daños ocasionados por la exposición al fármaco, pero si son bien diseñados pueden ayudar a demostrar una clara relación causa-efecto entre el medicamento y un evento adverso. Como no es frecuentemente posible ni ético realizar este tipo de análisis mediante los ensayos clínicos, los investigadores cuentan con los estudios de cohortes en los cuales se identifican los grupos de personas expuestas y no expuestas, las cuales son seguidas a través del tiempo. Cuando los efectos adversos son infrecuentes o toman mucho tiempo en presentarse se pueden utilizar los estudios de caso-control, pero debemos tener en cuenta que ambos tipos de estudio son susceptibles a una variedad de sesgos que no pueden ser controlados. Consideración de la relación entre beneficios y riesgos Acá tratamos de responder a la pregunta: ¿Cuál es el nivel límite por encima del cual es recomendable tratar? Esto implica especificar un valor relativo, que asocie la prevención del resultado no deseado contra los efectos adversos e inconvenientes ocasionados por el tratamiento, sin que ello implique reemplazar al juicio clínico. Los investigadores creen importante realizar un enfoque económico que involucre los costos por el tratamiento incluyendo gastos administrativos por el sistema de cuidado de la salud, el ahorro ocasionado por evitar el desenlace negativo, el costo que significa ocasionar la (s) reacción (es) adversa (s), incluyendo molestias o inconveniencias para los pacientes, la incidencia de los efectos adversos, el valor relativo en dinero por la prevención del evento y para prevenir los efectos adversos en base al grado de satisfacción, molestia o deseo. Para ello se utilizan ecuaciones que involucran estas variables mencionadas cuyos datos son limitados o no están disponibles, especialmente en nuestro medio, lo cual dificulta su aplicación. 6. EVALUAR SU UTILIDAD CLÍNICA: EFECTIVIDAD En la práctica clínica podemos preguntarnos: ¿Funciona el tratamiento para nuestro paciente de manera individual o para nuestro grupo de pacientes?, o ¿Son generalizables los resultados del estudio clínico (o metanálisis) de tal modo que nuestro paciente en particular o una determinada población real responderá de manera similar a los participantes del estudio? Estas preguntas abordan la validez externa del ensayo: la extrapolación o transferencia de sus resultados a la práctica clínica habitual evaluando la efectividad del tratamiento. Si el paciente o grupo de pacientes podrían ser elegibles de acuerdo con los criterios de inclusión y exclusión del estudio, disminuirían las dudas sobre su aplicabilidad. También las características de nuestro (s) paciente (s) pueden pertenecer a un subgrupo dentro del estudio clínico en el cual los resultados pueden ser “positivos” a diferencia del resultado global. Con frecuencia, el análisis de subgrupos no es planeado antes de la ejecución del estudio, es decir con una estratificación previa, sino realizada de manera posterior a los resultados obtenidos, lo cual debe interpretarse con mucho cuidado considerando que la diferencia de los efectos en los subgrupos debe ser: a) De gran magnitud; b) Muy poco probable que ocurra por azar (tamaño de la muestra adecuada); c) Resultado de un análisis especificado como hipótesis antes de ejecutar el estudio; d) Uno de los pocos análisis de subgrupos realizados en el estudio; e) Replicado en otros estudios. - 45 - Manual de Selección de Medicamentos Podríamos también preguntarnos si existe algún impedimento obligatorio adecuadamente documentado, por el cual no es posible aplicar los resultados al (los) paciente (s) de interés por ser el efecto farmacológico (deseado o adverso) diferente. Estos pueden ser: a) Factores biológicos (variabilidad biológica) Diferencia fisiopatológica de la enfermedad que pueda reducir la eficacia o incrementar el riesgo de reacciones adversas (por ejemplo, mecanismos distintos relacionados a la producción de enfermedad en el caso de hipertensión arterial; la diferencia del comportamiento biológico del agente causal de la infección. Características especiales de los pacientes (por ejemplo, diferencias farmacocinéticas, farmacodinámicas, farmacogenéticas o ambientales). Por ejemplo: raza, grado de severidad del proceso, respuesta inmune. b) Factores socioeconómicos y culturales Están ligados a la efectividad del tratamiento cuando ocasionan variabilidad en el cumplimiento o modifican sustancialmente la relación beneficio/riesgo entre las poblaciones por razones de creencia, educación, actitud o comportamiento, situación económica, sistema de atención para el cuidado de la salud, necesidad de contar con personal entrenado o equipamiento tecnológico, medios adecuados en caso ocurra una reacción adversa severa, etc. Por ejemplo, el uso de warfarina que requiere conocimiento por el paciente y/o familiares de los cuidados especiales además del control periódico del paciente y del monitoreo del tiempo de protrombina. c) Factores epidemiológicos locales: Enfermedades prevalentes en la región que dificulten realizar un diagnóstico exacto y, por lo tanto, induzca un tratamiento tardío o errado. Por ejemplo, como fiebre tifoidea siendo el verdadero diagnóstico malaria. Enfermedades coexistentes en los pacientes que afectan el pronóstico. Por ejemplo, la frecuencia incrementada de infecciones adquiridas en un determinado hospital en el contexto del tratamiento del infarto cardíaco. Diferencia importante en el riesgo basal de los pacientes para el evento clínico principal. Por ejemplo: Una menor incidencia de infarto cardíaco; lo cual disminuye la eficiencia del tratamiento con estatinas por tratarse de una población de bajo riesgo para sufrir el desenlace que se desea evitar con el tratamiento. Patrones de resistencia local de las bacterias distintos para el antibiótico de interés. El estudio clínico aleatorio es el mejor medio disponible en la actualidad para evaluar si una intervención funciona, pero no suele servir para evaluar quién se beneficiará de la misma, siendo más representativo cuando la heterogeneidad de la población del estudio es insignificante y se optimiza la homogeneidad dentro de cada estrato para lo cual también se espera en un futuro su facilitación incrementando el potencial de la genética molecular para caracterizar la función metabólica y predecir la respuesta a los agentes farmacológicos en los pacientes individuales. La decisión clínica en relación a si el resultado de un estudio clínico es aplicable a un paciente, en particular a un grupo de pacientes con características similares no debe basarse únicamente en los criterios de inclusión y exclusión del ensayo, los cuales son usualmente diseñados para mejorar su calidad metodológica, su precisión al mejorar el poder del estudio o maximizar la seguridad del tratamiento. Los ensayos clínicos pueden por lo tanto, excluir a la mayoría de pacientes que atendemos en la práctica clínica real, con problemas sociales o co-morbilidad significativa quienes tienen su propio riesgo basal (RAc). - 46 - Manual de Selección de Medicamentos Debemos tener en cuenta que los resultados que nos ofrecen el NNTB o la RRA parten de un riesgo de “base” dado por el grupo de control del estudio, el cual no necesariamente es similar al riesgo que tiene nuestro paciente o población a tratar. Es decir el NNTB de nuestros pacientes puede ser diferente al NNTB del estudio. En cambio, la RRR logrado con el tratamiento de interés en el estudio, casi siempre permanece constante en todos los niveles de riesgo, incluso en cada uno de los subgrupos (con algunas excepciones). En este sentido, conocer la RRR del estudio puede ofrecer la ventaja de acercarnos al NNTB (y RRA) de nuestros pacientes, si tenemos idea de cuál es su propio riesgo basal. Se debe enfatizar que los beneficios clínicos obtenidos en un estudio clínico podrían ser sobreestimados o subestimados cuando lo aplicamos a la práctica, pero los efectos deletéreos, es decir los riesgos o la seguridad del tratamiento son frecuentemente subestimados. Por ejemplo, la diferencia entre lo que acontece en nuestra realidad con la de los estudios clínicos sobre la anticoagulación con warfarina al evaluar el riesgo de sangrado y no incluir a pacientes ancianos con comorbilidad importante, no motivados, que no disponen del apoyo de un servicio de salud competente o de un soporte médico y de enfermería de calidad puede ser abismal. ¿es comparable el servicio de salud local al utilizado por los participantes del estudio? Se requiere entonces, para afinar la predicción basada en la evidencia, de un juicio cualitativo por parte del clínico. La toma de decisiones clínicas requiere la evidencia de la eficacia a partir de los ensayos clínicos y la evidencia de su aplicabilidad a los pacientes individualmente a partir de los estudios observacionales. No se puede negar la complejidad de utilizar la evidencia de los ensayos clínicos para las decisiones que se relacionan con individuos, siendo la comprensión del individuo, en su contexto social, tan importante como los conocimientos sobre la probable eficacia de la intervención. Un autor (Taylor) comenta al respecto, que lo que es blanco y negro en abstracto, puede volverse rápidamente gris en la práctica a medida que los clínicos tratan de satisfacer las necesidades de sus pacientes individualmente. Listas de verificación (“checklist”) y sistemas de puntuación para la lectura crítica de los ensayos clínicos. Revisar un estudio clínico es un proceso que requiere considerar una diversidad de detalles para juzgar su validez, el grado de calidad en la metodología y relevancia clínica, sobretodo si se trata de seleccionar los estudios más importantes en la toma de decisiones para elegir el tratamiento más apropiado para nuestros pacientes o tal vez la incorporación o sustitución de un medicamento dentro de un formulario o arsenal farmacológico. La información recogida y sintetizada también es fundamental para realizar las guías prácticas, los análisis de decisión, las revisiones sistemáticas o los metanálisis. Es recomendable realizar este proceso sistemáticamente para evitar errores de interpretación y de olvido a través de un “checklist” como podría ser el formato propuesto para los ensayos clínicos (Anexo N°3) o un sistema de puntuación (Cuadro N° 8 y N°9). - 47 - Manual de Selección de Medicamentos METANÁLISIS A diferencia del metanálisis puramente cuantitativo, empleado inicialmente, en la actualidad se le considera como una revisión sistemática que utiliza métodos cuantitativos y cualitativos, explícitamente descritos para evitar sesgos y que integra de manera sintética los resultados derivados de varios ensayos clínicos independientes y combinables . La mayoría de los metanálisis plantean el resultado que produce un tratamiento de una manera global, basado en la mejor evidencia disponible. A diferencia de las revisiones tradicionales (narrativas) y de la simple opinión de expertos, nos proporciona un resumen más objetivo y cuantitativo de la evidencia con instrumentos estadísticos que pueden, además, explicar la heterogeneidad que existe entre los resultados de los ensayos clínicos individuales. Utilidad del metanálisis a) Permite sintetizar los resultados de la mejor información científica disponible, ofreciendo un análisis crítico de los estudios clínicos. Con frecuencia plantea nuevas hipótesis para ser investigadas e identifica los vacíos existentes. b) Busca una respuesta ante un problema relevante que no ha podido ser resuelto por los estudios clínicos de manera individual. c) Mejora la precisión estadística del resultado clínico y proporciona resultados estadísticos confiables, principalmente cuando los estudios individuales no tienen un tamaño suficiente. A diferencia de los estudios clínicos, para los que se han establecido estándares para su realización en forma confiable, las normas para el diseño, análisis e interpretación de los metanálisis aún se vienen desarrollando. (Cuadro N° 10) Para que un metanálisis brinde una información confiable debe cumplir con los mismos estándares cualitativos y cuantitativos de un ensayo clínico grande bien diseñado, es decir, se debe seguir los pasos clásicos de planteamiento del problema, recolección y análisis de los datos y el reporte de los resultados. Se debe tener en cuenta el importante lugar que ocupa el metanálisis en los esquemas de calificación de los tratamientos recomendados en las guías prácticas clínicas basadas en la evidencia (Cuadro N° 1 y N° 2). Para la realización de un metanálisis de calidad se recomienda observar aspectos cualitativos, como los siguientes: a) El desarrollo de un protocolo detallado antes de iniciar el estudio, que formule el problema clínico y los objetivos específicos, definiendo las características de la población, para de esta manera poder identificar los ensayos que deben incluirse y también los subgrupos de interés a evaluar, las pautas de tratamiento y los datos que deben analizarse. b) Idealmente, debieran incluirse únicamente los estudios estrictamente aleatorios de relevancia y calidad metodológica. c) Basar las conclusiones en la información completa, es decir, considerando todos los objetivos importantes, la inclusión y seguimiento de todos los pacientes o análisis por intención a tratar, evaluación de todos los estudios incluyendo los no publicados e indicar el método utilizado para la búsqueda de la información. d) Es necesario contar con un registro estandarizado para la recolección de los datos y la evaluación de la calidad de los estudios; además, es preferible que sea realizado por dos observadores independientes, con el enmascaramiento de los nombres de los autores e institución y formato que impida reconocer la revista donde fue publicidad y del financiamiento. Posteriormente son confrontados con la finalidad de disminuir los sesgos. - 48 - Manual de Selección de Medicamentos También debe considerarse algunos aspectos cuantitativos: a) Cálculo de la cantidad óptima de información (análogo al cálculo del tamaño de la muestra en los ensayos individuales). b) Límites del monitoreo para valorar acumulativamente las evidencias a medida que se publiquen nuevos estudios, con actualizaciones periódicas que podrían hacer variar los resultados. c) Utilizar métodos estadísticos válidos para combinar los datos. Comentaremos algunos detalles al respecto. Cuando los estudios combinados muestran un diseño homogéneo para responder a la misma pregunta en poblaciones similares se utiliza un modelo de efectos fijos, el cual parte del principio que los efectos del tratamiento varían entre los diversos estudios únicamente por el error aleatorio. Para evaluar la homogeneidad (características demográficas y de la enfermedad, regímenes de tratamiento, método de seguimiento, análisis de los resultados) se utiliza la prueba de 2 heterogeneidad basada en la distribución de χ . Sin embargo una limitación de esta prueba es que carece de poder estadístico, con la posibilidad de fracaso en rechazar la hipótesis nula de resultados homogéneos, a pesar que puedan existir diferencias sustanciales entre los estudios. También se pueden utilizar presentaciones gráficas para observar los resultados de cada estudio y en forma combinada usando odds ratios (OR, tiene un significado parecido al RR), con sus intervalos de confianza respectivos. Cuando se encuentra heterogeneidad entre los estudios, se puede optar entre no efectuar, por el momento, el metanálisis o evaluar la posibilidad de utilizar un modelo de efectos aleatorios, que parte del supuesto que no existe un efecto único “verdadero”, sino que cada estudio tiene su efecto “verdadero” y que todos derivan de una población de “varias verdades” con una distribución normal. Para explicar por que existe heterogeneidad se trata de buscar la respuesta en las variables independientes mediante un análisis de regresión que a diferencia de los ensayos clínicos en que la unidad de observación es el paciente individual, en los metanálisis es cada estudio o cada subgrupo, lo cual ayuda a formular nuevas hipótesis. Otra manera sería utilizar el análisis de datos detallados de los pacientes individualmente (análisis multivariable / multidimensional) para lo cual se requiere contar con información proporcionada directamente de los investigadores de los estudios originales. La heterogeneidad estadística en lugar de ser considerada una barrera, debería ser considerada como una realidad que puede ayudarnos a entender la heterogeneidad clínica y biológica. Los análisis de sensibilidad pueden darle robustez a los resultados del metanálisis. En este caso, se modifica la manera como se realiza la revisión, luego se observa si ocurren o no cambios significativos en los nuevos resultados; por ejemplo, cambiando los criterios de inclusión/exclusión; incluyendo ensayos de baja calidad metodológica, ambiguos o los estudios no publicados. Por ejemplo: Observar si se modifica sustancialmente el efecto global y su IC95% al excluir del metanálisis, algunos estudios de calidad menor que demuestran separadamente más beneficio que los estudios de mayor calidad. Utilizar diferentes enfoques estadísticos para el análisis de los datos; por ejemplo, detectando si existe o no una diferencia importante al evaluar el efecto combinado calculado por el modelo de efectos fijos y el modelo de efectos aleatorios, lo que caracteriza a los estudios marcadamente heterogéneos. La interpretación clínica se basa en la calidad de la información disponible. Al igual que en los ensayos clínicos, se calcula la RRR y NNTB con sus respectivos IC 95% cuyos resultados dependerán esencialmente del número y cantidad de estudios que incluyan pacientes con riesgo bajo, intermedio o alto. - 49 - Manual de Selección de Medicamentos La respuesta al problema planteado en un metanálisis suele depender de los estudios efectuados, siendo muchas veces no concluyente e incluso puede generar, como ya mencionamos, nuevas interrogantes y plantear nuevas hipótesis. Cuando un metanálisis trata de responder varias preguntas, menos será la certeza de las respuestas. Estudios clínicos con resultados negativos pueden no haberse publicado y ocasionar un sesgo. La sospecha de sesgo de publicación puede ser identificado al estratificar el análisis de acuerdo al tamaño del estudio, considerando que el menor efecto globalmente encontrado puede reportarse como significativo en los estudios grandes, al excluirse del análisis total los estudios pequeños. La posibilidad que exista este sesgo de publicación puede ser detectado de manera práctica mediante técnicas gráficas. Si el metanálisis incluye únicamente ensayos pequeños se tiene la posibilidad de sobrevalorar los efectos del tratamiento. Se utilizan métodos para otorgarle a los resultados de los estudios pequeños un promedio ponderado menor en relación a los estudios más grandes, dependiendo también de su calidad. En la mayoría de los casos, el metanálisis aún representa un proceso retrospectivo y, por lo tanto, está sujeta a muchas limitaciones. Deben fomentarse los metanálisis prospectivos y realizar estudios nuevos teniendo en cuenta la necesidad de ampliar los metanálisis adicionando varios estudios con características similares. Los metanálisis prospectivos, como lo propone la Colaboración Cochrane, intentan dar mayor homogeneidad a los estudios y evitar los sesgos de publicación mediante el uso de registro de los estudios que incluyan un tamaño de muestra grande. Al igual que los estudios clínicos, los metanálisis nos informan sobre los efectos globales en la población pero no indican como tratar paciente individualmente. Sin embargo, debe ser el objetivo final del médico responsable del tratamiento, obtener a través de ellos, el conocimiento de la mejor forma de tratar al paciente en particular. - 50 - Manual de Selección de Medicamentos CUADRO N° 1: Categorías y niveles de las recomendaciones para el tratamiento utilizadas en las guías prácticas clínicas basadas en la evidencia científica. CATEGORÍA A NIVEL I (A - I) NIVEL II (A - II) NIVEL III (A - III) Ensayos clínicos controlados randomizados, adecuadamente diseñados de gran tamaño o metanálisis. Ensayos clínicos controlados randomizados bien conducidos pero de Pequeño tamaño. Estudios de cohortes bien diseñados. (B - IV) (B - V) (B - VI) Estudios caso-control bien diseñados. Estudios no controlados, no bien diseñados. Evidencia conflictiva que tiende a favor de la recomendación (C - VII) Opinión de expertos. Consenso de un grupo de expertos basado en la Experiencia clínica individual de sus miembros y en la escasez de Soporte de literatura de calidad CATEGORÍA B NIVEL IV NIVEL V NIVEL VI CATEGORÍA C NIVEL VII Extraído de ASHP Therapeutic Guidelines on Antimicrobial Prophylaxys in Surgery y citado “Manual de Selección de Medicamentos Esenciales: Principios para una selección racional de medicamentos” de la Dirección General de Medicamentos, Insumos y Drogas, 2001. - 51 - Manual de Selección de Medicamentos CUADRO N° 2 Valoración de las recomendaciones para el tratamiento utilizada en las guías prácticas clínicas basadas en la evidencia científica GRADO DE RECOMENDACIÓN A A1 Ensayos clínicos aleatorizados o metanálisis, sin heterogeneidad; o 1 ensayo clínico aleatorizado. a Resultado concluyente entre beneficios y riesgos. A 2 Ensayos clínicos aleatorizados o metanálisis, sin heterogeneidad; o 1 ensayo clínico aletorizado. Resultado dudoso entre beneficios y riesgos. b GRADO DE RECOMENDACIÓN B B 1 Ensayos clínicos aleatorizados o metanálisis, con heterogeneidad Resultado concluyente entre beneficios y riesgos. B 2 Ensayos clínicos aleatorizados o metanálisis, con hetoregeneidad. Resultado dudoso entre beneficios y riesgos. c GRADO DE RECOMENDACIÓN C C 1 Estudios observacionales. Resultado concluyente entre beneficios y riesgos. C 2 Estudios observacionales. Resultado dudoso entre beneficios y riesgos. RECOMENDACIÓN A1yB1 A2yB2 C1yC2 FUERTE INTERMEDIA DEBIL a A favor (positivo) o en contra del tratamiento. Cuando los resultados del tratamiento de varios estudios clínicos aleatorizados difieren ampliamente de forma inexplicable. Por ejemplo, cuando la diferencia entre dos valores de la reducción del riesgo relativo de los dos estudios más dispares es mayor al 20%, la diferencia entre los límites de los intervalos de confianza entre los dos estudios más dispares es mayor del 5%. c Estudios de cohorte y series de casos. También se incluyen las recomendaciones que pueden ser extrapoladas de los estudios clínicos aleatorizados para un subgrupo de pacientes con características importantes que no han sido estudiados de manera independiente. b Extraído de Guyatt GH y de Hayward R y citado “Manual de Selección de Medicamentos Esenciales: Principios para una selección racional de medicamentos” de la Dirección General de Medicamentos, Insumos y Drogas, 2001. - 52 - Manual de Selección de Medicamentos CUADRO N° 3 Niveles de evidencia para comparar la eficacia de fármacos de la misma clase terapéutica NIVEL DE EVIDENCIA 1 a Estudio clínico aleatorizado validado del fármaco de interés versus fármaco(s) de la misma b clase, para evaluar el efecto clínico principal . NIVEL DE EVIDENCIA 2 Estudio clínico aleatorizado validado del fármaco de interés versus fármaco(s) de la misma c clase, para evaluar el efecto sustituto que cuente con validez previa . Comparaciones indirectas o referenciales entre el fármaco de interés y fármaco(s) de la misma clase a través de diferentes estudios clínicos aleatorizados que comparan al fármaco de interés o fármaco (s) de la misma clase contra placebo, para evaluar el efecto clínico importante o el efecto sustituto previamente validado. NIVEL DE EVIDENCIA 3 Comparaciones indirectas o referenciales entre el fármaco de interés y fármaco (s) de la misma clase a través de análisis de subgrupos d diferentes estudios clínicos aleatorizados que comparan al fármaco de interés o fármaco (s) de la misma clase contra placebo, para d evaluar el efecto clínico importante . a) b) c) d) Se refiere a fármacos que poseen una estructura química y mecanismo de acción similares. Por lo menos un fármaco de la clase terapéutica debe haber demostrado impacto clínico importante en relación a placebo en un estudio clínico aleatorizado previo, en una población similar. Para las comparaciones debe tenerse presente las dosis utilizadas. Generalmente resultados clínicos a largo plazo, Ejemplo: infarto cardíaco, accidente cerebrovascular, muerte. Cuando se ha demostrado una asociación correlación fuerte, independiente y consistente con el resultado clínico importante a través de otros estudios. Ejemplo: reducción de LDL colesterol, reducción de la presión arterial. Ejemplos: estudios de cohortes, estudios caso-control o base de datos administrativos. Tomado de McAlsiter FA, et al. y citado “Manual de Selección de Medicamentos Esenciales: Principios para una selección racional de medicamentos” de la Dirección General de Medicamentos, Insumos y Drogas, 2001. - 53 - Manual de Selección de Medicamentos CUADRO N° 4 Niveles de evidencia para comparar la seguridad de fármacos de la misma clase terapéutica NIVELES DE EVIDENCIA 1: ESTUDIO CLÍNICO ALEATORIZADO Ventaja: Único diseño que permite la detección de efectos adversos cuando el efecto adverso es similar al evento que el tratamiento está tratando de prevenir. Desventaja que amenaza su validez: Su bajo potencial para detectar efectos adversos (tamaño de la muestra), tiempo de seguimiento no prolongado. NIVELES DE EVIDENCIA 2: ESTUDIO DE COHORTES Ventaja: La recolección prospectiva de los datos, tener cohorte definida. Desventaja que amenaza su validez: Su dependencia crítica al seguimiento, clasificación y mediciones exactas. NIVELES DE EVIDENCIA 3: ESTUDIO CASO – CONTROL Ventaja: El bajo costo y la rapidez de su ejecución. Desventaja que amenaza su validez: La selección y sesgo por recuerdo; la relación temporal puede ser dudosa. NIVELES DE EVIDENCIA 4: ESTUDIO DE VIGILANCIA POST–COMERCIALIZACIÓN (FASE IV) Ventaja: Si es suficientemente grande, puede detectar raros pero importantes efectos adversos. Desventaja que amenaza su validez: No tiene grupo control; su dependencia crítica al seguimiento, clasificación y mediciones exactas. NIVEL DE EVIDENCIA 5: SERIE DE CASOS Ventaja: El bajo costo y la rapidez de su ejecución. Desventaja que amenaza su validez: Su tamaño de muestra pequeña, el sesgo de selección; no tiene grupo control. NIVEL DE EVIDENCIA 6: INFORME(S) DE CASOS Ventaja: El costo y la rapidez para su ejecución. Desventaja que amenaza su validez: Su tamaño de muestra pequeña (<10 casos), el sesgo de selección; no tiene grupo control. Tomado de McAlister FA, et al y citado “Manual de Selección de Medicamentos Esenciales: Principios para una selección racional de medicamentos” de la Dirección General de Medicamentos, Insumos y Drogas, 2001. - 54 - Manual de Selección de Medicamentos CUADRO N° 5 Resumen sistematizado de un reporte de estudio clinico Objetivo Diseño Lugar Pacientes Intervención Desenlaces a medir Resultados Principales Conclusiones CUADRO N° 6 Tabla para calcular el número necesario a tratar para lograr un beneficio considerando el riesgo de “base” y la reducción del riesgo relativo Reducción del riesgo relativo obtenido por el tratamiento de interés (RRR%) 90 80 70 Riesgo de “base” RAc (%) 60 50 40 30 20 10 5 2 Número necesario a tratar para lograr un beneficio (NNTB)*: 0.9 0.8 0.7 0.6 0.5 0.4 0.3 0.2 90 80 70 60 50 40 30 20 1 1 2 2 2 3 4 6 1 2 2 2 3 3 4 6 2 2 2 2 3 4 5 7 2 2 2 3 3 4 6 8 2 3 3 3 4 5 7 10 3 3 4 4 5 6 8 13 4 4 5 6 7 8 11 17 6 6 7 8 10 13 17 25 11 13 14 17 20 25 33 50 22 25 29 33 40 50 67 100 56 63 71 83 100 125 167 250 0.1 0.05 0.01 0.005 0.001 10 5 1 0.5 0.1 11 22 111 222 1111 13 25 125 250 1250 14 29 143 286 1429 17 33 167 333 1667 20 40 200 400 2000 25 50 250 500 2500 33 67 333 667 3333 50 100 500 1000 5000 100 200 1000 2000 10000 200 400 2000 4000 20000 500 1000 5000 10000 50000 *NNTB= 100 / (RRR% x RAc). Al tomar los valores de los límites superior e inferior del IC 95% para el RRR podemos calcular aproximadamente el IC 95% del NNT. Extraído de: “Manual de Selección de Medicamentos Esenciales: Principios para una selección racional de medicamentos” de la Dirección General de Medicamentos, Insumos y Drogas, 2001. - 55 - Manual de Selección de Medicamentos CUADRO N° 7 PASOS RÁPIDOS PARA EL CÁLCULO DEL NÚMERO NECESARIO A TRATAR PARA LOGRAR UN BENEFICIO (NNTB) Plantilla de preguntas Respuesta (Ejemplo ficticio) A ¿Cuál es el fármaco de interés y su dosificación? Warfarina entre 2-3. B ¿Qué cuadro clínico se tratará? Fibrilación enfermedad coronaria. C ¿Cuál es el resultado a medir y en qué lapso de tiempo? Presencia de ACV no hemorrágico, seguimiento 1 año. D ¿Cuántos pacientes formaron el grupo de intervención? 8000 E ¿En cuántos pacientes del grupo de intervención se encontró el resultado? 600 F Expresarlo en porcentaje (100xE/D) y como proporción (E/D) 7.5% ó 0.075 G ¿Qué se utilizó como tratamiento control? Placebo H ¿Cuántos pacientes formaron el grupo de control? 8000 I ¿En cuántos pacientes del grupo de control se encontró el resultado? 800 J Expresarlo en porcentaje (100 x I/H) y como proporción (I/H) 10% ó 0.1 NNTB 1 = ----------------J - F 1 ---------------------0.1 - 0.075 dosis/d para auricular valvular INR sin o 40 pacientes Extraído de: “Manual de Selección de Medicamentos Esenciales: Principios para una selección racional de medicamentos” de la Dirección General de Medicamentos, Insumos y Drogas, 2001. - 56 - Manual de Selección de Medicamentos CUADRO N° 8.A. ANALISIS CRITICO DE UN ESTUDIO CLINICO* I.- ¿Son los resultados del estudio válidos? A.- Guías primarias: 1.- ¿Fueron asignados los pacientes, a los distintos tratamientos, en forma randomizada? Si No No se puede decir 2.- ¿Todos los pacientes que entraron al estudio, fueron debidamente contabilizados y caracterizados al final del estudio? Si No No se puede decir a)¿Fue el seguimiento completo? Si No No se puede decir b) ¿Fueron los pacientes analizados en el grupo en el cual fueron randomizados? Si No No se puede decir B.- Guías secundarias 3.- ¿Estuvieron los pacientes, trabajadores de la salud e investigadores, “ciegos” al tratamiento? Si No No se puede decir 4.- ¿Fueron los grupos similares al iniciarse el estudio? Si No No se puede decir 5.- ¿Aparte de la intervención experimental, fueron los grupos tratados de la misma manera? Si No No se puede decir II.- ¿Cuáles son los resultados? 1.- ¿Cuan grande fue el efecto del tratamiento ( promedios, medianas, RR, OR, diferencias de promedio.? III.- ¿Me ayudaron los resultados en el cuidado de mis pacientes? 1.- ¿Pueden los resultados, ser aplicados al cuidado de mis pacientes? Si No No se puede decir 2.- ¿Se consideraron los resultados clinicamente importantes? Si No No se puede decir 3.- ¿Sobrepasan los probables beneficios del tratamiento a los riesgos y costos potenciales? Si No No se puede decir * Guyatt G. et al. For the Evidence-Based Medicine Working Group.Users’ Guides to the Medical Literature. II How to use an Article About Therapy or Prevention. Jama January, 5. 1994 Vol 271.N°1 - 57 - Manual de Selección de Medicamentos CUADRO N° 8.B. Sistema de puntuación para evaluar la calidad metodológica de los estudios con fármacos y publicados en la literatura biomédica (Los números en paréntesis son los puntos otorgados a cada respuesta) Título del artículo: ____________________________________________________________ Autor (es):__________________________________________________________________ Fuente:____________________________________________________________________ 1. Diseño del estudio (marque sólo un casillero): a) Ensayo clínico controlado aleatorizado b) Ensayo clínico controlado no aleatorizado c) Estudio caso control o de cohortes d) Estudio experimental no controlado e) Reporte de casos o serie de casos f) Ninguno de los mencionados, Describirlo:______________________________________________ (15) (12) (9) (6) (3) (3) 2. ¿Cuál es la pregunta que plantea el objetivo del estudio? (escriba en el espacio en blanco). ____________________________________________________________________________ ____________________________________________________________________________ ____________________________________________________________________________ ____________________________________________________________________________ ____________________________________________________________________________ ____________________________________________________________________________ ____________________________________________________________________________ Conteste todas las preguntas (N°s 3 al 24). Por cada pregunta marque sólo un casillero. (S: si (2), P: parcial (1), N/A: no o no aplicable (0)) 3. ¿Fue la pregunta del estudio suficientemente clara? 4. ¿Fue apropiado el diseño del estudio del estudio para responder la pregunta? 5. ¿Fueron especificados los criterios de inclusión y exclusión?. (Para estudio de casos: 1 (c) o 1 (e), marcar N/A 6. Sólo para estudios de casos: ¿fueron las características de las personas adecuadamente reportadas? (Para estudios que no son de casos: 1(a), 1(b), 1(d), marcar N/A). 7. ¿Fueron apropiadas las personas del estudio para dar respuesta a la pregunta? 8. ¿Fueron apropiadas las personas del grupo de control? (Si no hubo grupo de control marca N/A). 9. ¿Fueron las personas seleccionadas aleatoriamente desde la población objetivo? 10. Si las personas fueron seleccionadas aleatoriamente, ¿fue el método de selección aleatoria suficientemente descrito? (Si no hubo selección aleatoria, marcar N/A). 11. Si las personas fueron asignadas aleatoriamente a los grupos de tratamiento, ¿fue el método de asignación aleatoria suficientemente descrito? (Si no hubo asignación aleatoria, marcar N/A). 12. Si el enmascaramiento de los investigadores para efectos de la intervención fue posible, ¿fue este reportado? (Si no fue posible, marcar N/A). 13. Si el enmascaramiento de las personas para efectos de la intervención fue posible. ¿fue éste reportado? (Si no fue posible, marcar N/A) 14. ¿Fueron los factores controlados por otros métodos diferentes al enmascaramiento? 15. ¿Fueron los factores de confusión identificables, controlados por el diseño de estudio? (Si no hay factores de confusión conocidos, marcas N/A) - 58 - Manual de Selección de Medicamentos 16. ¿Fueron los factores de confusión identificables, controlados por el análisis? (Si no hay factores de confusión conocidos, marcar N/A) 17. ¿Fue el cálculo del tamaño de la muestra fundamentando antes del estudio? 18. ¿Fueron reportados los análisis de potencia después de haber terminado el estudio (post hoc) o fueron reportados los intervalos de confianza para los resultados estadísticamente no significativos? 19. ¿Fueron los análisis estadísticos apropiados? 20. ¿Fueron las pruebas estadísticas especificadas? 21. ¿Fueron reportados los valores exactos de P ó los intervalos de confianza para cada prueba? 22. ¿Hubo personas que abandonaron el estudio y fueron reportados los motivos? 23. Para las personas que complementaron el estudio, ¿fueron los resultados reportados en su totalidad? 24. Los hallazgos fundamentan las conclusiones? Suma de puntos: ________________ Comentarios: Puntaje final (Σ P x 100/59): (mínimo: o; máximo: 100) ____________________________________ Revisor: Tomado de Cho MK, Bero La y y citado “Manual de Selección de Medicamentos Esenciales: Principios para una selección racional de medicamentos” de la Dirección General de Medicamentos, Insumos y Drogas, 2001. - 59 - Manual de Selección de Medicamentos CUADRO N° 8.C.Análisis Crítico de una Evaluación Económica* 1) ¿Existe una pregunta bien definida? SI NO No Aplicable (NA) 2) ¿Se describen adecuadamente las alternativas comparadas? SI NO No Aplicable (NA) 3) ¿Ha sido bien establecida la efectividad de las intervenciones? SI NO No Aplicable (NA) 4) ¿Se han identificado todos los costes y efectos relevantes de cada alternativa identificada? SI NO No Aplicable (NA) 5) ¿Se han medido los costes y los efectos de las intervenciones en unidades adecuadas? SI NO No Aplicable (NA) 6) ¿Son realistas los costes y los efectos de las alternativas? SI NO No Aplicable (NA) 7) ¿Se realiza un ajuste temporal de los costes y los efectos? SI NO No Aplicable (NA) 8) ¿Se realiza un análisis incremental de los costes y efectos evaluados? SI NO No Aplicable (NA) 9) ¿Se realiza un análisis de sensibilidad? SI NO No Aplicable (NA) 10) ¿Es adecuada la presentación y discusión de los resultados del estudio y es posible su aplicación? SI NO No Aplicable (NA) * Drummond M, Stoddart GL & Torrance GW. - 60 - Manual de Selección de Medicamentos CUADRO N° 9 Sistema de puntuación para evaluar la relevancia de los estudios clínicos con fármacos y publicados en la literatura biomédica (Los números en paréntesis son los puntos otorgados a cada respuesta) Conteste todas las preguntas (1 al 7). Por cada pregunta marque sólo un casillero. (2) (1) (0) (S: si, P: parcial, N: no) S P N 1. ¿Fueron importantes los resultados terapéuticos medidos en el estudio? 2. ¿Fueron las personas del estudio representativas de los pacientes quienes podrían realmente recibir el medicamento? (Si la información resulta insuficiente, marca N) 3. ¿Fue el grupo de comparación (control) clínicamente significativo? (Si no hay grupo control, marcar N) 4. ¿Fue el efecto terapéutico clínicamente significativo? 5. ¿Fueron los efectos adversos adecuadamente medidos? 6. ¿Hubo aprobación por un consejo revisor institucional explícitamente informado? 7. De acuerdo a lo mencionado en el artículo ¿fue ético el estudio? Suma de puntos: Comentarios: ________________ Puntaje final (Σ P x 100/14): (mínimo: o; máximo: 100) ____________________________________ Revisor: Tomado de Cho MK, Bero LA y citado “Manual de Selección de Medicamentos Esenciales: Principios para una selección racional de medicamentos” de la Dirección General de Medicamentos, Insumos y Drogas, 2001. - 61 - Manual de Selección de Medicamentos CUADRO N° 10 Evaluación de un metanálisis Validez de los resultados ¿El problema clínico fue claramente formulado? ¿Fueron adecuados los criterios de inclusión? ¿Faltó revisar algún estudio relevante? ¿Fueron adecuadamente validados los estudios incluidos? ¿Fueron evaluados los estudios por más de un revisor de manera independiente y los resultados de la evaluación reproducibles? ¿Fueron los resultados de los estudios homogéneos? ¿Cuánto de sensible son los resultados a los cambios en la manera como se realiza la revisión? Interpretación de los resultados ¿Fueron las conclusiones mencionadas consecuencias de la evidencia revisada? ¿Fueron las recomendaciones relacionadas al grado de evidencia? ¿Fueron interpretados cautelosamente los análisis de subgrupos? Considerar que no es lo mismo decir “no hay evidencia del efecto” que “existe evidencia que no hay efecto”. Tomado de Oxman AD y citado “Manual de Selección de Medicamentos Esenciales: Principios para una selección racional de medicamentos” de la Dirección General de Medicamentos, Insumos y Drogas, 2001. - 62 - Manual de Selección de Medicamentos PRINCIPIOS BÁSICOS DEL ANÁLISIS DEL FACTOR COSTO-BENEFICIO EN LA SELECCIÓN DE MEDICAMENTOS La farmacoeconomía es un concepto relativamente reciente que se refiere a “la aplicación de la teoría económica a la farmacoterapia”, que nace en los países industrializados a fines de los 80. En muchos países, aproximadamente el 70% del gasto en medicamentos es pagado directamente por el consumidor. Debido a esto no se trata de elegir entre una gama de terapias cuál es la más apropiada y eficaz, sino simplemente de poder acceder o no al único recurso disponible. En el campo de salud, algunas personas toman decisiones cuyos efectos recaen en parte sobre otras personas. Por ejemplo, los médicos que trabajan en un sistema sanitario público no absorben las consecuencias económicas de las prescripciones de medicamentos que ellos efectúan. En consecuencia, es posible que se prescriba un tratamiento atendiendo sólo al beneficio que puede aportar al paciente que lo recibe, sin preocuparse del factor costo. Su decisión, sin embargo, puede afectar al conjunto de la sociedad. Si se prescriben medicamentos innecesariamente caros, el resultado será que otros tendrán que pagarlos en forma de un menor consumo de otro tipo de productos o servicios necesarios, lo que implica una reducción del bienestar social. Este concepto ha sido recogido por la Organización Mundial de la Salud cuando al definir el Uso Racional de los Medicamentos, además de las consideraciones clínicas para el uso adecuado de un medicamento, señala que éste debe hacerse al menor costo para el paciente y su comunidad, pero con los mejores resultados posibles. Actualmente, es habitual encontrar estudios en lo que se incluye diversos tipos de evaluación económica de medicamentos, así como también datos de índole económico en artículos relativos a medicamentos, especialmente aquellos recientemente registrados. Existen numerosos estudios en los que se intenta dilucidar si un nuevo medicamento resultará más costoso o más económico, lo que podría ser de utilidad en la selección de los productos farmacéuticos. La farmacoeconomía es una disciplina que aplica los conceptos de la evaluación económica en la selección de las terapias, busca demostrar con datos objetivos la mejor relación entre los costos y los resultados, de manera que los recursos disponibles se utilicen de manera eficiente. Considera en su evaluación todos los costos asociados a cada una de las alternativas, costos directamente relacionados con la terapia relacionados (insumos médicos, días de hospitalización, requerimiento de ayuda diagnóstica entre otros), y los costos indirectos. Se consideran resultados clónicos, económicos y humanísticos. Es importante indicar que es necesario tener una actitud crítica ante un estudio farmacoecónomico, a fin de determinar la calidad del mismo antes de tomarlo como referencia para una decisión. Esto, debido a que los distintos métodos de análisis económicos necesitan una estandarización mínima que permita comparaciones y relaciones correctas. Así, la evaluación económica constituye un instrumento útil para la persona quien decide en la materia y que quiere maximizar la eficiencia de sus decisiones. Sin embargo, los estudios no deben utilizarse de manera mecánica, ya que no sustituyen a la reflexión, el buen criterio ni al sentido común. Si se emplean correctamente y se califican de manera apropiada, estos estudios pueden proporcionar una información importante para el proceso de toma de decisiones. En la actualidad existen diferentes tipos de análisis farmacoeconómicos: Análisis de Costo-Minimización (ACM) Este tipo de estudio resulta adecuado cuando los resultados clínicos de un fármaco ya conocido y del producto de comparación son los mismos, existiendo evidencia de que los resultados terapéuticos son equivalentes. En este caso, la decisión gira alrededor de los costos. - 63 - Manual de Selección de Medicamentos Análisis Costo – Efectividad (ACE) Es aplicable cuando los efectos de los tratamientos farmacológicos comparados tienen un nivel de efectividad distinto, pero comparten los mismos objetivos terapéuticos y, por lo tanto, pueden medirse con la misma unidad de efectividad. En los ACE, por ejemplo, se puede comparar en el tratamiento de la hipertensión arterial, tres medicamentos distintos como diuréticos, betabloqueadores e inhibidores de enzima convertidota de angiotensina. La medida común puede ser el número de hipertensos controlados o la reducción (en mm. Hg) de la presión arterial o el número de acontecimientos cardiovasculares evitados. Análisis Costo – Utilidad (ACU) Compara los costos de dos opciones de tratamiento distintas, en relación a su utilidad, considerando ésta última como el grado de satisfacción del paciente con el resultado obtenido con su tratamiento. Los resultados pueden ser medidos en años de vida ajustados por calidad de vida (AVAC). Klarman en 1968 en un análisis de costo-utilidad de las alternativas de tratamiento para la insuficiencia renal crónica, planteó la hipótesis arbitraria que 1.25 años de vida ganados por un paciente en diálisis equivalía a 1 año de vida ganado de un paciente trasplantando, para reflejar la mayor calidad de vida que se consigue con el trasplante renal. Análisis Costo – Beneficio (ACB) Valora tanto los costos como los efectos de las alternativas de tratamiento en términos monetarios. Tiene la ventaja que permite comparar opciones cuyos resultados se miden en diferentes unidades, sin embargo cada vez se le utiliza menos por la dificultad de transformar unidades de salud en unidades monetarias. El análisis de factor costo durante el proceso técnico de evaluación de un medicamento para su incorporación o no en un formulario o arsenal farmacológico, debe ser considerado como útil y necesario. Por tal motivo, los comités de farmacia y terapéutica, deben tomarlo en consideración para decidir, por ejemplo, si el beneficio adicional de un nuevo fármaco, en comparación con la alternativa existente en el formulario o arsenal, justifica un incremento del costo del tratamiento. Este análisis tiene que considerar no sólo el costo total del medicamento, sino también los costos relacionados (material médico, días de hospitalización, requerimiento de ayuda diagnóstica entre otros). A continuación se presentan algunos ejemplos de evaluación económica con medicamentos. CASO N° 1 Análisis costo – efectividad entre metronidazol, tinidazol y secnidazol en el tratamiento de la giardiasis Varios ensayos clínicos controlados han comparado la eficacia del metronidazol, tinidazol y secnidazol en el tratamiento de giardiasis en adultos. En ellos se ha demostrado que una dosis única de 2 gramos de secnidazol produce una cura del 92% de los casos tratados, mientras que un tratamiento con metronidazol a razón de 250 mg c/ 8 h por 5 días produce una cura del 82% de los pacientes y el tinidazol a dosis única de 2 g produce una cura del 89% de pacientes. Los costos* (aproximados) son: Secnidazol comprimido por 500 mg: USD $ 4 Tinidazol comprimido 1 g: USD $ 3.5 Metronidazol comprimido por 250 mg: USD $ 0.25 * Los valores son solo para fines del ejemplo. - 64 - Manual de Selección de Medicamentos La efectividad (curaciones logradas) son las siguientes: Secnidazol: 92% Tinidazol: 89% Metronidazol: 82% El objeto del análisis es efectuar un estudio de costo-efectividad entre los tres tratamientos. Pasos para la evaluación económica Paso 1: Cálculo del costo de cada tratamiento en dólares. Dosis Días de tratamiento Costo por tratamiento (dólares) Secnidazol Tinidazol Metronidazol 2g 2g 250 mg c/8h 1 1 5 USD $ 16 USD $ 7 USD $ 3.75 Paso 2: Cálculo de la variación del costo de los tratamientos con secnidazol y tinidazol en comparación con el tratamiento con metronidazol en dólares. a) Variación del costo de secnidazol respecto a metronidazol: Costo de secnidazol – Costo de metronidazol USD $ 16 - USD $ 3.75 = USD $ 12.25 b) Variación del costo del tinidazol respecto a metronidazol: Costo de tinidazol – Costo de metronidazol USD $ 7 - USD $ 3.75 = USD $ 3.25 Paso 3: Cálculo de la variación de la efectividad (curaciones) de los tratamientos con secnidazol y tinidazol en comparación con metronidazol, en porcentajes. a) Variación de efectividad de secnidazol respecto a metronidazol. Efectividad de secnidazol – Efectividad de metronidazol 92% - 82% = 10% b) Variación de efectividad de tinidazol respecto a metronidazol: Efectividad de tinidazol – Efectividad de metronidazol 89% - 82% = 7% Paso 4: Aplicación del análisis incremental entre el costo del tratamiento con secnidazol y tinidazol en cuanto al tratamiento con metronidazol respecto a su efectividad (curaciones logradas). Es el cociente entre la variación del costo y la variación de la efectividad. a) Para el secnidazol se calcula de la siguiente manera: Variación de costo entre secnidazol y metronidazol ------------------------------------------------------------------------ = Variación de efectividad entre secnidazol y metronidazol - 65 - USD $ 12.25 ----------------- = USD 122.5 10% Manual de Selección de Medicamentos b) Para el tinidazol se calcula de la siguiente manera: Variación de costo entre tinidazol y metronidazol USD $ 3.25 ------------------------------------------------------------------------- = ---------------- = USD $ 46.4 Variación de efectividad entre tinidazol y metronidazol 7% Paso 5: Interpretación, discusión y conclusiones. El análisis incremental muestra que cada curación adicional usando secnidazol para el tratamiento de giardiasis, tiene un costo de 122.5 dólares. Visto de otra manera, si se utiliza secnidazol, lo que se tiene que pagar por cada curación adicional es 122.5 dólares. Si estos recursos económicos se destinaran a tratar nuevos pacientes con metronidazol, se podría obtener la curación de 27 nuevos pacientes. Similarmente, el análisis incremental muestra que cada curación adicional usando tinidazol para el tratamiento de giardiasis, tiene un costo de 46.4 dolares. Visto de otra manera, si se utiliza tinidazol, lo que se tiene que pagar por cada curación adicional es 46.4 dólares. Si estos recursos económicos se determinaran a tratar nuevos pacientes con metronidazol, se podría obtener la curación de 10 nuevos pacientes. CASO N° 2 Análisis costo-efectividad entre cetirizina, loratadina y clorfenamina en el Tratamiento de rinitis alérgica y urticaria. Los estudios clínicos en adultos sin patologías asociadas demuestran una eficacia similar entre el empleo de dosis de cetirizina 10 mg/d, clorfenamina 4 mg c/8 h y loratadina 60 mg c/12 h en el tratamiento de afecciones frecuentes como rinitis alérgica y urticaria. Sin embargo, el efecto adverso somnolencia es diferente para cada medicamento y puede ser un criterio determinante para la inclusión o no de un nuevo antihistamínico a un petitorio o formulario de medicamentos. Los costos* son: Cetirizina comprimido por 10 mg: Loratadina comprimido por 10 mg: Clorfenamina comprimido por 4 mg: USD $ 2.12 USD $ 2.59 USD $ 0.14 * Los valores son solo para fines del ejemplo. La efectividad (respecto al efecto adverso somnolencia) es: Cetirizina: 11.6% Loratadina: 6.75% Clorfenamina: 40.5% Se debe efectuar un análisis costo-efectividad entre los 3 antihistamínicos para determinar cuáles son los costos comparativos entre los tratamientos y en cuanto a su efecto adverso somnolencia, considerando que el estándar actualmente utilizado es con clorfenamina. Pasos para la evaluación económica Para este ejercicio llamaremos costo al precio de los tratamientos y efectividad a la capacidad de producir pacientes sin somnolencia con los tratamientos. - 66 - Manual de Selección de Medicamentos Paso 1: Cálculo del costo diario de cada tratamiento en dólares. Paso 2: Cálculo comparativo porcentual entre el costo del tratamiento con cetirizina y loratadina respecto al tratamiento con clorfenamina (que tanto por ciento es más caro el tratamiento con cetirizina y loratadina respecto al tratamiento con clorfenamina). Paso 3: Cálculo de los pacientes que no presentarán somnolencia (%). Paso 4: Cálculo del costo efectividad medio de los 3 tratamientos. Es el cociente entre el costo y la efectividad de cada tratamiento (costo/efectividad), es decir se compara los costos y la efectividad de cada tratamiento (eficiencia media). Paso 5: Cálculo de la variación del costo de los tratamientos con cetirizina y loratadina en comparación con el tratamiento con clorfenamina en dólares. a) Variación del costo de la cetirizina respecto a la clorfenamina: Variación del costo = Costo de cetirizina - Costo de clorfenamina b) Variación del costo de la loratadina respecto a la clorfenamina: Variación del costo = Costo de loratadina - Costo de clorfenamina Paso 6: Cálculo de la variación de la efectividad (efecto somnolencia) de los tratamientos con cetirizina y loratadina en comparación con clorfenamina en porcentajes. a) Variación de efectividad de la cetirizina respecto a la clorfenamina: Variación de efectividad = Efectividad de cetirizina – Efectividad de clorfenamina b) Variación de efectividad de la loratadina respecto a la clorfenamina: Variación de efectividad = Efectividad de loratadina – Efectividad de clorfenamina Paso 7: Aplicación del análisis incremental entre el costo del tratamiento con cetirizina y loratadina en cuanto al tratamiento con clorfenamina y respecto al efecto adverso somnolencia. Es el cociente entre la variación del costo y la variación de la efectividad. a) Costo-efectividad incremental de cetirizina respecto de clorfenamina Costo-efectividad incremental = Variación de costo entre secnidazol y metronidazol ------------------------------------------------------------------------Variación de efectividad entre secnidazol y metronidazol - 67 - Manual de Selección de Medicamentos b) Costo-efectividad incremental de loratadina respeto de clorfenamina Costo-efectividad incremental = Variación de costo entre loratadina y clorfenamina ------------------------------------------------------------------------Variación de efectividad entre loratadina y clorfenamina Paso 8: Interpretación, discusión y conclusiones. Dosis Costo por día (dólares) Porcentaje Somnolencia Pacientes sin Somnolencia Costo-efectividad medio Variación de costos Respecto a clorfenamina (dólares) Variación de Somnolencia Respecto a clorfenamina Análisis costo-efectividad Incremental respecto A clorfenamina (dólares) Cetirizina Loratadina Clorfenamina 10 mg (1 Comprimido x 10mg) 10 mg (1 comprimido x 10 mg) 12 mg (3 comprimido x 4 mg) USD $ 2.12 USD $ 2.59 USD $ 0.42 504% 11.6% 616% 6.75% 100% 40.5% 88.4% 93.25% 59.5% 2.39 2.77 0.70 USD $ 1.7 USD $ 2.17 28.9% 33.75% USD $ 5.88 USD $ 6.42 Finalmente, si se realiza un análisis sectorizado de los resultados podremos concluir: 1. Análisis por factor costo: La Clorfenamina es la alternativa terapéutica de menor costo. 2. Análisis por factor efectividad: La Loratadina es la alternativa terapéutica de mejores resultados al presentar la menor incidencia de pacientes con somnolencia. 3. Análisis por factor Costo-Efectividad Medio: La alternativa con mejor relaciòn CostoEfectividad es la Clorfenamina. Lo anterior significa que por cada paciente sin somnolencia se debe gastar 0.5 dólares. 4. Análisis Incremental: Al no existir una alternativa dominante (mayor efectividad y menor costo) y considerando que Loratadina presenta mayor efectividad se calcula el costo efectividad incremental que significa cambiar Clorfenamina por Laratadina, La tabla muestra que el tratamiento con cetirizina o loratadina en comparación con clorfenamina, representa destinar aproximadamente 6 dólares (USD $ 5.88 con cetirizina y USD $ 6.42 con loratadina) por cada paciente adicional sin somnolencia que se logre. Si estos recursos económicos se destinaran a tratar nuevos pacientes con clorfenamina, se beneficiarían 14 nuevos pacientes. - 68 - Manual de Selección de Medicamentos Además, se debe considerar que el tratamiento antihistamínico a largo tiende a disminuir el efecto adverso somnolencia, y que para el tratamiento de rinitis y urticaria agudas (que demandan tratamiento por pocos días), este efecto adverso no perjudicaría grandemente la calidad de vida del paciente. - 69 - Manual de Selección de Medicamentos LOS NUEVOS MEDICAMENTOS En 1962 y a consecuencia de la tragedia ocurrida en los Estados Unidos por el uso de la talidomida en mujeres gestantes, se produjo una serie de reformas trascendentales en la regulación de medicamentos, las que fueron aplicadas por la Administración de Alimentos y Medicamentos (FDA). Se comenzó a exigir, a partir de ese año, investigaciones farmacológicas y toxicológicas en sistemas In Vitro y en animales antes de probar el nuevo producto en seres humanos; además de estudios clínicos para evaluar la eficacia y la seguridad de los medicamentos y se establecieron guías para el reporte de información sobre reacciones adversas. Se calcula que por cada 5.000 a 10.000 sustancias químicas aisladas o sintetizadas, solamente una de ellas será aprobada para su comercialización en el mercado norteamericano y que solamente alrededor del 10% de moléculas que son sometidas a los ensayos clínicos llegan finalmente a ser aprobadas para uso humano. Los estudios clínicos en seres humanos demoran de 2 a 10 años (promedio 5.6 años). En 1963 se estimó que el tiempo necesario para transferir una molécula nueva del laboratorio al mercado farmacéutico era aproximadamente 3 años, mientras que en 1985 debido a las modificaciones realizadas el tiempo se incrementó hasta 7 a 10 años. En realidad, todo este proceso de investigación supervisado por la FDA puede actualmente acelerarse dependiendo de la seguridad que ofrecen estos nuevos productos y de la necesidad de contar oportunamente, en un corto plazo, con cierto tipo de fármacos, otorgándose por tal motivo prioridad a las enfermedades que ocasionan una elevada mortalidad o que producen secuelas muy severas y que no cuentan con una alternativa terapéutica satisfactoria. Se estima que el costo del proceso de investigación y desarrollo de una nueva molécula en los Estados Unidos oscila entre 100 y 350 millones de dólares. Sin embargo, si se analiza los componentes de dicho gasto, se puede comprobar que el gasto relacionado con el desarrollo y la investigación representa un porcentaje relativamente bajo contrastando con el gasto en promoción y comercialización, que suele ser el doble al correspondiente a investigación y desarrollo. Valor terapéutico de los nuevos medicamentos: Entre 1975 y 1984 se desarrollaron en los Estados Unidos 508 medicamentos, de los cuales se reportó que 358 (70%) no representaron ningún progreso terapéutico, 115 (22%) se originaron de estructuras químicas ya conocidas y que brindaron un pequeño aporte terapéutico y sólo 35 (7%) fueron estructuras químicas nuevas y significaron un avance importante en terapéutica. En otro informe de la FDA, se reportó que entre 1981 y 1988 se introdujeron al mercado farmacéutico estadounidense 348 medicamentos nuevos; sin embargo, sólo un 3% representó una contribución importante en relación a los tratamientos ya existentes y el 84% constituyó poca o ninguna contribución. Igualmente, entre 1989 y 1993 la FDA aprobó 127 nuevas moléculas siendo la mayoría medicamentos considerados “me too” o “yo también”, es decir, de la misma clase terapéutica, con insignificantes modificaciones en su estructura química, tales como los bloqueadores del canal de calcio, inhibidores de la enzima convertidora de angiotensina, bloqueadores H, antiflamatorios no esteroideos, etc. Ello trae como resultado, una fuerte competencia entre las compañías farmacéuticas, con promociones exageradas para su venta, incremento de costos para el cuidado de la salud y finalmente, prescripciones inadecuadas. En el otro extremo se encuentran los denominados “medicamentos huérfanos”, medicamentos para enfermedades infrecuentes y, por consiguiente, de poco interés para la industria farmacéutica, que prefiere invertir en productos con alto potencial de venta. En esta categoría se han incluido también a fármacos que son necesarios para el tratamiento de enfermedades frecuentes de poblaciones de países pobres, con limitada capacidad adquisitiva. - 70 - Manual de Selección de Medicamentos El proceso de desarrollo de nuevos medicamentos: El desarrollo de un nuevo medicamento se realiza a través del ensayo o estudio clínico. En un sentido amplio definimos al ensayo clínico como el estudio sistemático de fármacos administrados a los seres humanos para descubrir o confirmar sus efectos y/o identificar reacciones adversas producidas por ellos y/o estudiar su farmacocinética, con el propósito de evaluar su eficacia e inocuidad. En los Estados Unidos, los ensayos clínicos con medicamentos se realizan por lo común en tres fases (figura N° 1), siendo la valoración preliminar del riesgo o peligro, uno de los objetivos prioritarios en estas pruebas. Los estudios posteriores, de fase IV, se realizan después que los medicamentos son aprobados para comercialización por la FDA. Podemos definir “medicamento nuevo”, a aquel que no se ha utilizado por un tiempo suficiente y/o en cantidades suficientes como para establecer satisfactoriamente su seguridad y efectividad. Además se incorpora en este concepto aquel medicamento que no se encuentra registrado en el país y se incluye también en esta definición a medicamentos previamente registrados a los cuales se quiere emplear para nuevas indicaciones o en el caso de una nueva forma farmacéutica de un medicamento ya aprobado. Mientras un producto ostente la denominación de medicamento nuevo, el fabricante tendrá que comunicar al organismo regulador (ISP) información relevante en relación a la seguridad o la eficacia cuando el fármaco es empleado en condiciones normales por la población. Seguridad de los nuevos medicamentos: Efectos adversos importantes de presentación tardía o con una frecuencia menor de un caso por 1.000 administraciones, muy probablemente no se detecten durante las tres primeras fases del proceso de investigación, antes de la aprobación del medicamento; es importante por lo tanto, recalcar el gran riesgo inherente que existe al indicar un medicamento recientemente aprobado para comercialización debido que en esta etapa se carece aún de amplia información sobre su seguridad, debiendo utilizarse con mucha cautela y de preferencia, en casos bien seleccionados, en los que el beneficio supere los riesgos. Resulta pertinente mencionar que en los últimos años la FDA ha retirado del mercado farmacéutico norteamericano 10 medicamentos: fenfluramina, dexfenfluramina, troglitazona, alosetron, mibefradilo, terfenadina, astemizol, cisaprida, grepafloxacino y bromfenaco. - 71 - Manual de Selección de Medicamentos Figura N° 1 PROCESO DE INVESTIGACIÓN Y DESARROLLO DE UN FÁRMACO SÍNTESIS DE UN MEDICAMENTO ESTUDIOS PRECLÍNICOS Estudios in Vitro Estudios en animales ESTUDIOS CLÍNICOS PRECOMERCIALIZACIÓN FASE I FASE II Voluntarios sanos 6-9 personas por dosis Inocuidad preliminar Farmacocinética, efectos biológicos. Pautas iniciales de dosificación. FASE III Pacientes seleccionados 10-200 pacientes Eficacia y seguridad a corto plazo. Relación dosis-respuesta Para establecer rango de dosis Pacientes seleccionados Más de 500 pacientes Eficacia y seguridad a corto y largo plazo. Reacciones adversas frecuentes ESTUDIOS CLÍNICOS POSTCOMERCIALIZACIÓN FASE IV Estudios de seguridad (farmacovigilancia) Pacientes de la población general Estudios de utilización del medicamento Estudios Complementarios de eficacia - 72 - Manual de Selección de Medicamentos GUÍAS TERAPÉUTICAS La mayoría de los profesionales prescriptores desarrollan “rutinas” para la evaluación y el manejo de las enfermedades más frecuentes. Dichas “rutinas” incluyen diversas tareas, desde obtener información del paciente, practicar un buen examen físico, solicitar exámenes auxiliares hasta diseñar el plan de tratamiento. Los primeros esbozos del surgimiento de estas rutinas se generan tal vez en los períodos finales del pregrado, como resultado de “copiar” los hábitos de diagnóstico y tratamiento de respetables profesores o seguir sus consejos frente a situaciones clínicas específicas. Con el tiempo el prescriptor suele lograr independencia, cuestionar algunos esquemas de manejo y desarrollar habilidades para la “búsqueda” y “evaluación” de información que le permitirá modificar o mejorar sus “rutinas”. De ese modo va incorporando nuevos exámenes y nuevos tratamientos en su práctica profesional. Este proceso de búsqueda, aplicación y evaluación implica inversión de tiempo y energías, pero ello vale la pena ya que representa un requisito indispensable para el buen manejo de sus pacientes. Recientemente las referidas “rutinas” se pueden establecer en base a evaluaciones sistematizadas llevadas a cabo por diversas organizaciones de profesionales del campo de la salud, algunas de ellas con evidencias de alta calidad (como la proveniente de la Biblioteca o iniciativa Cochrane). Estas rutinas traducen “declaraciones sistemáticamente desarrolladas para ayudar al profesional a tomar decisiones apropiadas en circunstancias clínicas específicas observadas en sus pacientes”, lo que se denomina “directivas” o “guías”. Una guía es considerada válida si “después de seguirla, nos conduce a una ganancia en la salud a un costo previsto por ella”. Al difundir e implementarse una guía válida debe producirse un cambio en la práctica clínica que mejore la atención de la salud del paciente. Por el contrario, si se implementa y difunde una guía no válida, nos llevará a una pérdida de recursos, inefectividad de las acciones y empeoramiento y deterioro de la salud de los pacientes. Según Sackett los dos componentes de una guía debieran ser: El resultado final Requerimientos subyacentes La pericia requerida para ejecutar los componentes. El sitio en donde el Componente debería Ser generado Formas de rendimiento EL COMPONENTE DE LA EVIDENCIA El efecto típico de la intervención sobre el diagnóstico/terapia/prevención para un paciente típico Validez Importancia Caducidad La biología humana, Ciencias Clínicas, Consumismo Búsqueda de bases de datos, Epidemiología clínica, Bioestadística Nacional o internacional EL COMPONENTE INSTRUCTIVO DETALLADO Qué hacer exactamente con el paciente Niveles de evidencia Grados de las recomendaciones y detalles de las instrucciones, algoritmos, protocolos (quizás computarizados) - 73 - La pertinencia local La práctica clínica, los valores de los pacientes, la práctica actual local, la geografía, la economía, la sociología, la política y la tradición locales local Manual de Selección de Medicamentos La validez de una guía depende de tres factores que deben considerarse en la etapa de elaboración: La composición del grupo de trabajo y el proceso de construcción La identificación y síntesis de la evidencia El método de construcción de la guía La calidad de una guía. Evaluación de la evidencia: Las publicaciones individuales son revisadas en cuanto rigor metodológico y relevancia clínica y son catalogadas de acuerdo al diseño de investigación, en varios niveles o categorías de evidencia (ver en este manual, el tema Reportes de Estudios Clínicos y Metanálisis: evaluación de su calidad y relevancia). La evidencia es sintetizada por métodos cuantitativos, de este modo el grupo tendrá una idea del peso de la evidencia. Las recomendaciones se derivan por métodos de consenso informales. La interpretación de la evidencia lleva consigo juicios de valor, aunque se trate de que el proceso sea lo más explícito y claro posible. Tópicos sin evidencia: En ausencia de evidencia se hace uso de los consensos. Revisores externos de las guías: Se debe considerar, al menos, tres tipos de revisores: Potenciales Expertos en los contenidos Metodólogo en guías Implicancias para la práctica: Las guías son desarrolladas usando métodos para maximizar su validez: identificación de la evidencia por revisiones sistemáticas; desarrollo por un grupo multidisciplinario; empleo de uniones explícitas entre la evidencia y las recomendaciones. La naturaleza explícita del desarrollo de las guías permite a los potenciales usuarios evaluar críticamente la validez de las guías y hacer un juicio informado para adoptar o no la guía para su práctica profesional. La guía propone principios para las buenas prácticas en la atención de salud. Selección de medicamentos para las guías Las guías nos dan directivas de diversa índole y conductas a seguir en cuanto al manejo de pacientes. En cuanto a tratamiento, pueden incluir recursos no farmacológicos, como farmacológicos. Los medicamentos se escogen de acuerdo a los criterios ya referidos, de eficacia, seguridad, conveniencia y costo. Es importante conocer, respecto a la eficacia y la seguridad del medicamento, la fuente de información, especialmente cuando se emplean medicamentos nuevos. Las fuentes de información deben ser evaluadas completamente y de modo crítico, calificando el nivel de la evidencia, lo que influirá en la fuerza de una recomendación. Los aspectos relacionados al costo son igualmente relevantes para la selección de los fármacos. Los medicamentos esenciales, que por definición permiten atender las necesidades de salud de la inmensa mayoría de la población, debieran ser seleccionados teniendo en cuenta los problemas sanitarios prevalentes del país. En otras palabras, el petitorio o formulario de medicamentos esenciales debiera basarse en las guías y protocolos terapéuticos nacionales e incorporar a los medicamentos allí considerados. - 74 - Manual de Selección de Medicamentos REVISIÓN Y ACTUALIZACIÓN DEL FORMULARIO NACIONAL DE MEDICAMENTOS (FN) El Formulario Nacional de Medicamentos se ajusta, en su formulación y revisión, a las pautas establecidas por el Comité de Expertos de la Organización Mundial de la Salud encargado de actualizar y revisar la Lista Modelo de Medicamentos Esenciales. Se considera como criterios fundamentales en la tarea de selección de los medicamentos: la eficacia, la seguridad, la necesidad y el costo del medicamento. La revisión de la lista debe constituir un proceso permanente, flexible y cautelosamente conducido, en base a nueva información científica debidamente sustentada y técnicamente evaluada, para atender necesidades no previstas o nuevas condiciones epidemiológicas: inclusiones, sustituciones y exclusiones de medicamentos. Este proceso ha sido regulado por el MINSAL en el DS Nº 263/2003, señalando al efecto una serie de conceptos de aplicación en el FN, así como la conformación de la comisión técnico-asesora que recomendará los diversos cambios o actualizaciones del FN, adaptándose a la realidad epidemiológica del país. Así mismo, dicho reglamento incorpora los criterios que permiten la selección de los medicamentos que formarán parte del FN, estableciendo los siguientes: 1. Eficacia y seguridad en el uso. 2. Adecuada relación riesgo-beneficio y efectividad en función del costo. 3. Cumplimiento de los principios de la medicina basada en la evidencia, en especial si integran la farmacoterapia incorporada en las normas clínicas, guías terapéuticas o protocolos que se aprueben para abordar las patologías de mayor prevalencia. Así mismo el decreto incorpora los elementos o informes a considerar en los procesos de revisión, listando los siguientes: 1. 2. 3. 4. 5. 6. Los informes sobre el logro del objetivo terapéutico de la farmacoterapia contenida en las normas, protocolos o guías clínicas en uso. Las sugerencias fundamentadas que realicen los comités de farmacia y terapéutica de los establecimientos asistenciales de los Servicios de Salud y de otras instituciones públicas y privadas del país. Las opiniones de las sociedades científicas. Los resultados de los estudios de utilización disponibles para grupos terapéuticos específicos. Los informes de farmacovigilancia nacionales e internacionales. Las revisiones sistemáticas sobre medicina basada en la evidencia. Sin perjuicio de lo anterior, y en términos generales la literatura incorpora las siguientes pautas y recomendaciones: Considerar solamente aquéllos fármacos para los que se disponga de suficiente información científica, producto de ensayos clínicos controlados y randomizados sobre eficacia y seguridad. La eficacia debe medirse, de preferencia, en base a resultados clínicos principales o finales. Es conveniente contar, además, con estudios epidemiológicos y pruebas de efectividad en su aplicación en diferentes escenarios clínicos reales (y dependiendo de la organización de los servicios asistenciales, infraestructura, recursos financieros, dispositivos especiales para la administración de ciertos fármacos, capacitación y experiencia del personal, factores socioculturales, demográficos, genéticos y ambientales). En este contexto, que un medicamento cuente con registro sanitario otorgado por el Instituto de Salud Pública de Chile, releva en parte esta evaluación, especialmente lo referido a eficacia, calidad y seguridad. - 75 - Manual de Selección de Medicamentos Incluir los medicamentos con el número mínimo de formas farmacéuticas y concentraciones que permitan garantizar su calidad y facilidad de administración. Será preciso considerar su estabilidad en las condiciones previstas de almacenamiento y uso. Evitar la multiplicidad innecesaria de fármacos dentro de un mismo grupo terapéutico. Cuando existan dos o más medicamentos para la misma indicación, la elección se basará en una evaluación comparativa de eficacia, seguridad, conveniencia, calidad y costo por tratamiento completo, incluyendo la evaluación del cociente beneficio/costo. Esta decisión puede también verse afectada por las características farmacocinéticas más favorables, interacciones farmacológicas con implicancias clínicas significativas, cobertura para un número mayor de indicaciones específicas, condiciones para su almacenamiento, disponibilidad o mayor oferta competitiva en el mercado farmacéutico local. Los medicamentos de reciente introducción en el mercado, llamados también “medicamentos nuevos”, deben incluirse únicamente si tienen ventajas claramente definidas en relación a aquellos que cuentan con un mayor tiempo de comercialización. Debe tomarse también en consideración que la seguridad de un medicamento se define de acuerdo a su comportamiento a través del tiempo y con una mayor utilización en diferentes poblaciones, evaluando especialmente los estudios de Fase IV que se encuentren disponibles. En principio, los medicamentos deben estar formulados como monofármacos o monodrogas. Las combinaciones en proporciones fijas sólo son aceptables si han demostrado que de esta manera aportan mayores beneficios clínicos en relación a los obtenidos individualmente. Para un grupo seleccionado de medicamentos debe tomarse en cuenta algunos mecanismos de restricción o recomendaciones específicas para su uso, debido al riesgo de poder ocasionar efectos adversos severos, utilización indiscriminada o debido a su costo elevado. MOTIVOS PARA NO INCLUIR UN MEDICAMENTO EN UN FORMULARIO O PETITORIO. 1. 2. 3. 4. 5. 6. 7. 8. Eficacia dudosa para la indicación propuesta. Relación entre el riesgo y el beneficio inaceptable. Limitados estudios que impiden definir su lugar en la terapia. Existir, en el formulario nacional, uno o más medicamentos alternativos que ofrecen igual o mayor beneficio en cuanto a eficacia, seguridad, costo, conveniencia o disponibilidad. Forma farmacéutica y/o concentración de un medicamento que no aporta mayores ventajas, sobre las existentes en el formulario. Asociación de fármacos no justificada técnicamente. Condición clínica, para la cual se propone el medicamento, mal definida o no clara. Costo demasiado elevado que resulta incompatible con una distribución equitativa de los recursos disponibles en un sistema de salud. En el Anexo N° 1 se presenta una propuesta de formulario a utilizar en las solicitudes de incorporación de un medicamento en el formulario o arsenal farmacoterapéutio, que facilitará la tarea del equipo técnico evaluador. Asimismo, en el Anexo N° 2 se incluyen modelo de formulario para la solicitud de medicamentos no considerados en el Formulario Nacional de Medicamentos Esenciales. - 76 - Manual de Selección de Medicamentos REFERENCIAS BIBLIOGRÁFICAS 1. “Manual de Selección de Medicamentos Esenciales: Principios para una selección racional de medicamentos” de la Dirección General de Medicamentos, Insumos y Drogas, 2001. 2. “Promoción del uso racional de medicamentos: Componentes centrales”, Organización Mundial de la Salud, Ginebra, septiembre de 2002. (http://apps.who.int/medicinedocs/en/d/Js4874s/) 3. Boletín de medicamentos esenciales – Nº 30-2001: Información sobre los medicamentos: Productos Médicos e Internet: guía de la OMS para navegar con seguridad. (http://apps.who.int/medicinedocs/en/d/Jh2976s/7.html) 4. “Con los medicamentos no se juega: El uso inapropiado de medicamentos limita sus beneficios, aumenta los riesgos y malgasta recursos”, Acción para la Salud, Latinoamérica y el Caribe, Boletín Correo de AIS, Edición Nro. 92, marzo de 2009. (http://www.aislac.org/index.php?option=com_docman&Itemid=150 ) 5. Laupacis A, Sackett DL, Roberts RS. An assessment of clinically useful measures of the consequences of treatment. N Engl J Med 1988;318:1728-1733 6. Feinstein AR. Problems in measurement. How do we measure “safety” an “efficacy”?. Chapter 18. Clinicals Biostatistics. 1977;256-270. 7. ASHP Therapeutic Guidelines on Antimicrobial Prophylaxis in Surgery. Am J Health-Syst Pharm 1999;56:1839-1888. 8. Guyatt GH, Sackett DL, Sinclair JC, et al. For the Evidence Based Working Group. User’ guides to the Medical Literatura, IX. A method for grading health care recommendations. JAMA 1995;274:1800-1804. 9. Hayward R. Wilson MC, Tunis SR, et al. For the Evidence Based Working Group. Users’ guides to the Medical Literature, VIII. How to use clinical practice guidelines: A Are the recommendations valid?. JAMA 1995;274:570-574. 10. McAlister FA, Laupacis A, Wells GA, et al. Users`guides to the Medical Literature, XIX, Applying Clinical Trial Results. B. Guidelines for Determining Whether a Drug is Exerting (More Than) a Class Effect. JAMA 1999; 282:1371-1377. 11. Guyatt G. et al. For the Evidence-Based Medicine Working Group.Users’ Guides to the Medical Literature. II How to use an Article About Therapy or Prevention. Jama January, 5. 1994 Vol 271.N°1 12. Cho MK, Bero LA. Instruments for assessing the quality of drug studies Publisher in the medical literatura. JAMA 1994;272:101-104. 13. Oxman AD, Cook DJ, Guyatt GH for the Evidence Based Working Group. Users´guide to the Medical Literature, VI. How to use an overview. JAMA 1994;272:1367-1371. - 77 - Manual de Selección de Medicamentos ANEXOS - 78 - Manual de Selección de Medicamentos ANEXO Nº 1 Modelo de solicitud para la inclusión de un medicamento en el Formulario Nacional (FN)* I.- TIPO DE ESTABLECIMIENTO APS HOSPITAL (I, II, III o IV) INSTITUTO ESPECIALIZADO Nombre: _______________________________________________________________________ Servicio de Salud al que pertenece: __________________________________________________ II.- MEDICAMENTO SOLICITADO Denominación Común Internacional (DCI)(7) Forma farmacéutica Concentración Vía de Dosis Administración Diaria(3) Costo Diario(4) Duración de Costo del Tratamiento(5) Tratamiento(6) III.- MOTIVO (requiere de por lo menos un criterio fundamental) A. CRITERIOS FUNDAMENTALES 1. Medicamento -de eficacia y seguridad demostrada- para cubrir un vacío terapéutico importante (8) (3) 2. Mayor eficacia e igual o mayor seguridad e igual o menor costo de tratamiento a la(s) alternativa(s) del Formulario Nacional (10) (9) 3. Mayor seguridad e igual eficacia e igual o menor costo de tratamiento a la(s) alternativa (s) Formulario Nacional 4. Menor costo e igual eficacia e igual seguridad a la(s) alternativa(s) del Formulario Nacional Para los criterios 2,3 y 4, especificar la (s) alternativa (s) del Formulario Nacional a sustituir ____________________ B. CRITERIOS COMPLEMENTARIOS 5. Conveniencia (mayor adherencia al tratamiento, facilidad de uso, etc). Especificar: ______________________________________________________________________________________ 6. Disponibilidad (o mayor disponibilidad) del producto en el mercado nacional. (11) IV. INDICACIONES A…………………………………………………………………………………………………………………………………………. B…………………………………………………………………………………………………………………………………………. C…………………………………………………………………………………………………………………………………………. V. RESTRICCION DE USO PARA EL MEDICAMENTO PROPUESTO: NO SI Especificar: …………………………………………………………………………………………………………………………………………… …………………………………………………………………………………………………………………………………………… (1) En caso se desee la exclusión sin sustitución, aplicar los ítem I, II y VI (C) En caso de una asociación a dosis fija consignar todos los principios activos (3) Si es pertinente no considerar el rango de dosificación. (4) Considerar el precio actual de venta al sistema público y consignar las condiciones de compra. . (5) En el caso de procesos que requieren de un tratamiento de largo plazo colocar el término “crónico” (6) En el caso de procesos que requieran de un tratamiento crónico calcular el costo mensual. (7) En el caso de que el nuevo principio activo solicitado para cubrir un vacío terapéutico forma parte de un grupo, proponer la alternativa que ostente la mejor relación beneficio/costo. Tomar en consideración la severidad del cuadro clínico o enfermedad, así como su frecuencia y la urgencia para el uso del medicamento. Este criterio podrá aplicarse a nuevas formas farmacéuticas y/o concentraciones de principios activos. (8) Se tomará en cuenta los estudios clínicos de Fase IV. (3) Si es pertinente no considerar el rango de dosificación. (2) (9) En casos excepcionales se podrá considerar un costo algo mayor, teniendo en cuenta el impacto clínico o terapéutico del incremento de la eficacia y/o seguridad. (10) Incluye un menor potencial de interacciones medicamentosas clínicamente relevantes. (11) Detallar la situación clínica específica y/o consideración especial para su uso. De ser pertinente considerar el grado de severidad o estado clínico Nota: Utilizar hoja adiciona en caso de ser necesario incluir mayor información, Favor ceñirse al presente formato de solicitud y completar toda la información requerida * Este modelo de solicitud también puede ser empleado para la solicitud de inclusión de un medicamento en los arsenales farmacológicos de los establecimientos. - 79 - Manual de Selección de Medicamentos VI. SUSTENTO TECNICO (de carácter obligatorio) a. Adjuntar información epidemiológica en relación a la enfermedad o situación clínica que motiva el uso del medicamento solicitado. b. Adjuntar información completa obtenida de fuentes independientes y de reconocido prestigio en relación a eficacia, seguridad o costos, que sustenten el medicamento solicitado para las indicaciones propuestas (ver anexo Nº 3). Además en el caso de existir otras alternativas al medicamento propuesto dentro de un grupo fármaco-terapéutico, documentar la evaluación del beneficio/costo del medicamento solicitado frente a las otras del grupo. c. Cuando se trate de solicitud de exclusión sin sustitución, adjuntar la fundamentación técnica correspondiente. VII. COMENTARIO DEL COMITÉ DE FARMACIA Y TERAPÉUTICA DEL ESTABLECIMIENTO …………………………………………………………………………………………………………………………………………… …………………………………………………………………………………………………………………………………………… …………………………………………………………………………………………………………………………………………… …………………………………………………………………………………………………………………………………………… …………………………………………………………………………………………………………………………………………… …………………………………………………………………………………………………………………………………………… …………………………………………………………………………………………………………………………………………… …………………………………………………………………………………………………………………………………………… …………………………………………………………………………………………………………………………………………… …………………………………………………………………………………………………………………………………………… …………………………………………………………………………………………………………………………………………… …………………………………………………………………………………………………………………………………………… ________________________________________ Firma Presidente del Comité de Farmacia y Terapéutica Nombre: _______________________________________ Firma Secretario del Comité de Farmacia y Terapéutica Nombre: - 80 - Manual de Selección de Medicamentos ANEXO Nº 2 MODELO DE SOLICITUD PARA LA ADQUISICIÓN DE UN MEDICAMENTO NO CONSIDERADO EN EL FN I. ESTABLECIMIENTO O DEPENDENCIA: SERVICIO DE SALUD: II. NOMBRE DEL PROFESION SOLICITANTE(1): Especialidad: III. IV. V. III. MEDICAMENTO SOLICITADO VI. VII. VIII. Denominación Común Internacional (DCI) (2) IX. X. XI. IV. MEDICAMENTO DEL FN(7) (8) Servicio o Departamento: Concentración Concentración Forma farmacéutica Vía de administración Dosis diaria(3) Costo diario(4) Duración del tratamiento(5) Costo del Tto.(6) Forma farmacéutica Vía de administración Dosis diaria Costo diario Duración del tratamiento Costo del tto. II. V. INDICACIÓN(9): Condición (es) clínica(s) asociada(s) (10) Número de casos estimados/año: Cantidad solicitada del medicamento: VI. MOTIVOS a) Reacción adversa que determine la suspensión definitiva del medicamento (11). b) Necesidad de una vía de administración alterna. c) Falla terapéutica. No se obtuvo la respuesta clínica esperada luego de…..(minutos) (horas) (días) (semanas) de tratamiento (12). …………………………………………………………………………………………………………………………… (1) En el caso de que la solicitud sea efectuada por más de un profesional consignar solamente el nombre de uno de ellos. Si se trata de esquemas combinados consignar los datos solicitados para cada uno de los medicamentos. Podría darse el caso que un esquema combinado incluya un medicamento considerado en el Formulario Nacional. (3) Si es pertinente considerar el rango de dosificación. (4) Considerar el precio de venta al sistema público de salud u otro que se disponga. (5) En el caso de procesos que requieren de un tratamiento de largo plazo colocar el término “crónico” (6) En el caso de procesos que requieren de un tratamiento crónico, calcular el costo mensual. (7) Medicamento que por el (los) motivo(s) señalado(s) en el ítem VI no puede ser usado. (8) Si se trata de esquemas combinados consignar los datos solicitados para cada uno de los medicamentos. (9) Especificar la enfermedad o situación o situación clínica para la cual se indica el tratamiento. De ser pertinente considerar el grado de severidad o estado clínico. Por ejemplo, para el caso del bromuro de ipatropio una de las indicaciones puede ser “enfermedad pulmonar obstructiva crónica (EPOC) sintomática”. (10) Se refiere a una segunda condición (o más) necesaria para ofrecer tratamiento. En relación al ejemplo anterior “espasmo bronquial asociado”. (11) Cada caso detectado debe reportarse a través del formulario correspondiente al CENIMEF. (12) En caso de antibióticos consignar la(s) bacteria(s) a tratar y adjuntar información pertinente del laboratorio de microbiología sobre la ecología y el patrón de sensibilidad de las bacterias aisladas en el establecimiento. (2) - 81 - Manual de Selección de Medicamentos d) Contraindicaciones(13) □ Antecedente de reacción de hipersensibilidad caracterizada por…………………………………………………………………… □ Gestación de……… semanas □ Lactancia materna □ Niños de………..de edad □ Interacción medicamentosa clínicamente relevante con(14)…………………………………………………………………………… □ Otros (especificar):………………………………………………………………………………………………………………………… e) Enfermedad o situación clínica no cubierta por los medicamentos del formulario. f) Falta de disponibilidad del medicamento en el mercado farmacéutico nacional. g) Disminución significativa del costo con una diferente concentración o forma farmacéutica del medicamento del formulario. h) Situación de monopolio para un medicamento, que afecte significativamente los costos. VII. SUSTENTO TÉCNICO (de carácter obligatorio) Adjuntar la sustentación técnica correspondiente. Cuando sea necesario, presentar reportes de fuentes de información independientes y de reconocido prestigio, como estudios clínicos controlados o metaanálisis sobre el medicamento propuesto, en cuanto a eficacia y seguridad comparativa frente a (los) medicamento(s) del petitorio o en su defecto al tratamiento convencional. Además en caso de existir otras alternativas al medicamento solicitado dentro de un grupo farmacoterapéutico documentar la evaluación del beneficio/costo del medicamento solicitado frente a los otros del grupo. ……………….., …..de …………………..de 200….. ……………………………………………………. Firma Cargo: ………………………..……… (13) Implica un alto riesgo de efecto adverso que imposibilita el uso del (los) medicamento(s) del formulario. Solamente para aquellos casos en los que no puede(n) emplearse otra(s) alternativa(s) del formulario para el (los) medicamento(s) con el (los) que se produce(n) la(s) interacción(es) (14) - 82 - Manual de Selección de Medicamentos DECISIÓN DEL COMITÉ DE FARMACIA Y TERAPÉUTICA 1. Para los motivos a), b), c),d) y e) APROBADA NO APROBADA Cantidad autorizada del medicamento………………………………para un periodo de:………………………………. De ser necesario describir las condiciones bajo los cuales se autoriza. Por ejemplo: protocolo o guía de tratamiento, indicaciones precisas, restricciones para su uso, seguimiento clínico del (los) pacientes (s). Evaluación del consumo. …………………………………………………………………………………………………………………………………………… …………………………………………………………………………………………………………………………………………… …………………………………………………………………………………………………………………………………………… ………………………………………………………………………………………………………………………………................. 2. Para los motivos f), g) y h) El comité farmacológico remite Al MINSAL la presente solicitud, para su consideración. …………………………………………… Firma ………………………………………………… Firma Presidente del Comité Farmacológico Secretario del Comité Farmacológico Nombre: Nombre: ……………………………..,………de…………….de 200…… - 83 - Manual de Selección de Medicamentos ANEXO Nº 3 MODELO DE FORMATO PARA LA EVALUACIÓN DE LOS REPORTES DE ESTUDIOS CLÍNICOS FARMACOTERAPEUTICOS 1. Titulo del artículo:……………………………………………………………………………………………………... 2. Autor (es):………………………………………………………………………………………………………………. 3. Revista:………………………………………………………………………………………………………………….. 4. Lugar:……………………………………………………………………………………………………………………. 5. Fecha en que se realizó:……………………………………………………………………………………………… 6. Apoyo o relación financiera con la industria farmacéutica: 7. Objetivo: Eficacia Eficiencia Perfil farmacocinético y/o farmacodinámico, dosis/efecto. No es claro 8. Seguridad Utilización (EUM) Otros:…………………………………. Tipo Primario Ensayo clínico (de intervención) Fase: I II III IV (pos-comercialización) Estudio de cohortes Estudio de casos y controles Estudio transversal Estudio ecológico (de correlación) Otro:………………………………………………………………………………………………………… Integrativo Revisión sistemática / Metanálisis Análisis de decisión Análisis económico: ( ) minimización de costos ( ) costo-efectividad Guía práctica Revisión narrativa ( ) costo-beneficio ( ) costo-utilidad 9. Comentario:…………………………………………………………………………………………………………… ………………………………………………………………………………………………………………………………… ………………………………………………………………………………………………………………………………… ………………………………………………………………………………………………………………………………… ………………………………………………………………………………………………………………………………… ………………………………………………………………………………………………………………………………… ………………………………………………………………………………………………………………………………… ………………………………………………………………………………………………………………………………… ………………………………………………………………………………………………………………………………… ………………………………………………………………………………………………………………………………… ………………………………………………………………………………………………………………………………… ………………………………………………………………………………………………………………………………… ………………………………………………………………………………………………………………………………… ………………………………………………………………………………………………………………………………… - 84 - Manual de Selección de Medicamentos ENSAYO CLÍNICO 1. Características generales 1.1 Pacientes / Diagnóstico (características principales): ………………………………………………………………………………………………………………………..... 1.2 Fármaco(s)/placebo:……………………………………………………vs…………………………………………. 1.3 Número de individuos:……………………………………………….…vs………………………………………… 1.4 Duración del estudio:………………………………………………………………………………………………… 1.5 Objetivo(s) Curación (o remisión) Principal Secundario Disminución de síntomas (o severidad) ( ) ( ) Prolongar sobrevida ( ) ( ) Mejorar calidad de vida ( ) ( ) Prevenir la enfermedad ( ) ( ) Prevenir sus complicaciones ( ) ( ) Prevenir su recurrencia ( ) ( ) Evaluar seguridad ( ) ( ) No es claro / otro:……………………………………………………………………………………………….. 1.6 ¿Cómo se midieron los resultados? Primarios(s)………………………………………………………………………................................................. Sustituto(s)…………………………………………………………………………………………………………... 1.7 Consentimiento informado: 2. Diseño 2.1 Si ……………………….………………….. No Tipo No controlado Controlado 2.2 Activo ( ) Placebo ( ) Concurrente ( ) Histórico ( ) Paralelo ( ) Cruzado ( ) Asignación Aleatoria simple/sistemática pareada / estratificada / en bloque / otra No probabilística: ……………………………………………………………………………………… 2.3 Periodo de lavado: 2.4 Enmascaramiento Abierto 3 Población 3.1 Tipo Si No Ciego único Otro ………….............................. Doble ciego Voluntarios sanos Pacientes 3.3 ¿Cómo de qué fueron reclutados? ……………………………………………………………………….. ……………………………………………………………………………………….................................... ……………………………………………………………………………………….................................... ……………………………………………………………………………………….................................... Criterios de inclusión: si no 3.4 Criterios de inclusión: 3.2 si no - 85 - Manual de Selección de Medicamentos 3.5 Comparabilidad de grupos antes de iniciar el estudio: ¿hubo diferencia estadísticamente significativa? Demográficos (edad, raza, sexo, etc.): si no………………………. Severidad/duración de la enfermedad: si no………………………. Respuesta a un tratamiento previo: si no………………………. Enfermedad(es) concomitante(s): si no………………………. Antecedentes; si no………………………. Exámenes de laboratorio: si no………………………. Otros: si no ¿cuáles?............................................................................... 3.6 Cálculo de tamaño de la muestra: si no ………………………………………………………………………………………………………………………… ………………………………………………………………………………………………………………………… ………………………………………………………………………………………………………………………… 4 Tratamiento 4.1 Esquema de administración Dosis:……………………………………………………………………………………………………….... Intervalo entre dosis: ……………………………………………………………………………………..... Forma farmacéutica: ……………………………………………………………………………………….. Ruta de administración: ………………………………………………………………………………..….. Duración del tratamiento: ……………………………………………………………………………….... Otros detalles: ………………………………………………………………………………………………. Régimen: dosis única tipo flexible, parámetros para el ajuste: ………………………………………………………………………………………………………………… ………………………………………………………………………………………………………………… 5 4.2 Equipotencia entre los fármacos activos comparados 4.3 Escenario: 4.4 Información sobre las características farmacéuticas/control de calidad 4.5 Tratamientos permitidos o no permitidos, estandarizados?: ………………………………................. ………………………………………………………………………………………………………………… 4.6 Control de cumplimiento del tratamiento por los pacientes 4.7 Se cumple protocolo por los investigadores/evaluadores: hospitalizado si no no se sabe no descrito…………………………….... ambulatorio si si si no no no se ignora se ignora Recolección de datos Mediciones para evaluar el logro de los objetivos: 5.1 Sobre eficiencia: apropiada / sensibles / validadas: si no cuestionable ………………………………………………………………………………………………… 5.2 Sobre efectos adversos. A través de preguntas estructuradas: si no se ignora por notificación espontánea ………………………………………............ 5.3 Realizadas en el tiempo apropiado: 5.4 Evaluadores: 5.5 Periodicidad y duración de las evaluaciones: …………………………………………………………… ………………………………………………………………………………………………………………… . constantes si variables - 86 - no …………………………………….................. no se describe…………………………….. Manual de Selección de Medicamentos 5.6 6 Método de colección estandarizado / reproducible: si no se ignora Análisis de datos 6.1 Datos incompletos o perdidos: 6.2 Pacientes perdidos en el seguimiento: si si no se ignora…………………. no se ignora………………… ¿Cuántos? ¿Por qué? ……………………………………………………………………………………... 6.3 Control de variable de confusión: si no 6.4 Análisis de subgrupos: si no 6.5 Análisis de supervivencia: si no 6.6 Análisis por intención a tratar: si no 6.7 Medidas de resumen: Tasa de resultados + desviación estándar y valor de P……………………………………………. Reducción del riesgo relativo su intervalo de confianza al 95%………………………................. Número necesario a tratar y su intervalo de confianza al 95%...…………………………………. Otros:…………………………………………………………..………………………......................... 6.8 Si se ha observado diferencia, tiene significado clínico? si no ¿por qué? ……………………………………………………………………………………………………. 6.9 Si se ha observado diferencia es debida al poder del estudio? (tamaño de la muestra) si 7 no ……………………………………………………………………………….................... Evaluación general 7.1 Existe(n) error(es) “fatal(es)” que invalide(n) los resultados? si no ………………………………………………………………………………………………………………… ………………………………………………………………………………………………………………… 7.2 Se justifica las conclusiones emitidas? si no ¿por qué? …………………………….. ………………………………………………………………………………………………………………… 8 si 7.3 Son los resultados extrapolables? 7.4 Son mejores los beneficios que los riesgos? Comentarios adicionales tal vez si no ¿en quienes? ……..………… tal vez no 8 ………………………………………………………………………………………………………………………… ………………………………………………………………………………………………………………………… ………………………………………………………………………………………………………………………… ………………………………………………………………………………………………………………………… ………………………………………………………………………………………………………………………… …………………………………………………………………………………………….. 8 De preferencia utilizar los numerales para referirse a los ítems que tengan relación con su comentario - 87 - Manual de Selección de Medicamentos ANEXO Nº4 GUIA PARA UNA LECTURA CRÍTICA DE LA LITERATURA MEDICA DEFINICION Y OBJETIVOS PROCESO DE ANALISIS E INTERPRETACION SISTEMATICA PARA OTORGARLE VALIDEZ INTERNA SIGNIFICADO CLINICO A LOS RESULTADOS APLICACIÓN CLINICA LA CONCLUSION NO ES DEFINITIVA Y DEBE SER DADA POR NIVLES DE CERTIDUMBRE O FUERZA INFERENCIAL MAS QUE DICOTOMICA TOPICOS PRINCIPALES PROBLEMAS CLINICOS EN - PREVENCION - PRONOSTICO - ECONOMIA - TRATAMIENTO - ETIOLOGIA - DIAGNOSTICO - CALIDAD DE VIDA BUSQUEDA DE LA MEJOR EVIDENCIA POSIBLE: 1. ESTUDIOS ORIGINALES DE ACUERDO AL TOPICO 2. ESTUDIOS INTEGRATIVOS REVISIONES SISTEMATICAS / METANALISIS GUIAS PRACTICAS ANALISIS DE DECISION ANALISIS ECONOMICO ESQUEMA 1. ESCENARIO CLINICO 2. DEFINIR EL PROBLEMA MEDIANTE PREGUENTA ESTRUCTURADA PACIENTE EXPOSICION RESULTADOS PRINCIPALES SECUNDARIOS 3. BUSQUEDA DE LA INFORAMCION Y SELECCIÓN DEL ESTUDIO 4. EVALUACION DE LA CALIDAD DEL ESTUDIO VALIDEZ INTERNA MAGNITUD Y PRECISION DEL EFECTO 5. APLICACIÓN AL CASO CLINICO - 88 - Manual de Selección de Medicamentos ANEXO 4: GLOSARIO DE TERMINOS DE INTERES EN SELECCIÓN DE MEDICAMENTOS. El siguiente listado de términos sido extraído de la literatura internacional y se adjunta solo para fines ilustrativos, pudiendo complementarse con los términos acuñados en la regulación chilena, siendo éstos últimos los aceptados legalmente. 1. Abierto, ensayo clínico (open clinical trial): Ensayo clínico no enmascarado en el que tanto el paciente como el investigador conocen la identidad de los fármacos empleados. 2. Aleatorización o asignación aleatoria (randomization): Procedimiento sistemático y reproducible por el cual los sujetos participantes en un ensayo clínico son distribuidos al azar en los distintos grupos de tratamiento. 3. Aleatorización ciega (blind randomization): Incluye cualquier método de aleatorización en el que la asignación a los grupos de tratamiento es desconocida para el investigador. 4. Análisis de costo-beneficio: Análisis que tiene por objetivo relacionar los costos y las consecuencias de un tratamiento o una intervención en términos monetarios. 5. Análisis de costo-efectividad: Análisis que tiene por objetivo relacionar el costo de un tratamiento o de una intervención con uno o varios indicadores expresados en unidades monetarias. 6. Análisis de costo-utilidad: Análisis que tiene por objetivo relacionar el costo de un tratamiento o de una intervención con uno o varios indicadores de efectividad, considerando la utilidad. 7. Análisis de costo-minimización: Análisis que tiene por objetivo comparar los costos de alternativas con resultados equivalentes. 8. Análisis de decisión (decision analysis): Técnica utilizada para ayudar en la toma de decisiones bajo condiciones de incertidumbre. 9. Análisis de sensibilidad: Método estadístico consistente en estudiar dentro de un modelo el efecto producido sobre el resultado final, al cambiar el valor de una o más variables. 10. Análisis incremental (incremental analysis): Costo y efectos sobre la salud adicionales que pueden obtenerse cuando se compara una opción con la siguiente más cara o agresiva. 11. Análisis marginal (marginal analysis): Costo y efectividad añadidos que pueden obtenerse de cada unidad adicional de servicio (p. ej. un día más en el hospital o una dosis extra de medicación). 12. Análisis por intención de tratar (analysis by intention to treat): Análisis estadístico de los resultados de un ensayo clínico que incluye a todos los pacientes asignados a cada grupo de tratamiento, independientemente del tratamiento recibido y de la duración del mismo. 13. Años de vida ajustados por calidad: (AVAC), corresponde a una medida de utilidad y representan un esquema de valores donde el tiempo invertido en una enfermedad, medido en años, se multiplica por el valor de las preferencias del individuo en ese estado de salud. 14. Años de salud equivalentes: (HYEs), corresponde al número de años en salud perfecta, que es equivalente a vivir un periodo de tiempo en mala salud. 15. Árbol de decisión: Elemento gráfico en los que se representa la secuencia temporal y lógica de un problema de decisión. 16. Beneficio neto (net benefit): Resultado de la diferencia entre los beneficios y el coste total, ambos medidos en unidades monetarias. Es la forma más común de expresar los resultados de un análisis coste-beneficio. 17. Cálculo del tamaño de la muestra (sample size calculation): Procedimiento estadístico utilizado para determinar el número de sujetos necesarios que deberán ser incluidos en un ensayo clínico para demostrar una posible diferencia con una probabilidad de error determinada. - 89 - Manual de Selección de Medicamentos 18. Calidad de vida (quality of life): Engloba el conjunto de experiencias, estados, percepciones y esferas de pensamiento relacionados con la vida de un individuo o una comunidad. La calidad de vida puede incluir dimensiones culturales, físicas, psicológicas, interpersonales, espirituales, financieras, políticas, temporales y filosóficas, tanto objetivas como subjetivas. La calidad de vida supone un juicio de valor en las experiencias de comunidades, grupos o individuos. 19. Copago (copayment): Fracción que paga el paciente al proveedor, por un determinado servicio. 20. Costo/AVAC ganado cost/QALY gained): Unidad de medida expresada en coste monetario por unidad de efecto, que sirve para comparar diferentes programas o intervenciones sanitarias. Se emplea en los estudios coste-utilidad. 21. Costo de la enfermedad, estudio de (cost/burden-of-illness study): Estudio que identifica y evalúa los costes directos (y a veces los indirectos) de una determinada enfermedad o factor de riesgo. 22. Costo de oportunidad (opportunity cost): Coste que supone utilizar determinados recursos para algún propósito, medido como su valor cuando se emplea en su mejor uso alternativo. 23. Costo incremental (incremental cost): Diferencia entre el coste de una intervención, programa o tratamiento y el de otro utilizado como control. Ç 24. Costo marginal (marginal cost): Es el coste adicional por unidad extra de servicio (efecto sobre la salud) producido. 25. Costo medio (average cost): Coste total de una intervención (tratamiento o programa) dividido por el número total de unidades de resultado proporcionadas. 26. Costos fijos (fixed costs): Son aquellos que no varían en función de la cantidad de unidades producidas. 27. Costos indirectos (indirect cost): Costes derivados de la reducción de capacidad productiva de un individuo como consecuencia de una enfermedad o un tratamiento. 28. Costos intangibles (intangible cost): Costes derivados del dolor y del sufrimiento, como consecuencia de una enfermedad o un tratamiento. 29. Costos médicos directos (direct medical costs): Son aquellos costes fijos y variables asociados directamente con los cuidados de la salud (p. ej. medicamentos, hospitalización, salario del personal sanitario). 30. Costos no médicos directos (direct nonmedical costs): Costes no médicos asociados al suministro de servicios sanitarios (p. ej. transporte del paciente al hospital). 31. Costos variables (variable costs): Son aquellos costes que varían en función de la cantidad de unidades producidas. 32. Disponibilidad a pagar (willingness to pay): Es la máxima cantidad de dinero que una persona estaría dispuesta a pagar: a) para alcanzar un determinado estado de salud preferido, o aumentar la probabilidad de alcanzar tal estado; b) para evitar un estado de salud no preferido. 33. Doble ciego, estudio (double-blind): Estudio enmascarado en el que ni el paciente ni el investigador conocen el grupo de tratamiento al que ha sido asignado el paciente. Exige asignación aleatoria ciega e iguales características de las muestras. 34. Eficacia: ensayo realizado en condiciones estandarizadas. 35. Efectividad : ensayo realizado en condiciones reales 36. Ensayo clínico: Es un estudio prospectivo en el que se compara, en seres humanos, el efecto y el valor de una o más intervenciones con un control, con el fin de evaluar cuál de ellas es más eficaz. 37. Enmascaramiento (blinding masking): Conjunto de medidas o precauciones que se toman con el fin de que, a lo largo del estudio, bien el paciente, el investigador (simple ciego), o ambos (doble ciego), desconozcan la asignación a los grupos de tratamiento. 38. Ensayo clínico controlado (controlled clinical trial): Ensayo clínico comparativo y concurrente en el tiempo que incluye, al menos, dos grupos de sujetos. La asignación de los sujetos a los grupos de tratamiento debe ser aleatoria. - 90 - Manual de Selección de Medicamentos 39. Ensayo clínico explicativo (explanatory clinical trial): Ensayo clínico en el que la muestra es muy homogéneo, de características muy definidas (criterios de selección estrictos) y en general pequeña, cuyo fin es valorar la eficacia de un tratamiento. La generalización de sus conclusiones debe realizarse con precaución. Se suele corresponder con los ensayos clínicos en fase II. 40. Ensayo clínico; fase l: Es el primer paso en la investigación de un nuevo fármaco en el hombre. Se realiza, salvo excepciones (antineoplásicos u otros fármacos de toxicidad elevada), en individuos sanos y se obtienen datos preliminares sobre la tolerancia, farmacocinética y farmacodinamia. 41. Ensayo clínico; fase II: Es el segundo estadio en la evaluación de un nuevo fármaco en el ser humano. Se realiza en un grupo reducido de pacientes, con criterios de selección, en general estrictos, que padecen la enfermedad o la entidad clínica de interés. Su principal objetivo es obtener información preliminar sobre la eficacia del fármaco, así como complementar los datos de seguridad obtenidos en la fase I. 42. Ensayo clínico; fase III: Su objetivo es evaluar la eficacia y seguridad de un fármaco en la indicación estudiada, por comparación con las alternativas disponibles. Estos estudios constituyen el soporte para la solicitud de registro y la autorización de comercialización de un fármaco, a una dosis y para una indicación determinada. Por ello, deben ser controlados y aleatorizados y, a ser posible, de carácter doble ciego, e incluir un número suficientemente elevado de pacientes que permita demostrar la eficacia y seguridad comparativa entre los tratamientos del estudio. 43. Ensayo clínico; fase IV: Comprende los ensayos clínicos que se realizan después de la comercialización de un fármaco. Pueden ser ensayos similares a los descritos en las fases I, II y III, si estudian algún tipo de efecto aún no valorado, por ejemplo, una nueva indicación, o bien los específicamente fase IV, incluidos en un programa de farmacovigilancia, que deben ser también controlados, aleatorizados y prolongados en el tiempo para evaluar eficacia y/o seguridad a largo plazo y en grupos heterogéneos de pacientes. 44. Equivalencia temporal (time-trade off): Técnica de obtención de preferencias de los estados de salud basada en el intercambio de la calidad y la cantidad de vida. 45. Error tipo I (type I error): Es la probabilidad de cometer un error al considerar que existe una diferencia estadísticamente significativa, cuando realmente no existe (falso positivo). También se define como la probabilidad de rechazar la hipótesis nula cuando ésta es cierta. Convencionalmente, se acepta una probabilidad de error de hasta un 5% (u = 0,05). 46. Error tipo II (type II error): Es la probabilidad de cometer un error al considerar que no existe una diferencia estadísticamente significativa, cuando en realidad existe (falso negativo). También se define como la probabilidad de no rechazar la hipótesis nula cuando ésta es falsa. Se acepta, como convención, una probabilidad de error de hasta un 20% (8 = 0,2). 47. Escala analógica visual (linear analogue instrument): Escala lineal (horizontal o vertical) con unos límites que van desde el estado de salud menos preferible (p. ej. " muerte”), hasta el más preferible (p. ej. " salud completa" ). El individuo debe marcar en qué zona de esta línea se encuentra. 48. Escala de utilidad (utility scale): Escala cardinal de estados de salud, definida por dos extremos o resultados fijos que se definen como 1= salud completa y 0 = muerte. 49. Estudio de casos y controles (case-control study): Estudio en el que, partiendo de la identificación de pacientes con una enfermedad determinada (casos), éstos se comparan con controles que son parecidos en otros aspectos, pero que no padecen la enfermedad. Se determina la odds ratio asociada al consumo de un determinado fármaco o fármacos en enfermedades raras y graves (p. ej. agranulocitosis y AINEs). 50. Estudio de cohortes (cohort study): Estudio en el que identifican dos grupos de sujetos, uno expuesto al fármaco o grupo de fármacos objeto del estudio y otro no expuesto a éstos. Ambos grupos son supervisados durante un período de tiempo generalmente largo y se registra la incidencia de diversas patologías. Se determinan los riesgos relativos y absolutos de varias patologías asociadas al consumo de fármacos. - 91 - Manual de Selección de Medicamentos 51. Estudio experimental (experimetal study): Estudio en el que las condiciones están bajo control directo del investigador (p. ej. asignación aleatoria a los distintos grupos de tratamiento). 52. Estudio observacional (observational study): Estudio en el que las condiciones no están sometidas a la intervención del investigador. 53. Estudio piloto (pilot study): Estudio que se realiza como paso previo a otros más amplios, con objeto de conocer datos que permitan un diseño más adecuado y poder establecer su viabilidad. 54. Farmacocinética: Es la ciencia que mide y cuantifica las velocidades de absorción, distribución y eliminación de un medicamento en el organismo. 55. Farmacoeconomía: Es un área de investigación que estudia los costos y las consecuencias del uso de los medicamentos en los pacientes, sistemas sanitarios y en la sociedad, aplicando la metodología de la evaluación económica. 56. Farmacoepidemiología: Disciplina que aplica los métodos y/o el razonamiento epidemiológico para evaluar la eficacia, el riego y el uso de los medicamentos. 57. Horizonte temporal de un proyecto sanitario (analytic horizon): Es el período de tiempo en el que los costes y los efectos sobre la salud del proyecto tienen importancia y son objeto de medición y evaluación económica. 58. HRQoL (health related quality of life), Indice de estado de salud (health status index):Instrumento de medida del estado de la salud que combina información de varios componentes (p. ej. salud física, mental y social) y se expresa en forma de un valor único. 59. Instrumento de medida de la calidad de vida (quality of life scale): Instrumento de evaluación de la calidad de vida, desde el punto de vista del paciente, en relación con su enfermedad. 60. Instrumento específico de medida de la calidad de vida relacionada con la salud (CVRS) (specific quality of life scale): Instrumento que mide solamente determinadas dimensiones de la CVRS, importantes para la afección o atributo que se pretende estudiar y que son aplicables a pacientes específicos. 61. Instrumento genérico de medida de la calidad de vida relacionada con la salud (CVRS) (quality of life general scale): Instrumento que mide múltiples dimensiones de la CVRS, tales como el funcionamiento físico, social y mental y es aplicable a todos los pacientes, independientemente de la enfermedad de que se trate. 62. Juego estándar: este es el método clásico de medición de las preferencias cardinales, basada en la teoría de Von Neuman y Morganstern (1953). Consiste en una comparación pareada en la cual el individuo puede elegir entre dos alternativas. 63. Metaanálisis: modelo estadístico que trata de combinar los resultados de varios ensayos realizados sobre un objetivo común, con el fin de obtener una mayor precisión de los datos. 64. Modelo Markov (Markov model): Representación estadística de acontecimientos recurrentes a lo largo del tiempo, que puede ser incorporado en un análisis de decisión. 65. Muestra (sample): Un grupo seleccionado de entre una población. 66. Perfil de salud (health profile): Instrumento de medida de la salud que incluye dos o más dimensiones de calidad de vida. 67. Perspectiva del análisis (analytic perspective): Punto de vista elegido para realizar el análisis (p. ej. sociedad, autoridades sanitarias, paciente, hospital). 68. Poder estadístico (statistical power): Probabilidad de rechazar la hipótesis nula cuando ésta es falsa. Generalmente se acepta el 80% (1-8) 69. Precio de referencia (reference pricing): Tipo de reembolso que recibe un grupo de fármacos equivalentes desde el punto de vista de su actividad farmacológica o terapéutica, tomando como referencia el precio de uno de los fármacos (normalmente el más barato) de su mismo grupo. 70. Preferencia (preference): Concepto referido a la deseabilidad de un determinado estado de salud. Los términos " utilidad" y " valor" se refieren a casos especiales del término general " preferencia". 71. Probabilidad: Frecuencia relativa que define el número de veces que se espera que se produzca un acontecimiento o se verifique una hipótesis, a lo largo de un gran número de tentativas, que tienden al infinito. - 92 - Manual de Selección de Medicamentos 72. Reacción adversa a medicamento: (RAM) De acuerdo a la definición de la OMS “ es todo efecto no intentado o no deseado que se observa después de la administración de un fármaco, en las dosis comúnmente empleadas en el hombre, con fines de diagnóstico, profilaxis o tratamiento. 73. Significación estadística, nivel de (significance level): Riesgo que voluntariamente asume el investigador de equivocarse al rechazar la hipótesis nula, cuando en realidad ésta es verdadera. Es el mismo valor que el del error tipo I. 74. Simple ciego, estudio (single blind): Estudio donde el sujeto desconoce el grupo de tratamiento al que pertenece. 75. Tasa de descuento (discount rate): Tasa utilizada para convertir costes y beneficios futuros (horizonte mayor de un año) en su valor presente o actualizado. Los valores utilizados normalmente oscilan entre el 0 y el 10%. 76. Tecnologías Médicas: El termino tecnologías médicas incluye fármacos, equipamientos médicos y dispositivos, procedimientos y técnicas médicas y quirúrgicas susceptibles de ser utilitzados por los profesionales de la medicina para la prevención, diagnóstico, tratamiento y rehabilitación de condiciones clínicas concretas, como también se incluyen los sistemes de soporte, organización y administración en la atención sanitaria. 77. Utilidades: Unidad de medida que se refiere a las preferencias del paciente o el grado de satisfacción que se obtiene con la alternativa evaluada. 78. Valor (value): Es una medida cardinal de las preferencias por (o deseabilidad de) un determinado nivel de estado de salud, o un efecto específico sobre la salud, medido bajo condiciones de certidumbre. 79. Variable principal de valoración (end-point): Se refiere a la variable que será considerada como más importante en la evaluación final de los resultados. Debe ser relevante desde el punto de vista clínico y lo más objetiva posible. - 93 - Manual de Selección de Medicamentos ANEXO Nº 5 FORMULARIO NACIONAL DE MEDICAMENTOS DTO. N° 194 DE 2005 (Actualizado a Mayo de 2010) GRUPO 1 01.00 MEDICAMENTOS USADOS EN ANESTESIA Y GASES MEDICINALES 01.01 Anestésicos generales 01.01.01 Agentes para administración intravenosa KETAMINA (Clorhidrato) Solución inyectable 50 mg/mL Alternativa: Propofol Emulsión acuosa 10 mg/mL TIOPENTAL Sódico Polvo para solución inyectable 0,5 g Polvo para solución inyectable 1 g 01.01.02 Agentes volátiles para inhalación HALOTANO Solución para inhalación Alternativa: Isoflurano Solución para inhalación SEVOFLURANO Solución para inhalación 01.01.03 Gases Medicinales OXIDO NITROSO OXIGENO 01.02 Anestésicos locales BUPIVACAINA (Clorhidrato) LIDOCAINA (Clorhidrato) 01.03 Gas Gas Solución inyectable 0,5% Solución inyectable 0,75% Solución inyectable 2% (11.02) Gel tópico 2% Gel tópico 4% Solución inyectable hiperbárica 5% Carpule uso odontológico 2% c/s vasocontrictor Solución oral 4% Spray 4% Spray 10% Agentes usados en premedicación anestésica ATROPINA Sulfato Solución inyectable 1 mg/mL DROPERIDOL Solución inyectable 2,5 mg/mL HIDRATO DE CLORAL (b) Solución oral 10% *DIAZEPAM (b) Solución inyectable 5 mg/mL Alternativa: *Midazolam (Clorhidrato) (b) Solución inyectable 5 mg/mL *Alternativa de Diazepam y Midazolam: Etomidato Solución inyectable 2 mg/mL 01.04 Relajantes musculares 01.04.01 Agentes despolarizantes SUXAMETONIO Cloruro de Polvo para solución inyectable 100 mg Polvo para solución inyectable 500 mg 01.04.02 Agentes no despolarizantes ATRACURIO Besilato de Solución inyectable 10 mg/mL PANCURONIO Bromuro de Solución inyectable 2 mg/mL ROCURONIO Bromuro de Solución inyectable 10 mg/mL - 94 - (16.04) (20.05) Manual de Selección de Medicamentos Alternativa: Vecuronio Bromuro de 01.04.03 Agentes Colinérgicos NEOSTIGMINA (Metilsulfato) PIRIDOSTIGMINA Bromuro de 01.04.04 Otros Agentes Relajantes BACLOFENO CICLOBENZAPRINA (Clorhidrato) DANTROLENO (Sódico) 01.05 Polvo liofilizado para solución inyectable 4 mg Polvo liofilizado para solución inyectable 10 mg Solución inyectable 0,50 mg/mL Comprimido 60 mg (16.07) (16.07) Comprimido 10 mg Comprimido 25 mg Comprimido 10 mg Cápsula 100 mg Polvo para solución inyectable 20 mg Analgésicos opiáceos y antagonistas FENTANILO (a) Solución inyectable 0,05 mg/mL METADONA (a) Solución inyectable 5 mg/mL MORFINA (Clorhidrato) (a) Solución inyectable 10 mg/mL Solución inyectable 20 mg/mL NALOXONA (Clorhidrato) Solución inyectable 0,4 mg/mL Solución inyectable 0,01 mg/mL (04.00) PETIDINA (a) TRAMADOL (Clorhidrato) Solución inyectable 50 mg/mL Solución inyectable 50 mg/mL GRUPO 2 02.00 ANALGÉSICOS OPIÁCEOS, NO OPIÁCEOS, ANTIGOTOSOS Y ANTIRREUMÁTICOS NO ESTEROIDALES 02.01 Analgésicos no opiáceos ACIDO ACETILSALICILICO DICLOFENACO (Sódico) IBUPROFENO KETOPROFENO METAMIZOL SODICO PARACETAMOL 02.02 Analgésicos opiáceos * CODEÍNA FOSFATO (a) METADONA (Clorhidrato) (a) Comprimido 100 mg Comprimido 500 mg Comprimido 25 mg Comprimido 50 mg Solución inyectable 25 mg/mL Supositorio infantil 12,5 mg Gragea o cápsula 200 mg Gragea o cápsula 400 mg Gragea o cápsula 600 mg Suspensión oral 100 mg /5 mL Suspensión oral 200 mg /5 mL Solución inyectable 50 mg/mL Comprimido 300 mg Solución inyectable 0,5 g/mL Supositorio 250 mg Comprimido 100 mg Comprimido 500 mg Comprimido 80 mg Supositorio 250 mg Supositorio 125 mg Solución oral para gotas 100 mg/mL Solución oral 6% Comprimido 10 mg - 95 - (11.05) (11.05) Manual de Selección de Medicamentos MORFINA (Clorhidrato) (a) MORFINA (Sulfato) (a) Alternativas: Morfina (Sulfato) (a) TRAMADOL (Clorhidrato) Solución oral para gotas 10 mg/mL Cápsula o comprimido 100 mg Cápsula o comprimido 30 mg Cápsula o comprimido 60 mg Cápsula o comprimido acción sostenida 10 mg Cápsula o comprimido acción sostenida 30 mg Cápsula o comprimido acción sostenida 60 mg Cápsula o comprimido acción sostenida 100 mg Cápsula acción sostenida 100 mg Solución oral para gotas 100 mg/mL * Analgésicos opiáceos parenterales ver Grupo 01.05 02.03 02.04 Antigotosos ALOPURINOL COLCHICINA Comprimido 300 mg Comprimido 100 mg Comprimido 0,5 mg Antirreumáticos no esteroidales PENICILAMINA AZATIOPRINA CICLOFOSFAMIDA METOTREXATO SULFASALAZINA Comprimido o cápsula 250 mg Comprimido 50 mg Comprimido 50 mg Comprimido 2,5 mg Comprimido 500 mg (04.00) (07.02) (07.01.01) (07.01.02) (16.03) GRUPO 3 03.00 MEDICAMENTOS ANTIALERGICOS Y USADOS EN EL TRATAMIENTO DE LA ANAFILAXIA 03.01 Antihistamínicos H1 CLORFENAMINA LORATADINA 03.02 Comprimido 4 mg Solución inyectable 10 mg/mL Jarabe 2,5 mg/5 mL Comprimido 10 mg Jarabe 5 mg/5 mL Adrenérgicos EPINEFRINA (Clorhidrato) Solución inyectable 1 mg/mL ISOPRENALINA (Clorhidrato) NOREPINEFRINA (Bitartrato) Solución inyectable 1 mg/mL Solución inyectable 1 mg/mL 03.03 Glucocorticoides HIDROCORTISONA (Succinato) PREDNISONA (11.02;11.04; 21.01.04) (11.02; 11.04) (11.02; 11.04) Polvo para solución inyectable 100 mg (17.01.01) Polvo para solución inyectable 500 mg (17.01.01) Comprimido 5 mg (07.03; 17.01.01) Comprimido 20 mg (07.03; 17.01.01) - 96 - Manual de Selección de Medicamentos GRUPO 4 04.00 ANTÍDOTOS Y OTRAS SUBSTANCIAS USADAS EN EL TRATAMIENTO DE INTOXICACIONES ACETILCISTEINA ATROPINA Sulfato CALCIO EDETATO (edetato de calcio y sodio) CARBÓN ACTIVADO DEFEROXAMINA DIMERCAPROL FLUMAZENIL HIPOSULFITO DE SODIO NALOXONA (Clorhidrato) (01.05) NITRITO DE SODIO *OBIDOXIMA Cloruro de PENICILAMINA *PRALIDOXIMA Ioduro de Solución inyectable 20% Solución para nebulización 10% Solución inyectable 2,5 mg/mL Solución inyectable 200 mg/mL Polvo para suspensión oral Polvo liofilizado para solución inyectable 500 mg Solución oleosa inyectable 10% Solución inyectable 0,1 mg/mL Solución inyectable 10% Solución inyectable 0,01 mg/mL Solución inyectable 30 mg/mL Solución inyectable 250 mg/mL Comprimido o cápsula 250 mg Polvo para solución inyectable 1 g (02.04) *Obidoxima y Pralidoxima son alternativas uno del otro de acuerdo a disponibilidad GRUPO 5 05.00 ANTICONVULSIVANTES Y ANTIEPILÉPTICOS ACIDO VALPROICO CARBAMAZEPINA CLONAZEPAM (b) ETOSUXIMIDA FENITOINA (Sódica) FENOBARBITAL (Sódico) FENOBARBITAL (b) Alternativa Primidona Comprimido 200 mg Jarabe 250 mg/5 mL Solución oral para gotas 10 mg/gota Comprimido 200 mg Comprimido 0,5 mg Comprimido 2 mg Solución oral 250 mg/5 mL Cápsula 250 mg Comprimido 100 mg Solución inyectable 50 mg/mL Polvo para solución inyectable 200 mg/mL Comprimido 15 mg Comprimido 100 mg Comprimido 250 mg GRUPO 6 06.00 MEDICAMENTOS ANTIINFECCIOSOS 06.01 Antihelmínticos intestinales ALBENDAZOL Comprimido 200 mg MEBENDAZOL Comprimido 100 mg Suspensión oral 100 mg/5 mL NICLOSAMIDA Comprimido 500 mg 06.02 Antibacterianos 06.02.01 Beta lactámicos AMOXICILINA Cápsula 250 mg Cápsula 500 mg - 97 - (06.06) Manual de Selección de Medicamentos Comprimido 750 mg Polvo para suspensión oral 250 mg/5 mL Polvo para suspensión oral 500 mg/5 mL AMOXICILINA + ACIDO CLAVULANICO Comprimido 875 mg + 125 mg Comprimido 500 mg + 125 mg Alternativa: Amoxicilina + Acido Clavulánico Suspensión oral 500 mg + 125 mg AMOXICILINA + ACIDO CLAVULANICO Polvo para solución inyectable 1 g + 0,2 g Alternativa de 1° eleccion: Amoxicilina + Sulbactam Alternativa de 2° elección: Ampicilina + Sulbactam AMPICILINA Polvo para solución inyectable 1 g + 0,5 g Polvo para solución inyectable 1 g + 0,5 g Polvo para solución inyectable 500 mg Polvo para solución inyectable 1 g BENCILPENICILINA Polvo para solución inyectable 1.000.000 UI Polvo para solución inyectable 2.000.000 UI BENZATINA BENCILPENICILINA Polvo para solución inyectable 600.000 UI Polvo para solución inyectable 1.200.000 UI Polvo para solución inyectable 2.400.000 UI CLOXACILINA (Sódica) Cápsula o comprimido 250 mg Cápsula o comprimido 500 mg Polvo para solución inyectable 500 mg FENOXIMETIL PENICILINA (Potásica) Comprimido 400.000 UI FLUCLOXACILINA Polvo para suspensión oral 250 mg/5 mL 06.02.02 Cefalosporinas CEFADROXILO CEFAZOLINA CEFIXIMA CEFOTAXIMA CEFRADINA CEFTAZIDIMA CEFTRIAXONA (sal disódica) CEFUROXIMA 06.02.03 Aminoglicósidos AMIKACINA (Sulfato) GENTAMICINA (Sulfato) Cápsula 500 mg Suspensión oral 250 mg/5 mL Polvo para solución inyectable 1 g Cápsula 400 mg Polvo para solución inyectable 1 g Polvo para solución inyectable 2 g Polvo para solución inyectable 500 mg Comprimido 250 mg Cápsula 500 mg Suspensión oral 250 mg /5 mL Polvo para solución inyectable 1 g Polvo para solución inyectable 500 mg Polvo para solución inyectable 1 g Comprimido 250 mg Comprimido 500 mg Gránulos para suspensión oral 125 mg/5 mL Gránulos para suspensión oral 250 mg/5 mL Solución inyectable 50 mg/mL Solución inyectable 250 mg/mL Solución inyectable 40 mg/mL Solución inyectable 10 mg/mL Solución oftálmica 0,3% Ungüento oftálmico 0,3% - 98 - (18.01) (18.01) Manual de Selección de Medicamentos KANAMICINA NEOMICINA (Sulfato) TOBRAMICINA 06.02.04 Macrólidos AZITROMICINA CLARITROMICINA ERITROMICINA (Etilsuccinato) ERITROMICINA (Lactobionato) 06.02.05 Sulfonamidas COTRIMOXAZOL SULFADIAZINA 06.02.06 Quinolonas CIPROFLOXACINO (Clorhidrato) LEVOFLOXACINO 06.02.07 Otros antibacterianos CLINDAMICINA CLINDAMICINA (Fosfato) CLINDAMICINA (Clorhidrato) CLORANFENICOL Solución inyectable 50 mg/mL Comprimido 500 mg Solución oftálmica 0,3% Ungüento oftálmico 0,3% (18.01) (18.01) Comprimido 500 mg Polvo para suspensión oral 200 mg/5 mL Comprimido 250 mg Comprimido 500 mg Polvo para suspensión oral 250 mg/5 mL Comprimido 500 mg Polvo para suspensión oral 200mg/5 mL Polvo para suspensión oral 400 mg/5 mL Polvo para solución inyectable 1 g Comprimido SMT 400 + TMP 80 mg Comprimido SMT 800 + TMP160 mg Suspensión oral SMT 200 mg + TMP 40 mg/5 mL Solución inyectable SMT 80 mg + TMP 16 mg/mL Comprimido 500 mg Comprimido 500 mg Solución oftálmica 0,3% Ungüento oftálmico 0,3% Comprimido 500 mg Crema vaginal 2% Loción o gel 1% Solución inyectable 150 mg/mL Cápsula 300 mg Cápsula 250 mg Cápsula 500 mg Polvo para solución inyectable 1 g Solución oftálmica 0,5% (18.01) (18.01) (12.02) (12.02 (18.01) DAPSONA ERTAPENEM (Sódico) IMIPENEM + CILASTATINA METRONIDAZOL NITROFURANTOINA TETRACICLINA (Clorhidrato) Alternativa: Doxiciclina TETRACICLINA (Clorhidrato) VANCOMICINA (Clorhidrato) 06.03 Antituberculosos CICLOSERINA Ungüento oftálmico 1% (18.01) Comprimido 100 mg Polvo liofilizado para solución inyectable 1 g Polvo para solución inyectable 500 mg + 500 mg Solución inyectable 5 mg/mL Comprimido 50 mg Comprimido 100 mg Cápsula 250 mg Cápsula 500 mg Comprimido o cápsula 50 mg Comprimido o cápsula 100 mg Ungüento oftálmico 1% Polvo para solución inyectable 500 mg Polvo para solución inyectable 1 g Comprimido 250 mg - 99 - (18.01) Manual de Selección de Medicamentos ESTREPTOMICINA ETAMBUTOL (Clorhidrato) ETIONAMIDA ISONIAZIDA KANAMICINA PIRAZINAMIDA RIFAMPICINA 06.04 Antifúngicos AMFOTERICINA B (sódica) Alternativa: Fluconazol CLOTRIMAZOL Alternativa: Bifonazol FLUCONAZOL Alternativa: Itraconazol GRISEOFULVINA KETOCONAZOL MICONAZOL (Nitrato) NISTATINA TERBINAFINA (Clorhidrato) 06.05 Antivirales 06.05.01 Antiherpéticos ACICLOVIR Alternativa: Valaciclovir (Clorhidrato) GANCICLOVIR (Sódico) 06.05.02 Antirretrovirales ABACAVIR (Sulfato) AMPRENAVIR Polvo para solución inyectable 1 g Comprimido 200 mg Comprimido 400 mg Comprimido 250 mg Comprimido 100 mg Polvo para solución inyectable 1 g Comprimido 500 mg Cápsula 150 mg Cápsula 300 mg Suspensión oral 100 mg/5 Ml Polvo para solución inyectable 50 mg Solución inyectable 2 mg/mL Óvulo o comprimido vaginal 100 mg Óvulo o comprimido vaginal 500 mg Loción 1% Crema 1% Crema 1% Cápsula 150 mg Cápsula 100 mg Cápsula 300 mg Comprimido 500 mg Comprimido 200 mg Óvulo vaginal 400 mg Crema 2% Crema 2% Suspensión oral 100.000 UI /mL Comprimido 100.000 UI Comprimido vaginal 100.000 UI Pomada 100.000 UI /g Comprimido 250 mg Crema 5% Ungüento oftálmico 3% Suspensión oral 200 mg/5 mL Solución inyectable 25 mg/mL Polvo para solución inyectable 500 mg Comprimido 200 mg Comprimido 400 mg Comprimido 800 mg (12.01) (12.01) (12.01) (12.01) (12.01) (12.01) (12.01) (12.01) (12.01) (12.01) (12.01) (12.01) (12.03) (18.01) Comprimido 250 mg Comprimido 500 mg Polvo liofilizado para solución inyectable 500 mg Solución oral 20 mg/mL Comprimido o cápsula 300 mg Comprimido 150 mg - 100 - Manual de Selección de Medicamentos ATAZANAVIR (Sulfato) Comprimido 150 mg Comprimido 200 mg DIDANOSINA Polvo para suspensión oral 4 g Comprimido 250 mg Comprimido 400 mg Comprimido 100 mg EFAVIRENZ Comprimido 50 mg Comprimido 100 mg Comprimido 200 mg Comprimido 600 mg ESTAVUDINA Comprimido o cápsula 15 mg Comprimido o cápsula 20 mg Comprimido o cápsula 30 mg Comprimido o cápsula 40 mg INDINAVIR Cápsula 400 mg LAMIVUDINA Solución oral 10 mg/mL Comprimido 150 mg LAMIVUDINA + ZIDOVUDINA Comprimido recubierto 150 mg + 300 mg LAMIVUDINA+ZIDOVUDINA+ABACAVIR Comprimido 150 mg+300 mg+300 mg LOPINAVIR + RITONAVIR Comprimido 133,3 mg + 33,3 mg Suspensión oral 80mg + 20 mg/mL NELFINAVIR (Mesilato) Polvo oral 50 mg/g Comprimido 250 mg NEVIRAPINA Solución oral 10 mg/mL Comprimido 200 mg RITONAVIR Cápsula 100 mg Solución oral 80 mg/mL SAQUINAVIR (Mesilato) Cápsula 200 mg TENOFOVIR Comprimido 300 mg ZIDOVUDINA Suspensión oral 10 mg/mL Comprimido 300 mg 06.06 Antiprotozoarios METRONIDAZOL NICLOSAMIDA TINIDAZOL Comprimido vaginal 500 mg Comprimido 250 mg Comprimido 500 mg Comprimido 500 mg Comprimido 500 mg (06.01) GRUPO 7 07.00 MEDICAMENTOS ANTINEOPLASICOS, INMUNOSUPRESORES Y USADOS EN CUIDADOS PALIATIVOS 07.01 Citotóxicos o antineoplásicos 07.01.01 Agentes alquilantes BUSULFANO CICLOFOSFAMIDA CISPLATINO CARBOPLATINO Comprimido 2 mg Polvo para solución inyectable 200 mg Polvo para solución inyectable 500 mg Polvo para solución inyectable 1.000 mg Comprimido 50 mg Polvo para solución inyectable 10 mg Polvo para solución inyectable 25 mg Polvo para solución inyectable 50 mg Polvo para solución inyectable 150 mg - 101 - (02.04) Manual de Selección de Medicamentos Polvo para solución inyectable 450 mg Solución inyectable 10 mg/mL Comprimido 2 mg Polvo para solución inyectable 1 mg/mL Polvo para solución inyectable 100 mg Polvo para solución inyectable 1 g Cápsula 40 mg Comprimido 2 mg Polvo para solución inyectable 10 mg CLORAMBUCILO CLORMETINA DACARBAZINA IFOSFAMIDA LOMUSTINA MELFALAN TIOTEPA 07.01.02 Antimetabolitos CITARABINA Polvo para solución inyectable 100 mg Polvo para solución inyectable 500 mg Polvo para solución inyectable 1.000 mg Solución inyectable 20 mg/mL Solución inyectable 100 mg/mL Polvo liofilizado para solución inyectable 50 mg Solución inyectable 50 mg/mL Comprimido 50 mg Comprimido 2,5 mg (02.04) Solución inyectable 25 mg/mL Comprimido 40 mg FLUDARABINA (Fosfato) FLUORURACILO MERCAPTOPURINA METOTREXATO TIOGUANINA 07.01.03 Antibióticos antineoplásicos BLEOMICINA (Sulfato) DACTINOMICINA DAUNORUBICINA (Clorhidrato) DOXORUBICINA (Clorhidrato) IDARUBICINA MITOXANTRONA (Clorhidrato) 07.01.04 Antídotos antifólicos FOLINATO CALCICO 07.01.05 Antimitóticos PACLITAXEL VINBLASTINA (Sulfato) VINCRISTINA (Sulfato) 07.01.06 Otros citotóxicos ASPARAGINASA ETOPOSIDO HIDROXIUREA IMATINIB (Mesilato) MESNA Polvo para solución inyectable 15 mg Polvo para solución inyectable 0,5 mg Polvo para solución inyectable 20 mg Polvo para solución inyectable 10 mg Polvo para solución inyectable 50 mg Polvo para solución inyectable 10 mg Solución inyectable 2 mg/mL Comprimido o cápsula 15 mg Solución inyectable 3 mg/mL Solución inyectable 50 mg/mL Polvo liofilizado para solución inyectable 5 mg/mL Solución inyectable 6 mg/mL Polvo para solución inyectable 10 mg Polvo para solución inyectable 1 mg Polvo para solución inyectable 5 mg Polvo para solución inyectable 10.000 UI Solución inyectable 20 mg/mL Cápsula 500 mg Cápsula 50 mg Cápsula 100 mg Solución inyectable 100 mg/mL Comprimido 400 mg Comprimido 600 mg - 102 - Manual de Selección de Medicamentos Alternativa: Exemestano PEGASPARGASA PROCARBAZINA (Clorhidrato) TENIPOSIDO TOPOTECAN (Clorhidrato) 07.02 Inmunosupresores AZATIOPRINA BASILIXIMAB Alternativa: Daclizumab CICLOSPORINA MICOFENOLATO (Mofetilo) SIROLIMUS Alternativa: Everolimus TACROLIMUS TIMOGLOBULINA 07.03 Comprimido 25 mg Solución inyectable 750 UI /mL Cápsula 50 mg Solución inyectable 10 mg/mL Polvo liofilizado para solución inyectable 4 mg Comprimido 50 mg Polvo para solución inyectable 20 mg (02.04) Polvo para solución inyectable 25 mg Cápsula 25 mg Cápsula 50 mg Cápsula 100 mg Solución oral 100 mg/mL Comprimido 250 mg Comprimido 500 mg Solución oral 1 mg/mL Gragea 1 mg Comprimido 0,25 mg Comprimido 0,5 mg Comprimido 0,75 mg Comprimido 1 mg Cápsula 1 mg Polvo liofilizado para solución inyectable 25 mg Hormonas y antihormonas DEXAMETASONA (Fosfato sódico) Comprimido 0,5 mg (17.01.01) Solución inyectable 5 mg/mL (17.01.01) MEDROXIPROGESTERONA (Acetato) Comprimido 100 mg (17.05) Suspensión inyectable 500mg (17.05) METILPREDNISOLONA Polvo para solución inyectable 1.000 mg (17.01.01) (Succinato sódico) Polvo para solución inyectable 500 mg (17.01.01) PREDNISONA Comprimido 5 mg (03.03; 17.01.01) Comprimido 20 mg (03.03; 17.01.01) PROGESTERONA Solución oleosa inyectable 25 mg/mL (17.05) TAMOXIFENO (Citrato) Comprimido 10 mg Comprimido 20 mg 07.04 Coadyuvantes terapia oncológica y cuidados paliativos ACIDO ZOLEDRONICO Polvo liofilizado para solución inyectable 4 mg Alternativa: Pamidronato (Sódico) Polvo liofilizado para solución inyectable 60 mg Polvo liofilizado para solución inyectable 90 mg FILGRASTIM Solución inyectable 30.000.000 UI /mL Solución inyectable 48.000.000 UI /mL INTERFERON alfa Polvo liofilizado p/ solución inyectable 3.000.000 UI (2b recombinante) Polvo liofilizado p/ solución inyectable 5.000.000 UI Solución inyectable 6.000.000 UI /mL Solución inyectable 10.000.000 UI /mL - 103 - Manual de Selección de Medicamentos GRUPO 8 08.00 ANTIPARKINSONIANOS BROMOCRIPTINA LEVODOPA + CARBIDOPA Alternativa: Levodopa + Benserazida TRIHEXIFENIDILO (Clorhidrato) Comprimido 2,5 mg Comprimido 5 mg Cápsula 250 mg + 25 mg Comprimido 200 mg + 50 mg Comprimido 2 mg GRUPO 9 09.00 MEDICAMENTOS USADOS EN TRASTORNOS SANGUÍNEOS 09.01 Antianémicos ACIDO FOLICO Comprimido 1 mg Comprimido 5 mg CIANOCOBALAMINA Solución inyectable 0,1 mg/mL COMPLEJO HIDROXIDO Solución inyectable 20 mg (Fe°) /mL FERRICO SACAROSA Alternativas: Complejo Hierro Dextrán Solución inyectable 50 mg (Fe°) /mL Complejo Hierro GluconatoSolución inyectable 62,5 mg (Fe°) /5 mL Sódico *EPOETINA FERROSO GLUCONATO FERROSO SULFATO PIRIDOXINA (Clorhidrato) Polvo para solución inyectable 2.000 UI Solución oral para gotas 200 mg/mL Comprimido 200 mg Solución oral para gotas 125 mg/mL Solución inyectable 100 mg/mL *La denominación comúnmente conocida es Eritropoyetina 09.02 Anticoagulantes y antagonistas ACENOCUMAROL FITOMENADIONA HEPARINA SODICA PROTAMINA Sulfato de Comprimido 4 mg Solución inyectable 10 mg/mL Solución inyectable 5.000 U.I/mL Solución inyectable 10 mg/mL (23.01) GRUPO 10 10.00 PRODUCTOS SANGUINEOS Y SUCEDANEOS DEL PLASMA ALBUMINA HUMANA DEXTRAN FACTOR VIII Solución inyectable 20% Solución inyectable 6% Polvo liofilizado para solución inyectable 250 UI Polvo liofilizado para solución inyectable 500 UI Polvo liofilizado para solución inyectable 1.000 UI FACTOR IX Polvo liofilizado para solución inyectable 250 UI Polvo liofilizado para solución inyectable 500 UI Polvo liofilizado para solución inyectable 1.000 UI Solución para infusión 35 g poligenina en 1.000 mL POLIPEPTIDOS DE GELATINA P.M 30.000 - 104 - Manual de Selección de Medicamentos GRUPO 11 11.00 MEDICAMENTOS CARDIOVASCULARES 11.01 Antianginosos ATENOLOL Comprimido 50 mg Comprimido 100 mg ISOSORBIDA Dinitrato de Comprimido sublingual 5 mg Comprimido 10 mg NITROGLICERINA Solución inyectable 0,05 mg/mL Comprimido 0,6 mg PROPRANOLOL (Clorhidrato) Comprimido 10 mg Comprimido 40 mg Comprimido 80 mg VERAPAMILO (Clorhidrato) Gragea 80 mg Gragea 120 mg Solución inyectable 2,5 mg/mL 11.02 Antiarrítmicos AMIODARONA (Clorhidrato) Comprimido 200 mg Solución inyectable 50 mg/mL ATENOLOL Comprimido 50 mg Comprimido 100 mg LANATOSIDO C Solución inyectable 0,2 mg/mL DIGOXINA Comprimido 0,25 mg EPINEFRINA (Clorhidrato) Solución inyectable 1 mg/mL ISOPRENALINA (Clorhidrato) LIDOCAINA (Clorhidrato) NOREPINEFRINA (Bitartrato) PROPRANOLOL (Clorhidrato) QUINIDINA VERAPAMILO (Clorhidrato) 11.03 Antihipertensivos ATENOLOL CAPTOPRIL ENALAPRIL (Maleato) HIDRALAZINA (Clorhidrato) Alternativa: Labetalol (Clorhidrato) HIDROCLOROTIAZIDA LOSARTAN (Potásico) METILDOPA NIFEDIPINO Alternativa: Nitrendipino Solución inyectable 1 mg/mL Solución inyectable 2% Solución inyectable 1 mg/mL Solución inyectable 1 mg/mL Comprimido 10 mg (11.01; 11.03) Comprimido 40 mg Comprimido 80 mg Comprimido 200 mg Gragea 80 mg Gragea 120 mg Solución inyectable 2,5 mg/mL (11.02; 11.03) (11.02; 11.03) (11.02; 11.03) (11.02; 11.03) (11.02; 11.03) (11.02) (11.02) (11.02) (11.01; 11.03) (11.01; 11.03) (11.04) (11.02;11.04; 21.01.04) (03.02; 11.04) (01.02) (03.02; 11.04) (11.01; 11.03) (11.01; 11.03) (11.01) (11.01) (11.01) Comprimido 50 mg (11.01; 11.02) Comprimido 100 mg (11.01; 11.02) Comprimido 25 mg Comprimido 50 mg Comprimido 5 mg Comprimido 10 mg Comprimido 20 mg Comprimido 25 mg Comprimido 50 mg Polvo para solución inyectable 20 mg/mL Solución inyectable 5 mg/mL Comprimido 50 mg (11.04; 15.01) Comprimido 50 mg Comprimido 250 mg Comprimido acción retardada 20 mg Comprimido 10 mg Comprimido 20 mg - 105 - Manual de Selección de Medicamentos NITROPRUSIATO DE SODIO mg PROPRANOLOL (Clorhidrato) 11.04 Polvo o liofilizado para solución inyectable 50 Comprimido 10 mg (11.01; 11.02) Comprimido 40 mg (11.01; 11.02) Comprimido 80 mg (11.01; 11.02) Medicamentos usados en insuficiencia cardíaca LANATOSIDO C Solución inyectable 0,2 mg/mL DIGOXINA Comprimido 0,25 mg DOPAMINA (Clorhidrato) Solución inyectable 40 mg/mL Alternativa: Dobutamina (clorhidrato) Solución inyectable 50 mg/mL EPINEFRINA (Clorhidrato) Solución inyectable 1 mg/mL HIDROCLOROTIAZIDA ISOPRENALINA (Clorhidrato) NOREPINEFRINA (Bitartrato) Comprimido 50 mg Solución inyectable 1 mg/mL Solución inyectable 1 mg/mL (11.02) (11.02; 11.04; 21.01.04) (11.03; 15.01) (03.02; 11.02) (03.02; 11.02) 11.05 Medicamentos Antitrombóticos y usados en el Infarto al Miocardio ACIDO ACETILSALICILICO Comprimido 100 mg (02.01) Comprimido 500 mg (02.01) ESTREPTOQUINASA Polvo liofilizado p/solución inyectable 250.000 UI Polvo liofilizado p/solución inyectable 750.000 UI Polvo liofilizado p/solución inyectable 1.500.000 UI 11.06 Hipolipidemiantes ATORVASTATINA Alternativas: Lovastatina Pravastatina GEMFIBROZILO 11.07 Comprimido 10 mg Comprimido 20 mg Comprimido 20 mg Comprimido 10 mg Comprimido 20 mg Comprimido 300 mg Medicamentos usados en el tratamiento del Ductus arterioso ALPROSTADIL Solución inyectable 500 mcg/mL INDOMETACINA Polvo para solución inyectable 1 mg GRUPO 12 12.00 MEDICAMENTOS USADOS EN DERMATOLOGIA 12.01 Antimicóticos CLOTRIMAZOL Óvulo o comprimido vaginal 500 mg Loción 1% Crema 1% Alternativa: Bifonazol Crema 1% GRISEOFULVINA Comprimido 500 mg KETOCONAZOL Crema 2% Óvulo vaginal 400 mg MICONAZOL (Nitrato) Crema 2% NISTATINA Comprimido vaginal 100.000 UI Pomada 100.000 UI /g TERBINAFINA (Clorhidrato) Comprimido 250 mg - 106 - (06.04) (06.04) (06.04) (06.04) (06.04) (06.04) (06.04) (06.04) (06.04) (06.04) (06.04) Manual de Selección de Medicamentos 12.02 12.03 12.04 12.05 Antiinfecciosos BACITRACINA + NEOMICINA CLINDAMICINA CLINDAMICINA (Fosfato) Pomada 5 mg + 500 UI /g Crema vaginal 2% Loción o gel 1% (06.02.07) (06.02.07) Antivirales ACICLOVIR Crema 5% (06.05.01) Antiinflamatorios y antipruriginosos CLOBETAZOL (Propionato) Crema 0,05% HIDROCORTISONA (Acetato) Ungüento dérmico 1% MOMETASONA (Furoato) Crema 0,1% Escabicidas y pediculicidas CROTAMITON (17.01.01) (17.01.01) (17.01.01) Crema 10% Loción tópica 10% Alternativa: DELTAMETRINA + PIPERONIL BUTÓXIDO Loción 20 mg + 2,5 mg Champú 20 mg + 2,5 mg VASELINA AZUFRADA Dto. 54/09. Nº 2 D. Of. 10.11.09 Ungüento 6% GRUPO 13 13.00 PRODUCTOS FARMACEUTICOS UTILIZADOS EN DIAGNÓSTICO 13.01 Medios de contraste radiológico ACEITE DE ADORMIDERA IODADA Solución inyectable 480 mg iodo/mL BARIO SULFATO Polvo para suspensión oral DIATRIZOATO DE SODIO + Solución inyectable 76% (370 mg iodo/mL) DIATRIZOATO DE MEGLUMINA IODIXANOL Solución inyectable 270 mg iodo/mL Solución inyectable 320 mg iodo/mL IOHEXOL Solución inyectable 350 mg iodo/mL IOXITALAMATO DE MEGLUMINA Solución inyectable 300 mg iodo/mL IOXITALAMATO DE MEGLUMINA + Solución inyectable 350 mg iodo/mL IOXITALAMATO DE SODIO 13.02 Otros GLUCAGON Polvo para solución inyectable1 mg/mL GRUPO 14 14.00 DESINFECTANTES Y ANTISEPTICOS AGUA OXIGENADA ALCOHOL ETILICO CLORHEXIDINA GLUCONATO GLUTARAL POVIDONA (Iodada) TRICLOSAN Solución uso externo 10 vol. Solución uso externo 30 vol. Solución desnaturalizada 70° Solución uso externo 2% Solución uso externo 4% Solución 2% Solución 10% Jabón 1% Jabón 2% - 107 - (17.06) Manual de Selección de Medicamentos GRUPO 15 15.00 DIURETICOS 15.01 Diuréticos tiazídicos HIDROCLOROTIAZIDA 15.02 15.03 15.04 15.05 Diuréticos de asa FUROSEMIDA Diuréticos depletores de potasio ESPIRONOLACTONA Diuréticos osmolares MANITOL Comprimido 50 mg (11.03; 11.04) Comprimido 40 mg Solución inyectable 20 mg/mL Solución oral 10 mg/mL Comprimido o gragea 25 mg Comprimido o gragea 100 mg Solución inyectable 15% Inhibidores de la anhidrasa carbónica ACETAZOLAMIDA Comprimido 250 mg (18.04) GRUPO 16 16.00 MEDICAMENTOS UTILIZADOS EN EL APARATO DIGESTIVO 16.01 Antiácidos y otros medicamentos antiulcerosos ALUMINIO HIDROXIDO Suspensión oral 6% Comprimido 500 mg RANITIDINA Comprimido 150 mg Comprimido 300 mg Solución inyectable 10 mg/mL Alternativa: Famotidina Comprimido 20 mg Comprimido 40 mg Solución inyectable 10 mg/mL OMEPRAZOL Cápsula c/gránulos c/recubrimiento entérico 20 mg 16.02 Antieméticos CLORPROMAZINA (Clorhidrato) DOMPERIDONA METOCLOPRAMIDA (Clorhidrato) ONDANSETRON (Clorhidrato) TIETILPERAZINA Comprimido 25 mg Solución inyectable 12,5 mg/mL Solución oral para gotas 40 mg/mL Comprimido o cápsula 10 mg Supositorio pediátrico 30 mg Solución oral para gotas 10 mg/mL Solución inyectable 2,5 mg/mL Solución inyectable 5 mg/mL Solución oral para gotas 2 mg/mL Comprimido 10 mg Solución inyectable 2 mg/mL Supositorio 16 mg Gragea 6,5 mg Solución inyectable 6,5 mg/mL Supositorio 6,5 mg - 108 - (20.01.01) (20.01.01) (20.01.01) Manual de Selección de Medicamentos 16.03 16.04 Antiinflamatorios SULFASALAZINA Antiespasmódicos ATROPINA Sulfato ESCOPOLAMINA Butilbromuro de Comprimido 500 mg (02.04) Solución inyectable 1 mg/mL Gragea 20 mg Supositorio 20 mg Solución inyectable 20 mg/mL (01.03) Alternativa: Pargeverina (Clorhidrato)Solución inyectable 5 mg/mL PAPAVERINA (Clorhidrato) Solución inyectable 40 mg/mL 16.05 Laxantes o estimulantes de la evacuación intestinal ACEITE DE RICINO Aceite FOSFATOS Solución oral Solución rectal MAGNESIO Sulfato de Solución oral 25% VASELINA LIQUIDA Aceite mineral 16.06 Medicamentos usados en la diarrea LOPERAMIDA Comprimido 2 mg SALES REHIDRATANTES Solución oral 60 mEq de sodio/ litro Solución oral 90 mEq de sodio/litro Otros LACTULOSA Solución oral 65% NEOSTIGMINA (Metilsulfato) Solución inyectable 0,50 mg/mL (01.04.03) NEOSTIGMINA Bromuro de Comprimido 15 mg Alternativa: Piridostigmina Bromuro de Comprimido 60 mg PANCREALIPASA Cápsula 4.500 UI Cápsula 10.000 UI Cápsula 18.000 UI 16.07 (01.04.03) GRUPO 17 17.00 HORMONAS Y OTROS MEDICAMENTOS ENDOCRINOS Y ANTICONCEPTIVOS 17.01 Medicamentos que modifican las funciones de la corteza suprarrenal, hormonas adrenales y substancias sintéticas 17.01.01 Glucocorticoides BETAMETASONA BETAMETASONA (Fosfato disódico) CLOBETASOL (Propionato) DEXAMETASONA (Fosfato sódico) HIDROCORTISONA HIDROCORTISONA (Acetato) HIDROCORTISONA (Succinato) METILPREDNISOLONA (Acetato) METILPREDNISOLONA (Succinato sódico) MOMETASONA (Furoato) Comprimido 0,6 mg Solución inyectable 4 mg/mL Crema 0,05% Comprimido 0,5 mg Solución inyectable 5 mg/mL Comprimido 20 mg Ungüento dérmico 1% Polvo para solución inyectable 100 mg Polvo para solución inyectable 500 mg Solución inyectable 80 mg/mL Solución inyectable 40 mg/mL Polvo para solución inyectable 500mg Polvo para solución inyectable 1.000 mg Crema 0,1% - 109 - (12.04) (07.03) (07.03) (12.04) (03.03) (03.03) (07.03) (07.03) (12.04) Manual de Selección de Medicamentos PREDNISONA 17.01.02 Mineralocorticoides FLUDROCORTISONA (Acetato) 17.02 17.03 17.04 Andrógenos NANDROLONA (Decanoato) TESTOSTERONA (Enantato) Estrógenos ESTRADIOL Valerato de ESTROGENOS CONJUGADOS 17.06 (03.03; 07.03) (03.03; 07.03) Comprimido 0,1 mg Solución oleosa inyectable 25 mg/mL Solución inyectable 250 mg/mL Anticonceptivos LEVONORGESTREL LEVONORGESTREL Alternativa: Levonorgestrel LEVONORGESTREL + ETINILESTRADIOL MEDROXIPROGESTERONA (Acetato) MEDROXIPROGESTERONA (Acetato) + ESTRADIOL (Cipionato) NORETISTERONA (Enantato) + ESTRADIOL Valerato de ETINILESTRADIOL 17.05 Comprimido 5 mg Comprimido 20 mg Comprimido 0,03 mg Comprimido 0,75 mg 9 Comprimido 1.5. mg Comprimido 0,03 mg + 0,15 mg Solución inyectable 150 mg Solución inyectable 125 mg + 5 mg Solución inyectable 50 mg + 5 mg Solución oleosa inyectable 10 mg/mL Comprimido 0,625 mg Comprimido 0,3 mg Comprimido 0,02 mg Progestinas/progestágenos HIDROXIPROGESTERONA (Caproato) Solución oleosa inyectable 250 mg/mL MEDROXIPROGESTERONA (Acetato) Comprimido 5 mg Comprimido 100 mg Suspensión inyectable 500 mg NORETISTERONA (Acetato) Comprimido 10 mg PROGESTERONA Solución oleosa inyectable 25 mg/mL Medicamentos usados en el tratamiento de la diabetes mellitus CLORPROPAMIDA Comprimido 250 mg GLIBENCLAMIDA Comprimido 5 mg GLUCAGON Polvo p/solución inyectable 1 mg/mL INSULINA HUMANA CRISTALINA Solución inyectable 100 UI /mL INSULINA HUMANA ISOFANA (NPH) Suspensión inyectable 100 UI /mL INSULINA ultrarrápida Solución inyectable 100 UI /mL METFORMINA (Clorhidrato) Comprimido 850 mg TOLBUTAMIDA Comprimido 500 mg (07.03) (07.03) (07.03) (13.02) 17.07 Medicamentos utilizados en tratamiento de enfermedades de la tiroides 17.07.01 Preparados de tiroides LEVOTIROXINA SODICA Comprimido 0,05 mg Comprimido 0,1 mg 17.07.02 Medicamentos antitiroideos IODO Solución 5% PROPILTIOURACILO Comprimido 50 mg 9 Frase agregada, como aparece en el texto, por el Nº 1º, del dto. Nº 15/10, del Ministerio de Salud, publicado en el Diario Oficial de 08.05.10 - 110 - Manual de Selección de Medicamentos 17.08 Otros medicamentos usados en trastornos endocrinos DESMOPRESINA (Acetato) Solución intranasal 0,1 mg/mL GONADOTROFINA CORIONICA Polvo para solución inyectable 5.000 UI GRUPO 18 18.00 MEDICAMENTOS USADOS EN OFTALMOLOGÍA 18.01 Antiinfecciosos ACICLOVIR Ungüento oftálmico 3% (06.05.01) CIPROFLOXACINO (Clorhidrato) Solución oftálmica 0,3% Ungüento oftálmico 0,3 CLORANFENICOL Solución oftálmica 0,5% (06.02.07) Ungüento oftálmico 1% (06.02.07) GENTAMICINA (Sulfato) Solución oftálmica 0,3% (06.02.03) Ungüento oftálmico 0,3% (06.02.03) TETRACICLINA (Clorhidrato) Ungüento oftálmico 1% (06.02.07) TOBRAMICINA Solución oftálmica 0,3% (06.02.03) Ungüento oftálmico 0,3% (06.02.03) TOBRAMICINA + DEXAMETASONA Solución oftálmica (0,3 mg + 0,1 mg) /mL 18.02 Antiinflamatorios BETAMETASONA (Fosfato disódico) DEXAMETASONA DICLOFENACO PREDNISOLONA (Acetato) 18.03 18.04 Anestésicos locales PROXIMETACAINA Antiglaucomatosos ACETAZOLAMIDA BETAXOLOL (Clorhidrato) DIPIVEFRINA (Clorhidrato) PILOCARPINA TIMOLOL (Maleato) 18.05 Midriáticos y ciclopléjicos ATROPINA Sulfato CICLOPENTOLATO (Clorhidrato) FENILEFRINA TROPICAMIDA 18.06 18.07 Medios de diagnóstico FLUORESCEINA Otros HIALURONATO SODICO HIALURONIDASA HIPROMELOSA Solución oftálmica 0,1% Ungüento oftálmico 0,1% Solución oftálmica 0,1% Ungüento oftálmico 0,1% Solución oftálmica 0,1% Suspensión oftálmica 0,12% Suspensión oftálmica 1% (17.01.01) (17.01.01) Solución oftálmica 0,5% Comprimido 250 mg Solución oftálmica 0,5% Solución oftálmica 0,1% Solución oftálmica 2% Solución oftálmica 4% Solución oftálmica 0,25% Solución oftálmica 0,5% (15.05) Solución oftálmica 0,33% Solución oftálmica 0,5% Solución oftálmica 1% Solución oftálmica 1% Solución oftálmica 2,5% Solución oftálmica 1% Solución inyectable 10% Solución oftálmica 2% Solución inyectable 1% Polvo liofilizado para solución inyectable 150 UI Solución oftálmica 0,3% - 111 - Manual de Selección de Medicamentos GRUPO 19 19.00 MEDICAMENTOS USADOS EN OBSTETRICIA 19.01 Oxitócicos METILERGOMETRINA (Maleato) Comprimido 0,2 mg Solución inyectable 0,2 mg/mL OXITOCINA Solución inyectable 5 UI /mL 19.02 Tocolítcos SALBUTAMOL (Sulfato) Alternativa: Fenoterol (Bromhidrato) 19.03 Otros MAGNESIO Sulfato de Solución inyectable 0,5 mg/mL Comprimido 2 mg Comprimido 4 mg Solución inyectable 0,05 mg/mL Comprimido 5 mg Solución inyectable 25% GRUPO 20 20.00 MEDICAMENTOS PSICOTERAPEUTICOS 20.01 Neurolépticos antisicóticos 20.01.01 Fenotiazínicos CLORPROMAZINA (Clorhidrato) Comprimido 25 mg Solución inyectable 12,5 mg/mL Solución oral para gotas 40 mg/mL Comprimido 100 mg FLUFENAZINA (Decanoato) Solución inyectable 25 mg/mL TIORIDAZINA Gragea o comprimido 25 mg Gragea o comprimido 100 mg Jarabe 2 mg /5 mL 20.01.02 Butirofenonas HALOPERIDOL (Decanoato) 20.01.03 Otros heterocíclicos CLOZAPINA RISPERIDONA (21.01.01) (21.01.01) (21.01.01) Solución inyectable 5 mg/mL Solución inyectable 50mg/mL Comprimido 1 mg Comprimido 5 mg Comprimido 25 mg Comprimido 50 mg Comprimido 100 mg Comprimido 1 mg Comprimido 3 mg Alternativa a Risperidona: Olanzapina Comprimido 5 mg Comprimido 10 mg Comprimido 15 mg Comprimido 20 mg Alternativas a Risperidona y Olanzapina: Quetiapina (Fumarato) Comprimido 25 mg Comprimido 100 mg Comprimido 200 mg Alternativas a Risperidona y Quetiapina: Ziprasidona (Clorhidrato) Comprimido 20 mg Comprimido 40 mg Comprimido 60 mg Comprimido 80 mg - 112 - (22.02) (16.02) (16.02) (16.02) Manual de Selección de Medicamentos SULPIRIDA Comprimido o cápsula 300 mg 20.02 Medicamentos usados en el trastorno del ánimo 20.02.01 Antidepresivos 20.02.02.01 Antidepresivos Tricíclicos AMITRIPTILINA (Clorhidrato) Comprimido 25 mg IMIPRAMINA (Clorhidrato) Gragea o cápsula 10 mg Gragea o cápsula 25 mg 20.02.01.02 Inhibidores de la recaptación de serotonina FLUOXETINA Cápsula 20 mg SERTRALINA Comprimido 50 mg 20.02.01.03 Estabilizador de ánimo LITIO Carbonato de Comprimido 300 mg 20.02.02 Ansiolíticos y medicamentos usados en trastornos del sueño ALPRAZOLAM (b) Comprimido 25 mg Comprimido 0,50 mg Solución oral para gotas 0,5 mg/mL DIAZEPAM (b) Comprimido 5 mg Comprimido 10 mg LORAZEPAM (b) Comprimido 1 mg Comprimido 2 mg 20.03 Medicamentos usados en trastornos por déficit de atención METILFENIDATO (Clorhidrato) (b) Comprimido 10 mg 20.04 Medicamentos usados en el tratamiento del alcoholismo DISULFIRAM Comprimido 500 mg Comprimido estéril para implante 100 mg 20.05 Medicamentos usados en otros trastornos psiquiátricos DIAZEPAM (b) Solución inyectable 5 mg/mL Alternativa: Lorazepam (b) Solución inyectable 4 mg/mL (01.03) GRUPO 21 21.00 MEDICAMENTOS QUE ACTUAN EN EL APARATO RESPIRATORIO 21.01 Broncodilatadores 21.01.01 Agonistas selectivos beta 2 SALBUTAMOL (Sulfato) Jarabe 2 mg/5 mL Suspensión para inhalacion oral 100 mcg/dosis Solución para nebulización 5mg/mL Solución inyectable 0,5 mg/mL (19.02) Comprimido 2 mg (19.02) Comprimido 4 mg (19.02) - 113 - Manual de Selección de Medicamentos 21.01.02 Antimuscarínicos IPRATROPIO Bromuro de 21.01.03 Xantinas AMINOFILINA TEOFILINA 21.01.04 Otros EPINEFRINA (Clorhidrato) 21.02 Glucocorticoides BECLOMETASONA (Dipropionato) Alternativa: Budesonida 21.03 21.04 21.05 Solución para inhalación 0,025% Suspensión para inhalación oral 0,02 mg/dosis Comprimido 100 mg Solución inyectable 25 mg/mL Solución oral 80 mg/ 15 mL Solución inyectable 1 mg/mL (03.02; 11.02; 11.04) Aerosol para inhalación 250 mcg/dosis Aerosol para inhalación 100 mcg/ dosis Suspensión para nebulización nasal y oral 0,050 mg/ dosis Aerosol para inhalación 200 mcg/dosis Suspensión para inhalación 200 mcg/dosis Mucolíticos SURFACTANTE PULMONAR Solución inyectable 25 mg/mL Enzimas DORNASA ALFA Solución inyectable 1,25 mg/mL Antitusígenos CLOBUTINOL (Clorhidrato) Comprimido 40 mg GRUPO 22 22.00 MEDICAMENTOS UTILIZADOS PARA CORREGIR PERTURBACIONES DEL MEDIO INTERNO 22.01 Azúcares GLUCOSA Solución inyectable 10% Solución inyectable 20% Solución inyectable 30% Solución inyectable 5% GLUCOSA + SODIO Cloruro Solución isotónica inyectable (según fórmula) 22.02 Electrolitos CALCIO Cloruro CALCIO Gluconato FOSFATO MONOPOTASICO MAGNESIO Sulfato de OLIGOELEMENTOS POTASIO Cloruro POTASIO Gluconato SODIO BICARBONATO Solución inyectable 10% Solución inyectable 10% Solución inyectable 15% Solución inyectable 25% (19.03) Solución inyectable (según fórmula) Solución inyectable 10% Elixir 31,2% Solución inyectable 8% Solución inyectable 5% Solución inyectable 2/3 M SODIO CLORURO Solución inyectable 0,9% Solución inyectable 10% SOLUCIONES PARA HEMODIALISIS Solución inyectable ácida o básica (según fórmula) SOLUCIONES PARA PERITONEO DIALISIS Solución inyectable Fórmulas PD 2 y PD 4 - 114 - Manual de Selección de Medicamentos SOLUCION RINGER LACTATO ZINC Sulfato Solución inyectable (según fórmula) Solución inyectable 0,88%, (1mg Zn°/mL) GRUPO 23 23.00 VITAMINAS Y OTROS NUTRIENTES 23.01 Vitaminas ACIDO ASCORBICO Comprimido 500 mg Comprimido 100 mg Solución inyectable 100 mg/mL ERGOCALCIFEROL Solución oral 300.000 UI /mL FITOMENADIONA Solución inyectable 10 mg/mL MENADIONA Bisulfito sódico de Solución inyectable 5 mg/mL POLIVITAMINICOS (Parenterales) Polvo liofilzado para solución inyectable (según fórmula) RETINOL Comprimido o cápsula 5.000 UI TIAMINA (Clorhidrato) Comprimido 10 mg Solución inyectable 100 mg/mL VITAMINAS A-C-D Solución oral para gotas (según fórmula) 23.02 Otros Nutrientes AMINOACIDOS Alternativa: Aminoácidos LIPIDOS (Intravenosos) GRUPO 24 24.00 Misceláneos FLUOR TOPICO Solución inyectable 8% Solución inyectable 6% Solución inyectable 8,5% Emulsión inyectable 10% Solución sellante, barniz 5% - 115 - (09.02) Manual de Selección de Medicamentos NOTAS EXPLICATIVAS 1.- Las sustancias sujetas a fiscalización internacional se señalan con: (a) a las afectas a la Convención Única sobre Estupefacientes e incorporadas al D.S. 404/83 que aprueba el Reglamento de Estupefacientes (b) a las incluidas en el Convenio sobre Sustancias Psicotrópicas e incorporadas al D.S. 405/83 que aprueba el Reglamento de Psicotrópicos 2.- Cuando un mismo medicamento aparece en más de un grupo o subgrupo, este hecho se señala con la numeración respectiva a continuación de la forma de presentación. 3.- Los productos contenidos en este listado se señalan de acuerdo a la denominación común internacional (DCI). Las sales o ésteres se indican con un paréntesis a continuación de la DCI cuando no forman parte del nombre 4.- Para los productos de este listado que estén disponibles con formas farmacéuticas diferentes de las señaladas, la presente nómina las incluirá indistintamente, sólo cuando correspondan a sistemas de liberación convencional para cada uno de los siguientes casos: a) comprimidos, cápsulas y grageas b) soluciones orales y suspensiones de uso oral c) óvulos vaginales y comprimidos vaginales - 116 - Manual de Selección de Medicamentos DPTO. POLÍTICAS FARMACÉUTICAS Y PROFESIONES MÉDICAS SUBSECRETARIA DE SALUD PÚBLICA – DIVISIÓN DE POLÍTICAS PÚBLICAS SALUDABLES Y PROMOCIÓN 2010 - 117 -