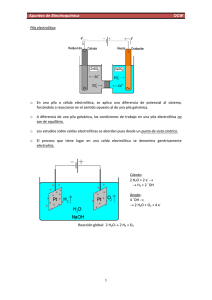
Actividades
Anuncio

UNIDAD 5 OBJETIVOS OXIDACIÓN–REDUCCIÓN Cuando termines de estudiar esta unidad serás capaz de: Determinar el nº de oxidación de un elemento en una molécula o ión. Reconocer si una reacción química es un proceso redox. Identificar el oxidante y el reductor, y las semirreacciones de oxidación y de reducción. LL A Ajustar una reacción redox por el método del ión electrón y resolver problemas de cálculos estequiométricos con ella. Conocer las principales sustancias oxidantes y reductoras. TI Establecer la fuerza relativa de oxidantes y reduc- tores a partir de los correspondientes potenciales de electrodo. AS Determinar el sentido en el que una reacción redox será espontánea. Describir las partes y el funcionamiento de una C pila y determinar su f.e.m. a partir de la tabla de potenciales de reducción. Escribir las reacciones en el ánodo y en el cátodo y la reacción global de la pila. Explicar la utilidad del puente salino. Conocer y clasificar las pilas comerciales. Cono- IE S R IB ER A D E Concepto tradicional. Número de oxidación. Reglas para asignar nos de oxidación. Concepto electrónico. Semirreacciones. Oxidante y reductor. Ajuste de reacciones redox. Método del ión−electrón. Medio ácido y básico. Principales especies oxidantes y reductoras. El agua oxigenada. Estequiometría de las reacciones redox. Pilas electroquímicas. La pila Daniell. Representación de las pilas. Electrodos de gases. Elec. normal de hidrógeno. Potenciales normales de reducción o de electrodo. Fuerza de oxidantes y reductores. Interpretación de la tabla de potenciales. Fuerza relativa de oxidantes y reductores. Sentido de una reacción redox. F.e.m. de una pila. Semirreacciones en los electrodos. Espontaneidad de un proceso redox. Pilas comerciales. Primarias. Leclanché o salina. Alcalinas. Tipos. Secundarias. Acumulador de plomo. Otros tipos: NiCd, NiMH, Litio Pilas de combustión. Electrólisis. CuCl2, NaCl fundido y disuelto. Electrólisis del agua. Reacciones en el ánodo Aplicaciones de la electrólisis Obtención de metales. Refino y purificación. Recubrimientos metálicos. Ley de Faraday. Acción de los ácidos sobre los metales. Ácidos no oxidantes. HCl. H2SO4 diluido Ácidos oxidantes. H2SO4 , HNO3. Corrosión y protección de metales. Formas de evitar la corrosión. Procesos metalúrgicos y siderúrgicos. El alto horno. QUÍMICA. 2º BCHTO. IES Ribera de Castilla. Tema 5 cer el proceso químico de las baterías de plomo, tanto en la carga como en la descarga, y determinar para todas ellas los riesgos de producir una contaminación ambiental al deshacerse de ellas. Describir las partes y el funcionamiento de una cuba electrolítica y de sus aplicaciones. Escribir las correspondientes reacciones. Realizar los cálculos que relacionen la cantidad de carga y de materia en los procesos electroquímicos. Conocer las reacciones de los ácidos con los metales. Determinar y explicar en que casos se comportarán como ácidos y como oxidantes. Conocer el mecanismo de los procesos de oxida- ción y corrosión de los metales mas corrientes, su importancia económica y la forma de evitarlos. Conocer los principales procesos metalúrgicos utilizados para obtener los metales a partir de sus minerales. Describir la estructura de un alto horno, las reac- ciones que tienen lugar en él y los productos que se obtienen. Pág 1 Potenciales normales de reducción a 25°C en disolución acuosa. Eo (voltios) Especies oxidantes frente al electrodo de hidrógeno. Producen la reacción: H2(g) → 2H+(aq) + 2e– y en el proceso se reducen. (semirreacción de reducción: cátodo) F2(g) + 2e– → 2F–(aq) O3(g) + 2H+(aq) + 2e– → O2(g) + H2O(l) 2.07 2- – S2O8 (aq) + 2e → 2SO4 (aq) 3+ – 2.01 2+ 1.82 – H2O2(aq) + 2H (aq) + 2e → 2H2O(l) 1.78 MnO4–(aq) + 8H+(aq) + 5e– → Mn2+(aq) + 4H2O(l) 1.49 Ce4+(aq) + e– → Ce3+(aq) – AS + TI Co (aq) + e → Co (aq) 1.44 – 1.36 C Cl2(g) + 2e → 2Cl (aq) 1.33 O2(g) + 4H+(aq) + 4e– → 2H2O(l) 1.23 E Cr2O72–(aq) + 14H+(aq) + 6e– → 2Cr3+(aq) + 7H2O(l) – + 2+ – D Br2(l) + 2e– → 2Br–(aq) – NO3 (aq) + 4H (aq) + 3e → NO(g) + 2H2O(l) 2+ – – A 2Hg (aq) + 2e → Hg2 (aq) – ER – Hg (aq) + 2e → Hg(l) + – – 0.90 0.85 Ag (aq) + e → Ag(s) 2+ 0.96 0.90 – ClO (aq) + H2O(l) + 2e → Cl (aq) + 2OH (aq) 2+ 1.07 0.80 0.80 Fe3+(aq) + e– → Fe2+(aq) 0.77 R IB Hg2 (aq) + 2e → 2Hg(l) 0.59 I2(s) + 2e– → 2I–(aq) 0.54 Cu+(aq) + e– → Cu(s) 0.52 IE S ClO2–(aq) + H2O(l) + 2e– → ClO–(aq) + 2OH–(aq) IO–(aq) + H2O(l) + 2e– → I–(aq) + 2OH–(aq) 0.49 ClO3–(aq) + H2O(l) + 2e– → ClO2–(aq) + 2OH–(aq) 0.35 Cu2+(aq) + 2e– → Cu(s) 0.34 AgCl(s) + e– → Ag(s) + Cl– (aq) 0.22 ClO4–(aq) + H2O(l) + 2e– → ClO3–(aq) + 2OH–(aq) 0.17 Cu2+(aq) + e– → Cu+(aq) 0.16 4+ – 2+ Sn (aq) + 2e → Sn (aq) QUÍMICA. 2º BCHTO. IES Ribera de Castilla. PODER OXIDANTE 2- LL A 2.87 0.15 Tema 5 Pág 2 Electrodo de referencia de hidrógeno. Su potencial es 0,00 V, (tomado arbitrariamente). 2H+(aq) + 2e– → H2(g) 0.00 Especies reductoras frente al electrodo de hidrógeno. Producen la reacción: Fe3+(aq) + 3e– → Fe(s) -0.04 – -0.13 Sn2+(aq) + 2e– → Sn(s) -0.14 Ni2+(aq) + 2e– → Ni(s) -0.23 2+ – 2+ – TI Pb (aq) + 2e → Pb(s) -0.40 AS Cd (aq) + 2e → Cd(s) Fe (aq) + 2e → Fe(s) -0.44 Cr3+(aq) + 3e– → Cr(s) C -0.74 Zn2+(aq) + 2e– → Zn(s) -0.76 - 2H2O(l) + 2e → H2(g) + 2OH (aq) – Mg (aq) + 2e → Mg(s) + – Na (aq) + e → Na(s) K+(aq) + e– → K(s) + – -0.83 -1.66 -2.38 -2.71 -2.76 ER Ca2+(aq) + 2e– → Ca(s) A 2+ D Al3+(aq) + 3e– → Al(s) E – PODER REDUCTOR 2+ LL A 2H+(aq) + 2e– → H2(g) y en el proceso se oxidan. (semirreacción de oxidación: ánodo) -2.92 -3.04 IB Li (aq) + e → Li(s) R Oxidantes: especies a la izquierda de la flecha. Reductores: especies a la derecha de la flecha. S La sustancia más oxidante de la tabla es el flúor mientras la más reductora es el litio. IE Un semisistema dado puede oxidar a cualquier otro que se encuentre por debajo en la tabla anterior. El valor positivo o negativo del potencial no tiene ningún sentido absoluto: un potencial negativo significa simplemente que el semisistema no puede ser reducido por el hidrógeno (potencial cero por convenio) pero sí por otras especies reductoras situadas por debajo. Ahora bien, como el sistema de referencia H+ / H2 está situado en una zona media de la serie electroquímica, los sistemas situados por encima del mismo es más habitual que actúen como oxidantes y los situados por debajo como reductores. QUÍMICA. 2º BCHTO. IES Ribera de Castilla. Tema 5 Pág 3 PILAS COMERCIALES CARACTERÍSTICAS GENERALES: (Ver los esquemas en las páginas 284−286) Tamaño reducido Voltaje constante Larga duración No deben ser contaminantes Posibilidad de recarga SALINAS o Pila LECLANCHÉ Zn(s) | MnO2, ZnCl2, NH4Cl, C en polvo | C(grafito) LL A PRIMARIAS (no recargables) 1,55 V ALCALINAS Zn(s) | ZnO(s), KOH(aq), MnO2(s), Mn2O3(s) | Acero 1,5 V AS Zn – Óxido de mercurio (pila botón) TI Zn – Dióxido de manganeso Zn(s) | ZnO(s), KOH(aq), HgO(s) | Hg(l) 1,35 V Muy contaminantes (Hg) Relojes, calculadoras, audífonos,... C Zn – Óxido de plata Zn(s) | ZnO(s), KOH(aq),Ag2O(s) | Ag(s) 1,8 V ACUMULADOR DE PLOMO (Batería de los automóviles) D E SECUNDARIAS O ACUMULADORES (recargables) Pb | Pb (aq), H2SO4(aq) | PbO2 (s) +2 + PbO2(s) + 4 H + SO4 A Cátodo –2 –2 Pb(s) + SO4 ER Ánodo Reacción global Contaminante (Pb y H2SO4) 2V + 2 e– → → PbSO4(s) + 2 e PbSO4(s) + 2 H2O(l) – Descarga Pb(s) + PbO2(s) + H2SO4(aq) 2 PbSO4(s) + 2 H2O(l) Carga R IB Descarga: Disminuye la concentración de H2SO4 Carga: Con corriente continua en sentido contrario al de la descarga. Se regenera el Pb y el PbO2 de los electrodos, y aumenta la concentración de H2SO4. Con el motor en marcha, la batería está siempre cargándose. Baterías de Ni–Cd (niquel cadmio) Baterías de Ni−MH (metal hidruro). Mayor capacidad de carga. Baterías de Li−Ión. Gran capacidad de carga con un peso y volumen reducidos. IE S Muy contaminante (Cd) PILAS DE COMBUSTIÓN De la reacción directa entre el hidrógeno y el oxígeno sólo se aprovecha el calor. En una pila de combustión, se aprovecha esta reacción para obtener electricidad. Su diseño es complicado ya que se necesitan depósitos de H2 y de O2, gases muy peligrosos y explosivos. Cátodo Ánodo ½ O2 + H2O + 2 e– → 2 OH– H2 + 2 OH– → 2 H2O + 2 e– Reacción global: H2(g) + ½ O2(g) → H2O(l) Se utilizan en naves espaciales y actualmente se investiga su utilización en los automóviles. Se trata de utilizar un motor eléctrico movido por un una pila de combustión. El combustible sería hidrógeno, en sustitución de la gasolina. QUÍMICA. 2º BCHTO. IES Ribera de Castilla. Tema 5 Pág 4 EL PROCESO SIDERÚRGICO Metalurgia: Es el proceso para obtener los metales a partir de sus minerales. La metalurgia del hierro recibe el nombre de Siderurgia. Mena: Mineral del que se obtiene el metal, que debe tener una concentración y unas propiedades físicas y químicas que hagan rentable su extracción. Ganga: Impurezas que acompañan a la mena y que deben ser eliminadas mediante operaciones físicas (trituración, flotación, lavados, etc.). Mena LL A Operaciones Premetalúrgicas Trituración Concentración (Preparación de la mena) Electrometalurgia Sulfuros Calcinación Óxidos ER IB Reducción química Menas de elementos muy reductores Reducción electrolítica R Metal S Afino Metal purificado IE Carbonatos A (Tratamiento químico de la mena) D Tostación Operaciones Metalúrgicas E C Vía térmica AS TI Mena concentrada Purificación del metal Utilización directa Preparación de aleaciones Calcinación: 4 FeCO3 + O2 2 Fe2O3 + 4 CO2 Tostación: 2 ZnS + 3 O2 2 ZnO + 2 SO2 2 PbS + 3 O2 2 PbO + 2 SO2 Reducción: Mn+ + ne– M QUÍMICA. 2º BCHTO. IES Ribera de Castilla. Tema 5 Pág 5 EL ALTO HORNO Tolvas Calentadores de aire Gas residual del alto horno Vagonetas Ladrillo refractario Aire Coque Mineral de hierro y caliza LL A Alto horno TI Chorro de aire caliente Arrabio AS Colada Escoria Carga C Minerales de hierro: Oligisto (hematites roja) Fe2O3 Magnetita Fe3O4 Limonita (hematites parda, óxido férrico hidratado) Fe2O3.nH2O Pirita FeS Siderita FeCO3 E Reacciones en un alto horno. ER A D Para la obtención del hierro en el alto horno, es necesario utilizar: Mineral de hierro. (óxidos y carbonatos). Coque metalúrgico. Es un carbón obtenido por destilación seca de la hulla. Hace las funciones de calefactor –eleva la temperatura– y de reductor. Fundente. (CaCO3 o SiO2). Rebaja el punto de fusión del mineral y forma la escoria. Aire caliente. Aporte de oxígeno para quemar el carbón de coque. Las principales reacciones que se producen son: S IB Combustión del coque y formación del monóxido de carbono: C + O2 CO2 CO2 + C 2 CO Reducción de los óxidos de hierro: Fe2O3 + CO 2 FeO + CO2 FeO + CO Fe + CO2 Formación de la escoria. CaCO3 CaO + CO2 CaO + SiO2 CaSiO3 R IE Obtención del hierro. En la parte baja del horno, se obtiene el hierro fundido, también llamado arrabio, a una temperatura de 1600-1800ºC. Éste se acumula en el crisol y se extrae periódicamente. Sobre él flota la escoria, que también es extraida y que protege al hierro de la oxidación. Afino del arrabio. El arrabio obtenido contiene de un 3 a un 5% de C y otros elementos y es muy débil y quebradizo. Debe ser sometido a un proceso de afino, en el que se obtienen los siguientes productos: ARRABIO 3–5% de C FUNDICIONES (2,5 – 3,5% de C) ACERO (0,2 – 1,5 % de C) HIERRO DULCE (0,1 – 0,2% de C) Las propiedades del acero mejoran con la adición de ciertos metales: Cr, Ni, Mn, V, Mo, etc. En este caso se obtienen los llamados aceros especiales. (Ej: acero inoxidable Ni-Cr, acero Cr-V para herramientas, Cr-Mo para bicicletas, ...). QUÍMICA. 2º BCHTO. IES Ribera de Castilla. Tema 5 Pág 6 1. Dadas las siguientes reacciones, deducir si son o no de oxidación reducción, y en caso afirmativo indicar que elementos se oxidan y cuáles se reducen. CO + 2 H2 CH3OH HCl + 2 H2S + Al+3 SO2 + KOH Cr+3 + I – NaCl 3S + H2O + 2 H2O AlOH+2 + H+ + H2O CaCO3 + HCl P NaOH + H2 CO2 + CaCl2 + H2O KH2PO2 + OH – + Cl2 + PH3 CrO42– + IO4– + Cl – + H2O 2. ¿Qué sustancias de las siguientes no pueden actuar como oxidante?: Cl2, MnO2, Cu, K2Cr2O7, NH3, HNO3 QUÍMICA. 2º BCHTO. IES Ribera de Castilla. Tema 5 Pág 7 3. Las siguientes reacciones son todas de oxidación reducción. Especifica para cada una que especies se oxidan y cuales se reducen, quién es el oxidante y quién el reductor. Fe2O3 + C Fe + CO2 NH3 + O2 NO + H2O HCl + MnO2 MnCl2 + Cl2 + H2O Zn S + O2 ZnO + SO2 HCl + O2 Cl2 + H2O QUÍMICA. 2º BCHTO. IES Ribera de Castilla. Tema 5 Pág 8 PbS + O2 SO2 + PbO HNO2 HNO3 + NO + H2O H2SO4 + S SO2 + H2O 4. Ajusta las siguientes reacciones por el método del ión-electrón, especificando las semirreacciones de oxidación, de reducción, el oxidante y el reductor. (3,10,10,6,2) I2 + HNO3 NO + HIO3 + H2O HNO3 + CdS S + NO + Cd(NO3)2 + H2O QUÍMICA. 2º BCHTO. IES Ribera de Castilla. Tema 5 (8,3,3,2,3,4) Pág 9 KMnO4 + K2Cr2O7 FeCl2 + HCl MnCl2 + FeCl3 + KCl + H2O + HCl CrCl3 + Cl2 + KCl + H2O KMnO4 + H2O2 + HCl KI + H2O2 + HCl I2 + KMnO4 + Na2SO3 + H2SO4 QUÍMICA. 2º BCHTO. IES Ribera de Castilla. MnCI2 + O2 + KCl + H2O KCl + H2O (1,5,8,1,5,1,4) (1,14,2,3,2,7) (2,5,6,2,5,2,8) (2,1,2,1,2,2) MnSO4 + K2SO4 + Na2SO4 + H2O (2,5,3,2,1,5,3) Tema 5 Pág 10 K2Cr2O7 + HI + HClO4 Cr(ClO4)3 + KClO4 + I2 + H2O (1,6,8,2,2,3,7) 5. MEDIO BÁSICO Ajusta las siguientes reacciones por el método del ión−electrón. Especificar en cada caso quién es el oxidante y el reductor. Br2 + NaOH H2O2 + CrCl3 + NaBr + NaBrO3 + H2O KOH QUÍMICA. 2º BCHTO. IES Ribera de Castilla. K2CrO4 Tema 5 + KCl + H2O (3,6,5,1,3) (3,2,10,2,6,8) Pág 11 MnO2 + KClO3 + KOH KMnO4 + NH3 K2MnO4 + KCl + H2O KNO3 + MnO2 + KOH + H2O QUÍMICA. 2º BCHTO. IES Ribera de Castilla. Tema 5 (3,1,6,3,1,3) (8,3,3,8,5,2) Pág 12 ESTEQUIOMETRÍA DE LAS REACCIONES REDOX 6. La reacción entre ácido clorhídrico y cromato de potasio genera cloruro de cromo (III), cloruro de potasio, cloro y agua. a) Ajustar la reacción por el método del ión–electrón. b) Calcular el peso de cromato de potasio necesario para obtener 125 g de cloruro de cromo (III) si el rendimiento de la operación es del 70%. S: 218,98 g QUÍMICA. 2º BCHTO. IES Ribera de Castilla. Tema 5 Pág 13 7. La acción del cloro sobre una disolución acuosa de hidróxido de potasio en caliente conduce a la formación de cloruro de potasio y clorato potásico. a) Escribir y ajustar por el método del ión–electrón la ecuación química correspondiente al proceso descrito. b) Calcular la cantidad de clorato potásico que puede obtenerse a partir de 150 g hidróxido de potasio de 97% de riqueza. S: 53 g QUÍMICA. 2º BCHTO. IES Ribera de Castilla. Tema 5 Pág 14 8. El ácido nítrico reacciona con el sulfuro de hidrógeno (gas) dando azufre y óxido de nitrógeno. a) Escribe la reacción ajustada. b) Determina el volumen de sulfuro de hidrógeno a 60 oC y 1 atm de presión necesario para reaccionar con 500 mL de una disolución de ácido nítrico 0,2 M. S: 4,09 L QUÍMICA. 2º BCHTO. IES Ribera de Castilla. Tema 5 Pág 15 9. El ácido oxálico (H2C2O4) se oxida a CO2 cuando reacciona con permanganato de potasio, en medio ácido sulfúrico. En esta reacción, el permanganato se reduce a ión manganeso (II). Se sabe que 20,0 mL de disolución de ácido oxálico 0,050 M han reaccionado con 21,2 mL de disolución de permanganato. Determinar la molaridad del permanganato. S: 0,0188 M QUÍMICA. 2º BCHTO. IES Ribera de Castilla. Tema 5 Pág 16 10. El permanganato de potasio se reduce en medio ácido sulfúrico mediante bromuro de potasio para dar sulfato de manganeso (II), sulfato de potasio y bromo elemental. Si 0,79 g de permanganato se reducen con 250 cm3 de una disolución de bromuro de potasio, determina la masa de bromuro de potasio y la molaridad de la disolución. S: 0,1 M QUÍMICA. 2º BCHTO. IES Ribera de Castilla. Tema 5 Pág 17 PILAS ELECTROQUÍMICAS 11. Ordena por orden creciente de carácter oxidante los iones: Cu+2 (que pasa a Cu), Al+3, Li+, IO3− (que pasa a I2). ¿Quién de ellos tiene más tendencia a reducirse? Escribe tres reacciones redox espontáneas en las que intervengan estos iones. Eo ( IO3– / I2) = 1,19 V 12. Utilizando la tabla de potenciales, ordena por orden creciente de carácter reductor los siguientes elementos: Na, Ag, H2, Al. Escribe tres reacciones redox espontáneas en las que intervengan estos elementos. 13. ¿Cuáles de las siguientes reacciones se producirán espontáneamente? a) Zn + 2Ag+ Zn+2 + 2 Ag b) Mn + 2 Li+ Mn+2 + 2Li c) Fe + I2 Fe+2 + 2 I – QUÍMICA. 2º BCHTO. IES Ribera de Castilla. Tema 5 Pág 18 14. En la pila formada por un electrodo normal de níquel (Ni+2|Ni 1M) y otro electrodo normal de plomo (Pb+2|Pb 1M), a) Determinar quién actúa de ánodo y quién de cátodo. b) Dibujar la pila. b) Escribir las reacciones que tienen lugar en cada electrodo. c) Escribe la reacción global de la pila. d) Escribe la notación abreviada de la pila. e) ¿Cuál es la f.e.m. de la pila? 15. Se dispone de un electrodo de Cr en disolución de Cr+3 1M y otro de Cu en disolución de Cu+2 1M. Con la pila voltaica que se puede construir, ¿será posible obtener cobre metálico a partir de los iones Cu+2 en disolución? Escribe la reacción redox que tiene lugar en la pila y calcula su fuerza electromotriz. Representa y dibuja la pila. Eo (Cr+3/Cr) = –0,74 V; Eo (Cu+2/Cu) = 0,34 V QUÍMICA. 2º BCHTO. IES Ribera de Castilla. Tema 5 Pág 19 16. Cuando la semipila Fe+2/Fe se conecta con la semipila Pb+2/Pb, el electrodo de plomo es el positivo. Si el electrodo Pb+2/Pb se conecta con la semipila Fe+3/Fe+2, (con un electrodo inerte de grafito), el electrodo de plomo es negativo. Identifica, sin ayuda de la tabla de potenciales, a) el oxidante más débil. b) el reductor más débil del conjunto de estas dos pilas. Posteriormente, confirma tus suposiciones utilizando la tabla. 17. Buscar los potenciales estándar de reducción de los siguientes electrodos: Cu+2/Cu; Ni+2/Ni; Cd+2/Cd; Fe+2/Fe. a) ¿Cuál de las pilas que se pueden construir tendrá la máxima f.e.m.?. ¿Y cuál la mínima?. Justificar las respuestas. b) Indica cómo prepararías en el laboratorio la pila de f.e.m. máxima. Dibuja y nombra todas las partes que la componen. Indica el ánodo, el cátodo y el sentido de los electrones que circulan por el circuito externo. QUÍMICA. 2º BCHTO. IES Ribera de Castilla. Tema 5 Pág 20 18. Dada la siguiente tabla de potenciales normales, expresados en voltios: Cl2/Cl– ClO4–/ClO3– ClO3–/ClO2– Cu+2/Cu SO3–2/S–2 SO4–2/S–2 Sn+4/Sn+2 Sn+2/Sn 1,35 1,19 1,16 0,35 0,23 0,15 0,15 –0,14 a) Escribe el nombre de: - La forma reducida del oxidante mas fuerte. - Un catión que pueda ser oxidante y reductor. - La especie más reductora. - Un anión que pueda ser oxidante y reductor. b) Escribe y ajusta reacciones que sean espontáneas entre especies que figuran en la tabla y que correspondan a: - Una oxidación de un catión por un anión. Un anión debe reducirse. (Hay cuatro posibilidades. Búscalas todas). - Una reducción de un catión por un anión. Un anión debe oxidarse. (Hay dos posibilidades. Búscalas). Pista: escribe las reacciones de los 8 electrodos, ordenadas por potenciales de mayor a menor. QUÍMICA. 2º BCHTO. IES Ribera de Castilla. Tema 5 Pág 21 ELECTRÓLISIS 19. Se desea recubrir con 0,5 mm de plata una esfera metálica de 5 cm de radio. ¿Cuánto tiempo ha de circular una corriente de 2 A por una disolución de nitrato de plata?. Haz un esquema de la cuba electrolítica. Densidad relativa = 10,5 S: 20 h, 41 min, 21 s 20. En una cuba electrolítica con una disolución de cloruro de cobre(II) se hace pasar una corriente de 2 A durante hora y media. Calcula las cantidades de producto obtenidos en cada uno de los electrodos. (Si son gases, su volumen en c.n.). S: 3,55g; 1,25 l 21. ¿Qué masa de hierro se depositará al paso de una corriente de un amperio durante una hora, si el electrolito empleado es: a) Una sal de hierro (II). b) Una sal de hierro (III). S: 1,041 g; 0,694 g QUÍMICA. 2º BCHTO. IES Ribera de Castilla. Tema 5 Pág 22 22. Tres cubas electrolíticas conectadas en serie contienen disoluciones de nitrato de plata, nitrato de cadmio y nitrato de cinc respectivamente. Cuando las tres son atravesadas por la misma cantidad de corriente, justificar si son ciertas las siguientes afirmaciones (dibuja un esquema de las tres cubas): a) En el cátodo se deposita la misma masa en las tres cubas. b) En la segunda y tercera cubas se deposita doble número de equivalentes que en la primera. c) En la segunda y tercera se deposita la misma cantidad de sustancia (número de moles). 23. a) Una corriente de 5,00 A que circula durante 30 minutos deposita 3,048 g de cinc en el cátodo. Calcula la masa equivalente del cinc. b) ¿Cuántos gramos de cobre se depositarán al pasar 10,00 A durante una hora? S: 32,68 g/eq; 11,85 g QUÍMICA. 2º BCHTO. IES Ribera de Castilla. Tema 5 Pág 23