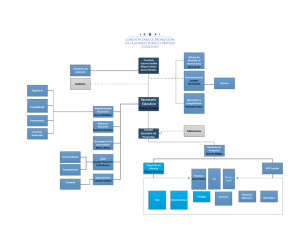
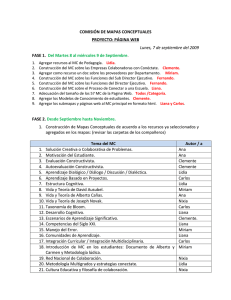
UNIVERSIDAD MAYOR DE SAN SIMÓN
Anuncio

UNIVERSIDAD MAYOR DE SAN SIMÓN FACULTAD DE CIENCIAS Y TECNOLOGIA CARRERA DE BIOLOGIA DIETA Y COMPORTAMIENTO ALIMENTICIO DE DOS GRUPOS DE MONOS TITI (Callicebus modestus) ENDÉMICOS DEL BENI, BOLIVIA. Tesis de Grado, Presentada Para Optar al Diploma Académico de Licenciatura en Biología Presentado por: Andrea Arnez Soria Tutor: PhD. Luis F. Aguirre COCHABAMBA – BOLIVIA Octubre, 2012 DEDICATORIA ……. No hay nada imposible, porque los sueños de ayer son las esperanzas de hoy y pueden convertirse en realidad mañana… A mis abuelos…. . AGRADECIMIENTOS A Wildlife Conservation Society, a Robert Wallace, a Heidy López-Strauss, Noelia Mercado, y colaboradores por el apoyo financiero y logístico, dedicación y paciencia desinteresada. A la Universidad Mayor de San Simón por la formación académica, Ph D Luis F. Aguirre, Lic. Freddy Navarro, Lic. José Balderrama y Lic. José Carlos Pérez por la ayuda y el apoyo en todo momento. A mi familia y amigos, gracias por acompañarme en todo momento… RESUMEN Callicebus modestus Lönnberg (1939), presenta una distribución altamente restringida al Suroeste del Departamento del Beni, (Martínez & Wallace, 2007; Felton et al., 2006) y de manera general no se conocen aspectos de su biología y ecología tales como comportamiento y hábitos alimenticios. El presente trabajo fue realizado con dos grupos de Callicebus modestus en estado silvestre, al interior de la Estancia San Miguel ubicada en Santa Rosa de Yacuma, con el principal objetivo de determinar la dieta y comportamiento alimenticio de dos grupos de Callicebus modestus, así como la variación general y estacional entre grupos, edades y sexos. El estudio se realizó desde abril-diciembre del 2010, con 8 entradas al campo, de 15-21 días y observaciones diarias de 10-12 horas (6:00-18:00 horas), se utilizó el método de scan grupal y ad libitum. Todas las plantas consumidas fueron marcadas para su posterior colecta e identificación. Los resultados muestran que la dieta de Callicebus modestus se basa principalmente en frutos-maduros, flores, semillas y artrópodos (larvas de mariposa/ termitas/ hormigas), y en menor proporción las hojas, rebrotes y lianas. Se registraron un total de 62 especies vegetales, donde se identificaron 42, pertenecientes a 20 familias. De manera general las especies de las familias Bignoniaceae, Moraceae, Arecaceae, Lauraceae y Rubiaceae, fueron las más consumidas. Se observó cierta variación mensual dentro la dieta, asociada a periodos de fructificación y floración. Dentro los comportamientos individuales en tiempos invertidos y en ítems alimenticios consumidos, no se evidenciaron variaciones significativas asociadas a la edad y sexo, puesto que forman grupos familiares donde todos los individuos se mueven en conjunto, y de manera general por lo que no existiría alta selectividad del recurso, solo falta de destreza e inexperiencia por parte de los individuos de edades inferiores. INDICE GENERAL Pág. 1 INTRODUCCIÓN 2 JUSTIFICACIÓN ……………………………………………………………………….. 3 OBJETIVOS 4 …………………………………………………………………… 1 ………………………………………………………………………… 6 2.1 Objetivo General ……………………………………………………………. 6 2.2 Objetivo específico ……………………………………………………………. 6 MARCO TEÓRICO ……………………………………………………………………… 7 …………………………………………. 7 4.1 Dieta y Comportamiento alimenticio …………………………………………………… 8 4.2 Especie de estudio 5 4.2.1 Clasificación taxonómica 4.2.2 Género Callicebus 4.2.3 Callicebus modestus ………………………………………….. 8 …………………………………………………… 8 ………………………………………….. 10 ………………………………………….. 10 4.2.3.1 Datos generales 4.2.3.2 Características diagnósticas 4.2.3.3 Distribución 4.2.3.4 Densidad poblacional ………………………………….. 13 4.2.3.5 Estado de conservación ………………………………….. 13 ………………………. 11 …………………………………………… 12 ……………………………………………………………………….. 15 METODOS ……………………………………………………….......... 5.1 Área de estudio 5.2 Selección y habituación de los grupos de estudio 5.3 Trabajo de campo ………………………. 15 18 ……………………………………………………………… 19 …………………………………. 19 5.3.1 Toma de datos comportamiento 5.3.2 Registros alimenticios …………………………………………………….. 21 5.4 Análisis de datos 6 4 RESULTADOS ……………………………………………………………… 23 ……………………………………………………………………….. 27 6.1 Tiempo de observación …………………………………………………….. 27 6.2 Caracterización general de la Dieta 6.2.1 ………………………………….. 28 Partes animales y vegetales consumidas por C. modestus …….. 6.2.1.1 Diversidad de dieta entre grupos 34 …….…………………. 36 …….. 39 6.3 Variación general de tiempos de consumo entre sexos y edades 6.3.1 Variación entre hembras y machos adultos 6.3.1.1 6.3.2 Diversidad de Dieta entre sexos ………………………… 40 ……………………………………………. 46 Variación entre edades 6.3.2.1 ………………………… 39 Diversidad de Dieta entre edades ………………………… 47 6.4 Variación mensual de la Dieta de Callicebus modestus 6.4.1 …..………….. Variación mensual en el consumo de especies como fuente de alimento ………………………………………………………………………………….. 6.4.2 50 50 Variación mensual en el consumo de partes animales y vegetales ………………………………………………………………………………… 52 6.4.3 Variación mensual de la dieta entre grupos 6.4.3.1 ……………………….. Variación mensual de especies vegetales consumidas como fuente de alimento en ambos grupos de estudio 6.4.3.2 …..... 56 Variación mensual en el consumo de partes animales y vegetales en ambos grupos de estudio ……………………….. 61 6.4.4 Variación mensual de la dieta entre sexos ………………………. 65 6.4.5 Variación mensual de la dieta entre edades ………………………. 68 6.5 Patrón Alimenticio 7 54 DICUSIONES ……………………………………………………….......... 71 ……………………………………………………………………….. 73 7.1 Tiempo de observación …………………………………………………….. 73 7.2 Caracterización general de la Dieta …………………………………………… 73 7.3 Partes animales y vegetales consumidas por Callicebus modestus …… 75 …….. 77 7.4 Variación general de tiempos de consumo entre edades y sexos 7.4.1 Variación entre hembras y machos adultos 7.4.2 Variación entre edades ………………………… 77 ……………………………………………. 77 7.5 Variación Mensual de la dieta de Callicebus modestus 7.5.1 ………………. 79 Variación mensual en el consumo de especies como fuente de alimento …………………………………………………………………………………. 79 7.5.2 Variación mensual en el consumo de partes animales y vegetales …………………………………………………………………………………. 79 7.5.3 Variación mensual de la dieta entre grupos ………………………… 81 7.5.4 Variación mensual de la dieta entre sexos ………………………… 84 7.5.5 Variación mensual de la dieta entre edades ………………………… 85 7.6 Patrón Alimenticio ……………………………………………………………… 86 8 CONCLUSIONES ……………………………………………………………… 87 9 RECOMENDACIONES ……………………………………………………………… 89 10 REFERENCIAS BIBLIOGRÁFICAS…………………………………………………….. 89 11 ANEXOS INDICE DE FIGURAS Pág Figura 1. Especímenes originales de C. olallae y C. modestus .…………… …………. 10 …….. Figura 2. Callicebus modestus en estado silvestre, dibujo y fotografía 11 ………….……………………….. 12 Figura 3. Distribución actual de Callicebus modestus Figura 4. Ubicación Área de Estudio: Islas de Bosque dentro la estancia “San Miguel” ………………………………………………………………………………………………….. 16 Figura 5. Islas de Bosque (al fondo) y ganado vacuno presente en la zona. Estancia San ……………………………………………………... 17 Miguel, Santa Rosa de Yacuma Figura 6. Marcaje de las plantas utilizadas por Callicebus modestus como fuente de alimento .…………………………………………………………………………………………………… 22 Figura 7. Porcentaje del tiempo de alimentación por cada parte vegetal y animal invertido por Callicebus modestus durante el periodo de estudio en la Estancia San Miguel…………..……………………………………………………………………………….. 35 Figura 8. Porcentaje Total del tiempo de alimentación por cada parte vegetal y animal invertido por el grupo “Corral” (en amarillo) y el grupo “Maramacho” (en azul) de Callicebus modestus durante el periodo de estudio en la Estancia San ………………………………………………….............................................................. Miguel 36 Figura 9. Curvas rango abundancia de las especies vegetales consumidas por ambos grupos (grupo Corral en verde, grupo Maramacho en azul) de Callicebus modestus………… 37 Figura 10. Porcentaje de tiempo invertido en el consumo de partes animales y vegetales (ítems alimenticios) por hembras (en rosado) y machos (en azul) adultos de Callicebus modestus, durante el periodo de estudio en la Estancia San Miguel ……………………………….. 39 Figura 11. Curvas rango abundancia de las especies consumidas por hembras ambos grupos (grupo Corral en círculos rojos, grupo Maramacho en rombos violetas) de Callicebus modestus a lo largo del periodo de estudio. Las especies utilizadas por ambos grupos se describen de forma descendente en el Anexo 10. …………………………………………………. 41 Figura 12. Curvas rango abundancia de las especies consumidas por machos de ambos grupos (grupo Corral con círculos azules, grupo Maramacho con cuadrados verdes) de Callicebus modestus a lo largo del periodo de estudio. Las especies utilizadas por ambos grupos se describen en orden descendente en el Anexo 10.……………………………………… 43 Figura 13. Curvas rango abundancia de las especies consumidas por el promedio de hembras y de machos adultos de ambos grupos (hembras en rosado, machos en celeste) de Callicebus modestus a lo largo del periodo de estudio. Las especies utilizadas por ambos sexos se describen de forma descendente en el Anexo 11…………………………………...… 45 Figura 14. Variación del porcentaje de tiempo invertido en el consumo de partes vegetales entre adultos (azul con rayas diagonales), juveniles (rojo con cuadricula) y crías (verde) de Callicebus modestus, durante el periodo de estudio en la Estancia Miguel.………………………………………………………………………………………… San 46 Figura 15. Curvas rango abundancia de las especies consumidas por el promedio de adultos, juveniles y crías de ambos grupos (adultos en azul, juvenil en rojo, cría en verde) de Callicebus modestus a lo largo del periodo de estudio. Las especies utilizadas por ambos sexos se describen de forma descendente en el Anexo 11 ……………………………... 49 Figura 16. Estacionalidad en el uso de partes vegetales (ítems alimenticios) por Callicebus modestus durante el periodo de estudio en la Estancia San Miguel ……………. 53 Figura 17. Diversidad dietética mensual (Inversa de Simpson en azul) y sobreposición dietética (Índice de Sorensen en rosado) a nivel de especie entre los meses adyacentes, del grupo “Corral”. ………………………………………………………………………………………. 55 Figura 18. Diversidad dietética mensual (Inversa de Simpson en azul) y sobreposición dietética (Índice de Sorensen en rosado) a nivel de especie entre los meses adyacentes, del grupo “Maramacho” ……………………………………………………………………. 55 Figura 19. Variación mensual en el tiempo de alimentación de partes vegetales y animales utilizadas por adultos del grupo “Corral”. ………………………………………….. 63 Figura 20. Variación mensual en el tiempo de alimentación de partes vegetales y animales utilizadas por adulto del grupo “Maramacho” . ………………………………………… 63 Figura 21. Variación mensual en el tiempo de alimentación de partes vegetales y animales utilizadas por el Promedio de hembras adultas de Callicebus modestus …….…… 67 Figura 22. Variación mensual en el tiempo de alimentación de partes vegetales y animales utilizadas por el Promedio de machos adultos Callicebus modestus ……………… 67 Figura 23. Variación mensual en el tiempo de alimentación de partes vegetales y animales utilizadas por el Promedio de los adultos de Callicebus modestus ……………… 70 Figura 24. Variación mensual en el tiempo de alimentación de partes vegetales y animales utilizadas por el individuo juvenil de Callicebus modestus ………………………… 70 Figura 25. Variación mensual en el tiempo de alimentación de partes vegetales y animales utilizadas por la cría de Callicebus modestus ……………………………………………. 71 Figura 26. Patrón Alimenticio de ambos grupos de C. modestus (grupo “Corral”: en color rojo; grupo “Maramacho”: en color azul) ……………………………………………………… 72 INDICE DE TABLAS Tabla 1. Horas de observación para cada grupo e individuos de Callicebus modestus durante todo el periodo de estudio (los valores con asteriscos corresponden al número de horas multiplicado por el número de muestreos por hora, es decir scans) .……………………………………………………………………………………………………. 27 Tabla 2. Tiempo invertido por ambos grupos de Callicebus modestus en el consumo de artrópodos (Corral – grupo 1, Maramacho – grupo 2) como fuente de alimento en la Estancia San Miguel, durante el periodo de estudio ……………………………………………. 29 Tabla 3. Especies vegetales utilizadas como fuente de alimento, por individuos de Callicebus modestus dentro el grupo Corral, durante el periodo de estudio en la Estancia San Miguel ……………………………………………………………………………………………………. 31 Tabla 4. Especies vegetales utilizadas como fuente de alimento, por individuos de Callicebus modestus dentro el grupo Maramacho, durante el periodo de estudio en la Estancia San Miguel.................................................................................................................... …….. 32 Tabla 5. Especies vegetales utilizadas por ambos grupos de Callicebus modestus como fuente de alimento en la Estancia San Miguel, durante el periodo de estudio………………… 33 Tabla 6. Variación mensual del porcentaje de tiempo invertido por Callicebus modestus en el consumo de especies vegetales, durante el periodo de estudio en la Estancia San Miguel (las casillas subrayadas corresponden a las especies con mayor porcentaje de tiempo de alimentación en el mes) ……………………………………………………………………… 51 Tabla 7. Variación mensual del % de tiempo invertido en el consumo de especies vegetales dentro la dieta de ambos grupos de Callicebus modestus, pairwise t-test (Grupo 1 = Corral; Grupo 2 = Maramacho). ……………………………………………………………… 56 Tabla 8. Variación mensual de las especies vegetales utilizadas dentro la dieta del grupo Corral, durante el periodo de estudio en la Estancia San Miguel ………………………………….. 59 Tabla 9. Variación mensual de las especies vegetales utilizadas dentro la dieta del grupo Maramacho, durante el periodo de estudio en la Estancia San Miguel ……………….. 60 Tabla 11. Variación mensual del % de tiempo de alimentación de las partes animales y vegetales, pairwise t-test (Grupo 1 = Corral; Grupo 2 = Maramacho) ………………. 61 1 1. INTRODUCIÓN Los primates pertenecientes al género Callicebus, comúnmente llamados “monos titi” comprenden uno de los grupos más diversos pero pobremente estudiados del Neotrópico (Müller, 1996; Eisenberg & Redford, 1999). Este género alberga a 30 especies, 6 de las cuales están presentes en Bolivia, dentro de estas, Callicebus olallae y Callicebus modestus son las únicas endémicas (Hershkovitz, P. 1988, Anderson, 1997; Kinzey, 1997; Van Roosmalen et al., 2002; Rowe & Martinez, 2003; Felton et al., 2006; Martinez & Wallace, 2007, 2010; Defler et al., 2010). Ambas especies tienen una distribución altamente restringida al Suroeste del Departamento del Beni, encontrándose a Callicebus modestus en parches o islas de bosques secos, en los bordes orientales y occidentales del Rio Yacuma, en un área aproximada de 450 km 2; con sólo un registro de un grupo encontrado a 100 metros al este del Río Maniquí (Martínez & Wallace, 2007; Felton et al., 2006). Por su lado Callicebus olallae se encuentra exclusivamente a lo largo del Río Yacuma en un área aproximada de 50km 2, con sólo un registro fuera de esta zona obtenido en el Río Maniquí (Martínez & Wallace, 2007). De manera general no se han encontrado datos relacionados con la dieta de C. modestus al margen de las observaciones realizadas por Felton et al. (2006) que mencionan el consumo de algunas semillas de Mapajo y frutos de Motacú por individuos de esta especie. En cuanto a la dieta de C. olallae, datos obtenidos por López (2011) señalan que esta especie dispone de una dieta basada principalmente en flores, frutos, brotes y hojas, similar a la descrita para el género Callicebus; con un consumo ocasional de insectos (Hershkovitz, 1990; Martínez & Wallace, 2010). 2 Felton et al. (2006) Martínez & Wallace (2007) revelan asimismo un alto grado de intervención humana en la zona ocupada Callicebus modestus y Callicebus olallae, que comprende actividades de manejo del ganado vacuno y ecoturismo poco regulado. A pesar de que actualmente, parte del área de distribución de la especie se halla comprendida dentro una Reserva Municipal denominada “Área Municipal Pampas del Yacuma”, se distingue una seria amenaza atribuible a la realización de proyectos carreteros que impulsa el Gobierno. Uno de ellos denominado “Corredor del Norte”, que atraviesa el área de distribución de la Callicebus modestus, podría ocasionar un impacto ambiental indirecto, principalmente en la fauna de la zona, puesto que la carretera daría lugar al destrucción de hábitat, debido a la tala y deforestación asociada al desplazamiento ganadero hacia los bosques remanentes, junto a la cacería y la extracción de otros recursos naturales y la colonización no planificada (Inturias, 2011; Bank Information Center, 2012). Puesto que los primates juegan un rol importante dentro de las comunidades ecológicas, actúan como polinizadores y dispersores de semillas, además de ser parte importante dentro de las cadenas alimenticias como presas y predadores (De la Torre, 2000 en Gavilanez– Enrada, 2006). Es de suma importancia disponer de información acerca de su ecología y comportamiento ya que pueden utilizarse como una medida del alcance de las alteraciones ecológicas en general, dentro de las comunidades (Mittermeier & Cheney, 1987). 3 Gran parte del beneficio de la conservación de Callicebus modestus, que puede verse favorecido con el conocimiento de su dieta, se encuentra orientado a un potencial manejo para la preservación de esta especie podría hacerse extensivo a todo su ecosistema, aprovechando su potencial como “especie bandera", estratégico para el establecimiento de futuras áreas de conservación o corredores. El presente trabajo fue realizado con dos grupos de Callicebus modestus en estado silvestre, al interior de la Estancia San Miguel ubicada en el Gobierno Autónomo Municipal de Santa Rosa de Yacuma, Departamento del Beni, Bolivia. Aporta información que contribuye al objetivo principal de la determinación de la dieta y hábito alimenticio de Callicebus modestus, así como adicionalmente, al conocimiento de la variación general y estacional entre grupos, edades y sexos. 4 2. JUSTIFICACIÓN La dieta de las especies es uno de los factores fundamentales de su ecología y entendimiento. Por tal motivo, su estudio es necesario no sólo para determinar sus requerimientos nutricionales, sino también para entender cómo la distribución de los recursos alimenticios puede determinar su densidad, distribución local e interacciones sociales (Oates, 1987). Al igual que los patrones de actividad, la dieta de los primates se encuentra altamente influenciada por las fluctuaciones estacionarias referidas principalmente a la disponibilidad de alimentos. He aquí la importancia de la identificación de la dieta para lograr la comprensión de diferentes aspectos de su anatomía y reproducción, tanto como los patrones de uso de su hábitat, tipo de comportamiento y organización social (Strier, 2007). Callicebus modestus es una especie altamente endémica de Bolivia, restringida a islotes de bosque en las pampas del Beni. Su principal característica es la formación de grupos familiares monógamos de 3 a 5 individuos. Son altamente territoriales y no se conoce mucho de su ecología, dieta y comportamiento en general. La principal amenaza para la conservación de esta especie es la ampliación y mejoramiento del tramo carretero Yucumo – Rurrenabaque integrado al llamado “Corredor del Norte” que forma parte de la llamada “Iniciativa de Integración Regional Sudamericana” - IIRSA, atravesando toda el área de distribución de la especie. Estas obras son capaces de impulsar el avance de la frontera agrícola a través de la deforestación de áreas remanentes, la cacería asociada y un mayor crecimiento demográfico en la zona, además del chaqueo constante de las pampas para acelerar el crecimiento de pastizales para el ganado y el turismo mal regulado en la zona (Inturias, 2011). 5 Para hacer frente a las amenazas mencionadas, el conocimiento de la alimentación de Callicebus modestus puede representar un gran aporte para la conservación de la especie orientadas a potencializar su rol como “especie bandera” para la protección de todo el ecosistema de ésta y del resto de especies integradas a su entorno; mediante el establecimiento de grandes áreas de conservación (Noss et al, 1996). La rareza y endemismo de Callicebus modestus constituyen los factores fundamentales enfocados a este fin; dado que al margen de determinar su distribución y abundancia, resulta valioso el conocimiento de sus necesidades ecológicas básicas, representadas en factores como su dieta y comportamiento, para formular actividades e instrumentos de gestión más eficientes. 6 3. OBJETIVOS 3.1. Objetivo General Determinar la dieta y el hábito alimenticio de dos grupos de “monos Titi” (Callicebus modestus) endémicos del Beni. 3.2. Objetivos específicos Identificar los ítems y especies vegetales comprendidas en la dieta de ambos grupos de Callicebus modestus. Comparar la variación de especies vegetales e ítems consumidos entre individuos de diferente edad y sexo. Determinar si existe alguna estacionalidad en cuanto al consumo de ítems animales y vegetales. Describir el patrón de alimentación de cada grupo de C. modestus. 7 4. MARCO TEÓRICO 4.1. Dieta y comportamiento alimenticio Los animales seleccionan cierto tipo de alimentos dentro de su dieta, que les permitan adquirir suficiente energía para cubrir sus necesidades metabólicas (Ross et al., 2009); puesto que el alimento constituye una necesidad fundamental, tanto para la sobrevivencia como para la reproducción (Altmann, 1998; Strier, 2007). Muchos primates exhiben ciertos patrones de conducta que influyen en la elección y la eficiencia de un tipo de alimento en particular, dentro de su dieta (Garber, 1989). La mayoría integra una gran proporción de plantas alimenticias en su dieta diaria, tales como hojas, frutos, semillas, néctar, flores, y cantidades moderadas de materia animal, generalmente invertebrados (Milton, 1999). Esto les permite adquirir los carbohidratos, grasas y proteínas necesarias para satisfacer sus requerimientos energéticos y nutritivos, los cuales varían de acuerdo a tamaño corporal y metabolismo (Strier, 2007). El tipo de dieta de los primates se halla determinada principalmente, por el alimento más consumido por cada una de sus diferentes especies (Strier, 2007). Por lo general se divide en tres categorías principales: hojas, frutos y fauna (usualmente insectos y arácnidos) Los grupos o especies de primates especializados en alguno de tales tipos de dieta, son llamados frugívoros, folívoros, insectívoros (o faunívoros) y omnívoros. Estas categorías se ajustan a las características estructurales y nutricionales (dientes, intestinos) de cada uno, que les permiten procesar y digerir el tipo de alimento consumido (Fleagle, 1999; Strier, 2007). 8 Al igual que sus patrones de actividad, la dieta de los primates se encuentra fuertemente influenciada por las fluctuaciones estacionales en cuanto a la disponibilidad de algún alimento en particular. Debido a la importancia de la nutrición en la reproducción y sobrevivencia, la identificación de la dieta de los primates resulta esencial para entender muchos aspectos de su anatomía y comportamiento, así como patrones de uso de hábitat, y organización social (Strier, 2007). 4.2. Especie de Estudio 4.2.1. Clasificación taxonómica Clase: Mammalia Subclase: Theria Orden: Primates Suborden: Haplorrhini Infraorden: Platyrrhini Familia: Pitheciidae Género: Callicebus Especie: Callicebus modestus 4.2.2. Género Callicebus Pertenecientes a la familia Pitheciidae, comúnmente llamados “monos tití”, comprende uno de los grupos más diversos pero pobremente estudiados de primates Neotropicales, (Müller, 1996; Eisenberg & Redford, 1999; Van Roosmalen et al., 2002). Estos primates están distribuidos principalmente a lo largo de los bosques tropicales de la Amazonía, en el bosque Atlántico de Brasil, a orillas del Orinoco y la región del Chaco y en bosques húmedos de Paraguay (Hershkovitz, 1988; 1990; Van Roosmalen et al., 2002; Norconk, 2007). 9 Bolivia alberga a 6 especies, de un total de 30 presentes en América del Sur (Defler et al., 2010) distribuidas en los departamentos de Pando, Beni, Santa Cruz, norte de La Paz y región oriental de Cochabamba, entre las cuales Callicebus olallae y Callicebus modestus son endémicas (Hershkovitz, 1988; Anderson, 1997; Kinzey, 1997; Van Roosmalen et al., 2002; Rowe & Martinez, 2003; Martínez & Wallace, 2010). El género Callicebus se caracteriza por conformar grupos familiares monógamos, integrados por la pareja de adultos, donde es por lo general el macho el que carga a la cría, observándose además la presencia de juveniles de años anteriores (Kinzey, 1997; Hershkovitz, 1988). Estos grupos de individuos producen elaboradas vocalizaciones o duetos entre las 6:00 y las 9:00 a.m., esta actividad es utilizada para asegurar el rango de hogar del grupo y consolidar la relación monógama, además de la demarcación territorial por parte de los grupos (Martínez & Wallace, 2010). De cola no prensil y desplazamiento cuadrúpedo, pesan de 0.8 a 1.4 kg con excepciones de hasta 2 kg en Callicebus personatus y miden entre 270 y 450 mm (Hershkovitz, 1988; 1990; Van Roosmalen et al., 2002; Norconk, 2007). Todos los primates del género Callicebus, son de hábitos diurnos, con una alimentación basada principalmente en flores, frutos, brotes y hojas, además de la ingesta de una pequeña cantidad de insectos, por lo que son considerados frugívoro-folívoros (Hershkovitz, 1990; Martínez & Wallace, 2010). El consumo de estos ítems en distintas proporciones depende del tipo de hábitat, además de la estacionalidad climática que determina los picos de floración, fructificación y producción de hojas nuevas (Martínez & Wallace, 2010). 10 4.2.3. Callicebus modestus Lönnberg, 1939 (mono tití/ lucachi) 4.2.3.1. Datos generales Figura 1. Especímenes originales de C. olallae (Nº A632187) y C. modestus (NºA612105). Fotografía de Olavi Gronwall, en Felton et al. 2006. Se conoce muy poco de la historia natural de Callicebus modestus. De manera general, entre 1937 y 1938, A.M. Olalla colectó dos especímenes (Adulto y subadulto macho, Fig. 1) en cercanías de la localidad de Santa Rosa en el Departamento del Beni. Posteriormente Einmar Lönnberg (1939) pudo determinar que los ejemplares pertenecían a una nueva especie, que fue identificada como Callicebus modestus (Felton et al., 2006). Más tarde Hershkovitz (1990) efectuó revisiones acerca de su morfología, taxonomía y distribución. Kobayashi en 1990, 1991 y 1995, realizó estudios sobre filogenética, dentición y tamaños craneales, registrando el volumen de su caja cefálica como la de menor tamaño entre los Cébidos (ahora pertenecientes a Pithecidos (Groves, 2001) con lo cual Callicebus modestus podría ser considerado como la forma más primitiva de este grupo (Van Roosmalen et al., 2002; Felton et al., 2006). 11 4.2.3.2. Características diagnósticas Presenta pelaje de coloración marrón con tonalidades naranjas, ligeramente más oscuras en la parte anterior dorsal, extendiéndose hacia las extremidades, lo cual se debe al patrón agutí de bandas marrón-naranja alternadas con bandas oscuras en cada pelo (Hershkovitz, 1990; Van Roosmalen et al., 2002; Felton et al., 2006; Martínez & Wallace, 2010; Fig. 2). Tanto el rostro como las orejas se distinguen por una coloración blanquecina, las manos y los pies están cubiertas por pelos de color gris claro (Fig. 2) la cola es de color gris uniforme. Estos contrastes hacen que sus extremidades sean distinguibles con relación al resto del cuerpo (Hershkovitz, 1990; Van Roosmalen et al., 2002; Felton et al., 2006; Martínez & Wallace, 2010). Figura 2. Callicebus modestus en estado silvestre, dibujo de Stephen D. Nash y Fotografía por Mileniusz Spanowicz en Felton et al., 2006. 12 4.2.3.3. Distribución Callicebus modestus, al ser una especie endémica, presenta una distribución restringida al oeste del departamento del Beni, en los límites Este y Oeste, dentro de islas de bosque situadas a lo largo del área entre el Río Beni y el Río Maniquí (Fig. 3) y en los límites sur y norte en la zona del camino Rurrenabaque-Yucumo, hasta el sur del bosque Amazónico del norte del Beni, habiéndose reportado registros dentro de un área aproximada de 1800 km 2 (Martínez & Wallace, 2007; 2009). Fig. 3 Distribución actual de Callicebus modestus (demarcado dentro del circulo punteado) en imagen satelital (Google-earth 2010) 13 La mayor parte de los bosques del área de distribución de Callicebus modestus, (localidades de Reyes y Santa Rosa) se encuentran fragmentados en forma natural, condición que se acentúa debido a la actividad ganadera extensiva, la producción agrícola, la caza, pesca y la explotación forestal por campesinos de las comunidades aledañas (Beck, 1983; PDB, 2001). Dicha fragmentación pone en riesgo el hábitat de esta especie, sumada a los chaqueos anuales y desmontes para la habilitación de nuevas áreas de pasturas y cultivos, que dan como resultado una distribución extremadamente restringida (Martínez & Wallace, 2007). 4.2.3.4. Densidad poblacional El tamaño de los grupos es de 1 a 5 individuos, con un promedio de 3 individuos por grupo (Martínez& Wallace, 2007) mostrando una densidad grupal de 12.33 grupos/km, con un máximo de 30.97 grupos/km y un mínimo de 2.21 grupos/km (López -Strauss, 2008). Los datos demográficos estimados por López-Strauss (2008) muestran que la abundancia de monos titi es mayor en áreas con poca o ninguna influencia humana y menor en áreas o lugares con mayor intervención antrópica y realización de actividades como la caza, ganadería y agricultura; con una población total mínima de 10807 individuos y una máxima de 50179 individuos. 4.2.3.5. Estado de Conservación En años anteriores, Callicebus modestus fue categorizada como con “Datos Insuficientes” (DD; Tarifa, 1996; Bernal & Silva, 2003) por existir dudas acerca de su taxonomía, distribución y ecología. 14 Desde el año 2002 hasta la fecha., investigadores de la Wildlife Conservation Society (WCS) se han dado a la tarea de llenar los vacios de información existentes sobre esta especie, situada actualmente en la categoría “En Peligro” (EN) tanto a nivel nacional como internacional (Veiga et al., 2008) debido a los cambios dentro de su área de distribución (Martínez & Wallace, 2009). La gran amenaza a futuro es la pavimentación del tramo carretero denominado “Corredor del Norte”, que según el Libro Rojo de la Fauna Silvestre de Vertebrados de Bolivia, el impacto en la fauna daría lugar a la reducción de hábitats debido a la tala de bosque en la apertura de las carreteras, además de la deforestación asociada junto a la cacería y extracción de otros recursos naturales, el desplazamiento de la actividad ganadera hacia bosques remanentes y la colonización no planificada (Martínez & Wallace, 2009). Actualmente, la zona ocupada por Callicebus modestus expone un alto grado de intervención humana atribuible a actividades de manejo del ganado vacuno y ecoturismo mal regulado (Felton et al., 2006; Martinez & Wallace, 2007) que a largo plazo repercute en la extracción ilegal de especímenes traficados como mascotas y acelera la destrucción de su hábitat. Estas son las principales causas de su grado de amenaza en vida silvestre, que han motivado a que el Municipio de Santa Rosa de Yacuma efectúe la declaratoria de la Reserva Municipal “Área Municipal Pampas del Yacuma” en donde se prevé implementar un plan de manejo integrado para la conservación de la especie (Martínez & Wallace, 2009). 15 5. METODOS 5.1. Área de estudio El presente estudio se realizó en dos islotes de bosque: “Corral” (-13.954234°/66.838497°) y “Maramacho” (-13.947639°/-66.838352°) dentro de la Estancia “San Miguel”, ubicada en cercanías de la Localidad de Santa Rosa (13.951749°/-66.834668°) al oeste del Departamento de Beni, Prov. Gral. José Ballivián (Fig.4). La isla “Corral” tiene un área de 12.22 Ha., dentro de la cual se encuentra establecido un grupo de monos titi conformado por dos individuos adultos. Esta isla tiene un mayor grado de fragmentación que la isla “Maramacho”, debido a la presencia de corrales de ganado vacuno y su tránsito ocasional a través de la isla; además de la existencia de un camino que corta una pequeña porción de ella. La isla “Maramacho”, por su parte, cuenta con un área aproximada de 64.8 Ha. Dentro de ella se han establecido más de dos grupos de monos titi, de los cuales solo se estudió a uno, compuesto por 4 individuos: dos adultos, un juvenil y una cría. Este grupo se desplaza dentro un territorio con un área aproximada de 10 Ha., que no comparte con ningún otro, debido al alto grado de territorialidad que caracteriza a los miembros de este género. 16 Figura 4. Ubicación Área de Estudio: Islas de Bosque dentro de la estancia “San Miguel”. La isla “Maramacho” presenta un menor grado de fragmentación, debido a que la densidad arbórea resulta mucho mayor a la presentada por la isla “Corral”, tal y como se muestra en la figura 4. El área corresponde a regiones situadas entre la provincia Biogeográfica del Beni (sector Llanos de Moxos) y la provincia Biogeográfica del Acre – Madre de Dios (Navarro & Maldonado, 2002) correspondiente a la Zona de Vegetación Llanos del Beni, que comprenden la llanura aluvial Policíclica del Río Mamoré y su cuenca de tierras bajas. La inundación en dicha zona se debe principalmente a desbordes de ríos y a las precipitaciones pluviales (Navarro & Ferreira, 2004). El paisaje de esta región está formado por islas de bosque fragmentado, inmersas en una matriz de pasturas de tierras bajas tropicales (sabana o pampa) (Navarro & Maldonado, 2002). 17 Las Sabanas del Beni están flanqueadas en el oeste por las estribaciones andinas y en el este por el Escudo Brasileño y se extienden en la cuenca preandina. Están formadas principalmente por grandes pastizales con fragmentos de bosques esparcidos a manera de islotes, humedales y vegetación arbustiva, además de la presencia de bosques de galería (Hanagarth, 1993). La composición florística varía en el transcurso del año, de acuerdo al microrelieve y el nivel del agua (Beck et al., 1993). Figura 5. Islas de Bosque (al fondo) y ganado vacuno presente en la zona. Estancia San Miguel, Santa Rosa de Yacuma. Estas formaciones presentan una diversidad estrechamente relacionada con el tamaño, ubicación y grado de influencia humana, con una zonificación interna que contiene especies del bosque húmedo de llanura en el centro y especies resistentes al fuego en el borde, siendo las más representativas: Genipa americana (bi) Guazuma ulmifolia (coco) Cupania cinérea (sama colorada) Copaifera reticulata (copaiba) Sterculia apétala (sujo) Tabebuia impetiginosa (tajibo) Triplaris americana (palo santo) y especies de Ficus (bibosi) (Beck et al., 18 1993). En islas altamente impactadas por la actividad ganadera, se observa predominio de las palmeras Attalea phalerata (motacú) y Acrocomia aculeata (totaí) que crece en los bordes (Miranda et al., 1991; Fig 5). La temperatura promedio anual es de aproximadamente 26º c, presenta un régimen bimodal de lluvias con picos de mayor precipitación en los meses de enero, febrero y marzo, que dan lugar a la típica inundación estacional (1300 a > 7000 mm anuales) y un periodo de sequía de alrededor de cinco meses (Junio-Octubre) (Moraes et al., 2000; Ibisch et al., 2008). 5.2. Selección y habituación de los grupos de estudio La selección de los grupos de estudio se realizó en base a datos obtenidos por Wildlife Conservation Society (WCS) en años anteriores, además de conocimientos previos de los trabajadores de la estancia en la que se realizó el trabajo de campo. Ambos grupos de estudio habitan en islas de bosque separadas físicamente entre sí; y dado el elevado grado de territorialidad atribuible a la especie, no se observaron casos de incursiones de individuos de ninguno de ambos grupos en el territorio del otro, lo cual respalda su independencia. Con el fin de registrar el comportamiento en estado natural de estos dos grupos, se procedió a la habituación de los mismos, que varía según la especie e individuo; alcanzándose un punto en el cual los animales aumentan su tolerancia y no son ahuyentados por la cercanía del observador, momento en el que los datos obtenidos se consideran confiables (Rabinowitz, 2003). A tales efectos, la habituación de los grupos estudiados fue realizada durante el mes de abril y parte de mayo; pero no obstante ello, el proceso fue continuo a lo largo del estudio. 19 5.3. Trabajo de campo El estudio se llevó a cabo durante los meses de abril a diciembre del 2010, con un total de 8 entradas al campo, de entre 15 y 21 días cada una. 5.3.1. Toma de datos referidos a comportamiento Las observaciones diarias se realizaron desde las 06:00 (amanecer) hasta las 18:00 horas (atardecer) en los dos grupos familiares de Callicebus modestus elegidos, (Anexo 1,2). Dicho horario se fue ajustando en función a las horas luz brindadas según el mes del año; además del tiempo de búsqueda y encuentro con cada grupo. Las observaciones se efectuaron con un equipo de binoculares Bushnell, de 10x50mm. Para la obtención de datos sobre comportamiento alimenticio, diferenciado con respecto a otros comportamientos; se utilizó el método de scan grupal, el cual consiste en un censado rápido del grupo de individuos donde el comportamiento de cada uno es registrado (Martin & Bateson, 1986). El método se aplicó con intervalos de 10 minutos. Para el registro de todos los eventos de alimentación observados, se utilizó un muestreo ad libitum, que involucra observaciones oportunistas o no pautadas (sin restricciones en el tiempo de medición) en las que se miden las distintas actividades realizadas por uno o varios individuos. A través de este procedimiento se miden comportamientos raros pero importantes, efectuando el registro de información en forma espontánea, es decir, sin sujeción a ningún método en específico “Lo que se ve, se anota” (Altman, 1974). Los datos registrados durante cada scan fueron colectados en una libreta de campo, la cual incluía datos de: fecha, nombre del grupo, hora del día, nubosidad, lluvia (leve, media, fuerte), viento (leve, medio, fuerte), hábitat en el 20 que se encuentra el individuo, localidad dentro de la isla de bosque, identidad del individuo, edad (“adultos”, “juveniles” y “crías”, de acuerdo a parámetros de comportamiento, tamaño del individuo y de sus órganos sexuales) sexo, altura a la que se encuentra el individuo, estrato del árbol en el que se encuentra (alto, medio, bajo) vecino más cercano, porcentaje de visibilidad (del 1 al 100%) presencia de otra especie (Observación directa / vocalización) y actividad realizada, la cual fue dividida en cinco categorías, dentro de las cuales se tomó en cuenta únicamente la alimentación: Se tomaron en cuenta las siguientes definiciones: - Alimentación: actividad en la que el individuo procesa o consume, ya sean ítems vegetales o presas animales, estando en movimiento, sentados, echados o de pie. - Movimiento: cambio de posición de los individuos, dentro o entre coronas de los árboles, o de una locación a otra; ya sea saltando, corriendo o caminando. - Vocalización: acto de emitir sonidos de llamados, en los que todos los individuos del grupo participan. Dicho llamado es iniciado por el individuo dominante, siendo seguido por el resto del grupo. Las vocalizaciones pueden ser territoriales, de búsqueda, de alerta, o de llamado, entre otras. - Descanso: estado inactivo del grupo en el que sus individuos no interactúan entre sí y reposan, ya sea echados o sentados. - Otras actividades: estado en el cual un individuo se encuentra dedicado a otros comportamientos sociales, tales como: i. Juego: actividad que comprende persecuciones de un individuo por otro u otros, e incluye 21 saltos en general, caídas esporádicas, esconderse, carreras, frotamiento de sus cuerpos, etc.; ii. Acicalamiento: actividad que comprende el revisar la superficie de su cuerpo o el del compañero en busca de parásitos, los cuales son extraídos con ayuda de sus dientes y dedos; iii. Apareamiento: actividad en la que individuos de ambos sexos (macho y hembra) copulan; iv. Agresividad / Pelea: actividad que incluye enfrentamientos entre dos o más individuos, donde uno expresa su dominancia sobre el otro; v. Acoso: Comprende aquella actividad en la que un individuo de sexo masculino persigue y hostiga a la hembra, con fines de apareamiento; vi. Defecación: Momento en el que el o los individuos son observados orinando o defecando; vii. Miedo: momento en el cual los individuos demuestran posturas de sumisión con gritos y carreras, ocultándose en respuesta a algún peligro inminente; viii. Lactancia: actividad en la que las madres dan de lactar a sus crías. 5.3.2. Registros alimenticios En cada evento alimenticio se registraron los siguientes datos: 1) grupo al que pertenece el individuo, 2) fecha, 3) identidad del individuo, 4) ítem consumido (nombre común / número de placa) 5) localidad en la que se encuentra, 6) hora de entrada y de salida del árbol, 7) parte consumida / ítem (frutos, semillas, flores, botón floral, hojas, hojas jóvenes, artrópodos) 8) micro parte consumida (pulpa, pétalos, semillas) y 9) comentarios. Durante cada registro de alimentación se marcaron las plantas de las cuales fueron extraídos los ítems alimenticios (Figura 6) a través de placas enumeradas, para su posterior colecta e identificación con la colaboración del Herbario Nacional de La Paz. 22 Figura 6. Marcaje de las plantas utilizadas por Callicebus modestus como fuente de alimento. La identificación de los ítems consumidos se logró a través de la observación directa realizada por el investigador y un guía de campo que corroboraba los datos. En el caso de los artrópodos, llegó sólo a Orden; aunque en algunos casos resultó imposible la visualización y posterior identificación del insecto consumido. Para identificarlos se tomó como base principal el tamaño, la forma del ítem animal y el modo en que era cazado: Consumo de hormigas: cuando un individuo de C. modestus introducía su mano en algún hormiguero, de tal manera que al extraer la misma, simplemente recogía con su boca las hormigas que caminaban encima de su pelaje. Consumo de saltamontes: cuando un individuo saltaba y capturaba el insecto con sus manos, éste podía ser identificado a través de la observación de sus extremidades; que sobresalían de las manos de aquel. 23 Consumo de arañas: a través de observación directa, cuando los individuos capturaban las telarañas y las iban comiendo, conjuntamente con las arañas y otros insectos probablemente pegados en las mismas. Consumo de gusanos: mediante observación directa de individuos capturando gusanos o larvas de mariposas entre las ramas de los árboles. Dicha observación se encontró facilitada por el tamaño de las larvas, que oscilaba entre 3 y 5 cm de longitud. 5.4 Análisis de datos Para expresar el tiempo de observación del total de individuos, se multiplicó el tiempo de alimentación total de cada individuo de cada grupo expresado en horas, por el número de muestreos por hora, es decir, scans. Tobs = Tt x #scans Donde: Tobs = Tiempo de observación de los individuos. Tt = Tiempo de alimentación total de cada individuo. #scans = número de muestreos por hora (scans). Con el fin de proporcionar información sobre las variaciones en las tasas de alimentación, se calculó la dieta en base a segundos, para posteriormente convertir los valores para cada artrópodo o especie de árbol, en porcentajes del tiempo total dedicado a la alimentación (Wallace, 2005). Para cada especie consumida por Callicebus modestus se calcularon los porcentajes de la siguiente manera: 24 (Registros de ítem i) X (Registros de todos los ítems) Donde: 100 i = cada ítem alimenticio registrado. En base a los registros y las frecuencias alimenticias de cada individuo en ambos grupos, se realizó un análisis de diversidad de dieta. Para esto se utilizó el Índice de Inverso de Simpson “Cinv”, debido a que este índice responde con mayor sensibilidad a los cambios en igualdad; otorgando el mismo valor tanto a las especies raras como a las comunes (Bravo-Nuñez, 1991; Feinsinger, 2003). Cinv = 1 / D Dónde: S = número total de especies vegetales consumidas N= número total de individuos de especies vegetales registrados ni= número de individuos de la especie vegetal i En cuanto a la interpretación de los índices de diversidad, se realizaron Curvas de Rango Abundancia para observar la variación de la dieta en ambos grupos, entre edades y sexos (Feinsinger, 2003). Puesto que el coeficiente de Spearman (rs) es una medida de relación lineal entre dos variables, se utilizó éste análisis para determinar la relación entre pares de variables (diversidad - % de tiempo de alimentación, etc.) el cual se define a través de la expresión siguiente: 25 Donde: d = diferencia entre los correspondientes estadísticos de orden de x - y n = número de parejas El grado de sobreposición mensual de las especies utilizadas como alimento entre grupos, fue determinado a través del coeficiente de similitud de Sorensen (Muñoz et al. 2005) que se define por la expresión siguiente: Dónde: Iss = Índice de Similitud de Sorensen A = Número de especies de la muestra A B = Número de especies de la muestra B C = Número de especies en común Para determinar la significancia del tiempo de observación mensual obtenido para cada grupo de C. modestus, se utilizó la prueba “t de student”, y para determinar la significancia de la variación mensual del tiempo invertido en el consumo de los ítems alimenticios por ambos grupos, se utilizó Pairwise t-test, estableciendo un nivel de probabilidad estándar de p<0.05. 26 Los demás datos presentados fueron analizados mediante pruebas de estadística no paramétricas, con un nivel de probabilidad estándar de P <0.05, estableciendo así la significancia de los datos: Para determinar si existen variaciones en el consumo de los diferentes ítems alimenticios entre hembras y machos de cada grupo, se aplicó la prueba de Wilcoxon, Para determinar la variación en el consumo de los diferentes ítems alimenticios entre las diferentes edades (adulto, juvenil, cría) se utilizó la prueba de Friedman ANOVA. 27 6. RESULTADOS 6.1. Tiempo de observación El tiempo de observación de los grupos de Callicebus modestus durante el periodo de estudio, mostró ligeras variaciones mensuales (Anexo 3) lo cual se debe principalmente a las horas luz definidas por la estación del año y el tiempo que se perdía en la búsqueda y el encuentro de los grupos a diario; además del grado de habituación de cada grupo respecto a la presencia de los investigadores. Otro factor que interfirió con la toma de datos, fue la presencia esporádica de individuos de Cebus libidinosus dentro de las islas de bosque, quienes espantaban a los individuos de Callicebus modestus dificultando su búsqueda o seguimiento a lo largo del día. Los datos obtenidos en el periodo de estudio dentro de los Grupos “Maramacho” y “Corral”, corresponden en promedio a 14790 (±4.03 DE) y 7214.5 (±3.53 DE) scans, haciendo un total de 2465 (±0.67 DE) y 1202,42 (±0.59 DE) horas de trabajo de campo respectivamente (Tabla 1). Tabla 1. Horas de observación para cada grupo e individuos de Callicebus modestus durante todo el periodo de estudio (los valores con asteriscos corresponden al número de horas multiplicado por el número de muestreos por hora, es decir scans) Grupo Individuo Tiempo total (horas) “Maramacho” Karina Timoteo Lita Macario Natusha Mandingo 2465,33(14792*) 2464,67(14788*) 2464,33(14786*) 2465,83(14795*) 1202 (7212*) 1202,83 (7217*) “Corral” Tiempo promedio (horas) 2465(14790*) 1202,42(7214,5*) 28 6.2. Caracterización general de la dieta El seguimiento total de los individuos (scans y ad libitum) muestran que durante todo el periodo de estudio en la Estancia San Miguel de Santa Rosa de Yacuma, el grupo “Corral” formado por dos individuos adultos (hembra y macho) registró el consumo de un total de 47 especies vegetales como fuente de alimento, 36 de las cuales, pertenecientes a 19 familias; fueron identificadas (Anexo 4). El grupo “Maramacho” formado por 4 individuos, dos adultos (hembra y macho) un juvenil (hembra) y una cría (macho) invirtió su tiempo de alimentación en un total de 41 especies vegetales, de las cuales fueron identificadas 25, pertenecientes a 15 familias (Anexo 5). Ambos grupos registraron el consumo de artrópodos pertenecientes a dos clases y 5 órdenes (Tabla 2). De manera general, se registraron un total de 62 especies vegetales, de las cuales solo se identificaron 42 especies pertenecientes a 20 familias (Tabla 5), además de artrópodos pertenecientes a dos clases con 5 órdenes (Tabla 2) utilizados por C. modestus como fuente de alimento. En el consumo de artrópodos, el grupo “Corral” y el grupo “Maramacho” invirtieron el 15.73% y 8.71% respectivamente, del total de su tiempo de alimentación. La Clase Insecta fue la más utilizada con un 15.01% y 8.7% del tiempo total, siendo los ítems más consumidos: gusanos / larvas de mariposas con un 7.74% y 4.30%, y hormigas con un 5.14% y 2.48% respectivamente. 29 Por ello, la Clase Insecta fue la más utilizada por todos los individuos de Callicebus modestus con el 11.17% del total del tiempo de alimentación, donde los ítems más consumidos fueron gusanos / larvas de mariposas con un 5.64% y hormigas con un 3.52% (Tabla 2). Tabla 2. Tiempo invertido por ambos grupos de Callicebus modestus en el consumo de artrópodos (“Corral” – grupo 1, “Maramacho” – grupo 2) en la Estancia San Miguel, durante el periodo de estudio. Tiempo de Alimentación Clase Orden Invertebrados Arachnida Araneae arañas Insecta Orthoptera grillos/saltamontes Insecta Lepidoptera mariposa Insecta Hymenoptera hormigas Insecta Isoptera termitas c/alas Insecta Indeterminada insectos s/id Insecta Indeterminada gusanos/larvas TOTAL General General (seg) (%) 4140 0,29 1860 120 50410 15600 11100 80860 0,13 0,01 3,52 1,09 0,78 5,64 11.46% Grup1 (seg) 3960 1260 0,000 28740 5280 5400 43240 Grup1 Grup2 Grup2 (%) (seg) (%) 0,71 180 0,02 0,23 0,00 5,14 0,94 0,97 7,74 15.73% 600 120 21670 10320 5700 37620 0,07 0,01 2,48 1,18 0,65 4,30 8.71% En cuanto a especies vegetales, las pertenecientes a las familias Bignoniaceae, Moraceae, Arecaceae (Palmae) y Rubiaceae fueron las más utilizadas por el Grupo “Corral” con un 17.53%, 15.50%, 8.87% y 8.80%, respectivamente. Las 15 familias de especies vegetales restantes representan el 16.42% del total del tiempo de alimentación y las especies de familias no identificadas, el 8.49% (Tabla 3). 30 De manera similar en el grupo “Maramacho”, las especies vegetales pertenecientes a las familias Arecaceae (Palmae) Lauraceae, Bignoniaceae y Rubiaceae con un 19.63%, 9.62%, 8.94% y 7.38% respectivamente; fueron las más utilizadas. Las demás familias identificadas representaron el 12.42%, y las especies no identificadas, el 28.26% del total del tiempo de alimentación (Tabla 4). En general, el consumo de partes vegetales representa el 88.55% del total del tiempo de alimentación de C. modestus, representando las especies de las familias Arecaceae (Palmae) y Bignoniaceae el conjunto de mayor consumo, con un 15.43% y 12.29% de tiempo de alimentación respectivamente; las especies de las familias Rubiaceae, Moraceae y Lauraceae representaron un 7.93%, 6.29% y 6.45% respectivamente; y el consumo de las especies de las 15 familias restantes totalizaron un 19.59%; a diferencia de las 20 especies vegetales no identificadas, que representaron el 20.55% del tiempo total de alimentación. El 67.86% de las especies vegetales consumidas corresponden a especies arbóreas; a diferencia de las lianas, que constituyen un 20.68%. De las mismas, un 16.42% no fueron identificadas (Tabla 5). 31 Tabla 3. Especies vegetales utilizadas como fuente de alimento, por individuos de Callicebus modestus dentro del grupo “Corral”, durante el periodo de estudio en la Estancia San Miguel. Familia Anacardiaceae Annonaceae Especies Astronium fraxinifolium Annona montana Annona vel sp. Nov. Arecaceae (Palmae) Attalea phalerata Acrocomia aculeata Tabebuia aurea Bignoniaceae Arrabidaea sp.1 Arrabidaea sp.3 Tabebuia spp. Tabebuia sp.1 Cecropia concolor Cecropiaceae Curatella americana Dilleniaceae Doliocarpus dentatus Aporosella cf. chacoensis Euphorbiaceae Pera benensis Fabaceae Inga sp. (Leg.Minos.) Fabaceae Dipteryx alata (Leg.Pap.) Swartzia jorori Dalbergia cf. foliosa Machaerium pilosum Casearia aculeata Flacourtiaceae Casearia gossypiosperma Salacia cordata Hippocrataceae Ocotea cernua Lauraceae Persea caerulea Ficus sp.1 Moraceae Clarisia biflora Ficus pertusa Maclura tinctoria Myrsine umbellata Myrsinaceae Agonandra peruviana Opiliaceae Genipa americana Rubiaceae Guettarda viburnoides Cupania cinerea Sapindaceae Smilacaceae Verbenaceae Indeterminada Smilax sp.1 Vitex cymosa Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada Nombre Común cuta biribá rupresia limoncillo motacu totai alcornoque Liana Canuto liana vaina larga Palo Cacha tajibo ambaibo chaquillo Liana Chaquillo Liana amarilla piraquina negra Pacay almendrillo jorori Tamarindillo Tusequi palo puja proquia limoncillo guapomo laurel Maramacho Bibosi chicle murure Matapalo mora falso aliso panejaja II bi Pata de michi trompillo liana cacho de gallo Taruma aceitunilla Granadilla liana cable liana coladora Liana de flor lila liana espinas pares Liana patito liana piper no det =335 maramacho Solda Solda uvilla Tiempo de Tiempo de alim alim (seg) (%) 6370 1,35 6120 1,30 1320 0,28 24480 5,20 25080 5,32 2760 0,59 6660 1,41 39900 8,47 1680 0,36 46960 9,97 13210 2,80 24550 5,21 4140 0,88 2460 9420 0,52 2,00 13440 2,85 120 600 6600 4440 300 0,03 0,13 1,40 0,94 0,06 1200 780 8240 120 12840 3060 68060 2700 19200 540 36780 12420 11580 0,25 0,17 1,75 0,03 2,73 0,65 14,45 0,57 4,08 0,11 7,81 2,64 2,46 3300 2160 660 15120 1200 1920 540 17530 240 1620 0,70 0,46 0,14 3,21 0,25 0,41 0,11 3,72 0,05 0,34 1140 3420 4080 0,24 0,73 0,87 32 Tabla 4. Especies vegetales utilizadas como fuente de alimento, por individuos de Callicebus modestus dentro del grupo “Maramacho”, durante el periodo de estudio en la Estancia San Miguel. Familia Anacardiaceae Annonaceae Arecaceae (Palmae) Bignoniaceae Cecropiaceae Cochlospermaceae Dilleniaceae Euphorbiaceae Fabaceae (Leg.Minos.) Fabaceae (Leg.Pap.) Flacourtiaceae Lauraceae Moraceae Myrsinaceae Rubiaceae Indeterminada especies Mangifera indica Annona montana Cardiopetalum calophyllum Annona vel sp. Nov. Attalea phalerata Acrocomia aculeata Tabebuia aurea Tabebuia sp.1 Cecropia concolor Cochlospermum vitifolium Curatella americana Doliocarpus dentatus Pera benensis Inga sp. Inga sp. 1 Swartzia jorori Machaerium pilosum Casearia aculeata Ocotea cernua Persea caerulea Ficus sp.1 Clarisia biflora Myrsine umbellata Guettarda viburnoides Coussarea hydrangeaefolia Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada nombre comun mango biribá piraquina xilopia rupresia limoncillo motacu totai alcornoque tajibo ambaibo algodoncillo chaquillo Liana Chaquillo piraquina negra Pacay pacay peludo jorori Tusequi palo puja laurel Maramacho Bibosi chicle murure falso aliso Pata de michi tutumilla arbol de resina roja bejuco simbao caripe liana cable liana codo Liana de flor lila liana de hojita larga liana espinas pares liana lechera Liana patito n/n palo corcho paquiocillo Solda Solda uña de gato uvilla Tiempo de Tiempo de alim (seg) alim (%) 25920 3,25 7380 0,92 16860 4860 71280 100320 5580 72620 15240 1320 7500 720 2460 39420 4560 4680 11940 2340 83100 1020 1680 1920 3780 8100 2,11 0,61 8,93 12,57 0,70 9,10 1,91 0,17 0,94 0,09 0,31 4,94 0,57 0,59 1,50 0,29 10,41 0,13 0,21 0,24 0,47 1,01 56400 14460 2820 2760 120 44640 58160 7,07 1,81 0,35 0,35 0,02 5,59 7,29 960 82680 1320 6540 2820 1920 2580 480 6540 18300 0,12 10,36 0,17 0,82 0,35 0,24 0,32 0,06 0,82 2,29 33 Tabla 5. Especies vegetales utilizadas por ambos grupos de Callicebus modestus como fuente de alimento en la Estancia San Miguel, durante el periodo de estudio. Las abreviaciones de los ítems alimenticios corresponden a: b-fl= botón floral; fl=flores; fr-m= fruto maduro; fr-v= fruto verde; fr-s= fruto seco (semilla); g-tll= guía del tallo /tallos tiernos; h= hojas maduras; h-t= hojas tiernas/ rebrotes; h-a= hojas amarillas. Familia nombre común Item alimenticio cuta mango biribá rupresia limoncillo b-fl;fr-m;h;h-t fr-m fl;fr-m;fr-s;g-tll;h;h-t piraquinaxilopia fl;fr-m;h Bignoniaceae Acrocomia aculeata Attalea phalerata Arrabidaea sp.1 Arrabidaea sp.3 Tabebuia aurea totai motacu Liana Canuto liana vaina larga alcornoque Cecropiaceae Tabebuia sp.1 Tabebuia spp. Cecropia concolor Cochlospermum vitifolium tajibo Palo Cacha ambaibo fl;fr-m;fr-v fr-m;h;h-t fr-m;g-tll;h;h-t b-fl;fr-m;fr-s;g-tll;h;h-t b-fl;fl;fr-m b-fl;fl;fr-m;fr-v;fr-s;gtll;h;h-t fl;h b-fl;fl;fr-m;fr-s;g-tll;h;h-t Curatella americana Doliocarpus dentatus Aporosella cf. chacoensis Pera benensis Inga sp. Inga sp. 1 Machaerium pilosum Dipteryx alata Dalbergia cf. foliosa Swartzia jorori Casearia aculeata Casearia gossypiosperma Salacia cordata chaquillo fr-m b-fl;fl;fr-m;fr-v;fr-s;gtll;h;h-t Liana Chaquillo fr-m;fr-v;h Liana amarilla piraquina negra Pacay pacay peludo Tusequi almendrillo Tamarindillo jorori palo puja Proquia limoncillo guapomo Sapindaceae Ocotea cernua Persea caerulea Clarisia biflora Ficus pertusa Ficus sp.1 Maclura tinctoria Myrsineum bellata Agonandra peruviana Coussarea hydrangeaefolia Genipa americana Guettarda viburnoides Cupania cinerea Smilacaceae Verbenaceae Smilax sp.1 Vitex cymosa Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada Anacardiaceae Annonaceae especies Astronium fraxinifolium Mangifera indica Annona montana Annonavel sp. Nov. Cardiopetalum calophyllum Arecaceae (Palmae) Cochlospermaceae Dilleniaceae Euphorbiaceae Fabaceae (Leg.Minos.) Fabaceae (Leg.Pap.) Flacourtiaceae Hippocrataceae Lauraceae Moraceae Myrsinaceae Opiliaceae Rubiaceae Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada Indeterminada Tiempo de alim (seg) Tiempo de alim (%) 6370 25920 13500 0.444 1.808 0.942 6180 0.431 16860 1.176 125400 95760 6660 39900 8340 8.749 6.681 0.465 2.784 0.582 119580 1680 28450 8.343 0.117 1.985 1320 0.092 32050 2.236 4860 0.339 fr-m;g-tll;h;h-t b-fl;fl;fr-m;fr-s;g-tll;h-t b-fl;fl;fr-m;fr-s;g-tll;h;h-t fr-m fr-m;fr-s;h;h-t fr-v fl;fr-m;fr-s;h;h-t fl;fr-m;h-t fr-m 2460 11880 52860 4560 16380 120 6600 5280 2640 0.172 0.829 3.688 0.318 1.143 0.008 0.460 0.368 0.184 1200 780 0.084 0.054 laurel Maramacho chicle murure Matapalo Bibosi mora falso aliso fr-m fl;fr-m;g-tll;h b-fl;fl;fr-m;fr-v;fr-s;gtll;h;h-t b-fl;fr-m;h fr-m;fr-v b-fl;fl;fr-m;g-tll;h;h-t;h-a fr-m;fr-s;g-tll;h;h-t fr-m;h-t fl;fr-m;fr-v;h 91340 1140 4980 68060 14520 2700 22980 6.373 0.080 0.347 4.749 1.013 0.188 1.603 panejaja II fr-m 540 0.038 tutumilla bi fr-m;g-tll fl;fr-m;h;h-t 56400 36780 3.935 2.566 Pata de michi trompillo liana cacho de gallo Taruma árbol de resina roja liana cable caripe liana lechera no det =335 (grup2) SoldaSolda Granadilla Liana patito liana codo Liana de flor lila liana de hojita larga palo corcho paquiocillo liana piper liana espinas pares liana coladora aceitunilla uvilla uña de gato bejuco simbao n/n b-fl;fl;fr-m;h;h-t fl;fr-m;fr-s;g-tll;h 20520 11580 1.432 0.808 3300 2160 0.230 0.151 flo;fr-m;fr-s;g-tll;h fr-m;h;h-t b-fl;h fr-m;g-tll 14460 1320 2760 1320 1.009 0.092 0.193 0.092 fl;fr-m fr-m;h;h-t fl;fr-m;fr-v;g-tll;h;h-t b-fl;fl;fr-m;g-tll;h;h-t b-fl;fl;fr-m;fr-s;g-tll;h b-fl;fl;fr-m;fr-s;g-tll;h 1140 3900 15120 6780 44640 58700 0.080 0.272 1.055 0.473 3.115 4.096 960 1920 2580 1620 0.067 0.135 0.180 0.113 100210 1920 660 22380 6540 2820 2820 1269160.0 6.992 0.134 0.046 1.562 0.456 0.197 0.197 88.551 algodoncillo fr-m;h fl;fr-m;fr-v;g-tll;h;h-t fl b-fl fl fl;h g-tll;h-t fl;fr-m;fr-v;fr-s;g-tll;h;h-t fl fr-m;h fl;fr-m fl fl fr-m TOTAL 34 6.2.1 Partes animales y vegetales (ítems) consumidas por Callicebus modestus De manera general, Callicebus modestus demostró preferencia por el consumo de frutos maduros, frutos secos (semillas) y flores (Anexo 4) siendo éstos los elementos más importantes dentro de la dieta, al representar el 74.55% del tiempo total de alimentación. El 49.54% de tiempo fue invertido en frutos maduros, 13.45% en flores y 11.56% en frutos secos (semillas). El consumo de hojas representó un 7.86%, siendo las hojas tiernas o rebrotes, las más consumidas, con un 4.03%. El resto de las partes vegetales (fruto verde, botón floral y guías de tallos / lianas) representan tan solo el 6.05% del total del tiempo invertido en la alimentación. El consumo de artrópodos representó un porcentaje total de 11.54%, donde los gusanos / larvas de mariposa y las hormigas resultaron los ítems más consumidos con un 5.81% y 3.41% respectivamente. El consumo de arañas, saltamontes, mariposas, terminas e insectos no identificados, representaron sólo un 2.32% del total de la dieta (Figura 7). 35 Figura 7. Porcentaje del tiempo de alimentación por cada parte vegetal y animal invertido por Callicebus modestus durante el periodo de estudio en la Estancia San Miguel Las partes vegetales más consumidas por ambos grupos (“Corral” y “Maramacho”) fueron los frutos maduros con un 53.61% y 57.92%, flores maduras con 11.30% y 18.61% respectivamente. Por su lado, en las partes animales consumidas el grupo “Corral” invirtió un tiempo mayor que el grupo “Maramacho” en el consumo de gusanos con un 7.80% y 3.92%, y hormigas con un 5.23% y 2.80% respectivamente, como se muestra en la figura 8 (Anexo 6; 7). 36 Figura 8. Porcentaje Total del tiempo de alimentación por cada parte vegetal y animal invertido por el grupo “Corral” (en amarillo) y el grupo “Maramacho” (en azul) de Callicebus modestus durante el periodo de estudio en la Estancia San Miguel. 6.2.1.1 Diversidad de dieta entre grupos La diversidad de dieta de Callicebus modestus en ambos grupos (“Corral” y “Maramacho”) presenta una distribución similar. Tal como se muestra en la figura 9, ambas curvas presentan un ancho similar, lo cual indica un número similar de especies utilizadas como fuente de alimento. El índice de diversidad inverso de Simpson (Cinv=1/D) muestra para el grupo “Corral” un valor de 16.11 y para el grupo “Maramacho” un valor de 13.67. Puesto que estos valores son muy similares, se podría decir que no existe una diferencia marcada en cuanto al número de especies consumidas por ambos grupos de C. modestus. 37 -0.5 Abundancia de especies -1.0 -1.5 Totaí Matapalo Laurel / Liana espinas pares Tajibo Tajibo / Motacú Liana vaina larga Liana de flor lila / Tutumilla Bi Liana codo Torai/ Chaquillo/ Motacu Pacay Falso aliso Mango Liana espinas pares Uvilla Granadilla / Pacay / Ambaibo / Bibosi / Pata de michi Piraquina xilopia Trompillo Ambaibo / Árbol resina roja Piraquina negra Tusequi Laurel /Liana canuto / Tamarindillo / Cuta -2.0 -2.5 Grupo Corral Grupo Maramacho -3.0 -3.5 Almendrillo / Maramacho Liana cable -4.0 Especies vegetales ordenadas segun el consumo Figura 9. Curvas rango abundancia de las especies consumidas por ambos grupos (grupo “Corral” en verde, grupo “Maramacho” en azul) de Callicebus modestus a lo largo del periodo de estudio. Las especies utilizadas por ambos grupos se describen de forma descendente en el Anexo 8. 38 Las especies más utilizadas por adultos del grupo “Corral” fueron: Ficus pertusa (matapalo, 12.18%) Tabebuia sp.1 (tajibo, 8.40%) Arrabidaea sp.3 (liana vaina larga, 7.14%) Genipa americana (bi, 6.58%) seguidas por Acrocomia aculeata (totaí, 4.49%) Curatella americana (chaquillo, 4.39%) y Attalea phalerata (motacú, 4.38%) que se encuentran en similar proporción; mientras que las especies más utilizadas por adultos del grupo “Maramacho” fueron Acrocomia aculeata (totai, 11.47%) seguida por Ocotea cernua (laurel, 9.50%) y liana espinas pares (especie sin identificación, 9.46%) que se encuentran en similar proporción, estas a la vez seguidas por Tabebuia sp.1 (tajibo, 8.31%) Attalea phalerata (motacu, 8.15%) Liana de flor lila (especie sin identificación, 6.65%) y Coussarea hydrangeaefolia (Tutumilla, 6.45%). Dichos resultados podrían deberse principalmente, a la oferta de alimentos dentro cada isla de bosque. En la parte horizontal de la curva (cola) de ambos grupos, se observa la presencia de especies que probablemente presentan un n i=1. Dichas especies podrían ser resultado de un azar dentro del muestreo, es decir, que podría tratarse de especies raras de la dieta de C. modestus de las cuales sus individuos se alimentaban pocas veces. Estas especies son: Dipteryx alata (Amendrillo, 0.02%) y Persea caerulea (Maramacho, 0.02%) por parte del grupo “Corral” y Liana Cable (especie no identificada, 0.01%) por el grupo “Maramacho” (Figura 9; Anexo 8). Las pendientes relativamente planas de ambas curvas (grupo “Corral” y grupo “Maramacho”) indican una mayor igualdad entre el tiempo de alimentación invertido en todas las especies, es decir que se trata de varias especies en las que se ocupan tiempos intermedios de alimentación, ninguna de las cuales demuestra dominancia numérica pronunciada (Figura 9). 39 6.3 Variación general de tiempos de consumo entre sexos y edades 6.3.1 Variación entre hembras y machos adultos El porcentaje de tiempo de alimentación de partes animales y vegetales entre hembras y machos, mostró ligeras variaciones que no fueron significativas (Prueba de Wilcoxon T= 56.00, p= 0.82, n= 16) siendo los ítems más consumidos tanto por hembras como por machos, los frutos maduros con 54.58% y 57.83%, flores maduras con 14.06% y 15.21% y artrópodos con 15.15% y 13% respectivamente. Otros ítems tales como hojas tiernas / rebrotes (3.98%) fueron ingeridos por las hembras con un tiempo de alimentación ligeramente mayor que los machos (Figura 10; Anexo 10). Figura 10. Porcentaje de tiempo invertido en el consumo de partes animales y vegetales (ítems alimenticios) por hembras (en rosado) y machos (en azul) adultos de Callicebus modestus, durante el periodo de estudio en la Estancia San Miguel. 40 6.3.1.1 Diversidad de Dieta entre sexos La diversidad de dieta entre las hembras adultas de ambos grupos (“Corral” y “Maramacho”) de Callicebus modestus (Figura 11) está representada con un número similar de muestras ya que el ancho de la curva es muy parecido, los índices de diversidad obtenidos muestran un valor ligeramente mayor para la hembra adulta del grupo “Corral” (Cinv=15.16) al obtenido para la hembra adulta del grupo “Maramacho” (Cinv=12.70) lo cual podría indicar el consumo de un número similar de especies entre las hembras de ambos grupos. Las especies más utilizadas por la hembra adulta del grupo “Corral” fueron: Ficus pertusa (Matapalo, 5.11%) Arrabidaea sp.3 (liana vaina larga, 3.33%) Genipa americana (bi, 3.32%) Tabebuia sp.1 (tajibo, 3.03%) las tres últimas en similar proporción, seguidas por Acrocomia aculeata (totai, 1.75%) Attalea phalerata (motacu, 1.63%). Mientras que las especies más utilizadas por la hembra adulta del grupo “Maramacho” fueron Attalea phalerata (motacu, 3.01%) Acrocomia aculeata (totai, 2.86%) Ocotea cernua (laurel, 1.96%) Tabebuia sp.1 (tajibo, 1.81%) liana espinas pares (1.64%) y liana de flor lila (1.59%) estas últimas sin identificación (Figura 11; Anexo 8). La cola o parte horizontal de ambas curvas, muestra la presencia de especies que representan ni =1, lo que indica que fueron muestreadas al azar, por lo que probablemente su consumo fue raro u ocasional. Dentro de ellas tenemos, para el grupo “Maramacho”, a palo corcho (0.02%) y liana cable (0.01%) aun sin identificación; y para el grupo “Corral”, a liana patito (0.02%, aún sin identificación) y Persea caerulea (maramacho, 0.02%). Las pendientes relativamente planas de ambas curvas, indican una mayor igualdad entre el tiempo de alimentación invertido en todas las especies, es decir varias de ellas con tiempos intermedios de alimentación y ninguna con dominancia numérica pronunciada (Figura 11). 41 -0.5 Matapalo -1.0 Abundancia de especies -1.5 Liana vaina larga / Bi Tajibo Totaí Motacu / Chaquillo Falso Aliso Trompillo / Granadilla Liana espinas pares /Laurel Ambaibo Pacay Bibosi Motacú Totaí Laurel Tajibo Liana espinas pares / Liana de flor lila Liana codo Tutumilla / Pacay Praquina xilopia Uvilla Mango Tusequi / Ambaibo -2.0 -2.5 -3.0 Liana cable Liana patito / Maramacho -3.5 Especies vegetales ordenadas segun el consumo Figura 11. Curvas rango abundancia de las especies consumidas por hembras ambos grupos (grupo “Corral” en círculos rojos, grupo “Maramacho” en rombos violetas) de Callicebus modestus a lo largo del periodo de estudio. Las especies utilizadas por ambos grupos se describen de forma descendente en el Anexo 8. 42 De manera similar al grupo de hembras adultas, la diversidad de dieta de los machos adultos de ambos grupos (“Corral” y “Maramacho”) de Callicebus modestus según la Figura 12, presenta un número similar de muestras, ya que el ancho de la curva es muy parecido; aunque la distancia de la parte posterior de la curva (cola) en el grupo “Corral” (Ocotea cernua - laurel, 0.003%) es más pronunciada que en el grupo “Maramacho” (Paquiocillo, 0.08% - especie no identificada) mostrando así datos extremos de una especie probablemente muestreada al azar, es decir, que fue consumida ocasionalmente. El índice inverso de Simpson, muestra un valor ligeramente mayor en el macho adulto del grupo “Corral” (Cinv= 16.04) que en el macho adulto del grupo “Maramacho” (Cinv= 12.50). Las especies más utilizadas por el macho adulto del grupo “Corral” fueron Ficus pertusa (Matapalo, 10.15%) Tabebuia sp.1 (tajibo, 8.28%) Arrabidaea sp.3 (liana vaina larga, 5.11%) Curatella americana (chaquillo, 4.37%) Attalea phalerata (motacu, 4.20%) Acrocomia aculeata (totai, 4.10%) y Genipa americana (bi, 4.01%); mientras que las especies más utilizadas por el macho del grupo “Maramacho” fueron Attalea phalerata (motacu, 11.01%) Acrocomia aculeata (totai, 10.98%) liana espinas pares (10.63%, aún sin identificación) Tabebuia sp.1 (tajibo, 10.20%) Ocotea cernua (laurel, 9.38%) Coussarea hydrangeaefolia (tutumilla, 7.59%) y liana codo (5.67%, aún sin identificación; Figura 12; Anexo 8). En cuanto a la diversidad general de dieta entre hembras y machos adultos de ambos grupos (“Corral” y “Maramacho”) según la Figura 13, tanto hembras como machos presentan un ancho de curva similar, lo cual indica un número similar de especies utilizadas como fuente de alimento. El índice inverso de Simpson, muestra un promedio para los machos de Cinv=14.27 (±2.50 DE) similar al promedio de las hembras adultas de Cinv=13.93 (±1.74 DE) lo que indica un número igual de especies consumidas, tanto por hembras como por machos. 43 0 Matapalo Tajibo -1 Liana vaina larga Chaquillo / Motacú / Totaí / Bi Liana espinas pares / Pata de michi / Falso aliso / Bibosi Pacay / Piraquina negra Ambaibo / GRanadilla / Liana canuto Motacú / Totaí Liana espinas pares / Tajibo Laurel Tutumilla Liana codo Liana de flor lila Pacay Mango Abundancia de especies Piraquina xilopia Uvilla / Árbol resina roja / Ambaibo -2 -3 -4 Laurel Paquiocillo -5 Especies vegetales ordenadas segun el consumo Figura 12. Curvas rango abundancia de las especies consumidas por machos de ambos grupos (grupo “Corral” con círculos azules, grupo “Maramacho” con cuadrados verdes) de Callicebus modestus a lo largo del periodo de estudio. Las especies utilizadas por ambos grupos se describen en orden descendente en el Anexo 8. 44 Las pendientes de ambas curvas, son relativamente planas, lo que indica una mayor igualdad en el consumo de todas las especies, es decir ninguna dominancia numérica en los tiempos de alimentación invertidos por C. modestus en cada especie vegetal. La parte horizontal de ambas curvas (colas) muestra la presencia de especies con ni=1 que probablemente fueron muestreadas al azar, es decir que su consumo fue ocasional, tales como: Dipteryx alata (almendrillo, 0.02%) palo corcho (0.03%, aún sin identificación) utilizadas por machos y hembras adultas respectivamente (Figura 13). Las especies más utilizadas por los machos adultos en su dieta, fueron Tabebuia sp.1 (tajibo, 9.56%) Attalea phalerata (motacu, 7.49%) Acrocomia aculeata (totai, 7.41%) liana espinas pares (6.70%, aún sin identificación) Ficus pertusa (matapalo, 6.05%) Ocotea cernua (laurel, 4.25%) e Inga sp. (pacay, 3.68%); las especies utilizadas por las hembras adultas representadas por Attalea phalerata (motacu, 7.35%) Tabebuia sp.1 (tajibo, 7.34%) Ficus pertusa (Matapalo, 7.29%) Acrocomia aculeata (totai, 7.27%) Ocotea cernua (laurel, 4.84%) Arrabidaea sp.3 (liana vaina larga, 4.74%) y Genipa americana (bi, 4.73%; Figura 13). 45 -0.5 -1.0 Abundancia de especies -1.5 -2.0 Motacú / Tajibo / Matapalo / Totaí Tajibo Motacú / Totaí Liana espinas pares / Matapalo Laurel / Liana vaina larga / Bi Liana espinas pares Pacay/ Liana de flor lila Chaquillo / Liana codo Falso aliso / Tutumilla Trompillo / Granadilla / Ambaibo Uvilla Tusequi Piraquina xilopia / Biribá / Bibosi Pata de michi Laurel /Pacay / Tutumilla Chaquillo / Liana vaina larga Liana codo / Bi / Liana de flor lila Pata de michi / Ambaibo Falso aliso / Bibosi Piraquina negra / Mango Granadilla/ Uvilla/ Liana canuto Piraquina xilopia -2.5 Machos Hembras -3.0 Palo Corcho -3.5 Almendrillo -4.0 Especies vegetales ordenadas segun el consumo Figura 13. Curvas rango abundancia de las especies consumidas por el promedio de hembras y de machos adultos de ambos grupos (hembras en rosado, machos en celeste) de Callicebus modestus a lo largo del periodo de estudio. Las especies utilizadas por ambos sexos se describen de forma descendente en el Anexo 9. 46 6.3.2 Variación entre edades El porcentaje de tiempo de consumo de partes vegetales entre las diferentes edades, no muestra variaciones significativas (Prueba de Friedman-ANOVA, x2= 0.40, n=9, gl=2, p=0.81) al igual que la existente entre sexos (Anexo 10) donde el porcentaje total de tiempo invertido dentro de la dieta, varía según el ítem alimenticio. Adultos invirtieron un porcentaje de tiempo ligeramente mayor, en el consumo de hojas tiernas / rebrotes (4.94% ±2.15 DE) botón floral (2.37% ±0.81 DE) y frutos verdes (2.86% ±0.66 DE) el individuo juvenil invirtió mayor porcentaje de tiempo en el consumo de frutos maduros (58.37%) y en guías de tallos tiernos / lianas (4.67%) y la cría invirtió un tiempo ligeramente mayor en el consumo de flores maduras (20.40%) y frutos secos / semillas (4.83%). El consumo de hojas amarillas se llevó a cabo sólo por un individuo adulto, tomándose este dato como un caso aislado (Figura 14). 70 % de Tiempo de alimentación 60 50 40 30 20 10 0 ro du to Fru ma r Flo ra du ma os na od ier róp ja t e Art Ho ebrot /r de ana ía i Gu llo / L ta jas Ho o sec s to a Fru emill /s to Fru al de flor ver tón Bo Ítems alimenticios Figura 14. Variación del porcentaje de tiempo invertido en el consumo de partes vegetales entre adultos (azul con rayas diagonales) juveniles (rojo con cuadricula) y crías (verde) de Callicebus modestus, durante el periodo de estudio en la Estancia San Miguel. 47 En cuanto al porcentaje de tiempo invertido en el consumo de partes animales (artrópodos) al igual que las partes vegetales, las variaciones existentes no fueron significativas (Prueba de Friedman, x2= 3.3, n=7, gl=2, p=0.19). Los individuos que invirtieron un tiempo ligeramente mayor en el consumo de todas las partes animales (artrópodos) son los adultos, exceptuando el consumo de termitas. La variación en el consumo de artrópodos entre el individuo juvenil y la cría, muestra que el juvenil invierte un tiempo mayor en el consumo de hormigas (4.18%) insectos no identificados (0.84%); la cría invierte un tiempo mayor en el consumo de gusanos / larvas de mariposa (5.81%) y termitas con alas (1.28%). además de ser el único individuo que fue observado consumiendo una mariposa a lo largo del periodo de estudio, siendo este un caso aislado al igual que las hojas amarillas. 6.3.2.1 Diversidad de dieta entre edades La diversidad de dieta en los individuos de diferentes edades (adultos, juvenil, cría) de Callicebus modestus (Figura 15) muestra curvas de ancho similares para las tres categorías de edades, por lo que se podría decir que el número de especies utilizadas como fuente de alimento es similar. El índice de diversidad promedio para los adultos resulta igual a Cinv=14.10 (±0.24 DE) que es similar al índice de diversidad del individuo juvenil y de la cría, siendo estos C inv=13.41 y Cinv=12.88, respectivamente. 48 En cuanto a las pendientes de las curvas, los adultos (en azul) presentan una pendiente más plana que el juvenil (en naranja) y éste a su vez que la cría (en verde) lo que indica, dado que varias especies presentan tiempos intermedios de alimentación y ninguna demuestra dominancia numérica pronunciada; que el tiempo de alimentación invertido en todas las especies por C. modestus presenta mayor igualdad, a diferencia del juvenil y la cría, que presentan curvas más escarpadas con dominancia numérica en cuanto al tiempo de alimentación respecto de algunas especies (Figura 15; Anexo 9). La parte horizontal de las curvas (colas) representan especies con un ni=1, por lo que podrían ser especies con datos extremos, consumidas de modo ocasional y probablemente muestreadas al azar; tales como Dipteryx alata (almendrillo) en adultos, Clarisia biflora (chicle murure) y liana lechera (aún sin identificación) en la cría. Este último también se registró en el individuo juvenil (Figura 15; Anexo 9). Las especies en las que los adultos invirtieron un tiempo mayor de alimentación fueron Tabebuia sp.1 (tajibo, 10%) Attalea phalerata (motacú, 8.82%) Acrocomia aculeata (totai, 8.73%) Ficus pertusa (matapalo, 7.96%) a diferencia del individuo juvenil y la cría que utilizaron las mismas especies en proporciones similares, siendo éstas: Acrocomia aculeata (totai, 13.56%; 12.36%) Liana espinas pares (aún sin identificación, 10.84%; 12.16%) Ocotea cernua (laurel, 10.84%; 12.29%) (Figura 15; Anexo 9). 49 -0.5 -1.0 Abundancia de especies -1.5 -2.0 Totaí Totaí / Laurel / Liana espinas pares Tajibo Liana espinas pares/ Lurel Tajibo Motacú / Totaí Motacú Tutumilla Matapalo Liana de flor lila/ Tajibo Liana de flor lila Liana espinas pares / Laurel Tajibo Liana vaina larga / Bi Tutumilla Pacay / Liana codo Pacay / Chaquillo / Tutumilla Pacay / Liana codo Mango Liana codo Mango Falso aliso / Amabaibo Ambaibo/ Árbol de resina roja Uvilla Pata de michi / Granadilla Uvilla Ambaibo/ Árbol resina roja Liana flor lila/ Bibosi Piraquina xilopia Uvilla/ Trompillo/ Mango Piraquina xilopia/ Tusequi Tusequi/ Piraquina xilopia Chaquillo Alcornoque Biribá/ Pata de michi/ Pacy peludo -2.5 -3.0 -3.5 Liana lechera Liana lechera Chicle mururé Almendrillo -4.0 Especies vegetales ordenadas segun el consumo Figura 15. Curvas rango abundancia de las especies consumidas por el promedio de adultos, juveniles y crías de ambos grupos (adultos en azul, juvenil en rojo, cría en verde) de Callicebus modestus a lo largo del periodo de estudio. Las especies utilizadas por ambos sexos se describen de forma descendente en el Anexo 9. 50 6.4 Variación mensual de la Dieta de Callicebus modestus 6.4.1 Variación mensual en el consumo de especies como fuente de alimento De manera general, el consumo de especies vegetales fue variando a lo largo de los meses; tal y como se muestra en la tabla 6, donde las especies más utilizadas fueron: Abril: Guettarda viburnoides (pata de michi, 16.3%) Cardiopetalum calophyllum (piraquina xilopia, 15.48%) Ocotea cernua (laurel, 11.41%) Attalea phalerata (motacú, 10.05%) Tabebuia aurea (alcornoque, 8.14%) y Liana patito (aún sin identificación, 7.33%). Mayo: Attalea phalerata (motacú, 27.36%) Liana de flor lila (aún sin identificación, 19.53%) Guettarda viburnoides (pata de michi, 8.64%) liana codo (aún sin identificación, 8.31%) y Ocotea cernua (laurel, 7.29%). Junio: Attalea phalerata (motacú, 28.93%) Ficus pertusa (matapalo, 20.45%) liana codo (aún sin identificación, 11.45%) y Liana de flor lila (aún sin identificación, 10.40%) e Inga sp. (pacay, 7.36%). Agosto: Tabebuia sp.1 (tajibo, 22.59%) Arrabidaea sp.3 (liana vaina larga, 16.07%) Magnifera indica (mango, 9.60%) y Ocotea cernua (laurel, 6.07%). Septiembre: Ocotea cernua (laurel, 22.54%) Tabebuia sp.1 (tajibo, 22.49%) Cupania cinérea (trompillo, 13.98%) y Curatella americana (chaquillo, 6.29%). Octubre: Coussarea hydrangeaefolia (tutumilla, 27.22%) Liana espinas pares (aún sin identificación, 14.08%) e Inga sp. (pacay, 10.52%). Noviembre: Liana espinas pares (aún sin identificación, 26.80%) Acrocomia aculeata (totai, 18.24%) Attalea phalerata (motacú, 7.44%) Ficus pertusa (matapalo, 6.38%) y Machaerium pilosum (tusequi, 6.10%). Diciembre: Acrocomia aculeata (totai, 41.04%) Genipa americana (bi, 9.64%) Cecropia concolor (ambaibo, 9.24%) Mysine umbellata (falso aliso, 7.38%) y Ficus pertusa (matapalo, 6.52%) 51 Tabla 6. Variación mensual del porcentaje de tiempo invertido por Callicebus modestus en el consumo de especies vegetales, durante el periodo de estudio en la Estancia San Miguel (las casillas subrayadas corresponden a las especies con mayor porcentaje de tiempo de alimentación en el mes). % de Alimentación mensual Familia Especies Nombre Vernacular Abr May Jun Anacardiaceae Astronium fraxinifolium cuta 1.132 0.976 Anacardiaceae Mangifera indica mango 0 Annonaceae Annona montana biribá 0 Annonaceae Cardiopetalum calophyllum Annonaceae Ago Sep Oct 0 0.392 1.026 0 0 9.602 0 0 0 piraquina xilopia 15.48 6.643 0.643 Annona vel sp. Nov. rupresia limoncillo 2.445 1.533 Arecaceae (Palmae) Attalea phalerata motacu 10.05 27.36 Arecaceae (Palmae) Acrocomia aculeata totai Bignoniaceae Tabebuia aurea Bignoniaceae Nov Dic 0.364 0.2181 0.1792 1.165 0 0.6544 0.5376 0 3.057 3.1357 0.9319 0.056 0 1.092 0.2727 1.0036 0 0 0 2.22 0 0 28.93 0 1.981 0 7.4438 1.9355 0 0 0.058 2.744 2.098 3.166 18.241 41.039 alcornoque 8.148 0 0.234 2.072 0.676 0 0.0545 0 Arrabidaea sp.1 Liana Canuto 0.543 0.046 0.468 2.436 0.28 0.036 0 0 Bignoniaceae Arrabidaea sp.3 liana vaina larga 0 0 0 16.07 0.35 0.4 0 2.3297 Bignoniaceae Tabebuia spp. Palo Cacha 0 0 0 0 0.653 0 0 0 Bignoniaceae Tabebuia sp.1 tajibo 5.432 0.372 1.227 22.59 22.49 4.294 1.4179 0.0717 Cecropiaceae Cecropia concolor ambaibo 0 0 0.409 0.392 0.559 2.838 2.5403 9.2473 Cochlospermaceae Cochlospermum vitifolium algodoncillo 0 0 0 0 0 0.801 0 0 Dilleniaceae Curatella americana chaquillo 0 1.161 1.753 3.415 6.297 1.71 0.3545 0.7527 Dilleniaceae Doliocarpus dentatus Liana Chaquillo 3.531 0.743 2.279 0 0.023 0.437 0 0 Euphorbiaceae Aporosella cf. chacoensis Liana amarilla 0 0 0.292 0.112 0.256 0.255 0.3817 0 Euphorbiaceae Fabaceae (Leg.Minos.) Fabaceae (Leg.Minos.) Pera benensis piraquina negra 0 0 2.572 0 1.002 4.039 0 0 Inga sp. Pacay 0 0.65 7.364 3.555 2.424 10.52 3.79 2.9391 Inga sp. 1 pacay peludo 0 0 0 0 0 0.655 1.5815 0 Fabaceae (Leg.Pap.) Dipteryx alata almendrillo 0 0 0 0 0.047 0 0 0 Fabaceae (Leg.Pap.) Swartzia jorori jorori 0 0 0 0.112 0 0 2.2359 0.0717 Fabaceae (Leg.Pap.) Dalbergia cf. foliosa Tamarindillo 0 1.347 0.759 0.448 1.095 0.109 0.0545 0 Fabaceae (Leg.Pap.) Machaerium pilosum Tusequi 0 0 0 0 0 0.801 6.1077 0.9677 1.086 0.046 0 0 0 0 0.1636 1.1828 Flacourtiaceae Casearia aculeata palo puja Flacourtiaceae Casearia gossypiosperma proquia limoncillo 0 0 0 0.056 0 0.582 0.0545 0 Hippocrataceae Salacia cordata guapomo 0 0 0 0 0.023 0 0.2454 0.1075 Indeterminada Indeterminada aceitunilla 0 0 0 0 0 0.364 0.0273 0 Indeterminada Indeterminada arbol de resina roja 0 0 0 5.739 0.653 0.291 0 0 Indeterminada Indeterminada bejuco simbao 0 0 0 0.84 0 0 0.1909 0.3584 Indeterminada Indeterminada caripe 0 0 0.058 0.056 1.002 0 0 0 Indeterminada Indeterminada Granadilla 0 0.093 0.175 0.616 0 0.218 1.9905 5.233 Indeterminada Indeterminada liana cable 0 0 0 0.056 0 0 0.1363 0.5376 Indeterminada Indeterminada liana codo 0 8.316 11.45 3.863 1.655 0 0.4908 0 Indeterminada Indeterminada liana coladora 0 0 0 0 0.746 0 0 0 Indeterminada Indeterminada Liana de flor lila 5.976 19.53 10.40 4.255 3.03 0.728 0.2454 0 Indeterminada Indeterminada liana de hojita larga 0 0 0 0 0 0 0 0 Indeterminada Indeterminada liana espinas pares 0 0 0 1.624 5.598 14.08 26.803 0.0717 Indeterminada Indeterminada liana lechera 0 0 0 0.112 0 0.655 0 0 Indeterminada Indeterminada Liana patito 7.334 0 1.461 1.54 0.093 0 0 0.0717 Indeterminada Indeterminada liana piper 0 0 0 0.728 0.023 0 0 0 Indeterminada Indeterminada n/n 2.716 1.719 0 0 0 0 0 0 Indeterminada Indeterminada no det =335 maramacho 0 0 0 0 0 0.582 0.0818 0 Indeterminada Indeterminada palo corcho 0 0 0 0.896 0 0 0 0 Indeterminada Indeterminada paquiocillo 0 0 0 1.204 0 0 0 0 Indeterminada Indeterminada Solda Solda 0 Indeterminada Indeterminada uña de gato Indeterminada Indeterminada Lauraceae 0 1.578 0.476 0.023 0.328 0.1091 0.1075 1.63 3.949 1.052 0 0 0 0 0 uvilla 0.543 0.093 0 0 0 2.329 4.9625 4.4086 Ocotea cernua laurel 11.41 7.294 0.584 6.075 22.54 2.62 1.2906 0.3584 Lauraceae Persea caerulea Maramacho 0 0 0.993 0 0.047 0 0 0 Moraceae Ficus sp.1 Bibosi 0 0 0.935 0.168 2.284 2.183 1.5815 0.1434 Moraceae Clarisia biflora chicle murure 0 0 0 1.4 0.023 1.164 0 0 Moraceae Ficus pertusa Matapalo 2.173 0.147 20.45 0.7 2.195 5.24 6.3804 6.5233 Moraceae Maclura tinctoria mora 0 1.161 0 0.56 0 0 0 0 Myrsinaceae Myrsine umbellata falso aliso 0 0.139 0 1.484 0.28 0.837 2.3449 7.3835 Opiliaceae Agonandra peruviana panejaja II 0 0 0 0 0 0.328 0 0 Rubiaceae Genipa americana bi 0 7.851 0 0 0 3.166 2.3995 9.6416 Rubiaceae Guettarda viburnoides Pata de michi 16.3 8.641 1.168 0.98 0.466 0 0 0 Rubiaceae Coussarea hydrangeaefolia tutumilla 0 0 0 0 1.748 27.22 1.7723 1.8638 Sapindaceae Cupania cinerea trompillo 0 0 2.688 2.436 13.98 0 0 0 Smilacaceae Smilax sp.1 liana cacho de gallo 4.074 0.186 0 0.14 0.326 0.291 0.2454 0 Verbenaceae Vitex cymosa Taruma 0 0 0.839 0 0 0 0 0 52 6.4.2 Variación mensual en el consumo de partes animales y vegetales La variación mensual en el tiempo de alimentación invertido por Callicebus modestus (Anexo 4) muestra la marcada estacionalidad en el uso de las partes vegetales, donde el uso de frutos maduros presenta un pico en el mes de mayo y una caída en el consumo durante los meses de junio hasta agosto, mes a partir del cual el consumo va en aumento constante, hasta llegar a su pico máximo en el mes de diciembre. Los frutos secos / semillas muestran dos picos de alimentación, uno en el mes de agosto y el otro en noviembre (Figura 16). El consumo de flores maduras, presenta dos picos de alimentación: uno en el mes de agosto, que coincide con el consumo de frutos secos y el otro en septiembre. El consumo de guías de tallo/ lianas y de hojas muestra un movimiento similar durante el periodo de estudio, con un número mayor de horas de alimentación en el mes de septiembre; a diferencia del consumo de hojas tiernas / rebrotes, donde el uso es mínimo pero constante a los largo de los meses, con caídas en los meses de abril, mayo y octubre (Figura 16). Las partes vegetales restantes, es decir el botón floral, hojas amarillas y frutos verdes, no presentan mucha variación a lo largo del periodo de estudio; menos aún, picos de alimentación (Figura 16) puesto que su consumo fue mínimo. En cuanto al consumo de artrópodos, el consumo de gusanos se mantiene nulo hasta el mes de septiembre, a partir del cual va en constante aumento hasta el mes de diciembre donde se encuentra el máximo pico de alimentación (Figura 16). 53 100 90 % de Tiempo de Alimentación 80 70 60 50 40 30 20 10 0 Abr May Jun Ago Sep Oct Nov Dic Variación mensual Figura 16. Estacionalidad en el uso de partes vegetales (ítems alimenticios) por Callicebus modestus durante el periodo de estudio en la Estancia San Miguel. hoja, maduro, guía de tallo/liana, fruto seco /semilla, botón floral, flor madura, Hoja tierna/rebrote, fruto verde, fruto artrópodos El consumo de termitas se realizó solo durante los meses de octubre a diciembre, exhibiendo un pico máximo en el mes de noviembre. La inclusión de hormigas en la dieta tuvo un aumento constante a partir del mes de junio, hasta llegar al pico más alto de consumo en el mes de octubre, para volver a descender nuevamente en el mes de diciembre (Figura 16). 54 El consumo de las demás partes de insectos, tales como arañas, saltamontes y mariposas, fue mínimo; mostrando poca o nula variación a lo largo de los meses; los insectos no identificados debido a la falta de visibilidad o rapidez en la ingesta, muestran cierta variación, con un aumento en el uso entre los meses de septiembre y diciembre y un pico máximo en octubre (Figura 16). 6.4.3 Variación mensual de la dieta entre grupos La diversidad media de la dieta mensual del Grupo “Corral” fue C inv=6.01 (± 2.93 DE) con un valor más bajo registrado en el mes de junio (C inv= 2.99) en contraste con el más alto, que se dio en el mes de octubre (C inv= 11.28). Similar diversidad media fue observada en el grupo “Maramacho”: C inv=4.65 (±1.99 DE) con un valor más bajo (Cinv=2.06) en el mes de diciembre y un valor mayor (Cinv= 8.15) en Abril (Figura 17, 18). El índice de similitud de Sorensen (Iss) en el uso de especies como fuente de alimento dentro del grupo “Corral”, tuvo una variación mensual media de Iss=0.61 (± 0.09DE) con una variación de 0.67 entre agosto-septiembre, 0.60 entre septiembre-octubre y 0.77 entre octubre-noviembre (Figura 17). En el grupo “Maramacho”, la variación mensual media fue de Iss=0.67 (± 0.09DE) con una variación de 0.56 entre junio-agosto, de 0.68 entre agostoseptiembre, de 0.52 entre septiembre-octubre y de 0.75 entre noviembrediciembre (Figura 18). 55 0.85 12 0.80 10 8 0.70 0.65 6 Similitud de Sorensen Diversidad Inv- Simpson 0.75 0.60 4 0.55 0.50 2 abr may jun ago sep oct nov dic Figura 17. Diversidad dietética mensual (Inversa de Simpson en azul) y sobreposición dietética (Índice de Sorensen en rosado) a nivel de especie entre los meses adyacentes, del grupo “Corral”. 0.80 9 8 0.75 7 Diversidad inv- Simpson 0.65 5 4 Similitud de Sorensen 0.70 6 0.60 3 0.55 2 0.55 1 abr may jun ago sep oct nov dic Figura 18. Diversidad dietética mensual (Inversa de Simpson en azul) y sobreposición dietética (Índice de Sorensen en rosado) a nivel de especie entre los meses adyacentes, del grupo “Maramacho” 56 6.4.3.1 Variación mensual de especies vegetales consumidas como fuente de alimento en ambos grupos de estudio El consumo mensual por ambos grupos de Callicebus modestus (“Corral” y “Maramacho”) de las especies vegetales, fue variando de mes a mes, mostrando solo variaciones significativas en cuanto al número y porcentajes de especies consumidas en los meses de abril y mayo (pairwise t-test) no así en los demás meses del periodo de estudio (Tabla 7). Tabla 7. Variación mensual del % de tiempo invertido en el consumo de especies vegetales dentro de la dieta de ambos grupos de Callicebus modestus, pairwise t-test (Grupo 1 = “Corral”; Grupo 2 = “Maramacho”). “Corral” vs t-value “Maramacho”. -2.358 Abril Mayo -2.438 -0.574 Junio N N Grupo 1 Grupo 2 DE Grupo 1 DE Grupo 2 df p 16 24 28 0.031 0.022 0.570 6 15 14 12 317.642 1154.93 11 3221.186 10863.38 16 5446.243 6610.14 F-ratio p Variances Variances 13.220 11.374 1.473 0.010 0.000 0.489 Agosto -0.764 44 0.449 23 23 7483.655 7932.43 1.124 0.787 Septiembre -1.221 43 0.228 30 15 7886.557 15038.36 3.636 0.003 Octubre -1.835 43 0.073 26 19 2288.923 10905.45 22.700 0.000 Noviembre -1.963 44 0.056 28 18 3831.826 13995.89 13.341 0.000 Diciembre -0.500 32 0.620 20 14 4989.468 14891.40 8.908 0.000 En cuanto a las especies más consumidas a lo largo del periodo de estudio, éstas se describen en la tabla 8, 9; resultando las más representativas de acuerdo a los meses del año: Abril: Smilax sp.1 (liana cacho de gallo, 32.49%) Doliocarpus dentatus (liana chaquillo, 28.16%) Ficus pertusa (matapalo, 17.33%) Astonium fraxinifolium (cuta, 9.02%) Caseraria aculeata (palo puja) para el grupo “Corral”. Mientras 57 que para el grupo “Maramacho” fueron: Guettarda viburnoides (pata de michi, 18.63%) Cardiopetalum calophyllum (piraquina xilopia, 17.70%) Ocotea cernua (laurel, 13.04%) Attalea phalerata (motacú, 11.49%) Tabebuia aurea (alcornoque, 9.31%) y Liana patito (aún sin identificación, 8.38%). Mayo: Genipa americana (bi, 35.12%) Guettarda viburnoides (para de michi, 32.01%) Dalbergia cf. foliosa (tamarindillo, 6.02%) y Attalea phalerata (motacú, 5.40%) para el grupo “Corral”. Para el grupo “Maramacho” fueron: Attalea phalerata (motacú, 33.68%) Liana de flor lila (aún sin identificación, 25.15%) Liana codo (aún sin identificación, 10.71%) Ocotea cernua (laurel, 9.39%) y Cardiopetalum calophyllum (piraquina xilopia, 8.55%). Junio: Ficus pertusa (matapalo, 54.77%) Attalea phalerata (motacú, 13.92%) Cupania cinérea (trompillo, 7.19%) y Doliocarpus dentatus (liana chaquillo, 6.10%) para el grupo “Corral”. Para el grupo “Maramacho” fueron: Attalea phalerata (motacú, 37.87%) Liana codo (aún sin identificación, 18.28%) Liana de flor lila (aún sin identificación, 16.6%) y Inga sp.1 (pacay 11.47%). Agosto: Tabebuia sp.1 (tajibo, 17.96%) Curatella americana (chaquillo, 7.43%) Arrabidaea sp.1 (liana canuto, 5.98%) y Cupania cinerea (trompillo, 5.98%) para el grupo “Corral”. Para el grupo “Maramacho” fueron: Tabebuia sp.1 (tajibo, 25.76%) Mangifera indica (mango, 16.18%) Ocotea cernua (laurel, 10.24%) y Árbol de resina roja (aún sin identificación, 9.67%). Septiembre: Cupania cinerea (trompillo, 27.7%) Tabebuia sp.1 (tajibo, 19.2%) y Liana espinas pares (aún sin identificación, 9.32%) para el grupo “Corral”. Para el grupo “Maramacho” fueron: Ocotea cernua (laurel, 42.92%) Tabebuia sp.1 (tajibo, 25.84%) y Liana de flor lila (aún sin identificación, 6.12%). 58 Octubre: Ficus pertusa (matapalo, 16.92%) Pera benensis (piraquina negra, 13.04%) Tabebuia sp.1 (tajibo, 11.75%) Genipa americana (bi, 10.22%) Ocotea cernua (laurel, 7.99%) y Ficus sp.1 (bibosi, 7.05%) para el grupo “Corral”. Coussarea hydrangeaefolia (tutumilla, 39.4%) e Inga sp.1 (pacay, 13.8%) para el grupo “Maramacho”. Noviembre: Ficus pertusa (matapalo, 18.94%) Acrocomia aculeata (totaí, 17.81%) Attalea phalerata (motacú, 12.14%) Cecropia concolor (ambaibo, 7.51%) y Genipa americana (bi, 7.12%) para el grupo “Corral”. Liana espinas pares (aún sin identificación, 39.84%) Acrocomia aculeata (totaí, 18.46%) Machaerium pilosum (tusequi, 7.44%) y Uvilla (aún sin identificación, 7.27%) para el grupo “Maramacho”. Diciembre: Genipa americana (bi, 19.27%) Myrsine umbellata (falso aliso, 14.76%) Acrocomia aculeata (totaí, 14.18%) Ficus pertusa (matapalo, 13.04%%) y Granadilla (aún sin identificación, 10.46%) para el grupo “Corral”. Acrocomia aculeata (totaí, 67.9%) y Cecropia concolor (ambaibo, 12.9%) para el grupo “Maramacho”. 59 Tabla 8. Variación mensual de las especies vegetales utilizadas dentro de la dieta del grupo “Corral”, durante el periodo de estudio en la Estancia San Miguel % de Tiempo - Grupo “Corral” Especies Nombre Vernacular Astronium fraxinifolium cuta Annona montana Abr May Jun Ago Sep Oct Nov Dic 9.025 4.364 0 0.964 2.03 1.175 0.648 0.358 biribá 0 0 0 0 0 3.878 4.128 1.289 Annona vel sp. Nov. rupresia limoncillo 0 0 0 0 0 2.585 0 0 Attalea phalerata motacu 0 5.404 13.92 0 3.92 0 12.14 3.868 Acrocomia aculeata totai 0 0 0 0 0 0 17.81 14.18 Tabebuia aurea alcornoque 0 0 0 1.032 1.34 0 0.162 0 Arrabidaea sp.1 Liana Canuto 4.332 0.208 1.252 5.988 0.55 0.118 0 0 Arrabidaea sp.3 liana vaina larga 0 0 0 39.5 0.69 1.293 0 4.656 Tabebuia spp. Palo Cacha 0 0 0 0 1.29 0 0 0 Tabebuia sp.1 tajibo 0 0 0 17.96 19.2 11.75 0.243 0.143 Cecropia concolor ambaibo 0 0 0 0.964 1.11 1.293 7.541 5.587 Curatella americana chaquillo 0 5.196 4.695 7.433 9 1.293 1.052 1.504 Doliocarpus dentatus Liana Chaquillo 28.16 3.325 6.103 0 0.05 0 0 0 Aporosella cf. chacoensis Liana amarilla 0 0 0.783 0.275 0.51 0.823 1.133 0 Pera benensis piraquina negra 0 0 0.47 0 1.98 13.04 0 0 Inga sp. Pacay 0 0 0.47 1.101 4.57 3.173 2.59 3.367 Dipteryx alata almendrillo 0 0 0 0 0.09 0 0 0 Swartzia jorori jorori 0 0 0 0 0 0 0.809 0 Dalbergia cf. foliosa Tamarindillo 0 6.027 2.034 1.101 2.17 0.353 0.162 0 Machaerium pilosum Tusequi 0 0 0 0 0 2.585 3.48 0.645 Casearia aculeata palo puja 8.664 0.208 0 0 0 0 0 0 Casearia gossypiosperma proquia limoncillo 0 0 0 0.138 0 1.88 0.162 0 Salacia cordata guapomo 0 0 0 0 0.05 0 0.728 0.215 Indeterminada aceitunilla 0 0 0 0 0 1.175 0.081 0 Indeterminada Granadilla 0 0.416 0.47 1.514 0 0.705 5.909 10.46 Indeterminada liana cable 0 0 0 0 0 0 0.405 1.074 Indeterminada liana coladora 0 0 0 0 1.48 0 0 0 Indeterminada Liana de flor lila 0 0 0 0.619 0 0 0 0 Indeterminada liana espinas pares 0 0 0 3.441 9.32 3.055 1.133 0 Indeterminada Liana patito 0 0 0 0 0.18 0 0 0 Indeterminada liana piper 0 0 0 1.789 0.05 0 0 0 Indeterminada no det =335 maramacho 0 0 0 0 0 1.88 0.243 0 Indeterminada Solda Solda 0 0 4.225 0.619 0.05 1.058 0.324 0.215 Indeterminada uvilla 0 0.416 0 0 0 0 0.405 4.37 Ocotea cernua laurel 0 0 0 0 2.58 7.991 0.27 0.716 Persea caerulea Maramacho 0 0 0 0 0.09 0 0 0 Ficus sp.1 Bibosi 0 0 2.504 0.413 3.23 7.051 4.694 0.287 Clarisia biflora chicle murure 0 0 0 3.441 0.05 0 0 0 Ficus pertusa Matapalo 17.33 0.658 54.77 1.721 4.34 16.92 18.94 13.04 Maclura tinctoria mora 0 5.196 0 1.376 0 0 0 0 Myrsine umbellata falso aliso 0 0.623 0 0 0.09 2.703 6.961 14.76 Agonandra peruviana panejaja II 0 0 0 0 0 1.058 0 0 Genipa americana bi 0 35.12 0 0 0 10.22 7.123 19.27 Guettarda viburnoides Pata de michi 0 32.01 1.096 2.271 0 0 0 0 Cupania cinerea trompillo 0 0 7.199 5.988 27.7 0 0 0 Smilax sp.1 liana cacho de gallo 32.49 0.831 0 0.344 0.65 0.94 0.728 0 60 Tabla 9. Variación mensual de las especies vegetales utilizadas dentro de la dieta del grupo “Maramacho”, durante el periodo de estudio en la Estancia San Miguel % de Tiempo - Grupo “Maramacho” Especies Nombre Vernacular Abr May Jun Ago Sep Oct Nov Dic Mangifera indica mango 0 0 0 16.187 2.356 0 0.987 1.08 Annona montana biribá 0 0 0 0 0 2.69 2.632 0.57 Cardiopetalum calophyllum piraquina xilopia 17.702 8.556 1.026 0.0944 0 1.58 0.411 2.01 Annona vel sp. Nov. rupresia limoncillo 2.795 1.9745 0 0 0 2.06 0 0 Attalea phalerata motacu 11.491 33.686 37.87 0 0 0 5.058 0 Acrocomia aculeata totai 0 0 0.093 4.6248 4.241 4.59 18.46 67.9 Tabebuia aurea alcornoque 9.3168 0 0.373 2.7843 0 0 0 0 Tabebuia sp.1 tajibo 6.2112 0.4787 1.959 25.767 25.84 0.95 2.015 0 Cecropia concolor ambaibo 0 0 0.653 0 0 3.53 0 12.9 Cochlospermum vitifolium algodoncillo 0 0 0 0 0 1.16 0 0 Curatella americana chaquillo 0 0 0 0.6607 3.534 1.9 0 0 Doliocarpus dentatus Liana Chaquillo 0 0 0 0 0 0.63 0 0 Pera benensis piraquina negra 0 0 3.825 0 0 0 0 0 Inga sp. Pacay 0 0.8377 11.47 5.2383 0.236 13.8 4.4 2.51 Inga sp. 1 pacay peludo 0 0 0 0 0 0.95 2.385 0 Swartzia jorori jorori 0 0 0 0.1888 0 0 2.961 0.14 Machaerium pilosum Tusequi 0 0 0 0 0 0 7.442 1.29 Casearia aculeata palo puja 0 0 0 0 0 0 0.247 2.37 Indeterminada arbol de resina roja 0 0 0 9.6744 1.319 0.42 0 0 Indeterminada bejuco simbao 0 0 0 1.4158 0 0 0.288 0.72 Indeterminada caripe 0 0 0.093 0.0944 2.026 0 0 0 Indeterminada Granadilla 0 0 0 0 0 0 0 0 Indeterminada liana cable 0 0 0 0.0944 0 0 0 0 Indeterminada liana codo 0 10.71 18.28 6.5125 3.345 0 0.74 0 Indeterminada liana coladora 0 0 0 0 0 0 0 0 Indeterminada Liana de flor lila 6.8323 25.15 16.6 6.7485 6.125 1.05 0.37 0 Indeterminada liana espinas pares 0 0 0 0.3775 1.79 19 39.84 0.14 Indeterminada liana lechera 0 0 0 0.1888 0 0.95 0 0 Indeterminada Liana patito 8.3851 0 2.332 2.5956 0 0 0 0.14 Indeterminada liana piper 0 0 0 0 0 0 0 0 Indeterminada n/n 3.1056 2.2138 0 0 0 0 0 0 Indeterminada palo corcho 0 0 0 1.5101 0 0 0 0 Indeterminada paquiocillo 0 0 0 2.0293 0 0 0 0 Indeterminada Solda Solda 0 0 0 0.3775 0 0 0 0 Indeterminada uña de gato 1.8634 5.0858 1.679 0 0 0 0 0 Indeterminada uvilla 0.6211 0 0 0 0 3.37 7.278 4.45 Ocotea cernua laurel 13.043 9.3937 0.933 10.241 42.92 0.21 1.809 0 Persea caerulea Maramacho 0 0 1.586 0 0 0 0 0 Ficus sp.1 Bibosi 0 0 0 0 1.319 0 0 0 Clarisia biflora chicle murure 0 0 0 0 0 1.69 0 0 Myrsine umbellata falso aliso 0 0 0 2.5012 0.471 0 0 0 Guettarda viburnoides Pata de michi 18.634 1.9146 1.213 0.0944 0.942 0 0 0 Coussarea hydrangeaefolia tutumilla 0 0 0 0 3.534 39.4 2.673 3.73 61 6.4.3.2 Variación mensual en el consumo de partes animales y vegetales en ambos grupos de estudio A lo largo del periodo de estudio, tanto el grupo “Corral” como el grupo “Maramacho” mostraron variaciones mensuales en el consumo de las diferentes partes animales y vegetales, siendo estas no significativas (Pairwise t-test, Tabla 10). Tabla 10. Variación mensual del % de tiempo de alimentación de las partes animales y vegetales, pairwise t-test (Grupo 1 = “Corral”; Grupo 2 = “Maramacho”). “Corral” vs. “Maramacho” Abril DE DE Grupo 1 Grupo 2 9 25.852 19.398 N F-ratio p Variances Variances 1.776 0.434 Mayo 9 27.244 22.187 1.508 0.575 Junio 9 21.943 18.622 1.388 0.654 Agosto 9 13.811 14.039 1.033 0.964 Septiembre 9 11.306 17.239 2.325 0.254 Octubre 9 16.181 26.156 2.613 0.196 Noviembre 9 21.608 19.873 1.182 0.819 Diciembre 9 22.929 20.769 1.219 0.786 La principal fuente de alimento para los dos grupos fueron los frutos maduros, con una variación para el grupo “Corral” desde 83.04% en el mes de mayo, 29.9% en septiembre, hasta 70.39% en diciembre (Figura 19) y para el grupo “Maramacho”, desde 54.85% en el mes de abril, 36.22% en agosto hasta un 80.65% en octubre (Figura 20). El porcentaje mensual invertido en el consumo de frutos maduros, se asoció negativamente con la diversidad dietética mensual, además de no ser significativa en ambos grupos, con una correlación modesta en el grupo “Corral” (r s= - 0.54, p= 0.16, n= 8) y débil para el grupo “Maramacho” (rs= - 0.26, p= 0.53, n= 8). 62 En el caso de las flores maduras, el consumo dentro del grupo “Corral” varió desde 11.44% en el mes de mayo, 29.8% en septiembre hasta 1.82% en octubre (Figura 19). En el grupo “Maramacho” el consumo tuvo una variación desde 6.8% en el mes de abril, 45.05% en mayo, hasta 2.36% en diciembre (Figura 20). La asociación entre el porcentaje mensual de tiempo invertido en el consumo de flores maduras y la diversidad dietética mensual, no fueron significativas en ambos grupos, además de ser negativas y débiles (rs= - 0.28, p= 0.49, n= 8; rs= - 0.21, p= 0.60, n= 8). En el consumo de frutos secos / semillas, el grupo “Maramacho” presenta variaciones desde agosto con 14.45%, septiembre con 0.4%, noviembre con 7.11% hasta diciembre con 0.24% (Figura 20). De manera similar, el grupo “Corral” mostró una variación desde el mes de agosto con 12.23% hasta noviembre con 1.83% (Figura 19). La asociación entre la diversidad dietética mensual y el porcentaje mensual de tiempo invertido en el consumo de frutos secos / semillas, fue positiva pero no así significativa, con una correlación modesta para el grupo “Corral” (r s= 0.55, p= 0.15, n= 8) y muy débil para el grupo “Maramacho” (r s= 0.02, p= 0.95, n= 8). En cuanto al consumo de hojas tiernas / rebrotes y hojas maduras, el grupo “Corral” mostró mayor afinidad por estos ítems con una variación mensual desde 9.71% y 3.19% respectivamente, en el mes de junio, 1.74% en octubre para hojas tiernas / rebrotes y 11.42% en septiembre para hojas maduras, hasta 7.97% y 1.07% respectivamente en diciembre (Figura 19). El grupo “Maramacho” consumió hojas tiernas / rebrotes solo los meses de junio (0.29%) y septiembre (2.93%) y hojas madur durante los meses de junio (1.18%) hasta octubre (3.33%) con un pico en el mes de septiembre con 9.89% (Figura 20). 63 100 90 80 % de Tiempo de Alimentación 70 60 50 40 30 20 10 0 Abr May J un Ago Sep Oc t N ov D ic V ari ac i ón mens ual Figura 19. Variación mensual en el tiempo de alimentación de partes vegetales y animales utilizadas por adultos del grupo “Corral”. hoja, guía de tallo/liana, botón floral, flor madura, fruto verde, fruto maduro, fruto seco /semilla, Hoja tierna/rebrote, artrópodos 100 90 80 % de Tiempo de Alimentación 70 60 50 40 30 20 10 0 Abr May J un Ago Sep Oc t N ov D ic V ari ac i ón mens ual Figura 20. Variación mensual en el tiempo de alimentación de partes vegetales y animales utilizadas por adulto del grupo “Maramacho”. tierna/rebrote, artrópodos hoja, guía de tallo/liana, botón floral, flor madura, fruto verde, fruto maduro, fruto seco /semilla, Hoja 64 La asociación entre el porcentaje mensual invertido en el consumo de hojas maduras y la diversidad dietética mensual no fue significativa, con una correlación débil tanto en el grupo “Corral” (rs= 0.16, p= 0.69, n= 8) como en el grupo “Maramacho” (rs= - 0.20, p= 0.62, n= 8). En cuanto a la asociación del porcentaje de tiempo de consumo de hojas tiernas / rebrotes con la diversidad dietética mensual, la correlación en ambos grupos tampoco fue significativa, además de muy débil y negativa (rs= - 0.14, p= 0.74, n= 8; rs= - 0.51, p= 0.19, n= 8). En el consumo de partes animales, el grupo “Corral” invirtió su tiempo principalmente en el consumo de gusanos / larvas con una variación mensual desde 22.13% en el mes de octubre, 8.87% en noviembre hasta 16.05% en diciembre. El consumo de hormigas presenta una variación desde 3.55% en el mes de mayo, 9.97% en octubre hasta 0.48% en diciembre. El consumo de insectos sin identificación, mostró una variación desde 1.18% en el mes de mayo, hasta 4.28% en octubre (Figura 19). El grupo “Maramacho” invirtió su tiempo en el consumo de gusanos / larvas con una variación desde 1.21% en el mes de octubre hasta 18.14% en diciembre. El consumo de hormigas con una variación desde 4.71% en el mes de junio, hasta 1.50% en noviembre; y en el consumo de termitas con alas, sólo en el mes de noviembre, con 5.75% (Figura 20). En cuanto a las correlaciones entre el porcentaje de tiempo de alimentación con partes animales y la diversidad dietética mensual, los gusanos / larvas presentan una correlación modesta y negativa, además de no ser significativa en el grupo “Maramacho” (rs= - 0.46, p= 0.24, n= 8) a diferencia del grupo “Corral” donde la correlación es significativa además de fuerte y positiva (r s= 0.84, p= 0.008, n= 8). El consumo de hormigas mostró correlaciones no significativas, modestas y positivas en ambos grupos (rs= 0.50, p= 0.20, n= 8; rs=0.40, p= 0.33, n= 8). 65 El consumo de insectos no identificados, mostró una correlación positiva y modesta dentro del grupo “Corral” (rs= 0.45, p= 0.25, n= 8) y el consumo de termitas con alas mostró una correlación muy débil pero positiva dentro del grupo “Maramacho” (rs= 0.08, p= 0.84, n= 8) ambas correlaciones no fueron significativas para los dos grupos 6.4.4 Variación mensual de la dieta entre sexos El uso mensual de partes animales y vegetales, mostró una variación similar en hembras (Figura 21) y machos (Figura 22) siendo el fruto maduro el ítem más consumido, con porcentajes que fluctúan entre 62.45% y 65.13% en el mes de mayo, 33.17% y 40.14% en septiembre, hasta 56.93% y 70.07% respectivamente en el mes de diciembre; dichas variaciones muestran un consumo relativamente mayor dentro del grupo de machos adultos, pero no así significativo (Prueba de Wilcoxon T= 8.00, p= 0.16, n= 8). El siguiente ítem en orden de importancia fue la flor madura, y al igual que los fruto maduros, no mostró variaciones significativas (Prueba de Wilcoxon T= 14.00, p= 0.57, n= 8) con consumos relativamente mayores para los machos, que fueron desde 33.12% y 33.24% en mayo, hasta 2.90% y 1.58% respectivamente, en el mes de diciembre. En el consumo de hojas tiernas / rebrotes, las hembras mostraron mayor afinidad que los machos, con variaciones mensuales, desde 5.81% y 6.97% en junio, 11.66% y 6.73% en agosto; hasta 14.17% y 3.35% respectivamente en el mes de diciembre. De manera inversa en el consumo de guías de tallo / liana, donde los machos invirtieron un tiempo mayor que las hembras, mostrando variaciones mensuales, desde 5.87% y 0.0% en junio, 8.01% y 6.30% 66 respectivamente en el mes de octubre. En ninguno de los casos, las variaciones entre hembras y machos fueron significativas (Prueba de Wilcoxon T= 8.00, p= 0.31, n= 8; T= 7.00, p= 0.46, n= 8) (Figura 21, 22). En cuanto al consumo de partes animales, los gusanos / larvas fueron los más consumidos, tanto por hembras como por machos; mostrando ligeras variaciones que no fueron significativas (Prueba de Wilcoxon T= 3.00, p= 1.00, n= 8) desde 13.47% y 21.30% en octubre, hasta 15.69% y 15.05% respectivamente, en el mes de diciembre. De manera similar, en el consumo de hormigas no se registraron variaciones significativas (Prueba de Wilcoxon T= 7.00, p= 0.12, n= 8) desde 3.39% y 1.36% en mayo, 8.79% y 1.94% en septiembre, hasta 3.62% y 8.53% respectivamente en el mes de diciembre (Figura 21, 22). 67 100 90 % de Tiempo de Alimentación 80 70 60 50 40 30 20 10 0 Abr May J un Ago Sep Oc t N ov D ic Var iación mensual Figura 21. Variación mensual en el tiempo de alimentación de partes vegetales y animales utilizadas por el Promedio de hembras adultas de Callicebus modestus. tierna/rebrote, hoja, guía de tallo/liana, botón floral, flor madura, fruto verde, fruto maduro, fruto seco /semilla, Hoja artrópodos 100 90 % de Tiempo de Alimentación 80 70 60 50 40 30 20 10 0 Abr May J un Ago Sep Oc t N ov D ic Variac ión m ens ual Figura 22. Variación mensual en el tiempo de alimentación de partes vegetales y animales utilizadas por el Promedio de machos adultos Callicebus modestus. tierna/rebrote, hoja, guía de tallo/liana, botón floral, flor madura, fruto verde, fruto maduro, fruto seco /semilla, artrópodos hoja 68 6.4.5 Variación mensual de la dieta entre edades El consumo de partes vegetales mostró ligeras variaciones entre las diferentes edades (adulto, Figura 23; juvenil, Figura 24; cría, Figura 25). Aunque el ítem con el mayor tiempo general de consumo fue el fruto maduro, éste no registró variaciones mensuales significativas (Prueba de FriedmanANOVA, x2= 2.25, n=8, gl=2, p=0.32) mostrando porcentajes diferentes entre los adultos, el juvenil y la cría que fueron desde 63.76%, 54.16% y 16.33 en abril, 36.62%, 57.12% y 65.58% en septiembre, 52.09%, 86.91% y 79.89% en octubre, hasta 62.34%, 64.68% y 62.36% respectivamente, en el mes de diciembre. Las variaciones observadas en el consumo de flores maduras entre adultos, juvenil y cría, no fueron significativas (Prueba de Friedman-ANOVA, x2= 2.25, n=8, gl=2, p=0.32) mostrando valores mayores para la cría, con variaciones a partir del mes de abril con 8.02%, 11.04% y 58.14%, el mes de mayo con 33.18%, 45.84% y 83.27%, hasta el mes de octubre con 1.96%, 2.85% y 1.90%, respectivamente. En el consumo de hojas maduras, al igual que las flores, la variación mensual entre edades no fue significativa (Prueba de Friedman-ANOVA, x2= 4.33, n=8, gl=2, p=0.11); aunque los adultos utilizaron dicho ítem a lo largo del periodo de estudio exceptuando el mes de abril, con fluctuaciones entre mayo (0.13%) septiembre (10.36%) y diciembre (1.30%). El individuo juvenil y la cría, consumieron este ítem sólo en los meses de agosto con 7.14% y 7.21%, septiembre con 8.90% y 13.54%, y octubre con 4.36% y 4.74% (Figuras 23, 24, 25). 69 En cuanto al consumo de hojas tiernas / rebrotes, se observaron variaciones mensuales significativas (Prueba de Friedman-ANOVA, x2= 10.64, n=8, gl=2, p=0.004) entre adultos, juvenil y cría, puesto que los adultos invierten un tiempo mayor que los anteriores, con una variación mensual desde 0.13% en mayo, 9.28% en agosto, 1.85% en octubre, hasta 9.71% en el mes de diciembre (Figura 23). La cría (Figura 25) solo consume hojas tiernas / rebrotes en el mes de abril (3.49%) y el mes de agosto (0.17%) mientras que el individuo juvenil se abstiene en el consumo de dicho ítem (Figura 24). En cuanto a la ingesta de partes animales, los gusanos / larvas fueron los más consumidos tanto por adultos como por el juvenil y la cría, mostrando variaciones mensuales no significativas entre las edades (Prueba de FriedmanANOVA, x2= 2.00, n=8, gl=2, p=0.36) desde 17.61%, 0.76% y 1.52% en octubre, 7.78%, 8.65% y 12.79% en noviembre, hasta 15.37%, 17.46% y 19.47% respectivamente en el mes de diciembre. El consumo de hormigas, mostró variaciones no significativas, al igual que los gusanos / larvas (Prueba de Friedman-ANOVA, x2= 0.83, n=8, gl=2, p=0.65) desde 2.39%, 0.0% y 0.41% en abril, 6.25%, 1.52% y 7.59% en octubre, hasta 0.29%, 3.77% y 1.53% respectivamente en el mes de diciembre (Figuras 23, 24, 25). 70 100 90 80 % de Tiempo de alimentación 70 60 50 40 30 20 10 0 Abr May Jun Ago Sep Oct Nov Dic Variación mensual Figura 23. Variación mensual en el tiempo de alimentación de partes vegetales y animales utilizadas por el Promedio de los adultos de Callicebus modestus. hoja, guía de tallo/liana, maduro, fruto seco /semilla, botón floral, Hoja tierna/rebrote, flor madura, fruto verde, fruto artrópodos 100 90 80 % de Tiempo de alimentación 70 60 50 40 30 20 10 0 Abr May Jun Ago Sep Oct Nov Dic Variación mensual Figura 24. Variación mensual en el tiempo de alimentación de partes vegetales y animales utilizadas por el individuo juvenil de Callicebus modestus. guía de tallo/liana, botón floral, fruto seco /semilla, artrópodos flor madura, hoja tierna/rebrote, fruto verde, hoja, fruto maduro, 71 100 90 80 % de Tiempo de alimentación 70 60 50 40 30 20 10 0 Abr May Jun Ago Sep Oct Nov Dic Variación mensual Figura 25. Variación mensual en el tiempo de alimentación de partes vegetales y animales utilizadas por la cría de Callicebus modestus. tallo/liana, /semilla, botón floral, flor madura, Hoja tierna/rebrote, fruto verde, hoja, fruto maduro, guía de fruto seco artrópodos 6.5 Patrón alimenticio Durante el periodo de estudio, ambos grupos de C. modestus, mostraron un patrón similar de alimentación, con picos de alimentación entre las 8 y 9 de la mañana para el grupo “Corral”, y entre las 8 y 11 de la mañana para el grupo “Maramacho”, estos picos descienden a medida que avanza el día principalmente entre las 12:00 y 14:00 horas, momento en el cual la temperatura es mayor. El comportamiento alimenticio se incrementa a medida que avanza la tarde, con picos mucho mayores entre las 16:00 y las 18:00 horas, momento en el cuál los individuos se preparan para dormir, pòr lo cual la actividad disminuye a partir de ese momento (Figura 26). 72 Figura 26. Patrón Alimenticio de ambos grupos de C. modestus (grupo “Corral”: en color rojo; grupo “Maramacho”: en color azul) 73 7. DISCUSION 7.1. Tiempo de observación Como ya se indicó, las variaciones mensuales en cuanto al tiempo de observación en ambos grupos, se basan principalmente en el grado de habituación de los individuos de cada grupo a la presencia de los investigadores (Rabinowitz, 2003) la presencia de tropas de monos silbadores (Cebus libidinosus) que asustaban a los grupos de Callicebus modestus, ocasionando la pérdida del rastro de los mismos, además del tamaño de cada grupo; puesto que al existir un número mayor de individuos dentro de uno de los grupos (“Maramacho”) la búsqueda y ubicación de sus miembros se hacía más fácil; de manera tal, que el grupo “Corral” presenta casi la mitad del tiempo de observación del grupo “Maramacho”. 7.2. Caracterización general de la dieta Los primates, al igual que otros animales, requieren de proteínas para el crecimiento, reproducción y renovación de los tejidos; carbohidratos y grasas para disponer de energía; y de otros elementos tales como vitaminas y nutrientes esenciales. Casi sin excepción, adquieren la mayor parte de su dieta diaria de elementos de las plantas, tales como hojas nuevas, hojas maduras, frutas maduras, semillas, resinas, néctares, flores, médula; ingiriendo sólo moderadas o pequeñas cantidades de materia animal, proveniente en su generalidad, de invertebrados (Milton, 1999). Los resultados del presente estudio muestran que la dieta de Callicebus modestus se basa principalmente en el consumo de partes vegetales (88.55%) y partes animales / artrópodos (11.45%) siendo las familias vegetales más representativas Arecaceae (Palmae) Bignoniaceae, Rubiaceae, Moraceae y 74 Lauraceae, muchos autores argumentan que la familia Moraceae es la más representativa dentro de la dieta del género Callicebus, puesto que presenta las especies más apetecibles; además de que soporta la mayor cantidad de especies frugívoras consumidoras, debido al volumen de la oferta anual de frutos que presentan las especies de estas familia, principalmente del género Ficus sp. (Kinzey, 1997; Wallace et al., 2000; Flores et al., 2002; Carrillo-Bilbao, 2005; Norconk, 2007). La mayor parte de las familias utilizadas como fuente de alimento también fueron descritas por López (2011) en la dieta de Callicebus olallae, mostrando una gran similitud dentro de la dieta de ambas especies, las cuales se encuentran estrechamente relacionadas (Martínez & Wallace, 2010). La diversidad de dieta vegetal obtenida para el grupo “Corral”, mostró un número similar al obtenido por el grupo “Maramacho”, por lo que se puede afirmar que el número de especies vegetales utilizadas como fuente de alimento, resulta muy similar entre ambos grupos. En cuanto al tiempo invertido en el consumo de especies vegetales, al igual que en la diversidad de dieta, existen ligeras variaciones entre ambos grupos; los resultados muestran que el grupo “Maramacho” invirtió un porcentaje de tiempo de alimentación ligeramente mayor (91.29%) que el grupo “Corral” (84.27%) con el consumo de especies similares en ambos grupos pero en diferente orden de importancia. Tales especies coinciden con lo señalado por varios autores, que indican que grupos de bibosis, pacayes y palmeras son reconocidos como recursos clave para frugívoros que habitan en los bosques tropicales de Bolivia y del Neotrópico (Terborgh, 1983; Painter, 1998; Pacheco & Simonetti, 1998; Wallace, 1998; Wallace et al., 2000; López, 2011). La diferencia porcentual en el consumo de especies vegetales, se ve compensada a través de la ingesta de partes animales, es decir de artrópodos; puesto que el grupo “Corral” invierte un porcentaje de tiempo de alimentación mayor que el grupo “Maramacho” (15.73% y 8.71% respectivamente) lo cual 75 podría deberse principalmente a la disponibilidad de alimento y a la distribución del mismo dentro del hábitat de cada uno de los grupos; además del estado fenológico de las plantas (Freeland & Janzen 1974; Milton, 1980; Solanki et al., 2008). Otra razón por la cual existe tal diferencia en los porcentajes de tiempos de alimentación podría deberse a la diferencia de tiempos de observación de cada grupo, atribuible al tamaño de los grupos y al grado de habituación de los mismos. 7.3. Partes animales y vegetales consumidas por Callicebus modestus Los individuos del género Callicebus se alimentan principalmente de hojas y frutos (Emmons & Feer, 1999). Puesto que los monos titi son considerados frugívoro-folívoros (Martínez & Wallace, 2010) los resultados muestran que el componente principal dentro de la dieta de Callicebus modestus, es el fruto maduro, puesto que resulta la principal fuente de proteínas; seguido por las flores, que son un buen complemento en época de floración, frutos secos / semillas que presentan un alto valor de lípidos y proteínas (Ayres, 1986; Norconk et al., 2002; 2007; 2009 ) y hojas (Norconk, 2007) principalmente hojas jóvenes, ya que contienen un porcentaje más alto de proteína cruda (relación proteína – fibra) además de dar mantenimiento al ambiente interno del intestino anterior, donde se produce la digestión (Davies, 1984; Jolly, 1985; Waterman et al., 1988; Chapman et al., 2002; Wasserman & Chapman, 2003; Muñoz et al., 2005; Fashing et al., 2007). Otra fuente importante de proteínas, provino de presas animales que representaron el 11.45% del total del tiempo de alimentación, principalmente los gusanos / larvas de mariposa y hormigas, que al parecer resultan un complemento importante para cubrir necesidades proteicas dentro de la dieta; puesto que en otras especies del género, se ha descrito que llegan a representar hasta un 20% del total de la dieta (C. torcuatus; Kinsey 1978; 1981). 76 La dieta vegetal de ambos grupos de C. modestus (“Corral” y “Maramacho”) incluyó principalmente frutos maduros y flores, mostrando porcentajes ligeramente mayores dentro del grupo “Maramacho”. De manera contraria, en el consumo de partes animales, el grupo “Corral” fue el que invirtió un tiempo ligeramente mayor, principalmente en el consumo de gusanos y hormigas; lo cual podría indicar el reemplazo de frutos por artrópodos en época de escasez, permitiendo así mantener una constante de tiempo de forrajeo, en lugar de aumentar el tiempo de búsqueda a expensas del reposo y una digestión eficiente (Milton, 1980) además de resultar un complemento proteico necesario para sus actividades diarias. Los registros muestran las sutiles diferencias preferenciales en cuanto a ítems consumidos dentro de la dieta de C. modestus y C. olallae, puesto que estudios realizados por López (2011) indican que esta segunda especie pasa la mayor parte del tiempo consumiendo frutos, seguidos por retoños y hojas maduras, con un consumo escaso de partes animales y registros ocasionales o únicos de gusanos y telarañas; evidenciando así las variaciones entre ambas especies, aunque estas se consideren especies hermanas (Martínez & Wallace, 2010). Es interesante destacar el consumo registrado de las hojas de una liana no identificada, que fueron masticadas y posteriormente frotadas por el cuerpo de manera ocasional, o cuando se observaba que algún individuo era picado por una avispa; de manera similar al comportamiento observado en Callicebus discolor con hojas de Tetrathylacium y Callicebus cupreus (Parque Nacional Manú en Perú) donde se observó a estos monos masticar hojas nuevas de cinco especies de la familia Annonaceae y de una enredadera (Bignoniaceae) y frotárselas por el abdomen (Carrillo-Bilbao et. al., 2005) al igual que en monos nocturnos en cautiverio (Evans et al., 2004). Tales datos podrían estar indicando propiedades insecticidas o repelentes, presentes en las hojas de dicha liana. 77 7.4. Variación general de tiempos de consumo entre edades y sexos 7.4.1. Variación entre hembras y machos adultos La variación de tiempos de alimentación en el consumo de las diferentes partes animales y vegetales, mostró que los frutos y las flores maduras fueron los ítems más empleados por los individuos de ambos géneros, exhibiendo porcentajes con diferencias no significativas; lo cual podría deberse al hecho de que conforman grupos estrictamente familiares. El índice de diversidad inverso de Simpson, mostró variaciones ligeras entre hembras y machos (Cinv-♂=14.27; Cinv-♀=13.93) habiendo ambos géneros incluido las mismas especies dentro de su dieta, pero en porcentajes ligeramente distintos; lo que podría indicar una determinada preferencia por algunas especies vegetales y los ítems ofrecidos por estas. Las variaciones observadas entre hembras adultas de cada grupo (“Corral” y “Maramacho”) de Callicebus modestus, muestran valores muy similares a los observados en los machos adultos; corroborando los datos previos de diversidad entre grupos, que podría ser una respuesta ante la variabilidad en la oferta del recurso, a través de cambios en su dieta manifiestos en el consumo de ciertos ítems en reemplazo de otros; de acuerdo a la época del año (Milton, 1980; Robinson, 1984; Chapman, 1987; Peres 1994). 7.4.2. Variación entre edades El tiempo de ingesta de partes animales y vegetales no presentó variaciones significativas entre los adultos, el individuo juvenil y la cría. Las variaciones porcentuales del tiempo de alimentación están en función al tipo de ítem consumido, por lo que se podría esperar que debido a la poca destreza del individuo juvenil y la cría en la manipulación de los alimentos, éstos expresen 78 sus preferencias por alimentos fáciles de adquirir y procesar como hojas y frutos blandos; por lo que es de esperar, que el individuo juvenil y la cría de monos titi, inviertan la mayor parte de su tiempo en el forrajeo de frutos blandos (Janson & Van Schaik 1993). Otro dato importante es que los adultos suelen ser tolerantes al robo de algunos frutos por las crías, tal es el caso del motacú (Attalea phalerata) el cual presenta una corteza demasiado dura como para ser pelada por una cría, razón que les impulsaba a sustraer el fruto ya pelado a uno de sus padres. Tal tolerancia disminuye cuando la cría crece y se hace más independiente y diestra en la alimentación, lo que se demuestra al observar que los porcentajes en el tiempo de alimentación de los individuos juveniles son cercanos a los de un adulto (Riveros & Ferreira, 2001). Los índices de diversidad obtenidos para las tres categorías de edades (Cinvadult=14.10 ±0.24 DE; Cinv-juv=13.4; Cinv-cria=12.88) muestran un número similar de especies utilizadas como fuente de alimento dentro de la dieta de los adultos, seguidos por el individuo juvenil y la cría, representadas principalmente por Tabebuia sp.1, Attalea phalerata, Acrocomia aculeata y Ficus pertusa en el caso de los adultos; mientras que las especies más representativas dentro de la dieta del individuo juvenil y de la cría fueron Acrocomia aculeata, Liana espinas pares (aún sin identificación) y Ocotea cernua. Dicha variación se debe principalmente a la destreza y la capacidad de ingesta de los ítems de alimentos que ofertan las distintas especies vegetales, de acuerdo a las características estructurales (tipo de corteza - dientes, intestinos) que les permiten procesar y digerir cada tipo de alimento consumido (Fleage, 1999; Strier, 2007). 79 7.5 Variación mensual de la Dieta de Callicebus modestus 7.5.1 Variación mensual en el consumo de especies vegetales como fuente de alimento El consumo de especies vegetales por Callicebus modestus, muestra variaciones mensuales durante el periodo de estudio, lo cual tiene que ver principalmente con la época de floración y fructificación de dichas especies (Beck et al., 1993). La preferencia o utilización de cada especie vegetal se halla en función al tipo de ítems alimenticios que éstas ofrecen (Wallace & Painter, 2002). 7.5.2 Variación mensual en el consumo de partes animales y vegetales Se ha registrado que la composición de la dieta de Callicebus modestus fue variando a lo largo del período de estudio. Los frutos maduros, al ser considerados como los componentes principales de la dieta, mostraron un consumo máximo en los meses de mayo y diciembre; lo que concuerda con la época de fructificación de las especies utilizadas (Killeen et al., 1993). Su consumo mínimo durante los meses de junio hasta agosto, denota un comportamiento similar observado por Solanki y colaboradores (2008) en langures. Describe como estos explotaban la mayor cantidad de especies alimenticias en los meses de menor abundancia de alimentos. A medida que disminuye el rango de alimentos preferidos, el tiempo para obtenerlos aumenta; por lo que se espera que los animales se dirijan después hacia las plantas de rango inferior, lo cual ocurre con los frutos secos / semillas y las flores maduras, puesto que se presentan dos picos de alimentación en agosto (conclusión de la época seca) y noviembre, meses que coinciden con la época de floración de las especies utilizadas (Killeen et al., 1993) y con el periodo de menor consumo de frutos maduros. 80 La ingesta de guías de tallo/ lianas y de hojas maduras exhibe un movimiento similar durante todo el periodo de estudio, con un número mayor de horas de alimentación en el mes de septiembre. Las hojas tiernas / rebrotes muestran un consumo mínimo pero constante a los largo de los meses, con caídas durante abril, mayo y octubre. Este patrón podría estar dando a entender el consumo de hojas y tallos como una alternativa a otros ítems, dadas las limitaciones en la abundancia de frutos (más allá de un nivel mínimo requerido) en ciertos meses del año y la abundancia casi continua de hojas a lo largo del año (Silver et.al., 1998). Las partes vegetales restantes, es decir el botón floral y los frutos verdes, no presentan mucha variación a lo largo del periodo de estudio; menos aún picos de alimentación, puesto que su consumo fue mínimo. El consumo de hojas amarillas se dio sólo en el mes de julio dentro del grupo “Corral”, por lo que se considera como un dato ocasional o raro. Las variaciones mensuales en el consumo de partes animales muestran a los gusanos / larvas como uno de los elementos principales en la dieta a lo largo del periodo de estudio, con variaciones entre los meses de septiembre y diciembre; periodo en el que se sitúa el pico máximo de alimentación. El consumo de termitas entre los meses de octubre y diciembre muestra un pico máximo en noviembre. Se ha observado que la utilización de hormigas como fuente de alimento fue relativamente constante a lo largo de los meses, con un pico máximo de consumo en el mes de octubre. Estas variaciones coinciden con los meses de menor consumo de frutos, por lo que podrían representar un reemplazo proteico, además de un complemento necesario en la dieta (Kinsey, 1978; Milton, 1980). 81 En general el consumo arañas y saltamontes fue mínimo, casi ocasional con una variación mínima o nula lo largo de los meses; un dato raro fue el consumo de una mariposa por la cría del grupo “Maramacho”, que no volvió a ocurrir. La reducida visibilidad durante la toma de datos atribuible a la altura, el follaje y el estrato arbóreo en el que se encontraban los individuos de C. modestus, además de la rapidez en la ingesta, tuvo como resultado la falta de identificación de varios insectos; principalmente durante los meses de septiembre y diciembre. 7.5.3 Variación mensual de la dieta entre grupos Las variaciones mensuales en el consumo de especies vegetales mostraron patrones similares en cada grupo de monos titi, con índices de diversidad que fueron variando sutilmente a lo largo de los meses. Para el grupo “Corral”, el valor más alto del índice de diversidad se registró en el mes de octubre, mientras que para el grupo “Maramacho” fue en el mes de abril; lo que podría indicar la utilización de un número relativamente mayor de especies vegetales dentro de la dieta durante dichos meses, contrariamente a los meses de junio para el grupo “Corral” y diciembre para el grupo “Maramacho”; cuando los valores del índice inverso de Simpson fueron los menores del periodo de estudio. Durante dichos meses, los monos titi emplearon un número relativamente menor de especies vegetales en su dieta. Los valores relativamente altos del índice de Similitud de Sorensen (Iss) intermensual de las especies vegetales usadas como fuente de alimento, indicarían que los cambios giraron en torno a la visita continua a los mismos árboles (Muñoz et al., 2005). Ciertas variaciones de los índices de similitud intermensuales dentro ambos grupos (Figura 11; 12) dan a entender un patrón entre el índice de similitud y la diversidad de dieta; ambos valores presentan movimientos similares, es decir a medida que aumenta la diversidad de especies dentro de la dieta (Cinv) aumenta la sobreposición dietética (Iss) con 82 ciertas variaciones a partir de octubre hasta diciembre, meses en los que ambas rectas se separan, tanto para el grupo “Corral” como para el grupo “Maramacho”. El índice de diversidad va en aumento entre los meses de septiembre a octubre pero el índice de similitud desciende de manera contraria en los meses de octubre-noviembre-diciembre, en los cuales índice de diversidad desciende poco a poco, a diferencia del índice de similitud que va en acenso; por lo que a partir del mes de octubre, en que aumenta el número de especies utilizadas dentro de la dieta de los monos titi, también disminuye la sobreposición dietética; la cual se va nivelando hasta el mes de diciembre, cuando el número de especies comprendida en la dieta va en bajada. Esto muestra cómo los primates pueden alterar su estrategia de alimentación en relación a la disponibilidad de recursos específicos, o incluso de algunos árboles en particular (Chapman,1988). Las variaciones significativas del consumo de especies vegetales mostradas en los meses de abril y mayo entre ambos grupos, podrían ser otra consecuencia de la diferencia del tiempo de observación registrado para ambos grupos; además de la habituación de éstos, puesto que abril y mayo fueron los primeros meses de la toma de datos, o simplemente deberse al tamaño de la isla de bosque y la oferta existente en la misma, dado que en un área de mayor tamaño y de menor intervención puede esperarse un número mayor de recursos alimenticios que cumplan con las necesidades de los primates (Wallace, 2005; 2006). Las variaciones mensuales en el consumo de ítems vegetales entre ambos grupos no mostraron datos significativos, lo cual podría indicar que las variaciones existentes entre el grupo “Corral” y el grupo “Maramacho” son mínimas. Los porcentajes de tiempos de alimentación de frutos maduros como principal fuente de alimento, observados a largo del periodo de estudio; 83 mostraron datos bajos durante en el mes de agosto para el grupo “Maramacho” y septiembre para el grupo “Corral”, similares a los de las flores maduras. Lo anterior podría deberse a la disponibilidad de alimento y a los estados fenológicos de las plantas (Solanki et.al., 2008) puesto que su consumo se realizó principalmente durante los meses de mayo, agosto y septiembre. Tales variaciones mensuales concuerdan con la época de floración de varias especies utilizadas en el consumo de este ítem (Killeen et al., 1993; Beck et al., 1993) además de la oferta y demanda de los diferentes ítems y la medida en que éstos cumplen con todos los requerimientos nutricionales (Freeland & Janzen 1974; Milton 1980). El uso de frutos secos / semillas dentro de la dieta de ambos grupos de monos titi, muestra solo un punto máximo en el mes de agosto. Al término de la época seca (Arbo, 1997) el consumo de hojas por ambos grupos, mostró variaciones mensuales, principalmente en el grupo “Maramacho”; puesto que su consumo se realizó solo en los meses de junio y septiembre en el caso de las hojas tiernas / rebrotes y en los meses de junio hasta octubre, con un punto máximo en el mes de septiembre para las hojas maduras. En el caso del grupo “Corral” el consumo de hojas se produjo a partir del mes de mayo hasta diciembre, con un punto máximo de consumo durante el mes de septiembre para hojas maduras y en junio para hojas tiernas / rebrotes. Esto podría traducirse en la necesidad de los primates por equilibrar sus necesidades dietéticas, a partir de las restricciones ejercidas por la disponibilidad de alimento (Richard, 1985; Chapman, 1988). Un complemento proteico necesario en la dieta, fue el consumo de partes animales / artrópodos (Kinsey, 1978; Milton, 1980). Cada grupo utilizó un porcentaje de tiempo de alimentación distinto al otro, de acuerdo al ítem consumido a lo largo de los meses, resultando el principal ítem los gusanos / 84 larvas, cuyo consumo se realizó solo en los meses de octubre, noviembre y diciembre; con un pico en octubre para el grupo “Corral” y diciembre para el grupo “Maramacho”. El consumo de hormigas con ligeras variaciones se observó a lo largo del periodo de estudio, con puntos máximos de consumo en abril para el grupo “Maramacho” y en octubre para el grupo “Corral”, tales variaciones podrían deberse a la disponibilidad de otros recursos alimenticios, por lo que este ítem quedaría en segundo plano. Las correlaciones en ambos grupos entre el porcentaje de tiempo de alimentación de frutos maduros, flores, frutos secos / semillas, hojas tiernas / rebrotes, hojas maduras, gusanos / larvas y hormigas, y la diversidad dietética mensual, no fueron significativas en todos los ítems consumidos para ambos grupos, excepto para el grupo “Maramacho” en el caso de los gusanos / larvas; lo que podría significar que la abundancia de todos los ítems es similar a la exigida por los monos titi, por lo que el consumo de todas las partes animales y vegetales difiere según la preferencia de los individuos, mostrando un principal interés en el consumo de frutos, flores y artrópodos (principalmente gusanos / larvas de mariposa y hormigas) puesto que podrían ser una parte importante de la dieta, como una forma alternativa a los elementos vegetales, según la época del año (Silver et.al., 1998). 7.5.4 Variación mensual de la dieta entre sexos El consumo mensual de partes animales y vegetales por hembras y machos adultos, mostró ligeras variaciones a lo largo del periodo de estudio; aunque dichas variaciones no fueron significativas, podrían estar relacionadas principalmente con la estacionalidad, la calidad del hábitat, la abundancia y las propiedades nutricionales de los ítems alimenticios (Jaman et al., 2010). Un ejemplo claro es el consumo de frutos maduros (principal fuente de alimento) con tiempos máximos de consumo en los meses de noviembre y 85 mayo para las hembras, y los meses de diciembre y mayo para los machos, el consumo de flores maduras con un pico en el mes de mayo y con máximas en los meses de agosto y septiembre, que coinciden con los meses en los cuales el consumo de frutos disminuye. El consumo de hojas tiernas / rebrotes, presenta un consumo máximo entre los meses de junio y agosto para los machos y los meses de agosto y diciembre para las hembras, que mostraron mayor afinidad que los machos en su consumo. Dentro del uso de partes animales, los gusanos / larvas fueron los más consumidos por ambos géneros, ambos con picos máximos de consumo registrados en los meses de octubre y diciembre; el consumo de hormigas con puntos máximo de alimentación en el mes de abril para ambos géneros, septiembre en hembras, y noviembre en machos. Estos datos coinciden con la Teoría de forrajeo óptimo (OFT) que postula que en el tiempo de elección de la dieta, la ubicación de los ítems y las decisiones de un animal, se basan principalmente en maximizar la tasa neta de ganancia de energía (Stephens & Krebs, 1986). 7.5.5 Variación mensual de la dieta entre edades Las variaciones mensuales en el consumo de partes animales y vegetales muestran patrones similares entre el juvenil y la cría en cuanto al consumo de frutos maduros, con picos máximos en el mes de octubre (86.91%, 79.89%) gusanos / larvas en el mes de diciembre (17.46%; 19.47%). Variaciones similares se observan en las tres categorías de edades en cuanto al consumo de frutos secos / semillas con máximas en el mes de agosto (12.34%; 14.33%; 14.84%) flores maduras en el mes de mayo (33.18%; 45.84%; 83.27%). Las hojas tiernas / rebrotes fueron consumidas por la cría solo en los meses de abril y agosto, a diferencia de los adultos que la consumieron durante todo el periodo de estudio; lo cual podría deberse a la cantidad de compuestos 86 secundarios que producen muchas plantas, entre ellos taninos y alcaloides que se unen con las proteínas para reducir la digestibilidad de los alimentos y actúan como toxinas que alteran los procesos metabólicos (Lambert, 1998; Fashing et al., 2007). La ingesta de los gusanos / larvas se realizó solo en los meses de octubre a diciembre, con ligeras variaciones en las diferentes edades, que muestran un mayor consumo por parte de adultos. Principalmente en el mes de octubre, la ingesta de hormigas al igual que de gusanos / larvas, se realizó principalmente por adultos, con variaciones a lo largo del periodo de estudio; ambos datos muestran la falta de destreza del individuo juvenil y la cría en la caza y manipulación de los artrópodos (Janson & Van Schaik 1993; Riveros & Ferreira, 2001). 7.6 Patrón alimenticio El comportamiento alimenticio de ambos grupos de C. modestus presentó dos picos de alimentación, uno principalmente a primeras horas de la mañana después de un prolongado descanso para así tener las energias necesarias para empezar el día. Un pico aún mayor en ambos grupos, se presenta a media tarde presumiblemente para maximizar la ingestión antes de un periodo prolongado de descanso nocturno (Chapman & Chapman, 1991; Wallace, 2005). 87 8. CONCLUSIONES La dieta de Callicebus modestus durante el periodo de estudio, estuvo compuesta principalmente por frutos maduros, flores, semillas y artrópodos. El consumo de hojas, rebrotes y lianas se presentó en menor proporción. Se registraron un total de 62 especies vegetales, dentro de las cuales solo se lograron identificar 42 especies pertenecientes a 20 familias, además del consumo de artrópodos pertenecientes a 2 Clases y 5 órdenes. Del total de las especies vegetales utilizadas por Callicebus modestus como fuente de alimento, el grupo “Corral” solo utilizó 47 especies y el grupo “Maramacho” 41, de las cuales solo fueron identificadas 36 y 25 especies respectivamente. Las especies de las familias Bignoniaceae, Moraceae, Arecaceae (Palmae) y Rubiaceae, fueron las más utilizadas dentro de la dieta del grupo “Corral” mientras que las familias Arecaceae (Palmae) Lauraceae, Bignoniaceae y Rubiaceae, las más utilizadas por el grupo “Maramacho”; por lo que de manera general, las familias más consumidas fueron Arecaceae (Palmae) y Bignoniaceae. Las especies vegetales más consumidas por el grupo “Corral” fueron Ficus pertusa (matapalo) Tabebuia sp.1 (tajibo) Arrabidaea sp.3, y Genipa americana (bi) y para el grupo “Maramacho” fueron Acrocomia aculeata (totai) Ocotea cernua (laurel) liana espinas pares (especie sin identificación) y Tabebuia sp.1 (tajibo). La variación mensual observada dentro de la dieta de ambos grupos de Callicebus modestus (“Corral” y “Maramacho”) al parecer está asociada a los periodos de fructificación y floración de las especies de las que se alimenta al interior de los islotes de bosque, además de la oferta de otros ítems alimenticios que sirven de suplemento en ausencia de éstos. 88 Dentro de los comportamientos individuales no se logró evidenciar la existencia de variaciones alimentarias significativas asociadas a la edad y al sexo, por lo que no existiría alta selectividad del recurso, sino simplemente falta de destreza en la manipulación de los alimentos, e inexperiencia por parte de los individuos de edades inferiores. En cuanto la edad, el tiempo de alimentación invertido no varía significativamente, aunque existen ligeras variaciones según el ítem alimenticio consumido, donde: - Los adultos invierten un tiempo mayor en el consumo de frutos verdes, botón floral y hojas tiernas / rebrotes. - El individuo juvenil invierte un tiempo mayor en el consumo de frutos maduros y guías de tallos tiernos / lianas, - La cría invierte un tiempo ligeramente mayor en el consumo de flores maduras y frutos secos / semillas, No existen variaciones alimentarias significativas asociadas al sexo, por lo que tanto hembras como machos adultos utilizan un número similar de especies vegetales dentro de su dieta, lo cual se debe principalmente al tipo de organización social que presenta esta especie; puesto que forman grupos familiares dentro de los cuales todos los individuos se mueven en conjunto para realizar las diferentes actividades diarias. En cuanto al comportamiento alimenticio, se logró evidenciar un patrón de actividad diaria, dentro el cual exisiten dos picos de alimentación uno a primeras horas de la mañana y otro a media tarde hasta el momento en que los individuos se preparan para dormir, lo cual conincide con el tipo de comportamiento que muestran todos los individuos Diurnos. 89 9. RECOMENDACIONES Es necesario reconocer el carácter preliminar de este estudio, aunque los datos obtenidos de la dieta de Callicebus modestus, son muy similares a los obtenidos para Callicebus olallae; siendo esta su especie hermana, resulta necesario realizar mayores estudios durante varios periodos, para así obtener mayor información sobre su comportamiento y dieta, además de estudios químicos que muestren el valor nutricional de cada ítem alimenticio, con los cuales se podrá hacer una mejor valorización de la dieta y los elementos que la componen. Estos datos ayudarán a establecer una línea base para su conservación y potencial manejo. Un dato adicional interesante asociado a la conducta de esta especie resulta ser el mordisqueo y utilización de hojas de una liana para frotárselas en el cuerpo, observada en ciertos individuos; lo cual podría resultar el objeto de posteriores investigaciones destinadas a identificar potenciales propiedades bioquímicas de estas plantas, dado que Callicebus modestus no ha sido la única especie en la que se ha observado dicho comportamiento. 10. REFERENCIAS BIBLIOGRÁFICAS Alsina, J. 1986. Etología Ciencia Actual. Ed Anthropos editorial del Hombre. Barcelona, España. pp 30-52. Altmann J. 1974. Observational study of behavior: sampling methods. Behaviour, 49: 227-267. 90 Altmann S. 1998. Foraging for survival: yearling baboons in Africa. Chicago: Univ. of Chicago Press. pp 1-25. Anderson, S. 1997. Mammals of Bolivia, taxonomy and distribution. Bull. Am. Museum of Natural History. 231: 1-652. Arbo M.M. 1997. El género arrabidaea (bignoniaceae) en argentina: nuevos registros" distribución y fenología. Bonplandia 9: 223-230. Ayres J.M. 1986. Uakaris and Amazonian flooded forest. Tesis Doctoral, University of Cambridge. Bank Information Center. 2012. Última actualización: 23-02-2012. En: http://www.bicusa.org/es/Project.10082.aspx Beck, S.G. 1983. Vegetation sökologishe Grundlagen del Viehwirtschaft in den Übersch wemmungss-Savannen des Río Yacuma (Departamento Beni, Bolivien). Dissertationes Botanicae 80:1-186. Beck, S.G., T. Killeen & E. García, 1993.Vegetación de Bolivia. pp 6-23. En: KilleenT.J., Beck S.G. & E. García (eds.) Guía de Árboles de Bolivia. Herbario Nacional de Bolivia- Missouri Botanical Garden, Editorial Quipus S.R.L. La Paz, Bolivia. Bernal, N. &C. Silva. 2003. Mamíferos. En: Flores E. & C. Miranda (eds.). Fauna amenazada de Bolivia ¿Animales sin futuro?. Ministerio de Desarrollo Sostenible. Proyecto de Fortalecimiento Institucional. pp 1-30. Bravo-Nuñez, E. 1991. Sobre la cuantificación de la diversidad Ecológica. Hidrobiología. 1: 87-93. 91 Carrillo-Bilbao G., Di Fiore A. & E. Fernández-Duque. 2005. Dieta, forrajeo y presupuesto de tiempo en cotoncillos (Callicebus discolor) del Parque Nacional Yasuní en la Amazonia Ecuatoriana. Neotropical Primates 13:7-11. Chapman, C. 1987. Flexibility in diets of three species of Costa Rican Primates. Folia Primatologica 49: 90-105. Chapman, C.A. 1988. Patch use and patch depletion by the spider and howler monkeys of Santa Rosa National Park. Behaviour 105: 99-116. Chapman, C., and L. J. Chapman. 1991. The foraging itinerary of spider monkeys: when to eat leaves? Folia Primatology. 56:162-166. Chapman C.A., Chapman L.J., Bjorndal K.A. & D.A. Onderdonk. 2002. Aplication of protein to fiber ratios to predict colobine abundance on different spatial scales. International Journal of Primatology. 23: 283-310. Davies A.G. 1984. Ecological study of the red leaf monkey (Presbytis rubicunda) in the Dipterocarpus forest of Northern Borneo. Tesis Doctoral, University of Cambridge. Defler T.R., Bueno M.L. & J. García. 2010. Callicebus caquetensis: A New and Critically Endangered Titi Monkey from Southern Caquetá, Colombia. Primate Conservation 25: 1-9. Eisenberg, J.F. & K.H. Redford. 1999. Mammals of the Neotropics, 3: The Central Neotropics: Ecuador, Peru, Bolivia, Brazil. The University of Chicago Press. Chicago. pp 582-591 Emmons, L.H. & F. Feer. 1999. Neotropical Rainforest mammals: A Field Guide. The University of Chicago Press, Chicago. 8p. 92 Evans, S., Weldon, P., Gioannetti, J., Moody, C. & E. Vicaria. 2004. Anointing in owl monkeys. American Journal of Primatology. pp 60:135. Fashing P.J., Dierenfeld E.S. & C.B. Mowry. 2007. Influence of plant and soil chemistry on food selection, ranging patterns, and biomass of colobus guereza in Kakamega Forest, Kenya. International Journal of Primatology, 28: 673-702. Feisinger, P. 2003. El Diseño de los Estudios de Campo para la Conservación de la Biodiversidad. Editorial FAN. Santa Cruz de la Sierra, Bolivia. pp 10-96 Felton A., A. M. Felton, R. Wallace & H. Gómez. 2006. Identification, behavioral observations, and notes on the distribution of the titi monkeys Callicebus modestus and Callicebus olallae. Primate Conservation. 20: 41– 46. Fleagle, J. G. 1999. Primate adaptation and evolution. San Diego, Academic Press. pp 47-89. Flores, J. G., C. Batte & J. Dapara, 2002. Caracterización de la vegetación del Río Undumo y su importancia para la conservación de la fauna Silvestre. Ecología en Bolivia. Instituto de Ecología, Universidad Mayor de San Andrés. La Paz, Bolivia. 31: 23-48. Freeland, W. J. & D.H. Janzen. 1974. Strategies of herbivory in mammals; the role of plant secondary compounds. American Naturalist 108: 269-289. Garber, P. A. 1989. Role of spatial memory in primate foraging patterns: Saguinus mystax and Saguinus fuscicollis. American Journal of Primatology 19:203-216. 93 Gavilanez-Endara, M. 2006. Demografía, actividad y preferencia de hábitat de tres especies de primates (Alouatta palliata, Ateles fusciceps y Cebus capucinus) en un bosque nublado del Noroccidente Ecuatoriano. Tesis de grado. Pontificia Universidad Católica Del Ecuador. Groves, C. P. 2001. Primate Taxonomy. Smithsonian Institution Press, Washington, DC. Hanagarth W. 1993. Acerca de la Geología de las Sabanas del Beni en el Norte de Bolivia. Ed. Instituto de Ecología, La Paz, Bolivia. 186 p. Hershkovitz, P. 1988. Origin, speciation, and dispersal of South American titi monkeys, genus Callicebus (family Cebidae, Platyrrhini). Proc. Academy of Natural Science. Philadelphia 140(1): 240 –272. Hershkovitz, P. 1990. “Titis”, New World monkeys of the genus Callicebus (Cebidae, Platyrrhini): A preliminary taxonomic review. Fieldiana Zoology. New series 55:1-109. Ibisch P.L., S.G. Beck, B. Gerkmann & A. Carretero. 2008. La diversidad biológica, ecoregiones y ecosistemas. pp 47-57. En: Ibisch P.L. & G. Mérida (eds). Biodiversidad: La riqueza de Bolivia Estado de Conocimiento y Conservación. Editorial FAN. Santa cruz de la Sierra, Bolivia. Inturias M.L., 2011. Un análisis a partir de la experiencia del Corredor Norte Plataformas, redes y megaproyectos. T’inkazos, 29: 65 – 85 Jaman M.F., Huffman M.A. & H. Takemoto. 2010. The foraging behavior of Japanese macaques Macaca fuscata in a forested enclosure: effects of nutrient composition, energy and its seasonal variation on the consumption of natural plant foods. Current Zoology 56 (2): 198 – 208. 94 Janson, C.H. & C.P. Van Schaik. 1993. Ecology risk aversion in juvenile primates: slow and steady wins the race. Pp. 57-74. En: Pereira M.E & L.A. Fairbanks (eds.): Juvenil Primates. Life History, Development and Behavior. New York, Oxford. Jolly, A. 1985. Evolution of Primate Behaviour. 2nd ed. MacMillan, New York. Killeen T.J., E.E. García & S.G. Beck (eds). 1993. Guía de árboles de Bolivia. Herbario Nacional de La Paz, Missouri Botanical Garden. Quipus S.R.L., La Paz, Bolivia. 958p. Kinzey, W.G. 1978. Feeding behaviour and molar features in two species of titi monkey. Pp 373-385. En: Chivers D.J. & J. Herbert (eds). Recent Advances in Primatology. Vol. 1: Behaviour Academic Press: London. Kinzey, W. G. 1981. The titi monkeys, genus Callicebus. Pp. 241-276. En: Coimbra-Filho A.F. & R.A. Mittermeier (eds) Ecology and Behavior of Neotropical Primates. Academia Brasileira de Ciências, Rio de Janeiro. Kinzey W.G. 1997. Callicebus. Pp 213–221. En: Kinzey W. G. (ed.). New World Primates: ecology, evolution y behavior. Aldine de Gruyter, New York. Lambert, J.E. (1998). Primate digestion: Interactions among anatomy, physiology, and feeding ecology. Evolutionary Anthropology. 7: 8–20. Lönnberg, E. 1939. Notes on some members of the genus Callicebus. Arkivfür Zoologi. Stockholm, 31 A (13):1-18. 95 López, L. 2011. Comportamiento de dos grupos de mono lucachi (Callicebus olallae) en la estancia ganadera “La Asunta”; municipio de Santa Rosa del Yacuma-departamento de Beni. Tesis de Grado. Universidad Mayor de San Andrés. 68 p. López -Strauss, H. 2008. Estimación de densidad y composición de grupos de dos especies de primates endémicos Callicebus olallae y Callicebus modestus, en el Sud - Oeste del Departamento del Beni – Bolivia. Tesis de Grado. Universidad Mayor de San Andrés. 67 p. Lorenz, K. 1986. Fundamentos de la etología, estudio comparado de las conductas. Ediciones Paidós Ibérica S. A. Barcelona, España. Pp 1-25 Martin P. & P. Bateson. 1986. Measuring behavior. New York: Cambridge University Press. 200 p. Martínez J. & R. Wallace. 2007. Further notes on the distribution of endemic Bolivian Titi Monkeys, Callicebus modestus and Callicebus olallae. Neotropical Primates 14(2): 47-54. Martínez J. & R. Wallace. 2009. Callicebus modestus. Pp 469-470. En: Ministerio de Medio Ambiente y Agua. Libro Rojo de la Fauna Silvestre de Vertebrados de Bolivia. La Paz, Bolivia. Martinez, J. & R.B Wallace. 2010. Pitheciidae. pp 305-330. En: Wallace, R.B., H. Gómez, Z.R. Porcel & D.I. Rumiz (Eds.). Distribución, ecología y conservación de los mamíferos medianos y grandes de Bolivia. Editorial: Centro de Ecología y Difusión Simón I. Patiño. Santa Cruz de la Sierra, Bolivia. 96 Milton, K. 1980. The foraging strategy of Howler monkeys. New York, Columbia University Press. 165 pp. Milton, K. 1999. Nutritional characteristics of wild primate foods: do the diets of our closest living relatives have lessons for us?. Nutrition. 15(6): 488-498. Miranda, C., M.O. Ribera, J. Sarmiento, E. Salinas & C. Navias. 1991. Plan de Manejo de la Reserva de la Biosfera Estación Biológica del Beni. A.N.C.B., E.B.B., LIDEMA. PL-480, La Paz, Bolivia. pp 556. Mittermeier, R A & D. L. Cheney. 1987. La conservación de los primates y sus hábitats. Bol. Primatol. Arg. 5(1-2): 28-64 Moraes, M., M.O. Ribera & E. Villanueva. 2000. La vegetación de la Reserva de la Biosfera Estación Biológica del Beni y su importancia para la conservación. pp 59-73. En: Herrera-Mc Bryde, O., F. Dallmeirer, B. Mc Bryde, J. A. Comyskey & C. Miranda (eds). Biodiversidad, Conservación y Manejo en la Región de la Reserva de la Biosfera Estación Biológica del Beni, Bolivia/Biodiversity, Conservation and Management in the Region of the Beni Biological Station Biosphere Reserve, Bolivia. Si/MAB Series No 4, Smithsonian Institut, Washington D.C. 423 pp. Müller, K.H. 1996. Diet and feedind ecology of masked titis (Callicebus personatus). pp 383–400. En: Norconk M.A., Rosenberger A.L. & P.A. Garber (ed.). Adaptive Radiations Of Neotropical Primates. Plenum Press. New York. Muñoz, D., A. Estrada & E. Naranjo. 2005. Monos aulladores (Alouatta palliata) en una plantación de cacao (Theobroma cacao) en Tabasco, México: aspectos de la ecología alimentaria. Universidad Juárez Autónoma de Tabasco. Villahermosa, México. Universidad y Ciencia. 02: 35-44 97 Navarro G. & M. Maldonado. 2002. Geografía Ecológica de Bolivia: Vegetación y Ambientes Acuáticos. Editorial: Centro de Ecología Simón I. Patiño. Cochabamba, Bolivia. Pp 51-70. Navarro G. & W. Ferrerira. 2004. Zonas de vegetación potencial de Bolivia: una base para el análisis de vacios de conservación. Editorial: Centro de Ecología Simón I. Patiño. Cochabamba, Bolivia. Revista Boliviana de Ecología. 15:1-40. Norconk M., O.T Oftedal, M.L. Power, M. Jakubasz & A. Savage. 2002. Digesta passage and fiber digestibility in captive white-faced sakis (Pithecia pithecia). American Journal of Primatology. 58: 23-34 Norconk M. 2007. Sakis, uakaris, and titi monkeys, behavioral diversity in a radiation of primate seed predators. pp 123-138. En: Campbell C., Fuentes A., MacKinnon K., Bearder S. & R. Stumpf (eds). Primates in Perspective. Second Edition. New York, Oxford University Press. Norconk M.A., B.W. Wright, N.L. Conklin-Brittain & C.J. Vinyard. 2009. Mechanical and Nutritional Properties of Food as Factors in Platyrrhine Dietary Adaptations pp 279-319. En: P.A. Garber et al. (eds.) South American Primates, Developments in Primatology: Progress and Prospects. Springer Science+Business Media Noss, F., H. Quigley, M.G. Hornocker, T. Merrill & P.C. Paquet. 1996. Conservation biology and carnivore conservation in the Rocky Mountains. Conservation Biology, 10(4): 949-963. Oates, J.F. 1977. Food distribution and foraging behavior. Pp 197-209. En: B.Smuts, D. Cheney, R. Seyfarth, R. Wrangham & T. Struhsaker (eds.) Primate Societies. Chicago University Press, Chicago. 98 Oates JF. 1987. Food distribution and foraging behaviour. Pp 197-209. En: Smuts BB, D.L. Cheney, R.M. Seyfarth, R.W. Wrangham & T.T. Struhsaker (eds). Primate Societies. Chicago University Press. Chicago Pacheco, L. F. & J. A. Simonetti. 1998. Consecuencias demográficas para Inga ingoides (Mimosoideae) por la pérdida de Ateles paniscus (Cebidae) uno de sus dispersores de semillas. Ecología en Bolivia 31: 67-90. Painter, R. L . E. 1998. Gardeners of the forest: Plant-animal interactions in a Neotropical forest ungulate community. Doctoral thesis, University of Liverpool, Liverpool, UK. 275p. Peres, C. 1994. Primate responses to phenological changes in an Amazonian tierra firme forest. Biotropica 26(1):98-112. Prefectura Departamental del Beni (PDB) 2001. Diagnóstico Agropecuario y Rural del Departamento del Beni. Prefectura del Departamento del Beni, Trinidad. Quiatt D. & V. Reynolds. 1995. Primate behaviour: information, social knowledge, and the evolution of culture. Cambridge University Press. Pp 2 50. Rabinowitz, A. 2003. Manual de Capacitación para la Investigación de campo y la conservación de la vida Silvestre. 1ra edición en español. Editorial FAN, Wildlife Conservatión Society, Bolivia. pp 51-138 Richard, A.F. 1985. Primate in Nature. W. H. Freeman and Co. New York. 99 Riveros M. & C. Ferreira. 2001. Comportamiento alimentario de una tropa de Pithecia pithecia (mono viudo cara blanca) en una isla del embalse de guri, estado bolívar. Sociedad Venezolana de Ecología. Ecotropicos 14(2):57-64. Robinson, J.G. 1984. Diurnal variation in foraging and diet in the wedge-capped capuchin Cebus olivaceus. Folia Primatologica 43:216-228. Ross, C.F., R.L. Washington, A. Eckhardt, D.A. Reed, E.R. Vogel, N.J. Dominy, Z.P. Machanda. 2009. Ecological consequences of scaling of chew cycle duration and daily feeding time in Primates. Journal of Human Evolution. 56: 570-585. Rowe N. & W. Martinez. 2003. Callicebus sightings in Bolivia, Peru and Ecuador. Neotropical Primates. 11(1): 32-35. Silver S.C., Ostro L.E.T., Yeager C.P., & R. Horwich. 1998. Feeding ecology of the black howler monkey (Alouatta pigra) in Northern Belize. American Journal of Primatology 45:263-279. Solanki G.S., Awadhesh Kumar & B. K. Sharma. 2008. Winter food selection and diet composition of capped langur (Trachypithecus pileatus) in Arunachal Pradesh, India. International Society for Tropical Ecology. Tropical Ecology 49(2): 157-166. Stephens D. W. & J. R. Krebs, 1986. Foraging Theory. Princeton: Princeton University Press. New Jersey. 247 p. Strier K. 2007. Primate Behavioral Ecology. Pearson Allyn and Bacon. 3rd Edition. Boston. 452 p. 100 Tarifa, T. 1996. Mamíferos. Pp. 165-264. En: Ergueta, P.S. & C. de Morales (eds). Libro Rojo de los vertebrados de Bolivia. Centro de Datos para la Conservacion-Bolivia, La Paz, Bolivia. Terborgh J. 1983. Five New World Primates- A study in Comparative Ecology. Princeton University Press. Princenton. New Jersey. 31p. Tinbergen, N. 1963. “On aims and methods of ethology.” Zeitschrift für Tierpsychologie 20:410-433. Tinbergen, N. 1981. El Estudio del Instinto. 7ª ed. Editorial Siglo Veintiuno. Bogotá. Van Roosmalen, M.G.M., T. Van Roosmalen, & R.A. Mittermeier. 2002. A taxonomic review of the titi monkeys, genus Callicebus Thomas, 1903, with the description of two new species, Callicebus bernhardi and Callicebus stephennashi, from Brazilian Amazonia. Neotropical Primates 10 (Suppl.): 1-52. Wallace, R. B., & L. E. Painter, D.I. Rumiz & J.C. Herrera. 2000. La estacionalidad y el manejo de vida Silvestre en los bosques de producción del oriente de Bolivia. Revista Boliviana de Ecología. 8:65-81. Wallace, R. B., & R. L. E. Painter. 2002. Phenological patterns in a southern Amazonian tropical forest: Implications for sustainable management. Forest Ecology Manage. 160: 19–33. Wallace R. B. 2005. Seasonal variations in diet and foraging behavior of Ateles chamek in a southern amazonian tropical forest. International Journal of Primatology. 26 (5):1053-1075. 101 Wallace, R. B. 2005. Diurnal Activity Budgets of Black Spider Monkeys, Ateles chamek, in a Southern Amazonian Tropical Forest. For Neotropical Primates. pp 19 Wallace, R. B. 2006. Seasonal variations in black spidermonkey, Ateles chamek, habitat use and ranging behaviour in a southern Amazonian tropical forest. American Journal of Primatology. 68: 313–332. Waterman P.G., Ross J.A.M., Bennett E.L. & A.G. Davies. 1988. A comparison of the floristic and leaf chemistry of tree flora in two Malaysian rainforests and influence of leaf chemistry on populations of colobine monkeys in the old world. Biological Journal of Linnaean Society. 34:1-32. Wasserman M.D. & C.A Chapman. 2003. Determinants of colobine monkey abundance: the importance of food energy, protein and fiber contein. Journal of Animal Ecology. 72: 650-659. 102 ANEXOS 103 ANEXO 1. Mapas de distribución de los árboles de las diferentes especies dentro los islotes de bosque, utilizados por Individuos de Callicebus modestus del Grupo “Corral” como fuente de alimento a lo largo del periodo de estudio en la Estancia San Miguel en Santa Rosa de Yacuma. 104 ANEXO 1a. Mapas de distribución de los árboles de las diferentes especies dentro los islotes de bosque, utilizados por Individuos de Callicebus modestus del Grupo “Corral” como fuente de alimento a lo largo del periodo de estudio en la Estancia San Miguel en Santa Rosa de Yacuma. 105 ANEXO 1b. Mapas de distribución de los árboles de las diferentes especies dentro los islotes de bosque, utilizados por Individuos de Callicebus modestus del Grupo “Corral” como fuente de alimento a lo largo del periodo de estudio en la Estancia San Miguel en Santa Rosa de Yacuma. 106 ANEXO 2. Mapa de distribución de los árboles de las diferentes especies dentro los islotes de bosque, utilizados por Individuos de Callicebus modestus del Grupo “Maramacho” como fuente de alimento a lo largo del periodo de estudio en la Estancia San Miguel en Santa Rosa de Yacuma. 107 ANEXO 2a. Mapa de distribución de los árboles de las diferentes especies dentro los islotes de bosque, utilizados por Individuos de Callicebus modestus del Grupo “Maramacho” como fuente de alimento a lo largo del periodo de estudio en la Estancia San Miguel en Santa Rosa de Yacuma. 108 ANEXO 3. Horas de observación para cada grupo e individuos de Callicebus modestus durante todo el periodo de estudio en la Estancia San Miguel (los valores con asteriscos, representan el número de scans mensuales, es decir el número de horas multiplicado por el número de muestreos por hora) Grupo Id Abril Mayo Junio Agosto Septiembre Octubre Noviembre Diciembre Maramacho karina 108(648*) 248.83(1493*) 202.67(1216*) 316 (1896*) 414(2484*) 308,83(1853*) 408,83(2453*) 457.83(2747*) timoteo lita macario natusha mandingo 108(648*) 108(648*) 107.33(644*) 32.17(193*) 32.17(193*) 248.83(1493*) 248.83(1493*) 248.83(1493*) 63,17(379*) 66.17(397*) 203(1218) 201.33(1208*) 203(1218) 108,83(653*) 103,83(623*) 315.33(1892*) 316,33(1898*) 316,33(1898*) 157,33(944*) 155,33(932*) 413,33(2480*) 413.83(2483*) 414.33(2485*) 257.5(1545*) 264,33(1586*) 308,17(1849*) 308,17(1849*) 308,17(1849*) 159,83(959*) 156,67(940*) 409.5(2457*) 409.33(2456*) 409.67(2458*) 191.33(1148*) 192.17(1153*) 457.83(2747*) 457.83(2747*) 457.83(2747*) 215,83(1295*) 215.5(1293*) Corral ANEXO 4. Uso de ítems Alimenticios (partes vegetales y animales) por Callicebus modestus durante el periodo de estudio en la Estancia San Miguel T (s) de alimentación 56000 52390 900 49630 14300 187080 20280 689190 160800 80860 4140 47410 1260 11100 120 15600 Items consumidos hoja tierna/rebrote hoja hoja amarilla guía de tallo/liana botón floral flor madura fruto verde fruto maduro fruto seco /semilla gusanos/larvas araña hormigas saltamontes insectos/no id mariposa? termita c/alas %T 4.03 3.77 0.06 3.57 1.03 13.45 1.46 49.54 11.56 5.64 0.29 3.52 0.13 0.78 0.01 1.09 ANEXO 5. Estacionalidad en el uso de partes animales y vegetales (ítems alimenticios) por Callicebus modestus durante el periodo de estudio en la Estancia San Miguel . Items consumidos Abril (T) hoja tierna/rebrote hoja hoja amarilla guia de tallo/liana boton floral flor madura fruto verde fruto maduro fruto seco /semilla gusanos/larvas araña hormigas saltamontes insectos/no id mariposa? termita c/alas 780 0 0 0 0 4920 360 15130 120 0 60 8220 0 240 0 0 Mayo (T) 60 60 0 0 3800 15960 0 73440 0 0 0 1140 0 180 0 0 Junio (T) 5280 2340 0 2160 5760 24300 0 58860 0 0 180 3180 480 180 0 0 Julio(T) 9480 240 900 0 0 5520 0 8280 0 0 480 0 0 0 0 0 Agosto (T) 8580 10140 0 10800 3780 62400 3600 43560 70380 0 480 3970 0 240 0 0 Septiembre (T) 8640 26950 0 26230 0 50640 6720 105730 5340 0 480 6740 0 1500 0 0 Octubre (T) 1440 11460 0 7920 0 4560 240 115680 23280 19370 1500 12620 0 4860 0 0 Noviembre (T) 11960 120 0 1200 960 14820 600 128710 61560 25430 840 9740 540 3000 120 15600 Diciembre (T) 9780 1080 0 1320 0 3960 8760 139800 120 36060 120 1800 240 900 0 0 109 ANEXO 6. Variación mensual en el consumo de ítems (partes animales y vegetales) por adultos del grupo Corral. Items consumidos Abr hoja tierna/rebrote hoja hoja amarilla guia de tallo/liana boton floral flor madura fruto verde fruto maduro fruto seco /semilla gusanos/larvas araña hormigas saltamontes insectos/no id mariposa ? termita c/alas 0,00 0,00 0,00 0,00 0,00 0,00 360,00 1205,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 % 0,00 0,00 0,00 0,00 0,00 0,00 23,00 77,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 May 60,00 60,00 0,00 0,00 0,00 1740,00 0,00 12630,00 0,00 0,00 0,00 540,00 0,00 180,00 0,00 0,00 % 0,39 0,39 0,00 0,00 0,00 11,44 0,00 83,04 0,00 0,00 0,00 3,55 0,00 1,18 0,00 0,00 Jun 2010,00 660,00 0,00 0,00 420,00 1860,00 0,00 14220,00 0,00 0,00 180,00 1110,00 240,00 0,00 0,00 0,00 % 9,71 3,19 0,00 0,00 2,03 8,99 0,00 68,70 0,00 0,00 0,87 5,36 1,16 0,00 0,00 0,00 Ago 3780,00 1350,00 0,00 1740,00 1620,00 8040,00 1290,00 20280,00 5490,00 0,00 480,00 810,00 0,00 0,00 0,00 0,00 Tiempos de alimentación mensual % Sep % Oct 8,42 1950,00 3,64 720,00 3,01 6125,00 11,42 3300,00 0,00 0,00 0,00 0,00 3,88 4985,00 9,30 3360,00 3,61 0,00 0,00 0,00 17,91 15980,00 29,80 750,00 2,87 3360,00 6,27 120,00 45,19 16055,00 29,94 16560,00 12,23 390,00 0,73 720,00 0,00 0,00 0,00 9145,00 1,07 240,00 0,45 750,00 1,80 3970,00 7,40 4120,00 0,00 0,00 0,00 0,00 0,00 570,00 1,06 1770,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 % 1,74 7,99 0,00 8,13 0,00 1,82 0,29 40,08 1,74 22,13 1,82 9,97 0,00 4,28 0,00 0,00 Nov 1780,00 120,00 0,00 330,00 0,00 1560,00 600,00 32075,00 900,00 4375,00 420,00 3700,00 270,00 540,00 0,00 2640,00 % 3,61 0,24 0,00 0,67 0,00 3,16 1,22 65,05 1,83 8,87 0,85 7,50 0,55 1,10 0,00 5,35 Dic 4020,00 540,00 0,00 420,00 0,00 1380,00 0,00 35520,00 0,00 8100,00 0,00 240,00 240,00 0,00 0,00 0,00 % 7,97 1,07 0,00 0,83 0,00 2,73 0,00 70,39 0,00 16,05 0,00 0,48 0,48 0,00 0,00 0,00 TOTAL 14320,00 12155,00 0,00 10835,00 2040,00 31310,00 5730,00 148545,00 7500,00 21620,00 2070,00 14490,00 750,00 3060,00 0,00 2640,00 %TOTAL 5,17 4,39 0,00 3,91 0,74 11,30 2,07 53,61 2,71 7,80 0,75 5,23 0,27 1,10 0,00 0,95 % 0,00 Dic 0,00 0,00 % 0,00 TOTAL 930,00 %TOTAL 0,43 0,00 0,00 0,00 3150,00 3090,00 0,00 27180,00 3120,00 3510,00 0,00 660,00 0,00 630,00 0,00 2520,00 0,00 0,00 0,00 7,18 7,05 0,00 61,97 7,11 8,00 0,00 1,50 0,00 1,44 0,00 5,75 0,00 0,00 120,00 660,00 600,00 2400,00 16080,00 60,00 4620,00 0,00 0,00 600,00 330,00 0,00 0,00 0,00 0,00 0,47 2,59 2,36 9,42 63,13 0,24 18,14 0,00 0,00 2,36 1,30 0,00 0,00 5610,00 0,00 6900,00 5250,00 40270,00 3420,00 125310,00 8940,00 8490,00 60,00 6060,00 600,00 1980,00 0,00 2520,00 2,59 0,00 3,19 2,43 18,61 1,58 57,92 4,13 3,92 0,03 2,80 0,28 0,92 0,00 1,16 ANEXO 7. Variación mensual en el consumo de ítems (partes animales y vegetales) por adultos del grupo Maramacho Items consumidos Abr hoja tierna/rebrote 0,00 % 0,00 hoja hoja amarilla guia de tallo/liana boton floral flor madura fruto verde fruto maduro fruto seco /semilla gusanos/larvas araña hormigas saltamontes insectos/no id mariposa ? termita c/alas 0,00 0,00 0,00 390,00 420,00 0,00 3390,00 0,00 0,00 60,00 1920,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 6,31 6,80 0,00 54,85 0,00 0,00 0,97 31,07 0,00 0,00 0,00 0,00 May 0,00 % 0,00 0,00 0,00 0,00 0,00 13230,00 0,00 16140,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 45,05 0,00 54,95 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 Jun 60,00 % 0,29 240,00 0,00 960,00 960,00 5940,00 0,00 11100,00 0,00 0,00 0,00 960,00 0,00 180,00 0,00 0,00 1,18 0,00 4,71 4,71 29,12 0,00 54,41 0,00 0,00 0,00 4,71 0,00 0,88 0,00 0,00 Ago 0,00 1440,00 0,00 1500,00 0,00 10470,00 1020,00 11430,00 4560,00 0,00 0,00 1020,00 0,00 120,00 0,00 0,00 Tiempos de alimentación mensual % Sep % Oct 0,00 870,00 2,93 0,00 % 0,00 4,56 0,00 4,75 0,00 33,17 3,23 36,22 14,45 0,00 0,00 3,23 0,00 0,38 0,00 0,00 3,33 0,00 4,03 0,00 2,62 0,00 80,65 3,63 1,21 0,00 2,52 0,00 2,02 0,00 0,00 2940,00 0,00 3120,00 90,00 5740,00 0,00 15990,00 120,00 0,00 0,00 750,00 0,00 120,00 0,00 0,00 9,89 0,00 10,49 0,30 19,30 0,00 53,77 0,40 0,00 0,00 2,52 0,00 0,40 0,00 0,00 990,00 0,00 1200,00 0,00 780,00 0,00 24000,00 1080,00 360,00 0,00 750,00 0,00 600,00 0,00 0,00 Nov 110 ANEXO 8. Nombres Vernaculares de las especies utilizadas por hembras y machos adultos del grupo Corral y Maramacho, ordenadas en forma descendente según las gráficas de rango abundancia. Grupo CORRAL Matapalo tajibo ♀ Corral Matapalo liana vaina larga liana vaina larga bi bi tajibo Nombre Vernacular Grupo ♂ Corral MARAMACHO Matapalo totai tajibo laurel liana espinas liana vaina larga pares chaquillo tajibo totai chaquillo motacu falso aliso liana espinas pares Granadilla totai motacu chaquillo falso aliso motacu totai bi liana espinas pares motacu Liana de flor lila tutumilla liana codo laurel tajibo liana espinas pares Liana de flor lila liana codo tutumilla Pata de michi falso aliso Pacay mango Pacay piraquina xilopia Pacay mango Pacay ambaibo trompillo Granadilla liana espinas pares laurel Bibosi Pacay uvilla piraquina xilopia uvilla mango Bibosi ambaibo piraquina negra Tusequi Pata de michi Pacay ambaibo ambaibo arbol de resina roja piraquina xilopia uvilla arbol de resina roja trompillo piraquina negra laurel Liana Canuto Tamarindillo Bibosi Liana Chaquillo cuta biribá Pata de michi liana cacho de gallo Solda Solda Tusequi piraquina negra mora Taruma Granadilla Liana Canuto Tamarindillo biribá cuta uvilla Tamarindillo chicle murure cuta biribá Tusequi Liana Chaquillo uvilla Solda Solda liana cacho de gallo chicle murure alcornoque mora Liana amarilla Taruma liana coladora Palo Cacha liana piper rupresia limoncillo proquia limoncillo liana cable no det =335 maram guapomo aceitunilla jorori Liana de flor lila panejaja II palo puja Liana patito almendrillo Maramacho alcornoque Liana Canuto rupresia limoncillo liana cable aceitunilla liana coladora Liana amarilla Liana de flor lila liana piper guapomo jorori panejaja II palo puja Liana patito Maramacho ♀ Maramacho motacu totai ♂ Maramacho motacu totai liana espinas pares tajibo laurel tutumilla liana codo Liana de flor lila ambaibo Tusequi Pata de michi chaquillo biribá Liana patito ambaibo arbol de resina roja Liana patito biribá uña de gato Pata de michi trompillo uvilla Liana amarilla Palo Cacha Tusequi chicle murure uña de gato alcornoque rupresia limoncillo jorori pacay peludo falso aliso chaquillo rupresia limoncillo jorori pacay peludo bejuco simbao paquiocillo Pata de michi uña de gato falso aliso pacay peludo Bibosi jorori alcornoque liana coladora proquia limoncillo no det =335 maramacho liana piper Solda Solda liana cable mora guapomo jorori liana cacho de gallo panejaja II bejuco simbao n/n caripe n/n palo puja Maramacho Liana patito alcornoque caripe paquiocillo piraquina negra palo puja palo corcho chicle murure Bibosi liana lechera algodoncillo Maramacho liana de hojita larga Liana Chaquillo Solda Solda liana cable caripe chicle murure liana lechera alcornoque algodoncillo palo corcho liana cable chicle murure liana lechera palo puja palo corcho algodoncillo piraquina negra paquiocillo rupresia limoncillo almendrillo Liana patito palo puja laurel Tusequi chaquillo biribá rupresia limoncillo n/n 111 ANEXO 9. Nombres Vernaculares de las especies utilizadas por el promedio hembras y machos adultos; juvenil y cría del grupo Corral y Maramacho, ordenadas en forma descendente según las gráficas de rango abundancia. ♀ Prom adul motacu tajibo Matapalo totai laurel liana vaina larga bi liana espinas pares Pacay Liana de flor lila chaquillo liana codo falso aliso tutumilla trompillo Granadilla ambaibo uvilla Tusequi piraquina xilopia biribá Bibosi Pata de michi mango Liana Chaquillo cuta liana cacho de gallo Solda Solda piraquina negra rupresia limoncillo arbol de resina roja Liana patito mora chicle murure Taruma alcornoque Tamarindillo uña de gato jorori Liana Canuto pacay peludo bejuco simbao palo puja paquiocillo liana cable Maramacho n/n aceitunilla liana coladora caripe Liana amarilla liana piper guapomo liana lechera algodoncillo panejaja II palo corcho ♂ Prom Adult tajibo motacu totai liana espinas pares Matapalo laurel Pacay tutumilla chaquillo liana vaina larga liana codo bi Liana de flor lila Pata de michi ambaibo falso aliso Bibosi piraquina negra mango Granadilla uvilla Liana Canuto piraquina xilopia Tamarindillo biribá Tusequi arbol de resina roja cuta chicle murure trompillo alcornoque Liana amarilla Palo Cacha rupresia limoncillo n/n liana coladora jorori proquia limoncillo uña de gato no det =335 maramacho liana piper pacay peludo Liana patito Solda Solda caripe liana lechera palo puja liana cable mora guapomo palo corcho algodoncillo liana cacho de gallo panejaja II paquiocillo almendrillo Nombre Vernacular Adultos tajibo motacu totai Matapalo liana espinas pares laurel liana vaina larga bi Pacay chaquillo tutumilla liana codo falso aliso ambaibo Pata de michi Granadilla Liana de flor lila Bibosi uvilla trompillo mango Tusequi piraquina xilopia biribá piraquina negra Liana Canuto Tamarindillo cuta arbol de resina roja chicle murure Liana Chaquillo rupresia limoncillo alcornoque Solda Solda liana cacho de gallo Liana patito uña de gato mora jorori Liana amarilla pacay peludo Taruma n/n liana coladora liana piper palo puja liana cable caripe proquia limoncillo no det =335 maramacho paquiocillo bejuco simbao liana lechera Palo Cacha guapomo Maramacho aceitunilla algodoncillo palo corcho panejaja II almendrillo juvenil totai liana espinas pares laurel motacu Liana de flor lila tajibo tutumilla Pacay liana codo mango ambaibo arbol de resina roja uvilla piraquina xilopia Tusequi alcornoque Pata de michi Liana patito biribá falso aliso uña de gato chaquillo rupresia limoncillo jorori pacay peludo caripe palo corcho paquiocillo chicle murure palo puja bejuco simbao algodoncillo Liana Chaquillo piraquina negra Maramacho n/n Solda Solda liana lechera cría totai laurel liana espinas pares tajibo tutumilla Liana de flor lila Pacay liana codo mango uvilla ambaibo arbol de resina roja piraquina xilopia Tusequi chaquillo alcornoque biribá Pata de michi pacay peludo jorori bejuco simbao uña de gato Liana patito falso aliso liana de hojita larga rupresia limoncillo paquiocillo palo puja palo corcho Bibosi caripe n/n algodoncillo Liana Chaquillo motacu Solda Solda liana lechera chicle murure 112 ANEXO 10.Tabla del Tiempo total y porcentaje de tiempo Invertido en el consumo de Ítems alimenticios (partes vegetales y artrópodos) por hembras y machos adultos, juveniles y crías de Callicebus modestus, durante el periodo de estudio en la Estancia San Miguel. Tiempo de Alimentación Partes animales y vegetales ♀ (s) ♀ (%) ♂ (s) ♂ (%) Adult(s) Adult(%) Juvenil(s) Juvenil(%) Cría(s) Cría(%) hoja tierna/rebrote 10145 3,98 5045 2,16 7595 3,11 4740 2,02 3180 1,62 hoja 8970 3,52 8645 3,71 8807,5 3,61 8880 3,78 6780 3,46 hoja amarilla 450 0,18 0 0,00 225 0,09 0 0,00 0 0,00 guia de tallo/liana 8730 3,43 7925 3,40 8327,5 3,41 10740 4,58 6060 3,09 boton floral 2940 1,15 4020 1,72 3480 1,43 10760 4,58 10680 5,44 flor madura 35830 14,06 35450 15,21 35640 14,61 30480 12,99 31860 16,24 fruto verde 4530 1,78 3630 1,56 4080 1,67 2400 1,02 2220 1,13 fruto maduro 139065 54,58 134790 57,83 136927,5 56,13 115860 49,37 90420 46,08 fruto seco /semilla 6990 2,74 9420 4,04 8205 3,36 28200 12,02 26520 13,52 gusanos/larvas 16495 6,47 13435 5,76 14965 6,13 9600 4,09 11400 5,81 araña 1320 0,52 690 0,30 1005 0,41 0 0,00 120 0,06 hormigas 13100 5,14 6010 2,58 9555 3,92 8340 3,55 3490 1,78 saltamontes 360 0,14 570 0,24 465 0,19 0 0,00 0 0,00 insectos/no id 3330 1,31 840 0,36 2085 0,85 1920 0,82 840 0,43 mariposa ? 0 0,00 0 0,00 0 0,00 0 0,00 120 0,06 termita c/alas 2550 1,00 2610 1,12 2580 1,06 2760 1,18 2520 1,28