notas introductorias sobre ingenieria quimica
Anuncio

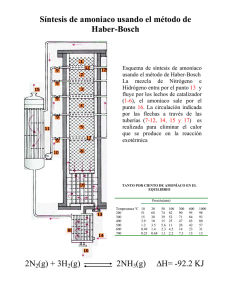
NOTAS INTRODUCTORIAS SOBRE INGENIERIA QUIMICA Dr. Ing. Qco. Sergio A. Giner (recopilación) Profesor Adjunto Simulación de Procesos I y II Área Departamental Ingeniería Química Facultad de Ingeniería, UNLP 2008 1 ¿QUE ES LA INGENIERIA QUIMICA? En términos generales, la ingeniería química es la aplicación de la ciencia, en particular, química, física, biología y matemática, al proceso de convertir materias primas o productos químicos en productos más útiles, aprovechables o de mayor valor. En términos más precisos, se puede decir que: Ingeniería Química es la rama de la Ingeniería que se dedica al estudio, síntesis, desarrollo, diseño, operación y optimización de todos aquellos procesos industriales que producen cambios físicos, químicos y/o bioquímicos en los materiales. La definición que aparece actualmente en la Constitución del Instituto Estadounidense de Ingenieros Químicos (AIChE) es*: “Ingeniería Química es la profesión en la cual el conocimiento de la matemática, química y otras ciencias básicas, ganados por el estudio, la experiencia y la práctica, es aplicado con juicio para desarrollar maneras económicas de usar materiales y energía para el beneficio de la humanidad”. Por ser Ingeniería, se necesita realizar estas actividades atendiendo a razones de tiempos y costos. Ejemplos (entre muchos otros): (1) Producción de amoníaco a partir del nitrógeno del aire y de hidrógeno (2) Manufactura de cloro, hidrógeno e hidróxido de sodio (soda cáustica) mediante la electrólisis de salmuera (3) Producción de ácido sulfúrico por el método de contacto (4) Producción de plásticos (polietileno, polipropileno, PVC) por polimerización de insumos petroquímicos básicos (5) destilación y procesamiento en refinerías de petróleo para producir gas, combustibles y lubricantes (6) Producción de Aluminio por reducción electroquímica del óxido (Al2O3) (7) Producción de leche deshidratada en polvo a partir de la leche líquida natural bovina (8) Extracción de aceite de soja desde las semillas, utilizando un solvente adecuado (9) producción de biocombustibles por transesterificación de aceites vegetales (biodiesel) o por fermentación de cereales o azúcar (bioetanol) (10) Deposición de metales (en forma de vapor) para circuitos electrónicos. Además de intervenir en la manufactura de productos útiles, la ingeniería química, en su actividad de investigación y desarrollo, es protagonista de la creación de nuevos productos y * extraído del sitio www.ingenieriaquimica.org 2 técnicas. Un profesional que desarrolle cualquiera de estas actividades se denomina Ingeniero Químico. La Ingeniería Química, principalmente, involucra el diseño y la operación de procesos químicos para la manufactura en escala industrial. Los ingenieros químicos dedicados a estos aspectos suelen denominarse Ingenieros de Procesos. El siguiente diagrama ilustra las interacciones de la ingeniería química, con sus ciencias sustentadoras, y las limitantes socio-ambientales Conceptos de Bioquímica y Tecnología de Alimentos Biología Ecología Economía Aplicación de productos y/o procesos Química Física INGENIERIA QUIMICA Matemática Consideraciones éticas Legislación Opinión Pública ALGUNAS NOTAS DE HISTORIA Y DE LA IDENTIDAD DE LA INGENIERIA QUIMICA La Ingeniería Química surgió como una disciplina específica hacia fines del siglo XIX, cuando se aceleró la revolución industrial. Se había creado la máquina de vapor, la máquina frigorífica, el ferrocarril, los motores a nafta (ciclo Otto) y Diesel, se mejoraban los aceros y hormigones. Los países centrales buscaban formas de expandir su economía, exportando productos manufacturados a otros países y compitiendo con sus vecinos por los mercados. Los desarrollos químicos que se hacían a nivel de laboratorio (sales, ácidos, explosivos, bases, fertilizantes) debían pasar a escala industrial. Se necesitaban nuevos combustibles, más eficientes, ir reemplazando la economía basada en la energía de la máquina de vapor a carbón, por otra fundada en la explotación del petróleo, que a su vez debía separarse en numerosos combustibles diferentes. Allí, además de química y procesos de purificación, se necesitaban nociones de economía, experiencia práctica y conocimiento de realización de obras en gran escala. El problema surgía de que no siempre el mejor método de síntesis a escala de laboratorio, era el mejor a escala industrial, especialmente porque, en el laboratorio, la palabra “mejor” podía involucrar la facilidad de ser llevada a cabo en escala pequeña, conduciendo a un producto de gran pureza. Pero a escala industrial, las limitantes económicas, de espacio, de tiempo, y de eficiencia energética podían cambiar el criterio. Con este fin, los químicos con orientación práctica, se vincularon a los ingenieros mecánicos, volviéndose con el tiempo químicos industriales. No obstante, la inclinación era producir procesos “discontinuos” (cargar, procesar, descargar), adecuados para bajas producciones, e ineficientes para la producción de gran escala (por los “tiempos muertos” de carga, descarga y limpieza). Para que la ingeniería química tuviera una identidad, más allá de la “mezcla” de química industrial e ingeniería mecánica, era necesario desarrollar conceptos propios. La necesidad de montar procesos continuos controlables posiblemente forzó la evolución conceptual. 3 Durante esta evolución, rápida por cierto, que tuvo lugar en los últimos años del siglo XIX y primeros años del siglo XX, especialmente en Europa y Estados Unidos, se fue llegando a la conclusión de que si bien cada industria química tenía materias primas específicas y un diagrama de producción específico, éste estaba conformado por un número relativamente reducido de “etapas” distintivas. Por ejemplo, el principio utilizado para separar el Gas Oil de la Nafta es el mismo que el empleado para separar el agua del alcohol etílico luego de una fermentación, aunque los compuestos en sí difieran apreciablemente. Este concepto, el de la Destilación, fue una de los primeros en la división de la Ingeniería Química en “Operaciones Unitarias u Operaciones Físicas” y “Procesos Unitarios”. Las primeras comprenden toda etapa donde puede haber un cambio físico o fisicoquímico, pero no una reacción química determinante, y así se incorporaron la Destilación, la Extracción Sólido Líquido (por ejemplo, para obtener el aceite de la soja), la extracción líquido-líquido (valioso proceso en la ingeniería química, cuando se requiere separar uno o más componentes de una mezcla líquida), la absorción de gases (que se utiliza, entre otros ejemplos, para purificar los efluentes gaseosos de las chimeneas industriales), Secado, Humidificación, Enfriamiento (por ejemplo, la torre de la Petroquímica de Ensenada, que simplemente enfría agua de proceso, y que parece un paraboloide de una hoja), bombeo de fluidos, reducción del tamaño de partículas, concentración (por ejemplo, de jugo de manzana o naranja, de proteínas de suero de quesería, de una solución de detergente), filtración. Las etapas que incorporan reacciones químicas, para dar lugar a nuevos productos, se llamaron procesos unitarios, y la ingeniería química se dedicó a estudiar y desarrollar los “espacios” donde pudieran tener lugar una diversidad de reacciones: Por ejemplo, el reactor tanque agitado discontinuo (TAD), el reactor tanque agitado continuo (TAC) y el reactor tubular (TUB), éste únicamente utilizado en procesos continuos. Es evidente que el reactor más intuitivo es el TAD, que correspondería al escalado del reactor químico de laboratorio por excelencia: el tubo de ensayo. Uno de los objetivos básicos de los procesos unitarios, que eventualmente devinieron en “Ingeniería de las Reacciones Químicas”, es lograr que los procesos de reacción se realicen en las condiciones más controlables, menos drásticas, costosas y peligrosas, por ejemplo a menores presiones y temperaturas. El desarrollo de catalizadores, sustancias químicas que formalmente no intervienen en la reacción, pero que permiten llevar a cabo las reacciones químicas mucho más rápidamente, y el diseño de los reactores químicos son actividades interrelacionadas. Uno de los pilares de la Ingeniería de los Reacciones Químicas es el Estudio de la velocidad de las reacciones químicas, la Cinética Química. El desarrollo de expresiones matemáticas que representen la cinética química de un proceso constituye una gran ayuda para el diseño y optimización de los reactores*. Por su parte, las “Operaciones Unitarias” han evolucionado mediante la aplicación sistemática de los fenómenos de transporte de masa, calor y cantidad de movimiento. El primero es específico de la ingeniería química, y el que aporta la mayor identidad; el segundo es muy importante, pero es estudiado también por la ingeniería mecánica, aunque no para aplicarlo en procesos químicos. Finalmente, el estudio de los fenómenos de transporte de cantidad de movimiento, es aplicable a la mecánica de fluidos, disciplina que el ingeniero químico comparte con los ingenieros hidráulicos y aeronáuticos, aunque los campos de aplicación de esta disciplina son diferentes según el tipo de ingeniería. El ingeniero químico utiliza la mecánica de fluidos para calcular redes de cañerías en plantas, sistemas de ventilación, potencia de bombas y compresores, distribución de velocidades en caños y columnas de destilación, etc. Los fenómenos de transporte permiten una descripción detallada de los fenómenos involucrados, y su aplicación va en aumento por la creciente información experimental y teórica disponible para determinar los “coeficientes” de transporte de los * Nótese que la palabra “Reactor” en Ingeniería Química surge, por supuesto, de la “reacción química”, en forma análoga a la del reactor nuclear, cuyo nombre surge por ser el continente de una reacción, del núcleo de un átomo. Sin embargo, el reactor de una aeronave, lo que normalmente se llama turbina, proviene de la utilización del principio de acción y reacción, no por la reacción de combustión que también ocurren en su interior. El cilindro de un automóvil no se llama reactor puesto que la reacción que allí ocurre tiene el objetivo de producir energía, y no un producto útil. 4 complejos modelos matemáticos resultantes, que están siendo organizados en programas propios y comerciales, utilizándose así en forma cada vez más extendida la velocidad de cálculo de las computadoras. ORIENTACIONES ACTUALES DE LA INGENIERIA QUIMICA A la rama que podríamos denominar “clásica” de la ingeniería química (la orientación procesos), representativa de la industria química inorgánica, orgánica, del petróleo y la petroquímica, se le suma el gran desarrollo de la industria de las fermentaciones, para transformar materias primas de origen biológico como el azúcar, en productos industriales, tales como el alcohol etílico (obsérvese el fenómeno brasileño de los autos que funcionan a etanol), y en la producción de alimentos y antibióticos (por ejemplo, la fructosa se fabrica a partir de glucosa en un proceso que utiliza la enzima glucosa isomerasa como catalizador biológico). Esta industria ha enriquecido a la ingeniería química que también puede aplicar sus conceptos al diseño y optimización de estos procesos de fabricación. A los procesos fermentativos, considerados los precursores de la biotecnología por utilizar catalizadores de origen biológico (enzimas) en procesos de interés industrial, se les suma la pujante industria de los alimentos que, con la ayuda de los ingenieros químicos, ha creado una rama nueva de la ingeniería química, que en muchas facultades se enseña como una carrera separada, la ingeniería de los alimentos. Esta abarca la industria de la conservación de materias primas alimenticias (cereales y oleaginosas, frutas y hortalizas, productos lácteos, huevos, productos cárneos, grasas y aceites) y su procesamiento, que en Argentina adquiere una significación muy particular. Los libros de Ingeniería de Alimentos, se basan en una clasificación aproximada de Operaciones Físicas proveniente de la Ingeniería Química, para sintetizar la descripción de etapas de concentración por evaporación y procesos de membrana, deshidratación de alimentos, refrigeración y congelación de alimentos, tratamientos térmicos para destrucción de microorganismos, estudio de la transferencia de materia durante el almacenamiento de alimentos envasados, etc. Estos temas requieren que los ingenieros químicos refuercen sus conocimientos de biología y bioquímica, que se imparten en la actual Orientación Alimentos de la Carrera de Ingeniería Química de la UNLP. En las últimas dos décadas creció la presión pública por incluir restricciones ambientales a los efluentes industriales, sean estos gaseosos, líquidos y sólidos. Esto motivó que el Clásico Manual del Ingeniero Químico, de Perry, incorporara, en sus últimas ediciones, un capítulo dedicado al Manejo de Desperdicios, y que hayan surgido manuales, publicaciones e investigaciones para el tratamiento de los efluentes, o bien para el desarrollo de tecnologías limpias o “sostenibles”. Los procesos sostenibles suelen estar inscriptos en un ciclo cerrado de materias primas y productos, donde se reaprovechan los desechos industriales, y los desechos del consumo de productos, y se reciclan para incorporarlos como materias primas del mismo u otros procesos. La Orientación Ambiental de Ingeniería Química de la UNLP, estudia los procesos de tratamiento de efluentes, tecnologías limpias y descontaminación dividiendo el estudio en “contaminación de la atmósfera, del agua, y del suelo”. Una orientación que todavía no ha sido definida como tal, y que tal vez pueda ser absorbida por la Orientación Procesos, es el estudio de las nuevas formas de producción de energía que minimicen las llamadas “emisiones de invernadero”. El desarrollo industrial, en el cual la ingeniería química ha tenido gran responsabilidad, se sustenta en la generación de energía quemando combustibles fósiles, generalmente derivados del petróleo: como se sabe esas reacciones dan lugar a dióxido de carbono y vapor de agua, más calor (aunque también producen óxidos de azufre y un poco de óxidos de nitrógeno, responsables ambos de lluvia ácida). En la última reunión de la Comisión Internacional de Cambio Climático de París (Enero de 2007), varios centenares de científicos de gran trayectoria llegaron a la conclusión de que los desarrollos industriales de la humanidad fueron responsables, en gran medida, del aumento de las temperaturas promedio que se vienen registrando en el mundo, y que provocan fusión de los hielos polares, con aumento del nivel del mar y casi seguro, sequías en algunos lugares, inundaciones en otros y, junto al incesante crecimiento de la población mundial, disminución de 5 las reservas de agua potable, tormentas tropicales de mayor fuerza destructiva, y desarreglos climáticos de todo tipo. El aumento de la proporción de CO2 en el aire (que es actualmente mayor de 0,035% v/v) deja pasar hacia el planeta la radiación solar, pero retiene en mayor medida que antes la reflexión de esta en La Tierra. El Efecto Invernadero es normal y posibilita la vida en el planeta, pero el exceso de CO2 produce un aumento del Efecto Invernadero, llamado “recalentamiento global”. El apagón de la Torre Eiffel de 5 minutos promovido por Greenpeace en Febrero de 2007 tuvo la intención de alertar sobre este problema, indicando que “todavía no es demasiado tarde para cambiar”. En consecuencia, sea porque el petróleo puede agotarse pronto, sea porque se está tomando conciencia en el poder empresario y gubernamental de que la quema de combustibles fósiles debe ir reduciéndose en forma consistente, se está, ahora mismo, atravesándose un período de transición hacia la utilización de biocombustibles, como el biodiesel y el bioetanol, y, mejor aún, hacia la utilización del hidrógeno como fuente de energía (por ejemplo, para celdas de combustible). También jugarán roles importantes energías producidas por métodos donde la ingeniería química no tiene, en principio, demasiada injerencia, como los sistemas fotovoltaicos (paneles solares) y la eoloelectricidad. No obstante, la posible utilización de celdas de combustible (fuel cells) como medio de producción de energía eléctrica mediante la reacción electroquímica de hidrógeno y oxígeno para dar agua, permite un excelente campo de investigación para los ingenieros químicos (Las preguntas como: ¿de donde sacar el hidrógeno?, ¿hay que acumularlo, o producirlo inmediatamente antes de su utilización?. ¿Es contaminante producir hidrógeno de fuentes que no sean agua? no han sido debidamente aclaradas). ALGUNOS EJEMPLOS CARACTERISTICOS DE LA INDUSTRIA DE PROCESOS Acido sulfúrico El ácido sulfúrico es un ácido mineral fuerte. Es soluble en agua en todas las concentraciones, y conocido en la antigüedad como “aceite de vitriol”, nombre acuñado en el siglo VIII por el alquimista Jabir ibn Hayyan, quien, posiblemente, haya sido su descubridor. El ácido sulfúrico tiene muchas aplicaciones, y su producción anual es mayor que la de cualquier otra sustancia química, 165 millones de toneladas en 2001, por un valor de 8000 millones de dólares. Los usos principales incluyen el procesamiento de minerales, la manufactura de fertilizantes, la destilación del petróleo, el procesamiento de efluentes, y la síntesis química. Debe indicarse, asimismo, que muchas proteínas están compuestas por aminoácidos que contienen azufre (como la cisteína y metionina), y que producen ácido sulfúrico cuando se las metaboliza en el organismo. En 1831, Peregrine Phillips, Británico, involucrado en el comercio de vinagre, patentó un proceso mucho más económico que los previos para fabricar trióxido de azufre y ácido sulfúrico concentrado, conocido como Proceso de Contacto. Esencialmente, todo el suministro actual de ácido sulfúrico se produce por este método. En la primera etapa, el azufre se quema para producir dióxido de azufre (1) S(s) + O2(g) → SO2(g) o se tuesta un mineral como pirita en exceso de aire: (1’) 4 FeS 2 ( s ) + 11O2 ( g ) → 2 Fe2 O3 ( s ) + 8SO2 ( g ) En ambas reacciones, el exceso de aire permite luego oxidar el dióxido a trióxido de azufre (reacción reversible), en presencia de un catalizador de vanadio (ésta es la reacción central del proceso) (2) 2SO2 ( g ) + O2 ( g ) → 2 SO3 ( g ) ∆H= -196 kJ mol-1 6 Finalmente, el trióxido de azufre se trata con agua (usualmente en la forma de H2SO4 al 9798% con 2-3% de agua para producir ácido sulfúrico de 98-99%) (3) SO3(g) + H2O(l) → H2SO4(l) Nótese que la disolución directa de SO3 en agua es impráctica por la elevada exotermia de la reacción. Se forman neblinas de producto en lugar de líquido. En consecuencia, el SO3 es absorbido en H2SO4 para producir H2S2O7, que es luego diluido para formar ácido sulfúrico. (3) H2SO4(l) + SO3 → H2S2O7(l) (denominado ácido sulfúrico fumante u oleum) El compuesto formado reacciona con agua para dar H2SO4 concentrado. (4) H2S2O7(l) + H2O(l) → 2 H2SO4(l) Figura de la parte final del proceso de contacto para la fabricación de H2SO4. El Oleum se considera aquí H2SO4 al 98,5%. Condiciones operativas de la conversión de dióxido en trióxido de azufre SO2 + O2 (del aire) en proporción de volumen 1:1 400-450ºC 1-2 atm de presión Explicando las condiciones 7 * Las proporciones de dióxido de azufre y oxígeno La mezcla que ingresa al reactor tiene iguales proporciones en volumen de dióxido de azufre y oxígeno. Como a bajas presiones, la proporción volumétrica es casi equivalente a la proporción molar, esto significa un exceso de oxígeno respecto de las proporciones especificadas en la ecuación 2 SO2 ( g ) + O2 ( g ) → 2 SO3 ( g )) ∆H= -196 kJ mol-1 De acuerdo al principio de Le Chatelier, el incremento en la concentración de oxígeno en la mezcla causa un desplazamiento en la posición del equilibrio hacia la derecha. Dado que el oxígeno se obtiene del aire, implica una forma muy económica de incrementar la conversión de dióxido en trióxido de azufre ¿Por que no usar una proporción aún más alta de oxígeno entonces? El equilibrio se desplazaría mucho hasta casi una reacción irreversible, no obstante, la producción de trióxido sería muy baja por hora dado que un gran exceso de oxígeno implicaría ocupar casi todo el espacio de reacción con O2 y N2 con muy poco SO2 para reaccionar con O2. En consecuencia, el aumento de la proporción de O2 aumenta la conversión de dióxido de azufre convertido, pero al mismo tiempo se reduce la cantidad de trióxido de azufre producido cada día. La mezcla 1 : 1 da el mejor resultado posible de trióxido de azufre. * La temperatura Consideraciones del equilibrio Hay una necesidad de desplazar la posición del equilibrio tanto como sea posible a la derecha para producir la máxima cantidad de trióxido de azufre en la mezcla del equilibrio. La reacción directa (producción de trióxido de azufre) es exotérmica. 2 SO2 ( g ) + O2 ( g ) → 2 SO3 ( g )) ∆H= -196 kJ mol-1 De acuerdo al principio de Le Chatelier, el equilibrio se favorecería si se disminuye la temperatura, pues el sistema responderá, para contrarrestar, produciendo más calor. En consecuencia, para lograr la mayor proporción de trióxido de azufre posible en la mezcla en equilibrio, necesitaremos una temperatura lo más baja posible. Sin embargo, 400 - 450°C no son temperaturas precisamente bajas Consideraciones de velocidad de reacción Cuanto menor sea la temperatura de reacción, la reacción se volverá más lenta, pero el fabricante tratará de producir tanto trióxido de azufre como sea posible por día. Entonces, no tendrá sentido reducir la temperatura para tener una alta proporción de trióxido de azufre en el equilibrio si esta reacción puede tomar años para producirse y alcanzar ese equilibrio. En realidad se necesita alcanzar el equilibrio en el poco tiempo que los gases estén en contacto con el catalizador en el reactor 8 Solución de compromiso 400 - 450°C es un rango de temperaturas de compromiso para producir una cantidad bastante alta de trióxido de azufre en la mezcla de equilibrio, en un tiempo muy corto. * Efecto de la presión Consideraciones del equilibrio 2 SO2 ( g ) + O2 ( g ) → 2 SO3 ( g )) ∆H= -196 kJ mol-1 Obsérvese que hay 3 moléculas en el lado de los reactivos y sólo 2 en los productos. De acuerdo al principio de Le Chatelier, el incremento de presión del sistema favorecerá la reacción que produzca menos moléculas, de manera que la presión se reduzca nuevamente. Así, para lograr una alta proporción de trióxido de azufre en la mezcla de equilibrio, se necesita tanta presión como sea posible. Las altas presiones también aumentan la velocidad de reacción. Sin embargo, en la industria la reacción se lleva a cabo a presiones cercanas a la atmosférica. Consideraciones económicas Aún a éstas presiones relativamente bajas, la conversión de dióxido a trióxido de azufre es de 99.5%, por lo que algún pequeño aumento que pueda lograrse por aumentar la presión no vale la pena económicamente: los equipos que resisten presiones altas son mucho más caros de fabricar y operar * El catalizador Consideraciones del equilibrio El catalizador no tiene un efecto sobre la composición de la mezcla en equilibrio, sino sobre la velocidad de reacción. En ausencia de un catalizador, la reacción es tan lenta que prácticamente no ocurre. El catalizador permite lograr una velocidad de reacción suficiente para que sea económicamente viable, aprovechando los cortos tiempos de contacto de los gases durante su paso por el reactor. Traducido y adaptado de www.chemguide.co.uk (Clark, J. (2008)), y http://en.wikipedia.org/wiki/Sulfuric_acid El ácido sulfúrico es un “commodity” importante de la industria química, y un indicador del poderío industrial de las naciones (Vian Ortuño, 1999). En la Argentina se fabrica, por ejemplo, por la Fábrica Militar de Río Tercero, Córdoba y por la compañía ICI-Duperial, en San Lorenzo, cerca de Rosario, Santa Fé; También por BASF y Meranol. (Cámara de la Industria Química y Petroquímica, 2007). 9 Amoníaco, Proceso Haber El proceso Haber (Clark, 2007) combina nitrógeno del aire con hidrógeno (todavía extraído del reformado de gas natural (metano) para formar amoníaco. Esto “fija” el nitrógeno atmosférico para la fabricación de fertilizantes, por ejemplo urea. La reacción es reversible y exotérmica. Así, pasa el N2 del aire de una forma que no puede aprovecharse mayormente para el crecimiento de las plantas, a otra que sí puede aprovecharse, especialmente luego de transformar el amoníaco en sulfato de amonio, o en nitratos. N 2 ( g ) + 3H 2 ( g ) ⇔ 2 NH 3 ( g )) ∆H= -92 kJ mol-1 Se muestra a continuación un diagrama de flujo esquemático del proceso Haber: N2 (g), H2 (g) Ar (g) REACTOR CATALITICO N2 (g), H2 (g) Ar (g) N2 (g) + 3H2 (g)Æ 2 NH3 (g) 400-450 ºC 200 atm Catalizador de hierro Conversión, 15%, por paso N2 (g), H2 (g) Ar (g) NH3 (g) Algunas notas sobre las condiciones operativas El catalizador El catalizador es un poco más complicado que el hierro puro. Contiene hidróxido de potasio como promotor, una sustancia que aumenta la eficiencia del catalizador. La presión Unas 200 atmósferas. Reciclo de reactivos En cada paso de los gases por el reactor, sólo cerca del 15% del nitrógeno e hidrógeno se convierten en amoníaco. Mediante el reciclo del nitrógeno e hidrógeno no reaccionados, la conversión global se acerca al 98%. Descripción de las condiciones * Las proporciones de nitrógeno e hidrógeno Son las estequiométricas. En algunas reacciones, se podría utilizar un exceso de los reactivos siempre y cuando se desee convertir lo más posible el otro. Pero esto no se da en este caso. * La temperatura Consideraciones del equilibrio Es necesario desplazar la posición del equilibrio lo más posible hacia la derecha en la reacción, para producir la máxima cantidad posible de amoníaco en la mezcla de equilibrio. La reacción directa (la proporción de amoníaco) es exotérmica. 10 N 2 ( g ) + 3H 2 ( g ) ⇔ 2 NH 3 ( g )) ∆H= -92 kJ mol-1 De acuerdo al Principio de Le Chatelier, el equilibrio se favorecerá si se reduce la temperatura. El sistema responderá moviendo la posición del equilibrio para contrarrestar esto, en otras palabras, para producir más calor. Así, a efectos de obtener la mayor proporción posible de amoníaco en la mezcla de equilibrio, se necesitará a una temperatura lo más baja que se pueda. Sin embargo, la temperatura de 400 - 450°C que se usa no constituye una temperatura baja. Consideraciones de velocidad de reacción Cuanto más baja es la temperatura que se use, menor será la velocidad de reacción. Dado que la compañía tratará de producir tanto amoníaco como sea posible por día, no tendrá sentido lograr una mezcla de equilibrio con una gran proporción de amoníaco si se necesitan años para lograrla. Los reactivos deberán llegar al equilibrio en el reactor, en el corto tiempo en que estarán en contacto con el catalizador. Solución de compromiso El rango de temperaturas de 400 - 450°C es un valor de compromiso para producir una proporción razonable de amoníaco en la mezcla de equilibrio (aún cuando la conversión por paso sea sólo del 15%), pero en un tiempo muy breve. * La presión Consideraciones de equilibrio N 2 ( g ) + 3H 2 ( g ) ⇔ 2 NH 3 ( g )) ∆H= -92 kJ mol-1 Nótese que hay 4 moléculas en el miembro izquierdo de la ecuación, y sólo 2 en el derecho. Esto tiende a bajar la presión. De acuerdo con el principio de Le Chatelier, si se aumenta la presión, el sistema va a reaccionar para contrarrestar la acción, desplazando el equilibrio hacia la derecha para bajar la presión. Por eso se utiliza una presión alta de 200 atm. Consideraciones de velocidad de reacción El incremento de la presión aproxima las moléculas entre sí, e incrementa la posibilidad de choque entre los reactivos, y contra la superficie del catalizador. En consecuencia, resulta beneficioso incrementar la presión también desde el punto de vista de la cinética de reacción. Consideraciones económicas Las presiones muy altas son doblemente costosas. Se necesita construir cañerías muy resistentes, aumentando los costos de inversión. Al mismo tiempo, las altas presiones son costosas de generar y mantener. El compromiso 200 atmósferas representan un valor de compromiso seleccionado sobre una base económica. Si la presión es muy alta, el costo de generación excede el valor extra que se puede ganar por vender más amoníaco. 11 * El catalizador Consideraciones de equilibrio El catalizador no tiene efecto sobre la proporción de amoníaco en el equilibrio. Su función es aumentar la velocidad de la reacción. Consideraciones de velocidad de reacción En ausencia de un catalizador, la reacción es tan lenta que virtualmente no ocurre. El catalizador asegura que la reacción sea suficientemente alta para lograr el equilibro en el breve período de tiempo que los gases tardan en atravesar el reactor. Separación del amoníaco Cuando los gases dejan el reactor, lo hacen a alta temperatura y presión. El amoníaco se licúa fácilmente bajo presión, siempre y cuando la temperatura es no sea muy elevada. Así, la temperatura de la mezcla es reducida para condensar el amoníaco a líquido. El nitrógeno y el hidrógeno se mantienen gaseosos aún a tales presiones y pueden reciclarse. 12 Producción electroquímica de aluminio El mineral del cual se extrae el aluminio, comúnmente llamado bauxita, es abundante y se encuentra principalmente en áreas tropicales y subtropicales: África, Antillas, América del Sur y Australia. Hay también algunas minas de bauxita en Europa. Este mineral se refina para obtener óxido de aluminio (alúmina), y luego, a través de un proceso electrolítico ser reducida a aluminio metálico. Las plantas de producción de aluminio primario están distribuidas por todo el mundo, especialmente en zonas donde la energía eléctrica sea abundante y barata. Se requieren de dos a tres toneladas de bauxita para producir una tonelada de alúmina, y, a su vez, dos toneladas de ésta última para dar lugar a una tonelada de aluminio metálico (del sitio www.aluar.com.ar, planta de Puerto Madryn, Chubut, Argentina) 13 Producción de polietileno Es un ejemplo clásico de la polimerización aditiva n CH 2 = CH 2 → [ −CH 2 − CH 2 − ]n El valor de “n” es variable, entre 2000 y 20000. Se fabrica a aproximadamente 200ºC y a cerca de 2000 atmósferas de presión. Se utiliza una impureza de oxígeno como iniciador. Propiedades y usos Polietileno de baja densidad El polietileno de baja densidad (PEBD, o LDPE) es muy ramificado, y esto impide a las cadenas estar muy cerca unas de las otras. Siempre en estado sólido, aquellas regiones donde las cadenas están muy cerca pueden adoptar la forma cristalina, mientras que cuando el ordenamiento es más al azar, están en estado amorfo. El PEBD tiene una proporción elevada de regiones amorfas. El PEBD se ha utilizado en las bolsas de supermercado y para otros fines donde se requiere un material flexible sin mucha resistencia mecánica Polietileno de alta densidad El polietileno de alta densidad (PEAD ó HDPE), se fabrica bajo distintas condiciones a partir de PEBD. El proceso se realiza a 60ºC, a pocas atmósferas de presión, empleando un catalizador Ziegler-Natta o compuestos metálicos. Los catalizadores Ziegler-Natta son mezclas de compuestos de cloruro de titanio (III) TiCl3, o cloruro de Titanio (IV) TiCl4, y de compuestos de aluminio tales como trietilo de aluminio Al(C2H5)3. Los catalizadores en uso cambian con el tiempo de acuerdo a los desarrollos tecnológicos. Los catalizadores mencionados trabajan en forma diferente en éste proceso a baja presión, y dan lugar a cadenas menos ramificadas. La cristalinidad es de 95% o mayor. El plástico es más fuerte y tiene un punto de fusión mayor. La mayor densidad resulta del mejor aprovechamiento del espacio por las moléculas menos ramificadas. Se ha utilizado para hacer botellas de plástico y accesorios donde hace falta mayor resistencia. (Traducido y adaptado de Clark, J(2007), www.chemguide.co.uk). Diagrama del sitio http://www.bvsde.opsoms.org/sde/ops-sde/bvsde.shtml (Organización panamericana de la salud) 14 Procesamiento de maíz por molienda húmeda Este es uno de los procesos característicos de la agroindustria/ tecnología de alimentos y consiste en separar los componentes del maíz, principalmente almidón, un producto rico en proteínas, otro producto rico en fibra y aceite comestible. El almidón por su parte puede hidrolizarse enzimáticamente a glucosa, la que puede isomerizarse a fructosa, o fermentarse para dar alcohol etílico (bioetanol) (Giner, 2007, Maestría en Tecnología e Higiene de los Alimentos, UNLP) Maíz limpio Tanques de maceración Aguas de maceración Molienda+ tamización húmeda Separadores de germen Lavado + Expulsión de humedad + secado Germ meal Germen Evaporadores Separadores centrífugos Cáscara y fibra Gluten Filtración Extractores con solvente ACEITE CRUDO CEF GLUTEN FEED Filtración, decoloración, desodorizado Secado y Molienda GLUTEN MEAL Aceite Refinado Almidón sin lavar Lavado en hidrociclón Hidrólisis Secado Almidón Glucosa Tostado Dextrinas 15 ALGUNOS DATOS DE LA INGENIERIA QUIMICA EN LA ARGENTINA LA FACULTAD DE INGENIERIA QUIMICA DE SANTA FE (www.fiqus.unl.edu.ar) La Asociación Argentina de Ingenieros Químicos (http://www.aaiq.org.ar) tuvo sus orígenes en la ciudad de Santa Fe el 10 de diciembre de 1928, cuando los primeros egresados de la Facultad de Ingeniería Química de Santa Fe, que había sido fundada en 1918, decidieron formar un centro que agrupe a los Ingenieros Químicos. En esa primera comisión directiva fue elegido como presidente el Ing. G. Maidana, como secretario al Ing. M. Schivazappa y como vocales los Ing. J. Salgado, G. Berraz, R. Contini, A. Abbate y J. Cruellas. En esos años, la AAIQ funcionó en la ciudad de Santa Fe, hasta ese momento sede de la única Facultad de Ingeniería Química del país. Los profesionales de la Ingeniería Química tuvieron desde entonces una activa participación en la naciente industria nacional, colaboraron en la tecnificación del agro y en la industrialización de sus productos. Dieron su aporte en temas tales como el saneamiento y potabilización de las aguas, en producir petróleo y acero y, por otra parte, contribuyeron a crear cientos de empresas Pymes. Hoy la Facultad de Ingeniería Química de la Universidad Nacional del Litoral (UNL), en Santa Fé, aquilata una rica historia, dio lugar al desarrollo de centros de investigación de la UNL y el CONICET, a la vez que un muy buen presente. 16 UNIVERSIDAD NACIONAL DE LA PLATA Y POLO PETROQUIMICO CERCANO http://www.ing.unlp.edu.ar/dquimica En las Universidad de La Plata, la Carrera de Ingeniería Química tuvo el apoyo inicial de los Químicos Industriales de la Facultad de Ciencias Exactas, pero se estableció en el Departamento de Ingeniería Química de la Facultad de Ingeniería. Con el continuo respaldo de la Facultad de Ciencias Exactas para las asignaturas básicas de Química General, Orgánica, Analítica, Fisicoquímica, e Ingeniería Bioquímica, el Departamento de Ingeniería Química de la Facultad de Ingeniería de la UNLP permitió, desde aproximadamente 1950, la graduación de cerca de 1000 ingenieros químicos. Se desarrollaron asignaturas propias como, entre otras, fenómenos de transporte, ingeniería de las operaciones físicas, termodinámica para ingenieros químicos, simulación de procesos, ingeniería de las reacciones químicas, electroquímica y optimización de procesos. También enriquece el proceso de enseñanza aprendizaje la condición de docentes/investigadores de buena parte de su plantel docente, quienes investigan en institutos cercanos, y la experiencia en “know how” de aquellos que trabajan en la industria. Los ingenieros químicos de la UNLP han trabajado en la cercana Destilería La Plata (DLP) de Yacimientos Petrolíferos Fiscales (hoy Repsol-YPF), en el Polo Petroquímico creado contiguo a la DLP, como la ex- Petroquímica General Mosconi (Benceno Tolueno Xilenos y aditivos antidetonantes), Maleic (Anhídrido Maleico), Polibutenos (Poliisobutileno) Petroken (Polipropileno y otros), y en industrias químicas (como ATANOR) y de alimentos (Molinos Río de La Plata, ARCOR, Productos de maíz, etc) de todo el país, además de las farmacéuticas (Bagó, Abbot, Roemmers, etc). Varios de sus docentes han escrito libros y apuntes sobre Fenómenos de Transporte, Diseño de Reactores Químicos, Programación de Computadoras para Simulación de Procesos, Termodinámica de sistemas multicomponentes, Control de Procesos, Evaluación Económica de Proyectos, entre otros. También se ha desarrollado la Electroquímica, para comprender la fabricación de productos como el aluminio, entender y prevenir los mecanismos de la corrosión de metales, y estudiar la electroprotección de superficies, entre muchas otras aplicaciones. Actualmente la carrera presenta las orientaciones de procesos, alimentos y ambiental, que se imparte entre el 9 y 10º semestres. 17 En círculo rojo se muestra la ex- Petroquímica General Mosconi, hoy parte del complejo Repsol YPF (http://www.ipqa.org.ar/momentaneas/IPA_CONACA_2003.pdf) 18 INGENIERIA QUIMICA EN LA UNIVERSIDAD NACIONAL DEL SUR PETROQUIMICO DE BAHIA BLANCA (Información del sitio www.cpibb.com.ar) Y POLO http://www.uns.edu.ar/departamentos/index.asp?dependen=19 En la Universidad Nacional del Sur, con sede en Bahía Blanca, se ha formado hace ya más de tres décadas un Departamento de Ingeniería Química importante. Su desarrollo fue promovido por la creación del Polo Petroquímico de Bahía Blanca. Simultáneamente a su desarrollo en el área de procesos, fue alcanzando también un importante predicamento en el área de Alimentos, especialmente en los aspectos de diseño y optimización de procesos de conservación. El Complejo Petroquímico de Bahía Blanca se originó en 1968, como un proyecto de la empresa norteamericana DOW CHEMICAL. Surgieron diversas alternativas pero ninguna de ellas prosperó hasta el nacimiento de PETROQUIMICA BAHIA BLANCA (PBB), una empresa con mayoría estatal, que se puso en marcha a comienzos de la década del '70. La misma fue creada por ley 19334, dictada por el Gobierno nacional el 3 de Abril de 1971. En la nueva empresa, el 51 % de las acciones se distribuyó por partes iguales entre YPF, Gas del Estado y Fabricaciones Militares. El resto quedó en manos privadas: IPAKO, INDUPA, ELECTROCLOR, CIDASA, SITOH e ISAURA. Varios años más tarde se encomendó a Fabricaciones Militares la construcción del complejo y la responsabilidad de constituir la sociedad anónima cuyo capital se compartiría con compañías estatales y del sector privado. En la década del ´90 se producen importantes cambios a partir de que el Estado decidió dejar todo el complejo en manos privadas. Esto se realizó a través de una licitación llevada a cabo a fines del año 1995. La elección de Bahía Blanca como punto para la localización de este complejo, se basó en los siguientes factores: La disponibilidad de gas etano en General Daniel Cerri, localidad situada a 10 Km del complejo. En ese punto confluyen los gasoductos Sur y Oeste que provienen de las cuencas Austral y Neuquén y las mayores reservas gasíferas del país. De esta forma el polo se asegura el pasaje diario de 18 millones de metros cúbicos de gas natural, con contenido de etano, propano, butano y gasolina natural. La presencia de salinas cercanas que garantizan la 19 disponibilidad de cloruro de sodio, materia prima requerida para la producción de cloro. Acceso a dos puertos marítimos de importancia, como Puerto Galván e Ing. White. Acceso a redes viales y ferroviarias .Disponibilidad de servicios esenciales como energía eléctrica, gas natural y agua, a lo que se agrega la proximidad a Bahía Blanca. La Planta de la empresa Profértil http://www.profertil.com.ar/, ubicada en la entrada de la ciudad de Bahía Blanca, produce amoníaco a partir de N2 extraído del aire atmosférico y de H2 obtenido por reformado de gas natural. El amoníaco producido, a su vez, se utiliza como materia prima para la fabricación del fertilizante nitrogenado Urea, que Profértil vende granulada por ser menos higroscópica y adaptarse a las condiciones húmedas de la zona pampeana argentina. Imagen de la planta de Profértil tomada de http://www.lanacion.com.ar/nota.asp?nota_id=928696 del 22 de junio de 2007. Los galpones almacenan urea granulada. 20 INGENIERIA QUIMICA EN LA UNIVERSIDAD DE BUENOS AIRES La Universidad Nacional de Buenos Aires ofrece la Carrera de Ingeniería Química desde hace décadas, situando su Departamento de Ingeniería Química en el “Pabellón de Industrias”, ubicado en Núñez, dentro del Campus de la Facultad de Ciencias Exactas y Naturales. Recientemente, un investigador del Laboratorio de Procesos Catalíticos de esa Universidad, que se había graduado en la Universidad Nacional de La Plata, desarrolló un método para obtener hidrógeno de alta pureza a partir de bioetanol. El artículo del diario La Nación es (www.lanacion.com.ar), en su edición digital del 3 de diciembre de 2005, indica Feria de Hannover Premian en Alemania un desarrollo argentino. Es un conversor de alcohol en hidrógeno La Feria de Hannover es la mayor exhibición anual de tecnología del mundo, y se dice que en ella se cierran contratos archimillonarios entre investigadores y empresas. Allí estará en marzo de 2006 el doctor Miguel Laborde y su equipo de la Facultad de Ingeniería de la Universidad de Buenos Aires (UBA), que ganó ayer el premio Hydrogen Ambassadors por haber desarrollado un sistema que convierte alcohol vegetal en hidrógeno de alta pureza. El premio Hydrogen Ambassadors existe en la feria desde hace 12 años. Cada año compiten por él cientos de equipos de investigación y desarrollo. Los pocos premiados pueden exhibir gratis su trabajo en la gigantesca feria. La nómina de premiados de este año, entre los equipos de los países que apuestan fuerte al hidrógeno, incluye una sorpresa: un desarrollo argentino. El desarrollo de Laborde, en el que colaboró el Ingar de Santa Fe, podría colaborar con el uso del hidrógeno como combustible. El año pasado, con mediación de la Fundación Innova-T, parte de esta tecnología fue transferida por 400.000 dólares a la multinacional química Abengoa. Pocos meses después, Laborde ganó un primer premio en otra competencia de proyectos energéticos limpios, organizado por la multinacional Hydro-Québec. El nuevo galardón tiene entonces una continuidad. 21 Una solución sencilla El llamado "conversor Laborde" elimina el principal problema del hidrógeno como combustible vehicular, que es su almacenamiento. Una alternativa es comprimirlo a 800 atmósferas para lograr apenas el rendimiento del GNC comprimido a 200 atmósferas. Otra alternativa es licuarlo, pero como hay que bajar la temperatura del gas a menos de 260° bajo cero, se pierde hasta un tercio de la energía del hidrógeno en el proceso. Con el conversor Laborde, la solución es mucho más sencilla: se carga alcohol común en el tanque, y el conversor lo transforma en hidrógeno a bordo, a medida que el motor (una pila combustible) lo demande. Otro aspecto del conversor Laborde es que consta de tres etapas catalíticas, y el producto de la primera es una mezcla de gases llamada "gas de síntesis", la materia prima de casi todos los procesos petroquímicos, de modo que el sistema no sólo permitiría adelantar la llegada de los vehículos de hidrógeno, sino que también podría abrir paso a una alcoquímica -o petroquímica sin petróleo-, basada en el alcohol vegetal. La cosecha de premios y atención internacional que va creando el conversor Laborde es buena noticia para un país que, como la Argentina, tiene el maíz más barato del mundo para fabricar alcohol y reservas de petróleo y gas que se extinguirán en 2014. Con la tecnología automotriz actual, el campo puede fabricar alcohol para que el país no se pare. Con la de mañana y este desarrollo de la UBA, podrá fabricar un combustible aún más limpio: hidrógeno. Daniel Arias -ANEXO 1. Refinación y separación del petróleo (Fuente, Instituto Argentino del Petróleo y el Gas (IAPG)) -ANEXO 2. La República Argentina y su Industria Petroquímica (Fuente, Instituto Petroquímico Argentino) -ANEXO 3. Panorama de la Industria Química y Petroquímica de Argentina (Fuente, Cámara de la Industria Química y Petroquímica) Acceda a los anexos desde los links ↑ BIBLIOGRAFIA UTILZADA (entre otras) -Bidner, M.S. (1979). La Ingeniería Química y la Industria Química de Procesos. Centro de Estudiantes de Ingeniería de La Plata -Felder, R.M.; Rousseau, R.W. (2004) Principios Elementales de los Procesos Químicos. 3º Edición, México: Limusa Wiley, 686 pp. -Clark, J. (2008) www.chemguide.co.uk -Giner, S.A. (2008) Notas sobre el Procesamiento de Maíz. Maestría en Tecnología e Higiene de los Alimentos, UNLP. -Himmelblau, D M y Riggs, J B. (2004) Basic Principles and Calculations in Chemical Engineering. Seventh Edition, Prentice Hall, New Jersey, 115 pp. -Himmelblau, D M (2007). Principios Básicos y Cálculos en Ingeniería Química, 6º Ed. Pearson, Prentice Hall Hispanoamericana, S.A., México, 728 pp. -Mascheroni, R.H. (2008) Clases teóricas de Simulación de Procesos I y II. Area Departamental Ingeniería Química, Facultad de Ingeniería, UNLP. Perry, R.H. (2001). Manual del Ingeniero Químico. Cuatro tomos. Mc-Graw Hill Int. de España -Vian Ortuño, A. (1999). Introducción a la Química Industrial, 2º Ed. Reverté, Barcelona. Sitos de Internet www.chemguide.co.uk, www.cheresources.com, http://www.iapg.org.ar/, http://www.ipqa.org.ar/, http://www.ciqyp.org.ar/templates/default/index.php http://www.ingenieriaquimica.org/, http://www.aaiq.org.ar/, http://www.aiche.org, www.icheme.org, http://www.cafagda.com.ar/. ------------------------------------0----------------------------LA CATEDRA, julio de 2008 22