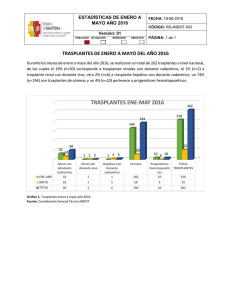
Actualizaciones en Trasplantes 2001.
Anuncio

1 Actualizaciones en Trasplantes 2001. ACTUALIZACIONES EN TRASPLANTES 2001. Edita: Hospitales Universitarios Virgen del Rocío Año 2001. AUTORES: COMISIÓN DE TRASPLANTES Coordinador científico de la obra: JOSÉ B. PÉREZ BERNAL Diseña y realiza: GRAPHIMAG&CYBERIA Martín Villa 4 4º 41003 SEVILLA Imprime: DIMOGRAF S.L. I.S.B.N.: 84-699-3529-1 2 Composición de la Comisión de Trasplantes. Dr. Ángel Bernardos Rodríguez Unidad de Trasplante Hepático Dr. José Miguel Cisneros Herreros Unidad de Enfermedades Infecciosas Dr. Miguel Ángel Gentil Govantes Servicio de Nefrología. Dra. María Francisca González Escribano Servicio de Inmunología Dr. Mario Mella Sousa Departamento de Traumatología Dr. Pedro Montañés Medina Unidad Quirúrgica de Trasplante Renal Dr. José Manuel Aznarez Cocho Servicio de Oftalmología Dr. Antonio Ordóñez Fernández Unidad Funcional de Trasplante Cardiaco Dr. José Benito Pérez Bernal Unidad de Trasplantes de U.C.I. Dr. José María Pérez Hurtado de Mendoza Actualizaciones en Trasplantes 2001. Servicio de Hematología 3 Dr. Luis Rodríguez de la Borbolla y Vázquez Servicio de Anestesia y Reanimación Secretario: Dr. José Luis Santamaría Mitsuf Coordinador Sectorial de Traplantes de Sevilla Presidente: Dr. Juan Rodríguez Alonso Director Médico Lista de autores Anselmo Abdo Cuza Equipo de Trasplante Hepático CIMEQ Centro de Investigaciones Médico Quirúrgicas Ciudad de la Habana. Cuba. Inmaculada Acevedo Durán Enfermera de Trasplante Hepático H.H. U.U. Virgen del Rocío. Sevilla Domingo Acosta Delgado Servicio de Endocrinología H.H. U.U. Virgen del Rocío. Sevilla. C. Alfonso Equipo de Trasplante Hepático CIMEQ Centro de Investigaciones Médico Quirúrgicas Ciudad de la Habana. Cuba. Antonio Alvarez Madrid Cirugía Cardiovascular Unidad de Trasplante Cardiaco H.H. U.U. Virgen del Rocío. Sevilla. Aurelio Arroyo Trillo Servicio de Microbiología H.H. U.U. Virgen del Rocío. Sevilla Ricardo Astorga Jiménez Servicio de Endocrinología H.H. U.U. Virgen del Rocío. Sevilla Joseba Barroeta Urquiza Director Gerente H.H. U.U. Virgen del Rocío. Sevilla Rafael Bedoya Pérez Unidad de Nefrología Pediátrica H.H. U.U. Virgen del Rocío. Sevilla. Angel Bernardos Rodríguez Unidad de Cirugía Hepatobiliopancreática y Trasplante Hepático H.H. U.U. Virgen del Rocío. Sevilla. Jose Miguel Borrego Domínguez Cirugía Cardiovascular Unidad de Trasplante Cardiaco H.H. U.U. Virgen del Rocío. Sevilla. Elías Cañas García-Otero Servicio de Enfermedades Infecciosas H.H. U.U. Virgen del Rocío. Sevilla. José Cañón Organización Nacional de Trasplantes -O.N.T. Madrid Antonio Caraballo Pérez Unidad de Nefrología Pediátrica H.H. U.U. Virgen del Rocío. Sevilla Magdalena Carmona González Servicio de Hematología y Hemoterapia H.H. U.U. Virgen del Rocío. Sevilla. Isabel Caro Organización Nacional de Trasplantes -O.N.T. Madrid María José Carrión Rodríguez Enfermera de Trasplante Hepático H.H. U.U. Virgen del Rocío. Sevilla F.Caso Sanz Servicio de Hematología y Hemoterapia H.H. U.U. Virgen del Rocío. Sevilla. Jose Miguel Cisneros Herreros Servicio de Enfermedades Infecciosas H.H. U.U. Virgen del Rocío. Sevilla. Cristobal Colón Pallarés Servicio de Cuidados Críticos y Urgencias H.H. U.U. Virgen del Rocío. Sevilla Fernanda Conejero Caballero Enfermera de Trasplante Hepático H.H. U.U. Virgen del Rocío. Sevilla Natalio Cruz Navarro Servicio de Urología H.H. U.U. Virgen del Rocío. Sevilla Concepción Díaz Aunión Unidad de Cirugía Hepatobiliopancreática y Trasplante Hepático H.H. U.U. Virgen del Rocío. Sevilla. María Jesús Díaz Mellado Enfermera de Trasplante Hepático H.H. U.U. Virgen del Rocío. Sevilla Julio Díaz Mesa Equipo de Trasplante Hepático CIMEQ Centro de Investigaciones Médico Quirúrgicas Ciudad de la Habana. Cuba José María Domínguez Roldán Servicio de Cuidados Críticos y Urgencias H.H. U.U. Virgen del Rocío. Sevilla. Mª. José Escobar García Coordinadora de Enfermería Servicio de Nefrología H.H. U.U. Virgen del Rocío. Sevilla Ildefonso Espigado Tocino Servicio de Hematología y Hemoterapia H.H. U.U. Virgen del Rocío. Sevilla. 4 Jorge Fernández Alonso Departamento de Anatomía Patológica H.H. U.U. Virgen del Rocío. Sevilla Joaquín Fernández Cruz Servicio de Radiodiagnóstico H.H. U.U. Virgen del Rocío. Sevilla Francisco Fernández Palacios Centro Regional de Transfusiones Sanguíneas Sevilla María Jesús Fernández Romana Enfermera de Trasplante Hepático H.H. U.U. Virgen del Rocío. Sevilla Julia Fijo Sanchez - Viota Unidad de Nefrología Pediátrica H.H. U.U. Virgen del Rocío. Sevilla. Ana Isabel Gallego Corpa Coordinación Sectorial de Trasplantes. Sevilla Actualizaciones en Trasplantes 2001. D. González Duarte Servicio de Endocrinología H.H. U.U. Virgen del Rocío. Sevilla M. F. González Escribano Servicio de Inmunología H.H. U.U. Virgen del Rocío. Sevilla Leonel González Rapado Equipo de Trasplante Hepático CIMEQ Centro de Investigaciones Médico Quirúrgicas Ciudad de la Habana. Cuba. Francisco González Roncero Servicio de Nefrología H.H. U.U. Virgen del Rocío. Sevilla. Encarnación García Organización Nacional de Trasplantes -O.N.T. Madrid Encarnación Gutiérrez Carretero Cirugía Cardiovascular Unidad de Trasplante Cardiaco H.H. U.U. Virgen del Rocío. Sevilla. Andrés García Curiel Servicio de Microbiología H.H. U.U. Virgen del Rocío. Sevilla A.Gutiérrez Crespo Servicio de Anestesia H.H. U.U. Virgen del Rocío. Sevilla Inmaculada García González Unidad de Cirugía Hepatobiliopancreática y Trasplante Hepático H.H. U.U. Virgen del Rocío. Sevilla. Carlos Gutiérrez Martín Unidad de Radiología Vascular Servicio de Radiodiagnóstico H.H. U.U. Virgen del Rocío. Sevilla Eloisa García Ortiz Enfermera Coordinadora Unidad de Trasplantes de UCI H.H. U.U. Virgen del Rocío. Sevilla Ana Hernández Fernández Cirugía Cardiovascular Unidad de Trasplante Cardiaco H.H. U.U. Virgen del Rocío. Sevilla. Felipe García de Pesquera Benjumea Unidad de Diagnóstico de Medicina Nuclear H.H. U.U. Virgen del Rocío. Sevilla Julio César Hernández Perera Equipo de Trasplante Hepático CIMEQ Centro de Investigaciones Médico Quirúrgicas Ciudad de la Habana. Cuba. Julián Garrido Nieto Enfermero de Trasplante Hepático H.H. U.U. Virgen del Rocío. Sevilla 5 Miguel Angel Gómez Bravo Unidad de Cirugía Hepatobiliopancreática y Trasplante Hepático H.H. U.U. Virgen del Rocío. Sevilla. Francisco Gavilán Carrasco Departamento de Anatomía Patológica H.H. U.U. Virgen del Rocío. Sevilla Miguel Angel Gentil Govantes Unidad de Trasplante Renal. S. Nefrología. H.H. U.U. Virgen del Rocío. Sevilla. Montserrat Giles Lima Departamento de Anatomía Patológica H.H. U.U. Virgen del Rocío. Sevilla Lourdes Gómez Izquierdo Departamento de Anatomía Patológica H.H. U.U. Virgen del Rocío. Sevilla Angel Herruzo Avilés Servicio de Cuidados Críticos y Urgencias H.H. U.U. Virgen del Rocío. Sevilla Rafael Hinojosa Pérez Unidad de Trasplantes de U.C.I. Servicio de Cuidados Críticos y Urgencias H.H. U.U. Virgen del Rocío. Sevilla. María Alcázar Iribarren Marín Unidad de Radiología Vascular Servicio de Radiodiagnóstico H.H. U.U. Virgen del Rocío. Sevilla Miguel Angel Japón Departamento de Anatomía Patológica H.H. U.U. Virgen del Rocío. Sevilla J.M. Jiménez Jiménez Servicio de Hematología y Hemoterapia H.H. U.U. Virgen del Rocío. Sevilla. Pedro Montañés Medina Servicio de Urología H.H. U.U. Virgen del Rocío. Sevilla Ernesto Lage Gallé Servicio de Cardiología Unidad de Trasplante Cardiaco H.H. U.U. Virgen del Rocío. Sevilla Antonio Moreno Vega Unidad de Nefrología Pediátrica H.H. U.U. Virgen del Rocío. Sevilla. Jorge Lage Dávila Equipo de Trasplante Hepático CIMEQ Centro de Investigaciones Médico Quirúrgicas Ciudad de la Habana. Cuba. Pedro Moya Marín D.U.E. Unidad de Insuficiencia Cardiaca y Trasplante Servicio de Cardiología H.H. U.U. Virgen del Rocío. Sevilla J. Leal Arenas Servicio de Urología H.H. U.U. Virgen del Rocío. Sevilla José Muñoz Terol Servicio de Nefrología H.H. U.U. Virgen del Rocío. Sevilla. Omar López Cruz Equipo de Trasplante Hepático CIMEQ Centro de Investigaciones Médico Quirúrgicas Ciudad de la Habana. Cuba. María Dolores Muñoz del Castillo Enfermera de Trasplante Hepático H.H. U.U. Virgen del Rocío. Sevilla Juan Luis López Romero Servicio de Anestesia H.H. U.U. Virgen del Rocío. Sevilla Juan Martín Govantes Unidad de Nefrología Pediátrica H.H. U.U. Virgen del Rocío. Sevilla. José Martín Juan Unidad Médico Quirúrgica Enf. Respiratorias H.H. U.U. Virgen del Rocío. Sevilla Mateo Martínez Servicio de Radiodiagnóstico H.H. U.U. Virgen del Rocío. Sevilla C.Martínez Carvajal Servicio de Hematología y Hemoterapia H.H. U.U. Virgen del Rocío. Sevilla. Julián Mateos Aguilar Servicio de Nefrología H.H. U.U. Virgen del Rocío. Sevilla. Macarena Naranjo Servicio de Nefrología H.H. U.U. Virgen del Rocío. Sevilla. Pilar Noguerol Novella Servicio de Hematología y Hemoterapia H.H. U.U. Virgen del Rocío. Sevilla. Antonio Núñez Servicio de Inmunología H.H. U.U. Virgen del Rocío. Sevilla Antonio Ordóñez Fernández Cirugía Cardiovascular Unidad de Trasplante Cardiaco H.H. U.U. Virgen del Rocío. Sevilla. Auxiliadora Pacheco Calvente Cirugía Cardiovascular Unidad de Trasplante Cardiaco H.H. U.U. Virgen del Rocío. Sevilla. Oliva Mateos Jiménez Coordinación Sectorial de Trasplantes. Sevilla Felipe Pareja Ciuró Unidad de Cirugía Hepatobiliopancreática y Trasplante Hepático H.H. U.U. Virgen del Rocío. Sevilla. Rafael Matesanz Organización Nacional de Trasplantes -O.N.T. Madrid Ricardo Parody Ruiz Berdejo Servicio de Hematología y Hemoterapia H.H. U.U. Virgen del Rocío. Sevilla. Antonio Mayol Deyá Unidad de Radiología Vascular Servicio de Radiodiagnóstico H.H. U.U. Virgen del Rocío. Sevilla Manuel Medrano Ortega Servicio de Radiodiagnóstico H.H. U.U. Virgen del Rocío. Sevilla Blanca Miranda Coordinadora Nacional de Trasplantes Organización Nacional de Trasplantes -O.N.T. Madrid. Teresa Pereda Salguero Departamento de Anatomía Patológica H.H. U.U. Virgen del Rocío. Sevilla José María Perez Hurtado Servicio de Hematología y Hemoterapia H.H. U.U. Virgen del Rocío. Sevilla. José B. Pérez Bernal Unidad de Trasplantes de U.C.I. Servicio de Cuidados Críticos y Urgencias H.H. U.U. Virgen del Rocío. Sevilla. 6 María del Carmen Pérez Torres Servicio de Anestesia H.H. U.U. Virgen del Rocío. Sevilla Porfirio Pereira Palomo Unidad de Trasplante Renal. S. Nefrología. H.H. U.U. Virgen del Rocío. Sevilla. Gertrudis Pereira Gutiérrez Centro Regional de Transfusiones Sanguíneas Sevilla Jose Pablo Quintero García Servicio de Farmacia H.H. U.U. Virgen del Rocío. Sevilla Carmen Regordan Rosado Servicio de Microbiología H.H. U.U. Virgen del Rocío. Sevilla José Ramón Rodríguez Rodríguez Servicio de Medicina Nuclear H.H. U.U. Virgen del Rocío. Sevilla Gabriel Rodríguez Algarra Unidad de Trasplante Renal. S. Nefrología. H.H. U.U. Virgen del Rocío. Sevilla. Juan Manuel Rodríguez Fernández Servicio de Hematología y Hemoterapia H.H. U.U. Virgen del Rocío. Sevilla. Angel Salvatierra Velázquez Cirugía Torácica Hospital U. Reina Sofía. Córdoba Marcia Samada Suárez Equipo de Trasplante Hepático CIMEQ Centro de Investigaciones Médico Quirúrgicas Ciudad de la Habana. Cuba. María Sánchez Organización Nacional de Trasplantes -O.N.T. Madrid Ana Sánchez Moreno Unidad de Nefrología Pediátrica H.H. U.U. Virgen del Rocío. Sevilla. Actualizaciones en Trasplantes 2001. José Luis Santamaría Mitsuf Coordinador Sectorial de Trasplantes. Sevilla 7 Manuel Sayago Mota Servicio de Enfermedades Digestivas Unidad de Trasplante Hepático H.H. U.U. Virgen del Rocío. Sevilla Carmen Segovia Organización Nacional de Trasplantes -O.N.T. Madrid Manuel Serrano Organización Nacional de Trasplantes -O.N.T. Madrid Juan Serrano Díez-Canedo Unidad de Cirugía Hepatobiliopancreática y Trasplante Hepático H.H. U.U. Virgen del Rocío. Sevilla. Ana Soucase Palmero Enfermera Coordinadora Unidad de Trasplantes de UCI H.H. U.U. Virgen del Rocío. Sevilla José Manuel Sousa Martín Unidad de Cirugía Hepatobiliopancreática y Trasplante Hepático H.H. U.U. Virgen del Rocío. Sevilla. Oscar Suarez Savio Equipo de Trasplante Hepático CIMEQ Centro de Investigaciones Médico Quirúrgicas Ciudad de la Habana. Cuba. María Jesus Tamayo López Unidad de Cirugía Hepatobiliopancreática y Trasplante Hepático H.H. U.U. Virgen del Rocío. Sevilla. Juan Luis Tirado Hospital Servicio de Medicina Nuclear H.H. U.U. Virgen del Rocío. Sevilla Francisco J. Torrubia Romero Servicio de Urología H.H. U.U. Virgen del Rocío. Sevilla Paulino Travado Soria Departamento de Anatomía Patológica H.H. U.U. Virgen del Rocío. Sevilla Jose Carlos Ugarte Suárez Equipo de Trasplante Hepático CIMEQ Centro de Investigaciones Médico Quirúrgicas Ciudad de la Habana. Cuba. Antonio Vaquero Franco Servicio de Hematología y Hemoterapia H.H. U.U. Virgen del Rocío. Sevilla. Antonio Velasco Méndez Supervisor de Enfermería Servicio de Nefrología H.H. U.U. Virgen del Rocío. Sevilla Alicia Vélez García Enfermera de Trasplante Hepático H.H. U.U. Virgen del Rocío. Sevilla Mario Wilford de León Equipo de Trasplante Hepático CIMEQ Centro de Investigaciones Médico Quirúrgicas Ciudad de la Habana. Cuba. Rosa Ysla García Equipo de Trasplante Hepático CIMEQ Centro de Investigaciones Médico Quirúrgicas Ciudad de la Habana. Cuba. Prólogo Prologar un libro es una tarea sumamente agradable, pues habitualmente lo solicita algún amigo o compañero, que amablemente considera que se es la persona indicada para ello. Pero en este caso, la tarea es doble o triplemente grata, ya que se trata de un tema que me es muy querido y que ha constituido el eje de mi trabajo y muchas horas de mi vida en los últimos años, pero sobre todo porque quienes participan, no sólo son amigos, sino que son buenos y verdaderos amigos, además de grandes profesionales. Los trasplantes son hoy día una terapéutica perfectamente establecida como opción de tratamiento sustitutivo para los pacientes con disfunción orgánica terminal e irreversible. Numerosos estudios demuestran la eficacia de los trasplantes, que presentan tasas de supervivencia, calidad de vida y eficacia funcional más que satisfactorias. Pero no es sólo esto lo que caracteriza a los trasplantes, los trasplantes son terapéuticas médico quirúrgicas que no pueden progresar sólo con más recursos o más inversiones tecnológicas. Los trasplantes tienen una enorme proyección ética y unas implicaciones sociales importantes. Es la sociedad, es el ciudadano, quiénes con sus donaciones hacen posible que la maquinaria de los trasplantes se ponga en marcha cada día. Los trasplantes necesitan de un enorme e importante dispositivo técnico dispuesto en todo momento, pero sin ese empujón inicial del ciudadano anónimo nada sería posible. Los ciudadanos que reciben los trasplantes son buenos conocedores de esta oportunidad que se les brinda, al percibir en sí mismos una de las mejores manifestaciones de solidaridad y altruismo. Son conscientes de la necesidad de vivir intensamente cada minuto, y disfrutar y celebrar ese regalo de vida que alguien les dio. La divulgación de la información sobre los trasplantes es pieza básica en el engranaje, como lo es la formación continuada en materia de trasplantes. Es muy importante que el proceso sea técnicamente impecable, pero es fundamental también, que exista una participación activa del receptor para el buen acoplamiento del órgano a su nuevo organismo, y poder asegurar en mayor medida el éxito del trasplante. Es por ello que, libros como el que hoy se presenta son tan importantes, libros que pretenden dar a conocer en mayor profundidad el proceso completo de la donación y el trasplante, y que dan cabida a los muchos profesionales que participan, algunos de los cuales son grandes desconocidos. 8 Libros que ayudan a los pacientes a saber algo más sobre sí mismos y su enfermedad, sobre cómo funciona su organismo, y sobre todo, como contribuir al éxito de todo el grupo; donante, equipo técnico y receptor. Espero y deseo que este libro cumpla sus objetivos y que sea de utilidad práctica. En todo caso, ya es todo un éxito plasmar en unos cientos de páginas la experiencia de un buen número de profesionales, de un hospital con una evidente vocación trasplantadora, vaya por delante mi enhorabuena y mejores deseos para todos. Blanca Miranda Actualizaciones en Trasplantes 2001. Coordinadora Nacional de Trasplantes 9 Dedicado: A la Asociación Andaluza de Trasplantados Hepáticos «Ciudad de la Giralda», por ser la mejor embajadora de la calidad asistencial de nuestro Hospital. A nuestra nueva Sociedad Andaluza de Trasplantes de Organos y Tejidos deseándole una larga vida científica. A los familiares de todos los autores Agradecimiento: A Eva Arana Benítez, periodista de la Unidad de Comunicación, por intentar siempre aumentar la autoestima de todos los profesionales de nuestro Hospital. A las 9 Monjas Clarisas Capuchinas del Monasterio de Santa Rosalía porque, desde el silencio de su Clausura, nos ayudan a luchar por la vida. A la Hermandad de la Macarena, por su gran colaboración para despertar la sensibilidad y solidaridad de la población hacia la donación de órganos. A los compañeros del Centro de Investigaciones Médico Quirúrgicas - CIMEQ de Ciudad de la Habana, por habernos elegido como su Hospital de Referencia. 10 Indice 3 Composición de la Comisión de Trasplantes. 4 Lista de autores 8 Prólogo Dra. Blanca Miranda Coordinadora Nacional de Trasplantes 15 Las Sesiones Clínicas de los Grupos de Trasplantes y el libro «Actualizaciones en Trasplantes»: «Puntos de Encuentro» de los profesionales del Hospital. José B. Pérez Bernal Unidad de Trasplantes de UCI. 19 Actividad Donación - Trasplantes en Sevilla. Año 2.000. José Luis Santamaría Mifsut, Ana Isabel Gallego Corpa, Oliva Mateos Jiménez Coordinación Sectorial de Trasplantes de Sevilla. 25 Resultados del trasplante renal (adultos) en 2000. Sevilla. Miguel A. Gentil, Gabriel R. Algarra, Porfirio Pereira, Macarena Naranjo, José Muñoz, Francisco González Roncero, Julián Mateos. Unidad de Trasplante Renal. Servicio de Nefrologia. 32 Trasplante renal infantil en Sevilla. Memoria asistencial año 2.000 J. Fijo, A. Sánchez. A, Moreno, R. Bedoya, A. Caraballo, J. Martín-Govantes. Unidad de Nefrología Pediátrica. 34 Actividad trasplantadora de la Unidad de de Cirugía Hepatobiliopancreática y Trasplante Hepático durante el año 2000 Pareja Ciuró, F.; Serrano Díez-Canedo,J.; Gomez Bravo, M.A.; García Gonzalez, I.; Díaz Aunión, C.; Tamayo, M.J.; Pérez Bernal, J.; Hinojosa Pérez, R.; Cañas,E.; Sousa Martín, J.M. Bernardos Rodríguez,A. Unidad de Cirugía Hepatobiliopancreática y Trasplante Hepático. Actualizaciones en Trasplantes 2001. 43 11 Resultados del Programa de Trasplante Cardiaco año 2000. Sevilla. Antonio Ordóñez, José Miguel Borrego, Encarnación Gutierrez, Antonio Alvarez, Ernesto Lage, Rafael Hinojosa, José Miguel Cisneros, José PérezBernal, Ana Hernández, Auxiliadora Pacheco. Unidad de Trasplante Cardíaco 50 Trasplante de progenitores hematopoyéticos. Memoria año 2.000. J.M. Rodríguez-Fernández, R. Parody, J. Mª. Pérez-Hurtado, M. Carmona, I. Espigado, A. Vaquero. Servicio de Hematología y Hemoterapia. 57 Memoria del Banco Sectorial de Tejidos del C.R.T.S. Sevilla - Huelva 2.000. Gertrudis Pereira Gutiérrez. Francisco Fernández Palacios. Centro Regional de Transfusiones Sanguíneas. 62 Trasplante de Órganos y Diabetes Mellitus D. Acosta Delgado, D González-Duarte y R. Astorga Jiménez Servicio de Endocrinología. 72 Rapamicina: Nueva droga inmunosupresora. Porfirio Pereira Palomo, Gabriel Rodríguez Algarra, Miguel Angel Gentil Govantes, Jose Pablo Quintero García . Unidad de Trasplante Renal. Servicio de Nefrología. Servicio de Farmacia. 80 Protocolo para el diagnóstico y tratamiento de la neumonía en los receptores de trasplante de órgano. Aurelio Arroyo, Elías Cañas, José Miguel Cisneros, Alfonso Espigado, Joaquín Fernández Cruz, Jorge Fernández Alonso, Andrés García Curiel, Miguel Angel Gentil, Rafael Hinojosa, José Martín Juan, Mateo Martínez y Carmen Regordan. Servicios de Anatomía Patológica, Cuidados Intensivos, Enfermedades Infecciosas, Hematología, Microbiología, Nefrología, Neumología y Radiología. 85 Sindrome linfoproliferativo postrasplante. Elías Cañas, José Miguel Cisneros, Jorge Fernández Alonso, Miguel Angel Japón. Servicios de Enfermedades Infecciosas y Anatomía Patológica. 92 ¿Es costoso el análisis de Ciclosporina? Felipe García de Pesquera Benjumea. Unidad de Diagnóstico de Medicina Nuclear. 96 Profilaxis de la reinfeccion por VHB en receptores de trasplante hepatico HBsAg positivo. J.M. Sousa Martín, M. Sayago , F. Pareja, C. Díaz-Aunion, J. Serrano, M.A. Gómez, I. García, M.J Tamayo, E. Cañas, J.B. Pérez-Bernal, R. Hinojosa, A. Bernardos. Unidad Trasplante Hepático. 104 Hepatitis viral recurrente tras trasplante ortotópico hepático. Teresa Pereda, Francisco Gavilan Carrasco, Lourdes Gómez, Jose M.Sousa. Departamento de Anatomía Patológica. 111 Hepatocarcinoma y trasplante hepático C. Díaz- Aunión , J. Serrano , M.A. Gómez, I. García, F. Pareja, M. J. Tamayo, J. Pérez-Bernal, R. Hinojosa, J. M. Sousa, E. Cañas, A. Bernardos. Unidad de Trasplante Hepático. 114 Trastornos intraoperatorio de la coagulación en el trasplante hepático J.L López Romero, A. Gutierrez Crespo, M. Pérez Torres. Servicio de Anestesia. 118 Postoperatorio inmediato del paciente trasplantado de hígado. R. Hinojosa Pérez; J.B Pérez Bernal; A. Herruzo; C. Colón; E. Cañas; J.M. Sousa; M. Sayago; J. Serrano; F. Gavilán; M.A. Gómez; A. Bernardos. Unidad de Trasplantes de Cuidados Intensivos. Servicio de Cuidados Críticos y Urgencias. 12 128 Protocolos de enfermería en la Unidad de Trasplantes de Cuidados Intensivos: Trasplante hepático. Ana Soucase Palmero, Eloisa García Ortiz. Enfermeras Coordinadoras. Unidad de Trasplantes de UCI. 136 Cuidados de enfermería en las distintas fases del pacientes trasplantado hepático. Mª Jesús Fernández Romana, Mª Jesús Díaz Mellado, Mª Dolores Muñoz Del Castillo, Fernanda Conejero Caballero, Julián Garrido Nieto, Mª José Carrión Rodríguez, Inmaculada Acevedo Durán, Alicia Vélez García. Enfermería de Trasplante Hepático. 141 Trasplante Hepático en Cuba. Resultados de nuestro primer año de trabajo. A. Abdo, L. González-Rapado, J.C. Hernández, M. Samada, O. López, M. Wilford, C. Alfonso, R. Ysla, C. Ugarte, J. Lage, J. Díaz, O. Suarez. Centro de Investigacioners Médico - Quirúrgicas. CIMEQ. Ciudad de la Habana. Cuba. 153 La Radiologia vascular intevencionista en los trasplantes hepático y renal Carlos Gutiérrez Martín, Maria Alcázar Iribarren Marín, Antonio Mayol Deyá, Manuel Medrano Ortega. Unidad de Radiologia Vascular. Servicio de Radiodiagnóstico. 157 Selección del receptor de riñón de cadáver. M.A. Gentil Govantes, M.F. González Escribano, G. Rodriguez Algarra, P. Pereira Palomo, A. Nuñez, J. Mateos. Unidad de Trasplante Renal. Servicio de Nefrologia y Servicio de Inmunologia 168 La Medicina Nuclear en el seguimiento del trasplante renal. Tirado, J.L.; Rodriguez, J.R. Servicio de Medicina Nuclear. 170 Protocolo del trasplante renal pediátrico. Julia Fijo, A. Moreno, A. Sanchez, R. Bedoya, A. Caraballo, J. Martin Govantes. Unidad de Nefrología Pediátrica. Hospital Infantil. 180 Protocolos de Enfermería en la Unidad de Trasplante Renal. Mª José Escobar García. Coordinadora de Enfermería. Antonio Velasco Méndez. Supervisor de Enfermería. Servicio de Nefrología. 184 Complicaciones de la via excretora en el trasplante renal F. J. Torrubia Romero; N. Cruz Navarro; J. Leal Arenas; P. Montañés Medina. Actualizaciones en Trasplantes 2001. Servicio de Urología 13 193 Atención de enfermería al paciente trasplantado de corazón en la U.T.C. Pedro Moya Marín. D.U.E. Unidad de Insuficiencia Cardiaca y Trasplante. Servicio de Cardiología. 201 Manifestaciones clinicopatológicas del fallo agudo del injerto cardiaco. Estudio revision de la casuistica postmortem. Jorge Fernández Alonso, Montserrat Giles, Paulino Travado. Departamento de Anatomía Patológica. Sección de postmortem. 208 Trasplante de progenitores hematopoyéticos en la leucemia linfoblastica del niño. Situacion actual y experiencia en nuestro servicio. J. Mª. Pérez Hurtado, J.M. Rodríguez-Fernández, R. Parody, M. Carmona, I. Espigado, A. Vaquero. Servicio de Hematología y Hemoterapia. 213 Trasfusión y complicaciones inmunohematológicas en el trasplante de órganos sólidos. P.Noguerol Novella, C.Martinez Carvajal, F.Caso Sanz, J.M.Jimenez Jimenez, J. M. Rodríguez-Fernández. Servicio de Hematología y Hemoterapia 222 El diagnóstico de muerte. Desde diagnósticos ancestrales de muerte hasta el diagnóstico de muerte por criterios encefálicos. José María Domínguez Roldán. Servicio de Cuidados Críticos y Urgencias. 230 Nueva legislación en trasplantes: Real Decreto 426/1980 José Luis Santamaría Mifsut, Ana Isabel Gallego Corpa, Oliva Mateos Jiménez Coordinación Sectorial de Trasplantes de Sevilla. 235 Programa integral europeo para la donación de organos. La comunicación de malas noticias y el proceso de donación Carmen Segovia, Manuel Serrano, José Cañón, Rafael Matesanz, María Sánchez, Blanca Miranda, Isabel Caro, Encarnación García. Organización Nacional de Trasplantes. Madrid. 242 Trasplantes de órganos y tejidos en Hospitales Universitarios Virgen del Rocío: una organización del siglo XXI Joseba Barroeta Urquiza. Director Gerente HH.UU. Virgen del Rocío. 248 Trasplante pulmonar Ángel Salvatierra Velázquez Cirugía Torácica. Hospital U. Reina Sofía de Córdoba 252 Xenotrasplante Blanca Miranda. Organización Nacional de Trasplantes. 14 Las Sesiones Clínicas de los Grupos de Trasplantes y el libro «Actualizaciónes en Trasplantes»: «Puntos de Encuentro» de los profesionales del Hospital. José B. Pérez Bernal Unidad de Trasplantes de U.C.I.. Servicio de Cuidados Críticos y Urgencias. Durante los últimos cuatro años, las Sesiones Clínicas de los Grupos de Trasplantes del Hospital han constituido un «Punto de Encuentro» de los profesionales relacionados con los Trasplantes de Organos y Tejidos. Actualizaciones en Trasplantes 2001. Los primeros lunes de cada mes, fieles a la cita de las 8,30 de la mañana, entre 30 y 50 médicos de distintas Especialidades nos reunimos a debatir, y aprender, alrededor de un tema científico de actualidad. Con el intercambio de conocimientos, con la convivencia en un ambiente distendido, estas tertulias médicas abiertas consiguen, junto a un objetivo docente, algo que todos consideramos muy importante: crear un ambiente de gran calidad científica y de tremenda cordialidad entre compañeros. 15 Aunque el mundo de los trasplantes de órganos y tejidos se pone como un ejemplo notable de la Medicina en Equipo, son tantos los Especialistas que intervienen en el llamado «Proceso de Donación - Trasplante», son tantos los trasplantes, es tan alta la presión asistencial y el grado de responsabilidad, que los médicos se sienten aislados. Los grupos reducidos de profesionales pioneros que iniciaron los distintos programas se han convertido, con el paso de los años y tras centenares de trasplantes, en grandes equipos multidisciplinarios cuyos miembros pertenecen a muy distintos Servicios o Departamentos. Prácticamente todo el Hospital participa en una Donación o en un Trasplante. Y no solamente el médico, sino todo el personal sanitario. Mas que en equipo trabajamos, con menos contacto que el deseado, en la misma dirección, como eslabones muy importantes de la «cadena» del proceso de la curación. En un Hospital de las dimensiones del Virgen del Rocío, es muy fácil no establecer contacto físico durante meses entre profesionales que trabajan con un mismo objetivo, como es el reincorporar a la sociedad a una persona con patología terminal mediante un trasplante. El aislamiento, la soledad o la falta de comunicación conducen a una pérdida de calidad asistencial y, por lo tanto, a un perjuicio de las personas enfermas. Los temas tratados en las Sesiones Clínicas han sido muy diversos. En estos cuatro años han participado casi todos los médicos mas prestigiosos de nuestro Hospital, es decir, de nuestro país. (Tabla I). Como fruto espontáneo de este esfuerzo común, surgieron las Sesiones Clínicas Extraordinarias. Cada año, a principios de Febrero, durante media jornada nos informamos de la actividad desarrollada por los diferentes Grupos de Trasplantes. También nos abrimos al exterior invitando a conferenciantes de gran prestigio nacional. Este año 2.001, el 12 de Febrero, hemos invitado a los siguientes compañeros: Dr. José María García Buitrón, Coordinador de Trasplantes del Hospital Juan Canalejo de La Coruña, para hablar de la «Donación en Asistolia». Lo ha presentado otro Urólogo, el Dr. Pedro Montañés Medina, Jefe de la Unidad de Trasplante Renal. Dr. Joaquín Álvarez Rodríguez, Coordinador Sectorial de Trasplantes del Hospital Universitario San Carlos de Madrid, para hablarnos de la «Donación en Asistolia en la Comunidad de Madrid». Lo ha presentado otro Intensivista y Coordinados de Trasplantes, el Dr. José Luis Santamaría Mitsuff Dr. Ángel Salvatierra Velázquez, del Hospital Universitario Reina Sofía de Córdoba. Nos habla de su experiencia en «Trasplante Pulmonar». Lo presentó otro Cirujano de Tórax de nuestro Hospital, el Dr. Juan Miguel Sánchez Navarro. El Libro «Actualización en Trasplantes 2.001» es otro «Punto de Encuentro». En él quedan recogidas, en soporte papel, las experiencias de los muchos y prestigiosos profesionales de nuestro Hospital. Con respecto al libro del año 2.000 observarán dos diferencias fundamentales: La primera que hemos disminuido el número de páginas dedicadas a las memorias asistenciales, y la segunda, que el número y calidad de los capítulos es notable. De un libro de memorias hemos pasado a un libro de estudio, a un libro de consulta, hecho por nosotros y, en principio, para nosotros. Son 37 capítulos escritos por 120 autores. Por primera vez, Enfermería nos acompaña. Han escrito cuatro capítulos de gran interés. Desde aquí les animamos a mantener, y aumentar, su colaboración para los años venideros. Todos trabajamos con el mismo objetivo y necesitamos estos «Puntos de Encuentro». La Dra. Blanca Miranda, Coordinadora Nacional de Trasplantes, ha prologado el libro. 16 Sus palabras transmiten amistad, ánimo, ética, fuerza, solidaridad, humanidad, pasión por los trasplantes y, hablando en términos taurinos, dominio, temple y arte. Son unas sabias palabras escritas por un ser humano excepcional, en plena madurez como médico, que dedica todos los minutos del día a trabajar por una causa difícil, dura y maravillosa: los trasplantes de órganos y tejidos. Desde estas páginas le transmitimos nuestro agradecimiento, nuestra amistad y todo el ánimo del mundo. Blanca Miranda también nos ha escrito un capítulo: «Xenotrasplante». Junto a ella, escriben otro capítulo autores del prestigio de Rafael Matesanz o Carmen Segovia entre otros, todos ellos pioneros en la creación de la Organización Nacional de Trasplantes en España. Su presencia supone un respaldo a nuestro trabajo, al Hospital, un privilegio para el libro y un orgullo para el resto de los autores. Los compañeros del Centro de Investigaciones Médico Quirúrgicas-CIMEQde Ciudad de la Habana nos escriben su experiencia del primer año de Programa de Trasplante Hepático en Cuba, Programa en el que hemos participado como Hospital de Referencia. En las primeras páginas les agradecemos la confianza que tienen en nosotros, en nuestra calidad asistencial. En la dedicatoria del libro destaca la nueva Sociedad Andaluza de Trasplantes de Organos y Tejidos. Muchos de los autores la hemos formado, junto a médicos de otros Hospitales andaluces que tienen la misma filosofía integradora y científica. La SATOT nos ayudará a compartir, a aprender, a olvidar la dinámica de «aislamiento» del Virgen del Rocío, además de impulsar, exigir y controlar la calidad asistencial en el terreno de los trasplantes. Actualizaciones en Trasplantes 2001. El libro del año 2.000 se introdujo en la Red, en Intranet, de nuestro Hospital. Desde cualquier ordenador conectado, todos los profesionales han podido leer, estudiar o imprimir sus capítulos. Este libro del 2.001 esperamos editarlo también en soporte informático, para entregarlo mediante un CD y poderlo "hojear" virtualmente en la Intranet. 17 La Comisión de Trasplantes ha hecho un gran esfuerzo económico para editar el libro. Cada uno de los autores lo agradecen. Todos reconocen el ejemplo que esta Comisión del Hospital ha dado en la gestión de unos recursos económicos, siempre escasos, administrados en beneficio del interés científico y repartidos entre todos los profesionales. Nos han tenido que ayudar, para conseguir este proyecto, tres Empresas que destacan entre la Industria Farmacéutica por su colaboración en la Investigación de nuevos medicamentos, para que los trasplantes de órganos y tejidos continúen siendo un éxito en la medicina actual. Desde estas páginas, y en nombre de todos los autores, les transmitimos nuestro agradecimiento. Animamos a todos los compañeros del Hospital a participar cada año escribiendo sus capítulos, para que los demás aprendamos, sepamos sus proyectos, sus resultados, sus protocolos, sus inquietudes y sus logros. Seguiremos solicitando a la Agencia Española ISBN la aprobación para que los capítulos de estos libros también tengan un valor reconocido para sus autores en los concursos de méritos. De esta manera el esfuerzo se ve recompensado con un incremento de su curriculum o méritos profesionales. Tabla 1.Sesiones clínicas de los grupos de trasplantes de los H.H. U.U. Virgen del Rocío 1996 - 2000. 18 Actividad donación trasplante en Sevilla. Año 2.000 José Luís Santamaría Mifsut, Ana Isabel Gallego Corpa, Oliva Mateos Jiménez Coordinación Sectorial de trasplante de Sevilla. SECTOR SEVILLA Protocolos Muerte Cerebral Actualizaciones en Trasplantes 2001. Protocolos Muerte Cerebral. Año 2000 19 DONANTES 2000 SECTOR SEVILLA Donantes de órganos 2000 Evolución donantes de órganos CAUSA DE MUERTE DONANTES Año 2000 20 Causa de muerte comparativa. Sector Sevilla. Donantes por grupo de edad. Sector Sevilla Actualizaciones en Trasplantes 2001. Edad Media 21 SECTOR SEVILLA AÑO 2000 Órganos generados Órganos viables Comparativa órganos generados. Sector Sevilla 22 Comparativa órganos viables. Sector Sevilla Actualizaciones en Trasplantes 2001. Riñones no válidos para trasplante. Año 2000 23 Trasplantes Renales procedencia TRASPLANTE DE ÓRGANOS Y TEJIDOS. SECTOR SEVILLA Trasplante de órganos Trasplantes de Tejidos Procedencia Tejido Óseo que llega al Banco Sectorial Destino y distribución Tejido Óseo 24 RESULTADOS DEL TRASPLANTE RENAL DE ADULTOS EN SEVILLA. AÑO 2000 Miguel A. Gentil, Gabriel R. Algarra, Porfirio Pereira, Macarena Naranjo, José Muñoz, Francisco González Roncero, Julián Mateos. Unidad de Trasplante Renal. Servicio de Nefrologia. En la figura 1 se muestra la evolución del número anual de trasplantes renales (TR) realizados por el Servicio de Nefrología (adultos) desde el comienzo del programa, en 1978. En 2000, con 52 TR y 1 trasplante hepato-renal simultáneo, ha disminuido la actividad en trasplante renal en un 7% respecto al año anterior. Esto ha ocurrido también en el resto de Andalucía y de España, pero en menor proporción (un 4,3%), por lo que nuestra tasa provincial por millón de población ha descendido en su posición relativa (figura 2). Por consiguiente, debe realizarse el máximo esfuerzo para incrementar el número de riñones obtenidos y alcanzar al menos los rendimientos logrados en el resto del país. Actualizaciones en Trasplantes 2001. Como consecuencia del propio éxito del procedimiento, la población de pacientes de insuficiencia renal mantenidos mediante un TR funcionante no cesa de crecer (figura 3). Sin embargo los recursos humanos dedicados a esta área permanecen constantes desde hace muchos años, determinado una dificultad creciente para mantener el nivel asistencial. Si no se da una pronta respuesta al problema por parte de los órganos de gestión del hospital, es de esperar que acabe por resentirse la calidad de la atención. Como se verá luego, los resultados de supervivencia del TR actualmente dependen ya más de la evolución postoperatoria tardía que de las primeras fases. 25 La lista de espera para TR de la provincia de Sevilla ha continuado disminuyendo en 2000, en cuanto a número total (figura 4). Pero en realidad los casos en lista activa han aumentado en un 11% (figura 5). Esto se debe a la actividad de depuración de la lista de espera desarrollada durante el último año. En colaboración con los centros de diálisis, se han revisado los casos clasificados como en «contraindicación» temporal, con recuperación de algunos de ellos tras las actuaciones oportunas; es probable que este proceso continúe durante este año próximo. Aún así, la proporción de pacientes de diálisis en lista activa sigue siendo del 15%, más baja que en el conjunto de la región. Como es lógico, la ligera ampliación de la lista de espera junto a la reducción del número de TR han dado lugar a una estabilización en la proporción de lista de espera trasplantada en el año (figura 6). Como se presenta en otro capítulo de este libro, recientemente hemos modificado los criterios de selección del receptor de TR, concediendo un mayor peso a la antigüedad en lista de espera. Como consecuencia (figura 7) en la casuística del pasado año casi se han duplicado la proporción de retrasplantes y la duración de la estancia en diálisis de los primeros TR. Resultados de los TR en 2000: de 53 trasplantes efectuados en este año, los 52 TR permanecían vivos a 19/01/2001 y el trasplante hepato-renal falleció por hemorragia digestiva. En esa fecha, 4 TR estaban aun en el postoperatorio inmediato dependientes de diálisis. Se habían perdido 4 injertos debido a: nefrectomía electiva por detección de cáncer de próstata invasivo en el donante; trombosis venosa; hemorragia en el injerto y multifactorial (riñón subóptimo con problemas de vías y rechazos repetidos). En conjunto los resultados a corto plazo han sido buenos (mortalidad nula en TR y menos del 10% de pérdidas de órgano en primer año, hasta ahora). Los TR de un centro en un solo año representan una muestra pequeña, expuesta a resultados muy variables por mero azar. En la figura 8 mostramos la supervivencia (SV) al final del primer año del paciente y del órgano para cada una de las anualidades desde el comienzo del programa: puede apreciarse, dentro de una determinada tendencia general, hasta qué punto oscilan los resultados de un año a otro. Por ello, deben hacerse análisis de SV por periodos, o en muestras mucho mayores. La figura 9 recoge la curva general de SV de paciente para el total de los TR de nuestro servicio, a 17/01/2001. Se muestran 3 formas distintas de cálculo: método clásico, el que se sigue al paciente hasta su paso a diálisis; método corregido, con ampliación del periodo de observación a los primeros 120 días tras el fracaso del órgano, y SV tras el trasplante, en el que seguimiento continúa durante la diálisis hasta el fallecimiento del paciente o un nuevo trasplante. El 2º método, que recoge la mortalidad muchas veces atribuible al TR ocurrida en las primeras semanas de la vuelta a diálisis, es el que consideramos más adecuado. Como puede comprobarse, las peores cifras corresponde a la curva tras el trasplante, indicando una peor SV del paciente en diálisis, la selección de los mejores receptores para el restrasplante, o ambas cosas. Sin embargo estas cifras históricas no expresan bien el pronóstico actual del TR en nuestro servicio. En los últimos 10 años (figuras 10 y 11), la SV del paciente a 1, 5 y 10 años es de 97 %, 93 % y 82 % respectivamente, y la del órgano, de 87 %, 77 % y 54 % para los mismos tiempos. Es de destacar que la mayor parte de la mejoría en la SV del injerto se ha registrado en el primer año de postoperatorio. A partir de ahí las curvas de SV tienen la misma pendiente y al cabo de los 10 años la diferencia entre ambos grupos se mantiene igual. Este fenómeno, observado de forma casi general por los grandes registros de TR y los centros individuales, viene a indicar que, al menos en lo que atañe a la ciclosporina, las pautas empleadas hasta ahora no previenen la llamada nefropatía crónica del trasplante, principal causa de pérdida de órganos después del primer año. En la SV del paciente sí es posible que estemos asistiendo a una mejoría mantenida, al menos en el medio plazo. La proporción de riñones con buena función inicial (no necesidad de diálisis en el 26 postoperatorio inmediato) sigue siendo poco satisfactoria: apenas la mitad de los casos. En ello influyen numerosos factores, algunos de difícil corrección como las cada vez peores características de los donantes en cuanto a edad y estado vascular. En el próximo año pretendemos analizar el problema en nuestro contexto específico. De entre los factores en los que es posible intervenir, destaca la duración de los tiempos de isquemia. En la figura 13 se demuestra una relación significativa entre la duración de la isquemia fría y la incidencia de riñones nunca funcionantes y con necrosis tubular inicial. Actualizaciones en Trasplantes 2001. Finalmente en la figura 14 pretendemos poner de manifiesto el impacto de los nuevos fármacos sobre la incidencia de rechazo agudo, muy en particular el del mofetil micofenolato. En nuestra serie, como ocurre en todos los análisis, la incidencia de rechazo agudo durante el primer año se ha asociado (en los pacientes tratados con ciclosporina, con o sin inducción) a una peor SV del injerto a largo plazo. Queda por ver ahora si la reducción obtenida en la incidencia de rechazo agudo se sigue de una mejoría de la evolución posterior. 27 28 29 Actualizaciones en Trasplantes 2001. 30 31 Actualizaciones en Trasplantes 2001. Trasplante renal infantil en Sevilla. Memoria asistencial año 2.000 J. Fijo, A. Sánchez. A, Moreno, R. Bedoya, A. Caraballo, J. Martín-Govantes. Unidad de Nefrología Pediátrica. 32 33 Actualizaciones en Trasplantes 2001. Actividad trasplantadora de la Unidad de Cirugía Hepatobiliopancreática y Trasplante Hepático durante el año 2000 *Pareja Ciuró, F.; *Serrano Díez-Canedo,J.; *Gomez Bravo, M.A.; *García Gonzalez, I.; *Díaz Aunión, C.; *Tamayo, M.J.; ** Pérez Bernal, J.; **Hinojosa Pérez, R.; ***Cañas,E.; ****Sousa Martín, J.M. *****Bernardos Rodríguez,A. *Cirujanos de la Unidad de CHBP yT; **Medicina Intensiva;***Enfermedades Infecciosas;****Aparato Digestivo*****Jefe de Sección de la Unidad de Cirugía Hepatobiliopancreática y Trasplante Hepático. Hospitales Universitarios Virgen del Rocío. Unidad de Cirugía Hepatobiliopancreática y Trasplante Hepático. INTRODUCCIÓN Durante el año 2000 nuestra unidad ha continuado consolidando el Programa de Trasplante Hepático iniciado en el año 1990. Durante este año se ha producido un descenso en el número de trasplantes realizados, que coincide con un receso en el número de donaciones que ha sido generalizado en toda nuestra comunidad autónoma. Este descenso, sin embargo, no ha frenado la tendencia a la mejora continua de los resultados obtenidos. Como principal novedad en este año cabe destacar el aumento del arsenal terapeutico destinado a la prevención del rechazo, habiendo introducido en la práctica clinica el uso de los nuevos anticuerpos monoclonales, así como el uso rutinario del mofetilmicofenolato, lográndose una cifra de rechazo inferior al 30% y una supervivencia cercana al 90%. El número de paciente en lista de espera a principios de 2000 era de 15 y al final de 2000 eran 17 los pacientes que esperaban trasplante hepático. La mortalidad en lista de espera ha sido de 1 enfermo (1.8% de mortalidad en lista). Otros 2 pacientes fueron excluidos de lista de espera por progresión de enfermedad maligna. El tiempo medio de lista de espera ha variado según grupo sanguíneo, siendo de 27.6 días para el grupo A, 107.1 días para el grupo AB, 141.2 días para el grupo B y 212.8 días para el grupo 0. Dos 34 pacientes del grupo 0 pasaron del año en lista de espera. MATERIAL Y MÉTODOS Durante el año 2000 nuestra unidad ha realizado un total de 39 trasplantes ortotópicos de hígado, todos ellos de tamaño completo y uno combinado (hígado-riñón). El número de pacientes trasplantados ha sido también 39, si bien, en dos de ellos se trataba del segundo injerto que recibían, habiendo recibido el primero hacía 16 y 20 meses respectivamente. De los 39 pacientes, 28 (71.8%) fueron hombres y 11 (28.2%) mujeres. La edad media fue de 51.6 años con un rango entre 21 y 68 años. La principal causa de trasplante fue la cirrosis alcohólica pura (15 pacientes, 38.4%), seguido de la cirrosis por VHC (11 pacientes, 28.2%). En 5 pacientes la cirrosis fue mixta por VHC y alcohol, mientras que 3 pacientes padecían cirrosis por VHB. Los restantes fueron 2 pacientes con cirrosis criptogenéticas, 2 retrasplantes y 1 pacientes con cirrosis biliar primaria. En los dos pacientes sometidos a retrasplante, la causa del mismo fue un rechazo crónico. (figura 1) Un total de 20 pacientes (51.2%) se encontraban en estadío B de Child-Pough en el momento del trasplante, mientras que 17 pacientes se encontraban en estadío C (43.6%). En los dos pacientes sometidos a retrasplante no procedía la clasificación de Child-Pough . (figura 2) Todos los injertos procedieron de donantes cadáveres. En nuestro hospital se generaron un total de 15 (38.4%) órganos, de otros hospitales de la ciudad procedían 4 (10.2%) y del resto de la comunidad autónoma procedían 17(43.6%). Los 3 restantes fueron generados en hospitales de fuera de la comunidad andaluza. (figura 3). Ninguno de los trasplantes constituyó una alerta 0. Un total de 8 injertos nos fueron remitidos por otras unidades, mientras que nuestra unidad ha remitido un total de 5. Actualizaciones en Trasplantes 2001. La edad media de donantes fue de 42.9 años, con un rango entre 14 y 75 años (figura 4). Un total de 25 (64.1%) donantes fueron hombres y los 14 restantes mujeres. La principal causa de muerte sigue siendo desde hace unos años el AVC hemorrágico (17, 43.6%), seguido del TCE por accidente de tráfico (15, 38.4%). (figura 5). 35 El tipo de extracción se realizó según técnica clásica en 35 donantes, constituyendo la técnica de elección. En 4 donantes se realizó extracción rápida por inestabilidad hemodinámica. La mayoría de donantes precisó alguna droga vasopresora para su mantenimiento, siendo necesaria dopamina en 21 donantes, noradrenalina+dopamina en 12 casos y dobutamina+dopamina en 1. En solo 5 donantes no fue precisa ninguna droga. Un total de 10 (25.6%) donantes presentaron alguna anomalía de la vascularización hepática, siendo la arteria hepática derecha procedente de la arteria mesentérica superior la anomalía más frecuente (60%). De todas ellas, un total de 7 precisó algún tipo de anastomosis añadida en cirugía de banco Según criterios clínicos, analíticos y macroscópicos, el equipo extractor consideró el Figura 1 Figura 2 Figura 3 36 Figura 4 Figura 5 Actualizaciones en Trasplantes 2001. injerto como óptimo en 26 (66.6%) ocasiones y subóptimo en 13. 37 El trasplante se realizó entre donante y receptor con mismo Rh e isogrupo en 26 ocasiones. En 10 casos el trasplante fue isogrupo pero con distinto Rh, mientras que en los 3 restantes donante y receptor eran de distinto grupo sanguineo, pero compatible. En todos los pacientes se realizó profilaxis antibiótica con ceftriazona 1 gr durante la inducción anestésica y dos dosis más a las 8 y 16 horas de la primera. La hepatectomía en el receptor se realizó según la técnica de preservación de cava (piggy-back) en 37 ocasione, constituyendo la técnica de elección siempre que sea técnicamente posible o se trate de un hepatocarcinoma. La reconstrucción se realiza mediante anastomosis de vena cava del donante a venas suprahepáticas del receptor, tratando de lograr una boca anastomótica lo más amplia posible, lo cual, suele lograrse uniendo las bocas de las venas suprahepáticas media e izquierda y en ocasiones incluso la derecha. La cava inferior del donante se cierra con sutura continua. No ha sido preciso realizar ningún by-pass vevovenoso. Apreciamos la existencia de trombosis portal en 6 pacientes, sin que fuera conocida a priori dicha trombosis. En 5 de ellos fue posible la trombectomía logrando un buen flujo en la vena porta y permitiendo una anastomosis termino-terminal entre vena porta de donante y receptor. En un paciente resultó tratarse de una trombosis tumoral masiva (hepatocarcinoma) de toda la porta que afectaba a las venas esplénica y mesentérica superior, no siendo posible lograr flujo mediante trombectomía ni embolectomía, ni siendo tampoco posible la revascularización mediante injerto venoso. En este caso la revascularización portal la realizamos mediante anastomosis cavo-portal. La reconstrucción arterial se realizó, siempre que fue posible, entre el tronco celíaco del donante y la bifurcación entre arteria hepática y gastroduodenal del receptor. Debido a la presencia de anomalías en vascularización del injerto, fue preciso realizar anastomosis arterial adicional en cirugía de banco en 7 casos (17.9%). La anastomosis biliar se realizó mediante coledoco-coledocostomía termino-terminal sobre tubo en T en todos los pacientes excepto en uno de ellos, al que se le realizó hepaticoyeyunostomía. Éste paciente fue uno de los dos retrasplantes y presentaba una colangitits esclerosante como motivo de su primer trasplante. Las pautas inmunosupresoras aplicadas durante este último año han venido marcadas por la introducción de dos nuevos anticuerpos monoclonales: basiliximab y daclizumab. Se han aplicado cuatro tipos de regímenes, dos de ellos clásicos y otros dos, en el contexto de ensayos clínicos, en los que se han administrado los nuevos anticuerpos monoclonales. En 6 pacientes se administró la pauta clásica de ciclosporina, esteroides y azatioprina. Se administró otra pauta clásica a base de tacrolimus y esteroides (con/sin azatioprina) en un total de 11 pacientes. Otros 13 pacientes fueron tratados con un régimen basal de tacrolimus y micofenolato junto a dos dosis de daclizumab a razón de 2 mg/kg de peso el primer día y 1 mg/kg de peso al séptimo día. Un último grupo ha recibido ciclosporina y esteroides junto a dos dosis de basiliximab (20 mg) el primero y cuarto día postrasplante. RESULTADOS Se han trasplantado un total de 39 pacientes de los que 34 viven en el momento actual, lo que supone una supervivencia actuarial tanto de pacientes como del injerto del 87.2%. Se han producido 3 fallecimientos dentro de los primeros 30 días, uno a los 40 días y otro a los 4 meses y medio. (figura 6) Un paciente fallece a los 5 días del trasplante por hemorragia digestiva masiva por hipertensión portal e insuficiencia hepática, tratándose del paciente con trombosis masiva tumoral de la vena porta y cuyo injerto se revascularizó mediante anastomosis cavoportal. Un segundo paciente fallece a los 9 días por sepsis bacteriana y fracaso multiorgánico desencadenado por neumonía por posible broncoaspiración. A los 15 días fallece el pa38 ciente sometido a trasplante hepatorrenal tras haber presentado peritonitis fecaloidea secundaria a necrosis isquémica de sigma. A los 40 días fallece otro paciente tras presentar fracaso renal agudo que precisó hemodiálisis y presentó ascitis refractaria que precisó paracentesis repetidas y frecuentes, produciédose una peritonitis fecaloidea tras punción accidental de colon. Un quinto paciente fallece a los 4 meses y medio, encontrándose previamente bien y con magnífica función del injerto, tras presentar un accidente vasculocerebral hemorrágico. Se han producido un total de 10 casos de rechazo agudo comprobado mediante biopsia, lo que supone una tasa de rechazo del 25.6% (figura 7). Según la clasificación de Snover, 4 de ellos fueron rechazos grado I, respondiendo uno al aumento de la inmunosupresión basal y los tres restantes a un bolo de esteroides. Otros 6 fueron rechazos grado II, que se trataron mediante dos o tres bolos de esteroides y precisando uno de ellos reconversión de ciclosporina a tacrolimus. De los pacientes con rechazo grado II, fallecieron dos pacientes. No se produjo ningún rechazo grado III. Ningún paciente precisó la administración de OKT-3 para el control del rechazo (no se utiliza desde mayo de 1998). En conjunto, el 90% de rechazos fue corticosensible. La incidencia de rechazo ha variado según pauta inmunosupresora, de manera que la tasa de rechazo fue de 33.3% en los grupos tratados con CyA/Esteroides (2 pacientes de 6) y con Basiliximab/CyA/Esteroides (3 pacientes de 9), mientras que en los tratados con FK/Esteroides fue del 27.3% (3 pacientes de 11) y en el grupo tratado con Daclizumab/ FK/MMF fue de solo 15.4% (2 pacientes de 13). (figura 8) El tiempo medio de isquemia venosa fue de 361 minutos (6 horas 1 minuto) y la isquemia arterial media fue de 397 minutos (6 horas 33 minutos). En la figura 9 se aprecia la reducción progresiva en los tiempos de isquemia a lo largo de estos años. Las necesidades medias de hemoderivados fueron de 7.1 unidades de sangre, 10.7 unidades de plasma y 2.9 unidades de plaquetas, lo que también ha constituido una mejora notable en dicho consumo, lo que se aprecia en la figura 10 Actualizaciones en Trasplantes 2001. Entre las complicaciones del injerto, cabe destacar que no se ha producido nunguna malfunción primaria. Se ha producido 1 caso de lesión de preservación comprobada histológicamentey un caso de síndrome colostático benigno. 39 Entre las complicaciones quirúrgicas, cabe destacar que no se ha producido nínguna complicación vascular arterial ni venosa. Tampoco se ha producido ninguna hemorragia postoperatoria que haya precisado revisión quirúrgica. Complicaciones biliares se han presentado en 3 pacientes (7.7%), dos estenosis biliares y una peritonitis biliar por fístula. Las estenosis biliares fueron tratadas ambas satisfactoriamente mediante técnicas de radiología intervencionista, mientras que que la peritonitis biliar precisó drenaje quirúrgico. La incidencia de infección de herida ha sido del 5.1% (2 pacientes) y presentaron hematoma de herida que precisó drenaje otros dos pacientes. 3 pacientes (7.7%) presentaron abceso intracavitario, dos de los cuales precisaron drenaje quirúrgico y uno drenaje percutáneo. Figura 6 Figura 7 Figura 8 40 Figura 9 Actualizaciones en Trasplantes 2001. Figura 10 41 En total 5 pacientes (12.8%) tuvieron que ser reintervenidos. Dos paciente se reintervinieron para realizar drenaje de abcesos intracavitarios. Otro prescisó reintervención por fístula biliar con coleperitoneo, realizándose drenaje de dicha fístula. Dos pacientes precisaron cirugía por presentar abdomen agudo, tratándose ambos casos de una peritonitis fecaloidea, secundaria a una rectocolitis isquémica con perforación libre en un caso y a una perforación de colon izquierdo tras paracentesis en otro caso. Ambos pacientes con peritonitis fallecieron. Las complicaciones renales fueron muy frecuentes, presentándose algún grado de fracaso renal agudo en 29 pacientes (74.3%), de los cuales 3 (7,7%) precisaron diálisis, falleciendo dos de los tres que se dializaron. Menos frecuentes, aunque a tener en cuenta, fueron las complicaciones hematológi- ca, que se han presentado en 18 pacientes (23.1%), siendo la más frecuente la bicitopenia (leucoplaquetopenia) que se produjo en 9 pacientes, seguida de la plaquetopenia (5 pacientes), la pancitopenia (3 pacientes) y un paciente con anemia hemolítica autoinmune. En 16 pacientes se presentó derrame pleural moderado y/o atelectasias, constituyendo la complicación respiratoria más frecuente, seguida de la infección pulmonar aguda (8 casos, 20.5%). Complicaciones digestivas se presentaron en 14 pacientes (35.8%), siendo la más frecuente el íleo paralítico prolongado (7 pacientes, 17.9%), seguida de la hemorragia digestiva alta (5 pacientes, 12.8%) Las complicaciones neurológicas también fueron frecuentes (10 pacientes, 25.6%), pero generalmente leves-moderadas, tratándose la mayoría de cuadros de temblores, desorientación y alguna convulsión, en relación con una etiología multifactorial en la mayoría de casos. Cuatro pacientes (10.2%) han desarrollado una hipertensión arterial que ha precisado tratamiento antihipertensivo. Un paciente (2,5%) presentó un cuadro de arritmia por taquicardia supraventricular. Se produjo algún episodio de infección bacteriana en 16 pacientes (41.0%), enfermedad por citomegalovirus en 4 pacientes (10.2%) y por hongos en un solo paciente (2.5%). En conjunto, la experiencia del año 2000, confirma la línea progresiva de mejora en resultados obtenidos, esperando dicha mejora constituya el inicio de nuevos retos dentro del campo de trasplante hepático. 42 RESULTADOS DEL PROGRAMA DE TRASPLANTE CARDIACO AÑO 2000. HOSPITAL UNIVERSITARIO VIRGEN DEL ROCIO. SEVILLA. Antonio Ordóñez, José Miguel Borrego, Encarnación Gutierrez, Antonio Alvarez, Ernesto Lage, Rafael Hinojosa, José Miguel Cisneros, José Pérez-Bernal, Ana Hernández, Auxiliadora Pacheco. Hospital Universitario Virgen del Rocío. Sevilla. El trasplante cardiaco hoy es una realidad consolidada en nuestro Hospital y aporta una solución valida a los pacientes en insuficiencia cardiaca terminal sin otras posibilidades medico-quirurgica. Actualizaciones en Trasplantes 2001. Durante el año 2000 se han realizado en nuestro hospital un total de 15 trasplantes cardiacos. Siendo la distribución por trimestre de la siguiente forma: 43 - Primer trimestre: cuatro trasplantes cardiacos. - Segundo trimestre: dos. - Tercer trimestre: tres. - Cuarto trimestre: cinco. Hemos observado como detalle más importante que durante los meses de verano, julio y agosto, ha descendido de forma importante la oferta de donantes a nuestro hospital y a nuestro programa, con respecto a años anteriores. En relación a las características de nuestros receptores este año la edad media ha sido 52 +/- 5 años ( 43 60); el peso medio ha sido 76,9 +/- 8,8 Kg, (61- 90). La mayoría de los pacientes fueron del sexo masculino, con un 86,7% de varones frente al 13,3% de mujeres. El grupo sanguíneo más numeroso entre los receptores, fue el grupo sanguíneo A, como en años anteriores (73%), seguido del grupo 0 (20%) y 1 paciente del grupo B (6,7%). La enfermedad de base, el diagnóstico más habitual entre nuestros pacientes en el año 2000, fue la cardiopatía isquémica de nuevo, como en los últimos años, continua la tendencia de crecimiento de la cardiopatía isquémica frente a la disminución de la dilatada de forma que el 66,7% fueron pacientes isquémicos, un 26,7% miocardiopatías dilatadas y un paciente (6,7%) fue sometido a retrasplante de corazón por enfermedad vascular crónica del injerto. Este es el primer retrasplante de corazón que se realiza en el Hospital Universitario Virgen del Rocío. Con respecto a los antecedentes y al estado funcional de los pacientes, la mayoría de ellos no estaban con tratamiento inotrópico intravenoso en el momento del trasplante (73,3%) pero un 26,6% de los enfermos lo que corresponde a 4 pacientes si estaban hospitalizados precisando tratamiento inotrópico intravenoso. El grado funcional mayoritario en nuestros pacientes fue el grado funcional IV (53,3%), seguido del grado funcional III (46,7%); en ningún caso en este año existieron pacientes en grado funcional I o II para trasplante. En relación a los datos hemodinámicos la presión de arteria pulmonar sistólica media fue 43,15 +/- 15,9 mmHg (13-75), destacando que 4 de los pacientes presentaron una presión arterial pulmonar sistólica mayor de 50. En la presión arterial pulmonar diastólica la media fue 25,4 +/- 11,9 mmHg (0-48) y en la presión arterial pulmonar media 31,8 +/- 13,3 mmHg (8-57). 5 pacientes presentaron presión de arteria pulmonar media mayor o igual a 30 lo que corresponde a que un 33,3% de los pacientes se encontraban en rango de hipertensión pulmonar severa en el momento del trasplante. La presión capilar pulmonar era de 26,7 +/- 13,2 mmhg (3-50) y la fracción de eyección media en nuestros pacientes para el momento del diagnóstico fue el 23% + 14% (10-60). Las resistencias vasculares pulmonares fueron 1,7 +/- 6 U.W (0,8-3). Cuatro de los pacientes presentaron resistencias vasculares pulmonares superiores o iguales a 2 u.w. en el momento del trasplante y por lo tanto se encontraban en rango definido por hipertensión pulmonar severa. El gradiente transpulmonar medio fue 6,7+2,4 mmHg (3-10). Entre los factores de riesgo o antecedentes personales más frecuentes en nuestros enfermos está la hipertensión arterial presente en 5 pacientes (33,3 %) , la hipercolesterolemia, factor de riesgo habitual en la cardiopatía isquémica (53,3%) de los enfermos, obesidad (26,7%) y diabetes previa (20%). Este es un dato importante a destacar ya que hasta hace unos años la diabetes era una contraindicación formal para trasplante, posteriormente se convirtió en relativa y hoy por hoy es uno de los factores que aunque aumenta la morbimortalidad del trasplante no imposibilita su realización. Durante el año 2000 sólo un paciente ha sido trasplantado precisando ventilación mecánica en espera del órgano y este mismo paciente requirió asistencia circulatoria mecánica mediante balón intraaórtico de contrapulsación, ya que se trato de un síndrome postcardiotomía tras una cirugía de revascularización coronaria con circulación extracorporea, que requirió la indicación de un trasplante cardiaco ya que el paciente no supero la situación de shock cardiogénico. 44 Como antecedente de reoperaciones cardiacas entre nuestros enfermos, encontramos un 20% de los pacientes, que corresponde a un número de tres; uno de ellos había sido intervenido hacía años de un mixoma cardiaco y posteriormente ha padecido una cardiopatía isquémica que ha llegado a su grado terminal por la que es trasplantado. El segundo paciente es el que hemos comentado anteriormente que se trasplanta en situación de urgencia y existencia de circulación mecánica y ventilación mecánica, con un síndrome postcardiotomía y el último es primer retrasplante de corazón realizado en el Hospital Universitario Virgen del Rocío. Con respecto al grupo de donantes que hemos utilizado este año para la realización de los trasplantes, la edad del donante media ha sido 26+/- 7,5 años (1437). Las causas de muerte más frecuentes se siguen manteniendo, el traumatismo craneoencefálico 71,4% frente al accidente cerebral vascular que estuvo presente en 21,4% de los donantes. Con respecto al procedimiento quirúrgico el tiempo de circulación extracorpórea medio fue 218,6 +/- 92,2 minutos y el tiempo de isquemia 190,8 +/- 51,1 minutos. Dos de los trasplantes fueron realizados en situación de urgencia; uno es el paciente ya comentado, un síndrome potcardiotomía tras cirugía de revascularización coronaria y el otro se trato de un paciente con cardiopatía isquémica en fase aguda. Esto ha supuesto un 13,3% del total. Actualizaciones en Trasplantes 2001. La mayoría de los enfermos, el 66,7% estaban en su domicilio cuando fueron avisados para la realización del trasplante cardiaco, pero un 33,3% es decir 5 pacientes, se encontraban hospitalizados y un 20% del total sin necesidad de cuidados intensivos, mientras que un 13,3 % estaban en la UCI en el momento del trasplante. 45 De los 15 enfermos, 4 han fallecido después del procedimiento, todos ellos en la primera semana postrasplante. Las causas de muerte han sido en un caso fracaso multiorgánico. Este es el caso del paciente que fue trasplantado por síndrome postcardiotomia tras circulación extracorporea por cirugía de revascularización coronaria. El gran número de horas de circulación extracorporea que preciso este paciente, junto con la mala situación en que se mantuvo hasta la llegada del órgano, provocó un fracaso multiorgánico como causa de su muerte. Los otros tres casos han sido fallo precoz del injerto. En nuestro grupo, como en la mayoría de los grupos de trasplantes, esta es la causa más frecuente de mortalidad; este se define como un fallo del injerto en las primeras 72 horas después del trasplante y se manifiesta clinicamente como un cuadro de shock cardiogénico en el que el injerto implantado no responde a pesar de altas dosis de aminas, incluso de asistencia ventricular con balón intraaórtico. En algunos casos es posible porque la situación del enfermo lo permite, realizar un retrasplante urgente pero en la mayoría de los casos el paciente comienza con deterioro renal, fracaso ventilatorio, encefalopatía multicausal y esto impide la realización de un nuevo trasplante. Con respecto al resto de los pacientes durante el seguimiento podemos fundamentalmente destacar como complicaciones las infecciosas, habiendo observado 8 infecciones en 6 pacientes. Dos de ellos han sufrido dos infecciones cada uno y en cuatro de ellos una infección. Cuatro pacientes han precisado diálisis por insuficiencia renal aguda en el postoperatorio inmediato y en cuatro pacientes se ha precisado la implantación de un marcapasos definitivo. Ha habido un número importante de pacientes, 6, que han presentado encefalopatía postrasplante de origen multifactorial. Más de la mitad de nuestros pacientes han presentado durante el postoperatorio inmediato algún grado de insuficiencia cardiaca derecha, en la mayoría de los casos un grado moderado severo que preciso tratamiento intensivo con diuréticos hasta su control. Acompañando a esta situación también ha sido muy frecuente el fracaso renal agudo aunque como hemos visto sólo en cuatro casos se preciso de la diálisis como apoyo. En relación al estudio de los rechazos de los pacientes el 33,3%, lo que supone un 60% de los enfermos que sobrevivieron a la primera semana postrasplante, han presentado rechazo de grado moderado-severo que ha precisado algún tipo de tratamiento para su control. De estos 6 pacientes con grado de rechazo moderado-severo (a partir del grado 2B), tres de ellos fueron pacientes asintomáticos a pesar del hallazgo en la biopsia y en dos de ellos el rechazo si provocó una descompensación cardiaca importante con repercusión hemodinámica y fallo congestivo severo. Estos enfermos respondieron satisfactoriamente a la optimización del tratamiento inmunosupresor. Actualmente todos los pacientes se encuentran de alta en su domicilio con buena recuperación de su calidad de vida y en revisiones periódicas para biopsias de control del rechazo. 46 47 Actualizaciones en Trasplantes 2001. 48 49 Actualizaciones en Trasplantes 2001. TRASPLANTE DE PROGENITORES HEMATOPOYÉTICOS. MEMORIA AÑO 2.000. J.M. Rodríguez-Fernández, R. Parody, J. Mª. Pérez-Hurtado, M. Carmona, I. Espigado, A. Vaquero. Servicio de Hematología y Hemoterapia. · Nº DE TRASPLANTES REALIZADOS: 52 (27V / 25M) · EDAD MEDIA: 33 años (4-58) · PACIENTES CON EDAD IGUAL o < 15 AÑOS: 8 (15%) PROCEDENCIA DE LOS PACIENTES - S.HEMATOLOGIA HUVR ...................................... 26 - ONCOLOGIA HUVR (adultos) ................................ 4 - REUMATOLOGÍA HUVR ........................................ 1 62% - ONCOLOGÍA HUVR (niños) ................................... 1 - S.HEMATOLOGIA H.U.MACARENA ....................... 5 - ONCOLOGÍA H.U.MACARENA (niños) ................. 3 - S.HEMATOLOGIA H.U.VALME ................................ 3 - H.MILITAR SEVILLA ................................................. 2 38% - S.HEMATOLOGIA HUELVA ..................................... 6 - GRANADA .............................................................. 1 TIPO DE TPH - TPH AUTÓLOGOS .............................................. 36 62% - TPH ALOGÉNICOS .............................................. 16 38% 50 FUENTE DE PH - MÉDULA ÓSEA .................................................... 10 19% - SANGRE PERIFÉRICA ........................................... 42 81% EN ESTE AÑO SE HA INICIADO EL PROGRAMA DE INFUSIÓN DE LINFOCITOS DEL DONANTE (ILD) PARA CASOS DE RECIDIVAS POST-ALO TPH - ILD realizadas .......................................................... 6 PROGRAMA TPH DE S.HEMATOLOGÍA DE H.U.V. DEL ROCÍO. SEVILLA DIAGNOSTICOS Y PROCEDIMIENTOS Actualizaciones en Trasplantes 2001. MEMORIA AÑO 2.000 51 DIAGNÓSTICOS TASPE TAMO ALO TMO ALO TMO NO EMP. ALO TSP TOTAL L.No Hodgkin 10 3 0 0 0 13 L. Hodgkin 2 1 0 0 0 3 LLC 1 0 0 0 1 2 MM 2 1 0 0 0 3 LMA 3 1 0 0 6 10 SMD 1 0 0 0 0 1 LLA 2 2 1 0 1 6 LMC 0 0 0 0 5 5 A. Fanconi 0 0 1 0 0 1 HPN 0 0 0 0 1 1 PTT 1 0 0 0 0 1 A. Reumat. 1 0 0 0 0 1 Ca. Mama 2 0 0 0 0 2 S. Ewing 1 0 0 0 0 1 Neuroblast 2 0 0 0 0 2 TOTALES 28 2 2 0 14 52 - PROCESOS HEMATOLÓGICOS ......................... 46 88% - PROCESOS NO HEMATOLÓGICOS ................... 6 12% PROGRAMA TPH DE S. HEMATOLOGÍA DE H.U. VIRGEN DEL ROCÍO. SEVILLA. MEMORIA AÑO 2.000 TASPE TAMO 28 14V/14M 33(4-53) 8 4V/4M 37(6-58) 9 3 2 1 3 1 2 6 LLA 3 1 1 5 LLC 1 1 2 MM 2 ENFERMOS SEXO EDAD (media) DIAG. LNH LH LMA SMD (AREB) ALO - TSP ALO - TMO 14 9V/5M 35(15-55) 2 0V/2M 10(9-11) TOTAL 52 27V/25M 33(4-58) 12 4 10 1 1 3 LMC 5 5 HPN 1 1 AAS 1 1 A.FANCONI 1 1 TUM. SÓLID. 5 5 ENF.A.I. 2 2 G-CSF 2 6 1 1 10 RECUPER. POST - TPH (DÍAS) 100 NEUT. 10(4-17) 10(7-13) 13(11-16) 10(10-11) 11(4-17) 500 NEUT. 13(8-22) 16(10-29) 15(11-24) 11(11-12) 14(8-29) NO PLAG 12(0-22) 17(9-29) 16(0-29) C.HEMAT 2(0-8) 5(2-7) 3(0-10) 2 3(0-10) C. PLAQ 6(0-13) 10(4-18) 9(4-17) 14(8-28) 10(0-28) NUT. PARENT 6(0-15) 11(5-21) 8(0-16) 12(7-17) 9(0-21) 21(15-33) 23(14-35) 21(24-18) 21(8-35) 16(10-27) 18(11-24) TRANSFUS ESTANCIAS POST-TPH* (media) 18(8-33) MRP** 1 1 0 0 2(4%) 52 *Contabilizadas desde día de TPH a fecha de alta en Unidad TPH. La media de estancias hospitalarias total en Unidad TPH ha sido 28. ** MRP= Mortalidad en los primeros 100 días post-TPH no achacable a recaida. INDICE OCUPACIÓN DE LA UNIDAD TPH: 73% Atendiendo a la normativa vigente, una vez dado de alta a los enfermos hay que efectuar control epidemiológico de cada habitación, lo que supone una serie de días sin posibilidad de ingresos. PROGRAMA ALO-TPH HUVR.- SEVILLA EVOLUCIÓN DE PACIENTES ALO-TRASPLANTADOS AÑO 1 (100%) 2 (50%) 3 (42%) 5 (29%) 3 (21%) 5 (36%) 1 2 7 7 11 10 SIGUEN VIVOS (31/12/99) 0 2(50%) 0 10(59%) 3(21%) 4(29%) 10 (38%) 2 (8%) 12 (46%) 14(54%) 11 0 2 (18%) 2 9(82%) 1.999 22 4(18%) 4 (18%) 8 (36%) 14(64%) 2.000 16 1 (6%) 1 (6%) 2 (12%) 14(88%) 132* 34(26%) 28(21%) 62(47%) 70(53%) Actualizaciones en Trasplantes 2001. RECAIDA 1.991 1.992 1.993 1.994 1.995 1.996 1 4 7 17 14 14 4 2 8 5 1.997 26 1.998 TOTALES 53 Nº DE ALOTPH 0 0 (58%) (12%) (57%) (36%) Nº DE FALLECIDOS MRP TOTAL *ALO-NO EMPARENTADOS: 15 ( 11,3%) PROGRAMA AUTO-TPH HUVR.- SEVILLA EVOLUCIÓN DE PACIENTES AUTOTRASPLANTADOS AÑO 1.988 1.989 1.990 1.991 1.992 1.993 Nº DE AUTO-TPH 1 11* 14 13 12 24* 1.994 28 12 (43%) 1 (3%) 13 15(54%) 1.995 27 14(%) 3 (11%) 17 10(%) 1.996 28 6(21%) 0 (0%) 6 22(79%) 1.997 26 5(19%) 0 (0%) 5 21(81%) 1.998 42 7(17%) 0 (0%) 8* (19%) 34(81%) 1.999 35 3 (9%) 2 (6%) 5 (15%) 30(85%) 2.000 36 2 (6%) 2 (6%) 4 (11%) 32(89%) TOTAL 297 79(27%) 20(7%) 100(34%) 195(66%) RECAIDA 6 8 6 4 6 (55%) (57%) (46%) (33%) (25%) FALLECIDOS MRP 1 (100%) 1 (9%) 2 (14%) 0 (0%) 4 (33%) 4 (14%) TOTAL 1 7 10 6 8 10 SIGUEN VIVOS 0 3(30%) 4(29%) 7(54%) 4(33%) 13(57%) PROGRAMA TPH HUVR. SEVILLA DATOS EVOLUTIVOS COMPARATIVOS TIPO TPH AUTO-TPH ALO-TPH Nº DE TPH A 31/12/00 297 132 FALLECIDOS POR: RECAIDAS MRP TOTAL 79(27%) 34(26%) 20(7%) 28(21%) 100(34%) 62(47%) SIGUEN VIVOS A (31/12/99) 195(66%) 70(53%) 54 TOTALES 429 TIPO DE TPH (años 1.989-2.000) FUENTE DE PH Actualizaciones en Trasplantes 2001. (años 1.988 a 2.000) 55 113(26%) 48(11%) 162(38%) 265(62%) MEDIAS DE ESTANCIAS EN UNIDAD TMO AÑO 1.989 1.990 1.991 1.992 1.993 1.994 1.995 1.996 1.997 1.998 1.999 2.000 TAMO 50 46 43 44 33 35 32 34 28 27 39 TASPE ALO-TPH 30 27 30 27 29 25 26 26 32 33 33 33 38 31 30 34 30 27 MEDIAS DE ESTANCIAS HOSPITALARIAS EN UNIDAD TPH (años 1989 a 2.000) 56 MEMORIA DEL BANCO SECTORIAL DE TEJIDOS DEL C.R.T.S. SEVILLAHUELVA 2.000 Gertrudis Pereira Gutierrez. Francisco Fernández Palacios. Centro Regional de Transfusiones Sanguíneas. Sevilla Como en otros años para mejor comprensión y valoración del trabajo realizado en el Banco Sectorial de Tejidos de este CRTS, diferenciaremos las tareas realizadas en tres apartados importantes. Para ello nos referiremos a las actividades de recepción de muestras de donantes potenciales y receptores; procesamiento de los tejidos recibidos y distribución de diferentes tejidos, incluyendo las relaciones con otros Bancos de Tejidos y Coordinación de trasplantes. Y en otro orden de cosas las actividades formativas como asistencias a cursos, congresos, formación continuada... MUESTRAS ESTUDIADAS: Actualizaciones en Trasplantes 2001. Hemos recibido muestras de donantes potenciales y muestras de receptores, las cuales se han procesado como si de donantes de sangre se trataran, efectuándoles a todas y cada una de ellas, Grupo y Rh, Antígeno de superficie de hepatitis B, ALT Anticuerpo de la hepatitis C, anticuerpo para el VIH, RPR . En el último trimestre se introduce la realización de la PCR para VIH y VHC a las muestras procedentes de donantes de tejidos reales. 57 Igualmente, a todos las muestras que se han comprobado pertenecian a donantes efectivos, ya fueran de órganos o de tejidos, y a todos los receptores que habían recibido algún aloinjerto, se les ha guardado suero en la seroteca que de estos donantes/receptores se tiene en este B.T. Dentro del apartado de donantes vivos han sido 37 los donantes, y 29 dentro del apartado de donantes cadaver, bien de órganos y/o tejidos. De los donantes órganos/tejidos, anteriormente referidos, nos han enviado: PIEL: Recepción: 15.730 cm2 perteneciente a 5 donantes, la procedencia de los cuales ha sido 2 del H.U.V.Rocío y 1 H.U.V.Macarena y 2 del H.U.J.Ramón Jimenez. Del material recibido para criopreservar se desecharon un total de 1.525 cm2 por mala calidad del tejido. Procesamiento y almacenamiento: 14205cm2 de piel se han procesado y validadao, el procesamiento se ha realizado utilizando DMSO como crioprotector y efectuando siempre la congelación en congelador programable; el almacenamiento se ha efectuado siempre en N líquido en fase líquida. Por presentar microbiología positiva se han desechado 835 cm2 . Distribución: Se han distribuido 14.190 cm2 , estos 14.195 cm2 se han utilizado para 3 pacientes de la unidad de quemados del H.U.V.Rocío, la cantidad solicitada para dichos pacientes ha oscilado entre m2 y cm2. Disponibilidad: A fecha 31 de diciembre de 2.000, se contaba en este Banco Sectorial de Tejidos, con 34.980 cm2 para su distribución. TEJIDO OSTEO-TENDINOSO: Recepción: Se han recibido tejido osteo-tendinoso pertenecientes a donantes correspondientes a donantes multiorgánicos y donantes vivos, obteniéndose un total de 252 aloinjertos que según tipo de piezas otenidas tenemos el siguiente reparto: 209 - piezas de tejido óseo para relleno. 29 - piezas óseas completas para aloinjertos ( estructurales ). 12 - piezas osteo-tendinoso (hueso-tendón). 2 - aloinjertos ligamentos La distribución según la procedencia de los hospitales de estos aloingertos, ha sido la que se relaciona a continuación: 58 Piezas óseas completas para aloinjertos ( estructurales ): 22 - del H.U.V.Rocío. 00 - del H.U.V.Macarena. 05 - del H.U.Juan Ramón Jimenez Piezas óseas para relleno: 113 - del H.U.V.Rocío. 40 - del H.U.V.Valme 10 - del H.U.V.Macarena. 46 - del H.U.Juan Ramón Jimenez. Piezas osteo-tendinoso. 03 - del H.U.V.Rocío. 01- del H.U.V.Valme 04 - del H.U.V.Macarena. 04 - del H.U.Juan Ramón Jimenez. Piezas aloinjerto ligamentos. 02- del H.U.V. Rocío. Se han desestimado 23 de las piezas del total, siendo 20 de relleno y 3 de tipo estructural. Los motivos que han ocasionado los referidos rechazos se han repartido de la siguiente forma: 6 - por tener los donantes reactividad frente alguno de los marcadores serológicos habituales. 13 - por ser piezas cuyo control microbiológico ha sido positivo. 02 - por alteraciones detectadas en el estudio de anatomia patológica. 01 - por alteraciones detectadas en el mantenimiento y/o conservación. 02 - por contaminación / manipulación. 05 - por cifras elevadas frente a diferentes marcadores tumorales. Actualizaciones en Trasplantes 2001. Procesamiento y almacenamiento: 59 Tanto las piezas para relleno como las de uso para sustitución estructural, se han congelado directamente a -80° C sin ningún tipo de manipulación previa y se han mantenido a esta temperatura hasta su distribución o anulación. Distribución: Se han distribuido 237 aloinjertos de tejido óseo según relación siguiente. Piezas óseas completas para aloinjertos ( estructurales ): 27 - al H.U.V.Rocío. 04 - al H.U.V.Macarena. 01 - al H.U.Juan Ramón Jimenez. 01 - al H.U.V.Valme. 01 - al CRTS/BST Málaga Piezas óseas para relleno: 115 - al H.U.V.Rocío. 10 - al H.U.V.Valme 49 - al H.U.V.Macarena. 14 - al H.U.Juan Ramón Jimenez. 01 - al H. De S. Lázaro. 01 - al CRTS/BST Jerez Piezas osteo-tendinoso./*ligamentosos 02 - al H.U.V.Rocío. 01 - al H.U.V.Macarena. *01 - al CTS/BT Valencia. 10 - al Hospital Madrid. Con el movimiento referido ha sido posible tratar de diferentes patologías a 224 pacientes, en los cuales se han utilizado 237 aloinjertos. Disponibilidad: A fecha 31 de diciembre de 2.000, se contaba en este Banco de Tejidos, con 54 piezas óseas 14 para relleno, 26 de aloinjertos estructurales y 13 osteotendinoso (HTH) y 1 ligamentoso para su distribución. TEJIDO VASCULAR: Procedentes del CRTS/BST de Córdoba, hemos recibido 3 válvulas pulmonares. Todas ellas han sido distribuidas al H.U.V.Rocío para C.C.V. del Hospital Infantil. En el informe que recoje lo referente al tejido cardiovascular, nuestra actividad sólo se refiere en este año a la distribución de las válvulas que nos han solicitado los hospitales de nuestra área. TEJIDO OFTÁLMICO: En lo referente al tejido para uso oftalmológico, se han recibido y criopreservado 6 córneas procedentes de 3 donantes siendo 4 córneas del H.Puerta del Mar de Cadiz y e del H.U.Virgen del Rocío de Sevilla. Estas córneas criopreservadas, han sido distribuidas 2, una al H.U.Virgen Macarena, y otra al H.U. Virgen de Valme. Quedan en nuestro depósito a fecha 31 de diciembre de 2.000, 5 córneas criopreservadas. 60 Igualmente se recibieron escleras procedentes todas ellas de 3 donantes del H.U.Juan Ramón Jimenez de Huelva. Este tejido esclerar se ha procesado y conservado en nuestro centro, obteniéndose un total de 5 fragmentos. Se han desechado por contaminación y problemas de conservación, 2 de estos fragmentos. Respecto a la distribución, una de ellas fue distribuida al H.U.Juan Ramón Jimenez de Huelva para su implante. Actualmente en nuestro depósito quedan 2 fragmentos de esclera disponibles. Por otro lado y respecto a la criopreservación de membrana amniótica, para uso fundamentalmente oftalmológico, hemos criopreservado 12 bolsas con 1-2 fragmentos por cada, procedentes de una donante,. Procedente del CRTS/BST de Malaga, recibimos dos bolsas con 2-3 fragmentos cada. Referente a la distribución, se ha distribuido una bolsa con dos fragmentos al H.U. Virgen del Rocío. Podemos contar a fecha 31 de diciembre de 2.000 con 13 bolsas criopreservadas. TEJIDO PARATIROIDE: Para pacientes cuyas paratiroides son extirpadas totalmente, se han congelado para su posterior utilización autóloga, por parte del servicio de cirugia del H.U.Juan Ramon Jimenez, se nos solicitó la congelación de una paratiroides que fue alicuotada en 6 fragmentos. TEJIDO REPRODUCTOR: Actualizaciones en Trasplantes 2001. Como servicio a pacientes oncohematológicos y con otros padecimientos potencialmente esterilizantes, hemos continuado en este año con el programa de recogida de Semen de este tipo de pacientes que ha sido solicitado por diferentes servicios, tanto de Oncología como de Hematología, de dentro de nuestra provincia y de otras provincias de nuestra comunidad. 61 Hemos atendido a 26 pacientes que acudieron en un total de 55 ocasiones, habiéndose procesado un total de 125 alícuotas. La procedencia de estos pacientes, ha sido 7 del H.U.V. Macarena y otros 7 del H.U.V.Rocío, 6 del H.U.Reina Sopfía de Córdoba, otros 6 del H.U.Juan Ramón Jimenez de Huelva, y uno del H.U.Vigil de Quiñones. A estos pacientes también se les conserva seroteca y se les ha efectuado la analítica habitual que se realiza a los donantes habituales. Trasplante de Órganos y Diabetes Mellitus D. Acosta Delgado, D González-Duarte y R. Astorga Jiménez Servicio de Endocrinología. Introduccion: En la actualidad, la diabetes mellitus comprende un grupo de alteraciones metabólicas que se caracterizan por la presencia de hiperglucemia, la cual es consecuencia de un defecto en la secreción de insulina, en la acción de la insulina o de ambos. Esta hiperglucemia crónica en la diabetes se asocia con el desarrollo de complicaciones crónicas, que constituyen el síndrome diabético tardío, con afectación de órganos tales como el riñón, el ojo, el sistema nervioso, el corazón y los vasos sanguíneos. Muchos son los procesos patogénicos que desencadenan la aparición de una diabetes, los cuales van desde la destrucción autoinmune de la célula beta pancreática hasta anormalidades que condicionan el desarrollo de insulín-resistencia. La base de la alteración del metabolismo de los carbohidratos, grasas y proteínas es la acción deficiente de la insulina en sus órganos diana. Esta acción deficitaria se puede deber a una escasa secreción de insulina o a una escasa respuesta de los órganos diana a la acción de la insulina. Es necesario conocer también que ambos mecanismos pueden estar presentes a la vez. Con la finalidad de afianzar conceptos, antes de introducirnos en el tema que no ocupa, vamos a recoger la clasificación y los criterios diagnósticos de la diabetes mellitus. CLASIFICACION DE LA DIABETES MELLITUS En la actualidad, la clasificación de este proceso patológico es la siguiente: 1.- Diabetes Mellitus tipo 1: Caracterizada por la destrucción de la célula b pancreática, lo cual va a condicionar una deficiencia insulínica. En ella vamos a distinguir: · Diabetes mellitus tipo 1 A: Inmunomediada · Diabetes mellitus tipo 1 B: Idiopática La Diabetes Mellitus tipo 1 A inmunomediada se caracteriza por la destrucción autoinmune de la célula b pancreática. En ella, marcadores inmunológicos tales como los 62 Anticuerpos Contrainsulares (ICAs), Autoainticuerpos Antiinsulina (AAIs), Autoanticuerpos Anti.Decarboxilasa del Acido Glutámico (Anti- GAD) y Autoanticuerpos Anti-tirosina fosfatasa IA-2 e IA-2b, están presentes en el 85 90% de los individuos en el momento del diagnóstico La Diabetes Mellitus Tipo 1 B idiopática no tiene una clara etiología conocida. En nuestro medio, son pocos los pacientes que pertenecen a esta categoría, si bien es más frecuente en sujetos de origen asiático y africano. Tiene un importante componente genético, no existe evidencia inmunológica de autoinmunidad, no tiene una clara asociación a HLA. 2.- Diabetes Mellitus tipo 2: En este grupo se incluye la mayoría de pacientes con diabetes mellitus de tal manera que un 80% de los pacientes pueden ser incluidos en este tipo de diabetes. En ella, la alteración metabólica va desde la presencia de insulínresistencia hasta la instauración de una marcada insulindeficiencia. Actualizaciones en Trasplantes 2001. 3.- Otros tipos específicos de Diabetes Mellitus: 63 - Defectos Genéticos de la Célula Beta: Este tipo de diabetes se caracteriza por la presencia de diabetes en edades tempranas, conocidas como Diabetes Mellitus tipo MODY (Maturity-Onset Diabetes of the Young), y que se caracteriza por una secreción insulínica alterada, sin que exista alteración en la acción de insulina - Defectos genéticos en la acción de la insulina: En este grupo se incluyen las situaciones de insulinresistencia por mutación del receptor de insulina, hasta situaciones de insulínresistencia por alteración pos-receptor - Enfermedades del páncreas exocrino: Cualquier proceso que afecte al páncreas de manera difusa puede producir diabetes: pancreatitis, traumas, infecciones, pancreatectomía, carcinoma pancreático, etc - Endocrinopatías: Existen varios cuadros endocrinológicos con secreción de hormonas contrainsulares que pueden condicionar diabetes : acromegalia, feocromocitoma, Síndrome de Cushing, glucagonoma. En estos casos, la diabetes aparece en individuos con cierta alteración preexistente en la secreción de insulina. - Diabetes inducida por fármacos: Son muchos los fármacos que pueden estar implicados en el desarrollo de una diabetes, siendo uno de los más conocidos los glucocorticoides - Formas inusuales de diabetes mellitus inmunomediada: Entre ellas encontramos a la diabetes asociada al Síndrome de Hombre Rígido, donde con frecuencia encontramos títulos altos de Anti-GAD. Otro cuadro se caracteriza por la presencia de anticuerpos anti-receptor de insulina, que pueden tener un efecto agonista, dando lugar a hipoglucemias, o un efecto antagonista, dando lugar a cuadros severos de insulínresistencia. - Otros síndromes genéticos asociados a diabetes: Son muchos los síndromes genéticos que se asocian a la presencia de diabetes: Síndrome de Down, Síndrome de Klinefelter, Síndrome de Turner, El Síndrome de Wolfram, caracterizado por la presencia de diabetes mellitus, diabetes insípida, atrofia óptica, sordera y alteraciones del tracto urinario 4.- Diabetes Mellitus Gestacional: Definida como cualquier grado de intolerancia a la glucosa detectado por primera vez durante el embarazo. Para su reclasificación y categorización suele ser necesario una evaluación posparto Categorías Clínicas de Glucemia Basal Anormal y Tolerancia Anormal a la Glucosa: Junto al grupo heterogéneo de diabetes, cada vez adquiere mayor relevancia clínica estas dos alteraciones: La Glucemia Basal Anormal hace referencia a un grupo de pacientes cuya glucemia basal ≥ 110 mg/dl pero < 126 mg/dl. La Tolerancia Anormal a la Glucosa hace referencia a un grupo de pacientes cuya glucemia 2 horas después de un test de tolerancia oral con glucosa es ≥ 140 mgr/dl y < 200 mgr/dl Criterios diagnósticos de Diabetes Mellitus: Para poder diagnosticar a una persona de diabetes basta que se cumpla uno de los siguientes criterios: 1.- Presencia de síntomas cardinales de diabetes más una glucemia plasmática casual ≥ 200 mg/dl. Casual quiere decir en cualquier momento del día, sin ninguna relación con la comida 2.- Glucemia plasmática basal ≥ 126 mgr/dl. Este dato ha de ser confirmado en otro día diferente 3.- Glucemia 2-horas pos-Test de Tolerancia Oral a la Glucosa ( 75 gramos de glucosa oral) ≥ 200 mgr/dl. Este dato ha de ser confirmado en otro día diferente. 64 DIABETES MELLITUS Y TRASPLANTES DE ORGANOS: Muchos pueden ser los factores condicionantes para que aparezca una diabetes mellitus en un paciente sometido a un trasplante de órgano. De una manera resumida vamos a mencionar los siguientes: Factores Genéticos: Dada la frecuencia con que se da la diabetes mellitus tipo 2 en la población adulta, es posible que muchos pacientes sometidos a trasplante tengan una carga genética predisponente al desarrollo de una diabetes mellitus, generalmente tipo 2, donde existe más de una veintena de genes implicados. La presencia de antecedentes familiares con diabetes mellitus tipo 2 puede indicarnos que serían los pacientes trasplantados que pueden desarrollar diabetes. Otro situación es la existencia de un Síndrome Metabólico, con la presencia de obesidad, dislipemia, hipertensión y diabetes tipo 2, cosa que hace que a lo largo del seguimiento de un paciente trasplantado se ponga de manifiesto una diabetes o empeore la situación metabólica de esta alteración ya previamente existente. El fenómeno de insulínresistencia, proceso subyacente en sujetos obesos, hipertensos, dislipémicos, puede convertirse en un factor de riesgo para el desarrollo de una diabetes en este tipo de pacientes. Influencia de la enfermedad subyacente: Actualizaciones en Trasplantes 2001. La Insuficiencia Renal Crónica produce alteraciones del metabolismo hidrocarbonado en un doble sentido: Por un lado condiciona un cierto grado de insulín-resistencia, pero la alteración más predominante es que, al ser el riñón un órgano donde se degrada la insulina, toda alteración de la función renal condiciona un menor aclaramiento de insulina, lo cual puede inducir a hipoglucemias 65 La insuficiencia cardiaca congestiva es otra situación que se acompaña de alteraciones en el control metabólico de pacientes con alteraciones del metabolismo hidrocarbonado, llegando a descompensarse con frecuencia la diabetes existente. Es posible que el incremento de hormonas vasoactivas, catecolaminas, con un claro efecto contrainsular e hiperglucemiante, tengan mucho que ver en la hiperglucemia del paciente en insuficiencia cardiaca La afectación hepática: El hígado es el órgano donde la propia glucosa y una serie de factores neoglucogénicos, tales como la fructosa, el lactato, los ácidos grasos, la alanina, etc, sirven de sustrato para la síntesis de glucógeno, siendo regulado este proceso por una serie de hormonas tales como la propia insulina, el glucagón, la hormona del crecimiento GH, las catecolaminas y los glucocorticoides. Hoy se conoce que la actividad metabólica del hepatocito depende de su posición relativa entre la triada portal y la vénula hepática. Con respecto al metabo- lismo de los carbohidratos, la gluconeogénesis y la síntesis de glucogeno a partir de los precursores neoglucogénicos ocurre fundamentalmente n la zona peri-portal rica en oxígeno. Por otro lado, la síntesis de glucógeno a partir de la glucosa se produce fundamentalmente en la zona perivenosa, y la zona donde se produce la glicolisis en respuesta al glucagón está regularmente distribuida. Son muchos los trabajos que han demostrado intolerancia hidrocarbonada en la enfermedad hepática, siendo la cirrosis el proceso más estudiado, observándose hiperinsulinemia y, a su vez, insulínresistencia. La hiperinsulinemia en los pacientes con cirrosis hepática puede venir condicionada por el menor aclaramiento hepático de insulina. Por otro lado, esa propia hiperinsulinemia también puede ser reflejo de un cierto grado de insulínresistencia, consecuencia de la alteración metabólica que se produce en el paciente cirrótico, con una sensibilidad pancreática a la glucosa conservada, lo cual hace que se segregue más insulina. En la enfermedad hepática avanzada se produce una menor eficiencia metabólica en los procesos de síntesis de glucógeno, una menor respuesta a la insulina en este proceso, pero también una menor metabolización hepática de la insulina, cosa que junto a la mayor secreción pancreática, hace que se produzca una hiperinsulinemia. Puede ser el agotamiento pancreático ante esta situación metabólica lo que condicione el desarrollo de hiperglucemia. El fenómeno de insulínresistencia también se pone de manifiesto por una menor captación de glucosa a nivel periférico, de tal manera que en la cirrosis hepática se produce una alteración muy similar a la que observamos en la diabetes mellitus tipo 2. Por otra parte, en la enfermedad hepática severa se han encontrado valores elevados de Hormona del Crecimiento GH y una falta de supresión con glucosa. Junto a esto, los factores de crecimiento IGF-1 e IGF-2, son producidos fundamentalmente en hígado, y de manera parecida pero menos potente que la insulina, favorecen la captación periférica de glucosa. Muchos estudios han demostrado que en patología hepática severa, los niveles de IGF-1 están disminuidos. También se sabe que en la cirrosis se produce un incremento de los valores de glucagón, debido a una situación de hipersecreción, tanto mayor cuanto mayor es el daño hepático, de tal manera que es posible que la enfermedad hepática subyacente requiera altos niveles de glucagón para mantener la producción hepática de glucosa normal. El estress: Son muchos los mecanismos implicados a través del estres que inducen hiperglucemia. De manera resumida vamos a mencionar dos factores que inducen estress en los pacientes trasplantados: - las infecciones - la secreción incrementada de hormonas contrainsulares . catecolaminas, cortisol, GH, glucagón, etc 66 El uso de fármacos: Varios son los fármacos habitualmente utilizados en los pacientes trasplantados que inducen hiperglucemia. - Glucocorticoides: Quizá los más significativos, ya que su acción hiperglucemiante es potente y ampliamente conocida. - Ciclosporina: A la cual se le ha evidenciado un efecto hiperglucemiante, y se ha pensado que el mecanismo pueda ser por lesión tóxica directa sobre los islotes de Langerhans - Takrolimus (FK-506): A lo largo de su uso se ha evidenciado que puede ser más diabetógeno que la ciclosporina El incremento ponderal: Un aspecto muy frecuente de observar en el paciente trasplantado es el incremento ponderal progresivo, explicable por varios mecanismos: - Recuperación de una enfermedad catabólica severa - Sensación marcada de bienestar - Incremento del apetito, por la mejoría del estado general y por el uso de fármacos tales como los esteroides. PACIENTES TRASPLANTADOS CON DIABETES MELLITUS: Actualizaciones en Trasplantes 2001. Entre los pacientes trasplantados en el Hospital Virgen del Rocío, el número de pacientes con diabetes es de 100: 67 - 39 pacientes con Trasplante Hepático - 56 pacientes con Trasplante Renal - 4 pacientes con Trasplante Cardiaco - 1 paciente con Trasplante Pulmonar Entre los pacientes con Trasplante Hepático : - 18 pacientes tenían diabetes mellitus previa al trasplante, sometidos a tratamiento con hipoglucemiante orales - 3 pacientes tenían una diabetes mellitus tipo 1 previa al trasplante - 18 pacientes desarrollaron diabetes entre unos días y 24 meses después del trasplante. Entre los pacientes con Trasplante Renal: - 8 pacientes tenían una diabetes mellitus tipo 2 previa al trasplante - 11 pacientes tenían una diabetes mellitus tipo 1 previa al trasplante - 37 pacientes desarrollaron diabetes post-trasplante Entre los pacientes con Trasplante Cardiaco: - 3 pacientes tenían una diabetes mellitus tipo 2 previa al trasplante - 1 paciente desarrollo la diabetes en el período post-trasplante El paciente sometido a trasplante pulmonar tenía una fibrosis quística y desarrollo una diabetes en el pos-trasplante inmediato PRESENCIA DE ANTECEDENTES FAMILIARES DE DIABETES EN PACIENTES TRASPLANTADOS CON DIABETES MELLITUS: Pacientes trasplantados de hígado con Diabetes Mellitus : n= 39: - Entre los 18 pacientes que tenían una diabetes mellitus no insulinodependiente antes del trasplante, 11 tenían antecedentes familiares de diabetes mellitus tipo 2 y 1 tenía antecedentes familiares de diabetes mellitus tipo 1 - Entre los 3 pacientes con Diabetes Mellitus tipo 1 antes del trasplante, 1 de ellos tenía antecedentes familiares de diabetes mellitus tipo 1 - Entre los 18 pacientes que desarrollaron diabetes tras el trasplante hepático, 7 tenían antecedentes familiares de diabetes mellitus tipo 2 y 2 tenían antecedentes familiares de diabetes mellitus tipo 1 Pacientes trasplantados de riñón con Diabetes Mellitus: n= 56 - Entre los 8 pacientes que tenían diabetes mellitus tipo 2 previo al trasplante, 7 de ellos tenían antecedentes familiares de diabetes mellitus tipo 2 - Entre los 11 pacientes con Diabetes Mellitus tipo 1, 7 tenían antecedentes familiares de diabetes - Entre los 37 pacientes que desarrollaron diabetes después del trasplante, 27 tenían antecedentes familiares de diabetes Pacientes trasplantados de corazón con Diabetes Mellitus: n= 4 - Entre los tres pacientes con diabetes mellitus previa al trasplante, los 3 tenían antecedentes familiares de diabetes - El paciente que desarrolló diabetes después del trasplante también tenía 68 antecedentes familiares de diabetes Pacientes trasplantados de pulmón con Diabetes Mellitus: n= 1 - El paciente, que desarrolló una diabetes pos-trasplante, no tenía antecedentes familiares de diabetes. Edad del paciente en el momento del trasplante de órgano y presencia de diabetes: Es sabido que con la edad aumenta la prevalencia de diabetes tipo 2. Analizamos este aspecto entre los pacientes trasplantados y observamos que en el grupo de trasplantados hepáticos y renales, aquellos que tenían diabetes mellitus previa al trasplante tenían una edad superior, dato que también puede indicar que este grupo de pacientes tenga una enfermedad más evolucionada antes de ser trasplantado Entre los pacientes trasplantados de hígado, la edad media de los que tenían DM previa era de 54,9 ± 7 años, frente a los 48,2 ± 12 años que tenían aquellos pacientes que no eran diabéticos antes del trasplante Entre los pacientes trasplantados de riñón, la edad media de los que tenían DM previa era de 57,7 ± 5 años, frente a los 43,5 ± 10 años que tenían aquellos pacientes sin diabetes antes del trasplante Sin embargo, entre los 4 pacientes cardíacos, la edad media de los que tenían DM previa era de 50,4 ± 4 años, frente a los 53,8 años que tenía el paciente sin diabetes previa al trasplante. La paciente con trasplante pulmonar tenía 19 años. Función Beta pancreática en pacientes trasplantados con Diabetes Mellitus: Actualizaciones en Trasplantes 2001. Excluyendo los pacientes que tenían diabetes mellitus tipo 1 antes del trasplante de órgano, analizamos los niveles de Péptido C basal en estos pacientes, obteniendo los siguientes resultados: 69 * En trasplantados hepáticos: 3,2 ± 1 ng/ml * En trasplantados renales: 5,1 ± 2 ng/ml * En trasplantados hepáticos: 2,2 ± 1 ng/ml * En el trasplantado pulmonar: 1,2 ng/ml Tanto en los pacientes hepáticos como renales y cardíacos, el patrón de secreción insular hablaba a favor de la presencia de una situación de insulínresistencia. Esta secreción endógena no fue diferente entre aquellos pacientes diagnósticados de diabetes de los que desarrollaron después la alteración. Los valores de péptido C fueron claramente más bajos entre aquellos pacientes con Diabetes Mellitus tipo 1 previa al trasplante con cifras inferiores a 0,3 ng/ml. Fármacos inmunosupresores empleados en los pacientes trasplantados con Diabetes Mellitus: Corticoides Ciclosporina Azatioprina Micofenolato Takrolimus Riñon(n=56) 55 45 34 6 5 Higado(n=39) 36 19 15 4 14 Corazón(n=4) 4 4 1 2 0 Pulmón(n=1) 1 1 0 0 0 Los medicamentos que prácticamente no han estado ausentes en ningún paciente trasplantado han sido los glucocorticoides, cuya acción hiperglucemiante es manifiesta, siempre asociados a otros inmunosupresores. Evolución Metabólica de pacientes trasplantados con Diabetes Mellitus: Para analizar la evolución metabólica de los pacientes trasplantados con diabetes, hemos analizado el primer año de seguimiento en el periodo pos-trasplante , midiendo Hba1c, con lo siguientes resultados: HbA1c(%) Tx hepático Tx renal Tx cardiaco Tx pulmonar Basal 9,1% 9,4% 10% 10,1% 3º mes 7,1% 8% 7,8% 7% 6º mes 6,1% 7,2% 7% 6% 12ºmes 5,8% 7,1% 6,4% 6,1% Tratamiento en pacientes trasplantados con Diabetes Mellitus: Hemos analizado el tratamiento durante el primer año pos-trasplante. Durante este periodo, todos han sido tratados con insulina, y los requerimientos han sido los siguientes: 70 UI/Kg Tx hepático Tx renal Tx cardiaco Tx pulmonar Inicial 0,6 UI/kg. 0,8 UI/kg. 1 UI/kg. 0,5 UI/kg. 6º mes 0,5 UI/kg. 0,7 UI/kg. 0,8 UI/kg. 0,4 UI/kg. 6º mes 0,4 UI/kg. 0,7 UI/kg. 0,7 UI/kg. 0,3 UI/kg. Observamos que los pacientes del grupo de trasplante renal y cardiaco tenían un mayor requerimiento insulínico, debido a que en esto pacientes existe un claro componente de insulínresistencia, mayor que en los pacientes sometidos a trasplante hepático. El paciente con trasplante pulmonar requirió escasas cantidades de insulina. Opciones terapéuticas para el tratamiento de la Diabetes en pacientes trasplantados: Las distintas opciones de tratamiento de la diabetes en los pacientes trasplantados son las siguientes: 1.- Insulina: Es la medida de elección en muchas situaciones: - Al inicio, donde los pacientes suelen estar muy descompensados - Cuando los pacientes tienen una diabetes mellitus previa al trasplante de muy larga evolución, donde la reserva insular es escasa - Cuando se utiliza medicación con clara acción hiperglucemiante 2.- Fármacos orales: A la hora de usar algún hipoglucemiante oral en el tratamiento de un paciente trasplantado, habrá que tener en cuenta varias situaciones: - Funcionalidad del órgano trasplantado - Situación clínica del paciente Actualizaciones en Trasplantes 2001. - Toma de medicación hiperglucemiante 71 Así, si la situación clínica del paciente es buena, la función hepática es normal y la función renal es adecuada, los criterios de uso de fármacos hipoglucemiantes deben ser los mismos que en situaciones normales. Teniendo en cuenta que estos pacientes tienen un importante componente de insulínresistencia, es necesario valorar el uso de metformina, siempre que exista una buena funcion renal y hepática, no existiendo compromiso hemodinámico ni circulatorio. También pueden ser utilizados los secretagogos de insulina, tanto los de la familia de las sulfonilureas como los secretagogos rápidos no sulfonilureas (repaglinida). Si el paciente toma medicación hiperglucemiante, sobre todo glucocorticoides, practicamente siempre vamos a necesitar el uso de insulina para controlar a estos pacientes. RAPAMICINA: NUEVA DROGA INMUNOSUPRESORA. Porfirio Pereira Palomo, Gabriel Rodríguez Algarra, Miguel Angel Gentil Govantes, Jose Pablo Quintero García *. Unidad de Trasplante Renal. Servicio de Nefrología. * Servicio de Farmacia. INTRODUCCIÓN. La Rapamicina o Sirolimus ( SRL ), es una nueva droga inmunosupresora, si bien es conocida su actividad como antibiótico, desde su descubrimiento (Rapa Nui-Isla de Pascua ) a principios de la década de los años 70. Aprobada en EE.UU., como inmunosupresor aún pendiente de su autorización por Sanidad, si usado como tratamiento compasivo. Su nombre comercial es Rapamune ( Laboratorio Wyeth-Ayersth ). La mayor experiencia , tanto experimental como clínica, y a quién nos referiremos con frecuencia es de Barry Kahan ( U. Texas ). La rapamicina es un macrólido, de fórmula química lactona macrocíclica , obtenida por fermentación del hongo Streptomices hygroscopicus. A pesar de tener una estructura química, similar a Tacrolimus, su mecanismo de acción, perfil de seguridad y efectos secundarios son distintos a los agentes anticalcineurina. En diversos ensayos clínicos se ha demostrado su capacidad para reducir la incidencia de rechazo agudo en el período de inducción, tanto en monoterapia como asociada a Ciclosporina (CsA), y sobre todo por no tener efecto nefrotóxico, lo que promete una posibilidad terapéutica de gran interés. Los datos que se poseen en apoyo del uso de sirolimus, después del período de inducción, asociado a distintas dosis de CsA., son escasos, por ésta razón se ha diseñado un ensayo clínico multicéntrico en el que participa nuestra unidad de Trasplante Renal y de iniciación muy reciente. 72 1. MECANISMO DE ACCIÓN. Los inmunosupresores , CsA y Tacrolimus, que son los agentes básicos en trasplante de órganos, ejercen su efecto por bloqueo de la calcineurina, inhibiendo la producción de IL-2 (Interleukina-2). Sirolimus no ejerce ésta acción, sino reduce la activación en un estadio tardío del ciclo celular La rapamicina es una prodroga y para ejercer su acción es necesaria su unión a una inmunofilina citoplasmática la FKPB-12, la misma que utiliza el Tacrolimus. El complejo RAFT (Rapamicina And FKPB Target ) actúa sobre la proteína TOR, interfiriendo la señal de transducción, necesaria para la progresión del ciclo celular en la fase G1 a S ( fig. 1 ). Fig. 1 Aunque el sustrato de la p-TOR, permanece oscuro parece que interviene en el control de la traducción del RNAm. La falta de proteína TOR conduce a una deplección de CLN3, activador de la transcripción de genes, en la fase G1. Aunque el mecanismo de acción de la rapamicina, no es conocido totalmente, se sabe ( fig. 2 ), que produce: Actualizaciones en Trasplantes 2001. 1. Inhibición de una proteinkinasa, llamada S6 Kinasa ( p70S6K), con la consiguiente inhibición de la proteina ribosómica S6, necesaria para la síntesis proteica y la respuesta al AMPc ( inductor de la transcripción del gen del antígeno nuclear, necesario para la proliferación celular ). 73 2. Inhibición de ciclina-D y complejos ciclina-E, con inactivación del factor de transcripción y bloqueo de la proliferación y diferenciación celular. 3. Bloquea la transcripción de Bcl-2, proteína que junto a la BAG1 y Bcl-X, protege a las células de la apoptosis. 4. Previene el efecto inhibidor de CD28 ( segunda señal de activación del linfocito T ), aunque su acción es limitada en la síntesis de IL-2. 5. Por ésta serie de mecanismos la rapamicina es un inhibidor del crecimiento de las células hematopoyéticas, linfoides y músculo liso, lo que explica algunos de sus efectos secundarios ( mielotoxicidad ). Fig. 2 2. FARMACOCINÉTICA. Sirolimus es sustancia lipofílica, de absorción en intestino delgado, una vez absorbida circula unida a una p-glycoproteína, diferentes factores pueden afectar la absorción, como los niveles de lipoproteínas, administración simultánea de CsA. Metabolización hepática, a través del sistema enzimático citocromo P-450, la misma vía que utilizan CsA. y Tacrolimus, por lo que puede haber interacción entre ellas cuando se administran de forma simultánea. Asimismo los medicamentos inhibidores del citocromo P-450, pueden aumentar los niveles, como son antifúngicos, eritromicina, anticonceptivos orales, algunos calcioantagonistas. Por otra parte los inductores del citocromo P-450, producen descenso de niveles como rifampicina, fenobarbital, fenitoína, carbamacepina, isoniazida. Biodisponibilidad de SRL., es variable ( 14-20% ), tanto inter-intraindividual, en la cual influyen diversos factores, como tiempo postrasplante transcurrido, administración de otros inmunosupresores, función hepática, permeabilidad intestinal... Sinergismo con Ciclosporina A: Desde los primeros estudios, aunque no todos son concluyentes, se comprueba la existencia de sinergismo entre ambas drogas. La administración simultánea eleva los niveles de ambas, en cambio si se hace de forma secuencial, sólo se elevan los niveles de CsA. Este sinergismo refleja actividades biológicas complementarias y mecanismos de interrelación ( ver fig. 3 ). En definitiva la combinación de SRL-CsA., reduce de forma significativa la incidencia y gravedad de las crisis de rechazo y posibilita reducir la dosis de Ciclosporina. 74 Fig. 3 3. ADMINISTRACIÓN. DOSIFICACIÓN. MONITORIZACIÓN. La única formulación es oral, en solución, frascos de 60 ml., (En EE.UU.,si se dispone en forma sólida) que se administra diluída en agua o zumos, en 1 sola toma diaria. En caso de asociación con CsA., la dosis recomendada de SRL., deberá espaciarse 4 horas de la toma matutina de Ciclosporina. Al igual que con otras drogas inmunosupresoras la dosificación ha sido uno de los grandes inconvenientes para su empleo clínico, a fin de conseguir equilibrio entre eficacia y toxicidad. En la combinación con CsA/Tacrolimus, se recomienda una dosis de 6 mgr/ dia 1º y posteriormente 2 mg./ diarios, de forma indefinida, con ajuste de niveles. Monitorización: Actualmente la única posibilidad es mediante cromatografía liquida, que plantea problemas técnicos en muchos hospitales; no obstante se espera disponer de una técnica de inmunoensayo en breve tiempo. Los niveles aconsejables son de 5 a 15 ng/ml., en asociación con CsA, y en caso de monoterapia es recomendable alcanzar los niveles máximos, sobre todo en fase de inducción. Actualizaciones en Trasplantes 2001. La concentración con dosis de 2 mg/día, suele ser estable, aunque es conveniente la monitorización frecuente , sobre todo en el primer mes postrasplante. 75 Es aconsejable la monitorización terapéutica en los siguientes casos: - TR. Infantil, por escasa experiencia hasta la fecha. - Fallo hepático ( elevación de niveles ). - Drogas que produzcan interrelación con SRL. - Asociada a CsA., ante cualquier modificación de dosis de la misma. 4.APLICACIÓN CLÍNICA: El empleo de nuevos inmunosupresores ha contribuido en gran parte a los resultados actuales en el trasplante de órganos, no obstante es necesario conseguir un equilibrio entre eficacia y toxicidad de los mismos. Tanto el efecto terapéutico como la nefrotoxicidad de la CsA, se encuentra relacionado con su mecanismo de acción, por ello un potente inmunosupresor que pueda reducir la dosis de las drogas anticalcineu-rina , podría prolongar la vida media de los órganos trasplantados. Basados en el hecho de que la rapamicina afecta a la activación de los linfocitos en una fase posterior, se ha demostrado que los estímulos de activación no bloqueados por los agentes anticalcineurina, son sensibles a la acción de la misma y de acuerdo con éstas características su aplicación clínica se podría resumir, brevemente, de la siguiente forma: 1) Como terapia de rescate: A) La experiencia como tratamiento de rescate es limitada, B. Kahan si ha comunicado resultados prometedores. B) Sustitución de otra droga en caso de nefrotoxicidad/efecto secundario indeseable. En un estudio pivotal en fase I, 40 pacientes trasplantados renales, en régimen inmunosupresor de Prednisona y CsA., la adicción de Sirolimus, no se acompañó de aumento de la disfunción renal. 2) Como droga básica de inmunosupresión: A) Asociada a esteroides. B) En protocolo de triple terapia, junto a Prednisona y fármacos anticalcineurina, o asociada a micofenolato mofetil. 3) Asociada al régimen habitual A) A dosis normales, como 4ª droga . No aconsejable dado el previsible desarrollo de una inmunosupresión excesiva. C) Efecto sinérgico, con otra droga, que permita la posibilidad de reducción de dosis. PREVENCIÓN DE RECHAZO AGUDO. Sirolimus se encuentra en fase de desarrollo para la profilaxis del rechazo agudo del trasplante renal, tanto como droga básica o bien asociada a CsA. Diversos ensayos clínicos en fases II y III, han demostrado la eficacia y seguridad de Sirolimus en la profilaxis del rechazo agudo. En un ensayo clínico- B- Kahan-, comparativo de 2 dosis de SRL ( 2 y 5 mg. ), frente a Azatioprina, y administración concomitante en ambos regímenes de Prednisona y CsA., la tasa de rechazo agudo, confirmado por biopsia, descendió del 29.8% ( grupo AZA. ) a valores del 16.9% y 12%, en los grupos de SRL. ( 2 y 5 mg. ), respectivamente. 76 En un estudio multicéntrico europeo ( Sirolimus European Renal Transplant Study Group ), fase II, los pacientes trasplantados renales fueron randomizados, 40/40, a recibir tratamiento con Pred+Aza+CsA, frente a Pred+ Aza+SRL. La incidencia de rechazo agudo fue similar ( 39%-41% ), con excelente supervivencia de paciente e injerto, al primer año. Hay que reseñar que la dosis de SRL., se ajustó para obtener niveles más elevados que los aconsejados actualmente. Posteriormente este mismo grupo de estudio europeo, realizó un 2º ensayo, en el cual los pacientes fueron randomizados a recibir Micofenolato Mofetil , en lugar de Azatioprina en ambos grupos. La incidencia de rechazo agudo fue ligeramente superior en el grupo de Sirolimus ( 27% ) frente a CsA ( 18% ). La adicción de MMF, en lugar de Aza., reduce los índices de rechazo, en cualquiera de los regímenes terapéuticos. Como última referencia, ensayo clínico-203, B. Kahan-, 151 pacientes trasplantados renales, fueron randomizados en 6 grupos ( fig. 4 ), con el objetivo de comparar la eficacia de SRL. (en distintas dosis), asociado a CsA. (a dosis plenas o reducidas ) y frente a un grupo placebo ( P+CsA a dosis plena) . En la figura 5, se recogen los resultados referentes a crisis de rechazo en los distintos grupos. Actualizaciones en Trasplantes 2001. Fig. 4 77 Fig. 5 De éstos ensayos, a pesar de las limitaciones de algunos de ellos, se pueden extraer una serie de conclusiones: - La combinación de Ciclosporina y Sirolimus, promete una potente inmunosupresión, permite reducir la dosis de CsA., manteniendo un riesgo moderado-bajo de crisis de rechazo y preservando la función renal. - La dosis altas de SRL ( 5 mgr/día ), puede asociarse con mayores riesgos (más frecuencia de neumonías, en la experiencia de B. Kahan ) , de ahí que se aconseje actualmente, en fase de mantenimiento, el empleo de 2 mgr/ día. - Sirolimus y CsA, son inmunosupresores equipotentes ( aunque la crisis de rechazo es ligeramente superior con SRL ), con un perfil de seguridad distinto. Los pacientes tratados con SRL., tienen mejor función renal al final del primer año, con una menor incidencia de HTA., síntomas neurológicos y no es diabetógena. Otras posibles aplicaciones clínicas de Sirolimus pueden ser: - Utilidad en riñones inicialmente no funcionantes, dada su carencia de nefrotoxicidad y permitir un régimen secuencial con agentes anticalcineurina. - Nefropatía crónica:Hay razones para pensar en un posible efecto beneficioso, ya que en estudios in vitro, se demuestra un bloqueo en la proliferación de células endoteliales y musculatura lisa. - Empleo en trasplante de órganos, distintos al renal. Shapiro, ha presentado recientemente una experiencia muy favorable en trasplante de islotes pancreáticos, tratados con Tacrolimus y Sirolimus. 5. SEGURIDAD CLÍNICA. Al igual que otros con inmunosupresores, el empleo de Sirolimus, se puede acompañar de una serie de efectos adversos. 1) MIELOTOXICIDAD: La mayor afectación es sobre las plaquetas y menor sobre leucocitos y hematíes. No suele acompañarse de trastornos hemorrágicos, es dosis dependiente y la recuperación es rápida, salvo si existe enfermedad por CMV. 2) DISLIPEMIA: Junto a la mielodepresión es la complicación más importante, su mecanismo no está claro, aunque se sugiere que Sirolimus puede inhibir insulina y/o factores de crecimiento insulina-like. La Hipercolesterolemia es más frecuente y se correlaciona mejor con la dosis, aunque la severidad de la hipertrigliceridemia es generalmente mayor. La dislipemia suele responder bien a tratamiento dietético, estatinas y reducción de dosis. 3) HIPERTRANSAMINASEMIA: En los primeros ensayos se recogen elevaciones 78 importantes de transaminasas, atribuibles a dosificaciones muy altas. No obstante se recomiendan controles de bioquímica hepática. 4) INFECCIONES: En los diversos ensayos no se ha demostrado una mayor frecuencia de infecciones, a excepción de herpes simple. En uno de los ensayos de Kahan, hubo un centro con incidencia alta de neumonía por Pn. Carinii, atribuida a no realizar profilaxis. Kreis ha publicado recientemente 2 casos de neumonitis por hipersensibilidad. Como hemos señalado previamente la dosis de 5 mgr/ día, si se ha acompañado de una mayor tasa de neumonías. 5) OTROS EFECTOS SECUNDARIOS: - DISFUNCIÓN TUBULAR: Se ha publicado Hipokaliemia, secundaria al uso de SRL., siempre en comparación con Ciclosporina . - DISTROFIA SIMPÁTICA REFLEJA: Descrita previamente con CsA. Se trata de un cuadro de artralgias, sobre todo en tobillos y rodillas, bilateral. Con escasos hallazgos analíticos y radiológicos, a excepción, de una hipercaptación gammagráfica. Respuesta favorable a tratamiento con Calcitriol, de evolución prolongada en el tiempo, sin necesidad de retirar totalmente la medicación. - DIARREAS: Sin relevancia clínica importante. 6. CONCLUSIONES: Podemos concluir que la Rapamicina o Sirolimus, es una nueva droga inmunosupresora de potencia equiparable a los agentes anticalcineurina, en la prevención de rechazo agudo en el trasplante renal. Actualizaciones en Trasplantes 2001. Su principal ventaja es no ser vasoconstrictora, carenciendo de nefrotoxicidad, asimismo no es diabetógena, hiperuricemiante, ni tiene demostrado efectos adversos neurológicos y causa menor tendencia a la Hipertensión arterial. 79 De los estudios disponibles hasta la fecha, parece que la mejor aplicación sería asociada a Ciclosporina A., dado que ésta combinación ha demostrado una disminución de las crisis de rechazo, sin afectar la función renal, y por su efecto sinérgico permite una reducción de dosis de CsA. Sus efectos secundarios más importantes y que precisan monitorización frecuente son la Mielotoxicidad ( plaquetopenia ) y la Dislipemia. PROTOCOLO PARA EL DIAGNÓSTICO Y TRATAMIENTO DE LA NEUMONÍA EN LOS RECEPTORES DE TRASPLANTE DE ORGANO Aurelio Arroyo, Elías Cañas, José Miguel Cisneros, Alfonso Espigado, Joaquín Fernández Cruz, Jorge Fernández Alonso, Andrés García Curiel, Miguel Angel Gentil, Rafael Hinojosa, José Martín Juan, Mateo Martínez y Carmen Regordan. Servicios de Anatomía Patológica, Cuidados Intensivos, Enfermedades Infecciosas, Hematología, Microbiología, Nefrología, Neumología y Radiología. Aprobado por la Comisión de Infecciones y Antimicrobianos INTRODUCCION La neumonía en los receptores de trasplante de órgano sólido y de médula ósea (TO) es una urgencia médica, que requiere la realización inmediata de una evaluación diagnóstica y terapéutica, que de ser apropiada reduce la mortalidad de esta grave complicación infecciosa de los receptores de TO. Esta evaluación diagnóstica y terapeútica requiere la actuación coordinada de varios especialistas. Por ello se ha realizado este protocolo de diagnóstico y de tratamiento de la neumonía en los receptores de TO, adaptado a nuestro Hospital y consensuado por los diversos especialistas que participan de forma directa en el manejo de esta patología. La utilidad del protocolo, se demostrará primero por su nivel de seguimiento y segundo por su eficacia diagnóstica y terapeútica. Para ello todas la neumonías incluídas en él se recogerán en una base de datos para su análisis semestral que permitirá conocer los resultados y en función de los mismos realizar cuantos cambios se consideren necesarios para mantener siempre el mayor nivel de calidad asistencial. 80 El período de aplicación del protocolo comienza en Enero del año 2000. PROTOCOLO DIAGNÓSTICO A. Valoración inicial del paciente (Hora 0): 1. Historia clínica y exploración física detalladas. 2. Radiografía de tórax en proyección posteroanterior y lateral. 3. Si se confirma la sospecha diagnóstica de neumonía, se continúa el proceso diagnóstico. 4. Tomografía computarizada (TC) de tórax de alta resolución está indicada si la radiografía de tórax deja dudas sobre la existencia de nódulos y/o de cavitación y, como guía de la punción pulmonar transtorácica. 5. Pruebas básicas para la evaluación general: - Hemograma, estudio de coagulación, velocidad de sedimentación globular, bioquímica hepática, función renal, glucemia, iones, oximetría digital o en su defecto gasometría arterial, y niveles de ciclosporina o de tacrolimus. 6. Pruebas para el diagnóstico microbiológico urgente (tiempo de realización: 1-3 horas); previas al tratamiento antimicrobiano: - Esputo para tinciones de Gram, Wright-Giemsa y Zielh-Neelsen, examen en fresco para hongos; y para cultivos cuantitativos para bacterias, hongos y cultivos de micobacterias. El esputo inducido se realizará si se sospecha P.carinii o M.tuberculosis. - Hemocultivos, 2 extracciones separadas por 30 minutos. - Tinciones de Gram y Zielh-Neelsen y cultivo de bacterias, micobacterias y hongos de las muestras obtenidas por punción de derrame pleural y/o lesiones cutáneas o articulares cuando las haya. Actualizaciones en Trasplantes 2001. - A las 8 h. de la mañana siguiente se enviarán muestras para: 81 - Shell-vial y cultivo de CMV en sangre (Hospital Virgen Macarena) - Antigenemia cuantitativa de CMV (Servicio de Microbiología, Hospital Infantil). - Antigenuria de L.pneumophila. (Servicio de Microbiología, Hospital Infantil). B. Segunda valoración (3 horas más tarde): Si las pruebas anteriores son diagnósticas (ej. P.carinii en esputo, o diplococos Gram positivos sugestivos de neumococo junto a cuadro clínico característico de esta etiología) se inicia el tratamiento antimicrobiano específico. Si las pruebas anteriores no son diagnósticas se indicará una prueba diagnóstica invasiva sin demora, salvo contraindicación expresa de la misma, y se iniciará tratamiento empírico inmediato: 1. La broncoscopia será el procedimiento diagnóstico de elección en la mayoría de los casos, con afectación pulmonar difusa: infiltrado alveolar extenso. Con ella se realizarán las siguientes técnicas y en las siguientes circunstancias: - Lavado broncoalveolar siempre - Cepillo telescópico ocluido reservado para cuando la principal sospecha sea la infección bacteriana - Biopsia transbronquial reservada para cuando se sospeche infección por microorganismos oportunistas, patología tumoral o EICH. La broncoscopia se realizará en el día o en las siguientes 24 h. Para ello contactar con el Dr. Martin Juan o con el Dr. Rodriguez Panadero, en el teléfono 8028. 2. La punción pulmonar transparietal (PPT) guiada por TC es el procedimiento de elección cuando la neumonía se manifiesta en forma de nódulos periféricos y sin infiltrado asociado. La PTT se realizará en las siguientes 24 horas. Para ello contactar con el Dr. Martínez o, con el Dr. Fernández Cruz en el teléfono 1689. Las muestras, obtenidas con la broncoscopia o con la PPT deben ser procesadas como se recoge más abajo. TRATAMIENTO EMPIRICO Se iniciará tratamiento antimicrobiano empírico inmediato si hay signos de gravedad clínica y/o radiográfica y/o la principal sospecha diagnóstica es la etiología bacteriana por patógenos habituales de la comunidad o por las bacterias de adquisición nosocomial. 1. Tratamiento empírico de las neumonías adquiridas en la comunidad: - Elección: BETALACTAMICO (ceftriaxona, cefotaxima o amoxicilina-clavulánico) al que se añade uno de los siguientes antimicrobianos dependiendo de las características clínicas: - Ciprofloxacino si la antigenuria de L.pneumophila no está disponible. - Cotrimoxazol si el paciente no realizaba profilaxis para P.carinii y las características clínicas y radiográficas (infiltrado intersticial difuso de predominio basal) son compatibles. 82 - Anfotericina B deoxicolato si existen nódulos y/o cavitación en la radiografía o en la TC. - Ganciclovir si hay retinitis y/o viremia por CMV. - Si sospecha de aspiración el betalactámico de elección será amoxicilinaclavulánico - Alternativa: levofloxacino en monoterapia en pacientes con neumonía sin signos de gravedad clínica ni radiológica. 2. Tratamiento empírico de las neumonías adquiridas en el Hospital: - BETALACTAMICO activo frente a A.baumannii y P.aeruginosa (imipenem) si el paciente está con ventilación mecánica: y si no está con ventilación mecánica (cefepime), y se añade uno de los siguientes anitimicrobianos dependiendo de las características clínicas: - Ciprofloxacino si la antigenuria de L.pneumophila no está disponible. - Cotrimoxazol si el paciente no realizaba profilaxis para P.carinii y las características clínicas y radiográficas (infiltrado intersticial difuso de predominio basal) son compatibles. - Anfotericina B deoxicolato si existen nódulos y/o cavitación en la radiografía o en la TC. - Ganciclovir si hay retinitis y/o viremia por CMV. - Si sospecha de aspiración, el betalactámico de elección será piperacilinatazobactam En los casos de neumonía de evolución crónica, sin signos de gravedad clínica, ni radiográfica, el tratamiento empírico se debe demorar al menos hasta la toma de muestras por técnica invasiva. Actualizaciones en Trasplantes 2001. NORMAS PARA EL PROCESAMIENTO DE LAS MUESTRAS RESPIRATORIAS 83 Como norma general todas la muestras respiratorias obtenidas en estos pacientes se identificarán en el volante de petición habitual como «MUESTRA URGENTE DE PACIENTE TRASPLANTADO» en color rojo. Esta identificación permitirá que en el laboratorio de Microbiología y en el de Anatomía Patológica se procesen con la urgencia que requieren. 1. Lavado broncoalveolar (LBA). Se obtendrá un volumen de 10-100 ml, que se distribuirá de la siguiente manera: - 50% para microbiología repartido en 3 partes alícuotas: - Muestra y volante para bacterias solicitándo: - Tinción de Gram - - Cultivos cuantitativos de bacterias aerobias y anaerobias (diagnóstico 104 UFC/ml) - Cultivo de L. pneumophila. Muestra y volante para parásitos y hongos solicitándo: - Técnica/s de microscopía para P.carinii y hongos - Cultivo de hongos - Muestra y volante para micobacterias solicitándo: - Técnica/s de microscopía - Cultivo de micobacterias - 25% para microbiología del Hospital Virgen Macarena - Shell-vial y cultivo de CMV - 25% para citología (Anatomía Patológica, referenciando al Dr. García Cantón) - Papanicolau - Células inclusiones intranucleares y/o intracitoplásmicas 2. Cepillo telescopico ocluido (CTO). El cepillo se lavará en 1 ml de suero fisiológico y se enviará en su totalidad en un volante para tinción de Gram y cultivo cuantitativo de bacterias (Diagnóstico >103 UFC/ml) 3. Biopsia transbronquial. La/s muestra/s obtenidas se enviarán en su totalidad al Departamento de Anatomía Patológica, solicitando: - Tinciones de Grocott, Amilasa-PAS, Ziehl-Neelsen - Inmunohistoquímica para CMV y virus del hepes simple - Técnicas para estudio de tumores - Técnicas para el diagnóstico de la enfermedad injerto-contra huesped, siempre que se trate de un trasplante de médula ósea/progenitores de sangre periférica 84 SINDROME LINFOPROLIFERATIVO POSTRASPANTE (SLPPT). Elías Cañas, José Miguel Cisneros, Jorge Fernández Alonso, Miguel Angel Japón. Servicios de Enfermedades Infecciosas y Anatomía Patológica. Hospitales Universitarios Virgen del Rocío. Sevilla. Los procesos linfoproliferativos constituyen la segunda neoplasia en orden de frecuencia en los receptores de trasplantes de órganos y tejidos tras los tumores cutáneos. Representan un grupo heterogéneo de proliferaciones anormales de células linfoides, generalmente de estirpe celular B. En su mayoría se asocian a infección por el virus de EpsteinBarr (VEB). Su incidencia varía entre los distintos tipos de trasplante (desde el 1% de los receptores de trasplante renal al 5-10% de los de trasplante cardíaco o de corazónpulmón y hasta el 19-23% de los receptores de trasplante intestinal). Asímismo, su presentación clínica es muy variable, con afectación frecuentemente extranodal, lo cual dificulta su diagnóstico precoz y contribuye a su elevada mortalidad (50-70%). Aspectos histopatológicos. Actualizaciones en Trasplantes 2001. El síndrome linfoproliferativo postrasplante (SLPPT) comprende un conjunto heterogéneo desde el punto de vista histopatológico de proliferaciones linfoides de origen clonal diverso. Entre las clasificaciones existentes, la propuesta por Knowles y colaboradores probablemente sea la más útil para predecir el comportamiento clínico1 . En ella se distinguen tres categorías: 85 1.- Lesiones hiperplásicas (hiperplasia plasmocítica): las órganos afectados (ganglios linfáticos, amígdalas, adenoides) generalmente conservan su arquitectura original y presentan una infiltración por linfocitos y células plasmáticas, siendo raros los inmunoblastos y las atipias celulares; en la mayoría de los casos se trata de células B y T policlonales. Estas lesiones se presentan preferentemente en niños y en adultos jóvenes, precozmente tras el trasplante (mediana 4 meses), y generalmente regresan tras la reducción o discontinuación de la inmunosupresión. 2.- Síndrome linfoproliferativo polimorfo: comprende las hiperplasias y los linfomas polimorfos de células B, en los que existe una alteración de la arquitectura tisular con una infiltración mixta de linfocitos con diferenciación plasmocitoide, células plasmáticas e inmunoblastos con necrosis y atipias celulares en grado variable; generalmente son monoclonales. Pueden afectar tanto a los ganglios linfáticos como a estructuras extranodales (pulmón, tracto gastrointestinal), aparecen con una mediana de 11 meses tras el trasplante, y el comportamiento clínico y la respuesta a la reducción de la inmunosupresión u otras medidas terapeúticas es variable. 3.- Linfoma maligno y mieloma múltiple, con características morfológicas y citogenéticas similares a los que aparecen en los sujetos inmunocompetentes, con alteraciones estructurales de uno o más proto-oncogenes y/o en genes supresores del tumor; invariablemente son monoclonales. Pueden afectar a estructuras ganglionares o extranodales, ocurren en personas de edad más avanzada y el curso clínico suele ser muy agresivo con escasa o nula respuesta a la reducción de la inmunosupresión y otras medidas. Recientemente se ha señalado el valor pronóstico de las mutaciones del gen bcl-6 en los SLPPT, de forma que los que las presentan tendrían un comportamiento clínico más agresivo y raramente regresarían tras la reducción de la inmunosupresión o la cirugía2 . La mayoría de los SLPPT son de origen B. No obstante, se han descrito varios casos de origen T. Estos, característicamente, pueden no estar asociados al VEB, son extranodales, tienen un mayor periodo de latencia (5-10 años) y un curso clínico más agresivo 3 . Factores de riesgo y etiopatogenia. Los dos factores de riesgo asociados al desarrollo de SLPPT de forma más consistente son la intensidad del tratamiento inmunosupresor y la primoinfección por el VEB tras el trasplante. Se estima que la inmunosupresión aumenta el riesgo de procesos linfoproliferativos entre 25 y 50 veces respecto a la población general4. Aunque se han implicado distintos inmunosupresores, parece que el factor clave es la intensidad de la misma. La ciclosporina A se ha asociado a SLPPT precoces, con afectación predominante del tracto gastrointestinal y de ganglios linfáticos y buena respuesta a la reducción de la inmunosupresión. Algunos estudios han sugerido que el tacrolimus (FK506) condicionaría una mayor incidencia de SLPPT en niños5, aunque esto no se ha constatado en estudios multicéntricos amplios en adultos6-8 . Los anticuerpos monoclonales (OKT3) aumentan el riesgo de SLPPT entre 3 y 11 veces9. Finalmente, no se conoce el efecto de los nuevos inmunosupresores como el mofetil-micofenolato o la rapamicina. En los trasplantes hematopoyéticos se han implicado, como factores de riesgo específicos, la existencia de enfermedad de injerto contra huésped (EICH), la utilización de injertos depleccionados de células T, el uso de anticuerpos monoclonales OKT3, la incompatibilidad HLA y las inmunodeficiencias congénitas10. La primoinfección por VEB en el periodo postrasplante constituye un factor de riesgo independiente para el desarrollo de SLPPT. Los receptores seronegativos tendrían un riesgo entre 1011 y 24 veces12 mayor que los seropositivos. Esto hace que la incidencia de SLPPT sea mayor en pacientes pediátricos que en adultos. 86 El virus de Epstein-Barr (VEB) es un herpesvirus capaz de inducir la activación policlonal y proliferación de los linfocitos B en sujetos inmunocompetentes. Se ha relacionado epidemiológicamente con diversas neoplasias, como el carcinoma nasofaríngeo, el linfoma de Burkitt o la enfermedad de Hodgkin. Su potencial oncogénico radica en la capacidad de transformar las células B infectadas en inmortales en sujetos inmunocomprometidos. La replicación del VEB comprende un ciclo lítico y un ciclo latente en los linfocitos B de sangre periférica. Como consecuencia de este último ciclo se origina una población de linfocitos B transformados, en los que el genoma viral se incorpora en forma de plámido circular con expresión genética restringida. De esta forma los linfocitos infectados expresan un número limitado de genes virales, que codifican 6 antígenos o proteinas nucleares (EBNA 16), 3 proteinas latentes de membrana (LMP-1, 2A y 2B) y 2 cadenas de ARN mensajero viral no traducidos (EBER 1-2). Los linfocitos transformados sufrirán una proliferación policlonal en los estadíos iniciales del SLPPT, que posteriormente se hará monoclonal debido a un proceso de crecimiento celular selectivo y, finalmente, sufrirá una transformación maligna caracterizada por la aparición de anomalías citogenéticas y la capacidad de crecimiento autónomo e incontrolado13. La respuesta del huésped es fundamentalmente de tipo celular (linfocitos T citotóxicos específicos y células natural-killer inespecíficas), siendo la respuesta humoral menos importante. En este contexto, la inmunosupresión farmacológica a la que están sometidos los receptores de trasplantes compromete los mecanismos de vigilancia inmune celular, facilitando la expansión descontrolada de los clones de linfocitos infectados. Diversos estudios retrospectivos han sugerido el posible papel de otros virus linfotropos en la aparición de SLPPT, como el citomegalovirus (CMV) 12,14 (aunque para algunos autores actuaría más como un marcador de la intensidad de la inmunosupresión) o el VHC en trasplantados hepáticos15. Actualizaciones en Trasplantes 2001. Finalmente se han descrito casos de SLPPT en los que no es posible demostrar la presencia de genoma viral o sus productos en los tejidos mediante técnicas moleculares. En algunas series constituyen hasta el 17-21% de los casos, y se caracterizan por una aparición más tardía (mediana de 50 meses), la presencia frecuente de translocaciones genéticas del tipo del gen c-myc, y una mayor agresividad clínica3,11 . 87 Aspectos clínicos. El cuadro clínico y momento de aparición de los SLPPT son muy variables, con una mediana de 10-12 meses a partir del trasplante. En una revisión clásica de la literatura los síntomas y signos de presentación más frecuentes fueron la fiebre (57%), las adenopatías (38%), los síntomas gastrointestinales (27%), la amigdalitis o faringitis (19%), los síntomas pulmonares (15%), la afectación de sistema nervioso central (13%) y la pérdida de peso (9%)16. De forma esquemática pueden señalarse varias formas clínicas de presentación4. El síndrome mononucleósico, similar al producido por el VEB en pacientes inmunocompetentes (fiebre, faringitis y linfadenopatías, con o sín linfomonocitosis y linfocitos activados en sangre periférica), suele observarse en los casos de primoinfección y aparece en los primeros 6 meses postrasplante. Una segunda forma de presentación es la de un síndrome febril no focalizado con leucopenia y marcadores de CMV habitualmente negativos. En tercer lugar, puede presentarse como síndromes focales frecuentemente extranodales, destacando la afectación del tracto gastrointestinal (especialmente del intestino delgado distal) y la del sistema nervioso central. Ocasionalmente los SLPPT pueden debutar con una afectación exclusiva del injerto, lo que obliga a realizar el diagnóstico diferencial con el rechazo y otras causas de disfunción. La afectación del injerto es muy variable, desde el 80% de los receptores de trasplante cardio-pulmonar 30% en los receptores de hígado, riñón o médula ósea16. Por último, la enfermedad diseminada es especialmente frecuente en los trasplantados de médula ósea. No es infrecuente la coexistencia de infecciones oportunistas (CMV, Pneumocystis carinii o micosis invasivas) o de gammapatías monoclonales persistentes (Pageaux GP, Transplantation 1998). Los factores clínicos de peor pronóstico son la aparición tardía tras el trasplante, el ser un receptor de trasplante cardíaco o de médula ósea, la presencia de síntomas sistémicos, la mayor masa tumoral y el estadío avanzado16. Diagnóstico De lo anteriormente expuesto se deduce que es necesaria una elevada sospecha diagnóstica. Entre las situaciones clínicas que deben hacer pensar en un SLPPT se encuentran la neutropenia febril sin evidencia de infección por CMV y/o respuesta a tratamiento empírico con ganciclovir; el síndrome mononucleósico o las adenopatías de cualquier localización; la gammapatía monoclonal persistente más de 6 meses; la afectación del injerto, del tracto gastrointestinal o del sistema nervioso central rápidamente progresiva y no explicable por otras causas; un patrón nodular pulmonar bilateral con hipoxemia, la sepsis mantenida sin diagnóstico microbiológico claro, y, en general, todo paciente con factores de riesgo que no evolucione adecuadamente sin una explicación evidente. Ante cualquiera de estas situaciones debe iniciar la búsqueda activa de un SLPPT mediante un protocolo que incluya una analítica general (con VSG, LDH, beta 2 microglobulina y niveles de inmunosupresores), frotis de sangre periférica, tomografía computarizada de tórax y abdomen (extensible a cráneo y cuello según sospecha clínica), inmunoglobulinas en sangre y en orina de 24 horas y subpoblaciones linfocitarias en sangre periférica. Otros estudios adicionales como la citología de LCR, endoscopias digestivas, exámen ORL y/o biopsia de médula ósea deben realizarse según indicación clínica. La serología convencional de VEB carece de utilidad para el diagnóstico. El diagnóstico de certeza se basa en el estudio histopatológico de biopsias o líquidos biológicos, incluyendo de forma rutinaria morfología e inmunotipo. En las lesiones precoces o polimorfas, la inmunotipificación sirve para la determinación de clonalidad mediante el fenotipo de las cadenas ligeras de las inmunoglobulinas; en los casos negativos, ésta se debería confirmar por reordenamiento de los genes de las cadenas pesadas por PCR, o 88 mediante estudio del genoma de VEB. En las lesiones monomorfas, la inmunotipificación tiene como objetivo la determinación del origen B o T, ya que estas lesiones son invariablemente clonales17. Dado que es posible el crecimiento sincrónico de tumores de distinta clonalidad, o la coexistencia de lesiones en distintos estadíos de progresión, es recomendable la obtención de varias muestras de toda lesión sospechosa siempre que sea posible. La detección del genoma de VEB o de sus productos en las muestras tisulares no es imprescindible para el diagnóstico en las lesiones monomorfas, aunque puede ser necesario en las lesiones precoces o polimorfas para diferenciarlas del rechazo. Los antígenos nucleares EBNA y la proteina latente de membrana LMP-1 pueden detectarse mediante inmunohistoquímica, aunque la sensibilidad es menor que la detección del DNA viral por hibridación in situ (utilizando secuencias complementarias del gen EBER-1), PCR o Southern blot, por lo que estas últimas técnicas deben considerarse de elección17. La negatividad del VEB en muestras histológicas no debe utilizarse como criterio de exclusión de SLPPT. En los últimos años se han desarrollado métodos para detectar replicación viral en secreciones orofaríngeas o en sangre periférica como método complementario de diagnóstico del SLPPT asociado a VEB, siendo preferibles éstas últimas. Las técnicas de PCR semicuantitativa poseen una elevada sensibilidad pero una baja especificidad para el diagnóstico de SLPPT en pacientes sintomáticos, que puede mejorarse mediante PCR cuantitativas competitivas en linfocitos de sangre periférica18 o mediante PCR cualitativas en suero19, con una sensibilidad del 83% y una especificidad del 100%. No obstante, estas técnicas precisan validarse en la infección primaria, donde puede detectarse viremia sin progresión posterior a SLPPT. Tratamiento. Actualizaciones en Trasplantes 2001. En la actualidad no existe ninguna modalidad terapeútica universalmente validada salvo la reducción y/o supresión temporal del tratamiento inmunosupresor con objeto de intentar la restauración funcional del sistema inmune. No obstante, no se conoce la extensión ni la duración óptima de esta medida. 89 La eficacia de los agentes antivirales es muy limitada, al no actuar sobre el ciclo latente de replicación del VEB. No obstante, existen casos aislados de respuesta a aciclovir20 o a ganciclovir21, probablemente al evitar la infección de nuevos linfocitos B en los estadíos más precoces del proceso. Recientemente se ha comunicado la remisión completa con foscarnet, tras 10 meses de seguimiento, de un paciente trasplantado simultáneamente de corazón y riñón con un cuadro linfoproliferativo pulmonar de aparición tardía22. A pesar de la escasa información disponible, muchos autores recomiendan el uso de antivirales a dosis altas en los cuadros mononucleósicos, en las lesiones hiperplásicas y en los síndromes linfoproliferativos polimorfos, junto a una reducción y/o supresión de la inmunosupresión. La excisión quirúrgica y la radioterapia se han utilizado en casos de enfermedad localizada, mientras que la quimioterapia (CHOP, ProMACE-CytaBOM, VAPEC-B) se recomienda exclusivamente en las lesiones monoclonales con evidencia de activación de proto- oncogenes o alteraciones de genes supresores. Existen casos aislados en los que se ha ensayado con éxito terapias experimentales con alfa-2b-interferón o con anticuerpos monoclonales antilinfocitos B. En los pacientes con trasplante alogénico de médula ósea tratados previamente con deplección de células T puede ser útil la denominada inmunoterapia adoptiva, consistente en la restauración rápida de la inmunidad específica frente a VEB mediante la infusión de leucocitos23 o de linfocitos T citotóxicos presensibilizados procedentes del donante24. Otra variante ha utilizado células NK autólogas activadas25. En cualquier caso, en ausencia de estudios prospectivos concluyentes, el tratamiento debe individualizarse. Mientras tanto, la reducción de la inmunosupresión debe constituir la primera medida a adoptar. Estudios preliminares han sugerido la utilidad potencial de las técnicas de carga viral para monitorizar la respuesta al tratamiento o detectar precozmente las recidivas26 . Prevención. En la actualidad se basa en la identificación de los pacientes de alto riesgo pretrasplante (seronegativos para VEB), y en el uso racional de la inmunosupresión. La eficacia de los antivirales en régimen profiláctico no está bien establecida. Adicionalmente, existe escasa experiencia sobre el tratamiento anticipado guiado por la monitorización de la carga viral en la prevención del SLPPT asociado a VEB27,28. En un estudio preliminar de Rowe y colaboradores, un punto de corte mediante PCR cuantitativa competitiva mayor de 200 copias/ 105 linfocitos de sangre periférica tendría un valor predictivo positivo de SLPPT con una sensibilidad del 93% y una especificidad del 100%18. No se conoce, sin embargo, la modalidad de tratamiento anticipado más eficaz para prevenir el desarrollo de SLPPT (reducción de la inmunosupresión, antivirales, inmunoglobulinas por vía intravenosa o una combinación de los anteriores). BIBLIOGRAFIA 1.- Knowles DM, Cesarman E, Chadburn A, Frizzera G, Chen J, Rose EA et al. Correlative morphologic and molecular genetic analysis demonstrates three distinct cathegories of posttransplantation lymphoproliferative disorders. Blood 1995; 85: 552-565. 2.- Cesarman E, Chadburn A, Liu YF, Migliazza A, Dalla-Favera R, Knowles DM. Bcl-6 gene mutations in post-transplantation lymphoproliferative disorders (PT-LPDs) as predictors of response to therapy and clinical outcome. Blood 1998; 92: 2294-2302. 3.- Nelson BP, Nalesnik MA, Bahler DW, Locker J, Fung JJ, Swerdlow SH.Epstein-Barr virus-negative post-trasplant lymphoproliferative disorders. A distinct entity?. Americal Journal of Surgical Pathology 2000; 24: 375-385. 4.- Basgoz N, Preiksaitis JK. Post-transplant lymphoproliferative disorder. Infect Dis Clin North Am 1995; 9: 901-923. 5.- Cox KL, Lawrence-Miyasaki LS, García-Kennedy R, Lennette ET, Martínez OM et al. An increased incidence of EpsteinBarr virus infection and lymphoproliferative disorder in young children on FK506 after liver transplantation. Transplantation 1995; 57: 524-529. 6.- Pirsch JD, Miller J, Deierhoi MH, Vicenti F, Filo RS for the FK-506 Kidney Transplant Study Group: a comparison of tacrolimus (FK-506) and cyclosporine for immunosupression after cadaveric renal transplantation. Transplantation 90 Actualizaciones en Trasplantes 2001. 91 1997; 63: 977-983. 7.- Mayer AD, Dmitrewski J, Squifflet JP, Besse T, Grabensee B, Klein B et al. Multicenter randomized trial comparing tacrolimus (FK-506) and cyclosporine in the prevention of renal allograft rejection. Transplantation 1997; 64: 436-443. 8.- Wiessner RH. A long-term comparison of tacrolimus (FK-506) versus cyclosporine in liver transplantation. A report of the United States FK-506 Study Group. Transplantation 1998; 66: 493-499. 9.- Swinnen LJ, Costanzo-Nordin MR, Fisher SG, O´Sullivan EJ, Johnson MR, Heroux AL et al. Increased incidence of lymphoproliferative disorder after immunosuppresion with the monoclonal antibody OKT3 in cardiac transplant patients. New England Journal of Medicine 1990; 323: 1723-1728. 10.- Bathia S, Ramsay NKC, Steinbuch M, Dusenbery KE, Shapiro RS, Weisdorf DJ et al. Malignant neoplasms following bone marrow transplantation. Blood 1996; 87: 3633-3639. 11.- Swerdlow AJ, Higgins CD, Hunt BJ, Thomas JA, Burke MM, Crawford DH, Yacoub MH. Risk of lymphoid neoplasia after cardiothoracic transplantation: a cohort study of the relation to Epstein-Barr virus. Transplantation 2000; 69: 897904. 12.- Walker RC, Marshall WF, Strickler JG, Wiesner RH, Velosa JA, Habermann TM, McGregor CGA, Paya V. Pretransplantation assesement of the risk of lymphoproliferative disorder. Clinical Infectious Diseases 1995; 20: 1346-1353. 13.- Knowles DM. Immunodeficieny-associatted lymphoproliferative disorders. Mod Pathol 1999; 12: 200-217. 14.- Mañez R, Breinig MC, Linden P, Wilson J, Torre-Cisneros J, Kusne S, Dummer S, Ho M. Posttransplant lymphoproliferative disease in primary Epstein-Barr virus infection after liver transplantation: the role of cytomegalovirus disease. J Infect Dis 1997; 176: 1462-1467. 15.- McLaughlin K, Wajstaub S, Maretta P, Adams P, Grant DR, Wall WJ, Jevnikar AM, Rizkalla KS. Increased risk for posttransplant lymphoproliferative disease in recipients of liver transplants with hepatitis C. Liver Transpl 2000; 6: 570-574. 16.- Cohen JI. Epstein-Barr virus lymphoproliferative disease associated with acquired immunodeficiency. Medicine (Baltimore) 1991; 70: 137-160. 17.- Harris NL, Ferry JA, Swerdlow SH. Posttransplant lymphoproliferative disorders: summary of Society for Hematopathology Workshop. Seminars in Diagnostic Pathology 1997; 1: 8-14. 18.- Rowe DT, Qu LL, Reyes J, Jabbour N, Yunis E, Putnam P, Todo S, Green M. Use of quantititive competitive PCR to measure Epstein-Barr virus genome load in the peripheral blood of pediatric transplant patients with lymphoproliferative disorders. J Clin Microbiol 1997, 35: 1612-1615. 19.- Limaye AP, Huang ML, Athneza E, Farrenberg JM, Corey L. Detection of Epstein-Barr virus DNA in sera from transplant recipients with lymphoproliferative disorders. J Clin Microbiol 1999, 37: 1113-1116. 20.- Hanto DW, Frizzera G, Gajl-Peczalska KJ, et al. Epstein-Barr virus-induced B-cell lymphoma after renal transplantation. Acyclovir therapy and transition from polyclonal to monoclonal B-cell proliferation. N Engl J Med 1982, 913-918. 21.- Pirsch JD, Stratta RJ, Sollinger HW, Hafez GR, DAlessandro AM, Kalayoglu M, Belzer FO. Treatment of severe EpsteinBarr virus-induced lymphoproliferative syndrome with ganciclovir: two cases after solid organ transplantation. Am J Med 1989; 86: 241-244. 22.- Oertel SH, Ruhnke MS, Anagnostopoulos I, Kahl AA, Frewer AF, Bechstein WO, Hummel MW, Riess HB. Treatment of Epstein-Barr virus-induced posttransplantation lymphoproliferative disorder with foscarnet alone in an adult after simultaneous heart and renal transplantation. Transplantation 1999; 67: 765-767. 23.- Papadoupoulos EB, Ladany M, Emanuel D, Mackinnon S, Boulad F, Carabasi MH et al.Infusions of donnor leukocytes to treat Epstein-Barr virus-associated lymphoproliferative disorders after allogenic bone marrow transplantation. N Engl J Med 1994; 330: 1185-1191. 24.- Heslop HE, Ng CY, LI C, Smith CA, Loftin SK, Krance RA, Brenner MK, Rooney CM. Long-term restoration of immunity against Epstein-Barr virus infection by adoptive transfer of gene-modified virus-specific T lymphocites. Nat Med 1996, 2: 551 555. 25.- Nalesnik MA, Rao AS, Furukawa HH, Pham S, Zeevi A, Fung JJ et al. Autologous lymphokine-activated killer cell therapy of Epstein-Barr virus-positive and negative lymphoproliferative disorders arising in organ transplant recipients. Transplantation 1997, 63: 1200-1205. 26.- Green M, Cacciarelli TV, Mazariegos GV, Sigurdsson L, Qu L, Rowe DT, Reyes J. Serial measurements of Epstein-Barr viral load in peripheral blood in pediatric liver transplant recipients during treatment for posttransplant lymphoproliferative disease. Transplantation 1998; 66: 1641-1644. 27.- Green M, Reyes J, Webber S, Michaels MG, Rowe D. The role of viral load in the diagnosis, management and possible prevention of Epstein-Barr virus-associated posttransplant lymphoproliferative disease following solid organ transplantation. Current Opinion in Organ Transplantation 1999, 4: 292-296. ¿ Es costoso el análisis de Ciclosporina? Felipe García de Pesquera Benjumea. Unidad de Diagnóstico de Medicina Nuclear. La ciclosporina es un agente inmunosupresor con un estrecho rango terapèutico , cuya farmacocinética presenta una muy marcada variabilidad de un paciente a otro, sobretodo en cuanto a biodisponibilidad y aclaramiento, y además la interacción con otras drogas puede alterar su concentración en sangre (1). El efecto terapéutico de la ciclosporina en los órganos trasplantados, no puede ser analizado realmente, así como tampoco se puede predecir la concentración de Ciclosporina, en base a la dosis administrada. Debido a estas circunstancias se hace imprescindible su monitorización, como ayuda esencial para ajustar las dosis individuales y asegurar, de este modo, una adecuada inmunosupresión, minimizando los riesgos de su elevada toxicidad. La monitorización terapéutica de la Ciclosporína presenta muchas dificultades (2) y ha creado en los clínicos una inquietud que se ha intentado solucionar con reuniones y seminarios monográficos, llegándose finalmente a un consenso en como y en que circunstancias se debe analizar la concentración de ciclosporína, estos protocolos tienen todos en común utilizar sangre total como muestra para el análisis. Cada Hospital y según los medios de que disponga utilizará el método analítico que considere más apropiado para sus fines, pues existen diferentes metodologías para su análisis, de las que vamos a hacer una somera descripción. METODOS ANALITICOS. El radioinmunoanálisis (RIA), el inmunoanálisis de polarización de fluorescencia (FPIA), el enzimoinmunoanálisis (EMIT)y la cromatografía líquida de alta resolución (HPLC) son los métodos principales para la monitorización de la ciclosporina. En la interpretación de los resultados obtenidos con RIA, EMIT y FPIA, es de crucial importancia la especificidad del anticuerpo utilizado para evitar las reacciones cruzadas con los metabolitos no activos, por lo que el método original desarrollado por Sandoz con un anticuerpo policlonal, ha sido sustituido por multitud de análisis que utilizan anticuerpos monoclonales (3), pero todavía como veremos más adelante algunos laboratorios continúan utilizando anticuerpos no específicos, con los problemas de interpretación que esto conlleva. La HPLC mide específicamente los componentes activos y sigue siendo el método de referencia. 92 El FPIA es un inmunoensayo competitivo, existe una relación inversa entre la cantidad de ciclosporina en la muestra del paciente y la intensidad de luz recibida por el receptor óptico del instrumento. Las altas lecturas de fluorescencia corresponden a bajas concentraciones de analito, por el contrario, bajas lecturas de fluorescencia corresponden a altas concentraciones de fármacos por lo que con este método se obtienen resultados precisos en bajas concentraciones de ciclosporina. Tambien en el RIA el resultado final, las cpm medidas en el contador de centelleo, es inversamente proporcional a la cantidad de fármaco en la muestra del paciente, es decir, cuando las cpm son elevadas la concentración de ciclosporina en la muestra del paciente es baja. La tecnología EMIT es similar al RIA, excepto en que el marcaje se hace con una enzima en lugar de una molécula radiactiva, cuando no existe fármaco en la muestra del paciente, el anticuerpo se une exclusivamente al fármaco marcado enzimático, por lo que la intensidad de color detectáble es baja, por el contrario, cuanto mayor es la producción de color, mayor es la concentración de fármaco en la muestra del paciente, es decir, la variación de color de la solución de ensayo es directamente proporcional a la concentración de ciclosporina en la muestra. Esta relación directa impide a la tecnología EMIT detectar con exactitud cantidades reducidas de fármaco. El método de HPLC es el método de referencia para el análisis de ciclosporina, pero no es una técnica especifica en si misma. La mayor desventaja de este método es que el laboratorio necesita un personal muy entrenado y en gran número para ser usada como de rutina, al existir múltiples problemas en su realización, como un sistema de extracción largo y difícil, poca eficiencia en la extracción, poca sensibilidad, o fácil deterioro de las columnas analíticas, por lo que esta técnica solo será válida para laboratorios muy experimentados en su uso. Actualizaciones en Trasplantes 2001. La comparación de los resultados obtenidos en el análisis de ciclosporina, es muy difícil, por los distintos métodos que se usan, así como, por los diferentes tipos de muestra. Los estudios publicados varían extraordinariamente por lo que las comparaciones son complicadas. Para poder establecer un control de calidad multicentro y una adecuada comparación entre los valores encontrados por los distintos laboratorios, se han establecido protocolos de consenso para la monitorización de ciclosporina.(4) 93 PROTOCOLO PARA LA MONITORIZACION DE CICLOSPORINA.Muestra.- El análisis de ciclosporina lo realizamos en sangre total, por lo que se evita el problema de la distribución irregular del fármaco entre los hematíes y el plasma. La extracción sanguínea se realiza antes de la toma de las dosis, generalmente antes de la dosis de la mañana, en tubo de extracción con EDTA, y teniendo especial cuidado en evitar la formación de coágulos, que atraparían una parte considerable de la ciclosporina, falseando los resultados, a continuación, hacemos una lísis total de los eritrocitos por congelación a -78 ºC, conservándose de este modo hasta el momento del análisis, así conseguiremos analizar toda la ciclosporina activa existente en la muestra. Solicitud.- La petición analítica debe cumplir todos los condicionantes del Decreto 112/98 de la Junta de Andalucía , y además indicar con claridad la dosis que se está administrando al paciente y la hora de extracción, así como el tipo de trasplante a que ha sido sometido. Análisis.- En nuestro Servicio de Medicina Nuclear utilizamos un método RIA comercial (CYCLO-Trac SP, DiaSorin, Stillwater MN,USA) de doble anticuerpo monoclonal con una reactividad cruzada inferior al 0.8 % con los metabolitos no activos de la ciclosporina y que necesita una extracción previa con metanol (grado HPLC).(5) El tiempo de incubación es de una hora por lo que aproximadamente a las 4 horas de haberse realizado la extracción el laboratorio está en condiciones de dar los resultados. Las muestras han de estar antes de las nueve de la mañana en el laboratorio, para recibir los resultados a partir de las 13 horas, hora aproximada en que se emite un informe preliminar y provisional, para los pacientes ingresados que se envían a las zonas de hospitalización en la misma mañana, y solo en casos de máxima urgencia y a requerimiento del clínico se dan los resultados por teléfono. Proximamente con la incorporación de nuestra informática a la Intranet del hospital, se tendran los resultados en las plantas de hospitalización en tiempo real, a medida que se vayan obteniendo. Al final de la mañana, una vez validado todo el ensayo, se realizan los informes definitivos, firmados y supervisados por el facultativo especialista. Control de Calidad.- En nuestro laboratorio realizamos un control de calidad interno con la introducción de dos muestras de valor conocido cada 30 pacientes. Una de concentración ligeramente por debajo de los límites inferiores de los valores terapeuticos, entre 72.0 y 108.0 ng/mL y otro en los límites superiores, entre 340.0 y 460.0 ng/ml, mientras que el control de calidad externo es realizado por The Analytical Unit, del St.George´s Hospital Medical School, London UK permaneciendo nuestra fiabilidad dentro de valores similares desde 1995 en que comenzamos este control europeo, con anterioridad el control de calidad externo para el análisis de ciclosporina lo realizaba el Istituto di Fisiologia Clinica de la Universidad de Pisa. De los 421 laboratorios que intervienen en el control de calidad externo, 203 utilizan metodología FPIA en sus distintas variantes, policlonal o monoclonal, 154 EMIT, 44 RIA, 11 HPLC y 9 utilizan métodos propios. Costes.- En un día ordinario de trabajo nuestro laboratorio de la Unidad de Diagnostico de Medicina Nuclear realiza una media de 40 determinaciones de Ciclosporina , lo que significa la dedicación a su análisis de un Técnico especialista / D.U.E durante la mitad de su jornada laboral. Los reactívos necesarios para este analítica tienen un coste de 38.650.,00 pts.. Si comparamos estos costes con los precios de catálogo de un método por FPIA que son de 196.627,00 pts para la realización de 100 muestras, no 100 pacientes, y contabilizamos curvas patrón y controles, los precios unitarios para cada paciente son mas del doble por FPIA que por el método de RIA utilizado por nosotros. El tiempo empleado por el personal especialista para realizar estos 40 pacientes diarios es el mismo aproximadamente, 94 para cualquier método pues el tiempo de recepción, grabado de datos, preparación de la muestra, extracción, validación, etc. es el mismo para todos los casos, por lo que el valor discriminante del coste es el precio de los reactivos. En nuestro caso el valor unitario es de 966.0 pts por cada paciente, que comparándolo con otros métodos resulta ser menos de la mitad de ellos (FPIA 2.195.0 pts). A MODO DE CONCLUSION.Está bastante extendido entre las Administraciones la idea de que la monitorización de Ciclosporina resulta una técnica muy cara por el costo de los reactivos, por el tiempo de personal especialista que necesita o por la poca capacidad analítica de las unidades dedicadas a ello, pero en nuestro caso todo esto es relativo pues como hemos demostrado los costos de realización son aproximadamente iguales a los de ciertas hormonas de petición rutinaria o los de algunos anticuerpos solicitados masivamente. La metodología RIA es la mejor de las posibles, en cuanto a sensibilidad y fiabilidad se refiere (6), lo que ocurre es que para su utilización hacen falta unas instalaciones y un personal entrenado que no todos los Hospitales pueden disponer de el, por lo que el único argumento que suelen utilizar las casas comerciales para la introducción masiva de técnicas alternativas, y las llaman así « técnicas alternativas al RIA», es lo «peligroso» de una instalación radiactiva y los «problemas» burocráticos que esta instalación representa. Nuestro Hospital dispone posiblemente de la mejor instalación radiactiva para uso hospitalario de España, y nuestra unidad tiene 30 años de experiencia con estas técnicas y además sus costos en el análisis de ciclosporina, son la mitad de cualquier otra metodología, por lo que ¿ todo esto puede ser despreciado por unos compromisos comerciales ?. El Hospital debe rentabilizar los medios de que dispone y más si son baratos. Creemos haber demostrado, con números, que la determinación de ciclosporina en nuestra Unidad de Diagnostico de Medicina Nuclear no es ni más cara ni más barata que otras determinaciones que se solicitan de rutina en nuestro Hospital. Lo que si es «otro cantar» es lo que cuestan determinaciones que se salen de la «glucosa, urea y colesterol», por poner un ejemplo, y que con seguridad no serian tan imprescindibles para el paciente, como lo es la monitorización de ciclosporina para un trasplantado. Actualizaciones en Trasplantes 2001. Referencias. 95 1.- Lindholm A., Henricsson S., Lind M., Dahlqvist R. Intraindividual variability in the relative systemic availability of cyclosporin after oral dosing . E J Clin Pharmacol 1988, 34: 461 464 2.- Yee GC., McGuire. Pharmacokinetic drug interactions with cyclosporin (part I) Clin Pharmacokinet 1990, 19 : 319 332 3.- Lee SF., Yang WC., Shann TY., Lui WY., Wang RB. Comparison of nonspecific radioimmunoassay, highperformance liquid chromatography, and fluorescence polarization immunoassay for cyclosporine monitoring in renal transplantation. Ther Drug Monitoring 1991 13 : 152 156 4.- Kahan BD, Shaw LM, Holt D., Grevel J., Johnston A. Consensus document : Hawk´s Cay meeting on therapeutic drug monitoring of cyclosporine. Clin Chem 1990 , 36 : 1510 - 1516 5.- Lee SC., Brudzinski AM., Yasmineh JL., et al Measurement of cyclosporine A by a specific radioimmunoassay with a monoclonal antobody and 125I tracer. Clin PROFILAXIS DE LA REINFECCION POR VHB EN RECEPTORES DE TRASPLANTE HEPATICO HBsAg POSITIVO. J.M. Sousa Martín, M. Sayago , F. Pareja, C. Díaz-Aunion, J. Serrano, M.A. Gómez, I. García, M.J Tamayo, E. Cañas, J.B. Pérez-Bernal, R. Hinojosa, A. Bernardos. Unidad Trasplante Hepático. La infección por VHB ha sido una indicación controvertida de Trasplante hepático, estas reticencias venían determinadas por la baja supervivencia que se alcanzaba en estos pacientes, debido principalmente a la gravedad de la recidiva de la infección por VHB. Actualmente el uso de la gammaglobulina hiperinmune anti VHB y los análogos de nucleósidos han disminuido de forma drástrica la reinfección por VHB, de tal forma que en la actualidad la supervivencia de pacientes trasplantados por infección VHB es similar o superior a otras indicaciones. CARACTERISTICAS DE LA REINFECCION POR VHB EN PACIENTES SOMETIDOS A TRASPLANTE HEPÁTICO. Se produce por la presencia de viriones circulantes en la sangre del receptor y por replicación extrahepática del VHB (ganglios, bazo, páncreas etc). Aún en ausencia de replicación viral, la reinfección es casi la regla (80 %) si no se realiza profilaxis específica de la misma postrasplante. Desde 1993 en un estudio multicéntrico de Samuel y cols (1) está bien establecido que el factor fundamental que determina el riesgo de recidiva es la presencia de replicación viral manifestada en forma de antígeno e positivo o/y DNA del VHB positivo por hibridación molecular, así mismo, la reinfección por VHB disminuye en estados asociados a menor replicación viral (infección concomitante con virus Delta y causa de trasplante secundaria a fallo hepático fulminante por VHB). Más del 90 % de pacientes reinfectados desarrollan lesiones en el injerto que generalmente son muy severas, con rápida progresión a cirrosis en pocos meses. Una forma muy grave y peculiar de recidiva del VHB en pacientes trasplantados es la hepatitis colostásica fibrosante (HCF) descrita en 1991 por Davies y cols (2); aparece en un 25% de pacien96 tes reinfectados y analíticamente cursa con aumento progresivo de bilirrubina , disminución de tasa de protrombina, descenso de albúmina y poca elevación de transaminasas. Histológicamente se caracteriza por gran grado de fibrosis y colostasis con poco infiltrado inflamatorio acompañado de gran presencia de antígeno core y de superficie en estudios inmunohistoquímicos. En ausencia de respuesta a tratamiento con análogos de nucleósidos, cursa como insuficiencia hepática aguda con la muerte del paciente en 6-8 semanas desde el inicio del cuadro. Por estos motivos el factor determinante de la supervivencia en pacientes trasplantados con HBsAg positivo es la reinfección por VHB. PROFILAXIS DE LA REINFECCION POR VHB: A- PROFILAXIS PRETRASPLANTE: Actualizaciones en Trasplantes 2001. 1- Interferón: El interferón es mal tolerado en pacientes con cirrosis avanzada y los efectos secundarios son más frecuentes y potencialmente más graves, por este motivo no se suele recomendar este tratamiento a este tipo de pacientes. El uso pretrasplante de interferón no se ha demostrado útil para disminuir la recidiva (3) 97 2- Análogos de nucleósidos: Presentan la ventaja respecto al interferón en su facilidad de administración y mejor tolerancia en pacientes con cirrosis hepática descompensada. Los análogos de nucleósidos y especialmente la lamivudina se han mostrado eficaces en inhibir la replicación viral pretrasplante, normalizar las transaminasas e incluso mejorar la función hepática con disminución de la puntuación en la clasificación de Child-Pugh, retrasando o evitando incluso la introducción del paciente en lista de espera (4). El problema que plantea la lamivudina en el pretrasplante es la rápida aparición de resistencias que se estima en torno al 25 % al año y 40 % a los dos años, además, los efectos beneficiosos sobre la replicación viral suelen revertir con la suspensión de la misma. En la actualidad se recomienda que el tratamiento con lamivudina no se prolongue más de 6 meses previo al trasplante, con el fin de evitar resistencias; a esta norma se puede hacer la excepción de pacientes con cirrosis muy avanzada , especialmente si presentan datos de actividad inflamatoria, en los que el tratamiento podría mejorar la función hepática y permitir la supervivencia del paciente hasta el trasplante. La mayoría de centros de Trasplantes consideran contraindicado el mismo en presencia de marcadores de replicación viral del VHB, el uso de análogos de nucleósidos ha permito ampliar el pool de enfermos con hepatopatía crónica por VHB que pueden ser sometidos a trasplante al conseguir negativizar la replicación viral. B-PROFILAXIS POSTRASPLANTE. Los pacientes trasplantados por infección crónica por virus B tienen una tasa de rechazo agudo menor que los trasplantados por otra indicación , esto estaría en relación con una alteración del sistema inmune que por una parte permite perpetuar la infección por VHB y por otra parte disminuiría la posibilidad de rechazo. El virus B presenta un receptor corticosensible que aumenta la replicación viral, también se sabe que la azatioprina au- menta la replicación viral de dos a cuatro veces y que el tratamiento prolongado con ciclosporina o FK 506 aumenta las replicación viral a largo plazo. Por estos motivos debe intentarse que la inmunosupresión de estos pacientes no sea agresiva a fin de disminuir el riesgo de recidiva. En cuanto al uso de fármacos en la profilaxis postrasplante la estrategia se puede dividir en cuatro tipos: 1- Gammaglobulina hiperinmune anti VHB (HBIG): Aumenta claramente la supervivencia del injerto y del paciente (1), podría disminuir la morbilidad de la recurrencia , incluso se ha ensayado con buenos resultados en pacientes con replicación viral . Las desventajas que presenta este tratamiento son varias: En primer lugar el altísimo costo. ya que es un tratamiento extremadamente caro y de por vida al estar comprobado la recidiva al suspender el mismo. En segundo lugar presenta efectos secundarios, si bien generalmente leves (rash, nauseas, vómitos etc), está descrita la posibilidad de intoxicación por mercurio en los preparados intravenosos. En tercer lugar que es eficaz sólo en un 80 % de pacientes, esta ineficacia puede venir determinada por la alta replicación viral pretrasplante, la obtención de títulos inadecuados de anti-HBs (<100 IU/L) o por la presencia de mutaciones de escape. Por último tampoco está clara la pauta y via de administración. Se usa tanto la vía i.v como la i.m y pautas fijas o lo que es más habitual, a demanda para mantener títulos de anti-HBs por encima de 100. La pauta más habitual es usar 10.000 u en fase anhepática y posteriormente 10.000 unidades al día hasta el 6º o 7º día postrasplante, se suele proseguir con 5.000-10000 unidades i.v. o i.m. generalmente una vez al mes, cambiando el intervalo si es necesario a fin de mantener anti-HBs por encima de 100 IU/L. Frente a esta pauta, más habitual, hay grupos que usan mayores dosis de gammaglobulina ya que lo correlacionan con menores pautas de reinfección (especialmente si mantienen niveles de anti-HBs >500 IU/L en los primeras semanas o meses) permitiendo trasplantar a pacientes incluso con replicación viral .Otros grupos usan pautas a dosis fijas, independientemente de los niveles de anti-HBs, obteniendo buenos resultados. Se ha comprobado que en la mayoría de los pacientes tratados a largo plazo con HBIG persiste el VHB por PCR tanto en células mononucleadas de sangre periférica, suero e hígado, indicando que la infección por VHB no desaparece con la profilaxis (5), pero que el VHB se mantiene a niveles tan bajos que no provoca enfermedad; este dato nos indica que la profilaxis debe ser indefinida ya que está bien establecida la alta posibilidad de reinfección en pacientes a los que se les suspende HBIG tras varios años de profilaxis. La reinfección por VHB suele acontecer en los primeros 12 meses y suele ser excepcional a partir de los dos años en pacientes en los que se mantiene la inmunoprofilaxis, es por este motivo por el que se deben extremar las precauciones para evitar la reinfección en los primeros 12-18 meses. 2- Análogos de nucleósidos: Tal como se ha comentado presentan las ventajas de su fácil administración, buena tolerancia, la carencia de efectos sobre la inmunidad celular y generalmente su menor coste respecto a la HBIG, por tanto a priori serían los fármacos ideales para usar como profilaxis. Todas estas ventajas vienen matizadas por la aparición de resistencias,m por lo que no se recomienda como 98 monoterapia para evitar la reinfección por VHB. De todos ellos (ganciclovir, famciclovir y Lamivudina) el más usado es la lamivudina a dosis de 100 mgrs al día. Hasta la fecha no hay experiencia en el campo de trasplantes con otros análogos de nucleotidos/nucleosidos (adefovir dipivoxil , entecavir) sobre los que ya hay resultados prometedores en el tratamiento de la infección por VHB. Los pacientes resistentes a lamivudina son resistentes también a famciclovir, pero en cambio los pacientes resistentes a famciclovir pueden ser sensibles a lamivudina. Estudios in vivo (6) e in vitro han demostrado que no hay resistencias cruzadas entre lamivudina y adefovir dipivoxil. Siguiendo el camino emprendido con la infección VIH , las expectativas futuras irán encaminadas al tratamiento combinado con análogos de nucleósidos a fin de disminuir o retrasar la aparición de resistencias. Aunque este puede ser el futuro del tratamiento de la infección por VHB, parece precipitado aventurar su uso como profilaxis de la reinfección por VHB en pacientes trasplantados. Actualizaciones en Trasplantes 2001. 3- Gammaglobulina hiperinmune anti VHB junto con análogos de nucleósidos (lamivudina): Aunque no hay excesiva experiencia, ni estudios a largo plazo, esta se puede considerar en la actualidad la profilaxis de elección para evitar la reinfección por por VHB postrasplante. No hay acuerdo en la dosis a emplear de HBIG y la duración del tratamiento con lamivudina. Varios autores propugnan usar la terapia combinada pero con dosis de HBIG menores de lo habitual (2000-5000 u) con excelentes resultados y ahorro de costes . Muy recientemente Dodson et al propone usar estos dos fármacos pero de forma secuencial,Publicación sustituyendo HBIG HBIG por lamivudina a los dos años del trasplante. En cualAutor Lamivudina Pacientes Me quier caso, diversos estudios muestran esperanzadores con la terapia combiVia resultados Mgrs/día 99 Markowitz Hepatology1998 I.V 150 13 13 Yao Liv Trans Sur1999 I.M 150 10 15 Marzano Hepatology1999 Abst - 100 24 22 Yoshida Liver Trans Surg 1999 I.M 100 6 17 MCaughan Liver Trans Surg 1999 I.M - 8 15 Han Hepatology1999 Abst I.V 150 60 15 Andreone J. Hepatol 2000 Abst I.V 100 19 27 Jang Transplant 2000 Abst - - 85 26 Dodson Transplant 2000 Abst IV/IM 150 36 43 nada tal como se muestra en la TABLA 1. Tabla 1: 1% de reinfección VHB con lamivudina mas HBIG 4- Vacunación: Tradicionalmente los pacientes cirróticos con mala función hepá- tica y los pacientes trasplantados sometidos a inmunosupresión han sido malos respondedores a la vacunación de virus B. Recientemente dos grupos españoles han presentado los resultados preliminares de un protocolo de vacunación a virus B en pacientes que han estado en tratamiento con HBIG al menos durante 18 meses (8-9). Las dosis empleadas son el doble de las habituales, se repetían los ciclos de vacunación si no había respuesta y los pacientes no presentaban datos de replicación viral pretrasplante. Ninguno de los pacientes se reinfectó y los títulos de anti-HBs que se consideraban protectores estaban por encima de 10 UI/L. Estos trabajos aportan dos perspectivas novedosas: Por una parte la buena respuesta a la vacunación (82 %), esto podría estar condicionado en primer lugar por el periodo trascurrido desde el trasplante y la consiguiente disminución de inmunosupresión y por otro lado la repetición de los ciclos de vacunación si no había respuesta inicial; el otro aspecto novedoso es que el título considerado como protector es de 10 UI/L frente a lo considerado tradicionalmente que estaba en 100 UI/L, posiblemente esto refleja la disminución de probabilidad de reinfección a medida que pasa el tiempo y el menor umbral protector necesario. Estos estudios incluyen a pocos pacientes, algunos trasplantados por fallo hepático fulminante por VHB lo cual se correlaciona con menos alteración del sistema inmune de base, y seguidos durante un periodo corto de tiempo por lo que hay que tomar estos resultados con extremada precaución. PROFILAXIS DE LA INFECCION POR VHB DE NOVO: Aproximadamente un 3 % de pacientes HBsAg VHB negativo antes del trasplante hepático lo adquieren después del mismo. Estas infecciones de novo por virus B pueden tener un triple origen: 1- Fallo hepático fulminante de etiología desconocida y con marcadores del virus B negativos. Se estima que entre un 5-35 % de estos fallos hepáticos fulminantes están provocados por VHB oculto sin expresión en marcadores virales. 2- Infección oculta procedente del receptor, por reactivación de virus B silente a pesar de la negatividad del antígeno de superficie. Son generalmente pacientes con marcadores de teórica infección pasada por virus B, pero en los que el virus puede persistir. 3- Donantes Anti HBc (+) con anti HBs (±). En este caso hay infección oculta por VHB en el donante. Ese grupo representa la mayoría de las causas de infecciones de novo, está bien establecida esta vía desde el año 1995 por Wachs. A pesar de presentar HbsAg (-) el hígado donante contiene VHB, generalmente detectable por técnicas de PCR en biopsia hepática, aparentemente silente, que se reactiva en el donante sometido a inmunosupresión. Este riesgo de transmisión de virus B procedente de donantes anti HBc positivo es muy alto oscilando en distintas series entre 35-90 %. El riesgo de infección de novo es menor si el receptor es anti HBs positivo, algo mayor si es anti HBc positivo con Anti HBs negativo y muy elevado si es anti HBc y anti HBs negativos. A la vista de estos datos es necesario establecer estrategias encaminadas a prevenir la infección de novo de 100 donantes anti HBc positivo, esta podría estar encaminada a usar estos órganos (En España representan entre el 10-15 % de donantes) en receptores HBsAg o Anti HBs positivos o bien realizar profilaxis con HBIG ± Lamivudina, aunque en este caso la pauta no está bien establecida y se desconoce si debe ser tan estricta como las usadas para prevenir la reinfección . El cuso clínico de la infección de novo es habitualmente hacia la cronificación, pero esta suele ser menos agresiva que la reinfección , siendo, por ejemplo, la hepatitis colostásica fibrosante, rara en este tipo de pacientes. RESULTADOS DEL TRASPLANTE HEPATICO EN RECEPTORES HBsAg (+) DEL H.U. VIRGEN DEL ROCIO: Ente Abril de 1990 y Abril del año 2000 se han realizado en nuestra Unidad 275 trasplantes en 258 receptores; de estos 39 trasplantes se han realizado en 35 receptores HBsAg (+) lo que representa el 13.5 % de las indicaciones de Trasplante Hepático en nuestro centro. Todos estos pacientes tenían la condición pretrasplante de presentar DNA VHB por hibridación molecular negativo o menor de 10 pg/ml. El protocolo de profilaxis habitualmente seguido en nuestra Unidad está basado en una pauta fija con 10.000 unidades de HBIG en fase anhepática, 10.000 unidades días 1-6 , 10.000 unidades al mes durante el primer año, 10.000 unidades cada dos meses el segundo y tercer año y 10.000 unidades cada tres meses a partir del cuarto año. 6 pacientes han recibido adicionalmente Lamivudina 100 mgrs al día en el postrasplante de forma indefinida. RESULTADOS: Actualizaciones en Trasplantes 2001. La supervivencia es del 69 % a los 1 y 5 años, con una supervicencia actuarial del 68.5 % con seguimiento medio de 42.62± 23.13 meses (TABLA 2). Sólo 1 paciente de los 35 ha fallecido como consecuencia de reinfección por VHB (un caso de hepatitis colostásica fibrosante), lo que representa tan sólo 3.53 % de mortalidad atribuible a VHB en nuestra serie de pacientes HBsAg (+). 101 La probabilidad de estar libre de reinfección en 23 pacientes, seguidos al menos durante 6 meses postrasplante, con seguimiento medio de 40.13± 21.72, es del 95 % a los tres meses, 86 % a los 6 meses, 82 % a los 12 meses y posteriormente se ha manteniendo en este 82 % de forma constante hasta los 5 años (TABLA 3). Por tanto, todas las reinfecciones en nuestro centro han acontecido en los 12 primeros meses, que es el periodo que consideramos de máximo riesgo. La reinfección ha aparecido en 4/17(23.5 %) pacientes que estaban en profilaxis única con HBIG y en 0/6 (0 %) que estaban en profilaxis combinada con HBIG y lamivudina, confirmando las halagüeñas perspectivas que esta combinación muestra en estudios recientes. Otro dato interesante de nuestra serie es que ha aparecido reinfección en 4/5 pacientes con Hepatocarcinoma y profilaxis única con HBIG y en 0/12 pacientes sin Hepatocarcinoma y en profilaxis única con HBIG, teniendo estos resultados significación estadística con el test de la probabilidad exacta de Fischer. Estos datos insinúan la posibili- dad de que los pacientes con Hepatocarcinoma sean de alto riesgo para la reinfección tal como apuntó Wong en 1995. En la TABLA 4 se muestran los niveles de Anti HBs alcanzados con esta pauta fija durante el primer año en 23 pacientes, como se aprecia en la gráfica hay un porcentaje importante de pacientes que en alguna determinación no alcanza los niveles de 100 de Tabla 2: Supervivencia de 35 pacientes HBsAg (+) en meses Tabla 3: % de pacientes libres de reinfección VHB en meses 102 Tabla 4: Determinaciones de los niveles de ANTI-HBs (UI/L) en 23 pacientes HBsAg(+) durante el primer año Tabla 5: Media de los niveles ANTI-HBs los tres primeros años postrasplante en 23 pacientes HBsAg (+) pretrasplante Actualizaciones en Trasplantes 2001. anti-HBs, habitualmente recomendados como protectores. En este mismo gráfico se aprecia la variabilidad alcanzada en los niveles tanto en un mismo paciente como entre estos. 103 En la TABLA 5 se refleja la media de niveles alcanzados cada mes en el conjunto de pacientes, como se aprecia, el título de anti-HBs disminuye progresivamente , siendo más altos en los primeros 12-18 meses que es el considerado periodo de máximo riesgo. BIBLIOGRAFIA 1- Samuel D, Muller R, Alexander G et al. Liver transplantation in European patients with the hepatitis B surface antigen. N Engl J Med 1993; 329: 1842-7. 2- Davies S, Portmann B, O´Grady J et al. Hepatic histological findings after trasplantation for chronic hepatitis B virus infection, including a unique pattern of fibrosing cholestatic hepatitis. Hepatology 1991 Vol 13; Nº 1: 150-157. 3- Marcellin P, Samuel D, Areiras J et al. Pre-trasplantation interferon treatmen and recurrence of hepatitis B virus infection after liver transplantation for hepatitis B-related endstage liver disease. Hepatology 1994; 19: 6-12. 4- Villenueve JP, Condreay LD, Willems B et al. Lamivudine tratment for descompensated cirrhosis resultin chronic hepatitis B. Hepatology 2000 , 31(1): 207-210. 5- Gigou M, Feray C, Roche B et al, Abstr, Liver Transplantation and Surgery 1999 supl, pag 31. 6- Perrillo R, Zif E, Yoshida E et al: Adefovir Dipivoxil for the traetament of lamivudine-resistetant hepatitis B mutants, Hepatology, July 2000, vol 31, Nº 1. 129-134 HEPATITIS VIRAL RECURRENTE TRAS TRASPLANTE ORTOTÓPICO HEPÁTICO Teresa Pereda, Francisco Gavilán, Lourdes Gómez, José M. Sousa. 1. INTRODUCCIÓN. La hepatitis viral, y fundamentalmente la causada por VHC, es una causa importante de enfermedad terminal hepática que conduce al trasplante ortotópico hepático (TOH). La infección puede recurrir en el injerto precozmente, incluso en el primer mes postrasplante, aunque típicamente lo hace de forma más tardía. Los virus B, C y D pueden producir en el injerto patrones morfológicos similares a los del hígado no trasplantado. Se presenta, en la mayoría de los casos, con necrosis hepatocitaria parcelar o individual, usualmemte acompañada de cierto grado de infiltrado linfocítico sinusoidal, portal o ambos. El solapamiento de hallazgos histológicos entre hepatitis viral y rechazo agudo del injerto puede dificultar la distinción entre ambos procesos, que incluso pueden ocurrir simultáneamente. Otro proceso a diferenciar de la hepatitis recurrente es la infección de novo del injerto. Ésta, evoluciona de forma más agresiva que la hepatitis en sujetos inmunocompetentes aunque presenta mejor pronóstico que la enfermedad recurrente, con una tasa de cronificación a los 2 años del 35% (frente al 5% descrito para pacientes inmunocompetentes). Revisamos los distintos patrones morfológicos de la recurrencia de enfermedad viral en el injerto en nuestro medio, así como la casuística de la que disponemos. 2. RECURRENCIA VHC 2.1. Historia natural del VHC en el injerto. La cirrosis por el virus de la hepatitis C (VHC) es una de las indicaciones más importantes de TOH. En nuestro Centro supone el 26% de las indicaciones de trasplante, de forma aislada, estando implicado el VHc en el 47% de los mismos, asociado a alcohol o a 104 carcinoma hepatocelular. La recurrencia de viremia VHC después del trasplante ocurre prácticamente en todos los pacientes trasplantados. De estos casos, existe evidencia histológica de hepatitis en el 50-60% de los injertos, entre 1 y 2 años después del trasplante y en más del 75% de los mismos, tras 4 años de seguimiento 1. Han sido descritos diferentes genotipos virales. El genotipo 1b es el que se asocia a enfermedad más agresiva con daño severo en el injerto 2. Existen publicaciones que correlacionan el daño histológico con el genotipo viral y carga viral 3. Este hecho no ha sido posteriormente contrastado en la literatura . La mayoría de los pacientes padecen una hepatitis leve, forma silente de larga evolución, con cambios inflamatorios mínimos al examen histopatológico. Entre el 35 y el 60% pueden desarrollar un cuadro de hepatitis crónica activa que puede evolucionar a cirrosis. Un número menor de pacientes desarrollan un cuadro de hepatitis colestásica, con disfunción grave del injerto y pérdida del mismo. Daño significativo del injerto se produce en el 20% de los casos 1. 2.2.Hallazgos histopatológicos. Histológicamente, la recurrencia de la enfermedad por VHC muestra cambios lobulillares en ausencia de hallazgos portales de rechazo agudo celular (endoteliolitis, infiltrado inflamatorio mixto y colangitis). Los típicos agregados linfoides de la hepatitis por VHC pueden no estar presentes en los estadios precoces de recurrencia y los linfocitos carecen de la morfología polimorfa reactiva del rechazo. Cambios en el epitelio biliar pueden observarse también en el injerto con recurrencia de VHC, lo que puede dificultar el diagnóstico diferencial con el rechazo agudo celular. Este último proceso contiene típicamente eosinófilos. (Tabla 1) Los cambios lobulillares varían desde una intensidad leve con cuerpos acidofílicos dispersos o infiltación sinusoidal por linfocitos hasta actividad lobulillar moderada o severa, característica de hepatitis aguda. (Figura 1) Actualizaciones en Trasplantes 2001. Figura 1 105 Hepatitis lobulillar recurrente por VHC. Hematoxilina-eosina Tabla 1 Rechazo Agudo H. Recidivante VHC Inflamación portal Universal Mayoría Linfocitos Activados Uniformes Agregados Ocasionales Frecuentes Escasos Prominentes Frecuentes Dispersos Lesión ductal Universal A veces Endotelialitis Usual Rara Esteatosis Ausente Frecuente, leve Necrosis parcelar Inusual Común Necrosis acidofílica Escasa Prominente Distorsión lobulillar Mínima A veces Leve Generalizada Necrosis parcelar Inusual Común Necrosis acidofílica Escasa Prominente Distorsión lobulillar Mínima A veces Inflamación lobulillar Leve Generalizada Necrosis "piecemeal" Ausente Variable Folículos Eosinófilos Inflamación lobulillar La enfermedad progresa con aumento de la inflamación lobulillar, necrosis con formación de puentes y necrosis confluente. Pueden verse hepatocitos hiperplásicos y reacción ductular de los mismos. Los conductos biliares pueden mostrar irregularidades en el revestimiento epitelial y existir diversos grados de proliferación ductular y colestasis. Se ha descrito asimismo una forma de hepatitis C colostásica fibrosante tras TOH. Los hallazgos histopatológicos son similares a los descritos para la forma típica de hepatitis colostásica fibrosante por VHB: balonización hepatocelular confluente y fibrosis periportal progresiva a cirrosis 4 .Existe además una variante colostásica de 106 hepatitis C recurrente con necrosis severa que carece de la fibrosis prominente descrita para la forma clásica 5. . Los casos de ictericia colostásica severa, generalmente, no entran dentro del espectro de hepatitis postrasplante. Su presencia debe inducir a descartar otras posibles causas de disfunción del injerto que pueden coexistir con VHC como rechazo crónico ductopénico, estenosis biliares extra e intrahepáticas y diversas medicaciones 6.. 2.3. Experiencia en nuestro Centro. De los pacientes trasplantados en nuestro Centro por cirrosis hepática por virus C, se produjo recidiva histológica de enfermedad viral en el 52% de los casos. Los hallazgos histopatológicos se distribuyeron de la siguiente forma, resultados que concuerdan con otras series publicadas en nuestro medio (R. Esteban): -Lesiones mínimas en un 18% de los casos. -Hepatitis lobulillar en un 54%. -Hepatitis crónica activa en un 9%. -Hepatitis colostásica fibrosante en un 9%. No se han presentado casos de infección de novo por VHC en nuestra casuística. 3. RECURRENCIA POR VHB. 3.1. Historia natural del VHB en el injerto. Actualizaciones en Trasplantes 2001. La infección recurrente por VHB es común, con un porcentaje de recidiva de la infección postrasplante del 50%, con un nivel medio de recurrencias cifrado en torno al 80%. Los pacientes con enfermedad crónica por VHB preexistente, especialmemte cirrosis, son los de mayor riesgo de reinfección. Los pacientes con infección crónica por HDV tienen menos riesgo de recurrencia postrasplante que los infectados únicamente porV HB 7. 107 La fuente de infección del injerto por VHB en receptores HbsAg+ es probable que corresponda a virus secuestrado en reservorios extrahepáticos. (linfocitos,bazo,páncreas, gónadas, tiroides, suprarrenales y riñones) 8,9. Aunque aproximadamente el 6% de los injertos infectados permanecen en un estado de portador, la mayoría de los pacientes desarrollan enfermedad activa hepática 10. La evolución del injerto hepático con infección por VHB es variable desde la expresión precoz de antígeno HB a manifestaciones histológicas de hepatitis B recurrente. Estas pueden corresponder a mínimas anormalidades, hepatitis aguda, hepatitis crónica y cirrosis, necrosis hepática masiva y la hepatitis colestásica fibrosante, una entidad propia de injertos hepáticos de evolución fatal. 3.2. Hallazgos histopatológicos. Se describe hepatitis morfológica del injerto infectado en el 65 al 100% de los casos , según los datos revisados. El estado de portador crónico puede evidenciar la típica apariencia de los hepatocitos en «vidrio esmerilado» sin inflamación aparente. La hepatitis aguda se manifiesta por moderada desestructuración lobulillar e hinchazón hepatocitaria, tractos portales normales o con inflamación leve, escasas células inflamatorias en el lobulillo y escaso número de hepatocitos apoptóticos (cuerpos de Councilman). Difiere de la hepatitis del órgano no trasplantado en que presenta menor inflamación y a menudo, cambios degenerativos hepatocitarios aumentados con expresión intensa de antígenos virales. Historia de las Sesiones Clínicas de los Grupos de Trasplantes... La prevalencia de infección de novo por VHB del injerto, es del 35% según algunas series. La fuente de la infección pueden ser donantes o receptores anti HBc positivo o antiHbc y antiHBs positivos11. La hepatitis crónica es la forma histológica de lesión por VHB postrasplante que se describe con mayor frecuencia, con una mayor prevalencia y curso morfológico más rápido que en pacientes no trasplantados 9. Se caracteriza por la aparición de necrosis en puentes y destrucción de hepatocitos, predominantemente periportal. Estos casos pueden evolucionar a cirrosis. Los estudios de inmunoperoxidasa muestran en el injerto infectado y con hepatits progresiva, una abundante expresión de AgHbs que coexiste con una tinción también difusa e intensa para AgHbc, al contrario de lo que ocurre en el hígado no trasplantado. En este último, existe una relación inversamente proporcional entre la cantidad de AgHbs y la de AgHbc 9,12 Figura 2 Tinción inmunohistoquímica antígenos AgHBc y AgHBs. 108 Una forma peculiar de hepatitis crónica tan sólo descrita en injertos hepáticos es la hepatitis colostásica fibrosante 13,,14. Clínicamente produce disfunción hepática , progresiva de evolución fatal. Se caracteriza por una fibrosis difusa intensa periportal, acompañada de abundante pigmento biliar, extensa pérdida de hepatocitos y notable proliferación de ductulillos (Figura 3). Se detecta marcada tinción hepatocitaria, nuclear y citoplásmica para HbcAg y tinción difusa citoplásmica o de membrana para HbsAg. Es característico de esta entidad una marcada expresión de HbeAg, tanto en el núcleo como en citoplasma hepáticos. Figura 3 Hepatitis colestásica fibrosante por VHB. Reticulina Actualizaciones en Trasplantes 2001. En general, existen diferencias entre la infección por VHB del hígado trasplantado y el no trasplantado, debido a la inmunosupresión y a la exposición más directa de los hepatocitos sanos al VHB, como son: una mayor prevalencia de hepatitis crónica, un curso morfológico mucho más rápido, el posible desarrollo de una forma de hepatitis B exclusiva del hígado trasplantado denominada hepatitis colostásica fibrosante, una falta de correlación morfológica entre necrosis hepatocelular e infiltrado inflamatorio interhepatocitario y una relación directamente proporcional entre cantidad de antígenos virales intracelulares y la severidad de la lesión hepatítica. 109 3.3.Experiencia en nuestro Centro. La cirrosis por VHB supone en nuestro Centro el 125% de las indicaciones de trasplante, con un total de 35 pacientes trasplantados hasta el momento por esta etiología. De estos casos, se ha producido recurrencia histológica de la enfermedad en 5 pacientes (142%), con el siguiente patrón morfológico: -Lesiones inflamatorias mínimas: 2 casos. -Recurrencia en fase cirrótica: 2 casos. Se ha presentado infección de novo del injerto por VHB en 4 pacientes, lo que supone un 16% del total de trasplantados. REFERENCIAS 1.- Dickson RC, Caldwell SH, Ishitani MB, Lau JYN, Driscoll CJ, Stevenson WC, McCullough CS, Pruett TL. Clinical and histologic patterns of early graft failure due to recurrent hepatitis C in four patients after liver transplantation. Transplantation 1996; 61: 701-705. 2.- Gane EJ, Portman BC, Naoumov N, Smith HS, Underhill JA; Donaldson PT, Maertens G , ,Williams R. Long-term outcome of hepatitis C infection after liver transplantation. New England Journal of Medicine 1996; 334:815-820. 3.- Di martino V, Saurini F, Samuel D, Gigou M, Dussaix E, Reynes M, Bismuth H, Feray C. Long-term longitudinal study of intrahepatic C virus replication after liver transplantation .Hepatology 1997; 26:1343-1350. 4- Schluger LK, Sheiner PA, Thung Sn, Lau JY, Min A, Wolf D, Fiel I, Zhang D, Gerber M, Miller Ch M, Bodenheimer HC. Severe recurrent cholestatic hepatitis C following orthotopic liver transplantation. Hepatology 1996; 23;971-976. 5- Santa Cruz DJ.Interpretation of biopsy findings in the trasplant liver. Seminars in Diagnstic Pathology 1998;15:306317. 6- Shiffman ML, Contos MJ, Luketic VA, Sanyal AJ, Purdum III PP, Mills AS, Fischer RA, Posner MP. Biochemical and histologic evaluation of recurrent hepatitis C following orthotopic liver transplantation. Transplantation 1994; 57: 526-532. 7- Terrault NA. Hepatitis B virus and liver transplantation. Clinics in liver disease. 1999; 3: 389-414. 8- Walker N, Aoel R, Kerlin P, Horn M, Tinniswood R, Lynch S, Strong R. Hepatitis B virus infection in liver allografts. American Journal of Surgical Pathology 1993; 17: 666-677. 9- Alberti N, Marchal T, Ballestín C, Colina F. Trasplante hepático en pacientes infectados por el virus de la hepatitis B. Aportaciones de la histopatología e inmunopatología. Gastroenterología y hepatología 1994; 17: 485-490. 10- Cummings OW. Disease recurrence after ortothopic liver transplantation. Seminars in Diagnostic Pathology 1993;10:292-301. 11- Roche B, Samuel D, Gigou M, Feray C, Virot V, Schmets L, David MF, Arulnaden JL, Bismuth A, Reynes M, Bismuth H. De novo and apparent de novo hepatitis B virus infection after liver transplantation. Journal of hepatology 1997; 26:517-26. 12- Phillips MJ, Cameron R, Flowers MA, Blendis LM, Greig PD, Wanless I, Sherman M, Superina R, Langer B, Levy GA.Post-trasplant recurrent hepatitis B viral liver disease.Viral-burden, steatoviral, and fibroviral hepatits B. American Journal of Pathology.1992;140:1295-1308. 13- Davies SE, Portmann BC, O Grady JG, Aldis PM, Chaggar K, Alexander GJ, Williams R. Hepatic histological findings after transplantation for chronic hepatitis B virus infection , including a unique pattern of fibrosing cholestatic hepatitis. Hepatology 1991; 13:150-157. 14- Harrison RF, Davies MH, Goldin RD, Hubscher SG. Recurrent hepatitis B in liver allografts: a distinctive form of rapidly developing cirrhosis. Histopathology 1993; 23:21-28. Historia de las Sesiones Clínicas de los Grupos de Trasplantes... -Hepatitis colostásica fibrosante: 1 caso (evolución fatal) 110 HEPATOCARCINOMA Y TRASPLANTE HEPATICO C. Díaz- Aunión , J. Serrano , M.A. Gómez, I. García, F. Pareja, M. J. Tamayo, J. Pérez-Bernal, R. Hinojosa, J. M. Sousa, E. Cañas, A. Bernardos. Unidad de Trasplante Hepático. El carcinoma hepatocelular es una de las enfermedades malignas más frecuentes del mundo, presentando amplias variaciones geográficas en su incidencia. España se considera de incidencia intermedia con 6-8 casos por 100.000 habitantes y año. La resección quirúrgica es el tratamiento de elección en el hepatocarcinoma , sin embargo, solo un 15-30 % de todos los tumores podrán ser resecados , según la localización del tumor y la reserva funcional hepática. Se indica resección hepática en pacientes portadores de hepatocarcinoma sobre hígado sano ( T1,T2 y T3 , No, Mo y resección anatómicamente posible) y en pacientes cirróticos con excelente función hepática ( Child A) , sin hipertensión portal , con nódulo pequeño ,único y resecable. Actualizaciones en Trasplantes 2001. El trasplante hepático es el tratamiento de elección en presencia de cirrosis hepática con función hepática alterada (Child B o C) . Pacientes con un único nódulo menor de 5 cm o con múltiples nódulos ( máximo 3 nódulos de menos de 3cm) , sin invasión vascular o diseminación extrahepática. 111 En el paciente cirrótico la recurrencia tumoral después de la resección del tumor es alta , de un 70-100% , siendo la supervivencia a largo plazo de un 15 a un 40 % . Esto quizás puede explicarse porque el hígado cirrótico es una situación preneoplásica y por la producción de factores de crecimiento secundarios a la regeneración hepática tras la resección. Por ello la tendencia actual es indicar el trasplante hepático en el hepatocarcinoma incluso en los pacientes cirróticos con buena función hepática ya que proporciona resultados de supervivencia mejores que la resección. Como problemas añadidos al trasplante hepático se achacan el número limitado de donantes , el tiempo en espera de donanción, la mortalidad perioperatoria del 10 % y la recurrencia del tumor por la inmunosupresión. Fundamentalmente es la escasez de donantes lo que en cierta medida limita la indicación de trasplante hepático en el hepatocarcinoma. Presentamos nuestra serie que consta de 17 pacientes cirróticos con hepatocarcinoma trasplantados entre 1992 y 1999 , de un total de 264 pacientes trasplantados hepáticos. Se han excluido aquellos pacientes con tumores incidentales y aquellos con supervivencia menor a un mes postrasplante. Entre los estudios pretrasplante para descartar metástasis a distancia se les realizaron : TAC toraco-abdominal, gammagrafia osea y quimioembolización arterial. De los 17 pacientes 15 eran varones y 2 eran mujeres con una edad media de 53.2 años. Según la clasificación de Child en estadio A se encontraban 4 pacientes ( 23.5%) , B 10 pacientes ( 58.8%) y C 3 ( 17.6%). Asociados en 5 casos al virus B de la hepatitis y en 8 al virus C. Según la clasificación pTNM : T1 4 ( 23.5%) , T2 7 (41.1%),T3 2 (11.7%) y T4 4 (23.5%). Todos No y Mo. Los resultados que hemos obtenido han sido : 4 pacientes fallecidos . Dos de ellos por recurrencia del hepatocarcinoma y dos por recurrencia de la enfermedad de base ( uno por cirrosis virus B y otro por cirrosis virus C). En más de dos años de seguimiento medio solo han recidivado 4 pacientes (dos comentamos que habían fallecido). Las recidivas fueron a los 7 meses ( torácica) , a los 10 meses ( en el trayecto de la PAAF) , a los 10 meses en el hígado receptor y a los 17 meses ( osea). Con estos datos la supervivencia actuarial según el método de Kaplan Meier , con un seguimiento medio de 28.2 meses , es del 80 % al año y del 70% a los 3 y 5 años. La supervivencia libre de enfermedad es del 77% al año y del 67% a los 3 y 5 años. Se han analizado la influencia de diferentes factores que podrían afectar a la recurrencia tumoral y a la supervivencia. Con respecto a la presencia de cápsula hemos encontrado un 80 % de supervivencia a los 4 años en los tumores capsulados frente al 40% de los no capsulados. Supervivencia libre de enfermedad a los 5 años del 80% sin invasión vascular y del 40 % con invasión vascular. No hemos encontrado recidiva en tumores menores de 3 cm (7 pacientes). Supervivencia a los 5 años del 100% frente a 40% de tumores mayores de 3 cm. Desglosando el tamaño : entre 1 y 2 cm supervivencia del 100%, entre 2 y 4 cm del 70% y del 40% en mayores de 4 cm. La recurrencia acumulada a los 5 años es del 33%. Un dato curioso es la posible relación entre hepatocarcinoma y recidiva de cirrosis por virus de la hepatitis B . Todos los pacientes en los que han recidivado de la serie total eran aquellos en los que se asociaba virus B y hepatocarcinoma. En definitiva , el trasplante hepático es una buena opción en el tratamiento del hepatocarcinoma y presenta resultados superponibles al trasplante hepático en pacientes cirróticos sin tumor. 112 BIBLIOGRAFÍA Actualizaciones en Trasplantes 2001. 1.- Liver Transplantation for hepatocellular carcinoma? . Von Thiel DH,Calantoni A, De Maria N. Hepatogastroenterology 1998 Nov-Dec; 45 (24):1944-9 2.- Resection versus transplantation for hepatocellular carcinoma. Esquivel CO, Keeffee EB, García G, Imperal JC, Millan MT, Monge H, So SK. J Gastroenterol Hepatol 1999 May; 14 Suppl: S37-41 3.- An active live transplant program for hepatocellular carcinoma cirrhotic patients: is it justified ? . Chui AK, Rao AR, McCaugham GW, Waugh R, Verran DJ , Koorey D, Painter D,Sheil AG. Clin Transplant 1999 Dec; 13 (6): 531-5 4.- Intention to treat analysis of surgical treatment for early hepatocellular carcinoma; resection versus transplantation. Llovet JM, Fuster J, Bruix J. Hepatology 1999 Dec; 30 (6): 1434-40. 113 TRASTORNOS INTRAOPERATORIO DE LA COAGULACIÓN EN EL TRASPLANTE HEPÁTICO J.L López Romero, A. Gutierrez Crespo, M. Pérez Torres. Servicio de Anestesia. Unidad de Trasplantes. Durante la realización del Trasplante Hepático se presentan graves trastornos de la coagulación que llegan a ensombrecer el pronóstico. Las alteraciones observadas podemos clasificarlas en dos tipos: 1.- Alteraciones de la coagulación que ya presenta nuestro paciente y que se correlacionan con su grado de disfunción hepática. En los pacientes con hepatopatía terminal es frecuente observar una anemia microcítica debido al elevado vol. de distribución y las pérdidas GI por sangrado de varices esofágicas y ulcus péptico. También podemos encontrar anemia megaloblástica por malabsorción debido a déficit de vit. B12 y ácido fólico, especialmente en cirrosis alcohólica. La leucopenia y trombocitopenia habitualmente se asocian con el hiperesplenismo y la depresión de la médula osea inducida por el etanol. Los pacientes con obstrucción del árbol biliar o con escasa producción de bilis desarrollan un déficit de los factores de la coagulación dependientes de la vit. K (II, VII, IX, X ). La mayoría de los pacientes con cirrosis hepática presentan anomalías de la coagulación. Los factores sintetizados en el higado se encuentran disminuidos por este orden VII, V, X, y II ( Protrombina ). El factor I (fibrinógeno ) suele estar disminuido por un aumento en su consumo, apreciándose un fibrinógeno estructuralmente anormal. Esta situación de fibrinolisis suele darse en la cirrosis del adulto y parece ser secundaria a una disminución de la antiplasmina y un menor aclaramiento del activador del plasminógeno tisular ( t-PA). Por el contrario en el niño lo que predomina es el déficit de antitrombina III lo que supone una situación de activación de la coagulación. El factor VIII que no depende del hígado para su síntesis, puede estar incrementado en estos pacientes. Los estudios de coagulación reflejan el déficit de los factores de coagulación en distintas circunstancias. Sin embargo no se ha encontrado una relación clara y definitiva entre la 114 gravedad de las coagulopatías y los requerimiento transfusionales durante la cirugía. Los protocolos de reposición de hemoderivados preoperatorios no han tenido ningún efecto beneficioso demostrable. 2.- Alteraciones de la coagulación que surgen durante el TOH. Al comienzo de la hepatectomía, el estado de la coagulación refleja la situación preoperatoria. Avanzada la fase, las causas de las pérdidas hemáticas son, esencialmente anatómicas como: dilataciones y colaterales venosas, anatomía poco definida, cirugía previa e hipertensión portal, entre otras. La coagulopatía que se manifiesta durante la fase anhepática se explica, tanto por la pérdida de capacidad de síntesis, como de aclaramiento hepático. El consumo de factores de la coagulación y de plaquetas puede multiplicar el problema. La aparición de signos de CID, hiperfibrinolisis, o una combinación de ambos, no resulta infrecuente en este periodo. La fase neohepática se caracteriza por el súbito deterioro de la coagulación en general y el incremento de la fibrinolisis en particular; algo ya vislumbrado en la fase anhepática y que se hace explosivo con la reperfusión del injerto. Posteriormente, la calidad de este determinará la intensidad y la duración de las perturbaciones que, además, son muy variables de un trasplante a otro. En consecuencia, advertimos que, junto a la coagulopatía preexistente, surgen otros factores que van a modificar intensamente el perfil de la hemostasia a lo largo de la intervención. Estos factores son, fundamentalmente dos: la transfusión masiva y el incremento de la actividad fibrinolítica. FISIOPATOLOGÍA DE LA FIBRINOLISIS. Actualizaciones en Trasplantes 2001. Diferentes estudios han demostrado el incremento de la actividad fibrinolítica durante el TOH, evaluada mediante el TLE (acortamiento del tiempo de lisis de euglobulina) y el TEG ( Tromboelastografía.). La actividad fibrinolítica va en aumento durante la fase anhepática y alcanza su nivel máximo con la reperfusión. Se cree que en su génesis están involucrados diversos factores, tales como : 115 - Liberación de activadores del plasminógeno tisular. ( t-PA ). - Disminución del aclaramiento hepático de la plasmina. - Descenso de los niveles plasmáticos del plasminógeno y alfa-2-antiplasmina. - Activación de la proteina C. La hiperfibrinolisis primaria podría ser el resultado de la alteración del equilibrio entre activadores e inhibidores, por lo que goza de amplia aceptación la teoría de una fibrinolisis activada a través de la liberación de t-PA desde el endotelio vascular agredido por la cirugía y la isquemia, junto con la destrucción del inhibidor del activador del plasminógeno (PAI) por la proteina C activada. En consecuencia una vez consumida la antiplasmina, quedaría plasmina libre circulando en cantidades suficientes para anular a los factores susceptibles (I, V, VIII), que descienden de forma desproporcionada con respecto a los demás. Queda patente pués, el papel clave que representa el t-PA producido en las células del endotelio vascular. En efecto, en los pacientes con fibrinolisis severa, se observa un marcado incremento de la actividad del t-PA y el descenso concomitante del PAI durante la fase anhepática y al inicio de la reperfusión, como muestran el TLE y TEG. La reducción de la actividad del PAI se explica por la formación de complejos con el t-PA, por lo que, después de saturar todo el PAI libre, habrá un notable incremento del t-PA en la circulación. Se han sugerido dos mecanismos diferentes como responsables de la elevación del t-PA durante el TOH. El aumento inicial en la fase anhepática, se explica por la acentuada producción y la reducción del aclaramiento hepático. El segundo mecanismo se manifiesta por el incremento explosivo del t-PA tras la reperfusión del injerto, y estaría mediado por diferentes factores como sustancias vasoactivas, oclusión venosa, anoxia y trombina, entre otras. La importancia del daño del injerto durante su conservación es capital durante este proceso. Por una parte, el injerto trasplantado y dañado por la isquemia es una fuente de t-PA; por atra parte, el retraso en el restablecimeinto de su función de aclaramiento hepático contribuye a prolongar la fibrinolisis. En la actualidad, la CID no parece ocupar un lugar determinante en la coagulopatía del TOH. A lo largo de la intervención se observa un descenso significativo del recuento plaquetario, que se acentúa tras la reperfusión y puede persistir los 3 o 5 primeros días del postoperatorio, pero actualmente el papel exacto de la disfunción plaquetaria durante el TOH está aún por dilucidar. MANEJO INTRAOPERATORIO DE LAS COAGULOPATÍAS. MONITORIZACIÓN Se basa en dos pilares fundamentales: una monitorización amplia y rápida, junto con un tratamiento agresivo y eficaz. Los métodos de monitorización pueden ser cuantitativos: que son las pruebas habituales, tales como: TP, TPTA, TT, TLE, T de reptilase, PDF, fibrina y antitrombina III, junto con recuento de plaquetas y hematocrito. Se considera que un TLE < 60 min. define la fibrinolisis severa. Los factores II, VII, IX, X y XII descienden discretamente durante la fase anhepática, alcanzan un valor más bajo al inicio de la reperfusión, y retornan a niveles basales al final de procedimiento. Por el contrario, los factores, I, V y VIII inician una disminución acusada y precoz, que se acentúa en la reperfusión y sólo se recupera parcialmente al concluir la cirugía. Los inconvenientes de los métodos cuantitativos son: a) son exámenes simplemente cuantitativos, que no valoran los efectos de distintos elementos celulares y humorales; b) no miden la calidad de los factores; y c) está por determinar el valor crítico del TP, TPTA y las plaquetas. El método cualitativo es el TEG, que estudia la elasticidad del coágulo. No está dispo116 nible en nuestro centro. TRATAMIENTO a) Transfusión de Hemoderivados: Los criterios intraoperatorios que definan la transfusión de hemoderivados no están determinados actualmente, aunque la transfusión masiva es usual en el TOH. Generalmente se emplean concentrados de hematíes para mantener un hematocrito en torno al 30%, plasma fresco para conseguir una tasa de protombina próxima al 50%, y crioprecipitados cuando el nivel de fibrinógeno es < 1,5 g/dl, y plaquetas cuando el nº desciende de 50.000 / microlitro. b)Tratamiento farmacológico: El incremento de la actividad del t-PA se asocia con la destrucción proteolítica del fibrinógeno y fibrina, junto con pérdidas sanguíneas elevadas, de forma que está justificado recurrir a fármacos antifibrinolíticos cuando la fibrinolisis adquiere una magnitud considerable. No existe, todavía, criterio homogéneo que sirva para indicar el momento de iniciar estos ttos. Los fármacos antifibrinolíticos de que disponemos son: - Acido epsilon- aminocaproico (AEAC) y Ac. Tranexámico. Estos son antifibrinolíticos sintéticos que antagonizan al plasminógeno e inhiben el efecto de la plasmina sobre la fibrina. Se diferencian en que la acción del segundo es más potente y duradera. - Aprotinina. Inhibe un amplio espectro de proteinas como la tripsina, plasmina y calicreinas, aunque su principal efecto en el TOH, es inhibir el t-PA. Se han propuesto diversas pautas de administración, pero no hay diferencias entre ellas en el ahorro de hemoderivados. Por último, no existe ningún estudio sólido que compare conjuntamente la eficacia de AEAC, ac. Tranexámico y aprotinina. En nuestro centro el antifibrinolítico utilizado es la aprotinina, en pacientes que presenten cirugía abdominal previa que nos haga sospechar una disección muy sangrante o ante la aparición de sangrado en sábana en un campo quirúrgico previamente seco. Actualizaciones en Trasplantes 2001. En definitiva, se recomienda el tratamiento farmacológico de la hiperfibrinolisis, por las siguientes razones: a) reduce el consumo de hemoderivados y acorta el tiempo de hemostasia quirúrgica; b) disminuyen las complicaciones asociadas a la politransfusión. 117 Bibliografía. 1.- Acosta F, Sansano T, Reche M. Anestesia en el trasplante hepático. 1999 ; 24 : 175 183. 2.- García L, Sabaté A, Doménech P et al. Aprotinin in orthotopic liver trasplantation. Trasplant Proc 1995; 27 : 2290 2291. 3.- Pérez-Cerdá F, Del Campo I, Cortés M et al. Consideraciones anestésicas en el trasplante hepático. Presente y futuro del trasplante de órganos abdominales. 1997; 67 78. 4.- Kang Y, Aggarwal S, Virji M et al. Clinical evaluation of autotransfusión during liver transplantation. Anesth Analg 1991 ; 72 : 94 100. 5.- Porte R, Knot E, Bontempo F. Hemostasis in liver transplantation. Gastroenterology 1989 ; 9 : 488 501. 6.- Lewis J, Bontempo F. Liver transplantation : intraoperative changes in coagulation factors in 100 first transplan. Hepatology 1989 ; 9 : 710 714. 7.- Kang Y. Clinical use of syntethic antifibrinolytic agents during liver transplantation. Semin Thron Hemost 1993 ; 19 : 258 261. POSTOPERATORIO INMEDIATO DEL PACIENTE TRASPLANTADO DE HÍGADO R. Hinojosa Pérez; J.B Pérez Bernal; A. Herruzo; C. Colón; E. Cañas; J.M. Sousa; M. Sayago; J. Serrano; F. Gavilán; M.A. Gómez; A. Bernardos. Unidad de Trasplantes de Cuidados Intensivos. Unidad de Trasplante Hepático. Cuando iniciamos nuestra andadura hace 10 años, el trasplante hepático era una autentica prueba de esfuerzo para el enfermo y al intensivista que le tocaba. Hoy, a pesar de que se ha mejorado sustancialmente en su manejo integral, mantiene aún dos connotaciones: - La hora de ingreso en la Unidad sigue siendo intempestiva. - El postoperatorio no está exento de complicaciones más o menos graves que dependen de una serie de factores que controlan y regulan la marcha del curso inmediato tras la intervención: - Estado preoperatorio del receptor - La presencia de eventos intraoperatorios - Función inicial del injerto. Factor más importante, que define y singulariza esta patología. Tras la intervención: Al llegar el enfermo a la Unidad de Cuidados Intensivos, viene intubado y conectado al respirador, y de inmediato valoramos frecuencia cardiaca, tensión arterial, parámetros de oxigenación y ventilación. Y a continuación, observamos el débito y las características de los drenajes abdominales (dos colocados en espacios subfrénicos derecho e izquierdo, uno a nivel subhepático y un tubo en T si se ha realizado una anastomosis biliar colecoledociana término-terminal). Vigilamos la diuresis y realizamos una rápida valoración neurológica, fundamentalmente, en pacientes con fallo hepático agudo que fueron al quirófano en situación de edema cerebral y coma. Una vez examinado el enfermo, nos planteamos una serie de objetivos terapéuticos a corto plazo: 118 - Debemos obtener una estabilidad hemodinámica mediante fluidos (cristaloides y coloides sintéticos) y drogas vasoactivas - Control respiratorio y prevención de complicaciones - Corregimos alteraciones metabólicas e hidroelectrolíticas - Procedemos sedación y analgesia - Profilaxis de infecciones. - Administramos soporte nutricional adecuado; especialmente, en aquellos pacientes con malnutrición previa o presentan un perfil hipermetabólico (18 20% de los cirróticos) o tienen un curso postoperatorio tórpido. - Prevenimos la aparición de úlceras pépticas gastroduodenales - Profilaxis antitrombótica - Valoramos y vigilamos la función del injerto. Que se inicia en el quirófano tras la fase de reperfusión (el aspecto del órgano sugiere la calidad del injerto, siendo deseable que el hígado sea blando y elástico y con reperfusión homogénea con respecto a otro con consistencia dura y edematoso y con reperfusión irregular). En el postoperatorio lo vamos a evaluar a través de signos clínicos (despertar de la anestesia, estabilidad hemodinámica, temperatura corporal) y con parámetros complementarios que nos expresan la función sintética del injerto (Tiempo de Protrombina alargado e hipoglucemia) o mediante la función excretora (cantidad y aspecto de la bilis). Nunca debemos valorar la función del injerto, exclusivamente, a través de los niveles plasmáticos de transaminasas que son parámetros que indican daño celular, y menos, aún tratarlos. Actualizaciones en Trasplantes 2001. Durante su estancia en la Unidad de Trasplantes de Cuidados Intensivos ( siete a ocho días), al paciente estereotipo se le realizan una sucesión de medidas establecidas de forma rutinaria: 119 - Retirada precoz de la ventilación mecánica (menos de 24 horas) - Cambio de catéteres venosos y retirada del cateter arterial en las primeras 24 horas de estancia en UCI. - Iniciamos dieta oral a las 36 48 horas - Incorporamos y sentamos al paciente a las 48 72 horas - Retiramos los drenajes subfrénicos en 48 72 horas, previa administración de analgésicos ( 0,05 a 0,1 microgramos de Fentanilo i.v) - Retiramos la sonda urinaria al 4º - 5º día - Dejamos el drenaje subhepático hasta el 6º - 7º día ( 24 horas después de realizar la colangiografía y pinzar el tubo de kehr) - Cuidados habituales de la herida quirúrgica, procurando no levantar los apósitos si no están manchados. Todos los días se extraen analíticas de rigor (bioquímica general, perfil hepático y hemograma con estudio de coagulación). se efectúa radiología de tórax y una estrecha vigilancia microbiológica. Se practica seguimiento con ecodoppler ante cualquier hallazgo anormal de la analítica hepática o evento referido por el cirujano en la intervención (dificultad en las anastomosis vasculares) Los niveles de ciclosporina o tacrolimus son extraídos a diarios aunque la determinación suele ser tres veces por semana. Y finalmente, hacemos un estudio con contraste de la vía biliar (Colangiografía) a través del tubo de kehr al 5º - 6º día. Tras descartar la presencia de obstrucción y fuga, se pinza el tubo en T y al día siguiente se retira el drenaje subhepático que nos sirve de testigo para diagnosticar la aparición de vertido biliar. Como hemos dicho al principio, a pesar de los buenos resultados en sobrevivencia, el postoperatorio del trasplante hepático no está exento de complicaciones y con frecuencia son múltiples y de diversa índole: 1) Respiratorias: La mayor parte de los pacientes van a presentar atelectasias laminares bibasales o derrame pleural derecho que en pocas ocasiones van a requerir drenaje por su escasa repercusión clínica. La aparición de lesión pulmonar aguda o distress respiratorio tiene un valor pronóstico ominoso porque en ocasiones es signo de disfunción grave del injerto o sepsis en el contexto de un fracaso multiorgánico severo. Fig. 1. Figura 1 Menos habitual, es la presencia de neumotórax, relacionado a la ventilación mecánica o por la canalización de vías venosas. 120 2) Cardiovasculares: La bradicardia sinusal es la alteración del ritmo más frecuente pero tiene escasa significación clínica. La mayoría de los trastornos del ritmo son debido a alteraciones hidroelectrolíticas ( hipokaliemia, hipomagnesemia, etc...) Es usual la aparición de hipertensión arterial (80%) en la que debemos descartar de entrada la presencia de dolor, ansiedad, hipovolemia o hipoventilación como factores inductores de la misma. Suele estar ligada al efecto nefrotóxico producida por inmunosupresores del tipo inhibidores de la calcineurina (ciclosporina o tacrolimus) por lo se recomienda para su manejo dieta hiposódica y antagonistas del calcio (dihidropiridinas). 3) Complicaciones abdominales. Son frecuentes y variadas (íleo adinámico, diarreas o estreñimiento) - Hemorragia Postoperatoria: Se observa en el 7 15% de los pacientes en las primeras 48 horas de evolución. Fig. 2. En bastantes ocasiones condiciona una alta morbimortalidad (politransfusión y reintervención quirúrgica) A menudo, no se identifica un punto sangrante concreto por lo que siempre debemos descartar y corregir la presencia de coagulopatía. El diagnóstico se realiza habitualmente al observar el débito de los drenajes abdominales, por la presencia de inestabilidad hemodinámica, por incremento del perímetro abdominal y por la determinación seriada de hemoglobina y hematocrito del contenido de los drenajes, comparándolo con los valores obtenidos en sangre. Actualizaciones en Trasplantes 2001. Figura 2 121 - Sangrado Gastrointestinal. Es otra causa de morbilidad frecuente en el postoperatorio inmediato. Las causa más corrientes son el úlcus péptico, enteritis virásicas, lesiones hipertensivas portales y hemorragias por anastomosis bilioentérica con Y de Roux. 4) Disfunción Renal. Casi todos los enfermos cursan con algún grado de disfunción renal en el postoperatorio y suele manifestarse con oligoanuria transitoria que se resuelve en dos o tres días. A ello, contribuye de forma primordial el empleo de inmunosupresores (ciclosporina y tacrolimus). Si al efecto nefrotóxico de las mismas, unimos la existencia de insuficiencia renal preoperatoria (síndrome hepatorrenal), sangrado e hipotensión per y postoperatoria, junto a la aparición de disfunción del injerto y la administración de otras drogas nefrotóxicas (antibióticos), condiciona una disfunción renal más grave que no va a responder a las medidas habituales (reposición de volemia, dopamina a bajas dosis o diuréticos), requiriendo el uso de terapias de reemplazo renal (intermitente o continúa). No olvidemos que la presencia de fracaso renal agudo (necrosis tubular) que demanda hemodiálisis tiene un enorme impacto pronóstico vital. 5) Alteraciones Metabólicas. La cirrosis hepática se asocia frecuentemente a deterioro del metabolismo de la glucosa, existiendo una situación prediabética en el 10 30% de los sujetos por un mecanismo de resistencia periférica a la acción de la insulina; a ello, debemos agregar que entre un 10 30% de los pacientes trasplantados desarrollan diabetes de novo por el stress quirúrgico, uso de esteroides o inhibidores de la calcineurina, todo esto contribuye a que la hiperglucemia sea el trastorno metabólico más frecuente en el postoperatorio inmediato del trasplante hepático. La aparición de hiperkaliemia o acidosis metabólica grave, frecuentemente se deben a shock, fracaso renal o disfunción del injerto 6) Complicaciones Neurológicas. Ocurre en el 12 20% de los pacientes, y la mayor parte de ellas, se manifiestan en la primera semana del postoperatorio. Las más frecuentes son: - Ansiedad y depresión - Cefaleas - Temblor - Agitación psicomotriz - Convulsiones - Encefalopatía multifactorial - Neuropatías periféricas por compresión Muy a menudo, están asociadas a efectos indeseables de diversos fármacos empleados rutinariamente (antibióticos, inmunosupresores y antivirásicos). 7) Complicaciones Hematológicas. Destacamos la trombocitopenia por la existencia de hiperesplenismo previo y el efecto de hemodilución y consumo en el postoperatorio inmediato, junto al efecto mielotóxico de algunas drogas (azatioprina o mofetil micofenolato). Se recomienda transfundir plaquetas cuando los niveles 122 en sangre son menores de 20,000 / mm3, o cuando es inferior a 50.000 / mm3 y necesitamos realizar un procedimiento invasivo. Debemos tener cuidado con los pacientes con plaquetopenia grave e hipertensión arterial porque son proclives a desarrollar hemorragias cerebrales espontáneas. Fig 3. 8) Disfunción Primaria del Injerto. Es una complicación dramática porque es una de las principales causa de pérdida del órgano y de mortalidad en el postoperatorio inmediato. Es el fallo funcional del órgano implantado y se caracteriza en los casos graves de escasa producción y excreción de bilis, ictericia progresiva, marcada elevación de los niveles sanguíneos de transaminasas, encefalopatía, coagulopatía grave, fracaso renal y considerables trastornos metabólicos que condiciona el desarrollo de fracaso multiorgánico. Incidencia: 2 - 10% Factores Predisponentes: a) Factores Intrínsecos: Grado de esteatosis o el deterioro producido en el donante por alteraciones hemodinámicas o por administración de drogas vasoactivas. Fig 4. b) Contribuye una amplia variedad de insultos durante el acto quirúrgico y en el postoperatorio inmediato (Hipotensión arterial, tiempo de isquemia fría prolongado, hipoxia, isquemia caliente o efecto de drogas hepatotóxicas). Histología: Caracterizada por necrosis centrolobulillar isquémico hemorrágica confluyente con microesteatosis Actualizaciones en Trasplantes 2001. Tratamiento: Medidas de soporte vital y plantear retrasplante en situaciones de No Función del Injerto. 123 9) Rechazo celular agudo. El 40 60% de los receptores de trasplante hepático sufren una o más reacciones inflamatorias que afectan a los conductos biliares interlobulares y endotelio vascular. Usualmente, aparece entre el 5º y el 14º día de evolución y se diagnostica por el cambio de aspecto de la bilis drenada por el tubo de kehr (fluida y anaranjada) junto al desarrollo de un progresivo patrón de colostasis. Y lo vamos a confirmar en la mayor parte de las ocasiones, mediante la realización de una biopsia hepática percutánea. Dependiendo de la intensidad del infiltrado inflamatorio y daño endotelial el rechazo celular se gradúa según la clasificación de Snover en varios niveles de gravedad, y ateniéndonos a ellos, realizamos diferentes tipos de tratamiento de rescate. Fig 5. En lo referente a las drogas inmunosupresoras, es conveniente disponer de unos protocolos bien diseñados y establecidos que eviten la necesidad de elaborar sobre la marcha una supuesta terapia urgente o cambios inapropiados de fin de Figura 3 Figura 4 Figura 5 124 semana. 10) Complicaciones Vasculares. En el trasplante hepático se efectúan varias anastomosis vasculares que son motivo de diversas complicaciones. Tabla 1: Incidencia F. Predisponentes Clínica Trombosis de Arteria Hepática Trombosis de Vena Porta 2 17% 1 3% Ateromatosis. Trombosis portal Resistencia alta al flujo preoperatoria. (estenosis, acodamientos) Postesplenectomia o Disección de la íntima Estenosis de anstomosis. al realizar anastomosis Discrepancia tamaño D/R Necrosis hepática masiva. Persistencia de ascitis, Bacteriemia recurrente. Esplenomegalia o Fuga biliar o Colangitis varices esofágicas Asintomática Diagnóstico Ecodoppler (80%) Ecodoppler TAC. Fig 6. Angiografía. Fig 7. Arteriografía selectiva Tratamiento Retrasplante en el 50 75% Trombectomia y de los casos Anticoagulación 11) Complicaciones Biliares. Se mantiene como una primordial causa de morbimortalidad postoperatoria (7 35%). - Fístula Biliar por dehiscencia de la anastomosis colecoledociana o alrededor del orificio de entrada del tubo de kehr. Fig. 8. Actualizaciones en Trasplantes 2001. - Obstrucción por estenosis anastomótica, por disfunción del esfínter de Oddi, litiasis o mala colocación o acodamiento del tubo en T. 125 12) Hepatotoxicidad. Siempre debemos tener en cuenta los efectos indeseables a nivel hepático provocados por diversas drogas y los diferentes mecanismos de interacción entre ellas, afectando fundamentalmente el metabolismo o mecanismos de excreción de las mismas. 13) Complicaciones Infecciosas. Entre el 40 60% de los enfermos tienen al menos un episodio infeccioso en el postoperatorio inmediato y es la primera causa de muerte en esta etapa. Ante esto, debemos mantener una actitud de estrecha vigilancia y un alto índice de sospecha para diagnosticarla y detectarla precozmente e instaurar tratamiento pertinente, sin emplear el recurso fácil e inadecuado de instaurar tratamiento antibiótico empírico que cubra todo al menor síntoma. Los gérmenes más frecuentes son bacterias gram positivas (Estafilococos o Enterococos), gram negativas (Pseudomonas y Enterobacterias) y hongos (Cándidas). Las causas son muy diversas, siendo las de origen abdominal (herida quirúrgica, absceso intracavitario residual, colangitis,etc.) y las originadas por el empleo de procedimientos invasivos (ventilación mecánica, catéteres venosos, sondas urinarias) las más habituales. El diagnóstico es complejo porque las manifestaciones clínicas son muy inespecíficas. En un trabajo reciente de Nina Singh (Transplantation 1999), observó que hasta el 32% de las infecciones cursaban sin fiebre y el 13% de los enfermos que la presentaban, ésta no se encontraba relacionada con un proceso infeccioso. Ésta misma autora, en otro trabajo publicado en el mismo año y en la misma revista, analizó la presencia de infiltrado pulmonar en la radiología simple de tórax, y advirtió que únicamente en el 38% de las ocasiones estaba ligado a una infección pulmonar. Fig. 9. Aparte de conocer y saber reconocer las múltiples complicaciones que pueden manifestar estos pacientes, debemos recordar que un aspecto fundamental en el cuidado del enfermo trasplantado es el Apoyo Psicológico, especialmente, los sujetos jóvenes que han sido intervenidos en situación de fallo hepático agudo y que por tanto son totalmente ignorantes de su situación y de lo que significa un trasplante. Figura 6 126 Actualizaciones en Trasplantes 2001. Figura 7 Figura 8 127 Figura 9 PROTOCOLOS DE ENFERMERÍA EN LA UNIDAD DE TRASPLANTES DE UCI: TRASPLANTE HEPÁTICO Eloísa García Ortíz y Ana Soucase Palmero. Enfermeras Coordinadoras. Unidad de Trasplantes de UCI. H.U Virgen del Rocío. Sevilla INTRODUCCIÓN.Para Enfermería de UCI, es importante saber el estado que va a presentar el paciente trasplantado hepático cuando nos llega a la Unidad procedente del quirófano (vías venosas, catéteres arteriales, drenajes), así como la preparación de todo el material, drogas, etc. que vamos a necesitar para la monitorización y vigilancia del paciente , tanto a su ingreso como en las horas posteriores. Mientras mayor sea la información sobre el paciente que nos va a ingresar, mejor y más eficaz será la actuación del enfermero/a de UCI. Dadas las características de la Unidad de Trasplantes de UCI (área estéril, restricción de entradas y salidas del personal, unidad cerrada), se vio la necesidad de establecer unos Protocolos de Actuación de Enfermería que pudieran ofrecer dicha información a todo el personal de UCI. Comenzaremos haciendo una descripción del estado que presenta el paciente trasplantado hepático a su ingreso en la Unidad para pasar a ver luego los recursos de los que disponemos para dicho ingreso y la vigilancia en el postoperatorio inmediato. INGRESO EN UCI DEL PACIENTE TRASPLANTADO HEPÁTICO 1.- ESTADO QUE PRESENTA EL PACIENTE A SU LLEGADA A LA UNIDAD: - Está bajo efectos anestésicos. - Intubación orotraqueal. - Herida abdominal cubierta con apósito. 128 - Una o dos arterias radiales canalizadas. - Un drenaje biliar en T de Kher conectado a bolsa. - Tres drenajes abdominales conectados a bolsas: subfrénico derecho, subfrénico izquierdo y subhepático. - Un catéter de Swan Ganz en yugular ó subclavia. - Vías venosas periféricas canalizadas. - Sonda uretral. - Sonda naso-gástrica. - Medias elásticas e inflables de plástico. 2.- RECURSOS: Para recibir al paciente trasplantado de hígado, que ingresa en nuestra Unidad procedente del quirófano, contamos con dos tipos de recursos: Materiales y Humanos. A.- Recursos Materiales: Es el material que tendremos que tener preparado para el ingreso, así pues contaremos con : * Cables: - Uno para frecuencia cardíaca. - Dos para presiones - Uno para tensión arterial incruenta. - Uno para pulsioximetría * Respirador comprobado y parámetros establecidos. * Aspiradores de alto y bajo vacío (para aspiración de secreciones y SNG). * Dos traductores de presiones (uno para Arteria y otro para catéter de Swan-Ganz) * Dos palos de sueros: - 1º Banco de llaves con sistema de P.V.C. Actualizaciones en Trasplantes 2001. - 2º Soporte para traductor de presiones. 129 * Dos bombas de perfusión: - 1 jeringa preparada con Mórfico. - 1 jeringa cargada con Dopamina (según necesidad). * Una bomba volumétrica para suero glucosalino. * 4 Urinómetros - Uno para diuresis. - Tres para drenajes abdominales (según necesidad). * Un manguito de tensión arterial. * Dos manguitos de presiones. * Fonendoscopio. * Sensor para pulsioximetría. * Electrocardiógrafo. * Termómetro. * Sondas de aspiración. * Botes para analíticas y de cultivos para sangre, orina y aspirado bronquial. * Tubo en T y Ventimask al 40%. * Aparato para BM-Test. * Carro de curas. B.- Recursos Humanos: * Dos enfermeros/as. * Un auxiliar. * Un médico intensivista. ACTUACIONES DE ENFERMERÍA A.- AL INGRESO EN LA UNIDAD. 1. Conectamos tubo orotraqueal al respirador comprobando, mediante auscultación, que ventilen ambos campos pulmonares. 2. El paso siguiente será conectar los electrodos al cable de frecuencia cardíaca del monitor. 3. Conectamos arteria y línea distal del Swan Ganz a los traductores de presiones. Los sueros irán sin heparinizar. La segunda arteria canalizada, si la hubiera, se mantendrá permeable (sin monitorizar) para extracción de analítica durante las primeras horas. 4. La vía proximal del Swan Ganz se conecta al banco de llaves para medición de la presión venosa central. 5. Las vías del dilatador del Swan Ganz se conectan a sueros ó a perfusiones. 6. Las vías periféricas se conectan a sueros y las utilizaremos para pasar hemoderivados en el caso que fueran necesarios. 7. Los drenajes abdominales (excepto el drenaje de Kher) se conectarán, según la cuantía de los mismos: - A urinómetros si son abundantes, para su medición horaria. - A bolsas, si son escasos . Su medición será por turno. 130 8. La sonda naso-gástrica se conectará a aspiración suave (-5 cm H2O). 9. Sonda vesical conectada a urinómetro. 10.Controles habituales de PA, Fc, PVC, PAP, Saturación de O2 : - Cada 15 minutos, durante las primeras 2-3 horas. - Cada 30 minutos durante las siguientes 4-6 horas. - Horarios cuando el enfermo se estabilice. 11.Extracción de sangre para analítica: - Hemograma y Estudio de Coagulación - GUI, Gasometría arterial, Creatinina, Proteínas totales, Calcio, Fósforo. - Bioquímica hepática según protocolo de trasplante hepático ( P10 con el sello). - Orina. - Cultivos de : sangre, orina y aspirado bronquial. 12.EKG 13.Rx de Tórax. 14.Las medias de plástico inflables se conectarán al sistema de llenado de aire. Este sistema de compresión secuencial mantendrá la circulación sanguínea en los miembros inferiores mientras el paciente esté inmóvil (24-48 horas). A las 24 horas se le quitarán las medias inflables de plástico y a las 48 horas las elásticas. La programación del aparato viene ya pautada desde el quirófano, por lo que únicamente se necesita conectar y encender. 15.Administrar el tratamiento según el protocolo elegido. B.- EN EL POSTOPERATORIO INMEDIATO. Actualizaciones en Trasplantes 2001. En las primeras 24-48 horas de UCI, vigilaremos muy de cerca no solamente las constantes vitales, sino también la cuantía y calidad de los drenajes. Así, observaremos si el tubo en T de Kher da bilis y el color y densidad de dicha bilis (indica el buen o mal funcionamiento del nuevo órgano), si los drenajes Subhepático y Subfrénicos derecho e izquierdo son hemáticos (sangrado, alteraciones en la coagulación), sero-hemáticos ó drenan líquido ascítico. 131 Siempre tendremos muy en cuenta que son pacientes inmunodeprimidos y extremaremos las medidas de asepsia y esterilidad. La dinámica de la Unidad es de eliminar lo antes posible el máximo de puertas de entrada a las infecciones, así se retirará el catéter arterial en cuanto el paciente esté estable; a las 48 horas se retirarán ambos drenajes subfrénicos. En todos los catéteres y drenajes que se retiren se cultivará la punta. Si el paciente mantiene una hemodinámica estable, retiraremos el cateter de arteria pulmonar ( Swan- Ganz) en las primeras 24 horas. El catéter venoso central que trae de quirófano lo sustituiremos igualmente dentro de las primeras 24 horas. PROTOCOLO DE COLANGIOGRAFIA TRANS-KHER EN UCI CONCEPTO.Consiste en un estudio radiográfico de las vías biliares, intra y extrahepáticas, mediante la introducción de un contraste radiopaco a través del drenaje en T de Kher. Se realiza alrededor del 4º-5º día postrasplante OBJETIVO.Visualizar las vías biliares, intra y extrahepáticas para: - Diagnosticar posibles fístulas o fugas biliares, estenosis u obstrucciones. - Comprobar su permeabilidad mediante el buen paso del contraste al duodeno. - Vigilar la correcta colocación del tubo en T. RECURSOS.1) Humanos: - Personal de Rayos. - Enfermera/o. 2) Materiales: - Aparato portátil de Rayos y placa. - Delantal de plomo para quien inyecta el contraste. - Aguja IV ó de tapón. - Jeringa de 5cc. - Abocath del nº 14 ó nº 20 según el calibre del tubo de Kher. - Contraste radiopaco. - Betadine. - Gasas y compresas. - Guantes estériles. - Un campo estéril. - Un paño de ojo. - Bolsa nueva de Kher. PROCEDIMIENTO.1) Información: Informar al paciente sobre la prueba, explicándolo que el objetivo es vigilar su nuevo hígado y que el estudio no le causará molestias. 2) Técnica realizada por enfermería de UCI y por el personal de Rayos. 3) Premedicación: Se administrará Augmentine 1gr. i.v. una hora antes de la 132 Colangiografía. En el caso de que el enfermo esté cubierto con antibióticos, se podrá prescindir de la premedicación. 4) Preparación: - Colocamos la placa de rayos y dejamos al paciente en decúbito supino. La placa comprenderá el espacio entre el hombro derecho y la cadera del paciente . - Lavado de manos. - Extendemos el campo estéril y colocamos sobre él el material a emplear. - Dejar la ampolla de contraste abierta sobre el carro de curas. - Utilizamos guantes estériles de plástico para retirar la bolsa de drenaje. Nos ayudaremos de una compresa estéril para coger el drenaje y apoyarlo sobre el paño de ojo con la máxima asepsia posible. - Pintamos con Betadine. - Nos ponemos los guantes estériles. 5) Técnica de la Colangiografía: - Cargamos la jeringa con 4cc. de contraste. - Procedemos a canalizar el drenaje biliar con el Abocath y retiramos luego la guía metálica. - Conectamos la jeringa de contraste al Abocath. - Avisamos al Técnico de Rayos para que esté preparado. - Inyectamos el contraste en bolo durante 5-7 segundos, siempre que no encontremos resistencia. - Una vez terminada la administración de contraste, el técnico hará inmediatamente la placa. - Retiramos el Abocath del drenaje. - Limpiamos la zona con yodo. - Colocamos la bolsa nueva de Kher. Actualizaciones en Trasplantes 2001. - Retiramos la placa de rayos. 133 6) Registro: - Anotamos en gráfica la hora de realización de la Colangiografía e incidencias, así como si el drenaje se deja pinzado o a bolsa. PROTOCOLO DE BIOPSIA HEPÁTICA EN UCI Concepto.La biopsia hepática se realiza para tomar una muestra del hígado trasplantado y analizarla en Anatomía Patológica. Objetivo.Diagnóstico de una crisis de rechazo y valoración de la intensidad o grado del mismo. También se pueden detectar signos de isquemia ó lesiones de preservación del injerto. Recursos.1) Humanos: - Médico. - Enfermera/o 2) Materiales: - Aguja IM - Jeringa de 10cc - Anestésico local (Scandicaín al 1-2%) - Aguja de biopsia. - Bote estéril con Formol al 10% - Bote con líquido violeta para CMV ( congelador). - Hoja de bisturí. - Povidona. - Gasas. - Guantes estériles. - Dos campos estériles. - Esparadrapo. Procedimiento.1) Información: Informar al paciente. Intentar quitarle angustias frente al miedo a la técnica de la biopsia y ante el rechazo al hígado trasplantado. 2) Técnica realizada por el médico (cirujano) con ayuda de enfermería. 3) Premedicación: No suele administrarse. 4) Preparación: - Administración de 6 unidades de plaquetas una hora antes de la biopsia. Esto será únicamente si el recuento plaquetario es inferior a 50.000. - Posición del paciente en decúbito supino, con brazo derecho levantado y apoyado sobre la cabeza. - Desinfectar la zona con povidona . - Extender los campos estériles y colocar sobre ellos el material a emplear. 5) Cuidados de enfermería: 134 - Una vez que el médico haya realizado la punción-biopsia, la muestra de tejido hepático se introducirá en el bote con formol. La muestra se enviará, debidamente identificada, con hoja de Biopsia Hepática a Anatomía Patológica. - Sólo en ocasiones, cuando lo indique el médico, se recoge muestra para estudio de CMV. - Dejamos un apósito compresivo en el punto de punción. - El paciente se mantendrá en decúbito lateral derecho, haciendo compresión sobre el punto de punción, durante 3-4 horas para prevenir el sangrado interno. 6) Registro: Anotaremos en la gráfica del paciente la hora de realización de la biopsia y las incidencias que se hayan producido durante dicha realización. CONCLUSIONES.Así pues, consideramos que Enfermería cumple un papel muy importante en los Programas de Trasplante y, concretamente, de forma decisiva en el postoperatorio inmediato en UCI. Actualizaciones en Trasplantes 2001. La penosidad de trabajar en UCI, en una zona estéril ,se compensa con la calidad asistencial que se ofrece al tener todo protocolarizado, con la satisfacción de trabajar en los equipos de Trasplantes y con la gratificación profesional y humana que implica el contacto con las personas trasplantadas y sus familiares. 135 Cuidados de enfermería en las distintas fases del pacientes trasplantado hepático. Mª Jesús Fernández Romana, Mª Jesús Díaz Mellado, Mª Dolores Muñoz Del Castillo, Fernanda Conejero Caballero, Julián Garrido Nieto, Mª José Carrión Rodríguez, Inmaculada Acevedo Durán, Alicia Vélez García. Enfermería de Trasplante Hepático. Introducción Desde el 7-IV-90, fecha en que se realizó el primer transplante hepático hasta la actualidad, la enfermería de la Unidad de Cirugía del Hospital Universitario Virgen del Rocío ha participado de forma activa en los cuidados pre y post transplante. En un principio las dificultades a las que nos enfrentábamos fueron muchas, debidas a la falta de experiencia y de una Unidad dotada con los medios físicos y humanos necesarios para una asistencia integral del paciente. Estas dificultades fueron superadas con interés y entusiasmo por parte de todo el personal En estos diez años, en los que se han realizado en nuestro hospital más de 300 trasplantes hepáticos, el protocolo de actuación en estos enfermos ha ido cambiando y evolucionando. Gracias a la gran experiencia acumulada por los profesionales, los cuidados pre y postoperatorios se han perfeccionado, mejorando sensiblemente la calidad asistencial. Aparte de la atención al enfermo en las referidas fases del trasplante, hay que reseñar que en nuestro Servicio reingresan con frecuencia estos pacientes con complicaciones, no necesariamente quirúrgicas, siendo las más frecuentes las relacionadas con efectos adversos del tratamiento inmunosupresor, infecciones, administración de algún tratamiento intravenoso, etc., a los que se les practican los cuidados necesarios en cada caso 136 CUIDADOS DE ENFERMERIA EN LAS DISTINTAS FASES EN QUE EL PACIENTE INGRESA EN NUESTRA UNIDAD: 1. ESTUDIO DEL PACIENTE COMO CANDIDATO A TRASPLANTE 2. PREPARACIÓN PREVIA A LA INTERVENCIÓN 3. CUIDADOS DEL ENFERMO TRASPLANTADO DESDE QUE ES DADO DE ALTA EN U.C.I. HASTA EL ALTA DOMICILIARIA. 1) ESTUDIO DEL PACIENTE COMO CANDIDATO A TRASPLANTE - Valoración inicial del paciente. - Control de constantes. - Nivel de conciencia. - Presencia de ascitis y o edemas. - Ingesta y eliminación - Color de piel y mucosas. - Valoración del estado bucal. - Preguntar y anotar tratamiento habitual. - Estado nutricional. - Condiciones socio-laborales y familiares. - Estudios complementarios fijos: 1. Pesar y tallar. 2. Mantoux. (Si fuera positivo se cursaran Baciloscopias seriadas en esputo y orina). 3. Electrocardiograma. 4. Rx. de Tórax. 5. Pruebas de función respiratoria. 6. Eco-Doppler abdominal. Actualizaciones en Trasplantes 2001. 7. Endoscopia oral 137 8. Gammagrafia cardiaca. 9. Estudio complementario en caso de LOE: - Gammagrafia ósea. - TAC Toraco-abdominal - Resonancia Magnética. - Arteriografia +Lípidos. - P.A.A.F. (punción de aspirado con control radiográfico) Todas estas pruebas y valoraciones se harán en el menor tiempo posible para que el tiempo de estancia hospitalaria no sea muy largo. 2) PREPARACIÓN EL DÍA DE LA INTERVENCIÓN - Pesar y tallar. - Rx. de Tórax. - Extracción de analítica según protocolo. - Rasurado completo.(tórax, abdomen, axilas e ingles.) - Ducha con antiséptico y cepillado de dientes. - Firma del consentimiento. - Antibioterapia prescrita. 3) CUIDADOS DEL ENFERMO TRASPLANTADO DESDE QUE ES DADO DE ALTA EN U.C.I. HASTA EL ALTA DOMICILIARIA El paciente ingresa en planta procedente de la Unidad de Cuidados Intensivos después de una estancia en la misma mas o menos larga. Para recibir al paciente se preparara una habitacion de las destinadas a tal efecto con medidas de aislamiento a) PREPARACIÓN DE LA HABITACIÓN - Ventilar antes de su uso - Limpiar con lejía techos, paredes y suelos - Limpiar con lejía fundas de colchón, camas, mesas, etc. - Preparar un carro de aislamiento con el siguiente material: 1 manguito de T.A. 1 Fonendoscopio 1 Termómetro - Material de cura variado y depresores linguales - Materiales para analítica - 1 Linterna pequeña - Colocar a la entrada de la habitacion: Guantes desechables Pmtériles Gorros masculinos Cubo para material desechado 138 b) RECEPCIÓN DEL PACIENTE - Todo el personal con acceso al enfermo debe mantener medidas higiénicas adecuadas pues los vehículos de transmisión de infecciones mas frecuentes son las manos y la ropa - Así pues se procederá al lavado previo de manos y se deberá entrar en la habitacion con papis, gorro, mascarilla, bata y guantes - Después de los quince primeros días postrasplante y si la situación del enfermo lo permite, únicamente serán necesarios el lavado de manos, los papis, guantes, y mascarilla - Solo debe haber un familiar por enfermo en la habitacion y deberá guardar las mismas medidas. - El paciente podrá salir de la habitacion con las medidas de aislamiento c) VALORACIÓN INICIAL DEL PACIENTE - Toma de constantes (TA, pulso, temperatura, etc.) - Oxigenación: Signos y síntomas que indiquen alteración respiratoria. - Ingesta: Determinar tipo de dieta, y trastornos de la masticación ó deglución. - Eliminación: control de calidad y cantidad de orina y deposiciones. - Higiene: comprobar la integridad de la piel y el estado de la misma así como de las mucosas. Anotar limitaciones debidas a la presencia de drenajes, heridas, etc. - Termorregulación: control de la temperatura. - Movilización: valorar el estado físico del paciente (heridas, drenajes, sueros, etc.) e intentar facilitarle en lo posible estas limitaciones para que su movilización sea lo más precoz posible, aunque sus movimientos han de estar limitados a la habitación, salvo autorización facultativa. Valorar también la necesidad de rehabilitación activa. - Comodidad: valorar reposo y sueño - Seguridad física y psíquica: el paciente suele reflejar angustia o miedo por el cambio de medio ambiente(UCI-Planta) Actualizaciones en Trasplantes 2001. d) PLAN DE CUIDADOS 139 - Toma de constantes por turno: (TA, Tº, Diuresis, Drenajes, etc.). En caso de fiebre (Tº>38ºC), se extraerán hemocultivos seriados(2 tandas), urocultivo, cultivo de bilis, drenajes y exudados si los hubiese y hacer Rx. de tórax. - Cura de visa centrales o periféricas cada 24 horas, cambiando sistemas de suero y protección de las conexiones de la vía central. - Anotar peso y medida del perímetro abdominal dos veces en semana. - Cura de herida quirúrgica, orificios de drenaje y tubo de khern; anotando en gráfica cantidad y características del débito de los mismos. - Administrar medicación e iniciar al paciente y sus familiares en el manejo y la importancia de la medicación inmunosupresora. (Vigilar los posibles efectos secundarios) - Estimular fisioterapia respiratoria con inspirómetro incentivado. - En pacientes inmovilizados efectuar cambios posturales frecuentes y protección de talones y sacro. Aunque es muy importante estimular al enfermo para la movilización precoz. - Controlar por turnos la ingesta y eliminación. - Preparar al paciente para pruebas diagnosticas dentro y fuera de la habitación. (cuando el enfermo deba salir para cualquier prueba debe ir protegido convenientemente) - Higiene diaria escrupulosa. - Extracción de la analítica de protocolo y los niveles en sangre de inmunosupresores (Domingos, Martes, y Jueves.) - Enseñar autocuidados (con vistas al alta) del cambio de apósito del drenaje de khern, ya que deberá tenerlo durante tres meses + ó -. - Entregar al alta documentación sobre autocuidados en su domicilio referente a medidas higiénicas, alimentación, administración de medicamentos, y aclararle todas las dudas que puedan plantearse. 140 Trasplante Hepático en Cuba: Resultados de nuestro primer año de trabajo. A. Abdo, L. González-Rapado, J.C. Hernández, M. Samada, O. López, M. Wilford, C. Alfonso, R. Ysla, C. Ugarte, J. Lage, J. Díaz, O. Suárez. Centro de Investigaciones Médico-Quirúrgicas -CIMEQ-. Ciudad de la Habana. Cuba. En Julio de 1999 comenzó la labor de la Coordinación de Trasplantes, y del Grupo de Trasplante Hepático del Centro de Investigaciones Medico Quirúrgicas (CIMEQ). El día 3 de Julio de 1999 se realizo el primer trasplante hepático, a una paciente de 37 años, que sufría de una Cirrosis Biliar Primaria en estadio terminal, y que hoy tiene una vida normal junto a su familia, a mas de un año del trasplante. Estos resultados de un año de trabajo (Julio 1999 Julio 2000) con 12 Trasplantes Hepáticos realizados, incluyendo un Hepato-renal han sido gracias al Sistema de Salud con que cuenta nuestro país, a la generosidad de las familias de los donantes y a la «Solidaridad sin fronteras», como la definiera nuestro profesor y amigo José Pérez Bernal, de un grupo de profesionales de los HH UU Virgen del Rocío, que nos han brindado su amistad y ayuda profesional. A todos muchas gracias y estos son también sus resultados. Actualizaciones en Trasplantes 2001. Coordinación de Trasplantes del CIMEQ ( Julio 1999 Julio 2000 ) 141 Iniciamos el trabajo de Coordinación con una red entre 3 hospitales de la ciudad, que en poco tiempo se extendió a toda la isla. Aunque el objetivo inicial fue el Trasplante Hepático, paralelo a el se desarrollaron otros programas de trasplantes que beneficiaron al país. En este periodo trabajamos con 13 Donantes reales, provenientes de todo el territorio nacional, lo que nos obligo a desplazarnos con medios terrestres y aéreos. (Figuras 1 al 5) Figura 1 Figura 2 Figura 3 142 Figura 4 Figura 5 Programa de Trasplante Hepático en el CIMEQ ( Julio 1999 Julio 2000 ) Actualizaciones en Trasplantes 2001. Evaluación de candidatos a THO 143 En mayo de 1999 se comienza el estudio de pacientes portadores de hepatopatías crónicas avanzadas, de diversas etiologías como candidatos a Trasplante Hepático, según el protocolo de nuestro centro. Para esto se creó una consulta especializada en la que se captan y evolucionan a estos pacientes. Transcurrido mas de un año de trabajo se han evaluado como probables candidatos a 92 pacientes procedentes de numerosas instituciones de salud del país. Para la evaluación del grado de severidad de la hepatopatía se utilizó la clasificación de Child- Pugh. De los pacientes evaluados han sido aceptados 25 para trasplante y de ellos se han trasplantado hasta la fecha 12. De estos últimos 8 corresponden al sexo masculino y 4 al femenino, con edades comprendidas entre los 15 y 60 años (promedio: 40,7). El diagnóstico de las enfermedades hepáticas de los trasplantados se muestra en la figura 6. Según la clasificación de Child-Pugh un enfermo se encontraba en un estadío A, 6 en estadío B y 5 en estadío C (figura 7). El paciente que se encontraba en el estadío A presentaba una enfermedad poliquística hepatorrenal con conflicto de espacio y en tratamiento dialítico desde hacía tres años, que fue tributario de un trasplante hepato-renal. Proceder quirúrgico Todos los Trasplantes realizados fueron de tamaño completo y solo uno fue de tipo combinado: hepato-renal. La hepatectomia se realizo según técnica de Piggy Back en el 91.7 % de los casos. No se utilizo by pass venovenoso en ningún caso. Las anastomosis vasculares fueron las estándares. La anastomosis arterial mas utilizada fue la bifurcación de la arteria gastroduodenal. La anastomosis biliar de elección fue la coledoco coledocostomia con tubo en T (91.7 %), en un solo caso se realizo hepatico yeyunostomia por tener una via biliar patologica. ( figura 8 ) El proceder quirurgico ha tenido una duración promedio de 8 horas. Los tiempos de isquemia fria promedio fueron de 6 horas. El uso de hemoderivados: glóbulos, plasma, y plaquetas, de 8.8, 13.1, y 5.3 unidades Figura 6 144 Actualizaciones en Trasplantes 2001. Figura 7 Figura 8 145 Figura 9 respectivamente. ( figura 9 ) Complicaciones quirúrgicas Se han presentado 2 complicaciones vasculares: una trombosis precoz de la rama derecha de la arteria hepática, que estuvo asociada a un episodio de hipotensión, y una estenosis tardía de la anastomosis de la porta. Las complicaciones relacionadas con la via biliar han constituido la principal causa de morbilidad por motivos técnicos (33.3%). Han existido 3 fístulas biliares, que en dos casos llevaron a un coleperitoneo con necesidad de reintervencion, y en el otro a un biloma que requirió de punción , drenaje, y luego de reconstrucción de la vía biliar. Un caso ha hecho estenosis isquemica tardía de ramas intrahepaticas. Figura 10 Se han realizado 7 reintervenciones sobre 5 casos, predominando el sangrado del lecho quirúrgico como causa en 4 de ellas. ( figura 10 ) Complicaciones medicas Dentro de las complicaciones relacionadas con el injerto la mas frecuente fue la lesión de preservación, que se encontró en el 91.7 % de los casos; esto pensamos esta relacionado con el mantenimiento del donante y el proceso de la extracción, aspectos estos que perfeccionamos en la actualidad. Fallo primario del injerto solo se presento en un caso, que murió en espera de un retrasplante que no se realizo por no haber existido un donante en tiempo. Episodios de Rechazo de distintos grados fueron diagnosticados en 7 pacientes ( 58.3 % ). Las complicaciones neurológicas (dentro de las que predomino algún cuadro de desorientación y temblores asociados a toxicidad por CyA ) se presentaron en el 75% de los casos, y las respiratorias en el 66.7 %, predominando el edema intersticial diagnosticado radiologicamente y en ocasiones asociado a hipoxemia, que pro- 146 Actualizaciones en Trasplantes 2001. Figura 11 Figura 12 147 Figura 13 Figura 14 longo la ventilación mecánica en 4 de ellos. Algún grado de Disfunción renal se encontró en el 66.7 %, sin embargo apoyo dialitico solo requirió 1 caso. ( figuras de la 11 a la 17 ) Inmunosupresión y Rechazo La inmunosupresion base fue la triple terapia: Ciclosporina A neoral, Azatioprina o Cell cept y Esteroides. Se diagnostico rechazo en 7 pacientes ( 58.3 % ). En uno de ellos la primera biopsia era compatible con rechazo celular agudo grado II y elementos de ductopenia, se trato según protocolo y en biopsias posteriores el cuadro era compatible con rechazo cronico ductopenico. ( figura 18 ) En estos casos se optimizo la dosis del inmunosupresor basal, se sustituyo la azatioprina por micofenolato, y en un escalón posterior se utilizaron bolos de esteroides. En el paciente con rechazo cronico ductopenico se sustiyuyo la CyA por FK 506 con buena respuesta clinica hasta el momento. Infecciones La profilaxis antibiótica se realizo con 3 dosis de 1 gr de Cefazolina, la infección más frecuente en nuestra serie fue la neumonía (5 casos), de etiología bacteriana en el 100%. El Fallo Múltiple de Organos ocasionado por sepsis fue causa de muerte en dos de ellos. 148 Actualizaciones en Trasplantes 2001. Figura 15 Figura 16 149 Figura 17 Figura 18 Figura 19 Figura 20 150 Infección micotica solo se presento en un paciente, infección de origen viral en dos, con un episodio de Herpes virus genital cada uno. No ha existido cuadro de infección por protozooarios. ( figura 19 ) Supervivencia La supervivencia actuarial al año es de un 58 %. Las causas de muerte se muestran en la figura 20. Los pacientes que presentaron FMO por sepsis fueron: uno con Absceso Hepático secundario a biloma por fuga biliar, y el otro, Neumonía con sepsis grave por Klebsiella pneumoniae. Nuestros resultados aunque no equiparables a los de grupos de alto nivel, no son desalentadores para un grupo que comienza; en el momento actual nuestro equipo se ha ganado el prestigio dentro de los profesionales que atienden a pacientes tributarios de este proceder en todo el país y la lista de espera se incrementa. Del 25 al 29 de septiembre del 2000 celebramos el I Simposio Internacional sobre Trasplante Hepático en Cuba, con la participación de profesionales de España, Perú, Guatemala, y Cuba; donde discutimos sobre el tema en un marco de alto nivel científico. Comprometidos estamos con ustedes de quienes hemos recibido tanta Solidaridad, y sobre todo con nuestro pueblo de perfeccionar nuestro trabajo para lograr mejorar estos resultados. NOTA DEL COORDINADOR CIENTÍFICO DEL LIBRO: Actualizaciones en Trasplantes 2001. Una vez que ya estaba el libro maquetado en la empresa de diseño gráfico, y pocas horas antes de imprimirlo en papel, recibimos una carta del Dr. Anselmo Abdo, Intensivista y Coordinador de Trasplantes del CIMEQ, de Ciudad de La Habana. 151 La carta está escrita con motivo de un sencillo y entrañable acto, que tuvo lugar el 2 de Febrero del 2.001 en la sede de la Asociación de Amistad Hispano Cubana de Sevilla, en el que la Lda. Dª. María Regueiro Mayo, Consul General de la República de Cuba en Sevilla, entregó una distinción a un grupo de 16 profesionales de nuestro Hospital destacados por su solidaridad con los Programas de Trasplantes en el CIMEQ. He dedicido reproducirla íntegramente por varios motivos: Primero porque hace un resumen de la actividad trasplantadora del CIMEQ en el año 2.000, lo que guarda relación con uno de los objetivos de este libro. En segundo lugar porque, al leer su carta, comprobamos el gran esfuerzo que necesitan hacer para desarrollar sus Programas de Trasplantes, el gran mérito que significa realizarlos en un ambiente lleno de dificultades y en un entorno socioeconómico y geográfico que , no podemos olvidar, es Centroamerica y Caribe. Y, por último, porque transmite sentimientos sinceros de respeto y agradecimiento a todos los profesionales del Hospital Virgen del Rocío. 2 de febrero de 2001 A los amigos del Hospital Virgen del Rocío y de la Asociación de Amistad Bartolomé de las Casas: En el pasado mes de enero realizamos en nuestro hospital, el Centro de Investigaciones Medico Quirúrgicas, CIMEQ, el Resumen de la actividad de trasplantes del año 2000. Durante ese año se realizaron 71 Trasplantes de órganos o tejidos: 8 Trasplantes hepáticos, 19 Trasplantes renales, 1 Trasplante combinado hepatorenal, ( el primero de este tipo realizado en nuestro país ), 7 Trasplantes de corneas, 1 Trasplante de medula ósea, y 15 Injertos óseos. Este numero de trasplantes que a lo mejor pudiera parecer para algunos una cifra ínfima, para nosotros ha representado un esfuerzo extraordinario, testigos han sido ustedes del esfuerzo que hace nuestro país para ofrecer una salud publica de calidad en condiciones difíciles, en ocasiones incluso disponiendo de dinero se nos hacen imposibles las compras de algunos productos y equipos medicos, con componentes norteamericanos, que como conocen dominan la industria medica. Quiero en esta carta hacerles llegar el agradecimiento de todo el equipo de trasplantes del CIMEQ, de los pacientes trasplantados y sus familiares, y de todo nuestro pueblo, que es el principal beneficiado; a todos ustedes amigos y hermanos del Hospital Virgen del Rocío, que fueron los que nos tendieron la mano desinteresadamente para iniciar este programa, y que hoy junto a los amigos de la Asociación de Amistad hispano-cubana Bartolomé de las Casas nos siguen ayudando día a día para mantenerlo con los logros alcanzados. Sepan que donde quiera que se hable de estos resultados pueden sentirlos como suyos pues honrados nos sentimos de habernos hermanados con personas como ustedes. Comprometidos estamos con nuestro pueblo cubano y con ustedes de llevar adelante este Programa, y que los resultados de este año 2001 sean mejores. De nuevo muchas gracias pues sabemos todo el esfuerzo que hacen para ayudarnos. Un fuerte abrazo Anselmo Abdo 152 LA RADIOLOGÍA VASCULAR E INTERVENCIONISTA EN LOS TRASPLANTES HEPATICO Y RENAL C. Gutiérrez Martín, M.A. Iribarren Marín, A. Mayol Deyá, M. Medrano Ortega. UNIDAD DE RADIOLOGÍA VASCULAR. SERVICIO DE RADIODIAGNÓSTICO La radiología Vascular e Intervencionista actúa, mediante diferentes exploraciones diagnósticas invasivas (angiografías, colangiografías) e intervenciones percutáneas (vasculares o biliares), en el estudio y tratamiento de los pacientes sometidos a transplante hepático o renal, en distintos momentos del proceso: A) PREVIOS AL TRASPLANTE: 1.- Aportando información del estado del árbol vascular arterial y venoso (y las posibles variantes de la normalidad) sobre el que se anastomosarán los vasos del injerto. Actualizaciones en Trasplantes 2001. 2.- Estudio de circunstancias que afectan a la elección del paciente como candidato a transplante (despistaje de tumoraciones). 153 3.- Exploraciones y terapéutica en Fístulas de Diálisis. B) POSTERIORES AL TRASPLANTE: 1.- Diagnóstico de posibles complicaciones (vasculares o no vasculares) y tratamiento de las mismas. 2.- Seguimiento del paciente y estudio y tratamiento de las complicaciones tardías. 3.- Cualquier situación del paciente durante su evolución que requiera la intervención de la Radiología Vascular aunque no afecte al órgano transplantado (Flebografía MMII, estudio de hemorragias digestivas, drenaje de colecciones, etc.) De todas estas posibles exploraciones e intervenciones, las más frecuentes y de mayor relevancia serían: 1.- EXPLORACIONES VASCULARES (Angiografías) a) Arteriografías de Tronco Celíaco y Arteria Hepática: Estudio de estenosis o trombosis de Arteria Hepática o la Vena Porta, tras la intervención. También suelen realizarse previas al trasplante para el estudio del árbol vascular hepático y en el diagnóstico diferencial de tumoraciones hepáticas (Arteriografía Lipiodol TAC) b) Arteriografías Mesentérica Superior y Esplénica: Se suelen realizar junto con las anteriores, con las mismas indicaciones. c) Arteriografía renal: Estudio de permeabilidad de la arteria del Riñón trasplantado. También se valoran posibles complicaciones como sangrado o Fístula A.V. d) Otros: Flebografía de MMII y Angiografía Pulmonar (si se sospecha TVP o TEP) Arteriografías y Flebografías (fístulografías) de miembros superiores (pacientes en diálisis en espera de Trasplante) 2. -INTERVENCIONES PERCUTANEAS VASCULARES. a) Angioplastias (ATP) 1.- Arteria Renal: Tratamiento de estenosis de la arteria del riñón trasplantado, cuando provoca deterioro de la función renal o HTA no controlable. 2.- Tronco Celíaco y Arteria Hepática. Para estenosis que limitan la irrigación del parénquima del hígado trasplantado. 3.- Accesos vasculares de Hemodiálisis. Tratamiento percutáneo de estenosis para preservar estos accesos vasculares en pacientes en espera de Trasplante Renal. b) Embolizaciones: Mediante catéterizaciones selectivas y utilizando partículas embolizantes o espirales metálicas (coils) 1.- Hemorragias: en el lecho quirúrgico o el órgano trasplantado, pueden beneficiarse de embolizacion percutánea. 2.- Fístulas Arterio Venosas: Habitualmente yatrógenas. 154 Foto 1 Arteriografía Iliaca derecha. Estenosis de arteria renal Foto 2 Actualizaciones en Trasplantes 2001. Resultado tras angioplastia 155 3.- EXPLORACIONES Y TERAPEÚTICA EN EL ARBOL BILIAR. La obstrucción del flujo biliar (por cicatriz, detritus epiteliales, colangitis, etc.) suele requerir tratamiento quirúrgico para solucionar el problema inicial; no obstante, tanto como para confirmar el diagnóstico (CTPH) como para resolver la ictericia previamente a la intervención (drenaje biliar), la Radiología Vascular e Intervencionista suele participar en esta patología con los siguientes procedimientos: a) Colangiografías: Transhepática (CTPH) o a través del Tubo en T. b) Drenaje biliar externo. c) Drenaje biliar interno: Comunica con intestino, consiguiendo una derivación interna de la bilis. d) Dilatación biliar: Mediante catéter de angioplastia, se pueden resolver estenosis de la vía biliar. e) Movilización de cálculos. 4. -OTRAS INTERVENCIONES. Drenaje de colecciones intrabdominales por vía percutanea: ABCESOS, BILOMAS Y HEMATOMAS. Foto 3 Dilatación de la vía biliar por estenosis del colédoco en la anastomosis Foto 4 Resultado tras dilatación con catéter balón 156 SELECCION DEL RECEPTOR DE RIÑÓN DE CADÁVER M.A. GENTIL GOVANTES, M.F. GONZÁLEZ ESCRIBANO, G. RODRÍGUEZ ALGARRA, P. PEREIRA PALOMO, A. NÚÑEZ, J. MATEOS. SERVICIOS DE NEFROLOGÍA E INMUNOLOGÍA. 1. PRINCIPIOS GENERALES. La selección de receptores para trasplante de órganos presenta dificultades comunes a otros procesos de asignación de recursos sanitarios limitados, en los que la demanda supera ampliamente a la oferta. Se añaden además peculiaridades como la especial dificultad para modificar la cantidad del bien escaso a repartir (los órganos) y el carácter altruista de su origen (la donación). Por tanto, el procedimiento de «racionamiento» debe ser especialmente preciso en sus fundamentos y muy transparente en la forma de aplicación. Deben cumplirse dos principios generales en el uso de recursos sanitarios limitados: Actualizaciones en Trasplantes 2001. Equidad: todos los pacientes deben tener acceso al trasplante en igualdad de condiciones, sin ningún tipo de discriminación por cuestiones sociales o económicas. Por ejemplo, debe descartarse cualquier influencia del lugar dónde el paciente reciba la diálisis y es preciso respetar lo máximo posible el orden de espera (es decir, la antigüedad en diálisis). Sin embargo, la auténtica equidad exige actuar de forma diferente ante casos diferentes. Así, será necesario tener cuenta la diversa necesidad o beneficio esperable desde un punto de vista médico (niños, superurgentes) y compensar las dificultades especiales para disponer de un órgano válido (hiperinmunizados). 157 Rendimiento óptimo: dado que los órganos son un recurso escaso, debe pretenderse formar la pareja donante/receptor que ofrezca perspectivas de una máxima supervivencia (SV) y calidad de vida. En el caso ideal este aspecto debería medirse en años-calidad de vida potencialmente ganados, pero en la práctica se trabaja sobre las posibilidades estimadas de SV del órgano. Es evidente que en una gran parte de casos estos dos objetivos entrarán en competencia y rara vez podrán satisfacerse simultáneamente. En consecuencia, es necesario establecer una sistemática que persiga un compromiso lo más eficiente posible entre ambos fines. 2. ANTECEDENTES A la hora de diseñar un método de selección es inevitable comenzar por considerar la enorme experiencia acumulada por los grandes sistemas de intercambio de órganos. En general, estas organizaciones aplican sistemáticas en las que predominan los criterios de histocompatibilidad, corrigiéndolos mediante otros factores como la antigüedad en lista, balance entre centros o zonas, etc, asignando puntuaciones que establecen el orden de prioridad de los receptores potenciales. Los criterios se apoyan en estudios de resultados que les atribuyen ventajas significativas en cuanto a SV. Revisamos brevemente algunas de estas sistemáticas, seguido de un breve análisis de nuestros resultados propios en relación con la histocompatibilidad: 2.1 United Network for Organ Sharing (U.N.O.S.). U.S.A. Hasta 1994 Puntuación: 6 identidades en A+B+DR 0 incompatibilidades (IC) en B+DR 0 IC en A+B 1 IC en B+DR 2 IC en B+DR 3 IC en B+DR 10 7 6 3 2 1 Grado de reactividad anti-HLA (PRA) actual >80% con prueba cruzada negativa: 4 puntos Tiempo de espera 1 punto Por cada año adicional 0,5 punto Desde 31/7/95 1 Puntuación: 0 IC en A+B+DR 0 IC en B+DR 1 IC en B+DR 2 IC en B+DR Envío obligatorio 7 5 2 Resto de casos: 0 puntos por compatibilidad PRA actual >79% con prueba cruzada negativa: 4 puntos Tiempo de espera máximo 1 punto (fracción proporcional para el resto de pacientes) Por cada año adicional 0,5 punto Puntuación adicional (2-3 puntos)para niños y adolescentes. 158 2.2 UNITED KINGDOM TRANSPLANT SERVICE Desde 1986 se aplica el Benefitial Matching Scheme por el cual el riñón es intercambiado en caso de compatibilidad favorable: no incompatibilidad en HLA A+B+DR (0-0-0); ninguna incompatibilidad en HLA-DR y 1 incompatibilidad en HLA A+B (1-0-0/0-1-0). Recientemente (1997) se ha ampliado a 0 incompatibilidades DR, 1 incompatibilidad en A y 1 incompatibilidad en B (1-1-0), al demostrarse resultados de SV similares a los de los grupos previos2. 2.3 EUROTRANSPLANT Desde marzo de 1996 Eurotransplant aplica una modificación de sus normas ETKAS (Eurotransplant Kidney Allocation System) para evitar desequilibrios en el intercambio de órganos y disminuir otras inequidades3. Se modificó en octubre de 1996. Algunos aspectos a tener en cuenta son: - Reglas para compatibilidad ABO: O® O+B; A® A+AB; B®B+AB; AB®AB. - Exclusión pacientes con PRA no actualizado - Orden de prioridad básico: - 0 incompatibilidades en A+B+DR - Urgencia clínica - Resto. Factores que tienen en cuenta para el resto: - Incompatibilidades HLA - Probabilidad de compatibilidad favorable (puntuación de corrección para HLA y ABO raros y para inmunizados) - Tiempo de espera Actualizaciones en Trasplantes 2001. - Distancia del donante al centro de trasplante (primando los locales) 159 - Balance nacional A los no residentes en la zona se les asigna puntuación cero en distancia y balance. Los niños se priman dándole doble puntuación por HLA y puntos adicionales en tiempo de espera (0-5 años de edad = 3 años; 6-10 = 1 año; 11-15 = 2 años). Como se puede comprender es un sistema muy complejo, de difícil traslación a nuestro ámbito. Por ejemplo, la máxima compatibilidad HLA (0 incompatibilidad en A+B+DR) puntúa 400 y un receptor local de máximo tiempo de espera puntuaría 300+200. 2.4 RESULTADOS DE SUPERVIVENCIA EN NUESTRO SERVICIO EN PACIENTE TRATADOS CON CICLOSPORINA4. En conjunto, no se encuentran diferencias significativas de SV en relación con el grado de compatibilidad HLA posiblemente por el pequeño tamaño de la muestra, pero se observan las siguientes tendencias: - Mejor SV con 0 incompatibilidad en DR - Mejor SV con 0-1 incompatibilidad en DR+B - Mejor SV con 0-1 incompatibilidades en A+B sólo en pacientes inmunizados (>50% de PRA actual). - La incompatibilidad en HLA B por separado no parece influir; la incompatibilidad en HLA A tampoco, e incluso se observa una tendencia paradójica. En el último análisis disponible (1991) para el conjunto de los TR hechos en Andalucía sólo se demostraba ventaja significativa para 0-1 incompatibilidades en HLA B+DR (del orden del 12% en la supervivencia a los 3 años)5. El factor más relevante en la SV del injerto es la edad del donante, con resultados óptimos para donante joven (<50 años) en receptor joven (<50 años). El documento de consenso español6 sobre uso de riñones de donante añoso (>60 años) recomienda su uso en receptor añosos y lo desaconseja en el donante joven, si bien no lo apoya en resultados propios. Análisis previos en el sistema de USA, U.N.O.S., habían mostrado resultados alentadores en el uso de riñones de donante añoso en receptor de edad avanzada, hasta el punto de proponerse la creación de un «senior pool» formado por receptores potenciales de mayor edad, para el aprovechamiento selectivo de este tipo de órganos7. Estudios posteriores discrepan parcialmente de este enfoque, por lo que la cuestión permanece aún muy abierta8. Nuestra experiencia particular9 no apoya por ahora una recomendación positiva de este tipo, por dos razones: La proporción de donantes añosos es actualmente muy superior a la de posibles receptores añosos (supondría dar prioridad a los receptores añosos en el acceso al trasplante); los resultados peores corresponden a la combinación donante >50 años /receptor >50 años. Por tanto, por ahora el esfuerzo principal debe dirigirse a procurar que los órganos de donantes jovenes (menos de 50 años) se dediquen preferentemente a receptores jovenes. También evitar que órganos de edad muy avanzada se empleen en receptores muy jóvenes, en los que hay que aspirar a SV superiores a los 10 años. Otro factor que resulta muy influyente es la inmunización anti-HLA I en el receptor, definida como reactividad contra más de 50% del panel (PRA) en el período inmediatamente anterior al trasplante. 160 3. SISTEMÁTICA GENERAL DE ASIGNACIÓN CRITERIOS GENERALES. Teniendo en cuenta todo lo anterior se han establecido los siguientes criterios generales Orden de preferencia: 1. Superurgentes 2. Hiperinmunizados 3. Lista regional pediátrica 4. Resto de lista de espera (pacientes no prioritarios) Cada categoría se define según los siguientes criterios: - Urgencia clínica («Superurgentes»). Pacientes con agotamiento de los accesos para diálisis (vasculares y peritoneo), que dependen del trasplante para sobrevivir a corto plazo. - Hiperinmunizados. Anticuerpos citotóxicos contra más de 75% del panel mantenidos en el último año (más de 3 determinaciones en este periodo de tiempo). - Lista regional pediátrica. Pacientes con menos de 17 años incluidos en la lista regional pediátrica; pueden estar en situación prediálisis. - Resto lista de espera. Pacientes no incluidos en ninguno de los apartados anteriores. Actualizaciones en Trasplantes 2001. Criterios de selección para cada grupo: 161 - Urgencia clínica («Superurgentes»): Compatibilidad ABO y prueba cruzada negativa con linfocitos T en sueros actual y recientes (6 meses, supuesto que el seguimiento es adecuado). - Hiperinmunizados: Compatibilidad ABO, prueba cruzada negativa con linfocitos T y B con los sueros del último año y una compatibilidad mínima establecida para cada caso (mínima 1 DR). - Lista regional pediátrica: Los requisitos específicos para cada paciente estarán registrados en una ficha donde se detallarán las condiciones a reunir por el órgano con respecto al peso y edad máximos del donante y el grado de compatibilidad HLA. Todos los laboratorios de histocompatibilidad de Andalucía disponen un suero reciente de cada paciente para realizar una prueba cruzada antes de ofrecer el órgano. Si existe compatibilidad ABO, se cumplen las condiciones específicas establecidas para cada caso y la prueba cruzada es negativa se ofertará el riñón para este receptor. Estos riñones se envían sin derecho a devolución. - Resto lista de espera (pacientes no prioritarios): Se aplica identidad de grupo ABO en el caso del grupo O y la compatibilidad para el resto (por tanto, los pacientes con grupo AB pueden recibir órganos de los grupos A, B y AB). Los pacientes no prioritarios se ordenan según su puntuación en 3 aspectos: a) Histocompatibilidad En el caso de pacientes con PRA < 50% en el último año 0 IC en DR+B+A 0 IC en DR+B 1 IC en DR+B 0 IC en DR + 2 IC en B 1 IC en DR + 1 IC en B 1 IC en DR 10 7 5 3 2 1 En el caso de pacientes con PRA > 50% en el último año, además, - Situación de 0 incompatibilidad en A+B: suma 3 puntos - Situación de 1 incompatibilidad en A+B: suma 1 punto b) Edad del donante /receptor Donante < 50 años / receptor < 40 años: se suman 2 puntos Donante de 60-69 años / receptor < 40 años: se restan 2 puntos Donante > 69 años: uso restringido a receptor >50 años. c) Antigüedad en lista de espera Se suma 0.5 puntos por cada año completo de estancia en diálisis. En retrasplantados, se restará tiempo de duración del (los) trasplante(s). 4. PROCEDIMIENTO PRÁCTICO DE SELECCIóN: Durante la alarma el inmunólogo de guardia introduce en el ordenador los datos clínicos y el tipaje del donante y los resultados de la prueba cruzada previa hecha con las dos placas que mantenemos actualmente: hiperinmunizados (PRA último año > 75%) e inmunizados (75% > PRA último año > 30%). De entrada se excluyen 1. Los pacientes con prueba cruzada previa positiva 2. Los receptores pediátricos que no cumplan los criterios preestablecidos 3. Los hiperinmunizados que no compartan 1 HLA-DR 162 4. Los pacientes que no estén incluidos en las placas y que presenten reiteradamente anticuerpos anti HLA frente a las especificidades HLA del donante en los sueros del último año. 5. Los pacientes de los que no se tengan recogidos sueros durante el último año. Como resultado se emite un listado de pacientes preseleccionados, que se compone de: - Datos del donante - Pacientes prioritarios de las tres primeras categorías mencionadas (superurgentes, hiperinmunizados e infantiles por este orden). - Pacientes no prioritarios ordenados según su puntuación. Partiendo de este listado de candidatos preseleccionados, el nefrólogo de guardia confeccionará un listado definitivo de candidatos. Es conveniente que se documente al máximo el proceso de decisión, mediante anotaciones en el listado de preselección que deben trasmitirse al inmunólogo de guardia, que debe justificar en la documentación informatizada de la selección los motivos por los que se descarta la inclusión en la lista definitiva de candidatos de cualquier paciente preseleccionado. El nefrólogo registrará los motivos de exclusión en el documento de alarma de trasplante de la historia clínica. Una vez confeccionado el listado de candidatos definitivos, el inmunólogo de guardia procederá a la realización de las pruebas cruzadas definitivas, en las cuales se incluirán al menos los siguientes sueros: 1. Suero pico, entendiendo como tal el que presenta la máxima PRA a los largo del tiempo de estancia en diálisis. Ante situaciones de sueros con PRA similar se escogerá el mas reciente. 2. Sueros de último año, depende de la recogida de sueros del paciente que se haya realizado durante este periodo, en los casos en que sea posible, se aconseja estudiar al menos 4 sueros recogidos con un intervalo de 3 meses, y cuando conste, seleccionar preferentemente los postrasfusionales. Actualizaciones en Trasplantes 2001. 3. Suero actual, el recogido durante la donación. En caso de pacientes con PRA negativas se pueden considerar actuales sueros recogidos hasta 3 meses antes de la donación, siempre que se tenga la certeza de que no han sido trasfundidos. 163 Algunas recomendaciones a tener en cuenta: A) Inmunológicas: 1. En caso necesario, pueden seleccionarse candidatos con 6 incompatibilidades («solo grupo ABO»), aunque en este caso, es preferible seleccionar pacientes con buen seguimiento de anticuerpos y no sensibilizados. 2. En caso de pacientes retrasplantados no es conveniente que reciban mas de 1 incompatibilidad en DR y si no se especifica lo contrario, no deberían recibir riñones que compartan DR no compatibles con el anteriormente rechazado; las repeticiones de incompatibilidades en HLA A y B son menos importantes, a no ser que haya habido sensibilización específica. 3. Los hiperinmunizados pueden trasplantarse con prueba cruzada histórica positiva en T o B (sueros > 1 año). Sin embargo, ante dos hiperinmunizados con prueba actual negativa, sería preferible seleccionar al que tenga prueba histórica negativa, con independencia de la compatibilidad (excepto 0 incompatibilidades) y antigüedad. Tanto en estos casos como en el de los retrasplantados con pérdida de órgano por causa inmunológica durante el primer año, se aplicará la inmunosupresión más potente del protocolo en vigor (pauta de pacientes de alto riesgo inmunológico). 4. El seguimiento inadecuado de anticuerpos anti-HLA crea incertidumbre acerca de la validez de la prueba cruzada, especialmente en pacientes con antecedentes de sensibilización. Por tanto, en igualdad de condiciones se relegará a estos pacientes respecto a los mejor seguidos. B) Clínicas 1. Información. La ausencia de información clínica suficiente es un motivo de exclusión para trasplante. Así, si no existe una ficha clínica recientemente actualizada y no es posible obtenerla de su centro de diálisis, puede decidirse no trasplantar al paciente. 2. Urgencia clínica. Aparte de la situación de URGENCIA CLÍNICA (los antes llamados superurgentes) definida antes, no tenemos establecida una escala concreta de valoración de urgencia. Al decidir entre receptores de similares características en otros aspectos, se dará preferencia a pacientes por dos posibles motivos: Problemas reiterados con el acceso vascular para hemodiálisis, que hagan temer una evolución a la situación de superurgente en un plazo corto. Problemas graves en diálisis que previsiblemente puedan mejorar o resolverse con el trasplante: por ejemplo, osteopatía grave por aluminio o amiloidosis de diálisis severa. 3. Compatibilidad de masas corporales. Este criterio se basa en la hipótesis de la oferta de masa nefronal de Brenner, según la cual no debería ponerse un único riñón con parénquima funcionante reducido a un receptor con necesidades elevadas. En la práctica nuestra postura debe ser evitar la colocación de órganos con parénquima presuntamente reducido a individuos con gran masa corporal. Por ejemplo, un órgano de donante de 6 años o de una donante de 50 Kg añosa o fallecida por AVC, no debería ser injertado a un varón de 90 Kg. El listado de preselección aporta la diferencia de pesos entre donante y receptor (lo ideal es una diferencia inferior a 10 Kg). 4. Prevención de problemas técnicos. En un reciente análisis en nuestro hospital, 164 la pérdida precoz por trombosis se asociaba a ciertos factores: donantes añosos con AVC, vasos múltiples, isquemias calientes largas y receptores con muchos años en diálisis (vasos ateromatosos). En la práctica, tras discusión con el urólogo, debe evitarse la acumulación de factores de riesgo. En particular debe eludirse la utilización de riñones con vasos múltiples en receptores con vasos previsiblemente en mal estado. No debe olvidarse que el objetivo final es contar con 2 pacientes con prueba cruzada actual negativa y en disposición clínica para recibir un trasplante, por cada riñón disponible. 5. CASOS ESPECIALES - Órganos HBsAg positivos. Pueden usarse en pacientes HBsAg positivos. Es necesario realizar marcadores de virus delta en sangre del donante, que deben ser negativos. En caso de desconocerse el virus delta los órganos pueden emplearse exclusivamente en pacientes que ya son portadores conocidos del virus delta. El paciente debe ser informado de esta circunstancia, que se hará constar en la autorización de trasplante, con el siguiente añadido al texto habitual: «He sido informado de que el donante era portador del virus de la hepatitis B y que no puede descartarse totalmente algún efecto perjudicial por ello. Acepto los riesgos potenciales derivados de este hecho.» - Órganos anti-VHC positivos. Es muy controvertido el uso de riñones procedentes de donantes anti-VHC positivos; en la mayoría de los centros españoles no se aceptan, aunque hay experiencia relativamente extensa en nuestro país con resultados (a corto-medio plazo) equivalentes a los de riñones VHC negativos10. Las condiciones de uso son: Actualizaciones en Trasplantes 2001. - En pacientes anti-VHC positivos por RIBA en determinaciones reiteradas, que sean repetidamente PCR positivos y sin indicación de tratamiento antiviral o sin respuesta al mismo. Debería disponerse de una biopsia hepática reciente con ausencia de cirrosis y sin actividad histológica muy elevada (que contraindicaría el trasplante en cualquier caso). 165 Debe existir autorización expresa por parte del paciente; los pacientes que aceptan actualmente este tipo de órganos están consignados en una lista nominal y en la base de datos de la lista de espera. Tanto al registrarlo en lista de espera como paciente que acepta este tipo de órganos, como en el momento del trasplante, firmará un addedum al permiso habitual, según el texto establecido. Es conveniente un grado elevado de compatibilidad, aunque no es imprescindible sobre todo si se dispone de un donante óptimo. Si se trata de una oferta de otro centro extractor, no se aceptarán órganos de donantes subóptimos (> 60 años; extracción en parada, etc.). 6. RESULTADOS INICIALES Desde la puesta en marcha de los nuevos criterios de selección (mayo de 2000) se han realizado un total de 24 implantes en pacientes no prioritarios con la siguiente distribución por grupos sanguíneos: 13 de grupo A, 3 de grupo B y 8 de grupo O. No se han tenido en cuenta los riñones de grupo AB en el análisis preliminar porque la lista de espera de pacientes AB es escasa o nula, con lo que la posibilidad de selección es muy limitada. Se analizaron las características de tiempo de espera y compatibilidad HLA de los pacientes trasplantados utilizando estos criterios de selección. Como control se utilizó un grupo de 24 pacientes trasplantados (11 de grupo A, 3 de grupo B y 10 de grupo O) para los que se habían aplicado los criterios anteriormente vigentes en la selección: fundamentalmente listado por compatibilidad HLA modificado, hasta cierto punto, por la antigüedad en lista de espera (recomendación de inclusión en la selección de pacientes con mas de 10 años en lista de espera) y la edad del riñón (en general asignación de riñones añosos a receptores añosos y de riñones jóvenes a pacientes jóvenes). Tiempo medio de espera de los pacientes trasplantados El tiempo medio de espera de los pacientes trasplantados con los nuevos criterios fue de 6.3 años, mientras que en el grupo control había sido de 2.8 años. En cuanto a los tiempos de espera medio de los pacientes trasplantados según su grupo sanguíneo, para los 13 pacientes de grupo A que se trasplantaron siguiendo los nuevos criterios el tiempo medio de espera fue de 3 años, mientras que para los 11 pacientes del mismo grupo que se trasplantaron siguiendo los criterios anteriores había sido de 2 años. Para los 3 pacientes de grupo B que se trasplantaron con los nuevos criterios el tiempo medio de espera fue de 2 años, mientras que para los 3 pacientes de grupo B trasplantados con criterios antiguos había sido de 5 años. Por último, para los 8 pacientes de grupo O que se habían trasplantado con los nuevos criterios el tiempo media de espera fue de 14 años, mientras que para los 10 trasplantados con criterios antiguos había sido de 3 años Grado de compatibilidad HLA El grado medio de compatibilidad HLA con el que se trasplantaron los 24 pacientes siguiendo los criterios nuevos fue de 1.25 puntos de compatibilidad HLA, lo que equivale aproximadamente a 1 incompatibilidad en HLA-DR y 2 incompatibilidades en HLA-B, mientras que en los 24 implantes anteriores el grado medio de compatibilidad HLA había sido de 3 puntos, lo que equivale a 0 incompatibilidades HLA-DR y 2 incompatibilidades en HLA-B. Por grupos sanguíneos, para los pacientes de grupo A que se trasplantaron siguiendo los nuevos criterios el grado medio de compatibilidad HLA fue de 1.5 puntos (1 incompatibilidad en HLA-DR y 2/1 incompatibilidades HLA-B), mientras que para el grupo control había sido de 3.2 puntos (0 incompatibilidades HLA-DR y 2 incompatibilidades HLA-B). Para los pacientes de grupo B que se trasplantaron siguiendo los nuevos criterios el grado medio de compatibilidad HLA fue de 1.3 puntos (1 incompatibilidad DR y 2 incompatibilidades HLA-B), mientras que para los pacientes del grupo control había sido de 2.3 puntos (1 incompatibilidad HLA-DR y 1 incompatibilidad HLA-B). Por último, para 166 los pacientes de grupo O que se trasplantaron siguiendo los nuevos criterios el grado medio de compatibilidad fue de 0.9 (1 incompatibilidad HLA-DR y 2 incompatibilidades HLA-B), mientras que para los pacientes del grupo control había sido de 3 puntos (0 incompatibilidades HLA-DR y 2 incompatibilidades HLA-B). CONCLUSIONES PRELIMINARES Aunque el número de implantes realizados siguiendo los nuevos criterios de selección es todavía escaso para extraer conclusiones, de forma preliminar, se observa que se están trasplantando pacientes con largos tiempos de espera, sobre todo en el caso de los pacientes de grupo 0 sin cambios significativos en el grado de compatibilidad HLA. Además, la informatización de todos los criterios que se aplican en la preselección de los pacientes permite una mayor uniformidad de aplicación de los mismos. Por último, y sin descartar que sean necesarios algunos ajustes en el sistema de puntuación, este parece bastante ajustado a la realidad, ya que en 14/16 (87.5%) de los casos en los que se disponía de varios receptores con prueba cruzada negativa se decidió trasplantar a los que tenían mayor puntuación. Actualizaciones en Trasplantes 2001. Bibliografía 167 1. The national impact of the 1995 changes to the UNOS renal allocation system. United Network for Organ Sharing. Leffell MS, Zachary AA. Clin Transplant, 1999, 13: 287-95. 2. A new national allocation scheme for adult kidneys in the United Kingdom. Fogle SV, Belger MA, Jonhson RJ, Ray TC, Morris PJ. Clin Transpl 1998, 107-113. 3. The new Eurotransplant Kidney Allocation System: report one year after implementation. Eurotransplant International Foundation. De Meester J; Persijn GG; Wujciak T; Opelz G; Vanrenterghem Y. Transplantation, 1998, 66: 1154-9. 4. Factores pronósticos en el trasplante renal. Tesis doctoral. J.L. Rocha. Sevilla, 1998. 5. Trasplante renal en Andalucía, 1985-1990. Informes Técnicos, nº 11. M.A. Gentil, F. Sánchez. Edit. Consejería de Salud, Junta de Andalucía, 1992. 6. Documento de consenso. Trasplante renal en pacientes de edad avanzada con un riñón de donante añoso. J.M. Morales, A. Andrés, L. Pallardó, L. Capdevila, J.M. Campistol et al. Nefrología, 1998, 18 (suplemento 5): 32-46. 7. Senior citizens pool for aged kidneys. Gjertson DW; Terasaki PI; Cecka JM; Takemoto S; Cho YW. Transplant Proc, 1997, 29: 129. 8. Renal transplantation in recipients over the age of 60: the impact of donor age.Basar H; Soran A; Shapiro R; Vivas C; Scantlebury VP; Jordan ML; Gritsch HA; McCauley J; Randhawa P; Irish W; Hakala TR; Fung JJ. Transplantation, 1999, 67: 1191-3. 9. La edad del donante como determinante de la supervivencia del trasplante renal de cadáver. M.A. Gentil, J.L. Rocha, G.R. Algarra, P. Pereira, R. Lopez, J. Muñoz, M. Naranjo, J. Mateos. XXVIII Congreso de la Sociedad Española de Nefrología, Sevilla, 1998. 10. Transplantation in the patient with hepatitis C. Morales JM, Campistol JM. J Am Soc Nephrol, 2000, 11: 1343-53. LA MEDICINA NUCLEAR EN EL SEGUIMIENTO DEL TRASPLANTE RENAL Tirado, J.L.; Rodríguez, J.R. Servicio de Medicina Nuclear El paciente trasplantado renal está sometido, especialmente durante el postoperatorio inmediato, a múltiples complicaciones que hacen necesario un control estrecho de distintas variables. A pesar de todo, no existe todavía un método ideal para el seguimiento de la función renal. El renograma isotópico es un método no invasivo introducido por Taplin en 1956, que permite documentar los cambios en la perfusión y función renal, independientemente de la función de los riñones nativos, por lo que desde su implantación se ha empleado para el control del injerto renal. En nuestro servicio empleamos el 99mTc-MAG3 como radiofármaco de elección para la realización del renograma, usando en adultos una dosis de 148 MBq. Es necesario que el paciente este bien hidratado y con la vejiga vacía antes de comenzar el estudio. La adquisición se realiza en una gammacámara dotada de un colimador de propósitos generales para baja energía, situado en región anterior de abdomen, de forma que incluya aorta abdominal, injerto y ambas ilíacas. Se administra el fármaco en bolo por vía intravenosa, con adquisición simultánea en ordenador de una fase dinámica rápida (30 imágenes de 2 segundos) para valorar la fase vascular y otra lenta (50 imágenes de 20 segundos) para la fase parenquimatosa y de drenaje. Ocasionalmente se realizan imágenes tardías para valorar la existencia de fugas, o bien se realiza un estudio más largo cuando se pretende valorar la existencia de obstrucción con furosemida (0.5 mg/kg) o la respuesta a IECA (25-50 mg de captopril) cuando se quiere descartar estenosis de la arteria renal. A partir de estas imágenes se generan curvas actividad tiempo mediante regiones de interés localizadas en el trasplante con sustracción de fondo y en aorta. Tradicionalmente se distinguen tres fases en el renograma: vascular, tubular y de drenaje. El 99m-Tc MAG3 es captado de forma homogénea y rápida por el injerto, de manera que prácticamente coincide el pico de actividad con el de aorta. A continuación se produce la fase tubular, que incluye la secrección y el tránsito intrarrenal, que alcanza un máximo de actividad antes de los 5 primeros minutos, en el cual comienza a apreciarse eliminación vesical, que corresponde con la fase de drenaje. De las curvas actividad tiempo pueden obtenerse diversos parámetros que han sido 168 utilizados para la cuantificación del renograma, siendo el tiempo pico y medio de eliminación, junto con el porcentaje de captación riñón/fondo los más empleados. Con fines didácticos podemos dividir las posibles complicaciones en tres grupos: prerrenales, renales y postrrenales. Complicaciones prerrenales: - Oclusión vascular. Es una complicación infrecuente que aparece en el postoperatorio inmediato y se observa en las imágenes un defecto de captación en el área del injerto. - Estenosis de la arteria. Suele localizarse sobre el sitio de la anastomosis y ocurre entre el 3-10% de los trasplantes. Según la severidad en el renograma produce un retraso en la fase vascular. El renograma antes y después de la administración de inhibidores de la ECA puede ayudar a su diagnóstico, permitiendo diferenciar entre estenosis funcionales de las que no lo son. Complicaciones renales: - Rechazo hiperagudo. Muestra un patrón indistinguible a la oclusión vascular. - Necrosis tubular aguda. Presenta una perfusión y captación sin cambios respecto al estudio inicial, con progresiva acumulación y retraso en la secrección del radiofármaco. - Rechazo agudo. El patrón es similar a la necrosis tubular, pero con perfusión alterada. El empeoramiento en la perfusión y captación respecto al estudio previo también pueden indicar rechazo. - Nefropatía por ciclosporina. Disminuye la perfusión y captación del trazador, hasta el punto que puede simular un rechazo agudo. - Enfermedad crónica. Ya sea por rechazo, toxicidad por ciclosporina o enfermedad del injerto, se produce un deterioro progresivo en la perfusión y captación del trasplante. - Infarto. Los infartos segmentarios se observan como lesiones frías, a veces con un anillo de hipercaptación que indica reacción inflamatoria. Actualizaciones en Trasplantes 2001. Complicaciones postrrenales: 169 - Obstrucción. En fases precoces se observa un aumento de tamaño de la pelvis renal y ectasia del radiofármaco, sin cambios en la perfusión. Es en esta fase cuando el renograma diurético con furosemida es útil, ya que ayuda al diagnóstico diferencial con otras causas no obstructivas. - Fuga urinaria. Se observa un acúmulo anormal del radiofármaco fuera del tracto urinario, que aumenta progresivamente con el tiempo. Bibliografía: · · · · Eva V. Dubovsky, Charles D. Russel and Belkis Erbas: Radionuclide evaluation of renal transplants. Semin Nucl Med 18:181-198, 1998 Eva V. Dubovsky, Charles D. Russel and Belkis Erbas: Radionuclide evaluation of renal transplants. Semin Nucl Med 14:49-59, 1995 Eddy K. Dunn: Radioisotopic evaluation of renal transplants. Urol Radiol 14: 115-126, 1992 Henrik S. Thomsen: Renal trasplant evaluation. Nuclear medicine in clinical diagnosis and treatment. Churchill Livingstone Vol 1: 339-351, 1994 PROTOCOLO DEL TRASPLANTE RENAL PEDIÁTRICO J. Fijo, A. Moreno, A. Sánchez, R. Bedoya, A. Caraballo, J. Martín Govantes Unidad de Nefrología Pediátrica. Hospital Infantil. Introducción: El TRASPLANTE RENAL (TR) es, sin lugar a dudas, la mejor terapeútica posible de la Insuficiencia renal crónica (IRC) ya que substituye completamente la función renal y no de forma parcial como todos los métodos actuales de diálisis. En la infancia lo es de forma especial, porque posibilita el crecimiento y proporciona mayor grado de rehabilitación. En nuestro país, según el Registro Nacional de niños en Insuficiencia renal terminal (IRT), ha experimentado un espectacular incremento en los últimos años, sólo frenado por la persistente escasez de órganos de cadáver. Probablemente son varios los factores que explican este incremento, pero no cabe duda que el convencimiento de los nefrólogos respecto al aserto con el que iniciábamos esta introducción es la causa primordial. No obstante, si tuviéramos que elegir algún factor individual que, junto a la citada disposición al TR, justifique este incremento, la elección recaería en los avances obtenidos en el campo de la inmunosupresión (IS), fundamentalmente desde la introducción de la Ciclosporina (CyA). El presente protocolo seguido en nuestra unidad se basa en la utilización de CyA o Tacrolimus como pilar fundamental de IS, asumiendo por tanto todas las modificaciones que estas drogas han provocado en el campo de la inmunología del TR, que llegan incluso a afectar las tradicionales barreras del HLA, sin perjuicio de admitir futuros cambios que vengan soportados por la mayor experiencia clínica. Se ha estructurado el protocolo siguiendo un enfoque que podemos calificar de cronológico, y así discutiremos los apartados que aparecen en el siguiente índice: 1. Medidas pretrasplante renal en niños. 2. Criterios de exclusión para el trasplante. 2.1. Exclusión absoluta. 2.2. Exclusión temporal. 170 3. Criterios para la elección donante-receptor. 3.1. Donante vivo. 3.2. Donante cadáver ideal. 3.3. Donante cadáver marginal. 3.4. Criterios de compatibilidad. 4. Intervención quirúrgica. 4.1. Requisitos legales. 4.2. Preparación del paciente. 4.3. Estudios complementarios. 4.4. Intervención quirúrgica. 4.5. Postoperatorio inmediato. 5. Inmunosupresión. 5.1. Definiciones previas. 5.2. Medicamentos inmunosupresores: 5.2.1. Esteroides. 5.2.2. Anticuerpos monoclonales anti-receptor IL-2. 5.2.3. Ciclosporina. 5.2.4. Tacrolimus. 5.2.5. Micofenolato Mofetil. 5.3. Pautas. 6. Seguimiento y controles. 1.Medidas pretrasplante renal en niños. Actualizaciones en Trasplantes 2001. A veces, no se puede llevar a cabo un TR una vez agotado el tratamiento conservador por dos razones fundamentales: 171 - Contraindicación temporal impuesta por la propia enfermedad: Sínd. HemolíticoUrémico (SHU), Glomerulonefritis rápidamente progresiva (GNRP),... - Necesidad de practicar actuaciones médico-quirúrgicas obligatorias: vacunaciones, corrección de anomalías urinarias,... Así, durante el tratamiento dialítico y cara al TR es preciso garantizar los siguientes puntos: - Corrección de malformaciones urológicas. - Cumplimiento del calendario vacunal y especialmente contra el VHB y varicela si no se ha padecido. Después de la vacuna de varicela, esperar al menos dos meses para trasplantar (virus vivos). - Determinación cada tres meses de anticuerpos citotóxicos, y 15 días después de cada transfusión. 2. Criterios de exclusión del TR. 2.1.EXCLUSIÓN ABSOLUTA: Cada día se han ido restringiendo más, quedando en la actualidad limitada a las tres siguientes situaciones: 1) Retraso mental profundo: Sería adecuado contar con el informe de Neurología y/ o Psiquiatría de tal condición ya que, en la práctica, no hay normativa legal sobre este asunto. 2) Enfermedad maligna diseminada. 3) Infección por VIH. 2.2. EXCLUSIÓN O CONTRAINDICACIÓN TEMPORAL (C.T.): 1) Enfermedad causal: SHU y GNRP idiopática, imponen una CT de al menos 6 meses desde el episodio agudo. 2) Malformaciones urológicas, hasta la corrección quirúrgica de las anomalías del tracto urinario inferior o hasta recibir como en el resto de los casos- el Vº Bº por Urología. 3) Vacunaciones con virus vivos atenuados (Triple vírica): seis meses de CT. 4) El peso inferior a 10 Kilos constituye una contraindicación relativa: siempre que sea posible debe iniciarse un tratamiento dialítico y una conducta nutritiva agresiva hasta alcanzar este límite de peso. 3.Criterios de elección donante-receptor. 3.1. DONANTE VIVO: Aunque en todas las estadísticas los resultados son mejores al utilizar órganos de donante vivo emparentado, esta diferencia no justifica, en nuestra opinión, la utilización sistemática de riñones de esta procedencia. Los casos en que estaría justificada serían: - Larga permanencia en diálisis. - Ofrecimiento reiterado y comprobado por parte del padre o de la madre. - Criterios de compatibilidad (retrasplante en respondedores). 3.2. DONANTE CADÁVER IDEAL: Donante con edad comprendida entre 3 y 50 años, que no padece enfermedad renal 172 conocida, HTA ni diabetes y en cuyo exitus no hayan concurrido alguna de las circunstancias siguientes: - Sepsis. - Infección vírica (especialmente VIH o factores de riesgo para padecerla). - Neoplasias o historia anterior de neoplasias, exceptuando las limitadas al SNC con criterios histológicos de benignidad. - Inestabilidad hemodinámica documentada durante el proceso diagnóstico de muerte cerebral y hasta la extracción. - Isquemia fría superior a 36 horas. 3.3. DONANTE CADÁVER MARGINAL: Aquel con edad superior a 50-60 años o inferior a 3. Anencéfalos: Los riñones procedentes de donantes menores a 3 años, presentan un índice de fallo primario superior al resto; esta circunstancia es más acusada en anencéfalos, cuyos órganos son , además, frecuentemente displásicos. Por todo lo anterior, los riñones procedentes de donantes marginales deben aceptarse para situaciones de urgencia o largas estancias en la lista de espera. 3.4. CRITERIOS DE COMPATIBILIDAD: La compatibilidad HLA ha sido muy debatida en la era de la CyA. De los estudios realizados en grandes series de enfermos, parecen deducirse los siguientes puntos: 1. A corto plazo (2 años), la diferencia fundamental radica entre 0 y 6 compatibilidades. Cualquier otro grado de compatibilidad que se considere ofrece diferencias inferiores al 10%. Actualizaciones en Trasplantes 2001. 2. A largo plazo (10 años o más), la diferencia es francamente favorable al TR con mayor compatibilidad, especialmente en B y DR. 173 3. En cualquier caso, el argumento más relevante y definitivo contra una muy buena compatibilidad es el largo plazo de espera necesario para lograrla. Por lo tanto, en el TR pediátrico, habrá siempre que individualizar la compatibilidad exigida, considerando los mejores resultados frente al deterioro físico y psíquico del niño en diálisis. Con todas las consideraciones anteriores, podemos resumir los CRITERIOS DE ELECCIÓN DE DONANTE-RECEPTOR de la siguiente forma: 1. Niños estables prediálisis, o con buena tolerancia a la diálisis y un plazo de tratamiento dialítico menor a 6 meses: riñón de cadáver ideal, con buena compatibilidad (1 haplotipo o 2 DR) 2. En cualquier otro caso: donante cadáver entre 3 y 55 años, con grupo sanguíneo y crossmatch (-) Considerar relación de tamaño injerto/receptor. 3. Hiperinmunizados y retrasplantes: grupo sanguíneo, 1 DR y crossmatch (-) actual; si hay positividad en suero histórico, aceptar siempre que sea para linfocitos B y de un plazo superior a 6 meses. 4. En largas esperas, considerar TR de donante vivo. 4. Intervención quirúrgica. 4.1. REQUISITOS LEGALES: Antes de proceder a la intervención, debe obtenerse el consentimiento escrito de la persona con autoridad legal para ello. El documento debe recoger explícitamente que se han comunicado los riesgos, tanto actuales como futuros. 4.2. PREPARACIÓN DEL PACIENTE: - Exámen físico y anamnesis que descarte contraindicación actual. Debe incluir: peso, talla, diuresis residual, tensión arterial decúbito y ortostática, frecuencia cardíaca. Rasurar pubis. Enema de limpieza. - Enfermo en HEMODIÁLISIS: dializar siempre. - Enfermo en DIÁLISIS PERITONEAL: practicar el mayor número de intercambios posibles hasta el momento del TR. Vaciar la cavidad peritoneal, retirar líneas y bolsas y pesar con el abdomen vacío. - Si la intervención se va a demorar unas horas, prescribir sueroterapia intravenosa para evitar deshidratación con ayunas prolongadas, sobre todo en enfermos con diuresis residual cuantiosa. Prescribir las necesidades basales más la diuresis. - Colocar vendaje protector de la fístula arterio-venosa. 4.3.EXÁMENES COMPLEMENTARIOS: - Determinaciones urgentes: hemograma, EAB, urea, iones, proteínas totales, glucemia, calcio, estudio de coagulación, Rx de tórax y abdomen, cultivo de orina, líquido peritoneal y orificio de salida del catéter peritoneal. Si hay diuresis residual, orina basal con proteinuria, iones, creatinina y urea. - Pruebas cruzadas para 2 unidades de sangre total. - Determinaciones no urgentes: Extraer sangre y conservar centrifugada si no puede cursarse inmediatamente, para: Enzimología hepática, ácido úrico, proteinograma, colesterol, triglicéridos, fósforo, fosfatasas alcalinas, serología virus del TR y PTH. 4.4.INTERVENCIÓN QUIRÚRGICA: Durante esta fase el papel del nefrólogo es secundario. Procuramos insistir en los siguientes puntos: 174 - Monitorización de PVC, que debe ser mantenida en todo momento >5 cms de agua (ideal entre 7 y 12). - Mucha atención al momento de desclampar: la arteria de un riñón adulto puede secuestrar bruscamente 250-300 cc de sangre, que supone ¼ a 1/3 de la volemia de un niño entre 11 y 15 Kg de peso. Administrar antes de desclampar: Manitol al 10%, de 250 a 300 cc./1,73 m2, IV Metilprednisolona 15 mg/kg IV. En niños menores a 20 Kg, con trasplante de donante adulto, valorar transfundir 250 cc de sangre total. Tras desclampar: Furosemida 2 mg/kg, IVD. - Recoger y anotar aspectos quirúrgicos de interés posterior: tiempo de isquemia caliente, recoloración total o parcial del órgano, peritoneo intacto o no, diuresis en quirófano, colocación de tutor ureteral y/o sonda de cistostomía (importante en los niños, al no admitir su uretra una sonda de buen calibre)... - Realizar cultivos (bacterias, hongos) del líquido de perfusión en que se ha conservado el riñón. 4.5.POSTOPERATORIO INMEDIATO: - Enfermo en UCI durante 24 horas como mínimo. En las primeras horas realizar controles de T.A., PVC, pulso y diuresis cada media hora, después cada hora. - Demorar la hemodiálisis todo lo clínicamente posible. - Líquidos: en general, pauta de IRA (30-40 cc / kg / 24 h + pérdidas urinarias + pérdidas digestivas y por drenajes), con la precaución de realizar la recuperación de pérdidas urinarias con suero fisiológico diluído en agua destilada, si la diuresis horaria es importante, para evitar diuresis osmótica por exceso de glucosa. En general, pretendemos: Conseguir un estado de hiperhidratación sin comprometer la función cardíaca. Actualizaciones en Trasplantes 2001. Mantener cifras de T.A. en el P95 de la normalidad. 175 Mantener PVC > 5 cms. de agua. Si es necesario infundir seroalbúmina o sangre. - No usar drogas nefrotóxicas (antibióticos, diuréticos) salvo que sean imprescindibles. Como profilaxis antibiótica, usar Cefalosporinas. - Sedantes y/o ansiolíticos: no usar fenitoína ni fenobarbital; en caso de necesitar sedación, usar hidrato de cloral, ácido valproico o diazepan. - Analgésicos a criterio médico. En general usamos NOLOTIL® (Metamizol) IV a dosis de 25 mg/kg/dosis (1 amp. de 5 cc tiene 2 g) y ADOLONTA ® (Tramadol) a 1-1,5 mg/Kg de peso y dosis (1 amp.=100 mg). - Dieta absoluta hasta que inicie movimientos intestinales. Después dieta con aporte de líquidos en función de la diuresis, y de iones según las pérdidas urinarias. - Medidas de asepsia extrema. - No levantar apósitos, a menos que estén muy manchados, hasta pasadas 24 horas de la intervención, para evitar contaminación de la herida. - Explorar el estado de hidratación, auscultación CR, perfusión, pulsos, peristáltica intestinal y buscar clínica de trastornos hidroelectrolíticos (vigilar ECG). Realizar balances hídricos horarios durante las primeras horas posttrasplante. - Cultivos líquido de drenaje y orina a las 24 horas. - Hemocultivo si la temperatura es superior a 38º C. - Controles analíticos de sangre y orina cada 12 horas los primeros días. Posteriormente cada 24 horas. - Rx tórax cada 24 horas. - Ecografía-doppler a las 24 horas de la intervención y estudio con radioisótopos del injerto (MAG-3) en la primera semana (antes si complicaciones). - Peso diario. - Iniciará deambulación a las 48-72 horas. - ECOGRAFÍA antes del alta. 5.Inmunosupresión. 5.1.ALGUNAS DEFINICIONES PREVIAS: - Fases de alorreactividad: - Fase de inducción: Momento donde la alorreactividad es más acusada. Porcentualmente registra la mayor incidencia de complicaciones inmunológicas (rechazo agudo); suele complicarse con infecciones bacterianas de la herida o pulmonares. Se extiende por espacio de unas seis semanas. - Fase de adaptación: Se estiende hasta los primeros seis meses del TR. La incidencia de rechazos es importante aunque inferior a la precedente. Respecto a las complicaciones infecciosas, suelen presentarse con frecuencia infecciones por gérmenes oportunistas y virus inmunomoduladores (hepatitis, CMV...) y entre las bacterianas son frecuentes las infecciones urinarias (ITU). - Fase de mantenimiento: En ella la función del injerto suele ser estable. Los 176 deterioros de la misma suelen deberse a nefropatía tóxica por CyA o nefropatía crónica del injerto. Destacan las ITU y las infecciones de la comunidad, ya que las dosis de IS son menores, aunque estas últimas pueden tener una presentación y evolución atípicas. - Riesgo inmunológico: Pueden distinguirse dos situaciones: - Enfermos de bajo riesgo inmunológico: primer TR, no sensibilizados. - Enfermos de alto riesgo inmunológico: retrasplantes, hiperinmunizados. 5.2.MEDICACIÓN INMUNOSUPRESORA: En su uso hemos de buscar la IS clínica que permita que el injerto sea aceptado, sin llegar a una inmunodeficiencia que facilite complicaciones, principalmente infecciosas o tumorales, que comprometan la vida del paciente, y todo ello con la menor toxicidad y/o efectos secundarios debidos a dichos fármacos IS. Por ello, las estrategias actuales de tratamiento buscan aprovechar la actividad sinérgica de distintos agentes IS, para poder así disminuir sus dosis individuales a fín de evitar es tos efectos. Nuestro protocolo actual de tratamiento se basa en la asociación de: - Anticuerpos monoclonales anti-receptor de IL-2. - Ciclosporina o Tacrolimus: en general, usamos Ciclosporina de entrada, cambiando a Tacrolimus si aparecen efectos secundarios (frecuentes en los niños las hipertricosis importantes) o rechazos. - Micofenolato Mofetil y - Prednisona. 1) Anticuerpos monoclonales quiméricos anti-receptor de IL-2 (Basiliximab, Simulect®): con sólo un 30% de su estructura de origen murino, presenta una alta afinidad para la cadena a del receptor de IL-2, impidiendo la unión de esta citoquina con dicho receptor. Actualizaciones en Trasplantes 2001. Dosis= 12 mg/m2 vía IV (puede ser periférica), disuelto además de en su diluyenteen 50 cc. de suero fisiológico o glucosado al 5%, a pasar en 30 min. dos dosis: la primera en las dos horas previas al trasplante, y la segunda el día 4 post-trasplante. 177 2) Ciclosporina (Sandimmun Neoral®): Inhibe la actividad fosfatasa de la Calcineurina y con ello- las señales calcio-dependientes que intervienen en la activación del linfocito T mediante la transcripción del RNA para la síntesis de citoquinas (principalmente IL-2). Indicada en todas las fases de inmunosupresión. Su nefrotoxicidad es el principal problema, incrementándose con tiempos de isquemia prolongados y con el uso concomitante de otras drogas nefrotóxicas. Otros efectos colaterales: Tumores malignos, intolerancia a la glucosa, aumento de colesterol y triglicéridos, hiperuricemia, hipomagnesemia, hipertricosis, temblor distal, hiperplasia gingival, hiperestesia de las manos, sínd. neurológicos, anemia,... Dosis inicial: 1 mg/kg/12 h. IV en 2-4 horas, diluidos en 100 cc. de S. Glucosado al 5% o fisiológico, iniciando el tratamiento antes del trasplante. Tan pronto como sea posible pasar a vía oral, a dosis de 7-8 mg/Kg/d, repartidos en 2 tomas (en 3 cuando el peso del receptor sea inferior a 25-30 Kg). Ajustar para mantener niveles valle en sangre total (RIA monoclonal) entre 150-200 ng/ml. el primer año; después entre 125-150 ng/ml. 3) Tacrolimus (Prograf®): Interactúa con la calcineurina inhibiéndola de forma similar a la Ciclosporina. Se metaboliza mediante el citocromo P-450 hepático, pudiendo actuar sobre sus niveles plasmáticos aquellos medicamentos que inhiban o induzcan dicho citocromo. Mínimo aclaramiento renal. No es dializable en caso de sobredosificación. Utilizado también en tratamiento de rescate tras rechazo agudo. Dosis: 0,15-0,30 mg/Kg/d, divididos en 2 tomas, para mantener niveles plasmáticos basales entre 5 y 10 ng/ml. Posibles efectos indeseables: Infecciones, disfunción renal, hiperglucemia y diabetes, trastornos neurológicos (temblor, cefaleas, insomnio, parestesias,..),HTA, anemia, alteraciones linfoproliferativas, alteraciones electrolíticas,... 4) Micofenolato Mofetil (Cellcept®): Es un éster del ácido Micofenólico en el que se convierte tras la ingestión. Inhibe la síntesis de novo de las purinas, única vía utilizada por los linfocitos y monocitos, de ahí su carácter selectivo sobre estas células, inhibiendo su proliferación y expansión clonal. Presenta circulación entero-hepática y el 87% se elimina por orina. No es dializable excepto pequeñas cantidades con concentraciones plasmáticas muy altas. Dosis: 25-30 mg/Kg/d (750-800 mg/m2/d), asociado con Ciclosporina. 15-18 mg/Kg/d (550-560 mg/m2/d), asociado con Tacrolimus Nos sirven de guía niveles plasmáticos basales de ácido Micofenólico entre 2 y 5 microg/ml. Principales efectos secundarios: anemia, leucopenia, diarreas, infecciones,... La dosis inicial debe darse oral dentro de las 48-72 horas post-trasplante, siendo recomendable administrarlo con el estómago vacío. 5) Esteroides: Inhiben, fundamentalmente, la síntesis de IL-1 (que activa las células Thelper) e IL-6 (que activa los linfocitos B). Se emplea Prednisona o Metil-prednisolona. Son el tratamiento de elección de las crísis de rechazo agudo. Son útiles durante la fase de inducción, adaptación y, más discutible, durante el mantenimiento. Se ligan a proteínas plasmáticas de forma saturable y por ello, los enfermos hipoproteicos están en mayor riesgo de toxicidad. Son dializables. Sus efectos secundarios son bien conocidos. Dosis: 6-Metil-prednisolona, IV, durante los primeros días, en 4 (primeras 48 h),3 ó 2 dosis diarias, hasta un total de 2 mg/Kg/d (máximo 60 mg/d). 178 Cuando el paciente tolere la alimentación, Prednisona, 2 mg/Kg/d (máx. 60 mg/ d); en una dosis por la mañana, a partir de la primera semana. 2ª semana: a 1,5 mg/Kg/d A los 15 días: 1 mg/Kg/d Al mes: 0,75 mg/Kg/d A los dos meses: 0,5 mg/Kg/d A los tres meses: 0,25 mg/Kg/d Desde los seis meses: 0,25 mg/Kg/48 horas. Actualizaciones en Trasplantes 2001. 5.3.MEDICACIÓN COADYUVANTE: 179 - Antibioterapia profiláctica con Cefotaxima, 1 g/1,73 m2 ,una sola dosis previa a la intervención quirúrgica, ajustándola a la insuficiencia renal. - Ranitidina profiláctica: 1 mg/Kg/dosis, cada 6 horas, IV, pasar a vía oral en una o dos dosis cuando tolere alimentación. - Analgésicos, como comentamos anteriormente. - Nifedipina, 5-10 mg/12 horas - Trimetropin-Sulfametoxazol, 2,5 - 5 cc de Septrínâ, cada 12 horas, oral, de forma profiláctica durante los 3 primeros meses. - Nistatina (Mycostatín®) 1 cc. cada 6 horas, vía oral, de forma profiláctica, durante los primeros 3 meses. - Profilaxis del CMV en todos los pacientes: Inmunoglobulina humana anti-CMV (Cytotect-Biotest®). Dosis de 1 cc/Kg diluídos en, al menos, la misma cantidad de suero fisiológico, IV, a un ritmo máximo de 1 ml/min. Utilizamos una dosis semanal durante las tres primeras semanas, seguidas de la misma dosis a intervalos de 21 días, durante los tres primeros meses. Los receptores CMV (-) que reciben injertos de donantes CMV(+), realizarán además tratamiento con Aciclovir oral, a dosis de 40 mg/Kg/d, repartidos en 3 tomas diarias, durante los tres primeros meses. La dosis debe ser ajustada a la función renal. 6.Seguimiento y controles. En general, tras el alta y con función renal estable, vigilar cada semana las dos primeras semanas; cada 15-20 días los tres primeros meses y mensualmente, al menos, hasta el año. Prestar especial atención a la velocidad de crecimiento. Protocolos de Enfermería en la Unidad de Trasplante Renal Mª José Escobar García. Coordinadora de Enfermería Antonio Velasco Méndez. Supervisor de Enfermería. Servicio de Nefrología. INTRODUCCION. La historia del trasplante renal,aunque breve, permite apreciar en toda su dimensión el esfuerzo científico llevado a cabo para comprender el fenómerno responsable de la pérdida de la mayoría de los injertos: la reacción del rechazo.La comprensión de los mecanismos genéticos y las reacciones histoquímicas responsables de la crisis de rechazo ha permitido diseñar estrategias para evitarlas,o tratarla con eficacia, minimizando el número y gravedad de las complicaciones. Todo ello ha hecho del trasplante renal la alternativa terapéutica a la insuficiencia renal terminal que complementándose con diálisis permite alcanzar supervivencias prolongadas gozando de una elevada calidad de vida. (Márius Morlans) La Unidad de Trasplante Renal. Consta de : - 2 habitaciones para aislamiento con: - Cristales que permiten la visualización del paciente en todo momento. - Ttº de agua y monitor para Hemodiálisis. - 1 habitación para aislamiento con: - Ttº de agua y monitor de hemodiálisis. - 2 habitaciones con 2 camas cada una, sin cristales. - 1 habitación de Pruebas Funcionales,donde se realizan: -Preparaciones de receptores de trasplantes. -Biopsias renales. -Extracciones de sangre, curas, etc. 180 Protocolos. 1. Preparación del Receptor 2. Pre-trasplante inmediato 3. Post.trasplante inmediato 4. 1ª semana post-trasplante 1. Preparación del receptor: - LOCALIZACIÓN INMEDIATA: - Seleccionar de la Lista de espera de TR a los posibles receptores, normalmente de 5 a 7, según el nº de riñones. - Telefonear inmediatamente para que acudan al Hospital, (Nefrólogo). - CROSS MATCH: - Extracción de Sangre para Cross Match en la Unidad de TR. Consiste en mezclar células de los ganglios linfáticos y del bazo del donante con la sangre del receptor para observar si se produce la muerte de dichas células, por tanto es imprescindible que esta prueba sea negativa. - Enviar, lo antes posible, al Servicio de Inmunología. 2. Pre-trasplante inmediato: - Se ponen en funcionamiento Protocolos establecidos: - HEMODIÁLISIS O DIÁLISIS PERITONEAL A TODOS LOS POSIBLES RECEPTORES. (Mientras se determinará el Cross Match). Son sesiones con unas características específicas y protocolizadas: Dejar al paciente por encima de su peso seco;mínima heparina; mantener en AYUNAS... Actualizaciones en Trasplantes 2001. - EXTRACCIÓN DE ANALÍTICA, sólo la URGENTE (GUI, pre y post hemograma, P.cruzadas y reservar. 181 - TODOS LOS PACIENTES se mantendrána en espera hasta la determinación de uno o dos candidatos y otro permanecerá como reserva hasta que finalice la intervención. - LLEGADA A LA UNIDAD DE TRASPLANTE: - Se informará al paciente de lo que se va a realizar y se firmará la autorización para el trasplante.(Nefrólogo). Rx. de Torax y abdomen. ECG Peso,talla,const. vitales Higiene y rasurado. Colocación de via periférica: para extracción de sangre (Analítica Normal - - Protocolizada), urocultivo,esputo, frotis nasal. Administración de medicación inmunosupresora, antibióticos y sueroterapia.(Según prescripción médica). Proteger brazo portador de la fístula. Se aprovechará el tiempo de preparación para comenzar la Educación Sanitaria e informar al paciente de todo lo referente al post-trasplante, intentando tranquilizarlo. Recoger por escrito, en la hoja destinada a enfermería, la actividad realizada tanto en nuestra Unidad como en Hemodiálisis. (fecha,hora y firma). 3. Post-trasplante inmediato: - Preparar habitación: instalar sistemas de infusión, sueroterapia, medición de PVC, urinómetros, oxigenoterapia,aspirador, humedificador y espirómetro (FTR). - Al recibir al paciente procedente de UCI (si no existe complicación a las 24h.),la atención de enfermería va dirigida a: - Valorar el estado de conciencia y general prioridades.Proceder a la toma de constantes vitales: T.A.,Tª,F.C., pvc. - Estado respiratorio, administración de oxígeno si fuera necesario (detectar diseña, cianosis, expectoración,etc.) - Diuresis ,controlar sonda vesical y catéteres ureterales (si los hubiera).Valorar anuria , poliuria... - Control de apósitos y drenaje , cantidad y aspecto, detectando posibles signos de sangrado. - Vigilancia de vias de administración de sueros, sangre... - Acomodar al paciente en un ambiente agradable y tranquilo.Calmar la ansiedad. - Documentar y anotar registros importantes procedentes de la gráfica de UCI: - Balance hemodinámico Balance aporte-pérdidas. Medicación administrada. Necesidad de hemodiálisis. - Comenzar protocolo de diuresis desde la hora de llegada a nuestra Unidad. 4. 1ª Semana post-trasplante: - Analítica diaria, para estado metabólico (potasio, fósforo, sodio, calcio, creatinina.) Hemograma completo;urocultivo; equilibrio ácido-básico diario; niveles de medicación inmunosupresora; hemocultivos seriados en caso de fiebre. - Balance entre aportes (oral e IV ) y pérdidas (vómitos, pérdidas insensibles, heces, drenajes, orina). 182 Actualizaciones en Trasplantes 2001. 183 - Peso diario,con faja abdominal. - Baño diario,proporcionando la ayuda necesaria. - Control de constantes vitales y diuresis horaria, con frecuencia decreciente según periodo post-TR. - Administración de medicación, respetando al máximo sus horarios. - F T R por turnos (M-T-N-) - Control de drenaje,anotar cantidad y aspecto. Se retirará normalmente a las 24/48 h. Si su débito es escaso. A partir de este momento,y dependiendo del estado del paciente, animaremos a la movilización siempre con faja abd.- al sillón, y poco a poco a deambular por su habitación. - Intentar a los 2 o 3 días, evacuación intestinal normal. - Curas de la herida quirúrgica y via central c/24h.,según protocolo de Prevención de Infecciones Quirúrgicas. - Ingesta de líquidos según circunstancias, se procurará una hidratación adecuada, sin sobrecarga. - Retirada de sonda vesical, de forma casi rutinaria a los 7 u 8 días. Excepto cuando existan complicaciones técnicas, vejiga pequeña u atrófica, ya que puede aumentar el riesgo de fuga urinaria. El urólogo puede elegir la colocación de un catéter ureteral o catéter doble J y mantenerlos por un tiempo más prolongado. - Evaluación de la Función Renal: Si evoluciona correctamente en 10 a 15 días es posible la recuperación funcional suficiente para no precisar diáliis e incluso ser alta hospitalaria. Si por el contrario evoluciona hacia la no función renal, exigirá un planteamiento rápido y eficaz. Puede necesitar sesiones de hemodiálisis,restricción de lçiquidos y dieta renal, normalmente se debe a una situación de Necrosis Tubular Aguda, causada por el daño isquémico, ocasionado durante el mantenimiento del donante, extracción, hipotermia fría y cirugía. El diagnóstico se hace por eliminación de otras causas de anuria. Pruebas : 1- Ecografía y Doppler renal. 2- Biopsia renal: prueba definitiva ante la sospecha del rechazo, si existiera, se inicia Protocolo de Rechazo. - Educación del paciente: 1- Medicación: dosis, horario,efectos secundarios, y razones de su utilización. 2- Riesgos del abandono del ttº: rechazo, infección, y pérdida del injerto. 3- Comunicar cualquier signo o síntoma extraño o anormal. BIBLIOGRAFÍA: - Cuidados de Enfermería en la Insuficiencia renal 1993 Carmen Fortuny, Joan Andrés. - La Enfermería en el trasplante renal Introducción Biseden III, Pallardó. COMPLICACIONES DE LA VIA EXCRETORA EN EL TRASPLANTE RENAL F. J. Torrubia Romero; N. Cruz Navarro; J. Leal Arenas; P. Montañés Medina. Unidad de Trasplante Renal. Servicio de Urología INTRODUCCION. Las complicaciones de la vía excretora adquieren especial relevancia en el Trasplante Renal dada su frecuencia (5-15 %) y su morbilidad. Se clasifican fundamentalmente como se refleja en la Tabla I Para entender algunas de estas complicaciones es fundamental recordar que la vascularización ureteral se realiza a partir de tres pedículos vasculares interconectados entre sí mediante vasos adventiciales : 1. Superior, procedente de los vasos renales o polares inferiores si las hay. Es un pedículo descendente. 2. Medio, procedente directamente de aorta y/o vasos ilíacos. 3. Inferior, procedente de ramas de la hipogástrica. Los dos pedículos inferiores se eliminan al realizar la nefrectomía del donante y la vascularización ureteral queda dependiente solo del pedículo superior. Esto puede determinar que en algunos casos el extremo distal del uréter quede sin vascularización o que ésta sea insuficiente, lo que dará lugar a necrosis ureteral con la fístula consiguiente o a estenosis ureteral a este nivel en caso de que el defecto de vascularización sea menos intenso. TABLA I. COMPLICACIONES VIA EXCRETORA EN EL TR RENAL - Fístulas Urinarias - Procesos Obstructivos : - - De la luz ureteral (litiasis, coágulos, bolas de hongos, etc.) Estenosis Ureteral (Fibrosis) Compresiones extrínsecas (Linfoceles, hematomas, etc.) Reflujo Vésico Ureteral 184 FISTULAS URINARIAS Las fístulas, que se pueden localizar a cualquier nivel de la vía excretora, suponen una complicación grave en el trasplante renal. Las especiales circunstancias del receptor (Hemodiálisis crónica, inmunosupresión, etc) facilitan la aparición de infecciones locales que no solo pueden poner en peligro la supervivencia del riñón sino la del propio paciente. Su frecuencia oscila entre el 2 y el 10 % según las diferentes series (1). ETIOPATOGENIA Las fístulas caliciales aparecen como consecuencia de necrosis polares o segmentarias por ligadura de arterias polares de suficiente calibre o infartos dependientes de trombosis en las arterias correspondientes. La fístula piélica tan solo se observa cuando se han realizado pielotomías o anastomosis a este nivel, como en los trasplantes ortotópicos en que se sutura la pelvis del riñón donante con la pelvis del receptor previa nefrectomía. Del mismo modo, las fístulas vesicales aparecen en relación con técnicas de reimplante transvesical. En los casos de anastomosis extravesical la zona de escape de orina, en caso de producirse, se sitúa en la propia anastomosis. Las fístulas ureterales son mas frecuentes en órganos procedentes de donantes visos en los que se realiza una mayor disección de los vasos y el uréter por razones obvias; en consecuencia es más fácil que el extremo ureteral distal quede isquémico. También cuando hay que colocar una mayor longitud de uréter (anastomosis altas, riñones en posición invertida, etc.) aumenta el riesgo de isquemia distal. DIAGNOSTICO Actualizaciones en Trasplantes 2001. Las fístulas muy precoces se relacionan fundamentalmente con escapes en las suturas y aparecen en cuanto el riñón emite orina. Las necrosis de uréter, generalmente distal como se expuso anteriormente, determinan fugas de orina habitualmente entre el tercer y séptimo día aproximadamente. 185 En los casos de fístulas precoces se objetiva aparición de orina por el drenaje o incluso a través de la herida. Si se retiró el drenaje y, sobre todo, si la herida quirúrgica está suficientemente cicatrizada, disminuirá el volumen de orina por uretra (sonda) y el paciente se suele quejar de dolor abdominal. En este caso, la exploración puede poner de manifiesto signos de irritación peritoneal y abombamiento en la zona del injerto por acúmulo de orina (urinoma). El análisis del líquido drenado, comparándolo con el suero y con la orina, ayudarán a confirmar su origen y diferenciación con exudado plasmático o linfa. Ecográficamente suele ser fácil observar existencia de líquido en forma mas o menos abundante, dependiendo de su facilidad de salida al exterior, en el espacio paravesical y perirrenal. La TAC no aporta mas datos que la ecografía y su coste raramente la justifica. Los estudios con radiofármacos (DTPA Tc99 y MAG3 Tc99) son muy utilizados en nuestro centro para la confirmación de la existencia de fístulas cuya diferenciación con otras causas de drenado excesivo no siempre es fácil. Ambas sustancias se eliminan fácilmente por filtrado glomerular aún en riñones con escasa función renal y las imágenes gammagráficas secuenciales son casi siempre definitivas. TRATAMIENTO Toda fístula urinaria debe considerarse como una urgencia en un riñón trasplantado. Por tanto, se deben tomar medidas inmediatas. Algunos grupos preconizan el drenaje percutáneo del urinoma con drenaje renal también percutáneo. Sin embargo, no siempre existe dilatación de las cavidades renales que faciliten el drenaje percutáneo renal; la gran ventaja de hacerlo es que se puede realizar una urografía anterógrada (a través del tubo de nefrostomía) y definir algunos casos de fístulas mínimas que pueden beneficiarse de la colocación de catéteres ureterales que tutorizan la conducción de orina y el cierre de la fístula (2). La mayoría de los autores, entre los que nos encontramos, preferimos la reconstrucción quirúrgica inmediata puesto que las intervenciones necesarias son, por lo general, poco complejas, permiten la resolución del problema en un espacio de tiempo significativamente menor y se evitan los riesgos de la permanencia prolongada de catéteres. Las fístulas caliciales son especialmente difíciles de reparar; generalmente obligan a nefrectomía parcial, cierre de la vía excretora y aplicación de colgajos peritoneales, de colágeno o de duramadre liofilizada. En ocasiones pueden determinar la pérdida del injerto por las dificultades que plantea su reparación y complicaciones infecciosas (3). Las fístulas piélicas y ureterales (más frecuentes) son reparadas con técnicas diversas que van desde la reanastomosis en vejiga cuando hay suficiente uréter sano en las fístulas distales, a reconstrucciones más amplias utilizando la vía urinaria del riñón propio (pielopielostomías, pielo-ureterostomía o uretero-ureterostomía) como se exponen en las Figuras 1, 2 y 3). Solo en el caso de anastomosis piélo-piélicas entre riñón donante y pelvis renal del receptor se hace necesaria la nefrectomía del riñón propio cuya vía urinaria va a ser empleada para la reconstrucción. En todos los casos es necesario mantener tutores ureterales tipo Doble J o nefrostomías percutáneas durante un periodo de tiempo que oscila entre los 10 y 14 días. La mayoría de las fístulas vesicales cierran manteniendo un adecuado drenaje vesical durante espacios de tiempo variables según los casos que pueden oscilar entre los 10 y los 20 días. Raramente requieren reintervención y cierre en varios planos. 186 Figura 1: Ureteroureterostomía T-L Actualizaciones en Trasplantes 2001. Figura 2: pielo pielostomía 187 Figura 3: pielo uresterostomía PATOLOGIA OBSTRUCTIVA Los procesos obstructivos del riñón trasplantado adquieren especial relevancia al tratarse de un riñón único funcionante en un paciente único deprimido. Pueden ser debidos a múltiples causas como se expone en la Tabla II. Su incidencia ha disminuido significativamente en las diversas series con el paso de los años desde cifras que llegaban al 29 % hasta las actuales que oscilan entre el 5 y el 15% (4, 5). Es importante tener en cuenta que se observa una ligera dilatación de la vía excretora en riñones trasplantados hasta en el 30% de casos normales, lo que se justifica por la denervación obligada para su implante y por determinadas posiciones anatómicas. TABLA II. PATOLOGIA OBSTRUCTIVA EN EL TRASPLANTE RENAL Clasificación Etiopatogénica - Obstrucción de la luz ureteral: - Litiasis - Coágulos - Fungus Ball - Complicaciones de la Pared Ureteral - - Estenosis Adherencias y Fibrosis Periureteral Acodaduras por Cordón Espermático o Lig.Redondo Acodaduras por Uréter Redundante Torsión Ureteral inadvertida Compresiones Extrínsecas - Colección Perirrenal (Linfoceles, Hematomas, Abscesos) - Túnel submucoso largo y/o excesivamente estrecho ETIOPATOGENIA La OBSTRUCCION DE LA LUZ ureteral puede deberse a diferentes causas entre las que destacan la obstrucción litiásica, por coágulos y por bolas de hongos. La litiasis es una complicación infrecuente en el trasplante renal. Raramente se transfiere con el órgano trasplantado. Generalmente aparecen como consecuencia de una amplia gama de factores favorecedores existentes en el paciente trasplantado como infecciones urinarias, trastornos funcionales no infrecuentes en estos pacientes como hiperoxaluria, acidosis tubular y alteraciones del metabolismo fosfo-cálcico, e incluso como efectos indeseables de alguna medicación: antiácidos, esteoides, etc. Algunos autores han 188 reseñado la elevada frecuencia de los factores referidos en comparación con la baja incidencia de litiasis en los pacientes trasplantados. Los coágulos también pueden obstruir la vía urinaria. Generalmente lo hacen de forma temporal con resolución por lisis o expulsión. Las biopsias percutáneas, frecuentemente necesarias en el seguimiento de estos pacientes, son una causa frecuente de hematuria. La hematuria en el postoperatorio inmediato suele deberse a sangrado en la anastomosis uréterovesical o en la sutura de la cistostomía cuando exista. Raramente afectan a la función renal; cuando lo hacen suelen ser sangrados importantes con coágulos en vejiga que impiden un adecuado vaciado por la sonda. La mayor incidencia de infecciones urinarias por hongos, mas frecuentemente por Cándida Albicans, en estos pacientes también pueden determinar obstrucción por bolas de hongos. ESTENOSIS DE LA PARED URETERAL aparece en un 2-6 % de los trasplantes renales y suponen la causa mas frecuente de obstrucción ureteral en la mayoría de las series. Se originan por aumento significativo de tejido fibroso en la pared ureteral como consecuencia de un aporte vascular insuficiente que generalmente se ocasiona por disecciones excesivas o elongaciones en la extracción del órgano que lesionan el sistema intrínseco de irrigación del uréter. El deterioro de este sistema tiene especial repercusión en el segmento distal dadas las características anatómicas antes descritas. No es infrecuente que la estenosis ureteral sea consecuencia de fibrosis retroperitoneal perirrenal, sobre todo en casos de infecciones repetidas, sangrados postoperatorios o reintervenciones. En algunos casos el ligamento redondo y el cordón espermático pueden determinar compresión extrínseca del uréter. Para prevenir esta complicación se debe ubicar el uréter en un canal amplio que es fácil de establecer por debajo de estas estructuras (el ligamento redondo se puede seccionar sin problemas). Actualizaciones en Trasplantes 2001. Diversas Colecciones perirrenales pueden también obstrucción por compresión extrínseca. La más frecuente es el linfocele, colección linfática que aparece como consecuencia de escapes de los linfáticos ilíacos o del seno renal. Se han publicado incidencias de hasta el 50 %, aunque las habitualmente comunicadas no superan el 15-20 % y solo en el 0,5-2 % adquieren un volumen suficiente como para determinar compresión ureteral y obstrucción. Los linfoceles pequeños, sin repercusión sobre la vía excretora, no requieren tratamiento (6). 189 Por último, defectos técnicos como torsión inadvertida de la pared ureteral, fruncimiento excesivo de las suturas y túneles submucosos excesivamente largos y/o estrechos, pueden determinar obstrucción ureteral. DIAGNOSTICO La forma de presentación clínica de un proceso obstructivo en el trasplante renal es variable en función de su etiología. Una particularidad del riñón trasplantado es el hecho de que, al ser un órgano denervado, la obstrucción de la vía excretora no se traduce en cólico nefrítico como ocurre en condiciones normales. Tan solo en ocasiones el paciente aqueja cierta sensación de peso o malestar sobre la zona del injerto. La torsión inadvertida del uréter determina una anuria postoperatoria mantenida que determina dilatación de vías altas objetivable ecográficamente cuando el riñón comienza a emitir orina. La movilización de litiasis y coágulos a uréter ocasiona anuria de aparición brusca con elevación de creatinina y deterioro del estado general. Mediante técnicas radiológicas convencionales y/o contrastadas así como ultrasonografía, se puede confirmar fácilmente la existencia de litiasis. La aparición de hematuria como causa de obstrucción es fácilmente objetivable; se observa en el postoperatorio inmediato o, tras la realización de biopsias percutáneas. La estenosis ureteral, fibrosis periureteral, acodaduras y compresiones extrínsecas suelen presentarse de forma insidiosa con elevación de creatinina y dilatación progresiva de la vía excretora que se objetiva fácilmente en los estudios bioquímicos y ecográficos estandarizados en el seguimiento de estos pacientes. Su localización exacta se determina mediante Urografía I.V. o Urografía Anterógrada mediante inyección de contraste a la vía excretora a través de una punción percutánea. Esta última técnica se reserva para los casos en que la función renal alterada no permite una adecuada visión con Urografía I.V. y existan dudas diagnósticas o sobre las alternativas terapéuticas. No podemos olvidar que el riñón trasplantado es, como se refirió anteriormente, un órgano denervado que frecuentemente mantiene una mínima ectasia de su sistema excretor sin repercusión funcional alguna. Si esta es algo mayor puede dar lugar a dudas que generalmente se resuelven mediante estudios funcionales como Urografía o Renograma con estímulo diurético. Si tras la administración del diurético se lavan adecuadamente las cavidades renales del contraste yodado o del radiofármaco, significará que la dilatación no es obstructiva; en caso contrario confirmarán la obstrucción. TRATAMIENTO El tratamiento de la litiasis renal en el riñón trasplantado sufrió en los últimos años los mismos cambios que en el no trasplantado. Generalmente la litotricia extracorpórea con ondas de choque, ayudada de la colocación de catéteres ureterales o nefrostomías percutáneas en los casos de obstrucción más severa, es la primera opción de tratamiento. La Nefrolitotomía percutánea es, con suficiente experiencia, poco agresiva y puede resolver determinadas litiasis piélicas con poca participación calicial. Los componentes caliciales múltiples pueden dificultar el acceso percutáneo y una litectomía suficientemente completa. La obstrucción de la luz por bolas de hongos obliga a desobstruir el tracto urinario mediante cateterismo ureteral (no fácil en el uréter reimplantado) o nefrostomía percutánea. Es obligado alcalinizar el aparato urinario, lo que frena el crecimiento de los hongos, y la irrigación del sistema excretor don Anfotericina B. Todo ello debe acompañarse de tto 190 sistémico con Anfotericina B durante períodos de tiempo de hasta dos meses. El acceso percutáneo permite el tratamiento de estenosis segmentarias y cortas mediante dilatación con balón y colocación de endoprótesis ureterales. Se debe huir del mantenimiento de catéteres durante tiempo prolongado. Las estenosis largas y las cortas recidivantes obligan a reconstrucción quirúrgica. En los casos de estenosis distales con suficiente uréter sano y en los procesos obstructivos debidos a uréter redundante y acodado o por compresión del cordón espermático, puede ser suficiente resecar el segmento inútil y reimplantar a vejiga. Sin embargo, cuando las estenosis comprometen a un segmento importante de uréter se puede hacer necesario el empleo de la vía excretora del riñón propio realizando alguna de las técnicas descritas en el apartado de las fístulas. Actualizaciones en Trasplantes 2001. Figura 4: Pieloureterostomía L-Lateral 191 Cuando el riñón se implantó en posición invertida se pueden observar adherencias y fibrosis periureteral en el codo de ascenso-descenso que describe el uréter. En estos casos hemos realizado en nuestro grupo de trabajo, con un 100% de éxitos, anastomosis piélo-ureterales que cortocircuitan la zona comprometida (Figura 4). Las colecciones perirrenales suelen ser de pequeño tamaño y no requieren tratamiento. El absceso perirrenal o perivesical obligan a su drenaje inmediato puesto que su repercusión séptica adquiere una mayor relevancia que cualquier potencial o real compresión de la vía excretora. Es obligado el drenaje de las colecciones linfáticas cuando comprometen la vía excretora. La primera opción es el drenaje percutáneo con instilación de sustancias esclerosantes (la mas empleada es la povidona yodada) que ejercen su acción sobre los linfáticos y controlan la fuga de linfa en la mayor parte de los casos. Entre un 35 y un 80% de los casos los linfoceles persisten tras punciones repetidas que pueden sobreinfectarlos y se hace necesaria su marsupialización a cavidad peritoneal con adecuada omentoplastia que generalmente es fácil de realizar mediante laparoscopia (7), o en su defecto por cirugía abierta. REFLUJO VESICO URETERAL El reflujo vésico ureteral en el Tx renal es una complicación infrecuente (<1% sintomáticos) que tiene diversas características propias. Por un lado, el uréter se implanta, mas frecuentemente, mediante técnicas extravesicales con túnel submucoso no excesivamente largo para evitar estenosis. Por otro lado, el detrusor de estos pacientes, frecuentemente con uso disminuido o nulo durante un período de tiempo variable, es atrófico e incluso fibrótico. Ambas cuestiones, a las que se suman capacidades disminuidas por el desuso que favorecen situaciones de aumento de presión intravesical, favorecen la aparición de reflujo al riñón trasplantado (8). Habitualmente el reflujo vésico ureteral al riñón trasplantado no tiene repercusión ni riesgo clínico y no es objetivado. En estos casos es sospechado a partir de ligeras o moderadas dilataciones de la vía excretora detectadas ecográficamente en los estudios estandarizados. Tan solo los casos que ocasionan dilataciones importantes del sistema excretor, infecciones o deterioro funcional renal, son investigados mas profundamente mediante Cistouretrografía miccional. Es conocido que el riñón adulto deteriora su función ante la presencia de reflujo solo si éste determina presionas intrapiélicas altas y dilatación progresiva o si provoca infección del parénquima renal, por lo que raramente se hace necesario actuar sobre el sistema excretor de un riñón trasplantado por reflujo. El reimplante vésico ureteral de un sistema refluyente de un riñón trasplantado tiene importantes limitaciones por la fibrosis postoperatoria y el segmento ureteral limitado del que se dispone. En algunas ocasiones, si existe vía propia sana y no refluyente, la mejor solución puede ser su utilización mediante pieloureterostomía o uréteroureterostomía. BIBLIOGRAFIA 1. Montañés P, Torrubia F.J. Sánchez E. : Fístulas Urinarias en el Trasplantado Renal. En Montañés P. Sánchez E., Torrubia F.J. Complicaciones Quirúrgicas del Trasplante Renal. Pgs 135-146. Tema Monográfico del LVII Congreso Nacional de Urología. Madrid 1992. 2. González Martín M., Chantada Abad V., Alvarez Castelo L.M.: Fístulas y Estenosis de la Vía Excretora en el Trasplante Renal. En González Martín M. Y García Buitron J.M.: Trasplante Renal. Pgs 345-354. Ed. Grupo Aula Médica. Madrid 2000. 3. Gutierrez Calzada J.L., Ramos Titos J., González Bonilla J.A., Santos García-Vaquero A., Martín Morales A y Burgos Rodríguez R. : Caliceal fistula formation following Renal Transplantation : Management with partial nephrectomy and ureteral replacement. J.Urol. 153 :612-614. 1995. 4. Espinosa F.J., Sánchez E., León E. : Obstrucción de le Vía Excretora en el Trasplante Renal. En Montañés P. Sánchez E., Torrubia F.J. Complicaciones Quirúrgicas del Trasplante Renal. Pgs 154-160. Tema Monográfico del LVII Congreso Nacional de Urología. Madrid 1992. 5. Robles J.E., Errasti P., Abad J.I., Martín-Marquina A., Zudaire J.J., Berian J.M. : Surgical complications in renal transplantation : Determinant factors. Transplant Proc. 27(4) :2258-2259.1995. 6. Torrubia F.J., Sánchez E., Espinosa F.J. : Colecciones Pararrenales. En Montañés P. Sánchez E., Torrubia F.J. Complicaciones Quirúrgicas del Trasplante Renal. Pgs 181-186. Tema Monográfico del LVII Congreso Nacional de Urología. Madrid 1992. 7. Le Roux Y., Bottet P., Brefort J.L., Dornier L., De Ligny H., Samama G. : Pelvic Lymphoceles after renal 192 Atención de enfermería al paciente trasplantado de corazón en la UTC D.U.E. Pedro Moya Marín UNIDAD DE INSUFICIENCIA CARDIACA Y TRASPLANTE Servicio de Cardiología. La Unidad de Trasplante cardíaco se encuentra ubicada y es parte integrante del Servicio de Cardiología de nuestro hospital. Esta unidad está aislada del resto de la planta de hospitalización, con aire acondicionado independiente, filtros especiales y presión positiva. Actualmente está dotada de tres habitaciones individuales que pueden convertirse cuando las necesidades lo requieran en cinco camas hospitalarias. Los recursos humanos con los que cuenta la unidad son: Tres auxiliares de enfermería, cinco enfermeros, un residente de cardiología y un médico responsable de la unidad. Tipo de pacientes: Fundamentalmente se atienden a los pacientes trasplantados de corazón una vez que son dados de alta en la Unidad de Trasplante de UCI. También se atienden a pacientes trasplantados que vienen de su domicilio para la realización de una biopsia del injerto y revisión clínica programada, o aquellos que presenten algún evento cardiológico grave como rechazo cardíaco, infección, arritmias, etc. Actualizaciones en Trasplantes 2001. Cuando las circunstancias lo permiten, y no estando ocupadas las camas por los pacientes anteriormente citados, se ingresan a pacientes en estudio pretrasplante y que por sus condiciones clínicas precisen de vigilancia especial y monitorización permanente 193 Los pacientes en estudio pretrasplante, una vez completados los mismos, serán susceptibles o no de incluirse en la lista de espera de trasplante cardíaco, en caso positivo podrán ser dados de alta, y con el tratamiento de mantenimiento adecuado pasarán a su domicilio, debiendo estar siempre localizados para el caso que se le asigne un posible órgano, o por el contrario deberán permanecer en la unidad hasta que se normalice su situación hemodinámica. También estos pacientes podrán ser trasladados a la UCI si las condiciones de vigilancia e instrumentalización que se requiera para su mantenimiento vital así lo aconsejen. En el caso que las condiciones clínicas del paciente no aconsejen un trasplante, estos seguirán dependiendo de nuestra unidad con un control periódico en las consultas de ICC donde se podrá detectar la nueva indicación o no de un trasplante. Cuidados de enfermería al paciente cardiotrasplantado Una vez señalados las diferentes categorías en que podemos encuadrar los pacientes que atendemos en la UTC, vamos a referirnos al paciente que se encuentra en su tiempo de trasplante, para lo cual vamos a realizar un esquema cronológico. ¡Alarma!, tenemos un corazón Habitualmente, el paciente se encuentra en su domicilio y el personal de la UTC será el encargado de recibirlo y prepararlo para el trasplante. En primer lugar prepararemos la historia clínica (que se encuentra retenida en nuestro Servicio), para que estén disponibles todos los datos precisos. En lo concerniente a la preparación física del paciente, el personal de enfermería ha elaborado un protocolo de actuación (Fig.1), asimismo tenemos que atender el aspecto psicológico, tanto al paciente como a la familia y prestar información de última hora. Es una buena técnica el acompañar al paciente hasta la misma sala quirúrgica, con ello pretendemos disminuir el elevado grado de ansiedad que le supone esta fase del proceso. Fig. 1 Una vez trasplantado el paciente ingresará en la Unidad de Trasplante de la UCI donde será atendido durante el tiempo necesario previo al traslado del mismo a la UTC. El paciente ya trasplantado en la UTC Cuando el paciente trasplantado llega a nuestra unidad, vamos a tener en cuenta tres características importantes a la hora de administrar nuestros cuidados: es un paciente inmunodeprimido, es un paciente postquirúrgico , y es un paciente cardíaco. El paciente inmunodeprimido Los cuidados al paciente inmunodeprimido están protocolizados en nuestra unidad siguiendo 194 los consejos del Servicio de Infeccioso y Medicina Preventiva de nuestro hospital (Fig 2,3,4,5,6,7,y 8). Estos pacientes han de ser tratados con una batería de medicación inmunosupresora que nos indicará en cada momento el cardiólogo responsable de la Fig. 2 Actualizaciones en Trasplantes 2001. Fig. 3 195 Fig. 4 Fig. 5 Fig. 6 Fig. 7 196 Fig. 8 unidad, siendo necesario el uso de unos horarios específicos en la administración de la citada medicación. Dentro de los inmunosupresores, los niveles de ciclosporína en sangre y los de Actualizaciones en Trasplantes 2001. Fig. 9 197 tacrólimus han de estar monitorizados debido al estrecho margen terapéutico de los mismos, por ellos es necesario realizar las extracciones tal y como nos ha sido indicado los respectivos laboratorios de Medicina Nuclear y Farmacología clínica. (Fig. 9) La inmunosupresión a que debe estar sometido el paciente trasplantado de corazón, va a hacer que éste se presente más susceptible a las infecciones oportunistas, las cuales pueden aparecer por múltiples causas, entre las que podemos destacar la propia cirugía del trasplante y las diversas técnicas agresivas a que el paciente es sometido en los primeros días del postoperatorio (sondaje vesical, catéter venoso central, drenajes mediastínicos, etc) y en ocasiones por reactivación de virus y gérmenes que se encuentran en estado latente en el receptor. La vigilancia constante de estos pacientes es pues imprescindible, desde la perspectiva primeros días del postoperatorio, así deberemos evitar los decúbitos laterales, ya que en esta posición los bordes de la herida esternal podrían perder su alineación montándose uno sobre otro. Al incorporar al paciente, deberemos hacerlo en forma de abrazo, realizando una pequeña presión sobre los hombros con una fuerza dirigida hacia el esternón de forma que quede lo más sujeto posible durante el movimiento. En la zona de la herida quirúrgica vigilaremos la aparición de tumoración, enrojecimiento y aumento de temperatura. Estaremos alerta a la cantidad y calidad del esputo y a los ruidos respiratorios que presente el paciente. Vigilaremos la calidad y la cantidad de las deposiciones en busca de signos de alarma. Observaremos lesiones que puedan aparecer en la mucosa oral, las cuales pueden extenderse hacia el resto del aparato digestivo. Y en definitiva estaremos en alerta ante cualquier síntoma que nos pueda hacer sospechar de algún tipo de infección. Todos estos hallazgos serán registrados en nuestra gráfica y anotados en la evolución de enfermería, así como procederemos a la transmisión verbal de los mismos al médico responsable de la Unidad. El paciente quirúrgico Al igual que ocurre en cualquier otra cirugía cardiaca, el paciente que ha sido sometido a un trasplante de corazón presenta una herida quirúrgica en sentido caudal que divide al esternón en dos mitades. Esta herida quirúrgica compromete no solo a piel, tejido celular, aponeurosis y músculo, sino que afecta a la estructura ósea del esternón, el cual quedará unido por varias suturas con alambre acerado. Debido a la participación del esternón en los movimientos respiratorios, éste se encuentra en cada respiración con una tensión que tiende a separar sus bordes, por ello independientemente de los cuidados propios de cualquier herida quirúrgica, tendremos que tomar una serie de medidas que minimicen el riesgo de separación de los bordes de la herida esternal. Entre estas medidas usaremos un corsé diseñado específicamente para este fin, el cual deberemos ajustar en el punto exacto para obtener una adecuada sujeción esternal sin comprometer la capacidad de expansión de la caja torácica y por lo tanto la ventilación pulmonar. También deberemos prestar atención a los movimientos que podamos realizar con el paciente, sobre todo durante los primeros días del postoperatorio, así deberemos evitar los decúbitos laterales, ya que en esta posición los bordes de la herida esternal podrían perder su alineación montándose uno sobre otro. Al incorporar al paciente, deberemos hacerlo en forma de abrazo, realizando una pequeña presión sobre los hombros con una fuerza dirigida hacia el esternón de forma que quede lo más sujeto posible durante el 198 movimiento. Cuando el paciente llaga a la UTC, ya le han sido retirados los tubos mediastínicos, solo nos encontraremos con la herida quirúrgica y los cables de marcapasos epicárdico que emergen a través de la piel y sujetos a ella por un punto de seda u otro material quirúrgico. Estos cables se dejarán unos días y solo se le aplicará un generador de marcapasos en caso de bloqueo con un ritmo de escape lento, asistolia o que el paciente presente un ritmo cardíaco demasiado lento, en cualquier caso el clínico nos indicará el momento, la intensidad y la frecuencia a que deberemos mantenerlo. Cuando tengamos que retirar los cables se realizará mediante tracción de los mismos una vez liberados de la sutura que le sujeta a la piel. El control radiográfico de estos pacientes se hace imprescindible para valorar un posible derrame pleural, parálisis diafragmática, neumonía, atelectasias, etc. Independientemente del cuidado que debemos prestar al esternón, no menos importante, y sobre todo en pacientes inmunodeprimidos, es la rehabilitación respiratoria para salvar zonas de compromiso atelectásico y evitar acumulación de secreciones. Estimularemos y enseñaremos al paciente a toser de forma productiva, aplicaremos aerosolterapia y le estimularemos para que realice ejercicios respiratorios con el inspirómetro. En este apartado podemos y debemos contar con el apoyo del Servicio de fisioterapia. El Paciente cardíaco Actualizaciones en Trasplantes 2001. El paciente cardiotrasplantado, en el postoperatorio inmediato va a mantener un ritmo cardíaco adecuado gracias a una perfusión de aleudrina, que será retirada de forma progresiva conforme el nuevo corazón va aumentando su automatismo. Generalmente el paciente nos llega a la UTC ya destetado de la misma o a unas dosis muy bajas. En cualquier caso la vía por donde se le perfunde la aleudrina no debe ser utilizada para la infusión o administración de cualquier otra medicación, ya que esto va a provocar una entrada en bolo de toda la aleudrina que se encuentra en el cateter venoso y probablemente una taquicardia sinusal muy elevada. 199 Los cuidados de este paciente incluyen la monitorización y vigilancia constante del ritmo cardíaco. Estaremos alerta a situaciones de bradicardias sinusales, bloqueos, fibrilación auricular y cualquier otro tipo de alteración eléctrica que deberá ser siempre documentada e informada al médico responsable. Así un rechazo agudo se puede presentar con unos síntomas eléctricos con arritmias cardíacas de cualquier tipo (generalmente supraventriculares) e insuficiencia cardíaca derecha y/o izquierda de rápida evolución, por ello estaremos alerta ante la aparición de edemas en miembros inferiores, edemas generalizados e incluso E.A.P. Por esta misma causa, el paciente puede presentar cierto grado de insuficiencia renal, por lo que deberemos estar alerta al balance hídrico que presente, controlar la ingesta de líquidos, vigilar la disminución de la diuresis, de la T.A. y monitorizar los niveles en sangre del sodio, potasio, urea y creatinina. El paciente trasplantado va a estar sometido a una serie de biopsias del injerto. Esta biopsia se realiza mediante un ceteterísmo con acceso generalmente a través de la vena femoral, para dirigirse hacia las cavidades cardíacas derechas. Esta técnica se hace en el quirófano de hemodinámica y requiere una mínima preparación del paciente que se realiza ajustándonos a un protocolo. (Fig. 10). Las muestras de tejido endomiocárdico son enviadas al Departamento de Anatomía Patológica, la primera información la obtendremos telefónicamente el mismo día y posteriormente nos remitirán un informe donde se detalla el grado de severidad del rechazo y los hallazgos encontrados. Es importante que el personal de enfermería conozca los diferentes grados de rechazo porque diferente será la indicación terapéutica. (Fig 11). Fig. 10 Fig. 11 200 MANIFESTACIONES CLINICOPATOLÓGICAS DEL FALLO AGUDO DEL INJERTO CARDIACO. ESTUDIO REVISIÓN DE LA CASUÍSTICA POSTMORTEM. Jorge Fernández Alonso, Montserrat Giles y Paulino Travado Dpto. Anatomía Patológica. Sección de Postmortem El injerto cardiaco en los enfermos trasplantados, está sometido a un plus de riesgos y situaciones adversas que pueden desencadenar el fallo irreversible de su función. Entre las mejor conocidas están los fenómenos de rechazo, en cualquiera de sus formas, y las complicaciones dependientes de la situación de inmunosupresión, ambas causas potenciales del fallecimiento de estos enfermos (1). Mucho menos conocido es el fallo del injerto. Actualizaciones en Trasplantes 2001. Concepto del fallo del injerto cardiaco 201 Se entiende como fallo del injerto el cese de las funciones del corazón trasplantado como consecuencia bien de las alteraciones cardiacas preexistentes en vida del donante vgr.: cardiopatía subclínica o bien tolerada, o desconocida por los familiares que conceden la donación; o relacionadas con el daño sufrido por el órgano durante el tiempo transcurrido entre la enfermedad final o muerte del donante y el trasplante cardiaco vgr.: muerte cerebral prolongada, tiempo de isquemia excesivo, factores dependientes de la conservación o de la propia intervención. El daño ocasionado al injerto por estas condiciones, más el grado de deterioro del receptor, al que el injerto tiene responder, pueden desencadenar un fallo en la función del injerto que desemboque en la muerte inmediata del receptor. Según los datos recogidos de un amplio registro multicéntrico de autopsias de trasplantados cardiacos, el fallo del injerto es el desencadenante del 64% de las muertes que tienen lugar durante el primer mes postrasplante y la causa inmediata de las mismas en un 49% de los casos; se manifiesta clínicamente por lo general como fallo de bomba del ventrículo derecho, y también como isquemia aguda miocárdica relacionada con arteriosclerosis coronaria del injerto, fallo del ritmo o trombosis cavitaria (1,2). Criterios de selección y relación de casos Hemos revisado los protocolos de las autopsias de pacientes fallecidos durante el primer mes del postrasplante cardiaco encontrando un total de 10 casos. En 5 existían los siguientes criterios de fallo del injerto : fallo ventricular derecho, isquemia aguda miocárdica, y/o trombosis cavitaria, no explicables por fenómenos de rechazo o miocarditis secundaria a infección. Ordenados por el tiempo transcurrido tras el trasplante son los siguientes: Caso nº 1 (A41/96) Varón de 62 años con antecedentes de cardiopatía coronaria dilatada por enfermedad multivaso, dos infartos agudos de miocardio e hipertensión pulmonar. A las 3h del trasplante cardiaco presentó dificultad para mantener presiones arteriales, requiriendo dosis altas de aminas y mostrando en el ECG signos de sobrecarga ventricular derecha. Fallece en las primeras 24 h postrasplante tras bradicardia progresiva y trastornos del ritmo. El diagnóstico clínico fue de fallo ventricular derecho secundario a hipertensión pulmonar o rechazo hiperagudo. Los hallazgos de autopsia más relevantes fueron: obesidad patológica (104 kg. para 166 cm de longitud) dilatación ventricular derecha y del infundíbulo de la arteria pulmonar con trombosis cavitaria, tromboembolismos e infartos pulmonares múltiples, y hemorragias subendocárdicas en el tracto de salida del ventrículo izquierdo comprometiendo el haz de Hiss. No existían lesiones de rechazo. La causa de la muerte fue debida a la trombosis cavitaria y fallo agudo del injerto. Caso nº 2 (A26/98) Mujer de 63 años, con cardiopatía valvular, insuficiencia mitral, aórtica y tricuspídea, que sufrió una comisurotomía mitral en el año 1967 y posterior sustitución protésica valvular. Llegó al trasplante con disfunción ventricular grave e insuficiencia renal prerrenal. Tras la intervención pasó a la UCI presentando sangrado abundante por drenajes mediastínicos, inestabilidad hemodinámica y oligoanuria, falleciendo dentro de las primeras 24 h. con la sospecha clínica de fallo del injerto. La autopsia pone de manifiesto una marcada flaccidez del ventrículo derecho con marcada dilatación de su cavidad, así como una lesiones importantes de nefroangioesclerosis por tromboembolismos suboclusivos antiguos. La causa inmediata de la muerte fue el atribuida a fallo del injerto. Caso nº 3 (A122/97) Varón de 53 años hipertenso, con cardiopatía coronaria con afectación de dos vasos y un estado funcional II/III. Ya en las primeras horas del postrasplante presentó grave hipoxemia y fallo ventricular derecho, evolucionando con fracaso renal agudo oligoanúrico, fracaso hemodinámico que precisó de ventilación asistida y fiebre de 38ºC. Posteriormente sobrevino un fallo multiorgánico que condujo a la muerte al 3º día postrasplante. Los diagnósticos clínicos fueron: fracaso multiorgánico con shock refractario probablemente séptico e insuficiencia cardiaca derecha severa. El supuesto origen séptico del shock 202 fue descartado tanto por los estudios microbiológicos como por los hallazgos de la autopsia. En esta se demuestra una dilatación del ventrículo derecho y del infundíbulo de la arteria pulmonar con lesiones secundarias de necrosis hemorrágica hepática extensa. La causa inmediata de la muerte se atribuyó a shock cardiogénico por fallo del injerto. Caso nº 4 (A56/96). Varón de 59 con antecedentes de cardiopatía coronaria grado IV, hipertensión arterial y diabetes tipo II. Ingresó en la UCI tras el trasplante, con fiebre, fallo renal agudo, condensación pulmonar, alteraciones metabólicas y hemodinámicas con aumento de la presión de llenado. Falleció al 4º día del trasplante en fracaso multiorgánico de causa séptica o secundaria a rechazo del injerto. El hemocultivo postmortem resultó positivo para enterobácter aerógenes, encontrándose así mismo neumonía masiva y fallo ventricular derecho con necrosis hemorrágica hepática confluente. Existía también arteriosclerosis sistémica grave, con daño renal crónico por nefroangiosclerosis. La causa desencadenante de la muerte a se atribuyó a sepsis y neumonía con fallo agudo del injerto. Caso nº 5 (A10/99) Actualizaciones en Trasplantes 2001. Varón de 62 años con cardiopatía isquémica dilatada, dos infartos de miocardio previos e insuficiencia cardiaca global. Diabético con nefropatía incipiente y cuadros de insuficiencia renal aguda prerrenal. A su ingreso en la UCI tras el trasplante sangraba abundantemente por los drenajes mediastínicos, constatándose fallo ventricular derecho y encefalopatía multifactorial. Posteriormente apareció sepsis por acinetobacter baumanni e insuficiencia renal, falleciendo el 11º día postrasplante en fallo multiorgánico y fallo ventricular derecho. La autopsia puso de manifiesto una grave neumonía por acinetobacter baumanni, asociada a cardiomegalia con dilatación ventricular derecha y equímosis subendocárdicas dispersas bilaterales (Figura 1), necrosis hemorrágica hepática por fallo agudo ventricular derecho y signos de necrosis tubular aguda. Las lesiones encefálicas eran de carácter hipóxico y edematoso. La causa desencadenante de la muerte fue el fallo 203 Figura 1: Injerto cardiaco abierto, mostrando notable dilatación de las cavidades derechas con hemorragias subendocárdicas en la pared libre del trayecto de salida ventricular. Causas de muerte en los pacientes autopsiados sin fallo del injerto demostrado En tres casos (A19-94; A52-97; A57-99) la causa inmediata de la muerte fue un shock hipovolémico por hemorragia masiva intratorácica, a las 3 y 7 horas, y 8º día postrasplante respectivamente. En 1 caso (A51-98) la muerte sobrevino a consecuencia de un fallo multiorgánico secundario a sepsis por estafilococo (l 7º día postrasplante). Otro caso (A31-99 ) falleció a consecuencia de un rechazo agudo grave del trasplante en el 19º día postrasplante. DonaciónTrasplante 1.999. del injerto, complicado con fallo multiorgánico y sepsis por acinetobacter. Análisis de la casuística El estudio mediante autopsia de las causas de muerte en el periodo postoperatorio se considera de sumo interés ya que la valoración por autopsia es más ajustada que la valoración clínica aislada, y permite incidir sobre complicaciones en ocasiones susceptibles de ser evitadas a través de su prevención o tratamiento (1,2, 3, 4). No existen muchas series de autopsias en trasplantados cardiacos que estudien las causas principales de muerte en el primer mes del postrasplante, que es el de mayor incidencia del fallo del injerto. La mayoría dividen los casos en periodos de tiempo muy amplios, o engloban los 3 primeros meses como periodo postoperatorio temprano (1). Es por ello por lo que creemos que nuestra casuística, aunque limitada, es representativa de la cronología de aparición del fallo del injerto. Este suele debutar de forma inmediata, en muchas ocasiones en la misma mesa de operaciones, y en otros casos de forma temprana en las primeras semanas del periodo postrasplante (2). En los casos 1 y 2 la muerte sobrevino en las primeras horas postrasplante y fue causada directamente por fallo del injerto que se manifestó como dilatación aguda del ventrículo derecho. En el primer de ellos el fallo del injerto se asoció además a una trombosis cavitaria con tromboembolismos pulmonares, probablemente a consecuencia de daño de preservación y/o trastornos del ritmo. En los otros tres casos el fallo del injerto aparecía inmerso dentro de un cuadro de fallo multiorgánico, y traducía un fallo cardiaco congestivo global, situación expresiva del fallo del injerto que acontece en periodos algo más tardíos (2). La distinción en estos casos entre la causa desencadenante y la causa inmediata de la muerte es para el patógo menos clara y la historia clínica es crucial para, en concordancia con los hallazgos, determinar si el fallo del injerto es causa o consecuencia del fallo multiorgánico. En el caso nº 3 el fallo del injerto aparece ya en las primeras horas, se complica posteriormente con un fallo multiorgánico y la muerte sobreviene en shock cardiogénico al 4º día. Igual sucede en el caso nº 5 donde aparentemente el inicial fallo cardiaco desencadena diversas complicaciones que conducen a la muerte al 11º día. El caso nº4 la cronología de los hechos es algo más compleja pues con los datos existenctes en el protolo de autopsia, resulta problemático establecer con certeza la patocronia de los hechos. Entre los factores predictivos de riesgo de muerte temprana en los pacientes someti204 Actualizaciones en Trasplantes 2001. dos a trasplante cardiaco se mencionan el retransplante, un largo periodo de isquemia del injerto, presiones de resistencia vascular pulmonar muy elevadas, la insuficiencia renal aguda, un tiempo prolongado la intubación endotraqueal, tratamientos prolongados con amiodarona (5, 6). Muchos de ellos o bien no están presentes en estos casos o no constan en los protocolos de autopsia. Respecto al grado de hipertensión pulmonar, una de las causas coadyuvantes del fallo agudo del injerto, conviene recordar que, a diferencia de lo que sucede con la hipertensión pulmonar primaria, donde existe una cierta correlación entre las lesiones histopatológicas del árbol arterial pulmonar y el grado de hipertensión clínica, las lesiones microscópicas observadas en estos casos son menos llamativas y no expresan la gravedad de la hipertensión existente. La hipertensión pulmonar es debida en estos enfermos a hipertensión venosa crónica e intervienen en ella no sólo la esclerosis del retorno venoso pulmonar sino también las lesiones que el fallo cardiaco izquierdo repetido produce en el parénquima pulmonar, particularmente ensanchamiento de tabiques, pérdida de elasticidad, fibrosis y hemosiderosis pulmonar (7). En todos nuestros casos se encontraron signos de hipertensión pulmonar en forma de: ateromatosis de las arterias pulmonares, esclerosis y lesiones de arterialización del retorno venoso y daño parenquimatoso secundario a fallo cardíaco izquierdo crónico. No existían sin embargo diferencias significativas con las alteraciones encontradas en los pulmones de los otros casos en los que la causa de la muerte no fue debida a fallo del injerto. 205 El fallo del injerto tiene una pobre expresividad en lo que se refiere a los hallazgos microscópicos observados en el miocardio. El más importante, por ser definitorio del proceso, es la ausencia de fenómenos de rechazo del injerto y de miocarditis por patógenos oportunistas. No encontramos en nuestros casos extensas lesiones de isquemia miocárdica probablemente debido al hecho de que el estudio de las arterias coronarias no mostraba lesiones arteriosclerosas significativas en ninguno de ellos, y al corto periodo de evolución. Las lesiones aparecieron en ambos ventrículos si bien fueron más frecuentes y extensas en el miocardio ventricular derecho. Edema intersticial, focos de hemorragia intramiocárdica o subendocárdica, y trombos de fibrina ocasionales en los vasos pequeños intramiocárdicos, son algunas de las lesiones microscópicas encontradas, todas ellas inespecíficas (Figuras 2 y 3). En el caso nº 3 existían necrosis isquémicas tanto subendocárdicas como intramiocárdicas de carácter focal (Figura 4). Esta tipo de isquemia focal, denominado daño isquémico temprano o de tipo A, está relacionada con fenómenos de reperfusión o administración de altas dosis de dopamina (8). El rechazo hiperagudo, que se sospechó en uno de nuestros casos, es en realidad un hecho cada vez más raro y como sucede en otras series, no tenemos ningún ejemplo estudiado por autopsia (2). Resulta igualmente de interés constatar que sólo uno de nuestros casos falleció a consecuencia de rechazo agudo de trasplante en este periodo postoperatorio. De lo anteriormenete expuesto de desprende que el fallo agudo del injerto se suele presentar en el periodo postopertorio temprano, se manifiesta preferentemente como un fallo ventricular derecho, y es responsable de aproximadamente el 50% de los fallecimientos ocurridos durante este tiempo. La funcionalidad del ventrículo derecho parece clave, no sólo para establecer el pronóstico a corto tiempo de los enfermos con cardio- DonaciónTrasplante 1.999. patía crónica grave (9), sino que también se configura como una de las causas más importantes del fallo del injerto cardiaco. El estudio de la misma en donantes de corazón, fallecidos tras daño cerebral de más de dos horas de duración, ha demostrado una disminución significativa en la función ventricular derecha, lo que ha lleva- Figura 2: Aspecto microscópico del miocardio mostrando hemorragias focales intersticiales. Figura 3: Aspecto microscópico del edema intersticial y trombosis de pequeños vasos intramiocárdicos. Figura 4: Aspecto microscópico de necrosis isquémicas de miofibrillas rodeadas por fibrillas con lesiones de anoxia aguda en forma de bandas de contracción y en el lado opuesta miofibrillas conservadas con edema entre ellas. 206 do a los autores a sospechar que este hallazgo podría tener relación con el fallo del injerto postrasplante (10). BIBLIOGRAFÍA: Actualizaciones en Trasplantes 2001. 1. Rose A, Viviers L, Odell Ja: Autopsy determined causes of death following cardiac transplantation. A study of 81 patients and literature review. Arch Pathol Lab Med 1992;116:1137-1141 2. Gallo P, Agozzino L, Arbustini E, Bartoloni G, Baroldi G, Bonacina E et al: Immediate causes of death in short-term surviving heart transplant recipients. Cardiovasc Pathol 1994;3:173-181. 3. Roosen J, Frans E, Wilmer A, Knockaert DC, Bobbaers H: Comparison of postmortem clinical diagnoses in critically ill patients. Mayo Clin Proc 2000;75:562-567. 4. Goodwin AT, Goddard M, Taylor Gj, Ritchie AJ: Clinical versus actual outcome in cardiac surgery: a postmortem study. Eur J Cariothorc Surg 2000;17:747-751. 5. Zuckermann AO, Ofner P, Holzinger C, Grimm M, Mallinger R, Laufer G, Wolner E: Pre- and early postoperative risk factors for death after cardiac transplantation: a single center analysis. Transpl Int 2000;13:28-34 6. Chin C, Feindel C, Cheng D: Duration of preoperative amiodarona treatment may be associated with postoperative hospital mortality in patients undergoing heart transplantation. J Cardiothorac Vasc Anesth 1999;13:562-566 7. Systemic Pathology. Third edition. General Editor W St C Symmers. Vol 5: The lungs. Edited by B. Curry .Chapter 14 : Congestion and oedema; thrombosis, embolism and infarction; hypertension. Churchill Livingston. London, 1992 8. Gallo P, Grillo LR, di Gioia C, Coppola L, Francanlanci P, dAmati GÇ: Working formulation nomenclature of heart transplant pathology: a retrospective evaluation of 1037 endomyocardial biopsies. Cardiovasc Pathol 1992;1:87-92 9. Gavazzi A Berzuini C, Campana C, Inserra C, Ponzetta M, Sebastiani R, Ghio S, Recusani F: Value of right ventricular ejection fraction in predicting short-term prognosis of patients with severe chronic heart faillure. J Heart Lung Transplant 1997;16:774-785 10. Kendall SW, Bittner HB, Peterseim DS, Campbell KA, Van Trigt p: Right ventricular function in the donor heart. Eur J Cardiothorac Surg 11;4:609-615 207 Resultados del trasplante renal de adultos en 1999. TRASPLANTE DE PROGENITORES HEMATOPOYÉTICOS EN LA LEUCEMIA LINFOBLASTICA DEL NIÑO. SITUACION ACTUAL Y EXPERIENCIA EN NUESTRO SERVICIO. J. Mª. Pérez Hurtado, J.M. Rodríguez-Fernández, R. Parody, M. Carmona, I. Espigado, A. Vaquero. Servicio de Hematología y Hemoterapia. La Leucemia Linfoblástica Aguda (LLA) es la neoplasia más frecuente en la infancia y por sí sola representa la cuarta parte de todos los tumores diagnosticados en la edad pediátrica. En la actualidad la tasa de curación de la LLA infantil se acerca al 80% de los casos. Los modernos esquemas de poliquimioterapia y una mejor comprensión de los factores de riesgo de recaída que presenta el paciente al diagnóstico son en gran parte responsables de este hecho. Cerca del 95% de los pacientes diagnosticados de LLA alcanzan la remisión completa con tratamiento quimioterápico y entre un 70-80% de los mismos se curan de su enfermedad tras finalizar el dicho tratamiento. Existe, por tanto un 30% de pacientes que actualmente no son susceptibles de ser curados sólo con quimioterapia. A estos pacientes se los denomina comúnmente de «muy alto riesgo (MAR). Para estos pacientes el trasplante de progenitores hematopoyéticos (TPH) en sus diversas modalidades aporta la posibilidad de curarse de su LLA. Identificar de manera precoz a dichos pacientes, se ha convertido en uno de los objetivos prioritarios para los hematólogos hoy en día. Existen varios factores pronósticos por los que podemos identificar a los pacientes con LLA de MAR: 1.- Factores derivados de la forma de presentación de la LLA al diagnóstico: Aquellos pacientes con formas hiperlecucocitarias (> 300 x 10E9/l y fenotipo 208 blástico de precursores B ó > 100 x 10E9/L y fenotipo blástico T), aquellos pacientes con grandes organomegalias y/o masa mediastínica y/o infiltración del SNC.. Es muy frecuente que en estos pacientes coexistan varios factores desfavorables de manera simultánea como son la hiperleucocitosis y las organomegalias. Son comúnmente considerados de MAR por la elevada carga tumoral al diagnóstico y por tanto candidatos a recibir un trasplante de progenitores hematopoyéticos como parte del tratamiento de su LLA. 2.- Factores derivados de la edad del paciente: La edad de presentación inferior al año corresponde a una entidad específica de la LLA denominada LLA del lactante que se suele acompañar de hiperleucocitosis, alteraciones citogenéticas de mal pronóstico, fenotipo blástico indiferenciado o bifenotípico (linfoide/mieloide) y mala respuesta al tratamiento. Estos pacientes son catalogados de MAR y supone una indicación para realizar un TPH. 3.- Factores derivados de determinadas alteraciones cromosómicas y/o presencia de reordenamientos de mal pronóstico en los exámenes de citogenética y biología molecular. Existen alteraciones citogenéticas en el 90% de las LLA infantiles. Algunas de estas alteraciones van a condicionar una mayor resistencia al tratamiento de la célula tumoral debido a que determinan elaumento en la proliferación celular, una inadecuada diferenciación celular o un retardo en la muerte celular programada entre otros sucesos. Son el resultado habitualmente de mutaciones somáticas adquiridas en la célula tumoral que producen ganancia o perdida de cromosomas, amplificaciones de genes, o reordenamientos por traslocaciones cromosómicas aberrantes. Alteraciones citogenéticas de MAR son por ejemplo la t(9;22) (reordenamiento bcr/abl) y la t(4;11) (reordenamiento MLL/AF4). Los pacientes en los que se demuestran estas alteraciones son candidatos a recibir un TPH una vez que se alcanza la remisión completa de su LLA. Actualizaciones en Trasplantes 2001. 4.- Factores derivados de la respuesta al tratamiento quimioterápico: 209 Aquellos pacientes que no alcanzan la remisión completa tras el primer ciclo de quimioterapia (inducción) son considerados de MAR y su pronóstico es especialmente pobre dada la resistencia de la célula tumoral a la quimioterapia. Suponen una indicación para realizar un TPH. Los pacientes con respuesta temprana pobre (evaluación de la respuesta en MO a las dos semanas de iniciar el tratamiento quimioterápico) en los que ya existían otros factores desfavorables son también catalogados de MAR. Los pacientes que recaen en médula ósea de manera precoz (antes de los tres años desde el diagnóstico) tras obtener la remisión completa son también considerados de MAR y candidatos al TPH. TIPOS DE TRASPLANTE DE PROGENITORES HEMATOPOYÉTICOS A APLICAR EN ESTOS PACIENTES: - TPH alogénico: Como fuente de progenitores se usa la médula ósea, las células progenitoras de sangre periférica o las células progenitoras de sangre de cordón umbilical. El donante puede ser familiar HLA idéntico, familiar parcialmente idéntico o no familiar HLA idéntico (trasplante de donante no emparentado, DNE). Permite tras administrar quimioterapia mieloablativa el injerto de progenitores hematopoyéticos de un donante sano, lo que reduce el riesgo de recaída leucémica pero supone un riesgo aumentado de fallo de implante, desarrollo de enfermedad injerto contra el huésped (EICH) aguda y crónica y una reconstitución inmunológica más lenta. El desarrollo de EICH puede también tener un efecto beneficioso si se presenta también reacción injerto frente a leucemia residual (EICL) y de hecho en pacientes seleccionados de especial riesgo de recaída se intenta potenciar esta reacción mediante la infusión de linfocitos del donante con posterioridad al TPH. - TPH autólogo: Como fuente de progenitores se usa la propia médula ósea o las células progenitoras de sangre periférica. El donante es el mismo paciente una vez que se encuentra en remisión completa. Los progenitores hematopoyéticos recogidos son manipulados in vitrocon métodos inmunológicos (ac. monoclonales) para eliminar en lo posible la enfermedad residual. Tras quimioterapia mieloablativa son de nuevo implantados en el paciente. El riesgo de fallo de implante es menor y la recuperación inmunológica es más rápida. No se desarrolla EICH ni por tanto EICL por lo que el riesgo de recidiva de la LLA es superior al TPH alogénico. En la actualidad, se encuentran en desarrollo técnicas de expansión clonal de progenitores hematopoyéticos in vitro para aquellos pacientes en lo que la recogida de progenitores hematopoyéticos autólogos no es suficiente en cantidad o calidad para garantizar un posterior implante. EXPERIENCIA EN NUESTRO CENTRO En nuestro Servicio de Hematología se realizan trasplantes en pacientes pediátricos desde el año 1988. En total se han realizado 109 trasplantes de progenitores hematopoyéticos en niños. En 47 pacientes (43% del total de enfermos pediátricos) el diagnóstico de base era una LLA infantil de MAR La edad media de los pacientes ha sido 8.2 años (Figura 1). En los pacientes afectos de LLA se han realizado 27 trasplantes autólogos de progenitores hematopoyéticos y 20 trasplantes alogénicos de progenitores hematopoyéticos. La fuente de progenitores hematopoyéticos en los 27 trasplantes autólogos ha sido la médula ósea en 25 de ellos y las células progenitores de sangre periférica en los dos restantes. La fuente de progenitores hematopoyéticos en los trasplantes alogénicos ha sido la médula ósea en 19 pacientes y células progenitoras de sangre de cordón umbilical en un paciente. En los trasplantes alogénicos se ha usado como donante un hermano HLA idéntico en 13 casos y en los 7 restantes se han realizado con 210 un donante no emparentado HLA idéntico. Un paciente sometido a trasplante alogénico de médula ósea, recibió posteriormente en dos ocasiones infusión de linfocitos del donante. La supervivencia global de los pacientes es de 47% (22 pacientes). El motivo de éxitus ha sido recidiva en 17 pacientes (70% de la mortalidad), EICH aguda en 3 pacientes (12%), infección en 3 pacientes (12%) y encefalopatía progresiva en 1 paciente (4%). Si se comparan los periodos comprendidos entre 1988 a 1994 y 1995 a 2000 (Fig 2) se pueden apreciar que existen diferencias en el número de trasplantes realizados que se han ido incrementando y en la supervivencia de los pacientes que ha mejorado (37.5% vs. 55%). El aumento de la supervivencia de los pacientes con LLA sometido a TPH puede ser debido a la mejora en los tratamientos de soporte y a los modernos métodos diagnósticos de las complicaciones, al mejor conocimiento de los factores de riesgo y la detección de la enfermedad mínima residual y a la progresiva experiencia acumulada en este centro por el equipo responsable de todas las fases del TPH que se extiende en la actualidad a12 Actualizaciones en Trasplantes 2001. Figura 1: 211 Figura 2: años. RESULTADOS DE TPH EN LAL INFANTIL SERVICIO DE HEMATOLOGÍA. HUVR. 1988-2000 TPH AUTÓLOGO ALOGÉNICO NÚMERO 27 20 1ª RC 15 5 2ª RC 12 10 ENF. AVANZADA 0 5 SUPERVIVENCIA 56% (15/27) 40% (8/20) SUPERV. 1ª RC 60% (9/15) 80% (4/5) SUPERV. 2ª RC 50% (6/12) 40% (4/10) - 0% (0/5) SUPERV. EA. Seguimiento medio: 5.2 años El motivo de éxitus ha sido recidiva en 17 pacientes (70% de la mortalidad), EICH aguda en 3 pacientes (12%), infección en 3 pacientes (12%) y encefalopatía progresiva en paciente (4%). 212 TRASFUSION Y COMPLICACIONES INMUNOHEMATOLOGICAS EN EL TRASPLANTE DE ORGANOS SOLIDOS P.Noguerol Novella, C.Martinez Carvajal, F.Caso Sanz, J.M.Jimenez Jimenez, J.M. Rodriguez Fernandez. Servicio de Hematología y Hemoterapia. INTRODUCCION La sangre es un producto alogénico que pueden causar en el receptor una doble respuesta inmune: sensibilización a unos antígenos incompatibles e hiporespuesta a otros. El resultado de la primera es la formación de aloanticuerpos contra hematíes , plaquetas, leucocitos y proteínas plasmáticas. La segunda da lugar a un estado de tolerancia inmunológica. (1) El efecto beneficioso de esta última se observó por primera vez comprobando la mayor supervivencia del órgano en los transplantados renales previamente transfundidos. Actualizaciones en Trasplantes 2001. El aspecto negativo es objeto de múltiples trabajos en la actualidad, que tratan de esclarecer cómo esta tolerancia favorece las infecciones e incluso el crecimiento de células tumorales. 213 El mecanismo regulador de la respuesta inmune, es el grado de histocompatibilidad de las células del donante y del receptor. Una transfusión incompatible en el sistema HLA producirá un efecto inmunogénico, mientras que si la incompatibilidad es parcial el efecto será inmunosupresor. Por otra parte la sangre aporta linfocitosT, células inmunocompetentes con capacidad de reaccionar contra los tejidos del receptor provocando la enfermedad injerto contra huésped (EICH asociada a transfusión ). Esta es una complicación grave, cuya frecuencia se estima entre el 0,1 y el 1% en pacientes inmunodeprimidos, especialmente los receptores de MO, transfusión intrauterina, e inmunodeficiencias congénitas. Finalmente puede ser trasmisora de enfermedades víricas HVC, HVB, HIV, CMV y otros gérmenes. Esto obliga a los Bancos de Sangre a extremar las medidas que garanticen un máximo de seguridad, siguiendo unas normas que se actualizan cada año por la Asociación Americana de Bancos de Sangre ( AABB ) (2) y el Consejo de Europa. De todo esto se deduce que la transfusión sanguínea es una terapia muy activa, que debe tener siempre una indicación clínica justificada, una selección adecuada del producto a transfundir y un control estricto por parte del Banco de Sangre Hospitalario. TRANSPLANTE DE ORGANOS SOLIDOS Los transplantes alogénicos de órganos sólidos (TxOS) han abierto un gran campo de posibilidades terapéuticas en las últimas décadas, pero también estamos asistiendo a nuevas patologías derivadas de trastornos inmunes. Los candidatos a Tx hepáticos, renales y cardíacos son pacientes que presentan los siguientes problemas: 1- Sensibilización por transfusiones previas ,con aloanticuerpos suero y memoria inmune. 2- Terapia inmunosupresora que facilita la reacción de los linfocitos presentes en la transfusión y en el injerto contra las células del donante , además favorece la infección por virus transmisibles. 3- Elección de un órgano que sea el mejor aceptado por el receptor, lo que no siempre es fácil especialmente en patologías que requieren máxima urgencia . 4- Alteraciones de la hemostasia y la coagulación especialmente en candidatos a Tx hepático y renal. En resumen el transplante de órganos sólidos y en especial el de hígado , es una actividad multidisciplinaria que requiere coordinación entre todos los especialistas y en la que el Banco de Sangre juega un papel que se analiza a continuación. MISION DEL BANCO DE SANGRE El Banco de Sangre Hospitalario no se limita al soporte hemoterápico , sino que atiende al estudio pre transplante del candidato, selecciona el producto adecuado y compatible durante la cirugía y diagnostica precozmente las alteraciones inmunohematológicas que se presentan en el postoperatorio. 1- SENSIBILIZACION POR TRANSFUSIONES La presencia de aloanticuerpos es relativamente frecuente en candidatos a Tx hepá214 tico , cardíaco y renal . La predisposición en cirróticos y afectos de hepatitis vírica a formar alo y autoanticuerpos anticuerpos, y las transfusiones recibidas por hemorragia, cirugía cardiaca y anemia renal, elevan en estos enfermos la incidencia de anticuerpos irregulares . Según algunos autores su frecuencia puede superar el 6% de anticuerpos anti eritrocitarios clínicamente significativos. En nuestro Centro , de 410 candidatos a Tx hepático y cardíaco 4,6 % han dado resultados positivos, frente al 1,8% de 5000 pacientes que han requerido transfusiones por otras patologías. Un paciente ha presentado asociaciones de Ac : anti C,E, Kell y Jka, y 6 han sido portadores de aglutininas frías ,activas a temperatura ambiente, que interfirieron la de prueba cruzada . Cuando existen anticuerpos que dificultan la búsqueda de sangre compatible , el equipo de transplante debe estar informado con antelación . El Banco debe de ser avisado con tiempo y conocer el grupo de donante y receptor para preparar la reserva de concentrado de hematíes (CH) y derivados. Los requerimientos transfusionales disminuyen paralelamente al perfeccionamiento de la cirugía , y han sido publicados .Se resumen en la TABLA 1 En el Tx hepático la media de consumo en la fase intraoperatoria es de 12U de CH con un rango muy amplio (1-200), las mismas unidades de plasma y 15 U de plaquetas (0-70) . En el postoperatorio 4U de sangre (0-75) , 14U de plasma (0-123) y 15U de plaquetas (0-400). Como mínimo se considera actualmente aceptable una reserva de dos veces la volemia , aunque el estado hemostático del candidato pueda hacer cambiar las previsiones. Si por la complejidad de los anticuerpos no es posible obtenerla se pueden efectuar plasmaféresis antes de la cirugía para reducir el nivel de anticuerpos circulantes . Actualizaciones en Trasplantes 2001. También se recurre a transfundir la sangre compatible al principio y la incompatible después , cuando el nivel de anticuerpos es mas bajo por hemodilución. 215 Sólo cuando se demuestren Ac antiplaquetas se pondrán concentrados obtenidos por aféresis de donante único compatible , siendo este método costoso y de difícil ejecución logística. 2- TERAPIA INMUNOSUPRESORA La terapia inmunosupresora a la que se someten estos enfermos para evitar el rechazo del órgano facilita: a) la reacción de los linfocitos del donante contra las células del receptor. b) La infección por gérmenes oportunistas transmisibles por la sangre y derivados. a) Los linfocitos T son células imunocopetentes. Se encuentran en la sangre y derivados transfundidos y en el órgano transplantado. Estas células pueden producir anticuerpos frente a los tejidos del receptor que no reconocen , provocando la enfermedad injerto contra huésped. Hay que sospecharla en el primer mes después de la transfusión cuando aparece fiebre, eritrodermia, diarrea, hepatitis y aplasia medular. Su desarrollo depende de la cantidad de linfocitos presentes (son suficientes 10E6), de la compatibilidad HLA entre donante y receptor, y del grado de inmunosupresión (3) Por este motivo, es especialmente grave en transplantados de MO alogénica , en inmundeficiencias congénitas y en prematuros sin capacidad de respuesta inmune. Como veremos mas adelante, en casos de transplante de órganos incompatibles en el sistema ABO, no es infrecuente que estos linfocitos den lugar a anticuerpos contra a los glóbulos rojos del receptor provocando hemólisis aguda de grado leve a muy grave. La desleucotización de los productos a transfundir mediante filtros que reducen a 10E5 la cantidad de leucocitos en el derivado final ,es un medio eficaz para prevenir este problema. Cuando se requieren transfusiones masivas en la cirugía, no es necesaria la desleucotización mientras dura la hemorragia , pero es de mucha importancia que la sangre no transfundida durante el acto quirúrgico sea devuelta al Banco. Alli se procesará adecuadamente aconsejándose su filtración para eliminar linfocitos antes de transfundir en el postoperatorio. En casos de alto riesgo como en los Tx alogénicos de MO con ablación de la médula del receptor , se procede a la irradiación gamma de sangre y plaquetas con 2.500 rads . b) El peligro de transmisión de virus y otros gérmenes en los productos sanguíneos ha llevado a los Bancos a adoptar medidas que actualmente hacen de la transfusión una terapia segura en receptores imunocompetentes. El riesgo de infectividad para el VIH 1 se considera en nuestro medio de 1/500.000 transfusiones. La del VIH 2 casi inexistente. Para el VHB el riesgo potencial es de 1/200.000 . Los casos residuales de transmisión de hepatitis por virus B se producen por donantes con cantidades de HbsAg debajo de niveles detectables ( < 0,5 micgr/ml ). Casi todas las hepatitis postransfusionales son por el VHC (1/3000 transfusiones). 216 La selección de donantes seronegativos por técnicas muy sensibles ha reducido al mínimo del riesgo de infecciones por estos virus. La pasteurización de derivados plasmáticos y el tratamiento con Solvente /Detergente , que rompe la capa lipídica de los virus , está siendo utilizado igual que la puesta en cuarentena de los preparados por parte de los Centros de Transfusión .(4) Aunque estas medidas han demostrado su eficacia por separado, está por valorar la relación costo beneficio para su generalización. Caso aparte es el CMV . La prevalencia de seropositivos en la población Española es muy alta: 70%, lo que hace imposible la selección de donantes. Este virus puede producir en personas con función inmune normal infección asintomática quedando latente en tejidos y leucocitos durante años. Se considera que solo el 2% de las personas seropositivas pueden transmitir el virus a través de la sangre. En personas inmunodeprimidas es causa de seria morbilidad. La enfermedad puede producirse por transmisión del virus latente en las células sanguíneas y en los órganos de donantes seropositivos . Se reactiva en el receptor después de la transfusión. También la inmunomodulación producida por esta puede reactivas el virus endógeno del receptor. La desleucotización de la sangre y plaquetas es un medio para prevenir la enfermedad al mismo tiempo que la administración profiláctica de medicación antiviral. 3- ELECCION DEL ORGANO. Es conocido que la supervivencia del Tx renal depende no sólo de la compatibilidad en el sistema HLA y de las pruebas de citotoxicidad , sino de la tolerancia inmune provocada por la Ciclosporina que ha venido a desplazar a la obtenida por las transfusiones en décadas anteriores. Actualizaciones en Trasplantes 2001. Pero también el Sistema ABO juega un papel importante en el transplante de órganos. 217 Las sustancias A y B se encuentran no sólo en los hematíes sino también en células del endotelio, epitelio y en varios líquidos del organismo. Las aglutininas anti A y anti B están de forma natural en el suero de todos los individuos excepto los AB. Por tanto los antígenos ABO pertenecen al Sistema mayor de histocompatibilidad. Elegir receptor y donante isogrupo ABO es fundamental aunque no siempre posible por la urgencia de algunas casos. El Banco debe decidir que grupos de sangre y derivados pueden administrarse En los receptores O y A la sangre y derivados se ponen isogrupo . Para los B , en los que se prevea un consumo importante de sangre se puede recurrir a poner O. Para los AB se puede poner sangre y plasma A, reservando el plasma AB para el final de la intervención y para las fases postoperatorias. En el Sitema Rh , la sangre negativa debe reservarse para mujeres en edad fértil y cuando existan aloanticuerpos anti D. En la administración de concentrado de plaquetas hay que tener en cuenta la contaminación de hematies las aglutininas pasivas anti A y anti B incompatibles que pueden se altas en las unidades de grupo O. Cuando no se dispone de donante compatible ABO, se puede poner un órgano no isogrupo. Pero hay que tener muy claras las posibles complicaciones para poderlas prevenir, diagnosticar y tratar adecuadamente . Es imprescindible que el Banco tenga información del grupo de donante y receptor en estos casos. Se pueden presentar dos tipos de situaciones: - Incompatibilidad mayor - Incompatibilidad menor. - La primera se da : cuando un receptor O reciben un donante A,B o AB . cuando un receptor A recibe un donante B o a la inversa. - La segunda se da : cuando los receptores A,B,o AB se trasplantan con órgano O. En el primer caso puede haber rechazo agudo del órgano por los anticuerpos antiA y anti B presentes en el receptor que agreden a los tejidos que contienen sustancias A y B. En el segundo caso los linfocitos T presentes de forma pasajera en el órgano trasplantado de grupo O , no reconocen los antígenos A y B , fabricando anticuerpos contra los hematíes del receptor y provocando hemólisis aguda entre los dias 714. Casi siempre es autolimitada desapareciendo espontáneamente, pero en ocasiones provoca la muerte del paciente con coaglulopatía de consumo y fracaso multiorgánico. En nuestra casuística se han documentado 2 casos de hemólisis y muerte por anti B entre10 casos de incompatibilidad menor de Tx hepático . Los dos estaban en tratamiento con Ciclosporina A. En la actualidad se eligen siempre trasplantes compatibles. Una hemoterapia adecuada ayuda a prevenir el cuadro y a su localización. La pauta transfusional se refleja en la TABLA II. 218 También se ha relacionado la supervivencia del transplante renal con el grupoABO siendo mayor en los pacientes de grupo O que han recibido Ciclosporina A como tratamiento inmunosupresor. 4-ALTERACIONES DE LA COAGULACION SANGUINEA. Los problemas en la coagulación que se presentan en los pacientes candidatos a transplantes, especialmente los hepáticos, exigen por parte del Banco un soporte importante que varía según las fases de la cirugía. La situación con que el paciente entra al quirófano (déficit de factores de síntesis hepática trombopenia e hipertensión portal), hace prever la reserva de sangre , plasma y plaquetas y es variable dependiendo de cada patología. En la fase de disección hepática se producen hemorragias derivadas de la cirugía y del estado hemostático del paciente. En la fase anhepática se produce una ausencia total de factores hepatodependientes . En la fase de revascularización del nuevo hígado se dan los trastornos mas graves, con paso a la circulacion de factores procoagulantes y fibrinolíticos, y atrapamiento de plaquetas que hay que valorar adecuadamente. Los productos base para conseguir de nuevo el equilibrio son: concentrado de glóbulos rojos para mantener oxigenación, plasma fresco congelado que contiene la totalidad de los factores de coagulación y sus inhibidores en proporciones fisiológicas , y concentrado de plaquetas : 1U /10 Kg peso de pool de varios donantes o 1U de donante único obtenida mediante aféresis. Pero su eficacia dependerá no sólo de las indicaciones sino de su correcto manejo. Actualizaciones en Trasplantes 2001. - 219 La sangre debe ponerse concentrada y desleucotizada. Se irradia en TxMO alogénicos considerados de alto riesgo. Post desleucotización no debe guardarse mas 6-8 horas por tratarse de un sistema abierto y con peligro de contaminación , por lo que este proceso debe hacerse en el Banco, inmediatamente antes de transfundir y sólo cuando se esta seguro de su administración. - El plasma debe estar descongelado recientemente para mantener factores de vida media muy corta como el V y el VIII. - Las plaquetas deben tener entre 5 y 7 días (se ha encontrado relación entre tiempo de almacenamiento y transmisión de infecciones), estar mantenidas a temperatura ambiente (nunca a 4 grados), en continua agitación para evitar la formación de agregados que las hace ineficaces y vigilando el color y turbidez por posibles cambios de PH. Hay que tener encuenta que la sangre compatible antes de la transfusión puede no serlo a las 48 horas de la misma por la aparición de nuevos anticuerpos debidos a la respuesta inmune de memoria que es muy rápida. Este hecho normal en inmunocompetentes , es menos frecuente en inmunodeprimidos , pero hay que tenerlo en cuenta. Por todos estos motivos, es aconsejable que los productos sanguíneos sean mantenidos y controlados en el Banco hasta su utilización y solo se disponga en quirófano de la reserva imprescindible. CONSIDERACIONES FINALES No hay que olvidar que después de cada proceso transfusional la situación inmune del paciente ha cambiado. Que un mejor conocimiento de los efectos de la transfusión nos llevará a extremar el cuidado con las indicaciones , administrando sólo los productos imprescindibles y en las mejores condiciones. Terapias alternativas como la utilización de Eritropoyetina recombinante han mejorado la calidad de los enfermos renales, disminuyendo sus requerimientos transfusionales y mejorando su calidad de vida . Actualmente Protocolos de utilización de EPO , Autodepósito y Congelacion de hematies están en estudio para evitar en lo posible el uso de sangre en los pacientes candidatos a cirugía de elevado riesgo hemorrágico y en receptores con anticuerpos públicos. Referencias Bibliográficas 220 (1) Technical Manual AABB,11th edition 1993.Chaper 7:Immunohematology 160-164 (2) Klein HG, de. Standards for Blood Banks and Transfusion services.17th edition. Bethesda,MD:American Association of Blood Banks,1996 (3) Transfusion induced graft versus-host disease. In: Garratty G. Inmunobiology of Transfusion medicine. 1994:631-56. (4) Sovent Detregent Treated Plasma. Educational Program Blood. American Society of Hematology Annual Congress. St.Louis. 1993: 122-127 Actualizaciones en Trasplantes 2001. TABLA I TABLA II 221 El diagnóstico de muerte. Desde diagnósticos ancestrales de muerte hasta el diagnóstico de muerte por criterios encefálicos. José María Domínguez Roldán. Servicio de Cuidados Críticos y Urgencias. INTRODUCCIÓN AL CONCEPTO DE MUERTE De todos los diagnósticos que pueden realizarse en medicina, el diagnóstico de muerte se producirá indefectiblemente en todos los individuos. La trascendencia por tanto del concepto muerte y de las herramientas médicas para su diagnóstico han sido objeto de tratados y escritos a lo largo de milenios. La importancia del establecimiento del diagnóstico de muerte viene dada por varios factores: Ser el único diagnóstico común a todos los seres vivos, el de ser un diagnóstico del que se derivan importantes tomas de decisiones ( enterramiento, incineración del cuerpo, extracción de órganos para trasplantes, etc..), y el de tener una trascendencia transcultural. Pero al igual que cualquier diagnóstico médico, debe partirse de un concepto inicial, en este caso la muerte, para posteriormente derivar en una definición, y tras ello, en función establecer cuales son las herramientas para el diagnóstico. Las implicaciones culturales en el diagnóstico de muerte son tan importantes (figura 1), que aun en nuestros tiempos es posible encontrar algunas tribus aisladas en los que la incapacidad del individuo para colaborar con el mantenimiento del grupo es considerara sinónimo de muerte social del individuo, demandándosele la exclusión del grupo. En esta situación, la exogamia tribal se implementa como el punto de inflexión entre el individuo vivo y el individuo muerto. La expulsión fuera del ámbito de protección de la tribu conlleva la muerte física por inasistencia durante los días o semanas siguientes. Los conceptos culturales de muerte, aunque vigentes en algunas áreas geográficas actualmente se plantean como social, cultural, ética y médicamente inaceptables con la perspectiva de la cultura occidental. Solo el la concepción médica de la muerte es aceptada actualmente para la definición de la misma. En consecuencia, solo criterios médicos son aceptados para definir la muerte. 222 Figura 1: Actualizaciones en Trasplantes 2001. No obstante, aun desde la perspectiva médica del diagnóstico de muerte, si revisamos los conceptos de muerte a lo largo de los años, podemos observar cómo han existido diversos conceptos de muerte y en consecuencia diversas definiciones de la misma. La rigidez cadavérica, o incluso la putrefacción corporal eran demandadas como signos de adrentramiento de la muerte en el individuo. Aun es posible observar cómo alguna documentación de certificación de muerte, con vigencia legal, se demandan, al menos en teoría, la existencia de signos manifiestos de descomposición corporal en el cadáver sobre el que se esta certificando la muerte. El miedo social a la certificación de la muerte en individuos aun vivos subyace, probablemente, en estos atavismos documentales. Evidentemente la confirmación de la existencia de putrefacción o descomposición corporal, se antojan actualmente como signos inaceptablemente tardíos para el diagnóstico de muerte. 223 Pero la sociedad demanda a los médicos no solamente la certificación de la muerte, sino el establecimiento preciso de un momento en el tiempo ( y de hecho así debe hacerse constar en la certificación de muerte) a partir del cual la muerte pueda ser legalmente establecida. Ello no solamente tiene trascendencia legal, sino también clínica, ya que a partir de ese momento las manipulaciones que puedan realizarse sobre el cuerpo debe ser consideradas manipulaciones sobre un cadáver y no sobre un individuo vivo. La extracción de órganos para trasplante es una de las manipulaciones a las que con frecuencia se somete al cadáver, por ello el establecimiento preciso y puntual de la muerte se convierte en un elemento no solo trascendente para el individuo fallecido, sino con importantes implicaciones clínicas para los potenciales receptores de órganos en trasplante. A pesar de estas consideraciones pragmáticas, no podemos olvidar que, definido en términos biológicos el fallecimiento de un ser humano, no es un evento instantáneo sino un proceso evolutivo, durante el que van extinguiéndose las distintas funciones de los órganos corporales, para finalizar cuando todas las células del organismo han cesado irreversiblemente su función. A pesar de la aceptación de la muerte como un proceso, la confirmación de muerte debe establecerse en términos biológicos objetivos y además debe definirse en un punto concreto del tiempo. Durante milenios, la ausencia de cualquier tipo de movimiento corporal (incluyendo movimientos respiratorios y latido cardíaco) había sido el signo mas aceptado para distinguir el adentramiento de la muerte en el individuo. Ello estaba justificado Figura 2: por el hecho de que a partir del cese de los movimientos cardíacos y respiratorios se desarrollaban rápida e irremediablemente múltiples procesos de desestructuración orgánica (rigidez, putrefacción, etc.,) identificados con la muerte (figura 2). Con el advenimiento de las unidades de cuidados intensivos y el desarrollo de técnicas de soporte vital (asistencia cardiaca, ventilatoria, etc....) se ha modificado el pronóstico de un gran número de procesos que clásicamente abocaban a la muerte. Actualmente ciertas enfermedades que antes se consideraban letales (shock cardiógeno, insuficiencia respiratoria grave etc.,..) pueden ser controlados mediante técnicas de soporte vital ( bombas de circulación extracorpórea, oxigenadores de membrana, etc...) capaces de sustituir completamente las funciones cardiaca y respiratoria del enfermo, de manera que este, tras la resolución del proceso agudo puede independizarse de los elementos mecánicos de soporte y reincorporarse a una vida normal. Ello ha llevado a una modificación de los conceptos de fallo orgánico que servían para establecer la frontera entre la vida y la muerte ya que hasta esas fechas, la presencia de fallo grave cardiocirculatorio, respiratorio o neurológico desencadenaban inevitablemente la muerte ante la ausencia de elementos sustitutivos para las funciones de dichos órganos. Por todo ello, en la actualidad, el fracaso completo e irreversible de las funciones de sistema nervioso central es la autentica frontera entre la vida y la muerte del ser humano. Varios son las razones para esta aseveración, aunque quizás la principal sea el hecho de que el fracaso neurológico completo se acompaña irremediablemente del cese de las funciones cardiaca y respiratoria, y en consecuencia el desencadenamiento inmediato del 224 proceso de la muerte. No obstante gracias a las técnicas de soporte antes mencionadas, es posible diferir durante unas horas, o días, el cese de la función cardiaca. Esa situación de afectación irreversible del sistema nervioso central, con incapacidad para el mantenimiento espontáneo de la homeostasis corporal, con función cardiocirculatoria espontánea (aunque a veces con apoyo farmacológico) y ventilación asistida, es definida como muerte encefálica, y reconocida en muchos países del mundo como la muerte legal del individuo. CONCEPTOS Y DIAGNÓSTICOS DE MUERTE ENCEFÁLICA. Actualizaciones en Trasplantes 2001. En los últimos años de la década de los 50, la existencia de unidades de cuidados intensivos propició los primeros casos de muerte encefálica: pacientes cuya función neurológica desaparecía a causa de un proceso encefálico, pero que a consecuencia de estar sometido a asistencia ventilatoria y circulatoria no desarrollaban el paro respiratorio y circulatorio consecuente con el fallo de la homeostasis controlada por el encéfalo. Esos primeros casos definidos como situación de coma depasse eran considerados como una situación de muerte inminente, es decir, la muerte del encéfalo como pronóstico. No fue hasta finales de los 60 en los que esa situación fue considerada como un diagnóstico de muerte. Es en esos años en que la muerte encefálica fue considerada la muerte del individuo como globalidad. 225 A pesar de que pudiera considerarse que desde el punto de vista clínico no deberían existir dificultades en el concepto de ausencia de funciones cerebrales hoy día existen diferencias conceptuales relevantes en el en la formulación de muerte encefálica. La ausencia de consenso sobre el concepto de muerte encefálica entre diversas escuelas médicas, deriva en la coexistencia actual de tres tres principales formulaciones de muerte encefálica: la Muerte Encefálica Global, la Muerte troncoencefálica y la Muerte Neocortical (figura 3). Esta discrepancia conceptual en un diagnóstico tan relevante como la muerte es capaz de sembrar la intranquilidad en algunos profesionales dedicados no solo a la atención del paciente neurocrítico, sino también en los relacionados con el mundo de la coordinación de trasplantes. La adscripción de las distintas legislaciones a cada una de las diferentes escuelas médicas, lleva a la paradoja que al pasar la frontera (incluso virtual entre países de la Unión Europea) entre dos países vecinos, como pudieran ser España y Portugal, un individuo podría estar legalmente muerto en un país y no estar en el otro. Pudiendo ser donante de órganos en un país, y siendo considerado un individuo vivo en otro. El concepto de Muerte Encefálica Global (figura 4), para establecer el diagnóstico de muerte en la mayor parte de los países de la Europa Occidental, entre ellos España, y EEUU, es preciso, por una parte la constatación clínica de la ausencia de todas las funciones neurológicas del sistema nervioso central, y por otra, la demostración de fenómenos intracraneanos hemisféricos vinculados a la muerte encefálica. Estos manifestaciones fisiopatológicas (ausencia de actividad bioelectrica cerebral o el cese de la circulación intracraneana, etc.), aparecen íntimamente ligadas a la muerte encefálica, y aunque no son sinónimos de la misma, su demostración refuerza los hallazgos clínicos, confirma la globalidad de la afectación de las funciones encefálicas y apoya la irreversibilidad del proce- so. Para establecer el diagnóstico de muerte encefálica según el concepto de muerte encefálica global, es preciso la constatación de ausencia de funciones encefálicas, para lo cual es necesario la realización de una completa exploración clínica que ponga en evidencia la ausencia , no solamente de consciencia, sino también de cualquier actividad neurológica a vinculada a tronco del encéfalo o hemisferios cerebrales. Dado que el examen clínico no es capaz de abordar los hemisferios cerebrales en los casos en que el tronco del encéfalo se muestra inactivo, es preciso recurrir a pruebas instrumentales (EEG, pruebas de flujo cerebral ...) para constatar la existencia de los fenómenos intracraneales antes comentados y vinculados a la ausencia de función hemisférica. En estos pacientes, no existe substrato biológico para el mantenimiento de contenido de conciencia ni despertar (arousal de los anglosajones). Los defensores del concepto de Muerte Troncoencefálica demandan la ausencia de función del tronco del encéfalo como requisito fundamental para la constatación de la muerte, y no requieren la inexistencia de funciones cerebrales hemisféricas(figura 5). En este caso, la ausencia de funciones neurológicas dependientes de los hemisferios cerebrales y la existencia de los fenómenos antes citados (cese circulatorio, cese de la actividad eléctrica) son fenómenos que pueden estar presentes o ausentes, y que en ningún modo condicionan el diagnóstico de muerte, siendo suficiente la demostración mediante exploración clínica de la ausencia de actividad neurológica para el establecimiento del diagnóstico. En este tipo de pacientes, seria posible, en algunos casos, la persistencia de substratos biológico para el mantenimiento del contenido la consciencia. Es decir si el encéfalo fuese un computador, podría persistir toda la información y programas en el disco duro, aunque la imposibilidad de demostrarlo por ausencia de conexión exterior, impediría su demostración. Para los críticos de este concepto de muerte encefálica el considerar estos sujetos como fallecidos parte de planteamientos éticos tales como si el paciente tiene substrato biológico para pensar o sentir ¿porqué considerarlos fallecidos?. Los que propugnan el concepto de muerte troncoencefalica, invocan el hecho de que indefectiblemente el paciente con muerte de tronco desarrollara muerte encefálica global a lo largo de días o semanas. Esta argumentación es contestada por los detractores del concepto en tanto que están convirtiendo el diagnóstico demandado de muerte en un pronóstico de muerte. Actualmente la mayor parte de los países de Europa del Este, el Reino Unido y Portugal emplean el concepto de Muerte Troncoencefálica. El concepto de Muerte Neocortical ha sido desarrollado mas recientemente y es una concepción de muerte basada en la consciencia. Existen dos principales elementos en la consciencia: una el contenido (donde se almacena toda la información) y en segundo lugar la capacidad de contactar con el entorno, también llamado despertar o arousal (figura 6). Algunos pacientes, como por ejemplo pacientes en estado vegetativo o anencefalicos, sufren una pérdida irreversible del contenido de la conciencia. Según la formulación neocortical de muerte encefálica, estos pacientes podrían ser considerados como fallecidos. En estos pacientes, pueden existir actividades corticales y subcorticales, así como funciones dependientes de tronco del encéfalo. Lógicamente el diagnóstico se basa exclusivamente en la exploración 226 Actualizaciones en Trasplantes 2001. Figura 3 Figura 4 227 Figura 5 Figura 6 clínica de la consciencia .La formulación Neocortical para el establecimiento de la muerte encefálica sustenta el concepto de muerte en la constatación de la pérdida irreversible de la percepción, la conciencia y las funciones cognitivas del individuo, con independencia de la existencia de otro tipo de actividad encefálica. Tampoco es precisa la demostración del cese de funciones intracraneanas entes citadas (como circulación intracraneal, etc...), por lo que los tests instrumentales para la constatación diagnóstica son considerados, por dichos autores, como innecesarios. HACIA LA UNIFICACION DEL CONCEPTO DE MUERTE La confrontación histórica de distinto conceptos de muerte y la confrontación actual entre distintas escuelas médicas y legislaciones, se presenta como uno de las situaciones mas llamativas de la medicina, en la época de globalización de actuaciones. Así como la actividad de trasplantes tiende a globalizarse: intercambio internacional de órganos, desplazamiento internacional de equipos extractores para trasplantes en otro país diferente, la ausencia de homogeneidad en el concepto de muerte se presenta como un anacronismo poco aceptable desde el punto de vista legislativo, cultural, ético y médico. Mas que una discrepancia conceptual algunos pensamos que es la aplicación pragmática de un diagnóstico cierto (solo es cuestión de esperar argumentan algunos) lo que conlleva la aplicación de criterios, poco aceptables hoy día para el diagnóstico de muerte. ¿ Que pasaría si las legislaciones de ciertos países demandaran la realización de EEG o pruebas de flujo sanguíneo cerebral en países en los que estas pruebas están prácticamente inaccesibles para el tratamiento cotidiano de pacientes? ¿ No se establecería el diagnostico de muerte? Probablemente el desarrollo socioeconómico de los sistemas sanitarios favorecerá el diagnóstico de muerte según el concepto de muerte encefálica global. Este concepto es el que reúne menor número de criticas, y si por alguna destaca es por la necesidad de empleo de herramientas instrumentales para su cumplimentación. Pero, ¿ No merece la pena su empleo cuando el diagnóstico de muerte es probablemente el mas importante 228 que puede realizarse en medicina?. Afortunadamente en España y la mayor parte de los países de nuestro entorno el concepto de Muerte Encefálica Global y las herramientas para su diagnóstico están siendo aplicadas de modo irrenunciable y certero. Probablemente, parte del éxito de los programas de trasplantes en el Estado Español pueda ser atribuible a la rigurosidad de la aplicación del diagnóstico de muerte, el cual no deja lugar a dudas a profesionales y ciudadanos. Solo una última reflexión. Debe de cuidarse la semántica cuando hablemos de muerte del encéfalo. Así como hasta hace pocos años Muerte Cerebral era el término mas empleado, mas recientemente fue sustituido por el de Muerte Encefálica, tratando de incluir los conceptos de muerte del todo el encéfalo (hemisferios y tronco del encéfalo). Probablemente, en los próximos años debe avanzarse aun mas en este aspecto terminologico. Partiendo de que no existe mas que un tipo de muerte, y de que son los conceptos y criterios médicos los que delimitan la frontera de la muerte, (muerte debida a parada cardiaca, muerte debida a parada respiratoria, muerte debida a ausencia de función encefálica), deberemos hablar de Diagnóstico de Muerte, según criterios Encefálicos por contraposición a Diagnóstico de Muerte según criterios cardiacos. Con ello no solamente nos aproximaremos con mayor exactitud a una realidad clínica, sino que favoreceremos el entendimiento de la actividad médica del diagnóstico de muerte por parte de la población general. BIBLIOGRAFÍA - Actualizaciones en Trasplantes 2001. - 229 - A definition of irreversible coma. Report of The Ad Hoc committee of The Harvard medical School to examine the definition of brain death. JAMA 205: 337-340; 1.968 Cerebral death and electroencephalogram: Report of the Ad Hoc Committee of the American Electroencephalographic Society on EEG criteria for determination of cerebral death. JAMA 209: 1505-1510; 1969. Chaparro D, Madrazo J. Potenciales evocados multimodales en el diagnóstico de muerte cerebral. Influencia de los barbitúricos y la hipotermia. En Diagnóstico neurofisiológico de muerte cerebral en la donación de órganos. Sociedad Española de Neurofisiologia Clinica. Saned. Madrid 1.986. Diagnosis of brain death: Conference of Royal Colleges and Faculties of the Unite Kingdom. Lancet 2: 1069-1070; 1.976. Domiguez-Roldan J.M. Garcia-Alfaro, Murillo-Cabezas, et al. Changes in the intracranial pulse pressure waveform associated with brain death. Transplant Proc, 1999 Sep, 31:6, 2597-8 Domínguez JM, Muñoz MA, Murillo F et al. La tomografia axial computarizada en el diagnóstico de lesiones con alto riesgo de evolución a muerte cerebral. Medicina Intensiva 15 (Suppl 1): S128; 1.991. Domínguez JM, Murillo F, González E et al. Utilidad de la monitorización de la presión de perfusión cerebral en el diagnóstico de muerte cerebral. Medicina Intensiva 15 (Suppl 1): S128-S129; 1.991 Domínguez JM, Murillo F, Muñoz A., et al. Changes in the doppler waveform of intracranial arteries in brain death status Transplantation Proceedings 1995; 27: 231-2392. Domínguez JM, Murillo F, Muñoz A., et al. Study of blood velocities in the middle cerebral artery using transcranial doppler sonography in braindead patients. Transplantation Proceedings 1995; 27: 2395-2396. Domínguez JM, Murillo F, Santamaria JL, et al. Cerebral oxygen extraction ratio. An useful determination for the diagnosis of brain death. transplantation Proceedings 1995; 27: 2393-2394. Domínguez JM, Murillo F, santamaria JL, et al. Changes in the resting energy expenditure after development brain death. Transplantation Proceedings 1995; 27: 2397-2398 Domínguez JM, Murillo F. Study of intracranial circulation in brain.dead patients using transcranial doppler sonography. In Machado C, ed. Brain detah. Springer-Verlag. Amsterdam 1995. Domínguez Roldan JM, Murillo Cabezas F, et al. Sonografia Doppler Transcraneal. Un método util para el diagnostico de la parada circulatoria cerebral que acompaña a la muerte cerebral. Revista Española de Trasplantes 3:30-35;1994. Domínguez Roldan JM, Murillo Cabezas F, Muñoz Sanchez MA, et al. Diagnostico de muerte cerebral. Medicina Intensiva 17: 327-334; 1993. Domínguez Roldan JM, Murillo Cabezas, F. Metodos alternativos en el diagnóstico de muerte cerebral. Nefrologia 11 (Supl 1):86-88;1991 Domínguez Roldan JM. el proceso de morir, muerte y muerte cerebral. Conceptos esenciales en la donación de órganos. Revista Española de Trasplantes 2 (Extra): 27-33;1993. Domínguez Roldan JM. Transcranial Doppler sonography for the diagnosis of cerebral circulatory arrest in brain death patients. Intensive Care Medicine, Suppl 2: S203;1992 Domínguez-Roldan J.M,. Barrera-Chacon J.M .Diagnosis of whole brain death Organs and tissues 1999: 2: 103-109 Domínguez-Roldan JM, Barrera Chacon JM, Rivera Fernández MV, Garcia Alfaro C. Sonografia Doppler transcraneal: su utilidad enel diagnóstico de la parada circulatoria cerebral que acompaña a la muerte encefálica. Med Intensiva 2000; 24: 151-160. Domínguez-Roldan JM, Murillo-Cabezas F, Muñoz-Sanchez, Madrazo Osuna J, Marques E. Diagnóstico de Muerte Cerebral. Med Intensiva 1993; 17:327-334. NUEVA LEGISLACIÓN EN TRASPLANTES: REAL DECRETO 426/1980 José Luis Santamaría Mifsut, Ana Isabel Gallego Corpa, Oliva Mateos Jiménez Coordinación Sectorial de Trasplantes. Sevilla. El martes 4 de Enero del 2000 se publico en el B.O.E. el nuevo Real Decreto 2070/ 1999 en el que se regulan algunos cambios de las distintas actividades en la obtención y utilización de órganos y tejidos humanos. 1) En el capitulo I y II se desarrollan los aspectos relativos a la confidencialidad, promoción, publicidad y gratuidad de las donaciones, que aunque ya estaban en la ley del 79, se adecuan a las normativas, aparecidas después de 1980. Se especifica que la familia del donante no podrá conocer la identidad del receptor, ni el receptor o su familia la del donante. En el capitulo III se desarrolla todos los aspectos relativos a la obtención, preservación y procesamiento de órganos, volviendo a recalcar la gratuidad i confidencialidad de todo el proceso. Con respecto al Donante Vivo se especifican las condiciones y requisitos necesarios para ello. El donante debe ser mayor de edad, gozar de plenas facultades mentales y estar bien informado de las consecuencias de su decisión. El estado de salud físico y mental deberá ser acreditado mediante certificado médico por un médico distinto a los que vayan a realizar la extracción o el implante. Así mismo se firmará un consentimiento expreso ante el juez del registro civil, en el que figura la firma del donante, la del médico que certifica su estado de salud, y la del equipo de trasplante, aportando así mismo un informe del comité de Ética del Hospital Trasplantador, debiendo transcurrir un mínimo de 24 horas entre la firma del documento de cesión y la extracción, pudiendo el donante revocar su consentimiento en cualquier momento antes de la intervención. La extracción de órganos de donante vivo solo podrá realizarse en los centros sanitarios expresamente autorizados para ello por la autoridad sanitaria de la comunidad autónoma correspondiente. 230 Con respecto al Donante Fallecido la Ley de trasplante decretada en el año 1979 establecía que la extracción de órganos u otras piezas anatómicas de fallecidos podría, hacerse previa comprobación de la muerte, contemplando tanto la Ley como el Real Decreto que la desarrollaba la obtención de órganos exclusivamente de los fallecidos en situación de Muerte Encefálica. En este nuevo Real Decreto se define que la muerte del individuo podrá certificarse tras la confirmación del cese irreversible de las funciones cardiorrespiratorias o del cese irreversible de las funciones encefálicas, contemplándose por lo tanto en este Real Decreto, tanto la Muerte Encefálica, como la Muerte por Parada Cardiocirculatoria. En el Anexo I de este Real Decreto se desarrollan los protocolos de Diagnóstico y Certificación de la Muerte, incluyendo las condiciones y requisitos necesarios para realizar el diagnóstico de muerte, tanto en el caso de Muerte por Parada Cardiorrespiratoria, como en el de Muerte Encefálica, facultando al Ministerio de Sanidad para modificar y actualizar estos protocolos según se produzcan avances científicos en la materia. Criterios Diagnósticos de Muerte Encefálica: - Coma de Etiología conocida y de Carácter irreversible. - Evidencia clínica o por Neuroimagen de la lesión destructiva. - Prerrequisitos previos a la exploración neurológica. - Estabilidad hemodinámica - Oxigenación y ventilación adecuada - Temperatura corporal > 32º C - Ausencia de sustancia depresoras del SNC - Ausencia de bloqueantes Neuromusculares - La Exploración Clínica debe ser sistemática, completa y rigurosa, debiendo presentar 3 hallazgos imprescindibles Actualizaciones en Trasplantes 2001. 1. Coma Arreactivo, sin ningún tipo de respuesta motora en el territorio de los 231 Nervios Craneales. 2. Ausencia de reflejos troncoencefálicos 3. Test de Apnea (+). Con este Real Decreto, desaparece la necesidad absoluta de realizar un EEG, y se posibilita, en caso de ser necesario otras pruebas instrumentales. Se definen así mismo una serie de determinadas situaciones clínicas que pueden dificultar o impedir el diagnóstico clínico de muerte encefálica al impedir que la exploración neurológica se pueda realizar de forma completa o con la seguridad necesaria. Será necesaria la autorización judicial para la extracción de órganos en los casos de muerte accidental o cuando media una investigación judicial. Criterios Diagnóstico de Muerte por Parada Cardiaca 1º El diagnóstico de muerte por criterios cardiorrespiratorios se basará en la contratación de forma inequívoca de ausencia de latido cardíaco, demostrado por la ausencia de pulso central o por trazado electrocardiográfico, y de ausencia de respiración espontánea, ambas cosas durante un periodo no inferior a cinco minutos. 2º La irreversibilidad del cese de las funciones cardiorrespiratorias se deberá constatar tras el adecuado período de aplicación de maniobras de reanimación cardiopulmonar avanzada. Este período, así como las maniobras a aplicar, se ajustará dependiendo de la edad y circunstancias que provocaron la parada cardiorrespiratoria. En todo momento deberán seguirse los pasos especificados en los protocolos de reanimación cardiopulmonar avanzada que periódicamente publican las sociedades científicas competentes. 3º En los casos de temperatura corporal inferior a 32 grados se deberá recalentar el cuerpo antes de poder establecer la irreversibilidad de la parada y por lo tanto el diagnóstico de muerte. Maniobras de mantenimiento de viabilidad y preservación. El equipo encargado del procedimiento de preservación o extracción sólo iniciará sus actuaciones cuando el equipo médico responsable del proceso de reanimación cardiopulmonar haya dejado constancia escrita de la muerte, especificando la hora del fallecimiento. En los casos que sea necesaria la autorización judicial según lo especificado en el artículo 10 del presente Real Decreto, se procederá como sigue: a) Se podrán reanudar las maniobras de mantenimiento de flujo sanguíneo a los órganos y se realizará la oportuna comunicación al juzgado de instrucción sobre la existencia de un potencial donante. b) Tras la respuesta positiva del juzgado o bien transcurridos quince minutos sin respuesta negativa al mismo, se podrá proceder a la extracción de una muestra de sangre de 20 cc y si fuera posible de 20 cc de orina y 20 cc de jugos gástricos (según el protocolo adjunto de cadena de custodia), que quedarán a disposición de Juzgado de Instrucción. Posteriormente se procederá a iniciar las maniobras de preservación. c) Una vez obtenida la correspondiente autorización judicial, según lo establecido en el artículo 10 de este Real Decreto, se podrá proceder a la extracción de órganos. 232 Requisitos para autorizar el trasplante de órganos humanos 1. El trasplante de órganos humanos sólo se podrá efectuar en centros autorizados para ello, con el consentimiento previo y escrito del receptor o sus representantes legales, conforme prevé el artículo 10.6 de la Ley 14/1986, General de Sanidad, y previa información de los riesgos y beneficios que la intervención supone, así como de los estudios que sean técnicamente apropiados al tipo de trasplante del que se trate en cada caso. 2. El documento en el que se haga constar el consentimiento informado del receptor comprenderá: nombre del centro sanitario, fecha de su autorización para hacer trasplantes y nombre del receptor y, en su caso, el de los representantes que autorizan el trasplante. El documento tendrá que ser firmado por el médico que informó al receptor y por éste mismo o sus representantes. El documento quedará archivado en la historia clínica del paciente y se facilitará copia del mismo al interesado. 3. En la historia clínica del receptor se recogerán los datos necesarios que permitan identificar al donante, al órgano y al centro hospitalario del que procede el órgano trasplantado, con las correspondientes claves alfanuméricas que garanticen al anonimato y confidencialidad, conforme a lo previsto en los apartados 3 y 4 del artículo 5. 4. El responsable de la unidad médica o quirúrgica en la que haya de realizarse el trasplante sólo podrá dar su conformidad si existen perspectivas fundadas de mejorar sustancialmente el pronóstico vital o las condiciones de vida del receptor, y de que se han realizado entre donante y receptor los estudios que sean técnicamente apropiados al tipo de trasplante que en cada caso se trate. Centros de trasplante de órganos humanos: requisitos generales mínimos. El trasplante de órganos humanos sólo podrá realizarse en aquellos centros sanitarios que dispongan de autorización específica para su práctica conforme a los requisitos señalados en el artículo anterior. Actualizaciones en Trasplantes 2001. Para poder ser autorizados, los centros trasplantadores de órganos humanos deberán reunir los siguientes requisitos generales mínimos: 233 1. Estar autorizado como centro extractor de órganos de donantes fallecidos y acreditar una actividad suficiente como para garantizar la viabilidad y calidad del programa de trasplante. 2. Disponer de una organización sanitaria y un régimen de funcionamiento adecuado para realizar la intervención que se solicita. 3. Disponer de los servicios sanitarios necesarios para garantizar la realización, el seguimiento adecuado y el correcto tratamiento de las eventuales complicaciones que la práctica de este trasplante precise. 4. Disponer de la unidad médica y quirúrgica correspondiente con el personal sanitario suficiente y con demostrada experiencia en el tipo de trasplante del que se trate. 5. Garantizar la disponibilidad de facultativos especialistas con experiencia probada en el diagnóstico y tratamiento de las complicaciones del trasplante a desarrollar. 6. Disponer de las instalaciones y material necesario para garantizar un adecuado proceso de trasplante, tanto en el preoperatorio como en la intervención en sí y el postoperatorio. 7. Disponer de un servicio de anatomía patológica con los medios técnicos y humanos necesarios para el estudio de complicaciones asociadas al trasplante y poder realizar los posibles estudios postmortem. 8. Disponer de un laboratorio de microbiología donde se puedan efectuar los controles de las complicaciones infecciosas que presenten los pacientes. 9. Disponer de una Comisión de Trasplante y de aquellos protocolos que aseguren la adecuada selección de los receptores, el proceso de trasplante y el seguimiento postoperatorio inmediato y a largo plazo que garanticen la calidad de todo el procedimiento terapéutico. 10.Disponer de una unidad de coordinación hospitalaria de trasplantes. 11.Disponer de un registro, de acceso restringido y confidencial, donde constarán los trasplantes realizados con los datos precisos para la identificación de los donantes, de tal forma que permita en caso necesario el adecuado seguimiento de los órganos trasplantados en el centro. 12.Disponer de un registro adecuado que permita evaluar la actividad de los trasplantes realizados en el centro, así como los resultados obtenidos. 13.Garantizar la disponibilidad de un laboratorio de inmunología, y una unidad de histocompatibilidad con los medios técnicos y humanos necesarios para garantizar la correcta realización de los estudios inmunológicos necesarios para la monitorización pre y postrasplante. Desarrollo de una estructura de Coordinación Interterritorial - Adecuación de la estructura y funciones de la ONT. - La ONT, previo acuerdo de la Comisión Permanente de Trasplantes del CIT y a demanda de las diferentes Administraciones sanitarias de las comunidades autónomas y servicios de Salud, podrá actuar como entidad para la evaluación y acreditación de los centros autorizados. - Adecuación de la coordinación Interterritorial de trasplante al estado de las autonomías. - Introducción del concepto y funciones de Comisión de Trasplantes de CI. - Adecuación de la Autorización de Entrada / Salida de órganos humanos de España. 234 PROGRAMA INTEGRAL EUROPEO PARA LA DONACIÓN DE ORGANOS. LA COMUNICACIÓN DE MALAS NOTICIAS Y EL PROCESO DE DONACIÓN Carmen Segovia, Manuel Serrano, José Cañón, Rafael Matesanz, María Sánchez, Blanca Miranda, Isabel Caro, Encarnación García. Organización Nacional de Trasplantes. El manejo de familias de pacientes en situación crítica es una de las situaciones que generan más tensión entre los profesionales sanitarios. Comunicar una mala noticia es algo que siempre quisiéramos que hiciera otro en nuestro lugar. Si además, esa noticia es la peor que se puede dar, la muerte de un paciente, la tensión aumenta, puesto que sabemos que va a generar en la familia una serie de reacciones difíciles de controlar. Actualizaciones en Trasplantes 2001. Desafortunadamente los profesionales sanitarios no estamos preparados para afrontar la pérdida de nuestros pacientes, al contrario, somos personas entrenadas para cuidar e intentar curar. Este hecho unido a la falta de formación en la comunicación de malas noticias y en el proceso del duelo, aumenta la ansiedad y dificulta la interacción con las familias en este trance y la capacidad de establecer una relación de ayuda en dicho proceso. 235 Cuando se trata de familias de potenciales donantes, esta falta de interacción y por lo tanto capacidad para establecer ayuda en el proceso de duelo, puede traer como consecuencia una mayor predisposición a la negativa a donar los órganos del ser querido. Lo que persigue el Programa Educacional Europeo para la Donación de Organos (EDHEP) es mejorar la interacción con las familias de pacientes en situación crítica en general, y potenciar la donación a través del establecimiento de la relación de ayuda a estas familias de pacientes fallecidos inesperadamente. A finales de los años 90 en los países integrantes de Eurotransplant (Holanda, Austria, Alemania, Luxemburgo y Bélgica), se observó un descenso importante en la tasa de donación, esto unido al incremento en el número de indicaciones de trasplante y el alarman- te aumento de las listas de espera, llevó a la Fundación Eurotransplant a iniciar un estudio para tratar de conocer los factores que habían influido en este descenso. Uno de los factores que había influido de forma muy importante estaba precisamente en los propios hospitales, y más concretamente en la dificultad que tenemos los profesionales sanitarios a la hora de relacionarnos con familias de pacientes en situación crítica. El diseño del programa EDHEP fue realizado por expertos en comunicación sanitaria, junto con la la Universidad de Limburg en los Países Bajos que puso a disposición del proyecto su departamento de Investigación Educativa y Desarrollo y el Departamento de Cirugía del Hospital Universitario de Maastrich. El primer Seminario piloto se llevó a cabo en Holanda en el año 1992 y a partir de ese momento se ofreció a diferentes países de Europa, entre ellos España. Aunque en aquél momento iniciábamos un aumento en la tasa de donación que, afortunadamente para nuestros pacientes, no ha dejado de crecer, nos pareció que todas las ayudas son pocas y sobre todo si esa ayuda cubre en cierto modo una laguna existente en la formación de los profesionales sanitarios, médicos y enfermeras, a la hora de la comunicación de malas noticias. Añadiendo cuestiones específicas, el programa se adaptó a nuestras necesidades y se realizó el primer seminario para el Hospital Infanta Cristina de Badajoz en Octubre de 1992. Desde entonces se han realizado un total de 121 seminarios repartidos por las diferentes Comunidades Autónomas (CCAA) (fig.1). Cada año se llevan a cabo entre 15 y 17 seminarios que son solicitados por los Coordinadores Autonómicos de Trasplante, seleccionando la Comisión de Docencia de la Comisión Permanente de Trasplantes del Consejo Interterritorial del sistema Nacional de Salud los que se pueden hacer. Se trata de un seminario interactivo con una duración de 9 horas y para facilitar la participación el número de asistentes no debe sobrepasar los 20. Consta de una pequeña parte teórica alternando con trabajos en grupo, análisis de vídeos y simulaciones prácticas. Los objetivos del seminario son: - Proporcionar una mejor técnica en la comunicación de una mala noticia, en este caso la peor que se puede dar, la pérdida de un paciente. - Tratar de identificar y conocer la respuesta de las familias ante el dolor, ante la comunicación de la mala noticia, además de identificar la respuesta de los profesionales ante las manifestaciones de duelo. Ver, en el caso de que se trate de la familia de un potencial donante, la posible influencia en la solicitud de donación. - Tomar conciencia del valor potencial de la donación para las familias de los fallecidos, en el sentido de ayuda a sobrellevar el duelo o constituir un hecho positivo en el drama que supone la muerte de un ser querido 236 Al finalizar la jornada el seminario es evaluado por los participantes, cubriendo diferentes aspectos tales como: La información, estrategias didácticas y los efectos del seminario. Desde que a finales del año 1992 se realizara el primer seminario, se ha llevado a cabo 121 en todo el país (fig.1). Han participado un total de 2154 profesionales (fig.2), que en un alto porcentaje habían realizado entrevistas con familiares de críticos en el último año (fig.3). En la figura 4 se refleja la cualificación profesional de los asistentes, Staff, enfermeras y residentes, siendo el 43% médicos y el 54% enfermeras. La mayoría de los asistentes considera adecuado el programa para los objetivos que persigue (fig.5), valorando que el entrenamiento conjunto de médicos y enfermeras resulta de utilidad, (Fig.6). Respecto a las escenificaciones en vídeo las consideran instructivas la mayoría de los participantes (fig.7). Algo muy importante a valorar son los efectos del seminario en los participantes, a este respecto la mayoría reconoce que le facilitará la identificación de las respuesta de las familias ante la pérdida (fig. 8). Por otro lado, a la mayoría de los asistentes le ayudará a reconocer en las familias respuestas referentes al proceso de duelo, la comunicación y las técnicas de comunicación a utilizar (fig.9). Actualizaciones en Trasplantes 2001. Finalmente, tras el seminario, el 97.4 % de los participantes cree que mejorarán sus habilidades en la interacción con las familias de pacientes en situación crítica (fig.10), y casi en el 81 % de los casos piensan que se sentirán más cómodos en el proceso de comunicación de malas noticias (fig.11). 237 Tras 10 años de experiencia, la adaptación del Seminario en nuestro país puede considerarse consolidada. La opinión, mayoritariamente positiva de más de 2000 profesionales sanitarios que han recibido este curso, es la constatación de que se trata de una buena herramienta de formación teórica, pero sobre todo de utilidad práctica en un terreno en el que los profesionales sanitarios desafortunadamente tenemos grandes carencias. Figura 1 Figura 2 Figura 3 238 Actualizaciones en Trasplantes 2001. Figura 4 Figura 5 239 Figura 6 Figura 7 Figura 8 Figura 9 240 Actualizaciones en Trasplantes 2001. Figura 10 Figura 11 241 TRASPLANTES DE ÓRGANOS Y TEJIDOS EN HOSPITALES UNIVERSITARIOS VIRGEN DEL ROCÍO,UNA ORGANIZACIÓN DEL SIGLO XXI Joseba Barroeta Urquiza Director Gerente H.H. U. U. Virgen del Rocío. Sevilla. En Andalucía, del mismo modo que en el resto del país y en el entorno europeo, el reto de fortalecer los servicios sanitarios determina en los responsables de las políticas sanitarias una preocupación importante para buscar soluciones a problemas financieros, de planificación y de cambio en las organizaciones, que aseguren el desarrollo de servicios sanitarios, produciendo buenos resultados, a un coste adecuado y manteniendo el nivel de prestaciones y el desarrollo tecnológico acorde a las nuevas necesidades y expectativas de la población. Hospitales Universitarios Virgen del Rocío ofrece las prestaciones y funciones que caracterizan a los hospitales de tercer nivel del Sistema Nacional de Salud, con capacidad de resolver los problemas que requieren la más alta asistencia sanitaria y el uso de las tecnologías más avanzadas para ofrecer la resolución de los problemas de los enfermos, aplicando el conocimiento que la investigación produce en beneficio de los pacientes. Hospitales Universitarios Virgen del Rocío es el mayor complejo hospitalario del Sistema Sanitario Público de Andalucía. La asistencia sanitaria, la generación de nuevos conocimientos que ofrecen la investigación clínica y aplicada y la formación de pre y postgrado necesarios para formar a los profesionales del futuro integran un marco multidisciplinario de respuestas de atención sanitaria a la población. Con una población asignada de 720.801 habitantes en la provincia de Sevilla, es también en algunas de sus especialidades más complejas hospital de referencia para toda la Comunidad Autónoma Andaluza, Ceuta, Melilla, Extremadura y Canarias. Un total de 7.426 profesionales forma la plantilla actual. Su presupuesto anual asciende a 53.052.164.820 pesetas. Su actividad asistencial en el año 2000 se resume en: 53.907 242 Actualizaciones en Trasplantes 2001. ingresos, 42.693 intervenciones quirúrgicas, 279.346 urgencias, 1.099.957 consultas y 211 trasplantes de órganos y tejidos. 243 Resaltar el carácter universitario de Hospitales Universitarios Virgen del Rocío. Tanto en el pre y postgrado de Medicina, como en la Escuela Universitaria de Enfermería, se han dado pasos importantes para la formación de futuros profesionales, teniendo el respaldo de la Universidad de Sevilla. Asimismo, todos los trabajadores del centro tienen acceso a amplios programas de formación, garantizándose su capacitación y adaptación a las exigencias científicas, tecnológicas y de gestión actuales. En cuanto a la Investigación, el hospital ocupa una posición muy destacada dentro y fuera del país, con más de 120 proyectos de investigación en marcha, 160 ensayos clínicos y un factor de impacto superior a los 220 puntos. La reciente incorporación del grupo de investigación del Profesor D. José López Barneo, al frente del Laboratorio de Investigaciones Biomédicas, reforzará aún más la capacidad investigadora del centro y sus profesionales y la interacción entre grupos clínicos y básicos, favoreciendo la aplicabilidad de la investigación. Desde la puesta en marcha de aquel Hospital General básico en 1954, se han vivido muchos cambios. La nueva sociedad y el nuevo siglo exige una nueva organización sanitaria, un nuevo Servicio de Salud, abierto a su entorno, centrado en ofrecer la mejor calidad asistencial a la población, satisfaciendo sus demandas, armonizando un crecimiento controlado, favoreciendo el desarrollo de los propios profesionales y, a su vez, generando valores sociales de reconocimiento hacia la función que lleva a cabo. Todo, en el contexto y marco legal de la Ley 2/1998 de 27 de mayo de Salud de Andalucía, que desarrolla en su artículo 30 el Plan Andaluz de Salud y que se completa con la puesta en marcha del Plan Estratégico del Servicio Andaluz de Salud: un Sistema de Salud público, universal, equitativo y solidario. Los ejes fundamentales del plan estratégico han orientado: por un lado, el ciudadano como centro de la atención y eje del sistema sanitario público, manifestada su voluntad a través de su capacidad de elección, derecho a la información y articulando fórmulas que les permita ejercer su capacidad de participación e influencia en la toma de decisiones; por otro, mayor autonomía de los profesionales en sus formas de organización, uso racional de recursos para una buena práctica clínica, priorizando la eficiencia global sobre la eficiencia económica. En la búsqueda de dicho sistema público, universal, equitativo y solidario, Hospitales Universitarios Virgen del Rocío ha apostado siempre por los Programas de Trasplantes, para, de esta forma, dar respuesta a una necesidad asistencial de la población que se demuestra vital. Más de veinte años de experiencia en el trasplante renal y diez en el hepático y cardíaco reflejan la trayectoria del hospital en este campo. La profesionalidad y riqueza humana de los distintos Equipos de Trasplantes, sumada a las altas prestaciones de la tecnología e infraestructura del complejo hospitalario Virgen del Rocío, lo sitúan en una posición privilegiada. El centro combina la asistencia especializada de excelencia de un hospital de especialidades y referencia regional, con el desarrollo de un importante Programa de Trasplantes que exige una ajustada coordinación entre sus numerosos Servicios y Unidades. El hospital está capacitado para dar respuesta desde los problemas más básicos de salud (Urgencias sentidas) hasta los que más altos niveles de complejidad requieren, como es en el caso de los Trasplantes. La evolución de los trasplantes en Hospitales Universitarios Virgen del Rocío ha sido de una tendencia creciente y progresiva, incorporando la actividad a su norma244 lidad asistencial, con el objetivo de disponer de una organización sanitaria que permita realizar la actividad que se le solicita. Hospitales Universitarios Virgen del Rocío ha ido desarrollando los servicios sanitarios necesarios que permiten garantizar la realización, el seguimiento y el correcto tratamiento de las eventuales complicaciones que la práctica de los trasplantes requiere. Más de doscientos trasplantes anuales de órganos y tejidos en la actualidad, frente a las veintenas y treintenas de los comienzos. En el año 2000 se han registra- Evolución Trasplantes Renales Actualizaciones en Trasplantes 2001. Evolución Trasplantes Cardíacos 245 Evolución Trasplantes Hepáticos do 57 trasplantes renales, 54 de médula ósea, 39 hepáticos, 34 de córnea y 15 cardíacos. Asimismo, el centro puso en marcha en mayo de 2000 la Unidad Regional de Reimplantes que absorbe toda la demanda de reimplante de la Comunidad Autónoma Andaluza. Durante el 2000, se han realizado 12 reimplantes. Se dispone, pues, de las Unidades médicas, quirúrgicas y de anestesia y el personal sanitario y de apoyo que han incorporado la experiencia que las técnicas del trasplante exigen. Ha sido necesario incorporar en los últimos años las instalaciones y materiales que garantizaran la práctica de los trasplantes tanto en la fase preoperatoria como en la intervención y el postoperatorio, garantizando la disponibilidad y formación continua de facultativos especialistas con experiencia probada en el diagnóstico y tratamiento de las complicaciones del trasplante. La garantía de calidad exigible al Programa de Trasplantes establece disponer de una Unidad de Coordinación de Trasplantes, un Comité Multidisciplinario de Trasplantes, un Comité de Ética y aquellos protocolos que aseguran la adecuada selección de los receptores, el proceso del trasplante y el seguimiento postoperatorio inmediato y a largo plazo de los pacientes trasplantados. De igual forma, se dispone de un Registro de acceso restringido y confidencial donde constan los trasplantes realizados y los datos necesarios para la identificación de los donantes, de manera que permita, en caso necesario, el adecuado seguimiento de los órganos trasplantados en el centro. Se requiere también un Registro para evaluar la actividad de los trasplantes y los resultados. Hospitales Universitarios Virgen del Rocío emplea, en todo momento, los progresos científicos existentes en la materia y sigue los protocolos diagnósticos y terapéuticos de acuerdo a la práctica médica. En la acreditación y reacreditación de los trasplantes se exige constantemente a Hospitales Universitarios Virgen del Rocío disponer de los servicios, recursos humanos, instalaciones, procedimientos y actividad de máxima calidad. Por ello, destacar su excelencia en los Servicios de Medicina Interna y Especialidades, Cirugía General y Especialidades, Anestesiología, Cuidados Intensivos, Unidades de Reanimación, Radiodiagnóstico, Medicina Nuclear, Laboratorios de Análisis Clínicos con Hematología, Bioquímica, Microbiología y Diagnóstico Virológico, Urgencias y otros Servicios relacionados con el trasplante. En el Área de Quirófanos, se cuenta con modernas instalaciones, todas bien comunicadas con la UCI. Igualmente, existe una importante Área de Hospitalización, en UCI y Plantas, para pacientes de trasplantes y Consultas Externas para el seguimiento de dichos. En lo que concierne a procedimientos, se dispone de protocolos escritos en las siguientes áreas: Criterios de inclusión en lista de espera y grado de prioridad, Consentimiento informado, Procedimientos quirúrgicos, Anestesia, Manejo en UCI, Control postoperatorio (Planta y Consultas Externas), Anatomía patológica, Inmunosupresión, Complicaciones médicas y quirúrgicas, Enfermería, Metodología de supervivencia del injerto y del paciente, Formato de recogida de datos (documentación clínica) y Evaluación de la calidad. 246 La acreditación también exige evaluar la actividad trasplantadora, tanto desde un punto de vista cuantitativo, como cualitativo: número de trasplantes y retrasplantes, supervivencias del injerto y del paciente, mortalidad intraoperatoria precoz y tardía, tiempo medio en lista de espera en días, mortalidad en lista de espera e infecciones hospitalarias. El éxito de Programa de Trasplantes en Hospitales Universitarios Virgen del Rocío se basa en una buena coordinación entre las Unidades de Trasplantes y los Servicios centrales (Radiología, Laboratorio, A. Patológica, Neurofisiología, C. General, UCI, Microbiología) y específicos (Inmunología, Medicina Nuclear, Angiorradiología, Hemodinámica, C.Trasplante, UCI TX y S. Infecciosos). De los resultados de esta coordinación, se desarrollan nuevas técnicas, se articulan otras posibilidades terapéuticas, se mejora la calidad asistencial y se potencian los servicios. Actualizaciones en Trasplantes 2001. Estructura Hospitalaria 247 El Programa de Trasplantes de Hospitales Universitarios Virgen del Rocío se marca, entre sus próximos objetivos: - Cumplir la sectorización de la lista de espera. - Aumentar el porcentaje de donantes de órganos. - Disminuir el porcentaje de órganos desechados. - Aumentar el consenso sobre criterios de selección de donantes. - Incrementar la tasa de trasplantes. - Reducir el porcentaje de rechazo por logística intrahospitalaria. TRASPLANTE PULMONAR Ángel Salvatierra Velázquez Cirugía Torácica Hospital U. Reina Sofía de Córdoba HISTORIA La historia del trasplante de órganos, uno de los más espectaculares hitos de la medicina del siglo XX, ejemplariza la importancia que tiene la cooperación interdisciplinaria para el desarrollo de la ciencia médica. El camino del trasplante clínico de órganos, siempre dificultoso y, en ocasiones, dramático tanto para los pacientes como para los cirujanos, lo inició el riñón, siendo el pulmón el último en incorporarse debido a una serie de problemas inherentes a este órgano. En 1963, tras muchos años de investigación y varios cientos de experimentos en perros, James H. Hardy, de la Universidad de Mississippi, llevó a cabo el primer trasplante pulmonar humano (1). Después de un curso postoperatorio inicial favorable, el receptor falleció a los 18 días del procedimiento por fallo renal, habiendo mantenido hasta su muerte una buena función respiratoria. Esta experiencia clínica, además de demostrar la posibilidad técnica del trasplante pulmonar, estimuló en todo el mundo la investigación en las diferentes áreas relacionadas con el trasplante. Entre 1963 y 1978, se llevaron a cabo unos 40 trasplantes pulmonares en diferentes centros del mundo. De ellos, solo un receptor de 23 años, afecto de silicosis, pudo ser dado de alta hospitalaria por Derom et al (2) a los 8 meses del trasplante, falleciendo dos meses más tarde debido a rechazo crónico, sepsis y estenosis bronquial . Dos décadas después de la gesta de Hardy, el Grupo de Trasplante Pulmonar de Toronto abrió el camino del éxito al trasplante pulmonar clínico. La introducción de la ciclosporina como base de la inmunosupresión y la publicación del primer trasplante cardiopulmonar realizado con éxito por Reitz et al, de la Universidad de Stanford (3), en 1982, contribuyeron al inicio de esta nueva era del trasplante pulmonar. El primer paciente trasplantado por el grupo de Toronto fue un hombre, de 58 años de edad, afecto de fibrosis pulmonar en estadio avanzado que,. después de ser dado de alta a la sexta semana de postoperatorio, pudo reasumir una vida activa de buena calidad falleciendo seis años y medio más tarde por complicaciones secundarias a una insuficiencia renal. Este y los siguientes casos trasplantados con éxito en Toronto sirvieron de pistoletazo de salida a la imparable carrera del trasplante pulmonar clínico. 248 INDICACIONES DEL TRASPLANTE PULMONAR Criterios generales de selección del receptor La rápida evolución del trasplante pulmonar ha permitido que se le considere, hoy día, como un tratamiento capaz de mejorar la cantidad y la calidad de vida de los pacientes con enfermedad pulmonar avanzada, no susceptible de tratamiento con métodos alternativos menos agresivos. Debido al riesgo inherente a la intervención, los efectos indeseables de los inmunosupresores, los problemas derivados del rechazo crónico y la escasez de órganos donantes, el trasplante solo debe ofrecérsele a pacientes con una esperanza de vida limitada por la enfermedad pulmonar -menos de 2 años- y con serias limitaciones para la realización de las actividades cotidianas. Así mismo, es necesario que el potencial receptor no presente alteraciones en otros órganos y sistemas que pudieran incrementar significativamente el riesgo de la operación o comprometer su resultado a largo plazo. De manera especial, debe comprobarse la inexistencia de alteración irreversible en las funciones cardiaca, renal y hepática. Aunque la mayoría de los pacientes que necesitan un trasplante presentan, por su enfermedad, cierto grado de ansiedad y depresión, es necesario descartar en ellos la existencia de enfermedades psiquiátricas importantes Un estado severo de desnutrición u obesidad son factores que añaden un riesgo lo suficientemente elevado como para evitar el trasplante hasta que no sean corregidos. CONTRAINDICACIONES El límite superior de edad para ser aceptado como candidato a trasplante pulmonar varía entre los distintos programas. Sin olvidar que la edad biológica predice mejor que la cronológica el riesgo ante procedimientos médicos enérgicos, 65 años para el trasplante unilateral, y 55 años para el bilateral, parecen límites razonables. Actualizaciones en Trasplantes 2001. La mayoría de los programas de trasplante pulmonar no aceptan como candidatos a pacientes que están sometidos a ventilación mecánica. No obstante, en algunos programas, entre los que se incluye el nuestro, se siguen considerando candidatos a aquellos pacientes que, estando incluidos en lista de espera activa, hayan requerido ventilación mecánica por problemas intercurrentes transitorios. 249 La existencia de enfermedad neoplásica activa, o de riesgo de recurrencia de una tumoración recientemente controlada, constituyen una contraindicación formal para el trasplante pulmonar. INDICACIONES ESPECÍFICAS Desde un punto de vista práctico, es conveniente clasificar la enfermedad pulmonar sujeto de trasplante según su alteración fisiopatológica predominante: obstructiva, restrictiva, vascular y séptica. Enfermedad pulmonar obstructiva La enfermedad pulmonar obstructiva es la indicación más frecuente para trasplante pulmonar, representando casi el 40 % de los trasplantes que se realizan en la actualidad. Los pacientes suelen evaluarse cuando el FEV1 post-broncodilatadores es inferior al 25 % del teórico, presentan hipoxemia en reposo, hipercapnia, hipertensión pulmonar significativa, o presentan un deterioro clínico rápido -exacerbaciones graves, disminución acelerada del FEV1, deterioro del estado general o desnutrición severa-. El tipo de trasplante más conveniente para tratar la enfermedad pulmonar obstructiva no está definitivamente establecido. El trasplante bilateral tiene la ventaja de proporcionar una reserva funcional útil en el caso de que se desarrolle una bronquiolitis obliterante; no obstante, consume dos órganos, es una intervención más larga y complicada, y presenta una tasa de complicaciones más alta que el trasplante unilateral. Enfermedad pulmonar restrictiva Generalmente, este tipo de enfermedad pulmonar se caracteriza por un curso evolutivo rápido, falleciendo un buen porcentaje de pacientes mientras esperan el trasplante. Por ello, suelen incluirse pronto en lista de espera, nada más comprobar que no responden al tratamiento médico, desarrollan disnea severa o presentan volúmenes o capacidades inferiores al 60-50% de los valores teóricos, hipertensión pulmonar significativa, reducción de la tolerancia al ejercicio, hipoxia en reposo o hipercapnia. Enfermedad vascular pulmonar El trasplante cardiopulmonar fue el tratamiento inicialmente asignado a los pacientes con hipertensión pulmonar; se pensaba que, además del pulmón, era necesario sustituir el ventrículo derecho afectado. Posteriormente, varios grupos demostraron que la función del ventrículo derecho mejora inmediatamente después del trasplante pulmonar y permanece normalizada a largo plazo. Los pacientes con hipertensión pulmonar primaria presentan una esperanza media de vida inferior a 3 años desde su diagnostico (4). Son signos de mal pronóstico una presión media arterial pulmonar elevada -mayor de 60 mmHg-, un estado funcional III-IV -según la clasificación de la New York Heart Association-, episodios de síncope o casi-síncope, y la existencia de signos clínicos de fallo ventricular derecho -elevación de la presión venosa central y disminución del índice cardíaco-. En los pacientes que desarrollan hipertensión pulmonar secundaria a situación de Eisenmenger no existen factores predictivos del curso evolutivo tan claros como en los afectos de hipertensión pulmonar primaria, por lo que el momento preciso para su introducción en lista de espera es más incierto. Generalmente suele proponérseles el trasplante cuando los signos de fallo ventricular derecho progresan. Enfermedad pulmonar séptica Las neumopatías sépticas susceptibles de trasplante se caracterizan por la existencia de bronquiectasias generalizadas muy evolucionadas. De ellas, la más frecuente es la fibrosis 250 quística. Los factores que presagian un curso letal rápido son los siguientes: un FEV1 inferior al 30 % del teórico, el desarrollo de hipercapnia, el progresivo incremento de las necesidades de oxígeno suplementario, la necesidad de hospitalizaciones frecuentes para tratar infecciones pulmonares agudas y la pérdida de peso (5). La presencia de alguno de estos factores justifica la inclusión del paciente en lista de espera. RESULTADOS Los resultados funcionales en los supervivientes son excelentes. Los parámetros de función pulmonar mejoran drásticamente, llegando a normalizarse tras el trasplante bipulmonar. La oxigenación arterial se normaliza rápidamente. En los pacientes con enfermedad vascular pulmonar, la resistencia vascular y la presión en arteria pulmonar alcanzan cifras normales, mejorando inmediatamente el gasto cardiaco. La capacidad para el ejercicio mejora lo suficiente como para reasumir una vida activa y sin limitaciones en un 80 % de los casos. Los pacientes trasplantados refieren mejorar significativamente en todos los parámetros que miden la calidad de vida. Sin embargo, el rechazo crónico, manifestado histológicamente como bronquiolitis obliterante, afecta de forma progresiva- a más del 60 % de los pacientes que sobreviven a los 5 años. La función pulmonar en los pacientes afectos por bronquiolitis obliterante va declinando paulatinamente -a pesar del incremento del tratamiento inmunosupresor-, intercalándose con episodios de relativa estabilidad. En cualquier caso, el pronóstico es malo, con una mortalidad del 40 % en los dos años que siguen al diagnóstico (6). La supervivencia actuarial según el Registro Internacional (7) es de 70% y 42% a 1 y 5 años. En nuestra experiencia es de 74% y 57% repectivamente. Hemos identificado algunos factores independientes de riesgo de muerte tras el trasplante (necesidad de ventilación mecánica preoperatoria, tiempo de isquemia, intubación postoperatoria y episodios de infección y rechazo) (8). La infección sigue siendo la principal causa de muerte temprana y las complicaciones de la anastomosis bronquial se han reducido con el progreso de las técnicas de anastomosis y de preservación del injerto. Actualizaciones en Trasplantes 2001. BIBLIOGRAFÍA 251 1.- Hady JD, Webb WR, Dalton ML Jr, Walker GR Jr. Lung homotransplantations in man. Report of the initial case. JAMA 1963; 186: 1065-1074. 2.- Derom F, Barbier F, Ringoir S et al. Ten month survival after lung transplantation in man. J Thorac Cardiovasc Surg 1971; 61:835-846. 3.- Reitz BA, Wallwork JL, Hunt SA et al. Heart-lung transplantation: successful therapy for patients with pulmonary vascular disease. N Engl J Med 1982; 306: 557-564. 4.- D´Alonzo GE, Barst RJ, Ayres SM et al. Survival in patients with primary pulmonary hypertension: results from a national prospective registry. Ann Intern Med 1991; 115: 343-349. 5.- Kerem H, Reisman J, Corey M et al. Prediction of mortality in patients with cystic fibrosis. N Engl J Med 1992; 326: 1187-1191. 6.- Date H, Lynch JP, Sundaresan S et al. The impact of cytolytic therapy on bronchiolitis obliterans syndrome. J Heart Lung Transplant 1998; 17: 869-875. 7.- Hosenpud JD, Bennett LE, Keck BM, Fiol B, Boucek MM, Novick RJ. The registry of the international society for heart and lung transplantation: sixteenth official report 1999. J Heart Lung Transplant 1999; 18: 611-26. 8.- Alvarez A, Lama R, Algar J, Salvatierra A. Predicting mortality after lung transplantation. Transplant Proc 2001; 33: (en prensa). XENOTRASPLANTE Blanca Miranda Organización Nacional de Trasplantes Madrid INTRODUCCIÓN La posibilidad de sustituir un órgano con una disfunción irreversible por otro procedente de un cadáver, y más raramente de un ser vivo, ha sido uno de los avances más importantes de la medicina en la segunda mitad del siglo XX. Sin embargo, el éxito del trasplante ha desbordado las expectativas y en la actualidad existe una demanda muy superior a la oferta disponible de órganos para trasplante. En la mayoría de los países, el número de pacientes en lista de espera se incrementa de año en año, mientras que el número de trasplantes permanece estacionario o con incrementos mínimos. El xenotrasplante o trasplante de células, tejidos u órganos procedentes de otras especies podría ser una solución. Aunque aún es pronto para pronunciarse sobre resultados concretos, ya se han alzado las primeras voces planteando los diferentes problemas que pueden derivarse de estos procedimientos. - La técnica quirúrgica del xenotrasplante no es diferente de la del trasplante de órganos humanos, de ahí que las primeras barreras para el éxito del trasplante inter-especies estén constituidas por las disparidades inmunológicas, fisiológicas y funcionales entre donante y receptor. - Se ha apuntado la posibilidad de transmisión de enfermedades infecciosas, especialmente virales, de animales a humanos; esto es, un salto de patógenos entre especies. También ha sido comentada la posibilidad de que exista una especial susceptibilidad de los órganos animales a las enfermedades humanas, aspecto este escasamente conocido. Y un caso especial lo constituirían las enfermedades por priones. El xenotrasplante se ofrece ante nuestros ojos como una posible solución al problema de la falta selectiva de órganos disponibles para trasplante, con indudables ventajas teóricas; pero en el momento actual, plantea, así mismo, no pocos interrogantes que distan de estar resueltos. 252 ASPECTOS HISTÓRICOS Los primeros intentos de trasplantar un órgano de una especie a otra datan de 1905 y hubo diferentes experimentos realizados con conejos, cerdos, cabras, ovejas y monos entre 1905 y 1923. Todas estas especies se encuentran muy lejos en la escala filogenética, por lo que la reacción inmunológica fue violentísima y la destrucción tisular fue inmediata, de forma que esta línea de investigación se abandonó. A partir de los años 60 y con la perspectiva de un mejor conocimiento del sistema inmunológico y la posibilidad de disponer de algunas medidas contra el rechazo se reanudan los experimentos de xenotrasplante, y se producen diferentes intentos de trasplante de riñones, corazones e hígados de cerdos, chimpancés y babuinos en humanos. Las supervivencias son muy variables, la mayoría referidos en horas o días. Las supervivencias más largas se consiguieron en 1965 tras el trasplante de un riñón de chimpancé que funcionó 4 meses, en 1984 cuando Bailey en California consigue una supervivencia de 20 días tras trasplantar el corazón de un babuino a una recién nacida, y en 1992, cuando Starlz consigue una supervivencia de un hígado de babuino a un adulto. El último intento de xenotrasplante a humanos se realiza en 1996, cuando se realiza un trasplante de progenitores hematopoyéticos de babuino a un paciente con SIDA. Tres semanas después del implante, las células de babuino habían desaparecido por completo del organismo del receptor. ASPECTOS TÉCNICOS Reacción Inmunológica: Actualizaciones en Trasplantes 2001. La primera barrera a la que se hace referencia cuando se habla de xenotrasplantes es la inmunológica. Todo organismo reacciona ante células de otro genéticamente diferente, ya sea o no de la misma especie. Esta reacción está mediada por el sistema inmune en sus dos vertientes fundamentales: inmunidad humoral, que consiste en la elaboración de anticuerpos contra las células extrañas gracias a la activación de linfocitos B, e inmunidad celular, secundaria a la activación de linfocitos T. Mientras que esta última es básica en la reacción del alotrasplante, la primera juega un papel esencial en la reacción de rechazo del xenoinjerto. 253 Los linfocitos B pueden producir anticuerpos tras la información transmitida por los linfocitos T o bien sin el concurso de estos, incluso sin que haya habido un contacto previo con el antígeno, son los anticuerpos naturales o preformados. Este concepto divide al xenotrasplante en concordante y discordante. En los modelos discordantes, la presencia de anticuerpos preformados determina la aparición de un rechazo violento, hiperagudo, inmediatamente después del trasplante. En los modelos concordantes el rechazo se produce por la presencia de anticuerpos, también, pero estos no estaban preformados, se desarrollan tras un contacto con el antígeno. En general, cuanto mayor es la distancia filogenética entre dos especies, mayor es la posibilidad de que existan anticuerpos preformados. Sin embargo, estos anticuerpos no son los únicos responsables del rechazo hiperagudo. La activación del complemento juega así mismo un papel determinante ya que además, la incompatibilidad de las proteínas reguladoras del complemento del injerto con el complemento del receptor provoca una activación incontrolable del mismo. Así pues, las estrategias que hay que desarrollar para evitar el rechazo hiperagudo de los modelos discordantes deben ir encaminadas a evitar la acción de los anticuerpos preformados y la activación del complemento, y por lo tanto la activación endotelial y destrucción celular subsiguiente. Se ha intentado disminuir la presencia de Ac preformados circulantes con técnicas de inmunoadsorción, sin embargo aún no están suficientemente desarrolladas y sólo consiguen descensos temporales de la tasa de Ac circulantes. También se ha intentado modificar la estructura genética del cerdo en el sentido que sus células endoteliales no expresen el antígeno causante de la reacción, que parece ser Galx1-3 Gal. Se ha visto que las células de estos cerdos, in vitro, no expresan el Ag, lo cual sugiere que los órganos de estos animales podrían ser resistentes al rechazo hiperagudo. La estrategia que se ha seguido hasta el momento es la producción de cerdos que están tratados genéticamente de forma que expresan las proteínas reguladoras del complemento humano. Los órganos de estos animales pueden ser trasplantados en otra especie (primates) y el rechazo hiperagudo no aparece, sin embargo no se evitan otras sucesivas reacciones de rechazo que son la consecuencia de otros mediadores. Uno de ellos es el rechazo vascular o xenogénico tardío. No se conocen los factores que están implicados en esta reacción, pero se ha sugerido que los Ac preformados, aunque no activen el complemento podrían activar factores de la coagulación o células mediadoras como los macrófagos o las NK. En los casos en los que se ha conseguido superar el rechazo hiperagudo y el vascular, aparece un rechazo celular que en general ha sido de una gran virulencia. Ello hace sospechar que los regímenes inmunosupresores convencionales serán poco eficaces en el xenotrasplante y habrá que utilizar tratamientos más potentes. En los trabajos experimentales que se han llevado a cabo con cerdos transgénicos y primates, en los casos en los que se ha conseguido evitar el rechazo hiperagudo, la medicación inmunosupresora que ha habido que administrar ha sido determinante en la evolución de los animales, siendo una causa muy importante de fallecimiento de los receptores, las patologías secundarias a estos regímenes farmacológicos: infecciones ó toxicidad gastrointestinal incontrolables. Aspectos Técnicos No Inmunológicos: Se desconoce, en el momento actual, cómo y por cuánto tiempo, el xenoinjerto va a desempeñar sus funciones en un medio diferente al suyo. Se ha sugerido que el corazón podrá funcionar correctamente, pero no se sabe por cuánto tiempo, ya que si se utilizan cerdos como fuente de órganos, estos tienen una esperanza de vida media muy inferior a 254 los humanos, y además la posición anatómica cardiaca es diferente en una y otra especie. El riñón podría efectuar una correcta función de filtro, pero ¿Serían las hormonas y precursores sintetizados en este órgano identificados por los receptores humanos?, ¿Podrían los receptores de este riñón de cerdo responder adecuadamente a los estímulos de los mediadores sintetizados en el cuerpo humano?. El caso del hígado es aún más complejo, dadas sus características funcionales. Gran cantidad de substancias endógenas y exógenas han de pasar un proceso de metabolismo hepático antes de ser funcionalmente activas. Existe actualmente falta de información definitiva sobre la viabilidad funcional del xenoinjerto por las cortas supervivencias alcanzadas hasta ahora. El Problema de las Infecciones: Tal vez el mayor grado de preocupación manifestado por los científicos ha sido aplicado a este terreno. La posibilidad de que se transmitan infecciones (especialmente virus) de los animales a los humanos, la posibilidad de que algún patógeno salte la barrera de la especie y origine un problema de salud pública de una magnitud imposible de predecir, no es sólo una suposición. Los xenoinjertos podrían actuar como reservorios para la introducción de virus en el hombre, una vez en el huésped humano. Existen datos en este caso de infección de células humanas por retrovirus endógenos del cerdo y más recientes acerca de su capacidad de recombinación posterior. Sin embargo no hay datos que avalen la transmisión celular. Actualizaciones en Trasplantes 2001. Se han autorizado diferentes protocolos de xenotrasplante, pero cada vez las agencias de sanidad responsables son más cautas, ya que no se trata de asumir un riesgo individual para un determinado paciente, sino un riesgo colectivo. Además, las infecciones con largos periodos de incubación y la situación de inmunodepresión de los pacientes trasplantados facilitarían mucho el camino al desarrollo de una pandemia. 255 Los riesgos de transmisión pueden/deben minimizarse mediante un adecuado control de los procedimientos, pero nadie, por el momento, puede asegurar que se pudieran eliminar. Diversos estudios han demostrado que la infección con cruce de especies es posible. El VIH-2 humano se ha podido transmitir a babuinos. El virus SIVmne de simio es muy similar al VIH-2 humano y también capaz de infectar babuinos y humanos. Uno de los motivos por los que se podría limitar el uso de babuinos como donantes potenciales es precisamente la cantidad de patógenos que tienen al capturarlos. También hay que tener en cuenta que muchas veces los brotes de infecciones en las colonias de primates provienen de contagios a partir de sus cuidadores humanos. Para reducir los riesgos de infección se debería tender a criar animales libres de gérmenes. La prevención de transmisión de bacterias, hongos y parásitos (tanto nosocomiales como oportunistas), se debe considerar igualmente importante. Se hace preciso establecer y seguir normas mínimas de control, tanto para los animales como para los cuidadores y todo el personal implicado en el proceso del xenotrasplante. ASPECTOS LEGALES No existe ninguna regulación expresa o específica de las prácticas de xenotrasplantes ni en el ámbito nacional ni internacional. Existen normativas a las que de forma tangencial deben aplicarse diversos aspectos de los xenotrasplantes. Aunque no existe prohibición expresa que impida el trasplante de órganos de animales a humanos en ninguna legislación y aunque el xenotrasplante dista mucho de ser un procedimiento rutinario, las investigaciones, en este campo, precisan del adecuado marco regulatorio. El gobierno Británico decidió la creación de un comité que monitorizará y hará un seguimiento de las investigaciones en xenotrasplante: UXIRA, siguiendo las recomendaciones del Comité Neuffield que hasta el momento han sido: 1. No es aconsejable iniciar ensayos clínicos en esta materia dada la falta de evidencias concluyentes sobre aspectos fisiológicos, inmunológicos y riesgos de infección. 2. El uso de cerdos (incluyendo cerdos transgénicos) como fuente de órganos y tejidos es aceptable. El uso de primates es éticamente inaceptable. 3. Se debe mantener el alotrasplante y si ello es posible potenciarlo poniendo atención especial en los aspectos relativos a las tasas de donación. Se debe promover la investigación en otras alternativas terapéuticas tales como los órganos artificiales o la terapia génica. 4. Se establecerá un comité que haga un seguimiento de las investigaciones sobre xenotrasplante y su posible aplicación clínica. El Instituto de Salud Pública de USA ha desarrollado unas guías de buena práctica en investigación en xenotrasplante y el Instituto de Medicina ha publicado un documento informativo. La FDA es en principio responsable de autorizar procedimientos experimentales y se creará un comité federal de seguimiento de investigaciones en xenotrasplante. El Comité de Salud del Consejo de Europa ha aprobado una recomendación que insta a los gobiernos de los estados miembros a desarrollar comisiones que puedan hacer un seguimiento de las investigaciones, así como que desarrollen los mecanismos de control necesarios para minimizar el riesgo de transmisión de infecciones y enfermedades conocidas ó desconocidas y también hacer un seguimiento de los eventuales receptores de xenoinjertos. En ausencia de regulaciones específicas en España, diversas legislaciones abordan aspectos colaterales que se refieren a investigaciones en animales y manipulación genética. Su relación es la siguiente: - Ley 15/1994, de 3 de Junio, por la que se establece el Régimen Jurídico de la 256 utilización confinada, liberación voluntaria y comercialización de organismos modificados genéticamente, a fin de prevenir los riesgos para la salud humana y el medio ambiente. - Real Decreto 951/1997, de 20 de Junio, por el que se aprueba el Reglamento General para el desarrollo y ejecución de la Ley 15/1994, de 3 de Junio, por la que se establece el Régimen Jurídico de la utilización confinada, liberación voluntaria y comercialización de organismos modificados genéticamente, a fin de prevenir los riesgos para la salud humana y el medio ambiente. - Orden, de 13 de Octubre de 1989, por la que se establecen las normas de registro de los establecimientos de cría, suministradores y usuarios de animales de experimentación de titularidad estatal, así como las de autorización para el empleo de animales en experimentos, en desarrollo del Real Decreto 223/1988 de 14 de Marzo. - INSTRUMENTO de ratificación del Convenio Europeo sobre protección de los animales vertebrados utilizados con fines experimentales y otros fines científicos, hecho en Estrasburgo el 18 de Marzo de 1986. - Directiva de la Unión Europea, de 24 de Noviembre de 1986 (Directivo 86/609 CEE) relativo a la armonización de las disposiciones legales, reglamentarias y administrativas de los animales utilizados para experimentación y otros fines científicos. - Real Decreto 223/1988, de 14 de Marzo sobre protección de animales utilizados para experimentación y otros fines científicos cuya finalidad es asegurar la protección de los animales, la provisión de los adecuados cuidados, la evitación de dolor innecesario, sufrimiento, estrés o lesión prolongada. Evita la duplicación inútil de experimentos y trata de que el número de animales utilizados se reduzca al mínimo. Actualizaciones en Trasplantes 2001. Asimismo, la práctica totalidad de las Comunidades Autónomas han dictado normas relativas a la protección de animales, si bien la mayor parte excluye en sus disposiciones lo relativo a la experimentación remitiéndose a la normativa estatal. 257 ASPECTOS ÉTICOS Esta serie de problemas y de avances en las cuestiones científicas, técnicas y legales que tiene planteada la investigación en xenotrasplante, están dando lugar a una preocupación a escala internacional en relación con el inicio de una fase clínica. Sin embargo en este momento el debate no debería centrarse en valorar hasta dónde debe permitirse seguir a la investigación, sino en cómo aprovechar sus progresos en beneficio de los enfermos. El riesgo de transmisión de una enfermedad infecciosa de características desconocidas transformará al sujeto en un paciente especial y asimismo transformará su vida, su relación con su entorno y probablemente transformará también la vida de los que le rodean. En este caso, el consentimiento informado se transforma en la piedra angular sobre la que debe apoyarse el dilema. Este documento tendrá características especiales que afectarán sobre todo a la comunicación del riesgo, a la confidencialidad, la revocabilidad ya que probablemente debería ser extensible a los familiares. Seguramente llegará a ser más parecido a un contrato legal o incluso se planteará que sea individual a cada paciente concreto. El xenotrasplante abrirá otro gran debate acerca del concepto de modificación substancial del ser humano cuando una parte de su cuerpo se ha sustituido por la de un animal de otra especie y la percepción de este sentimiento de quimera. Para algunos puede constituir una contaminación del ser humano en sí y dudan de la aceptación social de estos nuevos seres humanos por parte del resto de la sociedad que quizás no siente la necesidad de un órgano para poder seguir viviendo. En los últimos años estamos asistiendo a un debate social creciente con respecto al uso de animales con cualquier finalidad. Sin embargo, ya desde hace muchos años esta cuestión se había planteado en relación con el concepto de utilitarismo dentro de la ética. Sabemos que es necesaria la cría de animales con fines de alimentación y también está ampliamente aceptado el uso racional de animales para experimentación científica que se ha demostrado crucial en el desarrollo de muchos avances médicos. Los grupos de protección de animales, en general, se manifiestan contrarios al uso de animales vertebrados para cualquier finalidad, pero hay menos problemas con los invertebrados. Incluso dentro de los vertebrados, hay mucha más preocupación por el uso de felinos ó caninos ó cérvidos que por el uso de otros animales. Los grupos sociales de protección de animales exponen que los xenotrasplantes son una nueva fuente de explotación animal, pero estos grupos están mucho más desarrollados y arraigados socialmente en unos países que en otros. En realidad hay muy poca diferencia entre criar animales para consumo de alimentos o para producción de órganos para trasplante, pero lo que sí puede resultar algo distinto es la modificación genética de animales para producir xenoinjertos. Sobre este particular está abierto el debate acerca de la diferencia entre criar o alimentar sólo y criar o alimentar animales que han sido objeto de alguna práctica relacionada con la ingeniería genética. Es obvio que estas modificaciones han de hacerse para minimizar los riesgos de rechazo hiperagudo, pero el animal deberá mantener su aspecto externo intacto, siendo éste un principio básico aplicable a todos los seres vivos y aceptado universalmente. En todo caso, lo que sí es cierto es que hay una tendencia reciente a buscar 258 alternativas y a reducir y racionalizar el uso de animales para investigación. Una vez establecida la posibilidad de utilizar animales como fuente de órganos para trasplante en humanos, en primer lugar se podría plantear la decisión sobre cuál puede ser la especie animal más adecuada para ser utilizada como donante. El donante ideal debe estar disponible en grandes cantidades y libre de infecciones. Los primates no humanos resultaban una alternativa atractiva, debido a su similitud con humanos, pero presentan problemas por lo que se ha vuelto la vista hacia los cerdos. Comparación de los primates y los cerdos como donantes de órganos: En conclusión, probablemente al xenotrasplante haya que aplicarle la conocida ética de mínimos, que contempla los principios éticos de no maleficiencia, y justicia- utilitarismo, es decir, no producir daño de forma deliberada y a la vez, conseguir el mayor bien para el mayor número de personas o el menor daño para el mayor número de personas. Actualizaciones en Trasplantes 2001. LA SUBCOMISIÓN NACIONAL DE XENOTRASPLANTES 259 A pesar de las innegables posibilidades que esta opción terapéutica ha planteado a priori, existe una evidente preocupación a escala internacional en muchos aspectos relacionados con las investigaciones en marcha, y más en concreto con una hipotética fase clínica de las mismas o incluso una aplicación clínica establecida. - Se desconoce el futuro comportamiento de los agentes infecciosos de los animales en el ser humano y viceversa. - Se desconoce la capacidad de viabilidad funcional de los órganos de animales, tanto en sus aspectos cualitativos como en la duración media de esta función. - No existen normas tanto en el ámbito nacional como internacional al respecto, ni en el plano jurídico ni en el plano ético. - Se desconoce el impacto psicosocial que una eventual investigación en fase clínica o aplicación clínica terapéutica pudiera conllevar. Sobre la base de estos condicionantes, diferentes organismos internacionales relacionados con la salud han emitido posturas al respecto, y entre ellos, el Pleno de la Comisión de Sanidad (Health Committee) del Consejo de Europa, a petición de la Comisión de Trasplantes de dicho organismo, aprobó en Junio de 1997 una propuesta de recomendación a los Estados miembros para que se creen organismos de control sobre esta materia. En nuestro país, la Comisión de Trasplantes del Consejo Interterritorial del Sistema Nacional de Salud, aprobó la creación de una Subcomisión dedicada a las investigaciones en xenotrasplante en su reunión celebrada el 8 de Mayo de 1997. Asimismo el Pleno del Congreso de los Diputados aprobó el 10 de Junio del mismo año, una proposición no de ley en la que se instaba al Gobierno a realizar un seguimiento cercano de esta terapéutica. Dadas las implicaciones del tema, el Ministerio de Sanidad en cumplimiento de lo expuesto anteriormente ha creado una Comisión Multidisciplinaria en la que expertos en los diferentes campos relacionados con la materia contribuirán a la buena marcha de los proyectos. Sus misiones se pueden resumir en: - Conocimiento y seguimiento de los proyectos de investigación que se desarrollan en nuestro país y que afecten de alguna manera a simios y/o humanos. - Conocimiento de la marcha de las investigaciones en la materia en el ámbito internacional. - Elaboración de las recomendaciones oportunas para el desarrollo de las investigaciones, sobre todo en lo que se refiere al control de los riesgos de enfermedades transmisibles. - Asesoramiento de los organismos sanitarios y no sanitarios en materia de xenotrasplantes. - Emisión de informes periódicos o a demanda en materia de investigación en xenotrasplantes. - Análisis y aprobación de proyectos de investigación clínica de xenotrasplantes. - Desarrollo y mantenimiento de un registro de los receptores de xenotrasplantes y las fuentes de donación. La Subcomisión fue constituida el 29 de Junio de 1997 y se pone al servicio de cualquier demanda de la comunidad científica o de las diferentes instituciones médicas y sociosanitarias. Se compromete a mantener informados a todos los agentes sanitarios y 260 sociales implicados o relacionados con los xenotrasplantes sobre sus trabajos en marcha, así como a ser un foro de apoyo a las investigaciones en marcha. Esta Subcomisión ha presentado un Documento base e trabajo, como puesta al día de toda problemática planteada en relación con esta nueva opción terapéutica, así como publica las Recomendaciones de Regulación de esta actividad en España. Dicho documento, así como las Recomendaciones tienen el refrendo de la Comisión Permanente de Trasplantes del Consejo Interterritorial del Sistema Nacional de Salud. Actualizaciones en Trasplantes 2001. Bibliografía 261 1. Informe Subcomisión de Xenotrasplantes de la Comisión Permanente de Trasplantes del Consejo Interterritorial del Sistema Nacional de Salud: 1997, Ministerio de Sanidad y Consumo, Madrid. (En prensa) 2. 4th International Congress for Xenotransplantation. Nantes, Francia; Septiembre 1997. 3. Starzl TE, Tzakis A, Fung J, Todo S, Demetris A, Mañez R. Prospects of clinical xenotransplantation. Transpl Proc 1994. 26:1082-1088 4. Dorling A, Riesbeck K, Warrens A, Lechler Clinical xenotransplantation of solid organs. Lancet 1997; 349:867-871. 5. Chapman LE, Folks TM, Salomon DR, Paterson AP, Eggerman TE, Noguchi PD. Xenotransplantation and xenogenic infections. N Engl J Med 1995; 333:1498-1501. 6. Fishman JA. Xenosis and xenotransplantation: Addressing the infectious risks posed by an emerging technology. Kidney International 1997; 51 /suppl 58)41-45. 7. Fishman JA. Miniature swine as organ donors for man: Strategies for prevention of xenotransplant associated infections Xenotransplantation 1994; 4:455-477. 8. Draft Public Health Service Guideline on Infectious Disease Issues in Xenotransplantation. Federal Register 1996; 85:49919-49932. 9. Guidance on xenotransplantation sought. Nature Medicine 1997; 3:935. 10. Swindle MM. Considerations of specific pathogen-free swine in xenotransplantation. J Invest Surg 1996; 9:267-271. 11. Perico N, Remuzzi G. Xenotransplantation: Problems and prospects. Nefhrol Dial Transplant 1997; 12 (suppl 1):59.64. 12. Warrens AN, Dorling A Lechler RI. The prospects of xenotransplantation. QJM 1996; 89:885-891. 13. Ley General de Sanidad. 14/1986, de 26 de Abril: Artículo 10 (Consentimiento informado) y Artículo 31 (Competencias de las Comunidades Autónomas sobre protección y experimentación animal). 14. Convention on Human Rights and Biomedicine: Capítulos II y III. Oviedo, 4 de Abril, 1997. 15. Daar AS, D Phill Ethics of Xenotransplantation: Animal issues, consent, and likely transformation of transplant ethics. World J Surg 21:975-82, 1 Medical Research Council:1993. 16. Advisory Group on the Ethics of Xenotransplantation: 1997, Animal Tissue into Humans, TSO, London. 17. Reagan, Tom, 1983, The Case for Animal Rights. University of California Press. Berkeley and Los Angeles. 18. Documento de Consenso de la Comisión Permanente de Consejo Interterritorial del Sistema Nacional de Salud: Puntos éticos de conflicto que puede generar un trasplante de órganos Rev Esp Traspl 2 (Extr.1):9-11, 1993. 19. DRAFT Public Health Service Guideline on Infections Disease Issues in Xenotransplantation: Notice. Department of Health and Human Services Public Health Service (August 1.996) (Obtenido a través de Internet). 20. Ley 15/1994, de 3 de junio. Régimen jurídico de la utilización de organismos modificados genéticamente. 21. Real Decreto 951/1997, de 20 de junio, por el que se aprueba el Reglamento General para el Desarrollo y Ejecución de la Ley 15/1994, de 3 de junio. 22. INSTRUMENTO de Ratificación del Convenio Europeo hecho en Estrasburgo el 18 de marzo de 1986. BOE 25805 de 25 de octubre de 1990. 23. Real Decreto 223/1988, de 14 de marzo, sobre protección de los animales utilizados para experimentación y otros fines científicos. 24. Orden de 13 de octubre de 1989. Normas de registro de establecimientos, suministradores y usuarios de animales de experimentación de titularidad estatal.