cátedra: ingeniería de procesos
Anuncio

Universidad Nacional de San Juan – Argentina
Facultad de Ingeniería/Departamento de Ing. Química
CÁTEDRA: INGENIERÍA DE PROCESOS
MÓDULO: SÍNTESIS DE PROCESOS
TRABAJO PRÁCTICO Nº 1
OBJETIVOS:
1. Introducirnos en el Método de Síntesis Jerárquica de Douglas, mediante la Jerarquización de
flowsheets de procesos existentes.
2. Revisar los conceptos de conversión y selectividad, desarrollando correlaciones entre ambas,
para su utilización en el cálculo de balances.
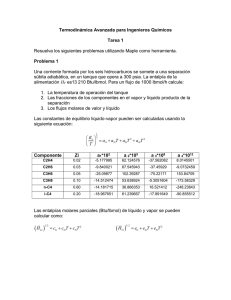
PROBLEMA Nº 1
Un flowsheet para la síntesis del etanol se muestra en la Figura 1. Las reacciones son:
Etileno + Agua
Etanol
2 Etanol
Dietil-Éter + Agua
La reacción tiene lugar a 560 ºK y 69 bar, y con una conversión del 7 % del etileno. La constante de
equilibrio para la producción del dietil-éter en esas condiciones es K = 0.2.
Las corrientes de alimentación son agua pura y etileno (90 % etileno, 8 % etano y 2% de metano).
Realice los niveles de jerarquización del flowsheet.
Figura 1.
Calentador de la
sección de
reacción
Venteo
Reactor
Agua
Separador
Lava
dor
Condensado
H2O
Año 2009
Columna
Columna
Alimentación
de etileno
Columna
Azeótropo
EtOH - H2O
DEE
H2O
1
Universidad Nacional de San Juan – Argentina
Facultad de Ingeniería/Departamento de Ing. Química
PROBLEMA Nº 2
En la figura 2, se muestra un diagrama de flujo para la producción de etilbenceno. Las reacciones son:
Etileno + Benceno
Etilbenceno
Etileno + Etilbenceno
Dietilbenceno
Etileno + Dietilbenceno
Trietilbenceno
La reacción se lleva a cabo con exceso de benceno y conversión casi completa del etileno, para tratar de
minimizar la formación de di y trietilbenceno, y la misma tiene lugar a 300 psig y 820ºF sobre catalizador.
Se requieren dos reactores (uno en funcionamiento y el otro en regeneración debido a la formación de
coque). La alimentación de etileno contiene 0.94% de etano y 0.28% de agua en la alimentación de
benceno. Realice los niveles de jerarquización del flowsheet.
Figura 2.
Año 2009
2
Universidad Nacional de San Juan – Argentina
Facultad de Ingeniería/Departamento de Ing. Química
PROBLEMA Nº 3
Considere dos reacciones isotérmicas en paralelo, de primer orden en un reactor batch (o tubular)
alimentado con reactante puro:
A
B
A
C
Siendo B el producto deseado y C el producto no deseado. Se define la selectividad como S = mol de
producto deseado / mol de A convertido. Realizar un análisis cinético para determinar la dependencia de
la selectividad con la conversión.
¿Cuál sería el resultado si la primera reacción fuese de primer orden y la segunda de segundo orden?
PROBLEMA Nº 4
El isooctano (gasolina) se puede producir mediante las siguientes reacciones:
Buteno + Isobutano
Isooctano
Buteno + Isooctano
C12
Las reacciones tienen lugar en fase líquida a 45ºF y 90 psia en un reactor tanque agitado continuo.
Asuma que la cinética de la reacción coincide con la estequiometría y desarrolle una expresión para la
selectividad (isooctano producido por buteno convertido). Tome como valores de k1 y k2, 70.4 y 166.5
respectivamente y que los reactivos se alimentan puros al reactor.
PROBLEMA Nº 5
El etileno puede producirse a partir del craqueo térmico del etano mediante las siguientes reacciones:
C2H6
C2H4 + H2
C2H6
½ C2H4 + CH4
Las que tienen lugar a 820 ºC y 3.5 atm.
Algunos datos de la distribución de producto se dan en la siguiente tabla. Convertir los datos de
porcentaje en peso a porcentaje en moles, y luego desarrollar una correlación para la selectividad (moles
de C2H4 en la salida del reactor por mol de C2H6 convertido) en función de la conversión.
Tabla.
Componente
Producción, % peso
H2
2.00
2.47
2.98
3.51
4.07
4.64
CH4
1.30
1.63
2.12
2.69
3.23
3.96
C2H4
28.90
35.8
43.20
51.10
59.40
67.80
C2H6
67.80
60.10
51.70
42.70
33.30
23.60
Año 2009
3
Universidad Nacional de San Juan – Argentina
Facultad de Ingeniería/Departamento de Ing. Química
CÁTEDRA: INGENIERÍA DE PROCESOS
MÓDULO: SÍNTESIS DE PROCESOS
TRABAJO PRÁCTICO Nº 2
OBJETIVO: Desarrollar los balances de materia y calcular el potencial económico para el segundo nivel
de decisión del método de Douglas.
PROBLEMA Nº 1
El etileno puede producirse a partir del craqueo térmico del etano mediante las siguientes reacciones:
CH6
C2H4 + H2
CH6
½ C2H4 + CH4
Las reacciones tienen lugar a 820 ºC y 3.5 atm. Se desea producir 875 lbmol/h de un producto que
contiene 75 % de etileno. Suponer que la selectividad está dada por:
S=
Mol de C2 H 4 formado
0.0381
= 1−
Mol de C2 H 6 convertido
(1 − X )0.241
La alimentación de etano contiene 5 % de CH4 como impureza y su costo es de $ 1.65/ lbmol. El etileno
con una pureza del 95 % vale $ 6.15/ lbmol. El valor del combustible es de $ 4/ 106 BTU.
ΔHC, H2 = 0.123 x 106 Btu/ lbmol,
ΔHC, CH4 = 0.383 x 106 Btu/ lbmol
•
Dibuje la estructura de Entrada-Salida del proceso
•
Realice el gráfico de potencial económico.
PROBLEMA Nº 2
Considere el esquema de producción de etanol dado en el práctico 1. El caudal de producción deseado
es de 783 lbmol/h de mezcla azeotrópica (85.4 %mol de etanol), y los costos son: alimentación de etileno
(mezcla) $ 6.15/ lbmol, agua de proceso = $ 0.00194/ lbmol, etanol como azeótropo = $ 10.89/ lbmol y el
costo del combustible es de $ 4.00/ 106 Btu.
•
Dibuje la estructura de Entrada-Salida del proceso.
•
Realice el gráfico de potencial económico.
Año 2009
1
Universidad Nacional de San Juan – Argentina
Facultad de Ingeniería/Departamento de Ing. Química
PROBLEMA Nº 3
Considere el esquema de producción de isooctano dado en el práctico 1. El caudal de producción
deseada es de 918 lbmol/h de isooctano.
Los costos de las corrientes son:
Buteno
$ 4.40/ lbmol
Isobutano
$ 5.63/ lbmol
Isooctano
$ 36.54/ lbmol
Combustible
$ 4.00/ 106 Btu
* Asuma el costo del n-dodecano como despreciable.
Y la composición de las corrientes de alimentación:
Componente
1
2
C3
8%
12 %
Buteno
80 %
-
i-C4
-
73 %
n-C4
12 %
15 %
•
Dibuje la estructura de Entrada - Salida del proceso.
•
Realice el gráfico de potencial económico.
PROBLEMA Nº 4
El estireno puede producirse por medio de las siguientes reacciones:
C6H5-C2H5
Etilbenceno
C6H5-C2H3 + H2
Estireno
(1)
C6H5-C2H5
Etilbenceno
C6H6 + C2H4
Benceno Etileno
(2)
C6H5-C2H5 + H2
Etilbenceno
C6H5-CH3 + CH4
(3)
Tolueno
Metano
La reacción tiene lugar a 1115 ºF y 25 psia. Se desea producir 250 lbmol/h de estireno.
Wenner y Dybdal encontraron correlaciones para la distribución de producto:
Moles de Benceno
= 0.333 X − 0.215 X 2 + 2.547 X 3
Mol de Estireno
Moles de Tolueno
= 0.084 X − 0.264 X 2 + 2.638 X 3
Mol de Estireno
Año 2009
2
Universidad Nacional de San Juan – Argentina
Facultad de Ingeniería/Departamento de Ing. Química
donde X es la conversión a estireno. La corriente de alimentación de etilbenceno contiene 2 % en moles
de benceno.
Los costos de los productos y los reactivos son:
Etilbenceno
$ 15.75/ lbmol
Estireno
$ 21.88/ lbmol
Benceno
$ 9.04/ lbmol
Tolueno
$ 8.96/ lbmol
Combustible
$ 4/ 106 Btu
•
Esquematice la estructura de Entrada - Salida del proceso.
•
Realice el gráfico de potencial económico.
Año 2009
3
Universidad Nacional de San Juan – Argentina
Facultad de Ingeniería/Departamento de Ing. Química
CÁTEDRA: INGENIERÍA DE PROCESOS
MÓDULO: SÍNTESIS DE PROCESOS
TRABAJO PRÁCTICO Nº 3
OBJETIVO: Desarrollar la estructura de reciclo, e incorporar los nuevos costos en el potencial
económico obtenido en el nivel de decisión anterior del Método de Douglas.
PROBLEMA Nº 1
Desarrollar la estructura de reciclo para el problema de la síntesis de etanol. Suponer que ΔHR,EtOH =
-
19440 BTU/mol y ΔHR,DEE = - 5108 BTU/mol; la constante cinética de reacción está dada por:
k1 = (1.4 x 109 ) exp { − 29807 / RT (º R) }hr −1
y es de primer orden respecto al agua; y
Keq = (1.679 x 10−7 ) exp [ 10119 / T (º R )
•
]
Graficar el potencial económico versus las variables de diseño.
PROBLEMA Nº 2
Desarrollar la estructura de reciclo para el proceso de producción de isooctano vía alquilación de buteno.
Suponer
que
ΔH1
=
-
27440
Btu/lbmol,
ΔH2
=
-
25180
Btu/lbmol,
k1 = (9.56 ×1013 ) exp{−28000 /[ RT (º R )} [=] h −1 y
k 2 = (2.439 ×1017 ) exp{−35000 /[ RT (º R )} [=] h −1 ,
asumir ambas constantes de primer orden respecto al buteno.
0.558
Usar reactor tanque agitado continuo con la siguiente correlación de costo: 3150 V R
•
Graficar el potencial económico versus las variables de diseño.
•
Justificar el tipo de contacto usado.
Año 2009
[=] $ / año
1
Universidad Nacional de San Juan – Argentina
Facultad de Ingeniería/Departamento de Ing. Química
CÁTEDRA: INGENIERÍA DE PROCESOS
MÓDULO: SÍNTESIS DE PROCESOS
TRABAJO PRÁCTICO Nº 4
OBJETIVO: Desarrollar el mejor sistema de separación para diferentes procesos, utilizando para tal
propósito, los heurísticos disponibles, las aproximaciones en los cálculos de separación y la asistencia
de simuladores (con ayuda del profesor).
PROBLEMA Nº 1
Realizar el cálculo aproximado de la separación flash producida sobre la corriente de salida del reactor
del proceso HDA. Considere que los caudales de salida de cada uno de los componentes de la corriente
y la constante de equilibrio líquido-vapor para cada uno de ellos son:
Componente
fi o fj (mol/h)
Ki o Kj
H2
1549
99.07
CH4
2323
20.00
Benceno
265
0.0104
Tolueno
91
0.00363
Difenilo
4
0.000008
Estos valores han sido calculados para una conversión 0.75 y un valor de yPH = 0.4
PROBLEMA Nº 2
Hacer la mejor propuesta de sistema de separación para los siguientes procesos, considere si es
necesario un sistema de recuperación de vapor, donde debería colocarse, qué tipo de sistema de sería
el mejor, dé alternativas de secuenciamiento de columnas de destilación, cuál sería la mejor. Describa
en detalle cuáles son las razones de su propuesta e indique qué cálculos debería realizar para verificar
sus suposiciones o realícelos en caso de disponer de un simulador de procesos.
a) Proceso del estireno.
b) Proceso del isooctano. En este caso: ¿se pueden considerar columnas con corrientes laterales?
Año 2009
1
Universidad Nacional de San Juan – Argentina
Facultad de Ingeniería/Departamento de Ing. Química
CÁTEDRA: INGENIERÍA DE PROCESOS
MÓDULO: SÍNTESIS DE PROCESOS
TRABAJO PRÁCTICO Nº 5
OBJETIVO: Desarrollar la red de intercambio calórico (RIC) más eficiente y económica posible para un
conjunto dado de corrientes.
PROBLEMA Nº 1
Dadas las siguientes corrientes y servicios auxiliares:
Corriente
Te (K)
Ts (K)
F.Cp, kW/K
Observación
1
430
340
15
Líquido
2
310
395
7
Líquido
3
370
460
32
Vapor
Servicio auxiliar
Te (K)
Ts (K)
Costo $/kg
Vapor
500
500
0.006
Agua de enfriamiento
305
≤ 325
0.00015
Coeficientes globales de transferencia de calor:
Uheater = 0.3505 kW/m2. K
Ucooler = 0.2629 kW/m2. K
Costo de compra de los intercambiadores de calor:
CP($) = 3000 A0.5
A = [m2]
Operación de equipos = 8500 h/año
Tasa de retorno = r = 0.1
1. Para un ΔTmín = 10 K, calcular los requerimientos mínimos de calentamiento y enfriamiento, el
calor disponible en cada intervalo de temperatura, dibujar el diagrama de cascada.
2. Calcular la temperatura de pinch.
3. Calcular el número de intercambiadores de calor, sin tener que pasar energía a través del pinch.
4. Desarrollar una red de intercambiadores de calor.
5. Hacer el cálculo del costo de la RIC.
6. Calcular el número mínimo de intercambiadores de calor.
7. Realizar la ruptura de loops para eliminar intercambiadores de calor.
Año 2009
1
Universidad Nacional de San Juan – Argentina
Facultad de Ingeniería/Departamento de Ing. Química
PROBLEMA Nº 2
Dadas las siguientes corrientes y servicios auxiliares:
•
Corriente
Te (C)
Ts (C )
F.Cp, kW/C
1
180
60
3
2
150
30
1
3
30
135
2
4
80
140
5
Servicio auxiliar
Te (C)
Ts (C)
Vapor
150
150
Agua de enfriamiento
32
≤ 52
Se requieren los mismos ítems que en el problema 1, con excepción del ítem 5.
Año 2009
2
Universidad Nacional de San Juan – Argentina
Facultad de Ingeniería/Departamento de Ing. Química
CÁTEDRA: INGENIERÍA DE PROCESOS
MÓDULO: SIMULACIÓN DE PROCESOS
TRABAJO PRÁCTICO Nº 6
OBJETIVO: A partir del diagrama de flujo de un proceso (DFP) determinado, obtener el diagrama de
flujo de información (DFI) asociado, y la secuencia lineal de resolución del mismo mediante los
algoritmos de Preprocesamiento de la Información.
PROBLEMA Nº 1
La alternativa tecnológica seleccionada para la producción de monoclorodecano se representa a través del
diagrama de flujo mostrado en la figura.
Las reacciones involucradas en el reactor son:
Cl2 + C10H22
MCD + HCl
MCD + Cl2
DCD + HCl
•
Realice el diagrama de flujo de información correspondiente y aplique el algoritmo de KehatShacham para su particionado, el de Lee Rudd para su rasgado y realizar el ordenamiento.
Año 2009
1
Universidad Nacional de San Juan – Argentina
Facultad de Ingeniería/Departamento de Ing. Química
PROBLEMA Nº 2
El flowsheet simplificado para la producción de etileno a partir del craqueo térmico del etano es el
siguiente:
H2 - CH4
Destilador (25 atm)
Compresor
Etileno
Destilador (31 atm)
Horno
Absorbedor (35 atm)
Alimentación
de Etano
Aceite
Nuevo de
Etano
Lavado
•
Se requieren los mismos ítems que en el problema 1.
Año 2009
2
Universidad Nacional de San Juan – Argentina
Facultad de Ingeniería/Departamento de Ing. Química
CÁTEDRA: INGENIERÍA DE PROCESOS
MÓDULO: SIMULACIÓN DE PROCESOS
TRABAJO PRÁCTICO Nº 7
OBJETIVO: Obtener el conjunto óptimo de variables de diseño y la secuencia de resolución de un
módulo básico de simulación (equipo), mediante la aplicación del Algoritmo de Lee, Christensen y Rudd.
PROBLEMA 01
Realizar la selección de variables de diseño y la secuencia de resolución, suponiendo que un proceso
está modelado por el siguiente conjunto de ecuaciones:
2 x 1 + 3 x 2 + 5 x 3 + 6 x 4 + x 5 = 10 (1)
4 x 2 + x 3 + 3 x 4 + 4 x 5 = 20
( 2)
x2 + 2 x3 +
+ x 5 = 25
( 3)
3 x3 +
+ 2 x 5 = 15
( 4)
2 x 1 + 7 x 2 + 6 x 3 + 9 x 4 + 5 x 5 = 30 (5)
PROBLEMA 02
Se requieren los mismos ítems que en el problema 01, pero para un intercambiador de calor líquido –
líquido (Figura), teniendo en cuenta las siguientes hipótesis:
1- Estado Estacionario.
2- Un solo componente.
3- Sin cambio de fase.
4- Equipo de un solo paso.
5- U (coeficiente global de transferencia) se supone constante.
6- Sin pérdida de carga a lo largo del equipo.
Las ecuaciones correspondientes son:
q = U . A . ΔT LM
(1)
q = Q1 ( H 1 s − H 1 e )
(2)
q = Q 2 ( H 2 s − H 2e )
(3)
ΔTLM =
(T1e − T2 s ) − (T1 s − T2 e )
⎡ (T − T2 s ) ⎤
ln ⎢ 1e
⎥
⎣ (T1 s − T2 e ) ⎦
H 1 s = H 1 s (T1 s , P )
Año 2009
(4)
(5)
1
Universidad Nacional de San Juan – Argentina
H 2 s = H 2 s (T2 s , P )
(6)
H 1e = H 1e (T1e , P )
(7)
H 2 e = H 2 e (T2 e , P )
(8)
Facultad de Ingeniería/Departamento de Ing. Química
Q2, T2e, H2e, P
INTERCAMBIADOR DE
CALOR – U.A
Q1, T1s, H1s, P
Q1, T1e, H1e, P
Q2, t2s, H2s, P
Figura.
Año 2009
2
Universidad Nacional de San Juan - Argentina
Química
Facultad de Ingeniería/Departamento de ing.
CÁTEDRA: INGENIERÍA DE PROCESOS
MÓDULO: SIMULACIÓN DE PROCESOS
TRABAJO PRÁCTICO Nº 8
OBJETIVO: Introducirnos en el manejo básico de un simulador comercial de procesos químicos y
petroquímicos, mediante la resolución de un problema de aplicación.
PROBLEMA
1- COLUMNA DEMETANIZADORA
Una columna demetanizadora es operada como una columna sin reflujo con una presión en el tope de
2273.7 kPa y una presión en el fondo de 2308.15 kPa. La torre tiene dos alimentaciones y un calentador
lateral para controlar el caudal interno de vapor de la columna. La carga de calor del intercambiador
lateral es de 2.11e6 kJ/h. La torre tiene 10 etapas teóricas incluyendo el reboiler, y el calentador lateral
está ubicado en la etapa 4, contando desde el tope. Se asume un caudal de 1339.3 kmol/h del producto
de tope y los estimados de temperatura para el tope y el fondo son –87.22 ºC y 26.67 ºC
respectivamente. A continuación se muestran las alimentaciones, sus caudales y ubicación.
Condiciones de las alimentaciones:
Alimentación
1
2
Etapa
1
2
2273.7
2287.5
-119
-83.3
Presión (kPa)
Temperatura (ºC)
Componentes
kmol/h
kmol/h
N2
4.14
1.23
CO2
7.82
0.63
C1
1142.13
157.69
C2
311.53
25.66
C3
114.58
16.36
i – C4
18.08
4.44
n – C4
13.80
4.29
i – C5
5.86
3.21
n – C5
3.24
2.22
n – C6
0.55
0.81
n – C7
0.33
1.04
n – C8
0.09
0.59
Año 2009
1
Universidad Nacional de San Juan - Argentina
Química
Facultad de Ingeniería/Departamento de ing.
Calcular:
1- Recuperación de etano en el producto de fondo.
2- Recuperación de propano en el producto de fondo.
Debe bombearse el producto de fondo de la demetanizadora hasta una presión de 2756 kPa y usar esta
corriente como alimentación a la deetanizadora.
2- COLUMNA DEETANIZADORA
La columna deetanizadora opera como una columna de destilación con reflujo y tiene 15 etapas teóricas,
incluyendo el condensador y el reboiler. El plato de la alimentación es el séptimo contando desde el tope.
El producto de fondo de la demetanizadora es la alimentación de la columna y entra a una presión de
2756 kPa. La presión del condensador es de 2721.55 kPa y la del reboiler es de 2790.45 kPa.
Para simular la columna se asume que se desea una especificación para el producto de fondo de C2/C3
≤ 0.01 en fracción molar y una relación de reflujo de 2.5.
Se desea saber:
-
Cuál es la recuperación de etano en el producto de tope.
-
Cuál es la recuperación de propano en el producto de fondo.
NOTA: El producto etano de tope es todo vapor. Asuma un estimado de temperatura para la etapa 1 de
–3.89 ºC, para la etapa 15 (reboiler) de 93.33 ºC, y un caudal del producto de cabeza de 317.8 kmol/h.
Regrese al modo EDIT FLOWSHEET (CHEMCAD) e instale una válvula para reducir la presión del
producto a un valor de 1584.7 kPa. Esta corriente será utilizada como alimentación a la columna
depropanizadora.
3- COLUMNA DEPROPANIZADORA
La presión de la columna depropanizadora es de 1584.7 kPa, siendo la presión del reboiler de 1600 kPa.
El objetivo es obtener por el tope un producto propano con la siguiente especificación de composición: i
– butano + n – butano ≤ 1.5 % molar. La composición del propano en el producto de fondo debe ser ≤
2% molar.
Asuma que la columna tiene un total de 25 etapas ideales y la etapa de alimentación es la 12 a partir del
tope. La pérdida de carga a través del condensador es de 34.45 kPa y el producto de tope es un
destilado líquido condensado.
Calcular:
-
Recuperación de propano en el producto de tope.
-
Recuperación total de etano y de propano en el tren de destilación.
Año 2009
2
Universidad Nacional de San Juan - Argentina
Facultad de Ingeniería/Departamento de Ing. Química
CÁTEDRA: INGENIERÍA DE PROCESOS
MÓDULO: SIMULACIÓN DE PROCESOS
TRABAJO PRÁCTICO Nº 8: Simulación del Proceso Otto – Williams
OBJETIVOS:
1-
Aplicar un programa generado en lenguaje de programación conocido (Qbasic), para la simulación de un proceso
sencillo.
2-
Comprender el funcionamiento de dicho programa para poder generar algoritmos propios de simulación.
Consideraremos la simulación de un proceso, propuesto inicialmente por Otto y Williams. Las corrientes de alimentación son especies
puras de A y B que se mezclan con una corriente de reciclo y entran a un reactor tanque agitado, donde tienen lugar las siguientes
reacciones:
A+B
C+B
P+C
C
P+E
G
Donde C es un producto intermedio, P es el producto principal, E es un subproducto, y G es un desecho aceitoso. Tanto C
como E pueden venderse por sus valores como combustible, mientras G debe ser tratado para poder ser desechado. La
planta consiste en un reactor, un intercambiador de calor para enfriar el efluente del reactor, un decantador para separar
el producto de desecho G de los reactantes y otros productos, y una columna de destilación para separar el producto P.
Debido a la formación de un aseó tropo, algo del producto (equivalente al 10 % en peso del flujo másico del componente
E) es retenido en el fondo de la columna. La mayoría del producto de fondo es reciclado al reactor y el resto es usado
como combustible (purga). El modelado de la planta puede realizarse sin un balance de energía y además simplificar el
problema considerando reacciones isotérmicas para la producción del producto P.
Consideremos los modelos de las diferentes unidades a fin de simular el flowsheet. Todas las corrientes están dadas en flujos
másicos.
Modelo de Reactor
F1
F2
FR
Feff
La velocidad de producción y descomposición de los componentes A, B, C, P, E y G están dados por cinéticas elementales
basadas en fracciones másicas. Por simplicidad se supone un reactor isotérmico. Las reacciones para este reactor son las
siguientes:
(
)
(
)
FeffA = F1 A + FRA − (k1 X A X B ).V .ρ
FeffB = F2B + FRB − (k1 X A + k 2 X C ). X B .V .ρ
( )
FeffC = FRC + (2k1 X A X B − 2k 2 X B X C − k 3 X P X C ).V .ρ
Año 2009
1
Universidad Nacional de San Juan - Argentina
Facultad de Ingeniería/Departamento de Ing. Química
( )
FeffE = FRE + (2k 2 X B X C ).V .ρ
( )
FeffP = FRP + (k 2 X B X C − 0.5.k 3 X P X C ).V .ρ
( )
FeffG = FRG + (1.5.k 3 X P X C ).V .ρ
Xj =
(F
A
eff
Feffj
+ FeffB + FeffC + FeffE + FeffP + FeffG
) , j = A, B, C , E, G, P
Donde las constantes de velocidad están dadas por:
[
k1 = 5.9755 ⋅ 10 9 exp(− 12000 / T ) h −1 ( fracción en peso )
[
exp(− 20000 / T )[h
−1
k 2 = 2.5962 ⋅ 1012 exp(− 15000 / T ) h −1 ( fracción en peso)
k 3 = 9.6283 ⋅ 1015
−1
]
−1
( fracción en peso )−1
]
]
y Xj es la fracción en peso del componente j, V es el volumen del reactor, T es la temperatura de reactor y ρ es la densidad de
la mezcla.
Modelo del Intercambiador de calor
Feff
Fex
Ya que no hay un balance de energía, las ecuaciones para esta unidad son directamente relaciones de entrada y salida
Fexj = Feffj , j = A, B, C , E , G, P
Decantador
Fex
Fd
Fwaste
Esta unidad supone una separación perfecta entre el componente G y el resto de los componentes, de tal forma que las
ecuaciones pueden ser escritas de la siguiente forma:
Fdj = Feffj , j = A, B, C , E , G, P
FdG = 0
G
Fwaste
= FexG
Año 2009
2
Universidad Nacional de San Juan - Argentina
Facultad de Ingeniería/Departamento de Ing. Química
j
Fwaste
= 0, j = A, B, C , E , G, P
Columna de Destilación
Fprod
Fd
Fbottom
Esta unidad supone la separación de producto P por la cabeza pero también supone que algo del producto es retenido por
debajo debido a la formación de un azeótropo, conduciendo a las siguientes ecuaciones:
j
Fbottom
= Fdj , j = A, B, C , E
j
F prod
= 0, j = A, B, C , E
P
Fbottom
= 0.1 FdE
P
F prod
= FdP − 0.1 FdE
Divisor de Flujo
Fbottom
FR
Fpurge
Las ecuaciones para esta unidad están dadas por:
j
j
F purge
= η ⋅ Fbottom
, j = A, B, C , E , P
j
FRj = (1 − η) ⋅ Fbottom
, j = A, B, C , E , P
Especificaciones para la simulación:
F1 = 6582 lb/h (todo A)
F2 = 14995.6 lb/h (todo B)
V = 1000 ft 3
η = 0.1
ρ = 50 lb/ft 3
T = < 600 ºR
•
•
Ejecutar la simulación del proceso, previo armado del flowsheet en base al enunciado del práctico.
Informar los resultados obtenidos adjuntando el flowsheet completo del proceso.
Año 2009
3
Universidad Nacional de San Juan - Argentina
Facultad de Ingeniería/Departamento de Ing. Química
CÁTEDRA: INGENIERÍA DE PROCESOS
MÓDULO: OPTIMIZACIÓN DE PROCESOS
TRABAJO PRÁCTICO Nº 9
OBJETIVO: Resolver problemas de optimización empleando la función Solver (programa)
correspondiente al utilitario de planilla de cálculo Excel.
PROBLEMA 1
Una refinería procesa petróleo crudo para producir un número de gasolinas intermediarias, las cuales
deben ser posteriormente mezcladas (o cortadas) para producir dos grados diferentes de combustible
para motor, común y premium. Cada gasolina tiene un octanaje conocido, una disponibilidad máxima, y
un costo unitario fijo. Los dos combustibles tiene un octanaje mínimo especificado y un precio de
venta, y el mezclado (corte) se lleva a cabo a un costo unitario conocido. Obligaciones contractuales
imponen requerimientos de producción mínima de ambos combustibles. Sin embargo, todo el exceso
de combustible o la gasolina no usada puede ser vendido en el mercado libre a precios conocidos.
Determinar el plan óptimo de producción de la refinería en el próximo periodo de tiempo.
Precio de
Gasolina
intermedia
Disponibilidad
Octanaje
Impuestos
Costo de
Venta
corte
αi (bbl/periodo) βi
ci(3)
ci(4)
ci(5)
1
2,00E+05
70
30
24
1
2
4,00E+05
80
35
27
1
3
4,00E+05
85
36
28.5
1
4
5,00E+05
90
42
34.5
1
5
5,00E+05
99
60
40
1.5
Tipo de Producto
Ventas
Octanaje
Precio de Venta de los
mínimas
Mínimo γj
productos ($/bbl)
contratadas δj
Contratista
Venta libre
cj(1)
cj(2)
Común
5.00E+05
85
40
46
Premium
4.00E+04
95
55
60
Año 2009
1
Universidad Nacional de San Juan - Argentina
Facultad de Ingeniería/Departamento de Ing. Química
Gasolina
intermediaria
1
α1
x1
Ventas
Directas
y1
Z1
2
x2
α2
Ventas
Directas
y2
Z2
3
Ventas
x3
α3
Contratadas
Ventas
Directas
y3
Z3
Común
x4
γ1
4
α4
y4
Ventas
Directas
Ventas
Contratadas
x5
Premium
γ2
5
y5
α5
Ventas en el
mercado
V1
Ventas en el
mercado
V2
Ventas
Directas
Z5
Año 2009
2
Universidad Nacional de San Juan - Argentina
Facultad de Ingeniería/Departamento de Ing. Química
El índice de perfomance en este caso será el beneficio neto durante el periodo planificado. El beneficio
neto estará compuesto por las ventas de combustible para motor y las ventas intermedias menos los
costos de mezclado menos los costos recargados por los intermediarios. Las variables independientes
serán simplemente los flujos representados en la figura. Así, cada intermediario tendrá asociado a el
una variable que representa la cantidad de intermediario asignado a la producción de combustible
común, otra que representa la cantidad usada para producir premium y una tercera que representa la
cantidad vendida directamente.
Así, para cada intermediario i
xi = cantidad usada para común, bbl/periodo
yi = cantidad usada para premium, bbl/periodo
zi = cantidad vendida directamente, bbl/periodo
Cada producto tendrá dos variables asociadas a el: uno representa las ventas contratadas y otro
representa las ventas en el mercado.
Así, para cada producto j
uj = cantidad asignada a los contratistas, bbl/periodo
vj = cantidad vendida en el mercado, bbl/periodo
El modelo consistirá de balances de materia de cada intermediario y producto, restricciones de
mezclado que aseguren que se alcanzarán las performances requeridas, y límites de las ventas.
1- Balance de materia para cada intermediario i:
xi + yi + zi ≤ αi
donde αi es la disponibilidad del intermediario i a lo largo del periodo, en bbl/periodo.
2- Balance de materia de cada producto:
Σ xi = u1 + v1
Σ yi = u2 + v2
3- Restricciones de mezclado de cada producto:
Σ βi xi ≥ γ1 (u1 + v1)
Σ βi yi ≥ γ2 (u2 + v1)
donde βi es el octanaje del intermediario i, y γj es el octanaje mínimo del producto j.
4- Restricciones de ventas por contrato para cada producto j:
uj ≤ δj
Año 2009
3
Universidad Nacional de San Juan - Argentina
Facultad de Ingeniería/Departamento de Ing. Química
Donde δj es la producción contratada mínima, en bbl/período.
El criterio de beneficio neto está dado por:
∑c
(1)
j
u j + ∑ c (j2 ) v j + ∑ ci( 3) z i − ∑ ci( 4 ) ( xi + y i + z i ) − ∑ ci(5) ( xi + y i )
i
i
Donde:
c (j1) = Pr ecio de unitario para las ventas por contrato de j
c (j2) = Pr ecio de unitario para las ventas libres de j
ci(3) = Pr ecio de unitario para las ventas directas del int ermediario i
ci( 4) = Im puesto unitario del int ermediario i
ci(5) = Costo de corte del int ermediario i
Utilizando los datos dados en la tabla, el problema de planificación se reduce a:
Maximizar:
40 ∗ u1 + 55 ∗ u 2 + 46 ∗ v1 + 60 ∗ v 2 + 6 ∗ z1 + 8 ∗ z 2 + 7.5 ∗ z 3 + 7.5 ∗ z 4 + 20 ∗ z 5 − 25 ∗ ( x1 + y1 )
− 28 ∗ ( x 2 + y 2 ) − 29.5 ∗ ( x3 + y 3 ) − 35.5 ∗ ( x 4 + y 4 ) − 41.5 ∗ ( x5 + y 5 )
Sujeto a las siguientes restricciones:
x1 + y1 + z1 ≤ 2.105
x2 + y2 + z2 ≤ 4.105
x3 + y3 + z3 ≤ 4.105
x4 + y4 + z4 ≤ 5.105
x5 + y5 + z5 ≤ 5.105
x1 + x2 + x3 + x4 + x5 = u1 + v1
y1 + y2 + y3 + y4 + y5 = u2 + v2
70.x1 + 80.x2 + 85.x3 + 90.x4 + 99.x5 ≥ 85.(u1 + v1)
70.y1 + 80.y2 + 85.y3 + 90.y4 + 99.y5 ≥ 95.(u2 + v2)
u1 ≥ 5.105
u2 ≥ 4.104
Además todas las variables deben ser mayores o iguales a cero.
Año 2009
4
Universidad Nacional de San Juan - Argentina
Facultad de Ingeniería/Departamento de Ing. Química
PROBLEMA 2
La relación entre presión-volumen molar- temperatura de gases reales está dada para gases ideales
por la relación:
P.v=R.T
Donde:
P = presión (atm)
v = volumen molar (cm3/gmol)
T = Temperatura (K)
R = constante de los gases ( 82.06 atm . cm3/ gmol . K)
La ecuación semiempírica,
P=
R ∗T
a
− 1/ 2
v − b T ∗ v ∗ (v + b)
intenta corregir las separaciones de la idealidad pero involucra dos constantes semiempíricas a y b
cuyos valores están mejor estimados a partir de datos experimentales. Se han realizado una serie de
medidas de P, v, T.
Experimento Nº
P (atm)
v (cm3/gmol)
T (K)
1
33
500
273
2
43
500
323
3
45
600
373
4
26
700
273
5
37
600
323
6
39
700
373
7
38
400
273
8
63.6
400
373
•
Restricciones: Pest >= Pexp
•
Estimar los valores de a y b.
Año 2009
a, b >= 0
5
Universidad Nacional de San Juan
Facultad de Ingeniería/Departamento de Ing. Química
CÁTEDRA: INGENIERÍA DE PROCESOS
MÓDULO: OPTIMIZACIÓN DE PROCESOS
TRABAJO PRÁCTICO Nº 10
OBJETIVO: Aplicar las herramientas correspondientes del simulador de procesos químicos y
petroquímicos CHEMCAD para:
•
Optimizar la operación de un equipo simulado previamente.
•
Realizar el Estudio de Sensibilidad de la solución obtenida ante perturbaciones en los
parámetros de diseño de dicho equipo.
PROBLEMA
a) Se desea minimizar la fracción de propano en el producto de fondo de la columna
depropanizadora, simulada en el práctico “Simulación de Procesos”, mediante valores óptimos
de la presión de salida de la válvula reductora y de la carga calórica del condensador de
reflujo. No se consideran restricciones en este último caso.
Nota: para ejecutar la optimización previamente deberá modificar las siguientes especificaciones y
ejecutar la simulación nuevamente:
•
En el condensador: cambiar especificación de i-butano+n-butano, por el valor de la fracción
de propano en el producto de tope, obtenido en el práctico “Simulación de Procesos”.
•
En el reboiler: cambiar especificación de propano por el valor de la carga calórica del
reboiler obtenida en el práctico “Simulación de Procesos”.
b) Se desea determinar la sensibilidad de la fracción mínima de propano en el producto de fondo
obtenido en (a), a una reducción del 10% en la carga calórica del reboiler (QR) debida a una
disminución en el coeficiente global de transmisión de calor de dicho equipo por
ensuciamiento.
c) En ambos casos anteriores, plantee el problema de optimización e informe los resultados
obtenidos.
Año 2009
1


![A↔ B (-rA) = 0.04CA-0.01CR, [=] mol*L](http://s2.studylib.es/store/data/005357341_1-6e8dd554fb791e1c2c9f555a9c29f5b3-300x300.png)