PRACTICA de laboratorio de quimica Unexpo
Anuncio

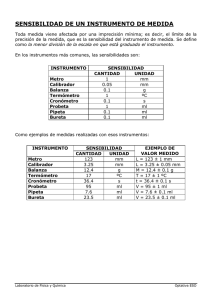
UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSE DE SUCRE VICERECTORADO “LUIS CABALLERO MEJÍAS” DEPARTAMENTO DE CIENCIAS BASICAS LABORATORIO DE QUÍMICA PRÁCTICAS DEL LABORATORIO DE QUIMICA CARACAS, ABRIL 2007 2 INDICE CONTENIDO Pág. Bibliografía sugerida para cada una de las practicas……………………………... 4 Practica 1: Medición y Errores………………………………………………… 5 A. Introducción…………………………………………………………………. 5 B. Objetivos……………………………………………………………………… 5 C. Parte experimental………………………………………………………… 6 D. Tabla de datos experimentales………………………………………….… 8 E. Cálculos y resultados……………………………………………………… 9 F. Cuestionario………………………………………………………………… 10 Practica 2: Purificación de sustancias……………………………………………… 11 A. Introducción………………………………………………………………… 11 B. Objetivos…………………………………………………………………… 11 C. Parte experimental………………………………………………………… 12 D. Tabla de datos experimentales………………………………………….… 16 E. Cálculos y resultados……………………………………………………… 17 F. Cuestionario………………………………………………………………… 17 Practica 3: Destilación simple………………………………………………….. 19 A. Introducción………………………………………………………………… 19 B. Objetivos……………………………………………………………………… 19 C. Parte experimental………………………………………………………… 19 D. Tabla de datos experimentales………………………………………….… 21 E. Cálculos y resultados……………………………………………………… 22 F. Cuestionario………………………………………………………………… 22 Practica 4: Reacciones químicas y su clasificación………………………………. 23 A. Introducción………………………………………………………………… 23 B. Objetivos…………………………………………………………………… 23 C. Parte experimental………………………………………………………… 24 D. Tabla de datos experimentales………………………………………….… 26 3 E. Cálculos y resultados……………………………………………………… 26 F. Cuestionario………………………………………………………………… 27 Practica 5: Síntesis de sulfato de bario………………………………………… 28 A. Introducción………………………………………………………………… 28 B. Objetivos……………………………………………………………………. 29 C. Parte experimental………………………………………………………… 29 D. Tabla de datos experimentales………………………………………….… 30 E. Cálculos y resultados……………………………………………………… 31 F. Cuestionario………………………………………………………………… 31 Practica 6: Determinación del contenido de vitamina C en una pastilla de 33 uso comercial……………………………………………………………………. A. Introducción………………………………………………………………… 33 B. Objetivos…………………………………………………………………… 34 C. Parte experimental………………………………………………………… 34 D. Tabla de datos experimentales………………………………………….… 36 E. Cálculos y resultados……………………………………………………… 37 F. Cuestionario………………………………………………………………… 37 Practica 7: Titulación Redox……………………………………………………. 39 A. Introducción…………………………………………………………………. 39 B. Objetivos…………………………………………………………………….. 39 C. Parte experimental…………………………………………………………. 39 D. Tabla de datos experimentales………………………………………….… 41 E. Cálculos y resultados………………………………………………………. 41 Practica 8: Comprobación de la constante universal “R” de los gases y 42 determinación del peso equivalente del magnesio…………………………….. A. Introducción…………………………………………………………………. 42 B. Objetivos…………………………………………………………………….. 42 C. Parte experimental…………………………………………………………. 42 D. Tabla de datos experimentales………………………………………….… 44 E. Cálculos y resultados………………………………………………………. 45 F. Cuestionario…………………………………………………………………. 46 4 BIBLIOGRAFÍA SUGERIDA PARA LAS PRACTICES DEL LABORATORIO 1. Alvarado J; Campos A,; Hernández A; “Manual de laboratorio de Química”. UMC. Catia la Mar, venezuela, 2003. 2. Brown T,; leMay, H; Bursten, B. “Química la ciencia central. Séptima edición. Prentice hall, México,1998. 3. C. Harris, Análisis Químico Cuantitativo, Reverté, 2001. 4. C. Harris, “Análisis Químico Cuantitativo”, Capítulos 1, 3 y 4, Editorial Iberoamérica. 5. C. Harris, “Análisis Químico Cuantitativo”, Capítulo 2, Editorial Iberoamérica. 6. Chocrón, P. y Escalona, I. 1976. Laboratorio de Física I. Facultad de Ciencias. Escuela de Física. 7. Curso de Química Analítica 2004 Unidad de Bioquímica Analítica Licenciatura en Bioquímica CIN – Facultad de Ciencias 8. Douglas, A.S. y Skoog, D.N. 1970. Fundamentos de Química Analítica. Tomo I. Editorial Reverte, España. 9. Goncalves, J., Machado, F., De Sola V. y Pardey, A. 2000 Laboratorio de Principios de Química. Universidad Central de Venezuela. Facultad de Ciencias. Escuela de Química. 10. Horta, S. Esteban, R. Navarro, P. Cornejo, C. Barthelemy, Técnicas Experimentales de Química, UNED, 3ª ed, 1991. 11. M. A. Martínez Grau, A. G. Csákÿ, Técnicas Experimentales en Síntesis Orgánica, Síntesis, 1998. 12. R. Q. Brewster, C. A. Vanderwerf, W. E. McEwen, Curso Práctico de Química Orgánica, Vertix, Alhambra. 1975. 13. Siegert C, G. “ Laboratrorio básico de Química” UCV. Facultad de Ingeniería. Caracas, venezuela, 1998. 14. Sienko,M; Plane, R. “ Química experimental. Manual de laboratorio”. Aguilar, España. 1969. 15. Skoog, D.; West, D. “ Química Analítica”. Cuarta Edición. Mc Graw Hill, España, 1989. 16. www.mtas.es/insht/ipcsnspn/spanish.htm. fecha de consulta: 20/04/2006 5 PRACTICA 1 MEDICIÓN Y ERRORES A. INTRODUCCIÓN La medida de una variable física (masa volumen, temperatura, tiempo, entre otras) es fundamental en la química por ser una ciencia experimental. En los experimentos se obtiene el valor cuantitativo de una propiedad mediante el uso de un instrumento. Existen diferentes instrumentos para medir una misma propiedad. Las características de cada instrumento son diferentes, por lo que el valor numérico obtenido puede variar considerablemente. Otro aspecto importante es que el instrumento usado este calibrado y tenga una escala de lectura adecuada. Para el trabajo en el laboratorio, es necesario el manejo adecuado de los reactivos (sólidos y líquidos). Por esta razón, es importante que el estudiante entienda cuando una medición realizada es correcta o presenta errores. La experiencia de muchos científicos y técnicos ha demostrado que todo proceso de medición esta acompañado en cierto grado de duda en cuanto a la validez de sus resultados, y si bien los instrumentos de medición y las técnicas para utilizarlos se han desarrollado, todo operador o profesional que realiza mediciones y/o trabaja con ellas debe tener siempre necesidad de verificar su confiabilidad. Para la realización de esta práctica se debe tener conocimientos previos en: La balanza: tipos, partes de una balanza, teoría de operación, carga y precisión, sensibilidad y técnica de pesado. Material volumétrico: manejo y uso, limpieza, calibración, límite de error, apreciación, lectura de escala, menisco. Conceptos básicos: errores determinados e indeterminados, precisión y exactitud, tratamiento estadístico de los datos, desviación normal y estándar, cifras significativas, propagación de errores, densidad, tabla de densidad del agua en función de la temperatura B. OBJETIVOS 1. Conocer y demostrar las principales fuentes de error cuando se realiza una medida. 2. Aplicar los conceptos de precisión, exactitud, error relativo, a un conjunto de mediciones 6 3. Medir y transferir volúmenes aproximados y exactos, calculando los errores de la medida. 4. Adquirir destreza en el uso de instrumentos y técnicas básicas en el laboratorio. 5. Calibrar y emplear diferentes instrumentos en la medición de masa y volumen. 6. Reconocer la incertidumbre de medidas y usar cifras significativas C. PROCEDIMIENTO EXPERIMENTAL Esta sección consta de tres partes: La primera consiste en el uso de la balanza, la segunda parte en la calibración del material volumétrico y la tercera en la determinación de la densidad de una muestra salina PARTE I. USO DE LA BALANZA 1. Verificar sus partes. 2. Demostración por parte del profesor de cómo se debe realizar una pesada de una muestra. 3. Pesar tres veces un material volumétrico siguiendo la técnica adecuada, indicando tipo de objeto a pesar, su uso y el peso obtenido, expresándolo con el número ce cifras significativas adecuadas. PARTE II. CALIBRACIÓN DEL MATERIAL VOLUMETRICO “PREPARAR ADEACUADAMENTE EL MATERIAL DE VIDRIO CON EL QUE SE VA A TRABAJAR, LAVANDOLOS CUIDADOSAMENTE SIN DEJAR RASTROS DE GRASAS O GOTAS ADHERIDAS A LAS PAREDES DE LOS MISMOS.” II.A CALIBRACIÓN DE CILINDRO GRADUADO 4. Tomar un cilindro graduado y determine su apreciación. 5. Llenar con agua el cilindro hasta el enrase total. Medir la temperatura del agua. 6. Tomar un vaso de precipitado, limpio y seco, de capacidad 100 mL, pesar el vaso precipitado vacío y verter en éste el volumen de agua que fue medido con el cilindro. 7. Pesarlo de nuevo al vaso precipitado con el contenido de agua. 7 8. Anotar todos los pesos con sus respectivos errores (apreciación de la balanza). Igualmente anotar todos los volúmenes con sus respectivos errores (apreciación del cilindro). 9. Repetir el procedimiento dos veces más desde el punto 5 hasta 8. II.B CALIBRACIÓN DE UNA PIPETA VOLUMÉTRICA 10. Tomar una pipeta volumétrica y determine su apreciación. 11. Llenar con agua la pipeta volumétrica hasta el enrase. 12. Tomar un vaso de precipitado, limpio y seco, de capacidad 100 mL, pesar el vaso precipitado vacío y verter en éste el volumen de agua que fue medido con la pipeta volumétrica. 13. Pesarlo de nuevo al vaso precipitado con el contenido de agua. 14. Anotar todos los pesos con sus respectivos errores (apreciación de la balanza). Igualmente anotar todos los volúmenes con sus respectivos errores (apreciación de la pipeta). 15. Repetir el procedimiento dos veces más desde el punto 11 hasta 14. II.C CALIBRACIÓN DE LA PIPETA GRADUADA 16. Tomar una pipeta graduada y determine su apreciación. 17. Llenar con agua la pipeta graduada hasta el enrase. 18. Tomar un vaso de precipitado, limpio y seco, de capacidad 100 mL, pesar el vaso precipitado vacío y verter en éste el volumen de agua que fue medido con la pipeta graduada. 19. Pesarlo de nuevo al vaso precipitado con el contenido de agua. 20. Anotar todos los pesos con sus respectivos errores (apreciación de la balanza). Igualmente anotar todos los volúmenes con sus respectivos errores (apreciación de la pipeta). 21. Repetir el procedimiento dos veces más desde el punto 17 hasta 20. II. D CALIBRACIÓN DE UNA FIOLA 22. Tomar una fiola de 125 mL y determine su apreciación. 23. Llenar con agua la fiola hasta el enrase. 24. Tomar un vaso de precipitado, limpio y seco, de capacidad 100 mL, pesar el vaso precipitado vacío y verter en éste el volumen de agua que fue medido con la fiola. 8 25. Pesarlo de nuevo al vaso precipitado con el contenido de agua. 26. Anotar todos los pesos con sus respectivos errores (apreciación de la balanza). Igualmente anotar todos los volúmenes con sus respectivos errores (apreciación de la pipeta). 27. Repetir el procedimiento dos veces más desde el punto 23 hasta 26. PARTE III. DETERMINACIÓN DE LA DENSIDAD DE UNA SOLUCIÓN SALINA. 28. Tomar 10 mL de la solución problema. Indicar el instrumento que utilizara para la realización de esta actividad y diga porque lo usa. 29. Pesar el líquido igual que en los experimentos anteriores. 30. Determinar la densidad de la solución. Expresar el resultado de la forma correcta (incluyendo los errores). 31. Tomar nota de los valores de densidad de sus compañeros y realizar el tratamiento estadístico con ellos, tabulando los datos y resultados 32. Comparar su resultado con el promedio obtenido y con el valor verdadero que le dará el profesor. D. TABLA DE DATOS EXPERIMENTALES PARTE I. USO DE LA BALANZA Masa muestra ( M + 0.0001) G Muestra 1 Muestra 2 Muestra 3 PARTE II: CALIBRACIÓN DE MATERIAL VOLUMETRICO Material Volumétrico Cilindro Graduado Pipeta volumétrica Pipeta Graduada Fiola 125 ml Capacidad Apreciación 9 Material Volumétrico Masa de Vaso Masa de Vaso precipitado precipitado (Vacío) (Lleno) Masa de agua Volumen real o calculado Cilindro Graduado Pipeta volumétrica Pipeta Graduada Fiola 125 ml PARTE III. DETERMINACIÓN DE LA DENSIDAD SOLUCIÓN SALINA DENSIDAD ( d + ) g/ mL Solución salina E. CALCULOS Y RESULTADOS Para los experimentos de la parte II del procedimiento experimental realizar lo siguiente: 1. Presentar los datos tabulados utilizando el número de cifras significativas correcto. 2. Determinar el volumen real o calculado del agua, para cada uno de los instrumentos empleados, considerando la temperatura y de la densidad del agua a esa temperatura. 3. Realizar los cálculos de errores correspondientes. 4. Calcular el factor de corrección del instrumento utilizado usando la siguiente ecuación: donde: fc= Factor de corrección ( adim) Vr= Volumen real o calculado (mL) Vl= Volumen leído (mL) = Densidad (g/mL) m= Masa total de agua (g) fc Vr Vl m Vr 10 F. CUESTIONARIO 1. ¿Cuál es la diferencia entre exactitud y precisión? 2. ¿Cuáles son las principales causas de variación en las mediciones de volúmenes realizadas con pipeta volumétrica, pipeta graduada, cilindro graduado y bureta? 3. ¿Cuáles son las principales causas error al comparar diferentes mediciones de una misma propiedad? 4. Cuales son los tipos de balanza y sus características. 5. Mencione algunos de los tipos de instrumentos de medida de sólidos y líquidos que se utilizan en el laboratorio. 6. Con que es más conveniente medir 22ml de agua destilada, con un cilindro graduado de 25ml o con uno de 50ml. ¿Por qué? 7. Cómo se determina la apreciación de un instrumento. 8. ¿Cuál es la utilidad de los conceptos manejados en la práctica para el ejercicio de la profesión de ingeniero? 11 PRACTICA 2 PURIFICACIÓN DE SUSTANCIAS A. INTRODUCCIÓN En la purificación de una sustancia sólida se puede utilizar la técnica de cristalización y para identificar a ese sólido se puede hacer determinando su punto de fusión como propiedad física. La cristalización es uno de los métodos más adecuado para la purificación de sustancias sólidas. En general la cristalización se basa en el hecho de que la mayoría de los sólidos son más solubles en un solvente caliente que en frío. Si con una cristalización sencilla no se consigue la sustancia pura, el proceso se puede repetir (recristalización) empleando el mismo u otro solvente. El punto de fusión es una constante física de gran importancia porque además de identificar al sólido constituye un valioso criterio de pureza. Este se define como la temperatura donde se cambia de estado sólido a estado líquido (se funde). Para la realización de esta práctica se debe tener conocimientos previos en: En qué consiste y en qué propiedad se basa el proceso de cristalización. Saber detalladamente cada uno de los pasos que constituyen el proceso de cristalización (Elección del solvente, preparación de la solución, filtración al vació, filtración de la solución en caliente, enfriamiento, separación de cristales, lavado y secado de cristales). Solución saturada. Punto de Fusión. Punto de Fusión Normal. Punto de fusión mixto. Instrumentos para medición de puntos de fusión. Funcionamiento detallado. B. OBJETIVOS Aplicar las técnicas correctas en el proceso de purificación de sustancias por cristalización. Diferenciar entre una filtración rápida y una al vacío. Determinar el porcentaje de pureza de la muestra impura. Estudiar y determinar la temperatura o punto de fusión de diversas sustancias, incluyendo una muestra desconocida y un compuesto previamente purificado mediante cristalización. 12 C. PARTE EXPERIMENTAL Esta sección consta de dos partes: La primera consiste en la cristalización de una sustancia impura y la segunda parte determinación del punto de función de sustancia PARTE I. CRISTALIZACIÓN DE UNA SUSTANCIA IMPURA. “PREPARAR ADEACUADAMENTE EL MATERIAL DE VIDRIO CON EL QUE SE VA A TRABAJAR, LAVANDOLOS CUIDADOSAMENTE SIN DEJAR RASTROS DE GRASAS O GOTAS ADHERIDAS A LAS PAREDES DE LOS MISMOS.” I.A SELECCIÓN DEL SOLVENTE: Tome 4 porciones pequeñas (la punta de la espátula) de la sustancia a cristalizar, que esta en la parte superior de su mesón de trabajo, pulverícela y añádala en igual número de tubos de ensayo. Ensaye con mucho cuidado la solubilidad de los solventes asignados de la siguiente forma: IMPORTANTE: REALICE ESTAS PRUEBAS EN LA CAMPANA, Y TOME EN CUENTA ANTES LOS PUNTOS DE EBULLICIÓN DE ESTOS SOLVENTES 1. Añadir el solvente poco a poco, con agitación continua. Cuando haya añadido alrededor de 1 mL., si es necesario agite con una varilla de vidrio, si es necesario. Si el solvente frío ha disuelto todo sólido, no es adecuado para la cristalización. ¿Por que? Y anotar sus resultados. 2. Si no se ha disuelto todo el sólido, caliente suavemente la mezcla hasta que el solvente comienza su punto de ebullición, agitándolo. (No acerque la boca del tubo a la llama, pues los solventes orgánicos son inflamables); si se ha disuelto todo el sólido considérelo fácilmente soluble en caliente. 13 3. Si no se ha disuelto, añada más solvente en porciones de 0,5 mL, calentando después de cada adición; si el sólido se ha disuelto en menos de tres milílitros del solvente caliente, puede considerarlo moderadamente soluble. I.B CRISTALIZACIÓN 4. Tomar un beacker de 100 mL, limpio y seco, proceder a pesarlo vacío. Anotar su valor en la tabla de datos. Después en el mismo beacker pesar entre 3 y 5 gramos de muestra impura. Anotar el valor, por diferencia de pesada usted sabrá cual es la cantidad exacta de muestra impura que se peso. 5. Pesar los papeles de filtro que le va a suministrar su profesor. Anotar el peso de cada uno e identificarlo. 6. Preparar el equipo de filtrado rápido que constará de: Fiola de 250 mL donde se recogerá el filtrado, un embudo de vidrio sin tallo y el papel de filtro plegado. (Ver Figura Figura Nº1. Filtración rápida Nº1) 7. La forma de plegar el papel de filtro se muestra en la figura Nº3. 8. Disolver el sólido que se encuentra en el beacker, añadiendo 30 mL de solvente escogido por usted y caliente lentamente hasta ebullición mientras agita con la varilla de vidrio. 9. Dejar ebullir la solución que preparo usted de sustancia impura con el solvente elegido, durante un cierto tiempo, al disolverse por completo, filtre de inmediato en el equipo de filtrado rápido. 10. Tapar la Fiola con un vidrio de reloj y deje enfriar el líquido. Observe cuando se forman los cristales. En caso de que no ocurra la cristalización, raspe las paredes del recipiente o siembre un poco de la sustancia pura. 11. Preparar el equipo de filtrado al vacío (Ver Figura Nº2), el cual constará de: Un Kitasato, en el cual Figura Nº2: Filtración al vacío 14 recogerá el filtrado. Un embudo Buchner provisto de papel filtrado humedecido.(Sin plegar), previamente pesado. 12. Cuando el líquido con los cristales esté completamente frío, transfiéralo al embudo Buchner guiándose con la varilla de vidrio abra la llave de agua para provocar el vacío y filtre. 13. Lavar el resto de los cristales que quedan en la fiola con pequeñas porciones de solvente puro y filtrarlos también. 14. Continuar aplicando la filtración por algunos minutos, para eliminar la mayor cantidad posible de solvente. 15. Guardar los dos papeles de filtros con los cristales y las impurezas, doblándolo cuidadosamente para no perder nada del sólido filtrado y guárdelo en un sobre preparado por usted en el sitio que le indique el profesor. 16. En la próxima sesión de laboratorio, pese el papel de filtrado con su contenido y determine el peso de los cristales puros y el peso de las impurezas. Figura Nº 3. Plegado del papel de filtro. 15 PARTE II. DETERMINACIÓN DEL PUNTO DE FUSIÓN 16. Se monta el aparato para la determinación de puntos de fusión (THIELE) como se muestra en la figura Nº 4. Figura Nº4: Montaje del tubo THIELE 17. En el tapón hay un corte longitudinal, para que toda la columna termométrica quede visible y se añade después el líquido del calentamiento hasta el nivel justamente por encima del brazo lateral. 18. Se toman pequeñas muestras de los compuestos a utilizar (compuesto conocido, compuesto cristalizado previamente). Si fuese necesario, se pulveriza en un mortero o sobre un papel de filtro con una espátula. 16 19. Se introduce después una pequeña cantidad de la primera muestra en el tubo capilar de puntos de fusión, que unirá al termómetro mediante un pequeño anillo de goma, de tal forma que la porción del tubo que contiene la sustancia quede a la altura del bulbo térmico (los dos deben tener una longitud aproximadamente igual). El anillo de goma debe quedar por encima de la superpie del líquido. 20. La calefacción se efectúa mediante las mismas consideraciones mencionadas anteriormente, y se observa y anota el intervalo del punto de fusión, desde el momento en que la muestra reblandece y se separa de las paredes del capilar hasta que se transforma en un líquido transparente. Anotar la temperatura en la tabla de datos. 21. A continuación se determinan y anotan los intervalos de fusión de la otra muestra (compuesto cristalizado), operando de la misma forma. 22. Enseguida se toma el compuesto desconocido y se determina su punto de fusión utilizando el procedimiento anterior. D. TABLA DE DATOS EXPERIMENTALES PARTE I. CRISTALIZACIÓN Valores Solvente seleccionado Masa de sustancia impura ( 0.001 g) Peso del papel de filtro I Peso del papel del filtro II Masa de cristales seco (+ 0.001 g) Porcentaje de pureza Punto de fusión de la sustancia cristalizada Punto de fusión de la sustancia desconocida 17 E. CÁLCULOS Y RESULTADOS 1. Describa el producto obtenido, compárelo con el material de partida y calcule el % de pureza. 2. Con los resultados obtenidos en las determinaciones de los puntos de fusión de la muestra conocida y cristalizada, compare estos con los valores reportados en la literatura. 3. Con el resultados obtenidos en las determinaciones de los puntos de la muestra desconocida, se decidirá, si es posible, cuál es esta la sustancia problema. Para ello compare sus resultados experimentales con valores de puntos de fusión reportados en la literatura. 4. En los resultados debe indicar el punto de fusión determinado por usted, el punto de fusión correspondiente encontrado en la literatura, la identidad de cada compuesto, así como otras propiedades físicas que pueda observar. F. CUESTIONARIO 1. ¿Cuáles son las características que debe cumplir un buen solvente para el proceso de cristalización? 2. Si usted tiene un compuesto cristalizable en agua, el cual esta impurificado con sustancias muy insolubles en agua, sustancias coloreadas solubles en agua y sustancias muy solubles en el mismo solvente: ¿Podría purificarlo por cristalización?, ¿Cómo lo haría? 3. Mencione dos métodos para provocar la cristalización, y explique en que consisten. 4. De acuerdo a la tabla siguiente diga si usted podría recristalizar los solutos A, B y C. JUSTIFIQUE SU RESPUESTA SOLVENTE AGUA BENCENO SOLUTO FRIO CALIENTE FRIO CALIENTE A i s i s B i i i s C i s i i 18 i = insoluble, s = soluble 5. ¿Que ventajas tiene el agua como solvente para cristalización? 6. Cuando se filtra un sólido por succión, ¿Por qué se debe interrumpir la succión antes de cerrar la trompa de agua? 7. En el proceso de cristalización ¿Qué es aconsejable, enfriar la solución rápida o más bien lentamente? Explique su respuesta. 8. Señale las ventajas y desventajas de realizar una recristalización. 19 PRACTICA 3 DESTILACIÓN SIMPLE A. INTRODUCCIÓN La destilación es un método que consiste en la separación de los componentes de una mezcla basándose en las diferencias en los puntos de ebullición de dichos componentes. Cabe mencionar que un compuesto de punto de ebullición bajo se considera "volátil" en relación con los otros componentes de puntos de ebullición mayor. Los compuestos con una presión de vapor baja tendrán puntos de ebullición altos y los que tengan una presión de vapor alta tendrán puntos de ebullición bajos. La destilación es el método más frecuentemente utilizado para la purificación de líquidos o aislamiento de los mismos de una mezcla de reacción. Para mayor entendimiento de este proceso el alumno debe tener los siguientes conocimientos. Destilación Temperatura o punto de ebullición Volatilidad Presión de Vapor Liquido Sobrecalentado Condensación Evaporación B. OBJETIVO DE LA PRÁCTICA Determinar experimentalmente la temperatura o punto de ebullición de una sustancia. Desarrollar las técnicas de destilación como proceso de separación y purificación. C. PARTE EXPERIMENTAL Esta sección consta de dos partes, la primera parte consiste en el montaje del aparato de destilación, la segunda parte es la separación del alcohol de una muestra de ron. 20 PARTE I. MONTAJE DEL APARATO DE DESTILACIÓN “PREPARAR ADEACUADAMENTE EL MATERIAL DE VIDRIO CON EL QUE SE VA A TRABAJAR, LAVANDOLOS CUIDADOSAMENTE SIN DEJAR RASTROS DE GRASAS O GOTAS ADHERIDAS A LAS PAREDES DE LOS MISMOS.” Para el montaje del aparato de destilación se deben tomar en cuenta los siguientes aspectos: (ver figura Nº 1) 1. El balón de destilación sujételo con una pieza a un soporte universal, (la pinza debe estar colocada por encima del brazo del balón). Este debe descansar sobre un brazo metálico o trípode en el cual debe colocarse una rejilla metálica con centro de amianto para prevenir que las llamas golpeen directamente al balón. 2. El tope del mechero no debe estar por debajo mas de 4 cm. por debajo de la rejilla. 3. Tome el refrigerante, con una pinza sujételo con la parte media al soporte Figura Nº1: Aparato de destilación universal, conéctelo al balón e introduzca una de las mangueras de goma en la llave de agua de manera que circule el agua en la forma correcta. Coloque al final del refrigerante el recipiente colector. 4. Introduzca el termómetro, en el tapón horadado que se suministra. 21 5. El tapón horadado con el termómetro colóquelo en la boca del balón por la parte superior, debe estar bien ajustado para prevenir la perdida de vapores. Vigile que el bulbo del termómetro, esté a nivel del brazo por donde salen los vapores del balón al condensador. 6. Una vez montado todo el aparato, llame al instructor para verificar que el montaje este bien. Revise todas las conexiones para asegurar que estén bien ajustadas. PARTE II. SEPARACION DE UN ALCOHOL DE UNA MUESTRA DE RON 7. Tomar el embudo colóquelo en la boca superior del balón, agregar 150 mL de RON , tenga cuidado con el nivel del líquido no debe sobre pasar la mitad del volumen del balón. 8. Añadir unas cuantas perlas de vidrio, para asegurar le ebullición controlada. 9. Calentar el balón con llama baja de forma que el destilado se recoja de una manera continúa. 10. Cuando aparezca la primera gota de destilado colocar un cilindro graduado. Anotar la temperatura en la tabla de datos. 11. Debe mantener este recipiente hasta que la temperatura sea de 80ºC. Medir el volumen y anotarlo en la tabla de datos. 12. Cuando llegue a 80ºC , cambiar el cilindro graduado por otro, y recoger el condensado hasta que la temperatura sea de 85ºC. Medir el volumen y anotarlo en la tabla de datos. 13. Una vez que alcance los 85ºC cambiar el recipiente por otro y recoger el condensado hasta los 90ºC. Medir el volumen y anotarlo en la tabla de datos. 14. Cuando la temperatura alcance 90 ºC, interrumpa la destilación y enfrié el balón de destilación, dejando que gotee en este, el condensado del cuello. 15. Medir el volumen de líquido que queda en el balón, una vez que este frió, anotarlo en la tabla de datos. D. TABLA DE DATOS EXPERIMENTALES Actividad Fracción I) X-80 ºC Muestra de Ron II) 80-85 ºC III) 85-90 ºC Residuo Volumen 22 E. CÁLCULOS Y RESULTADOS 1. Grafique una curva de destilación, la temperatura de destilación (eje vertical) contra el volumen (eje horizontal). 2. Determine al partir del grafico la temperatura de ebullición. 3. ¿Cuál es la temperatura de ebullición del alcohol? 4. ¿De que esta formada principalmente la fracción I? 5. Las fracciones I y II son soluciones de alcohol. ¿Cuál de ellas será más rica en alcohol? F. CUESTIONARIO 1. Explique el empleo de materiales porosos para evitar el sobrecalentamiento y proyecciones violentas de líquidos. 2. Explique si la lectura de la temperatura de ebullición será errónea por exceso o por defecto cuando el bulbo del termómetro no este mojado por los vapores condensados. 3.¿Por qué no debe llenarse el balón de destilación por encima de la mitad de su capacidad? 23 PRACTICA 4 REACCIONES QUIMICAS Y SU CLASIFICACIÓN A. INTRODUCCIÓN Reacción química, proceso en el que una o más sustancias (reactivos) se transforman en otras sustancias diferentes (productos) de la reacción. Un ejemplo de reacción química es la formación de dos (2) óxido de hierro producida al reaccionar el oxígeno del aire con el hierro. La estequiometría se ocupa de estudiar las relaciones o proporciones, en masa o peso, en que se encuentran los diferentes elementos en las fórmulas y reacciones químicas. La fórmula empírica es la proporción más simple existente entre los elementos que forman un compuesto. Por otra parte, la fórmula molecular es la proporción exacta que hay entre los elementos que integran un compuesto. No siempre la fórmula empírica y molecular de un compuesto son iguales. Para la realización de esta práctica el alumno debe tener conocimientos previos en: Mol. Peso atómico y Peso Molecular. Cálculo de Fórmula Empírica y Fórmula Molecular Estequiometría. Reacción química y Ecuaciones quimicas. Tipo de reacciones químicas Balanceo de reacciones químicas. B. OBJETIVO DE LA PRÁCTICA Determinar experimentalmente la fórmula empírica de una sal formada por potasio, cloro y oxígeno. Explicar cualitativamente los cambios que se producen en una reacción química como calor, color, desprendimiento de gases, formación de precipitados. Desarrollar y balancear la reacción química principal de cada proceso. 24 C. PROCEDIMIENTO EXPERIMENTAL Esta sección consta de dos partes: En la primera parte se comprobará la formula empírica de una sal de potasio y en la segunda se observarán los diferentes cambios que se producen en una reacción química. PARTE I. COMPROBACIÓN DE LA FÓRMULA EMPÍRICA DE UNA SAL DE POTASIO “PREPARAR ADEACUADAMENTE EL MATERIAL DE VIDRIO CON EL QUE SE VA A TRABAJAR, LAVANDOLOS CUIDADOSAMENTE SIN DEJAR RASTROS DE GRASAS O GOTAS ADHERIDAS A LAS PAREDES DE LOS MISMOS.” 1. Tomar dos tubos de ensayos pirex limpio y seco, pesarlo vacio e identifiquelos. 2. Añadir a cada uno de los tubos una pizca de dióxido de manganeso (MnO 2) y pesar su masa total en la balanza. Anotar su resultado en la tabla de datos. 3. Añadir luego, a cada tubo de ensayo, aproximadamente entre 0.25 y 0.5 gramos de la sal de potasio seca y pesar todo nuevamente. Anotar su resultado en la tabla de datos. 4. Asegurarse de que estén bien mezclados los compuestos en los tubos de ensayo. 5. Colocar una pinza de madera en la parte superior de uno de los tubos de ensayo. 6. Calentar el tubo de ensayo en posición vertical y con llama suave; tenga cuidado de no calentar la pinza. Note que la muestra funde y comienza a descomponer como lo pone de manifiesto la formación de burbujas de gas en el seno del líquido. Cuando el burbujeo deje de ser violento, caliente con llama fuerte por varios minutos para asegurar la total descomposición de la muestra. Caliente cualquier porción de material depositado en la parte superior del tubo. 7. Colocar el tubo en una rejilla metálica, hasta que este se enfríe. 8. Una vez que el tubo este frío, péselo de nuevo. Anotar su resultado en la tabla de datos. 9. Repetir todo el procedimiento desde el punto 5 hasta 8 para el otro tubo de ensayo. 25 10. Escribir y balancear la reacción química del proceso. PARTE II. TIPOS DE REACCIONES QUIMICAS II.A CAMBIO DE COLOR 11. Pesar aproximadamente 0.1 g de ácido oxálico. 12. En un tubo de ensayo, limpio y seco, añadir aproximadamente 2,0 ml de Permanganato de potasio acidificado con ácido sulfúrico (KMnO4+H2SO4). 13. Calentar el permanganato hasta que comienza su ebullición, utilizando un mechero o baño de maría. 14. Agregar la cantidad de ácido oxálico que pesó en el tubo de ensayo, con mucha precaución. 15. Observar el cambio que se produce y anotar sus resultados. II.B DESPRENDIMIENTO DE GAS 16. Tomar tres tubos de ensayo, limpio y seco, a cada uno agregar aproximadamente 2 ml de ácido clorhídrico (HCl) de concentración 0.1 N, 0.5 N y 1 N. 17. Pesar aproximadamente 0.1 g de Magnesio (Mg) y agregárselo a cada tubo de ensayo que contiene las distintas concentraciones de ácido clorhídrico. 18. Anotar sus observaciones. Escribir la reacción química y balancearla por el metodo de ión electrón. II.C REACCIÓN DE METALES CON HCl 19. En cuatro tubos de ensayos, limpios y secos, agregar aproximadamente el mismo peso de los siguientes metales: Zn, Pb, Mg y Fe. 20. Añadir a cada uno de los tubos de ensayo 3 mL de HCl cuya concentración el profesor le especificará. 21. Calentar suavemente aquellas soluciones en donde la reacción sea muy lenta a temperatura ambiente. 22. Anotar sus observaciones. Escribir la reacción química y balancearla. 26 D. TABLA DE DATOS EXPERIMENTALES PARTE I. FÓRMULA EMPÍRICA DEL CLORATO DE POTASIO Masa (±0,0001) 1ra deter 2da deter Masa del tubo de ensayo+catalizador Masa del tubo de ensayo+catalizador+clorato de potasio Masa del tubo de ensayo+catalizador+residuo Masa del clorato de potasio Masa del residuo (cloruro de potasio) Masa del oxígeno desprendido PARTE II. TIPO DE REACCIONES QUIMICAS ACTIVIDAD OBSERVACIONES Cambio de Color Desprendimiento de gas Reacción de metal con HCl Formación de precipitados E. CÁLCULOS Y RESULTADOS 1. Calcule lo siguiente para cada determinación de la primera parte. Suponga que Usted no conoce la fórmula del clorato de potasio pero si conoce la del cloruro de potasio: i) Número de moles de oxígeno desprendido. ii) Número de moles de cloruro de potasio. iii) Número de moles de potasio en la muestra inicial. iv) Número de moles de cloro en la muestra inicial. v) Número de moles de oxígeno en la muestra inicial. vi) Fórmula empírica del cloruro de potasio. 2. Calcule el porcentaje de clorato de potasio en la mezcla problema. Utilice para ello la fórmula que usted conoce del clorato de potasio. 27 3. Escribir la reacción química de cada una de las actividades de la parte II del procedimiento experimental y balancearla. F. CUESTIONARIO 1. El óxido de bario, BaO, incorpora más oxígeno cuando se calienta en condiciones adecuadas. Si 1,15 g de óxido pasan a 1,27 g del nuevo producto. ¿Cuál será la fórmula de este nuevo producto? 2. Al calentar nitrato sódico, NaNO3, desprende oxígeno y pasa a nitrito sódico, NaNO2. Una mezcla de NaNO3 y NaNO2 de masa 0,754 g pierde 0,064 g de O2 cuando se calienta. Calcule el porcentaje de NaNO3 en la mezcla inicial. 3. Un error bastante frecuente en este experimento consiste en no realizar la total descomposición del clorato de potasio. Suponga que se produce este fallo en la parte (a), ¿cómo resultará afectada la primera fase de la experiencia?, ¿qué resultados se obtendrían: una fórmula de clorato de potasio con mayor o menor proporción de oxígeno? 28 PRACTICA 5 SÍNTESIS DE SULFATO DE BARIO A. INTRODUCCIÓN Una reacción en la cual se conocen tanto los reactivos como los productos se puede representar mediante una ecuación química. Para que la información que brinda la ecuación química sea completa, esta deberá estar balanceada, es decir, el número de átomos de un mismo elemento debe ser igual en ambo lados de la ecuación. Una reacción química no esta completa sino esta balanceada. Cuando se colocan cantidades de reactivos que no están en la proporción exacta que la ecuación química indica, es decir, que uno de los reactivos se encuentra en exceso, la reacción procederá de manera que el reactivo que no estaba en exceso se consuma todo. Al suceder esto, sólo se consumirá la parte proporcional del reactivo en exceso, quedando el resto de este reactivo sin reaccionar. El reactivo que se consume todo recibe el nombre de reactivo limitante, ya que será el que establecerá el límite de la cantidad del reactivo en exceso que se consumirá. El reactivo limitante también determinará el máximo de la cantidad de los productos que se podría obtener, es decir, el rendimiento teórico. En esta práctica se va a preparar sulfato de bario mezclando soluciones acuosas de cloruro de bario y sulfato de aluminio: BaCl2 (ac) + Al2(SO4)3 (ac) BaSO4 (s) + AlCl3(ac) En un caso se hará con las cantidades exactas de los reactivos y en otro teniendo uno de los reactivos en exceso. Para ambas reacciones se obtendrá una cantidad de sulfato de bario que permitirá ilustrar el concepto de reactivo limitante. Para realizar la práctica se debe tener los siguientes conocimientos: Reacciones químicas. Reacciones de precipitación. Balanceo de ecuaciones químicas. Solubilidad. 29 Estequiometría. Cálculos estequiométricos. Reactivo limitante. Reactivo en exceso. Rendimiento teórico. Rendimiento experimental o práctico. Porcentaje de rendimiento. B. OBJETIVO Sintetizar sulfato de bario mediante una reacción de precipitación a partir de cloruro de bario y sulfato de aluminio. Determinar experimentalmente el reactivo en exceso y el porcentaje de rendimiento en el proceso de síntesis del sulfato de bario. C. PROCEDIMIENTO EXPERIMENTAL “PREPARAR ADEACUADAMENTE EL MATERIAL DE VIDRIO CON EL QUE SE VA A TRABAJAR, LAVANDOLOS CUIDADOSAMENTE SIN DEJAR RASTROS DE GRASAS O GOTAS ADHERIDAS A LAS PAREDES DE LOS MISMOS.” 1. Tomar un vaso de precipitado, limpio y seco, identificarlo y pesarlo. 2. Añadir sulfato de aluminio anhidro al mismo hasta que obtenga un peso de 0,5 – 1,0 g de dicha sustancia. Anotar este peso con su error asociado. 3. Calcular los moles de sulfato aluminio anhidro que hay en la cantidad que usted pesó. Calcule los moles de cloruro de bario que reaccionan exactamente según la estequiometría de la reacción con los moles de sulfato de aluminio pesado. Calcule el peso de ese número de moles cloruro de bario. Verifique la pureza del reactivo de acuerdo a la etiqueta del frasco que lo contiene, verifique que se trata de una sal deshidratada, de no ser así tome en cuenta el agua de hidratación y la pureza reportada por el fabricante. 4. Tomar otro vaso de precipitado limpio y seco, identifíquelo y pesarlo. 5. Añadir cloruro de bario hasta que obtenga la masa deseada (obtenida por estequiometría). Anotar el peso con su error asociado. 30 6. Añadir 6 mL de agua destilada a cada beacker y proceda a calentar en baño de vapor (baño de María) la solución de sulfato de aluminio, coloque en el baño también la solución de cloruro de bario hasta que se calienten ambas y luego apártelas. 7. Añadir la solución de sulfato de aluminio a la de cloruro de bario, lavar el vaso de precipitado de sulfato de aluminio con 3 mL de agua destilada (para asegurarse de trasvasar todo el reactivo) y añádalos a la mezcla de reacción. 8. Mientras la mezcla con el precipitado se digiere, realizar nuevamente el procedimiento desde el punto 1 hasta 2. 9. Tomar otro beacker limpio y seco, identificarlo y pesar la mitad de cloruro de bario que pesó anteriormente; anote el peso exacto y su error. 10. Realizar el paso número 6. 11. Tomar un papel de filtro, márquelo y péselo, haga lo mismo con otro papel de filtro. 12. Preparar dos embudos de filtración, colocando en un embudo el papel de filtro. 13. Filtrar la mezcla de cada uno de los beacker en los embudos con el papel de filtro. Tenga cuidado de que el líquido al filtrar nunca llegue al borde del papel sino que quede aproximadamente medio centímetro por debajo del borde. 14. Coloque los papeles de filtro con su contenido en un vidrio de reloj limpio y rotulado con su nombre y sección. Tenga cuidado de no tocar el precipitado ni derramarlo al cambiarlo del embudo de vidrio al vidrio de reloj. Deje secando hasta que el profesor le indique. Pese cada uno de los productos en sus respectivos papeles de filtro y anote el peso. D. TABLA DATOS EXPERIMENTALES DATOS Peso del Sulfato de Aluminio Peso del Cloruro de Bario Peso del papel de filtro Peso del papel de filtro+precipitado EXPERIMENTO I EXPERIMENTO II 31 E. CÁLCULOS Y RESULTADOS E.A CÁLCULOS PREVIOS Después de la tabla de datos experimentales y antes de las observaciones se deben colocar los cálculos relativos a los moles de sulfato de aluminio usados, así como también los moles y masa de cloruro de bario necesario en la reacción E.B PARA CADA UNO DE LOS EXPERIMENTOS 1. Calcular: a) Rendimiento Teórico de sulfato de bario, b) Rendimiento experimental o practico del sulfato de bario en base a los datos de su pesada, c) Porcentaje de rendimiento del sulfato de bario. 2. Especifique en una tabla el número de moles de cada reactivo usado, así como el resultado para cada uno de los cálculos realizados en cada experimento. F. CUESTIONARIO 1. Un estudiante necesita 0,025 moles de sulfato cúprico pentahidratado para ser usado en una reacción. ¿Qué cantidad de esta sal en gramos debe pesar el estudiante? 2. Para la reacción: 2AgNO3 + K2CrO4 Ag2CrO4 + KNO3 a) Cuántos gramos de cromato de potasio se necesitan, de acuerdo a la estequiometría, para la reacción de 8,49 g de nitrato de plata. b) ¿Cuál será el porcentaje de rendimiento de la reacción si el rendimiento experimental de cromato de plata es de 7,50 g? c) Cómo afectan los siguientes errores experimentales al porcentaje de rendimiento: i) El producto final fue pesado húmedo, j) No se tomó en cuenta la pureza de los reactivos. 32 d) ¿Qué significa digerir un precipitado?. ¿Es necesario digerir el sulfato de estroncio que precipita en la síntesis? ¿Cuándo se requiere del proceso de digestión? Explique. 33 PRACTICA 6 DETERMINACIÓN DEL CONTENIDO DE VITAMINA C EN UNA PASTILLA (TITULACIÓN ÁCIDO-BASE) A. INTRODUCCIÓN Las vitaminas y otros productos farmacéuticos a menudos es presentan en forma de pastillas, la cuales están compuestas por la mezcla de un material inerte o no reactivo, llamado relleno, con el ingrediente activo. El relleno proporciona dureza a la pastilla y diluye al ingrediente activo. Se pueden añadir también sustancias para dar sabor u otras propiedades deseables. La compañía que manufactura tal producto está obligada por la ley a mencionar en la etiqueta el peso o porcentaje del ingrediente activo, y debe mantener controles durante el proceso de manufactura para asegurar que la desviación de la masa del producto en cada tableta con respecto al valor reportado en la etiqueta sea pequeña. En este experimento usted va a determinar la masa de vitamina C en una pastilla y lo comparará con el valor en la etiqueta del frasco En otras palabras usted va a realizar una prueba típica de control de calidad sobre la pastilla. La vitamina C es un ácido orgánico, ácido ascórbico, el cual es esencial en la dieta humana. Como la vitamina C es un ácido o donador de protones, reacciona con el hidróxido de sodio, NaOH, que es una base o aceptor de protones, para producir agua y ascorbato de sodio. Usted utilizará una solución de NaOH, previamente estandarizada, para determinar la cantidad de vitamina C en la pastilla, mediante una titulación, empleando un indicador apropiado para determinar el punto final de la titulación. Para realizar la práctica se debe tener los siguientes conocimientos: Mol, Concentración. Molaridad. Normalidad. Peso molecular. Peso equivalente. Solubilidad., Ácidos y Bases. Titulación, Punto de equilibrio. Punto final, Indicador, Patrón primario. Solución estándar. Cálculos estequiométricos. 34 B. OBJETIVO Preparar una solución de concentración especificada por el profesor. Determinar la cantidad de ácido ascórbico (Vitamina C) contenido en una pastilla comercial, mediante una titulación ácido-base, empleando una solución de hidróxido de sodio. Comparar el resultado obtenido con el reportado por el fabricante. C. PROCEDIMIENTO EXPERIMENTAL Importante: Traer cuatro pastillas de vitamina C (no efervescente, sin sabor ni color artificial). Esta sección consta de dos partes: la primera consiste en la preparación de una solución de vitamina C y la segunda la determinación del contenido de vitamina C en una pastilla de uso comercial. PARTE I. PREPARACIÓN DE SOLUCION “PREPARAR ADEACUADAMENTE EL MATERIAL DE VIDRIO CON EL QUE SE VA A TRABAJAR, LAVANDOLOS CUIDADOSAMENTE SIN DEJAR RASTROS DE GRASAS O GOTAS ADHERIDAS A LAS PAREDES DE LOS MISMOS.” 1. Pedir al profesor el valor de la concentración que se necesita para preparar la solución de vitamina C. Anotar su valor en la tabla de datos. 2. Tomar un beacker (vaso precipitado) limpio y seco, pesarlo vacío y anotar su valor en la tabla de datos. 3. Pesar en el beacker la cantidad (vitamina C) que usted determinará de acuerdo al valor de concentración dado. 35 4. Agregar 50 mL de agua destilada y disgregar la pastilla con una varilla de vidrio. Lavar la varilla con agua destilada antes de retirarla de la mezcla. Agitar la muestra un poco. No se preocupe si algunas partículas no se disuelven, son el relleno; la vitamina C misma es bastante soluble. 5. Utilizando un embudo, transferir el contenido del vaso precipitado hacia un balón aforado, la capacidad del mismo el profesor se la debe especificar. Completar con agua destilada hasta la marca del aforo. 6. Limpiar y curar la bureta con dos proporciones pequeñas de agua destilada (5 mL). Vacíe la bureta completamente cada vez y luego cúrela con dos porciones y luego cúrela con dos porciones pequeñas de solución estándar de NaOH. Durante cada curada mantenga la bureta en posición horizontal, rótela, e inclínela hacia el extremo abierto de modo que toda la superficie interna de la bureta quede impregnada. A final de cada curada abra la llave y deje que todo el líquido se escape para que la punta también quede curada. Cerrar la llave. Recuerde que no puede verter los reactivos en los lavamanos. 7. Llenar la bureta con la ayuda de un embudo limpio y seco con una solución estándar de NaOH. Abrir la llave y dejar salir suficiente líquido para que se llene la punta de la bureta y para que el menisco quede en, o por debajo de 0,00 mL. Asegúrese de que no queden burbujas de aire atrapadas en la solución. Espere unos segundos para que el líquido drene de las partes superiores de la bureta. Anote el volumen inicial con dos cifras decimales. 8. Con una pipeta volumétrica tomar porciones de la solución de vitamina C que se encuentra en el balón aforado y transvasarla a una fiola de 250 mL. Añadir dos o tres gotas de indicador, solución de fenolftaleína, a la mezcla dentro de la fiola. 9. Colocar el matraz (fiola) debajo de la bureta de manera que la punta quede dentro de la boca del erlenmeyer (fiola), pero sin tocarlo. Puede ser útil el colocar un papel blanco debajo del erlenmeyer. 10. Abrir la llave de la bureta y comience a añadir lentamente la solución de NaOH. Agite constantemente moviendo el matraz suavemente en círculos. 11. A medida que uno se acerca al punto final el color de la fenolftaleína tarda en desaparecer después de la adición de la adición de la base, por lo que ésta debe añadirse gota a gota y con agitación constante a partir de este momento. Cuando una gota o menos de solución de 36 NaOH produce un color rosado pálido que persiste durante varios segundos, se ha alcanzado el punto final. Lea el volumen final de la bureta y anote el valor. 12. Repetir los pasos 8 hasta 11 dos veces mas. PARTE II. DETERMINACIÓN DE VITAMINA C 13. Pesar una pastilla de vitamina C y transfiera a una fiola de 250 mL. Anotar el número del frasco y el contenido de vitamina C reportado en la etiqueta. 14. Agregar 50 mL de agua destilada y disgregue la pastilla con una varilla de vidrio. Lavar la varilla con agua destilada antes de retirarla de la mezcla. Agitar la muestra un poco. No se preocupe si algunas partículas no se disuelven, son el relleno; la vitamina C misma es bastante soluble. 15. Realizar los pasos desde 6 hasta 11. 16. Repetir la determinación con otras dos pastillas del mismo frasco. D. TABLA DE DATOS EXPERIMENTALES PARTE I: PREPARACIÓN DE SOLUCIÓN Concentración Masa de Vitamina C vitamina C Solución de vitamina C Titulación Volumen Gastado Concentración de de NaOH NaOH 37 PARTE II. DETERMINACIÓN DE VITAMINA C Titulación Masa de Volumen Gastado de Porcentaje en masa de Vitamina C NaOH Vitamina C E. CALCULOS Y RESULTADOS 1. Resuma sus datos, incluyendo la masa de la pastilla, la concentración de NaOH estándar y los volúmenes inicial y final, para cada determinación. 2. Calcule la masa en mg y el porcentaje en masa de ácido ascórbico en las pastillas. 3. Exprese sus resultados con el número correcto de cifras significativas. 4. Compare sus resultados con los de los otros estudiantes que utilizaron pastillas del mismo frasco. Analice y discuta sus resultados. Utilice un gráfico o una tabla para representar sus datos. 5. Compare el resultado promedio de masa que obtuvo con e reportado con el fabricante en el frasco de pastillas. F. CUESTIONARIO 1. Explique cuál aparato volumétrico utilizaría usted para: a) Transferir una alícuota de 50 mL b) Medir cualquier volumen con una incertidumbre absoluta de ± 0,05 mL. 2. Una titulación que se llevó a cabo con una bureta de 25 mL requirió exactamente 18 mL de titulante. Exprese esta cantidad con el número correcto de cifras significativas 38 3. Se requirió 22,30 mL de una solución 0,1500 M de NaOH para titular una pastilla de vitamina C que pesó 0,680 g. Calcule la masa de ácido ascórbico en la tableta en miligramos. 4. ¿Por qué no hace falta ajustar el nivel del líquido en la bureta a la marca de 0,00 antes de comenzar la titulación? 5. Un estudiante se olvidó de llenar la punta de la bureta antes de comenzar la titulación ¿Cómo afectaría esto el valor experimental de la masa de vitamina C en la pastilla? Justifique su respuesta. 39 PRACTICA 7 TITULACIÓN REDOX A. INTRODUCCIÓN Las reacciones de óxido reducción (Redox) constituyen uno de los tipos más importante de las reacciones químicas tanto a nivel de fenómenos naturales, tales como la combustión de los hidrocarburos, fotosíntesis, respiración, el ciclo de nitrógeno, el contenido de azufre en la atmósfera, entre otras, y a través de muchos procesos industriales. Las reacciones redox implican transferencia de electrones entre sustancias. Las reacciones redox estudiada en esta practica involucra el uso de permanganato de potasio (KMnO4) como agente oxidante y peroxido de hidrogeno (H2O2) como agente reductor. Para la realización de la práctica se debe tener conocimiento en: Reacciones de oxidación-reducción Agente oxidante y Agente reductor. Balanceo de ecuaciones Redox en medio ácido y básico. Estequiometria Redox. Preparación de solución por dilución. Semireacciones de oxidación y reducción en la reacción entre el KMnO 4 y el H2O2. Reacción total balanceada. Precaución para el manejo de peroxido de hidrogeno y permanaganato de potasio. B. OBJETIVOS Reforzar los conceptos teóricos de las reacciones Redox. Preparación de solución por dilución. Determinar el porcentaje de peroxido de hidrogeno en una muestra problema, mediante valoración con KMnO4. C. PARTE EXPERIMENTAL En esta sección se realizará la valoración de una muestra comercial de peróxido de hidrogeno (H2O2), utilizando el permanganato de potasio (KMnO4) 40 “PREPARAR ADEACUADAMENTE EL MATERIAL DE VIDRIO CON EL QUE SE VA A TRABAJAR, LAVANDOLOS CUIDADOSAMENTE SIN DEJAR RASTROS DE GRASAS O GOTAS ADHERIDAS A LAS PAREDES DE LOS MISMOS.” 1. Pesar en un vaso precipitado de 100 mL alrededor de 6 g de la solución de peroxido de hidrogeno comercial (aproximadamente 3 % en H2O2). 2. Transfiera cuantitativamente la muestra a un balón aforado de 250 mL y dilúyala con agua destilada hasta el enrase. 3. Limpiar y secar tres fiolas de 175 mL. 4. Con una pipeta volumétrica medir 25 mL de la solución que se encuentra en el balón aforado de 250 mL, 5. Transferir este volumen a una fiola de 175 mL y diluir con agua destilada hasta alcanzar un volumen de 75 o 100 mL aproximadamente. 6. Acidifique añadiendo 5 mL de ácido sulfurico 0,3 M (H2SO4). 7. Tomar una bureta limpia y cúrela con dos porciones de aproximadamente 5 mL de KmnO 4 0.01 M, descarte estas porciones de solución. Llene su bureta (incluyendo la punta) hasta enrasar a cero. 8. Colocar la fiola con la muestra problema sobre un papel blanco debajo de la bureta con permanganato. 9. Anotar el volumen inicial de la bureta. Abrir la llave y comenzar a añadir la solución de KMnO4 mientras agita constantemente la fiola (movimiento circulares). 10. Titular hasta que se observe un color permanente. 11. Anotar el volumen final de la bureta. 12. Repetir dos veces más desde el punto 4 hasta 11. 41 D. TABLA DE DATOS Titulación Masa de H2O2 Volumen Volumen teórico Experimental KMnO4 KMnO4 Porcentaje en Porcentaje en masa teórico masa experimental E. CALCULOS Y RESULTADOS 1. A partir de los datos teóricos determinar el volumen de KMnO 4 aproximado que se consumirá en la valoración de H2O2. 2. A partir de la masa de H2O2, del volumen de KMnO4 gastado experimentalmente y de la molaridad de la solución patrón, determinar el porcentaje de peso del agua oxigenada en la muestra de solución comercial. 3. Compare le valor teórico con el obtenido por usted y explique a que se debe esta diferencia. 42 PRACTICA 8 COMPROBACIÓN DE LA CONSTANTE UNIVERSAL “R” DE LOS GASES Y DETERMINACIÓN DEL PESO EQUIVALENTE DEL MAGNESIO. A. INTRODUCCIÓN De los tres estados de la materia, es el estado gaseoso el que permite estudiar con mayor claridad el comportamiento de los materiales a nivel atómico y molecular (microscópico) y explicar científicamente los fenómenos macroscópicos en función de este comportamiento molecular, es así como surge la teoría cinética molecular de los gases y las leyes que rigen su comportamiento. Las propiedades de los gases son de fácil reconocimiento en comparación con la de los sólidos y líquidos, tal como su fácil expansibilidad, compresibilidad, difusibilidad, fluidez, isotropía. La densidad de los gases () es función de la temperatura (T) y presión (P) a la que se les someta. Mediante la reacción entre el magnesio (Mg) metálico y un ácido, se puede evaluar la constante universal “R” de los gases y a su vez por ser una reacción redox, se puede determinar el peso equivalente del Magnesio. B. OBJETIVOS Reforzar los conceptos básicos de las reacciones Redox. Medir el volumen (V) de gas desprendido en una reacción química, a una temperatura y presión determinadas. Evaluar la constante “R” de los gases mediante la medición de presión (P), temperatura (T) y volumen (V). Determinar el peso equivalente de un elemento dada una reacción química. C. PARTE EXPERIMENTAL En esta sección se hará reaccionar magnesio metálico con una solución de ácido clorhídrico (HCl) 1N y se recogerá el gas hidrogeno (H2) obtenido en la reacción química. El magnesio (Mg) es el limitante de la reacción. 43 “PREPARAR ADEACUADAMENTE EL MATERIAL DE VIDRIO CON EL QUE SE VA A TRABAJAR, LAVANDOLOS CUIDADOSAMENTE SIN DEJAR RASTROS DE GRASAS O GOTAS ADHERIDAS A LAS PAREDES DE LOS MISMOS.” 1. Pesar tres pedazos de cinta de magnesio (Mg) con una longitud aproximadamente de 3-3.5 cm. 2. Limpiar y secar tres tubos de ensayo. 3. Monte el aparato para la recolección y medición del gas hidrógeno (H2) tal como se muestra en la figura Nº1. 4. Llenar un vaso de precipitado de 1 L con agua destilada. 5. Llenar completamente con agua destilada una bureta de 50 mL, tapar cuidadosamente la boca de la bureta, evitando que queden burbuja en su interior. Figura Nº 1: Montaje de aparato para determinar la constante 6. Invierta con cuidado la bureta, sumergiendo la boca de los gases y peso equivalente del mismo en el agua contenida en el vaso de precipitado preparado en 3. 7. Sujetar la bureta en un soporte universal, desalojar con cuidado el agua dentro de la bureta hasta alcanzar el enrase. 8. Introducir un extremo de una manguera por la boca de la bureta, si se desaloja un gran volumen de agua repetir el procedimiento nuevamente. 44 9. Pipetear 4 mL de HCl 1,0 M y transferirlo al fondo de unos de los tubos de ensayo que limpio y seco en el punto 2. 10. Inclinar el tubo de ensayo y color uno de los trozos de cinta de magnesio (Mg) humedecida con agua de manera tal que se adhiera a una de las paredes del tubo de ensayo, se debe tener mucho cuidado de que la cinta de magnesio no entre en contacto con la solución de ácido clorhídrico. 11. Tapar el tubo de ensayo con un tapón provisto con la otra punta de la manguera. 12. Mover y agitar el tubo de ensayo de tal manera que la cinta de magnesio se deslice por las paredes internas del tubo y entre en contacto con la solución de HCl. Se producirá inmediatamente la reacción entre el metal y el ácido, dando como resultado el desplazamiento del agua dentro de la bureta. 13. Dejar que la reacción se complete hasta no observar más magnesio dentro del tubo y no exista más evolución de burbujas de gas desde el fondo del tubo ensayo, dejar todo el montaje en reposo durante unos 5 minutos, con la finalidad de que se establezca el equilibrio entre el aparato y el medio exterior.. 14. Anotar el volumen final de la bureta, así como lla presión barométrica y la temperatura ambiente. 15. Repita el mismo procedimiento desde el punto 3 hasta 14 para los otros pedazos de cinta de magnesio D. TABLA DE DATOS Experimento 1 Masa en g de cinta de Magnesio (Mg) Moles de Magnesio (Mg) Moles de H2 Volumen de H2 ( mL) Presión barométrica, P (mmHg) Presión de vapor de agua, Pv (mmHg) Presión corregida (Pc) atm Valor experimental de R Experimento 2 Experimento 3 45 E. CALCULOS Y RESULTADOS 1. Calcule el número de moles de magnesio (Mg). 2. Reacción química balanceada del proceso. 3. Calcule por estequiometria el numero de moles de gas hidrogeno (H2) recogido a partir de la reacción entre el Mg y HCl. 4. Determinar la Presión de vapor del agua (Pv). Esta se puede calcular: a)Usando la tabla de datos experimentales entre la presión de vapor de agua y la temperatura (ver tabla 1). b)Con la expresión analítica de la ecuación de Antoine log Pv 8,10765 1750,286 (235 T ) donde: Pv= presión de vapor del agua (mmHg) T= Temperatura expresada en ºC La ecuación de Antoine es valida para un rango de temperatura de 0ºC hasta 60ºC. c) Utilizando un gráfico de valores de presión versus temperatura. Tabla 1: Datos experimentales de presión de vapor y temperatura. Ecuación de Antoine. Temperatura ºC Presión de vapor de agua, Pv (mmHg) Temperatura ºC Presión de vapor de agua, Pv (mmHg) 20 17.5 26 25.2 21 18.7 27 26.7 22 19.8 28 28.3 23 21.1 29 30.0 24 22.4 30 31.8 25 23.8 31 33.7 5. Presión corregida (Pc) 46 Pc Pb Pv 760mmHg donde: Pb= Presión barométrica en mmHg 6. Volumen de gas hidrogeno recogido: Se calcula por la diferencia de volumen medida en los puntos inicial y final de la bureta. 7. Con la ecuación de gas ideal determinar la Constante universal de los gases (R). 8. Determinar el peso equivalente del magnesio (Mg) 9. Haga el tratamiento estadístico de los resultados obtenidos. F. CUESTIONARIO 1. ¿Qué diferencia existe entre un gas y un vapor?. Explique 2. ¿Qué es la presión barométrica? Explique. 3. Con cuál de los siguientes gases: Hidrogeno (H2) o difluoroetano (C2H4F2) esperaría usted encontrar experimentalmente un valor de constante R más cercano al teórico. Explique. 4. Se cometería error por exceso o por defecto en el cálculo de la constante R sino se removiera previa a la reacción, la capa de óxido en la cinta de magnesio. Explique. 5. Si por equivocación se utiliza 4 mL de HCl 0.1 N ( en vez de 1 N) ¿ Que volumen de gas hidrógeno en condiciones normales se generaría en la reacción.,si se añadieron 1*10 -3 moles de magnesio?