07-10 vilaplana.qxd
Anuncio
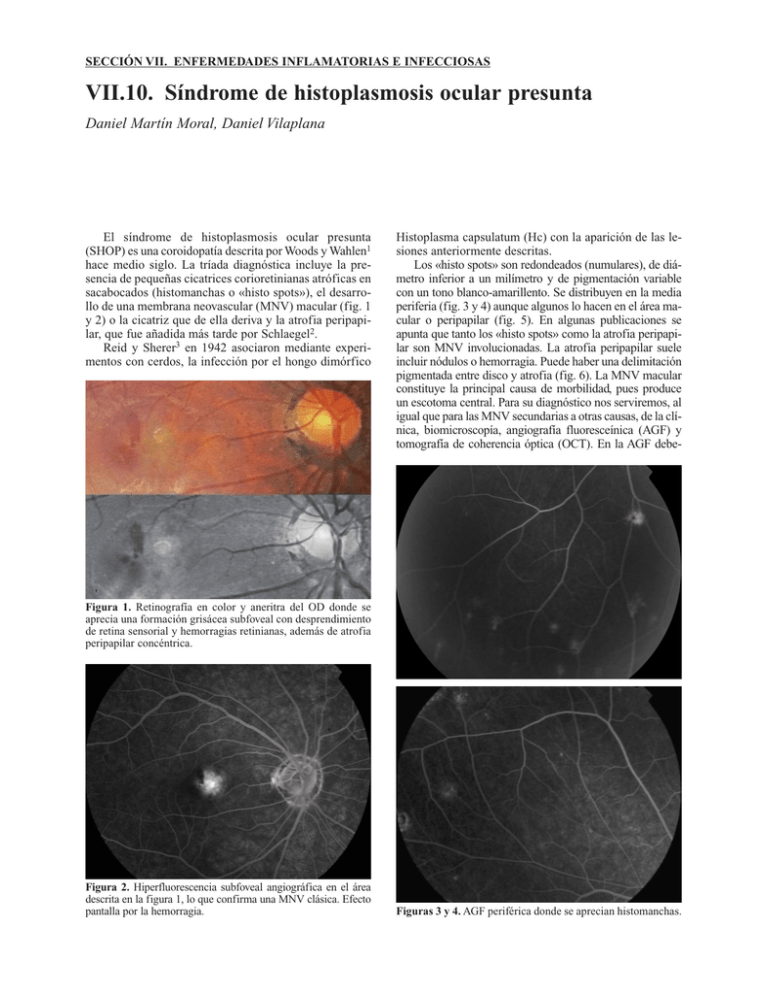
SECCIÓN VII. ENFERMEDADES INFLAMATORIAS E INFECCIOSAS VII.10. Síndrome de histoplasmosis ocular presunta Daniel Martín Moral, Daniel Vilaplana El síndrome de histoplasmosis ocular presunta (SHOP) es una coroidopatía descrita por Woods y Wahlen1 hace medio siglo. La tríada diagnóstica incluye la presencia de pequeñas cicatrices corioretinianas atróficas en sacabocados (histomanchas o «histo spots»), el desarrollo de una membrana neovascular (MNV) macular (fig. 1 y 2) o la cicatriz que de ella deriva y la atrofia peripapilar, que fue añadida más tarde por Schlaegel2. Reid y Sherer3 en 1942 asociaron mediante experimentos con cerdos, la infección por el hongo dimórfico Histoplasma capsulatum (Hc) con la aparición de las lesiones anteriormente descritas. Los «histo spots» son redondeados (numulares), de diámetro inferior a un milímetro y de pigmentación variable con un tono blanco-amarillento. Se distribuyen en la media periferia (fig. 3 y 4) aunque algunos lo hacen en el área macular o peripapilar (fig. 5). En algunas publicaciones se apunta que tanto los «histo spots» como la atrofia peripapilar son MNV involucionadas. La atrofia peripapilar suele incluir nódulos o hemorragia. Puede haber una delimitación pigmentada entre disco y atrofia (fig. 6). La MNV macular constituye la principal causa de morbilidad, pues produce un escotoma central. Para su diagnóstico nos serviremos, al igual que para las MNV secundarias a otras causas, de la clínica, biomicroscopía, angiografía fluoresceínica (AGF) y tomografía de coherencia óptica (OCT). En la AGF debe- Figura 1. Retinografía en color y aneritra del OD donde se aprecia una formación grisácea subfoveal con desprendimiento de retina sensorial y hemorragias retinianas, además de atrofia peripapilar concéntrica. Figura 2. Hiperfluorescencia subfoveal angiográfica en el área descrita en la figura 1, lo que confirma una MNV clásica. Efecto pantalla por la hemorragia. Figuras 3 y 4. AGF periférica donde se aprecian histomanchas. 420 Figura 5. Retinografía en color donde observamos histomanchas peripapilares. Patología y cirugía de la mácula Figura 7. AGF del caso anterior. La histomancha situada en la arcada temporal superior no evidenció MNV activa. Las histomanchas se aprecian como defectos en ventana por la atrofia del EPR. Figura 6. Atrofia peripapilar e histomanchas, una de ellas en la arcada temporal superior. Se aprecia una alteración muy tenue del EPR extramacular superior. mos distinguir la hiperfluorescencia por fuga de contraste que se da en una MNV, de la que muestra por efecto ventana una histomancha (fig. 7). Es destacable que estos hallazgos no se acompañan de inflamación ocular4 en el segmento anterior ni de vitreítis en el segmento posterior (por ello algunos autores dicen que es una tétrada). En un 5% de casos también han sido descritas estrías curvilíneas en la periferia de estos ojos (fig. 8), que también son cicatrices coriorretinianas5-9. Esta entidad aparece en personas jóvenes entre la segunda y la quinta década de la vida, a diferencia de la degeneración macular asociada a la edad (DMAE), que se describe clásicamente a partir de los 50 años. No parece haber predilección por sexos10,11 aunque otros autores encuentran mayor proporción de mujeres12. Suele ser bilateral. EPIDEMIOLOGÍA Y ETIOPATOGENIA El Hc prolifera tanto en tierra húmeda como en fómites de aves y murciélagos. Las microconidias o esporas llegan a los alvéolos por inhalación. Figura 8. Estría coriorretiniana lineal periférica. En estudios epidemiológicos llevados a cabo en las décadas de 1960 y 1970 en áreas endémicas se demostró que la prevalencia de SHOP es superior (entre un 1,6 y 5,3%) a la existente en zonas no endémicas. En los valles de los ríos Ohio y Mississipi, algunas zonas de América central y del sur, África y sudeste asiático, entre un 60-80% de la población presenta positividad en el test cutáneo de la histoplasmina. Entre los menores de 20 años puede llegar a haber una prevalencia del 90%13. Este test indica contacto previo con el antígeno. Se ha sugerido que se puede reactivar la enfermedad en un 7% de los pacientes a los que se les realiza el test cutáneo de la histoplasmina14-16. Un 4,4% de los que resultaron positivos en el test presentaban SHOP. Un 20% de los que tienen SHOP desarrollan nuevas cicatrices con el tiempo, pero sólo un 3,8% de los que presentan un fondo compatible desarrollan MNV macular17-22. De hecho, la prevalencia de cicatrices disciformes en zonas endémicas es de sólo un 0,12%23. En un estudio en el que se siguió la evolución de la enfermedad en 106 ojos de 82 pacientes durante 1 año como mínimo, se observó que el 21% de las MNV maculares se VII.10. Síndrome de histoplasmosis ocular presunta producían donde había una cicatriz previa24. Este hallazgo ya había sido publicado con anterioridad25-28 y confirmado en otro estudio publicado en 1996 de 5 años de seguimiento29. Un 18% presentaron papila congestiva y un 3% drusas (la incidencia poblacional es del 0,3%)30. La mitad tenía cicatrices coriorretinianas maculares en el ojo adelfo. De los 41 pacientes a los que se realizó el test de la histoplasmina ninguno tuvo una exacerbación de la enfermedad coincidente con el mismo. El intervalo entre la actividad de los dos ojos puede ser de treinta años. Los «histo spots» no muestran inflamación activa, pero representan defectos focales en la membrana de Bruch que podrían facilitar el desarrollo de la MNV31. Por tanto, estos pacientes deben autoevaluarse más frecuentemente con rejillas de Amsler a fin de detectar reactivaciones de forma más precoz32. Se ha descrito un paciente en el que la cirugía refractiva (LASIK) podría haber desencadenado la reactivación de estas lesiones33. Aunque en las cicatrices y MNV se han encontrado pruebas moleculares (ADN)34 de la implicación de este agente en la enfermedad, no se ha confirmado serológicamente35 ni se ha aislado el microorganismo causal en las muestras. Se ha constatado la presencia de anticuerpos de histoplasma C-reactivo con una dilución 1:2 en una muestra de vítreo obtenida durante la cirugía36. Se cree que el SHOP ocurre tras la diseminación hematógena del microorganismo desde el pulmón hasta la coroides. Allí la respuesta local formaría granulomas en los que se destruiría el hongo, quedando restos antigénicos. Estas áreas se correspondrían con las cicatrices atróficas que afectan a la coroides y el epitelio pigmentario de la retina. En su patofisiología las cicatrices coroideas representan defectos focales en la membrana de Bruch, y esta disrupción puede acabar en neovascularización, como se ha comentado anteriormente. Se interpone tejido fibrovascular entre la membrana de Bruch y el epitelio pigmentario de la retina. La enfermedad podría ser la respuesta curativa a un daño local. Este proceso desencadenaría una reacción autoinmune del tipo respuesta tardía. No es una enfermedad infecciosa como sí lo es la endoftalmitis por Hc. En la retina adyacente no se ha encontrado ADN de histoplasma. Hace ya 30 años se relacionó al SHOP con determinados HLA, como el B7, el DRw2, el DR15 o el DRB137-41. En Estados Unidos el 90% de los pacientes tienen HLA DR1542. En Holanda se ha llevado a cabo un estudio en 24 pacientes afectados de SHOP en los que se halló una isoleucina en la posición 67 del HLA-DRB143, en cambio sólo el 25% presentaba HLA DR15. Incluso se apunta la posibilidad de que aparezca la enfermedad sin el desencadenante de Hc, como se ha publicado en zonas no endémicas en el norte de Europa44-52 como Holanda, Bélgica, Alemania, Dinamarca y Reino Unido, y en Brasil9 o India53. No se hallaron anticuerpos contra el Hc ni relación con otras infecciones habituales de estas zonas (anticuerpos contra Toxoplasma gondii, Toxocara canis y cati, Ascaris sp, o presencia de antígenos de Cryptococcus neoformans) ni anticuerpos contra la retina o proteínas de la coroides54. Se postula que las mico- 421 bacterias atípicas o Mycobacterium avium intracellulare son otros agentes que podrían desencadenar la enfermedad ocular55. Debido a ello se sugiere que debería renombrarse esta entidad de un modo distinto. CLÍNICA SISTÉMICA Las manifestaciones sistémicas de la infección por Hc incluyen una reacción granulomatosa pulmonar con encapsulación y caseificación similar a la que se ve en la tuberculosis. Cursa de un modo asintomático en el 90% de los casos, aunque con patrón pulmonar evidente en las pruebas radiológicas. La bronconeumonía es poco frecuente. En niños o adultos inmunocomprometidos se produce diseminación con linfadenopatía, hepatoesplenomegalia y pancitopenia, simulando un cuadro hematológico. CLÍNICA OCULAR Las manifestaciones oculares se engloban en dos entidades distintas: la endoftalmitis o uveítis granulomatosa y el síndrome de histoplasmosis ocular presunta, que es la que nos ocupa. En el SHOP cursan asintomáticos si no hay MNV. Si la hay puede aparecer una disminución de la agudeza visual central, escotoma o metamorfopsia, de aparición más o menos brusca. El pronóstico visual sin tratamiento es malo cuando se desarrolla la MNV macular. Más del 75% de los ojos se deterioran a agudezas visuales de 0,2 o menos en tres años56,57. El segundo ojo se afecta en un 21% de los casos según un estudio retrospectivo de 81 pacientes llevado a cabo en Holanda por Suttorp-Schulten M, et al.47. Esto concuerda con artículos publicados previamente en los Estados Unidos y Canadá15,22-26,58,59. DIAGNÓSTICO DIFERENCIAL El diagnóstico diferencial hay que establecerlo con la DMAE, la toxoplasmosis, la miopía magna, la coroiditis multifocal con panuveítis y las estrías angioides. En la DMAE hay drusas y suelen ser pacientes de más de 50 años. Además no hay manchas atróficas ni cicatrices peripapilares. En la toxoplasmosis la cicatriz suele ser blanca y acostumbra a existir celularidad vítrea. La miopía magna habitualmente no presenta manchas atróficas fuera del polo posterior y las cicatrices son más blancas. Además hay creciente miópico en el lado temporal y el pigmento se encuentra en el borde externo del mismo. En la coroiditis multifocal con panuveítis existe también celularidad a diferencia del SHOP. Las estrías angioides aparecen como líneas que simulan vasos de la retina irradiando desde la papila. Otras patologías que hay que descartar60 serían la coroidopatía en perdigonada (birdshot), coroidopatía punteada interna, síndrome de múltiples manchas blancas evanescentes, MNV idiopáticas, coriorretinopatía serosa central o sarcoidosis. 422 Patología y cirugía de la mácula TRATAMIENTO La causa de las alteraciones clínicas en el SHOP es la MNV macular. Por este motivo, y dado que la etiología y patogénesis de la enfermedad es aún incierta, los esfuerzos se centran en tratarla. Cuando la MNV afecta al polo posterior puede ser de localización subfoveal, yuxtafoveal o extramacular. En algunas ocasiones afectan el área peripapilar. Los tratamientos que se han desarrollado han sido principalmente a base de antifúngicos, corticoides, fotocoagulación láser, cirugía submacular, terapia fotodinámica (TFD) y anti-Vascular Endotelial Growth Factor (anti-VEGF). Con la observación o conducta expectante no se suelen obtener buenos resultados61,62. Antifúngicos/Corticoides Figura 9. Retinografía en color de dos MNV. Una extramacular superior y otra yuxtafoveal inferior (AV = 0,2). Con el tratamiento antifúngico63,64 tampoco se obtuvieron buenos resultados. En cambio los corticosteroides65 sí tienen cierto efecto beneficioso. Esto apoya la hipótesis de que es una enfermedad autoinmune y no infecciosa. También se ha intentado modular la autoinmunidad con desensibilización a la histoplasmina66. Incluso llegaron a administrarse corticosteroides de forma preventiva, antes de la aparición de la MNV macular, cuando los pacientes presentaban signos compatibles con esta entidad en el fondo de ojo. Fotocoagulación Láser También se trataron las MNV maculares extrafoveales o yuxtafoveales mediante fotocoagulación con láser (krypton o argon) obteniendo unos resultados más que aceptables61,67-69. Los datos del Macular Photocoagulation Study62 mostraron que al cabo de 3 años, sólo el 9% de los pacientes con MNV extrafoveal tratados con láser krypton perdía visión, mientras que en el grupo no tratado lo hacía el 48% (figs. 9-11). En las MNV yuxtafoveales los valores son del 4,6% y 24,6%, respectivamente (fig. 12A-D). En las MNV subfoveales nos limita el inaceptable escotoma central que dejaría el tratamiento con láser67. Figura 10. AGF en tiempo arterial del mismo caso con MNV bien delimitadas. Cirugía macular Para las membranas peripapilares70,71 y subfoveales72se prefirió la cirugía (fig. 13A-D, fig. 14, fig. 15), aunque ésta no demostró resultados superiores a la observación al cabo de 24 meses, pese a una esperanzadora mejoría inicial. Las principales complicaciones incluyeron lesión a nivel del epitelio pigmentario macular (EPR) con atrofia secundaria de la capa coriocapilar, daño de la retina sensorial, y una elevada recurrencia de las MNV. En el artículo de Thomas MA, et al78 los autores otorgaron mejor pronóstico a las MNV secundarias a SHOP, pues son de tipo 2 (localizadas entre el EPR y la membrana de Bruch) y creciendo entre el EPR y la retina sensorial. Debido a esto se podría conservar mejor el EPR bajo 77 Figura 11. AGF en tiempos arterio-venosos del mismo caso con difusión del colorante en las MNV. la fóvea tras extirpar la membrana, hecho diferencial respecto a las MNV secundarias a DMAE, que son de tipo 1 y crecen por debajo del EPR, con lo que éste se suele deteriorar más duante el acto quirúrgico. En un estudio prospectivo y aleatorizado en 2004 (Submacular Surgery Trial79) que incluyó 225 pacientes con MNV secundarias VII.10. Síndrome de histoplasmosis ocular presunta 423 Figura 12 A-D. Mismo caso anterior, 1 mes post-fotocoagulación láser Dye amarillo 577 nm. MNV superior inactiva. Persistencia MNV yuxtafoveal inferior dirigiéndose al espacio subfoveal (AV = 0.1) (cortesía Centro de Oftalmología Barraquer. Archivo 1990 DVB). a SHOP o idiopáticas se comparó la cirugía con la historia natural de la enfermedad. El 58% de los ojos tratados sufrió una recurrencia a los 2 años. Existió un riesgo de rotura periférica del 12%, de rotura en el polo posterior del 2%, del 5% de desprendimiento de retina y se favoreció la formación de cataratas en un 40%. La cirugía resultó ligeramente ventajosa en aquellos pacientes con agudezas visuales iniciales de 20/100 o inferiores. El subgrupo de membranas subfoveales cuyo origen era yuxtafoveal presentaban mejores resultados80. Más recientemente, en 2008 se han publicado los resultados con 170 pacientes y no se han encontrado diferencias estadísticamente significativas en los test de satisfacción subjetivos (salud y calidad de vida) entre la cirugía y la actitud conservadora (observación) en MNV idiopáticas o asociadas a SHOP81. Terapia fotodinámica La fotocoagulación láser en el tratamiento de las membranas subfoveales secundarias a patologías como la miopía patológica, las estrías angioides, la coroidopa- tía punteada interna, la histoplasmosis y las MNV idiopáticas crea un escotoma central absoluto a diferencia de la TFD82-84. A los dos años las cicatrices por láser pueden crecer hasta un 50%85. El uso de la terapia fotodinámica con verteporfino (Visudyne®) en las MNV secundarias a SHOP86 fue aprobado por la FDA en agosto de 2001 tras la publicación de los resultados de un estudio prospectivo a un año, en 26 pacientes (Verteporfin in Ocular Histoplasmosis study)87. Este estudio demostró buenos resultados incluso a los dos años de seguimiento88. El número de tratamientos requerido fue menor que en la DMAE y la agudeza visual alcanzada también fue superior, incluso con resultados positivos en ojos previamente operados de cirugía submacular89. Los pacientes con mayor pérdida de visión fueron los que requirieron más sesiones de terapia fotodinámica y los que llevaron más tiempo con sintomatología. Tiene la ventaja de limitar el escotoma paracentral y conservar mejor agudeza visual. La terapia fotodinámica se aplicó en las MNV yuxtafoveales90 con estabilización o mejoría en el 78% de los casos respecto al 54% en el grupo no tratado. 424 Patología y cirugía de la mácula Figura 13 A-D. Retinografía color, aneritra y AGF en tiempo arterial y arterio-venosos con MNV subfoveal. Histomanchas en polo posterior y peripapilares (AV = 0,05) (autorización Annals de la Societat Catalana d´Oftalmologia). Figura 14. Postoperatorio del mismo caso anterior. Cirugía macular con extracción de la MNV subfoveal. Aprecien el nivel de aire al día siguiente de la intervención. Figura 15. Retinografía a los dos años. Ausencia de desprendimiento de retina sensorial. AVfinal = 0,85 (cortesía Centro de Oftalmología Barraquer. Archivo 1995 DVB). VII.10. Síndrome de histoplasmosis ocular presunta En nuestra experiencia los resultados a largo plazo no fueron los deseados (figs. 1, 2 y 16). Se temía la aparición de complicaciones en las membranas peripapilares por daño del nervio óptico, aunque algunos autores han referido buenos resultados cuando el tratamiento se hace de manera reglada y cuidadosa91. En 2008 Bernstein, et al92 publicaron una serie retrospectiva de 7 pacientes con MNV peripapilar secundaria a DMAE, tratados con TFD a dosis estándar abarcando el nervio óptico, sin hallar daño derivado de su aplicación con un seguimiento de hasta 2 años. 425 Anti-VEGF (Vascular Endothelial Growth Factor) Recientemente se están utilizando los fármacos antiangiogénicos (Anti-VEGF) en inyección intravítrea (fig. 17A-C). Esta terapia deriva del tratamiento de las MNV en la DMAE, que a su vez proviene de las terapias antineoplásicas (fig. 18A-C). Adán, et al.93 publicaron el primer caso de MNV secundaria a SHOP tratada con terapia antiangiogénica, con buen resultado. Posteriormente se han descrito más resultados prometedores94. En una revisión retrospectiva publicada en 200895 que incluyó 28 ojos de 28 pacientes afectos de MNV secundaria a SHOP tratados con inyecciones intravítreas de bevacizumab, la media de inyecciones por ojo fue de 1,8. El seguimiento medio fue de 22,43 semanas. La mejoría de la agudeza visual central se dio en un 71% de los pacientes, no mostrando cambios un 14% y empeorando el otro 14%. La AV media pasó de 0,65 a 0,43 en escala logMAR (equivalente Snellen: de 20/88 a 20/54). Otros tratamientos Figura 16. Cicatriz macular disciforme post-TFD en el mismo paciente que la figura 1 y 2. Otros tratamientos minoritarios como el haz de protones96 han sido probados, no habiéndose instaurado por su difícil disponibilidad y por haber sido superados por tratamientos posteriores. La maculopatía por SHOP es una enfermedad crónica que suele cursar a brotes. En la actualidad no existe un Figura 17 A-C. Mismo caso que figuras 6 y 7 a los tres años. MNV activa extramacular superior (flecha) en el OI con histomancha sin actividad en la arcada temporal superior. El OCT muestra quistes intrarretinianos. Discreta disminución de AV = 0,9, con metamofopsia. Figura 18 A-C. Resultado después de un mes de la inyección intravítrea de bevacizumab. No se aprecia actividad en la MNV descrita. OCT en la región de la membrana donde no observamos signos de actividad. Dieciocho meses después del tratamiento no ha mostrado signos de reactivación (AV = 1). 426 tratamiento curativo. La fotocoagulación láser provoca escotomas absolutos, la cirugía macular es invasiva, y aunque con la TFD y los anti-VEGF los secundarismos son menores, los resultados son a corto plazo. La individualización del tratamiento según cada caso clínico debe ser la norma en espera de resultados a largo plazo. Patología y cirugía de la mácula 32. 33. 34. 35. BIBLIOGRAFÍA 36. 37. 1. Woods AC, Wahlen HE. The probable role of benign histoplasmosis in the etiology of granulomatous uveitis. Am J Ophthalmol 1960; 49: 205-20. 2. Schlaegel TF, Kenney D. Changes around the optic nervehead in presumed ocular histoplasmosis. Am J Ophthalmol 1996; 62(3): 454-8. 3. Reid JD, Sherer JH, Herbut PA, et al. Systemic histoplasmosis diagnosed before death and produced experimentally in guinea pigs. J Lab Clin Med 1942; 27: 419-434. 4. Saxe SJ, Grossniklaus HE, Lopez PF, Lambert HM, Sternberg P Jr, L’Hernault N. Ultrastructural features of surgically excised subretinal neovascular membranes in the ocular histoplasmosis syndrome. Arch Ophthalmol 1993; 111(1): 88-95. 5. Bottoni FG, Deutman AF, Aandekerk AL. Presumed ocular histoplasmosis syndrome and linear streak lesions. Br J Ophthalmol 1989; 73(7): 528-35. 6. Maumenee AE. Clinical entities in «uveitis». An approach to the study of intraocular inflammation. Am J Ophthalmol 1970; 69(1): 1-27. 7. Gass JDM, Wilkinson CP. Follow-up study of presumed ocular histoplasmosis. Trans Am Acad Ophthalmol Otolaryngol 1972; 76: 672-94. 8. Fountain JA, Schlaegel TF Jr. Linear streaks of the equator in the presumed ocular histoplasmosis syndrome. Arch Ophthalmol 1981; 99(2): 246-8. 9. Amaro MH, Muccioli C, Abreu MT. Ocular histoplasmosis-like syndrome: a report from a nonendemic area. Arq Bras Oftalmol 2007; 70(4): 577-80. 10. Ferman SS, Podgorski SF, Penn MK. Blindness from presumed ocular histoplasmosis in Tennessee. Ophthalmology 1982; 89(12): 1295-8. 11. Smith RE, Ganley JP, Knox DL. Presumed ocular histoplasmosis II. Patterns of peripheral and peripapillary scarring in persons with nonmacular disease. Arch Ophthalmol 1972; 87(3): 251-7. 12. Cohen SY, Laroche A, Leguen Y, Soubrane G, Coscas GJ. Etiology of choroidal neovascularization in young patients. Ophthalmology 1996; 103(8): 1241-4. 13. Zeidberg LD, Dillon A, Gass RS. Some factors in the epidemiology of histoplasmin sensitivity in Williamson County, Tennessee. Am J Public Health Nations Health 1951; 41(1): 80-9. 14. Schlaegel TF. Presumed ocular histoplasmosis. In: Tasman W, Jaeger EA, eds. Duane´s Clinical ophthalmology. Philadelphia: Lippincott, 1990: vol 3, chapter 48. 15. Five-year follow-up of fellow eyes of individuals with ocular histoplasmosis and unilateral extrafoveal or juxtafoveal choroidal neovascularization. Macular Photocoagulation Study Group. Arch Ophthalmol 1996; 114(6): 677-88. 16. Krause AC, Hopkins WG. Ocular manifestation of histoplasmosis. Am J Ophthalmol 1951; 34(4): 564-6. 17. Walma D Jr, Schlaegel TF Jr. Presumed Histoplasmic Choroiditis. A clinical analysis of 43 cases. Am J Ophthalmol 1964; 57: 107-10. 18. Van Metre TE Jr, Maumenee AE. Specific ocular uveal lesions in patients with evidence of histoplasmosis. Arch Ophthalmol 1964; 71: 314-24. 19. Ganley JP, Smith RE, Knox DL, Comstock GW. Presumed ocular histoplasmosis. 3. Epidemiologic characteristics of people with peripheral atrophic scars. Arch Ophthalmol 1973; 89(2): 116-9. 20. Ellis FD, Schlaegel TF Jr. The geographic localization of presumed histoplasmic choroiditis. Am J Ophthalmol 1973; 75(6): 953-6. 21. Ganley JP. Epidemiology of presumed ocular histoplasmosis. Arch Ophthalmol 1984; 102(12): 1754-6. 22. Lewis ML, Van Newkirk MR, Gass JD. Follow-up study of presumed ocular histoplasmosis syndrome. Ophthalmology 1980; 87(5): 390-9. 23. Smith RE, Ganley JP. An epidemiological study of presumed ocular histoplasmosis. Trans Am Acad Ophthalmol Otolaryngol 1971; 75(5): 994-1005. 24. Gutman FA. The natural course of active choroidal lesions in the presumed ocular histoplasmosis syndrome. Trans Am Ophthalmol Soc 1979; 77: 51541. 25. Smith RE, Knox DL, Jensen AD. Ocular histoplasmosis. Significance of asymptomatic macular scars. Arch Ophthalmol 1973; 89(4): 296-300. 26. Sawelson H, Goldberg RE, Annesley WH Jr, Tomer TL. Presumed ocular histoplasmosis syndrome. The fellow eye. Arch Ophthalmol 1976; 94(2): 2214. 27. Smith RE, Ganley JP. The natural history of non-disciform ocular histoplasmosis. Can J Ophthalmol 1977; 12(2): 114-20. 28. Green WR, Wilson DJ. Choroidal neovascularization. Ophthalmology 1986; 93(9): 1169-76. 29. Five-year follow-up of fellow eyes of individuals with ocular histoplasmosis and unilateral extrafoveal or juxtafoveal choroidal neovascularization. Macular Photocoagulation Study Group. Arch Ophthalmol 1996; 114(6): 677-88. 30. Lorentzen SE. Drusen of the optic disk. A clinical and genetic study. Acta Ophthalmol (Copenh). 1966: Suppl 90: 1-180. 31. Ciulla TA, Piper HC, Xiao M, Wheat LJ. Presumed ocular histoplasmosis syndrome: update on epidemiology, pathogenesis, and photodynamic, an- 38. 39. 40. 41. 42. 43. 44. 45. 46. 47. 48. 49. 50. 51. 52. 53. 54. 55. 56. 57. 58. 59. 60. 61. 62. 63. 64. tiangiogenic, and surgical therapies. Curr Opin Ophthalmol 2001; 12(6): 442-9. Trevino R, Salvat R. Preventing reactivation of ocular histoplasmosis: guidance for patients at risk. Optometry 2006; 77(1): 10-6. Fedorovich I, Mehr DS, Oz O, Akduman L. Choroidal neovascularization after laser in situ keratomileusis in a patient with presumed ocular histoplasmosis syndrome. Eur J Ophthalmol 2004; 14(3): 261-3. Spencer WH, Chan CC, Shen DF, Rao NA. Detection of histoplasma capsulatum DNA in lesions of chronic ocular histoplasmosis syndrome. Arch Ophthalmol 2003; 121(11): 1551-5. Khalil MK. Histopathology of presumed ocular histoplasmosis. Am J Ophthalmol 1982; 94(3): 369-76. Escoto R, Vilaplana D. Foto diagnóstica. Annals d’Oftalmologia 1996; 6(4): 187-9. Braley RE, Meredith TA, Aaberg TM, Koethe SM, Witkowski JA. The prevalence of HLA-B7 in presumed ocular histoplasmosis. Am J Ophthalmol. 1978; 85(6): 859-61. Godfrey WA, Sabates R, Cross DE. Association of presumed ocular histoplasmosis with HLA-B7. Am J Ophthalmol 1978; 85(6): 854-8. Meredith TA, Smith RE, Duquesnoy RJ. Association of HLA-DRw2 antigen with presumed ocular histoplasmosis. Am J Ophthalmol 1980; 89(1): 70-6. Meredith TA, Smith RE, Braley RE, Witkowski JA, Koethe SM. The prevalence of HLA-B7 in presumed ocular histoplasmosis in patients with peripheral atrophic scars. Am J Ophthalmol 1978; 86(3): 325-8. Spaide RF, Skerry JE, Yannuzzi LA, DeRosa JT. Lack of the HLA-DR2 specificity in multifocal choroiditis and panuveitis. Br J Ophthalmol 1990; 74(9): 536-7. Dabil H, Kaplan HJ, Duffy BF, Phelan DL, Mohanakumar T, Jaramillo A. Association of the HLA-DR15/HLA-DQ6 haplotype with development of choroidal neovascular lesions in presumed ocular histoplasmosis syndrome. Hum Immunol 2003; 64(10): 960-4. Ongkosuwito JV, Tilanus MG, Van der Lelij A, van Schooneveld MJ, Jager MJ, Rozemuller EH, de Smet MD, Suttorp-Schulten MS. Amino acid residue 67 (isoleucine) of HLA-DRB is associated with POHS. Invest Ophthalmol Vis Sci 2002; 43(6): 1725-9. Saraux H, Pelosse B, Guigui A. [Multifocal inner choroiditis: pseudohistoplasmosis. The European form of the presumed American histoplasmosis]. J Fr Ophtalmol 1986; 9(10): 645-51. Braunstein RA, Rosen DA, Bird AC. Ocular histoplasmosis syndrome in the United Kingdom. Br J Ophthalmol 1974; 58(11): 893-8. Flage T, Sand AB, Syrdalen P. Haemorrhagic maculopathy in young adults. Acta Ophthalmol (Copenh) 1977; 55(3): 489-96. Suttorp-Schulten MS, Bollemeijer JG, Bos PJ, Rothova A. Presumed ocular histoplasmosis in The Netherlands—an area without histoplasmosis. Br J Ophthalmol 1997; 81(1): 7-11. Francois J, De Laey JJ, Dakir M. [Hemorrhagic macular choroidopathy in young subjects (presumed histoplasmosis choroiditis)]. Bull Soc Belge Ophthalmol 1974; 167: 664-78. Schildberg P, Wessing A. [Focal hemorrhagic choroititis]. Klin Monatsbl Augenheilkd 1975; 166(5): 651-9. Notting JG, Deutman AF, van der Werf PJ. [Diagnosis and treatment of macular lesions in multifocal choroiditis (presumed histoplasmosis)]. Klin Monatsbl Augenheilkd 1975; 166(5): 629-36. Craandijk A. Focal macular choroidopathy. Doc Ophthalmol 1979; 48 (1): 199. Chryssafis C, Neubauer A, Haritoglou C, Gandorfer A. [Presumed ocular histoplasmosis syndrome (POHS) in a non-endemic area]. Klin Monatsbl Augenheilkd 2004; 221(2): 128-30. Sinha R, Raju S, Garg SP, Venkatesh P, Talwar D. Presumed ocular histoplasmosis syndrome in India. Ocul Immunol Inflamm 2007; 15(4): 315-7. Ongkosuwito JV, Kortbeek LM, Van der Lelij A, Molicka E, Kijlstra A, de Smet MD, Suttorp-Schulten MS. Aetiological study of the presumed ocular histoplasmosis syndrome in the Netherlands. Br J Ophthalmol 1999; 83(5): 535-9. Watzke RC, Klein ML, Wener MH. Histoplasmosis-like choroiditis in a nonendemic area: the northwest United States. Retina 1998; 18(3): 204-12. Olk RJ, Burgess DB, McCormick PA. Subfoveal and juxtafoveal subretinal neovascularization in the presumed ocular histoplasmosis syndrome. Visual prognosis. Ophthalmology 1984; 91(12): 1592-602. Kleiner RC, Ratner CM, Enger C, Fine SL. Subfoveal neovascularization in the ocular histoplasmosis syndrome. A natural history study. Retina 1988; 8(4): 225-9. Lewis ML, Schiffman JC. Long-term follow-up of the second eye in ocular histoplasmosis. Int Ophthalmol Clin 1983; 23(2): 125-35. Elliott JH, Jackson DJ. Presumed histoplasmic maculopathy: clinical course and prognosis in nonphotocoagulated eyes. Int Ophthalmol Clin 1975; 15(3): 29-39. Dreyer RF, Gass DJ. Multifocal choroiditis and panuveitis. A syndrome that mimics ocular histoplasmosis. Arch Ophthalmol 1984; 102(12): 1776-84. Macular Photocoagulation Study Group. Argon laser photocoagulation for ocular histoplasmosis. Results of a randomized clinical trial. Arch Ophthalmol 1983; 101(9): 1347-57. Macular Photocoagulation Study Group. Krypton laser photocoagulation for neovascular lesions of ocular histoplasmosis. Results of a randomized clinical trial. Arch Ophthalmol 1987; 105: 1499-1507. Giles CL, Falls HF. Further evaluation of amphotericin-B therapy in presumptive histoplasmosis chorioretinitis. Am J Ophthalmol 1961; 51: 588-98. Makley TA Jr, Long JW, Suie T. Therapy of chorioretinitis presumed to be caused by histoplasmosis. Int Ophthalmol Clin 1975; 15(3): 181-96. VII.10. Síndrome de histoplasmosis ocular presunta 65. Rechtman E, Allen VD, Danis RP, Pratt LM, Harris A, Speicher MA. Intravitreal triamcinolone for choroidal neovascularization in ocular histoplasmosis syndrome. Am J Ophthalmol 2003; 136(4): 739-41. 66. Schlaegel TF Jr. Diagnosis and management of minimal recurrences of macular histoplasmosis. Int Ophthalmol Clin 1975; 15(3): 167-79. 67. Fine SL, Wood WJ, Isernhagen RD, Singerman LJ, Bressler NM, Folk JC, Kimura AE, Fish GE, Maguire MG, Alexander J. Laser treatment for subfoveal neovascular membranes in ocular histoplasmosis syndrome: results of a pilot randomized clinical trial. Arch Ophthalmol 1993; 111(1): 19-20. 68. Cummings HL, Rehmar AJ, Wood WJ, Isernhagen RD. Long-term results of laser treatment in the ocular histoplasmosis syndrome. Arch Ophthalmol 1995; 113(4): 465-8. 69. Argon laser photocoagulation for neovascular maculopathy. Five-year results from randomized clinical trials. Macular Photocoagulation Study Group. Arch Ophthalmol 1991; 109(8): 1109-14. 70. Almony A, Thomas MA, Atebara NH, Holekamp NM, Del Priore LV. Longterm follow-up of surgical removal of extensive peripapillary choroidal neovascularization in presumed ocular histoplasmosis syndrome. Ophthalmology 2008; 115(3): 540-545. 71. Atebara NH, Thomas MA, Holekamp NM, Mandell BA, Del Priore LV. Surgical removal of extensive peripapillary choroidal neovascularization associated with presumed ocular histoplasmosis syndrome. Ophthalmology 1998; 105(9): 1598-605. 72. Thomas MA, Grand MG, Williams DF, Lee CM, Pesin SR, Lowe MA. Surgical management of subfoveal choroidal neovascularization. Ophthalmology 1992; 99(6): 952-68; discussion 975-6. 73. Thomas MA, Dickinson JD, Melberg NS, Ibanez HE, Dhaliwal RS. Visual results after surgical removal of subfoveal choroidal neovascular membranes. Ophthalmology 1994; 101(8): 1384-96. 74. Melberg NS, Thomas MA, Dickinson JD, Valluri S. Managing recurrent neovascularization after subfoveal surgery in presumed ocular histoplasmosis syndrome. Ophthalmology 1996; 103(7): 1064-7; discussion 1067-8. 75. Holekamp NM, Thomas MA, Dickinson JD, Valluri S. Surgical removal of subfoveal choroidal neovascularization in presumed ocular histoplasmosis: stability of early visual results. Ophthalmology 1997; 104(1): 22-6. 76. Berger AS, Conway M, Del Priore LV, Walker RS, Pollack JS, Kaplan HJ. Submacular surgery for subfoveal choroidal neovascular membranes in patients with presumed ocular histoplasmosis. Arch Ophthalmol 1997; 115(8): 991-6. 77. Fleckner MR, Hochman MA, Buzney SM, Weiter JJ, Tolentino FI, Khadem JJ. Complications of surgery for subfoveal choroidal neovascularization. Int Ophthalmol Clin 2000; 40(1): 201-14. 78. Thomas MA, Kaplan HJ. Surgical removal of subfoveal neovascularization in the presumed ocular histoplasmosis syndrome. Am J Ophthalmol 1991; 111(1): 1-7. 79. Hawkins BS, Bressler NM, Bressler SB, Davidorf FH, Hoskins JC, Marsh MJ, Miskala PH, Redford M, Sternberg P Jr, Thomas MA, Toth CA; Submacular Surgery Trials Research Group. Surgical removal vs observation for subfoveal choroidal neovascularization, either associated with the ocular histoplasmosis syndrome or idiopathic: I. Ophthalmic findings from a randomized clinical trial: Submacular Surgery Trials (SST) Group H Trial: SST Report No. 9. Arch Ophthalmol. 2004; 122(11): 1597-611. Erratum in: Arch Ophthalmol 2005; 123(1): 28. 80. Melberg NS, Thomas MA, Burgess DB. The surgical removal of subfoveal choroidal neovascularization. Ingrowth site as a predictor of visual outcome. Retina 1996; 16(3): 190-5. 81. Bass EB, Gilson MM, Mangione CM, Hawkins BS, Miskala PH, Mann AL, Bressler NM. Surgical removal vs observation for idiopathic or ocular histoplasmosis syndrome-associated subfoveal choroidal neovascularization: Vision Preference Value Scale findings from the randomized SST Group H Trial: SST Report No. 17. Arch Ophthalmol 2008; 126(12): 1626-32. 427 82. Sickenberg M, Schmidt-Erfurth U, Miller JW, Pournaras CJ, Zografos L, Piguet B, Donati G, Laqua H, Barbazetto I, Gragoudas ES, Lane AM, Birngruber R, van den Bergh H, Strong HA, Manjuris U, Gray T, Fsadni M, Bressler NM. A preliminary study of photodynamic therapy using verteporfin for choroidal neovascularization in pathologic myopia, ocular histoplasmosis syndrome, angioid streaks, and idiopathic causes. Arch Ophthalmol 2000; 118(3): 327-36. 83. Keam SJ, Scott LJ, Curran MP. Verteporfin : a review of its use in the management of subfoveal choroidal neovascularisation. Drugs 2003; 63(22): 2521-54. 84. Postelmans L, Pasteels B, Coquelet P, Caspers L, Verougstraete C, Leys A, Wirix M, Mauget-Faÿsse M, Quanranta M, Snyers B, Smets E. Photodynamic therapy for subfoveal classic choroidal neovascularization related to punctate inner choroidopathy (PIC) or presumed ocular histoplasmosis-like syndrome (POHS-like). Ocul Immunol Inflamm 2005; 13(5): 361-6. 85. Brancato R, Pece A, Avanza P, Radrizzani E. Photocoagulation scar expansion after laser therapy for choroidal neovascularization in degenerative myopia. Retina 1990; 10: 239-243. 86. Liu JC, Boldt HC, Folk JC, Gehrs KM. Photodynamic therapy of subfoveal and juxtafoveal choroidal neovascularization in ocular histoplasmosis syndrome: a retrospective case series. Retina 2004; 24(6): 863-70. 87. Saperstein DA, Rosenfeld PJ, Bressler NM, Rosa RH Jr, Sickenberg M, Sternberg P Jr, Aaberg TM Sr, Aaberg TM Jr, Reaves TA; Verteporfin in Ocular Histoplasmosis (VOH) Study Group. Photodynamic therapy of subfoveal choroidal neovascularization with verteporfin in the ocular histoplasmosis syndrome: one-year results of an uncontrolled, prospective case series. Ophthalmology 2002; 109(8): 1499-505. 88. Rosenfeld PJ, Saperstein DA, Bressler NM, Reaves TA, Sickenberg M, Rosa RH Jr, Sternberg P Jr, Aaberg TM Sr, Aaberg TM Jr; Verteporfin in Ocular Histoplasmosis Study Group. Photodynamic therapy with verteporfin in ocular histoplasmosis: uncontrolled, open-label 2-year study. Ophthalmology 2004; 111(9): 1725-33. 89. Busquets MA, Shah GK, Wickens J, Callanan D, Blinder KJ, Burgess D, Grand MG, Holekamp NM, Boniuk I, Joseph DP, Thomas MA, Fish E, Bakal J, Hollands H, Sharma S. Ocular photodynamic therapy with verteporfin for choroidal neovascularization secondary to ocular histoplasmosis syndrome. Retina 2003; 23(3): 299-306. 90. Shah GK, Blinder KJ, Hariprasad SM, Thomas MA, Ryan EH Jr, Bakal J, Sharma S. Photodynamic therapy for juxtafoveal choroidal neovascularization due to ocular histoplasmosis syndrome. Retina 2005; 25(1): 26-32. 91. Rosenblatt BJ, Shah GK, Blinder K. Photodynamic therapy with verteporfin for peripapillary choroidal neovascularization. Retina 2005; 25(1): 33-7. 92. Bernstein PS, Horn RS. Verteporfin photodynamic therapy involving the optic nerve for peripapillary choroidal neovascularization. Retina 2008; 28(1): 81-4. 93. Adán A, Navarro M, Casaroli-Marano RP, Ortiz S, Molina JJ. Intravitreal bevacizumab as initial treatment for choroidal neovascularization associated with presumed ocular histoplasmosis syndrome. Graefes Arch Clin Exp Ophthalmol 2007; 245(12): 1873-5. 94. Wecke T, Knop C, Schreiber W, Behrens-Baumann W. [Intraocular injections of bevacizumab in rare indications—two cases]. Ophthalmologe 2009; 106(5): 435-42. 95. Schadlu R, Blinder KJ, Shah GK, Holekamp NM, Thomas MA, Grand MG, Engelbrecht NE, Apte RS, Joseph DP, Prasad AG, Smith BT, Sheybani A. Intravitreal bevacizumab for choroidal neovascularization in ocular histoplasmosis. Am J Ophthalmol 2008; 145(5): 875-8. 96. Liem SE, Armbruster FC. Proton-beam irradiation of subfoveal choroidal neovascular membranes in presumed ocular histoplasmosis syndrome: a case report. J Am Optom Assoc 1998; 69(8): 493-9.