Programación resumida química 10
Anuncio

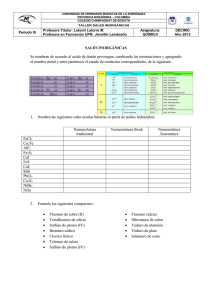
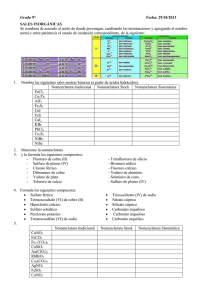
PROGRAMA DE QUÍMICA I. DATOS INFORMATIVOS SECCIÓN: DEPARTAMENTO: CURSO: AÑO LECTIVO: Secundaria Ciencias Experimentales 10A – 10B 2016 II. CONTENIDOS PROGRAMÁTICOS UNIDAD 1: CARACTERIZACIÓN DE LA QUÍMICA Y SU RELACIÓN CON OTRAS DISCIPLINAS. 1.1. Desarrollo histórico, Teoría Atómica Moderna. 1.2. Caracterización de la Química como ciencia y las ramas que la conforman. 1.3. Contribuciones de la Química al mejoramiento de la calidad de vida. 1.4. Materia, energía y temperatura. Conversión de Temperaturas 1.5. La materia. Propiedades físicas y químicas. Cambios Físicos y Químicos. Estados de agregación. 1.6. Propiedades de los metales, No metales y Metaloides. Febrero-Marzo UNIDAD 2: CLASIFICACIÓN EN ELEMENTOS, COMPUESTOS Y MEZCLAS. 2.1. Elementos esenciales. 2.2. El átomo partícula fundamental de los elementos. 2.3. Partículas subatómicas, número atómico y másico, isótopos, masa atómica promedio, cálculo de fórmula simple o empírica y fórmula molecular. 2.4. Cálculos químicos 2.5. Cuadernillo digital: formación de iones e isótopos. Beneficios de la energía nuclear. Marzo UNIDAD 3: LA MATERIA Y SU INTERIOR I. 3.1. Modelos atómicos. 3.2. Breve desarrollo histórico de los modelos atómicos. 3.3. Cuadernillo digital. Prácticas de modelos atómicos. Abril-Mayo UNIDAD 4: LA MATERIA Y SU INTERIOR II. 4.1. Números cuánticos. 4.2. Orbitales atómicos. 4.3. Configuración electrónica. Configuración por gases nobles. Principio de Pauli, Regla de Hund y Aufbau. 4.4. Elementos que presentan anomalías en su configuración electrónica. 4.5. Electrón diferenciante, electrones de valencia y tronco electrónico. Mayo-Junio UNIDAD 5: TABLA PERIÓDICA DE LOS ELEMENTOS. 5.1. Breve desarrollo histórico. 5.2. Organización actual de la Tabla Periódica. Períodos, Familias y Bloques. Elementos Representativos, Elementos de Transición y Elementos de Transición interna. 5.3. Propiedades periódicas: radio atómico (y radio iónico), afinidad electrónica, potencial o energía de ionización y electronegatividad. Julio-Agosto UNIDAD 6: EL ENLACE QUÍMICO. 6.1. Formación de compuestos. 6.2. Reacción química. Leyes que rigen las Combinaciones químicas. Representación de compuestos: fórmula molecular y estructural. 6.3. Formas de enlace químico. Regla del octeto. Enlace iónico o electrovalente, covalente polar y no polar, metálico. Enlaces: Coordinados, Sencillos, dobles y triples. Estructuras de Lewis (también incluye radicales). Enlaces coordinados o dativos y octeto expandido. 6.4. Propiedades de los compuestos que presentan enlace iónico y covalente. El enlace metálico, Teoría del mar de electrones, Propiedades de los metales. Estructura de la materia. 6.5. Geometría molecular. 6.6. Hibridación de orbitales. Hibridación del Berilio, Boro y Carbono. 6.7. Enlaces sigma y pi. 6.8. Fuerzas de Enlace. Fuerzas interiónicas e intermoleculares. AgostoSetiembre UNIDAD 7: NOMENCLATURA DE COMPUESTOS BINARIOS. 7.1. Cálculo de números de oxidación. 7.2. Clasificación de compuestos binarios: hidrácidos, hidruros metálicos e hidruros no metálicos, óxidos metálicos y no metálicos, sales binarias y compuestos covalentes moleculares. 7.3. Compuestos de Importancia química. 7.4. Nomenclatura de compuestos binarios. Utilización del Sistema Stoke y Sistema estequiométrico. Octubre UNIDAD 8: NOMENCLATURA DE COMPUESTOS TERNARIOS 8.1. Nomenclatura de Compuestos Ternarios: hidróxidos (Bases), sales oxácidas, ácidos oxácidos y sales de amonio ternarias. 8.2. Nomenclatura de Compuestos Cuaternarios: sales ácidas, básicas y sales de amonio cuaternarias. OctubreNoviembre