Simples - Marbioec
Anuncio

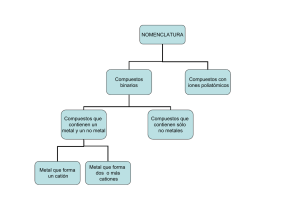
COMPUESTOS INORGÁNICOS Grupo: ______ Equipo: ________ Carrera: __________________________ COMPUESTO DESCRIPCIÓN VARIANTES Aniones – (No Metales) Cationes + (Metales) No. de Prefijos Simples Oxidación Sufijos 7‐‐‐‐‐8 Per‐‐‐‐‐ico Primarios o Monoatómicos 5‐‐‐‐‐6 ‐‐‐‐‐ico 3‐‐‐‐‐4 ‐‐‐‐‐oso 1‐‐‐‐‐2 Hipo‐‐‐‐‐oso FORMULA: Cationes: Ion + Elemento + Terminación oso‐ico + No. de Oxidación en Romano entre (). Na+1 = Ion Sodoso Aniones: Ion + Elemento + Terminación “Uro” H‐ = Ion Hidruro 1 AMAE: Análisis de la Materia y Energía Feb‐Jul‐2012 Semestre: 21112 Docente: L.E. Mariana Muñoz Ibarra Binarios: N. Tradicional: A partir del Catión y su No. de Oxidación Anhídrido + Elemento + terminación oso‐ico N. Stock: A partir del Catión y su No. de Oxidación Óxidos Ácidos Oxido + de + Elemento + No. de Oxidación del Catión en Romano y entre paréntesis. N. Sistemática: A partir de la Formula Prefijo Griego + Elemento (Derecha) + Prefijo Griego + Elemento (Izquierda) FORMULA: Óxidos Ácidos: No Metal + Oxigeno (No. de Oxidación + 2 ) Catión Anión Formula N. Tradicional N. Stock N. Sistemática C+2 O+2 CO Anhídrido Carbonoso Óxido de Carbono (II) Monóxido de Carbono N. Tradicional: A partir del Catión y su No. de Oxidación Binarios: Oxido + Elemento + terminación oso‐ico Cuando el No. de Oxidación es de 1 se le antepone la palabra “de” al nombre del elemento N. Stock: A partir del Catión y su No. de Oxidación Óxidos Básicos Oxido + de + Elemento + No. de Oxidación del Catión en Romano y entre paréntesis. N. Sistemática: A partir de la Formula Prefijo Griego + Elemento (Derecha) + Prefijo Griego + Elemento (Izquierda) 2 FORMULA: Óxidos Básicos: Metal + Oxigeno (No. de Oxidación‐ ) Cation Anion Formula N. Tradicional N. Stock N. Sistemática Mg+2 O‐2 MgO Óxido de Magnesio Óxido de Magnesio Monóxido de Magnesio 2 AMAE: Análisis de la Materia y Energía Feb‐Jul‐2012 Semestre: 21112 Docente: L.E. Mariana Muñoz Ibarra Binarios: ‐ También conocidos como Hidrácidos porque al combinarse con el agua producen soluciones ácidas. ‐ Halógenos: F, Cl, Br, I (Cuando actúan con No. de O. ‐1) y Se, Te, S, (Cuando actúan con No. de O. ‐2) ‐ Ácidos con aniones con terminación –Uro‐ se cambia por la terminación –Hídrico‐ en N. Tradicional. ‐ El Hidrógeno siempre tiene número de oxidación +1 N. Tradicional: A partir del Anión sin importar su No. de Oxidación Ácido + Elemento + Terminación –hídrico‐ Hidruros Ácidos N. Stock: A partir del Anión sin importar su No. de Oxidación Anión con terminación –uro‐ + de + Hidrógeno N. Sistemática: A partir de la Formula Anión con terminación –uro‐ (Derecha) + Prefijo Griego + Hidrógeno (Izquierda) FORMULA: Hidruros Ácidos: Hidrogeno + No Metal (Halógenos) Catión Anión H+1 Se+2 Formula N. Tradicional N. Stock N. Sistemática H2Se Ácido Bromhídrico Selenuro de Hidrógeno Selenuro de dihidrógeno Binarios: ‐ Están formados por no metales como el N, Si, Sb, O, P y As ‐ Se llaman así porque al combinarse con el agua producen soluciones básicas. N. Tradicional: Nombre común a partir del cual se le conoce N. Stock: A partir del Anión y su No. de Oxidación Hidruros Básicos Hidruro + de + Elemento + No. de O. en Romano y entre () N. Sistemática: A partir de la Formula Prefijo Griego + Hidruro (Donde quiera que se encuentre) + Anión 3 AMAE: Análisis de la Materia y Energía Feb‐Jul‐2012 Semestre: 21112 Docente: L.E. Mariana Muñoz Ibarra FORMULA: Hidruros Básicos: No Metal (Halógenos) + Hidrogeno Catión Anión H+1 O‐2 Formula N. Tradicional N. Stock N. Sistemática H2O Agua Hidruro de Oxígeno (II) Dihidruro de Oxígeno ‐ Están formados por la combinación del hidrogeno con No. de O. ‐1 y un metal. N. Tradicional: A partir del Catión y su No. de Oxidación Binarios: Hidruro + Elemento + Prefijos y/o sufijos Cuando el No. de Oxidación es de 1 se le antepone la palabra “de” al nombre del elemento N. Stock: A partir del Catión y su No. de Oxidación Hidruros Metálicos Hidruro + de + Elemento + No. de oxidación en Romano () N. Sistemática: A partir de la Formula Prefijo Griego + Hidruro (Donde quiera que se encuentre) + Catión FORMULA: Hidruros Metálicos: Hidrogeno ‐1 + Metal Catión Anión Al+3 H‐1 Formula N. Tradicional N. Stock N. Sistemática AlH3 Hidruro de Aluminio Hidruro de Aluminio (III) Trihidruro de Aluminio Binarios: N. Tradicional: Anión + terminación –uro‐ + Catión N. Stock: A partir del Anión y su No. de Oxidación Anión + terminación –uro‐ + Catión + No. de O. en Romano y entre () Sales N. Sistemática: A partir de la Formula Prefijo Griego + Anión (Derecha) + de + Prefijo Griego + Catión (Izquierda) 4 AMAE: Análisis de la Materia y Energía Feb‐Jul‐2012 Semestre: 21112 Docente: L.E. Mariana Muñoz Ibarra FORMULA: Hidruros Básicos: Metal + No Metal Catión Anión N+3 I‐1 Formula N. Tradicional N. Stock N. Sistemática NI3 Yoduro Niquélico Yoduro de Níquel (III) Triyoduro de Níquel ‐ Están formados por el hidrogeno (ion positivo) y un ion negativo (ion poliatómico) que contenga oxigeno y un no metal. ‐ Para conocer el No. de O. del No Metal: a) Se plantea la formula de la Molécula‐‐‐‐‐‐‐‐‐‐‐‐H2SO4‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐ b) Determinamos el No. de O. del Oxígeno e Hidrógeno recordando que por regla el primero tiene un No. de O. ‐2 y el segundo de +1. +1 ‐2 H2 S O4 Terciarios: c) Se multiplica el no. de átomos del Oxigeno e Hidrogeno, que indique la molécula, por su número de oxidación establecido. +1 (2) ‐2 (4) +2 ‐8 Oxiácidos H2 S O4 d) Recordando que de acuerdo con las reglas de Estados de Oxidación debe ser igual a cero la suma de los No. de O. de los elementos de un compuesto, y al tener resuelto el paso c, podremos determinar el No. de O. del elemento restante. +2 +6 ‐8 = 0 H2 S O4 e) De acuerdo con los No. de O. del elemento no metal determinaremos su terminación en base a los prefijos y/o sufijos, y finalmente establecer el nombre del compuesto. H2SO4‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐Ácido Sulfúrico 5 AMAE: Análisis de la Materia y Energía Feb‐Jul‐2012 Semestre: 21112 Docente: L.E. Mariana Muñoz Ibarra N. Tradicional: A partir del No Metal y su No. de Oxidación Ácido + No metal + terminación oso‐ico N. Stock: A partir del No Metal y su No. de Oxidación Ácido + Prefijo Griego + Oxo (de Oxígeno) + No. de O. del No Metal en Romano y entre (). N. Sistemática: A partir de la Formula, utilizando las terminaciones ato x ico, ito x oso Prefijo Griego + Oxo (de Oxígeno) + No Metal con terminación ato‐ito + No. de O. del No Metal en Romano y entre () + de hidrógeno FORMULA: Oxiácidos: Hidrógeno (No. de Oxidación + 1 ) + No Metal + Oxigeno (No. de O. variante –1,‐ 2,‐3) Catión Anión Formula N. Tradicional N. Stock N. Sistemática H+1 SO4‐2 H2SO4 Ácido Sulfúrico Ácido Tetraoxosulfúrico (VI) Tetraoxosulfato (VI) de hidrógeno ‐ Terciarios: Resultan de la combinación de un metal (ion positivo) y un ion negativo (ion poliatómico) que contenga oxigeno y un no metal. N. Tradicional: A partir del no metal del anión y su No. de Oxidación No Metal + terminación oso‐ico + de + Metal Oxisales N. Stock: A partir del Catión y su No. de Oxidación No Metal + terminación oso‐ico + de + Metal + No. de Oxidación del Catión en Romano y entre paréntesis. 6 AMAE: Análisis de la Materia y Energía Feb‐Jul‐2012 Semestre: 21112 Docente: L.E. Mariana Muñoz Ibarra N. Sistemática: A partir de la Formula Prefijo Griego + Oxo (de oxígeno) + No Metal del Anión con terminación ato‐ito + No. de O. del Oxígeno entre () + de + Catión. FORMULA: Oxisales: Metal + No Metal + Oxígeno Cation Anion Formula N. Tradicional N. Stock N. Sistemática Al+3 PO3‐3 AlPO3 Fosfito de Aluminio Fosfito de Aluminio Trioxofosfato (III) de Aluminio ‐ Terciarios: Hidróxidos Son compuestos formados por un ión negativo llamado hidróxido (OH) ‐1 y un metal N. Tradicional: Hidróxido + de + Metal con terminación oso‐ico N. Stock: A partir del Catión y su No. de Oxidación Hidróxido + de + Metal + No. de Oxidación del Catión en Romano entre (). N. Sistemática: A partir de la Formula Prefijo Griego + Hidróxido + de + Metal. FORMULA: Hidróxidos: Metal + Oxígeno + Hidrógeno Cation Anion Formula N. Tradicional N. Stock N. Sistemática B+3 OH‐1 B(OH)3 Hidróxido de Boro Hidróxido de Boro (III) Trihidróxido de Boro 7 AMAE: Análisis de la Materia y Energía Feb‐Jul‐2012 Semestre: 21112 Docente: L.E. Mariana Muñoz Ibarra