ESTUDIO DE LA FORMACIÓN DEL COMPLEJO Fe(SCN)+2
Anuncio

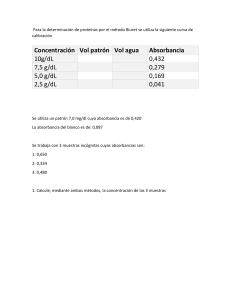
ESTUDIO DE LA FORMACIÓN DEL COMPLEJO FE(SCN)+2 Jenny Carolina Fraile Beltrán Daniel Esteban Arias Ramírez OBJETIVOS Estudiar el equilibrio entre el ion Fe3+ y el ion SCN- utilizando el método colorimétrico. Medir la absorbancia de varias mezclas de soluciones que se encuentran en diferentes proporciones del ion Fe3+ y el ion SCN-. Utilizar el método de Job para encontrar la fórmula del complejo formado (Fe(CNS)2+). MARCO TEÓRICO La estabilidad termodinámica de un complejo se expresa mediante la constante de equilibrio 𝑀𝑒+𝑦 + 𝐿 → 𝑀𝑒𝐿𝑛 +𝑦 La transmitancia, T se define como la fracción de la luz incidente que pasa a través de la muestra: 𝑃 𝑇= 𝑃0 MARCO TEÓRICO La absorbancia se define cómo: 𝐴𝑏𝑠 = 𝐿𝑜𝑔 𝑃 = −𝐿𝑜𝑔𝑇 𝑃0 𝐿𝑒𝑦 𝑑𝑒 𝐵𝑒𝑒𝑟: 𝐴 = 𝜀𝑏𝑐 La concentración de la muestra, c, el camino óptico o longitud de celda, b, y la cantidad ε es simplemente un coeficiente de proporcionalidad MARCO TEÓRICO Método de variaciones continuas o método de Job Consiste en mezclar alícuotas de disoluciones equimolares del ligando y del ion coordinado, de forma que la concentración total (formal) permanezca constante METODOLOGÍA Preparar soluciones 0,002 M de Fe+3, y HNO3 0,02M, (una sola solución), y 0,002 M SCN- y 0,03M HCl (una solución) Preparar 21 soluciones de manera que posean fracciones molares desde 1 a 0 Medir la absorbancia a 410 nm Usar como blanco agua destilada RESULTADOS RESULTADOS Constante Concentració Máxima Concentración Absorbancia inicial 0,98 0,001 de Concentración n en έ del complejo equilibrio formación 980 9,64E-04 3,57E-05 756000 RESULTADOS 𝐹𝑒 +3 − + 𝑆𝐶𝑁 ↔ 𝐹𝑒(𝑆𝐶𝑁) 𝑘𝑓 = 𝐹𝑒(𝑆𝐶𝑁)2+ 𝑆𝐶𝑁− 𝐹𝑒+3 2+ CONCLUSIONES La constante de formación del complejo es de 756000. La relación molar entre el catión y el anión es de 1:1 por lo cual la fórmula del complejo es 𝐹𝑒(𝑆𝐶𝑁)2+ . La reacción está muy desplazada a la derecha por lo cual este complejo es muy estable.