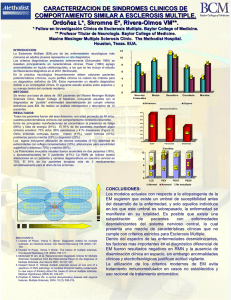
00-aPort Mod_XI_EM.indd - monografías: esclerosis múltiple
Anuncio

Epidemiología de la esclerosis múltiple MONOGRAFÍAS EN ESCLEROSIS MÚLTIPLE MONOGRAFÍAS EN ESCLEROSIS MÚLTIPLE QF-909124 Avalado por Sociedad Española de Neurología EPIDEMIOLOGÍA DE LA E L IP T L Ú M IS S O R E L C S E Las manifestaciones aquí recogidas no reflejan necesariamente la opinión sustentada por Bayer Schering Pharma. © Copyright 2011 de los autores. Monografía XI Fernández de la Hoz, 61, entreplanta. 28003 Madrid Telf.: 91 536 08 14 • Fax: 91 536 06 07 • Correo electrónico: [email protected] Balcells, 21-25, bajos, oficina 1. 08024 Barcelona SV: 61/05 - R – CM • ISSN: 1885-5520 • Depósito legal: Reservados todos los derechos. Ninguna parte de esta publicación puede ser reproducida, transmitida en ninguna forma o medio alguno, electrónico o mecánico, incluyendo fotocopias, grabaciones o cualquier sistema de producción, sin la autorización por escrito de los titulares del copyright. [ Consejo Editorial ] Dr. J. Carlos Álvarez Cermeño Hospital Universitario Ramón y Cajal. Madrid Dr. Txomin Arbizu Urdiain Hospital Universitari de Bellvitge. L’Hospitalet de Llobregat (Barcelona) Dr. Rafael Arroyo González Hospital Clínico San Carlos. Madrid Dr. Bonaventura Casanova Struch Hospital Universitario La Fe. Valencia Dr. Óscar Fernández y Fernández Hospital Regional Universitario Carlos Haya. Málaga Dr. Guillermo Izquierdo Ayuso Hospital Universitario Virgen Macarena. Sevilla Dr. J. Antonio García Merino Hospital Universitario Puerta de Hierro. Madrid Dr. Xavier Montalbán Gairin Hospital Universitari Vall d’Hebron. Barcelona Dr. José M.ª Prieto González Complejo Hospitalario Universitario de Santiago de Compostela (A Coruña) Dr. Alfredo Rodríguez-Antigüedad Hospital de Basurto. Bilbao 3 [ Sumario ] Epidemiología de la esclerosis múltiple El método epidemiológico: conceptos generales y características específicas en la esclerosis múltiple Autora: S. Otero Romero Editores: G. Izquierdo Ayuso, J.C. Álvarez Cermeño ...................... 7 Epidemiología descriptiva de la esclerosis múltiple Autores: Ó. Fernández y Fernández, X. Montalbán Gairin Editores: T. Arbizu Urdiain, J.A. García Merino ........................... 29 Epidemiología analítica Autor: F. García del Carrizo Editores: R. Arroyo González, A. Rodríguez Antigüedad ................. 45 5 [ Índice ] { El método epidemiológico: conceptos generales y características específicas en la esclerosis múltiple } Autora: Susana Otero Romero1 Editores: Guillermo Izquierdo Ayuso2, José Carlos Álvarez Cermeño3 1 Centro de Esclerosis Múltiple de Cataluña y Servicio de Medicina Preventiva y Epidemiología. Hospital Universitario Vall d’Hebron. Barcelona 2 Servicio de Neurología. Hospital Universitario Virgen Macarena. Sevilla 3 Servicio de Neurología. Hospital Universitario Ramón y Cajal. Madrid 1/ Definición y conceptos 2/ Características especiales en la esclerosis múltiple Bibliografía 7 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] Resumen La epidemiología es la disciplina científica que estudia la frecuencia y distribución de los estados relacionados con la salud y sus determinantes en la población, con el objetivo de lograr su prevención y control. El método de investigación epidemiológica se basa en la caracterización de las enfermedades (enfoque descriptivo) y en la elaboración y verificación de las hipótesis causales (enfoque analítico). La capacidad que posea un estudio epidemiológico de dar respuesta al objetivo propuesto dependerá de lo adecuado que sea el diseño elegido. Los estudios epidemiológicos se clasifican según criterios metodológicos (finalidad del estudio, unidad de análisis, direccionalidad, forma de selección de la muestra, relación temporal y control de la asignación del factor a estudio por parte del investigador) y emplean medidas de frecuencia y de asociación. Las medidas de frecuencia (incidencia y prevalencia) permiten caracterizar las enfermedades, ver su evolución a lo largo del tiempo y establecer comparaciones entre distintas poblaciones. Las medidas de asociación evalúan las relaciones, en términos probabilísticos, entre la exposición y la enfermedad. Las particularidades en el estudio de la epidemiología de la EM residen en la dificultad para establecer la definición de los casos y en los mecanismos para identificarlos a nivel poblacional. Por otro lado, es necesario tener en cuenta las características de la población a estudio en términos de tamaño y composición, para poder comparar los resultados con los de otras regiones, extraer conclusiones y establecer hipótesis etiológicas. Por último, el carácter multifactorial de la EM dificulta el abordaje analítico de la enfermedad, debido a que los mecanismos etiológicos de interacción entre genética y ambiente tienen lugar presumiblemente varios años antes del comienzo de las manifestaciones clínicas (periodos de inducción y de latencia). 8 [ El método epidemiológico: conceptos generales y características (…) ] 1/ Definición y conceptos Epidemiología. Concepto y usos La epidemiología es la ciencia que estudia las enfermedades en las poblaciones. Constituye la herramienta básica de investigación en el campo de la medicina preventiva y la salud pública. Etimológicamente, el término epidemiología deriva del griego epi (sobre), demos (pueblo) y logos (ciencia), lo cual subraya su carácter comunitario. Se trata de una disciplina relativamente joven, cuyos primeros estudios publicados datan de mediados del siglo XVI. En el siglo XIX surgen los autores precursores de lo que hoy se considera el método epidemiológico y las primeras definiciones modernas. En el año 1883, Hirsch estableció que la epidemiología era “la descripción de la frecuencia, la distribución y los tipos de enfermedades que afectan al hombre, en distintas épocas y en distintos puntos de la superficie terrestre, así como la relación de dichas enfermedades con las condiciones externas”(1). Durante la segunda mitad del siglo XIX la epidemiología tenía una clara orientación hacia las enfermedades infecciosas, que constituían las principales causas de mortalidad. En este periodo se produjeron importantes avances en el campo de la microbiología y la etiopatogenia de la mano de científicos como Koch, Pasteur o Klebs, lo cual desembocó en un modelo unicausal de pensamiento epidemiológico. En el ámbito poblacional fueron decisivas las investigaciones de John Snow sobre la cadena de transmisión del cólera(2). A lo largo del siglo XX, debido a los avances socioeconómicos, se produjo un cambio en la distribución de las enfermedades en los países industrializados, siendo las enfermedades crónicas –fundamentalmente las cardiovasculares y el cáncer– las principales causas de morbimortalidad. La definición de epidemiología adquirió entonces una aceptación más amplia, pasando a designar el campo de la ciencia médica que se interesa por los factores que determinan la frecuencia y distribución de una enfermedad o un estado fisiológico en una comunidad humana (Kenneth Maxcy, 1951). En aquel momento se desconocían las causas de las enfermedades crónicas, y el método de investigación epidemiológico tuvo que adaptarse para poder abordarlas. Se constató que no era posible identificar un factor imprescindible para que existiera la enfermedad (causa necesaria) y que ningún factor producía de manera irremediable la enfermedad (causa suficiente). Ante la imposibilidad de encontrar elementos causales, surgió el concepto de factor de riesgo, que adquirió gran importancia gracias a los estudios de la cardiopatía isquémica de Framingham(3) o los que exploraron la relación entre el cáncer de pulmón y el tabaco de Richard Doll(4). Los factores de riesgo son todas aquellas características genéticas, fisiológicas o de comportamiento de los individuos que condicionan una mayor probabilidad de desarrollar un problema de salud. Actualmente, la epidemiología se considera la disciplina científica que estudia la frecuencia y distribución de los estados relacionados con la salud y sus determinantes en las poblaciones, con el objetivo de lograr su prevención y control. En este sentido, la epidemiología actual se centra en el estudio de las enfermedades y de otros aspectos que 9 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] puedan tener repercusiones en el estado de salud de los individuos (la lactancia materna, el tabaquismo, la nutrición...)(5). El principal objetivo de la epidemiología es desarrollar conocimientos que tengan aplicación a nivel poblacional, convirtiéndose así en una herramienta básica de la salud pública. El método epidemiológico tiene dos enfoques principales, el descriptivo y el analítico. El enfoque descriptivo incluye las investigaciones encaminadas a caracterizar una enfermedad en una determinada población en términos de tiempo, lugar y persona. Con ello se pretende dar respuesta a cuestiones como ¿cuál es la magnitud de la enfermedad en ese medio?, ¿afecta por igual a todos los grupos de edad?, ¿es más frecuente en zonas urbanas?, ¿está aumentando a lo largo de los años? Esta información es útil para la toma de decisiones en ámbitos de actividad asistencial, gestión sanitaria e intervenciones en salud pública. El enfoque descriptivo constituye asimismo una fuente de hipótesis sobre el posible origen de las enfermedades estudiadas. El enfoque analítico incluye investigaciones dirigidas al estudio de los determinantes, es decir, aquellos factores físicos, biológicos, sociales, culturales y de comportamiento que influyen en los fenómenos de salud y enfermedad de las poblaciones. El objetivo es establecer la relación entre determinados factores y las enfermedades, y comprobar si esta relación es de tipo causal, lo cual podría tener implicaciones en las medidas de control y prevención. El concepto de población es esencial en el campo de la epidemiología. A diferencia de los sistemas sanitarios que han sido diseñados en torno a la población con problemas de salud, la epidemiología y la salud pública tienen responsabilidad sobre el total de la población. Esto supone que debe abarcar tanto a las personas sanas como a aquéllas con riesgo de padecer problemas de salud en el futuro, aquéllas con enfermedades en estadios subclínicos y aquéllas con enfermedad manifiesta. Esto hace referencia al modelo del iceberg, según el cual la cantidad de enfermedad detectable en una población constituye sólo una pequeña parte de todos los casos, ya que existe una importante proporción de casos subclínicos. Este modelo tiene especial relevancia para las enfermedades infecciosas, en las que los casos sin sintomatología escapan a las medidas de control poblacionales y contribuyen a mantener la transmisión de la enfermedad. A continuación, se describen los distintos usos de la epidemiología para el control de los problemas de salud (Figura 1). a) Establecer la magnitud, distribución y tendencias de la salud-enfermedad Uno de los parámetros iniciales más utilizados para caracterizar el estado de salud-enfermedad de las poblaciones, por su carácter objetivo e irreversible, fue la tasa de mortalidad. No obstante, esta tasa no refleja necesariamente el nivel de enfermedad en la población y puede ser poco precisa en países con registros de mortalidad deficitarios(6). Más adelante se procedió a estudiar las enfermedades, lo cual resulta complejo en ausencia de registros. Así, un investigador que quiera establecer la magnitud de una determinada patología en una población debería hacer una búsqueda activa de casos preguntando casa por casa, como hizo John Snow en el estudio del brote de cólera en Londres(2). La aparición de determinadas enfermedades como la viruela, el cólera o la peste, que suponían una grave amenaza por su transmisibilidad y mortalidad, impulsó el empleo de registros y sistemas de notificación de carácter internacional. Actualmente, los sistemas de notificación se han extendido a un mayor número de enfermedades consideradas de 10 [ El método epidemiológico: conceptos generales y características (…) ] Estudio de la enfermedad en la población • Frecuencia • Distribución espacial y temporal • Historia natural • Factores determinantes • Causalidad • Prevención y control • Planificación sanitaria (necesidades, recursos…) • Detección de nuevas enfermedades • Evaluación de estrategias comunitarias Figura 1. Concepto y usos de la epidemiología. declaración obligatoria. En el año 2005 la Organización Mundial de la Salud estableció una regulación sanitaria internacional con la finalidad de identificar, proteger y controlar la diseminación internacional de enfermedades. Así, 197 países acordaron implementar dicha regulación, que implica la declaración de las “emergencias de salud pública de importancia internacional”, es decir, todos aquellos eventos extraordinarios que constituyan un riesgo para la salud pública y que podrían exigir una respuesta internacional coordinada(7). b) Investigar los determinantes de la salud-enfermedad y establecer causalidad Una vez descrita la magnitud de la enfermedad en una determinada población, el paso inmediatamente siguiente es tratar de establecer los posibles factores relacionados. Esto ha sido especialmente relevante en los últimos años en el campo de las enfermedades crónicas. Así, por ejemplo, el estudio Framingham(3), realizado sobre una amplia cohorte de individuos, permitió conocer que el tabaquismo, la presión arterial, la colesterolemia, la intolerancia a la glucosa o la hipertrofia ventricular izquierda son algunos de los principales factores de riesgo de la cardiopatía isquémica. La presencia de una asociación entre un determinado factor y una enfermedad puede deberse a diversas circunstancias, sin implicar necesariamente una relación de tipo causal. De hecho, la evidencia epidemiológica por sí sola raramente es suficiente para determinar causalidad, aunque puede ser orientativa. Bradford Hill estableció una serie de criterios cuya presencia hace muy probable que la relación entre un potencial factor etiológico y una enfermedad sea de tipo causal(8): • Fuerza de la asociación. Las asociaciones fuertes tienen menor probabilidad de ser debidas a factores confusores. 11 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] • Consistencia de la asociación. La misma asociación se observa en otras poblaciones y otras circunstancias, lo que hace poco probable que exista un sesgo común a todas las observaciones. • Especificidad de la asociación. Una determinada exposición provoca una única enfermedad y, a su vez, una enfermedad está causada por un determinado factor. Ésta es la presunción de causalidad más débil, dado que en la actualidad se sabe que muchas enfermedades, fundamentalmente las crónicas, están causadas por la interacción de más de un factor, y existen factores, como, por ejemplo, el tabaco, que son responsables de más de una enfermedad. • Temporalidad. La exposición debe preceder a la enfermedad. Es un criterio absoluto de causalidad. • Gradiente biológico. La existencia de un gradiente dosis-respuesta es orientativa de que la relación observada no está confundida por otro factor. El riesgo de la enfermedad aumenta con el incremento de la exposición (o la disminución, en el caso de factores protectores). • Plausibilidad. La asociación tiene sentido desde el punto de vista biológico. • Coherencia. La asociación concuerda con el conocimiento actual disponible acerca de la enfermedad. • Evidencia experimental. El efecto puede ser alterado (aumentado, disminuido, anulado) en condiciones experimentales. • Analogía. Asociaciones causales similares pueden producir enfermedades similares. c) Conocimiento de la historia natural de la enfermedad La epidemiología permite medir el tiempo de inducción o incubación de las enfermedades. En las enfermedades infecciosas basta calcular la diferencia entre el momento en que aparece la enfermedad y aquel en el que se produjo el contagio. El tiempo de incubación es útil para poder controlar los brotes y epidemias, ya que establece el tiempo durante el cual las personas potencialmente infectadas deben mantenerse fuera del contacto con el resto de la comunidad para evitar el contagio(9). En el caso de las enfermedades crónicas, en las que la exposición al factor de riesgo dura varios años, la medida del tiempo de inducción es más compleja. Geoffrey Rose observó que la relación entre la colesterolemia y la mortalidad por cardiopatía isquémica en cohortes independientes era más fuerte en mediciones hechas muchos años antes del inicio de la enfermedad y estableció que el tiempo de incubación debía ser al menos de 10 años(10). La epidemiología también permite evaluar el pronóstico de una enfermedad, para lo cual es necesario seguir a lo largo del tiempo a un grupo de sujetos en los que se medirá la variable considerada (diseminación, nuevo brote, muerte…). Asimismo, permite establecer la eficacia de medidas preventivas y terapéuticas, es decir, sus beneficios cuando se administran en las mejores condiciones posibles, con pacientes que reúnen todas las indicaciones de tratamiento y que presentan un grado de cumplimiento terapéutico óptimo. Por último, es posible estimar la efectividad de las intervenciones sanitarias, es decir, sus beneficios cuando se administran en las condiciones habituales de la práctica clínica. Esta actividad de investigación recibe el nombre de outcomes research o investigación sobre las consecuencias de la práctica clínica. 12 [ El método epidemiológico: conceptos generales y características (…) ] d) Identificar nuevas enfermedades y amenazas para la salud La descripción de una agrupación temporo-espacial de sujetos que presentan una clínica similar ha permitido identificar enfermedades previamente desconocidas como la legionelosis, el sida o la enfermedad de Lyme. Por otro lado, los sistemas de vigilancia y monitorización epidemiológica permiten detectar variantes de enfermedades ya conocidas, como el virus influenza H1N1 descrito en el año 2009, o la presencia de determinadas amenazas para la salud (nuevos hábitos en la población, sustancias contaminantes ambientales…)(11). Diseño de estudios epidemiológicos El método de investigación epidemiológica consta de las siguientes etapas: observación y descripción de la realidad, elaboración de hipótesis, verificación de la hipótesis e inferencia causal(12). Un estudio epidemiológico es aquella actividad en la que se aplica el método epidemiológico para profundizar en el conocimiento de temas relacionados con la salud. La validez de la información derivada de los estudios epidemiológicos depende en gran medida de lo adecuados que sean los métodos utilizados. El punto de partida de un estudio epidemiológico implica identificar el problema de investigación, es decir, aquella cuestión a la que se pretende dar respuesta y que se formulará como objetivo de la investigación. Para ello es necesario tener un conocimiento extenso y actualizado del tema que será objeto del estudio. A continuación, es necesario elegir el diseño, es decir, la estrategia que se seguirá para cumplir los objetivos establecidos. El diseño hace referencia a la metodología que utilizaremos para definir nuestra población de estudio, determinar el tamaño muestral y seleccionar los sujetos. En el diseño debe incluirse también la definición de las variables, las fuentes de información que se van a utilizar, y cómo se van a desarrollar el procesamiento y análisis de los datos. Por último, se deben interpretar los resultados obtenidos y se han de comparar con otras investigaciones que se hayan llevado a cabo en el mismo campo; asimismo, han de analizarse las posibles limitaciones en el diseño. Clasificación de los estudios epidemiológicos El hecho de establecer una clasificación de los estudios proporciona una terminología para la comunicación entre los profesionales, facilita la transmisión del conocimiento y ayuda a prever los posibles sesgos y las limitaciones en función del tipo de estudio. La mayoría de las clasificaciones se basan en criterios comunes: la finalidad del estudio, la unidad de análisis, la direccionalidad, la forma de selección de la muestra, la relación temporal y el control de la asignación del factor a estudio por parte del investigador(13) (Figura 2). a) Finalidad Los estudios epidemiológicos se clasifican según su finalidad en descriptivos y analíticos. Los estudios descriptivos estudian la frecuencia y distribución de las enfermedades en una población y entre distintas poblaciones, mientras que los estudios analíticos evalúan los 13 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] Estudios descriptivos Unidad de estudio: población Unidad de estudio: individuo Hipótesis Estudios analíticos Estudios observacionales Estudios experimentales Estudio de cohortes Estudio de casos y controles Estudio ecológico Estudio transversal Ensayo clínico Figura 2. Tipos de estudios epidemiológicos. posibles determinantes de la enfermedad y las relaciones de causa-efecto. Así, los estudios descriptivos tratan de dar respuesta a preguntas sobre dónde, cuándo, quiénes y cómo; mientras que los estudios analíticos tienen por objeto responder al porqué de los fenómenos de salud y enfermedad. A su vez, los estudios analíticos pueden clasificarse en observacionales o experimentales, y se describirán más adelante. b) Unidad de análisis Todos los estudios epidemiológicos tienen en común que analizan problemas de salud en la población; no obstante, la unidad de análisis puede ser el individuo, cuando se utilizan datos desagregados de cada sujeto, o bien las poblaciones, cuando se utilizan datos agregados de grupos de individuos (países, regiones, ciudades, distritos, familias, colegios, empresas, etc.). Éstos suelen llamarse estudios ecológicos. En ellos las variables se miden a nivel poblacional o grupal y presentan la limitación de que los resultados obtenidos a nivel grupal pueden no ser ciertos a nivel individual (falacia ecológica). c) Direccionalidad Kramer y Boivin proponen clasificar los estudios según su direccionalidad atendiendo al momento en que acontece el evento de interés (la variable respuesta)(14). Así, si los sujetos están libres del evento de interés al iniciar su participación en el estudio, la direccionalidad es hacia delante, con una secuencia desde la causa al efecto, y el diseño se considera de tipo prospectivo. En ellos se seleccionan los sujetos en función de la exposición, y se evalúa la aparición del efecto tanto en las personas expuestas como en las no expuestas. Ésta es la característica fundamental de los estudios de cohortes. 14 [ El método epidemiológico: conceptos generales y características (…) ] Si, por el contrario, el evento ya se ha producido al comienzo del estudio y el investigador planea reconstruir su aparición en el pasado utilizando registros o entrevistando a los sujetos, la direccionalidad es hacia atrás, con una secuencia desde el efecto a la causa, y el diseño se considera de tipo retrospectivo. En este caso, los sujetos se seleccionan en función del evento de estudio, es decir, se elige de manera independiente un grupo de sujetos que presenta el evento (casos) y un grupo que no lo tiene (controles), y se determina la exposición para ambos grupos. Este diseño es el que caracteriza a los estudios de casos y controles. Los diseños de tipo prospectivo y retrospectivo se engloban bajo el término estudios longitudinales y permiten establecer el orden en el que se producen los acontecimientos en el tiempo, lo que constituye un argumento fundamental para demostrar relaciones de tipo causal. En general, se puede afirmar que los estudios prospectivos tienen mayor fuerza para evaluar causalidad, dado que en ellos se pueden planificar con antelación los instrumentos para la medición y el registro del evento, los cuales proporcionan mayor calidad. En cambio, en los estudios retrospectivos, los registros del evento y las medidas de la exposición dependen de instrumentos que no fueron diseñados explícitamente para responder a los objetivos de la investigación. Cuando la selección de los sujetos en el estudio se hace sin tener en cuenta el momento de la exposición y del evento y ambos son evaluados de forma simultánea, se trata de un estudio transversal, que se caracteriza por que se hace una única medición en el tiempo para cada sujeto. Estos estudios no permiten establecer relaciones de tiempo causal, y las asociaciones identificadas entre evento y exposición deben interpretarse con mucha cautela. No obstante, son útiles para caracterizar el estado de salud de las poblaciones y para la toma de decisiones en materia de planificación sanitaria. d) Control de la asignación de los factores de estudio Los estudios experimentales son aquellos de tipo analítico en los que el investigador controla la asignación de la exposición a estudio. Por razones éticas, suelen limitarse exclusivamente a evaluar intervenciones terapéuticas o preventivas. En ellos, las alternativas a la exposición deben ser igualmente aceptables en función del conocimiento que se tiene del tema. Es deseable que la asignación de la exposición se haga de forma aleatoria y que los grupos de comparación difieran exclusivamente en la presencia o ausencia del factor objeto de estudio. En la práctica, se considera aceptable si la variabilidad de factores distintos del que es objeto de estudio es suficientemente pequeña como para no afectar sustancialmente a los resultados. Los estudios observacionales son todos aquellos en los que el investigador no controla la asignación de la exposición, limitándose a analizar los factores cuya presencia o ausencia en los individuos se ha producido por un motivo independiente a la investigación. Medidas de frecuencia y asociación Para poder cuantificar y extraer conclusiones sobre los fenómenos observados en los estudios epidemiológicos, las relaciones entre las variables (exposición y enfermedad) se traducen en términos probabilísticos. Se trata de establecer cuál es la probabilidad de que un determinado factor sea el responsable de la aparición del evento considerado. Para 15 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] cumplir con este objetivo, la investigación epidemiológica se basa en la construcción de medidas de frecuencia y de asociación o efecto. Medidas de frecuencia Las medidas de frecuencia (incidencia y prevalencia) se emplean en los estudios descriptivos, ya que permiten caracterizar una determinada enfermedad en una población, ver su evolución a lo largo del tiempo y establecer comparaciones entre distintas poblaciones. Para ello, se emplean cifras relativas en forma de proporción y tasas que son independientes del tamaño de la población estudiada. La incidencia expresa el número de casos nuevos que aparecen en una población durante un periodo determinado, así como la velocidad con la que lo hacen. Es una medida de la probabilidad de enfermar. Los estudios de incidencia parten de poblaciones de individuos susceptibles libres del evento, poblaciones en las cuales se observa la aparición de casos nuevos a lo largo de un periodo de seguimiento. De esta manera, los resultados permiten establecer relaciones de causa-efecto entre las características de la población y las enfermedades. La incidencia puede medirse a través de la tasa de incidencia y mediante la incidencia acumulada. La tasa de incidencia (también denominada densidad de incidencia) expresa la aparición de la enfermedad en la población en relación con unidades de persona-tiempo a riesgo, por lo que mide la velocidad de aparición de la enfermedad. Mide el potencial instantáneo de cambio en el estado de salud por unidad de tiempo, durante un periodo específico, en relación con el tamaño de la población susceptible en el mismo periodo. Para que una persona se considere expuesta al riesgo en el periodo de observación, debe iniciar éste sin tener la enfermedad. El cálculo del denominador de la tasa de incidencia se realiza sumando los tiempos libres de enfermedad de cada uno de los individuos que conforman el grupo y que permanecen en el estudio durante el periodo. La tasa de incidencia no es una proporción –como lo son la prevalencia y la incidencia acumulada–, dado que el denominador expresa unidades de tiempo y, en consecuencia, mide casos por unidad de tiempo. La incidencia acumulada, en cambio, expresa únicamente el número de casos nuevos ocurridos en una población durante un periodo, y mide la probabilidad de que un individuo desarrolle el evento en estudio en el periodo considerado si todos sus miembros fuesen susceptibles de ella y ninguno de ellos falleciese o abandonase dicha población. La incidencia acumulada es una proporción y, por lo tanto, sus valores sólo pueden variar entre 0 y 1. La prevalencia hace referencia al número de individuos que padecen una determinada enfermedad en un momento específico en relación con la población total. Dado que se trata de una proporción, no tiene dimensiones y nunca puede tomar valores menores de 0 o mayores de 1. Generalmente se expresa como casos por 1.000 o por 100 habitantes. Las variaciones en la prevalencia dependen del equilibrio entre los casos de enfermedad que “aparecen” y los que “desaparecen”. El aumento de la incidencia, la mejora en las técnicas diagnósticas para la detección de casos o la inmigración de individuos enfermos a la población son factores que incrementan la prevalencia. Por otro lado, el incremento en la duración de la enfermedad debido a una mayor supervivencia o al inicio en edades 16 [ El método epidemiológico: conceptos generales y características (…) ] más jóvenes son situaciones que también contribuyen al incremento de la prevalencia por reducción de los casos que desaparecen. Considerando que es una medida que depende en gran parte de factores no relacionados directamente con la etiología de la enfermedad, los estudios de prevalencia no proporcionan hipótesis etiológicas, aunque a veces puedan sugerirlas. Sin embargo, son útiles para valorar las necesidades asistenciales y planificar los servicios de salud. Medidas de asociación Las medidas de asociación son indicadores que evalúan la fuerza con la que una determinada enfermedad o evento de salud (efecto) se asocia con un determinado factor (posible causa). Epidemiológicamente, las medidas de asociación son comparaciones entre la frecuencia de la enfermedad en las personas expuestas al factor estudiado y la frecuencia de la enfermedad en las personas que no se expusieron al factor estudiado. Estadísticamente, estos indicadores miden la magnitud de la diferencia observada y, por tanto, la fuerza con la que la exposición se asocia a la enfermedad. Las medidas de asociación más sólidas se calculan utilizando la incidencia. En ellas el efecto (el evento o la enfermedad) es posterior a la causa (la exposición), y existe una correcta relación temporal entre ambas. En las situaciones en las que no es posible calcular la incidencia, como en los estudios transversales o en los retrospectivos, puede estimarse la asociación entre el evento y la exposición comparando las prevalencias. Las medidas de asociación se obtienen dividiendo la frecuencia en un grupo expuesto entre la frecuencia de un grupo no expuesto. El resultado representa cuántas veces más (o menos) ocurrirá el evento en el grupo expuesto al factor, comparado con el grupo no expuesto. Si el resultado es 1, indica ausencia de asociación, no asociación o valor nulo. Valores inferiores a 1 indican asociación negativa o factor protector, y valores superiores a 1 indican una asociación positiva o factor de riesgo. Conforme el resultado se aleja más de la unidad, la asociación entre el factor y la enfermedad es más fuerte. Así, por ejemplo, un valor de 4 indica que el riesgo de enfermar entre los expuestos es 4 veces mayor que entre los no expuestos. Asimismo, un valor de 0,25 indicaría que el riesgo de enfermar entre los expuestos es 4 veces menor que entre los no expuestos. La incidencia y la mortalidad son las medidas de frecuencia más utilizadas en la construcción de las medidas de razón. Utilizando la densidad de incidencia se calcula la razón de densidad de incidencia, y con la incidencia acumulada se obtiene la razón de incidencia acumulada, también llamada riesgo relativo (RR). Ambas medidas permiten asumir inferencia etiológica, ya que siempre implican la posibilidad de establecer adecuadamente una relación de temporalidad causal. La razón de productos cruzados (odds ratio [OR]) se obtiene a través del estudio de casos-control en los que no es posible determinar la incidencia. Sin embargo, puede constituir un buen estimador de la razón de densidad de incidencia, principalmente cuando los controles son representativos de la población de la que han sido seleccionados los casos. El resultado se interpreta de la misma forma que en el resto de las medidas de razón. Cuando la OR tiene un valor de 1 (o nulo) el comportamiento del factor es indiferente; si el valor es superior a 1, el factor puede considerarse como de riesgo, y si es inferior a 1, es valorado como factor protector. 17 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] 2/ Características especiales en la esclerosis múltiple Las enfermedades crónicas, entre ellas la esclerosis múltiple (EM), son trastornos orgánicos o funcionales que obligan a una modificación del modo de vida del individuo y presentan un curso prolongado, generalmente discapacitante, sin resolución espontánea y raramente curan de forma completa(15). Son enfermedades que precisan mucho tiempo para establecerse, comenzando en edades jóvenes, con largas fases presintomáticas. En la gran mayoría de las ocasiones la causa es desconocida y tienen un carácter multifactorial, como resultado de múltiples pequeñas influencias que condicionan la probabilidad de desarrollar la enfermedad(6). El proceso etiológico de la EM incluye una serie de eventos que podrían traducir la acción de los distintos factores responsables de la enfermedad (Figura 3). El tiempo transcurrido entre la acción de las causas primarias y el inicio de la enfermedad es el periodo de inducción, en el que actúan los primeros factores causantes del mecanismo etiológico, siendo la genética el más precoz de todos ellos. Según Poser, durante este periodo el individuo desarrolla el “rasgo de EM” (multiple sclerosis trait), que equivale a la fase premórbida, caracterizada por una hiperreactividad inmunológica, con respuesta exacerbada frente a una serie de antígenos virales y vulnerabilidad de la barrera hematoencefálica, sin presencia de lesiones en la mielina(16). El tiempo transcurrido entre el inicio de los cambios patológicos característicos de la enfermedad y las primeras manifestaciones clínicas constituye el periodo de latencia y sería virtualmente nulo si se pudiera diagnosticar la EM en su fase presintomática. Sin embargo, este periodo también podría reflejar un rasgo del proceso etiológico, lo que indicaría que los factores causales de los cambios etiopatogénicos son necesarios pero no Periodo de inducción Periodo de latencia (prepatológico) Periodo de evolución (preclínico) MS trait (clínico) Inicio SCA Pre y perinatal Factores predisponentes Infancia Adolescencia Factores precipitantes EM Edad adulta Factores de evolución Figura 3. Etiopatogenia de la esclerosis múltiple. SCA: síndrome clínico aislado; EM: esclerosis múltiple; MS trait: rasgo de EM. 18 [ El método epidemiológico: conceptos generales y características (…) ] suficientes. En este sentido, para el desarrollo completo de la enfermedad sintomática, sería necesaria la presencia de otros factores precipitantes que actuarían durante el periodo de latencia. En la práctica, los periodos de inducción y de latencia son indistinguibles y de larga duración, lo cual dificulta la identificación de las causas de la enfermedad y aumenta el riesgo de confusión, al considerar como factores causales aquellos que han actuado cuando la enfermedad ya estaba iniciada(9). Todas estas características particulares condicionan la complejidad en el abordaje epidemiológico de la EM desde el punto de vista de la vigilancia, la prevención y el control. Al aplicar la estructura del método epidemiológico al estudio de la EM se deben considerar tres etapas. La primera consiste en describir la enfermedad en la población para responder a preguntas como cuánta EM hay y cómo se distribuye. En segundo lugar, atendiendo a los resultados descriptivos y poniéndolos en relación con datos de otras regiones del mundo, se formulan hipótesis sobre la etiología de la enfermedad. En tercer lugar, se comprueban dichas hipótesis etiológicas. A continuación, se exponen las particularidades metodológicas del estudio de la EM para cada una de estas etapas. Descripción de la enfermedad Los sistemas de vigilancia y registros poblacionales permiten conocer de forma precisa la magnitud de las enfermedades y sus posibles determinantes. En la mayoría de las enfermedades crónicas, estos sistemas están poco desarrollados y distan mucho de los disponibles para las enfermedades transmisibles, fundamentalmente aquéllas con potencial epidémico. Una aproximación, en ausencia de datos poblacionales, se basa en la información aportada por el análisis de la mortalidad. Sin embargo, en enfermedades como la EM –que causan importante discapacidad, pero que con menor frecuencia son mortales–, el análisis de la mortalidad no refleja la carga de enfermedad en la población. En este caso, la información sobre la carga de la enfermedad procede de estudios descriptivos de incidencia y prevalencia de la enfermedad, realizados a partir de los registros, de las bases de datos de los servicios sanitarios y de las encuestas poblacionales(17). El concepto de incidencia aplicado a la EM tiene una serie de matices que se deben tener en cuenta. Conceptualmente la incidencia representa el número de casos nuevos de la enfermedad por unidad de tiempo en una población determinada. Sin embargo, no existe un criterio único para establecer la aparición de un nuevo caso de EM. Se puede considerar nuevo en el momento en que se diagnostica la enfermedad o en el momento en que aparecen los primeros síntomas sugestivos de desmielinización (brote clínico aislado), que, tras un lapso variable de tiempo, pueden ser catalogados de EM. Teniendo en cuenta el significado último de la tasa de incidencia, que refleja la fuerza etiológica de la enfermedad, en el caso concreto de la EM, se puede afirmar que el momento del diagnóstico no es etiológicamente relevante y no refleja la “intensidad de aparición” de la enfermedad. El momento del diagnóstico viene determinado por la capacidad de detección de casos, que a su vez depende de la cobertura sanitaria y de la disponibilidad y del grado de entrenamiento de los neurólogos en la población considerada(18). Si se considera el momento de inicio de los síntomas, la incidencia refleja con mayor fiabilidad el impacto de la enfermedad en una determinada comunidad y, si se determina 19 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] sobre una población homogénea desde un punto de vista genético, puede orientar sobre la influencia de factores ambientales(19). De la misma forma, el concepto de “caso prevalente” de EM también se puede matizar. En general, los estudios de prevalencia determinan el número de pacientes con diagnóstico de EM el día de prevalencia acordado. Sin embargo, es posible que el día de prevalencia existan pacientes que cumplan los criterios diagnósticos pero que todavía no hayan sido catalogados como enfermos de EM. En un estudio realizado en Lanzarote en 1981, los autores documentaron haber identificado 2 pacientes con EM, con una prevalencia resultante de 3,3 por 100.000 habitantes. Durante un estudio realizado 6 años después en la misma zona, se incluyeron 9 casos, que supusieron una prevalencia considerablemente mayor (15 casos por 100.000 habitantes). Los autores de este último estudio destacaron que 6 de los 9 pacientes ya tenían criterios confirmatorios de EM, pese a que en aquel momento no habían sido catalogados como pacientes de EM. A raíz de estas observaciones, Poser et al. propusieron el concepto onset-adjusted prevalence, según el cual el cálculo de la prevalencia debería incluir tanto a los pacientes que hayan sido diagnosticados de la enfermedad como a aquellos que tuvieran criterios diagnósticos, pese a que todavía no hubieran sido catalogados como pacientes de EM el día de prevalencia(18). Antes de considerar qué factores pueden estar causando la enfermedad descrita, debemos plantearnos si los resultados obtenidos son válidos y comparables con los de otras regiones. La validez de los parámetros de frecuencia de la enfermedad depende directamente de la precisión del numerador (casos de enfermedad) y del denominador elegido (población a estudio). Para poder determinar si los resultados son comparables con los de otras regiones, es necesario tener en cuenta si en los distintos estudios se está midiendo lo mismo (definición de caso) y si las poblaciones son similares en cuanto a tamaño, estructura y composición. En el cálculo de incidencia y prevalencia de la EM, el numerador está sujeto a importantes errores que tienen que ver fundamentalmente con los criterios diagnósticos empleados y con la capacidad para identificar los casos en la población estudiada. El hecho de que los criterios diagnósticos hayan sufrido modificaciones a lo largo de los años puede condicionar cambios en las tasas de incidencia y prevalencia obtenidos en los estudios epidemiológicos. Esto tiene implicaciones en la interpretación de los resultados, en el valor que se les puede dar a las variaciones de frecuencia de enfermedad a lo largo del tiempo y en la posibilidad de hacer comparaciones entre diversas regiones. La incorporación de los criterios diagnósticos de McDonald permite hacer un diagnóstico más precoz de la enfermedad y detectar una mayor proporción de formas benignas. Esto se ha visto reflejado en una reducción del periodo de latencia diagnóstica y del grado de discapacidad, como se ha documentado en el registro NARCOMS(20) y en las series temporales de Padova y Ferrara(21,22) (Figura 4). De esta forma, las estimaciones de incidencia y prevalencia pueden resultar más altas, y dar una falsa impresión de aumento de la enfermedad en zonas donde los estudios previos habrían utilizado los criterios diagnósticos de Poser. Por otro lado, la escasez de registros poblacionales disponibles dificulta la identificación de casos de EM en los estudios epidemiológicos(23). En ausencia de registros, los investigadores utilizan bases de datos hospitalarias y, por tanto, la identificación de pacientes depende directamente de la calidad en las historias clínicas y de los sistemas de informatización hospitalaria. En países como Italia o España, no se disponía hasta hace 20 [ El método epidemiológico: conceptos generales y características (…) ] pocos años de historias clínicas informatizadas, lo cual pudo ser un factor que contribuyó a que la prevalencia de EM estuviera infraestimada en el sur de Europa y a que las comparaciones con los países del norte no fueran válidas. En la actualidad, Portugal, Grecia y otros países del este de Europa están comenzando a mejorar sus sistemas de identificación de casos(24-26). Otra circunstancia relacionada con las dos anteriores que puede afectar a la calidad del numerador es la posibilidad de que existan pacientes sintomáticos que no hayan sido adecuadamente diagnosticados o que no hayan solicitado atención médica. Esto ocasionaría una infraestimación de las tasas, ya que estos pacientes no estarían incluidos en los cálculos de incidencia y prevalencia, pese a padecer la enfermedad. Este hecho depende de la accesibilidad a la atención médica en la zona, del grado de entrenamiento de los neurólogos y de la disponibilidad de técnicas diagnósticas adecuadas(27). En un estudio realizado en Gröningen (Holanda) se obtuvo una prevalencia de 50 casos por 100.000 habitantes en 1981, y de 76 casos por 100.000 habitantes en 1992. La mayor parte del aumento de la prevalencia se atribuyó a la incorporación de la resonancia magnética al proceso diagnóstico de la enfermedad a partir del año 1985 en esa región(28). 1,0 1980-1984 Probabilidad de no ser diagnosticado 0,8 1985-1989 1990-1994 1995-1999 0,6 2000-2004 0,4 0,2 0,0 0 5 10 15 Latencia diagnóstica 20 25 Figura 4. Reducción de la latencia diagnóstica en función del año de inicio de los síntomas. Fuente: adaptado de R.A. Marrie et al.(20). 21 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] El tamaño y la composición de la población a estudio es un factor que puede afectar a la precisión de las medidas de frecuencia de la enfermedad y a la comparación entre distintas zonas. Los estudios realizados en poblaciones muy grandes (de más de 500.000 habitantes) confieren estimaciones más generalizables, pero están sujetos a una serie de problemas: • Por un lado, es posible que los resultados estén infraestimados por el hecho de que se haya escapado algún caso, ya que el proceso de identificación abarca una población muy amplia. • Por otro lado, realizar un estudio a gran escala conlleva un coste elevado y es difícil aplicar los criterios diagnósticos de forma homogénea. En el caso de las poblaciones pequeñas (de menos de 200.000 habitantes), las estimaciones son más precisas; sin embargo, los resultados no son generalizables a poblaciones más grandes. La composición de la población –en cuanto a las características genéticas y a la distribución por grupos de edad– es clave en la interpretación y comparación de los resultados. En la actualidad, existe una importante evidencia de una predisposición genética en el desarrollo de la EM(29,30). En este sentido, los resultados de frecuencia globales en poblaciones genéticamente heterogéneas son el producto de la contribución de la genética junto con la acción de posibles factores ambientales. Los fenómenos migratorios desde países con bajo riesgo de EM –como los ocurridos en los últimos años en Europa occidental– condicionan un falso efecto de dilución de las tasas y enmascaran la acción de determinados factores ambientales. Un estudio realizado en Hesse (Alemania) demostró que la tasa de prevalencia global (58,3 casos por 100.000 habitantes) estaba infraestimada respecto a su valor en la población autóctona (58,3 casos por 100.000 habitantes) por la presencia de población no germana, cuya prevalencia resultó en 14,3 casos por 100.000 habitantes(31). Por último, la comparación de tasas globales entre poblaciones con una composición de edades diferente tiene poco valor, fundamentalmente en enfermedades cuyo riesgo varía en función de la edad. Considerando que el riesgo de EM alcanza el máximo en torno a los 30 años de edad, si obtenemos dos tasas de incidencia cruda semejantes en dos poblaciones –una de ellas muy envejecida y la otra muy joven–, no podemos concluir que ambas tengan el mismo riesgo. La estandarización de tasas a una población de referencia permite salvar esta dificultad. Esta metodología consiste en trasladar las tasas obtenidas en cada una de las poblaciones origen a una de referencia acordada. Zivadinov et al.(32) recopilaron los resultados crudos (no estandarizados) obtenidos en diversos estudios de prevalencia e incidencia realizados entre las latitudes 40º y 60º, y los estandarizaron según las poblaciones europea y mundial. Estos autores observaron que, tras la estandarización, el efecto de la latitud se suavizaba para las tasas de prevalencia y desaparecía para la incidencia. Estos resultados cuestionan el clásico gradiente latitudinal descrito para la EM, y los autores plantean si esa distribución podría explicarse por la falta de estandarización en los estudios descriptivos publicados. Hipótesis causales En base a los resultados de los primeros estudios descriptivos de EM, Davenport y Steiner fueron los primeros autores que apuntaron la existencia de una relación entre la EM y los factores geográficos(19). Posteriormente, Kurtzke elaboró un modelo de distribución 22 [ El método epidemiológico: conceptos generales y características (…) ] geográfica en el cual se identifican tres zonas de riesgo (bajo, medio y alto) basadas en las siguientes tasas de prevalencia: inferiores a 5 casos; entre 5 y 30, y por encima de 30 casos por 100.000 habitantes, respectivamente. De acuerdo con este modelo, la frecuencia de EM tiene un patrón latitudinal, con mayor prevalencia en las zonas más alejadas del ecuador en ambos hemisferios(33). Se planteó una posible predisposición genética en la EM al observar que la enfermedad afectaba fundamentalmente a personas de origen escandinavo, era muy poco frecuente en la población de raza negra y nunca se había registrado en determinados grupos étnicos (inuits, maoríes…)(34). Posteriormente, la presencia de agregación familiar en la enfermedad, la evidencia de un alto grado de concordancia en gemelos monocigotos y la demostración de la asociación del gen HLA DRB1*15 dieron mayor soporte a esta hipótesis etiológica(35). Recientemente han surgido otros dos nuevos genes candidatos relacionados con la enfermedad, el receptor de la interleucina (IL) 7 (IL-7RA) y el receptor de la IL-2 (IL-2RA)(36). Por tanto, una posible hipótesis etiológica considera que la EM es una enfermedad de origen genético. En ese contexto, el patrón geográfico descrito por Kurtzke se podría explicar por la propia distribución de la genética de las poblaciones. No obstante, la teoría genética no permite explicar todas las características epidemiológicas de la enfermedad, lo cual se pone de manifiesto en los estudios de migraciones. Dichos estudios muestran que las personas con un determinado contexto genético que migran de una zona de alto riesgo de EM a una de bajo riesgo adquieren un riesgo intermedio entre el de origen y el de destino que se aproxima más al del lugar de destino cuanto menor sea la edad en el momento de la migración(37). Este hecho sugiere que existe algún factor ambiental que modula el riesgo conferido por la genética. Otros ejemplos de la influencia de lo ambiental en la EM son: • El incremento brusco en la incidencia de la enfermedad, como se observó en la epidemia descrita en las Islas Feroe(38,39) o en las Islas Orcadas y Shetland(40,41). • El aumento de la razón mujer/hombre, que podría indicar la influencia de cambios en el estilo de vida y en los hábitos reproductivos(42,43). • La variación en el riesgo de enfermar en función de los niveles de vitamina D circulantes durante la gestación(44) o el reciente aumento de la enfermedad en zonas tropicales y subtropicales, donde han disminuido las enfermedades infecciosas por las mejoras en los niveles de higiene y suministros de agua(45). Por tanto, otra hipótesis etiológica es que la EM está causada por la presencia de determinados factores ambientales que actúan en individuos genéticamente predispuestos. Comprobación de las hipótesis causales Tal y como se ha comentado anteriormente en este capítulo, el diseño epidemiológico de carácter observacional más adecuado para identificar factores de riesgo es el de carácter prospectivo, característico de los estudios de cohortes. Los individuos expuestos y no expuestos al factor son seguidos a lo largo del tiempo para determinar si desarrollan la enfermedad. Un ejemplo es el realizado a partir de una amplia cohorte prospectiva de enfermeras en los Estados Unidos en la que se midió el efecto de la suplementación de 23 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] vitamina D en el riesgo de desarrollar EM. Los autores concluyeron que las mujeres que tomaban suplementos de 400 UI de vitamina D tenían una reducción del riesgo frente a EM del 41% respecto a las que no tomaban suplementos(46). La gran ventaja de este diseño es que el investigador puede medir con precisión la exposición antes de que aparezca la enfermedad. Sin embargo, en enfermedades como la EM, este tipo de estudios son poco factibles por diversos motivos: • En primer lugar, el hecho de que la EM sea una enfermedad multifactorial impide identificar una exposición única. Así, se han planteado múltiples factores de riesgo de tipo infeccioso (virus, parásitos, vacunaciones…), agentes físicos (radiación solar y humo de tabaco), estrés, etc. • Por otro lado, como ya se ha mencionado anteriormente, la EM es una enfermedad con un proceso etiológico muy largo, de tal forma que en un estudio de cohortes sería necesario llevar a cabo seguimientos de varios años desde la medición de la exposición hasta la aparición de la enfermedad, lo cual conllevaría numerosas pérdidas y un elevado coste económico. Una alternativa práctica al diseño de cohortes es la llamada cohorte histórica, en la que se identifica a los individuos libres de enfermedad según la exposición y se determina la posterior aparición de aquélla, con la particularidad de que tanto la exposición como la enfermedad ya se han producido cuando se comienza el estudio. Este diseño reduce el tiempo de seguimiento y el coste; sin embargo, para llevarlo a cabo es preciso disponer de registros poblacionales fiables de la exposición (vacunaciones, infecciones en la infancia, marcadores serológicos…) y de la enfermedad (registros de EM). En caso de emplear información de los casos prevalentes de la enfermedad en lugar de datos de los casos incidentes, existe el riesgo de cometer el llamado sesgo de Neyman. Éste se produce cuando la exposición evaluada es, a su vez, un factor pronóstico de la enfermedad y, por tanto, se obtiene como resultado una infrarrepresentación de enfermos en el grupo de los expuestos (por una menor supervivencia)(47). Los diseños de carácter retrospectivo, como los estudios de casos y controles, constituyen un diseño más viable desde el punto de vista estratégico y económico. Los individuos se seleccionan en función de la presencia o ausencia de enfermedad, y se investiga de forma retrospectiva la exposición de interés en ambos grupos. Este diseño tiene la ventaja de que se pueden estudiar varias exposiciones simultáneamente. Sin embargo, existe el riesgo de que se produzca un sesgo de selección si los casos incluidos en el estudio presentan mayor probabilidad de estar expuestos al factor de estudio, lo cual sobreestimaría la asociación entre la exposición y la enfermedad. Por otro lado, este diseño está sujeto a un sesgo de memoria, ya que se investigan retrospectivamente exposiciones que acontecieron varios años atrás(48). En el caso de enfermedades con largos periodos de inducción, como la EM, resulta muy complejo determinar retrospectivamente –una vez que el paciente ya ha desarrollado la enfermedad– qué ocurrió varios años antes del inicio de los síntomas. El análisis de clusters representa una aproximación metodológica muy útil, ya que aporta información sobre zonas y momentos “fríos y calientes” de la enfermedad, que podrían reflejar la acción de factores causales. Un cluster supone una desviación respecto a una distribución aleatoria de casos en el tiempo o en el espacio. Existen dos tipos de análisis de clusters, el post hoc y los clusters espacio-temporales. Los estudios post hoc se basan en la descripción 24 [ El método epidemiológico: conceptos generales y características (…) ] de un exceso de casos específico en una determinada población. El reto en este tipo de estudios es determinar la validez de ese aparente exceso de casos, es decir, si representa un evento biológico real o es una agrupación al azar. En la epidemia descrita en las Islas Feroe se consideró que el aumento de casos se debió a la introducción de un agente infeccioso en las islas por las tropas británicas en 1941(38). Sin embargo, cuando se revisaron los datos considerando la posible fecha de adquisición de la enfermedad (infancia) en lugar del momento de inicio de los síntomas, se concluyó que la adquisición debió de producirse una década antes de la Segunda Guerra Mundial. Estas observaciones pusieron en duda las hipótesis iniciales y se propuso que la agrupación pudo haberse debido a una mejor identificación de la enfermedad, que era prácticamente desconocida hasta esa fecha(49). Los análisis de clusters espacio-temporales, en cambio, se llevan a cabo en poblaciones sin aparente presencia de una agrupación de casos y tienen como objetivo probar una hipótesis etiológica, generalmente de un agente infeccioso. Se basan en el estudio del lugar y el momento de residencia durante los años de adquisición de la enfermedad –en el caso de la EM, desde el nacimiento hasta el inicio de las manifestaciones clínicas–. Existen diversos diseños posibles en este tipo de estudios, pero en general todos ellos se basan en el hecho de que, si el número de casos de EM que han convivido en el mismo momento y la misma zona geográfica durante los años de susceptibilidad es superior al esperado por azar, entonces el patrón sugiere que pudo haber actuado un factor común en ese momento (un agente infeccioso transmisible, un foco ambiental común…). Para poder extraer hipótesis causales fiables de un análisis de clusters, es necesario que la población a estudio sea estable y genéticamente homogénea, con lo cual se elimina el efecto genético en el riesgo de desarrollar la enfermedad(50). BI BLIOGRAFÍA 1 Delgado Rodríguez M, Gili Miner M, Llorca Díaz J. Concepto y usos de la epidemiología. Medicina Preventiva y Salud Pública. Barcelona: Masson; 2008: 809-25. 2 Snow J. On the mode of communication of cholera. 2nd ed. London: John Churchill; 1860. 3 Mendis S. The contribution of the Framingham Heart Study to the prevention of cardiovascular disease: a global perspective. Prog Cardiovasc Dis 2010; 53: 10-4. 4 Doll R. Proof of causality: deduction from epidemiological observation. Perspect Biol Med 2002; 45 (4): 499-515. 5 Gillam S, Yates J, Badrinath P. Epidemiology. Essential Public Health: theory and practice. New York: Cambridge University Press, 2007. 6 Taylor W, Marks J, Livengood, J, Koplan, J. Current issues and challenges in chronic disease control. En: Brownson R, Remington P, Davis J (eds.). Chronic Disease Epidemiology and Control. Washington DC: American Public Health Association; 1993: 1-18. 7 WHO. Reglamento Sanitario Internacional. Organización Mundial de la Salud; 2005. 8 Van Reekum R, Streiner DL, Conn DK. Applying Bradford Hill’s criteria for causation to neuropsychiatry: challenges and opportunities. J Neuropsychiatry Clin Neurosci 2001; 13: 318-25. 9 Rothman KJ. Induction and latent period. Am J Epidemiol 1981; 114: 253-9. 25 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] 10 Rose G. Incubation period of coronary heart disease. 1982. Int J Epidemiol 2005; 34: 242-4. 11 CDC. Outbreak of swine-origin influenza A(H1N1) virus infection–Mexico, March-April 2009. MMWR 2009; 58: 467-70. 12 Feinstein AR. Clinical epidemiology: architecture of clinical research. Philadelphia: WB Saunders; 1985. 13 Rothman KJ, Greenland S. Types of epidemiologic studies. En: Rothman KJ, Greenland S (eds.). Modern Epidemiology. Philadelphia: Lippincott Raven; 1998. p. 67-78. 14 Kramer MS, Boivin JF. The importance of directionality in epidemiologic research design. J Clin Epidemiol 1988; 41: 717-8. 15 Centers for Disease Control and Prevention; Council of State and Territorial Epidemiologists; Association of State and Territorial Chronic Disease Program Directors. Indicators for chronic disease surveillance. MMWR Recomm Rep 2004; 53 (RR-11): 1-6. 16 Poser C. Multiple sclerosis trait: the premorbid stage of multiple sclerosis. A hypothesis. Acta Neurol Scand 2004; 109: 239-43. 17 Hernández Aguado I, Lumbreras Lacarra B. Epidemiología general de las enfermedades crónicas. 18 19 20 21 22 Estrategias de prevención. Medicina Preventiva y Salud Pública. Barcelona: Masson; 2008. p. 809-25. Poser CM, Benedikz J, Hodge SE. The epidemiology of multiple sclerosis: the Iceland model. Journal of the Neurological Science 1992; 111: 143-52. Poser CM. The epidemiology of multiple sclerosis: a general overview. Ann Neurol 1994; 36 (s2): s180-s193. Marrie RA, Cutter G, Tyry T, Hadjimichael O, Campagnolo D, Vollmer T. Changes in the ascertainment of multiple sclerosis. Neurology 2005; 65: 1066-70. Granieri E, Economou NT, De GR, Tola MR, Caniatti L, Govoni V, et al. Multiple sclerosis in the province of Ferrara: evidence for an increasing trend. J Neurol 2007; 254: 1642-8. Ranzato F, Perini P, Tzintzeva E, Tiberio M, Calabrese M, Ermani M, et al. Increasing frequency of multiple sclerosis in Padova, Italy: a 30 year epidemiological survey. Mult Scler 2003; 9: 387-92. Flachenecker P, Stuke K. National MS registries. J Neurol 2008; 255 [Suppl 6]: 102-8. 23 24 De Sa J, Paulos A, Mendes H, Becho J, Marques J, Roxo J. The prevalence of multiple sclerosis in the District of Santarem, Portugal. J Neurol 2006; 253: 914-8. 25 Papathanasopoulos P, Gourzoulidou E, Messinis L, Georgiou V, Leotsinidis M. Prevalence and incidence 26 27 28 29 30 31 26 of multiple sclerosis in western Greece: a 23-year survey. Neuroepidemiology 2008; 30: 167-73. Klupka-Saric I, Galic M. Epidemiology of multiple sclerosis in western Herzegovina and Herzegovina--Neretva Canton, Bosnia and Herzegovina. Coll Antropol 2010; 34 Suppl 1: 189-93. Rosati G. Descriptive epidemiology of multiple sclerosis in Europe in the 1980s: a critical overview. Ann Neurol 1994; 36 Suppl 2: S164-S174. Minderhoud JM and Zwanniken CP. Increasing prevalence and incidence of multiple sclerosis: an epidemiological study in the province of Groningen, The Netherlands; 1994. p. 113-21. Dyment DA, Ebers GC, Sadovnick AD. Genetics of multiple sclerosis. Lancet Neurol 2004; 3: 104-10. Ebers GC, Sadovnick AD, Risch NJ. A genetic basis for familial aggregation in multiple sclerosis. Canadian Collaborative Study Group. Nature 1995; 377: 150-1. Lauer K, Firnhaber W, Reining R, Leuchtweis B. Epidemiological investigations into multiple sclerosis in southern Hesse. I. Methodological problems and basic epidemiologic characteristics. Acta Neurol Scand 1984; 70: 257-65. [ El método epidemiológico: conceptos generales y características (…) ] 32 Zivadinov R, Iona L, Monti-Bragadin L, Bosco A, Jurjevic A, Taus C, et al. The use of standardized inci- 33 34 35 36 37 38 39 40 41 42 43 44 45 dence and prevalence rates in epidemiological studies on multiple sclerosis. A meta-analysis study. Neuroepidemiology 2003; 22: 65-74. Kurtzke JF. Geography in multiple sclerosis. J Neurol 1977; 215: 1-26. Ebers GC, Kukay K, Bulman DE, Sadovnick AD, Rice G, Anderson C, et al. A full genome search in multiple sclerosis. Nat Genet 1996; 13: 472-6. Sadovnick AD, Ebers GC, Dyment DA, Risch NJ. Evidence for genetic basis of multiple sclerosis. The Canadian Collaborative Study Group. Lancet 1996; 347: 1728-30. Lundmark F, Duvefelt K, Iacobaeus E, Kockum I, Wallstrom E, Khademi M, et al. Variation in interleukin 7 receptor alpha chain (IL7R) influences risk of multiple sclerosis. Nat Genet 2007; 39: 1108-13. Gale CR, Martyn CN, Svenningsson A, Runmarker B, Lycke J, Andersen O. Migrant studies in multiple sclerosis. Prog Neurobiol 1995; 47: 425-48. Kurtzke JF, Hyllested K. Multiple sclerosis: an epidemic disease in the Faeroes. Trans Am Neurol Assoc 1975; 100: 213-5. Kurtzke JF, Hyllested K. Multiple sclerosis in the Faroes: 1. Clinical and epidemiologic features. Trans Am Neurol Assoc 1978; 103: 201-5. Cook SD, Cromarty JI, Tapp W, Poskanzer D, Walker JD, Dowling PC. Declining incidence of multiple sclerosis in the Orkney Islands. Neurology 1985; 35: 545-51. Cook SD, MacDonald J, Tapp W, Poskanzer D, Dowling PC. Multiple sclerosis in the Shetland Islands: an update. Acta Neurol Scand 1988; 77: 148-51. Hader WJ, Yee IM. Incidence and prevalence of multiple sclerosis in Saskatoon, Saskatchewan. Neurology 2007; 69: 1224-9. Alonso A, Hernan MA. Temporal trends in the incidence of multiple sclerosis: a systematic review. Neurology 2008; 71: 129-35. Willer CJ, Dyment DA, Sadovnick AD, Rothwell PM, Murray TJ, Ebers GC. Timing of birth and risk of multiple sclerosis: population based study. BMJ 2005; 330: 120. Cabre P. Migration and multiple sclerosis: the French West Indies experience. J Neurol Sci 2007; 262: 117-21. 46 Munger KL, Zhang SM, O’Reilly E. Vitamin D intake and incidence of multiple sclerosis. Neurology 2004; 62: 60-5. 47 Riise T. Historical cohort studies in multiple sclerosis. Neurology 1997; 49: S15-S17. 48 Wolfson C, Granieri E, Lauer K. Case-control studies in Multiple Sclerosis. Neurology 1997; 49: S5-S14. 49 Poser CM, Hibberd PL, Benedikz J, Gudmundsson G. Analysis of the ‘epidemic’ of multiple sclerosis in the Faroe Islands. I. Clinical and epidemiological aspects. Neuroepidemiology 1988; 7: 168-80. 50 Riise T. Cluster studies in multiple sclerosis. Neurology 1997; 49: S27-S32. 27 [ Índice ] { Epidemiología descriptiva de la esclerosis múltiple } Autores: Óscar Fernández y Fernández1, Xavier Montalbán Gairin2 Editores: Txomin Arbizu Urdiain3, J. Antonio García Merino4 1 Servicio de Neurología. Instituto de Neurociencias Clínicas. Hospital Regional Universitario Carlos Haya. Málaga 2 Unidad de Neuroinmunología. Hospital Universitari Vall d’Hebron. Barcelona 3 Unidad de Esclerosis Múltiple. Servicio de Neurología. Hospital Universitari de Bellvitge. L’Hospitalet de Llobregat (Barcelona) 4 Unidad de Neuroinmunología. Servicio de Neurología. Hospital Universitario Puerta de Hierro Majadahonda. Majadahonda (Madrid) 1/ Introducción: aspectos metodológicos 2/ Resultados de los estudios epidemiológicos: epidemiología descriptiva Bibliografía 29 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] Resumen La epidemiología estudia la frecuencia con la que aparecen las enfermedades en diferentes grupos, así como sus causas. La epidemiología puede clasificarse en dos grandes áreas: descriptiva y analítica. La epidemiología descriptiva determina la frecuencia y distribución del binomio salud/enfermedad en relación con las características de los sujetos, el tiempo y el lugar del estudio. La epidemiología analítica estudia la causalidad, mediante la observación o la experimentación, estableciendo las relaciones entre los niveles de exposición de una población a determinados factores y el riesgo de padecer una enfermedad. Cada vez parece más probada la existencia de un factor genético de susceptibilidad a la EM, pero factores ambientales aún desconocidos explicarían mejor los cambios en la frecuencia de la enfermedad que se han descrito en varios países, entre los que cabe contar España, donde podemos decir que no sólo estamos asistiendo a un aumento de la prevalecía –por la existencia de un alto grado de sospecha de la enfermedad, mejores métodos diagnósticos y mayor supervivencia de los pacientes gracias a una mejor asistencia médica–, sino que también parece existir un aumento real de la frecuencia de la enfermedad –medida como incidencia o prevalencia–, fenómeno que parece producirse en los países del sur de Europa. El aumento de la incidencia de la EM podría estar relacionado con el del resto de enfermedades autoinmunes, de acuerdo con la hipótesis del déficit de radiación solar y de síntesis de la vitamina D, o bien con la “hipótesis de la higiene”, según la cual, en los países desarrollados, la incidencia de las enfermedades autoinmunes –entre ellas, la EM– está aumentado en sentido inverso al descenso de las infecciones durante la infancia, situación que proporcionaría las condiciones patogénicas necesarias para el desarrollo de enfermedades autoinmunes –entre ellas, la EM–. Ambas hipótesis podrían ser complementarias y determinar la aparición de EM en personas susceptibles de padecer la enfermedad. 30 [ Epidemiología descriptiva de la EM ] 1/ Introducción: aspectos metodológicos La epidemiología estudia la frecuencia con la que aparecen las enfermedades en diferentes grupos, así como sus causas. La enfermedad no surge al azar, sino con patrones que reflejan la actuación de causas subyacentes. La epidemiología puede clasificarse en dos grandes áreas: descriptiva y analítica. Epidemiología descriptiva La epidemiología descriptiva determina la frecuencia y distribución del binomio salud/enfermedad en relación con las características de los sujetos, el tiempo y el lugar del estudio. Cuantifica la frecuencia de la salud/enfermedad, siendo las medidas más utilizadas las tasas de incidencia, prevalencia y mortalidad. La incidencia se define como el número de casos nuevos de una enfermedad que se desarrollan en una población durante un periodo de tiempo determinado; se suele utilizar el número de nuevos casos por cada 100.000 habitantes y año. La prevalencia cuantifica la proporción de individuos de una población que padecen una enfermedad o evento en un periodo de tiempo determinado; se expresa como el número de casos vivos/100.000 habitantes en un día concreto (día de prevalencia). La tasa de mortalidad señala el número de fallecimientos atribuibles a una enfermedad en una población durante un periodo de tiempo; se expresa también en número de casos por 100.000 habitantes. Estos cocientes o tasas son medidas de frecuencia relativa y constituyen el instrumento que permite llevar a cabo comparaciones entre grupos y evaluaciones de hipótesis. Epidemiología analítica La epidemiología analítica estudia la causalidad, mediante la observación o la experimentación, y establece las relaciones entre los niveles de exposición de una población a determinados factores y el riesgo de padecer una enfermedad. La comparación de los estados de salud de diferentes poblaciones incluye el cálculo de tasas brutas y, para permitir su comparación, estandarizadas. El análisis simple del efecto de una exposición o una intervención sobre un resultado o sobre la enfermedad comprende el cálculo de las medidas absolutas del efecto (riesgo atribuible, diferencia de riesgos o diferencias de tasas) y de las medidas relativas (riesgo relativo, odds ratio y hazard ratio). Las causas de una enfermedad hay que buscarlas entre los factores que conforman el triángulo epidemiológico medio ambiente/agente/huésped. La modificación en el equilibrio de este triángulo puede variar la frecuencia de la enfermedad, por lo que dichos factores se consideran causas o determinantes de la enfermedad. El medio ambiente lo conforman los factores extrínsecos que influyen sobre la existencia, la exposición o la susceptibilidad al agente; incluye el ambiente físico, biológico y socioeconómico. El agente puede ser biológico, químico (tóxicos o alérgenos), físico (radiaciones ionizantes, etc.) o nutricional. En el proceso de enfermar, el huésped aporta todos los atributos 31 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] que influyen en su respuesta a los agentes, los cuales incluyen sus características genéticas, las adquiridas y otras características biológicas (edad, sexo, etc.). Por lo anterior, las variables de tiempo (periodo de incubación, cambios estacionales, etc.), lugar (zona geográfica) y persona (edad, raza, nivel socioeconómico, etc.) son las más examinadas por los epidemiólogos. Estudios epidemiológicos Los estudios epidemiológicos pueden considerarse un ejercicio de medición, dado que sus objetivos siempre incluyen la obtención de estimaciones sobre la frecuencia de la enfermedad (incidencia, prevalencia, mortalidad), el efecto de algún(os) factor(es) y derivaciones de las medidas anteriores. Existen diferentes maneras de clasificar los estudios epidemiológicos en función de sus diferentes características: descriptivo/analítico, transversal/longitudinal, experimental/observacional, retrospectivo/prospectivo(1). Estudios epidemiológicos descriptivos Se realizan cuando se conoce poco sobre la frecuencia de la enfermedad, su historia natural o los determinantes que la producen. Su objetivo es estimar la frecuencia de la enfermedad y las tendencias en la población, así como servir de base a posteriores estudios analíticos. El objeto de observación en este tipo de estudios lo pueden constituir poblaciones o individuos (series de casos). Las series de casos pueden permitir identificar un perfil de pacientes y delimitar nuevas enfermedades (por ejemplo, la neuromielitis óptica). Las encuestas transversales o de prevalencia son un tipo de estudio observacional descriptivo cuyas mediciones (prevalencia de la exposición y efecto) se realizan en un único momento; son metodológicamente sencillas pero no suelen ser útiles para establecer inferencias causales por la ambigüedad temporal (no sabemos si la exposición precede o no a la enfermedad; por ejemplo, la determinación de serologías frente al virus de Epstein-Barr [VEB]). Estudios epidemiológicos analíticos Precisan un conocimiento previo de la enfermedad que permita establecer hipótesis causales. Su objetivo es justamente demostrar o refutar las hipótesis etiológicas o preventivas. Los estudios analíticos pueden ser observacionales (estudios ecológicos, de casos y controles, y de cohortes), o de intervención (ensayos clínicos o intervenciones comunitarias). Los estudios de cohorte consisten en el seguimiento de una o más cohortes de individuos que presentan diferentes grados de exposición a un factor de riesgo y en quienes se mide la aparición de la enfermedad o condición en estudio. Dificultades para el diseño de estudios epidemiológicos sobre la esclerosis múltiple La esclerosis múltiple (EM) presenta algunas características que hacen complicado el diseño y desarrollo de los estudios epidemiológicos: es una enfermedad relativamente rara, con unos 32 [ Epidemiología descriptiva de la EM ] periodos de inducción y latencia probablemente muy prolongados, sin una prueba diagnóstica patognomónica, y muy heterogénea en su expresión clínica. Dado que la EM es una enfermedad relativamente rara, es complicado calcular el tamaño de la población a estudiar para estimar su frecuencia. Si empleamos poblaciones muy grandes, perderemos muchos casos, pero si empleamos poblaciones muy pequeñas, los resultados pueden no ser representativos de la realidad, y los resultados de ambos tipos de estudio no serán comparables. La ausencia de una prueba diagnóstica patognomónica plantea como problema la propia identificación del caso, dada la variabilidad de la enfermedad, que el diagnóstico se basa en criterios y que estos criterios diagnósticos se han ido modificando a lo largo de los años incorporando avances tecnológicos (resonancia magnética). Otro aspecto a tener en cuenta en los estudios epidemiológicos sobre EM es el método utilizado para reconocer los casos. Se han descrito tres métodos: el asirio, el de la araña y el del pariente político: • El método asirio consiste en la creación de un equipo dentro de una comunidad para identificar los casos (numerador) en un plazo breve de tiempo (por ejemplo, el estudio puerta a puerta, en el que en general un número elevado de entrevistadores lleva a cabo el estudio en una población no muy amplia en un breve plazo de tiempo). • El método de la araña consiste en lo opuesto: se trata de disponer de instalaciones médicas de excelencia a las cuales acuden los pacientes como a la tela de araña; se dispondría también de medios avanzados de registro. • En el método del pariente político, el equipo investigador se instala en el área del estudio y se establece por un tiempo prolongado, escrutando a la población a lo largo del tiempo, estableciendo relaciones a todos los niveles de la comunidad, que permitan localizar el mayor número de casos. Este tipo de estudios puede realizarse en zonas con pocos flujos migratorios y poblaciones relativamente reducidas. Es complicado estimar con precisión la incidencia en la EM, debido a que se precisa estudiar poblaciones enormes durante poco tiempo u otras más pequeñas y abordables pero durante periodos de tiempo prolongados (unos 10 años). Sin embargo, la estimación de la incidencia es de notable utilidad para ayudarnos a inferir hipótesis causales, sobre todo si se identifica un “efecto tiempo”. Los estudios de mortalidad tienen un valor muy limitado en la EM para calcular su frecuencia debido a la calidad de los certificados de defunción. En la práctica, sólo el Registro Danés de Esclerosis Múltiple(2) ha aportado datos precisos sobre mortalidad, pero principalmente sobre la evolución de la supervivencia de estos pacientes. En la búsqueda de relaciones causales con la EM, el diseño teórico ideal sería un estudio longitudinal prospectivo de una cohorte fija desde el nacimiento y suficientemente numerosa; obviamente, ello es imposible. Sin embargo, cada vez hay más estudios de casos y controles retrospectivos de colectivos de los que se dispone de información histórica fiable (por ejemplo, personal militar)(3,4). En todo caso, el desarrollo actual de nuevas tecnologías de la información y diagnósticas, así como el mayor conocimiento de la enfermedad hacen prever el incremento en los próximos años de los estudios epidemiológicos analíticos sobre la EM. 33 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] 2/ Resultados de los estudios epidemiológicos: epidemiología descriptiva Distribución de la enfermedad según las tasas de frecuencia Prevalencia Los estudios de prevalencia han permitido apreciar una distribución irregular a lo largo del mundo. Se detectan mayores frecuencias entre los 40 y los 60 grados de latitud norte y se aprecia un fenómeno muy similar en el hemisferio sur. Kurtzke definió zonas de riesgo alto (> 30 casos/100.000 habitantes), riesgo medio (5-25) y riesgo bajo (< 5) en los años setentaochenta(5). Posteriormente, al repetirse los estudios y realizarse otros más detallados, se han podido apreciar aumentos muy llamativos de las tasas de prevalencia, definiéndose estas zonas de riesgo en > 100, 50-100 y < 50(6). En Europa, se han descrito prevalencias elevadas (100-200 en el Reino Unido y los países escandinavos). Lo mismo ocurre en los EE UU y Canadá. En África, Asia y América del Sur, la enfermedad es infrecuente, aunque los estudios de que se dispone son aún escasos (Figura 1). Los escasos datos epidemiológicos en Cuba y México cifran la prevalencia en esta zona en 5-10 y 1,2-12, respectivamente. En Cuba y en la isla Martinica, donde la prevalencia documentada es de 17, se publican cifras cada vez más elevadas. En Centroamérica (Guatemala, El Salvador, Honduras, Nicaragua, Costa Rica y Panamá), las prevalencias registradas son muy bajas (prevalencias de 1-2 casos/100.000 habitantes). En América del Sur, los estudios realizados en Brasil, Argentina, Uruguay, Paraguay, Chile, Perú, Colombia y Venezuela comunican prevalencias de entre 4 y 22 casos/100.000 habitantes, con un gradiente de disminución en relación con la distancia al ecuador, si bien no tan acusado como en zonas bien estudiadas del hemisferio Sur, como Australia(7). Figura 1. Epidemiología de la esclerosis múltiple en el mundo. Tasas crudas de prevalencia. 34 [ Epidemiología descriptiva de la EM ] A partir de los años setenta-ochenta se han realizado numerosísimos estudios de prevalencia en el sur de Europa, y se han hallado frecuencias de riesgo medias, de alrededor de 50 casos/100.000 habitantes, y altas, como en Cerdeña (prevalencia de 144). Persiste la incógnita de la tasa de prevalencia tan baja de Malta (prevalencia de 4 en 1978, y de 13 en 1999), a pesar de la escasa distancia a la que está de Sicilia, donde el riesgo es alto, con prevalencias de 120(8,9). En España se han publicado 30 estudios de prevalencia(10), distinguiéndose claramente dos periodos, de 1968 a 1991, con tasas de prevalencia que oscilaban de 5 a 23 casos/100.000 habitantes, y de 1994 a 1999, con tasas de prevalencia que oscilaban de 32 a 65 casos/100.000 habitantes. Estudios posteriores al año 2000 han mostrado cifras aún más elevadas, de alrededor de 70-80 casos/100.000 habitantes (Tabla 1 y Figura 2). En 1994 publicamos una cifra de prevalencia de 53/100.000 habitantes en Vélez-Málaga (Málaga)(11). En un estudio paralelo se encontró una cifra similar (58/100.000) en Vic (Barcelona)(12). En el año 2010, usando el método captura-recaptura, hemos obtenido en Málaga una prevalencia de 125/100.000 (IC 95%: 102/105-169,5/105), muy similar a la de un estudio recientemente publicado del sur de Francia que usó la misma metodología(13). En conjunto, se aprecia un aumento progresivo de las cifras de prevalencia en el sur de Europa, donde las cifras son cada vez más similares a las de otros países situados más al norte (Figura 3). Incidencia Prevalencia En cuanto a la tasa de incidencia, se puede hoy afirmar que existen variaciones en la incidencia de la EM a lo largo del tiempo. Se han apreciado aumentos de incidencia (condado de Olmsted, en Minnesota, EE UU; Sassari, en Cerdeña; condados de More y Romsdal, en Noruega, etc.) y también disminuciones (Gotemburgo, en Suecia; Islas Orcadas; Dinamarca). Se han descrito focos y epidemias. Ambos tipos de hallazgos apoyan la existencia de un factor ambiental, pero son muy cuestionados debido a que entrañan dificultades metodológicas y no han conducido a ninguna conclusión respecto a la causa de la enfermedad. 90 80 70 60 50 40 30 20 10 0 1968 1996 Año del estudio 2004 Figura 2. Evolución de la tasa de prevalencia de la esclerosis múltiple en España. 35 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] Tabla 1. Epidemiología de la esclerosis múltiple en España. Estudios de prevalencia ordenados según el año de realización Año Lugar Latitud 1968 Cataluña 42º N ? 6 O. de la Riva Las Palmas 29º N 715.177 6 Sosa Cantabria 43º N 522.000 5 Miró 1986 Málaga 37º N 1.036.961 11 Fernández 1987 Aragón 42º N 1.230.000 9 Barduzal Alicante 38º N 133.915 17 Martín Salamanca 40º N 368.055 11 Ruiz-Ezquerro Zamora 41º N 224.369 12 Ruiz-Ezquerro Lanzarote 28º N 60.000 15 García Gijón 43º N 81.462 23 Uría Navarra 42º N 516.000 16 Antón Vélez-Málaga 36º 45’ N 36.104 53 (32-82) Fernández Vic 41º 50’ N 71.985 57 (40-74) Bufill 1995 Segovia 40º 55’ N 53.774 56 (36-76) Sempere 1996 Gijón 43º 35’ N 33.520 65 (38-92) Uría 1997 Teruel 40º 25’ N 143.680 32 (23-41) Modrego Pardo Calatayud 41º 20’ N 58.591 58 (39-78) Pina Móstoles 40º 20’ N 195.979 43 (35-54) Benito-León Valladolid 41º 39’ N 92.632 58 (44-76) Tola Zamora 41º N 207.475 44 Ruiz-Ezquerro Alcoi 38º N 130.786 41 (31-54) Mallada-Frechín Vizcaya 43º N 500.668 47,7 Antigüedad Menorca 39º 47’ N 67.009 69 (50-92) Casquero Las Palmas 28º 40’ N 81.507 42 (28-58) Hernández Costa Ponent (Barcelona) 41º 50’ N 1.046.969 48 Callén Vigo 44º 15’ N 275.000 28 Muñoz Las Palmas 28º 40’ N 82.623 78 (57-95) Aladro 2003 Bajo Aragón 40º 25’ N 58.666 75 (52-97) Modrego Pardo 2005 Las Palmas 28º 20’ N 82.623 78 (57-95) Aladro 2007 Santiago de Compostela 42º 53’ N 90.188 79 (60-97) Ares 1983 1988 1991 1994 1998 1999 2001 2002 36 Población Prevalencia Autor [ Epidemiología descriptiva de la EM ] Lanzarote La Palma Tenerife La Gomera Gran Canaria El Hierro Fuerteventura 79 75 149 125 CR Islas Canarias 44º 42º 40º 38º 127 CR 120 78 28º Año Área Latitud Población Prevalencia Autor Método 2010 43º N 1.155.838 127 (110-150) C. Sagnes-Raffy CR 42º 53’ N 90.188 79 (60-97) B. Ares 2003 Alto-Garona Santiago de Compostela Bajo Aragón 40º 25’ N 58.666 75 (52-97) P.J. Modrego 2001 Norte de Cerdeña 40º 30’ N 460.135 149 (138-161) M. Pugliatti 2001 Enna (Sicilia) 37º 34’ N 28.273 120 (84-167) L. Grimaldi 2010 Málaga 36º 45’ N 1.528.851 125 (102-169) Ó. Fernández 2005 Las Palmas 28º 20’ N 82.623 78 (57-95) Y. Aladro 2007 CR Figura 3. Prevalencia de la esclerosis múltiple en el sur de Europa. CR: captura recaptura. Un estudio reciente sobre la distribución geográfica de la EM a lo largo del tiempo en Suecia pone de manifiesto cambios en la frecuencia de la enfermedad por áreas geográficas(14). Los cambios marcados en la frecuencia de la enfermedad, en breves periodos de tiempo, que revela este estudio apuntan a la existencia de factores ambientales. La incidencia ha sido menos investigada en España, pero varios estudios informan de valores muy variables, que oscilan entre 0,5 y 5,3 casos/100.000 habitantes (Tabla 2 y Figura 4)(10). Se ha puesto en marcha un registro prospectivo de incidencia en Cataluña para intentar aclarar este aspecto(15). Mortalidad Los estudios de mortalidad requieren un sistema de codificación y un estándar muy alto de las fuentes de información, por lo que los datos comunicados sobre esta tasa deben ser valorados, en consecuencia, con cierta cautela. En Dinamarca, la tasa es de 2,6/100.000. En los EE UU es de 1,3. El primer estudio de mortalidad realizado con rigor metodológico en España encuentra una tasa de 0,35 fallecimientos/100.000 habitantes/año, lo que sitúa 37 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] Tabla 2. Epidemiología de la esclerosis múltiple en España. Estudios de incidencia ordenados según el año de realización Año Incidencia Autor 715.177 0,6 Sosa 43º N 522.000 1,2 Miró Málaga 37º N 1.036.961 2,1 Fernández Salamanca 40º N 368.055 1,4 Ruiz-Ezquerro Zamora 41º N 224.369 1,4 Ruiz-Ezquerro 1991 Navarra 42º N 516.000 0,5 Antón 1995 Segovia 40º 55’ N 53.774 3,2 Sempere 1996 Gijón 43º 35’ N 33.520 3,7 Uría 1997 Teruel 40º 25’ N 143.680 2,2 Modrego Pardo Calatayud 41º 20’ N 58.591 2,6 Pina Móstoles 40º 20’ N 195.979 3,8 Benito-León Zamora 41º N 207.475 2,8 Ruiz-Ezquerro Alcoi 38º N 130.786 2,8 Mallada-Frechín Menorca 39º 47’ N 67.009 3,4 Casquero Las Palmas 28º 40’ N 81.507 2,3 Hernández Costa Ponent (Barcelona) 41º 50’ N 1.046.969 2,9 Callén 1983 1986 1988 1998 1999 2001 Lugar Latitud Las Palmas 29º N Cantabria Población Vizcaya 43º N 500.668 2,8 Antigüedad 2003 Bajo Aragón 40º 25’ N 58.666 4,6 Modrego 2005 Las Palmas 28º 40’ N 82.623 4,1 Aladro 2007 Santiago de Compostela 42º 53’ N 90.188 5,3 Ares a España entre los países de riesgo medio. En un estudio más reciente que analiza la tasa de mortalidad ajustada por edad producida por la EM del año 1951 al año 1992, se aprecia un aumento desde 1951 a 1968, un descenso posterior, en 1969, coincidiendo con el cambio de la 7.ª a la 8.ª revisión de la Clasificación Internacional de Enfermedades (ICD), y a partir de 1970(10) se estabiliza. Estudios de epidemiología genética Los estudios de epidemiología genética se basan en la observación inicial de la epidemiología descriptiva sobre las diferencias étnicas en la distribución de la enfermedad y en la observación de casos multifamiliares (15-20%)(10). 38 [ Epidemiología descriptiva de la EM ] 6 Incidencia 5 4 3 2 1 0 1983 Año del estudio 1998 2004 Figura 4. Evolución de la tasa de incidencia de la esclerosis múltiple en España. Estudios étnicos Los estudios étnicos han permitido establecer que existen poblaciones aparentemente resistentes a la EM, a saber: lapones, maoríes de Nueva Zelanda, indios de Norteamérica, huteritas de Saskatchewan de Canadá, gitanos húngaros, etc.(10). Estos estudios han reconocido la importancia del antecedente escandinavo, que explicaría por sí solo la mayoría de los hallazgos epidemiológicos en los EE UU. Estudios en familias Los factores de riesgo genéticos familiares ajustados por edad varían según el parentesco con el enfermo estudiado. Mientras que el riesgo de EM para la población general es del 0,1-0,2%, los familiares en primer grado de un paciente con EM tienen un riesgo del 3-5%. Los hijos de padre y madre afectados tienen un riesgo del 30% de padecer la enfermedad. La concordancia entre gemelos monocigotos es del 30%, frente al 3-5% en gemelos dicigotos, que es similar al riesgo de familiares en primer grado(16). En general, las características clínicas de los pacientes con familiares afectos son similares a las de los casos esporádicos. Los estudios familiares también han permitido comprobar que los hijos adoptados que son parientes de sujetos afectos de EM no tienen mayor frecuencia de la enfermedad que la esperada en la población general, así como que la enfermedad no aumenta en los esposos de los sujetos afectos. Estudios genéticos de ligamiento y asociación Se ha descrito la asociación genética de la EM con el complejo mayor de histocompatibilidad (CMH), localizado en el brazo corto del cromosoma 6. La región de clase II de este sistema 39 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] se asocia fuertemente con la EM, en particular, con el alelo HLA-DR2 y su correspondiente haplotipo DR15 (DRB1*1501, DRB5*0101, DQA1*0102, DQB1*0602). La asociación es fuerte en pacientes con EM de origen caucásico, pero puede apreciarse en la mayor parte de los grupos étnicos. En algunas poblaciones mediterráneas (Cerdeña, Turquía) y en las Islas Canarias se encuentra una asociación con el haplotipo DR4 (DRB1*0405, DQA1*0301, DQB1*0302), con o sin la unión a DR15(10). En un mapeo genómico completo reciente se ha demostrado definitivamente la asociación con la región HLA y además con los genes de las interleucinas IL-2 e IL-7(17). La contribución de estos genes al riesgo genético total sería del 30%, y en la susceptibilidad a padecer la enfermedad interviene la epistaxis (interrelación) entre distintas regiones genéticas. Estudios en emigrantes A pesar de las debilidades inherentes a este tipo de estudios, a partir de los mismos se ha podido constatar la existencia de un periodo de susceptibilidad a contraer la EM entre los 10 y los 15 años de edad. Asimismo, estos estudios muestran que el periodo mínimo de exposición es de 2 años y que el periodo de latencia es de 18-19 años. También se ha observado que los hijos de los individuos que emigraron desde la India, África y las Indias Occidentales al Reino Unido tienen la misma prevalencia que la población del Reino Unido. Se han obtenido datos muy similares en estudios con emigrantes realizados en Israel, lo cual apoya la existencia de algún factor ambiental que modula el riesgo conferido por la genética(10). Una visión epidemiológica de conjunto Los estudios de epidemiología analítica constituyen el tema del tercer capítulo de esta monografía y serán abordados ahí de forma específica, aunque, para completar este capítulo y poder establecer un razonamiento acerca de por qué se producen los cambios tan marcados que hallamos en los estudios descriptivos de incidencia/prevalencia, resumimos algunos aspectos de los estudios analíticos. Podemos decir que los estudios ecológicos han puesto de manifiesto la asociación entre la EM y los climas fríos y, en probable relación con éstos, la humedad y lluvia, así como con las infecciones respiratorias, el suelo de turba y las coníferas. En cuanto a los aspectos socioculturales, se ha hallado asociación con la ingestión de grasa de origen animal, carne y productos de granja e industriales(18). De los estudios de casos y controles, se han hallado relaciones con el antecedente escandinavo, la historia familiar positiva, el género femenino, los genes de clase II del CMH, la latitud norte, el contacto con perros, las vacunas, y agentes ambientales como el tabaco y diversos virus(10). La radiación solar y la vitamina D se han relacionado con el aumento de frecuencia de la enfermedad y su supuesta distribución latitudinal(19). Esta hipótesis está apoyada también por un estudio en una cohorte de enfermeras en EE UU, estudio que demuestra una correlación inversa entre la ingesta de suplementos de vitamina D y el riesgo frente a EM(20). Asimismo, se ha visto que la probabilidad de padecer EM es mayor en los nacidos en los meses de primavera, lo que implica que la mayor parte del embarazo 40 [ Epidemiología descriptiva de la EM ] ha tenido lugar en los meses con menor irradiación solar y, por tanto, niveles más bajos de vitamina D circulante en la madre(21). Se han correlacionado las infecciones y la EM: el virus del moquillo canino, el del sarampión, el de la varicela zóster, el de la encefalitis por garrapatas, el HTLV-I, el LM 7 (retrovirus), el virus del herpes 6 (VHH 6), el VEB, el retrovirus asociado con la EM (MSRV) y diversas partículas retrovirales (MSRV/HERV-W, RGH/HERV-H, HERV-W). También se ha relacionado la EM con el agente Clamydophila pneumonie, pero no está comprobado(10). El posible riesgo patogénico de la vacuna del virus de la hepatitis B (VHB) no ha sido confirmado(22). Un estudio caso-control corrobora la ausencia de asociación entre las enfermedades típicas de la infancia y la EM. La amigdalectomía y la EM tampoco parecen relacionadas(10). Varios estudios caso-control relacionaron el contacto con perros con la predisposición a padecer EM(23), pero esta asociación no se ha comprobado, ni otra asociación descrita con el virus del moquillo canino(24). El contacto con gatos y pájaros se ha relacionado de manera inversa con la EM(25). Finalmente, el VEB se ha asociado a un riesgo de padecer EM. Considerando como referencia el hecho de haber padecido una infección por el VEB en la infancia temprana, el riesgo de EM es unas 10 veces menor en los individuos seronegativos para VEB, y 2-3 veces mayor en las personas que adquieren la infección por VEB más tardíamente y desarrollan mononucleosis infecciosa. Por tanto, existe un incremento de riesgo de hasta 20 veces en las personas con antecedente de mononucleosis infecciosa respecto a las seronegativas para VEB(26). Aunque se ha descrito en alguna ocasión, no parece existir asociación entre las amalgamas dentales empleadas por los dentistas y la EM(27). El consumo de tabaco podría estar relacionado con la EM según algunos estudios caso-control y prospectivos(28). Por medio de los estudios de cohortes se ha podido comprobar que las infecciones respiratorias preceden el 27% de los brotes(29), que la frecuencia de los brotes aumenta en el puerperio, que existe un descenso marcado del número de lesiones nuevas medidas por la resonancia magnética durante el embarazo(30) y que los traumatismos craneoencefálicos no son un factor causal de la EM(31). Los estudios de focos (acúmulos o clusters) en las Islas Faroe permitieron observar que en esa región se ha producido un incremento significativo de la incidencia de la enfermedad después de la Segunda Guerra Mundial, que se interpretó como un aumento epidémico producido por un factor exógeno, posiblemente infeccioso. Sin embargo, no se ha demostrado de forma convincente que ninguno de los factores propuestos (virus del moquillo canino, infección diferida por el virus del sarampión, etc.) desempeñe un papel etiológico definitivo en la génesis de la EM. Se han descrito también acúmulos de casos en algunas profesiones como veterinarios o trabajadores del zinc, sin que tampoco en estos casos pueda llegarse a conclusiones definitivas. Cada vez parece más probada la existencia de un factor genético de susceptibilidad a la EM, pero factores ambientales aún desconocidos explicarían mejor los cambios en la frecuencia de la enfermedad. La explicación del aumento de la incidencia de la EM, y de otras enfermedades autoinmunes, podría estar relacionada con la radiación solar y la vitamina D, o bien con la “hipótesis de la higiene”, según la cual, en los países desarrollados, las enfermedades autoinmunes –entre ellas la EM– están aumentando de incidencia en sentido inverso al descenso de las infecciones durante la infancia. Ambas hipótesis actuarían en el nivel inmune y podrían ser cofactores importantes en el desencadenamiento de la EM en personas predispuestas. 41 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] BI BLIOGRAFÍA 1 Argimon JM, Jiménez J. Métodos de investigación clínica y epidemiológica. Madrid: Elsevier España; 2004. 2 Brønnum-Hansen H, Koch-Henriksen N, Stenager E. Trends in survival and cause of death in Danish patients with multiple sclerosis. Brain 2004; 127: 844-50. 3 Levin LI, Munger KL, Rubertone MV, Peck CA, Lennette ET, Spiegelman D, Ascherio A. Temporal relationship 4 5 6 7 8 9 10 11 12 between elevation of epstein-barr virus antibody titers and initial onset of neurological symptoms in multiple sclerosis. JAMA 2005; 293: 2496-500. Ahlgren C, Torén K, Odén A, Andersen O. A population-based case-control study on viral infections and vaccinations and subsequent multiple sclerosis risk. Eur J Epidemiol 2009; 24 (9): 541-52. Kurtzke JF. The geographical distribution of multiple sclerosis: an update with special reference to Europe and the Mediterranean region. Acta Neurol Scand 1980; 62: 65-80. Pryse-Phillipis W. The epidemiology of multiple sclerosis. En: Cook S (ed.). Handbook of Multiple Sclerosis. New York: Marcel Dekker; 1990. p. 1-24. Oehninger C, Rega I, Ketzoian C. Multiple sclerosis in South America. Rev Neurol (Paris) 2000; 156: 3S163. Dean G, Elian M, de Bono AG, Asciak RP, Vella N, Mifsud V, Aquilina J. Multiple sclerosis in Malta in 1999: an update. J Neurol Neurosurg Psychiatry 2002; 73 (3): 256-60. Grimaldi LM, Salemi G, Grimaldi G, Rizzo A, Marziolo R, Lo Presti C, et al. High incidence and increasing prevalence of MS in Enna (Sicily), southern Italy. Neurology 2001; 57 (10): 1891-3. Fernández O, Fernández V, Guerrero M. Esclerosis múltiple. 2.ª ed. Madrid: McGraw Hill-Interamericana; 2005. Fernández O, Luque G, San Román C, Bravo M, Dean G. The prevalence of multiple sclerosis in the sanitary district of Vélez Málaga, southern Spain. Neurology 1994; 44: 425-9. Bufill E, Blesa R, Galan I, Dean G. Prevalence of multiple sclerosis in the region of Osona, Catalonia, northern Spain. J Neurol Neurosug Psychiatry 1995; 58: 577-81. 13 Sagnes-Raffy C, Gourraud PA, Hannon V, Bourrel R, Laffontan MA, Gaulene MC, et al. Multiple sclerosis in Haute-Garonne: an important underestimate of prevalence. Revue d’Epidemiologie et de Sante Publique 2010; 58: 23-31. 14 Landtblom AM, Riise T, Kurtzke JF. Further considerations on the distribution of multiple sclerosis in Sweden. Acta Neurol Scand 2005; 111: 238-46. 15 Otero S, Batlle J, Bonaventura I, Brieva L, Bufill E, Cano A, et al. REF: situación epidemiológica actual de la esclerosis múltiple: pertinencia y puesta en marcha de un registro poblacional de nuevos casos en Cataluña. Rev Neurol 2010; 50: 623-33. 16 Dyment DA, Ebers GC, Sadovnick AD. Genetics of multiple sclerosis. Lancet Neurol 2004; 2: 104-10. 17 International Multiple Sclerosis Genetics Consortium, Hafler DA, Compston A, Sawcer S, Lander ES, Daly MJ, De Jager PL, et al. Risk alleles for multiple sclerosis identified by a genomewide study. New Engl J Med 2007; 357: 851-62. 18 Granieri E. Exogeneous factors in the aetiology of multiple sclerosis. J Neurovirol 2000; 6 Suppl 2: 141-6. 19 Smolders J, Damoiseaux J, Menheere P, Hupperts R. Vitamin D as an immune modulator in multiple sclerosis, a review. J Neuroimmunol 2008; 194 (1-2): 7-17. 42 [ Epidemiología descriptiva de la EM ] 20 Munger KL, Zhang SM, O’Reilly E, Hernán MA, Olek MJ, Willett WC, Ascherio A. Vitamin D intake and incidence of multiple sclerosis. Neurology 2004; 62: 60-5. 21 Willer CJ, Dymen DA, Sadovnick AD, Rothwell PM, Murray TJ, Ebers GC. Timing of birth and risk of multiple sclerosis: population based study 2005; 330: 120. 22 Monteyne P, Andre FE. Is there a causal link between hepatitis B vaccination and multiple sclerosis? Vaccine 2000; 18 (19): 1994-2001. 23 Frutos-Alegria MT, Beltran-Blasco I, Quilez-Iborra C, Molto-Jorda J, Diaz-Marin C, Matias-Guiu J. A control 24 25 26 27 28 29 30 31 and case study of multiple sclerosis in the Alicante and Villajoyosa areas. Rev Neurol 2002; 34: 1013-6. Hernan MA, Zhang SM, Lipworth L, Olek MJ, Ascherio A. Multiple sclerosis and age at infection with common viruses. Epidemiology 2001; 12: 301-6. Ghadirian P, Dadgostar B, Azani MP. A case-control study of the association between socio-demographic, lifestyle and medical history factors and multiple sclerosis. Can J Public Health 2001; 92: 281-5. Thacker EL, Mirzaei F, Ascherio A. Infectious mononucleosis and risk for multiple sclerosis: a metaanalysis. Ann Neurol 2006; 59: 499-503. Casetta I, Invernizzi M, Granieri E. Multiple sclerosis and dental amalgam: case-control study in Ferrara, Italy. Neuroepidemiology 2001; 20: 134-7. Riise T, Nortvedt MW, Ascherio A. Smoking is a risk factor for multiple sclerosis. Neurology 2003; 61: 1122-4. Kriesel JD, White A, Hayden FG, Spruance SL, Petajan J. Multiple sclerosis attacks are associated with picornavirus infections. Mult Scler 2004; 10: 145-8. Confavreux C, Hutchinson M, Hours MM, Cortinovis-Tourniaire P, Moreau T. Rate of pregnancy-related relapse in multiple sclerosis. Pregnancy in Multiple Sclerosis Group. N Engl J Med 1998; 339 (5): 285-91. Siva A, Radhakrishnan K, Kurland LT, O’Brien PC, Swanson JW, Rodriguez M. Trauma and multiple sclerosis: a population-based cohort study from Olmsted County, Minnesota. Neurology 1993; 43: 1878-82. 43 [ Índice ] { Epidemiología analítica } Autor: Fernando García del Carrizo1 Editores: Rafael Arroyo González2, Alfredo Rodríguez Antigüedad3 1 Sección de Neurología. Hospital del Tajo. Aranjuez (Madrid) 2 Servicio de Neurología. Hospital Clínico San Carlos. Madrid 3 Servicio de Neurología. Hospital de Basurto. Bilbao 1/ Introducción 2/ Definiciones en epidemiología-genética 3/ Epidemiología ambiental 4/ Epidemiología genética Bibliografía 45 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] Resumen La epidemiología es la ciencia que estudia la distribución y los determinantes del fenómeno salud-enfermedad en las poblaciones humanas. La epidemiología analítica busca los factores que determinan la distribución encontrada en los estudios descriptivos e identifica asociaciones causales. Las causas de la EM siguen siendo desconocidas. La hipótesis más aceptada actualmente es que se trataría de un proceso de etiología multifactorial en el que uno o varios factores ambientales que inciden en las primeras etapas de la vida generarían el desarrollo de la enfermedad en personas con determinada susceptibilidad genética producida probablemente por varios genes independientes. Entre los factores ambientales estudiados, han demostrado mayor asociación con la EM la infección por el VEB, la hipovitaminosis D y el hábito tabáquico. En este capítulo nos centraremos en el análisis de dichos factores. Los estudios de genética molecular revelan que los polimorfismos que muestran una asociación mayor con el riesgo de desarrollar EM son los relacionados con el MHC de clase II (en concreto, DRB1*1501, DR15 y DQ6). También han sido propuestos otros candidatos, como el receptor de IL-7 (IL-7RA) y el receptor de IL-2 (IL-2RA). En este capítulo se repasan los últimos trabajos relacionados con la epidemiología ambiental y la epidemiología genética. Los estudios ponen de manifiesto la importancia de la interacción entre ambiente y genética y describen diferentes susceptibilidades genéticas que precisan de factores ambientales concretos para el desarrollo de esta enfermedad. Además, se repasa el papel de la epigenética en la EM y cómo determinados factores ambientales pueden modificar la expresión de genes y la implicación de éstos en la patogenia de la enfermedad. Con todo, y aunque se han descubierto muchas piezas del enorme puzle que es la EM, sigue y seguirá habiendo más preguntas que respuestas en relación con la etiología de esta enfermedad. 46 [ Epidemiología analítica ] 1/ Introducción La esclerosis múltiple (EM) es una enfermedad de causa desconocida. A partir del estudio, la investigación, el diagnóstico y el tratamiento que se vienen llevando a cabo desde hace ya numerosos años en multitud de países de todo el mundo, se ha llegado a la conclusión de que se trata de una enfermedad inflamatoria desmielinizante y neurodegenerativa crónica del sistema nervioso central (SNC). Se considera el resultado de la interacción de uno o varios factores ambientales que actuarían en las primeras etapas de la vida sobre personas predispuestas desde el punto de vista genético. Esta susceptibilidad estaría producida probablemente por varios genes independientes. Se desencadenaría una activación anómala del sistema inmunológico que, a su vez, reaccionaría contra componentes del SNC, lo que produciría inflamación de la mielina y degeneración axonal-neuronal, en un proceso que se mantendría a lo largo del tiempo(1-3). Como en otras enfermedades, al principio se crearon dos corrientes: la de los que defendían el papel del ambiente, y la de quienes defendían la importancia de la carga genética. Sin embargo, cuando se han aceptado ambas teorías como complementarias y se ha buscado la posible relación entre ambas ha sido cuando más se ha avanzado en el conocimiento de la etiopatogenia de la enfermedad. El papel ambiental lo determinaba clásicamente la presencia de cinco hallazgos epidemiológicos: a) El gradiente geográfico de frecuencia. b) Los agrupamientos de casos o posibles epidemias. c) Los cambios de frecuencia en relación con las migraciones. d) La falta de concordancia del 100% en gemelos monocigóticos. e) El cambio objetivado en la frecuencia en determinadas áreas con mayor rapidez de lo que se podría atribuir a una influencia genética. A favor de una predisposición genética se contarían los siguientes factores: a) Las diferencias raciales en su frecuencia b) La existencia de grupos étnicos resistentes a padecerla a pesar de las migraciones. c) La agregación familiar demostrada. d) La concordancia en gemelos monocigóticos en torno a un 30% frente al 5% de gemelos dicigóticos. e) La asociación con determinados haplotipos del antígeno leucocitario humano (HLA)(4). En los últimos trabajos epidemiológicos descriptivos se ha demostrado un sorprendente cambio en el patrón demográfico de la epidemiología de la EM. Se ha observado, por un lado, un incremento de la prevalencia de la enfermedad en clara relación con el aumento de la supervivencia. Por otro lado, se ha registrado un aumento de la incidencia en numerosos lugares, fundamentalmente en las mujeres, lo que genera un aumento en la ratio mujer-hombre de 2:1 a 3:1. Por último, se ha desterrado la teoría del gradiente latitudinal en Norteamérica y en Europa(5-7). 47 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] El elevado aumento en la ratio mujer-hombre observado indica la existencia de una influencia ambiental en el riesgo de EM, pero los factores ambientales posiblemente actúen a nivel poblacional más que a nivel individual. Probablemente, la razón de este incremento de la EM en las mujeres pueda deberse en parte a los cambios en el estilo de vida de las mujeres de los países industrializados en las últimas décadas (hábito tabáquico, incorporación a todo tipo de profesiones, control de la natalidad, maternidad tardía…). Los estudios analíticos que pretendan buscar asociación entre los factores de riesgo ambiental y la EM deberán tener presentes estos últimos cambios. Cada vez se considera más compleja la interacción ambiente-gen, dado que una determinada secuencia genética no sólo determina susceptibilidad sino que los factores ambientales pueden a su vez alterar la expresión genética y generar respuestas anómalas que acaban produciendo enfermedad(5). Como se verá más adelante en este capítulo, varios estudios relacionan factores ambientales concretos (vitamina D, tabaco…) con determinados polimorfismos genéticos (HLADRB1*1501). La epigenética que estudia las modificaciones en la función de un gen sin que haya cambios en la secuencia del ADN se ha demostrado implicada en esta enfermedad. Entre los factores que se han relacionado con los mecanismos epigenéticos, capaces de producir esos cambios, están algunos de los factores ambientales reconocidos y aceptados en la EM, como la vitamina D o el hábito tabáquico. Además, algunos trabajos han demostrado que se produce un efecto sinérgico en lo relativo al riesgo de desarrollar la enfermedad cuando interactúan en pacientes predispuestos varios factores de riesgo a la vez (la hipovitaminosis D y el hábito tabáquico multiplican el riesgo de desarrollar EM en las personas que han tenido mononucleosis infecciosa)(6). A nivel poblacional, un estudio que analiza múltiples fuentes y registros (estudios de HLA, tasa de radiación ultravioleta B [UVB], registro de hábito tabáquico, prevalencia de EM) en países de Europa ha demostrado que tanto el HLA como la variación de radiación UV y la presencia de hábito tabaquito explicarían hasta en un 75% la discordancia de prevalencia en EM en esos países(7). Esto, a su vez, podría explicar la enorme variabilidad clínica y paraclínica que presentan los enfermos y que vemos a diario en nuestras consultas (formas recurrentes, progresivas, casos más o menos agresivos, variabilidad en pruebas complementarias y en respuestas a distintos tratamientos…). Todo esto, junto con las cuatro variantes descritas en la anatomía patológica, refuerza la idea de que un mismo concepto (EM) podría, en realidad, estar abarcando enfermedades o procesos distintos. 2/ Definiciones en epidemiología-genética Comenzaremos este capítulo recordando algunos conceptos teóricos relacionados con la epidemiología y la genética (Tablas 1 y 2). 48 [ Epidemiología analítica ] Tabla 1. Definiciones en epidemiología TÉRMINO DEFINICIÓN Causa Condición que, sola o acompañada de otras condiciones, inicia o permite iniciar una secuencia de acontecimientos que producen un determinado efecto Epidemiología Ciencia que estudia la distribución y los determinantes del fenómeno salud-enfermedad en las poblaciones humanas. Etimológicamente viene del griego y significa “tratado sobre el pueblo” (epi: sobre; demo: pueblo; logos: tratado) La comunidad sustituye al individuo a la hora de buscar la respuesta a ciertas preguntas sobre la etiología y la prevención de la enfermedad, y sobre los recursos necesarios para los cuidados de salud de esa población Epidemiología analítica Busca los factores que determinan la distribución encontrada e identifica asociaciones causales Epidemiología descriptiva Estudia la distribución de las enfermedades en relación con las variables “lugar”, “tiempo” y “persona” Estudios analíticos (analizan hipótesis) 1. Observacionales: no existe asignación controlada del factor de estudio. Si eliges a los sujetos en función de la exposición al factor, sería un “estudio de cohortes”; si los eliges por el efecto, esto es la presencia –ausencia de enfermedad–, sería un “estudio de casos-controles” 2. Experimentales: existe asignación controlada del factor de estudio y asignación aleatoria de los sujetos que participan en el mismo. Destacan el “ensayo clínico aleatorio”, los “ensayos de campo” y los “ensayos clínicos cruzados” 3. Cuasiexperimentales: existe asignación controlada del factor de estudio, pero no de los sujetos participantes. Serían los “ensayos comunitarios de intervención”, los “estudios antes-después” y los “estudios controlados” Estudios descriptivos (describen una situación) Describen las características y la frecuencia de un problema de salud en función de las características de persona, de lugar y de tiempo. Entre ellos destacan las “series de casos clínicos”, los “estudios ecológicos” y los “estudios transversales o de prevalencia” Factor de riesgo Variable endógena o exógena al individuo, controlable, que precede al comienzo de la enfermedad y que está asociada a un incremento de la probabilidad de aparición de la misma, y al que podemos atribuir “responsabilidad” en la enfermedad Indicador de riesgo Variable sin relación causal con el problema, pero cuya presencia alerta precozmente sobre el padecimiento Marcador de riesgo Variable no controlable, endógena al individuo (constitucional) y cuya presencia anuncia a los individuos particularmente vulnerables Es la medida de asociación de los estudios de casos-controles. El significado sería similar al de riesgo relativo, aunque no se puede calcular igual, dado que en este tipo Odds ratio de estudios no se conoce la incidencia de la enfermedad. Sería el resultado de dividir (razón de inconveniente) el cociente de los casos expuestos (a) entre los casos no expuestos (b), con el cociente de los controles expuestos (c) entre los controles no expuestos (d): OR = (a / b) / (c / d) Riesgo Probabilidad de desarrollar una enfermedad por estar expuesto a ciertos factores Riesgo relativo Medida de asociación de frecuencia de enfermedad entre los individuos expuestos a un factor de riesgo y los no expuestos. Mide la “fuerza de asociación” entre el factor de riesgo y la enfermedad. Es la medida utilizada en los estudios de cohortes. Es el resultado de dividir la incidencia en los expuestos entre la incidencia en los no expuestos. Si es > 1 es un factor de riesgo; si es = 0 es indiferente, y si es < 1 es un factor de protección 49 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] Tabla 2. Definiciones en genética(8) TÉRMINO DEFINICIÓN Alelo Diferentes formas posibles de una mutación Epigenética Parte de la genética que estudia los procesos que desencadenan alteración en la función de un gen sin que se haya producido alteración en su secuencia de ADN. Dichas modificaciones pueden transmitirse a las células hijas Haplotipo La configuración de los alelos concretos de un individuo cuando existen varias mutaciones en un gen Impriming Condición en la que uno de los dos alelos de un típico par de genes es silenciado por un proceso epigenético tal como metilación o acetilación. Esto se convierte en un problema si el alelo expresado está dañado o contiene una variante que aumenta la vulnerabilidad a factores externos Mecanismos epigenéticos Mecanismos que generan alteración en la funcionalidad de un gen (metilación del ADN, modificación de la cromatina, acetilación, fosforilación…) Microsatélites El polimorfismo es de una secuencia más larga Polimorfismos Cuando una mutación aparece en una frecuencia superior al 1% de la población. Pueden aparecer sobre los exones y originar cambios en la proteína de efecto variable, ser silentes o aparecer en los intrones SNP (single nucleotide polymorphism) Cuando el cambio se produce en una sola base STR (short tandem repeat) Cuando los polimorfismos son de una determinada repetición de un doblete o triplete de bases 3/ Epidemiología ambiental Introducción Desde el inicio del conocimiento de la EM se ha considerado la posibilidad de que la enfermedad tuviera un origen ambiental. Los estudios de migración, los gradientes geográficos y el alto grado de discordancia en gemelos monocigóticos pusieron de manifiesto la importancia del ambiente en el desarrollo de la enfermedad (en concreto, la exposición a uno o varios factores durante la infancia y la adolescencia temprana[4]). Datos epidemiológicos observacionales han apuntado hacia la asociación de ciertos factores ambientales y la EM, lo cual no significa necesariamente causalidad. Esta equivalencia es especialmente difícil de probar en la EM, debido a que en esta enfermedad los periodos entre la actuación del posible factor causal, el inicio de la enfermedad y el momento de su diagnóstico pueden ser muy prolongados. 50 [ Epidemiología analítica ] Quizá el mayor peso de los factores ambientales en la etiología de la enfermedad lo han demostrado los estudios migratorios, que reflejan los cambios en el riesgo a padecer la enfermedad cuando se migra en edades tempranas de la vida de una zona de alto riesgo a otra de bajo riesgo; se observa una tendencia a adquirir el riesgo de la nueva área(4,9,10). Aunque muchos de estos estudios han presentado errores metodológicos y no están exentos de sesgos a la hora de poder sacar conclusiones, la característica común de todos ellos es que las poblaciones emigrantes tienden en general a adoptar la frecuencia del país de destino. No obstante, mantienen algunas diferencias según la etnia de origen. Esto se ha visto en distintos países (Israel, Sudáfrica, Estados Unidos, Reino Unido, Australia, Nueva Zelanda), pero dicho cambio de frecuencia no se produciría hasta la generación de los hijos de los emigrantes, ya nacidos en el país de destino. Los estudios de emigrantes apoyan la susceptibilidad genética a la EM pero influenciada por factores ambientales, que posiblemente actuarían antes de la adolescencia(4). Los diferentes estudios realizados en familias con algún miembro afecto han demostrado el poco peso que tienen los factores microambientales en el riesgo de desarrollar la enfermedad. Se asumen factores macroambientales que actúen a nivel poblacional(11). Numerosos factores ambientales han sido postulados como posibles desencadenantes o facilitadores de la enfermedad o como factores protectores(2,10,12-15). El listado es incontable (infección por virus de Epstein-Barr [VEB], herpes virus humano de tipo 6 [HHV6], sarampión, tifus, Chlamydia, otras infecciones, exposición solar, vitamina D, hábitos dietéticos, hábito tabáquico, actividades laborales, convivencia con animales domésticos, traumatismos, estrés psíquico, exposición a tóxicos, radiaciones…). Muchos de ellos vienen reflejados en estudios pequeños, no corroborados por otros grupos, en estudios mal diseñados o sin evidencia científica. Algunos de estos factores han demostrado ser posibles desencadenantes de brotes, al modificar el curso evolutivo de la enfermedad, lo que, no obstante, no significa causalidad. Además, la relación de asociación de algunos factores con la EM sólo se ha demostrado a nivel poblacional, pero no se ha podido concretar a nivel individual en numerosos pacientes. Debido a las características propias de esta enfermedad, es muy difícil establecer hipótesis causales, a pesar de que se ha podido demostrar asociación en algún estudio. Se debe huir de los titulares sensacionalistas que tanto gustan a la prensa (“usar móvil produce EM”) y tanto desconcierto generan en los enfermos. Además, a lo anterior se añade la dificultad de comparar resultados entre distintos estudios debido a los diferentes diseños metodológicos empleados, aun cuando se quiera medir lo mismo. Tras intentar compendiar la abundante información acumulada tras tantos años de estudio, se ha llegado a la conclusión que para poder responder a las distintas evidencias encontradas debe de haber un factor (Tabla 3) o seguramente varios factores ambientales que actúen en tres periodos distintos: 1. Durante el embarazo y en las primeras etapas de recién nacido, periodo también conocido como el “efecto maternal”. Dicho efecto se sustenta en tres observaciones epidemiológicas. La primera es que los “medio hermanos” (con sólo un progenitor común para ambos) tienen el doble de riesgo de presentar EM cuando comparten la madre que cuando es el padre el progenitor común. Se ha propuesto para explicar este hecho la posible existencia de un factor ambiental intrauterino o del periodo posnatal, aunque este incremento del riesgo podría no tener un origen ambiental sino que podría estar 51 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] Tabla 3. Posibles etapas del efecto de la vitamina D en relación con la esclerosis múltiple ETAPAS HECHOS EVIDENCIADOS La diabetes gestacional y la obesidad durante el embarazo, que disminuyen los niveles de vitamina D, están asociadas con mayor riesgo de EM. Hay teorías que relacionan el mayor riesgo encontrado en gemelos dicigóticos –en comparación con el de otros hermanos– con algún factor intrauterino Embarazo Varios estudios que demuestran el mayor riesgo en los nacidos en mayo lo relacionan con la mayor deficiencia de vitamina D maternal durante los meses de invierno Este periodo coincide con el rápido desarrollo del sistema nervioso. La observación de que el déficit de vitamina D puede alterar la expresión de genes codificantes mitocondriales y proteínas sinápticas en cerebros de rata podría ser importante en la etiología de la EM Estudios migracionales han demostrado que el riesgo se altera cuando la migración se realiza antes de los 15 años de edad Evitar el sol durante la infancia y niveles bajos de vitamina D en adolescentes se asocian Infancia temprana y con un mayor riesgo de EM adolescencia Este periodo coincide con el desarrollo tímico. La reducción en la expresión del HLA-DRB1*15 provoca una carencia de vitamina D en el timo durante las etapas tempranas de la vida, carencia que puede generar una pérdida de tolerancia central y aumentar el riesgo de desarrollar enfermedades autoinmunes Estudios migracionales en Australia han demostrado que el riesgo puede modificarse en la edad adulta. Trabajar al aire libre y habitar en áreas de alta exposición solar están asociados con un menor riesgo de EM Etapa adulta Después del inicio de la enfermedad, los niveles de vitamina D son más bajos en los pacientes de EM que en los controles. Los niveles de vitamina D son más bajos durante los brotes que en las remisiones Se ha demostrado que la capacidad de las células reguladoras T para suprimir la proliferación de las células T en la EM depende de los niveles de vitamina D. Esta información demuestra la importancia del papel de la vitamina D en los pacientes ya diagnosticados Fuente: modificado de B.R. Becklund et al.(21) vinculado a mecanismos epigenéticos así como a un impriming que favorecerían la expresión de determinados genes maternos. La segunda observación epidemiológica es la mayor concordancia entre gemelos dicigóticos (5,4%) que entre los hermanos que no son gemelos (2,9%), lo que apunta a posibles factores ambientales en este periodo. La tercera observación epidemiológica guarda relación con el mes de nacimiento. Se ha demostrado en diferentes países del hemisferio norte un predominio de pacientes con EM nacidos en el mes de mayo en comparación con los nacidos en el mes de noviembre. Además, se ha demostrado que este efecto se invierte en los países del hemisferio sur (mayor incidencia en Australia en los nacidos en noviembre-diciembre)(16). La hipótesis más aceptada, como veremos detalladamente más adelante, es la relación con una baja exposición solar y radiación ultravioleta los meses previos al nacimiento, situación que genera bajos niveles de vitamina D en la madre. 52 [ Epidemiología analítica ] IMIENT ina D Vitam es Nivel les a norm Niveles de suero de vitamina D O Fisio l la vit ogía de amin aD Pro ces Hip os inf hig ótes ecc ién is ios ica os VEB ,HH V-6 ... it Défic FACTORES o Efect utico é D terap itamina v de la ? FACTORES PROTECTORES ? ESCLEROSIS MÚLTIPLE ? DE RIESGO ? Hábito tabáquico, etc. FACTORES AMBIENTALES PACIENTES CON EM Experimentación (EAE) logía io Epidem I rel nmun a la v ciona ología itam da ina con D ES ANT CONOC M DE E FACTORES GENÉTICOS Figura 1. Representación esquemática de los factores de riesgo y protectores (flechas grises de trazo punteado) en la esclerosis múltiple. EAE: encefalomielitis autoinmune experimental; EM: esclerosis múltiple; HHV: herpes virus humano; VEB: virus de Epstein-Barr. Fuente: modificado de C. Pierrot-Deseilligny et al.(18). 2. En la infancia y la adolescencia. Los estudios de migración han demostrado el cambio en el riesgo en relación con la migración cuando se produce antes del final de la adolescencia. La migración de áreas de alta prevalencia a zonas de baja prevalencia provoca que se adquiera el riesgo de la nueva zona si se migra antes de los 15 años de edad, y se mantiene el de origen si se migra después. Además, los hijos de inmigrantes procedentes de áreas de baja prevalencia que nacen en áreas de alta prevalencia adquieren el riesgo de la población en la que nacen. 3. En la edad adulta. Se sabe que los síntomas clínicos de la EM se retrasan varios años o incluso décadas después de los periodos críticos descritos anteriormente. Se ha observado una enorme variabilidad en el desarrollo de la enfermedad en personas expuestas en esas fases a los mismos factores ambientales, por lo que se presupone la interacción de otros factores ambientales en edades posteriores que condicionen la aparición de la enfermedad(12,17). En términos generales, se acepta que el grupo étnico, la carga genética individual, la historia ambiental familiar, el mes de nacimiento, la latitud y el clima del país donde se vive, el estilo de vida individual, las infecciones ocurridas durante la infancia o en la adolescencia, y otros posibles factores ambientales, incluido el tabaco, van a contribuir a la aparición de la enfermedad (Figura 1)(18). 53 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] Vitamina D y esclerosis múltiple En los últimos años se ha considerado a la hipovitaminosis D un posible factor de riesgo ambiental en la EM. Metabolismo de la vitamina D La formación de vitamina D activa en el ser humano requiere, en un primer paso, la conversión del 7-deshidrocolesterol localizado en la piel a previtamina D3 mediante la acción de la radiación UVB (longitud de onda de 280-320 nm) presente en la luz solar. La vitamina D3 es la que se forma por la reorganización interna en la médula ósea a partir de la molécula previtamina D3. Después es hidroxilada por la 25-hidroxilasa a 25(OH)D3, sobre todo en el hígado, y posteriormente bajo la influencia de la hormona paratohormona, por la 1-α-hidroxilasa en los tejidos (sobre todo en el túbulo proximal renal) a su forma activa 1,25-dihidroxicolecalciferol o 1,25(OH)2D3 o calcitriol. Esta forma activa se libera al torrente sanguíneo con una vida media de varias horas, uniéndose y activando los receptores de vitamina D en diferentes tejidos (intestino, hueso, riñón, gónadas, pulmón, páncreas, sistema cardiovascular, cerebro-microglía y células inmunitarias circulantes-macrófagos, monocitos, linfocitos T y B activados). En todos estos sitios se puede transformar la 25(OH)D3 en 1,25(OH)2D3(18,19). Entre las funciones de la vitamina D descubiertas en los últimos años –aparte de su ya clásico papel en el metabolismo del calcio– estarían las antiinflamatorias, antiinfecciosas, inmunomoduladoras, antiproliferativas y como neurotransmisor. Asimismo, se ha demostrado que tiene importantes efectos en el desarrollo y la función cerebral, en la proliferación celular y la apoptosis, en la regulación de la presión sanguínea y en la secreción de insulina. Se ha relacionado la vitamina D con múltiples enfermedades autoinmunes (diabetes mellitus de tipo 1, artritis reumatoide, lupus) y se ha hallado que participa en la diferenciación de las células inmunes y que modula la respuesta inmunitaria. También se ha relacionado con algunos cánceres (especialmente los de colon y mama). Además, se ha visto que está implicada en enfermedades del sistema cardiovascular, en infecciones y en síntomas generales como debilidad muscular y caídas(18,19). Niveles óptimos de vitamina D La 25(OH)D3 es el parámetro representativo de todo el almacén de vitamina D en el organismo y es el valor utilizado en la práctica clínica. La vida media de la 25(OH)D3 es de varias semanas (20-60 días). Por consenso se ha establecido que los niveles mínimos para determinar un estado óptimo de vitamina D serían de 50-100 nmol/L (20-40 ng/mg). La mayoría de los expertos aconsejan valores mínimos de 75-80 nmol/L(18). Estas cifras son aleatorias y están basadas en estudios centrados fundamentalmente en el metabolismo del calcio y la enfermedad ósea. No se ha concretado con exactitud a partir de qué valores mínimos las restantes funciones de la vitamina D se considerarían deficitarias(18,19). Tras las últimas investigaciones también están cambiando las cantidades diarias recomendadas de vitamina D. Lógicamente, las cantidades necesarias vendrán condicionadas por 54 [ Epidemiología analítica ] los niveles de 25(OH)D3 que consideremos óptimos para la salud. Si consideramos el nivel óptimo los 75 nmol/L, serían necesarias unas 2.000 UI/día de media. El suministro en la dieta de vitamina D podría solventar la falta de vitamina procedente de la radiación UVB y mantener unos niveles adecuados en sangre de vitamina D, a pesar de que la exposición a dicha radiación sea baja. Desgraciadamente, son escasas las fuentes naturales dietéticas de aporte de esta vitamina. Sólo se ha encontrado en grasas de pescado azul de agua salada (atún, sardinas, salmón, arenques) y en la grasa de reno. Actualmente, y de forma artificial, también se encuentra en determinados alimentos fortificados (cereales, leche, quesos, algunos zumos de naranja…). Se calcula que el aporte de vitamina D en una dieta normal y equilibrada se situaría en torno a 100 UI/día (40-400 UI/día). Incluso en trabajos realizados con dietas fortificadas con vitamina D, los valores aportados se situarían por debajo de los requerimientos óptimos (75 nmol/L). La exposición solar es la principal fuente natural de vitamina D y proporciona cerca del 90% de los requerimientos diarios. Se calcula que la exposición directa al sol de la cara, el tronco y los brazos, en verano, durante media hora, proporciona 10.000 UI de vitamina D. Además, las personas mayores y los sujetos de raza negra tienen menor capacidad de sintetizar vitamina D tras la exposición solar que los jóvenes y las personas de piel clara. Otros factores, como el uso de cremas protectoras, vivir en áreas urbanas, o factores ambientales que reduzcan la longitud de onda de la UVB sobre la superficie terrestre (el invierno, la contaminación, los cielos cubiertos, las latitudes altas, niveles bajos de ozono), contribuyen a reducir la síntesis cutánea de vitamina D(19). Debido al papel primordial que cumple la exposición solar en relación con la vitamina D, se acepta que las poblaciones con mayor riesgo de presentar déficit de vitamina D son las situadas más allá de los paralelos 40 norte y sur (recuérdese que el paralelo 40 norte pasa por el centro de España). En estas zonas, la radiación solar (UVB) llega a ser insuficiente de 4 a 8 meses al año. Además, la radiación UVB sólo está presente unas pocas horas al día, en torno al mediodía. Los niveles de vitamina D en la población general de dichos países se sitúan en los límites bajos. Numerosos estudios poblacionales realizados en estas áreas (Estados Unidos, Canadá, Reino Unido, Australia, Alemania) han demostrado niveles bajos en general a nivel poblacional, con variabilidad regional (gradiente norte-sur), estacional (verano-invierno) y según el color de la piel o el estilo de vida. Además, en dos cohortes poblacionales realizadas en Estados Unidos con un intervalo de 10 años de diferencia se ha observado una caída en el nivel medio de vitamina D de hasta 10 nmol/L en relación con el desarrollo de hábitos urbanos y con el incremento del sedentarismo y la obesidad(18). Otros estudios han demostrado que los niveles de vitamina D estarían condicionados por una serie de factores entre los que destacan: la edad (a mayor edad, menor eficiencia en la síntesis de vitamina D), el género (las mujeres suelen presentar niveles más bajos que los hombres), el color de la piel (las pieles oscuras sintetizan la vitamina D peor que las pieles claras, al ser la melanina el pigmento que absorbe la UVB), el tipo de vestuario, la alimentación y el grado de desarrollo urbano (la vida sedentaria y la realización de actividades laborales y de ocio en espacios cerrados). Lo que se acepta, con excepciones, es que en torno al 50-90% de la población general de los países nórdicos presenta de forma más o menos permanente una insuficiencia de vitamina D(18,19). 55 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] Resultados experimentales de vitamina D y esclerosis múltiple La encefalomielitis autoinmune experimental (EAE) se ha considerado el mejor modelo experimental de EM. Sobre ese modelo existen en los últimos 20 años multitud de trabajos que han relacionado a la vitamina D con la inmunología y la patología inflamatoria neurológica central. Se ha demostrado que la 1,25(OH)2D3 tiene un efecto preventivo y curativo en la EAE. Este efecto requiere la presencia de calcio y posiblemente sea exclusivo de las hembras. Asimismo, se ha comprobado que es importante que los niveles de los receptores de vitamina D, de la interleucina (IL)-10 y del receptor de IL-10 se hallen dentro de los límites de la normalidad, dado que la vitamina D no previene la EAE en aquellos ratones que presentan defectos genéticos en estos mediadores. Se ha demostrado que hay varios mecanismos inmunológicos implicados en ello: efecto antiinflamatorio, acción sobre los macrófagos, acción sobre diferentes tipos de citocinas, regulación de los linfocitos T, e incremento de la ratio de linfocitos Th2 (protectores) y Th1 (agresivos) que genera una acción antiinflamatoria (mecanismo similar al desarrollado por el interferón β [IFN-β]). En trabajos publicados recientemente se ha demostrado que el efecto protector de la vitamina D residiría en la recombinación funcional con activación genética (RAG1) y que no afectaría directamente a las funciones de Th1 y Th2 in vivo, sino que promovería la regulación de la función de las células T (células dependientes RAG1)(19). Los últimos experimentos, además, han demostrado el efecto sinérgico y beneficioso desde el punto de vista terapéutico de asociar IFN-β y vitamina D en la EAE(18,19). En la EAE se ha demostrado recientemente que podría existir un efecto beneficioso de la UVB independientemente de los niveles de vitamina D, considerando un posible efecto inmunosupresor al atenuar la respuesta inmunológica mediada por Th1(21). Hallazgos epidemiológicos Efecto de la latitud y el riesgo de esclerosis múltiple El efecto latitudinal es algo bien conocido desde hace décadas y comúnmente aceptado. Se considera que la prevalencia de la enfermedad aumentaría conforme nos alejamos del ecuador en un modelo de distribución incompleta. Los países situados más allá de los paralelos 40 (al norte, Canadá, Estados Unidos, Rusia y los países de Europa, y al sur, Nueva Zelanda, Tasmania, y la Patagonia de Chile y Argentina) son los que mayor prevalencia de EM presentan. Existen excepciones a este modelo geográfico, con áreas de alta prevalencia, como Cerdeña, y poblaciones como los inuit, que, aun habitando en latitudes altas, presentan bajas tasas de prevalencia. Aunque no se conocen las razones de lo irregular de esta distribución, se cree que la presencia de otros factores ambientales y la importancia de la predisposición genética podrían explicarlo. En algún estudio reciente se ha seguido evidenciando el efecto latitudinal en relación con la prevalencia de EM. Este efecto se ha observado a escala mundial, en múltiples países y continentes, sobre todo en aquellas zonas que tienen poblaciones de origen noreuropeo, y se ha demostrado el gradiente latitudinal norte-sur incluso dentro de pequeños países, como Francia o Nueva Zelanda. En un trabajo realizado en granjeros franceses, el único factor estadísticamente significativo que distinguía la prevalencia de EM entre los de la región noreste y 56 [ Epidemiología analítica ] los de la región suroeste era el clima, que estaba condicionado por una notable diferencia en la exposición solar(22). No obstante, los últimos trabajos cuestionan la teoría latitudinal y descartan que la latitud ejerza un papel clave en el origen de la enfermedad(5). En Estados Unidos se han expuesto varias posibles explicaciones, que abarcarían desde las mejoras higiénicas en las poblaciones del sur (donde ha disminuido la tasa de infestación por helmintos –que era un factor protector frente a EM– y han aumentado, en cambio, las infecciones tardías por VEB –claro factor de riesgo para EM–) hasta la desaparición del gradiente norte-sur en lo referente a la vitamina D, al administrar de forma generalizada a toda la población leche enriquecida con vitamina D, debido a lo cual han disminuido claramente las tasas de raquitismo en el norte. Efecto de la exposición solar sobre el riesgo de esclerosis múltiple Los primeros trabajos en este campo se basaron en estudios de casos-controles mediante cuestionarios aplicados a los pacientes y los controles. Se les preguntaba por el tiempo de exposición al sol durante las vacaciones y los fines de semana. Se observó que el riesgo de EM era menor en los que habían tenido mayor exposición solar durante su juventud. Estos trabajos añadían valoraciones dermatológicas que calculaban la actividad actínica en la piel del dorso de la mano, observando que, a mayor actividad, menor riesgo. En trabajos más recientes, incluido un metaanálisis que engloba 52 estudios de varios países del mundo, se ha encontrado una relación altamente significativa entre la prevalencia de EM y el acúmulo anual de UV en esas áreas. Esta relación es 20 veces más significativa que la encontrada entre la prevalencia de EM y la latitud(23). Se ha demostrado que, a igual latitud, en las regiones más soleadas, el riesgo de EM es menor. En otro tipo de estudios epidemiológicos se ha visto menor incidencia de cánceres relacionados con la exposición solar en los pacientes afectos de EM que en los controles. No se ha objetivado menor incidencia en otros tipos de cáncer. Tampoco se ha observado menor incidencia de cáncer por exposición solar en otras enfermedades autoinmunes. La principal crítica a este tipo de estudios observacionales es que no se puede evaluar qué es primario y qué secundario, dado que la exposición solar en los enfermos puede estar condicionada por su mala tolerancia al calor o por las limitaciones físicas propias de la enfermedad(18,19). No obstante, los estudios realizados en poblaciones de inmigrantes judíos en Israel plantean numerosas cuestiones en relación con la exposición solar como factor de riesgo. Se aprecia, por un lado, mayor incidencia en los judíos descendientes de afroasiáticos que en sus antepasados, cuando la exposición solar de ambos grupos debería ser similar. Por otro lado, la tasa de prevalencia de EM en la población judía de Israel es mayor que en la población árabe que vive en esa misma área y que supuestamente debe estar expuesta a una radiación similar. Lo anterior se ha intentado explicar por las siguientes causas: a) Los cambios en el estilo de vida (de rural a urbano), con una reducción en el tiempo de exposición al sol. b) Las medidas preventivas inculcadas a la población con el fin de reducir la tasa de cáncer de piel relacionado con la exposición solar (aplicación de cremas protectoras, vestuario, evitación de la exposición en determinadas horas del día). c) Las diferencias raciales, con sus distintas susceptibilidades genéticas(18,19). 57 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] Efecto del estatus de vitamina D y riesgo de esclerosis múltiple Existe un único estudio de cohortes realizado en soldados americanos en los que se determinó la vitamina D en dos ocasiones, con un intervalo de varios años entre ambas. Este estudio demuestra que aquellos que presentan valores más elevados tienen menor riesgo de desarrollar EM. El riesgo de desarrollar EM es mayor en los nacidos en mayo que en los nacidos en noviembre. Los investigadores relacionan esto –desde el punto de vista teórico– con los niveles de vitamina D que recibe el feto durante el embarazo, dado que el aporte al feto de vitamina D es más elevado en otoño (tras la exposición solar del verano) y menor en primavera. Además, de forma indirecta, se han relacionado los niveles bajos de vitamina D durante el embarazo con un aumento del riesgo de padecer diabetes gestacional. En dos estudios longitudinales se observó un mayor riesgo (3-10 veces mayor) de EM en los individuos cuya madre había presentado diabetes gestacional. En un estudio prospectivo que incluyó a 200.000 mujeres en Estados Unidos se calculó de forma teórica el rango de vitamina D a través de un cuestionario semicuantitativo de comida, validado con muestras sanguíneas en 300 participantes y repetido cada 4 años. Se hizo un seguimiento durante 30 años y se determinaron los casos incidentes de EM. En este estudio se observó que, a mayor tasa de vitamina D, menor riesgo de EM; además, se vio que la incidencia decrecía en relación con el incremento de los niveles de vitamina D. Asimismo, la incidencia en las mujeres que tomaban suplementos de 400 UI o más de vitamina D era un 41% menor que en las que no los tomaban(19). No obstante, no se pueden extraer conclusiones irrefutables de los estudios publicados, dado que no han tenido en cuenta otros factores de riesgo que podrían sesgar los resultados. La obesidad se ha asociado a tasas más bajas de vitamina D. En varios estudios se ha encontrado que la diferencia entre los pacientes con un índice de masa corporal (IMC) en torno a 30 y los sujetos con un peso normal es de unos 37 nmol/L. Un estudio longitudinal que ha valorado el IMC a la edad de 18 años y el riesgo de EM encontró que la obesidad (IMC > 30) a los 18 años –pero no en etapas posteriores– confiere un riesgo 2 veces mayor de desarrollar EM(19). Con el fin de relacionar distintos factores de riesgo en la EM, algunos autores hipotetizan sobre la posibilidad de que los niveles de vitamina D actúen como factor de protección frente a las infecciones respiratorias (incluida la infección por el VEB) a través de la síntesis de catelicidina humana (LL-37). De hecho, se ha encontrado un paralelismo entre los meses en los que los niveles de vitamina D están más bajos (como marzo) y los picos de incidencia con enfermedades relacionadas con el VEB (como el linfoma de Hodgkin y la mononucleosis infecciosa)(24). Factores genéticos Los genes pueden afectar al metabolismo de la vitamina D, al color de la piel y al comportamiento de un sujeto. Todo ello, a su vez, puede condicionar los niveles de vitamina D en sangre. Además, variaciones genéticas en los receptores de vitamina D y de otros genes pueden influir en los efectos de la vitamina D sobre el sistema inmunitario. En gemelos monocigóticos y dicigóticos, el incremento de la ratio en concordancia con el incremento de la latitud sugiere que el efecto genético se incrementa con concentraciones bajas de vitamina D. Las variaciones en la tasa de vitamina D se han relacionado con factores genéticos, el más 58 [ Epidemiología analítica ] convincente de los cuales son los polimorfismos en el grupo de las proteínas transportadoras de vitamina D (group-specific component [GC]). No obstante, varios estudios han demostrado poca relación entre los distintos polimorfismos y la tasa de vitamina D. Algunos estudios iniciales encontraron una relación entre el riesgo de EM y ciertos polimorfismos en los genes que codifican los receptores de la vitamina D (en concreto, el polimorfismo CYP27B1)(20), aunque análisis posteriores no han demostrado una relación estadísticamente significativa(47). Lo mismo ha sucedido con otros polimorfismos estudiados (IL-10, SPP1, respondedores de vitamina D [VDR], NOD2…)(19,47). Sin embargo, se ha observado una asociación de algunos polimorfismos con determinados factores ambientales (por ejemplo, entre el polimorfismo del VDR FokI y los niveles de vitamina D procedente de la dieta, o entre los polimorfismos del VDR CDX23¨ o MC1R y la exposición solar). Estas observaciones ponen de manifiesto la importancia de los factores ambientales a la hora de valorar el riesgo de EM asociado a determinados polimorfismos genéticos(19). HLA-DRB1 y vitamina D El haplotipo HLA-DRB1*1501 es el marcador genético que mayor fuerza de asociación ha demostrado con el riesgo de EM (un riesgo 3 veces mayor) en pacientes con antecesores noreuropeos. No obstante, es difícil determinar la asociación entre los haplotipos HLA-DR y el riesgo de EM, debido a la gran heterogeneidad observada entre distintas poblaciones; además, en los últimos trabajos se ha observado que algunos haplotipos individuales tienen que verse influenciados por interacciones epistáticas con otros haplotipos HLA-DR. 0 Los efectos biológicos de la vitamina D están mediados por los receptores de vitamina D. Estos receptores pertenecen a la superfamilia de receptores esteroideos y modifican la transcripción de los genes respondedores a la vitamina D transportando en el genoma los elementos respondedores de vitamina D (VDRE). Los efectos de la vitamina D sobre la expresión de genes del complejo mayor de histocompatibilidad (MHC) de clase II son conocidos desde hace tiempo, y se ha demostrado que la vitamina D puede alterar la expresión y presentación de antígenos del HLA-DR. Recientemente se ha identificado en el promotor de la región del HLA-DRB1*1501 un VDRE altamente conservado (ausencia de mutaciones en 600 cromosomas). Sin embargo, este VDRE mostraba diferencias específicas en el haplotipo, dado que sí presentaba mutaciones en otros haplotipos no asociados a la EM. En los ensayos funcionales, con el fin de demostrar que ese VDRE influye en la expresión genética, se añadió 1,25(OH)2D3, y se observó respuesta sólo ante el haplotipo HLA-DRB1*1501. Los distintos experimentos realizados sugieren que los efectos de la vitamina D en el riesgo de EM serían dependientes de la presencia del haplotipo HLA-DRB1*1501. Este hecho deberá ser confirmado en estudios epidemiológicos. No obstante, ello supone un enorme avance, al relacionar de forma directa el locus con mayor susceptibilidad para EM y la vitamina D, uno de los factores ambientales más relevantes en esta enfermedad. Una hipótesis etiológica, pendiente de ser confirmada o rechazada, podría ser que la carencia de vitamina D en la infancia temprana podría alterar la expresión del HLA-DRB1 en el timo, lo que podría generar una pérdida de tolerancia central y un aumento del riesgo de autoinmunidad en edades posteriores(25,26). 59 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] La frecuencia de EM asociada al alelo HLA-DRB1*1501 varía sustancialmente entre los distintos grupos étnicos, siendo muy elevada en individuos caucásicos, y baja en africanos y asiáticos. Estos hallazgos descritos recientemente podrían explicar el gradiente geográfico de la EM, así como la razón de la baja prevalencia de EM en personas de razas con piel oscura que viven en climas templados, a pesar del déficit de vitamina D que presentan. Ello se debería a la capacidad de la melanina de filtrar la radiación UVB. Además, se ha observado que el HLA-DRB1*15 es más frecuente en mujeres afectas de EM que en varones, lo cual puede explicar, al menos parcialmente, por qué los niveles elevados de vitamina D se asocian con una incidencia reducida de EM específicamente en mujeres(25). Un estudio reciente realizado en familias de varias generaciones con EM demuestra la evidencia de un incremento en la penetrancia del HLA-DRB1*15 con el paso del tiempo en las mujeres, en paralelo al aumento del riesgo de EM en mujeres(27). En el futuro debería estudiarse la interesante posibilidad de si el descenso de los niveles de vitamina D en la población general debido a cambios en el estilo de vida (uso de protector solar, aumento de la obesidad, disminución de actividades al aire libre) ha aumentado la frecuencia de HLA-DRB1*15 en la EM(25). Por último, se ha demostrado que la relación entre el mes de nacimiento y el riesgo de EM (con un mayor riesgo en abril-mayo en el hemisferio norte) está presente cuando los pacientes son portadores del HLA-DRB1*15, pero no se aprecian diferencias estadísticamente significativas entre los pacientes no portadores y los controles(28). Aspectos inmunológicos Los macrófagos y las células T y B activadas contienen receptores de vitamina D, y la vitamina D controla la activación de las células T humanas. La 1,25(OH)2D3 ha demostrado poseer múltiples y diferentes mecanismos inmunológicos: a) Inhibe in vitro la producción de citocinas inflamatorias y promueve el desarrollo de linfocitos T que expresan antígeno 4, de linfocito T citotóxico (CTLA-4) y de foxp3, que produce un efecto antiinflamatorio. b) Suprime la formación de anticuerpos y la proliferación de células T en el timo. c) Disminuye la síntesis de citocinas proinflamatorias (IL-1, IL-2, factor de necrosis tumoral [TNF], INF-γ). d) Aumenta la síntesis de citocinas antiinflamatorias (IL-4, TGF-β). e) Inhibe la producción de óxido nítrico (NO) por los macrófagos (el NO es un potente bloqueante de la conducción axonal y su unión con otro radical libre de superóxido genera el peroxinitrito (NOOH), uno de los factores más agresivos y destructivos de oligodendrocitos y neuronas durante las fases inflamatorias). Se han publicado varios estudios de vitamina D y EM que demuestran que la proliferación de CD4+ está inhibida por la 1,25(OH)2D3. En otro estudio, se demostró la inhibición de la proliferación de Th1 en relación con los niveles de 25(OH)D(18,19). Niveles séricos de vitamina D en la esclerosis múltiple Numerosos estudios han demostrado la presencia de niveles bajos de vitamina D en pacientes con EM, incluso en fases muy tempranas. 60 [ Epidemiología analítica ] La media se situaba en torno a 50-65 nmol/L y lógicamente empeoraba en invierno con respecto al verano. En los estudios en que se usaban controles, éstos presentaban niveles significativamente más elevados. En algunos se ha demostrado relación entre los niveles de vitamina D y la tasa de brotes y el grado de discapacidad (EDSS [expanded disability status scale]). Desde el punto de vista radiológico, las resonancias magnéticas nucleares (RMN) cerebrales muestran un aumento de la carga lesional cuando los niveles de vitamina D están más bajos. En otro estudio realizado con 110 pacientes en edad pediátrica, se observó que la elevación de los niveles de vitamina D en 25 nmol/L se asociaba con un descenso del número de brotes de un 34%. Además, se demostró la presencia de niveles bajos de vitamina D durante los brotes y la elevación en los periodos de remisión(29). De todos modos, los expertos señalan que son necesarios estudios de cohortes poblacionales con seguimiento a largo plazo y con diferentes medidas de vitamina D en distintas estaciones para poder establecer el riesgo real de EM en caso de hipovitaminosis D. La mayoría de los estudios son casos-controles en los que se observan numerosos sesgos(19). De lo anteriormente expuesto se deduce que es preciso determinar el nivel de vitamina D de nuestros pacientes y administrar suplementos vitamínicos en caso de déficit. Algunos autores abogan por extender dicha determinación a las personas en situación de riesgo (síndrome clínico aislado [SCA], ciertos familiares de primer grado de pacientes con EM, y personas que han padecido mononucleosis infecciosa), con el fin de realizar un tratamiento preventivo en caso de déficit. Hallazgos recientes atribuyen importancia al efecto del HLA-DRB1*15 sólo en caso de déficit de vitamina D, por lo que algunos investigadores consideran que las campañas de suplementación con vitamina D a nivel poblacional serían más eficientes si se seleccionase a los sujetos según el HLA(25). En un estudio de cohortes poblacional se siguieron 2 grupos de mujeres durante 19 años y se observó una reducción del 40% en el riesgo de desarrollar EM en las pacientes que habían tomado suplementos de vitamina D (400 UI/día o más) frente a las que no los habían tomado(30). Por otra parte, se ha observado de forma reiterada un descenso paulatino de los niveles de vitamina D conforme avanza el curso clínico de la enfermedad. Ello se explica por varias razones: • Por un lado, la mala tolerancia al calor de los enfermos de EM (debido al fenómeno de Uthoff, al aumento de la fatiga y al empeoramiento de los síntomas neurológicos previos) hace que la exposición solar sea menor. • Por otro lado, la limitación física que genera la enfermedad impide, en muchas ocasiones, desarrollar actividades al aire libre. • Por último, se produce una pérdida de eficiencia en la síntesis de vitamina D relacionada con la edad. Se deberían analizar, en todos los pacientes con EM, los niveles séricos de vitamina D y administrar suplementos en caso de déficit, dado que además existen estudios que demuestran que los suplementos de vitamina D incrementan la salud general. Aun suponiendo la presencia de niveles normales de vitamina D en algunos pacientes incluso en invierno, no se excluye la hipótesis de una hipovitaminosis D como factor de riesgo a nivel poblacional (Tabla 4). Seguramente –y así lo demuestran determinados estudios–, la asociación de hipovitaminosis D con otros factores ambientales deletéreos (como el tabaco) y 61 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] Tabla 4. Evidencias del papel de la vitamina D en la esclerosis múltiple MECANISMO IMPLICADO HALLAZGOS La distribución global de la EM se incrementa con la distancia norte-sur del ecuador y está relacionada con la latitud La prevalencia de EM en emigrantes británicos a diferentes áreas de Australia Geografía y migraciones y Sudáfrica relacionadas con latitud y exposición solar genera un bajo riesgo de EM edad-dependiente Las ratios de concordancia de EM entre los gemelos varía con la latitud del lugar de nacimiento Exposición solar anual, radiación UV ambiental y radiación solar diaria en diciembre en el lugar de nacimiento están inversamente asociadas a la EM Exposición solar Trabajar al aire libre, vivir en un área de alta exposición solar y ocupaciones con alta exposición a radiación UV están asociados con un bajo riesgo de EM y bajas ratios de mortalidad Incrementos en actividades con exposición solar en la infancia están asociados a bajo riesgo de EM Administrar suplementos de vitamina D está inversamente asociado con riesgo de EM Niveles circulantes de vitamina D Altos niveles de vitamina D circulante están asociados con un bajo riesgo de EM previo al inicio de la enfermedad Bajos niveles de vitamina D están asociados con un riesgo aumentado de EM, mayor tasa de brotes y mayor discapacidad Variantes genéticas en los genes del receptor de la vitamina D están asociadas con la EM Se han descrito casos de EM asociados al raro raquitismo vitamina D-dependiente de tipo I (causado por mutación en el gen de la 1-α-hidroxilasa) Mecanismos genéticos Hay escasez de proteínas trasportadoras de vitamina D en muestras de LCR de pacientes con EM en comparación con los controles El alelo principal del HLA relacionado con la EM (HLA-DRB1*1501) es regulado por la vitamina D El genome-wide association study identifica el riesgo de EM en variantes próximas al gen de la 1-α-hidroxilasa Se han observado remisiones clínicas en la EM durante el embarazo coincidiendo con incrementos en los niveles de vitamina D Embarazo, estaciones del año y otros Las personas nacidas en mayo presentan mayor riesgo de EM que las nacidas en noviembre La diabetes gestacional y la obesidad durante el embarazo –que disminuyen los niveles de vitamina D– están asociadas con un mayor riesgo de EM Fuente: modificado de B.R. Becklund et al.(21) 62 [ Epidemiología analítica ] la predisposición genética (que, a su vez, puede condicionar el metabolismo y los efectos de la vitamina D) contribuirán al inicio y al desarrollo de la enfermedad. Infecciones y esclerosis múltiple Introducción Muchas de las investigaciones de agentes infecciosos como posible causa de la EM se basan en observaciones clínicas, de anatomía patológica o de experimentación animal. No obstante, cualquiera de los agentes propuestos debería poder explicar además las observaciones descriptivas encontradas en los estudios epidemiológicos tan característicos de la EM. Se han propuesto dos hipótesis en la etiología infecciosa de la EM con el fin de explicar la epidemiología de la enfermedad. Algo común a ambas es que los gérmenes implicados serían patógenos comunes de amplia distribución más que gérmenes raros. Las dos teorías propuestas son: • La hipótesis higiénica, según la cual el contacto o la infección en edades tempranas de la vida con el agente patógeno protege frente al riesgo de desarrollar EM, y contactos o infecciones con el mismo agente en etapas posteriores (infancia tardía y adolescencia) generarían la enfermedad. • La hipótesis de prevalencia, que postula que la EM es causada por un patógeno que es más común en regiones con alta frecuencia de EM. Según esta teoría, el patógeno generaría una infección persistente asintomática en muchos casos y sólo raramente y años después de la primoinfección el agente causaría síntomas neurológicos(31). Desde el punto de vista patogénico, se han propuesto varias teorías con el fin de explicar cómo la infección contribuye al desarrollo de la EM; algunas de ellas son más convincentes que otras: 1. Hipótesis de hit and run y mimetismo molecular: la EM sería consecuencia de una reacción autoinmune que se habría iniciado por una infección monofásica. 2. Hipótesis del mimetismo molecular por infección persistente: una infección periférica persistente generaría una reacción inmune que actuaría contra el SNC. 3. Hipótesis de la infección directa: la EM sería el resultado de la infección de las células de la glía (por ejemplo, los oligodendrocitos), que iniciaría la inflamación focal en el SNC. 4. Hipótesis de la desregulación inmunológica: una infección generaría la alteración del sistema inmunológico y produciría una enfermedad autoinmune órgano-específica. 5. Hipótesis de la doble infección: la EM sería el resultado de la coinfección de dos gérmenes. Numerosos agentes infecciosos han sido implicados como posibles agentes causales de la EM. De todos ellos, los que mayor asociación de riesgo han demostrado han sido el VEB, el HHV-6, los retrovirus endógenos humanos (HERV) asociados a EM y, en menor medida, la Chlamydia pneumoniae(13). Retrovirus endógenos humanos Se ha aislado HERV en muestras de suero, plasma y líquido cefalorraquídeo (LCR) de pacientes con EM. Estos retrovirus presentan complejas interacciones, lo cual incrementa la posibilidad, al interactuar con otros virus, de desarrollar la enfermedad (two-hit hypothesis). 63 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] En cultivos neuronales y de células endoteliales cerebrales, el herpes simple de tipo 1 induce la unión de HERV y proteínas de envoltura. Se ha observado expresión de esta unión en lesiones de EM. Asimismo, se ha observado un acúmulo de antígenos de unión en estructuras axonales en sustancia blanca desmielinizada y en células endoteliales de pacientes de EM, pero no en controles. Sin embargo, se ha encontrado proteína de envoltura en la microglía del cerebro en estudios de casos-controles. Aún no está confirmado si la presencia de copias de HERV es realmente resultado de la infección de éstos en los pacientes con EM o si, por el contrario, refleja una mala regulación de las copias de HERV. Herpes virus humano de tipo 6 Este virus infecta teóricamente a todos los niños a la edad de los 2 años, por lo que no se puede determinar el riesgo entre los infectados y los no infectados. Estudios patológicos demostraron la presencia del virus en las placas de EM. Se han hallado ADN viral y otros marcadores en células sanguíneas, suero y LCR de pacientes afectos de EM. Además, se ha demostrado mayor frecuencia de reactivación del virus en los pacientes de EM que en los sujetos sanos. No obstante, no se excluye la posibilidad de que estos hallazgos sean consecuencia y no causa de la EM(14,31). Chlamydia pneumoniae Un estudio inicial demostró que el 97% de los pacientes con EM tenían reacción en cadena de la polimerasa (PCR) positiva para C. pneumoniae en el LCR frente al 18% de los controles. No obstante, estos datos no han vuelto a ser reproducidos. En un estudio de cohortes prospectivo se demostró un aumento del riesgo de EM en las personas que tenían serología positiva para C. pneumoniae. No obstante, se ha encontrado C. pneumoniae en numerosas enfermedades neurológicas, no sólo en la EM. Por ello, aunque inicialmente se hizo mucho énfasis en el papel de la C. pneumoniae en la EM, actualmente se considera que es poco relevante. Es posible que los pacientes tengan mayor dificultad para eliminar este microorganismo del SNC(14,31). Virus de Epstein-Barr El agente infeccioso cuya implicación en la patogenia de la enfermedad ha sido más ampliamente demostrada y sobre el que más estudios se han desarrollado y publicado es el VEB. Se han publicado múltiples tipos de estudios tanto de epidemiología descriptiva como analítica, así como estudios experimentales que ponen de manifiesto dicha asociación. Una de las observaciones epidemiológicas que más pesan en el papel que desempeña el VEB en la etiopatogenia de la EM es el hecho de que es extremadamente raro encontrar EM en sujetos seronegativos. En un estudio longitudinal de seguimiento de una cohorte de adultos seronegativos se observó que la EM sólo se presentaba después de la infección por el VEB(32). Un hallazgo consistente encontrado en todos los estudios de casos-controles realizados es el de la infección por VEB en prácticamente todos los pacientes con EM (> 99%), frente al 90% encontrado en los controles. 64 [ Epidemiología analítica ] Por otra parte, el momento de la infección juega un papel fundamental. Se ha observado un aumento del riesgo (el cual es 2-3 veces superior) en los pacientes que se infectan en la adolescencia –infección que se manifiesta como mononucleosis infecciosa– frente a los que adquieren la infección en edades tempranas de la vida y no manifiestan síntomas. Se ha demostrado un paralelismo desde el punto de vista epidemiológico entre la EM y la mononucleosis infecciosa. Así, ambas afectan a adultos jóvenes, presentan un gradiente geográfico de distribución, afectan más a niveles socioeconómicos elevados, y menos a pacientes de raza negra y asiáticos, siendo excepcional encontrarlas en esquimales, y ninguna de las dos afecta a los pacientes que adquieren la infección por el VEB en edades tempranas de la vida. Otro hecho a favor del nexo entre el VEB y la EM fue una pequeña epidemia de EM que se desencadenó en un pueblo danés (Fjelso) donde se demostró que los 8 casos afectos de EM se produjeron directamente tras un brote infeccioso por VEB y todos habían sido infectados por una misma cepa de VEB(13). En las personas seropositivas los títulos de anticuerpos permanecen estables a lo largo de su vida y generan una estimulación continua del sistema inmunitario. Habitualmente se determinan dos tipos de anticuerpos: a) Uno frente al antígeno de cápside viral (VCA): es un antígeno temprano que se expresa en el ciclo lítico. b) Otro frente al antígeno nuclear EB (EBNA), expresado en las células infectadas de forma latente: es un complejo constituido por 6 proteínas distintas, una de las cuales (EBNA-1) es la reconocida primariamente en el complejo anti-EBNA. Habitualmente, en estudios clínicos y de investigación, se utilizan anticuerpos contra EBNA-1 y 2. Al inicio de la mononucleosis infecciosa se observan títulos elevados de IgM contra el VCA, con posterior elevación de títulos de IgG contra el VCA, que permanecerán de forma estable indefinidamente. La reactividad frente al EBNA-1 y 2 aparece en distintos momentos. La IgG EBNA-2 aparece en la fase aguda de la enfermedad y decrece durante la convalecencia. La IgG EBNA-1 se empieza a detectar únicamente durante la convalecencia y permanecerá estable a lo largo de la vida. La IgG anti-EBNA-1 y la IgG anti-EBNA-2 tienen comportamientos contrarios durante la inmunosupresión. Así, la IgG anti-EBNA-2 se eleva mientras decrecen los títulos de IgG anti-EBNA-1, lo que genera una inversión de la ratio anti-EBNA-1/anti-EBNA-2 que en sujetos sanos es mayor de 1. Los títulos de anti-EBNA-1 son proporcionales al grado de infección del VEB por linfocitos citotóxicos, y sería un fuerte marcador de la inmunidad celular del VEB. En otras enfermedades causadas por el VEB –como el linfoma Burkitt, el carcinoma nasofaríngeo y el linfoma de Hodgkin relacionado con el VEB– los títulos frente al VEB permanecen elevados varios años antes de desarrollar la enfermedad. En el linfoma de Burkitt existe una elevación de los anti-VCA pero no de los anti-EBNA, y la elevación de ambos se ha demostrado en el carcinoma nasofaríngeo y en el linfoma de Hodgkin(14). Se ha encontrado mayor tasa de linfoma de Hodgkin vinculado al VEB en pacientes con EM y en familiares directos de pacientes con EM que en la población general(13). En la EM, se ha observado un incremento de los anticuerpos anti-VEB hasta 5 años antes del inicio de los síntomas. En concreto, se ha demostrado un incremento de los anticuerpos anti-EBNA, y entre éstos, en concreto del anti-EBNA-1, lo que sugiere una primoinfección 65 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] más intensa o una reactivación de la infección acompañada por una vigorosa respuesta inmune celular. Se ha demostrado que la presencia de linfocitos T anti-EBNA-1 es mucho más frecuente en los pacientes con EM que en los sujetos sanos. Un hallazgo muy significativo es el cambio en la tasa de anticuerpos en relación con la edad. Cuando se miden los anticuerpos frente al VEB en personas menores de 20 años de edad, la media de anticuerpos en los individuos que más tarde desarrollarán EM es similar a la de los que se mantendrán sanos. Por otra parte, mientras que los títulos anti-EBNA permanecen estables a lo largo de la vida en los controles sanos, en los pacientes con EM se observa un incremento significativo entre los 20 y los 30 años, incremento que posteriormente se estabiliza. Esta diferencia entre los individuos que desarrollarán EM y los individuos sanos es importante. Si se compara una muestra realizada antes de los 20 años con otra muestra posterior, un aumento de hasta 4 veces los títulos de anti-EBNA eleva el riesgo de desarrollar EM hasta 15 veces más. Además, se ha visto una elevación de los títulos cuando comienzan los síntomas de la enfermedad. Aunque se desconocen las razones de este incremento de los anticuerpos edad-dependientes, se baraja la posibilidad de una coinfección por otro germen que altere la respuesta inmune frente al VEB, o de la coinfección por otra cepa de VEB diferente a la de la primoinfección. Por último, se piensa que esta elevación de anticuerpos podría ser un marcador de reacción autoinmune que en algunos individuos desencadenaría la enfermedad(14). Recientemente se ha demostrado que los títulos elevados de IgG EBNA-1 están selectivamente incrementados en pacientes con un SCA, en comparación con los controles. Se ha demostrado relación entre los títulos de IgG EBNA-1 y la carga lesional en RMN cerebral, con la diseminación espacial y temporal radiológica, así como con la progresión en la EDSS. Los autores sugieren que los títulos de IgG EBNA-1 podrían ser usados como marcador pronóstico para conversión a EM y como marcador pronóstico evolutivo de discapacidad(33). En otro estudio, se ha demostrado la replicación activa periférica del VEB durante los brotes de EM en comparación con pacientes con enfermedad estable(13). Quizá el mayor obstáculo para aceptar el papel del VEB en la EM sea la ausencia de VEB en las lesiones patológicas de la EM. Estudios recientes en los que se aplica la PCR a tiempo real en cerebros de pacientes con EM y en linfocitos B del LCR de pacientes descartaron la evidencia de infección activa por VEB(34). Los defensores de la importancia del VEB esgrimen la existencia de múltiples mecanismos por los que la infección por VEB puede incrementar el riesgo de EM sin necesidad de infectar directamente el SNC. La teoría más aceptada es que la infección por el VEB en pacientes predispuestos genéticamente reacciona contra antígenos de la mielina. Esta respuesta incluiría linfocitos T y anticuerpos. Sería la teoría del mimetismo molecular. A favor de la misma estarían el hallazgo en los pacientes con EM de mayor número de linfocitos T CD4+ específicos reconocedores de EBNA-1, y la identificación de 2 péptidos VEB, uno de los cuales, el EBNA-1, ha demostrado ser marcador de respuesta inmune en el LCR de pacientes con EM. Otras teorías propuestas serían la activación de superantígenos –una clase de antígenos que pueden activar poblaciones de linfocitos T inespecíficos–, un incremento de la expresión 66 [ Epidemiología analítica ] de la α-β-cristalina –una proteína de estrés que ha demostrado ser marcador de la inmunidad de linfocitos T CD4+ en la EM–, o la infección y activación crónica de linfocitos B autorreactivos. Debido a la heterogeneidad encontrada en la patología de la EM, no se descarta que puedan estar implicados distintos mecanismos. El hecho de que la EM aparezca años después de la mononucleosis infecciosa hace pensar que el VEB actuaría como factor iniciador del proceso patológico, pero sería necesario que se produjeran los restantes eventos para que comenzaran las manifestaciones clínicas de la enfermedad(32). No obstante, a pesar de los múltiples estudios realizados al respecto, sigue sin poder concretarse si la infección por VEB es la causa o si, en realidad, es un epifenómeno necesario para el inicio de la enfermedad. Su asociación con otras enfermedades autoinmunes, además de la EM, sugiere que podría ser un iniciador no específico de la cascada autoinmune. Hábito tabáquico y esclerosis múltiple Desde hace años, varios estudios epidemiológicos han demostrado la asociación del hábito tabáquico y la EM. Fumar cigarrillos aumenta el riesgo de desarrollar la enfermedad y modifica el curso de la misma. La odds ratio oscila entre 1,3 y 1,5 para los fumadores frente a los no fumadores (Figura 2). El riesgo es mayor en los hombres, y se ha demostrado además un efecto dosis-dependiente (a mayor dosis, mayor riesgo). Este riesgo incrementado se mantiene elevado hasta 5 años después de haber dejado de fumar(13,35). En un estudio realizado con pacientes con SCA y un seguimiento a 3 años se ha encontrado que el tabaco es un factor de riesgo estadísticamente significativo para convertir a EM clínicamente definida. Además, los pacientes fumadores tardan menos tiempo en presentar el segundo brote. Se ha comprobado que los fumadores con la forma recurrente-remitente de la enfermedad aumentan hasta 3 veces el riesgo de convertir a una forma secundaria progresiva, lo cual está condicionado, además, por la edad de inicio del hábito. Empezar a fumar antes de los 15 años se asocia con un riesgo mayor de pasar a una forma progresiva y a edades más tempranas. Cuando se analiza el grado de discapacidad en relación con el tiempo de evolución de la enfermedad, se observa mayor discapacidad en los pacientes fumadores que empezaron a fumar a edades tempranas (< 15 años) en comparación con los no fumadores. Esto hace pensar en un posible efecto del tabaco en la degeneración axonal(36,37). Entre las teorías patogénicas se contaría el efecto tóxico directo de los componentes del humo del tabaco en el SNC. La cianida es una sustancia que se encuentra muy elevada en la sangre de los fumadores. En estudios experimentales se ha sugerido el papel de la cianida como sustancia neurotóxica desmielinizante. La asociación del tabaco con otras enfermedades autoinmunes (artritis reumatoide, lupus eritematoso sistémico) ha postulado el papel clave de aquél en la cascada inmunitaria en sujetos predispuestos genéticamente. 67 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] Hernan Primer autor Ghadirian Thorogood Antonovsky Riise Hernan (1,34) Combinado 1 Odds ratio 2 3 Figura 2. Representación esquemática de los estudios prospectivos y retrospectivos de asociación del tabaco como factor de riesgo para esclerosis múltiple utilizando los análisis más conservadores. El tamaño de los rectángulos negros es inversamente proporcional al intervalo de confianza. Fuente: modificado de C.H. Hawkes et al.(35). Otras teorías implicadas pendientes de comprobación serían el efecto tóxico del NO –elevado en los fumadores–, que ha demostrado en modelos animales ser un radical libre vinculado al daño axonal. Además, el NO altera la permeabilidad de la barrera hematoencefálica, lo que permitiría la entrada anormal de células T(35). Aunque inicialmente se pensó en un efecto directo de la nicotina, al haber demostrado en modelos experimentales un descenso en la respuesta de anticuerpos con una inhibición de la proliferación de células T y una peor señalización antígeno-célula T, un trabajo reciente desarrollado en Suecia (estudio de casos-controles con 900 pacientes de EM y 1.800 controles) demostró el riesgo para el consumo de cigarrillos pero no para el de tabaco sueco (Swedish snuff), que se toma inhalado o por vía oral, y que también contiene nicotina(38). Otro de los principios que contiene el humo del tabaco es la acroleína, asociada a inmunosupresión y con un probable efecto sobre la neurodegeneración. También se ha investigado el tiocianato, un metabolito del tabaco que se encuentra elevado en la sangre de los fumadores y que se considera responsable de la toxicidad sobre el nervio óptico en la ambliopía tabáquica(35). Además, el hábito tabáquico aumenta el riesgo de infecciones de las vías aéreas, y muchos brotes de EM están precedidos por infecciones banales de probable origen vírico (influenza, adenovirus). Otra de las teorías planteadas desde el punto de vista patogénico, pendiente de ser corroborada en estudios específicos, es la del papel del tabaco como mecanismo epigenético en la EM. Es bien conocido que determinados productos presentes en la combustión del tabaco 68 [ Epidemiología analítica ] (como los benzopirenos) funcionan como factor epigenético en el desarrollo de muchos tumores. Los hallazgos epigenéticos encontrados en la EM son meramente descriptivos y, en principio, no están relacionados con ningún factor ambiental en concreto (tabaco, dieta, vitamina D, infecciones…)(39). Asimismo, el hábito tabáquico, y en concreto el aumento del consumo del mismo por parte de las mujeres, podría explicar el aumento de la ratio mujer-hombre (3:1) observado en los últimos estudios epidemiológicos. Recientemente se ha demostrado un incremento del riesgo a desarrollar EM cuando se asocia el hábito tabáquico con niveles elevados de anti-EBNA, pero no se ha hallado relación entre el tabaco y el haplotipo HLA-DRB1*1501(6). Como conclusión general, se recomienda promover el cese del hábito tabáquico en todos los pacientes. Debería ser una medida terapéutica más a ofrecer en consulta. Otra cuestión sería estudiar si, a nivel poblacional, medidas preventivas encaminadas a conseguir la disminución del consumo tabáquico (a través de campañas de educación y prevención o con leyes que restrinjan su uso) llevarían aparejada una disminución de la incidencia de la enfermedad. 4/ Epidemiología genética Introducción La EM no es una enfermedad hereditaria, aunque sí una enfermedad con predisposición genética. Numerosos estudios epidemiológicos y genéticos han demostrado la evidencia de esta susceptibilidad. Se asume un modelo de herencia poligénico, en el que la presencia de determinados polimorfismos de diferentes genes contribuiría a definir a un sujeto con mayor o menor riesgo para desarrollar la enfermedad. Epidemiología genética descriptiva Los estudios en distintas razas, en familiares de pacientes y en gemelos han reflejado desde hace tiempo el importante papel de la predisposición genética en esta enfermedad. Susceptibilidad racial a la esclerosis múltiple Desde un punto de vista racial, la EM afecta mayoritariamente a personas de raza blanca de origen caucásico y, de éstas, los escandinavos serían los de mayor susceptibilidad. Además, se sabe que determinados grupos étnicos (esquimales, lapones, gitanos, aborígenes australianos) tienen un riesgo muy bajo de presentar la enfermedad, inclusive si viven en áreas de alta incidencia. En algunas etnias, como los esquimales, no se ha descrito ningún caso. La resistencia racial a la enfermedad podría explicar la baja frecuencia de determinadas zonas geográficas, como África y Asia. 69 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] En la raza negra, la EM es muy rara en África, pero aumenta en frecuencia entre los negros afroamericanos, aunque presenta prevalencias mucho menores que las encontradas en la raza blanca. Las explicaciones a estas diferencias serían, por un lado, la mezcla genética de los afroamericanos con la raza blanca y, por otro, la presencia de determinados factores ambientales a los que aquéllos se someten al migrar a América. Asimismo, se ha observado una diferenciación clínica en las enfermedades desmielinizantes desde el punto de vista racial: las poblaciones de raza asiática presentan de forma mucho más prevalente la neuromielitis óptica(1,3,4). Estudios de agregación familiar Entre un 15 y un 20% de los enfermos de EM tienen un familiar afecto por la enfermedad. El mayor riesgo de padecer la enfermedad es para los hermanos del paciente (2-5% en una población con riesgo calculado de 0,2%) –similar en los gemelos dicigóticos– y el riesgo va disminuyendo con el alejamiento del parentesco (1% en parientes de segundo grado). Se estima que el riesgo en los gemelos monocigóticos es de alrededor del 30%(40,41) en poblaciones del norte de Europa y Norteamérica, y se reduce a la mitad en los gemelos monocigóticos de áreas geográficas del sur. Algunos estudios han demostrado formas subclínicas con pruebas paraclínicas positivas (RMN cerebral, potenciales evocados visuales, bandas oligoclonales en el LCR) en gemelos monocigóticos, por lo que la tasa de concordancia podría ser mayor. Los estudios realizados con hijos adoptivos, cónyuges y “medio hermanos” no han demostrado un aumento en la prevalencia de EM diferente al que cabría esperar en la población general. Esto consolida la hipótesis de que la agregación familiar es debida a factores genéticos y no a factores microambientales, y descarta además que la EM sea transmisible por algún agente infeccioso. En los “medio hermanos” (sólo un padre o una madre en común), se ha encontrado un riesgo intermedio entre el de los hermanos y el de la población general. Cuando ambos progenitores tienen EM, los hijos tienen un riesgo mayor que cuando tiene la enfermedad sólo un progenitor, lo que indica que el riesgo de padecer EM se hereda de ambos padres. La distribución familiar no se justifica por un patrón de herencia autosómica, ligada al X, ni mitocondrial, lo que sugiere una herencia más compleja, de tipo poligénico, mediada por varios genes independientes. Se ha encontrado mayor probabilidad de transmitir la enfermedad a los descendientes cuando el progenitor enfermo es mujer (parent of origin effect)(42). No se han demostrado diferencias clínicas entre las formas familiares y las esporádicas(1,3,4). Género y esclerosis múltiple Desde el principio, se ha visto que la EM es más frecuente en mujeres. La mayoría de los estudios presentan una ratio mujer-hombre en torno a 2:1, aunque se ha descrito un aumento de la ratio mujer-hombre a 3:1 en los últimos trabajos epidemiológicos. Esta ratio está condicionada por la edad de inicio de la enfermedad. Así, las formas infantiles presentan una ratio mujer-hombre de 3:1, mientras que las formas que apare- 70 [ Epidemiología analítica ] cen a una edad de más de 50 años invierten los valores de la ratio, con predominio en los hombres. Estas formas, además, asocian un predominio fenotípico clínico de mielopatía progresiva. Esta mayor afectación en mujeres se ha demostrado en los distintos grupos étnicos. No se sabe con certeza la razón de este predominio en mujeres, que también se ha observado en numerosas enfermedades autoinmunes. Se defiende la posibilidad de una interacción entre factores hormonales y el sistema inmunitario. Se sabe que el estradiol y la progesterona son inmunomoduladores, y se han descrito remisiones con estradiol en el modelo murino la enfermedad. Últimamente se ha relacionado con la presencia de microquimerismos: la presencia estable de un pequeño número de células no presentadoras, generalmente células madre, más prevalentes en las mujeres, donde el papel fisiológico parece restringir la respuesta materna contra el feto. La presencia de estos microquimerismos se ha visto relacionada con un aumento del riesgo de desarrollar enfermedades autoinmunes. Además, se ha observado una mayor proporción de determinados polimorfismos del HLA en las mujeres (DR2)(3,4). Genética molecular y esclerosis múltiple En el estudio de la EM se han seguido dos tipos de estrategias: • Estudios de ligamiento mediante el análisis completo del genoma: se estudia el genoma completo de familias afectas por EM (familias tríos: donde los dos padres y uno de los hijos se encuentran afectos). Se analizan cientos de marcadores polimórficos. • Estudios de asociación de genes candidatos: se estudian aquellos genes que, por su función, puedan tener algún papel en la patogenia de la enfermedad. La mayoría se centra en el estudio de genes codificadores de moléculas relacionadas con el sistema inmunológico (inmunoglobulinas, receptores de células T, citocinas…) o en el estudio de genes relacionados con la mielina. En los estudios de ligamiento con análisis completo del genoma de familias afectadas por EM no se ha encontrado la presencia de un único gen determinante en la susceptibilidad. Sí se han visto varias regiones cromosómicas que podrían contribuir, la mayoría de las cuales estarían relacionados con el sistema HLA(4). Como breve resumen, cabe recordar que los genes HLA se sitúan en un segmento del brazo corto del cromosoma 6 humano (6p21). La región que incluye las subregiones de clase I y clase II alcanza hasta las 7,6 megabases (Mb) y compromete como mínimo a 252 genes, la gran mayoría de los cuales están relacionados con el desarrollo, la maduración y la función del sistema inmune(43). Entre los genes de clase I (A, B, C) y los de clase II (DR, DQ, DP), se encuentra un grupo de genes que gobierna la síntesis de ciertos productos del sistema de complemento (factor B, C2 y C4) y los genes del citocromo P450 de la 21-hidroxilasa suprarrenal. Se les conoce como genes de clase III. Los antígenos HLA se expresan de forma co-dominante. El fenotipo HLA es la simple enumeración de los antígenos definidos en un individuo. Si se conocen los antígenos correspondientes a cada cromosoma, se puede definir el genotipo. La mitad del genotipo, es decir, lo que el individuo hereda de cada progenitor, se conoce como haplotipo. Una 71 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] característica especial del sistema HLA es la aparición de combinaciones preferentes en un mismo haplotipo. Este fenómeno se conoce como desequilibrio de asociación o de ligamiento. Cada región HLA (el conjunto de genes HLA de un cromosoma) da lugar a varias cadenas pesadas α de clase I (HLA-A, B y C) y a las cadenas α y β de las moléculas HLA de clase II (HLA-DR, DQ y DP). Únicamente el MHC ha demostrado de forma consistente su asociación con la enfermedad y es la clave de la susceptibilidad a padecer EM. Otros genes susceptibles contribuirían relativamente poco al riesgo total(44). Aunque inicialmente los estudios se centraron en valorar polimorfismos de HLA de clase I, los últimos estudios han demostrado gran asociación con los polimorfismos de la clase II del MHC. Hay varios polimorfismos implicados, que varían también en función del grupo poblacional estudiado. En Europa –también en España– el polimorfismo más relacionado ha sido el HLA-DRB1*1501, cuya presencia aumenta el riesgo hasta 3 veces más. A su vez, un individuo homocigoto para este alelo presenta 1,8 veces más riesgo que un portador heterocigoto(44). Otros haplotipos implicados han sido el HLA-DRB1*17, el HLA-DRB5*0101 (conocido como DR15, subtipo del DR2), el DQA1*01012 y el DQB1*0602 (conocido como DQ6, subtipo del DQw1). Sólo en Canarias se ha encontrado un haplotipo, el DR4, que se ha demostrado que posee relación con un incremento del riesgo(45). Además, se han visto determinados haplotipos de resistencia, como el HLADRB1*14(44). Todavía no está claro si el haplotipo HLA es lo que confiere la susceptibilidad genética a la EM o si en realidad el haplotipo HLA está en desequilibrio de ligamiento con otro gen, aún no identificado, que sea el responsable real de la susceptibilidad. De todas formas, lo que han demostrado los últimos estudios o revisiones realizadas en estudios previos es que la situación es más compleja de lo que se pensaba inicialmente. De hecho, los estudios de interacciones entre los haplotipos sólo fueron estadísticamente significativos con muestras muy elevadas de sujetos, y se encontró que el riesgo de determinados haplotipos sólo guardaba relación con la presencia e interacción de otros (por ejemplo, el HLA-DRB1*08 y el DRB1*01 sólo mostraron efectos sobre el riesgo en presencia de HLADRB1*15)(44). Otros genes de susceptibilidad identificados codifican receptores para dos citocinas proinflamatorias, la cadena α del receptor de IL-7 (CD127) y la cadena α del receptor de IL-2 (CD25). La variante asociada a EM del receptor de IL-7 incrementa la cantidad de receptor soluble en comparación con el receptor unido a membrana(46). Recientemente, se ha demostrado en estudios realizados en gemelos con EM una variación genética en la 1-α-hidroxilasa y en los genes de los receptores de la vitamina D, lo que podría explicar los déficits de vitamina D encontrados en los paciente afectos de EM. Además, se ha identificado una nueva interacción ambiente-gen entre la vitamina D y el alelo HLA-DRB1*1501(25). Posiblemente exista heterogeneidad genética en la EM, lo que significa que existen distintos genes causales en diferentes individuos, hecho observado en la variación de los haplotipos HLA en función de la etnia e incluso en la variación asociada a sus diferentes formas de evolución(4). 72 [ Epidemiología analítica ] Mecanismos epigenéticos y esclerosis múltiple Se conoce como epigenética cualquier proceso que altera la actividad de un gen sin cambiar la secuencia del ADN, generando modificaciones que pueden transmitirse a células hijas. Se han identificado muchos tipos de procesos epigenéticos que incluyen la metilación, la acetilación, la fosforilación, la ubiquitinación y la sumolización. Los procesos epigenéticos son naturales y esenciales para muchas funciones del organismo, pero si ocurren de manera inapropiada pueden producirse importantes efectos adversos en la salud y la conducta. Se ha demostrado además la presencia de diferencias epigenéticas en gemelos monocigóticos, lo que podría explicar, además de los factores ambientales, la concordancia de sólo un 30% encontrada en la EM, a pesar de que presenten la misma secuencia de ADN. Estas diferencias epigenéticas se acentúan con la edad, con el tiempo que han vivido separados y con los estilos de vida. Entre los causantes conocidos o sospechosos de estar detrás de los procesos epigenéticos se cuentan muchos agentes, incluyendo metales pesados, pesticidas, humo de tabaco, gases de escape diésel, hidrocarburos policíclicos aromáticos, hormonas, radiactividad, virus, bacterias y nutrientes básicos. Entre los procesos epigenéticos mejor conocidos están la metilación del ADN y la modificación de las histonas. El primero consiste en la adición covalente de un grupo metilo (CH3) en la posición 5 de citosina y usualmente se asocia con la silenciación de un gen. Esta metilación se produce en citosinas que van seguidas de guanina (dinucleótido CpG). En el genoma humano estos dinucleótidos se concentran en regiones llamadas “islas CpG”, que están localizadas preferentemente en regiones promotoras y no suelen contener 5-metilcitosinas. Los dinucleótidos CpG que se sitúan fuera de las “islas” suelen estar metilados. Las enzimas que participan en la metilación del ADN son las DNA-metiltranferasas (DNMT), que catalizan la transferencia del grupo metilo a la citosina. Se han descrito 5 proteínas pertenecientes a la familia de las DNMT. Existe otro grupo de proteínas –las responsables de reconocer y unir a las 5 metilcitosinas– conocidas como MBD (methyl-CpG-binding domain). Cada vez se usan más marcadores de metilación de ADN (estudio de respuesta terapéutica o farmacogenómica, riesgo de desarrollar un determinado cáncer o metástasis…). El segundo mecanismo epigenético más estudiado es la modificación de la cromatinahistonas. La cromatina es un complejo de proteínas (histonas) y ADN que está empaquetado de forma muy apretada para que quepa en el núcleo. El complejo puede ser modificado por sustancias tales como grupos acetilo (acetilación), enzimas y algunas formas de ARN (microARN y ARN de interferencia). Esta modificación altera la estructura de la cromatina para influenciar la expresión del gen. En general, la cromatina fuertemente doblada tiende a ser desactivada, o no expresada, mientras que la cromatina más laxa es funcional o expresada. Un efecto de tales procesos epigenéticos es la imprimación o impriming. Cada vez se conocen mejor los mecanismos epigenéticos que participan de una u otra manera en el desarrollo de la EM. En muestras de sustancia blanca de cerebros de pacientes con EM se ha encontrado 3 veces menos metilación de las islas de dinucleótidos citosina-guanina que en cerebros de controles sanos. 73 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] Además, se ha demostrado como ejemplo de hipometilación una sobreexpresión del promotor de la región PADl2 (peptidil-arginín-deaminasa de tipo II) en la EM. La PADl2 cataliza la citrulinación de la proteína básica de la mielina, lo que promueve su autofragmentación y la formación del consecuente nuevo epítopo que causa el reconocimiento por parte del sistema inmune(39). Asimismo, se ha observado que modificaciones epigenéticas en la frecuencia del alelo del HLA-DRB1*1501 o de regiones adyacentes están condicionadas por el sexo en las distintas generaciones, lo que puede explicar, al menos en parte, el aumento del riesgo específico de EM en las mujeres(27). Los futuros estudios etiológicos de la EM deberán incluir el análisis de la interacción gen-ambiente, aun a sabiendas de que estos estudios son complejos y caros. Actualmente, la genética de la EM se está moviendo en una fase en la que se necesita demostrar la relevancia funcional de los polimorfismos asociados. Los estudios etiológicos de la EM anteriormente mencionados deben explicar los mecanismos por los que determinados alelos asociados incrementan el riesgo de enfermedad, incluyendo estudios de expresión genética y de posibles mecanismos epigenéticos. Las modificaciones epigenéticas podrían ser una clave factible de la interacción entre determinados factores ambientales y las alteraciones en la expresión de los genes que modularan los fenotipos de la enfermedad. Quedaría pendiente determinar qué genes son alterados epigenéticamente por factores ambientales, y si los suplementos nutricionales podrían influir en estos efectos, así como la búsqueda de biomarcadores epigenéticos(10). BI BLIOGRAFÍA 1 Compston A, Lassmann H, McDonald I. The evolving concept of multiple sclerosis. Section One. The story of multiple sclerosis. En: Compston A, Confavreux C, Lassmann H, Mc Donald I, Miller D, Noseworthy J, et al. (eds.). McAlpine’s Multiple Sclerosis. 4.ª ed. Londres: Churchill Livingstone Elsevier; 2006. p. 3. 2 Compston A, Confavreux C. The environmental factor in multiple sclerosis. Section 2. The cause 3 4 5 6 74 and course of multiple sclerosis. En: Compston A, Confavreux C, Lassmann H, Mc Donald I, Miller D, Noseworthy J, et al. (eds.). McAlpine’s Multiple Sclerosis. 4.ª ed. Londres: Churchill Livingstone Elsevier; 2006. p. 105-11. Compston A, Wekerle H. The genetics of multiple sclerosis. Section 2. The cause and course of multiple sclerosis. En: Compston A, Confavreux C, Lassmann H, Mc Donald I, Miller D, Noseworthy J, et al. (eds.). McAlpine’s Multiple Sclerosis. 4.ª ed. Londres: Churchill Livingstone Elsevier; 2006. p. 113-80. Fernández Uría D. Epidemiología de la esclerosis múltiple. En: Fernández Fernández O (coord.). Esclerosis Múltiple. Continua Neurológica. Barcelona: Ars Médica; 2007. Koch-Henriksen N, Soelberg Sorensen P. The changing demographic pattern of multiple sclerosis. Lancet Neurol 2010; 9: 520-32. Simon KC, van der Mei IA, Munger KL, Ponsonby A, Dickinson J, Dwyer T, et al. Combined effects of smoking, anti-EBNA antibodies, and HLA-DRB1*1501 on multiple sclerosis risk. Neurology 2010; 74: 1365-71. [ Epidemiología analítica ] 7 Handel AE, Handunnetthi L, Giovannoni G, Ebers GC, Ramagopalan SV. Genetic and environmental factors and the distribution of multiple sclerosis in Europe. Eur J Neurol 2010; 17: 1210-4. 8 Jimenez Escrig A. Generalidades de genética. Manual de neurogenética. Madrid: Ediciones Díaz de Santos; 2003. p. 10-1. 9 Compston A, Coles A. Multiple sclerosis. Lancet 2008; 372: 1502-17. 10 Pugliatti M, Harbo HF, Holmøy T, Kampman MT, Myhr KM, Riise T, Wolfson C. Environmental risk factors in multiple sclerosis. Acta Neurol Scand Suppl 2008; 188: 34-40. 11 Ebers GC, Yee IM, Sadovnick AD, Duquette P. Conjugal multiple sclerosis: population-based preva- 12 13 14 15 16 17 18 19 20 lence and recurrence risks in offspring. Canadian Collaborative Study Group. Ann Neurol 2000; 48: 927-31. Ebers G. Environmental factors and multiple sclerosis. Lancet Neurol 2008; 7: 268-77. Giovannoni G. Multiple sclerosis: the environment and causation. Current Opinion in Neurology 2007; 20: 261-8. Ascherio A. Environmental risk factors for multiple sclerosis. Part I: The role of infection. Ann Neurol 2007; 61 (4): 288-99. Ascherio A. Environmental risk factors for multiple sclerosis. Part II: Non infectious factors. Ann Neurol 2007; 61 (6): 504-13. Staples J, Ponsoby AL, Lim L. Low maternal exposure to ultraviolet radiation in pregnancy, month of birth, and risk of multiple sclerosis in offspring: longitudinal analysis. BMJ 2010; 340: c1640. Goodin DS. The causal cascade to multiple sclerosis: a model for MS pathogenesis. PLoS One 2009; 4: e4565. Pierrot-Deseilligny C, Souberbielle JC. Is hypovitaminosis D one of the environmental risk factors for multiple sclerosis? Brain 2010; 133: 1869-88. Ascherio A, Munger KL, Simon KC. Vitamin D and multiple sclerosis. Lancet Neurol 2010; 9: 599-612. Smolders J, Peelen E, Thewissen M, Menheere P, Tervaert JW, Hupperts R, Damoiseaux J. The relevance of vitamin D receptor gene polymorphisms for vitamin D research in multiple sclerosis. Autoimmun Rev 2009; 8: 621-6. 21 Becklund BR, Severson KS, Vang SV, DeLuca HF. UV radiation suppresses experimental autoimmune 22 23 24 25 26 27 encephalomyelitis independent of vitamin D production. Proc Natl Acad Sci U S A 2010; 107: 6418-23. Vukusic S, Van Bockstael V, Gosselin S, Confavreux C. Regional variations in the prevalence of multiple sclerosis in French farmers. J Neurol Neurosurg Psychiatry 2007; 78: 707-9. Sloka S, Silva C, Pryse-Phillips J, Wang L, Metz S, Patten S, et al. Environmental risks for multiple sclerosis: quantitative analyses and biological mechanisms. Mult Scler 2009; 15 (Suppl 2): S158. Grant WB. Latitude and multiple sclerosis prevalence: vitamin D reduces risk of Epstein-Barr virus infection. Mult Scler 2010; 16 (3): 373. Handunnetthi L, Ramagopalan SV, Ebers GC. Multiple sclerosis, vitamin D, and HLA-DRB1*15. Neurology 2010; 74: 1905-10. Ramagopalan SV, Maugeri NJ, Handunnetthi L, Lincoln MR, Orton SM, Dyment DA, et al. Expression of the multiple sclerosis-associated MHC class II Allele HLA-DRB1*1501 is regulated by vitamin D. PLoS Genet 2009; 5 (2): e1000369. Chao MJ, Ramagopalan SV, Herrera BM, Lincoln MR, Dyment DA, Sadovnick AD, Ebers GC. Epigenetics in multiple sclerosis susceptibility: difference in transgenerational risk localizes to the major histocompatibility complex. Hum Mol Genet 2009; 18 (2): 261-6. 75 [ EPIDEMIOLOGÍA DE LA ESCLEROSIS MÚLTIPLE ] 28 Ramagopalan SV, Link J, Byrnes JK, Dyment DA, Giovannoni G, Hintzen RQ, et al. HLA-DRB1 and month of birth in multiple sclerosis. Neurology 2009; 73: 2107-11. 29 Mowry EM, Krupp LB, Milazzo M, Chabas D, Strober JB, Belman AL, et al. Vitamin D status is associated with relapse rate in pediatric-onset multiple sclerosis. Ann Neurol 2010; 67: 618-24. 30 Munger KL, Zhang SM, O’Reilly E, Hernán MA, Olek MJ, Willett WC, Ascherio A. Vitamin D intake and incidence of multiple sclerosis. Neurology 2004; 62: 60-5. 31 Milo R, Kahana E. Multiple sclerosis: geoepidemiology, genetics and environment. Autoimmun Rev 2010; 9 (5): A387-94. 32 Ascherio A. EBV and brain matter(s)? Neurology 2010; 74: 1092-5. 33 Lünemann JD, Tintoré M, Messmer BS, Strowing T, Rovira A, Perkal H, et al. Elevated Epstein-Barr virus-en- 34 35 36 37 38 39 40 41 coded nuclear antigen-1 immune responses predict conversion to multiple sclerosis. Ann Neurol 2010; 67: 159-69. Sargsyan SA. Absence of Epstein-Barr virus in the brain and CSF of patients with multiple sclerosis. Neurology 2010; 74: 1127-35. Hawkes CH. Smoking is a risk factor for multiple sclerosis: a metanalysis. Mult Scler 2007; 13: 610-5. Di Pauli F, Reindl M, Ehling R, Schautzer F, Gneiss C, Lutterotti A, et al. Smoking is a risk factor for early conversion to clinically definite multiple sclerosis. Mult Scler 2008; 14: 1026-30. Sundström P, Nyström L. Smoking worsens the prognosis in multiple sclerosis. Mult Scler 2008; 14: 1031-5. Hedström AK, Bäärnhielm M, Olsson T, Alfredsson L. Tobacco smoking, but not Swedish snuff use, increases the risk of multiple sclerosis. Neurology 2009; 73 (9): 696-701. Urdinguio RG, Sanchez-Mut JV, Esteller M. Epigenetic mechanisms in neurological diseases: genes, syndromes, and therapies. Lancet Neurol 2009; 8 (11): 1056-72. Sadovnick AD, Armstrong H, Rice GP, Bulman D, Hashimoto L, Paty DW, et al. A population-based study of multiple sclerosis in twins: update. Ann Neurol 1993; 33: 281-5. Nielsen NM, Westergaard T, Rostgaard K, Frisch M, Hjalgrim H, Wohlfahrt J, et al. Familial risk of multiple sclerosis: a nationwide cohort study. Am J Epidemiol 2005; 162: 774-8. 42 Ebers GC, Sadovnick AD, Dyment DA, Yee IM, Willer CJ, Risch N. Parent-of-origin effect in multiple sclerosis: observations in half-siblings. Lancet 2004; 363: 1773-4. 43 Ramagopalan SV, Knight JC, Ebers GC. Multiple sclerosis and the major histocompatibility complex. Current Opinion in Neurology 2009; 22: 219-25. 44 Ramagopalan SV, Morris AP, Dyment DA, Herrera BM, DeLuca GC, Lincoln MR, et al. The inheritance of resistance alleles in multiple sclerosis. PLoS Genet 2007; 3 (9): 1607-13. 45 Coraddu F, Reyes-Yañez MP, Parra A, Gray J, Smith SI, Taylor CJ, et al. HLA association with multiple sclerosis in the Canary Islands. J Neuroimmunol 1988; 87: 130-5. 46 The International Multiple Sclerosis Genetics Consortium. Risk alleles for multiple sclerosis identified by a Genomewide Study. N Engl J Med 2007; 357: 851-62. 47 Simon KC, Munger KL, Xing Y, Ascherio A. Polymorphisms in vitamin D metabolism related genes and risk of multiple sclerosis. Mult Scler 2010; 16 (2): 133-8. 76