Presentación de PowerPoint
Anuncio

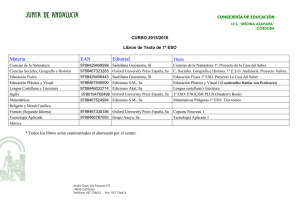
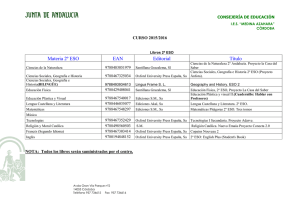
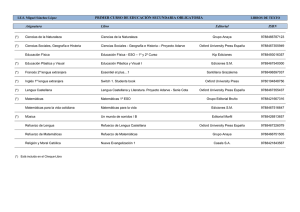
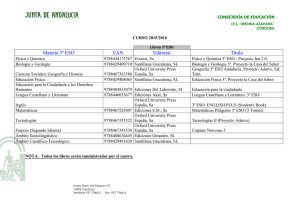
La geosfera Los elementos químicos Física y Química La geosfera Los elementos químicos Las primeras clasificaciones de los elementos © Oxford University Press España, S. A. Física y Química 3º ESO 2 La geosfera Los elementos químicos Un elemento químico es un tipo de materia constituido por átomos de la misma clase. La clasificación más sencilla de los elementos es en metales y no metales. Metales y no metales Metales No metales • Son opacos y poseen un brillo característico (brillo metálico). • Son buenos conductores del calor y la corriente eléctrica. • Son maleables y dúctiles. • Excepto el mercurio, que es líquido, son sólidos a temperatura ambiente. • La mayoría tienen elevados puntos de fusión y ebullición. • No poseen brillo metálico. • Son malos conductores del calor y la electricidad. • A temperatura ambiente pueden ser sólidos, líquidos o gaseosos. • En general tienen puntos de fusión y ebullición muy bajos. • En estado sólido son frágiles y se rompen con facilidad. Ejemplos de metales: hierro, cobre, cinc, mercurio, oro, plata, níquel, plomo, etc. Ejemplos de no metales: hidrógeno, oxígeno, cloro, nitrógeno, carbono, flúor, helio, etc. © Oxford University Press España, S. A. Física y Química 3º ESO 3 La geosfera Los elementos químicos Las primeras clasificaciones periódicas Mendeleiev dispuso 63 elementos en orden creciente de masa atómica, para situar en una misma fila aquellos con propiedades parecidas. o Evitó colocar metales junto a no metales. o Permutó el orden entre el telurio y el yodo, para que el telurio estuviera junto al azufre y el selenio, y el yodo junto al bromo y el cloro. o Cuando las propiedades de un elemento no guardaban relación alguna con la posición que le correspondía según su masa atómica, dejaba ese hueco, para que más adelante pudiera ocuparlo un nuevo elemento, aún no descubierto. © Oxford University Press España, S. A. Física y Química 3º ESO 4 La geosfera Los elementos químicos ¿Cómo se mide la masa de los átomos? © Oxford University Press España, S. A. Física y Química 3º ESO 5 La geosfera Los elementos químicos La unidad de masa atómica es la doceava parte de la masa de un átomo de C-12 (12C). La masa atómica relativa es la masa de un átomo medida en relación con la doceava parte del átomo de C-12 y es una magnitud adimensional. Un espectrómetro de masas es un aparato que permite medir la masa de un átomo en comparación con la doceava parte del átomo de C-12. La masa atómica relativa de un elemento se calcula como la masa media ponderada de sus isótopos. 𝑚𝑎𝑠𝑎 𝑎𝑡ó𝑚𝑖𝑐𝑎 𝑟𝑒𝑙𝑎𝑡𝑖𝑣𝑎 = © Oxford University Press España, S. A. % 𝑖𝑠ó𝑡𝑜𝑝𝑜 1 % 𝑖𝑠ó𝑡𝑜𝑝𝑜 2 % 𝑖𝑠ó𝑡𝑜𝑝𝑜 3 · 𝑚1 + · 𝑚2 + · 𝑚3 … 100 100 100 Física y Química 3º ESO 6 La geosfera Los elementos químicos Clasificación actual de los elementos © Oxford University Press España, S. A. Física y Química 3º ESO 7 La geosfera Los elementos químicos En la tabla periódica los elementos están ordenados de arriba abajo (grupos) y de izquierda a derecha (períodos) en orden creciente de número atómico. o Un grupo es cada una de las columnas verticales de la tabla periódica. Los elementos de un mismo grupo tienen el mismo número de electrones en la última capa (electrones de valencia). Existen 18 grupos, numerados del 1 al 18. o Un período es cada una de las filas horizontales de la tabla periódica. Los elementos de un mismo período tienen el mismo número de niveles electrónicos. Hay 7 períodos formando filas y numerados del 1 al 7. Metales y no metales en el sistema periódico Las propiedades metálicas de los elementos se acentúan a medida que nos desplazamos a la izquierda y a medida que bajamos en la tabla. © Oxford University Press España, S. A. Física y Química 3º ESO 8 La geosfera Los elementos químicos © Oxford University Press España, S. A. Física y Química 3º ESO 9 La geosfera Los elementos químicos La tabla periódica y la configuración electrónica de los elementos Grupo 18: helio, neón, argón, criptón, xenón y radón o Los elementos del grupo 18 reciben el nombre de gases nobles. Son elementos metálicos. o La configuración electrónica del helio es 2 0. o La configuración electrónica de la última capa del neón, argón, criptón, xenón y radón es 2 6. Grupo 17: flúor, cloro, bromo y yodo o Los elementos del grupo 17 se denominan halógenos. Son no metálicos. o La configuración electrónica de su última capa es 2 5, es decir, les falta un electrón para tener la configuración electrónica de un gas noble. o Tienden a formar iones con una carga negativa. © Oxford University Press España, S. A. Física y Química 3º ESO 10 La geosfera Los elementos químicos Grupo 1: litio, sodio, potasio, rubidio y cesio o A los elementos del grupo 1 se les llama alcalinos. Son elementos metálicos. o La configuración electrónica de su última capa es 1 0, es decir, les sobra un electrón para tener la misma configuración electrónica que la del gas noble más próximo. o Estos elementos tienden a formar iones con una carga positiva. Los elementos representativos o Son los elementos de los grupos 1, 2, 13, 14, 15, 16, 17 y 18. o La configuración electrónica de su capa más externa varía desde 1 0 hasta 2 6. © Oxford University Press España, S. A. Física y Química 3º ESO 11 La Elgeosfera Los método elementos científico químicos Agrupaciones de los átomos en los elementos: átomos, moléculas y cristales © Oxford University Press España, S. A. Física y Química 3º ESO 12 La Elgeosfera Los método elementos científico químicos Los elementos químicos están formados por la unión de átomos iguales, y los compuestos químicos por la unión de átomos de elementos diferentes. Algunos elementos químicos se encuentran en la naturaleza como átomos aislados, otros forman moléculas y muchos de ellos se presentan en forma de cristales. Átomos aislados: los elementos del grupo 18 o Los elementos del grupo 18, los gases nobles, se encuentran en forma de átomos aislados. o A temperatura ambiente son sustancias gaseosas que no conducen la corriente eléctrica. o Tienen su última capa electrónica completa, es decir, poseen ocho electrones, excepto el helio, que cuenta con dos. Esta configuración electrónica les proporciona gran estabilidad. © Oxford University Press España, S. A. Física y Química 3º ESO 13 La Elgeosfera Los método elementos científico químicos Formando moléculas: elementos no metálicos o Elementos como el hidrógeno, el oxígeno, el nitrógeno, el flúor, el cloro, el bromo, etc., se presentan en forma de moléculas diatómicas, es decir, H2, O2, N2, F2, Cl2, Br2… o A temperatura ambiente son sustancias gaseosas que no conducen la corriente eléctrica. Un enlace químico es una atracción de tipo electrostático entre dos o más átomos que permite que estos alcancen la estabilidad. Si el enlace se produce por compartición de electrones decimos que se trata de un enlace covalente. © Oxford University Press España, S. A. Física y Química 3º ESO 14 La Elgeosfera Los método elementos científico químicos Formando cristales covalentes: elementos no metálicos El átomo de carbono tiene cuatro electrones en su última capa. Puede formar cuatro enlaces covalentes. Forma un cristal covalente. Un cristal es un sólido cuyas partículas se ordenan conforme a un patrón que se repite en las tres direcciones del espacio El carbono puede encontrarse en la naturaleza en dos variedades: diamante y grafito. Cristal de diamante Cristal de grafito Cada átomo de carbono está unido a cuatro átomos de carbono. Esta red hace que el diamante sea un sólido muy duro, con altos puntos de fusión y ebullición. No conduce la corriente eléctrica. © Oxford University Press España, S. A. Cada átomo de carbono está unido a tres átomos de carbono en un mismo plano y en planos adyacentes a un cuarto átomo de carbono. Es un sólido blando y untuoso. Conduce la corriente eléctrica. Física y Química 3º ESO 15 La Elgeosfera Los método elementos científico químicos Formando cristales metálicos: elementos metálicos o Todos los metales conducen la corriente eléctrica. o La mayor parte de los metales poseen uno, dos o tres electrones en la capa más externa de sus átomos. En un cristal metálico, las partículas que constituyen la red son átomos (iones positivos) que han perdido esos electrones externos, los cuales están deslocalizados por todo el cristal (se dice que constituyen un «mar de electrones»), es decir, no pertenecen a un átomo en concreto. o Los metales conducen la corriente eléctrica porque estos electrones se pueden mover con facilidad por todo el cristal. o La mayoría de los metales son duros, porque sus átomos forman uniones muy compactas, y son dúctiles y maleables. o Este tipo de unión recibe el nombre de enlace metálico. © Oxford University Press España, S. A. Física y Química 3º ESO 16 La Elgeosfera Los método elementos científico químicos Propiedades de algunas familias de elementos químicos © Oxford University Press España, S. A. Física y Química 3º ESO 17 La Elgeosfera Los método elementos científico químicos Una familia o grupo es un conjunto de elementos químicos que presentan propiedades físicas y químicas parecidas. Estas propiedades varían de forma periódica dentro de la columna que ocupa el grupo. Dos de las familias más importantes son la de los alcalinos y la de los halógenos. Grupo 1: Alcalinos Propiedades Reactividad • La familia de los alcalinos está formada • Son los metales más reactivos que por: litio, sodio, potasio, rubidio y existen, por lo que no se encuentran cesio. en estado libre en la naturaleza, sino • Son metales. Tienen brillo metálico. combinados con otros elementos. • Tienen un electrón en la última capa. • Reaccionan violentamente con el • Los puntos de fusión y ebullición oxígeno y con el agua. disminuyen al bajar en el grupo. • Esta reactividad es mayor al bajar en • Son sólidos blandos. el grupo. • Son buenos conductores de la electricidad y del calor. © Oxford University Press España, S. A. Física y Química 3º ESO 18 La Elgeosfera Los método elementos científico químicos Grupo 17: Halógenos Propiedades • La familia de los halógenos está formada por: flúor, cloro, bromo y yodo. • Son no metales. • Tienen siete electrones en la última capa. • Los puntos de fusión y ebullición aumentan al bajar en el grupo. • A temperatura ambiente, el flúor y el cloro son gases, el bromo es un líquido y el yodo es un sólido. © Oxford University Press España, S. A. Reactividad • Los halógenos son sustancias muy reactivas que deben manejarse en el laboratorio con mucha precaución. Por ejemplo, el flúor y el cloro son corrosivos y venenosos. Física y Química 3º ESO 19