Hidradenitis supurativa - Revista Panamericana de Infectología
Anuncio
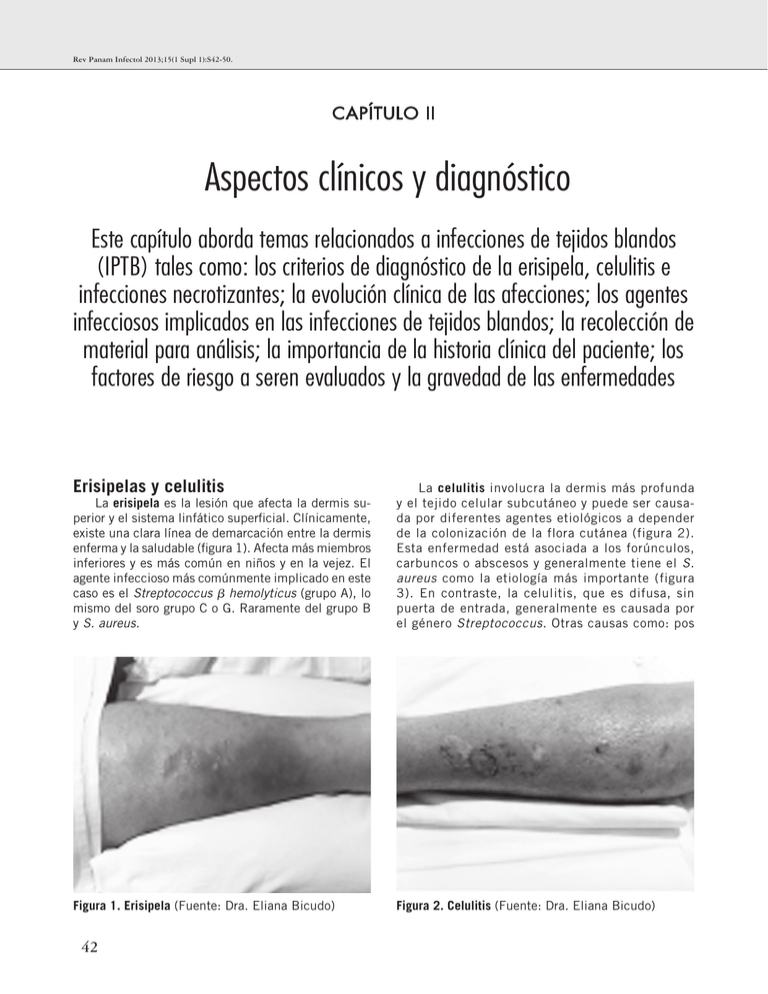
Rev Panam Infectol 2013;15(1 Supl 1):S42-50. CAPÍTULO II Aspectos clínicos y diagnóstico Este capítulo aborda temas relacionados a infecciones de tejidos blandos (IPTB) tales como: los criterios de diagnóstico de la erisipela, celulitis e infecciones necrotizantes; la evolución clínica de las afecciones; los agentes infecciosos implicados en las infecciones de tejidos blandos; la recolección de material para análisis; la importancia de la historia clínica del paciente; los factores de riesgo a seren evaluados y la gravedad de las enfermedades Erisipelas y celulitis La erisipela es la lesión que afecta la dermis superior y el sistema linfático superficial. Clínicamente, existe una clara línea de demarcación entre la dermis enferma y la saludable (figura 1). Afecta más miembros inferiores y es más común en niños y en la vejez. El agente infeccioso más comúnmente implicado en este caso es el Streptococcus hemolyticus (grupo A), lo mismo del soro grupo C o G. Raramente del grupo B y S. aureus. La celulitis involucra la dermis más profunda y el tejido celular subcutáneo y puede ser causada por diferentes agentes etiológicos a depender de la colonización de la flora cutánea (figura 2). Esta enfermedad está asociada a los forúnculos, carbuncos o abscesos y generalmente tiene el S. aureus como la etiología más importante (figura 3). En contraste, la celulitis, que es difusa, sin puerta de entrada, generalmente es causada por el género Streptococcus. Otras causas como: pos Figura 1. Erisipela (Fuente: Dra. Eliana Bicudo) Figura 2. Celulitis (Fuente: Dra. Eliana Bicudo) 42 Lima ALLM, et al. • Directrices panamericanas para el tratamiento de las osteomielitis... Patogenia En la patogenia de erisipela y celulitis, la invasión del agente infeccioso ocurre por medio de solución de continuidad de la piel. Los factores con predisposición para la invasión son:(5) • Traumas, como los quirúrgicos; • Obesidad; • Insuficiencia arterial y vascular periférica; • Obstrucción linfática; • Lesiones de piel previas como: acné, impétigo, ulceraciones, fisuras, micosis superficiales, eczemas y picaduras de insectos. Figura 3. Celulitis con absceso (Fuente: Dra. Eliana Bicudo) actividades físicas, traumas, contacto con agua, picaduras o mordeduras de animales o lesiones por trauma o quirúrgicas han de tener material de cultivos apropiadamente recolectadas. La evolución clínica de la celulitis es rápida y son evidentes las señales flogísticas. Generalmente, se hace acompañar de linfangitis e infartamiento ganglionar regional. La clásica señal de piel “en cáscara de naranja” se debe al edema cutáneo superficial asociado al edema de los folículos pilosos. Todavía pueden estar presentes vesículas, ampollas, petequias y equimosis. Manifestaciones sistémicas como fiebre, taquicardia, confusión mental y sepsis pueden acompañar la celulitis exigiendo internación y antibioticoterapia venosa.(1) Recolección de material Hay indicación de se realizar cultivos de abscesos y otras secreciones purulentas, principalmente en pacientes con complicadas infecciones de tejidos blandos; en aquellos pacientes con infección local grave o señales de enfermedad sistémica y pacientes que no respondieron adecuadamente a la terapia antibiótica inicial (A-III). Se debe evitar rigurosamente la recolección por medio de swabs, el adecuado es aspirado de secreción. (1) Los hemocultivos, en esta situación, son positivos en menos de 5% de los casos.(2) Ya la positividad de los aspirados de flictenas o ampollas queda alrededor del 5 a los 40%,(3) y por medio de biopsia “punch” de los 20 a los 30%.(4) Recomendación: Se debe evitar, rigurosamente, la recolección de muestra por medio de swabs. El adecuado es aspirado de secreción.(1) La historia clínica del paciente y la evaluación de los factores de riesgo son importantes antes de la decisión por el esquema antimicrobiano. La presencia de enfermedades asociadas como el diabetes mellitus y enfermedades del colágeno, admisión hospitalaria previa, contacto con animales e historia de picaduras o arañazo, uso de drogas inyectables y antecedentes de viajes contribuyen mucho para la adecuación del tratamiento. La tabla 1, muestra los factores de riesgo y los agentes involucrados más probables. Tabla 1. Factores de riesgo para IPTB causado por patógenos específicos(6) Factores de riesgo Patógenos Admisiones frecuentes en hospitales MRSA Contacto con deportes, ampollas y abscesos recurrentes MRSA o MSSA productoras de leucocidina Panton-Valentine Diabetes S. aureus (MRSA y MSSA), Grupo Estreptococos hemolyticus, anaerobios, Bacilos Gram negativo Neutropenia Bacilos Gram negativo, P. aeruginosa Mordeduras: Humana Gatos Perros Ratón Flora oral humana Pasteurella multocida Capnocytophaga canimorsus Streptobacillus moniliformis (considerar igualmente el tétano y la rabia) Contacto con animales Campylobacter spp, dermatofitosis, Bartonella henselae, Francissella tularensis, Bacillus anthracis, Yersinia pestis Exposición al agua (mar, ríos) Vibrio spp, Aeromonas hydrophila, Mycobacterium marinum, P. aeruginosa Contacto con reptiles Salmonella spp Uso de drogas inyectables MRSA, Clostridium botulinum, Clostridium tetani Viajes Leishmaniosis, larva migrans cutánea, miiasis, Cordylobia anthropophaga, Dermatobia hominis 43 Rev Panam Infectol 2013;15(1 Supl 1):S42-50. Recomendación: En el diagnóstico de la erisipela y de la celulitis se debe evaluar la historia clínica del paciente, los factores de riesgo y la presencia de enfermedades asociadas. Infecciones necrotizantes de piel y fáscias: fascitis necrotizante Las infecciones necrotizantes de piel y tejidos blandos son nombradas de acuerdo a la profundidad atingida por la infección: celulitis necrotizante (infección limitada a piel y tejido celular subcutáneo, sin alcanzar la fascia superficial), fascitis necrotizante (infección que afecta y trasciende la fascia superficial) y mionecrosis (Infección que afecta planos musculares profundos).(7-10) Se trata de infección de ocurrencia infrecuente, cerca de 0,4 casos/100.000 hab., pero de mortalidad muy elevada, principalmente en el caso de que tarde el diagnóstico o tratamiento. De un modo general, se puede afirmar que, cuanto más significativa la destrucción de tejido, mayor la mortalidad asociada y, debido al carácter rápidamente progresivo, se vuelve una infección de alta mortalidad y tiempo dependiente.(11-14) Clasificación No existen diferencias en cuanto a la evolución clínica, morbidad o mortalidad entre sus varios tipos, aunque los agentes etiológicos sean diferentes y existan particularidades en la fisiopatogenia de cada tipo: TIPO I (Gangrena sinérgica) – Responsable por más de 70% de los casos de fascitis necrotizante, se caracteriza por la etiología polimicrobiana, con participación de bacterias anaerobias ocurriendo, más frecuentemente, en pacientes diabéticos, vasculopatías y/o inmunodeficientes. Aunque pueda ocurrir en cualquier parte del cuerpo, las extremidades inferiores, región cervical y perineal son las más afectadas. TIPO II (Gangrena estreptocócica) – Menos frecuente que el tipo I, pero con número de casos creciente en las últimas dos décadas, es causada por estreptococos del Grupo A, generalmente relacionada a los pequeños traumas, aunque pueda ocurrir como resultado de diseminación hematógena. Se asocia, frecuentemente, a la Síndrome del shock tóxico estafilocócico (SSTE) y tiene mortalidad bastante elevada y, en general, desfigurante. TIPO III – en la actualidad, se ha descrito un tercer tipo de fascitis necrotizante, causado por vibriones marinos, y el Vibrio vulnificus está considerado el más virulento. Se trata de infección de más incidencia en individuos con más de 50 años y en diabéticos y, frecuentemente, tiene un carácter hiperagudo, por veces con evolución de horas hasta el óbito. Generalmente, se relacionan a las heridas hechas en el mar y en las playas, pero hay descripciones de casos relacionados a alimentos contaminados.(12-14) 44 Fisiopatogenia Factores de riesgo - Aunque sea común la asociación de la fascitis necrotizante con la presencia de una puerta de entrada (trauma, mordedura, perforación, cirugía, etc.), y, virtualmente cualquier persona pueda presentar este tipo de complicación, parece ser más común en pacientes que poseen algún factor de predisposición, principalmente alguna condición clínica inmunosupresora, que representa hasta 90% de los casos.(15-22) Tenemos los siguientes factores de riesgo: • Diabetes mellitus, • Edad > 60 años, • Alcoholismo, • Corticoides, • Neoplasias, • Obesidad, • Inmunodeficiencias, • Desnutrición, • Cirugías, • Traumas, • Uso de drogas inyectables, • Quemaduras, • Vasculopatías, • Insuficiencia renal, • Varicela. Microbiología Los agentes etiológicos involucrados son diferentes conforme el tipo de infección. En líneas generales, fascitis necrotizante del Tipo I son siempre de etiología polimicrobiana; mientras la del Tipo II, generalmente es causada por Streptococcus pyogenes; y fascitis necrotizante, del Tipo III, por vibriones marinos (tabla 2).(15-22) Tabla 2. Microbiología Tipo I Tipo II Tipo III Staphylococcus aureus Enterococci Escherichia coli Peptostreptococcus Prevotella porphyromonas Bacteroides fragilis Clostridium Streptococcus pyogenes Vibrio vulnificus V. parhemolyticus V. algilyticus En la fascitis necrotizante del Tipo I, las infecciones por anaerobios como clostridium y bacteroides exigen condiciones de oxi-reducción apropiadas en el tejido, generalmente garantizadas por la coinfección con anaerobios facultativos o Gram negativos, o aún por la presencia de cuerpo raro.(23,24) Ya en las infecciones estreptocócicas (Tipo II), la proteína M de la pared bacteriana desempeña importante papel en la adherencia bacteriana a los tejidos del huésped, además de actuar de forma inhibitória sobre Lima ALLM, et al. • Directrices panamericanas para el tratamiento de las osteomielitis... leucocitos, disminuyendo la fagocitosis, lo cual ayuda a explicar la evolución muchas veces fulminante de estas infecciones. Además de eso, estas infecciones están acompañadas por la producción de superantígenos y liberación maciza de citosinas, que amplifican la respuesta inflamatoria, contribuyendo para la instalación de la Síndrome del shock tóxico estafilocócico (SSTE) muy frecuente en estos casos.(25,26) Finalmente, las infecciones por vibriones marinos pueden se desarrollar a partir de traumas, pero igualmente por la ingestión de frutos del mar.(27,28) Evolución clínica Clínicamente, podemos reconocer tres fases evolutivas: Fase I (inicial): empieza en las 24h que se siguen a la lesión inicial (trauma, cirugía, bacteriemia); se caracteriza por la pobreza de señales clínicos. Puede haber aumento de temperatura, hiperemia y edema discretos, que contrastan con el dolor intenso y la repercusión sistémica concomitante, que puede variar de síntomas flu-like, hasta cuadro de sepsis; (29-31) Fase II (avanzada): entre el 1º y el 3º día después del comienzo del cuadro. Surgen señales de sufrimiento de tejido y necrosis, además de daño profundo de tejido, con producción de gas cuando bacterias anaerobias estuvieren presentes, además de la formación de ampollas, fluctuación y del crepitar. La toxemia y las señales flogísticas son más evidentes;(29-31) Fase III (crítica): entre 2º y 5º días después del comienzo del cuadro, ocurre necrosis de piel, cambio de sensibilidad superficial y hemorragia en las lesiones, a la vez que insuficiencia de los órganos, choque séptico y alteración del nivel de consciencia, que se desarrollan rápidamente, llevando el paciente al óbito.(29-31) La fascitis necrotizante puede manifestarse en la ausencia de un factor etiológico mejor definido, aunque en 80% de los casos sea posible encontrar una puerta de entrada para infección de la piel. Cualquier paciente con infección cutánea puede, a la primera mirada, presentar evolución para fascitis necrotizante volviendo el diagnóstico clínico desafiador.(23,29,32) La discrepancia entre los hallazgos del examen local y de las quejas álgicas de los pacientes, tal como la repercusión sistémica, comunes desde la fase inicial, pueden servir como señal de alerta. Pacientes diabéticos constituyen la población particularmente susceptible, pero el diagnóstico puede ser dificultado por la neuropatía periférica, que disminuye las manifestaciones álgicas y el cuadro evolutivo puede ser agravado por la vasculopatía concomitante.(23,29,32) Por lo tanto, el diagnóstico precoz puede ser decisivo para salvar vidas y evitar secuelas graves o cirugías mutilantes. Recomendación: Observar los factores de predisposición del paciente, principalmente alguna condición clínica inmunosupresora, que representa hasta 90% de los casos y los factores de riesgo. Evaluar los agentes etiológicos: Tipo I, Tipo II o Tipo III. El diagnóstico precoz puede ser decisivo para salvar vidas y evitar secuelas graves o cirugías mutilantes. Exámenes laboratoriales Hemograma: puede revelar leucocitosis (36% de los casos en fase inicial, con valor predictivo positivo de 66-77%); anemia (generalmente con Hb < 10) y linfopenia bajo los 1000 cel/ml, presente en casi todos y en 64% de los casos bajo los 500 cel/ml.(29) PCR: elevación superior a 100 mg/dL en la mayoría de los casos.(29) CPK: niveles superiores a los 600 U/L tienen VPP de 58%, sin embargo, tales niveles son encontrados en menos de 10% de los casos de fascitis necrotizante.(29) Recolección de material Hemocultivos: fascitis necrotizante se hacen acompañar de bacteriemia en más de 50% de los casos. Desde luego, se recomienda la recolección de por lo menos dos muestras de hemocultivos, con asepsia y antisepsia adecuadas, antes del comienzo de la antibioticoterapia. No existen evidencias de que la recolección con intervalos entre las muestras mejore la tasa de diagnóstico pero puede retrasar el inicio del antibiótico. Se recomienda la utilización de sitios diferentes para cada muestra y la siembra en medios de cultivo para aerobios y para anaerobios.(8,29) Otros exámenes: el hallazgo de hipoalbuminemia, aunque sea casi universal, es menos especifico, lo mismo con el hallazgo de hiponatremia y de hipocalcemia.(29) En función de la pobreza de manifestaciones clínicas locales en las fases iniciales y la dramaticidad de la evolución de los casos de fascitis necrotizante, cuando comparado con otras formas de infecciones de piel y tejidos blandos, es relevante que se disponga de instrumentos que puedan ayudar en la diferenciación entre esa enfermedad y otras infecciones de piel y tejidos blandos. Wong y colaboradores, por medio de la correlación de datos clínicos y laboratoriales, desarrollaron un score, utilizando seis variables laboratoriales, puntuadas de 0 a 4. La puntuación superior a 5 tiene valores predictivos positivos y valores predictivos negativos muy elevados, constituyendo eficaz instrumento para el diagnóstico diferencial entre fascitis necrotizante y otras infecciones de piel y tejidos blandos(19,23) (tabla 3). 45 Rev Panam Infectol 2013;15(1 Supl 1):S42-50. Tabla 3. LRINEC Score (Laboratory Risk Indicator for Necrotizing Fasciitis) 0 1 2 Leucocitos < 15000 15000-25000 > 25000 Hb > 13,5 11-13,5 < 13,5 Glucemia < 180 > 180 Creatinina < 1,5 > 1,5 PCR < 150 Sodio > 135 4 > 150 < 135 Interpretación: 0-5 = Bajo riesgo de FN (< 50%) VPN = 96% VPP = 92% 6-7 = Medio riesgo de FN (50-75%) > 8 = Alto riesgo de FN (> 75%) VPP = 94% Recomendación: Recoleccionar al menos dos muestras de hemocultivos, con asepsia y antisepsia adecuadas, antes del comienzo de antibioticoterapia. Utilizar sitios diferentes para cada muestra y hacer la siembra en medios de cultivo para aerobios y para anaerobios. Exámenes de imagen Rayos X - puede evidenciar la presencia de gas, hallazgo que tiene apenas 39% de sensibilidad, pero 95% de especificidad.(23) Ultrasonografia - Los hallazgos más frecuentemente relatados son: edema y la distorsión de la fascia y eventualmente el encuentro de colecciones a lo largo de la fascia superficial. Sin embargo, en fases precoces el ultrasonido parece de poca validez para el diagnóstico.(23) Tomografía Computadorizada (TC) - puede detectar alteraciones como edema y alteraciones texturales de la fascia superficial asimismo en fases más precoces, además de mostrar la presencia de gas y colecciones. La necesidad de contraste para diagnóstico preciso y el alto riesgo de desarrollo de IRA en estos pacientes, vuelve la indicación de TC muchas veces limitada.(33,34) Resonancia Magnética (RM) - cuando disponible, constituye el mejor método para diagnóstico de faciitis necrotizante, con sensibilidad de casi 100%, especificidad de 86% y exactitud de 94%. Además de señales de comprometimiento inflamatorio de la fascia superficial evidenciada por la señal hiperintensa en T2, permite delimitar el área de necrosis, y es útil para conducir el abordaje quirúrgico. A pesar de frecuentemente superestimar las alteraciones de la infección, la ausencia de alteraciones de la 46 fascia en la RM tiene alto valor predictivo negativo, permitiendo excluir el diagnóstico de fascitis necrotizante.(33,34) Biopsia En las situaciones en las cuales el diagnóstico de fascitis necrotizante, al momento del abordaje inicial, sea todavía dudoso, se recomienda la realización de biopsia en cuña, con área de 1 cm, y realización de histopatológico para confi rmación diagnóstica.(30,31) La realización de biopsia de congelamiento para el diagnóstico precoz de fascitis necrotizante en pacientes en los cuales los hallazgos clínicos no son suficientes para fundamentar el diagnóstico puede tener impacto en la sobrevida y en las tasas de amputaciones. Sin embargo, hallazgos negativos en la biopsia no permiten excluir el diagnóstico de esa enfermedad.(30,31) Hallazgos histológicos definidores de fascitis necrotizante son: necrosis de la fascia superficial con infiltración de polimorfonucleares en la dermis, presencia de trombos y señales de angeítis en arterias y venas de la fascia superficial, necrosis fibrinoide y presencia de microorganismos.(30,31) Diagnóstico diferencial El diagnóstico diferencial de fascitis necrotizante incluye las otras infecciones necrotizantes de piel y tejidos blandos: celulitis necrotizante, mionecrosis, además de piomiositis y miositis virales y parasitarias. Los datos del cuadro 1 permiten la comparación entre estas entidades.(29,32) Cuadro 1. Diagnóstico diferencial de fascitis necrotizante incluye las otras infecciones necrotizantes de piel y tejidos blandos Hallazgos Clínicos Fascitis necrotizante Gangrena gaseosa Piomiositis Miositis viral / parasitaria Fiebre ++++ +++ ++ ++ Dolor difuso + + + ++++ Dolor local ++++ ++++ ++ ++ Toxemia ++++ ++++ + + Gas em los tejidos - ++++ - - Puerta de entrada ++++ ++++ - - Diabetes Mellitus ++++ - - - Lima ALLM, et al. • Directrices panamericanas para el tratamiento de las osteomielitis... Piomiositis La mayoría de los cuadros son secundarios a focos contiguos de infección bacteriana, como celulitis y abscesos de piel, o secundarios a la diseminación hematógena de bacterias de focos a distancia.(35) Los abscesos primarios de músculos, piomiositis, son raros y en su mayoría están relacionados a factores de predisposición como diabetes, alcoholismo, uso de inmunosupresores, infección por el HIV y desnutrición. El absceso del músculo psoas, en particular, puede estar relacionado a los procesos infecciosos en vísceras abdominales u osteomielitis vertebrales. El diagnóstico diferencial entre pioartritis de la cadera y psoítis es particularmente difícil, una vez que ambos generan contracción en flexión de la articulación. Aunque rara, esta infección puede rápidamente evolucionar para septicemia y necesita tratamiento inmediato.(36-38) S. aureus es el agente aislado en la mayoría de los casos. En los abscesos relacionados al m. psoas, en especial, la etiología puede ser polimicrobiana, con participación de bacilos Gram negativos y bacterias anaerobias. Asimismo, las infecciones por micobacterias deben siempre ser acordadas, principalmente en nuestro medio (Brasil y América Latina).(35-38) Las piomiositis generalmente desarrollan en tres etapas: • Inicialmente hay la infección del músculo, con la formación de edema doloroso. Todavía no hay la presencia de colección purulenta, pero el paciente puede presentarse febril ya; • Tras una a tres semanas de la infección del músculo, hay la formación del absceso y el aparecimiento de señales inflamatorias en la piel adyacente, además de la tumoración característica. La mayoría de los diagnósticos se hacen en esa fase. • En el caso de que no haya tratamiento, la infección puede evolucionar para su tercera fase, con implicación sistémica, abscesos multifocales y choque séptico.(36-38) El diagnóstico puede ser auxiliado por exámenes de imagen. En la fase inicial, la Resonancia Magnética (RM) detecta las alteraciones inflamatorias en el músculo y es el recurso más indicado. Luego, la ultrasonografia y la tomografía computadorizada (TC) son útiles para detectar las colecciones, conduciendo punciones diagnósticas. El material obtenido debe ser enviado para cultivos.(35,38) Recomendación: La resonancia magnética es el examen más indicado para evaluar las alteraciones iniciales. El material obtenido por punciones y drenaje de colecciones debe siempre ser enviado para cultivos. Bursitis Son disturbios inflamatorios de las bursas, estructuras ubicadas en algunas articulaciones y que buscan disminuir la fricción entre estas y los músculos, tendones y piel adyacentes. La mayoría de las bursitis son asépticas, tan solo un tercio de ellas están relacionadas a los procesos infecciosos y son generalmente secundarias a traumas locales. El agente más frecuentemente aislado es el S. aureus, responsable por cerca de 80 a 90% de los casos, y las articulaciones más acometidas son hombros, codos y rodillas.(35,39,40) Generalmente, el cuadro se manifiesta con dolor e hiperemia en la articulación acometida, con la bursa volviéndose palpable. Puede haber fiebre en cerca de 60% de los pacientes. Los principales diagnósticos diferenciales son celulitis y pioartritis. La realización de ultrasonografia de la articulación acometida puede auxiliar en la diferenciación entre esos cuadros. Desde el punto de vista clínico, la pioartritis provoca dolor más intenso y bloqueo articular antálgico, lo que generalmente no ocurre en la bursitis o celulitis.(39,40) El diagnóstico definitivo se obtiene por la punción de la bursa. La presencia de número elevado de leucocitos en los aspirados (superior a 1000/mm3) con predominio de neutrófilos es sugestiva de infección bacteriana. El envío de este material para cultivo es importante para la confirmación del diagnóstico etiológico.(39,40) Recomendación: Tan solo un tercio de las bursitis son infecciosas, la mayoría es resultante de procesos inflamatorios sin infección. La ultrasonografia puede ser útil en la diferenciación de las bursitis y celulitis. El material obtenido por la punción de la bursa inflamada debe ser enviado para cultivos. Tenosinovitis Son inflamaciones de los tendones y de las vainas protectoras que los revisten. Entre los cuadros de origen infeccioso, el más común es la tenosinovitis de los flexores de los dedos de las manos, generalmente relacionada a traumas digitales. Esta infección está considerada una urgencia ortopédica, debido al grande riesgo de rápida destrucción y secuela funcional definitiva. Todavía hoy deben ser observadas las cuatro señales de Kanavel, descritas en 1.912, que incluyen: • Dolor intenso a la extensión pasiva de los dedos; • Postura en leve flexión del dedo cuando en reposo; • Edema difuso del dedo; • Dolor a la palpación y percusión a lo largo de la vaina del tendón.(41-43) El agente más frecuentemente aislado es S. aureus, 47 Rev Panam Infectol 2013;15(1 Supl 1):S42-50. principalmente en casos relacionados a traumatismos locales, pero Streptococcus spp y bacilos Gram-negativos tienen ocurrencia significante y se debe tener en consideración. Neisseria gonorrheae es particularmente importante en adultos jóvenes y sexualmente activos y sin antecedente de traumatismo.(41-43) El principal diagnóstico diferencial es el absceso subcutáneo de la región acometida, que generalmente no presenta dolor a la extensión pasiva de los dedos y tampoco edema en el recorrido de la vaina de los tendones. La ultrasonografia puede ser útil en la determinación del diagnóstico.(41-43) Recomendación: Se debe observar las señales de Kanavel. La ultrasonografia puede auxiliar en el diagnóstico. Hidradenitis Descrita por primera vez en 1854, por el cirujano francés Aristide Verneuil, se consideró una inflamación primaria de las glándulas apócrinas, hoy se considera más compatible como secundaria a la oclusión folicular.(44) Es una enfermedad inflamatoria crónica, recurrente, que afecta a las zonas donde predominan las glándulas sudoríparas apócrinas y se caracteriza por la aparición de nódulos subcutáneos dolorosos, que acaban evolucionando para abscesos y trayectos fistulosos supurativos con formación de cicatrices hipertróficas, afectando principalmente las axilas, región inguinal y región anogenital.(45) Tiende a manifestarse a partir de la segunda o tercera década de vida, con una prevalencia del 4%, rara después de los 40-50 años, aunque niños pre-puber y mujeres post-menopáusicas se han visto afectadas. Es mas frecuente en el sexo femenino 3:1 y les afecta mas la áreas genitofemorales.(45,46) I-A. (figura 4) Varios factores se han involucrado a esta patología: genéticos, hormonales, obesidad, tabaco, infección, alteración morfológica glandular, desregulación del Sistema Inmune e inclusive farmacológicos. Asimismo, se ha relacionado a las enfermedades foliculares oclusivas, enfermedad de Crohn, trastornos pigmentarios, pioderma gangrenoso y enfermedades reumatológicas. Cerca de un tercio de los pacientes tienen una historia familiar y afecta familias de manera autosómica dominante y en un numero menor de casos en la cual la hidradenitis es acompañada por acne grave y perifoliculitis capitis, la enfermedad se ha asociado al cromosoma 1p21.1–1q25.3 y mutaciones del complejo y-secretase, aunque varios estudios no han podido demostrar la asociación con antígeno HLA.(47) III-B. El tabaquismo y la obesidad son reconocidos como factores de riesgo para hidradenitis. Ambos factores tienen relación directa con la gravedad de la condición.(48,49) I-B. La enfermedad afecta la calidad de vida comparado a otras condiciones de piel crónicas en la población general. Condiciones reportadas como asociadas incluyen el acné grave, acné conglobata y quiste pilonidal. Datos de estudios epidemiológicos sugiere un incremento de 50% de cáncer de cualquier tipo, comparado con población general y la frecuencia ha sido reportada en incremento en pacientes con enfermedad de Crohn, afectando el 17% de los pacientes. Una relación entre las dos condiciones es sustentada por estudios clínicos, histológicos y epidemiológicos, similitudes, tales como trayectos sinuosos, inflamación granulomatosa, cicatrices, y su inicio después de la pubertad.(50,51) I-C Artritis con factor reumatoide negativo y HLAB27–negativo es más frecuente en estos pacientes comparados a población general y usualmente involucra articulaciones periféricas y muchas veces de forma assimétrica.(44-46,52) III-A. Patogénesis Permanece no siendo clara. Estudios histológicos sugieren una enfermedad multifocal, en la cual atro- Figura 4. Estadio de Hurley de lesiones en hidradenitis suppurativa (Fonte: Jemec GBE. N Engl J Med 2012;366:158-164) 48 Lima ALLM, et al. • Directrices panamericanas para el tratamiento de las osteomielitis... fia de las glándulas sebáceas es seguida por precoz inflamación linfocítica y hiperqueratosis de la unidad pilosebácea y más tarde destrucción del folículo piloso y formación de granuloma.(53-56) Recientes investigaciones sugieren que IL-12, IL-23 y TNF- están envueltos en la patogénesis, sustentando la propuesta de que es un desorden inmune e inflamatorio.(47,57-59) III-A. principales fallos de diagnóstico para reconocer tempranamente a las lesiones. Igualmente hay que hacer diagnóstico diferencial con Glándula de Bartolino infectada, quistes epidérmicos infectados o inflamados, linfogranuloma venéreo, escrofuloderma, actinomicosis, acné nodular y quiste pilonidal fístulizados.(62,63) I-A Diagnóstico Por lo general es clínico, se observan nódulos inflamatorios o no, drenando o no por trayectos fistulosos y abscesos en área axilar, inguinal y anogenital. Las lesiones se extienden en todas estas areas y aparecen alrededor del ano, nalgas o mama en las mujeres principalmente.(46) Los nódulos están localizados en la dermis profunda y en lugar de tener la elevación purulenta puntiaguda, se asemejan forúnculos simples. Lesiones secundarias como granulomas piógenos en las aberturas de los túneles, presentan una induración, cicatrices y comedones de múltiples cabezas gigantes. Biopsia y material para cultivo deben ser colectados en casos atípicos o refractarios, aunque los estudios bacteriológicos son frecuentemente negativos, pero pueden haber muchos gérmenes asociados a una superinfección, incluyendo S. aureus.(60,61) Clasificar la severidad es útil en el manejo y tratamiento, y se aceptan los diferentes estadios de la Clasificación de Hurley(59) para tales fines (Figura 4): • Estadio I: Formación de abscesos (únicos o múltiples), sin trayectos fistulosos ni cicatrización; • Estadio II: Abscesos recurrentes, únicos o múltiples pero ampliamente separados, con formación de trayectos fistulosos y cicatrices; • Estadio III: Presencia de múltiples trayectos fistulosos interconectados y abscesos que afectan a áreas enteras. La mayoría son estadio II en la Clasificación de Hurley, que evidencia el retraso en el diagnostico. Solo cerca de 1% de los pacientes progresa a estadio III. Estos tres criterios deben cumplirse para establecer el diagnóstico, adoptados por el Congress of the Hidradenitis Suppurativa Foundation (Marzo 2009): • Las lesiones típicas, es decir, profundamente arraigadas a nódulos dolorosos como forúnculos ‘ciegos‘; en las lesiones tempranas, hay abscesos, sinusitis, cicatrices de drenaje y puentes abiertos en las lesiones secundarias; • Topografía típica, es decir, axilas, región inguinal, regiones perineal y perianal, nalgas, pliegues infra e inter mamarios; • La cronicidad y recurrencia. Recomendación: Biopsia y material para cultivo deben ser recolectados en casos atípicos o refractarios, aunque los estudios bacteriológicos son frecuentemente negativos. Clasificar la severidad es útil en el manejo y tratamiento. Diagnóstico diferencial Absceso común, carbunclo, furunculosis son los 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. Referencias Stevens DL, Bisno AL, Chambers HF, Everett ED, Dellinger P,.Goldstein EJC, Gorbach SL, Hirschmann JV, Kaplan EL, Montoya JG,.Wade JC. Practice Guidelines for the Diagnosis and Management of Skin and Soft-Tissue Infections. Clin Infect Dis 2005;41(10):1373-406. Perl B, Gottehrer NP, Raveh D, Schlesinger Y, Rudensky B, Yinnon. AM. Cost-effectiveness of blood cultures for adult patients with cellulitis. Clin Infect Dis 1999; 29(6):1483-8. Lebre C, Girard-Pipau F, Roujeau JC, Revuz J, Saiag P, Chosidow O. Value of fine needle aspiration in infectious cellulitis. Arch. Dermatol 1996;132(7):842-3. Duvanel T, Auckenthaler R, Rohner P, Harms M, Saurat JH. Quantitative cultures of biopsy specimens from cutaneous cellulitis. Arch Intern Med 1989;149(2):293-6. Dupuy A, Benchikhi H, Roujeau JC, Bernard P, Vaillant L, Chosidow O, Sassolas B, Guillaume JC, Grob JJ, Bastuji-Garin S. Risk factors for erysipelas of the leg (cellulitis): case-control study. BMJ 1999;318(7198):1591-4. Dryden MS. Complicated skin and soft tissue infection. J Antimicrob Chemother 2010;65 Suppl 3:iii35-44. Swartz MN. Cellulitis and subcutaneous tissue infectious. Mandell GL, Bennett JE, Dolin R. Principles and practice of infectious diseases. New York: Churchill Livingstone 2005;1172-94. Stevens DL, Bisno AL, Chambers HF, Everett ED, Dellinger P, Goldstein EJ, Gorbach SL, Hirschmann JV, Kaplan EL, Montoya JG, Wade JC. Pratice guidelines for the diagnosis and management of skin and soft-tissue infections. Clin Infect Dis 2005;41(10):1373-406. Gunderson CG. Cellulitis: definition, etiology, and clinical features. Am J Med 2011;124(12):1113-22. Rogers RL, Perkins J. Skin and Soft Tissue Infections. Prim Care 2006;33(3):697-710. Kao LS, Lew DF, Arab SN, Todd SR, Awad SS, Carrick MM, Corneille MG, Lally KP. Local variations in the epidemiology, microbiology, and outcome of necrotizing soft-tissue infections: a multicenter study. Am J Surg 2011;202(2):139-45. Ustin JS, Malangoni MA. Necrotizing soft-tissue infections. Crit Care Med 2011;39(9):2156-62. Hasham S, Matteucci P, Stanley PR, Hart NB. Necrotising fasciitis. BMJ 2005; 330(7495):830-3. Kuncir EJ, Tillou A, St Hill CR, Petrone P, Kimbrell B, Asensio JA. Necrotizing soft-tissue infections. Emerg Med Clin North Am 2003;21(4):1075-87. Chen JL, Fullerton KE, Flynn NM. Necrotizing Fasciitis Associated with Injection Drug Use. Clin Infect Dis 2001;33(1):6-15. Clark P, Davidson D, Letts M, Lawton L, Jawadi A. Necrotizing 49 Revista Panamericana de Infectología 2013;15(1 Supl 2):S42-50. 17. 18. 19. 20. 21. 22. 23. 24. 25. 26. 27. 28. 29. 30. 31. 32. 33. 34. 35. 36. 37. 38. 39. 40. fasciitis secondary to chickenpox infection in children. Can J Surg 2003;46:1:9-14. Yanar H, Taviloglu K, Ertekin C, Guloglu R, Zorba U, Cabioglu N, Baspinar I: Fournier’s gangrene: risk factors and strategies for management. World J Surg 2006;30:1750-4. Shirley R, Mackey S, Meagher P. Necrotising fasciitis: A sequelae of varicella zoster infection. J Plast Reconstr Aesthet Surg 2011;64(1):123-7. Wong CH and Wang YS. The diagnosis of necrotizing fasciitis. Curr Opin Infect Dis 2005;18:101-6. Taviloglu K, Yanar H. Necrotizing fasciitis: strategies for diagnosis and management. World J Emerg Surg 2007;2:19. Miller LG, Perdreau-Remington F, Rieg G, Mehdi S, Perlroth J, Bayer AS, Tang AW, Phung TO, Spellberg B. Necrotizing Fasciitis Caused by Community-Associated Methicillin-Resistant Staphylococcus aureus in Los Angeles. N Engl J Med 2005;352(14):1445-53. Hassell M, Fagan P, Carson P, Currie BJ. Streptococcal necrotising fasciitis from diverse strains of Streptococcus pyogenes in tropical northern Australia: case series and comparison with the literature. BMC Infect Dis 2004;4(1):60. Wong CH, Chang HC, Pasupathy S, et al. Necrotizing fasciitis: clinical presentation, microbiology and determinants of mortality. J Bone Joint Surg Am 2003;85-A(8):1454-60. Japanese Society of Chemotherapy and The Japanese Association for Infectious Diseases. Guidelines for Management of Anaerobic infections Chapter 2-5-3a (individual fields): skin and soft tissue infections. J Infect Chemother 2011;17(Suppl 1):72-76. Bisno AL, Stevenes DL. Streptococcal infection of skin and soft tissues. N Engl J Med 1996;334:240-45. Johansson L, Thulin P, Low DE, Norrby-Teglund A. Getting under the skin: the immunopathogenesis of Streptococcus pyogenes deep tissue infections. Clin Infect Dis 2010;51(1):58-65. Daniels NA. Vibrio vulnificus oysters: pearls and perils. Clin Infect Dis 2011;52(6):788-92. Horseman MA, Surani S, A comprehensive review of Vibrio vulnificus: an important cause of severe sepsis and skin and soft-tissue infection. Int J Infect Dis 2011;15(3):e157-66. Anaya DA, Dellinger EP. Necrotizing soft-tissue infection: diagnosis and management. Clin Infect Dis 2007;44(5):705-10. Mukhopadhyay et al. A Clinicopathological Study of Necrotizing Fasciitis. Al Ameen J Med 2011;4:1. Peer SM, Rodrigues G, Kumar S, Khan SA. A clinicopathological study of necrotizing fasciitis – An institutional experience. J Coll Physicians Surg Pak. 2007;17(5):257-60. Hammond SP, Baden LR.Clinical decisions. Management of skin and soft-tissue infection-polling results.N Engl J Med 2008;359(15):e20. Wysoki MG, Santora TA, Friedman AC. Necrotizing fasciitis: CT characteristics. Radiology 1997;203(3):859-63. Schmid MR, Kossmann T, Duewell S. Differentiation of necrotizing fasciitis and cellulites using MR imaging. Am J Roentgenol 1998;170:615-20. Leite OHM, Freitas AC, Oliveira PRD, Campos SV, Levin ASS. Estafilococcias e estreptococcias. In Martins HS, Damasceno MCT, Awada SB Pronto-Socorro. São Paulo: Manole 2006. Penado S, Espina B, Francisco Campo J. Abscess of the psoas muscle. Description of a series of 23 cases. Enferm Infecc Microbiol Clin 2001;19(6):257-60. Brook I. Soft tissue and muscular infections (including group A Streptococci). Baillieres Best Pract Res Clin Rheumatol 1999;13(1):95-114. Crum-Cianflone NF. Infectious myositis. Best Pract Res Clin Rheumatol 2006;20:1083-97. Stell IM. Management of acute bursitis: outcome study of a structured approach. J R Soc Med 1999;92(10):516-21. Wasserman AR, Melville LD, Birkhahn RH. Septic bursitis: a 50 case report and primer for the emergency clinician. J Emerg Med 2009;37(3):269-72. 41. Clark DC. Common acute hand infections. Am Fam Physician 2003;68:2167-76. 42. Pang HN, Teoh LC, Yam AK, Lee JY, Puhaindran ME, Tan AB. Factors Affecting the Prognosis of Pyogenic Flexor Tenosynovitis. J Bone Joint Surg Am 2007;89:1742-48. 43. Langer MF. Pyogenic flexor tendon sheath infection: a comprehensive review. Handchir Mikrochir Plast Chir 2009;41(5):256-70. 44. Verneuil A. Etudes sur les tumeurs de la peau; de quelques maladies des glandes sudoripares. Arch Générales Méd 1854;t.4:447-68. 45. Alikhan A, Lynch PJ, Eisen DB. Hidradenitis suppurativa: a comprehensive review. J Am Acad Dermatol 2009;60(4):539-61;quiz 562-3. 46. Tratamiento de la Hidradenitis supurativa. Piel (barc) 2012;27(1):3742. 47. Schlapbach C, Hänni T, Yawalkar N, Hunger RE. Expression of the IL-23/Th17 pathway in lesions of hidradenitis suppurativa. J Am Acad Dermatol 2011;65(4):790-8. 48. König A, Lehmann C, Rompel R,Happle R. Cigarette smoking as a triggering factor of hidradenitis suppurativa. Dermatology 1999;198:261-4. 49. Sartorius K, Emtestam L, Jemec GB, Lapins J. Objective scoring of hidradenitis suppurativa reflecting the role of tobacco smoking and obesity. Br J Dermatol. 2009;161(4):831-9. 50. Lapins J, Ye W, Nyrén O, Emtestam L. Incidence of cancer among patients with hidradenitis suppurativa. Arch Dermatol 2001;137:730-4. 51. van der Zee HH, van der Woude CJ, Florencia EF, Prens EP. Hidradenitis suppurativa and inflammatory bowel disease: are they associated? Results of a pilot study. Br J Dermatol 2010;162(1):195-7. 52. Jemec GBE, Revuz J, Leyden JJ, eds. Hidradenitis Suppurativa. Berlin: Springer Verlag 2006. 53. Poli F, Jemec GB, Revuz J. Clinical presentation. In: Jemec GBE, Revuz J, Leyden J, eds. Hidradenitis Suppurativa. Springer, Heidelberg 2006:11-24. 54. Herane MI et al Hirosadenitis supurativa y procesos afines. Mas Dermatol 2012;16:4-12. 55. Wang B, Yang W, Wen W, Sun J, Su B, Liu B, Ma D, Lv D, Wen Y, Qu T, Chen M, Sun M, Shen Y, Zhang X. Gamma-secretase gene mutations in familial acne inversa. Science 2010;330(6007):1065. 56. Lapins J, Olerup O, Emtestam L. No human leukocyte antigen-A, -B or -DR association in Swedish patients with hidradenitis suppurativa. Acta Derm Venereol 2001;81:28-30. 57. Jemec GB. Clinical practice. Hidradenitis suppurativa. N Engl J Med. 2012;366(2):158-64. 58. Matusiak L, Bieniek A, Szepietowski JC. Increased serum tumour necrosis factor- alpha in hidradenitis suppurativa patients: is there a basis for treatment with anti-tumour necrosis factor-alpha agents? Acta Derm Venereol 2009;89:601-3. 59. Hurley HJ. Axillary hyperhidrosis, apocrine bromhidrosis, hidradenitis suppurativa, and familial benign pemphigus: surgical approach. In: Roenigk RK, Roenigk HH, eds. Dermatologic Surgery. Marcel Dekker, New York 1989:729-39. 60. Lapins J, Jarstrand C, Emtestam L. Coagulase-negative staphylococci are the most common bacteria found in cultures from the deep portions of hidradenitis suppurativa lesions, as obtained by carbon dioxide laser surgery. Br J Dermatol 1999;140:90-5. 61. Jemec GB, Faber M, Gutschik E, Wendelboe P. The bacteriology of hidradenitis suppurativa. Dermatology 1996;193:203-6. 62. Revuz J. Hidradenitis suppurativa. JEADV 2009; 23:985-98. 63. Hurley HJ. Axillary hyperhidrosis, apocrine bromhidrosis, hidradenitis suppurativa, and familial benign pemphigus: surgical approach. In: Roenigk RK, Roenigk HH Jr, eds. Dermatologic surgery: principles and practice. 2nd ed. New York: Marcel Dekker 1996:623-45.
![FASCITIS NECROTIZANTE [ ]](http://s2.studylib.es/store/data/000770902_1-3d5f9b583c0ae64b8ca027a6eb729e3b-300x300.png)




