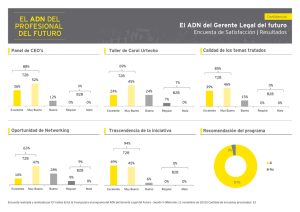
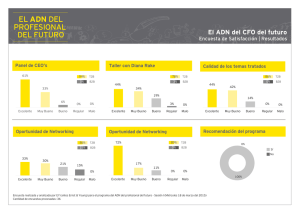
RPA RPB - Universidad Austral
Anuncio

UNIVERSIDAD DE BUENOS AIRES. FACULTAD DE FARMACIA Y BIOQUÍMICA RECEPTOR DE PROGESTERONA: ISOFORMAS Y GENES REGULADOS DIFERENCIALMENTE COMO HERRAMIENTA PREDICTIVA DE LA RESPUESTA AL TRATAMIENTO CON ANTIPROGESTÁGENOS Autor: María May Director: Dra. Claudia Lanari Codirector: Dr. Alfredo Molinolo Consejero de estudios: Dr. Carlos Davio Lugar: Instituto de Biología y Medicina Experimental (IByME) Lugar y Año: Ciudad de Buenos Aires, 2015 1 Agradecimientos A mi Tía-Aia que hizo el trabajo previo A Pato, Ine y Nacho que son la luz de mi vida A mis viejos que están siempre presentes y tan orgullosos de todos mis logros A todos los que no están pero están En especial y de todo corazón a Claudia por ser tan generosa y paciente A todo el grupo Lanari- Novaro por los mates compartidos, el trabajo diario y la buena predisposición de siempre. A Martín Abba por su ayuda con el manejo de bases de datos y al análisis de los RNAseq. A Claudio Núñez por el procesamiento y ayuda técnica de cortes, coloraciones y armado de TMAs. A toda la gente del IByME, incluyendo guardia, mantenimiento, lavadero, bioterio y limpieza, que de alguna u otra manera también hicieron posible este trabajo AL CONICET y a la Agencia Nacional de Promoción Científica y Tecnológica, por su apoyo a través de las becas y los proyectos financiados. 2 “Always two there are, no more, no less. A master and an apprentice.” – Yoda 3 Publicaciones Parte de los resultados presentados en este trabajo de tesis han sido presentados en formato poster en los siguientes congresos internacionales: “PRA isoform as a predictive marker of antiprogestin therapy in breast cancer: A tissue culture method to evaluate drug responsiveness”. May M., Rojas P., Sequeira G., Martínez Vázquez P., González P., Gass H., Lanari C. San Antonio Breast Cancer Symposium, San Antonio, Texas, US, diciembre de 2013. “Progesterone receptor isoform ratio defines the molecular signature of luminal breast cancers and their antiprogestin responsiveness”. May M., Rojas P., Sequeira G., Elia A., Martínez Vázquez P., González P., Abba M., Molinolo A., Hewitt S., Perou CM., Gass H., Lanari C. (Merit award; Conquer Cancer Foundation) American Society of Clinical Oncology, Annual Meeting, Chicago, US, mayo de 2015. LX Reunión Anual de la Sociedad Argentina de Investigación Clínica (SAIC) realizado en forma conjunta con la Sociedad Argentina de Fisiología (SAFIS), en la ciudad de Mar del Plata entre los días 18 y 21 de Noviembre del corriente. Premio Cossio al mejor trabajo en investigación clínica: Las isoformas del receptor de progesterona como marcador pronóstico del riesgo de recurrencia en cáncer de mama. María May, Martín Abba, Paola Rojas, Gonzalo Sequeira, Andrés Elías, Michelle Álvarez, Alfredo Molinolo, Stephen Hewiitt, Charles Perou, Paula Martínez, Pedro Gonzalez, Hugo Gass y Claudia Lanari. El manuscrito correspondiente a esta tesis se encuentra en redacción. 4 Durante la realización de esta tesis realicé el siguiente trabajo no incluido en los resultados de la tesis doctoral: 2015 - María May , Paula Martinez , Pedro Gonzalez , J Mosto , Hugo Gass , Claudia Lanari and Alfredo A. Molinolo “Nuclear staining of fgfr-2/ stat-5 and runx-2 in mucinous breast cancer: a possible role for fgf pathway” Exp Mol Pathol. 2015, Nov 6. pii: S0014-4800(15)00214-2. doi: 10.1016/j.yexmp.2015.11.003. Asimismo, durante el desarrollo de mi carrera de doctorado he colaborado con diversos proyectos de investigación, parte de los cuales han dado lugar a las siguientes publicaciones: 1. 2013 - Ana Sahores, Guillermina M. Luque, Victoria Wargon, María May, Alfredo Molinolo, Damasia Becu-Villalobos, Claudia Lanari, Caroline A. Lamb, “Novel, low cost, highly effective, handmade steroid pellets for experimental studies”, Plos One, May 15, 2013 DOI: 10.1371/journal.pone.0064049. 2. 2014 - Sabrina Copsel, Ariana Bruzzone, Maria May, Julien Beyrath, Victoria Wargon, Jeannette Cany, Frans GM Russel, Carina Shayo, Carlos Davio “Multidrug resistance protein 4/ ATP binding cassette transporter 4: a new potential therapeutic target for acute myeloid leukemia”. Oncotarget 2014 Oct; 5(19): 9308–9321. 3. 2014 - Gonzalo Sequeira,*, Silvia I Vanzulli,*, Paola Rojas, Caroline Lamb, Lucas Colombo, María May, Alfredo Molinolo and Claudia Lanari. “The effectiveness of nano chemotherapeutic particles combined with mifepristone depends on the PR isoform ratio in preclinical models of breast cancer”. Oncotarget. 2014 May 30;5(10):3246-60. 4. 2014 - Victoria Wargon*, Marina Riggio*, Sebastián Giulianelli, Gonzalo Sequeira, Paola Rojas, María May, María Laura Polo, María Alicia Gorostiaga, Alfredo Molinolo, Virginia Novaro and Claudia Lanari. “Progestin and antiprogestin responsiveness in breast cancer is driven by the PRA/PRB ratio via AIB1 or SMRT recruitment to the CCND1 and MYC promoters”.Int J Cancer. 2014, Nov 1. doi:10.1002/ijc.29304. 5. 2015 - M. L. Polo1, M. Riggio1, M. May1, M. J. Rodríguez1, M. C. Perrone1, M. StallingsMann2, D. L. Kaen3, M.H. Frost4, M.P. Goetz4, J.C. Boughey5, C. Lanari1, D.C. Radisky2 5 and V.Novaro1 “Activation of PI3K/Akt/mTOR signaling in the tumor stroma drives endocrine therapy-dependent breast tumor regression” Oncotarget, May 16 2015. 6 Resumen 7 El 75% de los carcinomas mamarios expresan receptores de estrógenos alfa (RE y receptores de progesterona (RP). Los mismos se clasifican como tumores de tipo luminal; y son tumores que a priori serán respondedores a la terapia hormonal. A pesar de que en la gran mayoría de los casos existe expresión de ambos receptores hormonales, la única terapia hormonal disponible para este gran grupo de tumores, se dirige exclusivamente al RE. En la actualidad el RP se utiliza como marcador secundario de la funcionalidad del RE El rol de los progestágenos en el cáncer de mama ha sido menos estudiado que el de los estrógenos, sin embargo numerosos datos bibliográficos y antecedentes de nuestro laboratorio, sostienen que existe un rol para la progesterona en la inducción y mantenimiento del fenotipo neoplásico en la glándula mamaria. La importancia de estos datos se puso en evidencia en los resultados obtenidos en dos importantes estudios, The Women’s Health Initiative trials y The Million Women Study, que mostraron que la inclusión de progestágenos en los esquemas de terapia de reemplazo hormonal causó un incremento de neoplasias mamarias en mujeres menopáusicas. La progesterona actúa sobre sus células blanco activando al RP. Este receptor presenta dos isoformas denominadas RPA y RPB, que son estructuralmente muy similares y están codificadas por un mismo gen pero difieren en el sitio de inicio de la transcripción. El gold standard para determinar el perfil de isoformas de una muestra es el Western Blot (WB) ya que ambas isoformas se diferencian por el peso molecular, lo que hace necesario contar con tejido fresco y una estructura técnica adecuada. Es importante resaltar que, la similitud estructural de ambas isoformas hace difícil contar con anticuerpos específicos que distingan a una de otra. En nuestro laboratorio, hemos demostrado, tanto en un modelo murino de carcinomas mamarios de tipo luminal, como en líneas celulares humanas de similares características, que existe una correlación entre una alta expresión del RPA y la respuesta al tratamiento con antiprogestágenos, específicamente la mifepristona (MFP). Por otra parte, hemos observado que cuando predomina RPB la respuesta a la misma droga puede llegar a ser de tipo estimulatoria. En este escenario planteamos la hipótesis de que los carcinomas mamarios humanos que posean similares características al modelo experimental, y que además expresen mayores niveles de RPA que RPB, serían los que se beneficien la adición del tratamiento con antiprogestágenos. El objetivo general de esta tesis es validar a la isoforma A del RP como marcador predictivo de dicho tratamiento, y en segundo lugar, diseñar un algoritmo de 8 expresión diferencial, que nos permita predecir la isoforma predominante a partir de muestras parafinadas. Para el primer objetivo, pusimos a punto un método de cultivo ex-vivo donde cuantificamos la respuesta de los tumores frente al tratamiento con MFP y su correlación con su perfil de isoformas cuantificado por WB. Se midieron los índices de proliferación con ki-67 en la misma muestra tumoral, tanto en condiciones control como en condiciones de tratamiento, durante 48 hs. De esta manera pudimos comprobar, sobre muestras de pacientes, que el 100% de los tumores con predominio de la RPA inhiben su proliferación frente al tratamiento con antiprogestágenos. Para el segundo objetivo nos basamos en resultados obtenidos de secuenciación de RNAm de pacientes catalogadas según su perfil de isoformas, y seleccionamos un listado de genes candidatos regulados de forma diferencial por RPA o RPB. Haciendo uso de tissue microarrays construidos a partir de muestras parafinadas de pacientes catalogadas según su perfil de isoformas, estamos analizando dichos genes para poder construir, en un futuro, una herramienta predictiva de la isoforma predominante en cada muestra. La meta final de esta segunda parte, consiste en universalizar y hacer posible la determinación de la isoforma predominante en hospitales de baja complejidad y recursos limitados, utilizando la inmunohistoquímica sobre muestras parafinadas de pacientes. Con los resultados de la secuenciación del RNAm de 9 pacientes catalogadas según su perfil de isoformas, realizamos un análisis de expresión génica sobre una plataforma comercial destinada a predecir riesgo de recurrencia y subtipo molecular de cáncer de mama. Los resultados de este análisis arrojaron una concordancia muy significativa entre la isoforma predominante y el perfil molecular, considerando a las muestras RPA como luminales A y a las RPB como luminales B. En línea con esto último, las pacientes RPA o luminal A tuvieron una predicción de un moderado riesgo a la recurrencia, y las pacientes RPB o luminal B, en cambio presentaron un alto riesgo. Por último analizamos aquellos factores pronósticos de uso clínico diario, como tamaño tumoral, status axilar, expresión de receptores y ki-67 entre otros, para definir un perfil clínico que acompañe al perfil de isoformas. En conjunto, la evaluación de estos parámetros nos sugiere que las pacientes con predominio de RPA se acompañan de buen pronóstico, validando el resultado del análisis de expresión génica utilizando una plataforma comercial. 9 En conclusión, los resultados de esta tesis proponen a la relación de isoformas A y B del RP como un marcador predictivo de la sensibilidad al tratamiento con antiprogestágenos, y pronóstico en carcinomas de tipo luminal. 10 Índice Agradecimientos……………………………………………………………..…………2 Publicaciones………………………………………………………………………….….4 Resumen……………………………………………………………………………………7 Índice……………………………………………………………………………………….11 Abreviaturas…………………………………………………………………………….13 Marco teórico………………………………………………………………………….15 Introduccion…………………………………………………………………………….16 1. El cáncer de mama. Generalidades clínicas y factores de riesgo. Cáncer de mama hereditario y esporádico. 2. Opciones terapéuticas para el tratamiento del cáncer de mama. 3. Clasificación del cáncer de mama. Factores pronósticos y predictivos clásicos. 4. La progesterona, su receptor y sus isoformas. 5. Genes diferencialmente regulados por las isoformas. 6. Isoformas en la clínica 7. Uso de antiprogestágenos en el tratamiento. Aplicabilidad en cáncer de mama. Hipótesis de trabajo y objetivos……………………………………………….38 Materiales y Métodos………………………………………………………………40 1. 2. 3. 4. Pacientes Técnicas Análisis estadístico Criterios Resultados……………………………………………………………………………….55 1 Análisis clínico de la población. a. Factores de Riesgo b. Enfermedad Actual 11 2 Análisis histológico de la población. a. Subtipos Histológicos b. Score pronóstico de Nottingham 3 Análisis de factores pronósticos RE, RP, HER-2 y ki-67 (IHQ). 4 Clasificación de las pacientes según su proporción de isoformas de RP (WB).correlaciones entre isoformas de RP y factores pronósticos. a. Correlación entre WB y factores pronósticos clínicos e histopatológicos b. Evolución de las isoformas en las recurrencias o metástasis 5 Análisis de la correlación existente entre la proporción de isoformas del RP y la respuesta ex vivo de carcinomas mamarios tratados con MFP. a. Métodos para evaluar respuesta ( breve explicación) b. Análisis clínico e histopatológico de pacientes evaluados. c. Correlación entre índice de ki-67 y WB: Respuesta a MFP 6 Selección y análisis de la expresión diferencial de genes regulados por una u otra isoforma. 7 Análisis gen por gen. Selección de genes candidatos y validación en nuestra población estudiada. 8 Desarrollo de un algoritmo diagnóstico predictivo de la isoforma predominante. Discusión…………………………………………………………………………….…105 Conclusiones………………………………………………………………………….111 Perspectivas futuras………………………………………………………….……113 Referencias…………………………………………………………………………….115 12 Abreviaturas ACO: Anti conceptivos orales BRCA: BReast CAncer type 1 - 2 suceptibility protein CK: Citoqueratina CM: Cáncer de mama CMTN: Cáncer de mama Triple Negativo CO: Cáncer de ovario E: Estrógenos EGF: Factor de crecimiento epidérmico H&E: Hemotoxilina y Eosina HER-2: Receptor del factor de crecimiento epidérmico de tipo 2 IA: Inhibidores de Aromatasa IARC: International Agency for Research in Cancer IF: Inmunofluorescencia IHQ: Inmunohistoquímica ILV: Invasion Linfovascular LKB1: Liver kinase B1 MA: Acetato de Megestrol MFP: Mifepristona MPA: Acetato de medroxiprogesterona NPI: Nottingham Prognostic Index Pg: Progesterona PTEN: phosphatase and tensin homolog RA: Receptor de Andrógenos 13 RE: Receptor de estrógenos RG: Receptor de glucocorticoides RP: Receptor de progesterona SNC: Sistema nervioso central SPRM: Moduladores selectivos del receptor de progesterona TAM: Tamoxifeno THR: Terapia de reemplazo hormonal TKI: Inhibidor de tirosina kinasa TP53: Tumor protein 53 TZM: Trastuzumab VEGF: Factor de crecimiento vascular y endotelial 14 Marco Teórico El cáncer de mama es la neoplasia de mayor incidencia a nivel mundial, y la de mayor mortalidad en países de bajos recursos como el nuestro. De la totalidad de los tumores diagnosticados, aproximadamente un 75% se clasifican como tumores de tipo luminal de la clasificación más comúnmente utilizada en la clínica, y eso implica la expresión de receptores hormonales (receptor de estrógenos o RE y progesterona o RP). Actualmente, la terapia para este gran grupo de tumores está exclusivamente dirigida contra el RE; y al RP se lo utiliza como un marcador secundario de la funcionalidad de RE. En nuestro laboratorio trabajamos con el RP y creemos que posee tanto un rol predictivo como pronóstico. El RP tiene dos isoformas: RPA y RPB que son estructuralmente muy semejantes, razón por la cual no es posible el desarrollo de anticuerpos específicos. Por otra parte, a nivel funcional, las isoformas presentan funciones muy diferentes. En la glándula mamaria normal las isoformas se expresan en cantidades semejantes o equimolares, pero desde muy temprano en el proceso carcinogénico, existe una desregulación de esta proporción, dando como resultado el predominio de RPA o RPB. En el laboratorio demostramos, en modelos experimentales con diferente expresión de la proporción de isoformas, que dependiendo cuál de ellas sea la predominante el tumor será susceptible de recibir terapia dirigida contra el RP (antiprogestágenos) En este trabajo nos propusimos validar la hipótesis de que los tumores con predominio de RPA son aquellos que van a responder frente al tratamiento con antiprogestágenos, y en segundo lugar, caracterizar clínica y molecularmente a este grupo de pacientes. 15 Introducción 16 El cáncer es un problema de salud mundial. En la medida en que otras causas de mortalidad son controladas y la población envejece, las enfermedades neoplásicas aparecen entre las más importantes causales de muerte y discapacidad en el mundo. El cáncer de mama (CM) es la neoplasia más diagnosticada y la primera causa de muerte en el sexo femenino a nivel mundial. Se estima que se producen alrededor de 1.7 millones de casos nuevos por año, que implican más de 521.900 muertes1. Aunque habitualmente se asume que esta patología es esencialmente un problema de las regiones industrializadas, más de la mitad de estos decesos ocurren en países de bajos o medianos ingresos2. La mortalidad por CM varía ampliamente de región en región. Para los países del continente americano oscila entre un 9,7 por 100.000, para Ecuador, y un 24,1 por 100.000 para Uruguay3. La República Argentina tiene la segunda tasa de mortalidad en el continente (21,8 por 100.000), lo que se traduce en alrededor de 5.400 muertes por año (http://www.msal.gov.ar/inc). Cáncer de mama: Generalidades clínicas y factores de riesgo El CM es considerado en la actualidad una entidad multifactorial que aparece como resultado de la interacción de diversos factores ambientales que actúan sobre individuos con grados variables de susceptibilidad. Este fenómeno se traduce epidemiológica y clínicamente en poblaciones donde los individuos pueden ser categorizados en diferentes estratos de riesgo para desarrollar la enfermedad. Una correcta caracterización de los casos a lo largo de esta línea de susceptibilidad variable, permite determinar con mayor precisión este riesgo, para luego adecuar las estrategias preventivas correspondientes. 17 Se identifican dos grandes grupos de pacientes si consideramos a los agentes causales de la enfermedad: por un lado, aquellas pacientes con carcinomas mamarios hereditarios causados por mutaciones germinales en BRCA-1 Y BRCA-24, y por el otro están aquellas pacientes con carcinomas mamarios esporádicos. Para este último grupo de pacientes, que representa un 95% del total, se han identificado algunos factores de riesgo como: 1) la historia familiar5, 2) la exposición a hormonas endógenas6 (larga vida reproductiva, baja paridad) o exógenas (terapia hormonal de reemplazo)78, 3) el sobrepeso9, 4) la ingesta moderada de alcohol10, y 5) el sedentarismo6. La modificación de estos factores requiere de un largo proceso y sus efectos tardarán en evidenciarse varias décadas, por lo tanto, los esfuerzos para lograr el control de la enfermedad, en un término más corto, deben centrarse en la detección precoz y la implementación de tratamientos pertinentes. La tasa de curación de esta enfermedad, depende principalmente del avance de la enfermedad al momento del diagnóstico (tamaño tumoral y presencia de enfermedad a distancia). La tasa de curación para los tumores menores de 2 cm supera el 80%. Asimismo, el diagnóstico de tumores más pequeños, potencialmente, permite aplicar tratamientos menos agresivos (cirugías conservadoras y tratamientos sistémicos menos tóxicos). Carcinoma mamario hereditario Comparado con los CM esporádicos, los casos familiares y hereditarios suelen presentar características clínicas de sospecha, que deben ser tomadas en cuenta como parámetro que propicie una evaluación más profunda del caso. Además de las características en relación a la patología mamaria en sí, existen otras pautas de sospecha particulares que dependen del síndrome involucrado y es necesario tenerlas en cuenta para la evaluación del riesgo de los pacientes. En la tabla i.1 se enumeran las características de los carcinomas y de los síndromes que deben ser evaluados para pensar en un componente hereditario (tomado de: Pautas para la Detección y Estudio de Casos con Alto Riesgo de Cáncer de Mama HeredoFamiliar, INC, 2015). Características generales de Cáncer de Mama hereditario CM antes de los 50 años CM bilateral o multicéntrico (sincrónico o metacrónico) CM en el hombre 18 CM en etnia de riesgo (ej.: judía askenazi, etc.) Dos o más casos de CM en familiares cercanos (1er y 2ndo) CM y otro tumor primario en el mismo individuo CM triple negativo (CMTN) antes de los 60 años específicas de síndrome (asociadas a otros tumores) Características Específicas de síndrome (asociadas a otros tumores) Familias con CM y cáncer de ovario (CO) o carcinoma de trompa o carcinoma peritoneal primario independientemente de la edad de aparición Familias con CM, cáncer de endometrio y/o carcinoma tiroideo Familias con CM y tumores pediátricos como por ej. sarcomas, leucemias y tumores del sistema nervioso central (SNC) Familias con CM y afección gastrointestinal como por ej. pólipos hamartomatosos, cáncer gástrico difuso, cáncer de colon, etc. Tabla i.1: Características clínicas de sospecha para carcinomas mamarios de tipo hereditario. *Ref. Familiares 1er grado: padres, hermanos, hijos / Familiares 2ndo grado: tíos, abuelos, nietos y sobrinos. Entre el 5-10% de los casos de CM son hereditarios y su aparición está asociada a la herencia de un algún gen mutado, deficitario en su función. Los genes más comúnmente mutados son BRCA-1 (55- 85%) o BRCA-2 (35-60%), y en menor medida de TP53 (<1%; Síndrome de Li-Fraumeni), de PTEN (<1%; enfermedad de Cowden) o de LKB1 (síndrome de Peutz-Jeghers). Los riesgos a los que están expuestos estos individuos son mayores que para el CM familiar, alcanzando valores que pueden superar el 80% a lo largo de la vida, según el síndrome y el gen involucrado. Los individuos de la familia que no heredan la mutación responsable del síndrome, presentan un riesgo similar al de la población general. Tradicionalmente, la decisión de estudiar las mutaciones en BRCA estuvo basada en “predecir” el riesgo futuro de padecer carcinoma mamario contra lateral o CO. Sin embargo, recientemente, la aparición de tratamientos novedosos como los inhibidores de PARP (polimerasa poli ADP ribosa)11 ha incrementado la búsqueda de mutaciones en estos genes de reparación siendo frecuentes sobre todo, en CMTN, representando hasta un 11% la frecuencia de mutaciones. Desde el año 2009, se recomienda el estudio de BCRA-1 en aquellas mujeres 19 en mujeres con CMTN de aparición temprana (<40 años), aún en ausencia de historia familiar de CM o CO 12,13 . Carcinoma mamario esporádico Los CM de tipo esporádico representan la gran mayoría de los casos, para los cuales se conocen múltiples factores de riesgo (resumidos en la tabla i.2). Factores Reproductivos EDAD DE LA PRIMERA MENSTRUACIÓN (temprana): Antes de los 12 años. EDAD DE LA MENOPAUSIA (tardía): Después de los 55 años. La menarca precoz, antes de los 12 años de edad, se asocia a un leve aumento del riesgo relativo de CM. La menopausia tardía, después de los 55 años de edad, tiene un riesgo relativo igual a 2 con relación a mujeres con edad de menopausia antes de los 45 años. Resumiendo, las mujeres que tienen 40 o más años de actividad menstrual tienen el doble de riesgo de desarrollar CM que aquellas con 30 o menos años de ciclos menstruales, lo que indica que el tiempo de exposición de la mama a esteroides ováricos influye en el riesgo de cáncer 14–16. EDAD AL PRIMER PARTO Las mujeres nulíparas presentan mayor riesgo que las que han tenido al menos un parto. El aumento de riesgo con la edad creciente al primer parto (mayor a 35 años), es aplicable a las mujeres sin antecedentes familiares. El efecto protector del embarazo temprano se podría explicar por la diferenciación del epitelio mamario 17,18 . LACTANCIA Se reduce en un 4% el riesgo de padecer CM, por cada 12 meses de lactancia. Una posible explicación a esta reducción de riesgo es atribuida a la amenorrea de lactancia con la consecuente disminución del número de ciclos menstruales y con ello la disminución de la exposición de la mama a los esteroides ováricos19. Factores Hormonales Exógenos ANTICONCEPTIVOS ORALES (ACO) Con respecto al uso de ACO, hubo un gran estudio colaborativo en 199620, con más de 53.000 mujeres donde se mostró un pequeño pero significativo aumento del riesgo de CM. La International Agency for Research in Cancer (IARC) retoma la evaluación del riesgo de las 20 usuarias a ACO en 2007, concluyendo que las formulaciones combinadas incrementan en riesgo con una significancia borderline7. Ambos trabajos postulan que el riesgo es constante y mantenido e independiente del tiempo de uso de la píldora, de otros factores de riesgo para CM y del tipo de formulación anticonceptiva, y que al suspender la píldora, el riesgo de CM desciende paulatinamente. Sólo 10 años después de la discontinuación, el riesgo se iguala al de las mujeres que nunca emplearon el método. Sin embargo, un estudio multicéntrico posterior de más de 1.000 mujeres confirma los resultados del estudio de Oxford pero sólo para las formulaciones anticonceptivas empleadas hasta el año 1975. Con las formulaciones actuales no se aprecia aumento del riesgo de CM, ni siquiera para las portadoras de mutaciones BRCA-1 y 221,22. TERAPIA DE REEMPLAZO HORMONAL (TRH) La combinación de estrógenos conjugados con acetato de medroxiprogesterona (MPA) produjo un aumento del riesgo de cáncer de mama de 26% que resultó estadísticamente significativo 23,24 (Ver: rol de los progestágenos en CM). Factores Dietarios y de Estilo de vida SOBREPESO Y OBESIDAD Clásicamente se ha descrito que la obesidad en mujeres postmenopáusicas aumenta el riesgo de CM debido a que aumenta la aromatización de andrógenos, lo que conlleva a un aumento de los estrógenos endógenos. Cabe aclarar que la conversión extraglandular de esteroides a estrógenos tiene lugar primariamente en el tejido adiposo y está catalizada por el complejo enzimático aromatasa/ citocromo P45025.Existen estudios que señalan correlación entre aumento del consumo de grasas en la dieta con aumento de la incidencia de cáncer de mama9,22. ALCOHOL La reducción del consumo de alcohol en las mujeres con una ingesta elevada (3 o más tragos por día) reduce el riesgo posterior de desarrollar CM6 10. ACTIVIDAD FÍSICA El ejercicio físico recreativo regular reduce el riesgo de CM, especialmente en la posmenopausia. Esto es debido a que evita el aumento de peso y por consiguiente la disminución en los niveles de estrógenos26. TABAQUISMO 21 Con respecto al consumo de tabaco, hay evidencia consistente de que el riesgo se incrementa de forma moderada, más aún, la exposición pasiva al humo del tabaco también incrementa el riesgo 27 Factores Relacionados con Procedimientos Médicos ALTA DENSIDAD MAMOGRÁFICA ALTA DENSIDAD MINERAL ÓSEA RADIACIÓN TORÁCICA DE ALTA DOSIS El antecedente de irradiación terapéutica del tórax (por ejemplo, en enfermedad de Hodgkin), especialmente si ocurrió en la adolescencia, aumenta marcadamente el riesgo de desarrollar cáncer de mama en el futuro. BIOPSIAS PREVIAS DE MAMA28 Con diagnóstico de lesiones benignas, y aún más con diagnóstico de hiperplasia atípica (HDA) y carcinoma lobulillar in situ (CLIS)29 30 . Estas dos lesiones comprenden a un espectro de proliferaciones del epitelio mamario, tanto en el ducto como en el lobulillo, que aún no han adquirido características de invasividad del tejido adyacente. Tabla i.2: Características clínicas de sospecha para carcinomas mamarios de tipo esporádico. Opciones terapéuticas para el tratamiento del CM (http://www.cancer.gov/espanol/pdq/tratamiento). Hay diferentes tratamientos disponibles para las pacientes de CM. Se utilizan 5 tipos de tratamiento estándar: 1. Cirugía La mayoría de las pacientes con CM se someten a cirugía a fin de extirpar la masa tumoral visible, siendo siempre esta opción la primera elección y la que ofrece mayores posibilidades de curación. Dichas posibilidades se encuentra directamente asociadas al estadio clínico en el que se encuentra la paciente al momento del diagnóstico. La tendencia quirúrgica actual abarca procedimientos quirúrgicos “conservadores”, donde se conserva la mama. Sin embargo, en los casos donde no es posible la conservación de la 22 misma, se realizan cirugías radicales, que incluyen en ocasiones al músculo pectoral y a otros músculos de la pared torácica. Es importante tener en cuenta que se puede administrar quimioterapia antes de la cirugía. El tratamiento administrado antes de la cirugía se llama terapia neoadyuvante y tiene como objetivo reducir el tamaño del tumor y la cantidad de tejido que es necesario extirpar durante la cirugía. Incluso si el médico extirpa todo el tumor visible en el momento de la cirugía, algunas pacientes pueden recibir radioterapia, quimioterapia o terapia con hormonas después de la cirugía para destruir cualquier célula neoplásica remanente. El tratamiento administrado después de la cirugía para disminuir el riesgo de recidiva se denomina terapia adyuvante. 2. Radioterapia La radioterapia es un tratamiento basado en rayos X de alta energía u otros tipos de radiación para destruir células neoplásicas malignas remanentes. Hay dos tipos de radioterapia: externa o interna. La forma en que se administra la radioterapia depende del tipo y el estadio del cáncer que se está tratando. 3. Quimioterapia La quimioterapia es un tratamiento donde se utilizan drogas para interrumpir el crecimiento de las células tumorales. Hay dos tipos de quimioterapia: aquella que se administra en forma sistémica y se distribuye en el torrente sanguíneo, y la quimioterapia local, donde la droga es administrada directamente en la cavidad u órgano afectado. 4. Terapia endocrina del CM La terapia endocrina para el CM incluye a una gran variedad de drogas que bloquean y/o modulan diferentes tipos de hormonas. La glándula mamaria es un tejido que expresa en condiciones normales, receptores de estrógenos (RE), de progesterona (RP)31, de andrógenos (RA)32 33y de glucocorticoides (RG). En diferentes proporciones, todas estas hormonas están implicadas de alguna manera en los procesos funcionales y evolutivos de la mama, y cuando sufren desregulación, también tienen un rol en el proceso carcinogénico. En el caso de los glucocorticoides, por medio de su receptor regulan la respuesta inflamatoria e inmunitaria, así como también la proliferación y la apoptosis 34. 23 Terapias hormonales dirigidas contra los estrógenos De las opciones terapéuticas disponibles en la clínica, aquellas dirigidas contra los estrógenos son las más comúnmente utilizadas. En líneas generales hay dos estrategias posibles, por un lado, modular o bloquear al receptor de dicha hormona; y por otro, bloquear su producción endógena. Para ello se utilizan inhibidores de la aromatasa, (IA) inhibiendo a la enzima cuya función es la de aromatizar los andrógenos, convirtiendo la testosterona en estrógenos. Con respecto al RE, cabe destacar que existen dos isoformas, REα y REβ, las cuales se expresan a partir de distintos genes ubicados en los cromosomas 6 y 14 respectivamente. Su expresión es tejido específica y una vez que se unen al ADN en secuencias denominadas elementos de respuestas a estrógenos (ERE), activan la transcripción de sus genes blanco35. Es bien conocida la función de REα en la progresión tumoral, y las estrategias de bloqueo están dirigidas a bloquear esta isoforma. Se dispone de dos clases de drogas: los moduladores selectivos del RE (SERMs) como el Tamoxifeno (TAM) y el Raloxifeno, y los antiestrógenos puros como el Fulvestrant. Con respecto a los IA, contamos con tres drogas: Anastrazol, Letrozol y Exemestano. Estos agentes se utilizan en varios escenarios clínicos, abarcando desde la quimioprevención hasta la adyuvancia en enfermedad temprana y metastásica36. 5. Terapia dirigida La terapia dirigida37 es un tipo de tratamiento que identifica y ataca células tumorales específicas sin dañar las células normales. Basados en características moleculares específicas del CM, como lo son por ejemplo, las mutaciones en BRCA-1/ BRCA-2, la sobreexpresión del factor de crecimiento epidérmico de tipo 2 (HER-2) y la activación de factores de crecimiento vascular/ epitelial (VEGF- EGFR) se han desarrollado variedad de agentes específicos para mejorar y aumentar la eficacia terapéutica. Dentro de la variedad de terapias dirigidas en CM, fuera del tratamiento contra los estrógenos, la primera droga en ser aprobada fue el Trastuzumab (TMZ) en 1998 38. Esta droga es un anticuerpo monoclonal que está dirigido contra el HER-2, y actualmente se la ha combinado con emtansina (un potente quimioterápico disruptor de microtúbulos) con el objetivo de guiar a la droga quimioterápica a su sitio específico de acción39. Existe otro abordaje que inhibe la dimerización del HER-2, y de esta manera previene la señalización 24 mediada por esta molécula; esta droga también es un anticuerpo monoclonal y se denomina Pertuzumab40. Por otro lado, existen abordajes terapéuticos que combinan la inhibición del HER-1 y HER2. Estas drogas tienen como mecanismo de acción inhibir el dominio activo de las tirosina quinasas (TK) de estos receptores y de esta manera evitar la fosforilación y consecuente activación de la vía. El único inhibidor de TK (TKI) aprobado actualmente es el Lapatinib41. Otro agente recientemente aprobado es el Everolimus, un inhibidor de m-TOR, efector de una vía de señalización implicada en proliferación, migración e invasión. Esta droga se usa en combinación con IA, y ha mostrado mejoras en la progresión libre de enfermedad y en la sobrevida total42. Otros agentes en vías de aprobación incluyen inhibidores de PARP (poli- ADP-ribosa) para pacientes BRCA-1/BRCA-2, inhibidores de HDAC (histona deacetilasa) o inhibidores de ciclinas dependientes de quinasa (CDK), entre otros43. Todas estas drogas han mejorado notablemente la sobrevida de la gran mayoría de las pacientes que padecen esta enfermedad, sin embargo, tienen dos mayores problemas: por un lado su altísimo costo y por el otro, la falta de biomarcadores que seleccionen a las pacientes que serán beneficiadas con cada una de estas estrategias44. Clasificación del CM. Factores pronósticos y predictivos clásicos Se han realizado considerables avances en lo que se refiere a alteraciones moleculares que contribuyen al desarrollo del CM. Sin embargo, excepto por la evaluación del RE, RP y HER-2, muy poco de esta información tiene significado real en términos de manejo clínico. Todo el resto de la información clínicamente relevante se obtiene a través de un examen histopatológico cuidadoso. Los factores pronósticos recomendados por la CAP (College of American Pathologists) para los reportes de anatomía patológica, y requeridos por los cirujanos incluyen: 1) tamaño tumoral, 2) estado de los ganglios axilares, 3) tipo y grado histológico (índice pronóstico de Nottingham; NPI), 4) estado de los receptores hormonales, 5) compromiso de piel y pared torácica, y 6) invasión linfovascular45. 1) Tamaño tumoral (TT): el TT está casi proporcionalmente relacionado con la probabilidad de tener metástasis ganglionar y es un factor pronóstico independiente y 25 considerado de los más importantes. A este respecto, la AJCC (American Joint Committee on Cancer) indica que el tamaño patológico debe ser cuidadosamente medido y solamente se considera al componente invasivo de los tumores. Existen algunas situaciones particularmente importantes al momento de informar el TT: Focos de microinvasión: se denomina microinvasión a la presencia de células tumorales por debajo de la membrana basal, con focos no mayores a 0,1 cm. Varios estudios han mostrado que las lesiones in situ y estas lesiones microinvasoras poseen la misma implicancia pronostica. Tumores pequeños (T1a y T1b): existe una especial dificultad relacionada con los tumores pequeños por varias razones, entre las que se encuentran sobre todo el muestreo subóptimo. 2) Estado de los ganglios axilares: es el factor pronóstico independiente más importante para los pacientes con esta enfermedad. Tanto la sobrevida total (OS: del inglés overall survival) como el tiempo a la recurrencia (ROR: del inglés risk of recurrence) disminuyen proporcionalmente al número de ganglios positivos 46. 3) Tipo y grado histológico: el grado histológico se correlaciona con la supervivencia independientemente del estado de los ganglios axilares o del tamaño tumoral 47 . El sistema de gradación más utilizado es la versión modificada de Scarff- BloomRichardson realizada por Nottingham (NPI), que utiliza un score del 1 al 3, teniendo en cuenta la formación de túbulos, pleomorfismo nuclear e índice mitótico. Dada la información pronóstica que proporciona el NPI, ha sido incorporada en varios algoritmos (como por ejemplo Adyuvant Online)48 y guías como St. Gallen49 para determinar el uso de quimioterapia. Este índice no tiene costos extra y agrega importante información sobre el comportamiento biológico intrínseco del tumor 50. En cuanto a los subtipos histológicos, sabemos que el 80% de los tumores se clasifican en ductales y lobulillares, y en ambos casos se aplica esta gradación. Por otro lado, algunos subtipos como el tubular, el mucinoso, el adenoide quístico y el cribiforme invasor son clásicamente de buen pronóstico. 4) El estado de los receptores hormonales (REyRP representan tanto un factor pronóstico del outcome clínico (sobrevida total y tiempo libre de recurrencia), como predictivo de la respuesta a una terapia específica (dirigida contra los estrógenos). Está ampliamente demostrado que el método de inmunohistoquímica (IHQ) es el más confiable para realizar la detección, y el punto de corte para avalar el tratamiento antiestrogénico es el 1% 49,51 . En el caso del RP, su rol aún no está enteramente explorado, por ahora los datos bibliográficos apuntan a proponerlo como una 26 marcador secundario de respuesta al tratamiento antiestrogénico52.Los tumores que expresan ambos receptores (REyRPtienen mejor pronóstico que aquellos que sólo expresan RESin embargo, está bien documentado que existe variación en la respuesta de los pacientes al tratamiento, a pesar de que expresen similares niveles de receptores hormonales54,55. Por otro lado, la expresión de RP tiene valor pronóstico per se, pero no tendría un valor predictivo frente a la elección del tratamiento con TAM o con inhibidores de la aromatasa56. 5) Compromiso de piel y pared torácica: en estos casos el sólo compromiso de la pared torácica o la piel conllevan a un estadio pT4b que confiere un muy mal pronóstico sin importar el tamaño del tumor primario o el estado de la axila. La presentación clínica de dicho compromiso es fácilmente evidente y se traduce en alteraciones locales como la piel de naranja o la retracción del pezón, y estos hallazgos se generan por una invasión directa del carcinoma sobre la dermis o una masiva invasión de los linfáticos dérmicos. Es importante destacar que el carcinoma inflamatorio (clasificado como pT4b) requiere tanto la presentación clínica antes mencionada como la documentación histológica del mismo. 6) Invasión linfo-vascular (ILV): Cuando se identifican embolias tumorales, las mismas se ubican dentro de “canales vasculares” de paredes muy finas; si estas estructuras son linfáticos, capilares o vénulas no puede ser determinado y parece no tener importancia pronóstica. Este es el motivo por el cual se denomina en conjunto como invasión linfovascular. Hay muchos estudios donde se documenta y correlaciona la presencia de ILV extratumoral con compromiso de ganglios linfáticos, indicando un peor pronóstico para pacientes con axila negativa al momento del diagnóstico inicial 57 58 . El diagnóstico de ILV debe ser cautelosamente analizado siempre por fuera del área tumoral invasiva, ya que los artefactos de retracción suelen generar falsos positivos. Por otro lado, los estudios de IHQ realizados para poner de manifiesto células endoteliales suele resultar tanto en falsos positivos como negativos 57. Clasificación del CM Tradicionalmente la clasificación utilizada para las lesiones de mama es aquella realizada por la Organización Mundial de la Salud (OMS) sobre las características histopatológicas de las lesiones. La última actualización fue realizada en el año 2012, y a pesar de los avances realizados sobre la biología de la enfermedad aún no se logra un consenso en la clasificación molecular del CM. Esta clasificación se focaliza en la morfología clásica de los tumores a la luz del microscopio óptico, e incorpora datos moleculares y genéticos que ayudan 27 a la estratificación de las lesiones. Sin embargo, en la actualidad se ha incorporado lo que llamamos “clasificación molecular” del CM. La misma fue descripta por Perou y Sorlie en el año 2000, a partir de microarrays de DNA de 65 especímenes de carcinomas mamarios 59 60 61. Esta forma de clasificación basada en patrones de expresión génica, no solamente agrupó tumores con características similares sino que también aportó valiosa información de la biología tumoral. Como por ejemplo, la variación en las tasas de proliferación y en vías de señalización específicas. Originalmente la clasificación se basó en la expresión de citoqueratinas (CK) de expresión luminal (CK8, 18, 19 y cadherina-P) o de expresión basal mioepitelial (CK5, 6, 14 y 17, además de cadherina-E). En la práctica estas CK tienen una gran concordancia con la expresión de receptores hormonales, aquellos clínicamente catalogados como RE+ se caracterizaron por contener un alto porcentaje de genes expresados en células epiteliales de tipo luminal. Estos resultados fueron validados utilizando IHQ para CK luminales 8-18 62. Otro gran grupo de tumores se agrupó bajo la denominación de basal-like por expresar genes relacionados a CK basales (CK 5/6) y ser RE (-); y un tercer grupo, en general también RE (-), se lo identificó por la sobre-expresión del HER-2. El cluster de genes más notorio que diferencia los grupos es el correspondiente a proliferación, y obviamente incluye genes como Ki-67 y PCNA. A partir del trabajo de Perou y col, la expresión de receptores hormonales, podemos agrupar a los tumores en tres grandes grupos con muy diferentes implicancias pronósticas y de tratamiento: los tumores LUMINALES (RERP, los BASALES [REHER-2 (-)]y los HER-2 59. A continuación, se generaron múltiples plataformas genéticas orientadas a predecir el pronóstico de las pacientes, y con el objetivo específico de ayudar en la decisión terapéutica adyuvante. De la variedad de plataformas disponibles, las más utilizadas son: 1) el MammaPrint Score, utiliza RNAm de 70 genes y estratifica a las pacientes en bajo o alto riesgo de recurrencia; 2) Oncotype dx Assay, es la plataforma más ampliamente utilizada, en este caso se basa en 16 genes relacionados al cáncer y 5 genes housekeeping y estratifica a las pacientes en tres grupos de riesgo; y por último 3) PAM50/risk of recurrence, que utiliza similares tecnologías y genes pero incorpora, además del riesgo de recurrencia, al subtipo molecular del CM 63. 28 La progesterona, su receptor y sus isoformas. La progesterona (Pg) es una hormona esteroidea sintetizada a partir de colesterol, que tiene importantes funciones en la fisiología sexual y reproductiva de las mujeres, jugando un rol central en órganos como útero, ovarios, glándula mamaria y sistema nervioso central. Se conocen múltiples vías de señalización celular reguladas por Pg64. Todas estas funciones son bien conocidas y nos dan una idea de la importancia de esta hormona y su complejidad de funciones 65 . Dependiendo de la etapa reproductiva en la que se encuentra la mujer, las terapias que contienen progestágenos se utilizan, ya sea en la formulación de ACO (edad fértil) o en la TRH combinada (postmenopausia). A su vez, son agentes que se utilizan frecuentemente para patologías ginecológicas de muy frecuente presentación como: síndrome premenstrual, irregularidades menstruales por alteraciones en la ovulación o por anovulación; mastopatías benignas, mastodinias y esterilidad de causa hormonal 6667. Si nos focalizamos en las acciones de la Pg en la fisiología de la glándula mamaria, sabemos que regula la expansión del componente epitelial durante el ciclo menstrual 68, y es la hormona responsable del edema estromal y la vacuolización presente en las células mioepiteliales durante la fase lútea 69. Durante el embarazo, se incrementa y se prolonga aún más este efecto, y hacia el final del mismo, la caída abrupta en los niveles de esta hormona facilita el parto y permite la lactancia 70. Rol de los progestágenos en el cáncer de mama El CM se origina en el epitelio ductal, y dicho epitelio es dependiente de la función de las hormonas ováricas, estrógenos (E) y Pg, para su completo desarrollo. Es bien conocido, por un lado, el rol protector de una corta vida reproductiva (menos ciclos endógenos de E y Pg) 71, y por otro, que las mujeres ooforectomizadas tienen un riesgo reducido de padecer esta enfermedad72 (ver Factores de riesgo). De hecho, la manipulación endocrina para inhibir a los E es la primera elección de tratamiento para mujeres con tumores RE+54. Con respecto a la Pg o a sus análogos sintéticos, la bibliografía no es concluyente con respecto a si posee un rol pro o anti proliferativo. Por un lado, durante la década del 70, se introdujo el uso de altas dosis de progestágenos sintéticos, como el MPA en el tratamiento del CM metastásico, observando remisiones objetivas de hasta un 30% de la masa tumoral total 73. En la actualidad, existen evidencias, por ejemplo, de que la administración de una inyección de Pg antes de la cirugía para CM, puede proporcionar beneficio clínico74.Más aún, en 2014, 29 concluyó un estudio de fase II donde se trataron pacientes postmenopaúsicas con CM con un progestágeno sintético (Acetato de Megestrol o MA). Estas pacientes, en su evolución, habían progresado a los IA no esteroideos (NSAI).En este estudio, los autores demostraron que el MA podría ser un tratamiento razonable, en cuanto a costo y efectividad75. Por último, es interesante destacar el uso de altas dosis de MPA en los tumores sin expresión de receptores hormonales, haciendo uso de sus acciones sobre el RG y el RA. Contrariamente a estos trabajos donde se propone el uso de progestágenos en el tratamiento del CM, hubo dos grandes estudios clínicos casi en simultáneo (Women´s Health Iniatiative; WHI y Million Women Study; MWS) donde se evidenció la asociación positiva entre el uso de progestágenos, en el contexto de la TRH y el incremento del riesgo de padecer CM. El WHI (en Estados Unidos) fue diseñado como un ensayo de prevención primaria de los eventos cardiovasculares asociados a TRH. Entre 1993 y 1998 se reclutaron 16.600 mujeres postmenopáusicas de entre 50 y 79 años, a las cuales se planeó hacerles seguimiento clínico durante 8.5 años. Sin embargo, luego de 5.2 años de seguimiento se decidió interrumpir el ensayo porque las pacientes que recibían TRH combinada (E y MPA) habían superado ampliamente los límites permitidos de aparición de CM23. El MWS (en Reino Unido) reclutó 1.000.000 de pacientes entre 1996 y 2001, de entre 50 y 64 años. La mitad de estas pacientes era usuaria de TRH y la otra mitad recibía placebo. El estudio fue diseñado para evaluar los efectos de este tipo de terapia sobre el riesgo de cáncer y resultó que al igual que el WHI, éste incrementa de forma significativa en usuarias de TRH combinada comparada contra placebo o contra formulaciones únicamente basadas en E. El Reino Unido estima que en la última década hubo unos 20.000 CM por sobre lo estimado, 15.000 de ellos asociados al uso de TRH combinada24. Receptor de Progesterona Al igual que los E, la Pg ejerce sus efectos mediante receptores nucleares específicos, que se expresan exclusivamente en una proporción de entre 20 y 40% en las células luminales de la mama76. Existe evidencia, además, que sugiere que aquellas células con receptores positivos no son las que proliferan directamente a la señalización hormonal, sino que ejercen una influencia paracrina en las restantes células que no poseen dicho receptor77. Actualmente, la presencia del RP en las muestras de pacientes con CM, se utiliza para predecir la funcionalidad de los RE y, por lo tanto, predecir la respuesta a la terapia endocrina78. 30 El RP se encuentra constituido por dos isoformas, la A y la B (RPA y RPB) las cuales se expresan a partir de un único gen pero con distintos promotores79. La RPA pesa 94 kDa y está incluida dentro de RPB, que tiene un peso molecular de 115-120 kDa en humanos. Las dos isoformas son idénticas excepto que RPA carece de 164 aminoacidos presentes en el extremo N- terminal de RPB. Esta región única que posee RPB contiene un dominio de activación trascripcional llamado AF-380 (figura i1). Cuando se analiza la actividad trascripcional de ambas isoformas individualmente, se observa que RPA es casi siempre dominante inhibitoria sobre la actividad de PRB. Sin embargo, esta situación no es fisiológica, ya que siempre ambas isoformas están siempre presentes, tanto en condiciones normales como tumorales 81 . Por otro lado, RPA puede regular además de a RPB, a otros receptores nucleares tales como receptores de mineralocorticoides, RG, RA y RE 828384. 1 165 DBD H LBD DBD H LBD 933 933 RPB RPA Figura i1: Esquema ilustrando las isoformas de RP. LBD o sitio de unión del ligando (del inglés, ligand binding domain), DBD o sitio de unión al DNA (del Inglés DNA binding domain), H o bisagra (del inglés hinge). Se puede apreciar el mayor tamaño de la isoforma B con respecto a la A constituido por el segmento BUS. En condiciones normales RPA y RPB se expresan en los mismos tipos celulares y en idéntica proporción, siendo su relación cercana a uno 81 . Sin embargo, en algunas circunstancias y tipos celulares predomina una isoforma sobre la otra. Un ejemplo de esta situación, es el estroma uterino donde predomina la isoforma A 85. 31 El desbalance en la proporción de isoformas y su relación con la progresión tumoral Se han encontrado variaciones en la proporción de isoformas en múltiples situaciones que preceden a la aparición de cáncer: por ejemplo, del análisis de tejido mamario normal de mujeres portadoras de mutaciones en los genes BCRA (conocida por conllevar un incremento del 30% del riesgo de padecer la enfermedad) se ha encontrado que la RPB casi desaparece8687. Otro ejemplo son las lesiones pre-malignas, como la hiperplasia ductal atípica, donde también se altera esta proporción 86 . Lo que sí está claro es que el desbalance en la proporción de isoformas es un evento temprano en la carcinogénesis 81. Los carcinomas mamarios invasores presentan una variedad de proporciones de isoformas de RP. En la gran mayoría de los casos, los tumores continúan expresando ambas isoformas con predominio de la RPA con mayor frecuencia. El primer reporte de la distribución de isoformas en los tumores lo realizó el grupo de Christine Clarke en 1995 65 , y en los sucesivos trabajos de diferentes grupos los resultados fueron similares77 87 89. Con respecto a la razón por la cual se genera este desbalance, aún no está claro, pero uno de los mecanismos involucrados podría ser el silenciamiento por metilación del promotor de RPA90 88. Genes diferencialmente regulados por las isoformas Es bien conocido que cada una de las isoformas del RP regula un set diferente de genes. Existen aproximaciones experimentales en diferentes modelos de CM de donde obtuvimos una primera selección de genes que serán analizados en la tesis. El primer trabajo fue publicado por el grupo de Horwitz de la Universidad de Colorado sobre microarrays de expresión génica de células T47D-Y (clon de células T47D sin expresión de RP) transfectadas con una u otra isoforma de RP (T47D-YA y T47D-YB). Observaron que, de un total de 94 genes regulados por Pg, 65 estaban regulados exclusivamente por la RPB, 4 estaban regulados por RPA y 25 estaban regulados por ambas 91 . En cuanto a las funciones de estos genes diferenciales, se encuentran varios con funciones relacionadas a adhesión celular (HEF-1, ITGA2, por ejemplo), ciclo celular y apoptosis (BCL- XL/S, NDRG1), factores de transcripción (STAT5a, C/EBP), entre otros. Otro trabajo posterior analiza la expresión diferencial de genes en un modelo donde ambas isoformas están presentes, a diferencia del abordaje anteriormente citado. Los autores observan que solo un porcentaje reducido de estos genes (n=18) fueron regulados de forma diferencial en células con ambas isoformas presentes 92. 32 Es interesante destacar que el balance de las isoformas no sólo es esencial en la glándula mamaria. Por ejemplo, hay un trabajo publicado en un modelo de células epiteliales uterinas que asocia la diferente proporción de isoformas con una expresión diferencial de MUC-1 93, sugiriendo que esta proteína podría ser un biomarcador a tener en cuenta. Isoformas en la clínica Hay en la bibliografía 6 trabajos publicados donde se estudian las isoformas del RP en pacientes y su relación con parámetros clínicos. El método para determinar del perfil de isoformas, y los puntos de corte para categorizar a las pacientes difiere en todos estos trabajos, y las conclusiones que se desprenden de los mismos son dispares. Sin embargo, toda la evidencia experimental y clínica, sugiere que el perfil de isoformas del RP podría tener implicancia en la decisión terapéutica (rol predictivo) además de un valioso rol pronóstico. Los primeros análisis en pacientes fueron realizados por el grupo de Clarke y col.65 donde se testearon 202 muestras de pacientes PR+. Las conclusiones de este trabajo fueron meramente descriptivas: encontraron que la mayoría de las pacientes presentan una proporción similar de ambas isoformas, y que de las restantes, un gran número de pacientes tiene disminuida la RPB resultando en un incremento proporcional de la RPA. En un siguiente trabajo realizado por un grupo alemán años más tarde 89, se analizaron las isoformas y su correlación con parámetros clínicos y patológicos. Al igual que en el trabajo de Clarke mencionado anteriormente, encontraron un claro predominio de pacientes con más isoforma A que B. Con respecto a los parámetros clínicos, no hubo correlaciones destacables, si bien hallaron una asociación positiva entre un mayor grado de agresividad tumoral y la RPA. Es importante destacar que el número de pacientes utilizados en este estudio fue muy escaso (n=53). Otro trabajo posterior, analizó las isoformas con RT-PCR, ya que se codifican de diferentes RNAm94. La expresión de ambas isoformas fue detectada en los 6 carcinomas invasores evaluados. En este trabajo también se buscaron correlaciones con parámetros clínicos, aunque todas ellas fueron negativas. En nuestra experiencia, resultados preliminares realizados sobre 50 muestras pareadas (RNAm y WB), no mostraron correlación entre los niveles de RNAm y proteína para RPA o RPB (Resultado del Dr. Gonzalo Sequeira -no publicado- (figura i2). 33 Relación WB/qPCR WB RATIO 5 4 3 2 1 0 0 10 20 30 PCRq Figura i2: Representación gráfica de tipo “DotPlot” relacionando en cada muestra (n=50) la proporción de isoformas de RP por WB (eje X) y por qPCR (eje Y). El análisis estadístico arroja un p= 0.62, lo que nos indica falta de correlación entre ambas técnicas. Resultado no publicado (Dr. Gonzalo Sequeira). En 2004 el grupo de Horwitz y Fuqua analizó por primera vez, la relación entre la proporción de isoformas y la respuesta a terapia endocrina con TAM. En este trabajo se estudiaron 297 pacientes en estadio II (ganglio axilar positivo) y encontraron que las pacientes con predominio de expresión de la isoforma A tenían dos veces mayor probabilidad de recaer durante su tratamiento con TAM78, sugiriendo que esta isoforma sería marcadora de mal pronóstico. Otro grupo, en un trabajo posterior, sobre 500 pacientes tratadas con TAM vs. 500 pacientes sin tratamiento sistémico (sólo sometidas a cirugía) , observó que la metilación de RPA, o sea su silenciamiento, se correlaciona con un peor pronóstico 88, resultado contrario a lo postulado por Horwitz en 2004. El trabajo publicado recientemente por el grupo de Clarke y col.95analiza la expresión de las isoformas por inmunofluorescencia (IF) en muestras de tejidos incluidos en parafina, obtenidas en su mayoría del estudio TransATAC (The translational arm of the Arimidex, Tamoxifen Alone or in Combination). Los autores concluyen, en este caso, que las isoformas 34 tienen un rol predictivo de la respuesta al tratamiento antiestrogénico de elección. Sostienen que la RPA predice una pobre respuesta al tratamiento con TAM95. Queda claro de lo expuesto anteriormente que los resultados clínicos son muy dispares, así como también lo son las maneras de determinar el perfil de isoformas en cada paciente. En ciertos casos los valores surgen del WB, en otros del RNAm y en este último estudio publicado en 2015, la determinación de las isoformas es por IF. Los puntos de corte para categorizar a las pacientes y las posibles maneras de determinar la proporción de isoformas serán discutidos más adelante. Uso clínico de los antiprogestágenos Tipos de antiprogestágenos Hay tres tipos de antagonistas esteroideos, y todos ellos compiten por el sitio ligando específico. Los antagonistas de tipo I previenen la unión al DNA e inhiben la fosforilación de RP (un ejemplo es la Onapristona). Los de tipo II, como la mifepristona (MFP, RU-486) promueven la unión al DNA y promueven la fosforilación de RP pudiendo actuar como agonistas progestacionales en determinadas condiciones. Los de tipo III promueven la unión al DNA, reclutan correpresores e inducen la fosforilación de RP, un ejemplo de este tipo de antagonista es el Lonaprisan96. En conjunto todos estos agentes se denominan “moduladores selectivos del RP” o SPRMs. 35 Figura i3: Mecanismos de acción de la Pg y SPRMs, tomada de: Los moduladores selectivos de los receptores de la progesterona en la medicina de la reproducción: farmacología, eficacia clínica y seguridad, PhillipeBouchard97. Uso de antiprogestágenos en enfermedades no neoplásicas En Estados Unidos hace 15 años se aprobó el uso de MFP como agente abortivo en forma conjunta con Misoprostol66 y hace 3 años para el tratamiento del síndrome de Cushing98. MFP muestra una alta afinidad por el RP y por el RG99, es por este motivo que se usa para esta enfermedad con altos niveles de glucocorticoides circulantes. Las dosis en este caso son superiores a 300 mg diarios y se administran por vía oral sin mostrar efectos tóxicos adicionales a los inducidos por su efecto endócrino100. Además de estas indicaciones se conoce la actividad inhibitoria de los SPRMs sobre la proliferación endometrial y el crecimiento de leiomiomas, por este motivo se utilizan como herramienta para el tratamiento de la endometriosis y miomas uterinos101. Uso de antiprogestágenos en cáncer de mama Nuestra evidencia experimental Nuestro Laboratorio se ha focalizado en los últimos años en estudiar el papel jerárquico de los RP en el desarrollo del CM, basado principalmente en observaciones realizadas en un modelo experimental murino de carcinomas mamarios inducidos por la administración continua de MPA. Este modelo tumoral se asemeja en muchos aspectos a la mayoría de las neoplasias mamarias que se desarrollan en humanos: son de histología ductal, expresan altos niveles de REα y RP, y poseen capacidad metastásica102. En este modelo hemos demostrado que, tanto el bloqueo de la expresión génica del 103 RP , así como su inhibición farmacológica usando diferentes inhibidores, pueden inducir la regresión tumoral 104. Observamos que las variantes tumorales, con resistencia adquirida y con resistencia constitutiva a la MFP, expresan mayor nivel de RPB que de RPA a diferencia de sus variantes respondedoras, que muestran el patrón opuesto 105 . Por otra parte, ya se había demostrado anteriormente que la MFP puede actuar como agonista de la progesterona al 36 activar a RPB y resultados de nuestro laboratorio muestran que la MFP no es inhibitoria en células con mayor proporción de RPB que RPA80. Recientemente el grupo de Tellería y col. postuló que la MFP sería un tratamiento oncológico favorable para distintas neoplasias independientemente de la expresión de RP106. Contrario a esta postura, nuestro laboratorio sostiene que es importante determinar el perfil de isoformas de RP para asegurar una respuesta inhibitoria de los antiprogestágenos. El patrón de expresión de RPA/RPB sería un marcador predictivo para elegir aquellos tumores que responderían eficientemente a esta terapia. Evidencia clínica Hasta el año 2000, fueron 5 los estudios en pacientes con cáncer de mama metastásico (avanzado) donde utilizaron la MFP u Onapristona. En un principio, las pacientes reclutadas podían o no tener expresión del RP, en trabajos posteriores el único criterio de selección fue la presencia de RP (+). En 3 de ellos las drogas fueron utilizadas en segunda o tercera línea, y en dos se aplicaron como drogas de primera línea. En todos los estudios se observaron respuestas parciales que variaron entre un 10 y 56%, pero sobretodo se observó una estabilización de la enfermedad. El estudio llevado a cabo por Robertson y col. en el año 1999, utilizando a la Onapristona como agente de primera línea, mostró una respuesta que en conjunto alcanzó al 67% de las pacientes, sin embargo, la toxicidad hepática fue la razón principal por la cual se detuvo el ensayo 107. El grupo de Robertson continúo los ensayos con Lonaprisan (antagonista del RP de tipo III) como terapia de segunda línea en mujeres con las mismas características arriba mencionadas. El objetivo primario de este último estudio no fue alcanzado ya que la droga mostró una eficacia limitada 96. Varios factores clínicos y moleculares pueden haber sido la causa de la falla en estos estudios. Por sobre todas las cosas, creemos que tanto las condiciones clínicas de las pacientes (todas ellas con enfermedad muy avanzada y múltiples sitios de metástasis) así como la inexistencia de selección de subpoblaciones sensibles al tratamiento propuesto, han sido dos de los mayores obstáculos para demostrar la eficacia de este abordaje novedoso. 37 Hipótesis de trabajo y Objetivos 38 Hipótesis de trabajo En concordancia con los estudios preclínicos, sólo aquellos carcinomas mamarios con mayor expresión de RPA que RPB, responden al tratamiento con antiprogestágenos. El patrón de expresión de RPA/RPB sería un marcador predictivo para elegir las pacientes que respondan eficientemente a la terapia con anti progestágenos. Objetivo general El objetivo general de esta tesis fue investigar si las muestras de cáncer de mama con mayor expresión de la RPA que RPB responden al tratamiento con el antiprogestágeno MFP en cultivos ex- vivo y caracterizar a las pacientes en su perfil clínico y molecular. Objetivos particulares 1. Caracterizar y conocer la cohorte de pacientes con carcinomas mamarios del Hospital de Pacheco en cuanto a sus factores de riesgo y sus características clínicas e histopatológicas. 2. Clasificar a las pacientes según su perfil de isoformas del RP en RPA, equimolares y RPB. Estudiar la correlación existente entre el perfil de isoformas y factores pronósticos clínicos e histopatológicos. 3. Estudiar la respuesta ex vivo a la MFP de carcinomas mamarios catalogados por su relación de isoformas de RP. 4. Conocer el perfil molecular de las pacientes RPA o RPB 5. Diseñar un algoritmo de expresión, basado en la técnica de IHQ, que nos permita discriminar a las pacientes RPA de las RPB 39 Materiales y Métodos 40 1. Pacientes La totalidad de este trabajo de tesis fue realizada sobre muestras humanas. Se incluyeron un total de 282 pacientes con cáncer de mama, de las cuales se obtuvieron muestras de tejido tumoral y ganglios o recurrencias en aquellos casos donde fue posible. Todos los pacientes fueron atendidos en el Servicio de Mastología del Hospital Provincial Magdalena V. de Martinez, Gral Pacheco, Tigre, entre los años 2007 y 2015. Los pacientes fueron seleccionados de acuerdo a los siguientes criterios: Criterios de inclusión: ser paciente mayor de 18 años tener confirmación histológica de cáncer de mama y presentarse en cualquier estadio de la enfermedad. Criterios de exclusión: Tumores de estirpe NO- epitelial Recolección de datos de las Historias Clínicas: Se cargaron los datos de las historias clínicas (H.C.) en un archivo de Microsoft Excell confeccionado para tal fin. Los datos de las historias clínicas incluyeron: fecha de cirugía, edad, antecedentes familiares de 1er o 2ndo grado de cáncer de mama u ovario, comorbilidades (diabetes mellitus, hipertensión arterial, úlcera, cardiopatía, alergias, traumatismos, operaciones), hábitos (tabaquismo, alcoholismo), fecha de menarca, fecha de última menstruación, paridad, edad al 1er parto, meses de lactancia, enfermedades mamarias preexistentes, cirugía mamaria previa, mamografía (bi-Rads), localización, diagnóstico histopatológico, subtipo, grado histológico, grado nuclear, índice mitótico, índice combinado de Nottingham (NPI), invasión linfática, vascular y perineural, necrosis, número de ganglios resecados, número de ganglios positivos, estadío TNM-UICC (primary Tumor, regional lymph Node, distant Metastasis), radioterapia adyuvante, quimioterapia (adyuvante, primera, segunda y tercera línea), fecha de último control, seguimiento (vive, perdido, fallecido), fechas de la primera, segunda o tercera progresión de la enfermedad y sitio metastásico, niveles de expresión de RE, RP, HER-2 y ki-67. El presente trabajo de investigación se encuentra enmarcado dentro del Código de Nüremberg promulgado en 1947, la Declaración Universal de los Derechos Humanos de 1948, la Declaración de Helsinki de 1964 promulgada por la Asociación Médica Mundial, la Propuesta de Normas Éticas Internacionales para las investigaciones biomédicas con sujetos humanos de 41 1982, las Normas Internacionales publicadas en las Guías de Ética Internacional para Estudios Epidemiológicos publicadas por el Council for International Organizations of Medical Sciences (CIOMS) en colaboración con la Organización Mundial de la Salud (OMS) en 1991, actualizadas en el 2000, 2002 y 2008 (CIOMS Ginebra, Suiza), y también contemplado tanto en la disposición Nº 5330/97 de ANMAT de Argentina (Capítulo II), como en la Ley 11.041 de la Provincia de Buenos Aires. Para la realización del presente trabajo se obtuvo el consentimiento informado de todos los pacientes. La evaluación respecto al “Riesgo” (Ley 11.044. Título 2, Aspectos Éticos de la Investigación en Seres Humanos, Art. 6) que implicó la realización de esta Tesis doctoral fue considerada por el Comité de Ética e Investigación del Hospital Provincial Magdalena V. de Martínez, como de “Riesgo Mínimo” para el paciente. Respetando las disposiciones de dicha institución, se incluyó este aspecto en el texto de conformidad del paciente. A su vez, el estudio fue aprobado por el Comité de ética del Instituto de Biología y Medicina Experimental (IByME) que fue el lugar dónde se desarrollaron las determinaciones de las pacientes. Se utilizó para la estadificación de los pacientes los criterios del American Joint Committee on Cancer (AJCC Cancer Staging Manual 8th ed, 2014). La clasificación histopatológica se realizó siguiendo los criterios de la OMS en su versión más actualizada (2014). La sobrevida global (SG) fue medida a partir de la fecha del diagnóstico hasta la fecha de último control o fallecimiento del paciente. El tiempo libre de progresión (TLP) de la enfermedad fue medido desde la fecha de diagnóstico hasta la fecha de la primera progresión tumoral. Procesamiento de las muestras: Condiciones y traslado de las muestras: Al menos un día antes de la cirugía programada por el equipo quirúrgico del Hospital de Pacheco, se prepararon un frasco caramelo con medio de cultivo (DMEM-F12; Sigma 2906) y un tubo eppendorf vacío, ambos debidamente rotulados. El día de la cirugía, se transportaron ambos contenedores al interior del quirófano y después de tener la confirmación del diagnóstico por congelación, se separaron dos porciones del tumor: una de ellas se colocó inmediatamente en el medio de cultivo y la otra en el tubo eppendorf que fue, a su vez, colocado en un telgopor con hielo seco para su congelación y conservación a -70°C. En estas 42 condiciones se trasladaron ambas muestras al laboratorio, donde en primer lugar se ingresaron a la base de datos dándole un número correlativo y, en adelante, la muestra será identificada sólo con este número. Preparación de las muestras para extracción de proteínas, RNA y DNA: Para preparar los extractos proteicos y separarlos en sus fracciones nuclear y citoplasmática, el fragmento de tejido se colocó en un mortero y en forma manual se pulverizó con el agregado de nitrógeno líquido. Una vez que la totalidad del tejido se pulverizó, se dividió en tres porciones debidamente rotuladas: Fracción para DNA: Se le agregó un buffer de lisis y digestión (100 mM NaCl, 10 mM Tris-Cl pH 8, 25 mM EDTA pH 8, 0,5% SDS y 0,1 mg/ml proteinasa K) y se incubó a 50ºC durante 12-18 hs. Luego se realizó la extracción del DNA con fenolcloroformo-isoamílico. Se purificó con ½ volumen de acetato de amonio (7.5 M) y 2 volúmenes de etanol 100%., se precipitó por centrifugación y se lavó con etanol 70%. Finalmente el DNA se resuspendío en agua hexa destilada. Fracción para RNA: Se colocó en TRIZOL- reagent, de Ambion, Life Technologies y se realizó la extracción según indicaciones del proveedor. El RNA final se resuspendió en agua-DEPC. Fracción para la extracción de proteínas: Esta fracción se procesó para separar las fracciones nuclear y citoplasmática con un Kit destinado para tal fin (Thermo Scientific: NE- PER Nuclear and cytoplasmic Extraction Reagents). Los extractos fueron inmediatamente congelados a - 70ºC previa determinación de la concentración proteica por el Método de Lowry (ver Apéndice). Preparación de las muestras para inclusión en parafina: Los tejidos fueron fijados en formol neutro al 10% (1 parte de formaldehido puro 40% y 9 partes de PBS 1x), luego deshidratados mediante el pasaje por alcoholes en graduación creciente (70º, 80º, 96º, 100º) a temperatura ambiente. Posteriormente, fueron aclarados impregnándolos en xilol para embeberlos en parafina líquida y colocarlos en estufa a 60ºC durante 1-3 hs. Por último se procedió a la inclusión definitiva y la formación del bloque histológico. Cada uno fue rotulado y almacenado a temperatura ambiente. Las muestras 43 embebidas en parafina fueron cortadas por el mismo operador con un espesor de 3-4 micrones. Una vez obtenido el corte histológico se lo colocó en estufa para su secado durante 1h. Anticuerpos utilizados: Se emplearon los anticuerpos monoclonales cuyos datos se resumen en la Tabla m&m 1 # 1 MUC-2 2 3 4 5 6 7 8 9 10 11 12 13 14 Marca Santa Cruz Biotech CRISP-3 FGF-10 AR GR BCL-XL HER-2 KI67 CK5 RE RP CK6a STAT-5 pSTAT-5a Proteintech Santa Cruz Biotech Cell Sinaling Santa Cruz Biotech Santa Cruz Biotech DAKO Abcam DAKO DAKO DAKO Covance Santa Cruz Biotech Epitomics (Abcam) N° Catalogo sc-15334 14847-1AP sc-7917 5153P M-20 sc-634 A0485 ab- 15580 D5/16 B4 ep-1 PgR 636 PRB-169p c-17 1289-1 Recaptura citrato pH6, 50min a 95° Dilución Secundario 1:200 Conejo citrato pH6, 50min a 95° citrato pH6, 50min a 95° citrato pH6, 50min a 95° citrato pH6, 50min a 95° citrato pH6, 50min a 95° citrato pH6, 50min a 95° citrato pH6, 50min a 95° Citrato pH6, 50min a 95° citrato pH6, 50min a 95° citrato pH6, 50min a 95° citrato pH6, 50min a 95° citrato pH6, 50min a 95° citrato pH6, 50min a 95° 1:250 1:100 1:250 1:150 1:200 1:1000 1:750 1:100 RTU RTU 1:500 1:100 1:100 Conejo Conejo Conejo Conejo Conejo Conejo Conejo Conejo Conejo Ratón Conejo Conejo Conejo Tabla m&m1: Anticuerpos utilizados y sus especificaciones técnicas*RTU: ready to use. 2. Técnicas La IHQ es una técnica que permite ver en forma directa la distribución celular de una molécula, utilizando anticuerpos u otros ligandos marcados. Entre los diversos tipos de marcación se encuentran la radioactiva, la fluorescente y la enzimática. Esta última es preferida sobre las anteriores debido a su sencillez y al menor riesgo que implica la no utilización de material radioactivo. Las enzimas más frecuentemente utilizadas son la peroxidasa y la fosfatasa alcalina que, al reaccionar con un sustrato no visible generan un producto insoluble y visible. Una vez establecida, esta reacción puede ser detectada por medio de la microscopía de luz convencional. Por lo general, se emplea un sistema de detección en sandwich en el que un primer anticuerpo específico (generalmente un anticuerpo monoclonal) reconoce al antígeno buscado y es a su vez reconocido por un segundo anticuerpo conjugado que transporta la enzima. La ventaja de este sistema 44 reside en la practicidad de no tener que marcar cada uno de los anticuerpos específicos y, por otra parte, existe la posibilidad de que se amplifique la señal lográndose una mayor sensibilidad. La principal desventaja radica en que muchas células pueden presentar actividad enzimática endógena, generándose falsas reacciones positivas. Sin embargo, esta actividad puede ser inhibida y, conjuntamente, se pueden establecer controles rigurosos en los que se omite el anticuerpo específico o el conjugado a la enzima. Por otra parte, la conformación de los epitopes puede ser modificada por el procedimiento empleado en la fijación por lo que es deseable aplicar métodos de “recuperación antigénica” a fin de lograr una conformación natural de los mismos. El empleo de temperaturas extremas, variaciones de pH y soluciones capaces de secuestrar iones de calcio son ampliamente utilizadas con tal fin. En nuestro estudio empleamos la técnica de IHQ indirecta como método de detección antigénica; la misma fue realizada siempre por el mismo operador. IHQ simple y doble: Los cortes incluidos en parafina, cortados y montados sobre portaobjetos, fueron desparafinados en xileno durante 30 min, e hidratados en una serie de alcoholes decrecientes: 100%, 96% y70% dos pasajes de 10 min cada uno. Seguidamente, se incubaron los cortes en etanol 70° con 10% de H2O2durante 25 min para inactivar la actividad endógena de la peroxidasa endógena. Se descartó la solución de bloqueo y se realizaron 3 lavados de 10 min con H2O2. A continuación, las muestras se incubaron en buffer de recaptura (especialmente seleccionado para cada anticuerpo, ver tabla m&m 1) durante 50 min a una temperatura de 90° en baño térmico. Una vez finalizado el tiempo de recaptura, se dejaron enfriar los cortes en el mismo buffer por 15 min a T° ambiente. Posteriormente se procedió a lavar los cortes: en el caso de utilizar la enzima peroxidasa para la reacción los lavados subsiguientes fueron con PBS1x, en cambio si la reacción enzimática utilizada fue con la fosfatasa alcalina, los lavados posteriores fueron en todos los casos con TBS1x. La razón de esta modificación es que el PBS es sustrato de la peroxidasa y limita su actividad. Una vez finalizados los 3 lavados de 10 minutos, se incubaron los cortes con BSA 2,5% a T° ambiente, en cámara húmeda durante al menos 30 min. Se descartó el suero y sin lavar los restos del mismo, los cortes se incubaron con al anticuerpo seleccionado en la dilución correspondiente (ver tabla m&m 1) en cámara húmeda durante toda la noche a 4 ºC. 45 Al día siguiente, se descartaron los anticuerpos y se realizaron 3 lavados en PBS1x/TBS1x de 10 min cada uno. Luego se incubaron con anticuerpo secundario biotinilado específico para el isotipo del anticuerpo en una dilución de 1:400, durante 60 min en cámara húmeda. A continuación se preparó el ABC (Complejo avidina- biotina) en BSA 2.5%, y se realizaron 3 lavados en PBS1x/TBS1x de 10 min cada uno. El complejo Avidina- Biotina se aplicó sobre los cortes pasados los 30 min de preparado, y luego se incubaron los cortes durante 30 min en cámara húmeda a T° ambiente. Por último se realizaron los 3 últimos lavados en PBS1x/TBS1x para luego revelar la reacción con Diaminobencidina (DAB) que produce un precipitado marrón. Cada anticuerpo fue expuesto a la DAB durante una cantidad de tiempo específica. Una vez finalizada la exposición a DAB los cortes se contrastaron con hematoxilina durante 5 a 10 segundos. A continuación, se procedió a la deshidratación en la secuencia de alcoholes de forma creciente y finalmente xilol. Finalmente, las muestras fueron montadas en un medio sintético y cubiertas con un cubreobjeto. En los casos donde quisimos poner de manifiesto dos anticuerpos en la misma muestra (figura m&m3: CK en rojo y KI-67 en negro), se repitió el mismo procedimiento utilizando en primera instancia un ABC unido a Peroxidasa y en segunda instancia unido a fosfatasa alcalina. Por otro lado, se utilizaron cromógenos diferentes para poder diferenciar cada anticuerpo. Figura m&m3: micrografía ejemplificando una doble marcación: carcinoma de mama GH3 marcando con rojo CK5 en el citoplasma y con negro KI-67 en determinados núcleos; barra: 400m. 46 WB: Los extractos proteicos se separaron en un gel de poliacrilamida discontinuo utilizando el sistema de buffers discontinuos de Laemmli108. Previo a la separación, las proteínas se diluyeron en solución desnaturalizante (cracking buffer, ver Apéndice) y se incubaron a 100ºC durante 5 min. En cada gel se sembraron las muestras correspondientes (100 µg de proteína/calle) junto con un marcador de pesos moleculares conocidos. La separación se realizó durante 20 min a 20 mA/gel hasta que las muestras pasaran el gel concentrador, y por aproximadamente 120 min a 25 mA/gel, en el gel separador. Concluida la electroforesis, las proteínas se transfirieron a una membrana de nitrocelulosa durante 1 h a 100 V. A continuación, las membranas se bloquearon en solución de bloqueo (ver Apéndice) durante al menos 1 h. Al terminar el bloqueo, las membranas se lavaron con TBS-T (ver Apéndice) y luego se incubaron con los anticuerpos primarios correspondientes, a 4°C, ON, en agitación. Al día siguiente, el anticuerpo primario se lavó con TBS-T, y se agregó el anticuerpo secundario conjugado con la enzima peroxidasa. Las bandas inmunoreactivas se revelaron mediante el agregado de un sustrato que genera una señal quimioluminiscente al ser modificado por la enzima peroxidasa. Para visualizar la señal, las membranas se expusieron a una placa radiográfica. Finalmente, las placas se escanearon utilizando un escáner digital, y las bandas se cuantificaron utilizando el programa ImageJ. Como control positivo se utilizaron extractos proteicos de la línea celular humana T47D. Cultivo tisular (Chopper): Debido a la baja efectividad obtenida con los cultivos primarios (eficiencia del 11%) se implementó una técnica basada en la incubación de lonjas de tejido fresco utilizando un dispositivo denominado Chopper (Vibratome VT1200; Ted Pella, Inc, USA). El equipo consta de un brazo metálico que sujeta una cuchilla que cae sobre el fragmento de tejido fresco. El equipo permite controlar la velocidad y el grosor de los cortes tomando contacto directo con el tejido lo menos posible para evitar cualquier tipo de contaminación. Este dispositivo se coloca en campana de seguridad biológica y se desinfecta antes de su uso con alcohol 70%. Las muestras a procesar llegan a T° ambiente en medio de cultivo estéril. La misma se coloca sobre papel Whatman estéril adherido a la platina del Chopper y se corta en lonjas de aproximadamente 100 µm de espesor. Estos fragmentos de tejido se colocan en una placa de Petri con medio DMEM/F12 donde se separan y luego se trasladan a una placa de 6 hoyos que contiene una cámara con filtro en cada hoyo (PICM3050; Millipore, Millerica, MA). Las cámaras con filtros permiten el contacto de las láminas de tejido con el medio de cultivo, y a la vez 47 mantienen la óptima oxigenación de las mismas, impidiendo al mismo tiempo la adherencia de las láminas al pocillo. Se incuban el mismo número de cortes en cada uno de los hoyos. En nuestro caso, el objetivo de estos experimentos fue evaluar el efecto de la MFP 10nM sobre la proliferación de los tumores con distinta expresión de isoformas de RP. En todos los casos las incubaciones se realizaron en presencia de 10% de SFB durante 48 hs en estufa gaseada a 37º C. Finalmente las muestras se fijaron en formaldehido neutro 10% para luego ser embebidas en parafina y cortadas en láminas de 3-4 μm de espesor para poder realizar el análisis de H&E y la posterior IHQ. Criterios para considerar muestra con conteo exitoso Para considerar a una muestra con material suficiente para el recuento de células ki-67 positivas, en primera instancia y basándonos en la H&E, tuvimos que tener al menos 5 fragmentos de tejido con células viables en cada uno de los escenarios (MFP o CONTROL). La cantidad mínima de células viables en cada fragmento superó en todos los casos las 50 células. En caso de no llegar a este número mínimo, se procedió a realizar un desgaste seriado de la totalidad del taco de parafina para obtener células diferentes en el mismo fragmento (utilizando el plano Z). Con este método nos aseguramos una cantidad más o menos homogénea de células evaluadas en todos los casos. Cabe destacar que la celularidad de la muestra difiere ampliamente de tumor a tumor, por lo que nos fue dificultosa la obtención de material suficiente en aquellos casos donde las muestras fueron altamente desmoplásicas (mucha cantidad de tejido estromal denso y poca celularidad epitelial). Análisis estadístico y bioinformático del transcriptoma (RNAseq) El RNA fue aislado y purificado usando TRIZOL (Life Technologies) como fue previamente descripto. La concentración e integridad del RNA fue medida con el sistema Agilent 2100 Bioanalyzer. Solamente aquellas muestras con índice de integridad RIN (RNA integrity values) superior a 8 fueron consideradas para su posterior análisis por secuencación con la plataforma Illumina HiSeq2000 (Lineberger Comprehensive Cancer Center, University of North Carolina). Los archivos FASTQ de las lecturas apareadas de cada tumor fueron analizados con el programa FASTQC (http://www.bioinformatics.babraham.ac.uk/projects/fastqc/) para efectuar los análisis de control de calidad de las lecturas generadas en cada muestra. Posteriormente, el alineamiento de las lecturas y la cuantificación de los niveles de expresión para cada gen del genoma fue realizado mediante el empleo del programa RSEM (RNA-Seq by Expectation48 Maximization) (http://deweylab.github.io/RSEM/)109. El alineador de secuencias cortas implementado fue el Bowtie empleando como genoma de referencia humano la versión hg19. El análisis estadístico de los perfiles de expresión génica se realizó con el algoritmo EBseq implementado en la plataforma R/Bioconductor (https://www.bioconductor.org/). Brevemente, el test Ebseq identifica genes diferencialmente expresados (FC>±2; FDR<0.05) en base a niveles de expresión estimados por la metodología de RSEM mediante el empleo de un método empírico Bayesiano basado en la distribución binomial negativa 110. Las visualizaciones con mapas de calor fueron generadas con el programa MultiExperiment Viewer software (MeV v4.9) (http://www.tm4.org/mev.html) 111 . La clasificación de los carcinomas en los subtipos intrínsecos fue realizada mediante el empleo del Bioclasificador predictivo basado en el modelo PAM50 en el lenguaje de análisis R112. El análisis de enriquecimiento funcional de los genes diferencialmente expresados fue realizado con las aplicaciones ClueGo y CluPedia en la plataforma Cytoscape (http://www.cytoscape.org/). El análisis comparativo de los perfiles de expresión identificados en los carcinomas PRA vs. PRB fue analizado en carcinomas ductales infiltrantes provistos por el proyecto TCGA-BRCA (TCGA 2012113). Los perfiles de expresión y la información clinicoplatológica asociada (https://genome-cancer.soe.ucsc.edu/) fue y descargada cBioPortal desde CancerBrowser (http://www.cbioportal.org/) respectivamente. El análisis e integración de dichos datos fue realizado en R/Bioconductor. TMA Con el objetivo de procesar y evaluar diferentes anticuerpos en múltiples pacientes a la misma vez, contamos con la construcción de Arrays de tejido (del inglés Tissue MicroArray). Para dicho fin utilizamos un kit (EZ-TMATMManual Tissue Microarray Kit) compuesto de un bloque pre fabricado de parafina con 24 hoyos de 3mm cada uno y dos agujas para realizar tomas de 3mm sobre los tacos parafinados originales de cada paciente seleccionada (figura m&m 1). Para la construcción del TMA, en primer lugar, seleccionamos a las muestras con un criterio de selección: la proporción de Isoformas del RP. A continuación tomamos todos los tacos parafinados originales y sus respectivos cortes coloreados con H&E, para seleccionar el área de interés (3mm). Una vez marcada dicha área sobre el corte H&E, se identifica la misma área en el taco de parafina y se procede a tomar la muestra con la aguja provista. Seguidamente se deposita cada muestra en su respectivo hoyo. Es de buena práctica colocar 49 en alguno de los extremos algún tejido diferente para poder identificar el orden de las muestras. Una vez finalizada la selección, se derrite la parafina del taco y de los cilindros en estufa a 60°C hasta obtener un taco homogéneo. Luego se obtienen los cortes coloreados y en blanco para proceder a realizar las técnicas planificadas. Figura m&m1: Construcción de TMAs, A) Kit utilizado, B) imagen del TMA construido en NIH- USA en colaboración con el Dr. Alfredo Molinolo. 3. Análisis estadístico Tamaño de la muestra: el tamaño muestral requerido para detectar un 50% de diferencia en la sensibilidad a MFP entre grupos RP+ fue de 19 pacientes por grupo. Consideramos RPA+ a todos los valores ≥1.2 y RPB+ a todos los valores ≤ a 0.83. Los errores de tipo I y II fueron de 5 y 10%, respectivamente. Para este punto contamos con la colaboración del Dr. José M. Belizán (Instituto de Efectividad Clínica y Sanitaria; IECS). Para comparar las 50 medias ± DS de la cuantificación de Ki-67 en los cultivos, o de la cuantificación de IHQ de tissue arrays, se utilizaron tests no paramétricos (Mann Whitney). Las muestras pareadas se analizaron con T de Student, y Chi2 para la comparación entre grupos en las variables de la Tabla clínica. 4. Criterios Definición de pacientes RP (+) o RP (-): Con el objetivo de caracterizar en forma precisa a los pacientes según su RP, fijamos los siguientes criterios a tomar en cuenta frente a discordancias entre las dos técnicas utilizadas (WB o IHQ), y frente a discordancias encontradas entre las determinaciones de IHQ realizadas en el ámbito hospitalario y en el laboratorio. En cuanto a la reproducibilidad de los valores hallados en la IHQ en los dos escenarios (laboratorio y hospital), es importante destacar que el tamaño de los fragmentos de tejido destinados para el hospital o el laboratorio no tienen las mismas dimensiones. Tampoco son seleccionados bajo microscopio para tener certeza de que la porción que se destina a la investigación posee celularidad suficiente para la realización de las técnicas planteadas. Es decir, recibimos tejido del mismo paciente pero de áreas distintas. Cabe aclarar que en orden de importancia, el diagnóstico clínico y las pruebas complementarias priman por sobre los objetivos de nuestra investigación, por ende, el tamaño de fragmento tisular que llega al laboratorio es muy pequeño. Al respecto, cuando realizamos a doble ciego las determinaciones de los receptores hormonales, de HER-2 y de ki-67 tenemos un 5.2% de discordancia. Creemos que la razón es la antes mencionada, aparte de que está bien documentado en la bibliografía que los tumores poseen poblaciones biológicamente heterogéneas114 115. En los casos donde la discordancia “cambiaría” la conducta terapéutica (positivo vs negativo); o cuando los valores informados se incluyen dentro de intervalos muy diferentes, por ejemplo 90% vs 5%, la IHQ se repite en el ámbito del laboratorio. En los casos donde se define la positividad del caso, y la repetición de la técnica sigue siendo discordante, se toman en cuenta también los valores de WB. Para simplificar y concluir, contamos con 3 determinaciones distintas para el RP: la IHQ de hospital, la IHQ del laboratorio y el WB. La paciente será considerada RP (+) si dos de tres valores son positivos. 51 Definición de valores de corte para WB: Criterio utilizado para la caracterización de las pacientes según la isoforma de RP Para clasificar a las pacientes RP+ según la proporción de isoforma predominante, tomamos un criterio interno de nuestro laboratorio ya que no existe al día de hoy un criterio aceptado. A priori catalogamos como RPA a aquellas pacientes con proporciones mayores o iguales a 1,2 y RPB a proporciones menores o iguales a 0,83. Con respecto a los valores comprendidos entre estos dos (1,2 a 0,83) consideramos que son pacientes que poseen similares cantidades de isoformas del RP, por lo tanto las catalogamos como equimolares (EQUI). Un cuarto grupo de pacientes corresponden a las RP (-), que representan una minoría pero que igualmente fueron testeadas en su sensibilidad a MFP. El análisis del valor obtenido por WB de todas las muestras se realizó en forma separada y comparativa de la fracción nuclear y la citosólica. En líneas generales los valores de ambas fracciones fueron coincidentes, en cuyo caso se tomaron en cuenta los valores nucleares; sólo en una minoría de casos se tomó el valor del citosol como el valor de referencia (aclarado en todos los casos. Método de cuantificación de ki-67 Para objetivizar el marcador de proliferación ki-67 se cuantificó la totalidad de las células tumorales con o sin marca positiva y la totalidad de las células tumorales marcadas. De esta manera obtuvimos un porcentaje de marcación positiva. Es importante aclarar, que en los casos donde la celularidad total fue menor a 50 células, tomamos la precaución de realizar una segunda y hasta tercera determinación en desgastes seriados. Método de cuantificación de marcadores de IHQ (criterio general) Para cada uno de los anticuerpos confeccionamos un score de marca contemplando dos parámetros: la intensidad de marca (0, 1, 2 y 3) y el porcentaje de células marcadas (0 a 100). En todos los casos consignamos la localización celular y subcelular de la marca, diferenciando en primera instancia si la marca se ubica en el espacio extracelular (Figura m&m2, A) o en el interior de la célula (Figura m&m2, B). Con respecto a la localización dentro de la célula, distinguimos la presencia de marca de membrana (presente débil o fuerte/ ausente, Figura m&m2, B.1), citoplasmática (intensidades y de características homogénea o localizada, Figura 52 m&m2, B.2) y/o nuclear (Figura m&m2, B.3). De cada una de las localizaciones antes mencionadas se obtiene un score multiplicando la intensidad y el porcentaje. Del producto de estos parámetros se obtiene un score que va de 0 a 300. En la figura m&m2 se muestran ejemplos de cada situación 116. 1 2 A B 3 C D E Figura m&m 2: Ejemplos de expresión diferencial según localización, intensidad y porcentaje de células marcadas. A1) marca en el espacio extracelular, A2) marca extra e intracelular (vacuolas citoplasmáticas), B1) marca de membrana parcial o incompleta, B2) marca de membrana completa, C1) marca citoplasmática débil, C2 der) marca citoplasmática 53 heterogénea, C2 izq) marca citoplasmática homogénea, C3) marca citoplasmática intensa, D1) marca nuclear de bajo porcentaje –aprox. 20%, D2) marca nuclear moderada- alta, D3) Marca nuclear del 100% de la celularidad, E1) marca mixta con predominio de marcación citoplasmática y E2) marca mixta con predominio de marcación nuclear. Barra: 50m. 54 Resultados 55 Descripción clínica de la población estudiada Iniciamos el análisis clínico117 con un dato muy básico como es la edad de las pacientes, que describe la población en estudio en su totalidad. Para la distribución por edades (Tabla 1.1), con un rango de 24- 96 y una media de 61 años, hallamos un 3,6 % de pacientes muy jóvenes (<35 años), y un 22% de pacientes premenopáusicas. Como es de esperar, la mayoría de la población se concentra en la porción de pacientes postmenopáusicas (definida como mayores de 51 años a los efectos de una descripción aproximada). GRUPO ETARIO FREC. ABSOLUTA % <35 AÑOS 9 3,629 35- 50 AÑOS 54 21,77 51- 65 AÑOS 87 35,08 >65 AÑOS 98 39,52 total 248 100 Tabla 1.1: Distribución de pacientes según grupo etario. Los datos de las historias clínicas se agruparon en dos categorías: 1. Factores de Riesgo:118 Para el análisis de los factores de riesgo, tomamos en cuenta 5 parámetros que se encuentran extensamente estudiados y de los que se conoce su asociación positiva con esta patología. En la Tabla 1.2 se muestra la frecuencia de cada uno de los factores de riesgo. Cabe destacar que más de la mitad (63%) de la población posee algún factor de riesgo asociado, y el 14% del total está representado por los antecedentes familiares. 56 FREC. ABSOLUTA % FACTOR DE RIESGO ANTECEDENTES FAMILIARES MADRE- HERMANAS O HIJAS PRIMA- TÍA- ABUELA MENARCA < 12 AÑOS O MENOPAUSIA >55AÑOS NULIPARIDAD O PRIMOPARICIÓN > 30 AÑOS MASTOPATÍAS CRÓNICAS (>6 MESES) ANTECENDENTES PERSONALES CÁNCER DE MAMA CÁNCER DE OVARIO CÁNCER DE ENDOMETRIO Total 25 15 8,865 5,319 81 24 3 28,72 8,511 1,064 27 2 2 179 9,574 0,709 0,709 63,48 Tabla 1.2: Distribución de pacientes según factores de riesgo asociados tomando como número total de pacientes las 179 que respondieron al cuestionario. Los factores de riesgo varían dependiendo en gran medida de factores socioeconómicos. En este caso particular, que los pacientes provienen de un hospital público del conurbano bonaerense sabemos que estamos frente a un segmento poblacional donde la mayoría tiene bajos recursos económicos y limitado acceso a la educación. Es importante hacer este tipo de aclaración ya que algunos de estos parámetros, como es la nuliparidad o la primoparición>30 años, representa sólo un 8%. 2. Enfermedad Actual: Cuando hablamos de enfermedad actual se tienen en cuenta todos los estudios complementarios y consultas realizadas y vinculadas al diagnóstico. Por protocolo, todas las pacientes se estadifican con el sistema T.N.M (Tumor, Node, Metastasis) 119 120 y según este parámetro se toma la conducta quirúrgica pertinente. El sistema T.N.M incluye los datos de tamaño tumoral (T), presencia y cantidad de ganglios axilares positivos (N) y presencia de enfermedad a distancia (M). Luego de la cirugía, se vuelve a estadificar a la paciente teniendo en cuenta los resultados de la anatomía patológica; se confirma el tamaño tumoral (pT) y la presencia y número de ganglios positivos (pN). Es importante destacar que el T.N.M clínico se basa en el diagnóstico semiológico y en las imágenes, que poseen ciertos falsos positivos, es por esta razón que se realiza el T.N.M patológico luego 57 de la cirugía. En la Tabla 1.3 se muestra la distribución de nuestras pacientes según su Estadio. Podemos observar que aproximadamente un 42% de las pacientes se presenta a la consulta con enfermedad avanzada, es decir con un estadio IIB o mayor. Estas pacientes se presentan con tumores > de 5cm (T3) o ya tienen comprometidos los ganglios (N1 o N2). Por otro lado, aproximadamente un 2% de las pacientes presentan recurrencias (recuadro aparte) a las cuales no les corresponde el estadio clínico aquí presentado. De lo analizado hasta acá, podemos decir que en nuestra población de estudio hay un alto porcentaje de pacientes jóvenes (<50%), que consultan por primera vez con enfermedad avanzada. Por otro lado, son pacientes de bajos recursos económicos y limitado nivel educativo, lo cual hace difícil el seguimiento periódico y los controles pautados. DEFINICIÓN FREC. % ABSOLUTA ESTADIO T N M 0 Carcinoma in situ 0 0 0 0,00 IA IB IIA 1* 0-1 0 1 2 0 1mi** 1 1 0 0 0 0 0 0 63 0 1 26 28 29,03 0,00 0,46 11,98 12,90 37 0 25,35 17,05 0,00 0 1 1 17 0 17,05 0,00 0,46 0,46 7,83 0,00 3 21 0 8,76 1,38 9,68 0,00 IIB IIIA IIIB 2 3 1 0 0 1 2 3 3 2 2 2 1 2 4 4 4 0 1 2 0 0 0 0 0 0 0 0 0 0 11,06 58 IIIC Cualquier T 3 0 0 0,00 IV Cualquier T Cualquier N 1 5 2,30 14 217 6,45 100,00 RECURRENCIAS NC*** TOTAL Tabla 1.3: Distribución de pacientes según su estadio clínico (Criterios clínicos basados en el sistema T.N.M para la estadificación de pacientes. Tomado de la última actualización de AJCC 7ma edición); *: incluye carcinomas microinvasores, **:micrometástasis ganglionar y *** no corresponde 59 2. Análisis histopatológico de la población estudiada Recibimos un fragmento de tejido tumoral de cada una de las pacientes que incluye en parafina como se detalla en Materiales y Métodos. De la observación de cortes coloreados con la H&E se obtiene el diagnóstico final del subtipo tumoral121 37 (Figura 2.1) y la gradación histológica, que se basa en el grado de formación de estructuras tubulares, la atipia nuclear y el número de mitosis 47. De la misma se desprenden 3 categorías, que constituyen un índice pronóstico per se: el índice de Nottingham o NPI (Nottingham Prognostic Index).El NPI se divide en 3 categorías: bien diferenciado (3, 4, y 5; Figura 2.2), moderadamente diferenciado (6 y 7) y pobremente diferenciado (8 y 9; Figura 2.3). Figura 2.1 a e b c d f g h k tumoral. Se muestra lal j Figura 2.1: Panel de i12 micrografías que ejemplifican la heterogeneidad diversidad que existe en la disposición espacial de la masa tumoral, la variación en la calidad y cantidad de estroma y en el grado de diferenciación. a) IC NST, b) CLI, c) IC NST con patrón cribiforme, d) carcinoma mucinoso, e) CI NST, f) CI NST, g) CI con patrón micropapilar, h) Figura 2.2 Carcinoma Ductal in situ –DCIS, i) carcinoma papilar, j) IC NST, k) CLI y l) IC NST. Tinción de rutina: H&E. Barra: m. 60 b a c Figura 2.2: Panel con 3 ejemplos diferentes de carcinomas considerados de bajo grado. En a) se observa un conjunto de ductos tumorales bien diferenciados GH1, moderado grado nuclear GN2 y bajo índice mitótico GM1; el score total es igual a 4, en b) estamos frente a un tumor bien diferenciado GH1, de bajo grado nuclear GN1 y bajo índice mitótico GM1; el score total es igual a 3, y en c) se observa un carcinoma mucinoso con bajo grado de diferenciación GH3 – ausencia de ductos bien constituidos-, bajo grado nuclear GN1 y bajo índice mitótico GM1; score total igual a 5. Tinción: H&E; barra: 50m. Figura 2.3 b a c Figura 2.3: Panel con 3 ejemplos diferentes considerados de alto grado. En a) se observan nidos sólidos de células tumorales sin diferenciación GH3, moderado grado nuclear GN2 y alto índice mitótico GM3 –las figuras mitóticas se marcan con flechas verdes; el score total es igual a 8, en b) estamos frente a un tumor de tipo micropapilar que no presenta diferenciación ductal GH3, con alto grado nuclear GN3 –se muestran con la barra tres o más tamaños dispares- y moderado índice mitótico GM3; el score total es igual a 9, y en c) se observa un carcinoma con moderado grado de diferenciación GH2, alto grado nuclear GN3 y alto índice mitótico GM3; score total igual a 8. Tinción: H&E; barra: m. 61 1. Distribución de las pacientes según subtipo histológico y NPI: La mayoría de los tumores y lesiones precursoras se originan en la unidad terminal ducto-lobulillar. Por otro lado, se han asociado ciertos subtipos especiales, como por ejemplo el carcinoma tubular, a cierto comportamiento biológico vinculado con el pronóstico. En este ejemplo la esperanza de vida de las pacientes portadoras de esta variedad tumoral, es similar a la esperanza de vida de ser portadora de patología mamaria benigna50. A pesar de esta evidencia, clasificamos a nuestra población según las guías de la Organización Mundial de la Salud (WHO, actualizada por última vez en 2012). En concordancia con la bibliografía, en nuestra población predominan los carcinomas infiltrantes NST – no special type representando un 80% del total, y siguen muy por debajo de ellos, los carcinomas lobulillares (CLI) representados aproximadamente por un 10%122. (Tabla 2.1 y Figura 2.1) CATEGORIA LESIONES PRECURSORAS DCIS LESIONES INVASORAS CI NST LOBULILLAR MUCINOSO METAPLASICO MEDULAR PAPILAR TUBULAR FREC. ABSOLUTA % 8 3,0075 210 28 8 1 2 7 2 266 78,947 10,526 3,0075 0,3759 0,7519 2,6316 0,7519 100 Tabla 2.1: Distribución de pacientes según subtipo histológico. En cuanto al NPI, las pacientes se distribuyen de forma uniforme entre las tres categorías, con un leve predominio de los carcinomas moderadamente diferenciados – score II (36%) Tabla 2.2. 62 SCORE I II III FREC. ABSOLUTA 68 72 63 203 % 33,498 35,468 31,034 100 Tabla 2.2: Distribución de pacientes según índice pronóstico de Nottingham (NPI). 63 3. Análisis de factores pronósticos RE, RP, HER-2 y ki-67 (IHQ). Actualmente en la práctica clínica se utilizan 4 marcadores que son tanto pronósticos como predictivos 1. El REα se utiliza como marcador predictivo de la respuesta a las drogas que se dirigen contra los estrógenos (SERMs, SERD, IA). El valor se considera positivo con tan sólo 1% de las células tumorales marcadas 120 , y este porcentaje habilita al tratamiento. En cuanto a su rol pronóstico, es bien conocido que los tumores con expresión de receptores son la variedad de mejor pronóstico 49 54. 2. El RP es un marcador pronóstico. Su rol se vincula a la respuesta que tendrá la paciente al tratamiento antiestrogénico52, si bien no importa cuál sea el resultado del mismo, el tratamiento de primera elección en pacientes RE+RP- son los antiestrógenos. En cuanto al rol predictivo se sugiere que podría ayudar a la elección del abordaje antiestrogénico (TAM vs IA) 56. 3. La presencia de HER-2neu indica el uso de un anticuerpo monoclonal que bloquea este factor de crecimiento en aquellos tumores donde haya sobreexpresión (3+). Es un marcador predictivo de la sensibilidad a su tratamiento específico con anticuerpos monoclonales como el Trastuzumab, y su expresión se asocia a mal pronóstico123,124. 4. El marcador ki-67 se usa para clasificar a las pacientes según su tasa de proliferación a pesar de que continúa siendo muy discutido el cut point125. El % de ki-67 define qué pacientes serán consideradas Luminales A o B, conjuntamente con los 3 marcadores anteriores mencionados. Actualmente es un marcador pronóstico, pero se está analizando su papel predictivo en la respuesta a quimioterapia neoadyuvante126. En nuestra población de pacientes la determinación de dichos factores pronósticos se realiza a doble ciego: por un lado se realiza de rutina en el contexto hospitalario, y la evalúa un patólogo experto perteneciente a Hospital. Por otra parte, las 4 determinaciones son repetidas en el laboratorio y evaluadas por segunda vez sin conocer el resultado del hospital. En la gran mayoría de las oportunidades ambas determinaciones son concordantes, sin embargo, existen algunos casos en donde no la hay. En estos casos, la determinación se repite y se compara también, con los valores obtenidos por WB, pero en todos los casos prima la determinación del hospital ya que cuentan con varios tacos representativos de tumor donde realizar cada determinación. La distribución de pacientes según sus intervalos de expresión de receptores, HER-2 y ki-67 se resume en la tabla 3.1. Es importante tener en cuenta que hasta un 20% de 64 los resultados de estas pruebas es equívoco en diferentes laboratorios de anatomía patológica127. Dentro de las posibles combinaciones de estos marcadores se esconden muy distintos escenarios en cuanto a pronóstico y tratamiento. La decisión terapéutica depende de esta combinación. En especial en nuestro laboratorio estamos interesados en el RP, es por eso que el grupo de tumores que estudiaremos con más profundidad corresponde a la categoría Luminal (A, B o C) de la clasificación molecular del CM, considerando negativos a aquellos tumores sin expresión de RP. CATEGORÍA DEFINICIÓN FREC ABS % LUMINAL A LUMINAL B LUMINAL C TOTAL LUMINALES HER-2 TRIPLE NEGATIVO TOTAL RRHH(+); ki-67<14% RRHH(+); ki-67>14% RRHH(+); HER-2 (+); cualquier ki-67 47 37 21 105 16 19 140 44,76 35,24 20,00 75,00 11,43 13,57 100,00 RRHH(-);HER-2 (+), cualquier Ki67 RRHH(-);HER-2 (-), cualquier Ki67 Tabla 3.1: Distribución de pacientes según la clasificación molecular del CM. Cuando analizamos a los carcinomas luminales por separado (RE y/o RP +/- HER-2) nos encontramos con 6 posibles escenarios resumidos en la tabla 3.2, todos ellos englobados dentro de la categoría LUMINAL pero ciertamente con diferencias biológicas importantes. 1 2 3 4 5 6 RE + + + + RP + + + + HER-2 + + + - FREC. ABS 3 0 12 5 21 157 % 1,52 0,00 6,06 2,53 10,61 79,29 Tabla 3.2: Distribución de pacientes categorizados como luminales Podemos observar que un 80% de las pacientes coexpresan ambos receptores hormonales solos; y si sumamos a aquellos con sobreexpresión de HER-2 llegan al 90%. Dentro del 10% restante hay sólo un 1,5% de pacientes sin RE y un 8% sin RP. 65 4. Clasificación de las pacientes según su proporción de isoformas de RP (WB). Correlaciones entre isoformas de RP y factores pronósticos. Contamos con la determinación de las isoformas del RP de 282 pacientes, de las cuales un 21,28% (n=60) resultaron negativas para el RP (valores concordantes con aquellos determinados por IHQ). Del 79% de pacientes con RP (+) la distribución según sus isoformas es la siguiente: la RPA (≥1.2) está representada por un 52,25% (n=116), las RPB (≤0.83) están representadas por un 28,83% (n=64) y las equimolares (entre 1.19 y 0.84), por un 18,92% (n=42). Datos resumidos en la Figura 4.1. A EQUI 19% RP (-) 21% RP (+) 79% RPB 29% RPA 52% B RPB RPA˂RPB RPA RPA˃RPB RPA=RPB RPA˂RPB Tumores RPA Tumores EQUI Tumores RPB RPA/RPB≥1.2 RPA/RPB <1.2 y >0.84 RPA/RPB≤0.83 Figura4.1: Distribución porcentual de pacientes según la isoforma de RP predominante. A) Gráfico de torta representando los porcentajes de RP (+) y RP (-), y dentro de los RP (+) la distribución del perfil de isoformas, B) Definición de los intervalos de RP para la categorización del perfil de isoformas y WB representativo de una paciente de cada grupo (RPA, EQUI y RPB). 66 Las pacientes RP (-) de nuestra población representan un 21% del total. Se presentan al diagnóstico con una media de edad de 57 años (rango: 24- 92), casi 5 años antes que las pacientes con RP (+). Con respecto a los antecedentes familiares, un 18% poseen familiares de 1er y 2do grado con carcinomas mamarios o de ovario; y hasta un 13% de estas pacientes tiene tumores recurrentes (<10 años entre ambos eventos). Con respecto al estadio clínico al momento del diagnóstico, un 54% se presentan con enfermedad avanzada (estadio IIb, IIIa, IIIb, IIIc y IV) lo que conlleva tratamientos más agresivos y un peor pronóstico. De las características histopatológicas, vale la pena remarcar que un 70% de los tumores son de alto grado. Según la expresión del RE, HER-2 y ki-67 para configurar los subtipos moleculares, la distribución de los mismos es la siguiente: un 19% son luminales (2% luminal A, 6% luminal B y 11% luminal C), un 35% son HER-2 (+) y el 45% restante pertenece al grupo de tumores denominados triple negativos. Dentro de los pacientes RP (+) podemos distinguir 3 grupos de pacientes según su perfil de Isoformas: RPA, EQUI Y RPB definidos anteriormente. Las pacientes cuyos tumores se clasifican como equimolares corresponden a valores que se encuentran entre RPA y RPB, y presentan las siguientes características clínico- patológicas: la media de la edad de presentación es de 63 años (rango: 34- 92), poseen un 20% de antecedentes familiares y un porcentaje similar de recurrencias de 20%. En cuanto a la estadificación clínica, el 65% de las pacientes se presenta en estadios tempranos y potencialmente curables quirúrgicamente (EI, y EIa) con tumores menores de 2cm y axila negativa. En cuanto a la morfología de las lesiones encontradas es destacable la presencia de lesiones in situ, siendo exclusivas de pacientes con perfil equimolar (de 222 pacientes RP (+), las 5 lesiones de CDIS son equimolares). Con respecto a la expresión de receptores hormonales, hay dos hechos llamativos: no existen pacientes con RE 0%, y hay una gran proporción de pacientes que sobre-expresan HER-2 también (21%). Para el marcador de proliferación ki-67, existe un predominio de lesiones altamente proliferativas (60%) por sobre aquellas con bajos índices de proliferación (40%). 67 RPA RPB % (n) % (n) % RP (+) 52,25 28,82 N 116 64 EDAD rango media 33- 96 63 29- 86 59 ANTECEDENTES FAMILIARES 26,7 (23) 18,1 (6) % DE RECURRENCIAS 2NDO PRIMARIO 6 (7) 4,3 (5) 9 (3) 6 (2) TAMAÑO TUMORAL NP <2 2-5 >5 O MULTIFOCAL 1 (1) 48,4 (48) 42,4 (42) 8 (8) 0 16,3 (9) 62 (34) 22 (12) AXILA COMPROMETIDA 53,2 (49) 51,3 (19) SUBTIPO HISTOLÓGICO IC NST ILC SS 81,2 (91) 12,5 (14) 6,2 (7) 81 (47) 8,6 (5) 10,3 (6) NPI 1 2 3 40,9 (36) 39,7 (35) 19,3 17) 30,4 (14) 39,1 (18) 30,4 (14) RE 0 1- 25 26- 50 51- 75 76- 100 1 (1) 11,2 (12) 3,7 (4) 17,7 (19) 66,3 (71) 1,9 (1) 13,4 (7) 7,7 (4) 21,1 (11) 55,7 (29) RP 0 1- 25 26- 50 51- 75 76- 100 0 20,3 (22) 10,1 (11) 20,3 (22) 49 (53) 0 34,6 (18) 25 (13) 7,7 (4) 32,7 (17) 68 ki-67 <14% >14% 74,13 (43) 25,86 (15) HER-2 POSITIVO 5,9 (6) 30,43 (7) 69,56 (16) 16 8) Tabla 4.1: Características clínico patológicas de la totalidad de las pacientes RPA y RPB. Dentro de los parámetros clínicos analizados nos focalizamos en especial en aquellos que poseen valor pronóstico independiente, ya que predicen el curso de la enfermedad una vez que está instalada. Es importante aclarar que vamos a profundizar el análisis únicamente en aquellos grupos de pacientes catalogados como RPA o RPB. Las variables evaluadas y sus resultados son los siguientes: 1. En primer lugar observamos que la media de la edad de presentación de las RPB (rango: 29- 86, media: 59 años) es 4 años menor que la media de las RPA (rango: 33- 96, media: 63 años). En la figura 4.1 se grafica dicha diferencia, si bien la diferencia no alcanza una diferencia significativa se observa una tendencia con un p= 0.1768. EDAD Edad a la 1era consulta 100 80 60 40 RP A RP B 20 Figura 4.1: Gráfico comparativo de la media de la edad de presentación, y el rango de edades de presentación de la enfermedad. 69 2. Con respecto a la incidencia de antecedentes familiares de 1er y 2ndo grado de cáncer de mama y ovario en ambos grupos de pacientes, no hallamos diferencias remarcables: la incidencia de antecedentes en las RPA es de aproximadamente un 26% y en las RPB de un 20%. 3. Tres son los elementos que componen la estadificación clínica (TNM): Tumor, N o axila y Metástasis. En el único de los componentes que vemos diferencias significativas, tomando cada uno como variable independiente es en el tamaño tumoral (T). Al respecto se observa que el grupo de pacientes RPB se presenta con tumores de mayor tamaño, y acompañado en su mayoría de compromiso ganglionar, si bien por separado la incidencia de esto último no es significativa. Es importante destacar también que cuando los tumores son <2cm en el grupo RPB, más del 50% se acompaña de compromiso axilar. Cuando analizamos los dos intervalos extremos de los tamaños tumorales (figura 4.2), observamos diferencias estadísticamente significativas a favor de tamaños <2cm para los RPA y >5cm para los RPB. TAMAÑO TUMORAL RPA (n = 99) RPB (n = 55) % de pacientes 80 * 60 *** 40 *** 20 cm > 5 cm -5 2 < 2 cm np 0 * p=0.0285 *** p=0.0001 Figura 4.2: Distribución porcentual de los tamaños tumorales según isoforma. Los intervalos utilizados son los mismos que se utilizan en el sistema TNM. Chi2 *: p= 0.0285, *** p= 0.0001 70 4. En cuanto a la evaluación de variables pronósticas de tipo histopatológicas se contemplaron tanto el subtipo histológico como el NPI (VER RESULTADO 2). En la tabla 4.2 se resume la distribución porcentual según cada isoforma. RPA % RPB % SUBTIPO HISTOLÓGICO DCIS IC NST ILC CARCINOMA MUCINOSO CARCINOMA PAPILAR CARCINOMA TUBULAR CARCINOMAMETAPLÁSICO 0 91 14 2 2 2 0 0,00 81,98 12,61 1,80 1,80 1,80 0,00 1 47 5 3 2 0 1 1,69 79,66 8,47 5,08 3,39 0,00 1,69 GRADO HISTOLÓGICO 1 2 3 9 35 44 10,23 39,77 50,00 1 12 33 2,17 26,09 71,74 36 40,91 39,77 19,32 14 30,43 39,13 30,43 NOTTINGHAM 1 (bajo) 2 (moderado) 3 (alto) 35 17 18 14 Tabla 4.2: Distribución de los subtipos histológicos especiales (WHO) según las Isoformas RPA y RPB. No hay grandes hallazgos a nivel morfológico en cuanto al subtipo histológico, pero sí se observa un predominio de lesiones menos diferenciadas en las muestras RPB. En la Figura 4.3 se grafican comparativamente el grado de diferenciación de tumores RPA y RPB. 71 GRADO HISTOLÓGICO * % de pacientes 80 RPA n=88 RPB n=46 60 p=0.1306 40 20 p=0.1633 3 2 1 0 * p=0.0617 Figura 4.3: Distribución de pacientes RPA y RPB según su grado de diferenciación: 1, bien diferenciado, 2, moderadamente diferenciado y 3, pobremente diferenciado. Chi2 *: p=0.0617 Después de evaluar los factores pronósticos clínicos, continuamos evaluando los 4 marcadores utilizados en la práctica, para seleccionar el tratamiento de las pacientes. En la tabla 4.3 se resumen los porcentajes relativos de expresión de cada uno de los marcadores, HER-2 y ki-67. RPA RPB 1 11,2 3,7 17,7 66,3 1,9 13,4 7,7 21,1 55,7 0 20,3 10,1 20,3 49 0 34,6 25 7,7 32,7 RE 0 1- 25 26- 50 51- 75 76- 100 RP 0 1- 25 26- 50 51- 75 76- 100 72 HER-2 (+) 5,9 16 74,13 25,86 30,43 69,56 ki-67 <14% >14% Tabla 4.3: Porcentajes relativos de expresión para RE, RP, ki-67 y HER-2 según las Isoformas RPA y RPB. Es destacable que el grupo RPB posee menores niveles en general, de ambos receptores hormonales, siendo más marcada la diferencia para el RP (figura 4.4). Además el grupo de tumores PRB, posee sobre-expresión de HER-2 (figura 4.5) y mayores niveles de proliferación (figura 4.6). RECEPTOR DE PROGESTERONA % de pacientes 60 p=0.0617 RPA n=108 RPB n= 52 p=0.078 40 * p=0.0652 20 1% -2 5% 26 % -5 0% 51 % -7 5% 76 % -1 00 % 0% 0 * p=0.0192 Figura 4.4: Distribución de pacientes RPA y RPB según los intervalos de expresión del RP. Chi2 *: p=0.0192. 73 HER-2 % de pacientes 20 * RPA n=101 RPB n=50 15 10 5 RP B RP A 0 *: p=0.0449 Figura 4.5: Distribución de pacientes RPA y RPB según la sobreexpresión de HER-2. Chi2 *: p=0.0449 KI-67 25 *** % ki-67 20 RPB n=12 RPA n=23 15 10 5 B RP RP A 0 *** p= 0.0010 Figura 4.6: Distribución de pacientes RPA y RPB según su índice de proliferación (ki-67 <14% o >14%). Chi2 ***: p=0.0010 74 a. Evolución de las isoformas en las recurrencias o metástasis Al día de la fecha contamos con 7 pacientes de las cuales tenemos sus biopsias en forma evolutiva, es decir, tenemos tanto sus tumores primarios como las recurrencias. Si descartamos aquellos casos donde no pudimos obtener algún resultado de WB durante su evolución contamos con 4 casos completos: 2/4 negativos y 2/4 RPA. Si bien es un número bajo de pacientes como para poder sacar conclusiones, nos permitirá en un futuro al aumentar la casuística, evaluar la variación que presenta la proporción de Isoformas en su evolución clínica. A su vez, contamos con los datos de factores pronósticos clásicos obtenidos del taco de parafina, y con la descripción histomorfológica. En la Tabla 4.4 se resumen los datos de las pacientes con recurrencias de las cuales tenemos datos de WB. En cuanto a evolución, se observa que una paciente RP (-) y una RPA tuvieron un tiempo a la recurrencia menor a 18 meses, lo que sugiere tumores biológicamente muy agresivos, o de presentación en enfermedad avanzada. Las otras dos pacientes, una negativa y una RPA, tuvieron recidivas con intervalos de tiempo mayores a 45 meses (casi 4 años). A la fecha (noviembre de 2015) ambas pacientes RPA fallecieron con sobrevidas de 5 y 1,5 años, y ambas pacientes RP (-) se encuentran vivas. Tenemos que tener en cuenta que, una de las pacientes RP (-) exhibe 90% de RE y también sobre-expresión de HER-2, lo que le otorga a la paciente mejores posibilidades terapéuticas. En cuanto a la evolución del RP, 1 de 4 pacientes pasó de negativo a positivo; el resto de las pacientes conservaron el status del RP: la paciente negativa continuó siéndolo, y de las dos RPA, una de ellas mantuvo su perfil de isoforma mientras que la otra cambió su categoría hacia RPB. 75 PACIENTE 1era CX # WB RE RP HER-2 ki-67 2nda CX # Localización anatómica WB RE RP HER-2 ki-67 3ra CX # 1 25/11/2008 61 NEG 0 0 NEG N/E 25/02/2010 143 2 06/01/2009 69 RPA 85 85 NEG N/E 19/06/2012 247 3 10/06/2010 158 RPA 30% 10% 2+ (fish neg) 16,00 N/E Prolongación axilar RPB N/E N/E N/E N/E RPB 85 25 NEG 21,71 30/11/2010 179 4 16/03/2010 145 NEG 95 0 3+ 14,11 09/09/2014 348 Multifocal al momento del MD y metástasis diagnóstico, MI en axila izquierda RPA 30% 8% N/E N/E NEG 95 0 3+ 7,11 18/02/2014 319 Localización anatómica Tórax WB3ra RE RP HER-2 ki-67 RPB 95% 80% NEG 49,35 Tabla 4.4: Evolución de WB y factores pronósticos evaluados por IHQ en 4 pacientes con recurrencias. De las pacientes nº1, 3 y 4 tenemos 2 muestras de las cuales se muestran sus datos de forma evolutiva. De la paciente nº 2 tenemos 3 muestras. Se especifican los valores de los datos de WB, RE, RP, HER-2 y ki-67, además de la fecha de la cirugía y la localización anatómica. A modo de resumen de esta sección de la tesis donde se analizaron parámetros clínicos clásicos y su relación con el perfil de expresión de las isoformas de RP, podemos decir que aquellas pacientes cuyos tumores expresan mayores niveles de RPA se acompañan de característicos clínicas asociadas a buen pronóstico. 76 5. Análisis de la correlación existente entre la proporción de isoformas del RP y la respuesta ex vivo de carcinomas mamarios tratados con MFP. En la evaluación de la sensibilidad a la MFP sobre muestras frescas de pacientes se comenzó utilizando el método de cultivo primario, con el cual se ensayaron 70 muestras y se obtuvieron resultados evaluables solamente en 7 (11.4%) pacientes, a pesar que se intentaron diversos protocolos de cultivo en adherencia en plástico, en matrigel o en mamoesferas. Adaptando una tecnología utilizada en neurociencias se puso a punto la técnica de cultivos tisulares mediante el uso de un chopper 128 (detallada en Materiales y Métodos). Con esta técnica se incuban lonjas de 100 µm de espesor, en presencia o no del antiprogestágeno. Luego de 48 hs de tratamiento, los fragmentos de tejido son fijados y embebidos en parafina para luego obtener una H&E y realizar cortes en blanco. Con esta última técnica, logramos una eficiencia aproximada del 45%. Es necesario destacar que la evaluación completa de la sensibilidad a MFP en las muestras humanas se compone de tres técnicas: a) el cultivo ex vivo (chopper) del tejido fresco obtenido de la cirugía, b) el WB realizado con la porción de la muestra que se congela a -70° ni bien se extrae en la cirugía y c) la evaluación de la viabilidad celular con H&E, técnica de IHQ para ki-67 y posterior cuantificación de esta última. Por otro lado, también es importante destacar que cuando se realiza el cultivo no se tiene información previa de la presencia o no de receptores hormonales, o del tipo de muestra que se está procesando. La selección del fragmento destinado al cultivo, se realiza dentro del quirófano teniendo en cuenta como parámetro único, las características macroscópicas de la muestra. Esto último también es uno de los motivos por los cuales disminuye la eficiencia de la técnica, ya que en principio es realizada “a ciegas”. Sin embargo y debido a que no hay criterio de selección para incluir la muestra en el testeo de la sensibilidad a MFP, hemos procesado muestras sin receptores hormonales que se inhiben de forma significativa. En la Figura 5.1a se muestra un ejemplo representativo de las imágenes de H&E y de las IHQ de Ki-67 de los cortes de muestras control o incubadas con MFP 10 nM de una muestra representativa RPA+ y en la Figura 5.1b se muestra un ejemplo representativo de una muestra RPB+. 77 5.1a A) B) * *p=0.0303 C) Figura 5.1a Ejemplo representativo de un cultivo tisular de un paciente RPA+. A. Cuantificación de Ki-67 (células positivas/ células totales) del área total de la muestra cuyas imágenes representativas se muestran en C; *: p=0.0303.B. WB de las isoformas A y B del RP en extractos nuclear (N) y citoplasmático (C) de una muestra representativa. C, arriba: H&E de un cultivo tisular de un carcinoma de mama (IC–NST) bien diferenciado creciendo en condiciones control y tratado con MFP (muestra #246), barra: 50 µm; abajo: Microfotografías ejemplificando la expresión de Ki-67 en cortes de explantos en condiciones control o tratados por 48 hs con MFP; barra: 100 µm. 78 5.1b A) * B) *p=0.0136 C) Figura 5.1b Ejemplo de un cultivo tisular de un paciente RPB+. A. Cuantificación de Ki-67 (células positivas/ células totales) del área total de la muestra cuyas imágenes representativas se muestran en C; *: p=0.0136. B.WB de las isoformas A y B del RP en extractos nuclear (N) y citoplasmático (C) de esta muestra que se estimuló con tratamiento de MFP. C, arriba: H&E de un cultivo tisular de un carcinoma de mama (IC –NST) bien diferenciado creciendo en condiciones control y tratado con MFP (muestra #319), barra: 50 µm; abajo: Microfotografías ejemplificando la expresión de Ki-67 en cortes de explantos en condiciones controlo tratados por 48 hs con MFP; barra: 100 µm. 79 Para medir la respuesta a MFP tomamos en cuenta dos parámetros: la tasa de proliferación comparada entre tratados y controles (calculada mediante el índice de ki-67) y la proporción de isoformas del RP (calculada haciendo la relación entre el valor de la isoforma A y la isoforma B). En la tabla 5.1 se muestran los valores de Ki-67 obtenidos en las 19 muestras RPA analizadas. El índice que se muestra es el cociente entre el valor de la media del Ki-67 del control y el tratado. Este número refleja la sensibilidad de cada muestra analizada frente al antiprogestágeno MFP. Observamos que en la totalidad de los casos RPA hubo una significativa diferencia en la tasa de proliferación cuando comparamos los controles y los tratados. Es importante destacar que cuanto mayor es el índice mejor es la respuesta de MFP, ya que estamos mostrando el cociente entre el índice de proliferación del control y el del tratado. Cuando se analizaron los valores en las 10 muestras RPB (Tabla 5.2), se observó que mientras en 3 casos las respuestas fueron inhibitorias al igual que las RPA, en dos de ellas se observó un aumento de proliferación (índice <1). Es importante destacar que las muestras antes mencionadas corresponden a la misma paciente, representando enfermedad recurrente. Cuando evaluamos las 4 muestras equimolares, sólo en una de ellas se observó una inhibición significativa (Tabla 5.3). Como habíamos mencionado anteriormente, cuando cultivamos las muestras lo hacemos sin conocer el estado de los receptores hormonales, es por eso que se estudiaron también muestras RP negativas. Uno de los 3 casos RP (-) evaluados, inhibió su proliferación con MFP (Tabla 5.4). Curiosamente esta muestra mostró un 100% de marcación para el RA. Esta observación sugiere que sería interesante investigar los efectos de MFP sobre muestras RA positivas y negativas para investigar si el efecto antiandrogénico de MFP induce inhibición de la proliferación celular. 80 Muestra índice Ki-67 Subtipo histológico NPI RE RP KI-67 HER-2 RA RG 242 2.18* ICNST 5 35% 25% n/e neg N/E N/E 245 2.11* ICNST 6 90% 75% 4,27 neg N/E 0 246 2.13* ILC NC 100% 100% 7,29 neg 0 80 252 3.03* ICNST 9 95% 70% 35,95 neg 50 30 260 4.33* ICNST 7 5% 5% 9,84 neg 1 30 262 2.00* ICNST 7 85% 45% n/e neg N/E N/E 273 2.5* ICNST 5 95% 95% 37,50 neg 5 30 284 2** ILC NC 90% 80% 24,76 neg 2 60 286 1.82* ICNST 3 80% 85% 8,21 neg 10 12 300 1.45** ICNST 7 95% 95% 7,89 neg 90 15 301 2* ICNST 4 85% 5% 14,52 neg 60 0 305 1.76* ICNST 5 100% 95% 6,69 neg N/E 25 315 1.706* ICNST 8 2% 5% 7,04 neg 0 N/E 323 2.08* ICNST 8 80% 100% 12,94 N/E 70 0 327 1,69* ICNST 6 95% 95% 10,48 neg N/E 0 328 1.52** ICNST 8 100% 90% 17,83 neg N/E N/E 336 1.46* ILC NC 70% 5% 8,90 neg N/E N/E 345 1.9* IC NST 9 2% 6% 25,60 neg 25 N/E 363 2.05* CARCINOMA TUBULAR 3 75% 80% 5,20 neg 70 0 Media ± SD 2.09 ± 0.65 Tabla 5.1: Índice de Ki-67 (Control/tratado) en muestras de pacientes RPA+. *: p<0.05; **: p<0.01 Mann Whittney test, control vs tratado con MFP. 81 Muestra índice KI-67 Subtipo histológico NPI RE RP KI-67 HER-2 RA RG 240 3* ICNST 6 65% 5% 15,16 3+ 35 0 247 0.73* ICNST 8 85% 25% 21,71 neg 50 5 266 1.56 ILC NC 90% 65% 22,31 neg 60% 65 267 0.99 ICNST 6 98% 95% 30,97 neg 50 40 307 1.04 ICNST 9 0% 2% 46,79 neg 0 10 316 1.46* MUCINOSO 5 75% 45% 0,92 neg 0 0 319 0.71* ICNST 9 95% 80% 49,25 neg 0 0 331 0.97 ICNST 8 N/E N/E N/E neg N/E N/E 355 1.82* IC NST 7 100% 90% 25,00 neg N/E N/E 369 1.45 IC NST 6 60% 20% 40 neg N/E N/E Media ± 1.37 ± 0.68 SD Tabla. 5.2 Índice de Ki-67 (Control/tratado) en muestras de pacientes RPB+. *: p<0.05; **: p<0.01 Mann Whittney test, control vs. tratado con MFP. 82 Muestra índice KI-67 Subtipo histológico NPI RE RP KI-67 HER-2 RA RG 249 1.32 ICNST 8 100% 85% 5,16 neg N/E N/E 259 1.71** ICNST 6 95% 85% 15,63 neg 0 0 285 1.66 ICNST 6 80% 95% 15,26 3+ 70 50 302 1.57 ICNST 5 75% 3% 8,13 3+ 0 0 Media ± 1,56 ± 0.17 SD Tabla 5.3: Índice de Ki-67 (Control/tratado) en muestras de pacientes Equimolares. **: p<0.01 Mann Whittney test, control vs tratado con MFP. Muestra índice KI-67 Subtipo histológico NPI RE RP KI-67 HER-2 RA RG 241 1.26 ICNST 4 0% 0% 12,96 3+ 10 20 348 2.02* ICNST 8 95% 0% 7,77 3+ 100 0 360 1.02 ICNST 7 95% 0% 16,80 N/E N/E N/E Media ± 1.43 ± 0.5 SD Tabla 5.4: Índice de Ki-67 (Control/tratado) en muestras de pacientes RP (-). *: p<0.05; **: p<0.01 Mann Whittney test, control vs tratado con MFP. 83 En resumen, en la Tabla 5.5 se muestra el número de casos en los cuales se obtuvo inhibición y a su vez se muestra la media +/- DS del índice de Ki-67 del grupo. Se puede observar claramente que el grupo RPA se favorece con el tratamiento con MFP mientras que en los otros 3 grupos las respuestas son muy variables pudiéndose observar inclusive estimulaciones frente al tratamiento con MFP. Queda por explorar porqué algunas muestras del grupo RPB, equimolar o sin expresión de RP se inhiben con MFP y el papel de los otros receptores hormonales. En la Figura 5.2 se muestra un ejemplo de una de las muestras sin expresión del RP, pero con 95% de expresión de RA (#348) que se inhibió con el tratamiento con MFP. Respuesta a la MFP Inhibiciones Estimulaciones Casos/total Casos/total RPA 19/19 a 0/19 2.09 ± 0.65c RPB 3/10 b 2/10 1.37 ± 0.68d Equi 1/4 0/4 1.37 ± 0.68 Neg 1/3 0/3 1.43 ± 0.5 Índice: Ki-67 Tabla 5.5: Resumen de la respuesta a MFP por isoforma. X2 global: p= 0.0002; a vs b: p<0.0001 Fisher´s exact test; c vs. d: p=0.0014 Mann Whitney test. #348 RE RP RA Figura 5.2: Ejemplo de muestra RP negativa (#348) con alta expresión de RA que mostró inhibición significativa frente al tratamiento con MFP. De izquierda a derecha se muestra la expresión de RE (95%), RP (0%) y RA (100%); barra: 50 µm. 84 En la Figura 5.3 se muestran los gráficos individuales de cada tumor control y tratado con MFP de los grupos RPA y RPB. Tumores RPB 50 50 40 40 índice Ki-67 índice Ki-67 Tumores RPA 30 20 30 20 10 10 0 0 Control Control MFP MFP Figura 5.3. Respuesta a la MFP de muestras de pacientes PRA+ (n=19) y pacientes RPB+ (n=10). Se muestran los casos individuales de la cuantificación de la media de Ki-67 en los cultivos control y la media del Ki-67 de los cultivos tratados con MFP, para cada muestra de paciente. Se realizó un t de Student para muestras pareadas y la diferencia es significativa para el grupo RPA+ (p<0.0001 no así para el RPB (p=0.38). En el análisis de las muestras NO RPA [RPB, EQUI y RP (-)] sometidas a MFP observamos respuestas muy heterogéneas. Se conoce el efecto de este antiprogestágeno sobre los RA y RG por lo que completamos el estudio de estas pacientes ponderando estos receptores. En la Tabla 5.6 se muestra la distribución de expresión nuclear de RA y RG en las subpoblaciones RPA y RPB. Categorizamos a estos receptores en: 1) negativo, 2) baja expresión (1-50%) y 3) alta expresión (>50%). Si bien no vemos 85 diferencias significativas cuando tomamos las pacientes en su totalidad, no descartamos que cada caso en particular posea un aporte diferente de estos otros receptores frente a la respuesta a la MFP. RPA RA 0% 1-50% 51-100% RPB n % 5,00 33,33 7,00 46,67 3,00 20,00 43,24 6,00 42,86 14,00 37,84 5,00 35,71 7,00 18,92 3,00 21,43 n 13,00 14,00 13,00 % 32,5 35 32,5 16,00 RG 0% 1-50% 51-100% Tabla 5.6: Distribución de pacientes según sus niveles de expresión de RA y RG, en poblaciones RPA y RPB. Por último, analizamos la expresión de los 4 receptores RE, RP, RA y RG, de forma comparativa en los grupos RPA y RPB, pero no observamos diferencias significativas. Lo único destacable es que la población de pacientes RPA posee el doble de pacientes con estas características cuando se compara con las pacientes RPB; siendo la frecuencia de 12% para los RPA y 6% para los RPB. Podemos concluir que la isoforma A del RP es la responsable de la sensibilidad al tratamiento con el antiprogestágeno MFP. Sin embargo, por los hallazgos observados en las pacientes sin RP, RPB o equimolares podemos hipotetizar que, donde RPA no es la isoforma predominante o directamente no está presente, el efecto inhibitorio de la MFP se podría deber a la acción de la droga sobre otros receptores hormonales, tales como RA y RG. 86 N (%) EDAD RANGO MEDIA RPA % RPB 19 57,5 10 37- 80 55,7 % 30,3 44- 68 58,8 3 30 21,05 4 40 0 63,16 26,32 0 10,53 0 3 3 5 0 0 30 30 11 57,89 4 40 IC- NST ILC SS 15 78,95 15,79 5,263 8 1 80 10 10 1 2 3 2 4 13 10,53 21,05 68,42 0 0 10 100 0% 1%- 25% 26%- 50% 51%- 75% 76%- 100% 0 4 1 1 13 0 21,05 5,263 5,263 68,42 1 0 0 3 4 10 0 0 30 40 0% 1%- 25% 26%- 50% 51%- 75% 76%- 100% 0 6 1 2 10 0 31,58 5,263 10,53 52,63 0 4 1 1 4 0 40 10 10 40 ANTECEDENTES FAMILIARES DE CM 5 PACIENTES CON RECURRENCIA 4 0 12 5 0 2 TAMAÑO TUMORAL NP (no palpable) <2CM 2- 5CM >5CM N/E AXILA COMPROMETIDA 26,32 50 0 SUBTIPO HSTOLÓGICO 3 1 1 GH 0 0 RE RP 87 KI-67 <14% >14% 14 5 73,68 26,32 2 7 20 70 POS 0 0 1 10 HER-2 Tabla 5.6: Características clínico- patológicas de las pacientes evaluadas en su sensibilidad a MFP 88 Selección y análisis de la expresión diferencial de genes regulados por una u otra isoforma. El objetivo principal de esta parte del trabajo consistió en seleccionar un grupo de genes candidatos que sean fácilmente medibles por IHQ, y que nos permitan predecir la isoforma predominante. Habiendo previamente validado a la RPA como biomarcador de la sensibilidad a antiprogestágenos, hicimos un extenso trabajo de selección de genes basándonos en estudios de otros grupos de trabajo y en los propios. Dichos genes debían tener, como condición sine qua non, anticuerpos disponibles para uso en técnicas de IHQ. Selección de genes a partir de datos bibliográficos Se conoce que las diferentes isoformas del RP regulan un diferente set de genes. Richer y col. realizaron microarrays de expresión génica de células T47D con expresión de una u otra isoforma de RP solamente, T47DYA y T47DYB. Observaron que de un total de 94 genes regulados por Pg, 65 estaban regulados exclusivamente por la RPB, 4 estaban regulados por RPA y 25 estaban regulados por ambas isoformas91. A pesar de que en condiciones fisiológicas la expresión de las isoformas es siempre conjunta, consideramos que fue un buen punto de partida para seleccionar genes candidatos. Por otra parte, Brayman y col demostraron en un modelo de células epiteliales uterinas la asociación entre la expresión de RPB y la expresión de MUC-1 93. El listado de genes candidatos seleccionados de la bibliografía para esta sección de la tesis se resumen en la Tabla 6.1. GEN Función Regulado por BCL-xl Proteína Anti apoptótica RPA NDRG1 Es un factor relacionado RPB con N-Myc y su señalización downstream. HEF-1 Adhesión celular RPA ERR- Factor de Transcripción RPA 89 MUC-1 Mucina de superficie RPB STAT5/ pSTAT5a Factor de transcripción RPB c-EBP Factor de Transcripción RPB ITGA-6 Adhesión celular RPB Tabla 6.1. Lista de genes tomados de datos bibliográficos, regulados de forma diferencial por las isoformas del RP. Se especifica la función de cada gen y qué isoforma lo regula de forma preferencial. Selección de genes candidatos a partir de RNAseq de un set de nuestras pacientes RPA vs RPB Se secuenciaron un total de 16 pacientes, 9 RPA y 7 RPB. Del total de muestras 2 de ellas fueron excluidas del análisis por diferencias en la calidad del RNA, una RPA (#246) y una RPB (#209). Una vez que se excluyeron las muestras con baja calidad de RNA, se realizó un análisis detallado utilizando el algoritmo EBSeq y se hallaron 140 transcriptos diferencialmente regulados por las isoformas: 55 de ellos regulados positivamente en RPA y 85 en las RPB. Posteriormente, utilizando tres algoritmos diferentes: EBSeq, baySeq y edgeR (Figura 6.1), se ponen en evidencia 3 nuevos candidatos que sobresalen de los demás y se tendrán en cuenta para validar en nuestra población de pacientes: MUC2, CRISP3 Y FCRLB. Este último gen corresponde a una fracción de Fc receptor-like de Linfocitos B que no posee anticuerpo para su determinación por IHQ. 90 Figura 6.1: Diagrama de Venn mostrando los genes más sobreexpresados que tienen en común los 3 análisis realizados (EBseq, baySeq y edgeR). Dado que cuando estudiamos las muestras por RNAseq las elegimos según el WB y la expresión de RP por IHQ sin conocer los datos de la historia clínica, decidimos analizar estos pacientes para seleccionar un subgrupo de pacientes más homogéneos en cada grupo. En la tabla 6.2 se resumen los datos clínico- patológicos de todas las pacientes secuenciadas, sin aplicar ningún criterio de exclusión. 91 WBn WBc ISOFORMA # EDAD PRIMARIO VS. RECURRENCIA ESTADIO SUBTIPO HISTOLÓGICO Nottingham (NPI) 0,66 0,66 0,75 0,39 0,69 0,14 0,67 1,2 N/E 3,36 2,32 1,83 2,5 2,3 2,2 4,8 0,66 0,66 0,75 0,84 0,56 X: RPB X: RPB X: RPB X: RPB X: RPB X: RPB X: RPB X: RPA X: RPA X: RPA X: RPA X: RPA X: RPA X: RPA X: RPA X: RPA 10 12 13 52 56 189 209 92 126 157 176 206 217 228 245 246 29 77 49 62 56 86 54 96 57 57 72 72 79 45 48 70 PRIMARIO N/E N/E N/E N/E RECURRENCIA PRIMARIO PRIMARIO PRIMARIO PRIMARIO PRIMARIO PRIMARIO PRIMARIO PRIMARIO PRIMARIO PRIMARIO N/E N/E N/E N/E IIA I IIA IIA IIA IIB IIIA IIIB IIIB I I I ICNST ICNST ICNST ICNST ICNST ICNST ICNST ICNST ICNST ICNST ILC ICNST ICNST ICNST ICNST ILC 7 7 4 3 6 4 6 6 6 6 7 8 6 5 6 7 0,5 3,20 1,21 3,8 1,37 0,92 1,54 1,4 2,14 Tabla 6.2: Características clínicas e histopatológicas de todas las pacientes estudiadas con RNAseq. 92 RE RP 75% 50% 85% 80% 85% 95% 90% 90% 95% 95% 60% 25% 70% 60% 95% 95% 80% 85% 95% 95% 80% 60% 90% 85% 90% 45% 95% 25% 90% 75% 100% 100% HER-2 neg neg 3+ 3+ neg neg neg neg neg neg neg neg 3+ 3+ neg neg Del análisis de los datos clínicos e histopatológicos surgen otros criterios de exclusión: 1. Datos clínicos relevantes Pacientes premenopáusicas: son pacientes con un background hormonal muy diferente. Son las muestras #10, #13,#217 y #228 La #217 posee un tamaño tumoral muy grande y un estadio avanzado 2. Evaluación Histológica y factores pronósticos En cuanto al subtipo histológico, las muestras #176 y 246 son las únicas diferentes. Son carcinomas lobulillares y el resto (tanto las muestras RPA como las RPB) son ductales. En cuanto al grado histológico hay una variedad entre bajo, moderado y alto. En cuanto a los factores pronósticos por IHQ, llama la atención que hay 4/16muestras que son triples positivas: dos de ellas son RPA (#228 y #217) y dos son RPB (#52 y #13). Teniendo en cuenta estos criterios se excluyeron las siguientes muestras: #176, #217, #228, #13 y #52. Finalmente, considerando todos los criterios de exclusión anteriormente explicados nos quedamos con 9 muestras, 5 RPA y 4 RPB. Los datos crudos del RNASeq de estas pacientes se analizaron con el script del PAM-50 (plataforma genética utilizada actualmente en la clínica para la clasificación de subtipos moleculares y para la predicción del riesgo a la recaída). En la Figura 6.2 se muestra un mapa de calor con tres sectores para analizar información. En la parte superior se muestran las pacientes clasificadas según su isoforma combinado con el subtipo molecular calculado con PAM-50. Se puede apreciar claramente que 4/5 pacientes catalogadas como RPA corresponden a pacientes Luminales A y que 4/4 pacientes catalogadas como RPB corresponden al subtipo Luminal B. 93 Figura 6.2: PAM-50 en 9 muestras catalogadas según su perfil de isoformas (5 RPA y 4 RPB) A la derecha se enumeran los 50 genes en los que se basa la plataforma genética, y específicamente en rojo aquellos que se correlacionan con proliferación. Por último, en la parte inferior, se puede discernir cada una de las pacientes y su riesgo de recaída, siendo MR: riesgo Moderado y HR: alto Riesgo. De este último análisis se desprende que aquellas pacientes catalogadas como RPA se acompañan de un perfil molecular similar al de las pacientes Luminales A, donde el riesgo de enfermedad recurrente oscila entre moderado y bajo. Acompaña este comportamiento menos 94 agresivo una menor sobreexpresión de genes de proliferación, como BIRC5 y ki-67, además de una menor sobreexpresión de HER-2. Contrariamente, aquellas pacientes RPB, conllevan un alto riesgo de recurrencia e incremento en los genes relacionados con proliferación y HER-2. 95 7. . Selección de genes candidatos. BCL-xl BCL-xl es una proteína anti apoptótica perteneciente a la familia BCL2. Esta familia de proteínas esta sobre-expresada en una gran cantidad de tumores 129. En cuanto a su relación con las isoformas del RP, está regulada por la Isoforma A, aumentando su expresión 3.2 veces 91. Cuando analizamos dicha proteína en nuestra población de muestras catalogadas según su perfil de isoformas, vimos que efectivamente hay una correlación estadísticamente significativa (p=0.0174) entre la mayor expresión de la proteína en su localización citoplasmática y la RPA. Hasta el momento hemos analizado su expresión en 35 muestras RPA y 20 RPB de las cuales contamos con valor de WB y muestra parafinada. En la figura 7.1 se grafica el score citoplasmático de BCL-xl de las pacientes con una u otra isoforma, y se ejemplifica con una micrografía de una paciente RPA (arriba) con un score de 200 y otra paciente RPB (abajo) con un score de 70. A RPA Score BCL-xl en citoplasma B BCL-XL 400 RPB (n=20) RPA (n=35) 300 200 100 * p=0.0174 RP B RP A 0 RPB Figura 7.1: A) Tumor catalogado como RPA con un score de 200 (arriba) y tumor RPB (abajo) con un score de 70; Barra: 50m; B) Dot plot del score citoplasmático de BCL-xl en tumores RPA y RPB,*: p=0.0174. 96 FGF-10 La familia de los factores de crecimiento fibroblástico (FGF) están constituidos por 22 miembros y están involucrados en desarrollo, reparación y metabolismo entre otras funciones. El FGF10 en particular señaliza mayormente a través de FGFR-2b y se sabe que tiene un rol crucial en desarrollo, enfermedad y medicina regenerativa 130 . Con respecto a su relación con el CM, se lo vincula con la iniciación de metástasis por su participación en el proceso de transición epitelio mesénquima (EMT)131,132. Según al análisis de RNAm realizado las muestras de nuestras pacientes, el fgf-10 estaría regulado de forma diferencial por la RPA, incrementado su expresión 22 veces. Hemos analizado 24 muestras RPA y 12 muestras RPB, y si bien aún la diferencia no es estadísticamente significativa (p=0.0730), existe una tendencia que acompaña los resultados del RNAseq, siendo mayor la expresión de FGF-10 en pacientes RPA. En la Figura 7.2 se grafica el score citoplasmático de FGF-10 de las pacientes con una u otra isoforma, y se ejemplifica con una micrografía de una paciente RPA (arriba) con un score de 150 y otra paciente RPB (abajo) con un score de 50. A FGF-10 300 RPA (n=24) RPB (n= 12) 200 100 ns p= 0.0730 RP B 0 RP A RPA score FGF-10 en citoplasma B RPB Figura 7.2: A) Tumor catalogado como RPA con un score de 150 (arriba) y tumor RPB (abajo) con un score de 50; Barra: 50m B) Dot plot del score citoplasmático de FGF-10 en tumores RPA y RPB, p=0.0730. 97 STAT-5 La familia de proteínas STAT está involucrada en todos los estadios del desarrollo mamario y además está implicada en la tumorigénesis mamaria 133 . STAT-5 consiste de 2 proteínas STAT5A/B, las mismas están involucradas en procesos de proliferación y diferenciación 134. Está descripto que la localización nuclear de este factor de transcripción está vinculado a buen pronóstico en tumores de tipo Luminal, y se postula que desde un punto de vista clínico, la desregulación de este factor representa un factor de riesgo 135 Con respecto a la relación entre el perfil de isoformas del RP y esta familia de proteínas, Richer y col 91 describen que RPB incrementa la expresión de STAT-5a unas 6 veces. En la figura 7.3 se grafica el score de STAT-5 y se ejemplifica una muestra RPA y un RPB (se evaluaron 25 muestras RPA y 17 RPB). Si bien la diferencia de expresión no es aún significativa, la tendencia es muy clara, con un p=0.0509. A B RPA Score STAT-5 en nucleo STAT-5 300 RPA (n=25) RPB (n=17) 200 100 ns p=0.0509 RP B RP A 0 RPB Figura 7.3:A) Tumor catalogado como RPA con un score de 30 (arriba) y un tumor RPB (abajo) con un score de 100; Barra: 50m .B) Dot Plot del score nuclear de STAT-5 en tumores RPA y RPB, ns: p=0.0509. 98 MUC-2 Las mucinas humanas (MUC) consisten de varios miembros, desde MUC-1 a MUC-21, y se clasifican en dos grandes categorías: formas secretadas o formas transmembrana. Las secretadas (MUC-2, MUC-5A, MUC-5B y MUC-6) forman una barrera física que provee protección de los epitelios que las secretan 136.Se ha reportado que el patrón de expresión de mucinas podría ser útil 137 para distinguir los orígenes de ciertos carcinomas . En particular MUC-2 se ha descripto en carcinomas mucinosos de varios sitios, incluyendo la mama 138. Con respecto a su relación con el perfil de isoformas del RP, los resultados de nuestro RNAseq arrojaron a esta mucina como uno de los genes más diferencialmente regulados por la RPB. En la figura 7.4 se grafica la diferencia entre la expresión citoplasmática de MUC-2 para muestras RPA y RPB. Se evaluaron un total de 24 muestras RPA y 14 muestras RPB, y las diferencias mostraron significancia estadística (p=0.0061) siendo más altos los scores de aquellas muestras catalogadas como RPB. A 300 RPA (n=24) RPB (n=14) 200 100 ** p=0.0061 0 RP A RPA MUC-2 RP B Score MUC-2 en citoplasma B RPB Figura 7.4: A) Tumor catalogado como RPA con un score de 90 (arriba) y un tumor RPB (abajo) con un score de 250; barra: 50m; B) Dot Plot del score citoplasmático de MUC-2 en tumores RPA y RPB, **: p=0.0061. 99 CRISP-3 La proteína CRISP-3 (cysteine-rich secretory protein 3), es una glicoproteína descripta en las interacciones presentes entre gametos masculinos y femeninos múltiples glándulas exocrinas 140 139 . Esta proteína es secretada por entre ellas páncreas y mama. Poco se sabe sobre el rol de CRISP-3 en CM; se la ha descripto entre los genes regulados por andrógenos en la próstata.141 Al igual que MUC-2, CRISP-3 resalta entre los genes más regulados entre las isoformas, sin embargo el análisis de las muestras RPA (n=25) y RPB (n=12) no mostraron diferencias significativas (p=0.1700; figura 7.5.) Sin embargo, fue llamativo que cuando hicimos la estratificación del total de muestras evaluadas, dejando afuera al grupo de CMTN, estas fueron las muestras que mostraron un score más elevado, siendo muy homogéneas entre sí para esta característica en particular. Este hallazgo necesita de validación posterior, pero haciendo un paralelismo con carcinomas de próstata podría estar relacionada con los andrógenos también en la mama. A CRISP-3 300 RPA (n= 25) RPB (n= 12) 200 100 ns p=0.1700 RP B 0 RP A RPA score CRISP-3 en citoplasma B RPB Figura 7.5:A) Tumor catalogado como RPA con un score de 100 (arriba) y un tumor RPB (abajo) con un score de 250; barra: 50m;A) Dot Plot del score citoplasmático de CRISP-3 en tumores RPA y RPB, ns: p=0.1700. 100 CK6A Las CK de expresión basal comprenden especialmente a la CK 5/6 y la CK 17. Las mismas se expresan en una minoría de carcinomas mamarios, y se asocian a mal pronóstico142. En nuestros estudios de RNAseq, la CK6a y la CK6c se regulan de forma diferencial por la isoforma B del RP. Analizamos un total de 28 pacientes RPA y 13 pacientes RPB y observamos que existe una correlación significativa (p=0.0493) para su expresión en la membrana plasmática. Las pacientes RPB poseen mayores niveles de expresión de esta proteína que las muestras RPA. Estos hallazgos acompañan los análisis realizados con la plataforma PAM50, sobre nuestras muestras, donde uno de los genes regulados de forma positiva por la isoforma B es justamente la CK6. En la figura 7.6 se grafica el score de membrana en las muestras catalogadas según su perfil de isoformas, y se ejemplifican dos casos (un RPA y un RPB) con diferente expresión. A CK6A 150 RPB (n=13) RPA (n=28) 100 50 *p= 0.0493 RP B 0 RP A RPA Score CK6A en membrana B RPB Figura 7.6: A) Tumor catalogado como RPA con un score de 10 (arriba) y un tumor RPB (abajo) con un score de 70; barra: 50m. B) Dot Plot del score de membrana de CK6a en tumores RPA y RPB, *: p=0.0493. 101 De estos 6 candidatos nos resta validar a aquellos genes que muestran significancia estadística o tendencia marcada (como es el caso del FGF10), en un número mayor de pacientes. De todas maneras, BCL-xl y FGF10 podrían ser exponentes de la RPA; y MUC-2, CK6A y STAT5 de la RPB. 102 Discusión 103 En este trabajo de tesis demostramos que la isoforma A del RP es un biomarcador de la sensibilidad al tratamiento con antiprogestágenos y posee, a su vez, un rol pronóstico vinculado a un menor riesgo a la recurrencia. De la totalidad de carcinomas mamarios diagnosticados, un 75% pertenece al subgrupo de tumores denominados luminales; los mismos expresan, en su mayoría, ambos receptores hormonales 143 . Este gran grupo de tumores es muy heterogéneo tanto a nivel clínico como molecular, pero al día de hoy posee un sólo abordaje terapéutico, dirigido al RE. En nuestro laboratorio sugerimos que aquellas pacientes con mayor expresión de RPA que RPB serían beneficiadas de la adición de MFP a su terapia antiestrogénica de elección, en un contexto adyuvante. En la población de tumores con RP (+) que comprenden un 75- 80% del total de tumores diagnosticados, aproximadamente un 52% posee un predominio de la RPA, y como consecuencia, dichas pacientes serían candidatas a recibir el tratamiento con antiprogestágenos propuesto. De las pacientes RP (+) restantes, un 28% se definen como pacientes RPB y un 19% como pacientes equimolares. Esta distribución de pacientes es similar en nuestra cohorte de pacientes y en trabajos publicados por otros grupos que analizan las isoformas del RP en las muestras de pacientes 95 89 78. Definición de puntos de corte para la categorización de pacientes según su perfil de isoformas Para la definición de las pacientes según su isoforma no hay consenso establecido, algunos autores consideran como punto de corte a valores entre 0 y 1, o >178, por ejemplo. Por otra parte, estos trabajos antes citados consideran los valores de cada una de las isoformas por separado, normalizando los valores de cada una de las isoformas, a los controles positivos realizados en general, con la línea t47Dwt considerada equimolar. En nuestro laboratorio, tomamos en cuenta siempre la relación de RPA sobre RPB como un único valor ya que tanto en el contexto normal como tumoral ambas isoformas están presentes en las células 81 , además tomando en cuenta nuestra experiencia sobre modelos experimentales que expresan una u otra isoforma, observamos que la proporción tiene mucho más peso que cada una por separado. No existen condiciones fisiopatológicas de ningún órgano con expresión de RP, donde se exprese una u otra isoforma, siempre lo hacen en forma conjunta. Además de esta consideración, definimos puntos de corte que poseen cierto nivel de “seguridad” dado que la isoforma predominante determinará la posibilidad de recibir un tratamiento (en caso de ser catalogada como RPA), o contrariamente, la posibilidad que 104 dicho tratamiento pueda ser perjudicial (en caso de ser RPB). Consideramos a una paciente RPA, si la misma posee al menos un 20% más de RPA que de RPB; y consideramos a la paciente como RPB si posee más del 20% de RPB que RPA. Esta manera de cuantificar y catalogar a las pacientes según su perfil de Isoformas genera sustanciales diferencias entre nuestros hallazgos y los de otros grupos, que vinculan a la isoforma A con resistencia al TAM, por ejemplo 78 95. Con respecto al motivo por el cual ocurre el desbalance entre las isoformas, no está del todo claro el mecanismo, sin embargo tenemos evidencias de nuestro laboratorio y del trabajo de Pathiraja y col88 que sugieren que la metilación del promotor de RPA90 sería uno de ellos. Se puede especular que cuando hay mas B hay menos receptor total entonces probablemente sea por pérdida de RPA más que por sobreexpresión de RPB. Caracterización clínica de las pacientes según su perfil de isoformas Con respecto al análisis de parámetros clínicos relacionados a cada una de las Isoformas enfermedad temprana (tumores de <2cm), con tumores primarios mejor diferenciados que los RPB, con mayores niveles de expresión de los niveles totales de RE y RP y con bajos índices de proliferación medidos con ki-67. Cuando clasificamos a la pacientes según si son luminales A o B, observamos que aproximadamente el 80% (37/47) de ellas fue, a su vez, catalogada como RPA en los estudios de WB. Además en forma complementaria pudimos realizar el estudio de PAM50 en algunas de las pacientes y su perfil molecular arrojó datos muy similares. El 80% de las pacientes RPA se correspondió con pacientes de tipo luminal A según esta plataforma. Con respecto a la respuesta de estas pacientes al tratamiento antiestrogénico, aún no tenemos un número importante de pacientes con seguimiento como para llegar a conclusiones relacionadas a este; pero al ser pacientes con parámetros clínicos de buen pronóstico, y por sobre todo, mayor expresión de receptores hormonales, creemos que de forma contraria a lo publicado por Hopp en 2004 y por Torsten en 2015, la respuesta de las pacientes RPA será mejor que en aquellas pacientes RPB. Las pacientes cuyos tumores se clasifican como equimolares corresponden a valores comprendidos entre 1.2 y 0.83 de RPA/RPB, y presentan características clínico- patológicas que en líneas generales se encuentran a mitad de camino entre el perfil RPA y RPB. Sin embargo hay ciertos hallazgos a destacar, como por ejemplo que de la totalidad de pacientes RP (+), son las que menos recurrencias (2,6%) y metástasis (0%) poseen. En cuanto a la morfología o subtipo tumoral, la presencia de lesiones in situes prácticamente exclusivo de este grupo de pacientes (de 222 pacientes RP (+), las 5 lesiones de CDIS son equimolares). Nuestros hallazgos apoyan lo publicado por Ariga y 105 col 94, que estudian una progresión de lesiones desde HDA hasta CI, y proponen que la desregulación del patrón de Isoformas es un evento temprano en la carcinogénesis. Podríamos hipotetizar que la desregulación de las isoformas en la evolución de estas lesiones in situ, les otorga un fenotipo más agresivo con capacidad migratoria. Más aún, entre los CDIS encontramos un 40% (2/5) con características de “inestabilidad”144 definido por la sobreexpresión de HER-2 y alto índice de ki-67, creemos que estos podrían ser aquellos que evolucionen hacia un predominio RPB ya que la población RPB posee con mayor frecuencia estas dos características. Con respecto a la expresión de receptores hormonales, no existen pacientes con RE 0% ni RP 0%. Técnicas para la determinación del perfil de isoformas Con respecto a la técnica utilizada para determinar el perfil de isoformas en las muestras de las pacientes hay algunos aspectos a discutir. En primer lugar, y haciendo uso de la diferencia de peso molecular de una y otra isoforma, la técnica "gold standard" para esta determinación es el WB, sin embargo existen trabajos en la bibliografía que utilizan qPCR94 o IF95. En primer lugar y con respecto a la qPCR, la misma es técnicamente posible aunque dificultosa. Como la isoforma A está contenida dentro de la isoforma B, la manera de tener los valores de las isoformas por qPCR es medir RP total y restarle la isoforma B. De esta forma se pueden calcular los valores de ambas con este método. En el laboratorio hicimos un análisis de muestras pareadas (RNAm/ Proteina) para evaluar la posible correlación entre mensajero y proteína (n=50); no observamos correlación entre ambos, lo que sugiere que existen modificaciones posteriores que regulan los niveles de proteína (Figura i2: Introducción), como por ejemplo microRNAs. En segundo lugar, existen trabajos que evalúan la expresión diferencial por IF. Para utilizar este abordaje, se hace necesario contar con anticuerpos específicos de una y otra Isoforma. En los trabajo de Clarke y col, utilizan anticuerpos que reconocen cada una de las Isoformas y realizan una IF secuencial, para posteriormente medir la señal de ambos canales y así determinar cuál de ellas predomina 95. Sin embargo, en este estudio existen algunas cuestiones técnicas que son discutibles, entre ellas, la más importante es que utilizan anticuerpos con diferentes afinidades. En el laboratorio utilizamos la técnica de WB para la determinación de las Isoformas. La limitación que posee esta técnica es la necesidad de contar con tejido fresco para la extracción de proteínas, pero además de esto último, en el proceso de extracción de proteínas no se conoce a 106 ciencia cierta la proporción de tejido no tumoral que acompaña a la muestra. Se conoce que la glándula mamaria normal expresa hasta un 40% de ambos receptores hormonales 31 , y que considerando específicamente a las Isoformas e RP, la glándula mamaria normal posee cantidades equimolares de las mismas 7888 . Este es el motivo por el cual cuando catalogamos a las pacientes según su perfil de Isoformas consideramos como complementarios los valores de RP total medido por IHQ. En los casos donde no existe coincidencia entre ambos valores en su positividad o negatividad, consideramos que la muestra destinada al análisis por WB ha sido insuficiente o incluye tejido normal y sus niveles de RP. Especialmente en este trabajo, durante la evaluación de las pacientes nos enfrentamos con algunos casos donde eran discordantes los valores de IHQ y los de WB. En todos los casos, ambas técnicas se repitieron las veces consideradas necesarias con controles positivos y negativos. Sin embargo, aún tuvimos valores discordantes: en los casos donde el WB fue negativo y la IHQ positiva la muestra se consideró positiva. Creemos que la diferencia en estos casos pudo estar en que la proteína del RP es muy lábil, pudiéndose perder su expresión por el método de WB. En los casos donde el WB fue positivo y la IHQ negativa, se consideró a la muestra como negativa. Creemos que la razón de la diferencia, en estos casos, fue el aporte del tejido mamario normal presente en la muestra procesada para extracción de proteínas. Es importante destacar que en la IHQ se puede evaluar en qué células está presente la marca: si la misma se halla en ductos normales peri tumorales o en células tumorales propiamente dichas, en el caso del WB esto no es posible. Esta es la razón por la que a nuestro criterio siempre prima el valor de la IHQ por sobre el del WB. Evaluación de la sensibilidad de los tumores al tratamiento con antiprogestágenos Para evaluar la sensibilidad de las muestras de carcinomas mamarios humanos a la MFP pusimos a punto una técnica que nos permite cultivar lonjas de tejido fresco dispuestas al azar a condiciones de control o de tratamiento. Esta técnica permite investigar las propiedades farmacológicas antitumorales preservando el microambiente tumoral original de cada paciente en particular. Además es un método reproducible, que preserva la arquitectura en 3D, la viabilidad celular y la expresión génica global con hasta 5 días de cultivo 145 128 . La predicción de la respuesta frente a un tratamiento es un gran desafío, y en base a la aplicación de este tipo de tecnologías podremos seleccionar mejor a las pacientes. 107 En nuestro caso, la gran ventaja de esta técnica es que, luego de 48hs, los fragmentos tratados o controles se fijan en formol e incluyen en parafina, pudiendo contar con el análisis exhaustivo de la H&E. La coloración de rutina (H&E) nos permite evaluar la viabilidad celular, que es de suma importancia ya que la muestra queda 48hs en estufa a 37°, y como consecuencia directa una gran cantidad de sus células muere. A su vez, y a diferencia del WB que se realiza “a ciegas”, si la muestra tomada de quirófano fuera insuficiente o no tumoral es posible determinar su condición gracias a la posibilidad de mirarla al microscopio óptico. La gran limitante de esta técnica, por otro lado, es la calidad de la muestra, el tamaño y la celularidad de la misma se relacionan de forma directamente proporcional al éxito de esta técnica. Del total de las muestras analizadas con este método (n=95), se logró la evaluación de la sensibilidad a MFP por el método de chopper en 40 pacientes, obteniendo así una eficiencia del 36.8%. Cuatro de ellas, fueron excluidas por presentar un WB no confiable (n=36). Además, si computamos también los resultados obtenidos de los cultivos primarios (n=6; resultados obtenidos previamente por la Dra. Paola Rojas y el Dr. Gonzalo Sequeira) y aquellos obtenidos por este nuevo método implementado, llegamos a un total de 42 pacientes evaluadas de forma completa y exitosa, para su sensibilidad a MFP. En el cálculo el número necesario de muestras a evaluar para validar nuestra hipótesis, se tomaron en cuenta la diferencia entre la media de la tasa de proliferación tanto en condiciones control como tratado, en estudios pilotos previos. Con estos datos y los errores y que son constantes, se calculó que era necesario tener 19 muestras en cada grupo (RPA y RPB). Como es de esperar, se completó el grupo RPA antes que el grupo RPB, ya que son mucho más frecuentes. En este punto, con 19 paciente RPA evaluadas, se realizó un simulacro imaginando que las 9 muestras faltantes del grupo RPB para llegar al número pautado de 19 dieran un resultado contrario al esperado. Aun así la diferencia entre ambos grupos seguiría siendo estadísticamente significativa, por lo que se consideró que el número de muestras es suficiente para demostrar la hipótesis planteada. Genes de regulación diferencial: importancia de una herramienta predictiva. Como discutimos anteriormente, la técnica más confiable para la determinación del perfil de isoformas en muestras de pacientes es el WB. Sin embargo, para ser implementada en la práctica clínica diaria como parte de las herramientas predictivas de diagnostico, es necesario buscar algún 108 método que lo reemplace. La técnica de WB es factible únicamente con extractos proteicos obtenidos de muestra fresca (ver Materiales y Métodos) y además metodológicamente es una técnica de muchos pasos, lo que la hace dificultosa. Con la premisa de reemplazar el WB como objetivo final, y valiéndonos de genes de regulación diferencial por parte de cada una de las isoformas, nos propusimos desarrollar una herramienta predictiva del perfil de isoformas que sea robusta, aplicable y reproducible. Sabemos que la técnica de IHQ es universal y de bajo costo, además, se realiza de rutina en hospitales de todo nuestro país sobre muestras parafinadas. Para la selección de genes diferenciales tomamos en cuenta, en primer lugar, datos bibliográficos realizados sobre la línea celular luminal t47D que expresa la RPA o la RPB 91. A pesar de que no existe tal situación ni en condiciones normales ni patológicas, los estudios sobre líneas celulares nos permiten disociar algunos mecanismos y regulaciones específicas. Además de estos estudios sobre t47D, investigamos otros modelos donde hubiera expresión diferencial de las isoformas. Al respecto, nos encontramos por ejemplo, con evidencias sobre un modelo de células epiteliales uterinas, donde la RPA se vincula con la regulación diferencial de MUC-1 93; o reportes donde en células de la granulosa de rata existe una regulación mediada por AMPc 146. Por otro lado, de nuestro propio análisis de RNAm realizado sobre las pacientes catalogadas por sus isoformas, obtuvimos un total de 140 transcriptos regulados de forma diferencial. En la selección de estos genes priorizamos aquellos que cuentan con anticuerpos comerciales específicos y de esa manera comenzamos a universalizar la regulación diferencial encontrada, en un mayor número de pacientes. La meta final será generar un algoritmo de expresión determinado por IHQ basado en algunos genes regulados por RPA y otros por RPB que nos permita predecir la isoforma y, como consecuencia directa la posibilidad del tratamiento con antiprogestágenos. La importancia de la selección de pacientes radica en que, a pesar de que los perfiles entre RPA y luminal A o RPB y luminal B son concordantes en muchos aspectos tanto clínicos como moleculares, no todas las pacientes catalogadas como luminales A serán beneficiadas de la adición de MFP a su tratamiento hormonal. En principio hasta un 20% de las pacientes catalogadas como luminales A no serían candidatas a recibir MFP, y por otro lado, también encontraremos algunas catalogadas como luminales B, que sobreexpresan RPA, que sí serán beneficiadas del tratamiento propuesto. 109 110 Conclusiones 111 1. Del análisis de los parámetros clínicos de mayor relevancia pronóstica y el perfil de isoformas del RP, podemos concluir que: Las pacientes RPA se asemejan en su perfil génico a las pacientes Luminales A de la clasificación molecular del CM; y que las pacientes RPB se asemejan a las de tipo Luminal B. Los parámetros clínicos clásicos vinculados a buen pronóstico, tales como tamaño tumoral <2cm, alta expresión de receptores hormonales y baja tasa de proliferación, se correlacionan con aquellas pacientes cuyos tumores tienen un predominio de RPA; y en forma contraria se comportan aquellas pacientes con tumores RPB. El perfil clínico se corresponde con el perfil molecular, pudiendo asociar a las pacientes RPA con aquellas Luminales A, tanto a nivel de expresión génica como su valor pronóstico. 2. Los tumores con predominio de la isoforma A del RP son sensibles (se inhiben) frente al tratamiento con MFP. Esta característica permitirá incorporar el tratamiento con antiprogestágenos al esquema adyuvante, en tumores de tipo luminal con predominio de RPA. De esta manera la terapia para este grupo de pacientes será dirigida contra ambos receptores hormonales, pudiendo potenciar el efecto antitumoral. 3. Un total de 140 trascriptos son regulados de forma diferencial por las Isoformas del RP, el 60% (n=85) regulados por la RPB y el 40% (n=55) restante por la RPA. Una selección de estos genes y otros tomados de la bibliografía, serán universalizados en un mayor número de muestras catalogadas según sus Isoformas para corroborar su expresión diferencial directamente sobre muestras parafinadas. 4. La determinación de varios genes expresados en los tumores, por técnicas de IHQ, permitirá en un futuro categorizar a las pacientes según su isoforma predominante. La construcción de un algoritmo diagnóstico contemplando genes regulados por RPA y RPB incluirá, en principio, a MUC-2 y CK6a por un lado, y a BCL-xl y FGF-10 por otro. La importancia de discriminar a los pacientes candidatos a recibir adyuvancia con MFP radica en que, tanto en modelos experimentales como en los cultivos organotípicos de muestras de pacientes, hemos demostrado que la sobreexpresión de la Isoforma B del RP puede conllevar una respuesta de tipo estimulatoria frente al tratamiento propuesto. 112 Perspectivas futuras El desarrollo de una herramienta predictiva del perfil de Isoformas del RP basada en IHQ es una meta a alcanzar en el futuro próximo, si bien sabemos que vamos a tener que analizar muchos genes candidatos en muchas pacientes. De todas formas, consideramos que proponer un tratamiento novedoso acompañado de un método que seleccione a las pacientes, es la base del tratamiento oncológico dirigido, buscando una mayor eficiencia y una menor proporción de efectos no deseados. Nos queda por delante: el análisis exhaustivo de la población RPB y equimolar, que por lo visto en este trabajo, es mucho más heterogénea que los RPA en su comportamiento biológico. explorar el rol de los receptores de andrógenos y glucocorticoides en los tumores de tipo luminal, y su papel en la respuesta al antiprogestageno MFP. Analizar el comportamiento del perfil de Isoformas en la evolución de lesiones, tanto el recurrencias como en metástasis. 113 “El misterio es lo más hermoso que nos es dado sentir. Es la sensación fundamental, la cuna del arte y de la ciencia verdadera. Quien no la conoce, quien no puede asombrase ni maravillarse, está muerto.” - Albert Einstein 114 Referencias 1. Torre, L. A. et al. Global Cancer Statistics, 2012. CA: a cancer journal of clinicians. 65, 87– 108 (2015). 2. DeSantis, C. E. et al. International Variation in Female Breast Cancer Incidence and Mortality Rates. Cancer epidemiology, biomarkers & prevention : a publication of the American Association for Cancer Research, cosponsored by the American Society of Preventive Oncology 24, 1495–506 (2015). 3. Justo, N., Wilking, N., Jonsson, B., Luciani, S. & Cazap, E. A review of breast cancer care and outcomes in Latin America. Oncologist 18, 248–256 (2013). 4. Antoniou, A. C. et al. Common Breast Cancer-Predisposition Alleles Are Associated with Breast Cancer Risk in BRCA1 and BRCA2 Mutation Carriers. Journal of Human Genetics 937– 948 (2008). doi:10.1016/j.ajhg.2008.02.008. 5. Möller, S. et al. The Heritability of Breast Cancer among women in the Nordic Twin Study of Cancer. Cancer epidemiology, biomarkers & prevention : a publication of the American Association for Cancer Research, cosponsored by the American Society of Preventive Oncology (2015). doi:10.1158/1055-9965.EPI-15-0913 6. Katzke, V. A., Kaaks, R. & Kühn, T. Lifestyle and cancer risk. Cancer journal (Sudbury, Mass.) 21, 104–10 (2015). 7. Humans, I. W. G. on the E. of C. R. to. Combined estrogen-progestogen contraceptives and combined estrogen-progestogen menopausal therapy. IARC monographs on the evaluation of carcinogenic risks to humans / World Health Organization, International Agency for Research on Cancer 91, 1–528 (2007). 8. Kabat, G. C. et al. Reproductive and menstrual factors and risk of ductal carcinoma in situ of the breast in a cohort of postmenopausal women. Cancer causes & control : CCC 22, 1415– 24 (2011). 9. Copson, E. R. et al. Obesity and the outcome of young breast cancer patients in the UK: the POSH study. Annals of oncology : official journal of the European Society for Medical Oncology / ESMO 26, 101–12 (2015). 10. Shin, A. et al. Alcohol consumption, body mass index and breast cancer risk by hormone receptor status: Women’ Lifestyle and Health Study. BMC cancer 15, 881 (2015). 115 11. Jiang, Q. & Greenberg, R. Deciphering the BRCA1 Tumor Suppressor Network. The Journal of biological chemistry 290, 17724–32 (2015). 12. Young, S. R. et al. The prevalence of BRCA1 mutations among young women with triplenegative breast cancer. BMC cancer 9, 86 (2009). 13. Evans, D. G. et al. Prevalence of BRCA1 and BRCA2 mutations in triple negative breast cancer. Journal of medical genetics 48, 520–2 (2011). 14. Trichopoulos, D., MacMahon, B. & Cole, P. Menopause and breast cancer risk. Journal of the National Cancer Institute 48, 605–13 (1972). 15. Henderson, B. E., Pike, M. C. & Casagrande, J. T. Breast cancer and the oestrogen window hypothesis. Lancet (London, England) 2, 363–4 (1981). 16. Cohen, Y. [Estrogen window hypothesis]. Harefuah 100, 585–6 (1981). 17. Rothman, K. J. et al. Maternal age and birth rank of women with breast cancer. Journal of the National Cancer Institute 65, 719–22 (1980). 18. Lipnick, R. et al. A case-control study of risk indicators among women with premenopausal and early postmenopausal breast cancer. Cancer 53, 1020–4 (1984). 19. Oms, O. P. S. & Organización Panamericana de la Salud. La alimentación del lactante y del niño pequeño: Capítulo Modelo para libros de texto dirigidos a estudiantes de medicina y otras ciencias de la salud. Genebra: WHO (2010). 20. Cancer, C. G. on H. F. in B. Breast cancer and hormonal contraceptives: collaborative reanalysis of individual data on 53 297 women with breast cancer and 100 239 women without breast cancer from 54 epidemiological studies. Lancet 347, 1713–27 (1996). 21. Thorbjarnardottir, T., Olafsdottir, E. J., Valdimarsdottir, U. A., Olafsson, O. & Tryggvadottir, L. Oral contraceptives, hormone replacement therapy and breast cancer risk: a cohort study of 16 928 women 48 years and older. Acta oncologica (Stockholm, Sweden) 53, 752–8 (2014). 22. WHO. Food, Nutrition, Physical activity, and the prevention of cancer: a Global Perspective. (2007). 116 23. Rossouw, J. E. et al. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results From the Women’s Health Initiative randomized controlled trial. JAMA 288, 321–33 (2002). 24. Beral, V. Breast cancer and hormone-replacement therapy in the Million Women Study. Lancet 362, 419–27 (2003). 25. Bulun, S. E., Mahendroo, M. S. & Simpson, E. R. Aromatase gene expression in adipose tissue: relationship to breast cancer. The Journal of steroid biochemistry and molecular biology 49, 319–26 (1994). 26. Wang, X., Simpson, E. R. & Brown, K. A. Aromatase overexpression in dysfunctional adipose tissue links obesity to postmenopausal breast cancer. The Journal of steroid biochemistry and molecular biology (2015). doi:10.1016/j.jsbmb.2015.07.008 27. Macacu, A., Autier, P., Boniol, M. & Boyle, P. Active and passive smoking and risk of breast cancer: a meta-analysis. Breast cancer research and treatment (2015). doi:10.1007/s10549015-3628-4 28. Visscher, D. W. et al. Clinicopathologic features of breast cancers that develop in women with previous benign breast disease. Cancer (2015). doi:10.1002/cncr.29766 29. McEvoy, M. P. et al. Breast Cancer Risk and Follow-up Recommendations for Young Women Diagnosed with Atypical Hyperplasia and Lobular Carcinoma In Situ (LCIS). Annals of surgical oncology 22, 3346–9 (2015). 30. Kuerer, H. M. Ductal carcinoma in situ: treatment or active surveillance? Expert review of anticancer therapy 15, 777–85 (2015). 31. Obr, A. E. & Edwards, D. P. The biology of progesterone receptor in the normal mammary gland and in breast cancer. Molecular and cellular endocrinology 357, 4–17 (2012). 32. Okcu, M. et al. Androgen Receptors Frequently Are Expressed in Potential Relevance to New Therapeutic Strategies. Cancer 1, (2003). 33. Safarpour, D., Pakneshan, S. & Tavassoli, F. A. Androgen receptor (AR) expression in 400 breast carcinomas: is routine AR assessment justified? American journal of cancer research 4, 353–68 (2014). 34. Baschant, U. & Tuckermann, J. The role of the glucocorticoid receptor in inflammation and 117 immunity. The Journal of steroid biochemistry and molecular biology 120, 69–75 (2010). 35. Schiff, R. et al. Cross-talk between estrogen receptor and growth factor pathways as a molecular target for overcoming endocrine resistance. Clinical cancer research : an official journal of the American Association for Cancer Research 10, 331S–6S (2004). 36. Chumsri, S. Clinical utilities of aromatase inhibitors in breast cancer. International journal of women’s health 7, 493–499 (2015). 37. Sinn, H.-P. & Kreipe, H. A Brief Overview of the WHO Classification of Breast Tumors, 4th Edition, Focusing on Issues and Updates from the 3rd Edition. Breast care (Basel, Switzerland) 8, 149–54 (2013). 38. Way, D. N. A. FDA Herceptin approval. 1–3 (1998). 39. FDA. DM1 pharmacology review.pdf. (2013). 40. Pertuzumab pharmacology review. Breast (2012). 41. Moy, B., Kirkpatrick, P., Kar, S. & Goss, P. Lapatinib. Nature reviews. Drug discovery 6, 431– 432 (2007). 42. Baselga, J. et al. Everolimus in postmenopausal hormone-receptor-positive advanced breast cancer. The New England journal of medicine 366, 520–9 (2012). 43. Bourdeanu, L. & Luu, T. Targeted Therapies in Breast Cancer: Implications for Advanced Oncology Practice. (2014). 44. Weigel, M. T. & Dowsett, M. Current and emerging biomarkers in breast cancer: prognosis and prediction. Endocrine-related cancer 17, R245–62 (2010). 45. Fitzgibbons, P. L. et al. Prognostic factors in breast cancer. College of American Pathologists Consensus Statement 1999. Archives of pathology & laboratory medicine 124, 966–978 (2000). 46. Fisher, B., Bauer, M. & Wickerham, D. Relation of number of positive axillary nodes to the prognosis of patients with primary breast cancer. An NSABP update. Cancer 52, 1551–7 (1983). 118 47. Elston, C. W. & Ellis, I. O. Pathological prognostic factors in breast cancer. I. The value of histological grade in breast cancer: experience from a large study with long-term follow-up. Histopathology 41, 154–61 (2002). 48. Mook, S. et al. Calibration and discriminatory accuracy of prognosis calculation for breast cancer with the online Adjuvant! program: a hospital-based retrospective cohort study. The Lancet. Oncology 10, 1070–6 (2009). 49. Goldhirsch, a. et al. Personalizing the treatment of women with early breast cancer: Highlights of the st gallen international expert consensus on the primary therapy of early breast Cancer 2013. Annals of Oncology 24, 2206–2223 (2013). 50. Rakha, E. a. et al. Tubular carcinoma of the breast: Further evidence to support its excellent prognosis. Journal of Clinical Oncology 28, 99–104 (2010). 51. Harvey, J. M., Clark, G. M., Osborne, C. K. & Allred, D. C. Estrogen receptor status by immunohistochemistry is superior to the ligand-binding assay for predicting response to adjuvant endocrine therapy in breast cancer. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 17, 1474–81 (1999). 52. Luoh, S.-W., Ramsey, B., Park, B. & Keenan, E. Quantitative progesterone receptor expression and efficacy of anti-estrogen therapy in breast cancer. The breast journal 20, 46–52 (2014). 53. Cui, X., Schiff, R., Arpino, G., Osborne, C. K. & Lee, A. V. Biology of progesterone receptor loss in breast cancer and its implications for endocrine therapy. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 23, 7721–35 (2005). 54. Dowsett, M. et al. Retrospective analysis of time to recurrence in the ATAC trial according to hormone receptor status: an hypothesis-generating study. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 23, 7512–7 (2005). 55. Thürlimann, B. et al. A comparison of letrozole and tamoxifen in postmenopausal women with early breast cancer. The New England journal of medicine 353, 2747–57 (2005). 56. Viale, G. et al. Prognostic and predictive value of centrally reviewed expression of estrogen and progesterone receptors in a randomized trial comparing letrozole and tamoxifen adjuvant therapy for postmenopausal early breast cancer: BIG 1-98. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 25, 3846–52 (2007). 57. Bettelheim, R., Penman, H. G., Thornton-Jones, H. & Neville, A. M. Prognostic significance 119 of peritumoral vascular invasion in breast cancer. British journal of cancer 50, 771–7 (1984). 58. Kuru, B., Camlibel, M., Gulcelik, M. A. & Alagol, H. Prognostic factors affecting survival and disease-free survival in lymph node-negative breast carcinomas. Journal of surgical oncology 83, 167–72 (2003). 59. Perou, C. M. et al. Molecular portraits of human breast tumours. Nature 406, 747–52 (2000). 60. Perou, C. M., Parker, J. S., Prat, A., Ellis, M. J. & Bernard, P. S. Clinical implementation of the intrinsic subtypes of breast cancer. The Lancet Oncology 11, 718–719 (2010). 61. Prat, A. & Perou, C. M. Deconstructing the molecular portraits of breast cancer. Molecular Oncology 5, 5–23 (2011). 62. Sørlie, T. et al. Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications. Proceedings of the National Academy of Sciences of the United States of America 98, 10869–74 (2001). 63. Győrffy, B. et al. Multigene prognostic tests in breast cancer: past, present, future. Breast Cancer Research 17, 1–7 (2015). 64. Edwards, D. P. Regulation of signal transduction pathways by estrogen and progesterone. Annual review of physiology 67, 335–376 (2005). 65. Graham, J. D. et al. Progesterone receptor A and B protein expression in human breast cancer. The Journal of steroid biochemistry and molecular biology 56, 93–98 (1996). 66. Elea Laboratorios. Progesterona Micronizada. (2008). 67. Sitruk-Ware, R. & El-Etr, M. Progesterone and related progestins: potential new health benefits. Climacteric : the journal of the International Menopause Society 16 Suppl 1, 69–78 (2013). 68. Söderqvist, G. et al. Proliferation of breast epithelial cells in healthy women during the menstrual cycle. American journal of obstetrics and gynecology 176, 123–8 (1997). 69. Longacre, T. A. & Bartow, S. A. A correlative morphologic study of human breast and endometrium in the menstrual cycle. The American journal of surgical pathology 10, 382– 120 93 (1986). 70. Topper, Y. J. & Freeman, C. S. Multiple hormone interactions in the developmental biology of the mammary gland. Physiological reviews 60, 1049–106 (1980). 71. Clavel-Chapelon, F. & Gerber, M. Reproductive factors and breast cancer risk. Do they differ according to age at diagnosis? Breast cancer research and treatment 72, 107–15 (2002). 72. Santen, R. J. Risk of breast cancer with progestins: critical assessment of current data. Steroids 68, 953–64 (2003). 73. Ganzina, F. High-dose medroxyprogesterone acetate (MPA) treatment in advanced breast cancer. A review. Tumori 65, 563–85 (1979). 74. Badwe, R. et al. Single-injection depot progesterone before surgery and survival in women with operable breast cancer: a randomized controlled trial. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 29, 2845–51 (2011). 75. Bines, J. et al. Activity of megestrol acetate in postmenopausal women with advanced breast cancer after nonsteroidal aromatase inhibitor failure: a phase II trial. Annals of oncology : official journal of the European Society for Medical Oncology / ESMO 25, 831–6 (2014). 76. Anderson, E. The role of oestrogen and progesterone receptors in human mammary development and tumorigenesis. Breast cancer research : BCR 4, 197–201 (2002). 77. Brisken, C. et al. A paracrine role for the epithelial progesterone receptor in mammary gland development. Proceedings of the National Academy of Sciences of the United States of America 95, 5076–81 (1998). 78. Hopp, T. a et al. Breast Cancer Patients with Progesterone Receptor PR-A-Rich Tumors Have Poorer Disease-Free Survival Rates Breast Cancer Patients with Progesterone Receptor PRA-Rich Tumors Have Poorer Disease-Free Survival Rates. 2751–2760 (2004). 79. Kastner, P. et al. Two distinct estrogen-regulated promoters generate transcripts encoding the two functionally different human progesterone receptor forms A and B. The EMBO journal 9, 1603–14 (1990). 80. Sartorius, C. A. et al. A third transactivation function (AF3) of human progesterone receptors located in the unique N-terminal segment of the B-isoform. Molecular 121 endocrinology (Baltimore, Md.) 8, 1347–60 (1994). 81. Mote, P. A., Bartow, S., Tran, N. & Clarke, C. L. Loss of co-ordinate expression of progesterone receptors A and B is an early event in breast carcinogenesis. Breast cancer research and treatment 72, 163–72 (2002). 82. Wiehle, R. D., Helftenbein, G., Land, H., Neumann, K. & Beato, M. Establishment of rat endometrial cell lines by retroviral mediated transfer of immortalizing and transforming oncogenes. Oncogene 5, 787–94 (1990). 83. Tung, L., Mohamed, M. K., Hoeffler, J. P., Takimoto, G. S. & Horwitz, K. B. Antagonistoccupied human progesterone B-receptors activate transcription without binding to progesterone response elements and are dominantly inhibited by A-receptors. Molecular endocrinology (Baltimore, Md.) 7, 1256–65 (1993). 84. McDonnell, D. P., Shahbaz, M. M., Vegeto, E. & Goldman, M. E. The human progesterone receptor A-form functions as a transcriptional modulator of mineralocorticoid receptor transcriptional activity. The Journal of steroid biochemistry and molecular biology 48, 425– 32 (1994). 85. Mote, P. A., Balleine, R. L., McGowan, E. M. & Clarke, C. L. Colocalization of progesterone receptors A and B by dual immunofluorescent histochemistry in human endometrium during the menstrual cycle. The Journal of clinical endocrinology and metabolism 84, 2963– 71 (1999). 86. Mote, P. A., Graham, J. D. & Clarke, C. L. Progesterone Receptor Isoforms in Normal and Malignant Breast. in Ernst Schering Foundation Symposium Proceedings 1, 77–107 (2008). 87. Mote, P. A. et al. Germ-line mutations in BRCA1 or BRCA2 in the normal breast are associated with altered expression of estrogen-responsive proteins and the predominance of progesterone receptor A. Genes, chromosomes & cancer 39, 236–48 (2004). 88. Pathiraja, T. N. et al. Progesterone receptor isoform-specific promoter methylation: association of PRA promoter methylation with worse outcome in breast cancer patients. Clinical cancer research : an official journal of the American Association for Cancer Research 17, 4177–86 (2011). 89. Bamberger, a M., Milde-Langosch, K., Schulte, H. M. & Löning, T. Progesterone receptor isoforms, PR-B and PR-A, in breast cancer: correlations with clinicopathologic tumor parameters and expression of AP-1 factors. Hormone research 54, 32–37 (2000). 122 90. Wargon, V. et al. Hypermethylation of the progesterone receptor A in constitutive antiprogestin-resistant mouse mammary carcinomas. Breast Cancer Research and Treatment 126, 319–332 (2011). 91. Richer, J. & Horwitz, K. Differential Gene Regulation by the Two Progesterone Receptor Isoforms in Human Breast Cancer Cells. THE JOURNAL OF BIOLOGICAL CHEMISTRY 92. Graham, J. D. et al. Altered progesterone receptor isoform expression remodels progestin responsiveness of breast cancer cells. Molecular endocrinology (Baltimore, Md.) 19, 2713– 2735 (2005). 93. Brayman, M. J. et al. Progesterone receptor isoforms A and B differentially regulate MUC1 expression in uterine epithelial cells. Molecular endocrinology (Baltimore, Md.) 20, 2278–91 (2006). 94. Ariga, N. et al. Progesterone receptor A and B isoforms in the human breast and its disorders. Japanese Journal of Cancer Research 92, 302–8 (2001). 95. Mote, P. a. et al. Progesterone receptor A predominance is a discriminator of benefit from endocrine therapy in the ATAC trial. Breast Cancer Research and Treatment (2015). doi:10.1007/s10549-015-3397-0 96. Jonat, W. et al. Randomized phase II study of lonaprisan as second-line therapy for progesterone receptor-positive breast cancer. Annals of Oncology 24, 2543–2548 (2013). 97. Bouchard, P. Los moduladores selectivos de los receptores de la progesterona en la medicina de la reproducción: farmacología, eficacia clínica y seguridad. Revista IberoAmericana de Fertilidad y Reproducción Humana (2011). at <http://www.revistafertilidad.org/noticias/plos-moduladores-selectivos-receptoresprogesterona-en-medicina-reproducci/62> 98. Guelho, D. & Grossman, A. B. Emerging drugs for Cushing’s disease. Expert opinion on emerging drugs 1–16 (2015). doi:10.1517/14728214.2015.1047762 99. Baulieu, E. Fertility control in women: results with RU 486 by the end of 1985. Journal of steroid biochemistry 25, 847–51 (1986). 100. Check, J. H., Dix, E., Wilson, C. & Check, D. Progesterone receptor antagonist therapy has therapeutic potential even in cancer restricted to males as evidenced from murine testicular and prostate cancer studies. Anticancer research 30, 4921–3 (2010). 123 101. Driák, D., Sehnal, B. & Svandová, I. [Selective progesterone receptor modulators and their therapeutical use]. Ceská gynekologie / Ceská lékarská spolecnost J. Ev. Purkyne 78, 175–81 (2013). 102. Lanari, C. et al. The MPA mouse breast cancer model: evidence for a role of progesterone receptors in breast cancer. Endocrine-related cancer 16, 333–50 (2009). 103. Lamb, C. a et al. Antisense oligonucleotides targeting the progesterone receptor inhibit hormone-independent breast cancer growth in mice. Breast cancer research : BCR 7, R1111–R1121 (2005). 104. Vanzulli, S. et al. P21, P27 and P53 in Estrogen and Antiprogestin-Induced Tumor Regression of Experimental Mouse Mammary Ductal Carcinomas. Carcinogenesis 23, 749– 58 (2002). 105. Wargon, V. et al. Reversal of antiprogestin resistance and progesterone receptor isoform ratio in acquired resistant mammary carcinomas. Breast cancer research and treatment 116, 449–60 (2009). 106. Tieszen, C. R., Goyeneche, A. A., Brandhagen, B. N., Ortbahn, C. T. & Telleria, C. M. Antiprogestin mifepristone inhibits the growth of cancer cells of reproductive and nonreproductive origin regardless of progesterone receptor expression. BMC cancer 11, 207 (2011). 107. Robertson, J. F., Willsher, P. C., Winterbottom, L., Blamey, R. W. & Thorpe, S. Onapristone, a progesterone receptor antagonist, as first-line therapy in primary breast cancer. European journal of cancer (Oxford, England : 1990) 35, 214–8 (1999). 108. Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 227, 680–685 (1970). 109. Li, B. & Dewey, C. N. RSEM: accurate transcript quantification from RNA-Seq data with or without a reference genome. BMC bioinformatics 12, 323 (2011). 110. Leng, N. et al. EBSeq: an empirical Bayes hierarchical model for inference in RNA-seq experiments. Bioinformatics (Oxford, England) 29, 1035–43 (2013). 111. Saeed, A. I. et al. TM4: a free, open-source system for microarray data management and analysis. BioTechniques 34, 374–8 (2003). 124 112. Parker, J. S. et al. Supervised risk predictor of breast cancer based on intrinsic subtypes. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 27, 1160–7 (2009). 113. Atlas, N. C. G. Comprehensive molecular portraits of human breast tumours. Nature 490, 61–70 (2012). 114. Bedard, P. L., Hansen, A. R., Ratain, M. J. & Siu, L. L. Tumour heterogeneity in the clinic. Nature 501, 355–64 (2013). 115. Zhou, X. et al. Alterations of biomarker profiles after neoadjuvant chemotherapy in breast cancer: tumor heterogeneity should be taken into consideration. Oncotarget (2015). at <http://www.ncbi.nlm.nih.gov/pubmed/26384297> 116. Jiang, D. et al. The prognostic value of EGFR overexpression and amplification in Esophageal squamous cell Carcinoma. BMC Cancer 15, 1–9 (2015). 117. Benia, D. W. & Tellechea, G. mama y cuello uterino en mujeres usuarias de tres policlínicas barriales de Montevideo . 1997. Articulo 16, 11 (2000). 118. Song, N. et al. Tumor Subtype-Specific Associations of Hormone-Related Reproductive Factors on Breast Cancer Survival. PloS one 10, e0123994 119. Guidelines, T. Breast Cancer. Nccn (2006). 120. National Comprehensive Cancer Network, R. NCCN Clinical Practice Guidelines in Oncology - Breast Cancer. (2013). at <http://www.nccn.com> 121. Moinfar, F. Essentials of Diagnostic breast pathology. World Health 122. Weigelt, B., Geyer, F. C. & Reis-Filho, J. S. Histological types of breast cancer: How special are they? Molecular Oncology 4, 192–208 (2010). 123. Fang, L., Barekati, Z., Zhang, B., Liu, Z. & Zhong, X. Y. Targeted therapy in breast cancer: What’s new? Swiss Medical Weekly 141, 1–9 (2011). 124. Hanna, W. M. et al. Defining a test for HER-2/neu evaluation in breast cancer in the diagnostic setting. Modern pathology 14, 677–685 (2001). 125 125. Coates, A. S., Winer, E. P., Goldhirsch, A., Gelber, R. D. & Gnant, M. Tailoring therapies improving the management of early breast cancer : St GallenInternational Expert Consensus on the Primary Therapy of Early Breast Cancer 2015 . 1–38 (2015). 126. Ingolf, J.-B. et al. Can ki-67 play a role in prediction of breast cancer patients’ response to neoadjuvant chemotherapy? BioMed research international 2014, 628217 (2014). 127. Hammond, M. E. H. et al. American society of clinical oncology/college of american pathologists guideline recommendations for immunohistochemical testing of estrogen and progesterone receptors in breast cancer. Journal of Clinical Oncology 28, 2784–2795 (2010). 128. Faversani, A. et al. Survivin family proteins as novel molecular determinants of doxorubicin resistance in organotypic human breast tumors. Breast cancer research : BCR 16, R55 (2014). 129. Croce, C. M. Oncogenes and cancer. The New England journal of medicine 358, 502–11 (2008). 130. Itoh, N. FGF10: a multifunctional mesenchymal-epithelial signaling growth factor in development, health, and disease. Cytokine & Growth Factor Reviews (2015). doi:10.1016/j.cytogfr.2015.10.001 131. Abolhassani, A. et al. FGF10: Type III Epithelial Mesenchymal Transition and Invasion in Breast Cancer Cell Lines. Journal of Cancer 5, 537–47 (2014). 132. El Agha, E. & Bellusci, S. Walking along the Fibroblast Growth Factor 10 Route: A Key Pathway to Understand the Control and Regulation of Epithelial and Mesenchymal CellLineage Formation during Lung Development and Repair after Injury. Scientifica 2014, 538379 (2014). 133. Haricharan, S. & Li, Y. STAT signaling in mammary gland differentiation, cell survival and tumorigenesis. Molecular and Cellular Endocrinology 382, 560–569 (2014). 134. Furth, P. A., Nakles, R. E., Millman, S., Diaz-Cruz, E. S. & Cabrera, M. C. Signal transducer and activator of transcription 5 as a key signaling pathway in normal mammary gland developmental biology and breast cancer. Breast cancer research : BCR 13, 220 (2011). 135. Barash, I. Stat5 in breast cancer: potential oncogenic activity coincides with positive prognosis for the disease. Carcinogenesis 33, 2320–5 (2012). 126 136. Kufe, D. W. Mucins in cancer: function, prognosis and therapy. Nature reviews. Cancer 9, 874–885 (2009). 137. Lau, S. K., Weiss, L. M. & Chu, P. G. Differential expression of MUC1, MUC2, and MUC5AC in carcinomas of various sites: An immunohistochemical study. American Journal of Clinical Pathology 122, 61–69 (2004). 138. García-Labastida, L. et al. CDX-2, MUC-2 and B-catenin as intestinal markers in pure mucinous carcinoma of the breast. Biological research 47, 43 (2014). 139. Da Ros, V. G. et al. From the epididymis to the egg: participation of CRISP proteins in mammalian fertilization. Asian journal of andrology 17, 711–5 140. Lee, U. et al. Cysteine-rich secretory protein 3 inhibits hepatitis C virus at the initial phase of infection. Biochemical and biophysical research communications 450, 1076–82 (2014). 141. Vaarala, M. H., Hirvikoski, P., Kauppila, S. & Paavonen, T. K. Identification of androgenregulated genes in human prostate. Molecular medicine reports 6, 466–72 (2012). 142. Ivković-Kapicl, T., Panjković, M., Nikolić, I., Djilas-Ivanović, D. & Knezević-Usaj, S. [Expression of cytokeratins 5/6 and cytokeratin 17 in invasive breast carcinoma]. Vojnosanitetski pregled 69, 1031–8 (2012). 143. Harris, J. R., Lippman, M. E., Veronesi, U. & Willett, W. Breast cancer. The New England journal of medicine 327, 319–28 (1992). 144. Davis, J. E. et al. Her2 and Ki67 Biomarkers Predict Recurrence of Ductal Carcinoma in Situ. Applied immunohistochemistry & molecular morphology : AIMM / official publication of the Society for Applied Immunohistochemistry (2015). doi:10.1097/PAI.0000000000000223 145. Vaira, V. et al. Preclinical model of organotypic culture for pharmacodynamic profiling of human tumors. Proceedings of the National Academy of Sciences of the United States of America 107, 8352–8356 (2010). 146. Park-Sarge, O. K. & Mayo, K. E. Regulation of the progesterone receptor gene by gonadotropins and cyclic adenosine 3’,5'-monophosphate in rat granulosa cells. Endocrinology 134, 709–18 (1994). 127