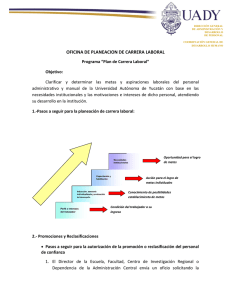
reclasificación
Anuncio

RECLASIFICACIÓN Reclasificación de medicamentos de prescripción a medicamentos de venta sin receta RECLASIFICACIÓN – Reclasificación de medicamentos de prescripción a medicamentos de venta sin receta © WSMI 2009. All rights reserved. Contenido Resumen Ejecutivo 2 Sección I La reclasificación y el surgimiento global de medicamentos de venta sin receta 4 Sección II Objetivos y beneficios de la reclasificación en la salud pública 10 Sección III Reclasificaciones futuras 24 Sección IV Condiciones del país para la reclasificación 32 Sección V Aspectos regulatorios sujetos a discusión sobre la reclasificación 42 Apéndice Tablas de Clasificación de Ingredientes de Venta sin receta 1 50 RECLASIFICACIÓN – Reclasificación de medicamentos de prescripción a medicamentos de venta sin receta Resumen ejecutivo Resumen Ejecutivo “ A través de la reclasificación de medicamentos de prescripción a medicamentos de venta sin receta, cientos de millones de consumidores alrededor del mundo se han beneficiado al tener un acceso más amplio y conveniente a diversas opciones de auto-tratamiento adecuadas. ” Los medicamentos disponibles sin prescripción son llamados medicamentos de venta sin receta o Over-the-Counter o medicamentos OTC. Existen diferentes medicamentos de venta sin receta, muchos de los cuales han estado disponibles por mucho tiempo y tienen un largo historial de seguridad y eficacia. Ejemplos de éstos son los medicamentos de venta sin receta utilizados en los casos de dolor leve a moderado, tos y resfriado, problemas menores de la piel y acidez estomacal. Otros productos de este tipo son más nuevos y se iniciaron como medicamentos de prescripción, los cuales fueron “reclasificados” como medicamentos de venta sin receta. Entre otros ejemplos tenemos a los triptanos para la migraña, los inhibidores de la bomba de protones para la prevención de la indigestión ácida y algunos antivirales para el herpes labial y antihistamínicos para la fiebre del heno. Este folleto es acerca de la “reclasificación”, el cambio de estatus de los medicamentos de prescripción al de venta sin receta, gracias al cual se incrementa el acceso a medicamentos seguros y eficaces que pueden usar pacientes y consumidores sin tener que recurrir en todos los casos a un profesional de la salud. En algunos países como Australia, Nueva Zelanda, Finlandia, Francia, Suecia y el Reino Unido, existe una cierta gradualidad en materia de disponibilidad de productos de venta sin receta. Puede haber algunas subdivisiones en esta categoría tales como la clase denominada “atrás del mostrador”, en donde existe la necesidad de contar con el apoyo del farmacéutico; la de “auto-selección” en la farmacia, o la de “venta general” en cualquier punto de venta. Aún cuando este folleto se enfoca en la reclasificación de los medicamentos de prescripción a venta sin receta, el término “reclasificación” puede ser empleado también para identificar el cambio al tipo de acceso a dichos productos, en aquellos países donde existan las categorías antes mencionadas. La automedicación responsable con medicamentos de venta sin receta es la forma mas frecuente de cuidado de tipo médico en el mundo. Un número cada vez mayor de gente confía en el auto-diagnóstico de padecimientos menores y tiene la habilidad de tratarse apropiadamente con los medicamentos de venta sin receta, con o sin la intervención inicial de algún profesional de la salud. Un estimado realizado en 2 el año 2002 mostró que más del 92% de la gente había utilizado cuando menos un medicamento de venta sin receta en el año anterior, y que el 55% había usado más de uno. A través de la reclasificación cientos de millones de consumidores alrededor del mundo se han visto beneficiados al tener un acceso más amplio y conveniente a diversas opciones de auto-tratamiento adecuadas. Este empoderamiento de los individuos en el manejo de su propia salud irá siendo cada vez más importante, ya que un mejor autocuidado es esencial para prevenir la futura epidemia global de enfermedades crónicas no transmisibles. Al determinar si un padecimiento es adecuado para auto-tratamiento, y si la reclasificación de un medicamento de prescripción al estatus de venta sin receta es adecuada, pueden plantearse diversas preguntas: — ¿Puede el paciente reconocer los síntomas del padecimiento que sufre? — ¿La enfermedad es autolimitada? — ¿Hay algunos trastornos subyacentes que pudieran ser enmascarados por el auto-tratamiento? — ¿Tiene el producto un amplio margen de seguridad? — ¿Puede usarse de manera segura sin supervisión médica? — ¿Puede el uso del producto llevar a un mal uso, abuso o dependencia? — ¿Puede el producto representar un riesgo a la comunidad si se usa sin supervisión? En el futuro, la reclasificación de medicamentos de prescripción a venta sin receta resulta ser ampliamente prometedora para los gobiernos, ya que les ayuda a aliviar las presiones que enfrenta el sistema formal de salud, toda vez que los consumidores pueden tratar más problemas de salud cotidianos sin los costos que generan para el sistema de salud establecido. Los cambios que pueden esperarse a futuro, podrán igualmente permitir a los médicos dedicar más tiempo y atención a padecimientos más complejos, y los farmacéuticos y otros profesionales de la salud podrán utilizar sus habilidades de comunicación y conocimientos clínicos para ayudar a los consumidores en materia de autocuidado y automedicación. Este folleto hace una revisión de la historia de la reclasificación, sus objetivos y beneficios para la salud pública, apoyada en ejemplos reales y estudios de caso de países, y explora las condiciones y las reglamentaciones que son necesarias para crear un exitoso programa de reclasificación en un determinado país. 3 La reclasificación y el surgimiento global de medicamentos de venta sin receta Sección I 4 “ En el campo de la salud pública, los ciudadanos están tomando de manera creciente, un mayor control del cuidado de su salud… ellos están haciéndose más exigentes y pro-activos en sus preferencias y en la defensa de su propia vida.1 ” Aún cuando ha habido una creciente atención hacia la reclasificación a nivel global, la tendencia en esta materia no es completamente nueva. Muchas reclasificaciones tienen un largo historial de nuevas oportunidades de automedicación para la gente y de seguridad de uso. Las reclasificaciones más antiguas con un largo historial de seguridad incluyen: — Acetaminofen/paracetamol – reclasificado en los 50’s. — Descongestionantes nasales y antihistamínicos – reclasificados en los 70’s. — Productos para el pie de atleta – reclasificados en los 70’s. — Ibuprofén – reclasificado en los 80’s. — Terapia de Reemplazo de la Nicotina (NRT) – reclasificada en los 90’s. Estados Unidos En los Estados Unidos los medicamentos de prescripción y de venta sin receta, se diferenciaron, por primera vez, en 1951, con la Enmienda Durham-Humphrey. Ésta, definió los criterios conforme a los cuales los medicamentos de prescripción podrían ser usados solamente bajo la supervisión de un médico, mientras que todos los demás medicamentos podrían ser vendidos fuera del mostrador. En 1962 las Enmiendas para Medicamentos Kefauver-Harris introdujeron controles más severos. En ese entonces los fabricantes tenían que probar no solamente la seguridad de los productos, sino también, su eficacia en las indicaciones que se tenían previstas para el producto. Estos requerimientos fueron aplicados de manera retroactiva a partir de 1938. Durante un sustancial proceso de evaluación de medicamentos, el personal de la Administración Federal de Alimentos y Medicamentos (FDA) y otros ‘socios en el cuidado de la salud’ reconocieron nuevamente que había algunos medicamentos seguros para ser usados sin la supervisión de un médico. 1 European Commission DG Health and Consumer Protection Future Challenges, Documento 2009-2014. 5 RECLASIFICACIÓN – Reclasificación de medicamentos de prescripción a medicamentos de venta sin receta Sección I Europa Hasta 1980, los padecimientos generalmente considerados como adecuados para ser tratados por la gente, sin la intervención de un médico, eran unos cuantos. Incluían el dolor leve a moderado, tos y resfriados, constipación y problemas menores de la piel tales como heridas y raspones. Sin embargo, en los últimos 20 años, la gente en Europa ha mostrado un creciente deseo por asumir su responsabilidad en todos aquellos temas relacionados con la salud. Este cambio de actitud se reflejó en una gradual modificación en las políticas de salud europeas, en las cuales los gobiernos reconocieron la importancia de desarrollar y aprovechar el potencial que ofrecía el cambio de actitud de sus ciudadanos. Los gobiernos impulsaron activamente este creciente interés de los ciudadanos europeos por tomar una mayor responsabilidad en el cuidado de su salud en la primera parte de los años 90’s, aprobando la reclasificación de un creciente número de ingredientes del estatus de prescripción al de venta sin receta. En el año 2001, la Comisión Europea financió un proyecto de investigación para la industria titulado “Desarrollo de una política de información para productos medicinales2”. El principal objetivo de este proyecto fue el de examinar las necesidades de información tanto del público como de los profesionales de la salud, en un rango de trastornos que pueden ser tratados con medicamentos de venta sin receta, pero que pudiera ser extendido a categorías que, en ese momento, no estaban disponibles para autotratamiento. Este proyecto identificó las etapas que se requieren para el desarrollo de una política centrada en los ciudadanos con un enfoque de salud pública, que pudiera darle a dichos ciudadanos una mayor responsabilidad en el manejo de su propia salud. Los principios de reclasificación han sido también apoyados por la Organización Mundial de la Salud (OMS) en un estudio sobre automedicación en Europa. La conclusión de este análisis consistió en contar con un marco que llevara a un desarrollo ordenado, incluyendo reformas en la educación y en la práctica profesional de los farmacéuticos3. 2 http://www.aesgp.be/ResearchProject/FinalReport.pdf 3 Lund L, Dukes G, eds. The role and function of the pharmacist in Europe. Report of a WHO working group. Groningen: Styx Publications 6 En todo el mundo Un número cada vez mayor de gobiernos han reconocido que la reclasificación puede hacer una contribución significativa a la salud pública. En México, en 1998, la Secretaría de Salud autorizó la reclasificación de 31 ingredientes como de venta sin receta. El principal aspecto en el que se basó la decisión que tomó la Secretaría de Salud fue una comparación a nivel internacional del estatus de prescripción/ venta sin receta de diversos ingredientes. En China, entre 2004 y el inicio de 2006, la Administración Federal de Medicamentos y Alimentos (SFDA) clasificó 4,542 medicamentos como de venta sin receta, incluyendo 3,548 formulados a base de plantas medicinales chinas y 994 medicamentos químicos. En marzo de 2006, se estimó que el 25% de los medicamentos comercializados en China eran de venta sin receta. En Australia, desde 1986, se ha venido publicando un listado que muestra el nivel de acceso autorizado para diversos ‘medicamentos y tóxicos’. Los medicamentos o sustancias para uso terapéutico, están incluidos en los listados 2, 3 y 4. De éstos, los medicamentos que contienen sustancias de los listados 2 ó 3, son considerados como de venta sin receta pero solamente pueden ser adquiridos en una farmacia. Los medicamentos de venta sin receta que contienen sustancias no catalogadas, están disponibles como productos para venta general y pueden ser adquiridos en establecimientos distintos de las farmacias. Desde 1986: – Aproximadamente 65 sustancias han sido reclasificadas de prescripción al listado 3. Estos medicamentos solamente pueden ser adquiridos en una farmacia, después de haber consultado a un farmacéutico – Más de 30 sustancias han sido reclasificadas de prescripción al listado 2, por lo que solamente pueden ser adquiridos en una farmacia – También ha habido un cierto número de modificaciones ‘en reversa’ al estatus de venta bajo prescripción A través de los años, muchas de las sustancias que han sido incluidas en los listados han sido excluidas o han visto modificada su posición entre los diversos listados existentes de venta sin receta, o han llegado a quedar fuera de éstos, haciendo posible de esta manera, que el medicamento sea adquirido en otros establecimientos distintos de las farmacias. Cabe hacer notar que las “reclasificaciones”, ya sea a un listado superior o inferior, pueden ser realizadas ya sea para 7 RECLASIFICACIÓN – Reclasificación de medicamentos de prescripción a medicamentos de venta sin receta Sección I una indicación específica, una forma farmacéutica o una dosis de una sustancia en particular, o para una sustancia en general. En Japón, el Ministerio de Salud y Bienestar emitió en 1967 una notificación sobre clasificación de medicamentos, dividiéndolos en prescripción y venta sin receta, aprobándose en 1983 la primera reclasificación. Este proceso fue impulsado en 2002, con la publicación del Reporte Preliminar sobre la Linearización de los OTC’s por el Ministerio de Salud, Trabajo y Bienestar (MHLW). En 2007, este Ministerio anunció la introducción de un esquema de reclasificación de medicamentos de prescripción a venta sin receta y una revisión hecha por la Sociedad Farmacéutica de Japón de 20 ingredientes candidatos a ser reclasificados, incluyendo medicamentos antialérgicos, AINES, inhibidores de la absorción de glucosa y de la ECA. Con respuestas adicionales de otros ‘socios en el cuidado de la salud’, que incluían las de los representantes de los médicos, el MHLW invitó a las compañías farmacéuticas a considerar la reclasificación de siete ingredientes más en agosto de 2008. En Canadá ha habido una evolución gradual del proceso de reclasificación durante las últimas décadas. Durante los años 80’s un gran número de ingredientes fueron reclasificados (vgr. peróxido de benzoilo, hidrocortisona, ibuprofén) después de llevarse a cabo diversas consultas con grupos de ‘socios en el cuidado de la salud’, en atención a las recomendaciones iniciales provenientes de los comités de asesores expertos que formó el Departamento Federal ‘Health Canada’. Desde los 90’s, todas las reclasificaciones de medicamentos de prescripción a venta sin receta en Canadá, han sido iniciadas por las compañías que las patrocinan, a través de la presentación de Solicitudes Adicionales de Nuevos Medicamentos. Una vez tomada la decisión de modificar el requisito de prescripción por parte del Health Canada, el Comité Asesor Nacional para la Clasificación de Medicamentos (National Scheduling Advisory Committee), un grupo asesor a los gobiernos provinciales, emite una recomendación acerca del lugar de venta para el ingrediente reclasificado (vgr. Listado II: atrás del dispensario en farmacias autorizadas, Listado III: expendedor frontal en farmacias autorizadas, o no listado: venta en cualquier establecimiento). Al inicio de 2009, la Dirección de Productos Naturales para la Salud del Health Canada inició consultas sobre una lista de once medicamentos de prescripción, incluyendo l-triptofano, l-carnitina y lovastatina, que propuso reclasificar al estatus de producto natural para la salud de venta sin receta. Hoy, muchas clases de ingredientes han sido reclasificados en diversos países, siendo las autoridades del Reino Unido, Alemania, Australia y los EUA quienes han encabezado este movimiento (Cuadro 1). 8 Cuadro 1 Algunos ejemplos de reclasificaciones a nivel mundial incluyen – Medicamentos antiinflamatorios no esteroides (AINEs) como: ibuprofén, diclofenaco y naproxén. Estos pueden ser utilizados para el dolor reumático, migraña, dolor leve a moderado, dismenorrea y dolor de garganta – Antihistamínicos como: acrivastina, cetirizina y loratadina para la prevención y tratamiento de la fiebre de heno – Antagonistas H2 como: cimetidina y ranitidina para la indigestión ácida y la acidez estomacal – Inhibidores de la bomba de protones como: omeprazol y pantoprazol para la acidez y la indigestión ácida – Análogos de la vitamina D3, como el calcipotriol para la psoriasis – Levonorgestrel para la anticoncepción hormonal de emergencia – Antimicóticos como: fluconazol para la candidiasis vaginal, amorolfina para las infecciones de las uñas y terbinafina para el pie de atleta – Antivirales como: el penciclovir y aciclovir para herpes labial y oseltamivir para la influenza – Simvastatina para disminuir el colesterol y para prevención de enfermedad coronaria del corazón – Triptanos para la migraña – Antimicrobianos como: el cloranfenicol para conjuntivitis bacteriana y azitromicina para chlamydia – Orlistat para el manejo del sobrepeso y la obesidad Los sitios web de la WSMI y la Asociación de la Industria Europea de Automedicación (AESGP) www.wsmi.org y www.aesgp.be, respectivamente, incluyen una comparación de más de 200 ingredientes y su estatus de clasificación legal en 37 países (ver Apéndice). Las oportunidades para dar a los ciudadanos de muchos países un mayor acceso a medicamentos de venta sin receta aún continúan desaprovechadas. El Apéndice muestra que, de 224 ingredientes disponibles en alguna forma sin prescripción, solamente en 5 de los 36 países que aparecen en dicho Apéndice cuentan con más del 50% de ellos. Más aún, 11 de los 36 mercados de esos países tienen menos del 30% de estos ingredientes disponibles sin prescripción. 9 Objetivos y beneficios de la reclasificación en la salud pública Sección II 10 Beneficios generales de reclasificación La gente se beneficia de diversas maneras si los medicamentos están disponibles ‘fuera del mostrador’ (‘Over–The–Counter’) y se venden sin receta. Así, pueden visitar una farmacia en lugar de esperar por una cita con su médico o pueden tratar trastornos comunes y molestos cuyos síntomas son fácilmente reconocibles, tales como fiebre del heno y herpes labial, y reducir el tiempo desde la aparición de los síntomas hasta su tratamiento. También pueden obtener más fácilmente productos en momentos críticos, tales como los anticonceptivos hormonales de emergencia que deben tomarse tempranamente a efecto de que sean más efectivos. Es interesante tener en cuenta que el problema más significativo que enfrenta la gente que se trata a si misma con medicamentos de prescripción (en países donde la aplicación de las disposiciones legales relativas a la venta de los medicamentos de este tipo es insuficiente) es el hecho de ver reducida la disponibilidad de un mayor número de medicamentos de venta sin receta. Un estudio llevado a cabo en México mostró un descenso del 20% en el grado de auto-prescripción en 10 años, entre 1989 y 1999. Esto fue atribuido al importante número de reclasificaciones que autorizó la Secretaría de Salud de México 1995 y 1998.4 Esta observación se apoya por la declaración que hizo la Organización Mundial de la Salud (WHO) respecto a las principales guías sobre medicamentos de venta sin receta: “…en algunos países un gran número de productos medicinales originalmente destinados, de manera inicial, para su uso bajo supervisión médica son, de hecho, ampliamente vendidos sin receta. En estas circunstancias, el reconocimiento real de la situación de automedicación y la introducción de medidas de seguridad apropiadas (vgr. tamaños de empaque y textos que se adoptan) pueden ser más del interés de la salud pública que el mantener un estatus de prescripción meramente teórico. La posibilidad de considerar la reclasificación al estatus de venta sin receta, en base a las experiencias en otros países, debe tenerse en la mente.” 5 4 Bolaños, H. Responsible Self-Medication in Latin America. Drug Information Journal, 2005, 39: 99. 5 WHO. Guidelines for the Regulatory Assessment of Medicinal Products for use in Self-Medication. WHO Geneva 2000, p21. 11 RECLASIFICACIÓN – Reclasificación de medicamentos de prescripción a medicamentos de venta sin receta Sección II Desde la perspectiva de los profesionales de la salud, la reclasificación implica que los médicos ya no tienen que verse presionados en una cirugía, porque les está esperando mucha gente que sufre problemas que ellos pueden tratar, o emitir recetas para padecimientos menores. Por su parte, los farmacéuticos pueden hacer mejor uso de sus habilidades profesionales al recomendar acciones adecuadas de autocuidado y de uso responsable de medicamentos de venta sin receta. La gente generalmente pagará directamente por los medicamentos de venta sin receta que compra y el gasto en medicamentos que hacen las aseguradoras y los gobiernos puede ser redirigido o disminuido. La reclasificación en apoyo de mejores conductas de autocuidado “ Los sistemas del cuidado de la salud en todas las regiones se encuentran bajo presión y no pueden manejarla si continúan centrándose en la enfermedad, en lugar de en los pacientes; dichos sistemas requieren que los pacientes se involucren individualmente, y se adhieran a su tratamiento y, que hagan cambios en su actitud y lleven a cabo un automanejo.6 ” Los sistemas de salud alrededor del mundo han evolucionado para concentrarse en el tratamiento de enfermedades transmisibles, basándose en un ‘modelo biomédico’ (Cuadro 2)7. Son, en esencia, ‘servicios de enfermedad’. 6 International Alliance of Patients Organisations, 2007 7 Jane Ogden. Health Psychology. McGraw Hill 2007, p. 2 12 Cuadro 2 Características del modelo biomédico de los sistemas de salud – Las enfermedades vienen de fuera, o se originan como cambios físicos internos involuntarios. Los pacientes son ‘víctimas’ pasivas – Se enfoca en el tratamiento de las enfermedades en lugar de prevenirlas – El tratamiento con medicamentos, vacunas, cirugía, etc., está diseñado para cambiar el estado físico del cuerpo en respuesta a la enfermedad – La profesión médica es la única responsable del tratamiento – Los componentes psicológicos y sociales de la enfermedad no se consideran significativos – El autocuidado y la automedicación responsable no se consideran importantes – No se les presta mayor atención a los factores de riesgo auto-impuestos de las enfermedades crónicas, tales como uso de tabaco, obesidad, ejercicio físico insuficiente, etc. Los sistemas de salud no han evolucionado de tal forma que tomen en cuenta las principales causas de muerte y discapacidad futuras, tales como las enfermedades crónicas no transmisibles. Sin embargo, las enfermedades no transmisibles (crónicas), (enfermedades cardiovasculares, cáncer, enfermedades respiratorias crónicas y diabetes) están surgiendo ahora como la principal fuente de la carga de enfermedades, tanto en los países desarrollados como en los que están en vías de desarrollo (ver más adelante). La principal característica de estas enfermedades es que son sustancialmente prevenibles a través de la adopción de conductas de autocuidado apropiados. Los sistemas de salud actuales –servicios de enfermedad– no están adecuadamente orientados hacia la prevención de enfermedades y a un mejor ejercicio del autocuidado. La investigación ha mostrado que una buena conducta en materia de salud, incluyendo un mejor ejercicio del autocuidado, está influida por una compleja combinación de factores psicológicos además del conocimiento y otros factores sociales, ambientales y económicos. Uno de los factores ambientales consiste en la disponibilidad de medicamentos eficaces de venta sin receta, que le ayudan a la gente a tener un sentido de control sobre la situación de su salud. Por lo tanto, los programas de reclasificación pueden ayudar a enfrentar las amenazas que enfrenta la salud pública por el surgimiento de las enfermedades crónicas, al darle a la gente la capacidad de cuidarse a si misma mejor, en lugar de sólo ser receptores pasivos del cuidado que ofrecen los cada vez más limitados sistemas de salud. 13 RECLASIFICACIÓN – Reclasificación de medicamentos de prescripción a medicamentos de venta sin receta Sección II El abordaje global de las enfermedades crónicas a través de la reclasificación “ Sin llevar a cabo ninguna acción, se estima que 388 millones de personas morirán de enfermedades crónicas en los próximos 10 años. Cada uno de nosotros tiene una opción: ya sea continuar con el status quo, o tomar el reto e invertir ahora en la prevención de las enfermedades crónicas.8 ” A nivel global, de los 58 millones de muertes en el 2005, aproximadamente 35 millones serán resultado de enfermedades crónicas tales como las cardiacas, las apoplejías, el cáncer, la enfermedad respiratoria crónica y la diabetes. Este número es equivalente al doble de las muertes causadas por enfermedades infecciosas (incluyendo VIH/SIDA, tuberculosis y malaria), padecimientos maternos y perinatales y deficiencias nutricionales combinadas. Cuatro de cada cinco muertes por enfermedades crónicas se encuentran en países de ingreso bajo y medio.8 De hecho, los factores de riesgo comunes modificables, subyacen en las principales enfermedades crónicas. Éstos, incluyen el uso de tabaco, la obesidad y los niveles elevados de colesterol. Reclasificar algunos medicamentos al estatus de venta sin receta puede contribuir significativamente a hacer frente a estos factores de riesgo, al capacitar a la gente a cuidarse a sí misma a través de mejores conductas de autocuidado. Tratamiento de la dependencia al tabaco con Terapia de Reemplazo de Nicotina (TRN) “ ¡Finalmente lo logré! Después de todos esos días con 20 al día. Estuve a punto de conseguir mí acostumbrada cajetilla de cigarros en la estación de gasolina, pero reaccioné momentáneamente y compré en vez de ésta, la Terapia de Reemplazo de Nicotina. Eso fue hace dos años y no he dado una bocanada de tabaco desde entonces… ” Mujer británica, 47 años de edad, 2008. 8 WHO. Preventing Chronic Diseases. A vital investment. WHO 2005. 14 Fumar tabaco es una de las causas principales de muerte alrededor del mundo. Suma actualmente 5.4 millones de muertes al año, aproximadamente, y con una predicción de 8 millones de muertes por año, dentro de los siguientes 20 años.9 Las tasas de abandono varían; por ejemplo en Europa, sólo el 21% de los fumadores logran dejar de fumar cada año, mientras que diariamente entre 80,000 a 100,000 jóvenes alrededor del mundo se vuelven adictos al tabaco. Tan sólo poco más de un tercio (37%) de los fumadores han usado en la vida la Terapia de Reemplazo de Nicotina (TNR) de venta sin receta. La TRN es un tipo de medicamento que libera nicotina, lo cual ayuda a la gente a dejar de fumar al actuar sobre los receptores cerebrales de nicotina, reduciéndose, de esta manera, los síntomas de abstinencia. Es una forma ‘limpia’ de administrar nicotina, que no se acompaña por los principales carcinógenos y otras sustancias tóxicas que se encuentran en los productos de tabaco y las que producen la misma combustión. Hay varios métodos para administrar TRN, tales como parches transdérmicos que liberan una cantidad relativamente uniforme de nicotina durante el tiempo que son aplicados, así como diversos métodos de dosificación agudas incluyendo gomas de mascar, inhaladores, aerosoles, tabletas y tabletas de disolución inmediata. Muchos países forman hoy parte de la Convención Marco de Control de Tabaco de la OMS (Framework Convention on Tobacco Control – FCTC) la cuál apoya el compromiso de reducir la demanda de tabaco a través de diversas medidas, incluyendo el hecho de facilitar el acceso a tratamientos farmacéuticos para combatir la dependencia de tabaco. El artículo 14 de la FCTC de la OMS, requiere que todas las partes involucradas implementen medidas para el manejo y tratamiento de la dependencia al tabaco, incluyendo productos farmacéuticos como la TRN. La disponibilidad de esta Terapia varía de manera importante de país en país, del hecho de estar disponible en farmacias, tiendas de abarrotes o a través de clínicas de especialistas para dejar de fumar, enfermeras y médicos, a sólo estar disponible bajo receta El fácil acceso a la TRN es crítico. Se ha demostrado que una proporción significativa de intentos para dejar de fumar no son planeados, y aún así, tienen una buena posibilidad de llegar a ser exitosos.10 La TRN ha estado disponible en muchos países de altos ingresos por muchos años y ha sido intensivamente motivo de estudio respecto de su eficacia, seguridad, 9 http://www.who.int/selection_medicines/committees/expert/17/application/NRT_inclusion.pdf 10West R, Sohal T. Catastrophic pathways to smoking cessation: findings from national survey. BMJ 2006, 1 February: 332 15 RECLASIFICACIÓN – Reclasificación de medicamentos de prescripción a medicamentos de venta sin receta Sección II efectos adversos, costo y costo–efectividad. Existe evidencia sólida y consistente de que el uso de la TRN incrementa la tasa de éxito de dejar de fumar y es costo–efectiva. La Biblioteca Cochrane ha hecho una revisión sistemática, desde 1994, acerca de la efectividad de la TRN para la población general. La séptima actualización fue publicada en 2008 y concluyó que todas las formas disponibles de TRN pueden incrementar las posibilidades de la gente para dejar de fumar. Gracias a la disponibilidad de la TRN como un producto de venta sin receta, su uso se incrementó en 152%, en el primer año después de su reclasificación. Esto se ha traducido en un estimado de 114,000 a 300,000 nuevos ex-fumadores por año en los EUA.11 La reclasificación de los productos de TRN para dejar de fumar en Australia ha traído consigo un estimado de 68,750 muertes prematuras prevenidas durante los 10 años en que la TRN ha estado disponible como un medicamento de venta sin receta en ese país12. No es de extrañar que en el 2009 la OMS y el 17o Comité Experto en la Selección y Uso de Medicamentos Esenciales, aprobara la inclusión de la TRN en la 16a Lista Modelo de Medicamentos Esenciales (la ‘Lista de Medicamentos Esenciales’). Tratamiento de la obesidad con orlistat “ Yo estaba cansada de los comentarios de mi doctor y de los programas para bajar de peso, que empezaban bien pero eran difíciles de mantener. Con el orlistat que compré en la farmacia para ayudarme puedo seguir con mis programas ¡y con mi doctor! ” Mujer británica en un foro de pacientes, 2009 El manejo del sobrepeso y la obesidad son áreas que han sido recientemente agregadas al campo del autocuidado. Tener sobrepeso u obesidad incrementa el riesgo de hipertensión, de enfermedad coronaria del corazón, diabetes y muerte prematura. Los principales programas comerciales para bajar de peso 11Shiffman S et al. Public Health Benefit of Over-the Counter Nicotine Medicines. Tobacco Control 306 1997. 12Bittoun R. Brain and Mind Research Institute, University of Sydney, Australia. A decade of over-the-counter therapeutic nicotine in Australia. Its contribution to improving quit rates and saving lives. May 2007 16 ha reportado resultados desalentadores. Particularmente se ha demostrado que los individuos no logran bajar y mantener una pérdida de peso del 5%, que es la recomendada para obtener un “claro beneficio a la salud”. Diversos estudios han apuntado a la necesidad de contar con enfoques coadyuvantes más eficaces y seguros, como la farmacoterapia. En muchos países alrededor del mundo, los medicamentos para bajar de peso han estado circunscritos al estatus de venta bajo receta únicamente. La reciente reclasificación del orlistat en diversos países, combinado con una dieta modificada ha llenado un importante vacío en el manejo del sobrepeso. En Australia y Nueva Zelanda, el orlistat ha sido clasificado en el listado 3, lo que significa que está disponible sin receta a condición de que los consumidores reciban asesoría. El orlistat ahora está disponible como un medicamento de venta sin receta en China, Filipinas, Singapur y los Estados Unidos. En 2009, el orlistat fue objeto de la primera reclasificación autorizada, de manera centralizada, en Europa por la Agencia de Evaluación de Medicamentos Europea (EMEA) para ayudar a frenar el incremento en la prevalencia de enfermedad cardiaca, convirtiéndose así en el primer auxiliar para la pérdida de peso autorizado para su venta sin receta en toda Europa. Tratamiento del aumento del colesterol con simvastatina La simvastatina ha sido reclasificada como un medicamento de venta exclusiva en farmacias en el Reino Unido, para toda aquella gente que actualmente tiene un riesgo moderado de sufrir un ataque cardiaco en los próximos 10 años. Los datos de eficacia considerados por la agencia reguladora del Reino Unido para su reclasificación, demostraron que este producto puede reducir significativamente el colesterol ‘malo’ (lipoproteína de baja densidad o LDL) en el cuerpo, en aproximadamente un 27% después de 4 semanas. La reducción en este orden, disminuye el riesgo de un evento coronario mayor (muerte o infarto al miocardio no-fatal) en alrededor de un tercio después de 3 años de tratamiento. Cabe mencionar que el nivel de reducción de riesgo absoluto depende del nivel de riesgo inicial. En el Reino Unido, el farmacéutico asesora a los consumidores acerca de si este medicamento es apropiado para ellos, además de proporcionarles información acerca de los factores de riesgo relacionados con enfermedad coronaria del corazón y brindarles información acerca de los estilos de vida 17 RECLASIFICACIÓN – Reclasificación de medicamentos de prescripción a medicamentos de venta sin receta Sección II apropiados. Los individuos que tienen un riesgo moderado de un ataque cardiaco en los próximos 10 años, se verán beneficiados al reducir sus niveles de colesterol, independientemente de los que inicialmente tenían. Los consumidores en el Reino Unido no están obligados a realizarse una medición de sus niveles de colesterol antes de empezar a tomar simvastatina. Después de 5 años de uso de este ingrediente como medicamento de venta sin receta, los datos recabados a través de los reportes de farmacovigilancia no muestran ningún problema significativo asociado con esta reclasificación. Los ejemplos de la TRN, orlistat y simvastatina ilustran cómo el hecho de reclasificar algunos medicamentos como de venta sin receta, puede hacer una contribución importante en contra de los factores de riesgo más significativos que enfrentan la mayoría de los países, al ayudarle a la gente a disminuir dichos factores en las enfermedades crónicas. Algunas otras reclasificaciones importantes “ Como mucha gente, yo sufro de migraña y los triptanos son los únicos medicamentos que yo sé que trabajan cuando tengo una migraña o siento que está llegando. Para mi, los triptanos son nada menos que milagrosos y estoy desconcertado por qué otros países aun no los tienen disponibles como medicamentos de venta sin receta. ” Consumidor alemán, 2009 Durante los últimos 10 años, la situación de la automedicación en muchos países se ha transformado por la introducción de nuevos productos que ofrecen diferentes formas de administración como parches y tabletas de disolución instantánea; nuevas combinaciones o tratamientos como la dimeticona para la erradicación de piojos, una indicación existente; triptanos para la migraña, nuevas indicaciones como el síndrome de colon irritable y los inhibidores de la bomba de protones para la prevención de la acidez estomacal. Hoy en día, en muchas categorías de medicamentos de venta sin receta el producto más empleado es aquel que fue reclasificado de estar bajo control de una prescripción. 18 Algunos otros ejemplos de reclasificaciones importantes incluyen las gotas oftálmicas de cloranfenicol. El cloranfenicol tópico está disponible en el Reino Unido, Bélgica y Portugal para el tratamiento de la conjuntivitis bacteriana aguda. La reclasificación de las gotas oftálmicas de cloranfenicol como medicamento de prescripción a venta sin receta, le permite al farmacéutico dispensar un medicamento eficaz que está considerado como el de elección para el tratamiento de la conjuntivitis bacteriana. En el 2008, la azitromicina se convirtió en el primer antibiótico por vía oral en estar a disposición del público, a través de un farmacéutico, sin necesidad de presentar una receta médica para el tratamiento de las infecciones asintomáticas por chlamydia en el Reino Unido. La azitromicina está disponible para personas de 16 años, y mayores, si sus pruebas resultan positivas y no presentan síntomas. Esta disponibilidad se extiende a sus parejas sexuales. La chlamydia es la enfermedad de transmisión sexual más común en el Reino Unido, ya que hasta un 70% de la gente la tiene sin presentar síntoma alguno y por lo tanto podría no ser diagnosticada. Esto conlleva a un enorme riesgo de complicaciones serias para la salud a largo plazo, incluyendo infertilidad y embarazo ectópico. Los individuos infectados por chlamydia que no presentan ningún síntoma y sus parejas, ahora son capaces de obtener un tratamiento conveniente y eficaz en su farmacia local después de que se confirma el diagnóstico de chlamydia por una simple prueba en orina. La anticoncepción hormonal de emergencia con productos conteniendo levonorgestrel están ahora disponibles en muchos países como un producto de venta sin receta, en consideración a que la seguridad de este medicamento está bien documentada y que la anticoncepción de emergencia para evitar embarazos no planeados es un área donde claramente el acceso a tiempo importa. Una encuesta llevada a cabo entre 2000 y 2002 por la Oficina para Estadísticas Nacionales del Reino Unido concluyó que la disponibilidad de la contracepción hormonal de emergencia como un producto de venta sin receta no elevó la proporción de mujeres que utilizaron la contracepción hormonal de emergencia, más de una vez, durante un año. Las mujeres prefirieron obtener la anticoncepción hormonal de emergencia, de esta manera, en lugar de hacerlo a través de un doctor, habiendo comprendido sus alcances en una gran proporción de los casos, además de haber generado ahorros en tiempo y aportado recursos para el servicio de salud. El hecho de 19 RECLASIFICACIÓN – Reclasificación de medicamentos de prescripción a medicamentos de venta sin receta Sección II hacer de la anticoncepción hormonal de emergencia un medicamento de venta sin receta en el Reino Unido, no llevó a un incremento en su uso o a un aumento en la actividad sexual sin protección o a una disminución en el uso de métodos más confiables de anticoncepción.13 El fluconazol oral ha sido reclasificado al estatus de venta sin receta en muchos países para el tratamiento de la candidiasis vaginal y la balanitis por cándida asociada. Estas enfermedades ocurren de manera muy común y presentan síntomas fácilmente reconocibles. La candidiasis vaginal es una de las infecciones más comunes que atienden los médicos, pues hasta el 75% de las mujeres sufren un episodio de candidiasis en algún momento de su vida y alrededor de la mitad tienen más de un episodio. La gente está capacitada para tratar esta enfermedad con un medicamento de venta sin receta, por lo que esta disponibilidad reduce el retraso en el inicio del tratamiento y puede también hacer menos penosas ciertas situaciones para el paciente. “ Bueno, yo soy alérgico a literalmente cualquier cosa: polvo, árboles, hierbas, moho, cucarachas, ácaros del polvo, lo que sea. Y he aprendido que el duro camino de tomar un antihistamínico diariamente, en mi caso cetirizina, es una necesidad durante todo el año ¡Qué alivio cuando la cetirizina finalmente se convirtió en un medicamento de venta sin receta al final del año pasado! No tenía sentido para mí por qué tenía que visitar al doctor para tomar un medicamento cuando yo conocía mis síntomas tan bien y había estado feliz con la cetirizina durante años. ” Hombre estadounidense de 40 años de edad, 2008 13Marston C et al. Impact on contraceptive practice of making emergency hormonal contraception available over the counter in Great Britain: repeated cross-sectional surveys. BMJ 2005, July 30: 331. 20 Estudios del beneficio económico de la reclasificación El costo real de obtener un medicamento de receta actualmente incluye el de la consulta médica. Aun cuando algunos pacientes asegurados podrían hacer desembolsos más elevados, al pagar por medicamentos de venta sin receta, evidencias provenientes de las reclasificaciones más recientes, demuestran que la mayoría de los pacientes se benefician de manera general por la disponibilidad de medicamentos de venta sin receta.14,15 Estudios hechos en Estados Unidos,16 Europa,17 el Reino Unido18 y en otros países, han mostrado consistentemente que existen beneficios económicos netos de consideración con la reclasificación de algunos medicamentos al estatus de venta sin receta. Estos beneficios provienen de un incremento en los beneficios adicionales que obtiene el consumidor en materia de ahorros en el tiempo que utiliza en la visita al médico y en el transporte hacia y desde el consultorio. En Australia se llevó a cabo una investigación sobre la naturaleza y el monto de los beneficios económicos del uso de medicamentos de venta sin receta19. Esta investigación analizó los beneficios provenientes del uso de estos medicamentos, tales como la disminución en la presión por el cuidado profesional, el beneficio adicional para el consumidor y los de tipo general que se generan para la balanza comercial de Australia. En un estudio inicial se estimó que el beneficio potencial de reclasificar más ingredientes al estatus de venta sin receta podría ser tan alto hasta alcanzar los $200 o $300 millones de dólares australianos. 14Cohen JP, Paquette C, Cairns CP. Switching prescription drugs to over the counter. BMJ 2005 330: 39 15Sullivan PW. Switching prescription drugs to over the counter: Consumers may benefit financially. BMJ 2005, 330, 904. 16Temin P. Costs, benefits, and politics in switching drugs from prescription to over-the- counter in the United-States. J. Social Admin. Pharmacy, 1984, Suppl. 1: 189. 17AESGP. The Economic and Public Health Value of Self-Medication. Brussels, June 2004, 74 pp. 18Ryan M, Yule, B. “Switching drugs from prescription to OTC availability; economic benefits in the UK” Health Policy 1990, 16: 233. 19Johnson LW. School of Business, Bond University, Gold Coast, Queensland, Australia. 21 RECLASIFICACIÓN – Reclasificación de medicamentos de prescripción a medicamentos de venta sin receta Sección II Un estudio publicado en Suecia concluyó que los beneficios de la reclasificación de más ingredientes al estatus de automedicación, superarían claramente sus posibles inconvenientes20. Esta investigación mostró que una reclasificación reduce el número de visitas médicas entre un 15% a 24%, y el de las recetas entre un 6% y 70%, lo que conlleva una disminución en los costos del cuidado de la salud. Tos y resfriado: Una investigación realizada entre 1976 y 1989 mostró que gracias a la reclasificación de todos los ingredientes para tos y resfriado en los EUA21 se han venido ahorrando $750 millones anualmente. En promedio, las visitas al médico para el alivio de estos síntomas disminuyeron en 110,000 visitas al año. Dado que el costo de una visita al doctor incluye la consulta, el transporte y el tiempo invertido en el viaje y en la espera en el consultorio, en 1989, el costo total de una visita fue de $42 dólares. Gracias a la política de reclasificación de la FDA, hubo 16,500 consultas menos para resfriados, que quince años antes, lo que dio como resultado un ahorro en recursos para la salud de $70 millones de dólares en el año antes mencionado. La investigación concluyó que en los últimos 14 años, con un 5% más de población y un 20% de incremento en el precio de las visitas al doctor, la disponibilidad de productos de venta sin receta para la tos y el resfriado habrá generado ahorros de cerca de un billón de dólares. Un estudio actualizado realizado por investigadores de la Northwestern University de los Estados Unidos, encontró que los medicamentos de venta sin receta para tratar las infecciones comunes del tracto respiratorio superior podrían generar ahorros por 4.75 billones de dólares al año. Este ahorro provendría de mejorar la productividad en el trabajo, reducir las visitas innecesarias al doctor y el tomar medicamentos de prescripción solamente cuando es adecuado.22 20Swedish Institute for Health Economics (IHE). On the Economic benefits of switching medicinal products to OTC status. March 2008. 21Temin P. Realized benefits from Switching Drugs. J. Law & Economics 1992, XXXV: 351 22Lipsky M et al. An Economic Analysis for Treating Viral Upper Respiratory Tract Infection in the United States. Paper presented to the World Self-Medication Industry Asia Pacific Regional Conference, October 28 2004. 22 Acidez estomacal: En 2009 un estudio mostró que al reclasificar las terapias para la acidez estomacal como de venta sin receta, les ahorró a los pacientes un promedio de $174 dólares en cuestión de consultas al médico y costos de los medicamentos por año. Adicionalmente, alrededor de $757 millones de dólares en ahorros anuales para el sistema de cuidado de la salud de los Estados Unidos, fueron atribuidos a la reducción de las visitas al médico. Todos estos hallazgos son reflejo de la evolución que han tenido los tratamientos para la acidez y de que la disponibilidad de opciones de tratamientos sin receta se han expandido en los últimos 15 años al incluir antiácidos, bloqueadores H2 e inhibidores de la bomba de protones.23 Candidiasis vaginal: En los Estados Unidos los antimicóticos vaginales estuvieron a disposición del público desde enero de 1991. La investigación llevada a cabo en este caso mostró una disminución del 15% en el número de visitas al doctor para el tratamiento de la vaginitis durante un periodo de 4 años, atribuido a la disponibilidad de productos antimicóticos de venta sin receta24. Esta disminución resultó en aproximadamente 45 millones de dólares de ahorro en costos directos para las aseguradoras y otros 18.75 millones de dólares en ahorros indirectos para el paciente, al reducirse el tiempo perdido de trabajo. En resumen, aparte de los beneficios para el cuidado de la salud, los estudios económicos confirman la sustancial reducción en los costos de los sistemas de salud resultantes de diferentes reclasificaciones. 23http://www.chpa-info.org/media/resources/r_5333.pdf 24Lipsky MS et al. Impact of Vaginal Antifungal Products on Utilization of Health Care Services: Evidence from Physicians Visits. J. Am Board Fam. Pract. 2000, 13: 178 23 Reclasificaciones futuras Sección III 24 “ Para los pacientes, la tendencia hacia más reclasificaciones llevará al autocuidado, a un nuevo nivel centrado, de manera creciente, en la prevención a largo plazo de enfermedades graves.25 ” En el pasado, un medicamento de prescripción se convertía en un candidato para la reclasificación, y consecuentemente para estar disponible como de venta sin receta, si era usado en un padecimiento cuyos síntomas eran fácilmente reconocibles y si contaba con un alto margen de seguridad en condiciones de una amplia disponibilidad. Hoy en día, los años de experiencia de muchos países que cuentan con una cantidad importante de ingredientes de venta sin receta y con un creciente interés y conocimiento de los pacientes y consumidores acerca del autocuidado y la automedicación, proporcionan una buena base para extender la reclasificación del estatus de prescripción a venta sin receta. La evolución de las tendencias en materia de reclasificación, ha llevado a la expansión de todas aquellas indicaciones susceptibles de auto–tratamiento dentro del campo de uso a largo plazo, bien sea en padecimientos crónicos o en los casos en los cuales el médico hace un diagnóstico inicial. Esto ha dado como resultado que más enfermedades ahora están siendo consideradas para reclasificarse como de autocuidado con medicamentos de venta sin receta. Identificando nuevas aéreas para reclasificación En 2001, la European Self-Medication Industry Association (AESGP), apoyada por la Comisión Europea, encabezó un grupo de trabajo que examinó como podría lograrse una expansión en el papel que tienen los productos de automedicación. Este grupo de trabajo incluyó representantes de las organizaciones “umbrella” de médicos, farmacéuticos, y consumidores, así como de las asociaciones nacionales de médicos y farmacéuticos y autoridades regulatorias. El grupo de trabajo buscó la manera de revisar las indicaciones o padecimientos que podrían ser considerados para automedicación en el futuro. 25Cohen JP et al. Switching prescription drugs to over the counter. BMJ 2005, 330, 39-41. 25 RECLASIFICACIÓN – Reclasificación de medicamentos de prescripción a medicamentos de venta sin receta Sección III Uno de los resultados de este grupo de trabajo, consistió en el desarrollo de una tabla en la que las indicaciones fueron mapeadas de acuerdo a las dos siguientes dimensiones: – ¿Se trata de un padecimiento agudo que requiere del uso a corto plazo de un medicamento, de un trastorno semi-crónico en el que se necesita usar de manera recurrente un producto de este tipo o de un padecimiento crónico que requiere del uso a largo plazo de un cierto medicamento? – ¿Se trata de un padecimiento que puede ser fácilmente auto-diagnosticable y auto-manejable o es un padecimiento que requiere consulta previa y el diagnóstico de un médico? La Gráfica 1 muestra los resultados de este ejercicio, en el que se mapea tanto el rango de indicaciones actualmente adecuadas para automedicación, en la mitad superior de la tabla, además de identificar otras sujetas a consideración. Esta Tabla proporciona una buena base de discusión entre ‘los socios para el cuidado de la salud’ sobre las indicaciones potenciales a ser reclasificadas. Campo de la automedicación tradicional Para las indicaciones listadas en la mitad superior de la Gráfica que constituyen el campo tradicional de la automedicación, las siguientes preguntas son hechas generalmente a efecto de determinar si la indicación es susceptible de auto-tratamiento: – ¿Puede el paciente reconocer los síntomas del padecimiento? – ¿La enfermedad es auto-limitada? – ¿Existen algunos otros problemas subyacentes que puedan ser enmascarados por el auto-tratamiento? – ¿Cuenta el producto con un amplio margen de seguridad? – ¿Puede utilizarse el producto de manera segura sin supervisión médica? – ¿Puede usarse el producto de manera inadecuada o provocar abuso o dependencia? – ¿Puede representar el producto un riesgo para la comunidad si se utiliza sin supervisión? 26 Gráfica 1Padecimientos mapeados de acuerdo a su potencial de automanejo y su cronicidad • Acné • Conjuntivitis alérgica • Resfriado • Herpes labial • Constipación • Tos • Diarrea • Anticoncepción de emergencia • Disfunción eréctil • Fiebre • Prevención de gripe • Tratamiento de gripe • Hemorroides • Prevención de fiebre de heno • Dolor de cabeza Auto-diagnóstico y auto-manejo • Indigestión/acidez • Insomnio (temporal) • Dolor leve a moderado • Cortes y contusiones leves • Ulceras de la boca • Náusea por causas conocidas • Dejar de fumar • Dolor de garganta • Síntomas de tensión pre-menstrual • Infecciones bacterianas tópicas • Manejo del sobrepeso Uso a corto plazo/ padecimientos agudos • Dolor artrítico • Prevención de caries • Disminución de colesterol/control de lípidos • Dermatitis/eczema • Tratamiento de la fiebre de heno •Calvicie masculina • Prevención de defectos del tubo neural Padecimientos recurrentes/semi-crónicos • Conjuntivitis bacteriana • Cistitis • Angina inducida por el ejercicio • Infecciones por helmintos • Infecciones del tracto urinario inferior • Candidiasis vaginal Uso a largo plazo/ padecimientos crónicos • Incontinencia • Ansiedad • Enfermedad inflamatoria • Asma del colon • Hipertrofia prostática • Síndrome de intestino benigna irritable • Insomnio crónico • Depresión (leve a moderada) • Prevención de malaria • Síndrome de menopausia • Diabetes (prevención de • Migraña complicaciones y tratamiento con agentes orales) • Obesidad • Gota • Anticoncepción oral • Prevención de enfermedad • Profilaxis de osteoporosis cardiaca • Psoriasis (leve) • Herpes genital • Reumatismo • Hipertensión • Úlceras venosas en las piernas Consultas al médico y asesoría de otro profesional de la salud y auto-manejo por el paciente (con/sin dispositivos médicos) 27 RECLASIFICACIÓN – Reclasificación de medicamentos de prescripción a medicamentos de venta sin receta Sección III Indicaciones de cuidado colaborativo Los padecimientos que están listados en el cuadrante inferior izquierdo, gradualmente han llegado a estar disponibles con cierta frecuencia como de automedicación en ciertos países, bajo el esquema de “cuidado colaborativo”. Esto significa que la gente va frecuentemente al doctor cuando se presentan los síntomas de estos padecimientos por primera ocasión. Una vez que el doctor ha hecho el diagnóstico correspondiente, la gente es capaz de reconocer los síntomas cuando estos vuelven a presentarse y tratan el padecimiento con un medicamento disponible sin receta. En este esquema el farmacéutico también puede proporcionar información y asesoría valiosa acerca del tratamiento apropiado y de la necesidad de consultar al doctor nuevamente, en aquellos casos en que llegan a presentar alguna variación. Indicaciones que podrían ser adecuadas para automedicación en el futuro El cuadrante inferior derecho de la Tabla incluye los padecimientos identificados por el grupo de trabajo como posibles nuevas áreas para tratamiento bajo el esquema de ‘cuidado colaborativo’. De acuerdo con el grupo de trabajo antes referido, hay necesidad de hacer las siguientes preguntas adicionales para determinar si estas nuevas indicaciones podrían ser adecuadas para auto-tratamiento: – ¿El padecimiento pone en peligro la vida? – ¿Puede mejorarse el manejo del padecimiento/enfermedad a través de un mayor acceso a medicamentos disponibles sin receta? – ¿Pueden realizar los pacientes un auto-monitoreo de manera adecuada (vgr. a través del uso de un dispositivo) y tratar enfermedades asintomáticas por ellos mismos? – ¿El padecimiento se comporta de manera estable durante el periodo recomendado de tratamiento? – ¿El régimen de tratamiento es simple y fácil de seguir o requiere de titulación de las dosis? – ¿Qué es un cumplimiento aceptable/y el no cumplimiento del tratamiento de la enfermedad? 28 Un estudio de caso ilustrativo de un candidato futuro para reclasificación: incontinencia urinaria aguda, aparece en el Cuadro 3. Cuadro 3 Estudio de caso: Incontinencia aguda como un futuro candidato para reclasificación La vejiga sobreactiva/incontinencia aguda es un padecimiento común que afecta a millones de personas e impacta negativamente su calidad de vida. Cerca de la mitad de quienes la sufren, tienen que cambiar su estilo de vida con el objeto de lidiar con el padecimiento además de considerarlo como un problema significativo. Muchas de las personas afectadas no buscan ayuda porque se avergüenzan de hacerlo o porque no saben que existe ayuda disponible. Aproximadamente la cuarta parte de ellas nunca han platicado acerca del problema con su médico. De llevarse este padecimiento al área de autocuidado, a través de la automedicación, sería posible incrementar la conciencia que existe a nivel de la opinión pública sobre el padecimiento y se informaría a quienes lo sufren, que hay algo que pueden hacer acerca del mismo. La incontinencia aguda es fácilmente identificable por el consumidor. Así, es razonable esperar que el consumidor pueda diferenciar entre la incontinencia “aguda” de la incontinencia por “stress” (escape de orina por la risa, la tos o los estornudos), a través de las instrucciones que se provean en las etiquetas. Un etiquetado adecuado también puede ayudar a identificar otros padecimientos. La oxibutinina y la tolterodina, medicamentos comúnmente usados para el tratamiento de la incontinencia aguda, han demostrado contar con un perfil de eficacia y seguridad que los hace, por estas razones, medicamentos potencialmente utilizables para ser usados sin una receta médica. 29 RECLASIFICACIÓN – Reclasificación de medicamentos de prescripción a medicamentos de venta sin receta Sección III Al analizar que tan conveniente es el estatus de venta sin receta, la OMS estableció lo siguiente en el documento más importante sobre regulación de medicamentos para automedicación:26 “Las características de riesgo/beneficio potenciales de un medicamento de automedicación, deben ser planteadas en relación a las que tiene como medicamento de prescripción. No puede asumirse que el estatus de medicamento de prescripción necesariamente provee una mayor garantía de seguridad que el de no prescripción. Por ejemplo, cuando se ha considerado que es preferible el estatus de prescripción porque el medico puede realizar ciertas pruebas diagnósticas o de sensibilidad, antes de seleccionar un producto, o porque se busca asegurar un buen cumplimiento por parte del paciente o para tomar las acciones necesarias a fin de evitar efectos adversos o interacciones, es importante saber si en la práctica los médicos pueden realizar estas tareas. Si ellos comúnmente no lo hacen, el hecho de contar con un medicamento de automedicación, con advertencias adecuadas, puede aportar un importante grado de seguridad para el usuario. De manera similar, existen en algunos países un gran número de medicamentos inicialmente indicados para su uso bajo supervisión médica que son, de hecho, vendidos ampliamente sin receta. En tales circunstancias, el reconocimiento de la situación real de la automedicación y la introducción de salvaguardias apropiadas (vgr. tamaños de empaque y textos apropiados) podrían estar más en el interés de la salud pública que el mantenimiento de un estatus de prescripción meramente teórico.” En resumen, en el futuro, los ciudadanos de los distintos países del orbe pueden esperar a verse beneficiados de la reclasificación en padecimientos crónicos, progresivos, recurrentes y asintomáticos. Por supuesto debe reconocerse que cada posible reclasificación plantea ciertas preguntas específicas las cuales necesitan ser evaluadas, y que en cada país varían las condiciones de educación de los pacientes y consumidores y el apoyo de los profesionales de la salud. Las condiciones necesarias que debe tener un país para acceder a una reclasificación eficiente son materia de la Sección V. 26WHO. Guidelines for the Regulatory Assessment of Medicinal Products for use in Self-Medication. WHO Geneva 2000, p21 30 Condiciones del país para la reclasificación Sección IV 32 Reclasificar los medicamentos de prescripción al estatus de venta sin receta, presenta oportunidades por demás claras para mejorar la salud pública de los países, tal y cómo se planteó detalladamente en las secciones III y IV. Se requiere de diversas condiciones básicas, incluyendo un sistema de clasificación regulatorio apropiado, el apoyo del gobierno (político), disponibilidad de información para pacientes y consumidores, profesionales de la salud que les apoyen y el reconocimiento y recompensas a las compañías que lleven a cabo nuevas reclasificaciones. Aun aquellas reclasificaciones que en el pasado pudieron haber sido consideradas como inadecuadas para un estatus de venta sin receta, pueden llevarse a cabo, de manera segura y exitosa, en la medida en que la industria, el gobierno, los farmacéuticos y los doctores trabajen juntos para proporcionar la información y el apoyo educativo que necesitan los consumidores para tomar decisiones informadas en materia de elección de alternativas de autocuidado y auto-tratamiento. El sistema de clasificación regulatoria La existencia de una clara diferenciación entre los medicamentos de prescripción y los de venta sin receta a nivel regulatorio, es un pre-requisito para una reclasificación. En un mercado donde los productos de prescripción y los de venta sin receta no están diferenciados, la reclasificación de ingredientes tiene poco sentido. España ilustra este punto. Una nueva Ley de Medicamentos emitida para preparar la implementación de la revisión farmacéutica de la UE, de 2004, fue adoptada como la Ley de las Garantías y el Uso Racional de Medicamentos en al año 2006. Esta Ley diferenció los medicamentos de prescripción y los de venta sin receta, y trajo una serie de cambios en el sistema de distribución de estos productos. Particularmente en el caso del suministro de medicamentos de prescripción se estableció la necesidad de presentar la receta de manera obligada, y se considero que el suministro sin la misma es una infracción severa. Con posterioridad a esta estricta disposición, a principios de 2007, se reclasificaron varios ingredientes al estatus de venta sin receta, incluyendo ketoconazol tópico, terbinafina, etofenamato, ketoprofeno, loratadina, azelastina y la TRN. En algunos países como Australia, Nueva Zelanda, Finlandia, Francia, Suecia y el Reino Unido, existe una gradualidad en el nivel de disponibilidad de los productos de venta sin receta. Así, existen algunas sub-divisiones en esta categoría, como la clase “atrás del mostrador”, donde hay necesidad de asistencia del farmacéutico; 33 RECLASIFICACIÓN – Reclasificación de medicamentos de prescripción a medicamentos de venta sin receta Sección IV la de “auto-selección” en la farmacia, o “venta general”, en cualquier punto de venta. Aunque este folleto se centra en la reclasificación de los medicamentos del estatus de prescripción al estatus de venta sin receta, el término reclasificación también puede ser empleado para la reclasificación de medicamentos de venta sin receta de “atrás del mostrador” al de “venta general”, en aquellos países donde existen estas categorías. Por ejemplo, en Australia, diversos medicamentos para el pie de atleta han sido reclasificados del listado S2 (auto-selección en farmacias) a venta general, desde 2006. En Finlandia, los productos para TRN pasaron del estatus de venta sólo en farmacias, al de distribución o venta general, desde febrero de 2006. En Suecia, se permitió la venta de los productos de TRN fuera de farmacias, desde marzo de 2008. Apoyo del gobierno Una razón importante de las diferencias que existen en los procedimientos de reclasificación de prescripción a venta sin receta, que se siguen en diversos países, es el liderazgo que llega a tener el gobierno en algunos de ellos. Por ejemplo, en diferentes formas los gobiernos de los Estados Unidos, China, Japón, México y el Reino Unido, han mostrado interés y apoyado el proceso de reclasificación (ver el Cuadro 4 con el ejemplo del Reino Unido). 34 Cuadro 4 Grupo Estratégico de Reclasificación del Reino Unido Una vez que se lanzó el nuevo procedimiento para la reclasificación, en mayo de 2002, se estableció un Grupo Estratégico de Reclasificación (GER) compuesto de representantes de la Agencia Regulatoria de Medicamentos y Productos para el Cuidado de la Salud (MHRA), el Departamento de Salud, la Real Sociedad Farmacéutica de Gran Bretaña (RPSGB), la Asociación de Medicamentos de Marca de Gran Bretaña (PAGB) y la Asociación de la Industria Farmacéutica Británica (ABPI) con el objeto de buscar nuevas oportunidades de reclasificación. Entre 2002 y 2008, más de 50 productos han sido reclasificados de prescripción a venta general, así como de prescripción a venta exclusiva en farmacias. Las reclasificaciones más recientes incluyen el naproxeno y diclofenaco oral, omeprazol, simvastatina, sumatriptán y antibióticos como cloranfenicol tópico y azitromicina. Entre Junio de 2004/Noviembre de 2005, se pusieron en vigor nuevas regulaciones para terminar con las restricciones impuestas para la publicidad de los medicamentos de venta sin receta en algunas áreas terapéuticas. Más aun, una disposición preparatoria de la ‘Revisión 2001’ de la Legislación sobre Medicamentos Europea, fue puesta en vigor en el Reino Unido, en enero de 2005, a fin de dar un año de exclusividad en materia de datos/mercado, por pruebas preclínicas o clínicas significativas o resultados de estudios utilizados para reclasificación.27 Las guías para reclasificación de la Unión Europea son un ejemplo de apoyo político supranacional. En 1996, el Consejo de Ministros de Salud y el Parlamento Europeo adoptaron una Resolución acerca de los lineamientos de una política industrial para el sector farmacéutico en la Unión Europea. Ambas resoluciones pedían un endurecimiento del sistema de clasificación para los productos medicinales y el establecimiento de procesos de reclasificación transparentes. En respuesta, en septiembre de 1998, la Comisión adoptó una guía detallada con vistas a la armonización de las condiciones para la reclasificación de los medicamentos de prescripción al estatus de venta sin receta para uso en automedicación28. Esta guía entró en vigor el 1 de Enero de 1999. 27MHRA website: http://www.mhra.gov.uk/Howweregulate/Medicines/Licensingofmedicines/ Legalstatusandreclassification/index.htm 28MHRA website: http://www.mhra.gov.uk/Howweregulate/Medicines/Licensingofmedicines/ Legalstatusandreclassification/index.htm Guideline on changing the classification for the supply of a medicinal product for human use of 29 September 1998 35 RECLASIFICACIÓN – Reclasificación de medicamentos de prescripción a medicamentos de venta sin receta Sección IV Otro valioso desarrollo en los años recientes, ha sido el apoyo político adicional del Consejo de la Unión Europea para la expansión de las reclasificaciones en indicaciones previamente no disponibles para automedicación. El Consejo de Salud de la Unión Europea dijo en su Programa Comunitario sobre promoción de la salud: “después de un diagnóstico inicial y una prescripción, es posible la automedicación una vez que el doctor haya delegado el control, y retenido su papel de asesor tal y como en el caso de la diabetes y el asma.” La Organización Mundial de la Salud (OMS), en sus lineamientos centrales sobre los medicamentos de venta sin receta ha establecido: “La reclasificación de los productos medicinales de venta con prescripción solamente, a venta sin receta, actualmente tiene gran interés para muchos países… Se ha aceptado ampliamente que la automedicación tiene un lugar importante en el sistema de cuidado de la salud. El reconocimiento de la responsabilidad de los individuos por su propia salud y el hecho de estar consciente que la atención profesional para trastornos menores es frecuentemente innecesaria, ha contribuido a esta visión. La mejoría en el conocimiento que tiene la gente en general, en su nivel educativo y en su nivel socio-económico constituye una base razonable para el éxito de la automedicación en muchos países. Nuevos medicamentos con acciones farmacológicas específicas, tales como los antagonistas de los receptores de histamina H2, los compuestos antiinflamatorios no esteroides (AINES) y las preparaciones de nicotina para dejar de fumar, han sido exitosamente reclasificados de prescripción al estado de venta sin receta en muchos países.29” 29WHO. Guidelines for the Regulatory Assessment of Medicinal Products for use in Self-Medication. WHO Geneva 2000. p4. 36 Disponibilidad de información El autocuidado y la automedicación responsable le brindan a la gente más opciones y responsabilidad, pero también, implican ayudarles a asegurarse de que están equipados para hacer elecciones adecuadas. La tendencia hacia la automedicación debe estar acompañada por un reforzamiento de las medidas de información, por ejemplo, el especial papel que desempeñan las etiquetas e insertos de los medicamentos de venta sin receta, el dirigir la atención en la información efectivamente útil o en el reconocimiento de las limitaciones y fortalezas de la gente y el papel de la publicidad. Las buenas etiquetas de los medicamentos de venta sin receta (etiquetas y/o insertos), especialmente diseñadas para los consumidores, son un requisito fundamental para la automedicación responsable. Por definición, la información que los consumidores necesitan para usar correctamente los medicamentos de venta sin prescripción, y sin supervisión profesional, debe estar en la etiqueta o en el inserto que viene con el producto. La caja o el empaque externo, es el lugar más adecuado para poner a disposición de los pacientes y consumidores la información en materia de automedicación. La información en este lugar les facilita a los consumidores, hacer una selección rápida y fácil en el punto de venta respecto a si el medicamento es el adecuado a sus necesidades. El inserto que se coloca dentro del empaque le permite al consumidor encontrar y usar las instrucciones para utilizar el medicamento de una manera segura y eficaz, después de haber adquirido el producto. A los consumidores se les puede proporcionar información adicional a través de folletos y ligas a sitios web. La información en las etiquetas de los medicamentos de venta sin receta debe ser presentada de tal manera, que los consumidores puedan: – Escoger el medicamento adecuado por ellos mismos. – Utilizar el medicamento de manera segura y eficaz. – Encontrar fácilmente la información que necesitan, entenderla y actuar adecuadamente en consecuencia. – Acceder a mayor información si ellos quieren saber más acerca de un medicamento. 37 RECLASIFICACIÓN – Reclasificación de medicamentos de prescripción a medicamentos de venta sin receta Sección IV Dándole a la gente más opciones y responsabilidad, también puede involucrar el hecho de asegurarse de que está equipada para hacer elecciones adecuadas. Al final, mientras más informado y educado sea el consumidor, se harán más extensos los límites que pueden establecerse para la automedicación. Tal y como lo manifestó la OMS: “La información adecuada para el uso apropiado de los productos medicinales siempre debe acompañar a éstos. Puede proporcionarse asesoría adicional para la automedicación por los profesionales de la salud. Una consideración importante es si los textos que acompañan a los productos medicinales y a sus usos (información, recomendaciones y advertencias) pueden ser planteados de una manera suficientemente clara y completa, a fin de que el consumidor sea capaz de usar el producto de una manera segura, efectiva y racional.30” En contraste con el etiquetado, la publicidad –un medio de comunicación de menor involucración y dirección– no está diseñada para proporcionar información detallada. No obstante, puede desempeñar un papel importante al comunicar al paciente o al consumidor la existencia de un padecimiento y la disponibilidad de un producto de venta sin receta que tiene ver con dicho problema. Por lo tanto, la publicidad es una parte importante de un cúmulo de informaciones que no debería estar sujeto a restricciones innecesarias. 30WHO. Guidelines for the Regulatory Assessment of Medicinal Products for use in Self-Medication. WHO Geneva 2000. p21. 38 Apoyo profesional para el cuidado de la salud “ ” Con su educación, entrenamiento y fácil acceso, los farmacéuticos son una fuente excelente de información y asesoría acerca de los medicamentos de venta sin receta. Sería completamente equivocado pensar que el autocuidado y la automedicación no requieren o implican el apoyo de los profesionales de la salud, y en realidad éste, es particularmente el caso de algunas de las reclasificaciones más avanzadas. Tal y como se mencionó en las Secciones III y IV, puede esperarse que veamos un aumento en todas aquellas situaciones en donde el diagnóstico inicial y las opciones de automedicación sean determinados por un médico y discutidos con el paciente. Entonces, ante la recurrencia de los síntomas, el paciente puede responder adecuadamente y tratarlos como sea necesario, sin visitar al doctor en cada ocasión que se presenten. La evolución gradual en las tendencias en materia de reclasificación, ha significado una expansión de las indicaciones susceptibles de auto-tratamiento en el área de uso a largo plazo y en padecimientos crónicos. En términos generales, los doctores pueden y deben jugar una parte muy importante en motivar y apoyar las actividades de autocuidado. La gente necesita ser motivada y apoyada en general y no tan sólo para disminuir los factores de riesgo evitables en enfermedades crónicas, tal y como se describe en la Sección III. No obstante que los doctores continuarán teniendo un importante papel en motivar el ejercicio del autocuidado y la automedicación responsable, las oportunidades que tienen las nuevas reclasificaciones para los farmacéuticos son aun mayores. Ellos, son una fuente confiable y conveniente de asesoría, no sólo para medicamentos recientemente reclasificados. La comunidad de farmacéuticos tiene un estrecho contacto con los pacientes y los consumidores buscan su asesoría. Por otra parte, los farmacéuticos adecuadamente entrenados y ubicados convenientemente, pueden proporcionar información y educación acerca de los medicamentos de venta sin receta. Los farmacéuticos también están entrenados para identificar las posibles interacciones que puede presentar un producto con otros que pudiera estar tomando una 39 RECLASIFICACIÓN – Reclasificación de medicamentos de prescripción a medicamentos de venta sin receta Sección IV persona, así como educarla y asesorarla sobre el uso adecuado y los posibles efectos secundarios y otros aspectos importantes de los medicamentos de venta sin receta. Es probable que los farmacéuticos (y su staff) lleguen a desempeñar un papel aun mayor en la automedicación en el futuro, y sin duda, su apoyo será esencial para futuras reclasificaciones exitosas. Reconocimiento y recompensa por la innovación El apoyo a la innovación de los medicamentos de venta sin receta es tan importante como lo es el que se requiere para el desarrollo de nuevos medicamentos de prescripción. El hecho de contar con más medicamentos que obtengan el estatus venta sin receta, requiere de una inversión inicial de capital y de investigación significativa. Sin embargo, las sustancias químicas existentes que conforman el grupo actual de medicamentos de venta sin receta no están protegidas, por lo general, por patentes de propiedad intelectual en lo que a su molécula básica se refiere. En muchos países, las solicitudes de reclasificación tienen que ver con ingredientes y no con productos. Esto significa que todos los productos que contienen un ingrediente en particular, podrían verse beneficiados de una solicitud de reclasificación que logre un determinado fabricante, lo cual es injusto para la compañía que invirtió en dicha reclasificación. La innovación en los medicamentos de venta sin receta, está basada también en el desarrollo de nuevos reclamos terapéuticos para los productos que se encuentran en el mercado, por lo que se necesita tanto de reconocimiento como recompensa. En los mercados desarrollados todo esto normalmente se da a través de la protección de datos, de marca y exclusividad de mercado. Se puede considerar que un mínimo de 3 años de protección de datos o exclusividad de mercado es adecuado para aquellos innovadores a quienes se les otorgó una autorización en indicaciones novedosas para los productos de autocuidado existentes y para la reclasificación de un producto de prescripción al estatus de venta sin receta. En los Estados Unidos, el Acta Hatch-Waxman especifica un periodo de tres años de exclusividad de los datos para las solicitudes de reclasificación que requieren de estudios clínicos, lo que incluiría nuevas indicaciones para 40 productos existentes. Disposiciones similares están en vigor en Japón, mientras que en Europa, la Directiva de la Unión Europea 2004/27/EC establece que cuando se formula una solicitud para una nueva indicación de una sustancia bien establecida, debe otorgarse exclusividad de datos por un periodo de un año, en el entendido de que se han llevado a cabo un numero significativo de estudios pre-clínicos y clínicos en relación con la nueva indicación. En la Sección V, página 46, aparecen mayores detalles sobre la legislación en materia de protección de datos. De manera más general, puede decirse que el valor de las marcas de autocuidado debe ser reconocida. Una marca bien conocida, apoyada por una publicidad informativa y responsable, les facilita a los consumidores decidir si el producto es el que ellos necesitan y a tener confianza para darse la oportunidad a utilizarlo. Por lo tanto, una marca de confianza es un vehículo importante para llevar a cabo un adecuado comportamiento en materia de autocuidado. El uso de las llamadas “marcas umbrella”, en las que una marca conocida cubre a todos aquellos productos que se utilizan para tratar padecimientos que tienen algún tipo de relación entre sí, también es importante para promover la confianza del consumidor en un nuevo producto. Esto implica el hecho de permitir el uso del mismo nombre comercial para diferentes presentaciones de un mismo medicamento de venta sin receta y para aquellos cuyo estatus ha sido reclasificado. En vista del valor que tiene una marca reconocida para los pacientes y consumidores, el hecho de protegerla en contra de una copia o de las que “se hacen pasar por” (como es el caso de las compañías que presentan engañosamente sus productos como si fueran los de otra, refieriéndose por lo general a la marca líder), debe ser adecuadamente implementada y puesta en práctica. 41 Aspectos regulatorios sujetos a discusión sobre la reclasificación Sección V 42 Regulaciones sobre reclasificación Tal y como se menciona en este folleto, varios países han llevado la delantera en el mundo al reclasificar productos de prescripción al estatus de libre acceso y se han caracterizado por desarrollar un proceso de revisión muy minucioso, en el que han reconocido que la seguridad de los consumidores tiene la más alta prioridad. Cuando se decide si un medicamento puede llegar a ser reclasificado como de venta sin receta, las autoridades regulatorias deben hacer un balance entre los beneficios que conlleva el hecho de facilitar su acceso, en contra del peligro potencial que implica un uso no supervisado o inapropiado. Dado que ningún producto, ya sea que se trate de un medicamento o de cualquier otro artículo, puede llegar a ser completamente seguro, las autoridades regulatorias locales han venido pidiendo a quienes solicitan una reclasificación, evidencias adecuadas de que él o los productos a reclasificar cuentan con un amplio margen de seguridad y de efectividad, antes de hacer que el medicamento tenga el estatus de venta sin receta. Así, el perfil de seguridad de los productos reclasificados como de venta sin receta, ha sido establecido y documentado a través de años de experiencia y un uso extenso como medicamentos de prescripción. Es innecesario e inapropiado que cada país alrededor del mundo repita la experiencia de otros países. La comparación internacional es, por lo tanto, el primer paso importante a seguir para reclasificar aquellos productos que tienen una larga historia de uso seguro y eficaz. Fundamentalmente, los productos de venta sin receta no necesitan sujetarse a las mismas disposiciones reglamentarias aplicables a los nuevos medicamentos de prescripción, al momento de hacer una solicitud de reclasificación o en su uso acostumbrado. Algunas estrategias regulatorias susceptibles de aplicarse pueden optimizar la seguridad de los medicamentos de venta sin receta. Por ejemplo, los reguladores pueden llegar a disminuir el potencial de daño de un medicamento, al especificar su concentración, dosis o contenido que un farmacéutico podría dispensar sin receta. En general, es importante que la evaluación de un producto o ingrediente esté basada solamente en criterios de riesgo/beneficio. El medicamento debe ser seguro para ser usado por el mismo consumidor y la enfermedad a ser tratada debe ser auto-reconocible o contar con el diagnóstico previo de un médico, como es el caso de reclasificaciones más complejas. Ningún otro aspecto, como el hecho de que el medicamento esté sujeto a reembolso o la existencia de 43 RECLASIFICACIÓN – Reclasificación de medicamentos de prescripción a medicamentos de venta sin receta Sección V grupos profesionales que tengan el control exclusivo sobre el mismo, deben ser materia de evaluación. A fin de concentrar los recursos en la industria y en las autoridades, también es necesario disponer de un programa de actividades, así como de una amplia comunicación entre todas las partes a efecto de acordar las acciones que se requiere llevar a cabo para efectuar una reclasificación en el esquema de tiempo deseado. Un procedimiento de reclasificación claro, transparente y bien fundamentado es un requisito básico para una reglamentación exitosa en materia de reclasificación. El Cuadro 5 proporciona los detalles de las reglamentaciones que específicamente se siguen en varios países. En el Reino Unido, las solicitudes de reclasificación de medicamentos son evaluadas por la Agencia Reguladora de Medicamentos y Productos para el Cuidado de la Salud (MHRA), con la asesoría de un comité experto idóneo, por ejemplo, la Comisión de Medicamentos para uso Humano (CHM), o Grupos Asesores Expertos (EAGs) según sea necesario. Cuando se considera que la reclasificación propuesta puede ser hecha de manera segura, se lleva a cabo una amplia consulta pública por parte de la MHRA. Las organizaciones interesadas son notificadas en el momento en que se hace pública una nueva consulta. Las respuestas a la consulta son evaluadas por la MHRA y se recurre a la asesoría de la CHM, solamente si surge alguna duda acerca de la seguridad del medicamento durante la consulta. Una vez que la propuesta de reclasificación ha sido aprobada, tiene lugar el cambio de estatus legal. Todos los otros productos que contienen la misma sustancia activa necesitan hacer una solicitud por separado, a fin de obtener el mismo estatus. En Alemania, el procedimiento para un cambio de estatus de clasificación está claramente definido en la Ley de Medicamentos de Alemania (AMG). En los últimos años, un número considerable de reclasificaciones ha sido recomendado por el Comité Experto para la Clasificación de Medicamentos de Alemania, y subsecuentemente incorporado en dicha Ley en un lapso de nueve meses. La responsabilidad de decisión respecto de la clasificación de los medicamentos recae en el Ministerio de Salud Federal. No obstante que las solicitudes de reclasificación pueden ser hechas, en principio, por cualquier instancia, normalmente es el fabricante quien inicia la solicitud. En Australia existen lineamientos del Comité Nacional de Listados de Medicamentos y Tóxicos (NDPSC) los cuales especifican la naturaleza del proceso de reclasificación en el cambio de categoría de los medicamentos, con respecto a asuntos tales como los procedimientos del Comité, el proceso de evaluación, los lineamientos para la solicitud y los requisitos de información. 44 Cuadro 5 Guías sobre las regulaciones relacionadas con la reclasificación, alrededor del mundo Unión Europea: Guideline on changing the classification for the supply of a medicinal product for human use: http://ec.europa.eu/enterprise/pharmaceuticals/eudralex/vol-2/c/ switchguide_160106.pdf Reino Unido: MHRA Guidance Note 11. Changing the Legal Classification in the United Kingdom of a Medicine for Human Use: http://www.mhra.gov.uk/Howweregulate/Medicines/Licensingofmedicines/ Legalstatusandreclassification/index.htm Australia: Guidelines for the National Drugs and Poisons Schedule Committee: http://www.tga.gov.au/ndpsc/ndpscg.htm NDPSC scheduling/rescheduling template: http://www.tga.gov.au/ndpsc/schedule-template.htm Guidelines for brand advertising of substances included in Schedule 3 of the Standard for Uniform Scheduling of Drugs and Poisons (SUSDP): http://www.tga.gov.au/ndpsc/ndpsc3a.htm Canadá: Factors for listing drugs in Schedule F (Rx status) http://www.hc-sc.gc.ca/dhp-mps/prodpharma/applic-demande/pol/schf_annf_ fact_pol-eng.php Tan sólo en algunos cuantos casos, la introducción de un nuevo ingrediente de venta sin receta al mercado no sigue la ruta de la reclasificación, sino llega directamente al mercado como un medicamento de venta sin receta. Por ejemplo, algunas de las concentraciones y formas de dosificación de los productos para tratar infecciones vaginales por levaduras, fueron originalmente introducidas como productos de venta sin receta en los Estados Unidos. Tal y como fue el caso del triclosán como un ingrediente antigingivitis. El bentoquatum para la protección de la hiedra venenosa en los Estados Unidos es otro ejemplo. En el Reino Unido, la dimeticona fue introducida directamente como un producto de venta sin receta para el tratamiento de las infestaciones de piojos en la cabeza, como una alternativa a los insecticidas químicos. En Japón, el minoxidil fue introducido directamente como un producto de venta sin receta para el tratamiento de la pérdida de cabello en los hombres. 45 RECLASIFICACIÓN – Reclasificación de medicamentos de prescripción a medicamentos de venta sin receta Sección V Mientras que la introducción de un producto con el estatus de venta sin receta, sin la experiencia previa como un producto de prescripción es muy rara, el punto principal es que los datos de seguridad y eficacia deben conducir a una decisión y no una arbitraria limitación en términos de tiempo en el mercado. Por lo tanto, el estatus directo de medicamento de venta sin receta, sin una experiencia previa como producto de prescripción, no debe ser automáticamente prohibido. Protección de datos ‘Protección de datos’ significa que, por un periodo limitado y definido, una autoridad regulatoria no debe hacer referencia a los datos de un fabricante para otorgar el registro o aprobación a otro, sin el acuerdo del propietario de dichos datos. Este tipo de protección reconoce la significativa inversión que se necesita para generar y proveer todos aquellos datos que se requieren para satisfacer los crecientes requisitos regulatorios. Asimismo, fomenta el desarrollo y mantenimiento de productos, su innovación y acceso, al proporcionar una protección exclusiva de los datos, por un periodo definido. La protección de datos abarca tanto la exclusividad de los mismos (el derecho exclusivo para usar la información de la que se es propietario, en apoyo a una solicitud presentada, por un periodo definido) y la exclusividad de mercado (el derecho exclusivo para comercializar un producto). El periodo de exclusividad generado por la legislación correspondiente es usualmente más largo que el de la legislación de exclusividad de mercado. Por ejemplo, si un país tiene una legislación de exclusividad de datos, un solicitante genérico podría ser capaz de utilizar los archivos de registro de la solicitud original, solamente después de (por así decirlo) tres años. Esto significa que aquel que originó la exclusividad la tiene efectivamente a nivel del de mercado por tres años, más el tiempo que puedan tomar las autoridades regulatorias del país para aprobar una solicitud genérica. En el caso de una legislación de exclusividad de mercado, se le debería permitir a un solicitante genérico utilizar los datos del archivo de registro del medicamento original, antes de haber transcurrido tres años, a fin de asegurar la entrada inmediata al mercado al momento en que expire la exclusividad de mercado. El periodo de exclusividad de los datos debe empezar cuando el producto es lanzado al mercado y no cuando la autorización de comercialización es emitida. Actualmente, la exclusividad de los datos empieza cuando se aprueba 46 la reclasificación, pero muchos procesos como el desarrollo del etiquetado y la publicidad, no pueden iniciarse hasta que se otorga la autorización para comercialización. Pueden entonces pasar muchos meses antes de que un producto sea comercializado, resultando en beneficios comerciales limitados. En los Estados Unidos, una reclasificación puede gozar de tres años de exclusividad de datos si la “solicitud de nuevo medicamento” (o “solicitud suplementaria de nuevo medicamento”) para la reclasificación, contiene reportes de nuevas investigaciones clínicas (diferentes de los estudios de biodisponibilidad) esenciales para la aprobación de la solicitud, y si las investigaciones son llevadas a cabo o patrocinadas por el solicitante.31 En Japón están en vigor reglas semejantes. La Unión Europea emitió una Directiva que posteriormente modificó, en la cual el periodo de protección de datos originalmente establecido fue de tres años, mismo que fue reducido a uno, en las etapas finales de su aprobación,32 tal y como aparece a continuación: “En los casos donde se ha autorizado un cambio de clasificación de un producto medicinal sobre la base de pruebas pre-clínicas o estudios clínicos significativos, la autoridad competente no debe referirse a los resultados de esas pruebas o estudios cuando examine una petición de otro solicitante para obtener una autorización, o del titular de una autorización de comercialización para modificar la clasificación de la misma sustancia por un año, después de que la reclasificación inicial fue autorizada.” Sin embargo, hay muy pocos indicios de que un periodo de protección de datos de un año, es un incentivo suficiente para motivar a las compañías a invertir en el trabajo que se requiere para introducir nuevas reclasificaciones al mercado. Además, es importante hacer notar que el periodo de protección de datos de un año, empezaría en la fecha en que se otorga la autorización o la variación que afecta la reclasificación, no en la fecha en la cual el producto aparece por primera vez en el mercado. La claridad legal de la Directiva de la Unión Europea y las enmiendas subsecuentes, se han visto afectadas por consideraciones políticas, y como una consecuencia, existe un gran número de formulaciones incompletas. El valor real del sistema actual es, por lo tanto, un asunto crucial para el futuro. 31US Federal Food, Drug and Cosmetic Act, section 505: New Drugs 32Article 54 of EU Directive 2004/27/EC amends Directive 2001/83/EC wording, inserting a new Article 74a 47 RECLASIFICACIÓN – Reclasificación de medicamentos de prescripción a medicamentos de venta sin receta Sección V Las disposiciones actuales en las legislaciones de muchos países no proveen exclusividad alguna de datos. A efecto de impulsar la presentación de solicitudes de reclasificación sería adecuado contar con un modelo similar al de los Estados Unidos, que otorga un periodo de tres años de exclusividad de comercialización. Escrutinio de seguridad Una vez que los medicamentos han sido reclasificados, son objeto de revisión en su seguridad, no obstante que al aprobar dicha reclasificación, un país está haciendo, en efecto, un juicio balanceado de la relación riesgo/ beneficio de los ingredientes individuales, y de la automedicación como un todo. Así lo expresa la OMS:33 “No se asume, y no puede ser razonablemente asumido, más que en otros campos de la farmacoterapia, que el beneficio podrá siempre ser asegurado o que el riesgo será completamente eliminado. Debido a que los factores de riesgo varían de grado, de un individuo a otro, y de una situación a otra, podrá haber pacientes que llegarán a sufrir inconvenientes o daños. Sin embargo, considerando a la población como un todo, si el grado y la incidencia de tales daños no están en desproporción a los beneficios ofrecidos, el riesgo será aceptable.” Los primeros puntos que se requiere confirmar tienen que ver con el hecho de que los medicamentos de venta sin receta han mostrado ser seguros y eficaces en las indicaciones para las cuales fueron propuestos, son vendidos con instrucciones explícitas para su uso y fabricados con calidad, de acuerdo a los principios de las Buenas Prácticas de Fabricación (GMP). Las medidas de protección básicas que se deben implementar incluyen la selección de las sustancias más adecuadas y seguras, las dosis y formas de dosificación, el proveer de información especial o de educación para el público, el control de la publicidad y los textos del etiquetado, así como la definición de los canales de distribución. A través de la detección global de todas aquellas señales de posibles reacciones adversas que hacen los fabricantes y reguladores, acompañadas de los 33WHO. Guidelines for the Regulatory Assessment of Medicinal Products for use in Self-Medication. WHO Geneva 2000, p14 48 informes que proveen los consumidores, existen medidas de protección para la farmacovigilancia en las reclasificaciones. Un método de seguimiento se lleva a cabo través de tales sistemas de reporte de eventos adversos. Aun en aquellos casos en que los sistemas de reporte para los medicamentos de venta sin receta reconocidos no son formalmente requeridos por el gobierno, los sistemas no gubernamentales, los centros de control de envenenamiento y los estudios de caso publicados en la literatura médica desempeñan una función similar. Las autoridades regulatorias necesitan aceptar que cualquier requisito adicional que se imponga a las compañías debe ser proporcional a los datos que se hayan recabado a través de décadas de uso seguro hecho por el público, antes de la reclasificación. No es razonable esperar que los fabricantes proporcionen en cada solicitud de reclasificación, de manera rutinaria, estudios adicionales de vigilancia post-comercialización, independientemente del tipo de molécula, especialmente si no hay datos o disposiciones de exclusividad de mercado permitidas para esto. Solamente la experiencia a largo plazo con una suficiente y elevada exposición a la población puede evidenciar eventos adversos raros o tardíos. A medida que la ciencia avanza y se conoce más acerca de un ingrediente, si surgen nuevas evidencias que lleven a las autoridades a considerar que un ingrediente que ostenta el estatus de venta sin receta no debe ser considerado como seguro o eficaz para tal uso, pueden hacer que retome el estatus de medicamento de prescripción o aún más, retirarlo totalmente del mercado. El hecho de que en muy pocos ingredientes ha sido necesario llevar a cabo tal reclasificación ‘en reversa’ es un testimonio de la cuidadosa evaluación que se hace en las solicitudes de reclasificación. Por ejemplo, en el Reino Unido, los antihistamínicos terfenadina y astemizol fueron reclasificados del estatus de prescripción al de venta en farmacias exclusivamente, pero en 1997 fueron nuevamente reclasificados al estatus de prescripción cuando se estimó que era posible que pudieran llegar a causar “torsade de pointes” (un tipo de taquicardia ventricular). Sin embargo, existe muy poca evidencia, en general, que muestre que las reclasificaciones actuales y las políticas de reclasificación hayan causado problemas de salud pública en algún país. 49 Tablas de Clasificación de Ingredientes de Venta sin receta Apéndice 50 Tablas de Clasificación de Ingredientes de Venta sin receta Las siguientes tablas son ejemplos modelo de las Tablas de Clasificación de Ingredientes de Venta sin Receta de la AESGP/WSMI. Las tablas completas están disponibles a través del sitio web de la WSMI en: http://www.wsmi.org/ otc.htm y en el sitio web de la AESGP en: http://www.aesgp.be/publications/ otcIngredientTables.asp Tabla 1. Estatus de la Clasificación Legal de Ingredientes Seleccionados (productos para la acidez) en 15 países de la Unión Europea Tabla 2. Estatus de la Clasificación Legal de Ingredientes Seleccionados (dermatológicos) en los 10 nuevos países de la Unión Europea y en países no pertenecientes a esta Unión Tabla 3. Estatus de la Clasificación Legal de Ingredientes Seleccionados (analgésicos) en 12 países en todo el mundo Notas en las Tablas El acrónimo “OTC” significa que al menos una cierta dosificación o forma farmacéutica del ingrediente, tiene el estatus legal de medicamento de venta sin receta en el país en cuestión. En donde se dispone de información, se señala la primera ocasión en que se modificó el estatus del ingrediente de prescripción al de venta sin receta, indicado por el “año” en el cual tuvo lugar. Por lo tanto, un año también equivale a “OTC”. Las notas de pie de página proporcionan información adicional y pueden ser accesadas con las Tablas completas a través de los sitios web. 51 OTC OTC Rx Hexetidina Triamcinolona (oral) Rx N.R. Rx N.R. Rx Rx 200336 Rx OTC11 OTC14 Rx N.R. Rx Rx Rx OTC35 OTC45 Carbenoxolona Cimetidina Famotidina Lansoprazol Nizatidina Omeprazol Pantoprazol Ranitidina Sucralfato 52 Rx 1989 1989 Rx Rx Rx 1985 199637 Rx Rx N.R. Rx 1996 1996 1994 199738 Rx Rx Rx Rx 1997 22 199715 N.R. OTC OTC Dimeticona OTC N.R. OTC N.R. OTC N.R. OTC N.R. 23 Rx OTC N.R. Rx 199939 OTC N.R. Rx Rx Rx Rx32 Rx Rx Rx Rx Rx N.R. OTC N.R. N.R. OTC OTC Rx Rx 1999 Rx Rx OTC OTC 20036 OTC 19862 24 OTC OTC47 Rx 199940 Rx OTC Rx48 OTC46 Rx Rx OTC N.R. OTC 199641 Rx 2008 Rx Rx N.R. 1996 1996 N.R. OTC N.R. Rx OTC OTC Rx Rx OTC 25 199313 N.R. OTC 10 N.R. OTC OTC OTC Rx Rx Rx Rx Rx 2002 Rx OTC OTC N.R. OTC OTC 1982 Rx Rx 199842 Rx Rx Rx Rx 1996 26 199617 Rx 1982 1982 OTC N.R. Rx 199543 OTC 199933 OTC OTC49 Rx 199444 Rx 200434 199631 Rx N.R. 2004 199428 29 1995 199419 OTC13 OTC 1994 OTC7 OTC OTC3 RU 27 Rx18 N.R. OTC Rx8 Rx N.R. Rx 1992 OTC 4 Suecia 1995 Holanda Portugal España 1999i 1996 Rx OTC12 OTC Rx Rx OTC OTC Italia OTC = Estatus de venta sin receta – Año = Año en el cual tuvo lugar el cambio al estatus de venta sin receta – Rx = Estatus de venta con receta – N.R. = No registrado o no comercializado Fuente: AESGP/WSMI© 19 Diciembre 2008 Página 2 N.R. Diciclomina (Dicicloverina) A03 Medicamentos para los trastornos gastrointestinales funcionales Rx Rx Rx N.R. Rx 20 21 N.R. <1965 N.R. 1989 N.R. OTC OTC OTC 9 Carbonato de Calcio OTC N.R. OTC Hidróxido de Aluminio OTC OTC N.R. OTC 20035 OTC A02 Medicamentos para trastornos relacionados con la acidez N.R. OTC OTC1 Fluoruro (sodio) Rx TRACTO ALIMENTARIO Y METABOLISMO Austria Bélgica Dinamarca Finlandia Francia Alemania Grecia Irlanda A01 Preparaciones estomatológicas A. Ingrediente Tabla 1. Estatus de la clasificación legal de ingredientes seleccionados (productos para la acidez) en 15 países de la Unión Europea. RECLASIFICACIÓN – Reclasificación de medicamentos de prescripción a medicamentos de venta sin receta Apéndice 53 Rx N.R. N.R. N.R. Nistatina Oxiconazol Sulfuro de selenio Nitrato de sulconazol (tópico) N.R. N.R. N.R. Rx N.R. N.R. N.R. N.R. 199822 N.R. N.R. N.R. N.R. OTC21 N.R. Rx Rx N.R. Rx OTC13 Rx Rx N.R. Rx OTC N.R. N.R. N.R. Rx Rx N.R. Rx N.R. N.R. Rx Rx N.R. Rx N.R. Rx N.R. OTC N.R. Rx N.R. N.R. N.R. N.R. N.R. OTC OTC 24 OTC Rx N.R. N.R. OTC OTC N.R. N.R. Rx N.R. Rx Rx Rx Rx OTC17 OTC16 OTC20 OTC Rx N.R. Rx N.R. OTC OTC5 N.R. N.R. N.R. OTC Rx República Eslovaca Rx N.R. OTC14 N.R. N.R. N.R. OTC9 N.R. OTC4 N.R. N.R. Rx 20022 Rx Polonia OTC1 Noruega N.R. N.R. N.R. Rx N.R. N.R. N.R. OTC18 OTC N.R. N.R. N.R. OTC10 N.R. OTC6 Rx N.R. OTC Rx Eslovenia OTC26 OTC25 OTC23 Rx Rx Rx Rx OTC19 199815 Rx N.R. OTC11 N.R. OTC7 Rx N.R. N.R. Rx Suiza OTC = Estatus de venta sin receta – Año = Año en el cual tuvo lugar el cambio al estatus de venta sin receta – Rx = Estatus de venta con receta – N.R. = No registrado o no comercializado Fuente: AESGP/WSMI® 19 Diciembre 2008 Página 5 Rx N.R. Natamicina (tópica) N.R. Miconazol & Hidrocortisona (tópicos) Naftifina (tópica) N.R. Miconazol (tópico) Rx Rx OTC12 N.R. Ketoconazol (tópico) Rx N.R. N.R. N.R. OTC Rx N.R. N.R. N.R. Lituania OTC3 Rx Rx Hungría OTC8 Rx N.R. Rx N.R. N.R. Rx Econazol OTC Isoconazol (tópico) N.R. Croconazol Rx Rx N.R. Rx Rx Clotrimazol (tópico) N.R. N.R. N.R. Rx Ciclopirox olamina Rx 2002 N.R. N.R. Butenafina Rx República Checa Haloprogin (tópico) Rx Croacia Fenticonazol (tópico) N.R. Bifonazol Antimicóticos de uso dermatológico Amorolfina (tópica) DERMATOLÓGICOS D01 Bulgaria D. Ingrediente Tabla 2. Estatus de la clasificación legal de ingredientes seleccionados en los 10 nuevos países de la Unión Europea y en los países no pertenecientes a la Unión Europea. N.R. Prilocaina N.R. Rx N.R. OTC Rx Rx N.R. Diflunisal Dihidrocodeina Naratriptano Paracetamol Paracetamol + dihidrocodeina Sumatriptán Zolmitriptan Rx Rx Rx Rx Rx OTC OTC9 OTC12 Rx Rx OTC8 Rx Rx Rx OTC OTC 19931 OTC4 OTC OTC Canadá N.R. Rx 54 N.R. Rx N.R. Rx 2008 N.R. N.R. Rx N.R. Rx Rx Rx OTC N.R. Rx Rx OTC5 Rx N.R. Rx China N.R. Rx Rx Rx Rx N.R. OTC Rx Rx Rx OTC Rx N.R. Rx Chile 2001 N.R. N.R. N.R. Rx Rx Rx Rx N.R.13 OTC Rx OTC Rx OTC Rx N.R. Rx Japón OTC N.R. N.R. Rx Rx OTC Rx Rx Rx OTC Rx Rx Rx OTC OTC OTC Rx Corea OTC N.R. Rx N.R. Rx N.R. Rx OTC N.R. OTC N.R. N.R. Rx OTC OTC N.R. Rx N.R. N.R. N.R. OTC18 OTC N.R. Rx N.R. Rx Rx N.R. OTC11 N.R. N.R. N.R. OTC7 N.R. Rx N.R. Filipinas N.R. N.R. Rx OTC15 Rx Rx Rx OTC10 Rx Rx Rx OTC6 OTC2 Rx Rx México Nueva Zelanda 200219 N.R. N.R. N.R. Rx Rx Rx Rx N.R. OTC Rx N.R. Rx OTC OTC N.R. OTC Singapur 199620 Rx Rx Rx Rx Rx Rx 1955 Rx Rx Rx OTC Rx OTC Rx EUA OTC = Estatus de venta sin receta – Año = Año en el cual tuvo lugar el cambio al estatus de venta sin receta – Rx = Estatus de venta con receta – N.R. = No registrado o no comercializado Fuente: AESGP/WSMI© 19 Diciembre 2008 Página 10 N05 Psicolépticos N.R. N.R. N.R. Clorproetazina (tópica) Rx Rx Rx Hidroxizina N.R. 200014 Rx Proclorperazina N06 Psicoanalépticos N.R. N.R. N.R. Piritinol N07 Otros medicamentos del sistema nervioso Nicotina (goma de mascar) OTC 198816 199217 21 Nicotina (atomizador nasal) N.R. OTC 2003 20033 Ácido acetilsalicílico Analgésicos Rx Pramocaina N02 Rx Argentina Australia Oxibuprocaina Ingrediente Tabla 3. Estatus de la clasificación legal de ingredientes selecccionados en 12 países de todo el mundo. RECLASIFICACIÓN – Reclasificación de medicamentos de prescripción a medicamentos de venta sin receta Apéndice The World Self-Medication Industry W.S.M.I C.I.B. • Immeuble A • “Keynes” 13, Chemin du Levant 01210 Ferney-Voltaire • France Tel: + 33 (0) 4 50 28 47 28 Fax: + 33 (0) 4 50 28 40 24 E-mail: [email protected] www.wsmi.org WSMI is a non-governmental organisation in official relations with the World Health Organisation