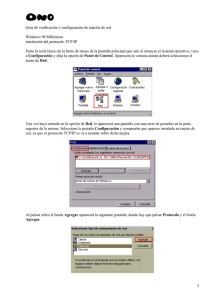
Distribución de TCP en fantoma 3-D basado en simulación
Anuncio

Distribución de TCP en fantoma 3-D basado en simulación de radioterapia convencional por método MC usando modelo lineal-cuadrático. Pérez P.A.(1,2), Altamirano N.B(2), Romero J.A(2), Valente M.A.(2,3) (1) ANPCyT-SeCyT (UNC) (2) FaMAF, UN Córdoba (3) CONICET RESUMEN En la actualidad diferentes facilidades en radioterapia están disponibles en todo el mundo y éstas pueden emplear tanto fuentes externas como internas. La dosimetría específica del paciente representa uno de los requisitos obligatorios para la fiabilidad y precisión de la terapia. Técnicas dosimétricas convencionales pueden verse limitadas debido a las dificultades intrínsecas y/o las pobres facilidades experimentales actuales en relación con la dosimetría in vivo, por ejemplo. Por otro lado, las técnicas de Monte Carlo (MC) han demostrado ser la herramienta más fiable para una descripción completa del transporte de radiación. Actualmente, incluso en el campo de la dosimetría, las técnicas de MC son a veces capaces de obtener mejores aproximaciones, y por lo tanto convertirse en la mejor forma de obtener datos dosimétricos ya que la situación específica del paciente no puede ser adecuadamente representada por las técnicas de dosimetría convencionales. Por otro lado, el modelo lineal-cuadrático (LQ) proporciona una buena guía para estimar la probabilidad de control tumoral (TCP) y el modelo Lyman-KutcherBurman (LKB), para la probabilidad de complicaciones en tejido normal (NTCT) en una terapia determinada. Este trabajo presenta el desafío de explotar las utilidades de las diferentes técnicas para lograr un análisis integral del proceso de planificación, valorando la distribución de dosis 3D mediante subrutinas MC y la estimación de las TCP y NTCP de un tratamiento, utilizando un fantoma genérico que imite las propiedades de los pacientes. MARCO TEÓRICO La TCP se define como la probabilidad de no tener ninguna célula clonogénica sobreviviendo en el tumor al final del tratamiento de radioterapia. Si el tumor es homogéneo, la dosis D uniforme sobre el tumor y el número inicial de células clonogénicas es N0, entonces, el número Ns de células clonogénicas sobrevivientes después de la radiación está dado por(1,2): N N exp D D s 0 2 dónde α es el parámetro biológico asociado a la ruptura de una hélice del ADN en la célula y β a la ruptura de la segunda hélice, habiéndose producido la primera. La TCP está dada por: TCP exp N s El depósito de dosis suele involucrar la irradiación parcial de alta dosis en los órganos de riesgo (OARs) en las cercanías del órogano blanco. Para evitar este riesgo, una decisión de tratamiento puede incluir una reducción innecesaria de dosis en el blanco causando una reducción en el efecto paliativo, por lo que se debe alcanzar un balance justo entre la minimización de la irradiación parcial de ciertos OARs y la alta dosificación en los volúmenes blanco. Es necesario entonces, un modelo cuantitativo de la probabilidad de complicaciones para ciertos OARs. Una herramienta simple para calcular la NTCP en el tratamiento integral proviene del modelo LKB. La NTCP se define por(3): 2 1 t NTCP cu exp dt 2 2 u D TD u mTD donde 50 50 y, m es un parámetro adimensional y TD50 es la dosis sobre todo el órgano para la cual la NTCP es del 50%. Se puede definir, también, c(u) como ku 1 exp k u , 2 2 c(u ) 1 k u 1 exp ku 2 2 2 2 2 2 u0 , u 0 donde se encuentra que el valor más adecuado para k es k=0,8154. METODOS Y RESULTADOS Se realizó una simulación MC (PENELOPE) irradiando un fantoma de H2O con 107 electrones de una fuente monoenergética de 9MeV y se colocaron colimadores de W de forma tal de obtener una irradiación 10x10cm2 en el fantoma sobre un universo de aire, como se observa en la figura. Figura 1 Una vez realizada la simulación y obtenidos los datos, se utilizó MATLAB R2008a para construir un tensor con la distribución de dosis 3D sobre todo el fantoma (en la Figura 2 se observa la distribución de dosis en la superficie del fantoma), dividiéndolo en 106 voxels de 2mm de lado y suponiendo una distribución de dosis homogénea dentro de cada voxel. Se obtuvo la curva de dosis en profundidad y se observó que la estadística daba una incerteza estadística menor al 1% (Figura 3), lo cual asegura la fiabilidad de los datos siguientes. Figura 2 Posteriormente se aplicó el modelo LQ para la obtención de la TCP. Se fijó =0,12Gy-1 y =0,0137Gy-2. Se varió porcentualmente como se muestra en el Cuadro 1, con el fin de analizar el cambio en la TCP según la variación del parámetro. Además, para distintos valores de profundidad se calculó la TCP en slices transversales al eje de incidencia (Z). Los valores medios de la TCP para cada slice se pueden observar en el Cuadro 2. Profundidad (cm) 1,7±0,1 2,3±0,1 2,9±0,1 3,5±0,1 4,1±0,1 Variación -2% +2% -4% +4% -6% +6% -8% +8% -10% +10% Media TCP 0,997 ± 0,041 0,997± 0,047 0,997 ± 0,059 0,94 ± 0,11 0,57± 0,06 Variación TCP (1,55±0,03)% (1,37±0,02)% (3,3±0,03)% (2,58±0,02)% (5,26±0,03)% (3,65±0,02)% (7,46±0,03)% (4,59±0,02)% (9,93±0,04)% (5,41±0,02)% Cuadro 1 Cuadro 2 Utilizando el modelo LKB se calculó la NTCP para los mismos slices para los cuales se calculó el TCP. Se tomó k=0,8154, TD50=70 y se obtuvieron datos preliminares que se pueden observar en la Figura 4 (slice a 2,3cm de profundidad) a modo cualitativo. Figura 3 Figura 4 ANALISIS, CONLUSIONES Y TRABAJO FUTURO Se logró realizar un análisis integral del proceso completo comprendido desde la simulación de un caso genérico de depósito de dosis sobre un fantoma de agua utilizando una fuente puntual, hasta el cálculo de la dosis y la probabilidad de control tumoral correspondiente al depósito de energía en el cuerpo. Se pudo realizar también, un análisis cualitativo y preliminar de lo que implicaría la probabilidad de complicaciones en el tejido normal. Se observó cómo varía la TCP en función de la variación de , y se pudo ver que un error en la estimación del parámetro biológico puede causar un error no despreciable en el cálculo de la TCP, por lo que es necesario establecer algún método paciente-dependiente del cálculo de , que permita estimar con mayor precisión estas características del paciente. Actualmente, el cálculo de se realiza através de valores medios y es necesario conocer la variación de éste en función de 1. 2. APLICATION OF THE LINEAR-QUADRATIC MODEL TO COMBINED MODALITY RADIOTHERAPY. R.K. Bodey, P.M. Evans and G.D. Flux. Int. j. Rad. Onc. Biol. Phys., Vol. 59, No. 1, pp. 228-241, 2004. TUMOUR CONTROL PROBABILITY: A FORMULATION APPLICABLE TO ANY TEMPORAL PROTOCOL OF DOSE la situación específica de cada paciente. A partir del tensor de dosis, además de la TCP, se pudo observar el comportamiento cualitativo de la NTCP, lo cual nos permitirá, en el futuro, obtener mayor precisión y fiabilidad en el proceso de planificación de tratamientos. Se conluye, finalmente, que es posible establecer un mecanismo integral de planificación de tratamientos que involucre desde la simulación del caso hasta el cálculo de la probabilidad de controlar el tejido tumar y la probabilidad de obtener complicaciones en tejidos sanos expuestos a depósitos de dosis parciales en las cercanías del blanco. En trabajos futuros se prevee avanzar en el estudio sobre fantomas antropomórficos y la inclusión de datos reales de un paciente extraidos de técnicas de diagnóstico como PET-CT. 3. DELIVERY. M. Zaidert and G.N. Minerbo. Phys. Med. Biol. 45 (2000) 279-293. A NEW FORMULA FOR NORMAL TISSUE COMPLICATION PROBABILITY (NTCP) AS A FUNCTION OF EQUIVALENT UNIFORM DOSE (EUD). G. Luxton, P.J. Keall and C.R. King. Phys. Med. Biol. 53 (2008) 23-36.