lab. 10: espectroscopia optica edgar manuel rodriguez cod. 75 073
Anuncio

LAB. 10: ESPECTROSCOPIA OPTICA
EDGAR MANUEL RODRIGUEZ
COD. 75 073 300
LABORATORIO DE FISICA III
UNIVERSIDAD TECNOLOGICA DE PEREIRA
FACULTAD DE CIENCIAS BÁSICAS
LIC. MATEMÁTICAS & FÍSICA
PEREIRA
JULIO DE 2012
1. RESUMEN
En esta práctica se estudia el comportamiento del espectro de emisión del
hidrogeno y así verificar la teoría de Bohr. Logramos obtener de la mayoría de los
tubos espectrales un haz de rayos los cuales nos permitieron realizar las medidas
propuestas en la guía.
Vale destacar que con una de las bombillas utilizadas, la del elemento potasio (K),
se presentó un problema: Produjo luz muy tenue que impidió visualizar la posición
de sus líneas espectrales de emisión. Otros tubos espectrales no funcionaron, por
lo tanto se pudo realizar la práctica de laboratorio con todos los datos pedidos.
También se pudo notar que cada tipo de tubo espectral produce luz a una
temperatura específica del elemento bajo estudio, dada por un voltaje
característico.
SUMMARY
In this lab we study the behavior of the emission spectrum of hydrogen and thus
verify Bohr's theory. We managed to get most of the spectral tubes ray beam which
allowed us to realize the measures proposed in the guide.
It is noteworthy that one of the bulbs used, the element potassium (K), there was a
problem: He produced very dim light that prevented display the position of
emission spectral lines. Other spectral tubes did not work, so could make the lab
with all the information requested.
It was also noted that each spectral type of tube produces light at a specific
temperature of the element under consideration, given by a characteristic voltage.
2. INTRODUCCIÓN
Cada elemento químico tiene un espectro característico, es decir, una
distribución determinada de la radiación electromagnética. Ese espectro
particular permite identificar la composición de una sustancia desconocida; la
técnica recibe el nombre de espectroscopia. Los espectros de emisión, como los
vistos en la presente práctica, están formados por varias líneas de longitud de
onda determinada, separadas por zonas oscuras. Las líneas indican la
estructura atómica, y corresponden a transiciones de los electrones entre
estados de energía definidos.
3. OBJETIVOS
3.1 Utilizar el espectroscopio como herramienta para la identificación de elementos
desconocidospormediodesuespectrodeemisión.
3.2. Estudiar el espectro de emisión del hidrógeno para verificar la teoría de Bohr
respectoalátomodeésteelementoydeterminarlaconstantedeRydberg.
4. MARCO TEORICO
4.1 La luz que nosotros percibimos está siempre formada por radiaciones
correspondientes a una gran cantidad de frecuencias. El laser constituye la única
radiación visible formada por radiaciones de la misma longitud de onda todas
ellas.
Como fenómeno de propagación ondulatoria que es, la luz es refractada al
cambiar su medio de transmisión y se llama igualmente índice de refracción de un
medio respecto a otro al cociente entre las velocidades de propagación en el
segundo medio y en el primero. Para el caso de la luz se define el índice de
refracción de una sustancia como el cociente entre la velocidad de la luz en el
vacío (3,0.108 m/s) y la que posee en el interior de la sustancia.
Se observa que en muchos materiales transparentes a la luz, la velocidad de
propagación para cada longitud de onda es distinta, y por lo tanto, también varía
con la longitud de onda, el índice de refracción. Esta característica de la mayoría
de cuerpos transparentes se puede aprovechar para demostrar la composición de
la luz y efectuar sus análisis.
Un prisma óptico es un cuerpo con dos caras planas no paralelas. Este dispositivo
se utiliza, con accesorios más o menos sofisticados, para efectuar análisis de la
luz.
Si sobre una cara de un prisma óptico se hace incidir una luz compuesta, debido al
distinto índice de refracción que presenta el prisma para cada longitud de onda,
las distintas radiaciones sufrirán desviaciones distintas y se podrán discernir
fácilmente.
La luz visible, se produce al perder energía un electrón cortical de un átomo
excitado. En sentido decreciente de energías liberadas, se emiten rayos Rontgen,
radiación ultravioleta, visible e infrarroja.
La luz emitida por un cuerpo sólido ofrece una gama continua de frecuencias,
hecho que se traduce en que la dispersión de su luz por un prisma óptico presenta
una continuidad, lo cual se expresa diciendo que el espectro de luz emitida por un
gas incandescente solamente presenta unas frecuencias muy bien determinadas
si está constituido por átomos aislados, o por frecuencias agrupadas en bandas si
está constituido por moléculas. De ambos se dice que presentan espectros
ópticos de rayas y bandas respectivamente.
A los espectros formados por la luz que emiten los cuerpos se les denomina
espectros de emisión. En el espectro aparecen zonas oscuras, en un caso
abarcándolo todo, en otro a rayas y en otro a bandas. Las zonas obscuras
denotan ausencia de radiación en el intervalo correspondiente debido a la
absorción de esta radiación por el cuerpo atravesado. A este tipo de espectro se
le denomina espectro de absorción.
Las rayas o bandas que aparecen en el espectro de emisión y en el de absorción
de una misma sustancia tienen una misma posición, lo cual demuestra que un
cuerpo absorbe el mismo tipo de radiación que es capaz de emitir. El hecho
de que las distintas sustancias tengan un espectro característico es de gran
utilidad en el análisis químico cuando se desea tener una idea cualitativa de los
elementos que intervienen en un determinado compuesto o mezcla.
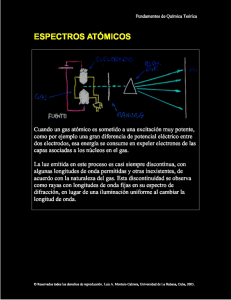
4.2 Cuando hacemos pasar la luz a través de un prisma óptico se produce el
efecto llamado dispersión que consiste en la separación de las distintas longitudes
de onda que forman el rayo incidente.
La luz blanca produce al descomponerla lo que llamamos un espectro continuo,
que contiene el conjunto de colores que corresponde a la gama de longitudes de
onda que la integran.
Sin embargo, los elementos químicos en estado gaseoso y sometidos a
temperaturas elevadas producen espectros discontinuos en los que se aprecia un
conjunto de líneas que corresponden a emisiones de sólo algunas longitudes de
onda. El siguiente gráfico muestra el espectro de emisión del Na (sodio):
El conjunto de líneas espectrales que se obtiene para un elemento concreto es
siempre el mismo, incluso si el elemento forma parte de un compuesto complejo, y
cada elemento produce su propio espectro diferente al de cualquier otro elemento.
Esto significa que cada elemento tiene su propia firma espectral.
Si hacemos pasar la luz blanca por una sustancia antes de atravesar el prisma
sólo pasarán aquellas longitudes de onda que no hayan sido absorbidas por dicha
sustancia y obtendremos el espectro de absorción de dicha sustancia. El gráfico
siguiente muestra el espectro de absorción del sodio:
Observa que el sodio absorbe las mismas longitudes de onda que es capaz de
emitir.
La regularidad encontrada en los espectros discontinuos supone un apoyo muy
importante para comprender la estructura de los átomos.
4.3 Las LEYES DE KIRCHHOFF DE LA ESPECTROSCOPÍA pueden enunciarse
de la siguiente manera:
1. Un sólido o un líquido [o un gas muy denso] incandescente produce
Siempre un espectro continuo.
2. Un gas [enrarecido] incandescente produce un espectro de líneas
brillantes de emisión, sin continuo.
3. Un espectro continuo cuando pasa a través de un gas se transforma en
un espectro con líneas oscuras.
4. Las posiciones de las líneas tanto de emisión como de absorción son
características de la constitución química de la materia que las produce.
Cada elemento y cada compuesto tienen sus líneas características. Los
elementos absorben o emiten luz sólo de ciertas longitudes de onda. En
consecuencia el estudio de un espectro permite la identificación de los
elementos químicos que lo produjeron.
Se muestra a continuación las líneas correspondientes a los espectros de
emisión de los elementos trabajados en esta práctica:
Cadmio,Cd
Mercurio
Hidrógeno
Helio
Neón
Argón(si)
4.4 El descubrimiento de que cada elemento químico llevaba su propia firma
espectral tuvo enormes implicaciones en química, física y astronomía. A través del
análisis espectral, Bunsen y Kirchhoff identificaron los patrones característicos de
las líneas de emisión de colores de todos los elementos entonces conocidos.
Kirchhoff, mientras tanto, empezó a realizar experimentos que conformarían lo
fundamental de una rama de la astronomía conocida después como astrofísica.
Primero resolvió el viejo misterio del origen de las líneas en los espectros solar y
estelar. Confirmando la coincidencia descubierta por Fraunhofer, demostró que
ciertas líneas solares de absorción, conocidas como las líneas de Fraunhofer, se
correspondían con las líneas de emisión del sodio. Calibró el espectroscopio con
una llama de sodio quemando en un fondo oscuro para producir las líneas de
emisión amarillas dobles, características de este elemento, y luego desplazó la
llama hacia el recorrido de un rayo de luz solar, pensando que las líneas de
emisión brillantes se anularían con las líneas del espectro solar. Al contrario. las
líneas de absorción aparecieron más contrastadas y oscuras que antes.
Aparentemente, el gas estaba absorbiendo mucha más energía de la luz solar que
la que estaba emitiendo.
Kirchhoff aplicó estos principios a la astronomía con asombrosos efectos. Kirchhoff
concluyó que la luz del caliente Sol, o de otras estrellas, pasa a través de una
atmósfera circundante de gases más fríos. Gases como el vapor de sodio
absorben de la luz sus longitudes de onda características, produciendo las líneas
oscuras de Fraunhofer en el espectro que llega a la Tierra. Para demostrarlo,
Kirchhoff aplicó a un telescopio un espectroscopio de cuatro prismas que le
permitió ver y comparar simultáneamente las líneas oscuras del espectro solar con
las líneas de emisión brillantes de treinta elementos diferentes que se encuentran
en la Tierra. Descifrando la composición de la atmósfera solar, halló no sólo sodio
sino también cantidades importantes de hierro, calcio, magnesio, níquel y cromo.
Algunos años después, astrónomos que miraron al Sol durante un eclipse solar
hallaron incluso las líneas espectrales de un elemento no descubierto aún en la
Tierra. Lo llamaron helio, a partir del nombre griego helios, de «sol».
Con este descubrimiento los astrónomos pudieron apuntar sus telescopios al Sol y
las estrellas y valerse del espectro que veían para determinar las clases y
cantidades de elementos presentes en esos sitios distantes. Gracias al análisis
espectral de la luz, la física terrestre había dado un brinco hacia el cosmos. El Sol
y las estrellas poseían espectros como los que se podían producir en Heidelberg,
lo cual llevaba a la sencilla conclusión de que las estrellas tenían pocas
diferencias (aparte de la temperatura media) con nuestro mundo.
5. DESCRIPCION DE MATERIALES Y EQUIPOS
• LámparadeReuter.
• FuenteparatubosGeissleryfuenteparatubosdehidrógenode220VAC.
• TubosespectralesdeCd,Hg,Ne,Ar,He.
• TuboespectraldeH.
Soportesparatubosespectrales.
•
• Cablesdeconexión.
• Espectrómetroóptico:
Elespectrómetroconsiste,enesencia,enunanteojo(T),doscolimadores(C1yC2)
yunprismadedispersión(P).(C1)esunsistemadelentesmontadodentrodeun
tubotelescópicoconunaranuraajustableenunextremo,tieneporobjetolograrun
haz de rayos paralelos provenientes de la ranura iluminada. Los colimadores están
fijosyelanteojovaunidoaunbrazoquegiraalrededordelcentrodelsoporte,yse
disponen horizontalmente con los ejes en el mismo plano. En el centro del
instrumento hay una plataforma (B) sobre la cual hay un prisma de dispersión (P)
que produce una serie de líneas espectrales debido a alguna fuente luminosa (F1)
(unodelostubosquesedanparalapráctica).Elanteojo(T)tendrásobresuescala
una posición definida para cada línea, correspondiente a cada longitud de onda en
particular.Laescalaestácolocadaenelextremodelcolimador(C2),ajustadodemodo
quedirijalosrayosluminososhaciaelanteojo(T),despuésdereflejadosenunacara
delprisma(P).
6. PROCEDIMIENTO EXPERIMENTAL
1. Encienda la lámpara de Reuter (F2) y aumente lentamente el voltaje de
alimentación de un tubo espectral (F1) justo hasta que éste encienda. NO
SOBREPASE EL VOLTAJE MAS ALLA DEL PUNTO DE ENCENDIDO – PUEDE
QUEMAR EL TUBO – y observe a través del anteojo (T).
2. En el extremo del colimador (C1) hay un tornillo que regula la abertura de la
ranura ajustable y de esa manera se le puede dar nitidez a las líneas espectrales.
3. Observe una línea espectral bien definida y anote su ubicación en la escala
graduada (ss´):
Al tiempo vaya girando el anteojo en su plano horizontal, ¿cómo es la ubicación de
la línea espectral elegida con respecto a la escala graduada para cualquier
posición del anteojo?
La línea espectral puede cambiar de posición respecto a la escala
graduada según sea el ángulo con que se le observe, fenómeno
que se conoce como PARALAJE; una característica de todos los
instrumentos análogos que puede generar un gran margen de
incertidumbre en las mediciones. Para este experimento, se
observó teniendo el cuidado de cerrar el ojo contrario al del objetivo y
lo más perpendicularmente posible a la escala graduada para obtener
medidas más confiables.
4. Anote las posiciones sobre la escala para una serie de líneas espectrales bien
definidasybusqueenunatablaestandarizadalalongituddeondacorrespondiente,
acordealelementoenestudio.
5. Repita el paso anterior con cada uno de los tubos espectrales de elementos
conocidos.
6. Con los datos tomados en las partes 3 y 4 construya un gráfico de longitud de
onda λ (en A), vs. la escala (ss´), la cual será llamada curva de calibración.
7. Reemplace la fuente para tubos geissler por la fuente para alimentar el tubo de
hidrógeno, enciéndala y observe el espectro nítidamente.
8. Anote las posiciones sobre la escala para las líneas espectrales del hidrógeno
y por medio de la curva de calibración, determine las longitudes de onda λα
(Rojo), λβ (Azul) y λγ (Violeta) correspondientes con cada línea espectral.
7. DATOS OBTENIDOS
ELEMENTO
COLOR
POSICION DE LA
LINEA EN LA ESCALA
GRADUADA SS’
HIDROGENO, H
ROJO
7,3
AZUL-VERDE
10,3
VIOLETA
12,1
ROJO
7,5
VERDE
9,7
VERDE-AZUL
10,4
AZUL
10,8
VIOLETA
11,8
ANARANJADO
8,4
VERDE
8,9
AZUL
12
VIOLETA
13,6
ROJO
7,2
AMARILLO
8,2
VERDE
9,8
AZUL
10,1
AZUL
10,7
VIOLETA
11,5
(2,6 kV)
CADMIO, Cd
MERCURIO, Hg
HELIO, He
(2,6 kV)
ELEMENTO
COLOR
POSICION DE LA
LINEA EN LA ESCALA
GRADUADA SS’
ROJO
6,8
6,9
7,1
7
7,4
7,5 (EL MAS
INTENSO)
NEON, Ne
ANARANJADO
8,1
AMARILLO
8,2
AMARILLO CLARO
8,3
VERDE
8,9
9,1
(0,7 kV)
AZUL
ARGON, Ar
9,4
9,5 9,6 9,7
VIOLETA
10,7
ROJO INTENSO
7
ROJO
7,5
AMARILLO
(0,6 kV)
7,9
8,1
VERDE
8,6 8,7 8,8 8,9
VERDE-AZUL
9,5
VIOLETA
11,4
12,2
12,5
9,8
12,4
12,8
Las longitudes de onda correspondientes a las anteriores posiciones son:
COLOR
POSICION EN LA
ESCALA SS’
LONGITUD DE
ONDA, λ (nm)
ROJO
7,5
643,8
VERDE
9,7
538,2
AZUL
(10,4 + 10,8) /2 = 10,6
480,0
VIOLETA
11,8
372,9
ANARANJADO
8,4
(579,1 + 577)/2=578,0
VERDE
8,9
(546,1+491,6)/2=518,8
AZUL
12
435,8
VIOLETA
13,6
(407,8+404,7)/2=406,2
ROJO
7,2
(706,5+667,8)/2=687,2
AMARILLO
8,2
587,6
VERDE
9,8
(504,8+501,6+492,2)/3
=499,5
AZUL
10,1
471,3
AZUL (INDIGO)
10,7
447,1
VIOLETA
11,5
439,0
ROJO
(6,8 + 6,9+ 7+7,1+7,4 +
(653,2+640,2)/2=646,7
VERDE-AZUL
7,5)/6= 7,1
ANARANJADO
8,1
AMARILLO
(8,2+8,3)/2=8,2
AMARILLO CLARO
(590,2+587,2)/2=588,7
580,4
VERDE
(8,9+ 9,1)/2=9,0
(508,0+505,2)/2=506,6
AZUL
(9,4+ 9,5+ 9,6+9,7+
NO SE CONOCE
9,8)/5=9,6
VIOLETA
10,7
NO SE CONOCE
ROJO INTENSO
7
694,5
ROJO
7,5
(687,1+675,3+668,4+6
41,6)/4=668,1
AMARILLO
(7,9+ 8,1)/2=8,0
(603,2+591,2+588,9+5
60,7+556,9)/5=580,2
VERDE
(8,6+ 8,7 + 8,8+
8,9)/4=8,8
550,6
VERDE-AZUL
9,5
451,1
VIOLETA
(11,4 + 12,2 +
12,4+12,5 +
12,8)/5=12,3
(433,4+426,6+419,8+4
16,4)/4=424,0
ROJO
7,3
656,3
AZUL-VERDE
10,3
486,1
VIOLETA
12,1
434,0
Resumiendo resultados, tenemos:
POSICION EN LA
ESCALA SS’
LONGITUD DE
ONDA, λ (nm)
7,5
643,8
9,7
538,2
10,6
480,0
11,8
372,9
8,4
578,0
8,9
518,8
12
435,8
13,6
406,2
7,2
687,2
8,2
587,6
9,8
499,5
10,1
471,3
10,7
447,1
11,5
439,0
7,1
646,7
8,1
588,7
8,2
580,4
9,0
506,6
7
694,5
7,5
668,1
8,0
580,2
8,8
550,6
9,5
451,1
12,3
424,0
7,3
656,3
10,3
486,1
12,1
434,0
8. ANALISIS Y DISCUSION DE RESULTADOS
1.Conlosdatostomadosenlaspartes6.3y6.4construyaungráficodelongitudde
ondaλ (ennm),vs.laescala(SS’),lacualserállamadacurvadecalibración.
R//.
Donde se utilizó para λ los siguientes datos estandarizados:
LONGITUDESDEONDADELÍNEASESPECTRALES
ElementoColorIntensidadLongituddeOnda(nm)
NeónRojoFuerte653,2
(Ne)RojoFuerte640,2
NaranjaFuerte590,2
NaranjaFuerte587,2
AmarilloFuerte580,4
VerdeDébil508,0
VerdeDébil505,2
HidrógenoRojoFuerte656,3
(H)Verde-azulMediano486,1
VioletaMediano434,0
ElementoColorIntensidadLongituddeOnda(nm)
HelioRojooscuroDébil706,5
(He)RojoFuerte667,8
AmarilloMuyfuerte587,6
VerdeDébil504,8
VerdeMediano501,6
Verde-azulMediano492,2
AzulDébil471,3
AzulFuerte447,1
VioletaDébil439,0
MercurioAmarilloMuyfuerte579,1
(Hg)AmarilloMuyfuerte577,0
VerdeFuerte546,1
Verde-azulMediano491,6
AzulFuerte435,8
VioletaMediano407,8
VioletaMediano404,7
CadmioRojoFuerte643,8
(Cd)VerdeFuerte538,2
AzulFuerte480,0
VioletaFuerte372,9(HASTAAQUÍ,INFOTOMADADEFUENTE1)
ArgónRojo4,0694,5
(Ar)Rojo1,0687,1
Rojo1,1675,3
Rojo0,8668,2
Rojo0,8641,6
Amarillo1,2603,2
Amarillo0,4591,2
Amarillo0,4588,9
Amarillo0,5560,7
Amarillo0,5556,9
Verde0,4550,6
Azul0,4451,1
Púrpura0,6433,4
Púrpura1,0426,6
Púrpura2,2419,8
Púrpura1,4416,4(INFOTOMADADEFUENTE17)
2.Delasposicionessobrelaescalaparalaslíneasespectralesdelhidrógenoydela
curva de calibración, determine las longitudes de onda λα (Rojo), λβ (Azul) y λγ
(Violeta)correspondientesconcadalíneaespectral.
R//.
HIDROGENO, H
(2,6 kV)
ROJO
7,3
AZUL-VERDE
10,3
VIOLETA
12,1
La ecuación obtenida de la curva de calibración es:
Y = - 46,78. X + 974,4,
Siendo Y = longitud de onda, λ (nm),
X = posición de la línea de emisión en la ESCALA SS’.
De ella podemos obtener,
λα (Rojo) = - 46,78. 7,3 + 974,4 = 632,9 nm
λβ (Azul) = - 46,78. 10,3 + 974,4 = 492,6 nm
λγ (Violeta) = - 46,78. 12,1 + 974,4 = 408,4 nm.
Calculemos porcentajes de error:
% e (λα) = (656,3 - 632,9)*100 / 656,3 = 3,6, por defecto.
% e (λβ) = (486,1 – 492,6)*100 / 486,1 = - 1,3, por exceso.
% e (λγ) = (434,0 – 408,4)*100 / 434,0 = 5,9, por defecto.
3.Conbaseenlaecuación(10.4)esposibleencontrarelvalordelaconstantede
Rydberg, RH y así demostrar que la teoría de Bohr es válida para el átomo de
hidrógeno.Contalfinconstruyaunagráficalinealconsusdatosexperimentalesde1/
λenfunciónde(1/m2–1/n2)apartirdelacualsepuedaobtenerunvalordeRH.
R//.
Los siguientes gráficos no dejan la menor duda sobre las transiciones electrónicas
que tienen lugar en el átomo de Hidrógeno, y por tanto cómo debo operar con la
serie de Balmer de emisión y la ecuación (10.4):
1 / (6,329. 10-7) = RH. {(1 / 22) – (1 / 32)}, RH1 = 11 376 204,77 m-1
1 / (4,926. 10-7) = RH. {(1 / 22) – (1 / 42)}, RH2 = 10 826 904,86 m-1
1 / (4,084. 10-7) = RH. {(1 / 22) – (1 / 52)}, RH3 = 11 659 903,92 m-1
Promediando estos valores, tenemos:
RH = 11 287 671,18 m-1.
4.ObtengaunporcentajedeerrorentreelvalorqueobtuvodeRH yelvalorquese
encuentraenloslibros.
R//.
La constante de Johannes Robert Rydberg (Suecia, 1854-1919) aceptada para
el Hidrógeno es:
RH = (10 967 758,341 ± 0,001) m-1
De aquí que puedo deducir un porcentaje de error de:
% e = (10 967 758,341 - 11 287 671,18 )*100 / 10 967 758,341 = -2,92,
por exceso.
¡CREO QUE FUE TODO UN ÉXITO!
5.¿Sepuedeconlaecuación(10.4)hallarlaconstantedeRydbergutilizando
cualquierelementodeemisiónconocido?Explique.
R//.
Cada uno de los elementos químicos tiene su propia constante de Rydberg.
Para todos los átomos similares al Hidrógeno (átomos con un solo electrón en su
última órbita) la constante de Rydberg
puede ser derivada de la constante de
Rydberg del "infinito", de esta forma:
Donde:
es la constante de Rydberg para cierto átomo con un electrón con la
masa en reposo es la masa de su núcleo atómico.
Siendo la constante de Rydberg del "infinito" (según CODATA, Committee on
Data for Science and Technology en el 2002):
6.¿Existenlíneasespectralesdealgunoselementosquenoseanvisiblesparaelojo
humano?
R//.
El ojo humano sólo está capacitado para observar en un margen muy estrecho del
espectro electromagnético, entre (380 - 750) nm:
Color
violeta
azul
verde
Longituddeonda
380–450nm
450–495nm
495–570nm
amarillo
naranja
rojo
570–590nm
590–620nm
620–750nm
Por esta limitante, quedan líneas espectrales de emisión y absorción en las
regiones UV, IR, RX, …, para cada uno de los elementos químicos, que son
imperceptibles para el ojo humano; excepto que se cuente con la tecnología
adecuada para tal fin.
Un ejemplo de lo anterior:
El espectro de emisión del hidrógeno abarca una amplia gama de longitudes de
onda desde el infrarrojo hasta el ultravioleta.
En la tabla se indican las series de transición para el espectro de este átomo que
llevan el nombre de sus descubridores. La serie de Balmer fue más fácil de
estudiar porque muchas de sus líneas caen en la región visible.
7. Consulte algunas aplicaciones de la espectroscopia óptica.
R//.
El análisis espectral centra sus aplicaciones en campos tan importantes como:
* ANÁLISIS QUÍMICO: Puesto que el espectro de un elemento determinado es
absolutamente característico de ese elemento, el análisis espectral permite
estudiar o identificar la composición y la estructura de las moléculas:
a. LA ESPECTROSCOPIA DE RESONANCIA MAGNÉTICA NUCLEAR (RMN) es
una técnica empleada principalmente en la elucidación de estructuras
moleculares, aunque también se puede emplear con fines cuantitativos.
Algunos núcleos atómicos sometidos a un campo magnético externo absorben
radiación electromagnética en la región de las frecuencias de radio o
radiofrecuencias. Como la frecuencia exacta de esta absorción depende del
entorno de estos núcleos, se puede emplear para determinar la estructura de
la molécula en donde se encuentran éstos.
b. La ESPECTROSCOPIA DE ABSORCIÓN ATÓMICA (a menudo llamada AA)
es un método instrumental de la química analítica que determina una gran
variedad de elementos al estado fundamental como analitos.
c. ESPECTROSCOPIA ULTRAVIOLETA-VISIBLE O ESPECTROFOTOMETRÍA
ULTRAVIOLETA-VISIBLE (UV/VIS): es una espectroscopia de emisión de fotones
y una espectrofotometría. Utiliza radiación electromagnética (luz) de las regiones
visible, ultravioleta cercana (UV) e infrarroja cercana (NIR) del espectro
electromagnético. La radiación absorbida por las moléculas desde esta región del
espectro provoca transiciones electrónicas que pueden ser cuantificadas.
La espectroscopia UV-visible se utiliza para identificar algunos grupos funcionales
de moléculas, y además, para determinar el contenido y fuerza de una sustancia.
Se utiliza de manera general en la determinación cuantitativa de los componentes
de soluciones de iones de metales de transición y compuestos orgánicos
altamente conjugados.
Se utiliza extensivamente en laboratorios de química y bioquímica para determinar
pequeñas cantidades de cierta sustancia, como las trazas de metales en
aleaciones o la concentración de cierto medicamento que puede llegar a ciertas
partes del cuerpo.
d. Espectrómetro de masas
La espectrometría de masas es una técnica experimental que permite la
medición de iones derivados de moléculas. El espectrómetro de masas es un
instrumento que permite analizar con gran precisión la composición de diferentes
elementos químicos e isótopos atómicos, separando los núcleos atómicos en
función de su relación masa-carga (m/z). Puede utilizarse para identificar los
diferentes elementos químicos que forman un compuesto, o para determinar el
contenido isotópico de diferentes elementos en un mismo compuesto.
* APLICACIONES ASTROFÍSICAS: La distancia a la que puede situarse un
espectroscopio de la fuente de luz es ilimitada, lo que permite que el estudio
espectroscópico de la luz de las estrellas permita un análisis preciso de su
estructura, especialmente en el caso del Sol. De hecho el helio fue descubierto
antes en el Sol que en la Tierra. Además permite medir con cierta precisión la
velocidad relativa de cualquier fuente de radiación.
a. La espectroscopia astronómica es la técnica de espectroscopia usada en
astronomía. El objeto de estudio es el espectro de la radiación electromagnética,
incluida la luz visible, que radia desde estrellas y otros objetos celestes. La
espectroscopia se puede usar para averiguar muchas propiedades de estrellas y
galaxias distantes, tales como su composición química y movimiento, mediante
efecto Doppler.
Diagrama que muestra cómo un pequeño objeto (tal como un planeta extrasolar)
que orbita en torno a un objeto mayor (tal como una estrella) puede producir
cambios en la posición y velocidad de esta última a medida que orbita su centro de
masa común (cruz roja).
b. La espectroscopia Doppler, también conocida como medición de la velocidad
radial, es un método espectroscópico para encontrar planetas extrasolares.
Involucra la observación de desplazamientos Doppler en el espectro de la estrella
alrededor de la cual la estrella orbita.
Es extremadamente difícil observar directamente planetas extrasolares ya que
tienen un brillo muy tenue a distancias interestelares. Como resultado, los planetas
fuera de nuestro sistema solar usualmente son descubiertos usando métodos
indirectos, a través del efecto del planeta sobre un objeto que es más fácil de
observar, tal como una estrella mayor. Los métodos exitosos incluyen
espectroscopia Doppler, astrometría, sincronización pulsar, tránsitos, y microlentes
gravitacionales. Casi todos los planetas extrasolares conocidos han sido
descubiertos usando espectroscopia Doppler.
* La espectroscopia también es empleada en el campo de la FÍSICA NUCLEAR,
para estudiar la influencia del tamaño y la forma del núcleo de un átomo sobre su
estructura atómica externa.
* ESPECTROSCOPIA RAMAN (llamada así por C.V. Raman) es una técnica
espectroscópica usada en química y física de la materia condensada para estudiar
modos de baja frecuencia como los vibratorios, rotatorios, y otros. Se basa en los
fenómenos de dispersión inelástica, o DISPERSIÓN RAMAN, de la luz
monocromática, generalmente de un láser en el rango de luz visible, el infrarrojo
cercano, o el rango ultravioleta cercano.
* La ESPECTROSCOPIA INFRARROJA es ampliamente usada en investigación y
en la industria como una simple y confiable práctica para realizar mediciones, control
de calidad y mediciones dinámicas. Algunas máquinas indican automáticamente cuál
es la sustancia que está siendo medida a partir de miles de espectros de referencia
almacenados.
Al medir a una frecuencia específica a lo largo del tiempo, se pueden medir cambios
en el carácter o la cantidad de un enlace particular. Esto es especialmente útil para
medir el grado de polimerización en la manufactura de polímeros. Las máquinas
modernas de investigación pueden tomar mediciones infrarrojas a lo largo de todo el
rango de interés con una frecuencia de hasta 32 veces por segundo. Esto puede
realizarse mientras se realizan mediciones simultáneas usando otras técnicas. Esto
hace que la observación de reacciones químicas y procesos sea más rápida y
precisa.
*
ESPECTROSCOPIA
DE
FLUORESCENCIA,
también
llamada
ESPECTROFOTOMETRÍA O FLUOMETRÍA; es un tipo de espectroscopia
electromagnética, la cual analiza la fluorescencia de una muestra. Esto involucra el
uso de un haz de luz comúnmente de luz ultravioleta, que excita a los electrones en
las moléculas de ciertos componentes y causa entonces la emisión de luz.
9. CONCLUSIONES
9.1 Un gran logro obtenido con el desarrollo de esta práctica estuvo en la
deducción de la ecuación de calibración; a partir de la cual y con los datos de
posición en la escala SS’ para el Hidrógeno, se calcularon las longitudes de onda
λα (Rojo), λβ (Azul) y λγ (Violeta) con un mínimo porcentaje de error respecto a
los valores estandarizados en los Handbooks de física.
9.2 Respecto al valor experimental de la constante RH, un porcentaje de error de
2,92 % por exceso, fue realmente exitoso dada la cantidad de cifras significativas
(11) que CODATA ha publicado para este valor; con una incertidumbre tan
pequeña: ± 0,001 m-1. Este logro no hubiese sido posible sin el gráfico donde se
explicitan las líneas de emisión de la serie Balmer en la región visible para el
átomo de Hidrógeno, que condujo a aplicar con rigor la ecuación de Rydberg
aprovechando la gran precisión de las λ previamente obtenidas.
9.3 Repasando el importante modelo atómico del genio N.H.D. Bohr, se pudo
comprender la importancia del mismo para explicar la estructura electrónica del
HIDROGENO relacionada con los espectros de emisión y absorción. Además, se
precisó que cada átomo genera su propia constante de Rydberg.
9.4 Se realizó una amplia búsqueda de aplicaciones de la espectroscopia en áreas
como la química, la física, la astronomía y la biología molecular, que llevó a realzar
la necesidad de profundizar en este importante campo de la ciencia.
10. FUENTES CONSULTADAS
(1)Arcos Velasco, HECTOR IVAN et al. Guías de Física Experimental III.
(2011). Publicaciones UTP, Pereira.
(2)http://www.mitecnologico.com/iem/Main/EspectrosDeEmisionYSeriesEspectrales
(3)http://www.educaplus.org/sp2002/espectros/spespectro.html
(AQUÍSEPUEDEVERCOMOSONLOSESPECTROSDEABSORCION&EMISIONDELOS
ELEMENTOSNATURALES,¡EXCELENTE!)
(4)http://menteacida.com/espectros-de-emision-del-hidrogeno.html
(5)http://html.rincondelvago.com/espectroscopia.html
(6)http://es.wikipedia.org/wiki/Espectroscopia_infrarroja
(7)http://es.wikipedia.org/wiki/Espectroscopia_de_resonancia_magn%C3%A9tica_nuclear
(8)http://es.wikipedia.org/wiki/Espectroscopia_astron%C3%B3mica
(9)http://es.wikipedia.org/wiki/Espectroscopia_Doppler
(10)http://es.wikipedia.org/wiki/Espectroscopia_de_absorci%C3%B3n_at%C3%B3mica_(AA)
(11)http://es.wikipedia.org/wiki/Espectroscopia_ultravioleta-visible
(12)http://es.wikipedia.org/wiki/Espectroscopia_Raman
(13)http://es.wikipedia.org/wiki/Espectroscop%C3%ADa_de_masas
(14)http://es.wikipedia.org/wiki/Espectroscopia_de_fluorescencia
(15)http://translate.google.com.co/translate?hl=es&langpair=en%7Ces&u=http://astro.u-
strasbg.fr/~koppen/discharge/
(16)http://es.wikipedia.org/wiki/Espectro_electromagn%C3%A9tico
(17)http://translate.google.com.co/translate?hl=es&langpair=en|es&u=http://www.mpsvt.org/atom
iclearning/assets/reference_information/emissions_ref_wavelengths.pdf (AQUÍ PUEDE
ENCONTRARSE LOS VALORES ACEPTADOS PARA LONGITUDES DE ONDA DE LOS
ESPECTROS DE EMISION DE ALGUNOS ELEMENTOS ESTUDIADOS EN ESTE INFORME)
(18) http://personales.ya.com/casanchi/fis/espectros/cadmio.htm
(19)http://es.wikipedia.org/wiki/Constante_de_Rydberg