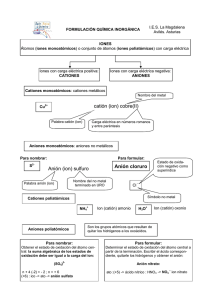
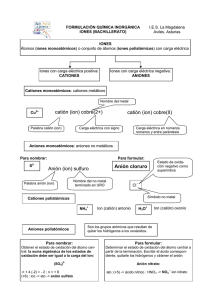
Nomenclatura Inorgánica
Anuncio

Preuniversitario Belén UC Macul Área: Química Contenido: Nomenclatura Inorgánica Pastoral UC NOMENCLATURA INORGÁNICA Estados de oxidación positivos: +1 : H, Li, Na, K, Rb, Cs, Fr, Ag. +2 : Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd. +3 : B, Al, Ga, In, Sc, La, Ac. +4 : Ge. +1 y +2 : Cu, Hg. +1 y +3 : Tl, Au. +2 y +3 : Fe, Co, Ni. +2 y +4 : C, Si, Sn, Pb, Pt. +3 y +4 : Ti, Zr. +3 y +5 : N, P, As, Sb, Bi, V. +4 y +6 : S, Te, Se. +2, +3 y +6 : Cr. +2, +4 y +6 : Mo, W. +1, +3, +5 y +7 : Cl, Br, I, F. +2, +3, +4, +6, +7 : Mn. Para nombrar los distintos compuestos químicos e iones, es necesario conocer los siguientes aspectos: a) el nombre del elemento. b) estado de oxidación. Ahora bien, el nombre de un determinado elemento tiene su origen en el nombre del país donde fue descubierto, en la raíz del nombre del descubridor, etc. Carbono de Carboneum Oro de Aurum Estaño de Stannum Bromo del griego bromos (hediondo) Einstenio en honor a Einstein Estados de oxidación negativos: -1 : H, F, Br, I, Cl -2 : O, S, Te. -3 : N, P. -4 : C, Si. -1 y -2 : O Los estados de oxidación, por su parte, corresponden a la carga eléctrica que presenta en elemento. Ésta puede ser positiva o negativa. Además, un elemento puede tener una o varias cargas. Por lo tanto, el estado de oxidación de un elemento está relacionado, en parte, con el grupo al cual pertenece. Grupo Estado de Oxidación más común E L E M E N T O S IA IIA IIIA IVA VA VIA VIIA +1 +2 +3 +4 +5 +6 -2 +7 -1 H (-1) Li Na K Rb Cs Fr Be Mg Ca Sr Ba Ra B Al Ga In Tl (+1) C (-4, +2) Si (-4, +2) Ge Sn (+2) Pb (+2) N (+3, -3) P (+3, -3) As (+3) Sb (+3) Bi (+3) S (+2, +4) Se Te (+4) O (-2, -1) Cl (+1, +3, +5, +7) Br (+1, +3, +5) I (+1, +5) At (+1, +5) F (-1) 1 Grupo Estado de Oxidación más común E L E M E N T O S IB IIB IIB IVB VB VIB VIIB VIIIB +1 +2 +3 +4 +5 +6 +7 +2 Zn Cd Hg (+1) Sc Y La Ac Mn (+2, +3, +4, +6) Tc (+2, +4) Re (+1, +2, +4, +6) Fe (+3) Co (+3) Ni (+3) Ir (+3) Pt (+4) Cu (+2) Ag Au (+3) Ti (+3) Zr Hf V (+3) Nb (+3) Ta Cr (+2, +3) Mo (+2, +4) W (+2, +4) Un estado de oxidación determinado, se va a manifestar en presencia de otros elementos. DETERMINACIÓN DE LOS ESTADOS DE OXIDACIÓN EN COMPUESTOS Para realizar esta determinación, vamos a distinguir dos casos: - Compuesto neutro - Compuestos positivos y negativos CaO Cax + O-2 x + 1(-2) =0 x-2=0 x = +2 Compuesto neutro En este caso la suma de los estados de oxidación es cero. Por lo tanto, el estado de oxidación del Ca es +2 Compuestos positivos y negativos La suma de los EO debe ser positiva o negativa, según indique la carga del compuesto H2O 2H+ + O-2 2(+1) + (-2) = 0 NH4+ N+-3 + 4H+ (-3) + 4(+1) = +1 -3 PO4 P+5 + 4O-2 1(+5) + 4(-2) = -3 K2Cr2O7 2K+ + 2Cr+6 + 7O-2 2(+1) + 2(+6) + 7(-2) = 0 Si no se conoce el estado de oxidación de un elemento determinado, se puede establecer conociendo el estado de oxidación de los otros elementos que conforman el compuesto. Al igual que en el caso anterior, también se puede conocer el EO de un elemento en base al otro. 2 NOMENCLATURA DE CATIONES Los que tienen un solo estado de oxidación: H+: ion Hidrógeno Ca+2: ion Calcio Al+3: ion Aluminio Los elementos que tienen más de dos estados de oxidación: Cl+1: ion Cloro (I) o ion hipocloroso Cl+3: ion Cloro (III) o ion Cloroso Cl+5: ion Cloro (V) o ion Clórico Cl+7: ion Cloro (VII) o ion Perclórico Los que tienen dos estados de oxidación: Fe+2: ion Hierro (II) o ion Ferroso Fe+3: ion Hierro (III) o ion Férrico Cu+1: ion Cobre (I) o ion Cuproso Cu+2: ion Cobre (II) o ion Cúprico Como vemos en el caso del halógeno Cloro, que presenta cuatro estados de oxidación, se hace uso de la nomenclatura tradicional de prefijos y sufijos. Es decir +1 Hipo…oso +3 …oso +5 …ico +7 Per…ico Se puede observar que la primera forma de nombrarlos, conserva el nombre del elemento, y entre paréntesis, el estado de oxidación. La segunda forma usa sufijos, “oso” e “ico”, para indicar el menor y el mayor estado de oxidación respectivamente. Estos sufijo sólo proceden cuando hay dos estados de oxidación. NOMENCLATURA DE ANIONES Br-: ion bromuro S-2: ion sulfuro Tienen un sólo estado de oxidación H-: ion hidruro Cl-: ion cloruro F-: ion fluoruro I-: ion yoduro Vemos que el sufijo uro es característico para los elementos que presentan estados de oxidación negativos. 3