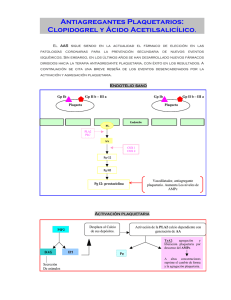
1. DENOMINACIÓN DEL MEDICAMENTO Plavix 75 mg
Anuncio

1. DENOMINACIÓN DEL MEDICAMENTO Plavix 75 mg comprimidos con cubierta pelicular. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Clopidogrel, hidrogenosulfato 97,875 mg (equivalente a 75 mg de clopidogrel base). 3. FORMA FARMACÉUTICA Comprimidos con cubierta pelicular. Plavix 75 mg comprimidos con cubierta pelicular son de color rosa, redondos, biconvexos, con cubierta pelicular, el número «75» aparece grabado en una de las caras y el número «1171» en la otra cara. 4. DATOS CLÍNICOS 4.1 Indicaciones terapéuticas Reducción de eventos ateroscleróticos (infarto de miocardio, infarto cerebral, muerte de causa vascular) en pacientes con antecedentes de aterosclerosis sintomática definida por infarto cerebral isquémico (desde los 7 días hasta un máximo de 6 meses), infarto de miocardio (desde los pocos días hasta un máximo de 35 días) o arteriopatía periférica establecida. Esta indicación se basa en los resultados del estudio CAPRIE que comparó clopidogrel con ácido acetilsalicílico (AAS). La ligera pero estadísticamente significativa diferencia de clopidogrel sobre AAS fue debida principalmente a los pacientes incluidos por arteriopatía periférica. Para mayor información ver el Apdo. 4.4. Advertencias y precauciones especiales de empleo y Apdo. 5.1. Propiedades farmacodinámicas. 4.2 Posología y forma de administración • Adultos y ancianos Clopidogrel debe administrarse en una toma única diaria de 75 mg con o sin alimentos. • Niños y adolescentes No se ha establecido la seguridad ni la eficacia en pacientes menores de 18 años. 4.3 Contraindicaciones Hipersensibilidad al principio activo o a cualquier componente del producto. Insuficiencia hepática severa. Hemorragia patológica activa, como por ejemplo úlcera péptica o hemorragia intracraneal. Lactancia materna (ver Apdo. 4.6. Embarazo y lactancia). 1 4.4 Advertencias y precauciones especiales de empleo En pacientes con infarto agudo de miocardio el tratamiento con clopidogrel no debe iniciarse durante los primeros días tras el infarto de miocardio. Debido a la falta de datos, clopidogrel no puede ser recomendado en angina inestable, ACTP (stenting), injerto de derivación aortocoronaria e infarto cerebral isquémico agudo (menos de 7 días). Tal como sucede con otros fármacos antiplaquetarios, clopidogrel debe utilizarse con precaución en pacientes con riesgo de hemorragia debido a traumatismos, cirugía u otras situaciones patológicas. Si el paciente va a ser sometido a cirugía programada y no se desea un efecto antiplaquetario, la administración de clopidogrel debe suspenderse 7 días antes de la intervención. Clopidogrel prolonga el tiempo de sangría y debe administrarse con precaución en pacientes que presentan lesiones con propensión a sangrar (particularmente, gastrointestinales e intraoculares). Debe advertirse a los pacientes de la posibilidad de hemorragias más prolongadas cuando están en tratamiento con clopidogrel, y que deben informar a su médico de cualquier hemorragia no habitual. Antes de someterse a cualquier intervención quirúrgica y antes de iniciar cualquier otro tratamiento, los pacientes deberán informar a su médico y a su odontólogo de que están tomando clopidogrel. La experiencia terapéutica con clopidogrel es limitada en pacientes con insuficiencia renal. Por tanto clopidogrel debe utilizarse con precaución en estos pacientes. La experiencia es limitada en pacientes con insuficiencia hepática moderada que pueden sufrir diátesis hemorrágicas. En consecuencia, clopidogrel debe administrarse con precaución a este grupo de pacientes. No se recomienda la administración concomitante de clopidogrel con warfarina debido a que puede incrementar la intensidad de los sangrados. Debido al posible aumento del riesgo de sangrado, la administración concomitante de clopidogrel con AAS, AINEs, heparina o trombolíticos debe realizarse con precaución (ver Apdo. 4.5. “Interacción con otros medicamentos y otras formas de interacción”). Los medicamentos que puedan producir lesiones gastrointestinales (por ejemplo antiinflamatorios no esteroideos) deben utilizarse con precaución en pacientes bajo tratamiento con clopidogrel (ver Apdo. 4.5. Interacción con otros medicamentos y otras formas de interacción). 4.5 Interacción con otros medicamentos y otras formas de interacción Warfarina: Ver Apdo. 4.4. Advertencias y precauciones especiales de empleo. Ácido acetilsalicílico (AAS): AAS no modifica la inhibición mediada por clopidogrel de la agregación plaquetaria inducida por ADP, pero clopidogrel potencia el efecto del AAS en la agregación plaquetaria inducida por colágeno. Sin embargo, la administración concomitante de 500 mg de AAS dos veces al día durante 24 horas no aumentó significativamente el alargamiento del tiempo de sangría inducido por la administración de clopidogrel. No se ha establecido la seguridad de la administración crónica concomitante de AAS y clopidogrel (ver Apdo. 4.4. Advertencias y precauciones especiales de empleo). Heparina: en un estudio clínico realizado en individuos sanos, clopidogrel no requirió la modificación de la dosis de heparina ni alteró el efecto de ésta sobre la coagulación. La administración conjunta de heparina no tuvo ningún efecto sobre la inhibición de la agregación plaquetaria inducida por clopidogrel. Sin embargo, no se ha establecido la seguridad de esta combinación y la administración concomitante debe efectuarse con precaución (ver Apdo. 4.4. Advertencias y precauciones especiales de empleo). 2 Trombolíticos: la seguridad de la administración concomitante de clopidogrel, rt-PA y heparina se estudió en pacientes que habían sufrido infarto de miocardio recientemente. La incidencia de hemorragias clínicamente significativas fue similar a la observada cuando se administraron conjuntamente rt-PA y heparina con AAS. No se ha establecido la seguridad de la administración conjunta de clopidogrel y otros agentes trombolíticos y deberá realizarse con precaución (ver Apdo. 4.4. Advertencias y precauciones especiales de empleo). Antiinflamatorios no esteroideos (AINEs): en un estudio clínico realizado en voluntarios sanos, la administración concomitante de clopidogrel y naproxeno aumentó la pérdida oculta de sangre gastrointestinal. Sin embargo, debido a la falta de estudios sobre interacciones con otros AINEs, no está claro, actualmente, si se produce un incremento del riesgo de hemorragia gastrointestinal con todos los AINEs. Por consiguiente, la administración de clopidogrel y AINEs deberá realizarse con precaución (ver Apdo 4.4. Advertencias y precauciones especiales de empleo). Otros tratamientos concomitantes: se han realizado diversos estudios clínicos con clopidogrel y otras medicaciones concomitantes para investigar el potencial de interacción farmacocinética y farmacodinámica. No se observaron interacciones farmacodinámicas significativas al coadministrar clopidogrel con atenolol, nifedipina o ambos. Además, la actividad farmacodinámica de clopidogrel no se vio significativamente influenciada por la administración conjunta de fenobarbital, cimetidina o estrógenos. No se observó modificación de la farmacocinética de digoxina o teofilina por la coadministración de clopidogrel. Los antiácidos no modificaron la absorción de clopidogrel. Datos obtenidos a partir de estudios realizados con microsomas hepáticos humanos mostraron que el metabolito carboxílico de clopidogrel podía inhibir la actividad del citocromo P450 2C9. Este hecho podría provocar potencialmente el incremento de los niveles plasmáticos de fármacos, tales como fenitoína y tolbutamida y los AINEs, que son metabolizados por el citocromo P450 2C9. Los datos obtenidos a partir del estudio CAPRIE indican que fenitoína y tolbutamida pueden administrarse conjuntamente con clopidogrel de forma segura. 4.6 Embarazo y lactancia • Embarazo Se han efectuado estudios de reproducción en ratas y conejos que no han revelado efectos en cuanto a reducción de la fertilidad o daño fetal debidos a clopidogrel. Sin embargo, no existen estudios adecuados y bien controlados en mujeres embarazadas. Debido a la falta de datos no se recomienda la administración de clopidogrel durante el embarazo. • Lactancia Los estudios efectuados en ratas indican que clopidogrel y/o sus metabolitos son excretados en la leche. Se desconoce si este fármaco es excretado en leche humana (ver Apdo. 4.3. Contraindicaciones). 4.7 Efectos sobre la capacidad para conducir y utilizar máquinas Tras la administración de clopidogrel, no se ha observado disminución alguna de la capacidad de conducción o psicométrica. 3 4.8 Reacciones adversas La seguridad de clopidogrel ha sido evaluada en más de 11.300 pacientes, incluyendo más de 7.000 tratados durante un año o más. Clopidogrel 75 mg/día fue bien tolerado en comparación con AAS 325 mg/día en un amplio estudio clínico controlado (CAPRIE). En este estudio, la tolerancia global de clopidogrel fue similar a AAS, independientemente del sexo, edad o raza. Los efectos adversos clínicamente relevantes observados en el estudio CAPRIE se exponen a continuación: Trastornos hemorrágicos: la incidencia global de hemorragia para pacientes tratados tanto con clopidogrel como AAS fue del 9,3 %. La incidencia de los casos graves fue del 1,4 % para clopidogrel y del 1,6 % para AAS. En pacientes que recibieron clopidogrel, la incidencia de hemorragia gastrointestinal observada fue del 2,0 %, y requirió hospitalización en un 0,7 %. En pacientes que recibieron AAS, los porcentajes correspondientes fueron del 2,7 % y 1,1 %, respectivamente. La incidencia de otras hemorragias fue superior en el grupo clopidogrel comparado con AAS (7,3 % versus 6,5 %). Sin embargo, la incidencia de efectos adversos graves fue similar en ambos grupos de tratamiento (0,6 % versus 0,4 %). Los efectos adversos reportados más frecuentemente en ambos grupos de tratamiento fueron: púrpura/equimosis/hematoma y epistaxis. Otros efectos adversos comunicados con menos frecuencia fueron hematoma, hematuria y hemorragia ocular (principalmente conjuntival). La incidencia de hemorragia intracraneal fue del 0,4 % en pacientes que recibieron clopidogrel y del 0,5 % en pacientes que recibieron AAS. Hematológicos: se observó neutropenia grave (< 0,45 x 109/l) en 4 pacientes (0,04 %) tratados con clopidogrel y en 2 pacientes del grupo AAS (0,02 %). Dos de los 9.599 pacientes que recibieron clopidogrel y ninguno de los 9.586 pacientes que recibieron AAS presentaron recuentos de neutrófilos de cero. Un caso de anemia aplásica ocurrió durante el tratamiento con clopidogrel. La incidencia de trombocitopenia grave (< 80 x 109/l) fue del 0,2 % para clopidogrel y del 0,1 % para AAS; muy raramente se han comunicado casos de recuento de plaquetas ≤ 30x109/l. Gastrointestinales: la incidencia global de efectos gastrointestinales (por ejemplo: dolor abdominal, dispepsia, gastritis y estreñimiento) en pacientes que recibieron clopidogrel fue significativamente menor que en aquellos que recibieron AAS (27,1 % versus 29,8 %). Además, el número de efectos adversos que provocaron discontinuación prematura y permanente del tratamiento fue menor en el grupo clopidogrel comparado con AAS (3,2 % versus 4,0 %). Sin embargo, la incidencia de efectos adversos considerados como clínicamente graves no fue significativamente diferente en los grupos (3,0 % versus 3,6 %). Los efectos observados con mayor frecuencia en ambos grupos fueron dolor abdominal, dispepsia, diarrea y náuseas. Otros efectos menos frecuentes fueron estreñimiento, alteraciones dentales, vómitos, flatulencia y gastritis. Los casos de diarrea observados en el grupo de clopidogrel tuvieron una frecuencia significativamente superior a los casos observados con AAS (4,5 % versus 3,4 %). La incidencia de diarrea grave fue similar en ambos grupos (0,2 % versus 0,1 %). La incidencia de úlceras gástricas, pépticas o duodenales fue del 0,7 % para clopidogrel y del 1,2 % para AAS. Trastornos de piel y anejos: la incidencia global de trastornos de piel y anejos fue significativamente superior con clopidogrel (15,8 %) en comparación con AAS (13,1 %). La incidencia de eventos graves fue similar con ambos tratamientos (0,7 % versus 0,5 %). Hubo un número de pacientes con rash cutáneo significativamente superior en el grupo tratado con clopidogrel en comparación con el grupo tratado con AAS (4,2 % versus 3,5 %). En el grupo 4 clopidogrel se produjo un número significativamente superior de casos de pacientes con prurito en comparación con el grupo tratado con AAS (3,3 % versus 1,6 %). Trastornos del Sistema Nervioso Central y Periférico: la incidencia global de los trastornos del Sistema Nervioso Central y Periférico (cefalea, mareos, vértigos y parestesia) fue significativamente menor en pacientes con clopidogrel en comparación con AAS (22,3 % versus 23,8 %). Trastornos hepáticos y biliares: la incidencia global de los trastornos hepáticos y biliares fue similar tanto en pacientes tratados con clopidogrel como en pacientes tratados con AAS (3,5 % versus 3,4 %). Experiencia post-comercialización: la experiencia post-comercialización conforma el perfil de seguridad definido durante el desarrollo clínico; se han descrito reacciones de hipersensibilidad : incluyen principalmente reacciones cutáneas (rash maculopapular o eritematoso, urticaria...) y/o prurito. Muy raramente se han observado casos de broncospasmo, angioedema o reacciones anafilácticas. Como parte de la experiencia post-comercialización, se han descrito casos muy raros de púrpura trombótica trombocitopénica (PTT) (1/200.000 pacientes expuestos). 4.9 Sobredosificación Se ha comunicado un solo caso de sobredosis intencionada con clopidogrel. Una mujer de 34 años tomó una dosis única de 1.050 mg de clopidogrel (equivalente a 14 comprimidos de 75 mg). No se produjeron efectos indeseables asociados. No se aplicó tratamiento específico y la paciente se recuperó sin secuelas. No se observaron reacciones adversas tras la administración oral única de 600 mg de clopidogrel a individuos sanos (equivalente a 8 comprimidos de 75 mg). El tiempo de sangría aumentó en un factor de 1,7 similar al observado con dosis terapéuticas de 75 mg/día. No se ha encontrado ningún antídoto contra la actividad farmacológica de clopidogrel. Si se requiere una corrección rápida de la prolongación del tiempo de sangría, una transfusión de plaquetas puede revertir los efectos de clopidogrel. 5. PROPIEDADES FARMACOLÓGICAS 5.1 Propiedades farmacodinámicas Grupo farmacoterapéutico: inhibidores de la agregación plaquetaria, excluida la heparina, Código ATC: B01AC/04. Clopidogrel inhibe selectivamente la unión del adenosin-difosfato (ADP) a su receptor plaquetario y la activación subsiguiente del complejo GPIIb-IIIa mediada por ADP, inhibiendo de esta forma la agregación plaquetaria. Es necesaria la biotransformación de clopidogrel para conseguir la inhibición de la agregación plaquetaria. Clopidogrel también inhibe la agregación plaquetaria inducida por otros agonistas, mediante el bloqueo de la amplificación de la activación plaquetaria por el ADP liberado. Clopidogrel actúa modificando de forma irreversible el receptor plaquetario del ADP. Por consiguiente, las plaquetas expuestas a clopidogrel se ven afectadas durante el resto de su vida y la recuperación de la función plaquetaria normal se produce a una velocidad que depende de la reposición de las plaquetas. La administración de dosis repetidas de 75 mg/día produce, desde el primer día, una inhibición sustancial de la agregación plaquetaria inducida por ADP; ésta aumenta progresivamente y alcanza el estado de equilibrio (steady state) entre el día 3 y el día 7. En el estado de equilibrio, el nivel medio de inhibición observado con una dosis de 75 mg/día está entre el 40 % y 60 %. En general, la agregación plaquetaria y el tiempo de sangría vuelven gradualmente a los valores basales en los 5 días siguientes tras la suspensión del tratamiento. 5 Se ha evaluado la seguridad y la eficacia de clopidogrel en la prevención de eventos vasculares isquémicos en una comparación a ciego con AAS (CAPRIE: clopidogrel versus ASA in patients at risk of ischaemic events). Este estudio incluyó 19.185 pacientes con aterotrombosis, manifestada por infarto de miocardio reciente (< 35 días), accidente cerebrovascular isquémico (entre 7 días y 6 meses) o arteriopatía periférica establecida (AP). Los pacientes fueron distribuidos aleatoriamente para recibir clopidogrel 75 mg/día o AAS 325 mg/día, y el seguimiento se efectuó durante 1 a 3 años. En el subgrupo con infarto de miocardio, la mayoría de pacientes recibieron AAS durante los primeros días post-infarto agudo de miocardio. Clopidogrel redujo significativamente la incidencia de nuevos eventos isquémicos (variable principal de valoración combinada de infarto de miocardio, accidente cerebrovascular isquémico y muerte vascular) en comparación con AAS. En el análisis por intención de tratar, se observaron 939 eventos con clopidogrel y 1.020 con AAS (reducción relativa del riesgo (RRR) 8,7 % [IC 95 %: 0,2 a 16,4 %]; p = 0,045), que corresponde, por cada 1.000 pacientes tratados durante 2 años, a 10 [IC: 0 a 20]pacientes adicionales a los que se les evita que presenten un nuevo evento isquémico. El análisis de la mortalidad total como un criterio secundario de la evaluación no mostró ninguna diferencia significativa entre clopidogrel (5,8 %) y AAS (6,0 %). En un análisis de subgrupos por criterios de inclusión (infarto de miocardio, infarto cerebral isquémico y AP) el beneficio se demostró superior (alcanzando significación estadística con p = 0,003) en los pacientes incluidos por arteriopatía periférica (especialmente aquellos que también tenían historia de infarto de miocardio) (RRR = 23,7 %; IC: 8,9 a 36,2) y menor (sin diferencias significativas respecto al AAS) en los pacientes con infarto cerebral (RRR = 7,3 %; IC: - 5,7 a 18,7). En los pacientes que fueron incluidos en el ensayo por haber sufrido únicamente un infarto de miocardio reciente, clopidogrel fue numéricamente inferior pero no estadísticamente diferente de AAS (RRR = - 4 %; IC: - 22,5 a 11,7). Además, un análisis de subgrupos por edad sugirió que el beneficio de clopidogrel en pacientes mayores de 75 años fue inferior al observado en pacientes ≤ 75 años. Dado que el ensayo CAPRIE no fue diseñado para calcular la eficacia de subgrupos individuales, no está claro si las diferencias en cuanto a reducciones relativas del riesgo entre los diferentes grupos de inclusión son reales, o son resultado del azar. 5.2 Propiedades farmacocinéticas Clopidogrel se absorbe rápidamente tras la administración de dosis orales repetidas de 75 mg/día. Sin embargo, las concentraciones plasmáticas de la molécula original son muy bajas y por debajo del límite de cuantificación (0,00025 mg/l) transcurridas 2 horas tras su administración. La absorción es al menos del 50 % en base a la excreción urinaria de los metabolitos de clopidogrel. Clopidogrel sufre un importante metabolismo hepático y su metabolito principal, que es inactivo, es el derivado carboxílico, que representa alrededor del 85 % del compuesto circulante en plasma. El nivel plasmático máximo de este metabolito (aproximadamente 3 mg/l tras la administración de dosis orales repetidas de 75 mg) se alcanza aproximadamente al cabo de una hora después de la administración. Clopidogrel es un profármaco. El metabolito activo, un derivado tiol, se forma por oxidación de clopidogrel a 2-oxo-clopidogrel e hidrólisis subsiguiente. El paso oxidativo está regulado primariamente por los isoenzimas 2B6 y 3A4 del Citocromo P450 y en menor medida por los 1A1, 1A2 y 2C19. El metabolito tiol activo, que ha sido aislado in vitro, se une rápidamente y de forma irreversible a receptores plaquetarios, inhibiendo entonces la agregación plaquetaria. Este metabolito no ha sido detectado en plasma. La cinética del metabolito principal circulante es lineal (las concentraciones plasmáticas aumentan proporcionalmente a la dosis) para el rango de dosis de clopidogrel comprendido entre 50 y 150 mg. 6 In vitro, clopidogrel y el metabolito principal circulante se unen de forma reversible a proteínas plasmáticas humanas (98 % y 94 % respectivamente). In vitro, la unión es no saturable para un amplio rango de concentraciones. Tras una dosis oral de clopidogrel marcado con 14C en humanos, aproximadamente el 50 % se excreta por orina y aproximadamente el 46 % por vía fecal en las 120 horas siguientes a la administración. La vida media de eliminación del metabolito circulante principal es de 8 horas tras administraciones únicas y repetidas. Tras la administración de dosis repetidas de 75 mg/día de clopidogrel, los niveles plasmáticos del metabolito circulante principal fueron menores en pacientes con insuficiencia renal grave (aclaramiento de creatinina entre 5 y 15 ml/min) en relación a pacientes con insuficiencia renal moderada (aclaramiento de creatinina entre 30 y 60 ml/min) y a los niveles observados en otros estudios realizados en voluntarios sanos. Aunque la inhibición de la agregación plaquetaria inducida por ADP fue menor (25 %) que la observada en voluntarios sanos, la prolongación del tiempo de sangría fue similar a la observada en voluntarios sanos a quienes se les administró 75 mg/día de clopidogrel. Además, la tolerancia clínica fue buena en todos los pacientes. Las características farmacocinéticas y farmacodinámicas de clopidogrel fueron estudiadas en ensayos realizados con dosis únicas y múltiples, tanto en voluntarios sanos como en cirróticos (Child-Pugh, clase A ó B). La administración diaria de 75 mg/día de clopidogrel durante 10 días fue segura y bien tolerada. La Cmax de clopidogrel, tanto para dosis únicas como en el estado de equilibrio en cirróticos, fue muy superior a la observada en sujetos normales. Sin embargo, los niveles plasmáticos del metabolito circulante principal junto con el efecto de clopidogrel sobre la agregación plaquetaria inducida por ADP y el tiempo de sangría fueron comparables en ambos grupos. 5.3 Datos preclínicos sobre seguridad Durante los estudios preclínicos realizados en ratas y babuinos, los efectos observados con mayor frecuencia fueron los cambios a nivel hepático. Estos hechos se produjeron a dosis que representan al menos 25 veces la utilizada en el hombre que es de 75 mg/día y fueron consecuencia de un efecto sobre enzimas metabólicos hepáticos. No se observó ningún efecto sobre los enzimas metabólicos hepáticos en humanos que recibieron clopidogrel a dosis terapéuticas. A dosis muy elevadas se observó una baja tolerancia gástrica a clopidogrel en ratas y babuinos (gastritis, erosiones gástricas y/o vómitos). No se evidenciaron efectos carcinogénicos al administrar clopidogrel a ratones durante 78 semanas y a ratas durante 104 semanas, a dosis de hasta 77 mg/kg/día (lo cual representa un ratio de exposición como mínimo de 25 veces el humano a la dosis clínica de 75 mg/día). Clopidogrel fue ensayado en diferentes estudios sobre genotoxicidad in vitro e in vivo y no mostró actividad genotóxica. Se ha observado que clopidogrel no ejerce ningún efecto sobre la fertilidad de las ratas machos y hembras y que no posee efecto teratógeno en la rata ni en el conejo. Cuando se administró a ratas en período de lactancia, clopidogrel causó un ligero retraso en el desarrollo de las crías. Estudios farmacocinéticos específicos llevados a cabo con clopidogrel marcado radiactivamente, han mostrado que clopidogrel o sus metabolitos son excretados con la leche. Consecuentemente, no se puede excluir un efecto directo (ligera toxicidad) o un efecto indirecto (baja palatabilidad). 6. DATOS FARMACÉUTICOS 6.1 Relación de excipientes Núcleo: Lactosa anhidra Almidón de maíz modificado Macrogol 6.000 Celulosa microcristalina Aceite de ricino hidrogenado 7 Recubrimiento: Hipromelosa Macrogol 6.000 Dióxido de titanio (E171) Óxido de hierro rojo (E172) Cera carnauba 6.2 Incompatibilidades No procede. 6.3 Período de validez Tres años. 6.4 Precauciones especiales de conservación Ninguna especial. 6.5 Naturaleza y contenido del recipiente Estuches de cartón con 28, 50 y 84 comprimidos acondicionados en blisters de PVC/PVDC o blisters de Alu/Alu. . 6.6 Instrucciones de uso/manipulación y eliminación (en su caso) No procede. 7. NOMBRE O RAZÓN SOCIAL Y DOMICILIO O SEDE SOCIAL DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN Sanofi Pharma Bristol-Myers Squibb SNC 174 Avenue de France 75013 París - Francia 8. NÚMERO DEL REGISTRO COMUNITARIO DE MEDICAMENTOS EU/1/98/069/001a – Estuches de cartón de 28 comprimidos en blisters de PVC/PVDC. EU/1/98/069/001b – Estuches de cartón de 28 comprimidos en blisters de Alu/Alu. EU/1/98/069/002a – Estuches de cartón de 50 comprimidos en blisters de PVC/PVDC. EU/1/98/069/002b – Estuches de cartón de 50 comprimidos en blisters de Alu/Alu. EU/1/98/069/003a – Estuches de cartón de 84 comprimidos en blisters de PVC/PVDC. EU/1/98/069/003b – Estuches de cartón de 84 comprimidos en blisters de Alu/Alu. 9. FECHA DE LA PRIMERA AUTORIZACIÓN O DE LA RENOVACIÓN DE LA AUTORIZACIÓN 15 de julio de 1998 10. FECHA DE REVISIÓN DEL TEXTO 8