Enunciado
Anuncio

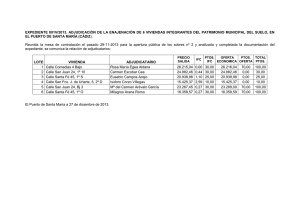
CUADERNILLO DE ACTIVIDADES PARA ALUMNOS DE 4º DE E.S.O., CON FÍSICA Y QUÍMICA DE 3º PENDIENTE DE CALIFICACIÓN POSITIVA CUADERNILLO DE RECUPERACIÓN DE FÍSICA-QUÍMICA ( 1ª EVAL) 1ª UD.: LA CIENCIA, LA MATERIA Y SU MEDIDA 1.-Explica cuáles son las fases o etapas del método científico ( 0,5 puntos). 2.-Convierte ( 0,5 puntos): a) 10 días en horas, minutos y segundos. b) 17280 segundos en minutos, horas y días. 3.-Escribe mediante notación científica con tres cifras significativas las siguientes cantidades: 1238000 , 0,00005224, 0,0000001957 y 9540100000 (0,5 puntos). 4.-Expresa en unidades del SI: 12µm, 1,24 hm, 154 dag, 96 hg, 125 ml, 42 daL, 26 min, 8245 ns, 235 mA y 2daA (0,5 puntos). 5.-El volumen de una piedra puede determinarse midiendo el agua que desaloja al echarla en una probeta que contenga este líquido. En términos físicos esta medición, ¿es directa o indirecta?.( 0,5 puntos). 6.-Dos átomos próximos de carbono en la red del diamante distan 0,154 nm. Expresa mediante notación científica esa distancia en m. y en mm( 0,5 puntos). 7.- Al introducir un líquido a 20ºC en un congelador, se observa que cada dos minutos disminuye su temperatura tres grados centígrados. Ordena una tabla los datos de descenso de temperatura hasta 8 minutos. Realiza la representación gráfica y escribe la ecuación que la representa (0, 8 puntos). Magnitud 1ª Medida 2ª Medida 3ª Medida 4ª Medida 5ª Medida Tiempo(min) 0 2 4 6 8 T(ºC) 20 17 14 11 8 8.-Ordena, de menor a mayor, las magnitudes de cada uno de los apartados( 0,6 puntos): a) 154,5 cm, 1551mm; 0,1534 m. b) 25 min; 250 s; 0,25 h. c) 36 Km/h; 9m/s; 990 cm/s. 9.-Sustituye el dato y despeja la incógnita de cada ecuación( 1punto): a) V= 15 + 3 t, v=20 b) F= 9,8 •m, F= 980 c) s= 35- 5 t, S= 25 d) v-2 = 2t, v=2 10.-Observa los datos de la tabla que relacionan la masa de varios montones de monedas de 1 euro ( 1 punto). Nº mon 4 8 12 16 20 24 Masa(g) 30 60 90 120 150 180 a)Representa gráficamente la masa frente al número de monedas. ¿Qué forma tiene la gráfica? b) Expresa en lenguaje científico ( ecuación y escrito) la conclusión que se puede obtener. c) Indica cómo calcular la masa de una moneda. 11.-Completa la tabla ( 0,6 puntos): Unidad Múltiplos Submúltiplos hm Kg m3 12.-En un laboratorio se ha medido la temperatura que alcanza un líquido a intervalos regulares de tiempo, obteniéndose los siguientes resultados( o,6 puntos): Tiempo(min) Temperatura(ºC) 0 25 1 29 2 35 3 37 4 41 5 45 a) Representa los datos en una gráfica. b) ¿Qué tipo de gráfica se obtiene? c) ¿Crees que algún punto puede corresponder a una medida mal hecha? 13.-Un enfermero ha controlado la temperatura de un paciente durante el tiempo que permaneció ingresado en el hospital(este ejercicio vale 0,6 puntos). 1.-El primer día ingresó sin fiebre (37ºC). 2.-El segundo día la fiebre le subió a 39ºC y se mantuvo así durante tres días. 3.-A partir de entonces, la fiebre bajó a razón de medio grado por día. Cuando el enfermo estuvo tres días sin fiebre, se le dio el alta en el hospital. Reconstruye la gráfica de la temperatura. 14.-Copia en tu cuaderno esta tabla y complétala expresando los múltiplos y submúltiplos del metro( 0,6 puntos). Unidad Símbolo Equivalencia Notación científica 103 Kilómetro hm 100 m 1 dm 0’1 Decámetro Metro 1 10-2 0’001 15.- Vas a medir la superficie de una hoja de papel utilizando una regla graduada. En primer lugar observa la regla y determina (0,6 puntos): a) La longitud más pequeña que podemos medir con ella. b) La longitud más grande que podemos medir con la regla. c) Determina la superficie de una hoja e indica en qué unidad da el resultado. 16.- Indica la unidad de longitud que utilizarías para expresar las siguientes medidas( 0,6 puntos): a) La distancia de Sevilla a Granada b) La superficie del aula en la que estás c) El diámetro de la cabeza de un tornillo d) La longitud de tu pie e) El volumen de tu teléfono móvil. 2ª UD.: LA MATERIA: ESTADOS FÍSICOS Cada uno de los siguientes ejercicios puntúa 0,52 puntos. 1.-Imagina que tomas una jeringa y realizas la siguiente experiencia: 1.1. Levantas el émbolo de la jeringa para que se llene de aire. 1.2.-Luego cierras el orificio con el dedo y a continuación, empujas sobre el émbolo con fuerza sin quitar el dedo del agujero de la jeringa. a) al empujarlo, ¿el émbolo baja? b) ¿Qué ocurre con el aire que está en el interior? c) ¿Qué magnitudes están variando al bajar el émbolo? d) ¿Qué es la presión del gas? e) ¿Ocurrirá lo mismo si llenamos la jeringa con agua? 2.-Enuncia las leyes de los gases siguientes: a) Ley de Boyle-Mariotte. b) Ley de Gay-Lussac. 3.-Relaciona mediante una flecha ambas columnas. • El agua se congela • Evaporación • El hielo se derrite • Ebullición • El agua hierve • Sublimación • El alcanfor(sól)se evapora • Fusión • El charco se seca • Solidificación 4.-Agrupa los siguientes fenómenos según se produzcan por un aumento o por una disminución de temperatura: a) Paso de líquido a sólido b) Dilatación de un gas c) Paso de hielo a agua líquida d) Condensación del vapor de agua e) Dilatación de un sólido f) Congelación del agua 5.- A temperatura constante, si disminuimos a la cuarta parte el volumen de un gas,¿qué le ocurre a la presión? 6.-Determina, en grados centígrados, la temperatura de un gas que en condiciones normales ocupa un volumen de 150 L y que a 10 atm de presión solo ocupa un volumen de 20 L. 7.-En la tabla que aparece a continuación se encuentran los puntos de fusión y de ebullición de algunas sustancias: Sustancia Mercurio Butano Cobre P.F. -39 ºC -135 ºC 1083 ºC P.E. 357 ºC -0,6 ºC 2595 ºC Explica cuál será su estado físico a las siguientes temperaturas: a) 25 ºC b) 50 ºC c) 100 ºC d) 1200 ºC e) 2800 ºC 8.-En un recipiente de 5 L se introduce gas oxígeno a la presión de 4 atm. ¿Qué presión ejercerá si duplicamos el volumen del recipiente sin que varíe su temperatura? 9.-En un recipiente de 5 L se introduce gas oxígeno a la presión de 4 atm y se observa que su temperatura es 27 ºC.¿Cuál será su presión si la temperatura pasa a ser de 127 ºC sin que varíe el volumen? 10.-Un gas ocupa un volumen de 5 L a 0ºC. ¿Cuál será su temperatura si ha pasado a ocupar un volumen de 10 L sin que varíe su presión? 11.- Explica, basándote en la teoría cinética, por qué la fluidez aumenta al elevarse la temperatura. 12.-Transforma las siguientes temperaturas centígradas a la escala absoluta ( kelvin). a) 0 ºC b) 20ºC c) -100 ºC d) -27ºC 13.-Pasa a atmósferas las siguientes presiones: a) 670 mm Hg b) 700 mm Hg c) 1040 mm Hg 14.-Expresa los siguientes volúmenes en cm3: a) 200 ml b) 0,5 L c) 100 m3 15.-Una masa de gas ocupa un volumen de 5 L cuando la presión es de 1 atm. ¿Cuál será el nuevo volumen si la presión aumenta a 2 atm y la temperatura no cambia? 16.-Un recipiente de 5 L contiene un gas a 2 atm de presión y 27 ºC. ¿Cuál será el volumen que ocupará este gas a 27 ºC y 1,0 atm de presión? 17.-La nieve carbónica que se utiliza en algunos efectos especiales de películas es dióxido de carbono (CO2) sólido que se sublima a -78 ºC. ¿En qué estado se encuentra a temperatura ambiente? 18.-Completa el texto con los términos que faltan : La vaporización es el cambio de estado que experimenta un líquido cuando pasa de estado________ a estado_________. Si el cambio se produce en toda la masa, a una temperatura y presión determinadas, se denomina___________. Pero si el cambio se produce solamente en la superficie del líquido y a cualquier temperatura, entonces se denomina__________. 19.-¿Por qué se empaña el espejo del cuarto de baño mientras te duchas? 3ª UD.: LA MATERIA: CÓMO SE PRESENTA Cada una de las actividades realizadas puntúa 0,83. 1.- Si preparas un zumo de naranja y lo dejas en reposo, observarás que después de un rato se hace transparente en la parte superior y turbio en la inferior. Al colar el zumo se separa la pulpa de naranja del líquido. Contesta a las siguientes cuestiones: a) ¿A qué tipo de sustancia pertenece el zumo de naranja? b) ¿Qué nombre recibe la técnica de separar con el colador? 2.-Haz un esquema de la composición de la materia y su clasificación. 3.-El granito es una roca que se utiliza como material de construcción por su gran solidez y resistencia. ¿Es una sustancia pura o mezcla?¿Cuáles son sus componentes y cómo se distinguen a simple vista? 4.-Relaciona los siguientes términos: • Gasolina • Elemento • Agua • Mezcla homogénea • Azufre • Compuesto • Agua con arena • Mezcla heterogénea 4.-Explica cómo separarías las siguientes mezclas en el laboratorio. Nombra y dibuja el material necesario. a) Azucar y agua b) Agua y gasolina c) Arena y sal común d) Agua y acetona e) Limaduras de hierro y limaduras de plomo. 5.-Indica cuál de los métodos de separación se basa en las distintas densidades de las sustancias que se quieren separar. • Filtración • Cristalización • Decantación • Destilación 6.- Indica cuál es el principal soluto y cuál el disolvente en las siguientes disoluciones. Disolución 30 ml de alcohol en 100 ml de agua Agua de mar Vinagre( ac. Acético: 3%) Soluto principal Disolvente 7.-Una bebida alcohólica tiene un 14% en volumen de alcohol. Calcula la cantidad de alcohol que tomaremos si ingerimos un vaso de 120 cm3 de dicha bebida. 8.-Para preparar 0,3 L de una disolución de alcohol en agua al 4% , ¿qué cantidades de alcohol y agua son necesarias? 9.-¿Cuál es la concentración en g/L de una disolución que se preparó disolviendo 34 g de azúcar ( C12H22O11) en agua hasta tener 250 ml de disolución? 10.-Para preparar medio litro de disolución al 7% en masa de cloruro de sodio ( NaCl), ¿qué cantidad de cloruro de sodio es necesaria? ( dNaCl= 1g/cm3). 11.- Observa la gráfica y contesta: a) ¿Cuál de las dos sustancias tiene una mayor solubilidad a 40ºC? b) ¿Cuál es la solubilidad de cada sustancia a 10ºC? c) ¿Cuál de las dos sustancias tiene una mayor solubilidad a 70 ºC? d) ¿Qué ocurrirá si echamos 100 g de cada sustancia en dos recipientes con 2 L de agua cada uno a 50ºC?¿Se disolverá todo? 12.- A 500 ml de una disolución de cloruro de calcio cuya concentración es de 10 g/L, se le añade 2 g de soluto. ¿Cuál es la nueva concentración?. 4ª UD.: LA MATERIA: PROPIEDADES ELÉCTRICAS Y EL ÁTOMO Cada una de las actividades realizadas puntúa 0,83 puntos. 1.-¿Por qué los siguientes átomos, distinto símbolo químico?. 18 39 Ky 19 39 K tienen el mismo número másico y 2.- Completa la tabla: Elemento Símbolo Carbono Calcio Oxígeno Flúor Nº atómico 6 Nº másico 12 7 16 Nº de protones 8 Nº de neutrones 20 Nº de electrones 20 7 3.-La plata se presenta en la naturaleza con dos isótopos estables: • • 107 47 Ag 109 51,82% 47 Ag48,18% ¿Cuál será entonces la masa atómica de la plata? 4.-Observa los siguientes átomos: 10 5 B; 11 5 B; 12 5B; 14 7N; 16 8O; 12 12 8 C; 7C Agrupa los átomos anteriores según: a) Sean isótopos. b) Tengan el mismo número másico. c) Tengan el mismo número de neutrones. 5.-Escribe el símbolo del ión que se forma y determina si son aniones o cationes cuando: a) El hidrógeno pierde un electrón. b) El hidrógeno gana un electrón. c) El cloro gana un electrón. d) El calcio pierde dos electrones. 6.- Dado el elemento químico de número atómico 15 y número másico 31, determina: a) La constitución de su nucleo. b) El número de protones, neutrones y electrones que tiene el ión estable que forma. c) Su posición en la tabla. 6.-Relaciona con flechas: • Z = 11 □ Sodio •Z=20 •Z=28 □ Niquel □ Calcio 7.- Completa la siguiente tabla: Símbolo del ión Br_ Al +3 O2- N3- Tipo de ión Nº de e ganados Nº de e perdidos 8.-Explica las siguientes frases: a) La experiencia de Rutherford demostró que la mayor parte del átomo está vacío. b) La experiencia de Rutherford demostró que la carga positiva del átomo se concentra en una región muy pequeña: en el núcleo. c) La experiencia de Rutherford demostró que el tamaño del núcleo es muy pequeño comparado con el tamaño del átomo. 9.- Enumera algunas de las aplicaciones de ciertos isótopos radiactivos en investigaciones y experimentos científicos. 10.-Busca alguna noticia relacionada con la energía nuclear o su industria y comenta brevemente la noticia. 11.-Completa las frases: a) Los protones y los__________ tienen la misma carga eléctrica, pero distinto signo. b) Cuando el número de _____________ es igual al de electrones, el átomo es_________. c) Si un cuerpo gana electrones, adquiere carga de signo__________, y si los pierde, adquiere carga de signo_____________. d) Las cargas de igual signo se ___________ y las de distinto signo se _______________. 12.- Los técnicos que realizan las radiografías abandonan la sala en la que está el paciente justo antes de tomar la imagen. ¿De qué se protegen? 5ª UD.: SUSTANCIAS SIMPLES Y COMPUESTOS QUÍMICOS 1.-¿Existen más compuestos orgánicos o más inorgánicos? 2.-Escribe el nombre de cuatro gases contaminantes e indica dónde se produce. 3.-Escribe el nombre de los cuatro elementos químicos más abundantes en los seres vivos, en la corteza terrestre y en el Universo. Representa su abundancia en un diagrama de barras. 4.- Busca un extracto de artículo periodístico que hable de algún compuesto orgánico o inorgánico y haz un breve resumen de la noticia. 5.- Clasifica los siguientes elementos químicos como bioelementos y oligoelementos: Hierro, carbono, cobre, hidrógeno, flúor, oxígeno, cinc, calcio, magnesio, potasio, yodo. 6.- Haz un dibujo de la tabla periódica representado los metales, no metales y gases nobles y busca para 12 de estos elementos alguna de su utilidad o uso. Indícalo por debajo del símbolo del elemento correspondiente. 7.- Elige la respuesta correcta: En el Sistema periódico los elementos se ordenan en función de … a) El número másico, A. b) El número de protones del núcleo. c) La cantidad de compuestos químicos que pueden formar. 8.-Indica la posición en el sistema periódico de los siguientes elementos: a) Z= 5. b) Z= 14 c) Z= 26 d) Z= 18 Tema 6 6.1.) ¿Qué diferencia fundamental hay entre un cambio físico y uno químico? (0,5 ptos.) 6.2.) Distingue razonadamente los cambios físicos de los químicos: (0,5 ptos.) a) Evaporación de un perfume b) Combustión de la madera c) Oxidación de una viga de hierro d) Encendido de una cocina de vitrocerámica f) Encendido de una cocina de gas g) Disolución de azúcar en agua h) Caramelización de azúcar para hacer un flan i) Oscurecimiento de una manzana al contacto con el aire j) Pelado y troceado de una manzana k) Dilatación de una barra de hierro por el calor l) Formación de chispas al forjar el hierro m) Fermentación de los azúcares de la uva n) Cocción de un huevo ñ) Triturado de uva para obtener mosto 6.3.) Contesta: (0,5 ptos.) a) ¿Qué ocurre a los cubitos en un vaso al sol? b) ¿Es posible que el agua se convierta en hielo? ¿Y el hielo en agua? c) ¿La madera puede transformarse en ceniza? ¿Y la ceniza en madera? d) ¿En qué se convierte el agua cuando se calienta? 6.4.) Razona la veracidad o falsedad de las afirmaciones: (0,5 ptos.) a) La proporción entre sustancias que reaccionan es igual que la proporción entre los productos de reacción. b) El volumen total de reactivos es igual que el volumen total de productos. c) La masa total de los reactivos es igual que la masa total de los productos de la reacción. d) Los reactivos siempre se consumen completamente, sea cual sea la proporción en que se combinan. 6.5.) Si medimos la masa de un trozo de cinta de magnesio y después la hacemos arder, midiendo la masa del óxido de magnesio obtenido, observamos que no son iguales. ¿Por qué? ¿No se cumple la ley de conservación de la masa? (0,5 ptos.) 6.6.) Según la teoría de colisiones, para que una reacción tenga lugar: (0,5 ptos.) a) Sólo se necesitan que choquen entre sí las moléculas de los reactivos b) Es suficiente con que la orientación de las moléculas de los reactivos sea la adecuada c) Deben romperse los enlaces en las moléculas de los reactivos y formarse otros nuevos d) Las moléculas de los reactivos deben de estar a elevada temperatura 6.7.) En 3·1022 moléculas de fosfina (PH3): (0,5 ptos.) a) ¿Cuántos moles de PH3 hay? b) ¿Cuántos gramos de PH3? c) ¿Cuántos átomos hay en total? Masas atómicas: P = 31 u.m.a.; H = 1 u.m.a. 6.8.) Completa la tabla: (0,5 ptos.) Sustancia O3 H2O NH3 HNO3 Masa molecular (u.m.a.) Cantidad de sustancia (moles) Número de moléculas Masa (g) 5 0,1 17 3,011·10 23 6.9.) En una muestra de 51 g de ácido sulfhídrico (H2S): (0,5 ptos.) a) ¿Qué cantidad de sustancia en moles de H2S hay? b) ¿Cuántas moléculas hay? c) ¿Qué cantidad de sustancia en moles de átomos de H contienen 51 g de H2S? Masas atómicas: H = 1 u.m.a.; S = 32 u.m.a. 6.10.) Uno de los combustibles más utilizados es el gas propano, de fórmula C3H8. Se quema cuando reacciona con el oxígeno del aire (O2) dando dióxido de carbono y agua: (0,5 ptos.) a) Escribe y ajusta la reacción. b) ¿Cuántos moles de gas propano se habrán quemado si se obtienen 12 moles de dióxido de carbono? c) ¿Cuántos gramos de oxígeno habrá que utilizar para obtener 12 moles de dióxido de carbono? 6.11.) El carbón se quema con oxígeno produciendo dióxido de carbono mediante una reacción que podemos representar así: C(s) + O2(g) ↔ CO2(g) (0,5 ptos.) a) ¿Qué masa de oxígeno hará falta para quemar 6 kg de carbón? b) ¿Qué masa de dióxido de carbono se obtendrá? 6.12.) El ácido clorhídrico (HCl) se obtiene haciendo reaccionar ácido sulfúrico (H2SO4) con cloruro de sodio (NaCl), por medio de la reacción: (0,5 ptos.) 2 NaCl + H2SO4 ↔ Na2SO4 + 2 HCl a) ¿Cuántos gramos de cloruro de sodio hacen falta para obtener 1 kg de ácido clorhídrico? b) ¿Cuántos gramos de ácido sulfúrico reaccionarán? 6.13.) Cuando se echa agua a la cal viva (óxido de calcio) se forma cal apagada (hidróxido de calcio): (0,5 ptos.) a) Escribe la ecuación de la reacción y ajústala b) Calcula los gramos de cal apagada, Ca(OH)2, que se formarán si tenemos 10 g de cal viva (CaO). c) Calcula la cantidad de agua que se necesita para apagar la cal viva (CaO) que tenemos 6.14.) El amoniaco (NH3) se descompone dando gas hidrógeno y gas nitrógeno: (0,5 ptos.) a) Escribe y ajusta la reacción. b) Calcula cuántos gramos de amoniaco se deben descomponer para obtener 7 g de nitrógeno. c) ¿Qué cantidad de sustancia en moles de amoniaco representan esos gramos? d) Calcula la cantidad de sustancia en moles de gas hidrógeno que se obtienen cuando se descomponen 34 g de amoniaco. Dato: la reacción transcurre en condiciones normales de presión y temperatura. 6.15.) El ácido clorhídrico reacciona con el hidróxido de calcio para dar cloruro de calcio y agua: (0,5 ptos.) a) Escribe la ecuación de la reacción y ajústala b) ¿Qué cantidad de sustancia en moles de cloruro de calcio se obtiene si reaccionan 3 moles de ácido clorhídrico? c) ¿Cuántos gramos de hidróxido de calcio reaccionan en ese caso? d) ¿Cuántos gramos de ácido clorhídrico deben reaccionar? e) ¿Cuántos gramos de cloruro de calcio se obtienen? f) ¿Cuántos gramos de agua se obtienen? g) Se conserva la masa en la reacción. 6.16.) Una central térmica utiliza un determinado carbón que contiene el 1,6% en masa de azufre. Sabiendo que el azufre se transforma en dióxido de azufre según la reacción: S + O2 ↔ SO2, determina los moles y los kg de dióxido de azufre que se producen al día, si cada hora en la central térmica se queman 10000 kg de carbón (0,5 ptos). 6.17.) Dado el proceso: SO2 + HNO3 + H2O ↔ H2SO4 + NO (0,5 ptos.): a) Ajusta la anterior reacción química b) Determina la cantidad de NO que se produce por reacción de 100 kg de SO2 si el rendimiento del proceso es del 80% 6.18.) El N2 reacciona con el H2 para dar NH3 según la reacción: N2 + 3 H2 ↔ 2 NH3. Si tenemos 3 litros de nitrógeno medidos en condiciones normales, determina: (0,5 ptos.) a) Los moles de N2 presentes b) Los moles de H2 que se necesitan para reaccionar completamente con el N2 c) El volumen que ocupa el H2 en condiciones normales d) El volumen que ocupa el N2 a 25ºC y 5 atmósferas de presión e) Los moles de amoníaco obtenidos si asumimos un rendimiento del 100% f) Los gramos de amoníaco obtenidos si asumimos un rendimiento del 80% 6.19.) Para la reacción química del ejercicio anterior, determina: (0,5 ptos.) a) El volumen de hidrógeno medido a 3 atm y 22ºC que se obtiene al hacer reaccionar 327 g de cinc con exceso de ácido clorhídrico b) El volumen de disolución 3M de HCl que se necesita para hacer reaccionar 327 g de cinc 6.20.) Para la reacción del cinc en ácido clorhídrico: 2 HCl + Zn↔ ZnCl 2 + H2, calcula la cantidad de cinc que reaccionará con 540 mL de disolución de HCl 2M, suponiendo un rendimiento del 100% (0.5 ptos). Tema 7 7.1.) Escribe la reacción ajustada de combustión del etanol (0,5 ptos). a) Calcula la cantidad de sustancia (en moles y en gramos) necesaria para que se produzcan 4 moles de agua b) Determina el volumen de dióxido de carbono, en condiciones normales, que se desprende al quemar 2 moles de etanol 7.2.) Completa y ajusta las siguientes reacciones ácido-base: (0,5 ptos.) a) HBr + NaOH ↔ ____ + H2O b) HCl + Ca(OH)2 ↔ CaCl2 + ____ c) H2SO4 + ____ ↔ Na2SO4 + H2O 7.3.) Escribe ajustada la reacción de neutralización entre el hidróxido potásico y el cloruro de hidrógeno: (0,5 ptos.) a) Calcula la cantidad de cloruro potásico (en moles y en gramos) que se obtendrá a partir de 5 moles de hidróxido de potasio y exceso de cloruro de hidrógeno. b) Calcula la cantidad de sustancia en moles de agua que se formará con 20 g de cloruro de hidrógeno y exceso de hidróxido potásico. 7.4.) El llamado agujero de ozono se refiere a la disminución del espesor de la capa de ozono. Los derivados de clorofluorocarbonados que pasan a las nubes por acción de las personas se convierten en radicales libres que destruyen millones de moléculas de ozono. El grosor de la capa de ozono se mide en Unidades Dobson (UD), en honor a G. Dobson, uno de los primeros científicos en investigar el ozono atmosférico: 100 UD equivalen a 1 mm de gas de ozono puro a temperatura normal y a una atmósfera de presión. A continuación, se muestran algunos valores medios de las concentraciones de ozono en el Antártico: (0,5 ptos.) Estación del año Nivel de ozono (UD) a) b) c) d) Primavera 150 Verano 240 Otoño 220 Invierno 210 Expresa las unidades Dobson en milímetros de ozono ¿Hay alguna relación entre el nivel de ozono y la época del año? ¿En qué época del año empieza a disminuir el nivel de ozono? ¿Qué efectos sobre el medio ambiente origina esta alteración? 7.5.) En el análisis del aire de una ciudad se han medido 14 mg/m3 de dióxido de azufre (0,5 ptos). a) ¿Qué cantidad de dióxido de azufre habrá en 1 L de aire? b) ¿Cuántos moles representa la cantidad anterior? c) ¿Y moléculas? 7.6.) En muchas ciudades se separan los residuos sólidos (vidrio, cartón, materia orgánica…) en distintos contenedores. ¿Qué ventajas tiene este sistema? (0,5 ptos.) 7.7.) El carbón que quema una central térmica contiene aproximadamente un 2,5% de azufre. ¿Qué cantidad de dióxido de azufre pasa a la atmósfera por cada tonelada de carbón? La reacción de combustión del azufre es: S + O2 ↔ SO2 (0,5 ptos). 7.8.) Los botes de refrescos se usan cada vez más. Razona cómo serán las fases de Reducir, Reutilizar y Reciclar el material del que están hechos, y explica sus ventajas económicas y medioambientales (0,5 ptos). 7.9.) En la gráfica se indica el porcentaje estimado de diferentes compuestos en la destrucción de la capa de ozono (0,5 ptos). Claves: • CFC: clorofluorocarbonos • CCl4: tetracloruro de carbono • CH3CCl3: tricloruro de etilo a) ¿Cuál es la principal sustancia que destruye la capa de ozono? b) Investiga: ¿cuál es el origen de esta sustancia? c) ¿Qué medidas se pueden tomar para reducir la presencia de CFC en la atmósfera? 7.10.) El efecto invernadero está originado por diferentes sustancias gaseosas. La contribución relativa de estos gases a este efecto aparece en la tabla (0,5 ptos). Gases Contribución (%) a) b) c) d) CO2 50 CH4 18 CFC 17 O3 9 NOx 6 ¿Qué problemas medioambientales origina el incremento del efecto invernadero? ¿Cuál es el gas que tiene mayor influencia en este problema? ¿Qué medidas se pueden tomar para disminuirlo? ¿Tiene algún efecto positivo? ¿Qué sucedería si no existiese efecto invernadero? 7.11.) La EPO o eritropoyetina es una hormona natural producida por los seres vivos encargada de fabricar glóbulos rojos que transportan el oxígeno en la sangre. Esta hormona natural no se puede diferenciar científicamente de la obtenida artificialmente en el laboratorio; sólo se puede sospechar su presencia de forma indirecta por un elevado porcentaje de glóbulos rojos en la sangre. El valor máximo permitido de hemoglobina (índice de hematocrito) en los controles antidopaje de los deportes de larga distancia (ciclismo, maratón, esquí de fondo…) es de un 50%. Los valores normales oscilan entre 38-50% (0,5 ptos). Porcentaje de glóbulos rojos en la sangre (índice de hematocrito) 0 – 50 % 50 % >50 % a) b) c) d) Análisis control antidopaje Negativo Valor máximo permitido Positivo ¿Cuál es la ventaja adquirida por los atletas que toman EPO? ¿Qué indica en un análisis la presencia de un índice de hematocrito del 52%? ¿Por qué razón siempre se realiza un contraanálisis en estos controles? ¿En qué enfermedades se puede recetar la EPO como medicamento? 7.12.) ¿Qué efectos produce en el organismo humano un antiácido, un antibiótico y un antipirético? (0,5 ptos.) 7.13.) La tabla siguiente muestra los valores aceptados en la Unión Europea respecto a los umbrales máximos permitidos de contaminantes metálicos para suelos de cultivo y el análisis de una muestra de lodos destinados a la agricultura (0,5 ptos). Metal Concentración máxima UE (mg/kg) Concentración obtenida (mg/kg) Plomo 300 Mercurio 1,5 Níquel 75 Cinc 300 Cobre 140 5000 1,5 55 200 1900 a) Compara los resultados de la muestra con los valores permitidos e indica qué metales sobrepasan el umbral máximo b) ¿Se podrá utilizar este lodo en agricultura? ¿Por qué? c) Busca información y contesta: ¿qué problemática presenta la absorción de metales pesados por los seres vivos? 7.14.) A veces las tierras de cultivo no tienen la acidez adecuada, por lo que no son buenas para que se desarrollen ciertas plantas. Explica por qué se utilizan abonos como amoniaco para elevar el pH de los suelos (0,5 ptos). 7.15.) Investiga y busca información sobre el componente fundamental de los chalecos antibalas llamado “Kevlar” (0,5 ptos). a) ¿Cuál es la ventaja de este material sobre otros materiales? b) Cuáles son las principales aplicaciones del Kevlar? c) ¿A qué materiales sustituye? 7.16.) Calcula el pH de una disolución de HCl de concentración: (0,5 ptos.) a) 0,1 M b) 10-3 M c) 10-8 M 7.17.) Calcula el pH de una disolución de NaOH de concentración: (0,5 ptos.) a) 0,1 M b) 10-3 M c) 10-8 M 7.18.) ¿Qué concentración debe tener una disolución de un ácido fuerte HA para que el pH sea 2,23? (0,5 ptos.) 7.19.) ¿Cuántos centímetros cúbicos de una disolución 0,1 M de ácido sulfúrico se precisan para neutralizar 50 cm3 de una disolución 0,2 M de NaOH? Nota: Asúmase que el ácido sulfúrico se comporta como un ácido fuerte en los dos equilibrios de disociación (0,5 ptos). 7.20.) Escribe los equilibrios químicos que conducen a la formación de la lluvia ácida (0,5 ptos.) Tema 8 8.1.) ¿Cuántos electrones ha perdido un cuerpo que tiene una carga de +6μC? (0,5 ptos.) 8.2.) Clasifica los materiales como conductores o aislantes (0,5 ptos). a) Agua e) Cobre b) Aire f) Madera c) Plástico g) Plata d) Aluminio h) Vidrio 8.3.) A partir de la siguiente gráfica, determina: (0,5 ptos.) i) Cartón j) Mármol k) Leche l) Oro a) ¿Qué relación existe entre I y ΔV? b) ¿Qué significado tiene la pendiente de la recta? c) ¿Cuál será la intensidad para un voltaje de 20 V? 8.4.) La resistencia de un hilo de cobre de 10 m de longitud y 10-4 m2 de sección es de 1,72·10-3 Ω. Calcula las resistencia de un hilo de cobre que tiene las dimensiones que se indican en la siguiente tabla de datos (0,5 ptos). Resistividad (Ω·m) 1,72·10-8 Longitud (m) 1 2 2 1 Resistividad (Ω) 1,72·10-3 Sección (m2) 10-4 10-4 2·10-4 2·10-4 8.5.) Por un conductor circula una intensidad de corriente de 10 mA. Calcula la carga que circula y el tiempo en los siguientes apartados: (0,5 ptos.) Carga (C) Tiempo (s) Intensidad (mA) 3 10 1 10 10 10 60 8.6.) Un circuito eléctrico tiene instalada una resistencia variable. Aplica la ley de Ohm para completar los valores de la tabla (0,5 ptos). Intensidad (A) 10 5 Diferencia de potencial (V) 20 20 2 Resistencia (Ω) 1000 3000 50 8.7.) A un conductor se le aplican distintos voltajes. En la tabla siguiente se muestran junto con la intensidad de corriente que circula en cada caso (0,5 ptos). ΔV (V) I (A) 1 0,2 2 0,4 3 0,6 5 1 7 1,4 a) Representa gráficamente ΔV frente a I. b) ¿Qué relación se puede escribir entre el voltaje y la intensidad? c) ¿Qué significado físico tiene la pendiente de la recta obtenida? ¿Cuál es su valor? 8.8.) En este circuito, R1 = 3 Ω, R2 = 5 Ω, y R3 = 15 Ω (0,5 ptos). a) ¿Cuál es la resistencia equivalente del circuito? b) ¿Cuál es la diferencia de potencial en cada resistencia? 8.9.) Calcula la intensidad que circula por el circuito, sabiendo que las resistencias de las bombillas son R1 = 20 Ω y R2 = 30 Ω (0,5 ptos). a) ¿Cómo conectarías un amperímetro para medir la intensidad de la corriente? b) ¿Cómo se debería conectar un voltímetro para medir la diferencia de potencial entre los extremos de una de las resistencias? c) Si se conectan las resistencias en paralelo, ¿cómo varía su intensidad? 8.10.) Dibuja un circuito en el que aparezcan cuatro resistencias de 5 Ω conectadas de diferente forma. Calcula la resistencia equivalente en cada uno de los siguientes apartados (0,5 ptos). a) Las cuatro en serie b) Las cuatro en paralelo c) Dos en serie y dos en paralelo 8.11.) Calcula la resistencia equivalente en las siguientes asociaciones de resistencias: (0,5 ptos.) a) Dos resistencias en serie de 3 y 5 Ω b) Dos resistencias en paralelo de 2 y 4 Ω c) Tres resistencias en serie de 2, 4 y 5 Ω d) Tres resistencias en paralelo de 1, 3 y 4 Ω 8.12.) Dado el siguiente circuito, donde R1 = 5 Ω, R2 = 5 Ω y R3 = 10 Ω, calcula la resistencia total y la intensidad que circula por él (0,5 ptos). 8.13.) Lee el texto y responde a las preguntas (0,5 ptos). En las bombillas incandescendetes, aproximadamente el 90% de la electricidad que entra se convierte en calor, y no en luz. Las investigaciones sobre nuevos sistemas de iluminación que ahorren energía han encontrado una nueva tecnología: los LED. Los diodos emisores de luz, llamados LED, son pequeños dispositivos fabricados de un material semiconductor que permiten a la corriente eléctrica desplazarse en un único sentido y que producen luz como un subproducto de la corriente. No tienen filamentos, al igual que los tubos fluorescentes y, por tanto, no se calientan, consumen muy poca energía y tienen larga vida. Uno de los inconvenientes que tienen es que emiten una luz muy brillante, pero sólo en un punto, no en una amplia área, como las lámparas incandescentes o fluorescentes. Esto es un problema para llenar de luz una habitación. Además, el precio aún resulta excesivo para emplearlos en iluminación. a) ¿Cuáles son las ventajas de los diodos de luz frente a las bombillas de Edison? b) ¿Qué ventajas tiene el fluorescente frente a un LED? c) ¿Cómo es la luz que emiten los LED? 8.14.) Investiga: ¿qué diferencias hay entre las lámparas de incandescencia o bombillas y las de descarga eléctrica o fluorescentes? (0,5 ptos.) 8.15.) Busca información sobre Michael Faraday y escribe unas cuantas lineas destacando sus contribuciones más importantes al estudio de la relación entre electricidad y magnetismo (0,5 ptos). 8.16.) Una carga de 2 culombios pasa en 0,1 segundos de un punto A, cuyo potencial es 125 voltios, a otro punto B, cuyo potencial es 25 voltios. Calcula: (0,5 ptos). a) La energía de la carga de 2 culombios en el punto A b) La energía de la carga de 2 culombios en el punto B c) La energía que libera al pasar del punto A al punto B d) La potencia desarrollada 8.17.) Por un hilo de ferroníquel de 1 m de longitud, 0,2 mm2 de sección y 80 microohmios·cm de resistividad, sumergido en un litro de agua, se hace pasar durante 16 minutos y 40 segundos una corriente de 5 amperios. Calcula: (0,5 ptos.) a) La resistencia del hilo b) El calor producido c) El aumento de temperatura que experimenta el agua suponiendo que no hay pérdidas de calor d) El aumento de temperatura que experimenta el agua suponiendo que se pierde el 30% 8.18.) Suponiendo que la intensidad de corriente principal es I = 2 A y que las resistencias R1 y R2 de dos conductores asociados en paralelo valen respectivamente 5 y 15 ohmios, calcula las intensidades I1 e I2 de las corrientes que circulan por ellos (0,5 ptos). 8.19.) Un generador de fuerza electromotriz (f.e.m.) de 26 V y resistencia 1 ohmio se conecta a los extremos de una asociación formada por la unión en paralelo de dos resistencias de 20 y 30 ohmios, respectivamente. Calcula: (0,5 ptos.) a) La intensidad de corriente que pasa por el circuito b) La tensión en los bornes del generador c) La potencia consumida por la resistencia de 30 ohmios 8.20.) Una plancha eléctrica trae la siguiente inscripción 220 V – 1100 W. ¿Cuánto vale su resistencia? ¿Qué energía consume durante 3 horas de funcionamiento? (0,5 ptos.) NOTA: En todos los ejercicios las masas atómicas son datos que puedes buscar en la tabla periódica. Las masas atómicas más frecuentes son: H = 1 g/mol, C = 12 g/mol, N = 14 g/mol, O = 16 g/mol, Na = 23 g/mol, S = 32 g/mol, Cl = 35,5 g /mol, Zn = 65,4 g/ mol, I = 127 g/mol.