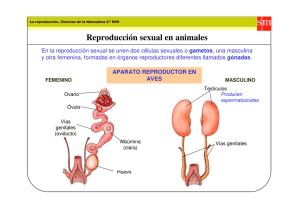
Estudio Morfo-Funcional de Espermatozoides de Camélidos
Anuncio

UNIVERSIDAD NACIONAL DE TUCUMÁN Facultad de Agronomía y Zootecnia TESIS DOCTORAL Estudio Morfo-Funcional de Espermatozoides de Camélidos Sudamericanos. Interacciones con el Oviducto Silvana Andrea Apichela San Miguel de Tucumán - 2008 UNIVERSIDAD NACIONAL DE TUCUMÁN RECTORADO RECTOR CPN JUAN ALBERTO CERISOLA VICERRECTORA PSIC. MARIA LUISA ROSSI DE HERNÁNDEZ SECRETARIA GENERAL Dn. JOSÉ HUGO SAAB SECRETARIA ADMINISTRATIVA ING. JUAN CARLOS REIMUNDÍN Sub-Secretaria CPN. LUIS SACCA SECRETARIA ACADEMICA DRA. MARTA PESA Sub-Secretaria PROF. MARTA JUAREZ DE TUZZA SECRETARIA DE POSGRADO DRA. SUSANA MAIDANA SECRETARIA DE EXTENSION UNIVERSITARIA PSIC. MANUEL RAÚL ANDUJAR Sub-Secretario LIC. RAMIRO GARROCHO SECRETARIO DE CIENCIA Y TECNICA DR. DANIEL ENRIQUE CAMPI Sub-Secretaria DRA. MARIA PERAL DE BRUNO SECRETARIA DE PLANEAMIENTO, OBRAS Y SERVICIOS CPN. MÓNICA INÉS DE LABASTIDA Sub-Secretario DR. ARQ. FRANCO MARIGLIANO SECRETARIA DE BIENESTAR UNIVERSITARIO LIC. RAMIRO MORENO Universidad Nacional de Tucumán Facultad de Agronomía y Zootecnia Decano Ing. Agr. Alberto Bruno Andrada Vicedecano Ing. Susana Gianfrancisco Secretaria de Asuntos Académicos Ing. Adriana Pastoriza de Tarifa Secretaría de Posgrado Secretaria Dra. Susana H. Maidana Representante Titular en el Consejo del Departamento de Graduados de la Universidad Nacional de Tucumán Ing. Zoot. Mirta Blanco de Belascuaín Consejo Titular Ing. Zoot. Mirta Blanco de Belascuaín Arq. Raúl Ajmat Dr. Eduardo Elias Rosenzvaig Dra. Susana Alvarez Dr. Hugo Daniel Ferullo Dra. Bibiana Maria Luccioni Dra. Olga Lucrecia Nieto Dra. María del Pilar Amenábar Dra. María Isabel Danna de Calderó Dra. Nilda Flawia de Fernández Dr. Fernando Koch Dr. Jorge Olmos Farsi Psic. Estela Irene Rosig Secretaria Administrativa Sra. Magdalena Peña de Tuero TRABAJO DE POSTGRADO PARA LA OBTENCIÓN DEL GRADO ACADÉMICO SUPERIOR DE DOCTORA EN BIOLOGÍA CARRERA DE DOCTORADO EN CIENCIAS BIOLÓGICAS Acreditado y Categorizado A ante la Comisión Nacional de Acreditación Universitaria (CONEAU) Resolución nº: Nº 615/07 Director: Dr. Faustino Siñeriz Vice-Director: Dr. Eduardo Dominguez Comité Académico Dra. Dora Cristina Miceli Dra. Marta Buhler Dr. Atilio Castañaro Dra. Graciela Savoy Trabajo de Tesis para optar por el Título de Doctora en Ciencias Biológicas Estudio Morfo-Funcional de Espermatozoides de Camélidos Sudamericanos. Interacciones con el Oviducto Ing. Zootecnista Silvana Andrea Apichela Tesista Dra. Dora C. Miceli Directora de Tesis Este trabajo de Tesis Doctoral se realizó en: Departamento de Biología del Desarrollo Instituto Superior de Investigaciones Biológicas (INSIBIO) CONICET – UNT Instituto de Biología “Dr. Francisco Barbieri” Facultad de Bioquímica, Química y Farmacia Universidad Nacional de Tucumán. El apoyo financiero fue otorgado por el Consejo de Investigaciones de la Universidad Nacional de Tucumán (CIUNT), el Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET) y la Agencia de Promoción y Desarrollo de la Investigación. Comisión de Supervisión de Tesis Doctoral Dra. Maria Atilana Jiménez Díaz Ing. Zootecnista Oscar Wilde Dra. Dora Cristina Miceli A mis padres. A mi familia emocional. A mi lado seguidor de utopías. AGRADECIMIENTOS Quiero expresar mi más sincero agradecimiento a las siguientes personas, que estuvieron cerca de mí durante el tiempo que llevó desarrollar este trabajo de Tesis, enseñando, compartiendo y apoyando: ? A la Dra. Dora C. Miceli, mi directora de Tesis, por haberme recibido en su laboratorio, brindándome su apoyo, confianza y generosidad. Porque cada día a su lado es una oportunidad de aprender. Porque la contención y cariños recibidos quedan en mi para siempre. Porque no sólo es mi directora, ella representa el lugar donde quiero ir y, en muchos aspectos, la persona que quiero ser. ? A la Dra. María A. Jiménez Díaz, siempre a mi lado para enseñarme y acompañarme en las campañas a Abra Pampa, sin que la afecte el clima ni la distancia a recorrer. Por estar siempre dispuesta a brindarme su colaboración. Por sus oportunas y acertadas sugerencias. Porque después del tiempo compartido siento que puedo llamarla amiga. ? Al Ing. Zootecnista Oscar Wilde miembro de mi Comisión de Supervisión, por su constante apoyo, sus valiosas sugerencias. ? Al personal del INTA Abra Pampa, por la colaboración brindada con la donación del material biológico utilizado en este trabajo y por la amabilidad con la que siempre nos recibieron. Especialmente quiero agradecer a la Veterinaria Sandra Romero, porque su eficiencia y calidad humana hizo que nuestras visitas a Abra Pampa sean siempre agradables y provechosas. ? Al personal del Laboratorio de Microscopía Electrónica (LAMENOA), y en modo muy especial a la Dra. Beatriz Winik, por su inestimable colaboración en la interpretación de las imágenes observadas con el microscopio electrónico. Por su calidad humana y rectitud que admiro. ? A Jorge Valz Gianinet, amigo querido, por su generosidad, su humor que tanto me divierte. Por todo los momentos hermosos que compartimos dentro y fuera del laboratorio. Por la complicidad. Por apadrinarme en la vida. ? A Luisa Peralta, amiga, por haberme brindado tanto cariño. Por su sonrisa y apoyo, siempre necesarios. ? A Mariela Roldan-Olarte, amiga y compañera de laboratorio. Porque siempre me brindó con generosidad su experiencia en el laboratorio. Por su afecto, su conducta ejemplar y su calidez de siempre. Ejemplo de compañera. ? A Martín Argañaraz, amigo y compañero. Por estar siempre a mi lado, por escucharme, y por su humor genial. Por su enorme generosidad en el laboratorio y la vida misma. Por que se permitirtió cruzar las fronteras y salir a explorar conmigo. Por los momentos compartidos que hoy me hacen llamarlo amigo. ? A Daniel Barrera, por su estímulo, su confianza y su amistad, por su ayuda en el laboratorio y muchos momentos compartidos. ? A Andrea Longo, por compartir lo cotidiano, por estar siempre dispuesta a colaborar en todo, por su amistad. Por su preocupación por mi bienestar. El espejo en que me miro. ? A Cristina Estévez, por los momentos compartidos, pero sobre todo por su amistad y afecto. ? A Constanza López, Vanesa García, Daniela García, Julián Juárez y Renato Zampini. Por compartir lo cotidiano y el compañerismo de siempre. ? A Mariana Ferrero y Ricardo Llanos, por su compañerismo, su colaboración y su amistad. ? A María Teresa Ajmat, Graciela Sánchez Toranzo, Marcela Medina, Federico Bonilla, Sergio Pasteris, Lita Oterino, Hugo Genta, Marcela Bonano y Claudia Otero por su amistad y compañerismo, personas a las que aprecio de corazón. ? A Claudia Pucci, la “secre” del Instituto de Biología y amiga, por estar siempre dispuesta a ayudarme, por su sonrisa fresca que nos recibe día a día, por su gran corazón. ? A todo el personal docente y no docente del Instituto de Biología, por su amistad y compañerismo, por estar siempre atentos a mi trabajo y por la colaboración recibida durante el desarrollo de mi trabajo de Tesis. ? A la Vet. Susana Giuliano. Por recibirme con los brazos abiertos, por enseñarme con generosidad y por alentarme. Porque mientras estudiábamos los camélidos aprendimos de la vida misma. Porque en ella encontré una amiga. ? Al personal docente de la cátedra de Teriogenología de la Fac. de Ciencias Veterinarias de la UBA, en especial a los Dres. Alicia Agüero, Marcelo Miragaya y Graciela Chavez. ? Al Ing. Julio Cisneros. Por su paciencia y apoyo durante el desarrollo de esta Tesis. ? Al Dr. Máximo Valentinussi. Porque cuando mis fuerzas caen, pienso en su ejemplo de alegría, trabajo y amor a la vida. ? A Rossana Rulli, mi gran amiga y hermana del alma, por “saber estar”. Por su apoyo constante e incondicional. Por haber compartido tantos logros, alegrías y momentos muy especiales de nuestras vidas. Por escucharme, por sostenerme. Porque no alcanzan palabras para agradecer por nuestra amistad. ? A Alicia Castro, a veces madre y siempre amiga. Por quererme tanto, por cuidarme, por alentarme, por brindarme todo tan generosamente. Por tantos momentos compartidos. ? A Bruno Bustos y Marcelo Lizarraga, amigos queridos. Por su apoyo, por las palabras justas y el aliento de siempre. Porque el camino es más fácil si sé que están ahí. ? A Fernando Campos, amigo del alma y compañero en la distancia. Porque de su mano entré en el “mundo” de la investigación y seguí en él caminando sus pasos. Porque lo vivido en el pasado es y será un presente. ? A María Isabel Hernández, por haberme recibido con tanto cariño en su casa las veces que tuve que viajar a capacitarme a Buenos Aires. Por su generosidad y cuidados siempre. Porque es una tía elegida. ? A mis amigos: Adriana Castillo, Sonia Terán, Marcelo Ibáñez, Daniel Ponce de León, Carlos Ottonello, Analía Cadenas, Valeria Martínez Marconi, Hector Soria, Sol Cosiansi, Sebastián Barrionuevo. Por su amistad, paciencia y adaptación a mis tiempos durante estos últimos años. Porque nuestra amistad sigue. ? A la Escuela de Artes Orientales Pakua y a mis compañeros: Martín Rearte, Pedro Pacheco, Verónica Conejos, María Cheín, Sergio Cannizzo, Diego Tolosa, Jorge Vernal, Enzo Torasso, Nicolás Bauzá y Barbara Steimberg. A los Maestros Joaquín Nader y Juan Pablo Puig. Porque allí aprendo, encuentro sosiego y, sobre todo, amigos que me hacen creer y confiar en que podemos construir un mundo mejor. ? Al Maestro Roberto Lamarque, por su contención y su amor infinitos. Por darme un cable a tierra siempre que lo necesito. ? A Daniel Pero, por tener fe en mí. Por estar siempre dispuesto a escucharme y compartir. Porque lo elijo como Maestro y amigo. ? A Esteban Amador, hijo en el corazón. Porque su juventud me renueva y me concientiza de la responsabilidad de trabajar para dejar un lugar mejor a los que vienen atrás. ? A mis compañeras de voley: Ana, Alicia, Rossana, Fabiana, Gabriela, Erika, Lorena, Mónica y Marta; y a mis entrenadores: Gustavo y Ramiro. Porque todos los martes y jueves a la noche vuelvo a casa con una sonrisa. Por tantas victorias, derrotas y momentos compartidos. Porque, como siempre decimos, “hay equipo”. ? A mamá y papá, por brindarme su amor incondicional en todo momento. Por sus ejemplos, sus consejos, su estímulo constante, su apoyo y todo lo que me enseñan día a día. Porque me enorgullece ser su hija. ? A mi tía Estela Rusco, porque siempre estuvo atenta a mi trabajo. Por tanto amor y cuidados. Por sus consejos que me van a acompañar toda la vida. ? A mis hermanos Valeria y Ariel, porque siempre están para apoyarme. Por su fe en mí y su inagotable cariño. ? A CONICET y CIUNT, organismos que mediante el otorgamiento de becas me dieron la posibilidad concreta de dedicar todo mi esfuerzo a la realización de este trabajo de Tesis. ? Al Padre, porque en él deposito mi confianza y porque recibo su amor. De allí vengo y hacia allí voy. Los resultados obtenidos durante este trabajo de Tesis dieron lugar a las siguientes publicaciones y presentaciones a Congresos Científicos. PUBLICACIONES ? Apichela, Silvana; Jimenez-Diaz, Maria; Shuster Stephanie; Miceli, Dora C. (2006) "Vicuna Oviduct Mucosa: Ultrastructure and Lectin Afffinities". Small Ruminant Research. Vol. 66, November, p 164-168. Disponible en www.sciencedirect.com ? Apichela Silvana, Jiménez-Díaz María. A., Roldan-Olarte Eugenia., Valz-Gianinet Jorge, Miceli Dora. (2008) "In Vivo and In Vitro Sperm Interaction with Oviductal Epithelial Cells of Llama". Reproduction in Domestic Animals. Aceptado para su publicación PUBLICACIÓN DE TRABAJOS COMPLETOS EN LIBRO DE CONGRESOS INTERNACIONALES ? Apichela Silvana, Jimenez Díaz María., Miceli Dora. (2003) “Estudio Morfofuncional de Oviducto de Llama: Análisis Ultraestructural y Cultivo de Células Oviducales”. Memorias del III Congreso Mundial Sobre Camélidos T1:81-85. ? Apichela, Silvana, Jimenez Díaz María, Miceli Dora (2004) "Ultraestructura y Distribución de Glicoconjugados en Epitelio Oviducal de Vicuña". Memorias de las XII Jornadas de Jovens Pesquisadores da AUGM. Integraçao educacional, científica e tecnológica para a inclusao social no Mercosul. PUBLICACIÓN DE INTERNACIONALES RESÚMENES DE CONGRESOS EN REVISTAS ? Apichela S., Chaves G., Trasorra V., Carretero M., Pinto M., Rutter B., Jimenez Díaz M., Agüero A., Miceli D. (2007) “Bulbouretral Glands Secretions Involvement in Lama Oviduct Sperm Reservoir Formation”. Biocell. XXIII Jornadas Científicas de la asociación de Biología de Tucumán. ? Apichela S., Valz Gianinet J., Roldan-Olarte M., Jiménez Díaz M., Miceli D.C (2008) “The Function of the Utero Tubal Junction as Sperm Reservoir in Lama”. Biocell. En prensa. Reunión Conjunta de Sociedades de Biología de la República Argentina ? Apichela, S.; Jiménez-Díaz M.; Romero S. and Miceli, D. C.(2008) “Glycoconjugates Charaterization of Lama Oviduct by Lectinhistochemestry”. Biocell. En prensa. XXIV Jornadas Científicas de la asociación de Biología de Tucumán. COMUNICACIONES A CONGRESOS ? Apichela Silvana, Miceli D, Jiménez Díaz M. (2003) “El Oviducto de Llama. Análisis Estructural y Ultraestrutural”. IV Jornadas “Los Jóvenes y la Ciencia”. Centro Cultural E. F. Virla. UNT. 20 y 21 de Octubre de 2003. ? Apichela Silvana, Jiménez Díaz María, Rebuffi Gustavo, Miceli Dora. (2004). “Ultraestructura y Distribución de Glicoconjugados en Epitelio Oviducal de Vicuña” 4º Seminario Internacional de Camélidos Sudamericanos y 2º Seminario Internacional del Proyecto DECAMA. Auditorio Diego de Torres. Universidad Católica de Córdoba. Córdoba. Argentina. 20 al 22 de Mayo. ? Apichela, Silvana; Jiménez Díaz, M; Miceli, D. (2004) "Histomorfología de Ovario y Oviducto de Llama". 1ª Jornadas Nacionales de Cátedras de Histología”. San Miguel de Tucumán, 12, 13 y 14 de Agosto. ? Apichela Silvana, Jiménez Díaz María, Miceli Dora. (2005) "Ultraestructura del Epitelio Oviducal de Dos Especies de Camélidos Sudamericanos: Llama y Vicuña. Interacción con Espermatozoides". XXII Jornadas de la Asociación de Biología de Tucumán. Tafí del Valle, Octubre. ? Apichela Silvana, Jiménez Díaz María, Miceli Dora C. (2006) “Interacción Espermatozoide - Oviducto en Lama glama”. II Simposium Internacional de Investigaciones Sobre Camélidos Sudamericanos y Seminario Final del Proyecto DECAMA. Arequipa, Perú. 22 al 26 de Mayo. ? Apichela, Silvana; Jiménez Díaz María; Miceli, Dora C. (2006). "Reservorios Espermáticos en el Oviducto de Llama". IV Congreso Mundial Sobre Camélidos. Santa María, Catamarca. 11 al 15 de Octubre. ? Apichela, Silvana; Jiménez Díaz M.A.; Valz Gianinet, J., Roldán Olarte, M.E., Miceli, D. C. (2008). ”Llama Sperm Binding to Oviductal Epithelium Involves NAcetyl Galactosamine Recognition”. The International Congress on Animal Reproduction. Budapest, Hungría. 11 al 13 de Julio RESUMEN El conocimiento de los mecanismos reproductores en camélidos sudamericanos (CSA) es de interés por las características adaptativas de estos animales a zonas inhóspitas para el hombre, y su aporte de carne magra y fibra de alto valor económico. Los CSA son ovuladores inducidos por la cópula. Durante el apareamiento el macho eyacula un semen con consistencia de moco dentro de los cuernos uterinos. La deposición del semen se realiza alrededor de 36 horas antes de la ovulación. Esta Tesis enfoca su estudio en el oviducto de los CSA y su interacción con los espermatozoides. En los mamíferos el oviducto proporciona un ambiente óptimo para el mantenimiento de la capacidad fecundante de los espermatozoides hasta la fecundación. Esto es importante en animales de ovulación refleja, donde la inseminación precede a la ovulación por muchas horas. Nuestra primera hipótesis de trabajo fue que el oviducto de los CSA almacena espermatozoides hasta el momento de la ovulación. En este sentido se realizó un estudio anatómico, histológico, histoquímico y ultraestructural del oviducto de llama y vicuña. Se observaron diferencias entre el istmo y la unión útero tubal (UUT). Posteriormente se realizaron ensayos in vivo tendientes a determinar cuál es el segmento oviductal involucrado en el almacenamiento de los espermatozoides en llama. Observamos que la UUT forma un reservorio de espermatozoides donde éstos permanecen adheridos durante al menos 28 horas después de la cópula. La adhesión a la mucosa es firme ya que los espermatozoides permanecen unidos incluso después de haber perfundido el oviducto. 35 horas después de la cópula, cuando la ovulación es inminente, no se observan espermatozoides adheridos al oviducto, por lo que se propone una posible participación del oviducto en su liberación. Mediante ensayos in vitro se determinó que, por sus características de superficie, las células de la UUT adhieren mayor cantidad de espermatozoides por superficie que el Istmo. Estudios in vitro también nos permitieron demostrar que el sistema de reconocimiento de carbohidratos de la superficie oviductal - lectinas del espermatozoide, participa en el proceso de adhesión al epitelio de la UUT, siendo Galactosa y N-Acetil galactosamina los principales azúcares involucrados en esta interacción. La molécula que reconoce estos azúcares sería aportada al espermatozoide por el plasma seminal durante la eyaculación, ya que los espermatozoides epididimales no son capaces de unirse a estos azúcares. Considerando lo expuesto y las particulares características físicas (viscosidad) del semen de llama, se estudió la participación del plasma seminal, en especial las secreciones de las glándulas bulbouretrales, en la adhesión de los espermatozoides al oviducto. Ensayos in vivo confirmaron esta hipótesis. Se concluye que el oviducto de llama forma reservorios espermáticos en la UUT por adhesión de los espermatozoides a la mucosa. Contribuyen a este proceso el diseño anatómico de la UUT, las características de superficie de las células epiteliales, el reconocimiento de carbohidratos oviductales específicos por el espermatozoide y el plasma seminal. “Solo es útil el conocimiento que nos hace mejores”. Sócrates ÍNDICE SECCIÓN A ..............................................................................................................................1 INTRODUCCIÓN ...................................................................................................................1 SECCIÓN B ..............................................................................................................................6 REVISIÓN BIBLIOGRÁFICA..............................................................................................6 CAPÍTULO I. EL OVIDUCTO DE LOS MAMÍFEROS.....................................................7 I. 1. CARACTERÍSTICAS ANATÓMICAS E HISTOLÓGICAS DEL OVIDUCTO ...............................................7 I.2. EL FLUIDO OVIDUCTAL.............................................................................................................................................9 I.3. FUNCIONES DEL OVIDUCTO..................................................................................................................................12 I.3.1. Transporte, orientación y mantenimiento de gametos......................................................................................12 I.3.2. Capacitación de los espermatozoides ..................................................................................................................13 I.3.3. Fecundación.............................................................................................................................................................13 I.3.4. Desarrollo embrionario ............................................................................................................................................13 CAPÍTULO II. INTERACCIÓN FUNCIONAL ENTRE LOS ESPERMATOZOIDES Y EL OVIDUCTO..................................................................................................................... 15 II.1. MECANISMOS DE ALMACENAMIENTO DE LOS ESPERMATOZOIDES EN EL OVIDUCTO ....................................................................................................................................................................................................16 II.1.1. Estructura anatómica.............................................................................................................................................16 II.1.2. Moco oviductal......................................................................................................................................................16 II.1.3. Adhesión de espermatozoides a la mucosa.......................................................................................................16 II.2. FUNCIONES DEL RESERVORIO ESPERMÁTICO ...........................................................................................18 II.2.1. Reducción de la polispermia ................................................................................................................................18 II.2.2. Mantenimiento de la viabilidad y motilidad espermática..............................................................................19 II.2.3. Modulación de la capacitación............................................................................................................................19 II.3. LIBERACIÓN DE LOS ESPERMATOZOIDES DEL RESERVORIO ESPERMÁTICO OVIDUCTAL..20 CAPÍTULO III. CARACTERISTICAS REPRODUCTIVAS DE LOS CAMÉLIDOS SUDAMERICANOS (CSA)................................................................................................. 22 III.1. CARACTERÍSTICAS REPRODUCTIVAS DE LA HEMBRA .........................................................................22 III.1.1. Anatomía de los órganos reproductores...........................................................................................................22 Ovarios...........................................................................................................................................................................22 Oviductos.......................................................................................................................................................................22 Útero...............................................................................................................................................................................22 III.1.2. Fisiología reproductiva........................................................................................................................................23 Crecimiento y regresión de los folículos ováricos.................................................................................................23 Inducción de la Ovulación..........................................................................................................................................25 Actividad luteal.............................................................................................................................................................26 III.2. CARACTERÍSTICAS REPRODUCTIVAS DEL MACHO................................................................................28 III.2.1. Anatomía de los órganos reproductores...........................................................................................................28 Testículos.......................................................................................................................................................................28 Epidídimos.....................................................................................................................................................................29 Conductos deferentes...................................................................................................................................................30 Pene................................................................................................................................................................................30 Glándulas accesorias..................................................................................................................................................30 III.2.2. Fisiología reproductiva........................................................................................................................................30 III.2.3. Semen.....................................................................................................................................................................31 Recolección del semen.................................................................................................................................................31 Características seminales...........................................................................................................................................32 Características de los espermatozoides...................................................................................................................34 III.3. COMPORTAMIENTO REPRODUCTIVO ............................................................................................................34 SECCIÓN C ........................................................................................................................... 37 MATERIALES Y MÉTODOS ............................................................................................. 37 Capítulo IV - MATERIAL BIOLÓGICO .................................................................................................................... 38 1. Animales .........................................................................................................................................................................38 1.1. Animales bulboretrectomizados.........................................................................................................................38 2. Oviductos........................................................................................................................................................................38 2.1 Obtención de oviductos a partir de animales faenados...................................................................................38 2.2. Obtención de Oviductos a partir de animales vivos mediante cirugía ........................................................39 2.3. Clasificación de oviductos..................................................................................................................................39 3. Espermatozoides............................................................................................................................................................40 3.1. Obtención de semen.............................................................................................................................................40 3.2. Evaluación del semen ..........................................................................................................................................40 3.3. Aislamiento de espermatozoides .......................................................................................................................41 3.4. Obtención de espermatozoides epididimales ...................................................................................................41 4. Cultivo de células oviductales ....................................................................................................................................41 4.1. Cultivo en monocapa...........................................................................................................................................41 4.2. Cultivo en explanto..............................................................................................................................................42 Capítulo V - MÉTODOS ................................................................................................................................................... 43 1. Histológicos ...................................................................................................................................................................43 1.1. Histología del Oviducto de Llama .....................................................................................................................43 1.2. Coloración con Hematoxilina – Eosina............................................................................................................43 1.3. Coloración con Tricrómico de Masson – Goldner..........................................................................................44 2. Histoquímicos................................................................................................................................................................44 2.1. Detección de Mucopolisacáridos PAS/AB......................................................................................................44 2.2. Detección de residuos glicosilados mediante Lectinhistoquímica...............................................................45 2.3. Detección de mo léculas de reconocimiento de N-Acetil galactosamina-FITC en espermatozoides....46 3. Inmunocitoquímicos para detección de citoqueratina.............................................................................................47 4. Microscopía electrónica de barrido............................................................................................................................48 5. Microscopía electrónica de transmisión....................................................................................................................48 6. Experimentos in vivo para estudiar la interacción espermatozoides - oviducto de llama. ...............................49 6.1. Ensayo in vivo con oviductos obtenidos a diferentes tiempos después de la cópula con machos normales.........................................................................................................................................................................49 6.2. Ensayo in vivo con oviductos obtenidos 24 horas después de la copula con machos bulboretrectomizado ....................................................................................................................................................49 7. Experimentos in vitro para estudiar la interacción espermatozoides-oviducto ..................................................49 7.1. Ensayo de interacción espermatozoides – explantos de células oviductales de Unión Útero Tubal e Istmo ...............................................................................................................................................................................49 7.2. Ensayos de inhibición competitiva de la interacción espermatozoides – células oviductales con azucares monosacáridos..............................................................................................................................................50 7.3. Definición del Índice de Unión (IU).................................................................................................................51 7.4. Análisis estadísticos.............................................................................................................................................51 SECCIÓN D........................................................................................................................... 53 RESULTADOS ..................................................................................................................... 53 Capítulo VI - CARACTERIZACION DEL OVIDUCTO DE LLAMA Y VICUÑA........................................ 54 VI.1. ANATOMÍA DEL OVIDUCTO DE LLAMA Y VICUÑA ...........................................................................54 VI.2. HISTOLOGÍA DEL OVIDUCTO DE LLAMA Y VICUÑA ........................................................................55 VI.3. ULTRAESTRUCTURA DEL OVIDUCTO DE LLAMA Y VICUÑA .......................................................57 VI.3.1. Ultraestructura del oviducto de llama y vicuña.........................................................................................57 VI.4. CARACTERIZACIÓN DE MUCOPOLISACÁRIDOS DE LA MUCOSA OVIDUCTAL MEDIANTE HISTOQUÍMICA ................................................................................................................................63 VI.5. CARACTERIZACIÓN DE LOS RESIDUOS AZUCARADOS DE LA MUCOSA OVIDUCTAL MEDIANTE LECTIN - HISTOQUÍMICA ..................................................................................................................65 VI.6. CARACTERIZACIÓN DE LOS RESIDUOS AZUCARADOS DE CÉLULAS EPITELIALES CULTIVADAS EN MONOCAPA DE MEDIANTE LECTIN – HISTOQUÍMICA ...........................................71 CONCLUSIONES PARCIALES ...................................................................................................................................74 CONCLUSIONES PARCIALES ...................................................................................................................................75 Capítulo VII - ESTUDIOS IN VIVO PARA LOCALIZAR EL ALMACENAMIENTO DE ESPERMATOZOIDES EN EL OVIDUCTO DE LLAMA.................................................................................... 76 CONCLUSIONES PARCIALES ...................................................................................................................................82 Capítulo VIII - ESTUDIOS IN VITRO PARA DETERMINAR LA CAPACIDAD DE LAS CÉLULAS OVIDUCTALES PARA ADHERIR ESPERMATOZOIDES ................................................................................ 83 CONCLUSIONES PARCIALES ...................................................................................................................................86 Capítulo IX - ESTUDIOS DE LA INTERACCIÓN ESPERMATOZOIDES -OVIDUCTO MEDIADA POR CARBOHIDRATOS ................................................................................................................................................ 87 IX.1. Inhibición competitiva por monosacáridos de la unión de los espermatozoides al oviducto....................87 IX.2. Sitios de unión para N-Acetil galactosamina en espermatozoides de llama ................................................90 CONCLUSIONES PARCIALES ...................................................................................................................................93 Capítulo X - PARTICIPACION DEL SEMEN EN LA FORMACIÓN DE RESERVORIOS ESPERMÁTICOS ............................................................................................................................................................... 94 CONCLUSIONES PARCIALES ...................................................................................................................................96 DISCUSIÓN .......................................................................................................................... 97 SECCIÓN G.........................................................................................................................108 REFERENCIAS ..................................................................................................................108 SECCIÓN A INTRODUCCIÓN Introducción El género Lama comprende dos especies de camélidos domésticos: Lama pacos o alpaca y Lama glama o llama y dos especies silvestres: Lama vicugna o vicuña y Lama guanicoe o guanaco. Los camélidos sudamericanos (CSA) habitan las formaciones ecológicas situadas en la Puna y los Altos Andes que se localizan desde el norte del Perú hasta el sur de Argentina, incluyendo las áreas alto - andinas de Bolivia y Chile. Esta región se caracteriza por poseer una vegetación árida y semiárida, con índices pluviales que no superan los 350 mm/año, lo que produce una marcada insuficiencia hídrica. El clima es frío, caracterizado por una amplitud térmica cercana a los 30º C, con más de 200 días de heladas por año. Los suelos son arenosos, pobres en materia orgánica y con altos niveles de salinidad. En esta inhóspita región alto-andina, de escasas o nulas posibilidades de diversificación productiva, se asientan los sistemas ganaderos de crianza de camélidos. Estas especies representan los únicos animales capaces de transformar los pastos naturales que crecen en las alturas puneñas en productos de primera necesidad como la carne y la fibra, ambas de excelente calidad. Las particulares características de los camélidos en cuanto a rusticidad, forma de pastoreo, utilización de forrajes con alto contenido en fibra, los convirtieron en una alternativa económica muy importante que permite incorporar sectores marginados en donde no es posible otro tipo de explotación pecuaria. Siendo los CSA un recurso natural renovable de importancia y significación desde el punto de vista social, económico, ecológico y estratégico para el noroeste argentino, la aplicación de criterios técnicos precisos se hacen necesarios a fin de mejorar su reproducción y la calidad de su carne y su fibra. Debido a la creciente demanda de llamas y alpacas, el estudio de su fisiología reproductiva se ha incrementado intensamente durante los últimos 10 años. Aunque se conocen pocos detalles sobre ella, está bien establecido que tanto la anatomía del sistema reproductor como las estrategias reproductivas son únicas (Brown, 2000). La fisiología reproductiva del macho es considerada única por varias razones: la duración del coito (promedio 20 min), la forma de eyaculación (en varias dosis pequeñas, consecutivas), el sitio de deposición del semen (en ambos cuernos uterinos) y el comportamiento durante la cópula (Bravo, 2002a). Es importante recalcar que debido a que en un rodeo convencional el macho da servicio a numerosas hembras, su influencia en la calidad del mismo es relevante. Las hembras son ovuladoras inducidas pudiendo estar receptivas en cualquier momento de la fase folicular del ciclo ovárico (Chaves y col., 2002); en caso de no copular su receptividad 2 Introducción sexual puede durar hasta 40 días, por lo que se considera que pueden reproducirse en cualquier época del año (Revisado por Brown, 2000). Quizás por la particularidades de la fisiología reproductora de los camélidos sudamericanos, por la dificultad de mantener rodeos en los sitios donde se realizan investigaciones en biotecnología de la reproducción, por la lejanía de los habitats naturales y porque sólo recientemente han comenzado a requerirse carnes y fibras exóticas en el mercado, es que no hubo un desarrollo de biotecnologías aplicadas a estos animales. Su desarrollo no sólo permitiría aumentar la eficiencia reproductiva de los animales sino también lograr la mejora genética de los rodeos en menor tiempo. La aplicación de biotecnologías tales como la inseminación artificial y la transferencia de embriones en los CSA eficientizaría el uso de los reproductores genéticamente superiores. Sin embargo, es claro que los protocolos de criopreservación, inseminación artificial y transferencia de embriones que son exitosos en otros ganados o en humanos, no pueden aplicarse en los CSA. Esto plantea la necesidad del diseño de protocolos específicos, basados en el conocimiento claro de la fisiología reproductiva de los animales, la que es muy poco conocida hasta el momento. Con respecto a la inseminación artificial, se han realizado importantes aportes relacionados a la recolección y evaluación del semen (revisado por Miragaya y col., 2006). El desarrollo de técnicas de recolección del semen por vagina artificial junto con la adecuación de técnicas para disminuir la alta viscosidad característica de estos animales significó un gran avance biotecnológico (Bravo, 2000a; Giuliano y col., 2007a). Existe poca información de inseminación artificial de hembras con semen fresco o diluido, y en los casos reportados las tasas de preñez son variables y bajas comparadas con otras especies (Bravo y col., 1997a; Aller y col., 2003). La aplicación de ésta y otras biotecnologías se ve muy limitada por el escaso conocimiento sobre manejo y criopreservación del semen (Vaughan y col., 2003a; Giuliano y col., 2007a) como así también por el limitado conocimiento y manejo de la fisiología reproductiva de la hembra. En este sentido se han realizado avances significativos en el control de la onda folicular mediante el uso de hormonas exógenas (Miragaya y col., 2006). Algunos autores consideran que los resultados de la aplicación de biotecnologías reproductivas dependen de dos fuentes de variabilidad: a) la fisiología y bioquímica de los espermatozoides y b) el transporte de los espermatozoides en el tracto genital femenino (Holt, 2000). En ésta última variable, está fuertemente involucrado el oviducto en todos los 3 Introducción mamíferos estudiados hasta el momento, ya que dicho órgano regula la movilidad, viabilidad y capacidad fecundante de los espermatozoides (Yanagimachi, 1994). Además, en este segmento del tracto reproductor ocurren eventos fundamentales para el éxito de la reproducción tales como la capacitación de los espermatozoides, fertilización y desarrollo embrionario temprano. Existen antecedentes que indican que en los mamíferos el oviducto actuaría como reservorio funcional de espermatozoides (Wilmut y Hunter, 1984). Estos reservorios espermáticos asegurarían que un gran número de espermatozoides se mantengan fértiles hasta el momento de la ovulación. En los porcinos, ovinos y bovinos la unión útero tubal y el istmo caudal serían los sitios de depósito de los espermatozoides (Hunter, 1981 y 1984; Hunter y Nichol, 1983). Algunas evidencias indirectas sugieren que la adhesión de los espermatozoides a las células oviductales in vivo sería un requisito para lograr una fecundación exitosa. Otras indican que los espermatozoides liberados del reservorio son los más aptos para fecundar al ovocito. En realidad, aunque en las especies mencionadas anteriormente se ha comprobado que los espermatozoides se unen al epitelio oviductal (Smith y Yanagimachi, 1991; Suarez y col., 1991), todavía no se conoce el mecanismo por el cual los espermatozoides prolongan su tiempo de vida fértil. En este sentido, se ha demostrado que tanto las secreciones oviductales (Abe y col., 1995) como el medio condicionado obtenido cuando se cultivan cultivo de células oviductales o algunas glicoproteínas oviductales específicas (Abe y col., 1995; Lefebvre y col., 1995) prolongan la vida media del gameto masculino. Estudios con fracciones de membranas plasmáticas de células oviductales proveen datos interesantes en relación a los cambios de motilidad y vitalidad de los espermatozoides al contacto con las mismas (Murray y Smith, 1997). En el caso particular de los CSA, se desconoce si existe algún tipo de interacción entre los espermatozoides y el epitelio oviductal. Debido a que en llamas la ovulación ocurre entre las 26 y las 42 horas después de la cópula (Adams y col., 1991), el establecimiento y mantenimiento de reservorios espermáticos en el oviducto parece imprescindible para mantener la fertilidad de los espermatozoides hasta el momento de la fecundación. Sin duda un mejor conocimiento de la estructura y fisiología del oviducto, como así también de los mecanismos de interacción espermatozoide-oviducto contribuirá al desarrollo de biotecnologías reproductivas específicas para camélidos. En caso de que el oviducto de los CSA ejerza una acción positiva sobre la viabilidad espermática, la inclusión de extractos 4 Introducción celulares o fluido oviductal permitiría mejorar los medios de criopreservación de espermatozoides. El uso de componentes oviductales en medios de inseminación in vitro o en medios de cultivo embrionario podría conducir a incrementar las tasas de fecundación y desarrollo in vitro. Finalmente, el mayor conocimiento de la fisiología del transporte espermático en el oviducto genera bases lógicas para la elección del momento de inseminación artificial en los CSA. Por todo ello, los objetivos de este trabajo experimental han sido los siguientes: ? Conocer si las diferentes regiones del oviducto de llama y de vicuña presentan características estructurales o químicas diferenciales. ? Desarrollar un sistema biológico para el estudio in vitro de la interacción oviducto- espermatozoide mediante la obtención de un cultivo primario en monocapa de células epiteliales oviducales. ? Localizar los reservorios espermáticos en el oviducto de llama. ? Conocer si existe interacción entre las células del oviducto de llama y los espermatozoides homólogos. ? Determinar los factores involucrados en la formación de reservorios espermáticos del oviducto de llama. 5 SECCIÓN B REVISIÓN BIBLIOGRÁFICA Revisión Bibliográfica Capítulo I. EL OVIDUCTO DE LOS MAMÍFEROS I. 1. CARACTERÍSTICAS ANATÓMICAS E HISTOLÓGICAS DEL OVIDUCTO En los mamíferos domésticos los oviductos son órganos pares del tracto reproductor femenino en los que se llevan a cabo funciones esenciales para la reproducción. El oviducto dejó de ser considerado un simple conducto por el cual circulan los gametos. Actualmente se conoce que posee una participación activa en el transporte y maduración de los gametos, la fecundación y en las primeras etapas del desarrollo embrionario. Este órgano presenta la forma de un tubo, está suspendido en el mesosalpinx, el largo y el diámetro varían con la especie y la edad del animal. Se extiende desde la región ovárica hasta el útero y comunica el abdomen con la cavidad uterina. En él se diferencian tres regiones: infundíbulo, ampolla o ámpula e istmo, con características histológicas propias, acordes con la función que realizan (Figuras I.1 y I.2). Figura I.1: Esquema representativo del oviducto. Se detallan las tres regiones que lo conforman y se localiza la unión útero tubal (UUT) (Imagen obtenida de la página de Internet: http://www.acontece.com.ar/modulo1.htm). 7 Revisión Bibliográfica Figura I.2.: Esquema del oviducto, en el cual se muestra la disposición de los diferentes tejidos que lo conforman, en cortes transversales realizados a la altura del ámpula y del istmo. También se muestra un esquema a mayor aumento del epitelio oviductal (Senger, 2003). 8 Revisión Bibliográfica Cuando se separan los mesenterios, se puede apreciar en el oviducto las tres regiones mencionadas. El infundíbulo presenta una forma cónica o de embudo. Se continúa con el ámpula y luego con el istmo. Esta última zona es la más estrecha del oviducto. Desde el punto de vista estructural se pueden distinguir cuatro capas concéntricas diferentes en la pared del oviducto. La capa más interna es la capa mucosa, caracterizada por la presencia de pliegues longitudinales que se proyectan hacia el lumen. Rodeando esta capa se encuentra la túnica muscular o miosálpinx, formada por una capa circular interna y otra longitudinal más externa. Esta capa muscular se hace más gruesa a medida que se aproxima a la unión útero tubal. La disposición y el grosor de la capa muscular varían dependiendo de la especie animal y de la porción del oviducto que se observe. En la unión útero tubal el miosálpinx adquiere especial desarrollo funcionando a modo de válvula. Por último, la capa más externa es la serosa. Los oviductos son estructuras muy vascularizadas, característica que se hace mas ostensible cuando la hembra se encuentra en la fase folicular del ciclo estral. La irrigación es derivada de las arterias ovárica y uterina. El notable incremento de vascularización está dominado por los estrógenos y está particularmente asociado a la función secretora del epitelio del oviducto. El oviducto posee una inervación vegetativa, tanto simpática como parasimpático. Las ramas parasimpáticas del nervio sacro constituyen el nervio pélvico o pelviano. Este nervio presenta fibras simpáticas que provienen de la cadena ganglionar simpática (plexo mesentérico caudal). Las terminaciones adrenérgicas son prominentes a la altura del istmo y de la unión ámpula-istmo. Esta inervación tiene gran importancia en la regulación del transporte de los ovocitos y óvulos fecundados. I.2. EL FLUIDO OVIDUCTAL El medio biológico donde se llevan a cabo los procesos mencionados dentro del lumen del oviducto es el fluido oviductal. Los análisis químicos indican que el fluido oviductal es una compleja mezcla de constituyentes derivados del plasma sanguíneo, a través de una trasudación selectiva, y de proteínas oviductales específicas (Leese, 1988, Buhi y col., 2000), aunque no deben olvidarse otras fuentes como el contenido de los folículos de De Graaf, liberado en la ovulación, el fluido peritoneal en especies carentes de bolsa ovárica y el fluido uterino debido a un movimiento de reflujo del líquido a través de la unión uterotubárica (Hunter, 1988). El fluido oviductal varía su composición según el estadio del ciclo estral y está controlado por las hormonas esteroideas ováricas. Esto determina que la composición bioquímica del fluido oviductal durante las distintas fases del ciclo sexual y los 9 Revisión Bibliográfica estadios embrionarios previos a la implantación, presente diferencias cíclicas de acuerdo a un espectro de patrones tiempo-específicos (Cox y Leese, 1997). El volumen del fluido oviductal es mayor en el momento en el que los gametos o los embriones están presentes en los oviductos (Hunter, 1988). En porcinos la secreción aumenta 1 ó 2 días antes del estro, es máxima durante un periodo de 24 h después de iniciado el estro y luego desciende (Wiseman y col., 1992). El análisis de los componentes de las secreciones del oviducto de distintas especies de mamíferos indica que el fluido oviductal es bioquímicamente complejo. Dentro de los componentes del fluido oviductal, podemos encontrar electrolitos (iones) y compuestos orgánicos (compuestos energéticos, hormonas, aminoácidos, proteínas y enzimas). Los electrolitos son los principales responsables de mantener la osmolaridad y pH del fluido oviductal, pero algunos aniones y cationes podrían tener funciones específicas. Por ejemplo, ha sido comentado con frecuencia que durante los primeros días de la implantación embrionaria existe un medio ambiente con altos niveles de K+ y bicarbonato (Leese, 1988). El pH del fluido oviductal se ha registrado en una amplia variedad de modelos animales y los valores son del mismo orden dentro de un rango ligeramente alcalino. Por ejemplo en las cerdas el pH del fluido oviductal oscila entre 7,9 y 8,1 durante el estro, justo antes de la ovulación (Hunter, 1988). Por otro lado se conoce que los sustratos energéticos que se encuentran con mayor frecuencia en el oviducto de animales de experimentación son piruvato, lactato, glucosa y glucógeno. Se piensa que estos componentes están involucrados en el soporte metabólico de los gametos y/o embriones en los estadios previos a la implantación. Al igual que el resto de los componentes no electrolitos, los sustratos energéticos varían en su concentración en las distintas fases del ciclo estral. Los aminoácidos (AAs) son esenciales para el desarrollo y crecimiento del embrión, dado que son precursores de proteínas, moduladores de pH, actúan como moléculas señal y quelan metales pesados. Es interesante considerar que la concentración de aminoácidos no varía demasiado: por ejemplo la concentración en el momento del tránsito del embrión en dirección al útero no es diferente a la del momento de la ovulación. Algunos AAs del oviducto de bovinos tienen concentraciones mayores a las del plasma sanguíneo; debido a que son el producto de la actividad secretoria de las propias células del oviducto 10 Revisión Bibliográfica (Hugentobler y col., 2007). Los 3 AAs que se encuentran en mayor concentración en el mucus oviductal durante la ovulación, son la glicina, la alanina y el ácido glutámico, los cuales están relacionados con la modulación del pH y la protección contra el estrés osmótico. La glicina, la alanina y el piruvato son además una fuente de energía para los espermatozoides (Hugentobler, 2008). En cuanto a las hormonas presentes en el fluido oviductal, se han detectado hormonas esteroideas y prostaglandinas, y hay evidencias de la existencia de prolactina, gonadotrofinas y varios péptidos hormonales los que varían su concentración dependiendo del ciclo estral. La fuente de hormonas esteroideas (y otras) en el fluido oviductal está aún en discusión. Aunque es probable que estas moléculas deriven principalmente del plasma sanguíneo, las contribuciones del fluido peritoneal, fluido folicular ovárico, células de la granulosa y de los propios embriones no pueden ser descartadas (Hunter, 1988). En cuanto a su función en el medio oviductal, ha sido ampliamente documentado que los esteroides influyen directamente sobre los espermatozoides y embriones, al menos durante el cultivo in vitro. Las proteínas son los constituyentes principales del fluido oviductal. Éstas han sido analizadas básicamente mediante electroforesis observándose que la mayoría de los constituyentes proteicos del fluido oviductal son consecuencia de un pasaje desde el plasma sanguíneo. La concentración de las proteínas plasmáticas en el fluido oviductal es usualmente baja si se compara con la de la sangre (sólo el 5-10% de la encontrada en suero). La máxima concentración de estas proteínas se alcanza en el momento de la ovulación y consisten predominantemente en albúmina, ß y ? globulinas y lipoproteínas de alta densidad (HDL) (Harper, 1988). Otras proteínas presentes son: factor C3b del complemento, cadena pesada A de inmunoglobulina, preprocolágeno, haptoglobina, osteopontina y clusterina (Gabler y col., 2003). Se encontraron también factores de crecimiento (Viuff y col., 1995), de los cuales podemos mencionar al factor de crecimiento epidermal (EGF) (Adachi y col., 1995; Strandell y col., 2004), factores de crecimiento tipo insulina 1 y 2 (IGF-1 y 2) (Gabler y col., 1998, Pushpakumara y col., 2002) y factor de crecimiento transformante alfa (TGF-? ) (Chegini y col., 1994, Strandell y col., 2004). Algunos de ellos son sintetizados y posiblemente secretados al fluido oviductal como el factor de crecimiento de fibroblastos tipo 1 y 2 (FGF-1 y 2) (Gabler y col., 1997, 1998) y el factor asociado al sangrado endometrial (Ebaf) (Valdecantos y col., 2004, Argañaraz y col., 2007). También se han identificado algunas glicoproteínas sintetizadas y secretadas específicamente por el oviducto, sin embargo 11 Revisión Bibliográfica se desconoce su función (Buhi y col., 1997). Actualmente existe un gran interés en conocer cual es su rol en los procesos que ocurren dentro del oviducto como así también la regulación de los genes correspondientes. I.3. FUNCIONES DEL OVIDUCTO El oviducto de los mamíferos cumple diversas funciones, proveyendo un medio ambiente adecuado para el transporte de los gametos, la fecundación y el desarrollo embrionario temprano hasta el momento en que el embrión ingresa en el útero progestacionalmente receptivo. I.3.1. Transporte, orientación y mantenimiento de gametos En los mamíferos, después del apareamiento, los espermatozoides depositados en el útero son transportados hacia el oviducto; allí son almacenados en la región del istmo bajo condiciones que mantienen la viabilidad de los mismos (Hunter, 1988). En hámster, los espermatozoides mantienen una relación dinámica con este órgano ya que interactúan con las células del epitelio de revestimiento manteniéndose adheridos a ellas durante varios días; en el momento de la ovulación, los espermatozoides son liberados del epitelio oviductal y se dirigen al sitio de fertilización (Smith y Yanagimachi., 1990). Hasta el momento se desconoce si el oviducto, el ovocito o ambos coordinan este proceso. Una vez producida la ovulación, el ovocito es captado por las fimbrias y transportado por la actividad ciliar de las células epiteliales del oviducto hacia el ámpula, en donde ocurrirá el encuentro de los gametos. En los últimos tiempos ha surgido la posibilidad que para incrementar las probabilidades de encuentro entre gametos en el lugar y el momento adecuado, el espermatozoide deba ser guiado en el oviducto. La forma más conocida es la atracción por quimiotaxis, el movimiento direccional orientado a través de señales químicas, cuya acción está restringida a una corta distancia del ovocito (Eisenbach, 1999, Fabro y col., 2002). Ésta tendría lugar en 2 etapas: la primera a través del efecto de atracción de las células del cúmulo y después por efecto del ovocito (Sun y col., 2005). Otro nuevo sistema de orientación propuesto es la termotaxis; las diferencias de temperatura entre el istmo y el ámpula orientarían a los espermatozoides hacia el sitio de fecundación (Bahat y col., 2005). 12 Revisión Bibliográfica Se ha propuesto que los espermatozoides distantes del lugar de la ovulación migran, orientados por la termotaxis y asistidos por las contracciones peristálticas del istmo, en dirección al ámpula. Luego, cuando las células espermáticas están próximas al ovocito, la orientación se produciría por quimiotaxis. I.3.2. Capacitación de los espermatozoides Durante la capacitación del espermatozoide se producen modificaciones en su membrana plasmática, necesarias para que tenga lugar la reacción acrosómica (Gadella y col., 1995). Esta capacitación ocurre in vivo en el tracto reproductor femenino, adquiriendo allí la capacidad de fecundar al ovocito. I.3.3. Fecundación La fecundación es el proceso mediante el cual los gametos se fusionan para formar un nuevo individuo, que tendrá la carga genética de ambos progenitores. En los mamíferos, la fecundación tiene lugar en la región anterior del oviducto llamada ámpula (Yanagimachi, 1994). Para que ocurra la fecundación, el espermatozoide debe atravesar la matriz extracelular del ovocito, denominada zona pelúcida (ZP). La ZP de diferentes especies de mamíferos está constituida por tres glicoproteínas principales denominadas ZP1, ZP2 y ZP3 (McLeskey y col., 1998). Cuando los espermatozoides capacitados se adhieren a la ZP, rompen el acrosoma y liberan su contenido constituido fundamentalmente por enzimas hidrolíticas que digieren el camino a través de la ZP. Durante este proceso, el espermatozoide expone receptores presentes en la membrana acrosomal interna que reconocen a ZP2, que actúa como un receptor secundario (Bleil y col., 1988; Mortillo y Wassarman; 1991) La unión de los gametos concluye con la fusión de la membrana acrosomal interna con la membrana plasmática del ovocito, lo que permite la entrada del núcleo espermático, que en el citoplasma ovocitario, se transformará en el pro núcleo masculino (n). Posteriormente éste se unirá al pro núcleo femenino (n) y se formará el cigoto (2n). A todo el proceso se denomina fecundación y ocurre en la primera porción del oviducto o ámpula. I.3.4. Desarrollo embrionario Una vez formado, el cigoto inicia una etapa de sucesivas divisiones mitóticas comenzando el proceso de diferenciación celular. Estas primeras etapas del desarrollo transcurren en el oviducto hasta que en el estadio de blastocisto llega al útero donde ocurrirá la implantación. Durante este periodo de preimplantación, el oviducto provee de un medio 13 Revisión Bibliográfica ambiente bioquímico esencial y óptimo para el desarrollo apropiado del embrión (ConwayMyers, 1998). El conocimiento de condiciones físico-químicas únicas de este órgano (temperatura, pH, presión osmótica, nutrientes), permitió el desarrollo de las técnicas de fecundación in vitro (Leese, 1988; Gandolfi, 1995). 14 Revisión Bibliográfica Capítulo II. INTERACCIÓN FUNCIONAL ENTRE LOS ESPERMATOZOIDES Y EL OVIDUCTO El pasaje de los espermatozoides a través del tracto reproductor femenino está finamente regulado a fin de maximizar la oportunidad de fecundación y asegurar que sólo los espermatozoides con morfología normal y motilidad vigorosa sean capaces de fertilizar al ovocito. El ovocito es usualmente fertilizado horas después de la ovulación. Sin embargo, en algunas especies como la equina, bovina, porcina y camélida los espermatozoides pueden ser depositados en el tracto genital uno o varios días antes de la llegada del ovocito al sitio de fertilización (revisado por Scott, 2000). Mientras tanto los espermatozoides deben sobrevivir y mantener sus capacidades intactas (Yanagimachi, 1994) (Figura II.1). Figura II.1.: Secuencia de los procesos que sufre el espermatozoide en el oviducto de la hembra: 1) Ingreso y constitución del reservorio espermático 2) Capacitación, 3) Hiperactivación, 4) Reconocimiento entre gametos, 5) Reacción acrosomal, 6) Adhesión y 7) Fusión. (Olivera y col., 2006). 15 Revisión Bibliográfica II.1. MECANISMOS DE ALMACENAMIENTO DE LOS ESPERMATOZOIDES EN EL OVIDUCTO II.1.1. Estructura anatómica A medida que los espermatozoides entran al oviducto, éstos son atrapados y mantenidos en un reservorio espermático. Se han propuesto varios mecanismos por los cuales los espermatozoides permanecen almacenados en el oviducto. La unión útero tubal (UUT) representa una barrera anatómica que impide el pasaje de los espermatozoides en la mayoría de los mamíferos. El lumen del oviducto es particularmente angosto y tortuoso, la entrada al oviducto a través de esta barrera parece ser simple en humanos, mientras que es complicada por los pliegues de la mucosa en vacas, cerdas, conejas y otras especies (Hunter y col., 1975; Hunter y col., 1991a; Suarez y col., 1997). En la vaca, la arquitectura de los pliegues de la mucosa forma cul-de-sacs que parecerían estar diseñadas para atrapar a los espermatozoides y prevenir su ascenso por el oviducto (Yaniz y col., 2000). También en estos animales, las paredes de la UUT y el istmo caudal poseen una gruesa capa muscular que le permitiría disminuir la luz del lumen por tensión muscular (Wrobel y col., 1993, Suarez y Pacey, 2006). II.1.2. Moco oviductal Otro mecanismo propuesto para el almacenamiento de los espermatozoides en el oviducto caudal es la obstrucción del ascenso de los mismos por la presencia de un denso moco oviductal. Se ha encontrado presencia de mucus en la UUT de mujeres (Jansen, 1980), conejas (Jansen y Bajpai, 1982), cerdas (Suarez y col., 1990) y vacas (Suarez y col., 1997). En la yegua, experimentos realizados in vitro con co-cultivos de explantos de ámpula e istmo con espermatozoides, se obtuvieron resultados que sugieren que el istmo también funcionaría como un sitio de almacenamiento espermático (Thomas y col., 1994a). Análisis bioquímicos de las secreciones del istmo oviductales de cerdas y vacas muestran la presencia de polipéptidos que tienen la capacidad de unirse a los espermatozoides (Revisado por Killian, 2004). Se ha postulado que ello contribuye a evitar la polispermia debido a que permite la retención efectiva de gametos masculinos en esta región y evita un exceso de espermatozoides en el ámpula y unión istmo-ampular, que son los sitos de la fertilización. 16 Revisión Bibliográfica II.1.3. Adhesión de espermatozoides a la mucosa Con respecto al mecanismo de retención, se ha demostrado mediante microscopía electrónica de barrido que existe unión de espermatozoides con la mucosa de la UUT y el istmo caudal en vacas (Hunter y col., 1991b, Lefebvre y col., 1995) y cerdas (Mburu y col., 1997), y solamente con la UUT en yeguas (Scott, 2000). Estas observaciones permitieron plantear la hipótesis que existe un contacto directo espermatozoides – células del oviducto y que este es el mecanismo que lleva a la formación del reservorio espermático. Esta hipótesis está avalada por experimentos que demuestran que la adhesión del espermatozoide a las células epiteliales del oviducto es de naturaleza ligando receptor y por otros que demuestran que los espermatozoides permanecen adheridos aún después de un lavado enérgico (Smith y Yanagimachi, 1990, Suárez, 1998). Se conoce que en la adhesión de los espermatozoides al oviducto de vacas, yeguas, hámster y cerdas (De Mott y col., 1995; Lefebvre y col., 1995b y 1997; Green y col., 2001) está involucrado un sistema de reconocimiento entre carbohidratos del epitelio oviductal y lectinas de la membrana espermática (Töpfer-Petersen y col., 2002). Esta interacción parece realizarse de un modo especie-específico: en hámster es mediada por el ácido siálico (De Mott y col., 1995), mientras que en equinos es mediado por galactosa (Lefebvre y col., 1995b). En bovinos, los espermatozoides se unen a ligandos fucosilados del epitelio oviductal (Lefebvre y col., 1997) y en cerdos participan residuos de maltosa, lactosa y manosa (Green y col., 2001). Más aún, se ha encontrado que los sitios de unión a estas moléculas se encuentran sobre la región acrosomal de la cabeza del espermatozoide, región por la cual éste se une al oviducto (Marini y Cabada., 2003; Cortés y col., 2004). En espermatozoides de bovinos se han caracterizado un grupo de proteínas responsables de unir los espermatozoides al oviducto homólogo, identificadas como PDC-109, BSP-A3, y BSP30-kDa (Gwathmey y col., 2003; 2006), las cuales presentan dos dominios conservados de fibronectina tipo II. Estas son producidas por las vesículas seminales y cubren al espermatozoide cuando entra en contacto con estas secreciones (Nauc y Manjunath, 2000). Los espermatozoides epididimales del toro se unen en muy bajo número a explantos de epitelio oviductal, pero cuando se los preincuba con estas proteínas, su capacidad de adhesión es similar a la de los espermatozoides eyaculados (Gwathmey y col., 2006). 17 Revisión Bibliográfica II.2. FUNCIONES DEL RESERVORIO ESPERMÁTICO II.2.1. Reducción de la polispermia El sitio de deposición del semen define las barreras anatómicas que el espermatozoide encontrará durante su tránsito hacia el sitio de fecundación o ámpula oviductal. Estas barreras restringen el pasaje de los espermatozoides, estableciendo un gradiente en el número de éstos a lo largo del tracto reproductor (revisado por Hunter, 2005) (Figura II.2). En especies con deposición del semen a nivel del útero, la unión útero tubal es la barrera física primaria hacia los oviductos, y a partir de allí se establece un gradiente de espermatozoides que reduciría el riesgo de polispermia permitiendo que sólo unos pocos espermatozoides alcancen el ovocito en el lumen ampular. En cerdos, se ha observado un incremento de la polispermia cuando el reservorio de espermatozoides es salteado mediante de remoción quirúrgica del istmo caudal o cuando se administra progesterona en la capa muscular para inhibir la constricción del lumen (revisado por Hunter, 2005). Además se ha sugerido que glicoproteínas secretadas por las células epiteliales no ciliadas de la mucosa oviductal pueden unirse a la membrana del espermatozoide y reducir la incidencia de polispermia (Kouba y col., 2000). Figura II.2. : Distribución cuantitativa de los espermatozoides en el tracto genital de la coneja, después de la inseminación con 10 x 106 espermatozoides e inducción de la ovulación (Palma y Miceli, 2008) 18 Revisión Bibliográfica II.2.2. Mantenimiento de la viabilidad y motilidad espermática Quizás la función básica de un reservorio de espermatozoides sea la de asegurar el encuentro exitoso entre los gametos al mantener la viabilidad y la capacidad fertilizante del espermatozoide (Pollard y col., 1991). El contacto con el epitelio oviductal parece ser importante en el mantenimiento de la capacidad fertilizante durante el periodo de almacenamiento en el oviducto. Observaciones in situ realizadas en hámster luego de la inseminación, mostraron que los espermatozoides adheridos al epitelio del istmo caudal mantienen la actividad flagelar y sobreviven más tiempo que los espermatozoides que están libres en el lumen oviductal (Smith y Yanagimachi, 1991). También en bovinos se ha demostrado que los espermatozoides pueden mantener su viabilidad y motilidad por más de 48 horas (in vitro) mientras permanecen unidos por la porción rostral del acrosoma a la mucosa. Esta propiedad es especifica de las células oviductales ya que no sucede lo mismo si lo espermatozoides se unen a otros epitelios ciliados como el de la tráquea (Pollard, 1991). II.2.3. Modulación de la capacitación Una vez que son eyaculados, los espermatozoides de mamíferos no son aún capaces de fertilizar el óvulo, éstos requieren cambios funcionales que se realizan en el tracto reproductor femenino. Estos cambios que otorgan la capacidad fertilizante son denominados colectivamente como capacitación espermática, un complejo proceso fisiológico que involucra modificaciones bioquímicas, biofísicas y metabólicas del espermatozoide, resultando en una alteración de la arquitectura y permeabilidad de la membrana plasmática, en cambios en la actividad flagelar, habilidad para penetrar las células del cúmulo y unirse a la zona pelúcida del ovocito (Harrison y col., 1996). Aunque la capacitación espermática es una propiedad del propio espermatozoide que puede ser alcanzada in vitro en un simple medio fluido (Harrison y Gadella, 2005), in vivo es un proceso secuencial. En cerdos la capacitación espermática es un proceso que en condiciones óptimas requiere del paso por el útero y del oviducto. (Revisado por RodriguezMartinez, 2007a). Se ha sugerido que la exposición a productos solubles presentes en el fluido oviductal produce la capacitación espermática. En este sentido se ha reportado que el oviducto produce un potente factor capacitante que está presente en el fluido oviductal obtenido durante el estro (Parrish y col., 1989, Chian y Sirard, 1995). 19 Revisión Bibliográfica Como consecuencia de modificaciones en la composición de la membrana espermática, se ha observado influjo de Ca2+ durante la capacitación. Se ha sugerido que el contacto de los espermatozoides con las células epiteliales del oviducto mantiene baja la concentración de calcio intracelular en base a experimentos en los que se compara los niveles del ión en espermatozoides adheridos y no adheridos. (Dobrinski y col., 1996). Más aún, se ha sugerido que moléculas inductoras de la capacitación tales como el bicarbonato, deben mantenerse a niveles bajos a nivel del reservorio oviductal y comparativamente con otros segmentos del oviducto, a fin de retardar la capacitación (Rodríguez-Martinez, 2007). Mediante el co-cultivo de espermatozoides con vesículas obtenidas a partir de la membrana apical de las células epiteliales del oviducto (MCEO) se ha demostrado que el contacto entre la MCEO y el espermatozoide puede modular la concentración de calcio intracelular, demorando la capacitación (Smith y Nothnick ,1997). De acuerdo a estas observaciones, el contacto espermatozoides-células oviductales parecería retardar más que inducir la capacitación espermática, prolongando la habilidad fertilizante del espermatozoide. II.3. LIBERACIÓN DE LOS ESPERMATOZOIDES DEL RESERVORIO ESPERMÁTICO OVIDUCTAL Después de la ovulación, las células espermáticas son liberadas gradualmente del reservorio espermático, y ascienden hacia el sitio de fertilización en el ámpula. Los cambios asociados a la capacitación serían los responsables de la liberación de los espermatozoides del epitelio oviductal (Suarez, 1998; Revah y col., 2000). Se ha demostrado que sólo los espermatozoides no capacitados son capaces de unirse a las células del epitelio oviductal (Smith y Yanagimachi, 1991). En cambio, cuando éstos son expuestos a condiciones capacitantes, su habilidad de unirse in vitro a las células epiteliales del oviducto es limitada. Del mismo modo, cuando se induce la capacitación de los espermatozoides adheridos al oviducto por medio de heparina, éstos se liberan (Talevi y Gualtieri, 2001). Se ha propuesto que ocurren cambios en la superficie del espermatozoide durante la capacitación, los que podrían ser responsables de la baja afinidad de los espermatozoides capacitados a los oligosacáridos oviductales. En bovinos estos cambios se asocian a la pérdida o modificación de la proteína de unión PDC-109 durante la capacitación, lo cual facilitaría la liberación de los espermatozoides del epitelio oviductal (Gwathmey y col., 20 Revisión Bibliográfica 2006). (Figura II.3). También se ha descrito hiperactivación en los espermatozoides que se despegan del epitelio oviductal (Pacey y col.,1995). Estos factores, capacitación e hiperactivación actuarían conjuntamente en el despegado de los espermatozoides del epitelio oviductal. Figura II.3. PDC-109, es una proteína secretada por las vesículas seminales bovinas que se asocia a la membrana plasmática del espermatozoide y le permiten interaccionar con el oviducto homólogo. La pérdida o modificación de PDC109, asociada a la capacitación, facilita la liberación de los espermatozoides del epitelio oviductal. (Gwathmey y col., 2006). 21 Revisión Bibliográfica Capítulo III. CARACTERISTICAS REPRODUCTIVAS DE LOS CAMÉLIDOS SUDAMERICANOS (CSA) III.1. CARACTERÍSTICAS REPRODUCTIVAS DE LA HEMBRA III.1.1. Anatomía de los órganos reproductores El aparato reproductor de las hembras de los CSA está constituido por un par de ovarios, un par de oviductos, los que se continúan con los cuernos uterinos que confluyen en el cuerpo del útero y se continúan con el cervix o cuello del útero y la vagina. Estos órganos cooperan en conjunto para cumplir la importante función de producir los ovocitos y hormonas sexuales, proveer el medio óptimo para el transporte de los gametos, permitir el encuentro del óvulo y el espermatozoide en el momento de la fecundación, alojar al embrión y sus envolturas y, finalmente servir de canal durante el nacimiento. Ovarios Los ovarios son redondos a ovales con una textura irregular y firme a la palpación (Sumar, 1983). Se ubican en la cavidad abdominal, a nivel de la séptima vértebra lumbar y a aproximadamente 17 cm de la vulva, y se encuentran suspendidos por el mesovario, una rama del ligamento ancho uterino (Bravo, 2002b). El tamaño del ovario depende marcadamente de las estructuras presentes en el ovario (folículo – cuerpo lúteo) pero aproximadamente mide (1.5–2.5) cm ×1.2 cm ×1.0 cm en alpacas y llamas (Fowler y Bravo, 1998; Sumar y Adams, 1997). Los folículos se ubican, en forma característica, en la periferia del ovario. Aquellos que tienen un tamaño mayor de 2mm pueden detectarse mediante ultrasonografía transrectal (Bourke y col., 1992; Tibary y Memon, 1999; Tibary, 2001). Oviductos Los oviductos son dos conductos convolutos y pequeños en diámetro. Están suspendidos por el mesosalpinx, una rama del ligamento ancho. En su extremo craneal se encuentran las fimbrias, que en alpacas y llamas envuelven al ovario (Fowler y Bravo, 1998; Sumar y Adams, 1997). Hacia caudal, el oviducto termina en el útero formando una papila, la cual tiene un esfínter que protruye dentro del cuerno uterino (Tibary y Memon, 1999). Útero 22 Revisión Bibliográfica Los camélidos poseen un útero bicórneo (forma de Y), suspendido en la pared abdominal por el ligamento ancho. Puede dividirse en tres partes: cuernos uterinos, cuerpo del útero y el cérvix. Los cuernos uterinos son dos, de extremos redondeados y se encuentran separados por un septum. En general, el cuerno uterino izquierdo es más largo que el derecho (Bravo, 2002b). El cuerpo del útero es pequeño en diámetro y longitud. El cérvix o cuello del útero se caracteriza por poseer de 2 a 3 anillos formados por pliegues de la mucosa. (Johnson, 1989; Smith y col., 1994). III.1.2. Fisiología reproductiva La producción de hormonas ováricas comienza aproximadamente a los 6 meses de edad en las llamas, indicando actividad ovárica desde esta edad en adelante aunque algunos individuos pueden alcanzar la pubertad a los 3-4 meses de edad (Revisado por Brown, 2000). La primera monta se realiza generalmente a los 12 meses de edad en regiones donde los requerimientos nutricionales están satisfechos como para que las hembras hayan alcanzado dos tercios de su peso adulto (Novoa y col., 1972). A diferencia de la mayoría de las especies domésticas, las hembras de CSA no son poliéstricas es decir que no tienen períodos regulares de receptividad sexual – celo, luego de los cuales se produce la ovulación en forma espontánea sino que son ovuladoras inducidas ( Revisado por Brown, 2000 y Bravo, 2002b). Las hembras de llama y alpaca no preñadas muestran prolongados períodos de receptividad sexual, que se extiende por más de 36 días después de la primera introducción de los machos al rodeo y en algunos casos, más de 90 días. Estos períodos de celo se interrumpen por breves episodios de anestro, los cuales no duran más de 48 horas (revisado por Brown, 2000). Crecimiento y regresión de los folículos ováricos Estudios realizados mediante laparoscopía, ultrasonografía y determinación de hormonas sexuales han revelado que las hembras sexualmente maduras de llama (Adams y col., 1989,1991), alpaca (Vaughan y col., 2004) y vicuña (Aguero y col., 2001) que no se aparearon exhiben un patrón similar a ondas de crecimiento folicular en los ovarios. El ovario que porta al folículo dominante generalmente se alterna de una onda folicular a otra (England y col., 1969; Bravo y Sumar, 1989) Por conveniencia, el crecimiento folicular se 23 Revisión Bibliográfica dividió en tres periodos: crecimiento, maduración (incluyendo el período de dominancia) y regresión o atresia (Figura III.1). Se ha estimado que en llamas el intervalo para el desarrollo de dos folículos consecutivos que alcanzan 7mm de diámetro (un tamaño donde el folículo puedo responder al estímulo de la cópula y ser ovulado) es de 11 a 12 días (Bravo y col., 1990). El desarrollo folicular en el ovario contra-lateral comienza ya sea en forma tardía durante la fase de maduración o durante la atresia temprana de los folículos del ovario opuesto. Generalmente, dos o tres folículos son reclutados para desarrollarse durante la fase inicial de crecimiento pero sólo uno y a veces dos alcanzan el tamaño ovulatorio en alrededor del 10% de los animales. Este tamaño se determinó como de 7mm de diámetro (Adams y col., 1989; Bravo y col., 1990). El folículo maduro ejerce su dominancia sobre los otros folículos en desarrollo y suprime el crecimiento de los mismos en ambos ovarios durante el tiempo que dura su tamaño maduro, el cual se estima en alrededor de 5 días. Si la cópula no tiene lugar, el folículo dominante sufre una regresión durante 3 a 5 días y una nueva onda de folículos comienza su rápida fase de crecimiento después de la atresia incipiente del folículo dominante anterior. Un nuevo folículo puede volverse dominante 2 a 3 días después (Bravo y col., 1990, Chaves y col., 2002). Estudios mediante ultrasonografía indican una tasa de crecimiento folicular de 0.5–0.9 mm/día (Adams y col., 1989, 1990; Chaves y col., 2002) en llamas, 0.43 mm/día en alpacas (Vaughan y col., 2004) y 1.8 mm/día en vicuñas (Agüero y col., 2001). El intervalo entre ondas se define como el tiempo en días entre la emergencia de dos folículos dominantes sucesivos. El intervalo entre ondas es de aproximadamente 20 días en llamas (Adams y col., 1990), de 12 a 22 días en alpacas (Vaughan y col., 2004) y de 4 días en vicuñas (Agüero y col., 2001). Bravo y Sumar (1989) y Bravo y col. (1990) reportaron un intervalo de 11-12 días tanto para llamas como para alpacas. Se ha encontrado una correlación positiva entre el tamaño del folículo y la concentración de 17ß estradiol en plasma en alpacas (Aba y Forsberg, 1995; Aba y col., 1995; Bravo y col., 1990) y llamas (Aba y col., 1995; Bravo y col., 1990, 1991, Chaves y col., 2002). El pico de la concentración de estradiol plasmático coincide con el tamaño máximo del folículo, 10-13 días desde el inicio del crecimiento folicular en llamas (Chaves y col., 2002) y 8 días en alpacas (Vaughan y Tibary, 2006). Los niveles plasmáticos de progesterona permanecen por debajo de 1 ng/mL en la mayoría de las hembras no copuladas (Aba y col., 1995; Bravo y col., 1990). En algunos casos, folículos anovulatorios hemorrágicos pueden luteinizarse y producir niveles significativos de progesterona (Tibary y Memon, 1999). 24 Revisión Bibliográfica Figura III.1. Tamaño folicular promedio (círculo abierto, concentraciones plasmáticas de 17ß estradiol (triangulos) y concentraciones plasmáticas de progesterona (círculo lleno) durante la onda folicular en llamas. (Chaves y col., 2002). Inducción de la Ovulación Los CSA son ovuladores inducidos. En alpacas y llamas el primer aumento significativo de la LH plasmática ocurre 15-40 minutos después del inicio de la cópula (Bravo y col., 1991). El coito induce un rápido reflejo neuroendocrino con señales que llegan al hipotálamo a lo largo de varios caminos aferentes dentro de minutos de iniciada la cópula (Spies y col., 1997). Los estímulos nerviosos, que influencian el eje neuroendocrino en los camélidos e inducen la elevación de LH en hembras, incluyen la penetración peneana del cervix, los sonidos que el macho emite durante la cópula y el contacto físico (revisado por 25 Revisión Bibliográfica Brown, 2000) así como la presencia de un factor inductor de la ovulación que se encuentra en el semen (Adams y Ratto, 2001; Chen y col., 1985). La respuesta de LH depende del tamaño folicular al momento de la cópula en alpacas y llamas (Bravo y col., 1991). El estímulo copulatorio induce una liberación de LH en todos los estados de la onda folicular, pero aquellas hembras con folículos menores a 4–5mm de diámetro liberan menos cantidad de LH comparadas con las hembras con folículos mayores a 5mm. El apareamiento en presencia de un folículo maduro =7mm de diámetro resulta en una liberación de cantidades suficientes de LH y en la consecuente ovulación en alpacas y llamas (Adams y col., 1991; Bravo y col., 1991; Vaughan y col., 2003). Repetidas cópulas luego de 6 a 24 horas del primer evento no incrementan significativamente los valores de LH (Bravo y col., 1992). El intervalo entre la cópula y la ovulación es de aproximadamente 30 horas (rango de 24 a 48 horas) (Tibary y Memon, 1999). La ovulación ocurre con igual frecuencia en el ovario izquierdo como en el ovario derecho, aún cuando la mayoría de las preñeces se localizan en el cuerno uterino izquierdo (Bravo y col., 1995). La localización original del ovocito (derecho o izquierdo) no tiene efecto sobre la probabilidad de ocurrencia de la preñez (Vaughan y col., 2003). La elevación de LH altera la estructura y función del folículo preovulatorio, produciendo la maduración del mismo, la expansión del cúmulo y la ruptura de la pared folicular (Khatir y col., 2004, 2005). Se produce un cambio en la producción de esteroides por parte del ovario en el intervalo entre el pico de LH y la ovulación. En llamas, las concentraciones en plasma de estradiol permanecen invariables hasta 18 horas después de la cópula (11 a 12 pg/mL), luego declinan a las 22 horas (9 pg/mL) y son significativamente bajas a las 48 horas después de la cópula (6 pg/mL) (Bravo y col., 1990). También se observó que las concentraciones de LH no difieren en amplitud o duración entre aquellas hembras que conciben y aquellas que fallan en la concepción (Aba, 1998; Aba y Forsberg, 1995; Aba y col., 1995; Bravo y col., 1990). Actividad luteal El cuerpo lúteo (CL) se desarrolla en el sitio del folículo que ovuló 3 a 5 días después de la cópula (2–4 días después de la ovulación), coincidentemente con la elevación de los niveles de progesterona en plasma (Adams y col., 1991; Sumar y Bravo, 1991) Aba y col., 1995). El tamaño máximo del CL se encuentra entre 10-15mm en llamas y alpacas, y es 26 Revisión Bibliográfica alcanzado 7–9 días después de la cópula, coincidente con el máximo nivel plasmático de progesterona (Adams y col., 1991; Aba y col., 2000). La secreción de progesterona del CL decrece entre los 9-11 días después de la cópula. (Adams y col., 1991; Sumar y Bravo, 1991). La vida del CL es de 8–9 días- Cuando no ocurre preñez, las hembras vuelven a estar receptivas sexualmente aproximadamente 12–14 días después de la cópula. El decrecimiento en los niveles plasmáticos de progesterona ocurre 1-3 días después del decrecimiento en tamaño del CL. Niveles de progesterona circulante mayores a 2 ng/mL (6.4 nmol/L) se consideran indicativo de la presencia de un CL funcional y maduro (Adams y col., 1991). 27 Revisión Bibliográfica III.2. CARACTERÍSTICAS REPRODUCTIVAS DEL MACHO III.2.1. Anatomía de los órganos reproductores Como en todos los mamíferos, el aparato reproductor del macho se encuentra ubicado en el interior de la cavidad abdominal, debajo del recto. El aparato reproductor del macho consta de las siguientes estructuras anatómicas: testículos, conductos genitales, glándulas accesorias y pene (Figura III.2). Figura III.2.: Tracto Reproductor de la Alpaca. UB: Vejiga urinaria, P: Próstata, UM: Músculo uretral, IcM: Músculo isquiocavernoso, CP: inserción del pene, T: testículo, DD: Conducto Deferente, SF: flexura sigmoidea del pene, RPM: Músculo retractor del pene, GP: glande del pene. (Senger, 2003). Testículos Los testículos son dos y están sostenidos por un escroto no pendular situado aproximadamente 9 centímetros detrás del ano. Generalmente son de forma ovoide y se orientan en posición dorso ventral. El escroto cumple la función de mantener la posición de los testículos y los espermatozoides que estos contienen a una temperatura levemente mas baja que la temperatura corporal. En un macho adulto los testículos suelen tener el mismo tamaño y firmeza y no se mueven libremente dentro del escroto. 28 Revisión Bibliográfica Los túbulos seminíferos miden entre 174 y 240 µm de diámetro (Tibary y Vaughan, 2006) y se encuentran rodeados por una delgada capa de tejido conectivo. Dentro de cada túbulo pueden diferenciarse fácilmente las células de Sertoli, de núcleo alargado, y los diferentes componentes de la línea germinal, desde espermatogonias hasta espermatozoides (Figura III.3) (Rodríguez y col., 1999). Otro componente de los testículos son las células de Leydig, productoras de testosterona, las cuales se ubican entre los túbulos seminíferos, rodeadas de vasos sanguíneos y linfáticos. Los testículos desembocan en el epidídimo y estos en los conductos deferentes. Figura III.3.: Esquema del proceso de espermatogénesis y su localización en los túmulos seminíferos (Purves y col., 2002). Epidídimos Macroscópicamente pueden reconocerse tres partes: cabeza, cuerpo y cola. En general, el tamaño de la cabeza es mayor que el de la cola. A diferencia de lo descrito en bovinos y caprinos, la cabeza de los epidídimos se ubica en posición ventral y la cola en posición dorsal. Microscópicamente, los epidídimos constituyen un tubo cuyo interior se encuentra tapizado por un epitelio columnar pseudoestratificado con células ciliadas. Al igual que en otros 29 Revisión Bibliográfica mamíferos, su función es de almacenamiento y maduración de los espermatozoides producidos en los testículos. Conductos deferentes Cada epidídimo se continúa con el conducto deferente, el cual desemboca cercano a la vejiga pero no en la característica ampolla deferente observada en otras especies (Sumar, 1985). Pene El pene es del tipo fibroelástico y no depende de vascularización o estímulo friccional para la cópula. En ausencia de erección, el pene se retracta por medio de la flexura sigmoidea, la cual se ubica en posición anterior al escroto. La longitud del pene varía de 35 a 45 cm en llamas y alpacas (Smith y col., 1994). En su extremo posee una proyección cartilaginosa como un gancho curvo y un pequeño proceso uretral de aproximadamente 1cm de longitud (Sumar, 1985), el cual posiblemente sea una adaptación para facilitar la penetración del pene a través del cérvix durante la cópula (Bravo, 2002a). Glándulas accesorias En cuanto a las glándulas accesorias, podemos decir que la característica más notable en los camélidos es la ausencia de vesículas seminales (Smith, 1985). La próstata tiene forma de H y se ubica en el cuello de la vejiga. Las glándulas bulbouretrales, de forma ovalada, se ubican a ambos lados de la uretra pélvica y se encuentran parcialmente cubiertas por el músculo bulbocavernoso (Revisado por Brown, 2000).. III.2.2. Fisiología reproductiva Se considera que la edad de comienzo de actividad sexual es a partir de los 2 años de edad, cuando el macho pierde completamente la adherencia prepucial que impide la completa erección e intromisión del pene. Sin embargo, se describen comportamientos reproductivos a partir del año de edad (Sumar, 1985). A esa misma edad también comienza la espermatogénesis en los túbulos seminíferos (revisado por Brown, 2000). La producción de 30 Revisión Bibliográfica espermatozoides está correlacionada con el tamaño testicular característica que es considerada de fácil uso cuando se desea estimar la probabilidad de producción de espermatozoides de un macho (Tibary y Vaughan, 2006). La espermatogénesis ocurre a lo largo del año en todos los camélidos, sin embargo se han reportado efectos estacionales en la producción de espermatozoides dependiendo adicionalmente del sitio geográfico (Tibary y Vaughan, 2006). III.2.3. Semen Recolección del semen Las principales técnicas usadas son la extracción con vagina artificial, la electroeyaculación, y la obtención del semen pos-coital a partir de una hembra. También se ha reportado recolección de semen mediante el uso de esponjas vaginales y fistulación de la uretra (Bravo y col., 2000, Tibary y col., 2006). A continuación se describen alguna de ellas, sus ventajas y desventajas. Para la extracción del semen pos-coital se ha descrito el uso de un condón humano, conteniendo una bola de acero pequeña en su extremo, el cual es insertado en la vagina de una hembra sexualmente receptiva con la ayuda de una barra de cristal. Posteriormente se inyecta una pequeña cantidad de aire a través de un tubo para adherir el condón a la pared vaginal. Las desventajas de este método consisten en que los machos no copulan la longitud normal de tiempo y las hembras dejan de cooperar luego de algunas tentativas (Johnson, 1989; Sucapuca, 1991). Cuando se utiliza una esponja estéril para la colección del semen, esta se inserta en el fondo de la vagina (San Martin y col., 1968). No parece ser muy eficiente ya que de muestras recolectadas de 39 machos no contenían espermatozoides en el 20% de los casos. La recolección de semen a través de una fístula en la uretra peneana tiene la desventaja del cuidado postoperatorio y el debilitamiento del macho. Para la recolección del semen por electroeyaculación es necesaria la sedación o anestesia general del animal (Johnson, 1989; McEvoy y col., 1992). El glande del pene debe exteriorizarse con la ayuda de una gasa y el semen debe colectarse en un tubo atemperado. Luego de la inserción de la sonda en el recto, la estimulación eléctrica se inicia en el punto más bajo y gradualmente se incrementa a estímulos de 4–6 s, seguido por períodos de 4 s de descanso. Se han reportado recolecciones exitosas mediante esta metodología (Giuliano y col., 2008), la cual tiene como ventaja que se obtienen eyaculados bajos en espuma (a diferencia de la recolección con vagina artificial) y como desventaja la necesidad de contar con más de un operario y la posible contaminación con orina de las muestras de semen. La 31 Revisión Bibliográfica recolección del semen por vagina artificial (VA) se considera un método natural y confiable. Se ha informado recolección exitosa de semen por vagina artificial en alpacas (Sumar y Leyva, 1981; Vaughan y col., 2003) y llamas (Lichtenwalner y col., 1996, Giuliano y col., 2008). Para la recolección se utiliza una VA para toro modificada (25 centímetros de largo, diámetro interno de 5 centímetros). El interior del cilindro se cubre con un tubo de látex, dejando una cavidad en el centro. Esta cavidad se llena con agua caliente (40º C) para dar una temperatura interna de 38-40º (Giuliano y col, 2008). Se utiliza una hembra como excitadora y cuando el macho está en posición de apareamiento, el operador toma el prepucio y lo desvía hacia la VA. Las muestras de semen que se obtienen están completas, pero debido al alto contenido de proteínas del plasma seminal y a los movimientos que el macho realiza dentro de la VA, estas muestras forman mucha espuma y en algunos casos deben descartarse. Características seminales Las características físicas y biológicas del semen de CSA son absolutamente variables dependiendo del método de la recolección del semen, fertilidad y libido del macho, y temperatura ambiente entre otros factores. El eyaculado individual generalmente es de bajo volumen, alta viscosidad y baja concentración de espermatozoides (Revisado por Tibary y Vaughan, 2006). Los eyaculados tienden a no estar separados en fracciones (Sumar, 1983), pero algunos parámetros por ejemplo: concentración, porcentaje de vitalidad, porcentaje de espermatozoides normales pueden variar levemente del principio al final de la eyaculación (Bravo y col., 2002c; Lichtenwalner y col., 1996). En la alpaca, el volumen del semen varía entre 0.4 a 12.5 ml (Garnica y col., 1993; Sumar y Leyva, 1981). En esta especie, el semen obtenido por vagina artificial tiende a disminuir en volumen con el aumento de la frecuencia de uso. En eyaculaciones sucesivas, el volumen del último eyaculado es perceptiblemente más bajo (Bravo y col., 1997). En la alpaca, el plasma seminal ocupa el 88.5% y los espermatozoides el 11.5% del volumen seminal, sin diferencias significativas entre edades (Garnica y col., 1993). El pH del semen es de 7.5 para la alpaca (Bravo y col., 1997) y 8.1 para la llama (Lichtenwalner y col., 1996). En llamas, el pH del semen recogido por la vagina artificial no se diferenció perceptiblemente en las fracciones recogidas en diferentes momentos durante la cópula (Lichtenwalner y col., 1996). Esto es probablemente debido al hecho de que el semen de camélidos no se emite en fracciones distintas. 32 Revisión Bibliográfica Una de las características físicas más importantes del semen de los camélidos es su alta viscosidad que hace que sea muy difícil de manipular durante procedimientos del laboratorio y de mezclar con medios de dilución (Garnica y col., 1993; Vaughan y col., 2003, Tibary y col., 2006). La viscosidad del semen se atribuye generalmente a la presencia de mucopolisacáridos originados de las secreciones de las glándulas bulbouretrales (Copa y Gonzales, 2003). El papel fisiológico de esta característica no está claro. El grado de viscosidad del semen depende del macho, y tiende a disminuir con el número de eyaculaciones en el día (Bravo y col., 1997). La licuefacción completa del semen de la alpaca puede tomar varias horas. En un estudio, el tiempo promedio para la licuefacción del semen de la alpaca fue 23 ± 1.2 h (rango de 8-48 h) (Garnica y col., 1993). Se ha descrito la licuefacción del semen de camélidos por tratamiento con diversas enzimas proteolíticas (tripsina, colagenasa, fibrolisina, hialurodinasa). Todas estas enzimas son eficaces pero pueden causar daño a los espermatozoides si se prolonga la incubación o la concentración es demasiado alta (Bravo y col., 1999, 2000b). Resulta interesante que después del agregado de colagenasa al 0,2% las muestras de semen fresco disminuyen su viscosidad pero además los valores de motilidad progresiva (porcentaje de espermatozoides que presentan movimiento de traslado) aumentan un 35%. Adicionalmente, se eleva el porcentaje de espermatozoides que presentan membrana estable (endósmosis) (Giuliano y col, 2007). La composición bioquímica del semen de camélidos es similar a la divulgada para otras especies de ganado. El cloruro es el anión principal y el calcio es el catión principal (Garnica y col., 1993). Estos electrolitos tendrían importancia en los procesos filológicos de la célula espermática tales como motilidad y capacitación. La glucosa se encuentra en alta concentración en el plasma seminal de camélidos y podría ser el substrato energético principal (Garnica y col., 1993). Otros componentes del semen tales como lípidos, fosfolípidos y proteínas se han cuantificado en el plasma seminal de la alpaca (Garnica y col., 1993) aunque sus funciones todavía no se han estudiado. La concentración de espermatozoides es altamente variable (82-250 millones de espermatozoides/mL) y es afectada por la edad y el método de colección (Bravo, 2002c). La interrupción de la cópula da lugar a la reducción en la concentración (Bravo y col., 2002c). La concentración del semen decrece pero no se observó ninguna diferencia entre la concentración de dos eyaculaciones sucesivas si se permite un intervalo de por lo menos 12 h (Bravo y col., 1997). 33 Revisión Bibliográfica En cuanto a la motilidad, puede observarse motilidad masal (porcentaje de espermatozides que presentan algún tipo de movimiento) en eyaculados no diluidos si la concentración espermática es lo suficientemente alta (Tibary y Anouassi, 1997). La motilidad individual de los espermatozoides es muy baja en semen no diluido, y el movimiento se describe como oscilatorio. Solamente del 5 al 10% de los espermatozoides individuales presentan movimiento progresivo (Bravo y col., 1997). La motilidad progresiva, según lo descrito, es muy difícil de apreciar en semen de camélido debido a la naturaleza viscosa del mismo, razón por la cual este parámetro no suele utilizarse para evaluar la calidad del semen. Características de los espermatozoides Los espermatozoides maduros de los CSA exhiben las mismas características morfológicas que otros mamíferos domésticos. La longitud total de la célula espermática de CSA es más pequeña que la del toro, del búfalo, del asno y del caballo pero es más grande que la del cerdo. La longitud total del espermatozoide de la llama es 49.5 ± 2.2 µm. Se distinguen cabeza, pieza media y cola. La longitud de la cabeza es de 5.3 ± 0.5 µm, el ancho de la cabeza 3.8 ± 0.1 µm, la longitud de la pieza media 5.3 ± 1.6 µm, y la longitud de la cola 36.6 ± 1.8 µm (Merlian y col., 1986). La cabeza de los espermatozoides de CSA es elíptica. Las longitudes de la cabeza y de la pieza media son más cortas que en otros animales mientras que la cola es más larga que en el caso del cerdo y el caballo (Merlian y col., 1986). Todas las anormalidades espermáticas reportadas para otras especies también han sido encontradas en el semen de los camélidos (Tibary, 2003; Tibary y Anouassi, 1997). Esta incluye anormalidades de la cabeza, la pieza media y la cola, como así también la presencia de gota citoplasmática proximal y distal. El efecto de estas anormalidades sobre la fertilidad aún no se conoce. (Tibary y col., 2006). III.3. COMPORTAMIENTO REPRODUCTIVO Como previamente se mencionó, las hembras no preñadas están esencialmente en celo continuo, y cuando se introducen machos a una manada, éstos procurarán aparearse con la primera hembra receptiva que encuentren. El cortejo comienza cuando el macho persigue a hembras receptivas y procura activamente montarlas. Una vez que una de las hembras lo acepta, la hembra toma una posición prona o sentada, con la pelvis elevada, permitiendo que el macho pueda montarla a horcajadas por detrás (Figura III.4). Los Camélidos son los únicos ungulados que se aparean en posición recumbente. Luego de penetrar la vulva, el 34 Eliminado: 1 Revisión Bibliográfica macho dirige su pene dentro de la vagina y a través del cérvix. Esto lleva un tiempo considerable. Luego con movimientos suaves de empuje, el semen se deposita directamente en los cuernos uterinos (England y col., 1971; Franco y col., 1981; Sumar, 1985; FernándezBaca, 1993). El proceso de la cópula de los camélidos es considerado único por varias razones: la duración del coito, el tiempo de eyaculación y el sitio de deposición del semen. La duración de la cópula es muy variable, con promedios de 20 a 25 minutos y variando desde unos pocos minutos hasta más de una hora. No se encontró correlación entre la duración de la cópula y la tasa de concepción (Tibary y Vaughan, 2006). Coincidentemente, la eyaculación parece acontecer durante todo el tiempo que dura la cópula, la cual responde a pulsos uretrales. En el caso de la llama se describe que comienza aproximadamente 4 minutos después del comienzo de la cópula y se registraron aproximadamente 18 a 19 eyaculaciones cada 22 minutos (Lichtenwalner y col., 1996). Durante la cópula el semen es depositado profundamente dentro de los cuernos uterinos, o bien en la papila de la unión útero tubal (Bravo, 2002b). En este sentido, se ha observado hemorragia e inflamación de los cuernos uterinos en hembras que copularon 24 horas antes de ser faenadas (Bravo, y col, 1996). Esta inflamación puede durar 3 a 4 días. Cuando los machos y las hembras se mantienen juntos por mucho tiempo, se ha observado que algunas hembras pueden aparearse varias veces al día por varios días, mientras otras sólo se aparean una vez. (revisado por Brown, 2000). Como norma de manejo pecuario, los machos se mantienen generalmente separados de las hembras, lo cual tiene el efecto de acrecentar la libido (Moseley, 1995). Las cuatro especies de CSA pueden intercruzarse para producir híbridos fértiles. La más común es el huarizo, resultado de la cruza entre un macho de llama y una hembra de alpaca. Este animal se produce para obtener fibra de alta calidad. La cruza inversa, misti, es menos frecuente. Cruzas entre macho de vicuña y hembra de alpaca producen la paco-vicuña, la cual tiene una fibra más fina y más liviana que la alpaca. 35 Revisión Bibliográfica Figura III.4.: Posición adoptada por los camélidos sudamericanos para la cópula. 36 Eliminado: 1 SECCIÓN C MATERIALES Y MÉTODOS Materiales y Métodos Capítulo IV - MATERIAL BIOLÓGICO 1. Animales Para realizar este trabajo se utilizaron machos y hembras de llama “Lama glama” pertenecientes al Centro Experimental de Altura INTA Abra Pampa, Jujuy, Argentina y a la Facultad de Ciencias Veterinarias de la Universidad de Buenos Aires. Se eligieron animales adultos de 3 a 11 años de edad. En algunos experimentos se utilizaron machos a los que se les extrajeron las glándulas bulbouretrales mediante cirugía a fin de eliminar la viscosidad del semen en estos animales. 1.1. Animales bulboretrectomizados Los animales bulboretrectomizados fueron obtenidos con otros fines en la Cátedra de Teriogenología de la Facultad de Veterinaria de la UBA y fue realizada por profesionales de dicha Facultad. Las maniobras de cirugía se realizaron según lo descrito por Copa y Gonzales (2003). Sintéticamente, se realiza una incisión de la piel y tejido subcutáneo, hemostasis y ligadura de vasos sangrantes hasta visualizar la parte dorsal de la uretra pélvica. La incisión se ejecuta en forma de medialuna, profunda y transversal a la línea media de la zona perineal, 5-7cm por debajo del músculo del esfínter anal. Seguidamente se realiza la disección lateral profunda de las aponeurosis, hasta visualizar el plano anatómico dorsal de la uretra pélvica y las glándulas bulbouretrales. Durante esta operación se evita cuidadosamente no lesionar los músculos retractores del pene. Posteriormente se disec an las glándulas separando el músculo bulbouretral en ambos lados de la uretra pélvica. La extirpación se realiza a través de una incisión en la base de la glándula a nivel del conducto excretor, en la línea media dorsal del istmo uretra, evitando lesiones en la uretra pélvica. Para finalizar se realiza el cierre de las incisiones profundas o sutura interna y luego la sutura externa o cierre de piel. 2. Oviductos Los oviductos se obtuvieron a partir de hembras faenadas en el INTA Abra Pampa las que posteriormente fueron destinadas a consumo humano. En aquellos experimentos en los que se usaron hembras pertenecientes a la Facultad de Ciencias Veterinarias de la UBA, éstas fueron sometidas a cirugía por integrantes de la Cátedra de Teriogenología a fin de obtener los oviductos. 38 Materiales y Métodos 2.1 Obtención de oviductos a partir de animales faenados Para la faena los animales son colgados por las patas traseras. Esta posición desplaza hacia abajo los estómagos y el intestino. Sólo los órganos del aparato reproductor, sostenidos por sus mesenterios, quedan en la región pélvica. Se realiza una incis ión en el abdomen hasta llegar a la cavidad pelviana. Utilizando pinzas Köcher se cierran los extremos caudal y craneal de cada oviducto y luego se disecan los ovarios y los oviductos, los que se colocan en solución fisiológica fría e inmediatamente se transportan al laboratorio. 2.2. Obtención de Oviductos a partir de animales vivos mediante cirugía Las hembras sometidas a cirugía para extraer el oviducto se trataron según el siguiente protocolo. Doce horas antes de la cirugía, las hembras se sometieron a un ayuno de sólidos. La preanestesia consistió en xilacina (Rompunâ) por vía endovenosa a una dosis de 0,4 mg/kg. Luego se realizó anestesia local infiltrativa con lidocaína al 2 % (Lidocalâ) sin epinefrina. Luego de 10 minutos se llevó al animal a plano quirúrgico con una aplicación por vía endovenosa de xilacina 0,4 mg/kg y ketamina (1,5mg/Kg). Luego de llegar al plano anestésico se aplicó butorfanol a una dosis 0,1 mg / kg (Torbugesicâ). En caso de prolongarse la cirugía, el animal se mantiene en plano con xilacina 0,4 mg/kg y ketamina (1 mg/Kg.). Para la cirugía se tomó como punto de referencia a la región anterosuperior de las mamas, por debajo del pliegue de la babilla. Se realizó incisión de la piel y tejido subcutáneo, hemostasis y ligadura de vasos sangrantes. La línea de incisión se realizó en dirección dorso caudal a cráneo ventral. Una vez realizada la incisión, se expusieron ovarios, oviducto y parte de los cuernos uterinos. Se realizó una ligadura en la porción craneal de los cuernos para luego cortar. De este modo se obtuvieron los oviductos y una pequeña porción de cuernos uterinos. Para finalizar se realizó el cierre de las incisiones profundas o sutura interna y luego sutura externa o cierre de piel. Los oviductos fueron recolectados y colocados en solución fisiológica fría e inmediatamente transportados al laboratorio. 2.3. Clasificación de oviductos La clasificación de los oviductos se basó en la morfología del ovario, especialmente el tamaño del folículo ovárico dominante la que se determinó post mortem en el caso de las hembras faenadas o bien durante la cirugía en el caso correspondiente . 39 Materiales y Métodos Se conoce que los camélidos sudamericanos son ovuladores inducidos por la cópula. En ausencia de éste estímulo, la actividad ovárica ocurre en ondas de crecimiento y regresión folicular, correla cionadas con los niveles plasmáticos de estrógeno (Chaves y col., 2002). Por lo tanto no exhiben un ciclo estral con fases determinadas, como otros mamíferos. Por este motivo se clasificaron los ovarios por su aspecto morfológico según el tamaño del folículo dominante en dos grupos: a) fase no madura: folículos dominantes menores a 7.0 mm, correspondiente a ovarios con folículos en fase de crecimiento y con folículos en fase de regresión; b) fase madura: folículos dominantes mayores a 7.0 mm, correspondiente a folículos capaces de responder al estímulo de la cópula y ovular. 3. Espermatozoides 3.1. Obtención de semen Las muestras de semen se obtuvieron mediante vagina artificial, luego de un período de abstención sexual de cinco días como mínimo utilizando una hembra como súcubo de acuerdo a Giuliano y col. (2007a). Debido a que no existe disponible en forma comercial una vagina artificial para esta especie, se adaptó una vagina artificial para toro (25 centímetros de largo, diámetro interno de 5 centímetros). El interior del cilindro se tapizó con un tubo de látex. La cavidad entre el tubo de látex y la pared de la vagina artificial se llenó con agua caliente (40º C) a fin de obtener una temperatura interna de 38-40º C (Giuliano y col, 2007a). Una vez obtenido, el eyaculado se mantuvo en Baño Maria a 38-39º C. 3.2. Evaluación del semen En casi todos los mamíferos la calidad seminal se evalúa utilizando los parámetros de viabilidad y concentración espermática. Pero en llamas, debido a que los espermatozoides presentan baja o nula motilidad progresiva, éste criterio de evaluación no fue utilizado (Bravo, 2000a; Tibary y Vaughan, 2006). La concentración de espermatozoides se determinó mediante hemocitómetro utilizando una dilución 1:20 en PBS formolado al 2%. Se consideraron aceptables muestras con concentraciones mayores a 75 x 106 espermatozoides/ml. Para estimar la viabilidad se utilizó la técnica Eosina-Nigrosina. La eosina es un colorante vital por lo que las células vivas e intactas excluyen el colorante, pero aquéllas que han sufrido algún daño pierden la selectividad de membrana y se vuelven permeables al colorante por lo que se observan coloreadas. El colorante nigrosina aumenta el contraste y 40 Materiales y Métodos permite una mejor visualización de los espermatozoides no coloreados. Se coloca una gota de semen sobre un portaobjetos atemperado a 38º C, se agregar 1 gota de la mezcla eosina/nigrosina (1:2), se mezcla suavemente y se realiza un frotis. Los espermatozoides muertos aparecen teñidos de rosa y los vivos traslúcidos. Se determina el porcentaje de vivos sobre el total de espermatozoides. Se seleccionan las muestras con viabilidad mayor al 80%. 3.3. Aislamiento de espermatozoides A fin de separar los espermatozoides del plasma seminal cada muestra fue lavada tres veces con medio de TALP (Tyrode Albumin Lactate Pyruvate), conteniendo piruvato de sodio 6 mg/ml y 2.2 mg/ml de BSA (Albúmina Bovina) (Parrish y col., 1988). El pellet final se resuspendió en 5 ml del mismo medio y se determinó concentración mediante hemocitómetro. 3.4. Obtención de espermatozoides epididimales Se obtuvieron espermatozoides de la cola de epidídimo. Inmediatamente después de la faena se disecaron las bolsas escrotales, conteniendo testículo s y epidídimos de dos machos. El tejido fue colocado en solución fisiológica fría y transportado al laboratorio. Dentro de los 30 minutos luego de la obtención, se procedió a disecar las colas de epidídimos, y se colocaron individualmente en cajas de Petri. El contenido del conducto se obtuvo mediante incisiones con bisturí. El fluido conteniendo los espermatozoides se fijó con formaldehído 12% (Dil 1/6, v/v) tamponado a pH 7.4 y mantenido a 5º C hasta su utilización. 4. Cultivo de células oviductales 4.1. Cultivo en monocapa Se seleccionaron oviductos correspondientes a ovarios en fase no madura, en los que se observaban claramente folículos en crecimiento menores a 7.0 mm. Los oviductos se colocaron en PBS pH 7,4 estéril, adicionado con antibióticos y antifúngico (Penicilina 100.000 UI/l, Estreptomicina 100 mg/l y Anfotericina B 250 µg/l) y se transportaron en frío hasta el laboratorio. Los oviductos fueron lavados repetidamente con este medio hasta la ausencia de sangre en el líquido de lavado sobre una placa de Petri estéril se procedió a la disección del oviducto completo, separándolo de los tejidos adyacentes y el ovario. Se establecieron las condiciones apropiadas para la obtención y el cultivo de las células epiteliales del oviducto de llama, tomando como referencia los protocolos descriptos por 41 Materiales y Métodos otros autores para el cultivo primario de células oviductales de otras especies de mamíferos (Ijaz y col., 1994; Thomas y col., 1994b, 1995). En base a la experiencia realizada en el laboratorio con las células del oviducto de llama se diseñó un nuevo protocolo de obtención de células y cultivo de las mismas, el que se describe a continuación. El interior de los oviductos se perfundió con medio D-MEM + Ham’s-F12 (Gibco BRL). Seguidamente se cerró uno de los extremos del oviducto con una pinza de Köcher, se llenó la luz oviductal con una solución de Colagenasa tipo I (Gibco BRL) 1 mg/ml en medio D-MEM + HAM-F12. El otro extremo se obturó con otra pinza y se dejó actuar a la enzima por un periodo de 60 minutos a 38,5ºC. Pasado este tiempo se sacaron las pinzas y se extrajo el contenido oviductal ejerciendo una suave presión mecánica con una pinza sobre las paredes del oviducto. El contenido se recogió en una placa de Petri estéril conteniendo 3 ml de medio D-MEM + Ham’s-F12 y las células oviducales se disgregaron mecánicamente con ayuda de una pipeta. A continuación se centrifugó a 1.000g durante 10 min utos descartándose el sobrenadante y diluyendo el sedimento celular con Medio 199 (Gibco BRL) suplementado con 10% de Suero Fetal Bovino (Gibco BRL), ácido pirúvico 0,2 mM y Gentamicina sulfato 50 µg/ ml (Medio 199 suplementado). Una alícuota de la suspensión celular previamente coloreada con Azul Tripan se empleó para determinar la concentración y viabilidad celular mediante recuento en cámara hemocitométrica. Una vez confirmada la calidad de las células, se sembraron en botellas de cultivos celulares de 25 cm 2 (Nunc) en una concentración de 1 x 10 5 células por botella. Esta concentración fue suficiente para obtener cultivos primarios. Transcurridas 48 h desde la siembra, se comprobó la adhesión de las células a la superficie inerte de la botella y se removió el medio de cultivo, reemplazándolo por Medio 199 suplementado. Es te proceso se repitió cada 2 días, durante 12 días cuando las células fueron utilizadas. Luego de cada cambio de medio se comprobó la ausencia de contaminación, el crecimiento celular y el movimiento ciliar de las células oviductales con un microscopio invertido. Para comprobar la ausencia de contaminación, el medio de cultivo retirado de cada botella se sembró en medios de cultivos para control bacteriológico, Tripticase Soya Agar (TSA) y caldo tioglicolato, y control micológico (Sabouraud). 4.2. Cultivo en explanto Para el cultivo de explantos de oviducto se utilizaron hembras con ovario en fase no madura. Cuatro oviductos obtenidos a partir de dos hembras fueron disecados. Los mismos se lavaron con PBS (Phosfate Buffer Saline, pH 7.2) adicionado de antib ióticos y se los separó 42 Materiales y Métodos del tejido conectivo. Luego se separaron los segmentos oviductales UUT e istmo, que fueron procesados por separado. Cada segmento fue abierto longitudinalmente y la superficie de la mucosa raspada con un bisturí estéril. Las células epiteliales obtenidas se transfirieron a Medio 199 (Gibco BRL) suplementado con 10% de suero fetal bovino (FBS, Gibco BRL), ácido pirúvico 0,2 mM y gentamicina sulfato 50 µg/ ml. Con la ayuda de una pipeta se disgregaron mecánicamente las células y luego se centrifugaron suavemente durante 10 minutos descartándose el sobrenadante. Las células se lavaron por centrifugación 3 veces. Cada pellet se resuspendió en 2 ml de medio de cultivo suplementado con FBS al 10%, 20 µg/ml de piruvato de sodio, 50 ug/ml Gentamicina, penicilina 100 UI/ml, estreptomicina 100 µg/ml, y 0.25 µg/ml de amphotericin B y el medio con las células fue transferido a botellas de cultivo de 50 µl . Previamente se midió la concentración de las células epiteliales usando hemocitómetro y se evaluó la viabilidad con Azul Tripan al 4% (Sigma). Las células se cultivaron durante la noche a 38 °C en estufa con 5% O2 y 95 % aire con 100% de humedad. Luego del cultivo las células forman un conglomerado con forma vesicular en los que éstas se ubican con la superficie apical mirando hacia fuera. Mediante microscopio estereoscópico pudo observarse, el movimiento de las cilias que origina el desplazamiento de las vesículas en el medio de cultivo. Estas vesículas fueron designadas explantos. Capítulo V - MÉTODOS 1. Histológicos 1.1. Histología del Oviducto de Llama Para el estudio histológico se tomaron secciones de los siguientes segmentos: útero, unión útero tubal (UUT), istmo, ámpula e infundíbulo. Las piezas se fijaron en paraformaldehido al 4% durante 24 h. Posteriormente se deshidrataron en soluciones crecientes de alcohol. Luego de dos baños en Xilol (Cicarelli) se incluyeron en paraplast. Los cortes, de 7 um de espesor, se desparafinaron con Xilol y se hidrataron en soluciones decrecientes de alcohol para luego colorear con Hematoxilina – Eosina o Tricrómico de Masson. Luego se deshidrataron con soluciones crecientes de alcohol, Xilol y se montaron con bálsamo de Canadá. Los preparados se observaron en un microscopio Olympus Bx40 . 1.2. Coloración con Hematoxilina – Eosina ? Desparafinar con Xilol durante 10 minutos, dos veces. 43 Materiales y Métodos ? Hidratar con concentraciones de alcohol decrecientes hasta alcohol 50º , 2 minutos cada baño. ? Colocar en agua destilada. ? Sumergir en Hematoxilina durante 1 minuto. ? Colocar en Agua corriente 10 minutos. ? Lavar en Agua destilada. ? Sumergir en Eosina durante un minuto. ? Lavar en Agua destilada. ? Deshidratar con concentraciones de alcohol crecientes hasta alcohol 100º , 2 minutos cada baño. ? Dos baños de xilol de 5 minutos cada uno. ? Montar en bálsamo de Canadá. Los núcleos (basófilos) se colorean de azul con la hematoxilina, mientras que la eosina tiñe de rosa más o menos intenso estructuras acidófilas, como las fibras de colágeno y los citoplasmas. Los colorantes Eosina y Hematoxilina fueron provistos por Sigma. 1.3. Coloración con Tricrómico de Masson – Goldner El método del Tricrómico de Masson-Goldner se utiliza para distinguir las células de la matriz conjuntiva. Esta compuesto por hematoxilina de Groat, y los colorantes rojo fucsin a Ponçeau, naranja G (en solución de ácido fosfomolíbdico) y verde luz (solución acética) (Sigma). Se observa el tejido conjuntivo en verde, el tejido muscular en verde pardo, los eritrocitos en rojizo, los núcleos en azul negro y el citoplasma en rosa. A continuación se describe la técnica de tinción a partir de una muestra desparafinada e hidratada: ? Hematoxilina 5 min. ? Lavar con agua corriente 10 min. ? Lavar en Agua destilada. ? Fucsina de Ponceau 3 min. ? Lavar en Agua destilada. ? Orange G, 3 min. ? Lavar en Agua destilada. ? Verde luz 2 min. ? Lavar en Agua destilada. 44 Materiales y Métodos ? Deshidratar y montar 2. Histoquímicos 2.1. Detección de Mucopolisacáridos Para la detección de mucopolisacáridos se realizó la técnica de coloración mixta con el reactivo de Schiff (PAS) combinado con Azul de Alcián (AA) pH 2.5. La técnica de PAS se basa en la reacción con el reactivo de Schiff de los grupos aldehído presentes en los carbohidratos tras su oxidación con ácido periódico. El reactivo de Schiff contiene fucsina básica, que en solución ácida y en presencia de SO 2 da lugar a una forma no coloreada (ácido N-sulfónico). Al reaccionar con los grupos aldehído libres este reactivo forma un compuesto insoluble de color púrpura que identifica a los mucopolisacáridos neutros. Combinando la tinción PAS con AA 2.5 se identifican además los mucopolisacáridos ácidos que no pueden ser oxidados por el ácido periódico, los que se observan de color azul. Secciones de aproximadamente 7 µm de Ámpula, Istmo y UUT fueron coloreados con PAS. Algunos cortes fueron coloreados previamente con una solución 1% AA 8Gx (Biopack), pH 2.5, durante 25 minutos. La coloración de contraste se realizó con Hematoxilina de Harris. A continuación se indican los pasos de la técnica de coloración PAS/AA: ? Desparafinar e hidratar los cortes ? Solución de Azul Alcian por 10 min. ? Lavar en Agua destilada. ? Solución de ácido Periódico por 10 min ? Lavado con Agua destilada. ? Solución de Schiff por 30 min ? Lavado con agua sulfurosa 1 mm., y luego agua destilada 3 veces. ? Lavar con agua corriente hasta que tome color rojo. ? Colorear con Hematoxilina (contraste de núcleos) por 2 min. ? Lavar, deshidratar, aclarar y montar. 2.2. Detección de residuos glicosilados mediante Lectinhistoquímica La caracterización de los residuos azucarados de las células oviductales se realizó mediante lectin-histoquímica del oviducto de llama y de células epiteliales de oviducto 45 Materiales y Métodos cultivadas en monocapa. Se utilizaron las siguientes lectinas fluorescentes: WGA, WGA succinilado, UEA 1, DBA, RCA 120, Con A, PSA, LCA, GSL y SJA (Sigma), conjugadas con FITC o Rhodamina (en la Tabla V.1. se detallan sus ligandos). Las lectinas se utilizaron en una concentración de 12 µg/ ml en buffer TRIS. Los cortes de tejido (7 µm) fueron desparafinados con xilol/isopropanol e hidratados con diluciones decrescientes de etanol. Luego se lavaron varias veces en buffer TRIS (pH 7,4) antes de tratar con la primer lectina. Los cortes se cubren con cada solución de lectina y se incuban en cámara húmeda, a temperatura ambiente y en la oscuridad durante 60 minutos. Antes de aplicar la segunda lectina se lava en buffer TRIS. Los núcleos se colorean con Dapi 1:1000 en PBS durante 5 minutos en la oscuridad, luego se lava en buffer TRIS para luego deshidratar y montar. Los preparados se observaron mediante Microscopía Confocal Láser (MCL). 2.3. Detección de moléculas de reconocimiento de N-Acetil galactosamina-FITC en espermatozoides Se obtuvieron espermatozoides eyaculados y espermatozoides epididimales como se describió anteriormente. Los espermatozoides fueron fijados con 2% de formaldehído tamponado a pH 7.4. Se tomaron alícuotas de 10 µl de la suspensión de espermatozoides, las que se dejaron secar sobre un portaobjetos recubierto con Poly-lisina (Sigma). Después de lavar con PBS la muestra adherida al portaobjetos, se incubó durante una hora con 150 mg/ml de N-Acetilgalactosamina-PAA-FITC (Glycotech). Luego se montaron con glicerol y se observaron en microscopio fluorescente Olympus BX 40. El control negativo consistió en muestras de espermatozoides incubadas con PBS. 46 Materiales y Métodos Tabla V.1. Lectinas utilizadas y residuos azucarados que reconoce. Lectina Fuente Oligosacárido ConA Canavalia ensiformis a-manosa y a-glucosa LCA Lens culinaris a - manosa y a -glucosa PSA Pisum sativum a - manosa y a -glucosa UEA 1 Ulex europeus a –L-Fucosa DBA Dolichus Biflorus a-N-Acetil Galactosamina GSL Griffonia simplicifolia a-galactosa y -N Acetil Galactosamina SBA Soybean Agglutinin a-galactosa y -N Acetil Galactosamina RCA 120 Ricinus communis ß-Galactosa y ß-N Acetil Galactosamina SJA Sophora japonica a ,ß-galactosa y a , ß-N Acetil Galactosamina WGA Triticum vulgaris N Acetil Glucosamina y Acido siálico WGAsucc Triticum vulgaris N Acetil Glucosamina 3. Inmunocitoquímicos para detección de citoqueratina Para establecer la naturaleza epitelial en los cultivos celulares se realizaron pruebas de inmunocitoquímica indirecta utilizando un anticuerpo contra citoqueratina, proteína especifica de las celulas epiteliales, (anti-Pan citoqueratina monoclonal, clon PCK-26, Sigma). El procesamiento de las células epiteliales fue similar al descrito anteriormente pero en este caso se emplearon cajas de Petri para cultivos celulares de 60 mm (Nunc), dentro de las que se introdujeron cubreobjetos estériles para que las células se desarrollen sobre los mismos, a fin de poder maniobrar con ellos más fácilmente durante las incubaciones. Pasados 5-7 días de la siembra, y tras comprobar la adhesión y crecimiento de las células, los cubreobjetos con células de los cultivos, se lavaron tres veces en PBS antes de fijarlos en una solución de metanol: acetona (7:3 v/v) durante 7 min. Luego de realizar el bloqueo de sitios inespecíficos con albúmina bovina al 1% en PBS durante 20 min , se añadió 50 µl de anticuerpo monoclonal anticitoqueratina en dilución 1:20 (v/v) en PBS con 0,5% de Triton X- 47 Materiales y Métodos 100. Sobre otros cubreobjetos se añadió solamente 50 µl de PBS con Triton X-100 sin ningún anticuerpo como testigos blanco de la técnica. Este preparado se empleó como control de anticuerpo secundario (control negativo). Todas las muestras se incubaron a 37 º C durante 2 h en cámara húmeda. Pasado este tiempo, los cubreobjetos se lavaron 3 veces con PBS y se incubaron con 500 ? l del segundo anticuerpo durante 1 h a 37 º C en cámara húmeda. Como anticuerpo secundario se empleó anti IgG de ratón obtenido en conejo conjugado con biotina, en una dilución 1:300 (v/v) en PBS más 0,5% de Triton X-100. Después de lavar 3 veces con PBS, se incubaron nuevamente con 500 µl de extravidina- FITC, en dilución 1:200 (v/v) a temperatura ambiente en cámara oscura durante 1 h. Finalmente se coloreó con 100 µl de Hoescht (0,2 mg/ml) a temperatura ambiente durante 10 minutos, para observar los núcleos celulares. Las muestras se analizaron mediante un microscopio de epifluores cencia (Olympus BX40). 4. Microscopía electrónica de barrido Para el estudio con Microscopía Electrónica de Barrido (MEB) se utilizaron muestras de Istmo y UUT de llama y de vicuña. Se utilizaron segmentos cortados en forma transversal para estudiar las distintas capas que componen dichos segmentos, y segmentos cortados longitudinalmente, a fin de exponer los pliegues de la mucosa. Las muestras se procesaron en el Laboratorio de Microscopía Electrónica del Noroeste Argentino (LAMENOA) para su observación. La metodología utilizada se describe brevemente a continuación. Los segmentos oviductales previamente fijados en solución de Karnovsky se lavaron en PBS 0.1M (pH 7.4), se posfijaron en 1% de tetróxido del osmio en la misma solución tampón durante 2 horas. Posteriormente fueron deshidratados en un gradiente de graduación creciente de etanol (25 a 100%) y acetona. Luego, las muestras fueron desecadas mediante punto crítico, montadas en soportes de aluminio de 3cm de diámetro (stubs), y finalmente metalizadas con oro para su observación. Las muestras fueron examinadas mediante un microscopio electrónico de barrido Jeol CF 35. Las imágenes más representativas de las observaciones realizadas se documentaron mediante microfotografías. 5. Microscopía electrónica de transmisión Para los estudios de Microscopía Electrónica de Transmisión (MET), las muestras fueron fijadas en solución de Karnovsky durante 24h, lavadas en PBS 0.1M, y luego posfijadas en tetróxido del osmio a 4ºC en la misma solución tampón. Finalmente las muestras fueron tratadas con una solución acuosa de Acetato de Uranilo al 2% durante 48 Materiales y Métodos 45min. La deshidratación de los tejidos fue llevada a cabo en una serie de alcoholes de graduación creciente seguida de acetona. La inclusión se realizó en la resina Spurr. Mediante ultramicrótomo se realizaron cortes ultrafinos que se contrastaron con acetato del uranilo y citrato del plomo. Los cortes ultrafinos se examinaron con un microscopio electrónico de transmisión Zeiss EM 109. Las imágenes más representativas se documentaron mediante microfotografías. 6. Experimentos in vivo para estudiar la interacción espermatozoides - oviducto de llama. 6.1. Ensayo in vivo con oviductos obtenidos a diferentes tiempos después de la cópula con machos normales Con el objeto de conocer cuánto tiempo después de la cópula los espermatozoides permanecen adheridos a la mucosa oviductal, se obtuvieron oviductos de hembras previamente inseminadas una sola vez por el macho. Los oviductos se disecaron a las 6, 18, 24, 28 y 35 horas poscópula. Los oviductos se clasificaron de acuerdo a la fase folicular del ovario en fase no madura (folículos dominantes menores a 7 mm) y en fase madura (folículo dominante mayor a 7 mm). El oviducto fue dividido en UUT, istmo, ámpula. Se ligó previamente el oviducto para evitar "deslizamientos" del semen , cuidando que las porciones de todos los oviductos tengan igual tamaño para que sean comparables los contenidos seminales. Los oviductos se perfundieron con 300 ul de buffer TRIS a 37º (para recuperar los espermatozoides no adheridos). Después, y por separado, se transfirieron las porciones oviductales al fijador correspondiente (formol tamponado 4% o Karnovsky) para estudios estructurales y ultraestructurales. Como controles se utilizaron hembras no inseminadas. 6.2. Ensayo in vivo con oviductos obtenidos 24 horas después de la copula con machos bulboretrectomizado Se aparearon hembras con ovario en fase madura, controlada mediante ultrasonografía, con machos bulboretrectomizados ya que se piensa que la característica viscosa del semen es debida a la secreción de las glándulas bulbouretrales. Como controles se usaron machos y hembras adultas de fertilidad probada pertenecientes a la Facultad de Ciencias Veterinarias UBA y al CEA INTA Abra Pampa de Jujuy. 24 horas después de la cópula las hembras fueron sometidas a cirugía con anestesia general a fin de obtener la porción craneal de los cuernos uterinos y ambos oviductos. Los oviductos se perfundieron con 500 ul de buffer Tris 49 Materiales y Métodos (Tris 20mM y NaCL 130 mM pH 7,4) a 37º C a fin de comprobar la presencia de espermatozoides y eliminar a los que se encuentran libres en el lumen oviductal. Posteriormente se separaron las regiones UUT e istmo, las que fueron fijadas y procesadas para MEB. 7. Experimentos in vitro para estudiar la interacción espermatozoides -oviducto 7.1. Ensayo de interacción espermatozoides – explantos de células oviductales de Unión Útero Tubal e Istmo Los explantos de UUT e Istmo se lavaron dos veces con TALP -Sp mediante centrifugación (100 x g, 3 minutos). El sobrenadante fue descartado y el pellet conteniendo los explantos se resuspendió en el mismo medio. Posteriormente alícuotas iguales de la suspensión de explantos de UUT e Istmo se agregaron, en forma separada, a 420 ul de espermatozoides (obtenidos según M&M IV.3) y se distribuyeron en tres placas de cultivo. La concentración final de espermatozoides fue 1 - 1.5 x 106 sperm / ml en cada placa. Se tomaron alícuotas de 10 ul cada 10 minutos para verificar la interacción espermatozoide - oviducto. Para ello se colocaron una gota de cada suspensión entre porta y cubreobjetos atemperados, y se observó al microscopio óptico. Al cabo de 1 hora de coincubación, los explantos junto con los espermatozoides unidos a ellos fueron fijados con 20 ul de paraformaldehido 12.5% durante 1 hora, y después lavados dos veces con medio fresco para remover los espermatozoides no adheridos. Los explantos se colorearon con Azul Tripan al 4% y se observaron en un microscopio Olympus Bx40 utilizando objetivos 40x y 100x y oculares 10x. 30 explantos de cada cámara de cultivo fueron fotografiados con cámara Olympus C-5060 a fin de determinar el número de espermatozoides unidos a cada explanto. 7.2. Ensayos de inhibición competitiva de la interacción espermatozoides – células oviductales con azúcares monosacáridos. Con el objeto de conocer si los glicoconjugados del glicocáliz del epitelio oviductal están involucrados en la interacción espermatozoide oviducto y cuál/es de ellos intervienen en dicha interacción, se realizaron ensayos de inhibición competitiva. Diferentes lotes de espermatozoides fueron preincubados con manosa, N-acetil galactosamina, galactosa ó glucosa y luego co-cultivados con explantos oviductales como se describe a continuación. ? Pre-incubación de espermatozoides con monosacáridos 50 Materiales y Métodos Se prepararon soluciones stock de 1 µg de monosacáridos / µl TALP-Sp para cada uno de los monosacáridos: Manosa, N-Acetyl D galactosamina, Galactosa o glucosa. Para la incubación se utiliza una suspensión de 1,6 x 106 espermatozoides/ml con una concentración final de monosacáridos de 10 ug/ml. Se incuba durante 20 minutos, se lavan las células y se mantienen a 4º C. Como control se usaron espermatozoides pre – incubados durante 20 minutos en TALP-Sp pero sin el agregado de azúcares. ? Cocultivo de explantos de células epiteliales oviductales con espermatozoides tratados A cada suspensión de espermatozoides se agregan 20 ul de una suspensión homogenea de explantos. La concentración final de espermatozoides en el cocultivo fue 1-1,5 x 106 espermatozoides/ml. Después de 1 hora de co-incubación, las muestras fueron fijadas con paraformaldehido 12.5% durante 2 horas (v/v), y lavadas tres veces por centrifugación suave. Los explantos se colorearon con Azul Tripan al 4% y se observaron en un microscopio Olympus Bx40. 30 explantos de cada cámara de cultivo fueron analizados y fotografiados con una cámara Olympus C-5060 a fin de determinar el número de espermatozoides unidos a cada explanto. 7.3. Definición del Índice de Unión (IU) El número de espermatozoides unidos a la cara de los explantos que mira al objetivo del microscopio fue contado. El área de los explantos fue determinada a partir de las imágenes digitales mediante el software Image-Pro Express (v. 5.1, Media Cybernetics). El Índice de Unión (IU) se define como el número espermatozoides unidos por cada 0.1 mm2 de explantos de células oviductales. 7.4. Análisis estadísticos La distribución de los IU de los explantos para cada tratamiento se graficó mediante diagrama de caja (Figura IV.1) La caja indica el rango en el que se concentran el 50% de los datos. Sus extremos son el 1er y 3er cuartil de la distribución (Q1 y Q3). La línea que corta la caja es la mediana (el valor de IU que deja el mismo número de datos antes y después que él). Los extremos en línea llena que salen de la caja son los valores que delimitan el 95% central de los datos. Los círculos indican los valores de IU que caen fuera de este rango (valores extremos). En el diagrama de caja también graficamos, mediante una línea delgada, el valor de la media para ese grupo de datos. 51 Materiales y Métodos Figura IV.1. Esquema de un diagrama de caja (box plot). Para estudiar las diferencias entre los IU de los distintos tratamientos se empleó el t-test no apareado, utilizando para ello el programa Sigma Plot v7.0. Valores de p < 0.01 se consideraron altamente significativos. 52 SECCIÓN D RESULTADOS Cap VI - Caracterización Del Oviducto De Llama Y Vicuña Capítulo VI - CARACTERIZACION DEL OVIDUCTO DE LLAMA Y VICUÑA VI.1. ANATOMÍA DEL OVIDUCTO DE LLAMA Y VICUÑA Se realizó la caracterización anatómica e histológica del oviducto de llama y de vicuña. Ambas especies presentan sólo algunas diferencias desde el punto de vista anatómico, las cuales serán descriptas más adelante. Podríamos considerar al tracto femenino como una serie de tubos interconectados. Cada uno de estos tubos posee características anatómicas diferentes y pueden identificarse fácilmente. Los componentes del tracto femenino, comunes a todos los mamíferos, son: los oviductos, el útero, el cérvix y la vagina (Figura VI.1). Los oviductos son dos órganos pares con forma de tubo convoluto. Uno de sus extremos (distal) se abre hacia la cavidad peritoneal y el otro extremo se comunica con la cavidad uterina. El oviducto está suspendido en el mesosalpinx, y se encuentra sumamente plegado cerca del ovario, formando un ovillo. El largo y el diámetro varían con la edad, el tamaño del animal, y la especie. Así, en el caso de la vicuña adulta, donde las hembras tienden a ser uniformes en peso y tamaño, tiene una longitud aproximada de 15 cm. En la hembra adulta de llama, debido a las diferencias en tamaño entre los diversos ecotipos, el oviducto varía entre los 14 y 25 cm de largo. Cuando, mediante disección, se separan los mesenterios pueden apreciarse las diferentes regiones oviductales: infundíbulo, ámpula, istmo y unión útero tubal (UUT), con características histológicas propias acordes con la función que realizan (Figura VI.2). El infundíbulo se continúa hacia caudal con el ámpula, ésta con el istmo, y finalmente conectando con los cuernos uterinos, la UUT. El extremo craneal del oviducto, el infundíbulo, es la región más cercana al ovario. Es una estructura en forma de embudo, que se presenta como una fina membrana que prácticamente envuelve al ovario. Su borde libre presenta flecos o fimbrias, que le permiten captar al ovocito luego de haber sido liberado a la cavidad peritoneal, durante la ovulación. La región del ámpula, de aproximadamente 3 cm, ocupa la región media y en ella ocurre la fecundación del ovocito. La unión entre istmo y ámpula generalmente está poco definida aunque a veces es posible diferenciar una constricción donde comienza el istmo. El istmo abarca aproximadamente la mitad de la longitud total del tubo, midiendo entre 7-8 cm. La UUT, como su nombre lo indica, es el segmento que une al oviducto con el cuerno uterino. Se distingue claramente por su forma convoluta y por su dureza al tacto debido al 54 Cap VI - Caracterización Del Oviducto De Llama Y Vicuña engrosamiento de las capas musculares. La UUT se proyecta en el cuerno uterino formando una constricción anatómica conocida como papila. VI.2. HISTOLOGÍA DEL OVIDUCTO DE LLAMA Y VICUÑA Considerando que las características histológicas del oviducto de ambas especies no presentan diferencias, he elegido describir las características histológicas del oviducto de vicuña por tratarse de un material al que es difícil acceder ya que es un animal silvestre protegido. La vicuña se encuentra incluida en el Apéndice II del CITES (Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres) que prohibe su caza. Las muestras analizadas en esta tesis provienen de una hembra que murió por accidente durante una captura para control sanitario. El estudio histológico del oviducto muestra que está constituido por tres capas bien definidas. La más externa es la túnica serosa, compuesta por un mesotelio y una capa delgada de tejido conjuntivo, que es una continuación del peritoneo y sirve de sostén del órgano. En la parte media se encuentra la túnica muscular. Esta capa es muy delgada en la región del infundíbulo y se va engrosando a medida que se aproxima al útero, es decir en el istmo. Está formada por músculo liso, el cual está organizado en una capa circular interna bastante gruesa y una capa longitudinal externa más delgada. El límite entre ambas es poco nítido. El lumen del oviducto está revestido por una capa de epitelio secretor conocido como túnica mucosa, la cual presenta numerosos pliegues longitudinales. Éstos son abundantes y tortuosos especialmente en la zona del infundíbulo, donde se pueden observar pliegues secundarios y terciarios. 55 Cap VI - Caracterización Del Oviducto De Llama Y Vicuña u v o ov A Figura VI.1: Aparato reproductor de una hembra de vicuña adulta: ovarios (o), oviductos (ov), útero (u) y parte de la vagina (v). B A D C Figura VI.2. Cortes histológicos de los distintos segmentos oviductales de una hembra de vicuña: Infundíbulo (A), Ámpula (B), Istmo (C) e UUT (D) coloreados con Tricrómico de Masson. Barras: 50 µm en A, B y D; 200 µm en C. 56 Cap VI - Caracterización Del Oviducto De Llama Y Vicuña El epitelio de la mucosa oviductal está constituido por un epitelio pseudoestratificado columnar que se compone de dos tipos celulares: células ciliadas y células no ciliadas con características de células secretorias. Las células ciliadas son abundantes en la región del infundíbulo y en el ámpula, y disminuyen hacia la UUT donde predominan las células no ciliadas. La mucosa oviductal descansa sobre la lámina basal, que la separa del tejido conectivo subyacente. En el caso particular de la UUT, debajo de la capa epitelial, puede distinguirse claramente una lámina propia de importante espesor, compuesta de tejido conectivo laxo y numerosos vasos sanguíneos y linfáticos. Esta lámina acompaña a los plegamientos de la túnica mucosa y posee numerosas glándulas tubulares, consideradas las primeras glándulas uterinas, que desembocan en el lumen oviductal. La mucosa del istmo, al igual que en otras especies, forma un patrón complejo de ramificaciones, originado por los plegamientos longitudinales de la mucosa. El lumen entre los pliegues secundarios de la mucosa es muy estrecho, midiendo solamente algunos micrones. Por debajo del epitelio se observa tejido conectivo laxo el cual pliega, junto con el epitelio, formando numerosos ramificaciones que reducen la luz del oviducto. A diferencia del istmo y de la UUT las paredes del ámpula son delgadas, observándose sólo pliegues primarios. El infundíbulo es más delgado aún, predominando los pliegues longitudinales. VI.3. ULTRAESTRUCTURA DEL OVIDUCTO DE LLAMA Y VICUÑA El estudio ultraestructural del oviducto, se focalizó en el epitelio de las dos regiones más caudales del oviducto, la unión útero tubal (UUT) y el istmo, las que en otras especies están involucradas en la interacción espermatozoide - oviducto. Para el estudio en Microscopía Electrónica de Barrido (MEB) se utilizaron muestras de istmo y UUT de llama y de vicuña. VI.3.1. Ultraestructura del oviducto de llama y vicuña Como fue descrito anteriormente, la mucosa oviductal presenta un complejo patrón de ramificaciones que aumenta hacia caudal (Figura VI.3). El epitelio de la mucosa es columnar pseudoestratificado (Figura VI.4) con alternancia de células ciliadas y células no ciliadas. Las células ciliadas se distinguen fácilmente por la abundante cantidad de cilias en 57 Cap VI - Caracterización Del Oviducto De Llama Y Vicuña la superficie apical. Las células secretoras poseen la superficie apical cubierta de microvellosidades. Característicamente, el citoplasma de éstas células suele protruir hacia el lumen lo que podríamos denominar procesos bulbosos (PB) (ver PB en la figura VI.5.A y en la figura VI.7). La disposición de ambos tipos celulares varía a lo largo del oviducto. En istmo la cantidad de células ciliadas es mayor, las que pueden observarse dispuestas en forma lineal entre las células no ciliadas. Estas características se observan tanto en llama como en vicuña (Figura VI. 6B). La observación de la UUT con MEB permitió distinguir dos regiones claramente diferenciadas: a) la región que desemboca en el cuerno uterino, con una formación papilar a modo de esfínter, en donde desembocan las glándulas de la UUT, formando una abertura de salida en forma de anillo. Esta región presenta únicamente células no ciliadas (Figura VI.6.A). Y b) la región que mira hacia el oviducto, en la cual se observa epitelio en mosaico donde las células ciliadas se ubican dispersas entre grupos de células no ciliadas, y no se observan aberturas de salida de conductos glandulares (Figura VI.6.B). Observaciones mediante MET determinaron que las células ciliadas poseen núcleos basales y presentan cilias cuyos cuerpos basales exhiben profundas raicillas ciliares con un patrón de estriación transversal característico. Las células secretoras de la UUT poseen un aparato de Golgi bien desarrollado y un núcleo central redondeado, alrededor del cual se disponen gránulos del glicógeno. Estas células se identifican por la presencia de cortas microvellosidades en su superficie y por gránulos secretorios de tamaño y densidad electrónica variable. La localización de los gránulos está restringida típicamente al citoplasma supranuclear, entre los cuales se observan mitocondrias redondeadas. El citoplasma apical de las células secretoras forma proyecciones citoplasmáticas apicales ya observadas por SEM y denominadas PB como se indicó anteriormente .Con frecuencia se observa que los PB se liberan a la luz oviductal por un mecanismo de secreción apocrina (Figura VI.7). Interesantemente, pueden distinguirse diferencias en cuanto al contenido de gránulos secretorios de las células secretoras de la UUT y las del istmo. En este último segmento los gránulos secretorios tienen mayor tamaño y distintos grados de electrodensidad, siendo de mayor tamaño en el borde apical de la célula. Los gránulos secretorios de la UUT son electrodensos y de menor tamaño que los descritos anteriormente. 58 Cap VI - Caracterización Del Oviducto De Llama Y Vicuña Al que igual que lo observado mediante histología, la ultraestructura de Istmo y UUT de vicuña no difiere de la observada en llama. El epitelio se encuentra compuesto por un mosaico de células ciliadas y células secretoras cuya distribución y ultraestructura es similar a la descrita en llama. 59 Cap VI - Caracterización Del Oviducto De Llama Y Vicuña A B C D Figura VI.3. Microfotografía obtenida con MEB que muestra la complejidad de los pliegues internos de dos segmentos adyacentes: istmo (A y C) y UUT (B y D). En A y B se pueden observar los pliegues de la mucosa que reducen la luz oviductal y las diferentes túnicas que forman este órgano. Comparando C y D se puede observar como la mucosa aumenta su grado de plegamiento desde la UUT hacia el istmo. Barra: A y B: 1 cm, C y D:100 µm 60 Cap VI - Caracterización Del Oviducto De Llama Y Vicuña ba e Figura VI.4. Microfotografía obtenida por MEB que muestra el epitelio de revestimiento de la UUT formado por células columnares (e). ba: borde apical de las células epiteliales. Barra: 10 µm pb cc A Figura VI.5. Microfotografía obtenida por MEB que muestra la distribución de los diferentes tipos celulares en superficie apical de la mucosa de istmo (A) y UUT (B) de llama. cc: células ciliadas, pb: procesos bulbosos de las células secretoras, mv: microvellosidades de las células secretoras. Barra: 1 µm. 61 Cap VI - Caracterización Del Oviducto De Llama Y Vicuña g Figura VI.6. Microfotografía obtenida por MEB de la cara uterina (A) y la cara oviductal (B) la UUT de vicuña. g: apertura de las glándulas secretoras en la superficie de la mucosa. Barra: 10 µm. Figura VI.7. Microfotografía del epitelio de la UUT de llama obtenida por MET. Pb: procesos bulbosos, flecha: gránulos secretorios (flecha). Barra: 5 µm. 62 Cap VI - Caracterización Del Oviducto De Llama Y Vicuña VI.4. CARACTERIZACIÓN DE MUCOPOLISACÁRIDOS DE LA MUCOSA OVIDUCTAL MEDIANTE HISTOQUÍMICA A fin de caracterizar los mucopolisacáridos del epitelio oviductal se realizaron estudios histoquímicos mediante la reacción del Ácido Periódico de Schift (PAS) que colorea carbohidratos y moléculas ricas en carbohidratos (mucopolisacáridos neutros) y la reacción con Azul de Alcián (AA) pH 2.5 que distingue a los mucopolisacáridos ácidos. Los oviductos se separaron en dos grupos según el folículo dominante del ovario sea mayor o menor a 7mm y se dividieron en UUT, istmo y ámpula. Secciones de aproximadamente 7µm fueron procesadas para PAS/AA. La coloración con PAS/AB reveló diferencias en el contenido de carbohidratos entre las células epiteliales de UUT, istmo y ámpula. En istmo y ámpula se destaca la intensa reacción PAS positiva en el citoplasma de las células secretoras de la mucosa, indicando presencia de carbohidratos y/o mucopolisacáridos neutros. Mediante la técnica utilizada no se detectaron diferencias entre istmo y ámpula en cuanto a la presencia y ubicación de los mucopolisacáridos, los que se observan coloreados en fucsia profundo (Figura VI.8). Se observa reacción positiva al AA y al PAS en la superficie de las células epiteliales de la UUT (Figura VI.9). Al comparar los oviductos de los dos estados fisiológicos estudiados no se observaron diferencias en el tipo y distribución de los mucopolisacáridos. 63 Cap VI - Caracterización Del Oviducto De Llama Y Vicuña Figura VI..8. Ámpula (A) e istmo (B) coloreados con PAS/AB. Los segmentos exhiben reacción PAS (rojo magenta) positiva en el citoplasma de las células no ciliadas. Las flechas indican sitios de reacción PAS positiva. Figura VI.9. UUT coloreada con PAS/AB. Se observa reacción positiva al AB y al PAS en la superficie de la mucosa. Barra:10 µm. 64 Cap. VI - Caracterización Del Oviducto De Llama Y Vicuña VI.5. CARACTERIZACIÓN DE LOS RESIDUOS AZUCARADOS DE LA MUCOSA OVIDUCTAL MEDIANTE LECTIN - HISTOQUÍMICA Conociendo que en otras especies de mamíferos, los azúcares de la superficie de la mucosa oviductal interactúan con los gametos y los embriones, se estudiaron los residuos glicosilados del oviducto de llama mediante lectinas fluorescentes que reconocen residuos de manosa, glucosa, galactosa, fucosa, ácido siálico, N Acetilgalactosamina y N Acetilglucosamina. Se usaron oviductos extraídos de animales que se encontraban en dos momentos diferentes del ciclo ovárico, clasificándolos en dos grupos según el folículo dominante sea mayor o menor a 7mm. Cada oviducto se dividió en ámpula, istmo y UUT. Se utilizaron las siguientes lectinas fluorescentes: WGA, WGA succinilado, UEA 1, DBA, RCA 120, Con A, PSA, LCA, PHA E, PHA L, GSL y SJA, conjugadas con FITC o Rhodamina. Los preparados se observaron mediante Microscopía Confocal Láser. Se observa la presencia de manosa, glucosa, galactosa, ácido siálico, N Acetilgalactosamina y N Acetilglucosamina a lo largo del oviducto de llama. Llamativamente, en el tejido incubado con UEA 1 no se observó señal fluorescente en ningún segmento por lo que se sugiere la ausencia de ? -fucosa, o bien su presencia en concentraciones por debajo del limite de detección del método. El análisis de los patrones de unión con las lectinas Con A, PSA y LCA indicó la presencia de abundantes residuos terminales de ? -manosa y ? - glucosa en la porción apical de las células epiteliales de ámpula (FiguraVI.10), istmo (Figura VI.11) y UUT (Figura VI.12) como así también en el tejido conectivo oviductal. Se observaron residuos de N - Acetil glucosamina y ácido siálico, detectados por unión a WGA y WGAs, en todos los segmentos estudiados, aunque se localizan de forma característica en cada uno de ellos. En ámpula y UUT (Figura VI.13) los residuos azucarados se localizan en el borde apical de la mucosa, mientras en istmo sólo están presentes en el citoplasma de las células secretoras de la mucosa, no así en las células ciliadas (Figura VI.14). Esta característica podría indicar que las células poseen una intensa actividad secretora, debido a que se conoce que el aparato de golgi reacciona con WGA. Mientras las lectinas DBA, RCA, SJA y GSL detectan residuos de Galactosa y N Acetil galactosamina, la lectina SBA detecta solamente N - Acetil galactosamina. Al compararlas observamos que ambos residuos azucarados están presentes en el oviducto. N 65 Cap. VI - Caracterización Del Oviducto De Llama Y Vicuña - Acetil galactosamina se localiza en sólo en algunas regiones del borde apical de la mucosa (Figura IV.15), mientras galactosa se localizaría en todo el borde apical de las células epiteliales (Figura IV.16). La comparación entre los dos estados fisiológicos estudiados no permitió distinguir diferencias en el contenido y distribución de los residuos azucarados. 66 Cap. VI - Caracterización Del Oviducto De Llama Y Vicuña Figura VI.10: Localización de a-manosa y a-glucosa en Ámpula detectada con ConA – Rodamina (rojo). Figura VI.11: Localización de a-manosa y aglucosa en Istmo detectada con PSA – FITC (verde). Los núcleos coloreados con DAPI se observan en azul. La flecha indica el borde luminal de las células epiteliales. 67 Cap. VI - Caracterización Del Oviducto De Llama Y Vicuña Figura VI.12: Localización de amanosa y a-glucosa en UUT detectada con PSA – FITC (verde). Los núcleos coloreados con DAPI se observan en azul. La flecha indica el borde luminal de las células epiteliales. B A A B Figura VI.13: Localización de NAcGlucosamina y Acido siálico en Ámpula (A) y UUT (B) detectada con WGA. En ámpula la lectina fue marcada con Rodamina (rojo), y en UUT con FITC (verde). Los núcleos coloreados con DAPI se observan en azul. Las flechas indican el borde luminal de las células epiteliales. 68 Cap. VI - Caracterización Del Oviducto De Llama Y Vicuña Figura VI.14: Localización de NAcGlucosamina y Acido siálico en Istmo detectada con WGA marcada con FITC (verde). Los núcleos coloreados con DAPI se observan en azul. Las flechas indican el borde luminal de las células epiteliales. A B Figura VI.15: A: Localización de a-N-Acetil Galactosamina y a-galactosa en UUT detectada con GSL. B: Localización de a-N-Acetil Galactosamina en UUT detectada con DBA. Las lectinas fueron marcadas con FITC (verde). Los núcleos coloreados con DAPI se observan en azul. Las flechas indican el borde luminal de las células epiteliales. 69 Cap. VI - Caracterización Del Oviducto De Llama Y Vicuña B A Figura VI.16: Localización de a-N-Acetil Galactosamina y a-galactosa en Ampula (A) e Istmo (B) detectada con RCA. En ámpula la lectina fue marcada con Rodamina (rojo), y en Istmo con FITC (verde). Los núcleos coloreados con DAPI se observan en azul. Las flechas indican el borde luminal de las células epiteliales. 70 Cap. VI - Caracterización Del Oviducto De Llama Y Vicuña VI.6. CARACTERIZACIÓN DE LOS RESIDUOS AZUCARADOS DE CÉLULAS EPITELIALES CULTIVADAS EN MONOCAPA DE MEDIANTE LECTIN – HISTOQUÍMICA Los cultivos celulares primarios ofrecen un modelo in vitro para el estudio de los fenómenos celulares que acontecen in vivo. Mediante la técnica de cultivos celulares descripta en materiales y métodos, se obtuvieron cultivos primarios de células del epitelio oviductal de llama y de vicuña Las células se adhirieron a la superficie del recipiente de cultivo entre las 48 y 72 h de cultivo, perdiendo su forma cuboide y exhibiendo forma estrellada. En los primeros días de cultivo se observaron clones celulares aislados, los cuales comenzaron a confluir a medida que las células se duplicaban, hasta cubrir toda la superficie de cultivo (Figura VI.17.A). Los clones celulares presentaban cilias en movimiento. Se observó que las células tardan aproximadamente 10 días para formar una monocapa de células poligonales cohesivas, observándose junto a ellas algunas células fibroblásticas (Figura VI.17.B). Para verificar que las células del cultivo no hubieran perdido su naturaleza epitelial, se realizó la detección de citoqueratinas como moléculas marcadoras de células epiteliales (Thibodeaux y col., 1992; Reischl y col., 1999). Para ello se empleó una técnica de inmunocitoquímica, con un anticuerpo monoclonal anticitoqueratina humana, el cual reconoce citoqueratinas de varias especies de mamíferos. Se observó la presencia de filamentos de queratina en las células cultivadas, las que en la mayoría de los cultivos alcanzaron un 90 a 95% de células citoqueratina positivas (Figura VI.18). Los controles realizados en los que no se agregó el anticuerpo primario dieron negativos. 71 Cap. VI - Caracterización Del Oviducto De Llama Y Vicuña B A B Figura VI.17: Microfotografías de cultivos primarios de células oviducales de vicuña coloreadas con hematoxilina - eosina,. A: Luego de 8 días de cultivo se observan células de morfología poliédrica, característica de las células epiteliales. B: En cultivos recientes (48h) se pueden observar dos tipos celulares coexistentes: células epiteliales poliédricas y células fibroblásticas alargadas. Figura VI.18: Microfotografía de un cultivo primario de células del epitelio oviductal de vicuña marcado con anticuerpo monoclonal anticitoqueratina mediante inmunofluorescencia. 72 Cap. VI - Caracterización Del Oviducto De Llama Y Vicuña A fin de verificar si las células en cultivo mantienen las características de su glicocáliz después de ser aisladas del resto de tejido oviductal, se estudió la presencia de los mismos residuos azucarados analizados en cortes de tejido con la misma metodología. La monocapa de células oviductales, obtenida sobre pequeños portaobjetos luego de 12 días de cultivo, se incubó con las lectinas ConA, WGA, PNA y DBA marcadas con FITC o Rodamina a fin de detectar la presencia de manosa, glucosa, NAcGlucosamina Terminal, galactosa y NAcetilGalactosamina. Las muestras se observaron con Microscopio Confocal Láser. Se confirmó que los azúcares detectados en la mucosa oviductal también se encuentran en las células epiteliales en cultivo (Figura VI.19 y VI.20) y que esta característica se mantiene luego de 12 días de cultivo. A diferencia de lo observado en cortes histológicos del epitelio oviductal, donde cada residuo azucarado se distribuye en forma característica, en los cultivos las lectinas presentan fluorescencia homogénea sobre el área de cultivo. 73 Cap. VI - Caracterización Del Oviducto De Llama Y Vicuña A B Figura VI.19. Localización de azúcares en monocapa de células epiteliales de llama en cultivo. A: En verde se observa ß galactosa que fue detectada con PNA marcada con FITC. B: En rojo NAcetilGalactosamina que fue detectada con DBA marcada con Rodamina. A B Figura VI.20 Localización de azúcares en monocapa de células epiteliales de llama en cultivo. A: vista frontal, B: vista transversal. En verde se observa a-d-manosa y a-dglucosa que fue detectada con ConA marcada con FITC. En rojo NAcGlucosamina terminal que fue detectada con WGA marcada con Rodamina. 74 Cap. VI - Caracterización Del Oviducto De Llama Y Vicuña CONCLUSIONES PARCIALES < El oviducto de llama y de vicuña poseen una estructura con características anatómicas, histológicas y ultraestructurales similares. < En el oviducto de CSA se pueden distinguir 4 segmentos claramente diferenciados: UUT, Istmo, Ámpula e Infundíbulo con características comunes a ambas especies. < Las diferencias ultraestructurales entre UUT y Istmo, en cuanto al tipo celular que compone el epitelio y su distribución, podrían asociarse a una diferente función de ambos segmentos. < El contenido de residuos azucarados parece no variar a lo largo del oviducto, lo que indicaría que no existirían diferencias regionales en la capacidad de adhesión mediada por carbohidratos a lo largo del oviducto. < Las células epiteliales en cultivo no presentan modificaciones en la composición de los azúcares del glicocáliz respecto a lo observado en el oviducto in situ. 75 Capítulo VII - Estudios in vivo para localizar el almacenamiento de espermatozoides en el oviducto de llama. Capítulo VII - ESTUDIOS IN VIVO PARA LOCALIZAR EL ALMACENAMIENTO DE ESPERMATOZOIDES EN EL OVIDUCTO DE LLAMA. Considerando que en llama el tiempo que transcurre entre la deposición del semen y la ovulación es de por lo menos 36 horas, los espermatozoides deben permanecer viables en el oviducto todo ese tiempo, lo que convierte a estos animales en un sistema biológico ideal para estudiar los mecanismos de la interacción espermatozoide- oviducto. Con el objeto de determinar si uno de los mecanismos involucrados es la formación de reservorios espermáticos en el oviducto, se obtuvieron oviductos de llamas que previamente fueron inseminadas por un macho. El estudio se enfocó en las regiones de istmo y UUT, las que en otras especies son sitios de almacenamiento de los espermatozoides. Los oviductos se obtuvieron a las 6, 18, 24, 28 y 35 horas después de la cópula y se separaron en dos grupos según el folículo dominante del ovario sea mayor o menor a 7mm. A fin de recuperar los espermatozoides presentes en el lumen oviductal, ámpula, istmo y UUT de todos los oviductos fueron aislados y perfundidos. La perfusión remueve los espermatozoides libres del lumen oviductal y aquellos débilmente adheridos a la superficie de la mucosa (Smith y Yanagimachi, 1990). En general el número de espermatozoides observado fue escaso y muy variable entre el mismo tipo de muestra de diferentes animales, pero pudieron detectarse variaciones entre istmo y UUT de un mismo experimento. Los espermatozoides estuvieron presentes en el líquido perfundido de la UUT en todos los tiempos poscópula observados, siendo el número de espermatozoides obtenido marcadamente superior que en líquido perfundido de istmo. En éste último sólo se observaron espermatozoides a las 18 y 24 horas después de la cópula. En el líquido perfundido de ámpula solamente se observó presencia de espermatozoides 35 horas después de la cópula (Figura VII.1). A nivel macroscópico, durante la disección de los oviductos, se constató proceso inflamatorio e hiperemia en la papila de la UUT de todas las hembras, independientemente del tiempo transcurrido desde la cópula. Ello fue corroborado al examinar los cortes histológicos, donde la mucosa y la submucosa se presentan invadidas de células sanguíneas (Figura VII.2). 76 Capítulo VII - Estudios in vivo para localizar el almacenamiento de espermatozoides en el oviducto de llama. Figura VII.1: Número total de espermatozoides recuperados del perfundido de UUT, Istmo y ámpula obtenido a las 6, 18, 24, 28 y 35 horas después de la cópula. Mediante microscopía óptica, microscopía electrónica de barrido (MEB) y microscopía electrónica de transmisión (MET) de los segmentos oviductales previamente perfundidos se analizó la presencia de espermatozoides adheridos a las paredes de los distintos segmentos aislados. Se observó que los espermatozoides estaban presentes sólo en la UUT y ausentes istmo y ámpula. A pesar de haber perfundido los segmentos, los cortes histológicos de UUT obtenida a diferentes tiempos poscópula mostraron subpoblaciones de espermatozoides en el lumen (Figura VII.3), los que se observaron aglutinados por una sustancia traslúcida (figura VII.4). Al colorear el tejido con PAS/AB, se observó que esta sustancia se colorea de azul, indicando contenido de mucopolisacáridos ácidos. Como se describió en el capítulo anterior, la misma reacción positiva al AB se observa en el glicocalix de las células epiteliales (Figura VII.5). 77 Capítulo VII - Estudios in vivo para localizar el almacenamiento de espermatozoides en el oviducto de llama. Además de los espermatozoides del lumen se observaron subpoblaciones de espermatozoides conglomerados en las profundidades de los pliegues de la mucosa y subpoblaciones de espermatozoides unidos a la pared de la mucosa. Los oviductos estaban presentes y la unidos a las células epiteliales de la UUT a las 6, 18, 24 y 28 horas después de la cópula, pero ausentes en las muestras de UUT obtenidas 35 horas poscópula. Mediante MEB se pudo comprobar que los espermatozoides se disponen en parches sobre el epitelio de las células epiteliales de la UUT y se encuentran recubiertos por una sustancia de aspecto laminar (Figura VII.6 A). Al MET los espermatozoides se observaron contiguos a la superficie de las células epiteliales y vinculados a una sustancia de baja electrodensidad (Figura VII.6 B). Es interesante destacar que esta sustancia sólo se detectó en los sitios de la mucosa donde se observaron espermatozoides. Interesantemente, los oviductos de hembras no apareadas no exhiben presencia de esta sustancia Mientras en la cara oviductal de la UUT se observa gran cantidad de espermatozoides en contacto con la mucosa, sobre la papila o sea la región que mira al útero, se observaron sólo unos pocos espermatozoides adheridos a la mucosa (Figura VII.7). Es interesante destacar que no observaron espermatozoides adheridos a la mucosa de UUT ni del istmo en las muestras de oviducto obtenidas 35 horas después de la cópula (Figura VII.8). El examen de los oviductos pertenecientes a dos estados foliculares diferentes no mostró diferencias. En ambos casos se encontraron espermatozoides adheridos a la mucosa de la UUT (Figura VII.9). 78 Capítulo VII - Estudios in vivo para localizar el almacenamiento de espermatozoides en el oviducto de llama. Figura VII.2.:. Imagen de un corte histológico de la papila de la UUT coloreada con hematoxilina-eosina. Puede notarse el gran contenido de células sanguíneas que invaden la submucosa (rojo). Barra 100um. Figura VII.3: Vista transversal de la UUT 24 hs poscópula coloreada con Hematoxilina – Eosina. Pueden observarse dos poblaciones de espermatozoides: una adherida al epitelio (E) y la segunda libre en la luz oviductal (flecha). Barra: 50 µm. Figura VII.4.: Vista transversal de un pliegue de la mucosa de la UUT 28 hs poscópula coloreada con Hematoxilina – Eosina. En la luz oviductal se observan espermatozoides libres asociados a una sustancia translucida (flecha). Barra: 20 µm. Figura VII.5.: UUT 24 horas después de la cópula coloreada con PAS/AB. Puede observarse como el contenido luminal (flecha) se colorea de azul, indicando la presencia de mucopolisacáridos ácidos. Barra: 20um 79 Capítulo VII - Estudios in vivo para localizar el almacenamiento de espermatozoides en el oviducto de llama. Figura VII.6.: Microfotografía de la interacción espermatozoides –UUT por MEB (A) y TEM (B). Nótese como la sustancia adhesiva, de baja electrodensidad se encuentra rodeando a los espermatozoides (S). En la imagen B, la flecha señala el borde de la célula epitelial. Barra 5 µm. B Figura VII.7.: Microfotografía de la UUT a las 18 horas postcópula obtenida por MEB. A: Papila de la UUT, unos pocos espermatozoides se encuentran en contacto con la mucosa y recubiertos por una sustancia adherente (SS) que cubre sólo algunos sectores del epitelio. B: UUT oviductal, numerosos espermatozoides cubriendo la mucosa y la presencia de la sustancia antes mencionada Barra 10 µm. 80 Capítulo VII - Estudios in vivo para localizar el almacenamiento de espermatozoides en el oviducto de llama. Figura VII.8.: Microfotografía de la UUT a las 35 horas postcópula obtenida por MEB. El epitelio se encuentra libre de espermatozoides y de la sustancia adherente. Barra 10 µm. A Figura VII.9.: Imagen Obtenida al Microscópio Electrónico de Barrido que muestra espermatozoides adheridos a la UUT 24 hs poscópula en hembra con folículo ovárico menor a 7 mm (A) y en hembra con folículo ovárico mayor a 7 mm (B). Una sustancia adhesiva recubre los espermatozoides y la mucosa oviductal. Barra 5 µm. 81 Capítulo VII - Estudios in vivo para localizar el almacenamiento de espermatozoides en el oviducto de llama. CONCLUSIONES PARCIALES < Los espermatozoides de llama se almacenan preferencialmente en la UUT en comparación con el istmo y el ámpula < Una sustancia de origen desconocido adhiere los espermatozoides a la mucosa de la UUT. < Durante la fase preovulatoria, el almacenamiento de espermatozoides en la UUT sería independiente del tamaño del folículo. <Los espermatozoides se mantienen en la UUT hasta, al menos, 28 horas después de la cópula. < No se encontraron espermatozoides en la UUT 35 horas después de la cópula. Se plantea la posibilidad que sean liberados cerca del momento de la ovulación. 82 Capítulo VIII - Estudios in vitro para determinar la capacidad de las células oviductales para adherir espermatozoides. Capítulo VIII - ESTUDIOS IN VITRO PARA DETERMINAR LA CAPACIDAD DE LAS CÉLULAS OVIDUCTALES PARA ADHERIR ESPERMATOZOIDES Los diferentes segmentos oviductales presentan diferencias en relación al tipo celular que los compone como así también a la distribución de las células ciliadas y no ciliadas en la mucosa oviductal. Dado que estos dos tipos celulares presentan diferencias ultraestructurales en su superficie, es probable que la capacidad para adherir espermatozoides varíe en función de su distribución y abundancia particular en los diferentes segmentos. Por este motivo se evaluó la capacidad de células aisladas de UUT y de Istmo para unir espermatozoides mediante métodos in vitro. Las células epiteliales de UUT y de istmo fueron obtenidas separadamente y cultivadas como se indica en Materiales y Métodos. Al cabo de 24 horas, la mayoría de las células habían formado conglomerados con estructura esferoidal, compuestos por células epiteliales ciliadas y células secretoras, denominados explantos como se anticipa en Materiales y Métodos (Figura VIII.1). Las células se disponen con la superficie apical hacia fuera por lo que las cilias al moverse producen el desplazamiento de los explantos en el medio de cultivo. Los explantos de células epiteliales de la UUT y de células epiteliales de Istmo fueron distribuidos cada uno en tres placas de cultivo. Con el objetivo de estudiar la posible unión diferencial de los espermatozoides a los explantos de estas dos regiones se co-incubaron con espermatozoides según se explica en Materiales y Métodos. Los espermatozoides comenzaron a unirse a las células epiteliales de ambas regiones luego de 45-50 minutos de co-incubación. Al cumplirse 1 hora de co-cultivo se fijaron los explantos para su posterior análisis por Microscopía Óptica. Se comprobó la adhesión de los espermatozoides tanto a las células de la UUT como a las células del istmo. Los espermatozoides se distribuyeron en forma variable sobre los explantos: denso en algunas áreas, escaso en otras e incluso ausente en otras. Una particularidad a destacar es que la adhesión de los espermatozoides a las células epiteliales se realiza tanto por la cabeza como por diferentes sectores de la cola (Figura VIII.2). 83 Capítulo VIII - Estudios in vitro para determinar la capacidad de las células oviductales para adherir espermatozoides. Figura VIII.1.: Explanto formado por células epiteliales de Istmo coloreado con Azul Tripán y observado con microscopio de contraste de fase. Barra 10 µm. Figura VIII.2.: Explanto de UUT coloreado con Azul Tripán y observado con microscopio óptico. Las estrellas indican algunos núcleos de las células epiteliales. Barra 10 µm. Figura VIII.3.: Diagrama de caja que muestra la distribución de los valores de IU (número de espermatozoides por 0.1 mm2 ) en UUT e Istmo. a: mediana, b: media. 84 Capítulo VIII - Estudios in vitro para determinar la capacidad de las células oviductales para adherir espermatozoides. El área de los explantos obtenidos varió entre 900 ? m2 y 28.000 ? m2. Con el objeto de estandarizar las observaciones, sólo se consideraron los explantos oviductales con áreas entre 2.000 y 10.000 ? m2. La capacidad de adherir espermatozoides se calculó mediante un índice de unión que indica el número de espermatozoides adheridos por unidad de superficie. Se analizaron las superficies de explantos correspondientes a un área total de 184.638,23 ? m2 de explantos de istmo, y 202.193,88 ? m2 de UUT. En la figura VIII.3 se observa la distribución de los valores de IU para UUT e istmo respectivamente. El Índice de Unión (IU) para los explantos de istmo (n=71) fue 613,86 ± 34,05 espermatozoides/0.1 mm2 (Media ± Error Standard,), y el correspondiente de UUT (n=51) fue 1203,69 ± 70,21 espermatozoides /0.1 mm2 (Media ± Error Standard). El análisis estadístico de los datos mostró que las diferencias entre los IU de UUT e Istmo son altamente significativas (p=0.000015). 85 Capítulo VIII - Estudios in vitro para determinar la capacidad de las células oviductales para adherir espermatozoides. CONCLUSIONES PARCIALES < Las células epiteliales de UUT e istmo mantienen su capacidad de adherir espermatozoides al ser cultivadas in vitro. < In Vitro, las células de la UUT presentan mayor capacidad de unir espermatozoides por unidad de superficie que las células del Istmo. Esto coincide con lo observado in vivo. 86 Capítulo IX - Estudios de la interacción espermatozoides -oviducto mediada por carbohidratos Capítulo IX - ESTUDIOS DE LA INTERACCIÓN ESPERMATOZOIDES OVIDUCTO MEDIADA POR CARBOHIDRATOS El objetivo fue conocer si los carbohidratos de la superficie de las células epiteliales oviductal podrían estar participando en el almacenamiento de los espermatozoides. Se conoce que los espermatozoides de otras especies presentan moléculas tipo lectinas en su superficie. Estas moléculas serían capaces de reconocer uno o varios tipos de azúcares de la superficie oviductal. Nosotros pensamos que en la adhesión de los espermatozoides al oviducto de llama podría estar involucrado un sistema de reconocimiento entre carbohidratos del epitelio oviductal y lectinas de la membrana espermática de los espermatozoides homólogos. El (los) glicoconjugado(s) involucrado(s) en esta interacción varia según la especie animal, de modo que si existe este sistema de reconocimiento en llama, el azúcar involucrado podría ser distinto al descrito para otras especies. En experimentos preliminares se identificaron los residuos azucarados presentes tanto en el glicocalix de células de la mucosa oviductal como de células epiteliales cultivadas en monocapa por lectinhistoquímica observadas mediante microscopía confocal láser. En este capítulo, mediante ensayos de interacción competitiva, se estudia cuál/les azúcares interaccionan con posibles lectinas presentes en el espermatozoide de llama. IX.1. Inhibición competitiva por monosacáridos de la unión de los espermatozoides al oviducto Como se mencionó anteriormente, en la adhesión de los espermatozoides de mamífero a la mucosa oviductal estaría involucrado un sistema de reconocimiento entre carbohidratos de la superficie oviductal y lectinas dependientes de calcio de la membrana espermática. Esta interacción parece realizarse de un modo especie-específico: en hámster es mediada por el ácido siálico, en bovinos por fucosa, mientras que en equinos es mediado por galactosa. Los experimentos previos, realizados mediante lectinhistoquímica, demostraron que las células oviductales presentan en su superficie glucosa, galactosa, manosa, N Acetil glucosamina y N Acetil galactosamina. No se detectó fucosa. También se comprobó que la UUT tiene mayor capacidad que el istmo para adherir espermatozoides. 87 Capítulo IX - Estudios de la interacción espermatozoides -oviducto mediada por carbohidratos En estos ensayos de interacción competitiva se utilizaron células epiteliales aisladas de UUT. Las células se cultivaron hasta formar explantos tal como se describe en Materiales y Métodos. Los espermatozoides fueron previamente incubados con alguno de los siguientes azucares: glucosa, manosa, galactosa ó N-Acetilgalactosamina. Posteriormente estos espermatozoides previamente lavados se co-cultivaron con los explantos de UUT. El azúcar capaz de impedir o disminuir la adhesión de los espermatozoides a las células epiteliales posiblemente estaría involucrado en la unión respectiva. Como control se co-cultivaron los explantos de UUT con los espermatozoides preincubados en ausencia de azúcares. El área de los explantos de UUT obtenidos varió entre 900 ? m2 y 25.000 ? m2. Con el objeto de estandarizar las observaciones, sólo se consideraron los explantos oviductales con un área no mayor a 10.000 ? m2, rango en el cual se encontraba la mayoría de las muestras. El análisis cuantitativo de la unión espermatozoides - explantos de UUT para cada uno de los azúcares se realizó mediante el Índice de Unión (IU). En la figura IX.1 se observa la distribución de los valores de IU para cada tratamiento representados en gráfico de caja. Los valores medios del IU de los diferentes tratamientos se compararon con los valores de IU del control. Se observó que todos los azúcares ensayados disminuían la adhesión de los espermatozoides con respecto al control (Tabla IX.1). Al comparar estadísticamente, mediante t test, los valores promedio del IU de cada uno de los tratamientos con el control se determinaron diferencias altamente significativas (p< 0.01) galactosamina y Galactosa. 88 para los azúcares N Acetil Capítulo IX - Estudios de la interacción espermatozoides -oviducto mediada por carbohidratos Tratamiento Nº de espermatozoides/ 0.1 mm2 (Media ± ES) Nº de Muestras Manosa Glucosa N Acetil Control Galactosa 831 ± 70 464 ± 59 85 75 50 82 78 202.193 176.371 172.708 245.551 248.041 0,0001? 0,036 0,247 0,00001? 617 ± 55 733 ± 44 Galactosamina 456 ± 38 Area Total Estudiada (µm2) Valor de p Tabla IX.1. Valores medios ± Error Standard para los Índices de unión de espermatozoides pretratados con los azúcares indicados a explantos de UUT (? altamente significativo p<0.01). Figura IX.1.: Gráfico de caja que muestra la distribución de los valores de IU para cada tratamiento. a: mediana, b: media. 89 Capítulo IX - Estudios de la interacción espermatozoides -oviducto mediada por carbohidratos IX.2. Sitios de unión para N-Acetil galactosamina en espermatozoides de llama A fin de conocer si los espermatozoides de llama presentan en su superficie sitios de unión a alguno de los azúcares detectados como involucrados en la adhesión espermatozoides – oviducto, se investigaron éstos sitios de unión. Siendo N- Acetil galactosamina uno de los azúcares que en experimentos de inhibición competitiva impidió la adhesión en forma más significativa. Se utilizó la técnica de marcación directa con este azúcar marcado con FITC. La microscopía de fluorescencia mostró sitios de unión a N- Acetil galactosamina distribuidos en todo el espermatozoide. Los espermatozoides en este ensayo fueron aislados de dos eyaculados obtenidos por vagina artificial, cada uno de un macho fértil. Nos preguntamos entonces si la posible molécula similar a lectina que reconocía NAcetil galactosamina, presente en el espermatozoide, también se encontraba en los espermatozoides que todavía no habían sido eyaculados. Para ello usamos espermatozoides extraídos de cola de epidídimo. Interesantemente, los espermatozoides de epidídimo no mostraron la capacidad de unir N-Acetil galactosamina marcada (Figura IX.2 y IX.3). 90 Capítulo IX - Estudios de la interacción espermatozoides -oviducto mediada por carbohidratos Figura IX.2.: A: Espermatozoide control en campo oscuro, la flecha señala una débil fluorescencia intrínseca. B: Espermatozoide control en contraste de fase C: Espermatozoides incubados con N-Acetil galactosamina – PAA –FITC. Puede observarse fluorescencia en todo el espermatozoide, la flecha indica la cabeza del espermatozoide. D: El mismo espermatozoide en contraste de fase. Barra: 10 µm 91 Capítulo IX - Estudios de la interacción espermatozoides -oviducto mediada por carbohidratos Figura IX.3.: A: Espermatozoides epididimales en campo oscuro, la flecha señala una débil fluorescencia intrínseca. B: Espermatozoides epididimales en contraste de fase C: Espermatozoides epididimales incubados con N-Acetil galactosamina – PAA –FITC, la flecha indica la cabeza del espermatozoide. D: Imagen de los espermatozoides en contraste de fase. Barra: 10 µm 92 Capítulo IX - Estudios de la interacción espermatozoides -oviducto mediada por carbohidratos CONCLUSIONES PARCIALES < Existe un sistema de reconocimiento de azúcares de la superficie de la mucosa oviductal por parte del espermatozoide de llama. < De los 4 azúcares estudiados y presentes en el oviducto de llama, los azúcares Galactosa y N-Acetilgalactosamina parecen interactuar con el espermatozoide. < La molécula capaz de reconocer éste azúcar podría incorporarse a la membrana del espermatozoide epididimal durante la eyaculación, por aporte del plasma seminal. 93 Capítulo X - Participación del semen en la formación de reservorios espermáticos Capítulo X - PARTICIPACION DEL SEMEN EN LA FORMACIÓN DE RESERVORIOS ESPERMÁTICOS Todos los estudios realizados hasta este momento parecen indicar que la Unión Utero Tubal (UUT) sería el sitio de almacenamiento de espermatozoides en llama. También los resultados indican que en la adhesión al epitelio oviductal intervendría una sustancia de origen no determinado que se pega tanto a los espermatozoides como a la mucosa del oviducto. Aunque se presumía su origen seminal, ya que no la observamos en los oviductos de hembras no copuladas, no puede descartarse un origen oviductal relacionado a algún estímulo secretorio producido por el macho durante la cópula. Considerando las características particulares del semen de llama que presenta una alta viscosidad, con propiedades físico químicas aun no determinadas que le otorgan la particularidad de no licuarse por incubación a 38º C (observaciones personales), se consideró fuertemente la posibilidad que el material adherente observado en el oviducto fuera de origen seminal. Para proveer algún tipo de evidencia en ese sentido se aparearon hembras con ovario en fase madura, controladas mediante ultrasonografía, con machos a los que se les eliminó el factor de viscosidad del semen mediante extirpación de las glándulas bulbouretrales. Veinticuatro horas después de la cópula, las hembras fueron sometidas a cirugía con anestesia general a fin de obtener la porción caudal de los cuernos uterinos y ambos oviductos. Los oviductos se perfundieron con buffer Tris a fin de eliminar aquellos espermatozoides que se encontraban libres en el lumen oviductal o bien levemente adheridos a las paredes del mismo. Posteriormente, la mucosa de UUT e istmo fueron observadas mediante MEB. Como controles se usaron machos y hembras adultos de fertilidad probada. Las observaciones realizadas en la UUT de las hembras apareadas con machos no bulboretrectomizados (normales) muestran claramente la presencia de espermatozoides adheridos a la mucosa oviductal mediante una sustancia de aspecto laminar que se distribuye en parches. En otras regiones del oviducto no se observaron espermatozoides adheridos ni la presencia de la sustancia adherente, en concordancia con estudios preliminares que indicaban a la UUT como la región de almacenamiento espermático. Por el contrario, en el oviducto de las hembras apareadas con el macho bulboretrectomizado no se observaron espermatozoides adheridos a la mucosa oviductal ni la presencia de sustancia adherente en UUT e Istmo (Figura X.1). 94 Capítulo X - Participación del semen en la formación de reservorios espermáticos cs A B Figura X.1.: Imagen Obtenida al Microscopio Electrónico de Barrido que muestra el epitelio de la UUT 24 hs después de la cópula con macho bulboretrectomizado (A) y después de la cópula con machos control (B). cs: célula secretora. Barra: 1 µm. 95 Capítulo X - Participación del semen en la formación de reservorios espermáticos CONCLUSIONES PARCIALES < Elementos del plasma seminal estarían involucrados en la adhesión de los espermatozoides al oviducto. < Los mismos parecen ser partícipes necesarios para la formación de reservorios espermáticos oviductales in vivo. 96 SECCIÓN E DISCUSIÓN Discusión Como en otros mamíferos, el oviducto de llama se divide en cuatro segmentos: unión útero tubal (UUT), istmo, ámpula e infundibulo. Como se ha mencionado anteriormente, el oviducto cumple numerosas funciones en el proceso reproductivo. En esta tesis hemos estudiado su función como reservorio espermático. Los reservorios de espermatozoides aseguran la presencia de espermatozoides viables y fértiles en el oviducto hasta el momento de la ovulación para garantizar que se produzca la fecundación. Como consecuencia de la presencia de estos reservorios se produce la selección de una subpoblación de espermatozoides, que tiene muchas posibilidades de fecundar el ovocito (revisado por Scott, 2000). De los segmentos oviductales, la UUT es considerada en varios mamíferos como una barrera anatómica y fisiológica para el pasaje de los espermatozoides (Suarez y Pacey, 2006; Hunter, 2005). En llama, este segmento forma anatómicamente una constricción convoluta que se proyecta hacia el útero formando una pequeña papila. Al examinar el lumen de la UUT, observamos un espacio virtual que aparece como un intrincado laberinto formado por los numerosos y complejos pliegues de la mucosa. Este diseño estructural supone una barrera a la migración de los espermatozoides desde el cuerno uterino, donde son depositados, hacia el ámpula. El abrupto estrechamiento del lumen de la UUT, sumado a los profundos e intrincados surcos que forman los pliegues de la mucosa contribuiría a retener a los espermatozoides, facilitando la interacción entre ellos y las células de la mucosa. En otros animales se ha demostrado que es frecuente la formación de reservorios espermáticos originada por la adhesión de los espermatozoides a las células epiteliales del istmo o UUT (Smith y Yanagimachi, 1990, Suárez y col., 1998, Hunter, 2005). Por ejemplo, en el caso de la yegua, los reservorios están situados en la UUT, en hámster en el istmo caudal y en la cerda se encuentra en ambos, UUT e Istmo (ver Scott, 2000). Se conoce que la adhesión de los espermatozoides al oviducto es firme, y que mediante perfusión del oviducto se recuperan los espermatozoides libres en el lumen pero no aquellos adheridos a la mucosa (Smith y Yanagimachi, 1990). Dicha adhesión se estudió en otras especies mediante observación directa de la mucosa oviductal por MO (Smith y Yanagimachi, 1991, Chatdarong y col, 2004) y por MEB (Lefebvre y col., 1995, Mburu y col, 1996). En esta tesis se estudió la presencia de espermatozoides posteriormente a la copula en el oviducto de llama tanto de las subpoblaciones libres en el lumen oviductal como las adheridas a la mucosa. 98 Discusión Mediante MO y MEB de la mucosa de istmo y UUT se observó que los espermatozoides se adhieren solamente al epitelio de la UUT en todas las muestras tomadas desde la cópula hasta las 28 horas después de la misma. Considerando que en llamas la ovulación se produce entre 26 a 42 horas después de ocurrida la cópula (Adams y col., 1990), se estudió también la presencia de espermatozoides adheridos a la mucosa de istmo y UUT de oviductos obtenidos 35h después. Interesantemente, cuando la ovulación ya aconteció, no se encontraron espermatozoides en contacto con la mucosa. Si comparamos estos resultados con los obtenidos acerca de la presencia de espermatozoides en el perfundido oviductal que indican un incremento en la proporción de espermatozoides libres en lumen a las 35h, podemos pensar que los espermatozoides que estaban adheridos a la UUT se liberan al momento de la ovulación con el fin de ascender hasta el ámpula para fecundar al ovocito. En la alpaca, Bravo y col. (1996) estudiaron el fluido obtenido por perfusión del oviducto poscópula y observaron que en las primeras 12h la mayoría de los espermatozoides se encontraban en la UUT; 6h después, la mayor proporción estaba en istmo, pero luego llamativamente, cercano al momento de ovulación (24 y 30h poscópula) la mayor proporción estaba presente en el perfundido de la UUT. Los autores postulan un flujo retrógrado hacia la UUT para explicar estos resultados ya que no realizan un estudio de los espermatozoides adheridos. Nosotros al estudiar las dos poblaciones: espermatozoides libres y adheridos, podemos argumentar con mayor certeza que aunque pueda existir algún tipo de reflujo también hay espermatozoides que se liberan de la mucosa en la UUT en este tiempo. Este mecanismo de regulación de las subpoblaciones de espermatozoides en el oviducto concuerda con lo reportado en otras especies (Hunter y col., 1991, Hunter, 1995, Mburu y col., 1997). En esta tesis se localizaron espermatozoides adheridos al epitelio de la UUT cuando el ovario se encuentra tanto en fase de madurez folicular como cuando se encuentra en fase no madura, lo cual sugeriría que el oviducto es capaz de retener espermatozoides en ambas etapas y regular la presencia de espermatozoides fértiles al momento de la ovulación. Ello está de acuerdo con lo conocido de que la hembra de los camélidos sudamericanos puede copular a cualquier tiempo de la fase folicular del ciclo ovárico (Adams y col., 1990). Pero aunque puede cruzarse, ello no significa que pueda quedar preñada ya que el ovario solamente responde al estímulo de la cópula (ovulación) cuando el folículo se encuentra en fase madura (Tibary y col., 2006). No tenemos evidencias acerca del papel que juegan las hormonas ováricas en la liberación de los espermatozoides desde los reservorios espermáticos pero en otros ovuladores reflejos como conejo, los espermatozoides se acumulan en el istmo 99 Discusión luego de la inseminación artificial, y sólo se despegan por acción de las hormonas liberadas al momento de la ovulación pudiendo ascender hasta el ámpula (Overstreet y col., 1979). Es claro que en el oviducto de llama se constituye un reservorio preovulatorio de espermatozoides en la UUT. En consecuencia consideramos importante conocer cuáles son los factores que definen que los espermatozoides se adhieran a este segmento en particular. ¿Las células de la mucosa de la UUT poseen características especiales o los espermatozoides se adhieren porque es la primera región que encuentran en su ascenso por el oviducto? Nuestros resultados al MO, MET y MEB demuestran que la UUT y el istmo, dos segmentos adyacentes postulados en otros mamíferos como reservorios, presentan diferencias en relación a la ultraestructura de las células secretoras y a la distribución de los distintos tipos celulares en la mucosa. Hemos observado, tanto a nivel histológico como ultraestructural, que el epitelio oviductal de llama se encuentra tapizado por dos tipos de células, ciliadas y secretoras, las que se distribuyen de manera diferente entre un segmento y otro: mayor cantidad de células ciliadas en istmo y mayoría de células secretoras en UUT. Estas observaciones coinciden con lo descrito en conejas (Gaddum - Rosse y Blandau, 1975), monas (Odor y col., 1980), cerdas (Hunter y col., 1987), vacas (Hunter y col., 1991) y yeguas (Ball, 1996). Las células secretorias de la UUT presentan algunas particularidades específicas con respecto a las del istmo: la membrana apical presenta micro vellosidades y los gránulos de secreción son más electro densos. Las distintas características celulares mas la diferente distribución de las células secretorias en istmo y UUT, nos hicieron pensar que podría existir una diferente capacidad entre ambas regiones para unir espermatozoides. Para demostrarlo se utilizó un sistema in vitro de cocultivo de explantos oviductales con espermatozoides que nos pareció una metodología útil para investigar la interacción entre los espermatozoides y las células oviductales sin la intervención de sustancias externas al sistema. Debe enfatizarse que las observaciones fueron realizadas durante un tiempo de incubación relativamente corto en un sistema sin la modulación endocrina local. En este estudio hemos determinado que superficies de explanto de hasta 10.000 µm2 nos proporcionarían los resultados más repetibles. En bovinos los resultados más reproducibles se han encontrado trabajando con explantos de oviducto menores a 20.000 µm2 (De Paw y col., 2002). La adhesión se cuantificó mediante el índice de unión, que considera el número de espermatozoides adheridos por unidad de superficie de explanto. Diversos autores coinciden en que el IU constituye un valor confiable para detectar la afinidad de los espermatozoides 100 Discusión por las células oviductales, existiendo una correlación positiva entre este índice y la tasa de no retorno en vacas. (De Pauw y col., 2002). Nuestros resultados en llama mostraron que los espermatozoides se unen preferentemente a las células de la UUT con respecto a las del istmo. También en la especie equina la interacción es afectada por el origen anatómico de los explantos presentando mayor capacidad Istmo que ámpula, lo que junto a otros experimentos lleva a postular que el reservorio espermático en yeguas se encuentra en la región ístmica (Thomas y col., 1994). Lamentablemente no existen datos acerca de la capacidad de UUT que nos permitan comparar nuestros resultados ( ver revisión Troedsson y col, 1998). En otras especies como la porcina y bovina, el número de espermatozoides adheridos a los explantos oviductales no dependió de la región del oviducto (Petrunkina y col., 2001, Lefebvre 1995). Las evidencias indirectas indican que en todos los mamíferos estudiados, la adhesión de los espermatozoides a las células oviductales in vivo es un prerrequisito para la fecundación. Nuestras observaciones directas de la mucosa de oviductos obtenidos después del apareamiento, demuestran la ausencia de espermatozoides adheridos al istmo. Sin embargo in vitro los espermatozoides son capaces de unirse a los explantos de istmo. Nuestra idea es que ambas regiones oviductales (Istmo y UUT) presentan sitios de adhesión para el espermatozoide. Sin embargo dado que la UUT representa una importante barrera anatómica como se describe en el Cáp. VI de esta tesis, se convierte de hecho en el reservorio espermático. Esto sumado a que el espermatozoide de llama se caracteriza por poseer baja movilidad progresiva explicaría porqué los espermatozoides pueden unirse a las células del istmo in vitro pero no in vivo donde las barreras anatómicas sí están presentes . Además la motilidad espermática sería importante in vivo para el ascenso de los espermatozoides hasta el istmo. In vitro, al descartar estos dos factores de influencia in vivo, las células de ambos segmentos estarían igualmente accesibles a los espermatozoides. Existe evidencia de que la unión de los espermatozoides al oviducto involucra un reconocimiento específico de uno o más oligosacáridos del epitelio oviductal por parte de los espermatozoides (Suarez y col., 1997, Green y col., 2001; Gwathmey y col., 2003). Como una primera aproximación al conocimiento de los carbohidratos de la mucosa oviductal, se realizó la caracterización histoquímica del oviducto de llama mediante la técnica de PAS/AB y se detectaron diferencias entre la mucosa de la UUT y la de istmo, los dos segmentos oviductales que, tanto in vivo como in vitro, demostraron diferente capacidad para unirse a 101 Discusión los espermatozoides. Mientras se observa que la superficie apical de las células epiteliales de la UUT se detectan mucopolisacáridos ácidos y mucopolisacáridos neutros, en istmo prevalecen sólo los mucopolisacáridos neutros. Estudios similares indicaron presencia de mucopolisacáridos ácidos y neutros a lo largo del oviducto de bovinos y porcinos donde el patrón de reacción PAS/AB parece no variar entre segmentos (Suarez y col., 1997, Johansson y col., 2000). Sin embargo, ya que la histoquímica por PAS/AB puede detectar una gran variedad de moléculas, estas observaciones no permiten asegurar que los carbohidratos de la mucosa del oviducto de llama sean distintos de los observados en otras especies. A fin de detectar específicamente algunos residuos azúcares realizamos lectinhistoquímica en oviducto de llamas con ovarios con folículos maduros e inmaduros para tratar de dilucidar algún tipo de regulación hormonal de dichos carbohidratos ( Ver resultados Cap. VI). La utilización de distintas lectinas que localizan el mismo tipo de azúcar pero que están unidas a la glicoproteína por distinta posición, permitió confirmar la presencia o ausencia de algunos residuos azucarados. Los estudios de afinidad de lectinas detectaron residuos terminales de ? -manosa, ? - glucosa, Galactosa, N-acetil glucosamina, ácido siálico y N acetil galactosamina. El tipo de carbohidratos presentes en el oviducto de llama parece ser característico para camélidos, así como su distribución en la superficie epitelial oviductal. Por ejemplo, mediante la lectina UEA1 que reconoce residuos de a –L-Fucosa determinamos que este azúcar se encontraría ausente en el oviducto de llama, mientras que en bovinos no sólo está presente sino que se ha demostrado que el espermatozoide bovino se une al oviducto por reconocimiento de residuos fucosilados (Lefebvre y col., 1997, Gwathmey y col., 2003). El oviducto de rata también tendría residuos de fucosa detectados por unión a la misma lectina (Cortés y col., 2004). En llama observamos que los residuos azucarados estudiados se encuentran presentes en ámpula, istmo y UUT. En otras especies se han reportado diferencias regionales en este sentido. En el oviducto de la cerda N Acetil galactosamina sólo se encuentra en el ámpula mientras que fucosa sólo en el istmo caudal (Walter y col., 1997). Aparentemente no existiría variación en la composición de carbohidratos, al menos los estudiados, en relación a la concentración de estradiol ya que las dos fases de la onda folicular presentan el mismo patrón en llamas. Esto coincide con lo observado en el oviducto de la cerda, donde no habría diferencias entre proestro y estro (Walter y col., 1997; Raychoudhury y col., 1993). En estas dos etapas del ciclo estral el estradiol es la hormona principal, al igual que en las fases estudiadas en llama como se mencionó anteriormente. En llamas es de esperar que, en caso 102 Discusión de estar involucrado un sistema de reconocimiento carbohidratos-espermatozoide, el azúcar que medie esta interacción se encuentre presente en los dos estadíos, ya que la hembra es receptiva en ambas fases. Esta premisa coincide con los resultados obtenidos in vivo ya que hemos observado espermatozoides unidos al oviducto de llama en ambas fases foliculares. El conocimiento acerca de cuáles son los azúcares presentes en la superficie del epitelio oviductal es un requisito preliminar para realizar los estudios de competencia tendientes a determinar la posible participación de un sistema de reconocimiento entre determinados carbohidratos de las células oviductales con moléculas tipo lectinas presentes en la superficie espermática. Para conocer si el cultivo de las células oviductales provoca modificaciones en los azúcares de su superficie, se realizaron cultivos en monocapa y se identificaron algunos residuos glicosilados por lectinhistoquímica confocal láser. Una de las conclusiones fue que el glicocalix mantiene su composición de azúcares durante el cultivo. Sin embargo no sabemos si estas células en cultivo podrían servir para mimetizar las condiciones del ambiente oviductal necesarias para el uso de las mismas en el desarrollo de embriones in vitro como ocurre con otros animales. Conocida la presencia de algunos azúcares sobre la superficie epitelial se realizaron ensayos de competencia. Considerando que la UUT tiene mayor capacidad que el istmo para interaccionar con los espermatozoides, los ensayos de interacción competitiva se realizaron en explantos de células de la UUT. Galactosa, manosa, glucosa o N Acetil galactosamina posiblemente se unen a sitios de la superficie del espermatozoide involucrados en la adhesión a las células epiteliales, ya que la preincubación de éstos con los azúcares afecta su capacidad de unión al oviducto. Estos resultados indicarían que el sistema de reconocimiento carbohidrato – lectina detectado en otras especies también funciona en la unión de los espermatozoides de llama al epitelio oviductal homólogo (DeMott y col., 1995; Lefebvre y col., 1995;1997, Cortés y col., 2004). Llamativamente, en cada especie estudiada se ha identificado como involucrado a un carbohidrato diferente. En la yegua está involucrada la galactosa (Lefebvre y col., 1995), en hamster y rata el ácido siálico (DeMott y col., 1995; Cortes y col., 2004) y en bovinos la fucosa (Lefebvre y col., 1997). En llama , galactosa y NAcetil galactosamina reconocieron sitios e inhibieron la unión de los espermatozoides en forma significativa, lo que implicaría que estos residuos carbohidratos detectados por lectinhistoquímica confocal láser en el glicocalix de las células de la mucosa oviductal, participarían de la interacción oviducto-espermatozoide. En este sentido, en cerdo se ha 103 Discusión identificado una glicoproteína (SBG, sperm binding glycoprotein) cuyos restos de galactosa presentan afinidad por los espermatozoides homólogos y estarían participando de la unión de los mismos a la mucosa (Marini y Cabada, 2003). En llama todavía no sabemos si estos azúcares son parte de glicoproteínas o glicolípidos o algún otro tipo de molécula. La distribución de galactosa y N acetil galactosamina no es homogénea o pareja en toda la superficie de la mucosa, lo que coincide con nuestras observaciones que en la UUT de llama poscópula los espermatozoides aparecen adheridos a la mucosa en parches. En rata se publicaron resultados similares: el ácido siálico, que media la adhesión espermática en esta especie, también se encuentra sólo en algunas regiones del glicocálix oviductal (Cortes y col., 2004) y la adhesión de los espermatozoides al reservorio espermático in vivo se produce sólo en ciertas regiones de la mucosa de istmo (Smith y Yanagimachi, 1990). Se confirma que el espermatozoide de llama es capaz de reconocer N-Acetil galactosamina mediante el uso de este azúcar marcado con FITC. Los sitios de unión no se encuentran ubicados sólo en la zona rostral sino que se detectan en toda la superficie del espermatozoide. Coincidentemente el espermatozoide parece adherirse a las células oviductales tanto por la cabeza como por distintos sectores de la cola según las observaciones de interacción realizadas tanto in vivo como in vitro. En bovinos, cerdos y ratas las moléculas de unión al epitelio oviductal se localizarían sólo en la superficie apical de la cabeza del espermatozoide que es el sitio por el cual se adhieren al epitelio oviductal homólogo. (Gwathmey y col. 2003, Marini y Cabada, 2003; Cortés y col., 2004) ¿Los sitios de reconocimiento de N-acetil galactosamina se encuentran expuestos en los espermatozoides maduros y no eyaculados? Se ha descrito que los espermatozoides epididimales bovinos tienen una limitada capacidad de unirse al oviducto pero en el eyaculado algunas proteínas seminales se asocian a la superficie del espermatozoide . Una de ellas , PDC 109, se uniría a los residuos fucosilados del epitelio oviductal (Gwathmey y col., 2003, 2006). Nuestras observaciones indican que los espermatozoides epididimales de llama, que aún no tomaron contacto con el plasma seminal, no reconocen N-Acetil-galactosamina. Esto sugiere un rol activo de los componentes del plasma seminal en la formación de reservorios espermáticos en llama. En apoyo a esta hipótesis están nuestros estudios realizados mediante MEB, en donde observamos que los espermatozoides adheridos a la superficie oviductal se presentan 104 Discusión cubiertos por una sustancia de aspecto laminar. Esta sustancia sólo se observó en la UUT de hembras apareadas (no se observó en los controles de hembras sin aparear) lo que descarta su origen oviductal. ¿Se trata de componentes del plasma seminal que cooperan en la formación del reservorio? Se conoce que el macho de camélidos eyacula un semen altamente viscoso en el cual quedan atrapados los espermatozoides (Lichtenwalner y col., 1996, Bravo y col., 1997). Como consecuencia, no hay motilidad progresiva y sólo se observa movimiento oscilatorio (Garnica y col., 1993; Bravo y col., 1997, Giuliano y col., 2007). Esta alta viscosidad se atribuye generalmente a la presencia de mucopolisacáridos aportados por las secreciones de las glándulas bulbouretrales (Copa y col., 2003), la que puede ser eliminada mediante la extracción quirúrgica de éstas glándulas. Se sabe que la bulboretrectomía no afecta la calidad del semen con respecto a pH, vitalidad y concentración de espermatozoides (Gonzáles y col., 2003). Mediante microscopía electrónica de barrido en oviductos de hembras apareadas con machos bulboretrectomizados no se observan espermatozoides adheridos al epitelio de la UUT. Se observó nuevamente la sustancia adherente en la UUT de hembras apareadas con machos no bulboretrectomizados. Estos resultados indican que en llama el plasma seminal participaría también en la formación del reservorio espermático. Nuestros estudios demuestran lo que se había sugerido en camellos pero sin demostrarlo. Deen y col.( 2005) propusieron que la viscosidad del semen podría participar como reservorio de espermatozoides en el tracto genital femenino del camello y que además tendría cierta acción protectora sobre la viabilidad de los espermatozoides. Es más, cuando realizaron inseminación artificial 24 horas después de aplicar hormonas para inducir la ovulación (pero sin saber si ésta efectivamente aconteció) sólo obtuvieron preñeces si la inseminación se realizaba con semen no diluido. Este hecho señala la importancia del factor seminal, el cual se alteraría con la dilución, resultando en fallas en la fertilización. Giuliano y col. (2006), estudiando los efectos de la dilución del semen, tampoco obtuvieron preñeces al inseminar llamas con semen diluido. Los resultados nuestros y de otros autores indicarían que el plasma seminal, dado sus particulares características físicas (viscosidad) en camélidos, participaría en el almacenamiento de espermatozoides en el oviducto y sería un factor importante a considerar en el desarrollo de biotecnología. Pero también son interesantes los mecanismos que permiten la liberación de los espermatozoides del reservorio para que asciendan hasta el sitio de fecundación: el ámpula. Llegado el momento de la ovulación los espermatozoides deberían desunirse de las células de la UUT y los componentes del plasma seminal deberían licuarse. Aparentemente esto ocurre 105 Discusión así: cuando observamos el epitelio de la UUT a 35 horas después de la cópula, no se encontraron espermatozoides en contacto con la mucosa ni tampoco presencia de algún componente adhesivo. En otras especies se ha sugerido que la progesterona produce la desunión de los espermatozoides que están ligados a las células oviductales (Revisado por Hunter, 2005). Otros indican que al producirse la capacitación, ocurren cambios en la membrana espermática que producen el despegue (revisado por Suarez y Pacey 2006). Con respecto a la digestión de la sustancia adhesiva, pareciera que los mecanismos de disolución corresponden al oviducto. La viscosidad seminal no disminuye con el tiempo ya que hemos observado (notas personales) que al incubar el semen de llama a 37º por 40 horas no se produjo disminución de la viscosidad del semen. La necesaria disolución de este “coágulo” seminal no se produciría entonces por acción del semen en sí mismo y por lo tanto la intervención del oviducto parece indispensable. El estudio de los mecanismos del oviducto para producir la liberación de los espermatozoides es un tema que deberá ser encarado ya que hasta el momento es una función desconocida del oviducto. Por otra parte la conservación del semen manteniendo su viscosidad pareciera ser una condición en camélidos sudamericanos cuando se quieren aplicar biotecnologías reproductivas tales como la inseminación artificial o la criopreservación del semen. 106 Discusión CONCLUSIÓN FINAL En base a las conclusiones parciales detalladas al final de cada capitulo se concluye finalmente que los resultados en general indican fuertemente que: ? La Unión Útero Tubal (UUT) funciona como reservorio espermático en CSA. ? El reservorio se forma por influencia de tres factores: A) diseño anatómico de la UUT ; B) interacción de los espermatozoides con las células epiteliales de la UUT por medio de reconocimiento tipo carbohidrato-lectina, siendo N-Acetil galactosamina y galactosa los oligosacáridos involucrados; C) adhesión de espermatozoides a la UUT mediada por material de origen seminal. 107 SECCIÓN G REFERENCIAS Referencias REFERENCIAS ?Aba MA, Forsberg M (1995). Heterologous radioimmunoassay for llama and alpaca luteinizing hormone with a monoclonal antibody, an equine standard and a human tracer. Acta Vet. Scand. 36, 367–375. ?Aba MA, Forsberg M, Kindahl H, Sumar J, Edqvist LE (1995). Endocrine changes after mating in pregnant and non-pregnant llamas and alpacas. Acta Vet. Scand. 36, 489–498. ?Aba MA (1998). Hormonal interrelationships in reproduction of female llamas and alpacas. Acta Univ. Agricult. Sueciae Vet. 35. ?Aba MA, Kindahl H, Forsberg M, Quiroga M, Auza N (2000). Levels of progesterone and changes in prostaglandin F2alpha release during luteolysis and early pregnancy in llamas and the effect of treatment with flunixin meglumine. Anim. Reprod. Sci. 59 (1–2), 87–97. ?Abe H, Sendai Y, Satoh T, Hoshi H (1995). Secretory products of bovine oviductal epithelial cells support the viability and motility of bovine spermatozoa in culture in vitro. J Exp Zool. 272, 54-64. ?Adachi, K., Kurachi, H., Adachi, H., Imai, T., Sakata, M., Homma, H., Higashiguchi, O., Yamamoto, T. & Miyake, A. (1995). Menstrual cycle specific expression of epidermal growth factor receptors in human fallopian tube epithelium. J Endocrinol 147, 553-563. ?Adams GP, Griffin PG, Ginther OJ (1989). In situ morphologic dynamics of ovaries, uterus, and cervix in llamas. Biol. Reprod. 41, 551–558. ?Adams GP, Sumar J, Ginther OJ (1991). Form and function of the corpus luteum in llamas. Anim. Reprod. Sci. 24, 127–138. ?Adams GP, Ratto MH (2001). Reproductive biotechnology in South American camelids. Revista Invest. Vet. Peru. 1, 134–141. ?Aguero A, Miragaya MH, Ferrer MS, Capdevielle EF, Chaves MG, Rutter B (2001). Follicular dynamics in Vicugna vicugna.Theriogenology. 55, 379. ?Aller JF, Rebuffi GE, Cancino AK, Alberio RH (2003). Influencia de la criopreservación sobre la motilidad, viabilidad y fertilidad de espermatozoides de llama (Lama glama). Arch. Zootec. 52, 15–23. ?Argañaraz ME, Valdecantos PA, Abate CM, Miceli DC. (2007) Rat Lefty2/EBAF gene: isolation and expression analysis in the oviduct during the early pregnancy stage. Genes Genet Syst 82(2):171 ?Bahat A, Eisenbach MI, Tur-Kaspa (2005). Periovulatory increase in temperature difference within the rabbit oviduct. Hum Reprod. 20, 2118-2121. ?Ball BA (1996). Scanning electron microscopy of the equine oviduct and 109 Referencias observations on ciliary currents in vitro at day 2 after ovulation. Theriogenol. 46, 13051311. ?Bleil JD, Greve JM, Wassarman PM (1988). Identification of a secondary sperm receptor in the mouse egg zona pellucida: role in maintenance of binding of acrosomereacted sperm to eggs. Dev Biol, 128, 376-385. ?Bourke DA, Adam CL, Kyle CE (1992). Ultrasonography as an aid to controlled breeding in the llama (Lama glama). Vet. Rec.130, 424–428. ?Bravo PW, Sumar J (1989). Laparoscopic examination of the ovarian activity in alpacas. Anim. Reprod. Sci. 21, 271–281. ?Bravo PW, Fowler ME, Stabenfeldt GH, Lasley BL (1990). Ovarian follicular dynamics in the llama. Biol. Reprod. 43, 579–585. ?Bravo PW, Stabenfeldt GH, Lasley BL, Fowler ME (1991). The effect of ovarian follicle size on pituitary and ovarian responses to copulation in domesticated South American camelids. Biol Reprod. 45 (4) 553-559. ?Bravo PW, Tsutsui T, Lasley BL (1995). Dose response to equine chorionic gonadotropin and subsequent ovulation in llamas. Small Rumin. Res. 18, 157–163. ?Bravo PW, Moscoso J, Ordoñez C, Alarcón V (1996). Transport of spermatozoa en ova in female alpaca. Anim Reprod Sci. 43, 173-179. ?Bravo PW, Flores U, Garnica J, Ordoñez C, (1997). Collection of semen and artificial insemination of alpacas. Theriogenology. 47, 619–626. ?Bravo PW, Pacheco c, Quispe G, Vilcapaza Ll, Ordoñez C (1999). Degelification of alpaca semen and the effect of dilution rates on artificial insemination outcome. Arch. Androl 43 (3), 239-246 ?Bravo PW, Skidmore JA, Zhao XX (2000a). Reproductive aspects and storage of semen in Camelidae. Animal Reproduction Science. 62, 173–193. ?Bravo PW, Ccallo M, Garnica J (2000b). The effect of enzymes on semen viscosity in llamas and alpacas. Small Rumin. Res. 38, 91–95. ?Bravo PW (2002a). Male reproduction. En : The Reproductive Process of South American Camelids. Bravo Publishing. 49-64. ?Bravo PW (2002b). Female reproduction. En: The Reproductive Process of South American Camelids. Bravo Publishing. 49-64. ?Bravo PW, Moscoso R, Alarcon V, Ordonez C (2002c). Ejaculatory process and related semen characteristics. Arch. Androl. 48, 65–72. ?Brown BW (2000). A review on reproduction in south american camelids. Anim. Reprod. Sci. 58, 169 – 195. ?Buhi, W.C., Alvarez, I.M. & Kouba, A.J. (1997). Oviductal regulation of fertilization and early embryonic development. J Reprod Fertil Suppl 52, 285-300. 110 Referencias ?Buhi, W.C., Alvarez, I.M. & Kouba, A.J. (2000). Secreted proteins of the oviduct. Cells Tissues Organs 166, 165-179. ?Chaves MG, Aba M, Agüero A, Egey J, Berestin V, Rutter B (2002). Ovarian follicular wave pattern and the effect of exogenous progesterone on follicular activity in non-mated llamas. Ani. Reprod. Sci. 69, 37-46 ?Chegini, N., Zhao, Y. & McLean, F.W. (1994). Expression of messenger ribonucleic acid and presence of immunoreactive proteins for epidermal growth factor (EGF), transforming growth factor alpha (TGF alpha) and EGF/TGF alpha receptors and 125I-EGF binding sites in human fallopian tube. Biol Reprod 50, 1049-1058. ?Chen BX, Yuen ZX, Pan GW (1985). Semen-induced ovulation in the bactrian camel (Camelus bactrianus). J. Reprod. Fertil. 74, 335–339. ?Chian RC, Sirard MA (1995) Fertilizing ability of bovine spermatozoa cocultured with oviduct epithelial cells. Biol Reprod. 52 (1), 156-162. ?Conway-Myers BA (1998). Co-culture update: creating an embryotrophic environment in vitro. Semin Reprod Endocrinol. 16, 175-182. ?Copa S, Gonzales V (2003). Maceda E. Técnica de bulbouretrectomía en llamas macho. Memorias del III Congreso Mundial de Camélidos TI. 59-63. ?Cortés PP, Orihuela P, Zuñiga L, Velásquez L, Croxatto HB (2004). Sperm binding to oviductal epithelial cells in the rat: role of sialic acid residues on the epithelial surface and sialic acid-binding sites on the sperm surface. Biol Reprod. 71 (4), 1262-1269. ?Cox, C.I.& Leese, H.J. (1997). Retention of functional characteristics by bovine oviduct and uterine epithelia in vitro. Anim Reprod Sci 46, 169-178. ?Deen A, Vyas S, Sahani MS (2005). Problems of artificial insemination in dromedarius camel - failure of ovulation and entrapment of spermatozoa in gelatinous camel semen. Veterinarski Arhiv. 75 (4), 293-301. ?DeMott RP, Lefebvre R, Suarez SS (1995). Carbohydrates mediate the adherence of hamster sperm to oviductal epithelium. Biol Reprod. 52, 1395-1403. ?De Pauw IMC, Van Soom A, Laevens H, Verberckmoes S, De Kruif A (2002) Sperm binding to epithelial oviduct explants in bulls with different non return rates investigated with a new in vitro model. Biol Reprod. 67(4):1073-9 ?Dobrinski, I., Suarez, S.S., Ball, B.A. (1996). Intracellular calcium concentration in equine spermatozoa attached to oviductal epithelial cells in vitro. Biol. Reprod. 54, 783–788. ?Eisenbach M (1999). Sperm chemotaxis. Rev Reprod. 4, 56–66 ?England BG, Foote WC, Matthews DH, Cardozo AG, Riera S (1969). Ovulation and corpus luteum function in the llama_Lama glama. J. Endocrinol. 45, 505–513. 111 Referencias ?England BG, Foote WC, Cardoza AG, Matthews DH, Riera S (1971). Oestrus and mating behaviour in the llama_Lama glama.. Anim. Behav. 19, 722–726. ?Fabro G, Rovasio RA Civalero S, Frenkel A, Caplan SR, M Eisenbach and LC Giojalas (2002). Chemotaxis of capacitated rabbit spermatozoa to follicular fluid revealed by a novel directionalitybased assay Biol Reprod. 67, 1565–1571. ?Fernández-Baca S, (1993). Manipulation of reproductive functions in male and female New World camelids. Anim. Reprod. Sci. 33, 307–323. ?Fowler ME, Bravo PW (1998). Reproduction. In: Fowler, M.E. (Ed.), Medicine and Surgery of South American Camelids, second ed. Iowa State University Press, Ames, USA. 381–429. ?Franco E, Sumar J, Varela M (1981). Eyaculación en la alpaca _ Lama pacos. Proc. 4th Conv. Int. Camelidos Sudam., Punta Arenas, Chile, 22–27 Noviembre, citado en Fowler, 1989. ?Gabler C, Lauer B, Einspanier A, Schams D, Einspanier R (1997). Detection of mRNA and immunoreactive proteins for acidic and basic fibroblast growth factor and expression of the fibroblast growth factor receptors in the bovine oviduct. J Reprod Fertil. 109, 213-221. ?Gabler, C., Plath-Gabler, A., Einspanier, A. & Einspanier, R. (1998). Insulin-like and fibroblast growth factors and their receptors are differentially expressed in the oviducts of the common marmoset monkey (Callithrix jacchus) during the ovulatory cycle. Biol Reprod 58, 1451-1457. ?Gabler,C, Chapman, DA, Killian, GJ (2003). Expression and presence of osteopontin and integrins in the bovine oviduct during the oestrous cycle. Reproduction 126, 721-729. ?Gaddum-Rosse P, Blandau RJ (1975). In vitro studies on ciliary activity within the oviducts of the rabbit and pig. Am J Anat. 136 91-104. ?Gadella, B.M., Lopes-Cardozo, M., van Golde, L.M., Colenbrander, B. & Gadella, T.W., Jr. (1995). Glycolipid migration from the apical to the equatorial subdomains of the sperm head plasma membrane precedes the acrosome reaction. Evidence for a primary capacitation event in boar spermatozoa. J Cell Sci 108 (Pt 3), 935-946. ?Gandolfi, F. (1995). Functions of proteins secreted by oviduct epithelial cells. Microsc Res Tech 32, 1-12. ?Garnica J, Achata R, Bravo PW (1993). Physical and biochemical characteristics of alpaca semen. Anim. Reprod. Sci. 32, 85–90. ?Giuliano, S.M.; Chaves, M.G.; Director, A.; Trasorras, V.L.; Miragaya, M.H. (2006). Inseminacion artificial con semen refrigerado en llamas. Resultados preliminares. Actas del IV Congreso Mundial sobre Camélidos. 112 Referencias ?Giuliano S, Carretero I, Gambarotta M, Trasorras V, Pinto M, Miragaya M (2007). Mejoramiento de las características seminales del eyaculado de llama. I Reunión conjunta de Sociedades de Biología de la República Argentina. Libro de Resúmenes. 79 ?Giuliano S, Director A, Gambarotta M, Trasorras V, Miragaya M (2008). Collection method, season and individual variation on seminal characteristics in the llama (Lama glama). Ani Reprod Sci 104 (2-4), 359-369. ?Gonzales V, Copa S, Ochoa R (2003). Efecto de la bulbouretrectomía y periodicidad de colección den las características macro y microscópicas del eyaculado en llamas de tres edades. Memorias del III Congreso Mundial de Camélidos TII. 743746. ?Green CE, Bredl J, Holt WV, Watson PF, Fazeli A (2001). Carbohydrate mediation of boar sperm binding to oviductal epithelial cells in vitro. Reprod. (122), 305-315. ?Gwathmey TM, Ignotz GG, Suarez SS (2003). PDC-109 (BSP-A1/A2) promotes bull sperm binding to oviductal epithelium in vitro and may be involved in forming the oviductal sperm reservoir. Biol. Reprod. Sep 69 (3), 809-15. ?Gwathmey TM, Ignotz GG, Mueller JL, Puttaswamy M, Suarez SS (2006). Bovine seminal plasma proteins PDC-109, BSP-A3, and BSP-30-kDa share functional roles in storing sperm in the oviduct. Biol Reprod. 75 (4), 501-7. ?Harper, M.J.K. (1988). Gamete and zygote transport. In The Physiology of Reproduction., E.y.N. Knobil, JD, ed (New York, Estados Unidos: Raven Press), pp. 103-134. ?Harrison RAP (1996). Capacitation mechanisms, and the role of capacitation as seen in eutherian mammals. Reprod Fertil Dev. 8, 581–94. ?Harrison RAP, Gadella BM (2005). Bicarbonate-induced membrane processing in sperm capacitation. Theriogenology. 63, 346–60. ?Holt WV (2000). Basic aspects of frozen storage of semen. Ani Reprod Sci. 62, 3-22. ?Hugentobler SA, Morris DG, Sreenan JM, Diskin M (2007). Ion concentrations in oviduct and uterine fluid and blood serum during the estrous cycle in the ovine. Theriogenology. 68 (4), 538-548 . ?Hugentobler SA, Humpherson PG, Leese HJ, Sreenan JM, Morris DG (2008).Energy substrates in bovine oviduct and uterine fluid and blood plasma during the oestrous cycle. Mol Reprod Dev. 75 (3) 496-503. ?Hunter RHF (1975). Physiological aspects of sperm transport in the domestic pigs, Sus scrofa II. Regulation, survival and fate of cells. Br. Vet. J. 131, 681-690. ?Hunter RH (1981). Sperm transport and reservoirs in the pig oviduct in relation to the time of ovulation.J Reprod Fertil. 63 (1) 109-17. 113 Referencias ?Hunter RHF, Nichol R (1983) Transport of spermatozoa in the sheep oviduct: preovulatory sequestetring of cells in the cauda isthmus. J. Exp. Zool. 228, 121-128. ?Hunter RH, Wilmut I (1984). Sperm transport in the cow: peri-ovulatory redistribution of viable cells within the oviduct. Reprod Nutr Dev. 24(5A), 597-608. ?Hunter RHF, Fléchon B, Fléchon JE (1987). Pre- and peri-ovulatory distribution of viable spermatozoa in the pig oviduct: a scanning electron microscope study. Tissue Cell. 19 (3), 423-36. ?Hunter RH (1988). Fallopian tube fluid: the phisiological medium for fertilization and early embryonic development. In The fallopian tubes. Their role in fertility and infertility, Springer-Verlag, ed (Berlin, Alemania). 30-52. ?Hunter RHF, Fléchon B, Fléchon JE (1991a). Distribution, morphology and epithelial interactions of bovine spermatozoa in the oviduct before and after ovulation: a scanning electron microscope study. Tissue Cell. 23, 641–656. ?Hunter RHF (1991b). Oviduct function in pigs, with particular reference to the pathological condition of polyspermy. Mol Reprod Dev. 29, 385–391. ?Hunter RHF (2005). The Fallopian tubes in domestic mammals: how vital is their physiological activity Reprod. Nutr. Dev. 45, 281–290. ?Ijaz A, Lambert RD, Sirard MA (1994). In vitro-cultured bovine granulosa and oviductal cells secrete sperm motility-maintaining factor(s). Mol Reprod Dev. 37, 5460. ?Jansen RPS (1980). Cyclic changes on the human fallopian tubes isthmus and their functional importance. Am J Obstet Gynecol. 136, 292–308. ?Jansen RP, Bajpai VK. (1982). Oviduct acid mucus glycoproteins in the estrous rabbit: ultrastructure and histochemistry.Biol Reprod. 26(1):155-68. ?Johnson LW (1989). Llama reproduction. Vet. Clin. N. Am. Food Anim. Pract. 5, 159–182. ?Khatir H, Anouassi A, Tibary A (2004). Production of dromedary (Camelus dromedarius) embryos by IVM and IVF and coculture with oviductal or granulosa cells. Theriogenology. 62, 1175–1185. ?Khatir H, Anouassi A, Tibary A (2005). In vitro and in vivo developmental competence of Dromedary (Camelus dromedarius) embryos produced in vitro using two culture systems (mKSOMaa and oviductal cell). Reprod. Domest. Anim. 40, 245–249. ?Killian GJ. (2004). Evidence for the role of oviduct secretions in spermfunction, fertilization and embryo development. Ani Reprod Sci (82–83) 141–153 ?Kouba AJ, Abeydecra LR, Alvarez IM, Day BN, Buhi WC (2000). Effects of the porcine oviduct specific glycoprotein on fertilization, polyspermy, and embryonic development in vitro. Biol. Reprod. 63, 242–250. 114 Referencias ?Leese, H.J. (1988). The formation and function of oviduct fluid. J Reprod Fertil 82, 843-856. ?Lefebvre R, Chenoweth PJ, Drost M, LeClear CT, MacCubbin M. Dutton JT, Suarez SS (1995). Characterization of the oviductal sperm reservoir in cattle. Biol Reprod. 53, 1066-1074 ?Lefebvre R, DeMott RP, Suarez SS, Samper JC, (1995b). Specific inhibition of equine sperm binding to oviductal epithelium. In: Sharp D, Bazer FW (eds.), Equine Reproduction VI (Biol Reprod Monogr 1). Madison, WI: Society for the Study of Reproduction. 689-696. ?Lefebvre R, Lo MC, Suarez SS, (1997). Bovine sperm binding to oviductal epithelium involves fucose recognition. Biol. Reprod. 56, 1198–1204. ?Lichtenwalner AB, Woods GL, Weber JA (1996). Seminal collection, seminal characteristics and pattern of ejaculation in llamas. Theriogenology. 46, 293–305. ?Marini PE, Cabada MO (2003). One step purification and biochemical characterization of a spermatozoa-binding protein from porcine oviductal epithelial cells. Mol Reprod Devel. 66, 383-390. ?Mburu JN, Rodriguez-Martinez H, Einarsson S (1997). Changes in sperm ultrastructure and localisation in the porcine oviduct around ovulation. Anim. Reprod. Sci. 47, 137–148. ?McEvoy TG, Kyle CE, Young P, Adam CL, Bourke DA (1992). Aspects of artificial breeding and establishment of pregnancy in South American camelids. Proc. 12th Int. Congr. Anim. Reprod., The Hague vol. 4. 1963–1965. ?McLeskey SB, Dowds C, Carballada R, White RR, Saling PM (1998). Molecules involved in mammalian sperm-egg interaction. Int Rev Cytol. 177, 57-113. ?Merlian CP, Sikes JD, Read BW, Boever WJ, Knox D (1986). Comparative characteristics of spermatozoa and semen from a bactrian camel, dromedary camel and llama. J. Zoo An. Med. 10, 22–25. ?Miragaya MH, Chaves MG, Agüero A (2006). Reproductive biotechnology in South American camelids. Small Rumin Res. 61, 299–310. ?Mortillo S, Wassarman PM (1991). Differential binding of gold-labeled zona pellucida glycoproteins mZP2 and mZP3 to mouse sperm membrane compartments. Development. 113, 141-149. ?Moseley G, (1995). Commercial management of small Camelidae in northern Europe. Vet. Annu. 35, 320–330. ?Murray SC, Smith TT (1997). Sperm interaction with fallopian tube apical membrane enhances sperm motility and delays capacitation. Fertil Steril. 68, 351-357. ?Nauc V, Manjunath P (2000). Radioimmunoassays for bull seminal plasma proteins (BSP-A1/-A2, BSP-A3, and BSP-30-Kilodaltons), and their quantification in seminal plasma and sperm. Biol Reprod. 63, 1058–66. 115 Referencias ?Novoa C, Fernandez-Baca S, Sumar J, Levya V, (1972). Pubertad en la alpaca. Revista Invest. Pecuarias (IVITA) 1, 29–35. ?Odor DL, Gaddum-Rosse P, Rumery RE, Blandau RJ (1980). Cyclic variations in the oviductal cilicated cells during the menstrual cycle and after estrogen treatement in the pig-tailed monkey, Macaca nemestrina. Anat Ret. 198, 35-57 ?Olivera M, Ruiz T, Tarazona A, Giraldo C (2006). El espermatozoide, desde la eyaculación hasta la fertilización Rev Col Cienc Pec Vol. 19, 4. ?Overstreet JW, Cooper GW (1979). Effect of ovulation and sperm motility on the migration of rabbit spermatozoa to the site of fertilization. J Reprod Fertil. 55, 53–9. ?Pacey AA, Davies N, Warren MA, Barratt CL, Cooke ID (1995). Hyperactivation may assist human spermatozoa to detach from intimate association with the endosalpinx. Hum Reprod. 10, 2603–2609. ?Palma G, Miceli DC (2008). Interacción funcional entre los espermatozoides y el tracto genital femenino. En: Biotecnología de la Reproducción, 2º Edición. Ed: Palma G. 93-134. ?Parrish JJ, Susko-Parrish J, Winter MA, First NL (1988). Capacitation of bovine sperm by heparin. Biol Reprod; 38:1171-1180. ?Parrish JJ, Susco-Parrish JL, Handrow RR, Sims MM, First NL (1989). Capacitation of bovine spermatozoa by oviduct fluid. Biol Reprod 40, 1020-1025. ?Petrunkina AM, Gehlhaar R, Drommer W, Waberski D, Töpfer- Petersen E (2001) Selective sperm binding to pig oviductal epithelium in vitro. Reproduction 21, 889–896. ?Pollard JW, Plante C, King WA, Hansen PJ, Betteridge KJ, Suarez SS (1991). Fertilizing capacity of bovine sperm may be maintained by binding to oviductal epithelial cells. Biol Reprod. 44, 102-107. ?Purves WK, Sadava D, Orians GH, Heller HC (2002). La reproducción en los animales. Biología de los animales. En: Vida, 6º Edición. Ed: Panamericana. 731-749. ?Pushpakumara PG, Robinson RS, Demmers KJ, Mann GE, Sinclair KD, Webb R, Wathes DC. (2002). Expression of the insulin-like growth factor (IGF) system in the bovine oviduct at oestrus and during early pregnancy. Reproduction. 123(6):859-68. ?Raychoudhury SS, Suarez SS, Buhi WC (1993). Distribution of lectin binding sites in the oviducts of cycling and hormone-treated pigs. J Exp Zool. 1. 265 (6), 65968. ?Revah I, Gadella BM, Flesch FM, Colenbrander B, Suárez SS (2000) Pysiological state of bull sperm affects fucose- and mannose-binding properties. Biol Reprod. 62(4), 1010-5. ?Rodríguez A, Rojas MA, Bustos-Obregón E, Urquieta B, Regadera J (1999). Distribution of keratins, vimentin, and actin in the testis of two South American 116 Referencias camelids: Vicuna (Vicugna vicugna) and llama immunohistochemical study. The Anat Rec. 254, 330–335. (Lama glama). An ?Rodriguez-Martinez H (2007) Role of the oviduct in sperm capacitation. Theriogenology. 68 (1), 138-146. ?San-Martin M., Copaira M, Zuniga J, Rodreguez R, Bustinza G, Acosta L (1968). Aspects of reproduction in the alpaca. J. Reprod. Fertil. 16, 395–399. ?Scott MA (2000). A glimpse at sperm function in vivo: sperm transport and epithelial interaction in the female reproductive tract. Anim Reprod Sci. 60–61, 337– 348. ?Senger PL (2003). Pathways to pregnancy and parturition. Washington, E.E.U.U.: Current Conceptions, Inc. ?Smith CL, Peter AT, Pugh DG (1994). Reproduction in llamas and alpacas: a review. Theriogenology. 41, 573–592. ?Smith TT, Yanagimachi R (1990). The viability of hamster spermatozoa stored in the isthmus of the oviduct: the importance of sperm-epithelium contact for sperm survival. Biol Reprod. 42, 450–457. ?Smith TT, Yanagimachi R (1991). Attachment and release of spermatozoa from the caudal isthmus of the hamster oviduct. J Reprod Fertil. 91, 567–573. ?Smith TT, Nothnick WB (1997). Role of direct contact between spermatozoa and oviductal epithelial cells in maintaining rabbit sperm viability. Biol Reprod. 56, 8389. ?Spies HG, Pau KYF, Yang SP (1997). Coital and estrogen signals: a contrast in the preovulatory neuroendocrine networks of rabbits and rhesus monkeys. Biol. Reprod. 56, 310–319. ?Strandell A, Thorburn J, Wallin A. (2004). The presence of cytokines and growth factors in hydrosalpingeal fluid. J Assist Reprod Genet 21(7):241-7. ?Suarez SS, Drost M, Redfern K and Gottlieb W (1990) Sperm motility in the oviduct. In Bavister BD, Cummins J and Roldan ERS (eds), Fertilization in Mammals. Serono Symposia, Norwell, MA, 111–124. ?Suarez SS, Redfern K, Raynor P, Martin F, Phillips DM (1991). Attachment of boar spermatozoa to mucosal explants of oviduct in vitro: possible role in formation of a sperm reservoir. Biol Reprod. 44, 998–1004. ?Suarez SS, Brockman K, Lefebvre R (1997). Distribution of mucus and sperm in bovine oviducts after artificial insemination: the physical environment of the oviductal sperm reservoir. Biol. Reprod. 56, 447-453. ?Suarez SS (1998). The oviductal sperm reservoir in mammals: mechanism of formation. Biol Reprod 58,1105-1107 ?Suarez SS, Pacey AA (2006). Sperm transport in the female reproductive tract. 117 Referencias Hum Reprod Update. 12(1), 23-37. Review. ?Sucapuca V (1991). Características físicas del semen de la alpaca obtenido por el método del perservativo. MVZ Tesis, Univ. Nac. Altiplano, Puno, Peru. 49. ?Sumar J (1983). Studies on reproductive pathology in alpacas. MS Thesis, Department of Obstetrics and Gynaecology, College of Veterinary Medicine, Swedish University of Agriculture and Science, Uppsala. 9–103. ?Sumar J (1985). Reproductive physiology in South American Camelids. In: Land, R.B., Robinson, D.W._Eds., Genetics of Reproduction in Sheep. Butterworths, London. 81–95. ?Sumar J, Leyva V (1981). Coleccion de semen mediante vagina artificial en la alpaca. In: Proceedings of the IVth International Conference on South American Camelids, Punta Arenas, Chile. 12. ?Sumar JB, Adams, G (1997). Reproductive anatomy and physiology of the female llama. In: Youngquist, R.S. (Ed.), Current Therapy in Large Animal Theriogenology. WB Saunders, Philadelphia, USA. 792–798. ?Sun F, Bahat A, Gakamsky A, Girsh E, Katz N, Giojalas LC, Tur-Kaspa I, Eisenbach M (2005). Human sperm chemotaxis: both the oocyte and its surrounding cumulus cells secrete sperm chemoattractants. Hum Reprod. 20, 761-767. ?Talevi R, Gualtieri R (2001) Sulfated glycoconjugates are powerful modulators of bovine sperm adhesion and release from the oviductal epithelium in vitro. Biol Reprod. 64(2), 491-8. ?Thomas PGA, Ball BA, Miller PG, Brinsko SP, Southwood L (1994a). A subpopulation of morphologically normal, motile spermatozoa attach to equine oviductal cell monolayer. Biol Reprod. 51, 303-309. ?Thomas PG, Ball BA, Brinsko SP (1994b). Interaction of equine spermatozoa with oviduct epithelial cell explants is affected by estrous cycle and anatomic origin of explant. Biol Reprod. 51, 222-228. ?Thomas PG, Ignotz GG, Ball BA, Miller PG, Brinsko SP, Currie B (1995). Isolation, culture, and characterization of equine oviduct epithelial cells in vitro. Mol Reprod Dev. 41, 468-478. ?Tibary A, Anouassi A (1997). Theriogenology in Camelidae, Actes ed. Rabat, Morocco. ?Tibary A, Memon MA (1999). Reproductive physiology in the female South American camelidae. 6, 217–233. ?Tibary A (2001). Approach to diagnosis of infertility in camelids. In: Proceedings of the Annual Conference of the Society for Theriogenology, Vancouver, BC, Canada. 12–15, 407–416. 118 Referencias ?Tibary A, Vaughan J (2006). Reproductive physiology and infertility in male South American camelids: A review and clinical observations. Small Rumin Res. 61 283–298. ?Töpfer-Petersen E, Wagner A, Friedrich J, Petrunkina A, Ekhlasi-Hundrieser M, Waberski D, Drommer W (2002). Function of the mammalian oviductal sperm reservoir. J. Exp.Zool. (292), 210-215. ?Troedsson MHT, Liu IKM y Crabo BG (1998). Sperm transport and survival in the mare. Theriogenology, 49 (5), 905-915. ?Valdecantos, P.A., Argañaraz, M.E., Abate, C.M. & Miceli, D.C. (2004). RNA fingerprinting using RAP-pCR identifies an EBAF homologue mRNA differentially expressed in rat oviduct. Biocell 28, 287-297. ?Vaughan JL, Galloway D, Hopkins D (2003). The development of artificial insemination technology in alpacas (Lama pacos). A report of the Rural Inducstries Research and Development Corporation, RIRDC Publication No. 03, 104. ?Vaughan JL, Macmillan KL, D’Occhio MJ (2004). Ovarian follicular wave characteristics in alpacas. Anim. Reprod. Sci. 80, 353–361. ?Vaughan JL,Tibary A. (2006). Reproduction in female South American camelids: A review and clinical observations. Small Rumin Res 61 259–281. ?Viuff, D., Hyttel, P., Greve, T., Eriksen, T. & Alexandersen, S. (1995). Transcription and localization of growth factor mRNA in the bovine oviduct. Mol Reprod Dev 42, 28-34. ?Walter I, Bavder S (1997). Lectin binding pattern of porcine oviduct mucosa and endometrium during oestrus cycle. J. Anat. (190), 299-307. ?Wilmut I, Hunter RH (1984). Sperm transport into the oviducts of heifers mated early in oestrus. Reprod Nutr Dev. 24(4), 461-8. ?Wiseman, D.L., Henricks, D.M., Eberhardt, D.M. & Bridges, W.C. (1992). Identification and content of insulin-like growth factors in porcine oviductal fluid. Biol Reprod 47, 126-132. ?Wrobel K-H, Kujat R, Fehle G (1993). The bovine tubouterine junction: general organization and surface morphology. Cell Tissue Res. 271, 227–239 ?Yanagimachi R (1994). Mammalian fertilization. In: Knobil E, Neill JD (eds.), The Physiology of Reproduction, Vol1, 2nd ed. New York: Raven Press. 189-317. ?Yániz JL, Lopez-Gatius F, Santolaria P, Mullins KJ (2000). Study of the functional anatomy of bovine oviductal mucosa. Anat Rec. 260, 268–278. 119 ¡PIU AVANTI ! No te des por vencido, ni aún vencido, no te sientas esclavo, ni aún esclavo; trémulo de pavor, piénsate bravo, y acomete feroz, ya mal herido. Ten el tesón del clavo enmohecido que ya viejo y ruin, vuelve a ser clavo; no la cobarde estupidez del pavo que amaina su plumaje al primer ruido. Procede como Dios que nunca llora; o como Lucifer, que nunca reza; o como el robledal, cuya grandeza necesita del agua, y no la implora... Que muerda y vocifere vengadora, ya rodando en el polvo, tu cabeza! Almafuerte