PROPIEDADES DE LOS ENLACES QUÍMICOS
Anuncio
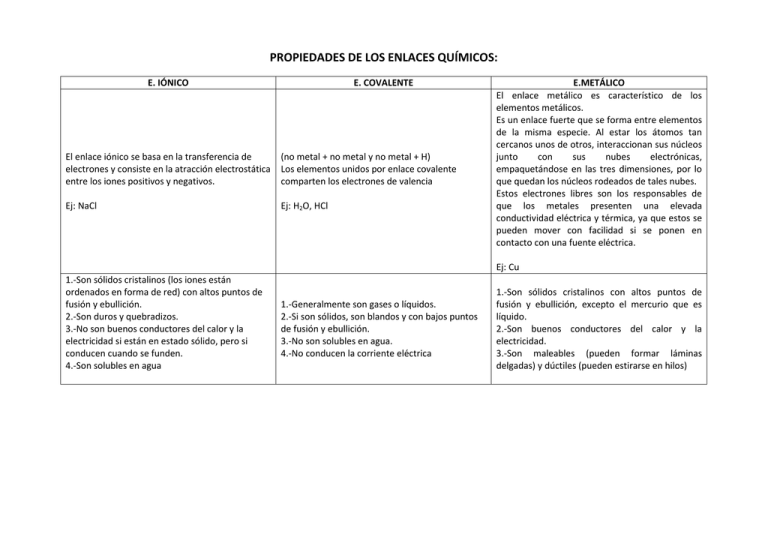
PROPIEDADES DE LOS ENLACES QUÍMICOS: E. IÓNICO E. COVALENTE El enlace iónico se basa en la transferencia de electrones y consiste en la atracción electrostática entre los iones positivos y negativos. (no metal + no metal y no metal + H) Los elementos unidos por enlace covalente comparten los electrones de valencia Ej: NaCl Ej: H2O, HCl E.METÁLICO El enlace metálico es característico de los elementos metálicos. Es un enlace fuerte que se forma entre elementos de la misma especie. Al estar los átomos tan cercanos unos de otros, interaccionan sus núcleos junto con sus nubes electrónicas, empaquetándose en las tres dimensiones, por lo que quedan los núcleos rodeados de tales nubes. Estos electrones libres son los responsables de que los metales presenten una elevada conductividad eléctrica y térmica, ya que estos se pueden mover con facilidad si se ponen en contacto con una fuente eléctrica. Ej: Cu 1.-Son sólidos cristalinos (los iones están ordenados en forma de red) con altos puntos de fusión y ebullición. 2.-Son duros y quebradizos. 3.-No son buenos conductores del calor y la electricidad si están en estado sólido, pero si conducen cuando se funden. 4.-Son solubles en agua 1.-Generalmente son gases o líquidos. 2.-Si son sólidos, son blandos y con bajos puntos de fusión y ebullición. 3.-No son solubles en agua. 4.-No conducen la corriente eléctrica 1.-Son sólidos cristalinos con altos puntos de fusión y ebullición, excepto el mercurio que es líquido. 2.-Son buenos conductores del calor y la electricidad. 3.-Son maleables (pueden formar láminas delgadas) y dúctiles (pueden estirarse en hilos)