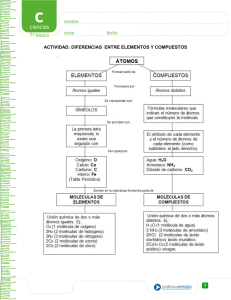
química ii - CCH Sur
Anuncio

UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO COLEGIO DE CIENCIAS Y HUMANIDADES PLANTEL SUR ÁREA DE CIENCIAS EXPERIMENTALES GUÍA Y MATERIAL DE AUTO – ESTUDIO PARA PREPARAR EL EXAMEN EXTRAORDINARIO de QUÍMICA II Coordinadoras y autoras: Espinosa Pérez Areli Román Guerrero María del Pilar Autores: Zenteno Mendoza Blanca Estela Navarro León Francis Guzmán Flores Guadalupe López Gómez Luz María del Refugio Sánchez Ornelas Andrés Roberto Córdova Zwanziger Sofía Castillo Urueta Pável Mayo 2016 1 Página INDICE PRESENTACIÓN 2 4 OBJETIVO GENERAL 4 SUGERENCIAS 4 RECOMENDACIONES GENERALES 5 PRIMERA UNIDAD. SUELO, FUENTE DE NUTRIMENTO PARA LAS PLANTAS ¿Por qué es importante el suelo? 6 8 ¿Qué es el suelo? 9 ¿Cómo se clasifican los componentes sólidos del suelo? 11 ¿De qué está formada la parte inorgánica del suelo? 11 ¿Qué son las sales y qué propiedades tienen? 13 ¿Cómo se representan y nombran las sales en el lenguaje de la química? 23 ¿Cuál es el alimento para las plantas? 35 ¿Cómo mejorar un suelo deficiente en sales? 36 ¿Cómo se obtienen las sales? 37 ¿Cómo ayuda la química a determinar la cantidad de sustancias que intervienen en las reacciones de obtención de sales? 39 ¿Qué importancia tiene conocer la acidez del suelo? 49 SEGUNDA UNIDAD. ALIMENTOS, PROVEEDORES DE SUSTANCIAS ESENCIALES PARA LA VIDA 56 ¿Por qué comemos? 58 ¿Qué tipo de sustancias constituye a los alimentos? 59 ¿Por qué el carbono es el elemento predominante en los alimentos? 60 ¿Qué grupos funcionales están presentes en los nutrimentos orgánicos? 69 ¿Cuál es la función en el organismo de los nutrimentos? 79 ¿Hay entre la estructura de los nutrimentos y su función en el organismo? 81 Y tú, ¿cómo te alimentas? 108 ¿Cómo se conservan los alimentos? 109 2 TERCERA UNIDAD. MEDICAMENTOS, PRODUCTOS QUÍMICOS PARA LA SALUD 115 ¿Qué son los medicamentos? 118 ¿Cómo se obtienen los medicamentos? 123 ¿Cómo se sintetiza un principio activo? 132 ¿Cómo ayuda la química a combatir las enfermedades? 135 ¿Cómo ayuda la Química a mejorar tu forma de vida? 137 Prueba tipo extraordinario 141 3 PRESENTACIÓN La presente guía fue elaborada basándose en los planes y programa de estudios vigentes a la fecha con la finalidad de proporcionar un material didáctico de apoyo para la preparación del examen extraordinario de Química II. Esta guía contiene información teórica con ejemplos ilustrativos y ejercicios denominados “A practicar ” con la finalidad de que identifiques el avance en tu estudio. Al final de la guía viene un examen tipo extraordinario con el cuál pondrás a prueba los conocimientos adquiridos y de este modo podrás ahondar en aquellos temas que así lo requieran. UNIDADES TEMATICAS DE QUÍMICA IV PRIMERA UNIDAD. SUELO, FUENTE DE NUTRIMENTOS PARA LAS PLANTAS SEGUNDA UNIDAD. ALIMENTOS, PROVEEDORES DE SUSTANCIAS ESENCIALES PARA LA VIDA TERCERA UNIDAD. MEDICAMENTOS, PRODUCTOS QUÍMICOS PARA LA SALUD OBJETIVO GENERAL Apoyar al alumno en su etapa de preparación para presentar el examen extraordinario de Química II SUGERENCIAS Esta guía comprende temas y conceptos que se revisan a lo largo de un semestre, por lo que cuál debes planear tus actividades a lo largo del día para que dediques una buena parte de tu tiempo a su estudio, por lo que te sugerimos: 1.- Leer la información proporcionada, realiza notas propias sobre cada tema revisado para que vayas reforzando los aprendizajes abordados. 2.- Responde por escrito de manera ordenada y sistemática cada uno de los ejercicios propuestos basándote en el contenido de la guía 3.- Verifica que cada una de las respuestas con la finalidad de detectes el nivel de avance que llevas. 4.- Una vez que hayas terminado de estudiar todos los temas de la guía y completado los ejercicios propuestos, es momento de que realices el prototipo de examen extraordinario para que te des cuenta de cuáles son tus fortalezas y debilidades. 4 Recuerda que si quieres profundizar en algún tema puedes utilizar la bibliografía propuesta para tal fin, además puedes acudir con los asesores de la asignatura para que te brinden su apoyo en los temas que te sean más difíciles de comprender. RECOMENDACIONES GENERALES 1.- Consulta en la Secretaría de Servicios Estudiantiles o en la Jefatura del Área de Ciencias Experimentales los requisitos y trámites a seguir para tu inscripción al examen. 2.- Anota y recuerda la fecha del examen extraordinario. 3.- El día del examen debes presentar la credencial que te acredite como alumno del Colegio, o en su defecto una constancia expedida por Servicios Estudiantiles (no podrás presentar tu examen, si no cuentas con cualquiera de las dos identificaciones mencionadas) 4.- La revisión del examen solo podrá ser atendida por los profesores que lo evaluaron, por lo que es importante que anotes y recuerdes el nombre del sinodal asignado. 5 Primera unidad. Suelo, fuente de nutrimentos para las plantas 6 7 ¿Por qué es importante el suelo? Los seres humanos siempre han tenido una relación cercana con el suelo. Aún antes del inicio de la agricultura sedentaria, los suelos eran reconocidos como fuentes importantes de alimentos, fibras y combustibles. La evidencia de prácticas agrícolas más antigua de que se tiene registro se encontró en un lugar cercano a la actual ciudad de Jarmo en Iraq aproximadamente 11,000 años A. C La función más universalmente reconocida del suelo es su apoyo a la producción alimentaria. Es la base para la agricultura y el medio en que crecen casi todas las plantas de las que obtenemos alimentos. Se estima, que el 95% de nuestros alimentos se produce directa o indirectamente de nuestros suelos. Los suelos sanos suministran los nutrientes esenciales, agua, oxígeno y el soporte para las raíces que nuestras plantas productoras de alimentos necesitan para crecer y prosperar. Los suelos también sirven como protección para las delicadas raíces de las plantas frente a las fuertes fluctuaciones de temperatura. Los suelos sanos mantienen una comunidad variada de organismos que ayudan a controlar las enfermedades de las plantas, insectos y malezas, forman asociaciones simbióticas beneficiosas con las raíces, reciclan nutrientes esenciales para las plantas, mejoran la estructura del suelo con efectos positivos para el agua del suelo y la capacidad de retención de nutrientes, y en última instancia mejoran la producción agrícola. Un suelo sano también contribuye a la mitigación del cambio climático, manteniendo o aumentando su contenido de carbono. La disponibilidad de alimentos depende de los suelos: los alimentos nutritivos y de buena calidad y el forraje para los animales solo pueden producirse si nuestros suelos están sanos. Por tanto, un suelo vivo y sano es un aliado crucial para la seguridad alimentaria y la nutrición. Además de su importante papel en la producción de alimentos, los suelos son un componente esencial de los ecosistemas y, por esta razón, brindan una gran cantidad de beneficios a los seres humanos entre los que vale la pena resaltar: Funciones de abastecimiento. Además de la producción de alimentos, los 8 suelos permiten el abastecimiento de agua dulce, combustibles, minerales, fibras para la producción textil y diferentes principios activos utilizados en la producción de medicamentos. Funciones de regulación. Los suelos contribuyen a regular el clima y almacenar y purificar el agua dulce. Funciones culturales. Los suelos permiten una serie de actividades turísticas y de recreación, espirituales y religiosas. ¿Qué es el suelo? El término suelo, que deriva del latín solum, y significa piso, puede definirse como la capa superior de la Tierra que se distingue de la roca sólida y en donde las plantas crecen. Con este enfoque, los suelos deben considerarse como formaciones geológicas naturales desarrolladas bajo condiciones muy diversas de clima y materiales de origen, lo cual justifica su continua evolución y, en consecuencia, su gran variedad. Pero, tal como ocurre con muchas palabras que corrientemente se utilizan, el suelo puede definirse de formas diferentes. Esto depende del criterio que se adopte en lo que respecta a su utilización, formación, origen, constitución o función. Para un ingeniero de caminos, por ejemplo, el suelo puede ser el material donde construir una carretera. Un ingeniero de minas lo puede considerar como el conjunto de restos diversos que cubren las rocas y minerales que él debe estudiar. Y para un agricultor, por no citar más ejemplos, el suelo puede ser exclusivamente el lugar donde crecen sus cultivos. Bajo el punto de vista menos aplicado y general, y más científico, también se pueden encontrar otras orientaciones. Así, existe una dirección o criterio geológico que define el suelo en función de su formación a partir de las rocas originarias. Y en este sentido, el suelo puede definirse como el producto de erosión de las rocas, evidenciado en las partes superficiales de la corteza terrestre y que contiene en ocasiones restos de materia orgánica descompuesta o en descomposición. Pero el suelo, independientemente de su origen tiene una 9 función: soportar una vegetación, y en él se deben dar las condiciones necesarias para el desarrollo de las plantas. Con este enfoque, nos encontramos con una concepción fisiológica vegetal que define el suelo como la mezcla de partículas sólidas pulverulentas, de agua y de aire que, provista de los elementos nutritivos necesarios para las plantas, puede servir como sustentadora de una vegetación. El siguiente mapa conceptual muestra las fases que constituyen el suelo. El suelo, sin embargo, como parte de la biosfera, está poblado de organismos. El suelo respira, nitrifica, origina humus. Nos encontramos también con un criterio biológico, donde se da prioridad para su definición a los organismos que en él habitan y a las transformaciones o procesos que realizan. Las definiciones expuestas ponen claramente en evidencia que el concepto de suelo puede ser diferente. Y ello dependerá de la disciplina que lo estudie. Bajo el punto de vista químico y agrícola también es aceptable su correspondiente orientación. Y en este sentido, el suelo puede considerarse como una mezcla heterogénea constituida por tres fases: sólida, líquida y gaseosa, que constituye el soporte mecánico y, en parte, el sustento de las plantas. La composición de las tres fases puede variar con el tiempo y de un lugar a otro, sin embargo, de manera general se puede considerar que la fase gaseosa está conformada por aire y la fase líquida por agua, en tanto que la fase sólida contiene materia orgánica (restos de plantas y animales) y materia inorgánica (diferentes minerales) 10 ¿Cómo se clasifican los componentes sólidos del suelo? Los componentes sólidos del suelo son una mezcla formada por materiales orgánicos e inorgánicos (minerales); estos se encuentran en distintas proporciones, dependiendo del tipo de suelo y de la región de origen. Material Orgánico Este componente del suelo está formado por restos vegetales y animales en diferente estado de descomposición de estos restos se forma el “humus”, que es el que le da el color oscuro al suelo. La última etapa de la descomposición de la materia orgánica, llamada “mineralización” consiste en la destrucción total de los restos orgánicos que se transforman en compuestos inorgánicos sencillos debido a la actividad de los microorganismos (hongos y bacterias). Los organismos que viven en el suelo son factores determinantes para la circulación de nutrientes y del carbono en el suelo. Una gran parte de la materia orgánica originada por la descomposición de los residuos vegetales se acumula en la superficie del suelo y se consume casi por completo por los microorganismos creando así una reserva de carbono con una rápida tasa de renovación. La vegetación fija el carbono de la atmósfera por fotosíntesis transportándolo a materia viva y muerta de las plantas. Los organismos del suelo descomponen esta materia transformándola a materia orgánica del suelo. El carbono se libera de la biomasa para la materia orgánica, en organismos vivos por un cierto tiempo o se vuelve a emitir para la atmósfera por respiración de los organismos (organismos del suelo y raíces) en forma de dióxido carbono, CO 2 o metano CH4, en condiciones de encharcamiento en el suelo. La materia orgánica del suelo está compuesta en su mayoría de carbono, tiene una capacidad de retener una gran proporción de nutrientes, cationes y oligoelementos esenciales para el crecimiento de las plantas. ¿De qué está formada la parte inorgánica del suelo? La parte inorgánica del suelo está formada por partículas de roca finamente partidas que contienen minerales. Los compuestos que la forman son algunos elementos en pequeñas cantidades, como hierro (Fe), oro (Au), manganeso (Mn), azufre (S) y los óxidos de esos elementos. Un componente importante son los silicatos, que constituyen el 75% de la corteza terrestre. 11 También existe el espacio poroso del suelo se refiere al porcentaje del volumen del suelo no ocupado por sólidos. En general el volumen del suelo está constituido por 50% materiales sólidos (45% minerales y 5% materia orgánica) y 50% de espacio poroso. La cantidad de nutrientes presente en el suelo determina su potencial para alimentar organismos vivos. Los 16 nutrientes esenciales para el desarrollo y crecimiento de las plantas se suelen clasificar entre macro y micro nutrientes dependiendo de su requerimiento para el desarrollo de las plantas. a) Los macronutrientes se requieren en grandes cantidades e incluyen Carbono(C), Hidrógeno (H), Nitrógeno(N), Fósforo (P), Potasio (K), Calcio (Ca), Magnesio (Mg), Azufre(S). b) Los micronutrientes por otro lado se requieren en pequeñas cantidades, su insuficiencia puede dar lugar a carencia y su exceso a toxicidad, se refieren a Hierro (Fe), Zinc (Zn), Manganeso (Mn), Boro (B), Cobre (Cu), Molibdeno (Mo), Cloro (Cl). Todas las plantas necesitan tomar del suelo 13 elementos minerales, de tal manera que si en un suelo no hubiese nada, cero gramos, de cualquiera de ellos, la planta moriría, porque todos son imprescindibles. • Un suelo rico en materia orgánica (humus) es rico en Nitrógeno (N). Cuanto más estiércol se agregue más Nitrógeno tendrá y por supuesto, más humus. Cuando se aporta materia orgánica a un suelo estás consiguiendo dos cosas: 1. Humus 2. Nutrientes minerales (nitrógeno, fósforo, descomposición de esta materia orgánica. potasio, azufre,...) de la A practicar Cuestionario 1. ¿Qué es el suelo? 2. ¿Cuál es la importancia del suelo como recurso natural? 1. ¿Por qué se considera que la principal función del suelo es la de productor de alimentos? 2. ¿Cuál es la relación entre el suelo y las plantas? 3. Además de la producción de alimentos, ¿qué otros beneficios aporta el suelo a los seres humanos? 12 4. Desde el punto de vista químico, ¿qué es el suelo? 5. ¿Cuáles son las tres fases que conforman el suelo? 3. Elabora un diagrama en el que señales los diferentes componentes del suelo 4. El suelo está formado tanto por sustancias orgánicas como inorgánicas ¿cuáles son las características físicas y químicas que permiten diferencias estos dos tipos de compuestos? 5. Explica la importancia de los siguientes minerales en el suelo y cuál es su función en las plantas 6. Sodio b) manganeso c) fósforo 7. ¿Para qué emplean las plantas el dióxido de carbono que absorben del aire? 8. ¿Por qué el agua es indispensable para los seres vivos? 9. ¿Cuáles son los principales compuestos inorgánicos que forman el suelo? ¿Qué son las sales y qué propiedades tienen? Los minerales en el suelo. Como recordarás, la fase sólida del suelo está formada principalmente por minerales los cuales son producto de la intemperización de la roca madre principalmente óxidos de silicio (SiO2), aluminio (Al2O3) y hierro (Fe2O3) las sales que las conforman son compuestos químicos formado por cationes (iones con carga positiva) enlazados a aniones (iones con carga negativa) mediante enlace iónico. Éstos tienen entre otras funciones dar soporte al suelo y aportar los nutrientes necesarios a las plantas, para ello tienen que ser solubles en agua para poder ser asimilable, se componen de iones positivos metálico combinados con iones negativos no metálicos. Las sales que son solubles en agua por lo general contienen al menos uno de los siguientes iones: Li+ (litio), Na+(sodio), K+(potasio), NH41+(amonio), NO31- (nitrato). Solo una sal que contenga un catión o anión soluble se disolverá en agua. En la tabla se presenta un resumen de los iones solubles en agua para los compuestos iónicos comunes. La tabla está organizada con base en el anión del compuesto, pero revela muchas cosas importantes acerca de los cationes. Observe que todos los compuestos iónicos comunes de los iones de metales alcalinos (grupo 1A de la tabla periódica) y del ion amonio (NH41+) son solubles en agua. 13 Ejemplos de iones solubles en agua Compuestos iónicos solubles Excepciones importantes Compuesto que contienen: *ion nitrato NO31* Iones cloruro Cl1Bromuro Br1Ioduro I1- Ninguna * Sulfato SO42- Compuestos de Sr2+, Ba2+ , Hg22+ Pb2+ Compuestos de Ag1+, Hg22+ y Pb2+ y A la fuerza que mantiene unidos a dos o más átomos para formar compuestos o moléculas se le conoce como enlace, los átomos que participan se estabilizarán tendiendo a lograr una configuración electrónica similar a la de un gas noble, para cumplir con la regla del octeto. En general, podemos decir que las fuerzas que mantienen unidos a los átomos son de origen eléctrico. La formación de un enlace químico entre dos o más átomos se producirá básicamente por ceder, aceptar o compartir electrones; los cuales pueden o no provenir de un mismo elemento. Los electrones de valencia, que están más alejados del núcleo en un átomo, serán los responsables de la formación del enlace excepto para el helio, que sólo tienen dos, por lo que los enlaces se forman mediante la atracción entre núcleos (positivos) y electrones (negativos) o mediante la atracción entre un ion positivo y uno negativo. La denominación “regla del octeto” surgió en razón de la cantidad necesaria de electrones para lograr la estabilidad de un elemento, es decir, el átomo queda estable cuando presenta en su capa de valencia (última capa de valencia) 8 electrones. Enunciada en 1916 por Walter Kossel y Gilbert N. Lewis. Propiedades de los compuestos iónicos Las propiedades de los compuestos iónicos pueden explicarse por el acomodo de los iones en una red cristalina, por ejemplo, el cloruro de sodio tiene un punto de fusión alto, debido a que cada catión sodio Na1+, rodea y es rodeado por 6 aniones cloruro Cl1- así para pasar del estado sólido al líquido no basta romper un enlace hay que romper 6, este costo extra de energía se traduce en una temperatura de fusión alta. 14 Los compuestos iónicos usualmente son sustancias muy duras, pero quebradizas. Esto también es consecuencia del arreglo cristalino, romper mecánicamente el enlace de un ion sujeto por varios iones de carga opuesta no es fácil, sin embargo, si se aplica la fuerza suficiente para desplazar ligeramente a los iones al acercarse los de cargas iguales las fuerzas de atracción se convierten en repulsión y el cristal se rompe. La representación de modelos atómicos de Bohr y Lewis para los elementos sodio (Na) y cloro (Cl) como se muestran en la siguiente imagen. Representación Na (sodio) 2 e- 2 e- 88ee- 1 e- 1e- Cl (cloro) 2e- 8 e- 7 e- Modelo de Bohr Representación de Lewis Na × Cl Notarás que el sodio con número atómico 11, tiene 2 electrones en su primer orbital, 8 en el segundo y solo 1 electrón en el último orbital, por lo que para formar compuestos y cumplir con la regla del octeto cede ese último electrón y se carga positivamente, formando un catión (Na1+), mientras que el cloro con número atómico 17, tiene 2 electrones en el primer orbital, 8 electrones en el segundo y 7 en el último orbital, por lo que para cumplir la regla del octeto y formar un compuesto, acepta el electrón del sodio y se carga negativamente formando un anión (Cl1-), formando así el enlace iónico del cloruro de sodio (NaCl). 15 La formación de iones que forman una sal sucede debido a la gran diferencia de electronegatividad entre ambos elementos catión -anión, por ello como se muestra en el ejemplo del modelo de Bohr, el electrón del átomo de sodio pasa a formar parte del átomo de cloro para formar un catión Na 1+ (metal) y un anión Cl1- (no metal). La representación de Lewis muestra únicamente los electrones de valencia de cada uno de los átomos, en ella se utilizan puntos para representar los electrones de uno de los átomos y cruces para el otro, esto es sólo para diferenciar su origen. En el siguiente esquema se muestra el diagrama de Lewis para las familias de los elementos representativos A practicar Escribe el diagrama de Lewis para los elementos: Elemento Rubidio Estroncio Galio Estaño Diagrama de Lewis Elemento Diagrama de Lewis Arsénico Selenio Bromo Kriptón Las propiedades y formación de los compuestos con enlace iónico se forman cuando existe una diferencia considerable en la electronegatividad( propiedad 16 periódica que nos ayuda a reconocer el modelo de enlace que forman los elementos cuando se combinan), Linus Pauling definió el concepto de electronegatividad como una representación del grado de atracción de un par de electrones en un enlace covalente y estableció una escala de valores de electronegatividad para diferentes elementos asignándole al flúor el valor máximo de 4 y al cesio un valor mínimo de 0.7. En la siguiente escala se muestran los intervalos de la diferencia de electronegatividad para los diferentes tipos de enlaces. Diferencia de electronegatividad Superior a 1.7 entre 0.5 y 1.6 entre 0 y 0.4 Tipo de enlace iónico covalente polar covalente no polar Analizando el siguiente ejemplo: Elemento Na Cl Diferencia de electronegatividad Electronegatividad 0.9 3.0 2.1 Por lo tanto como 2.1 >1.9, el enlace que se forma entre un átomo de cloro y uno de sodio es iónico. A practicar De acuerdo a los valores de electronegatividad de la tabla determina qué tipo de enlace presentan las siguientes sustancias: Sustancia Diferencia de Tipo de enlace Electronegatividades BaO Na2O NaF AlBr3 H2O N2 17 Tabla de valores de electronegatividad de Pauling La sal cloruro de sodio NaCl no solo se puede hablar de moléculas sencillas, en realidad es una combinación de muchos iones sodio Na+, con muchos iones cloruro Cl1-, formando una red cristalina, en estado sólido se encuentran acomodados de tal forma, que cada catión sodio está rodeado por seis aniones cloruro y a su vez cada anión cloruro está rodeado por seis cationes sodio como se muestra en el siguiente modelo: La solubilidad de las sales se explica mediante las interacciones electrostáticas que ocurren entre el disolvente y el soluto. Se dice que el agua es un disolvente polar porque sus moléculas actúan como pequeños dipolos, en los que la carga negativa está situada en el oxígeno y la positiva en el átomo de hidrógeno. Cuando una sal entra en el seno del líquido las moléculas de agua rodean a los aniones y cationes, se orientan según la carga del ion. Aunque el efecto de un solo dipolo no es significativo en conjunto separan al ion de su red cristalina dejándolo rodeado (solvatación) y lo disuelve. En la disolución de cloruro de sodio NaCl, las partículas cargadas se mueven libremente para conducir una corriente eléctrica. En estado sólido, los compuestos iónicos no son conductores de electricidad debido a la posición fija en 18 los iones. No obstante, en estado líquido, o cuando se disuelven en agua, los compuestos iónicos son conductores eléctricos porque los iones se mueven libremente, como se muestra en el siguiente modelo de disolución o solvatación de cloruro de sodio NaCl en agua. Para determinar si una sustancia en disolución es un electrólito o un no electrólito (no conduce), se utiliza un sencillo aparato, constituido por un par de electrodos conectados a un foco, una pila y un vaso de precipitados, si el foco enciende se trata de un electrólito, en caso contrario es un no electrólito. Svante Arrhenius explicó que cuando un electrólito se disuelve en agua se disocia dando lugar a partículas, unas con carga negativa y otras con carga positiva, denominadas iones. Al pasar una corriente eléctrica a través de la disolución, los iones se mueven hacia los electrodos de carga opuesta, de tal manera que los iones positivos, llamados cationes, se dirigen hacia el electrodo negativo o cátodo porque atrae los cationes hacia él y los iones negativos llamados aniones, se dirigen hacia el electrodo positivo o ánodo, este movimiento permite el flujo de la corriente eléctrica, como se muestra en el siguiente esquema conocido como celda electrolítica En los electrodos se produce transferencia de electrones proceso conocido como oxidación– reducción (redox) donde la oxidación representa la pérdida de electrones (el número de oxidación aumenta de reactivos a productos) y reducción representa ganancia de electrones (el número de oxidación disminuye de reactivos a productos). 19 El número de oxidación de cada elemento estará definido por el número de electrones que se encuentren en el último nivel de energía, que a su vez está asociado con el grupo en el que se ubica cada elemento en la tabla periódica en la que podemos observar que algunos elementos poseen más de un número de oxidación. Para ejemplificar, se muestran los números de oxidación de los elementos del período 1. Grupo Elemento Número de oxidación 1 Li 1 2 Be 2 3 B 3 4 C 2,+ - 4 5 N 2, +-3,4,5 6 O -2 7 F -1 8 Ne 0 El cálculo del número o estado de oxidación está determinado por las siguientes reglas básicas: 1. Los átomos de un elemento puro tienen número de oxidación igual a cero. 2. La suma de los números de oxidación para los átomos de elementos que forman un compuesto estable es igual a cero. 3. La carga de un ion es igual a la suma de los números de oxidación. Como se muestra en los siguientes ejemplos: Compuesto Número de oxidación Elemento 1 Elemento 2 Na3N Nitruro de sodio +1×3 átomos de sodio (Na) + -3 × 1átomos de nitrógeno (N)= MnCl2 Cloruro de +2×1 átomos de manganeso manganeso II + -1 ×2 átomos de cloro= Carga neta 0 0 A practicar Calcula el número de oxidación de las siguientes sales Compuesto Número de oxidación Elemento 1 Elemento 2 Carga neta CuH NaCl Al2O3 MgS 20 Los iones negativos o aniones ceden electrones al ánodo (oxidación) y los iones positivos o cationes toman electrones del cátodo (reducción). Lo que ha ocurrido es una reacción de tipo óxido-reducción o redox donde la fuente de alimentación eléctrica ha sido la encargada de aportar la energía necesaria. A la producción de una reacción química mediante la energía eléctrica se le denomina electrólisis, y tiene múltiples aplicaciones, por ejemplo, en la purificación de metales como el cobre, la electrólisis del agua, la obtención de aluminio a partir de bauxita (Al2O3•2H2O) como se muestran en los siguientes ejemplos: Cuando se someten a electrólisis soluciones concentradas de cloruro de sodio, los productos son hidróxido de sodio, hidrógeno y cloro. La reacción general es: 2Na+(ac) + 2OH1-(ac) + H2(g) + Cl2(g) 2NaCl + 2H2O(l) Electrólisis La reacción puede escribirse en forma gradual como semirreacciones Cl1- Cl20 + 2 eNúmero de oxidación de 1- a 0 en productos semirreacción de oxidación (ánodo) (oxidación) en reactivos Durante la electrolisis, los iones sodio Na+ se desplazan hacia el cátodo y los iones cloruro Cl- hacia el ánodo, aun cuando los iones Na+ son atraídos hacia el cátodo, los hechos demuestran que ahí se libera hidrógeno. No se encuentra ninguna evidencia de que haya sodio metálico, pero el área que rodea al cátodo da prueba de ser alcalina a causa de los iones OH 1- acumulados. La reacción en el cátodo es: 2H2O(l) + 2e- H2(g) + 2OH1-(ac) H1+ → H20 semirreacción de reducción (cátodo) + Número de oxidación de 1 en reactivos a 0 en productos (reduce) Si la electrólisis prosigue hasta que reaccione todo el cloruro Cl1-, la solución que queda contendrá sólo hidróxido de sodio NaOH y por evaporación se obtendrá en estado sólido. Mediante este proceso se preparan grandes cantidades de hidróxido de sodio NaOH y cloro Cl2(g). 21 Cuando se somete a electrólisis el cloruro de sodio NaCl(l) fundido (sin agua) se forman sodio metálico Na(l) y cloro gaseoso Cl2(g). Como se muestra en la siguiente reacción: 2NaCl (l) → 2 Na(l) + Cl2(g) Electrólisis 2Na+(l) + 2 Cl1-(l) → 2Na(l) + Cl2(g) Electrólisis Semirreacciones: Oxidación (ánodo): Cl1- → Cl2 0 Reducción (cátodo): Na1+ → Na0 número de oxidación 1- a 0 número de oxidación de 1+ a 0 A practicar 1.- Para las siguientes semirreacciones describe si hay ganancia o pérdida de electrones y concluye si se trata de un proceso de oxidación o de reducción, sigue el ejemplo. Semirreacción Descripción del proceso Conclusión Fe2+ →Fe3+ + 1 e- El hierro pierde 1 electrón Se oxida F20 + 2 e- → 2 F1N5+ → N3+ + 2eAl3+ + 3e- → Al0 O20 + 4e- → 2O2S2- → S0 + 2 e- 22 2.-En los siguientes ejemplos identifica si en la semirreacción es de tipo redox o no redox, analiza el ejemplo. Ba 2+ Ba0 F0 F1- Ca0 Ca0 Mn7+ Na1+ Na0 Br1- Br1- V5+ Cl 20 Cl 1- Al 3+ Al 3+ Mg0 Mn7+ Au1+ Au1+ redox C2+ O2- C4+ O20 V5+ Mg2+ N0 N0 Hg2+ Hg2+ ¿Cómo se representan y nombran las sales en el lenguaje de la química? Nomenclatura de los compuestos químicos según la IUPAC La Unión Internacional de Química Pura y Aplicada (IUPAC) se formó en 1919 por químicos pertenecientes a diferentes ramas de la industria, personal académico e investigadores. Este organismo se encarga de definir las reglas para nombrar a los diferentes compuestos químicos. A continuación se describirán las reglas básicas de nomenclatura para los compuestos de origen inorgánico, en esta guía se detallara principalmente la nomenclatura de tipo Stock. 23 Nomenclatura Stock Este sistema se basa en la representación del nombre genérico (catión) más el específico (anión) y a continuación, si el elemento tiene más de un número de oxidación se indica el correspondiente con números romanos, sin signo y entre paréntesis. Número de oxidación Para definir el nombre de algunos compuestos es necesario tener claro el concepto de valencia o número de oxidación y su determinación en las fórmulas. Este número es importante, ya que determina la capacidad de combinación de los átomos. El número de oxidación de cada elemento es un número entero que representa el número de electrones que un átomo pone en juego cuando forma un compuesto determinado. El número de oxidación es positivo si el átomo pierde electrones, o los comparte con un átomo que tenga tendencia a captarlos. Y será negativo cuando el átomo gane electrones, o los comparta con un átomo que tenga tendencia a cederlos. La capacidad de combinación para formar compuestos dependerá de la configuración electrónica de los átomos y del elemento o elementos que se combinen químicamente. En la tabla periódica se indica el número de oxidación o valencia para cada uno de los diferentes elementos y se puede observar que algunos poseen más de uno. Se han mencionada anteriormente las reglas para determinar el número oxidación o valencia. Cuando nos refiramos al número de oxidación el signo positivo (+) o negativo (-) lo escribiremos a la izquierda del número, como en los números enteros. Por otra parte la carga de los iones, o número de carga, se debe escribir con el signo a la derecha del dígito: Ca+2, ión (catión) calcio (2+), CO3-2, ión (anión) carbonato (2-). Por lo que la fórmula resultante es: carbonato de calcio CaCO3, podemos darnos cuenta que el compuesto formado no tendría carga, es decir los iones neutralizarían su carga. 24 Recuerda algunos números de oxidación que están en la siguiente tabla Números de oxidación de elementos Elementos H O Grupo 1 (metales alcalinos) Grupo 2 (metales alcalino-térreos) Grupo 13 (térreos) Grupo 14 (carbonoideos, excepto Si, Ge = +4) Grupo 15 (nitrogenoideos) Número de oxidación más frecuente +1, excepto en hidruros metálicos (-1) -2, excepto en los peróxidos (-1) +1 +2 +3 +2, +4, en los Carburos (-4) +1, +3, +5 en los Nitruros (-3), Fosfuros Grupo 16 (anfígenos, excepto O) (-3) +2, +4, +6, en los óxidos (-2) Grupo 17 (halógenos, excepto F = -1) Grupo 6 Grupo 7 Grupos 8,9,10 Metales Grupo 10 Grupo 11 de Grupo 11 Grupos 11, 12 transición Grupo 12 Cr Mn Fe, Co, Ni Pt Ag Au Cu, Hg Zn, Cd +1, +3, +5, +7 +2, +3, +6, +2, +4, +6, +7 +2, +3 +2, +4 +1 +1,+3 +1, +2 +2 +2, +4 Números de oxidación de elementos en compuestos Compuesto Números de oxidación de los elementos del anión Catión Anión Fórmula Bromato de calcio Ca2+ BrO31- Br5+ O-2 Ca(BrO3)2 Hipoclorito de sodio Na+ ClO1- Cl1+ O-2 NaClO Sulfato de aluminio Al3+ SO42- S6+ O-2 Fosfato de magnesio Mg2+ PO43- P5+ O-2 Nitrato de hierro(III) Fe3+ NO3 1- N5+ O-2 Al2(SO4)3 Mg3(PO4)2 Fe(NO3)3 25 A practicar Determina el número de oxidación de los elementos en las siguientes sales Compuesto AlCl3 MnO2 K2S . Compuesto Na3PO4 Co(NO3)3 K2SO4 Número de oxidación Al= Cl= Mn= O= K= S= Número de oxidación Na= P= Co= N= K= S= Compuesto CaHSO4 Ca= KLiSO3 K= Ca(HCO3)2 Ca= Carga neta Carga neta O= O= O= Número de oxidación H= S= Li= S= H= C= Carga neta O= O= O= Descripción de los sistemas de nomenclatura Una vez que hemos analizado el sistema de asignación de números de oxidación o valencia podemos iniciar con la descripción de los sistemas de nomenclatura. Ácidos (hidrácidos y oxiácidos) Describiremos la nomenclatura clásica o tradicional, todos los ácidos tienen en su estructura al menos un átomo de hidrógeno que se representará a la izquierda en la fórmula. El nombre comenzará siempre con la palabra ácido, seguido de la raíz del nombre del elemento base, el cual generalmente será un no metal o un metal de transición, luego, se escribirá el prefijo o sufijo correspondiente, y éste dependerá del número de valencia u oxidación que posea el elemento base. Para esto último se deben considerar las siguientes reglas: 1.- La terminación hídrico, correspondiente a los ácidos que no poseen oxígenos en sus estructuras y siempre serán compuestos binarios. 2.- La terminación oso corresponderá a los ácidos con el menor número de oxidación y la terminación ico corresponde a los del mayor número de oxidación del no metal o metal, lo cual dependerá del número de oxígenos presentes en la fórmula. 3.- Los prefijos Hipo y Per, se utilizarán para diferenciar entre dos números de oxidación bajos, Hipo para el más bajo y Per para el más alto. En general tenemos la siguiente tabla: 26 Prefijo y sufijo Número de oxidación Hipo______oso 1,2 ________oso 3,4 ________ico 5,6 Per _____ico 7 Hidrácidos Para nombrar el ácido formado por cloro e hidrógeno, se antepondrá la palabra ácido seguida de la raíz del nombre del elemento base y la terminación hídrico. HCl ácido clorhídrico Oxiácidos Este grupo de ácidos contienen al menos un átomo de oxígeno en su estructura, el cual se representará siempre a la derecha. H2MnO2 ácido hipomanganoso A practicar Completa la siguiente tabla; para ello, escribe las fórmulas de los compuestos faltantes, considerando los números de valencia de los elementos y el número de átomos de oxígenos presentes. Acido+ ____hídrico Cl HCl Br I N Hipo______oso HClO ________oso HClO2 ________ico HClO3 Per _____ico HClO4 clor C Mn S ---------- ------------------- P --------- -------- --------- -------- ---------brom yod nitr carbon ------mangan sulfur --------fosfor Puedes practicar la nomenclatura tradicional y la de IUPAC, para los oxiácidos y algunos compuestos inorgánicos, la siguiente página electrónica. 27 http://www.juntadeandalucia.es/averroes/recursos_informaticos/proyectos2003/quimica/quim_ino.html Clasificación de sales Una vez que has comprendido el mecanismo de nomenclatura para los ácidos, te será más fácil entender el proceso de nomenclatura de las sales. Una sal se forma cuando el o los hidrógenos del ácido son sustituidos por un metal. En otras palabras, el anión que forma el compuesto proviene de un ácido. Un ejemplo sencillo de la formación de una sal se da cuando en el ácido clorhídrico (HCl) se cambia el H+1 por Na+1 y entonces se formará cloruro de sodio (NaCl). Para nombrar a estos compuestos, siguen las siguientes reglas: 1.- Se suprime la palabra ácido y se toma como base el nombre del elemento central en la fórmula del ácido. 2.- La terminación hídrico se sustituirá por la terminación uro. 3.- La terminación oso se sustituirá por la terminación ito. 4.- La terminación ico se sustituirá por la terminación ato. 5.- Las prefijos hipo y per se conservan 6.- Se termina con el nombre del metal que sustituye al hidrógeno. De manera que al aplicar las reglas tenemos lo siguiente. Ácido Nombre Sal Nombre Ácido clorhídrico Ácido fluorhídrico Ácido hipocloroso Ácido hipomanganoso Ejemplo de elemento que sustituye al H Na Li K Ca HCl HF HCIO H2MnO2 NaCl LiF KClO CaMnO2 HNO2 H2SO3 H3PO4 H2CO3 Ácido nitroso Ácido sulfuroso Ácido fosfórico Ácido carbónico Na Be Ca Mg NaNO 2 BeSO3 Ca3(PO4)2 MgCO3 HClO4 Ácido perclórico Na NaClO4 Cloruro de sodio Fluoruro de litio Hipoclorito de potasio Hipomanganito de calcio Nitrito de sodio Sulfito de berilio Fosfato de calcio Carbonato de magnesio Perclorato de sodio Aquellas sales que contienen hidrógeno en sus estructuras se nombran como sales ácidas, por ejemplo: 28 Ácido Nombre Sal Nombre Ácido fosfórico Ácido carbónico Ejemplo de elemento que sustituye al H Na Li H3PO4 H2CO3 Na2HPO4 LiHCO3 Ácido hipomanganoso K KHMnO2 Fosfato ácido de sodio Carbonato ácido de litio Hipomanganito ácido de potasio H2MnO2 A practicar Completa la siguiente tabla, asignando el nombre o representando la fórmula para cada uno de los siguientes ácidos, posteriormente sustituye al menos un hidrógeno por los elementos metálicos para formar una sal binaria o una sal ácida y escribe el nombre de la sal que se forma. Ácido Nombre Elemento que sustituye al H Sal Nombre HClO2 HBrO2 HIO3 HI HBrO4 HNO2 Ácido selenioso Ácido fluorhídrico Ácido sulfúrico Ácido clórico Ácido nítrico Ácido permangánico Ácido carbónico Ácido selénico Ácido fosforoso Es necesario indicar que en las fórmulas de sales, se escribe primero el catión y después el anión, además, en todas las fórmulas debe cumplirse que la carga neta del compuesto debe ser igual a cero. Para formar diferentes tipos de compuestos en las siguientes tablas se muestran las fórmulas de algunos cationes y aniones presentes en el suelo. 29 Tabla de cationes Na+ Sodio* B3+ Boro* 1 Pb2+ Plomo (II) + 6+ 2 4+ K Potasio* Mo Molibdeno* Pb Plomo (IV) NH41+ Amonio Fe3+ Hierro (III) * Cu+ Cobre (I) 2+ 2+ 3+ Mg Magnesio* Fe Hierro (II) Al Aluminio Ca2+ Calcio* Ag+ Plata Hg2+ Mercurio (II) Cu2+ Cobre (II)* Au3+ Oro Li+ Litio Zn2+ Zinc (II)* Cr3+ Cromo (III) Cd2+ Cadmio Mn2+ Manganeso (II)* Cr6+ Cromo (VI) Co2+ Cobalto (II) 1 2 * Son los cationes presentes en el suelo, como Borato, como Molibdato Tabla de Aniones CO3-2 S-2 SO4-2 SO3-2 PO4-3 PO3-3 Cl 1NO3-1 NO2-1 MnO4 -1 H1- BO33BO22B4O72B2O54B3O75MoO4 1SeO32SeO42CrO42Cr2O72N3- Carbonato* Sulfuros* Sulfato* Sulfito Fosfato* Fosfito Cloruro* Nitrato* Nitrito Permanganato Hidruro I1ClO 1ClO2 1ClO31ClO41IO31IO41AsO43AsO2C2O42P3- Borato* Metaborato Tetraborato Diborato Triborato Molibdato* Selenito Selenato Cromato Dicromato Nitruro Ioduro Hipoclorito Clorito Clorato Perclorato Iodito Iodato Arseniato Arsenito Oxalato Fosfuro *Aniones presentes en el suelo A practicar 1.- Escribe la fórmula de las sales que se forman al combinar los siguientes iones. Anión vs Catión 1- Br 2+ Ca 3+ Al O 2- 2- S CO3-2 4 CrO42- 5 PO3-3 6 ClO41- 1 2 3 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 33 34 35 AlBr3 2+ Fe 3+ Fe Fe2(CO3)3 29 30 31 32 1+ Na 30 1- Br Mn O 2- 2- CO3-2 S 36 37 38 43 44 45 39 CrO42- 40 PO3-3 41 ClO41- 42 7+ 46 47 48 49 5+ V 2.- Escribe el nombre químico según la nomenclatura tipo Stock de los compuestos formados en la tabla anterior 1- Br 2+ Ca 3+ Al O 2- 2- CO3-2 S CrO42- PO3-3 ClO41- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 Bromuro de aluminio 2+ Fe 3+ Carbonato de hierro (III) Fe 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 1+ Na Mn 7+ 5+ V Óxidos metálicos y no metálicos (O2-) A los compuestos binarios que contienen oxígeno se les conoce como óxidos y pueden estar enlazados a un metal o un no metal. En la fórmula de estos compuestos el oxígeno aparece siempre a la derecha. Su nombre se formará con la palabra óxido de más el nombre del elemento metálico o no metálico. En el caso de la nomenclatura Stock se indicará el número de oxidación o valencia con números romanos entre paréntesis como se muestran los siguientes ejemplos: 31 Fórmula Nomenclatura Stock FeO Óxido de hierro (II) Co2O3 Óxido de cobalto (III) Hg2O Óxido de mercurio (I) PtO2 Óxido de platino (IV) A practicar Completa la siguiente tabla, asignando el nombre o representando la fórmula del compuesto para cada uno de los siguientes óxidos. Fórmula Nomenclatura Stock Al2O3 MnO HgO BaO Au2O3 Óxido de potasio Óxido de cobre (II) Óxido de cromo (III) Óxido de hierro (III) Óxido de cobalto (II) Óxido de plata Hidruros metálicos (H1-) Cuando se enlaza un metal con hidrógeno se forma un compuesto binario que recibirá el nombre de hidruro. El nombre se forma con la palabra hidruro más el nombre del elemento, en esta representación el hidrógeno debe aparecer a la derecha en la fórmula. Se aplican las reglas antes descritas para la nomenclatura Stock, como se ejemplifica en la siguiente tabla: 32 Fórmula Nomenclatura Stock CuH Hidruro de cobre (I) AlH3 Hidruro de aluminio SnH4 Hidruro de estaño (IV) FeH3 Hidruro de hierro (III) A practicar Completa la siguiente tabla, asignando el nombre o representando la fórmula del compuesto para cada uno de los siguientes hidruros metálicos. Fórmula Nomenclatura Stock NaH KH CaH2 BeH2 MnH3 FeH2 Hidruro de titanio (II) Hidruro de manganeso (IV) Hidruro de Litio Hidruro de vanadio (IV) Hidruro de Plomo (IV) Hidruro de aluminio Hidruro de mercurio (II) Hidróxidos (OH-) Este grupo está formado por compuestos ternarios, cuya composición básica estará dada por un anión hidróxido y un metal (catión). Su nombre se compone 33 por la palabra hidróxido de más el nombre del metal. En este caso también se aplican las reglas antes descritas como se muestran en los siguientes ejemplos: Fórmula Nomenclatura Stock LiOH Hidróxido de litio NaOH Hidróxido de sodio Ba(OH)2 Hidróxido de bario Fe(OH)3 Hidróxido de hierro (III) A practicar Completa el siguiente cuadro y asigna el nombre o la fórmula que corresponde a cada uno de los siguientes compuestos. Fórmula Nomenclatura Stock Hg(OH)2 KOH Ca(OH)2 Al (OH)3 Fe(OH)2 Hidróxido de níquel (II) Hidróxido de Plata Hidróxido de bario Hidróxido de manganeso (VII) Hidróxido de magnesio Hidróxido de vandio (IV) Oxisales Son compuestos ternarios formados por un metal, un no metal y oxígeno. Se forman al neutralizar una base con un oxiácido. Ejemplos: 34 Fórmula Nomenclatura Stock Na2CO3 Carbonato de sodio AlPO4 Fosfato de aluminio Ca(NO3)2 Carbonato de calcio K2Cr2O7 Dicromato de potasio A practicar Completa el siguiente cuadro y asigna el nombre o la fórmula que corresponde a cada uno de los siguientes compuestos. Fórmula Nomenclatura Stock CuCrO4 Ba(MnO4)2 Mg(IO3)2 Na2SO3 CaSO4 Clorato de potasio Sulfato de titanio (III) Carbonato de cobre (II) Nitrito de sodio Clorito de potasio Perclorato de calcio ¿Cuál es el alimento para las plantas? Los vegetales a diferencia de los animales son capaces de fabricar su propio alimento a partir de: Agua y sales minerales que toman del suelo a través de sus raíces 35 Gases que toman del aire La luz del sol Con estos componentes las plantas producen otras sustancias más complejas que utilizan para crecer y realizar sus funciones vitales, la fotosíntesis es el mecanismo por el que se producen estas sustancias complejas Las plantas se nutren de sales minerales (conocidos como fertilizantes) disueltas en agua, las cuales se dividen en macronutrientes, los cuales la planta los requiere en mayores cantidades (niveles de 11 kg por hectárea para el N 2 nitrógeno o 10 kg por hectárea para el P fósforo) y micronutrientes, en cantidades mucho menores (niveles de 500 g por hectárea para el Fe hierro de 10 mg por hectárea para el Mo molibdeno). Algunos de los factores que afectan la cantidad de nutrientes, para las plantas, disponibles en el suelo son: La calidad del suelo La calidad del agua El tipo de planta En el siguiente esquema se muestran los macro y micro nutrientes en su forma asimilable por las planteas. ¿Cómo mejorar un suelo deficiente en sales? Un suelo puede perder sus nutrientes al no ser explotado de forma adecuada, por ejemplo usar un solo cultivo y no rotarlos, también por salinización o acidificación 36 (lluvia acida) de los mismos, por erosión ocasionada por agua (inundaciones) o por el viento, por uso ganadero, también por ser sobreexplotados, etc. Se recomienda rotar los cultivos, que consiste en alternar las familias de cultivos con diferentes necesidades de nutrición en un mismo lugar. Normalmente con el tiempo los suelos al ser cultivados suelen ser deficientes en nutrientes, esta situación se debe adicionalmente al intemperismo y a los procesos microbiológicos para recuperarlos son muy lentos. Para reponer los nutrientes de un suelo, se adicionan sustancias químicas, como las sales, que se conocen como fertilizantes, los cuales se obtienen por dos tipos de reacciones químicas: reacciones redox y reacciones no redox (ácido – base). Para estas situaciones se utilizan los llamados fertilizantes químicos, los cuales proporcionan los nutrientes requeridos para el desarrollo de las plantas. ¿Cómo se obtienen las sales? Se dice que un suelo es pobre en sales, cuando las plantas extraen esos nutrimentos; para reponer éstas sustancias químicas se aplican los fertilizantes químicos. Un fertilizante es un material que proporciona uno o más nutrientes que necesitan los vegetales para su crecimiento y desarrollo. Como se ha mencionado anteriormente, las sales son los compuestos químicos obtenidos de la combinación de un elemento metálico con un elemento no metálico. No olvides que los fertilizantes se aplican al suelo con el propósito de incrementar el crecimiento de las plantas y el rendimiento de las cosechas. Ahora vas a conocer los diferentes tipos de reacciones químicas que existen para la obtención o síntesis de las sales (fertilizantes); en párrafos anteriores se mencionó que pueden ser por reacciones redox o por reacciones no redox. Reacciones químicas de obtención de sales A) Síntesis o combinación. La reacción de un metal y un no metal, reacción Redox (cambios en el número de oxidación de reactivos a productos) Metal + No metal Ca + Cl2 Calcio + cloro B) Sal (binaria) CaCl2 cloruro de calcio De desplazamiento simple 37 La reacción de un metal con un ácido, reacción Redox ( hay cambios en el número de oxidación de reactivos a productos) Metal + Acido Zn Sal (binaria) + Hidrógeno + 2HCl ZnCl2 Zinc + ácido clorhídrico H2 cloruro de zinc + hidrógeno Doble sustitución, reacción no Redox ( No hay cambios en el número de oxidación de reactivos a productos) C) Ácido + Base 2HCl + Sal (binaria) + Agua (neutralización) Mg(OH)2 MgCl2 Ácido clorhídrico + hidróxido de magnesio + H2O cloruro de magnesio + agua La reacción entre dos sales, reacción no Redox ( No hay cambios en el número de oxidación de reactivos a productos) D) Sal 1 + Sal 2 CaCl2 + Cloruro de calcio + Na2SO4 sulfato de sodio Sal 3 + Sal 4 2NaCl cloruro de sodio + + CaSO4 sulfato de calcio A practicar En la primera columna de la siguiente tabla encontrarás una serie de reacciones de obtención de sales. Clasifícalas como de síntesis, descomposición de sustitución sencilla o sustitución doble o de neutralización e indícalo en la segunda columna. Reacción Tipo de reacción 2Fe + 3Cl2 → 2FeCl3 HNO3 + NaOH → NaNO3 + H2O 2AlCl3 + 3Na2S → 6NaCl + Al2S3 2NaCl → 2Na + Cl2 Mg + 2HCl → MgCl2 + H2 38 ¿Cómo ayuda la química a determinar la cantidad de sustancia que intervienen en las reacciones de obtención de sales? ¿Qué nos dicen las ecuaciones? Las reacciones químicas que se llevan a cabo en la vida cotidiana o en el laboratorio, pueden ser representadas mediante ecuaciones, las cuales utilizan una simbología que nos proporciona información acerca del estado de agregación de las sustancias reaccionantes y sobre las condiciones en las que se efectúa la reacción Sin embargo, una ecuación química no está completa en tanto no esté balanceada, porque una ecuación química balanceada cumple con la ley de conservación de la materia y en ella podemos observar que durante el proceso los átomos y la masa se conservan. El procedimiento general para balancear ecuaciones es el siguiente: Paso 1 Identificación de la reacción. Escribe una descripción o ecuación en palabras de la reacción; por ejemplo, considera la descomposición del óxido de mercurio II en mercurio y oxígeno. Óxido de mercurio II mercurio + oxígeno Paso 2. Escritura de la ecuación (el esqueleto) sin balancear, asegúrate de que la fórmula de cada sustancia esté correcta y de que los reactivos estén escritos a la izquierda y los productos a la derecha de la flecha. En nuestro ejemplo HgO Hg + O2 Se deben conocer las fórmulas correctas o deducirlas consultando la tabla periódica, listas de iones o datos experimentales. Paso 3. Balanceo de la ecuación. Utiliza el siguiente procedimiento cuando sea necesario: cuenta y compara la cantidad de átomos de cada elemento en cada miembro de la ecuación y determina los que se deben balancear: el Hg está balanceado (1 de cada lado), el oxígeno necesita balancearse (1 en el lado de los reactivos, 2 en el lado de los productos). Balancea cada elemento, uno a la vez, escribiendo números enteros (coeficientes) antes de las fórmulas donde aparezca el elemento sin 39 balancear. De ordinario, lo más conveniente es balancear los metales, después los no metales y luego el hidrógeno y el oxígeno. Selecciona los coeficientes mínimos que den la misma cantidad de átomos del elemento en cada lado. Un coeficiente antes de una fórmula indica que debes multiplicar cada átomo de la fórmula por ese número (por ejemplo, 2H 2SO4 representa dos moléculas de ácido sulfúrico y también cuatro átomos de H, dos átomos de S y ocho átomos de O). Coloca un 2 antes de HgO para balancear el O: 2HgO Hg + O2 Comprueba que los demás elementos queden balanceados, para ver si al balancear un elemento dado quedan sin balancear otros. Efectúa los ajustes necesarios. Ahora el mercurio (Hg) no está balanceado. Para ajustarlo escribimos el coeficiente estequiométrico 2 antes del Hg: 2HgO 2Hg + O2 balanceada haz una comprobación final, asegurándote que cada elemento y/o ion poliatómico esté balanceado y de que hayas empleado el conjunto mínimo posible de coeficientes enteros. 2HgO(s) 2Hg (l) + O2(g) A practicar Balancea por el tanteo o inspección las siguientes ecuaciones químicas. Al2(CO3)3 → Al2O3 + CO2 FeCl3 + NaOH → Fe(OH)3 + NaCl Bi2S3 + HCl → BiCl3 + H2S K3PO4 + BaCl2 → KCl + Ba3(PO4)2 Fe + Cl2 → FeCl3 Estequiometría Estequiometría es la rama de la química que estudia la relación entre la cantidad de reactivos y productos. Es decir da cuenta de la proporción en la que se combinan los reactivos para producir una determinada cantidad de productos. Así que si conocemos la cantidad de reactivos que se combinan y si podemos expresar la reacción que se efectúa, mediante una ecuación química balanceada, 40 podremos calcular la cantidad de productos que se obtiene, deduciendo la relación estequiométrica que guardan reactivos y productos en dicha reacción química. La cantidad de reactivos y/o productos pueden estar dadas en mol, en masa (gramos) o en volumen (litros). Para deducir la relación estequiométrica es necesario calcular la masa molar de cada término de la ecuación balanceada, a partir de las masas atómicas y masas moleculares. Pero, ¿Cuál es el significado de estos términos y cómo podemos realizar su cálculo? Masa atómica y masa molecular Sabemos que cuando hablamos de masa atómica nos estamos refiriendo a la masa de un átomo. La masa de un átomo es muy pequeña para medirla individualmente en una balanza, la masa del átomo de hidrógeno es de 1.6736*10-24g. Sin embargo, no es conveniente ni práctico comparar las masas reales de los átomos, expresadas en gramos; esa es la razón por la que se inventó una tabla de masas atómicas relativas, en la que se usan unidades de masa atómica (uma). Para realizar el cálculo de masas atómicas relativas, se tomó como patrón de referencia al isótopo carbono 12. A este isotopo se la asignó un valor exactamente igual a 12 veces la unidad de masa atómica. Por lo que se define la unidad de masa atómica (uma) igual a 1/12 de la masa de un átomo de carbono 12. Una analogía sencilla ayudará a ilustrar este punto. Supongamos que deseamos relacionar el peso de cada una de las personas del salón de clases al de una sola persona como patrón de referencia. A esta persona la llamaremos Julio Ramos. Este preciso día, Julio pesa 200 libras y vamos a asignarle una masa relativa de 12 unidades en una escala arbitraria. Ya que el peso de una persona varía diariamente, debemos elegir un día en particular. Podríamos hablarle asignado un valor de 10, 15, 20 o cualquier otro, pero en forma arbitraria seleccionamos un valor de 12. Ahora otra persona del mismo salón pesa 266 libras o 1.33 (266/200) veces lo que pesa Julio Ramos, por lo tanto, estas personas tendrán una masa relativa de 16 unidades (1.33*12). Una relación similar se podría aplicar a cada integrante de la clase para asignarle una masa relativa, con base en el peso de Julio de ese día en particular. 41 Como la mayor parte de los elementos son mezclas de isótopos con diferente masa, el peso atómico determinado para un elemento representa la masa relativa promedio de todos los isótopos naturales del dicho elemento. De igual forma, cuando se habla de la masa molecular se refiere a la masa de una molécula la cual también se expresa en uma. Para tener una idea de lo pequeño que es esta unidad baste decir que 1 uma es igual a 1.660 x 10 -24g, ya que la unidad de masa atómica se refiere a la doceava parte (1/12) de la masa del átomo de carbono 12. El mol En nuestra vida cotidiana, compramos naranjas por docenas, bolsas por cientos, tabiques por millares, calcetines por pares etc. Frecuentemente utilizamos unidades para contar y para cada unidad, tenemos en mente un valor numérico; por ejemplo: ya sea que contemos una docena de naranjas, una docena de guayabas o una docena de huevos, numéricamente tendremos 12 piezas de cada especie. De forma análoga, los químicos también se ven en la necesidad de contar con la única diferencia de que lo que cuentan es infinitamente pequeño, porque así lo son los átomos y las moléculas. Estos tienen una tamaño aproximado a 1x10 -9 m, son más pequeños que los microorganismos cuyo tamaño es del orden de 1x10-5 m. Para tener una idea de lo pequeño que son los átomos basta decir que si comparamos la relación que guarda un átomo, una pelota de golf y la tierra. La pelota de golf es tantas veces mayor que un átomo como la tierra lo es respecto a la pelota de golf. Para contar partículas, los químicos utilizan como unidad al mol. El mol es la unidad de la magnitud fundamental denominada cantidad de sustancia, esto en el Sistema Internacional de medidas. La cantidad de sustancia expresa el número de átomos, iones, moléculas, electrones presentes en una muestra. Sistema Internacional de unidades Magnitud fundamental Unidad en la que se expresa Masa kilogramo (kg) Tiempo segundos (s) 42 Temperatura kelvin (K) Intensidad luminosa candela (cd) Intensidad de corriente amperio (A) Cantidad de sustancia mol (mol) El mol tiene un valor numérico igual a 6.023x10 23 átomos, moléculas, que se conoce como el número de Avogadro y así como una docena de naranjas tiene doce naranjas y una docena de guayabas tiene 12 guayabas, un mol de moléculas de agua tiene 6.023x1023 moléculas de agua como un mol de átomos de oro tiene 6.023x1023 átomos de oro. Ahora bien, las naranjas son diferentes a las guayabas en varias de sus características, entre ellas la masa, por lo que 12 naranjas no tendrán la misma masa que 12 guayabas. De forma análoga, un mol de moléculas de agua tendrá una masa diferente a la que tiene un mol de átomos de oro. Masa Molar (M.M) Si se conoce la fórmula de un compuesto su masa molar (M.M) se puede determinar sumando las masas atómicas de todos los átomos de la fórmula, si hay más de un átomo de cualquier elemento, su masa se debe sumar tantas veces como aparezca en el compuesto. A practicar 1.- Consulta la tabla periódica la masa atómica de los siguientes elementos. a. b. c. d. e. f. Sodio Na=_____ Cloro Cl =_____ Fósforo = _____ Calcio=______ Plata=_____ Estroncio=_____ 43 Ejemplo: calcula la masa molar (M.M) del HNO3 (ácido nítrico), a partir de su masa atómica. H = 1 uma, N = 14 uma, O = 16 uma Masa atómica átomos en la fórmula H 1 X 1 = 1 uma N 14 X 1 = 14 uma O 16 X 3 = 48 uma Masa molar = 63 uma A practicar 1.- Calcula la masa molar (M.M) de las siguientes sales a. b. c. d. Al2O3______________ Ca (OH)2___________ Al2(SO4)3__________ Mg(NO3)2 _________ En reacciones químicas de obtención de sales como las de sustitución doble se puede calcular la masa molar de las sustancias involucradas una vez que se ha balanceado la reacción. La masa molar (M.M) será entonces la masa de un mol de partículas (sean átomos, moléculas, iones) y se expresa en gramos. Al realizar los cálculos y la conversión de unidades resulta que es numéricamente igual a la masa atómica si hablamos de un mol de átomos o numéricamente igual a la masa molecular si hablamos de un mol de moléculas, pero expresada en gramos. De aquí que 1mol de átomos de oro tendrá un valor en número de partículas y un valor en masa. 6.023x1023 átomos de oro = 1 Mol de átomos de oro = 197g de oro(masa atómica). El mol viene a ser el puente entre el mundo macroscópico (el mundo de lo que percibimos con los sentidos) y el mundo nanoscópico o subatómico que no vemos. 44 Ejemplo: 3Mg(NO3)2 + 3mol 3Mg(NO3)2 Masa atómica × número de átomos 2AlCl3 3MgCl2 2 mol 3 mol 2AlCl3 Masa atómica × número de átomos + 2Al(NO3)3 2 mol 3MgCl2 2Al(NO3)3 Masa atómica × número de átomos Masa atómica × número de átomos Mg= 24 ×3 = 72 Al= 27 × 2 = 54 Mg = 24 × 3 = 72 Al = 27 × 2 = 54 N= 14 × 6 = 84 Cl= 35 × 6 = 210 Cl= 35 × 6 = 210 N= 14 × 6= 84 O= 16 × 18 = 288 suma= 444 g O= 16 × 18 = 288 Suma= 264 g Masa molar o molecular (M.M) Suma= 426 g Masa molar o molecular (M.M) 444 g + 264 g = 708 g/ mol reactivos Masas atómicas Mg = 24 g/ mol Suma= 282 g O= 16 g/ mol 282 + 85 = 708 g / mol productos N= 14 g/ mol Cl= 35 g/ mol Al= 27 g/ mol 45 A practicar Cuestionario 1. Calcula cuantas moléculas de agua ingieres cuando bebes 1Lt de agua. Recuerda que la densidad del agua es 1g/mL. 2. ¿Cuántos átomos de oro conforman una moneda de oro puro cuya masa es de 50g? 3. ¿Qué masa tendrá dos mol de plata? 4. Calcula la masa molar de la sacarosa (C12H22O11) 5. ¿Calcula cuanto mol de azúcar tienes en una taza que contiene 500g de azúcar? 6. Si adicionas un cubito de azúcar a tu café cuya masa es de 5g ¿qué cantidad de moléculas endulzan tú café? 7. Sí te pidieran mostrar un mol de sal (NaCl) en un salero, ¿Qué cantidad en masa de sal pondrías? Relación mol-mol y masa-masa Una ecuación balanceada cumple con la ley de la conservación de la materia, lo que permite establecer las relaciones estequiométricas que rigen los procesos industriales. Con frecuencia necesitamos calcular la cantidad de una sustancia que se produce a partir de, o que necesita reaccionar con una cantidad dada de otra sustancia. El método de relación molar es generalmente el mejor para resolver problemas de estequiometria; para calcular la relación entre la cantidad de mol de dos especies cualesquiera que participan en una reacción química y poder determinar la cantidad que se requiere por ejemplo: para la reacción de obtención de antimonio a partir del mineral antimonita (Sb2O3), según la siguiente reacción balanceada. 2Sb2O3(s) + 3C(s) 2 mol 3mol 4Sb(s) + 3CO2(g) 4mol 3mol Es posible representar doce relaciones molares en base a la reacción anterior: 2 mol de Sb2O3 3 mol de C 2 mol de Sb2O3 2 mol de Sb2O3 4 mol de Sb 3 mol de CO2 46 3 mol de C 3 mol de C 3 mol de C 2 mol de Sb2O3 4 mol de Sb 3 mol de CO2 4 mol de Sn 4 mol de Sn 4 mol de Sn 3 mol de C 2 mol de Sb2O3 3 mol de CO2 3 mol de CO2 3 mol de CO2 3 mol de CO2 4 mol de Sn 3 mol de C 2 mol de Sb2O3 Relación mol-mol Utilizamos la relación molar de cualquier reacción balanceada, para convertir el número de mol de una sustancia en el número correspondiente de mol de otra sustancia en una reacción química, como se representa en la siguiente ecuación de obtención de aluminio a partir de óxido de aluminio anhidro por electrólisis. electrólisis 2Al 2O3(s) 4Al(s) + 3O2(g) Ejemplo: A nivel industrial el óxido de aluminio (Al2O3) mediante electrolisis se obtiene aluminio. ¿Cuántas mol de aluminio se producirán en la reacción, si reaccionan 7.0 mol de óxido de aluminio? Según la reacción balanceada establece que se producirán 4 mol de aluminio a partir de 2 mol de óxido de aluminio, usando el método de relación molar tenemos: 2Al 2O3(s) 7 mol Al 2O3 × 4 mol Al 4Al(s) + 3O2(g) = 14 mol de átomos de aluminio (Al) 2 mol Al 2O3 47 A practicar Relación mol - mol 1.- Calcula la cantidad de mol que se producen en la reacción de obtención de vanadio, donde se ponen a reaccionar 0.55 mol de calcio, según la siguiente reacción balanceada. V2O5 + 5Ca 2V + 5CaO 2.- ¿Cuántos moles de cloruro de sodio se requieren para obtener 2.45 mol de cloruro de aluminio de acuerdo con la siguiente reacción balanceada. 3NaCl + AlPO4 AlCl3 + Na3PO4 3.- ¿Cuántos moles de cloruro de potasio y de agua se obtendrán si se hacen reaccionar 0.876 mol de hidróxido de sodio de acuerdo con la siguiente reacción. KOH + HCl KCl + H2O Relación masa – masa Esta relación nos permite determinar las masas de los reactivos o productos utilizando las ecuaciones balanceadas, la relación molar y el número de moles de cada sustancia, en los procesos industriales se hace uso de esta relación debido a que es más fácil medir en gramos que medir números de moles. Por ejemplo en la reacción de obtención de cobre a partir de sulfuro de cobre (I) por el método de tostación (calentar a altas temperaturas en presencia de un gas como el oxígeno); una vez balanceada la reacción tenemos: Cu2S(s) + O2(g) 2Cu(s) + SO2(g) Si a partir de 100 g de Cu2S ¿Qué masa de Cu obtendremos? La sustancia inicial es 100 g de Cu2S se transforma a moles usando la masa molar del compuesto: 100 g Cu2S × 1 mol Cu2S =0.628 mol Cu2S 159.14 g Cu2S Calculamos el número de mol de Cobre (Cu) por el método de la relación molar de la ecuación balanceada: 48 0.628 mol Cu2S × 2 mol de Cu = 1.25 mol de Cu 1 mol Cu2S Convertir mol de Cobre (Cu) en gramos de Cobre (Cu) 1.25 mol de Cu × 63.54 g de Cu = 1 mol de Cu Se obtendrán 79.42 g de cobre A practicar Cuestionario 1.- El hidróxido de sodio se prepara haciendo reaccionar al carbonato de sodio con hidróxido de Calcio, obteniéndose además carbonato de Calcio. a. Escribe la reacción involucrada y balancéala b. ¿Cuántos gramos de hidróxido de sodio se obtienen a partir de 250 g de hidróxido de calcio? c. ¿Cuántos kilogramos de hidróxido de sodio se obtienen a partir de 3 Kg de carbonato de sodio? 2.- La reacción entre aluminio y óxido de hierro III puede producir temperaturas cercanas a los 3000 ºC, lo que se utiliza para soldar metales. Aluminio + óxido de hierro III óxido de aluminio + hierro metálico Ecuación química:______________________________________________ a) En un proceso industrial se hicieron reaccionar 550 Kg de aluminio. b) ¿Con cuántos kilogramos de óxido de hierro III reaccionaron? ¿Qué importancia tiene conocer la acidez del suelo? El desarrollo de los cultivos se encuentra estrechamente relacionado con la acidez de un suelo, debido a que la disponibilidad y asimilación de los nutrientes depende en gran medida de este parámetro. Desafortunadamente el proceso de degradación de suelos más importante en México es la erosión hídrica, la cual afecta al 37% del territorio nacional. Las intensas lluvias, producen el “lavado” de los suelos y por percolación o lixiviación se van perdiendo los nutrientes de este, en especial los elementos que le proporcionan alcalinidad. De aquí que en regiones donde llueve mucho, los suelos 49 tienden a ser ácidos y en zonas áridas donde no se dan este tipo de lavados, los suelos son alcalinos. El término “reacción del suelo” hace referencia al grado de acidez o alcalinidad presente en el sistema suelo-agua. La acidez de una solución acuosa depende de la concentración de iones hidrógeno [H+], la escala de pH nos da una forma numérica sencilla y conveniente para establecer la acidez de una solución. Los valores de la escala de pH se obtienen mediante una conversión matemática de concentraciones de iones [H +] protones o iones hidrógeno a unidades y matemáticamente lo expresa como el logaritmo negativo (base diez) de la concentración de iones [H+], la ecuación: pH = - log [H+] El cálculo del valor de pH de la concentración de iones [H+] requiere el uso de logaritmos decimales, los cuales son exponentes. El logaritmo decimal (log) de un número es, sencillamente, la potencia a la cual se debe elevar 10 para obtener ese número. Así, el log de 100 es 2, porque 100= 10 2, y el log de 1000 es 3, porque 1000 = 103. El log de 500 es 2.70, pero no se puede determinar este valor fácilmente sin ayuda de una calculadora científica. Por ejemplo: Determinar el pH de una muestra acuosa de suelo cuya [H +] = 2× 10-5 con una calculadora. Teclea 2× 10-5 y después la tecla log. El número -4.69…aparecerá en la pantalla. Entonces, el pH es: pH = - log [H+] = -(-4.69…)= 4.7 A practicar 1.-Calcula el pH de las siguientes soluciones cuyas concentraciones de [H+] son: a) b) c) d) e) [H+] = 1.0 ×10-11 [H+] = 6.0 ×10-4 [H+] = 3.9 ×10-12 [H+] = 61.3 ×10-3 [H+] = 3.72 ×10-6 2.- Completa la siguiente información calculando el valor de pH o de concentración de protones [H+] Carácter de la solución pH [H+] 50 Ácida / básica o neutra 3.6×10-13 7.0 7.1×10-8 3.1 De acuerdo al valor de pH, los suelos pueden ser ácidos (si el pH es menor a 7), neutros (si pH=7) o básicos (si el pH es mayor a 7). La mayoría de los cultivos crecen en un intervalo de pH que va de 5.5 a 7.5, sin embargo, existen plantas que se desarrollan mejor a un pH ácido y otras a un pH básico (alcalino). Por ejemplo: Cultivo Intervalo de pH mínimo máximo arroz 5.0 6.5 caña de azúcar 6.0 8.0 papa 4.8 6.5 Plátano 6.0 7.5 Vid 5.4 6.8 maíz 5.5 7.5 51 Los efectos que ejerce el pH del suelo son diversos: De él depende los procesos de humificación, lo que determina los distintos tipos de materia orgánica. Determina la movilidad de los iones al hacerlos más o menos solubles, lo que con lleva a que la disponibilidad de los elementos (como nutrientes) cambie dependiendo de la acidez o alcalinidad del suelo. El pH del suelo influye en el proceso de intercambio catiónico al permitir la solubilidad de ciertos iones. Por ejemplo el hierro, cobre y manganeso, no son solubles en medio ácido lo que implica que los cultivos que requieren estos nutrientes se encuentren a pH ligeramente alcalinos. Por otro lado, el nitrógeno, fósforo, potasio y azufre, están disponibles a pH cercano a la neutralidad. El fenómeno de acidez en el suelo, impide el desarrollo adecuado de los cultivos debido a que este fenómeno: Reduce el crecimiento de las plantas. Disminución en la disponibilidad de nutrientes como el Ca, Mg, K, P. Favorece la solubilidad de elementos tóxicos para las plantas como el Al y Mn. Para modificar el pH de un suelo y adecuarlo a las condiciones que los cultivos requieren, se adicionan sustancias que poseen propiedades acido-base. Propiedades de los ácidos y las bases En la siguiente tabla se describen algunas características de los ácidos y las bases. 52 Ácidos Bases Sabor agrio Sabor amargo o cáustico Cambian el color del tornasol de Cambian el color del tornasol de azul a rojo rojo a azul Reaccionan con los metales como No reaccionan con los metales el hierro, magnesio y zinc produciendo hidrógeno gaseoso para producir hidrógeno Para explicar el comportamiento de los ácidos y las bases, en 1887 el químico noruego Svante Arrhenius tomó en cuenta una propiedad común a los ácidos y las bases: la conductividad eléctrica que presentan cuando están en disolución acuosa, sugirió que los ácidos son compuestos que se disocian al disolverse en agua, produciendo iones hidrógeno o protones H+ y un ion negativo correspondiente. El ion hidrógeno que se genera no existe aislado en disolución acuosa, sino que se une a una molécula de agua formando al ion llamado hidronio (H3O+). De acuerdo con este modelo, del cloruro de hidrógeno (HCl) es un ácido, porque al disolverse en agua se ioniza formando iones hidrógeno (H+) o (H3O+) y iones cloruro (Cl-). La disociación se expresa de la siguiente forma: HA(ac) → H+(ac) + A-(ac) ácido HCl(ac) + H2O(l) → H+(ac) + Cl-(ac) De la misma forma el modelo de Arrhenius define a las bases como sustancias que al disolverse en agua forman iones hidróxido (OH1-), además de un catión correspondiente. El hidróxido de sodio es una base de Arrhenius, ya que al disolverse en agua forman iones Na1+ y OH1- . MeOH(ac) → Me+ (ac) + OH-(ac) NaOH(ac) → Na1+(ac) + OH1-(ac) Desafortunadamente este modelo tiene limitaciones porque únicamente explica el comportamiento ácido-base de sustancias disueltas en agua (disolución acuosa) y no en otro tipo de disolvente. Por otro lado, el modelo de Arrhenius no explica el comportamiento básico del amoniaco que carece de grupos OH- en su estructura. En esencia, las limitaciones del modelo de Arrhenius son las siguientes: 53 No explica reacciones en otros medios diferentes al acuoso como las que ocurren en fase gaseosa, medio sólido o en disoluciones no acuosas. Asume que el carácter ácido-base de las sustancias depende de la presencia de iones hidrógeno y iones oxhidrilo. Asume que el ion hidronio (H+) es la partícula que se intercambia cuando termodinámicamente se ha demostrado la improbabilidad de su existencia como ion libre. No explica adecuadamente el comportamiento ácido-base de diversas sustancias como el amoniaco (NH3), el carbonato ácido de sodio (NaHCO3), el óxido de calcio (CaO). Tiene dificultades para explicar el comportamiento ácido-base de algunas sustancias que teniendo hidrógeno en su fórmula se comportan como bases Cuando llama a las reacciones entre un ácido y una base “neutralización” induce la idea de que la disolución resultante siempre será neutra. Sugiere que en una reacción de neutralización el ácido y la base se consumen mutuamente. No explica las reacciones ácido-base a elevadas temperaturas como las que se llevan a cabo en la fabricación del cemento y del vidrio. 54 Referencias Dingrado, L; Greg, K; (2002). Química, materia y cambio, Mc Graw Hill, Columbia. Garritz, Andoni, Chamizo, José Antonio (2001). Tú y la química, Pearson Educación, México. W.R. Peterson; (2013).Nomenclatura de las sustancias químicas; Reverte, Barcelona, España. Castillejos, A.(coord.), (2006). Conocimientos fundamentales de química. Vol. I, México, UNAM/Pearson Educación, Colección Conocimientos Fundamentales Brown, L, LeMay, Jr., E. Bursten (2004) Química la ciencia central, Pearson, México Hein,M & Arena.S. (2005). Fundamentos de Química. México: Thomson. Ocampo, O. (2013). Química 2. México: Oxford. Timberlake, K. (2013). Química general, orgánica y biológica.. México: Person. Daub,W, & Seese, G,. (2015). Química. México: Person. 55 Segunda unidad. Alimentos, proveedores de sustancias esenciales para la vida 56 57 ¿Por qué comemos? ¿Te has hecho esta pregunta alguna vez? Pensamos que sí, por tal motivo te diremos que nuestro cuerpo necesita el aporte constante de materia y energía para su buen funcionamiento, ya que nuestro organismo no es capaz de sintetizar muchos compuestos que requiere y por ello los debe adquirir del medio ambiente. La forma y manera de proporcionar al organismo los alimentos que le son indispensables es lo que entendemos por alimentación, este proceso finaliza en el instante de la introducción de los alimentos en la cavidad bucal. Lo importante de este proceso es que es educable, consciente y voluntario. Desde el instante en el que finaliza la alimentación comienza la nutrición. La nutrición se define entonces como el conjunto de procesos mediante los cuales el organismo vivo transforma e incorpora una serie de sustancias que recibe del mundo exterior y que forma parte de los alimentos con objeto de suministrar energía, construir y reparar estructuras orgánicas, así como regular los procesos biológicos. A diferencia de la alimentación, presenta las características de no ser educable y ser inconsciente e involuntaria. El suministro de nutrientes debe realizarse en unas cantidades tales que se consigan las siguientes finalidades: a) b) c) d) Evitar la deficiencia de nutrientes Evitar exceso de nutrientes Mantener el peso adecuado Impedir la aparición de enfermedades relacionadas con la nutrición. Con base en lo anterior podemos decir que comer no es garantía de buena salud, ya que se pueden estar ingiriendo una gran cantidad de alimentos cuyos componentes no sean benéficos para el organismo, más aun que generen sobrepeso, estamos hablando entonces de una malnutrición. Por el contrario si la cantidad de alimentos ingeridos es insuficiente y además carecen de los nutrientes necesarios estamos hablando de desnutrición. Los nutrientes se pueden clasificar en tres grandes grupos, revisa la siguiente tabla. 1.- Macronutrientes 2.- Micronutrientes Hidratos de carbono, Vitaminas y minerales lípidos y proteínas 3.- Agua En ella se encuentran los electrolitos sodio, potasio y cloro. Tabla 1.- Clasificación de nutrientes 58 El cuerpo requiere de los macronutrientes en grandes cantidades mientras que los micronutrientes se deben consumir en bajas dosis. Ahora si te pones a pensar te darás cuenta que hay un elemento presente tanto en los macro como en los micronutrientes, nos referimos al carbono. Observa las siguientes estructuras y verás que es cierto. Ejemplo de carbohidrato Ejemplo de lípido Ácido linoleico Vitamina A Glucosa, fuente de energía para las células Figura 1.- El carbono presente en biomoléculas ¿Qué tipo de sustancias constituye a los alimentos? En el punto anterior habrás notado que en los alimentos se encuentran mezclados macro, micronutrientes y agua en diferentes proporciones, más aun y en términos generales es una mezcla de compuestos orgánicos e inorgánicos. Por compuestos orgánicos entendemos que son aquellos que contienen en sus moléculas átomos de carbono, en base a esto se define a la química orgánica como parte de la química que se encarga del estudio de los compuestos del carbono. Algunos compuestos del carbono que pertenecen al campo de estudio de la química inorgánica son: monóxido de carbono (CO), dióxido de carbono (CO2) y los carbonatos (CO3-2). El número de compuestos que forma el carbono es muy grande, y aunque no existe una barrera como tal entre los compuestos orgánicos e inorgánicos, estos últimos representan una cantidad mucho menor en relación con la totalidad de los compuestos químicos existentes. De modo muy general en la siguiente tabla podrás encontrar las principales diferencias entre ambos tipos de compuestos. 59 Compuestos orgánicos Presentan enlaces covalentes Tienen bajo punto de fusión No son buenos conductores de la corriente eléctrica La mayoría son combustibles Generalmente no se disuelven en agua Compuestos inorgánicos Muchos de los compuestos presentan enlaces iónicos Tienen puntos de fusión altos (a veces hasta de 1000oC) Conducen la electricidad No son combustibles Son solubles en agua Tabla 2.- Comparación entre compuestos orgánicos e inorgánicos ¿Por qué el carbono es el elemento predominante en los alimentos? Comenzaremos esta sección mencionándote que los compuestos orgánicos no sólo se encuentran en los alimentos, están presentes en muchos otros productos que empleamos en forma cotidiana, como los plásticos y las medicinas o los combustibles, como la gasolina, entre otros. Pero la increíble cantidad de compuestos del carbono existentes se deben a sus propiedades. Recordemos que el átomo de carbono es un elemento que se ubica en el grupo IV A y segundo periodo de la tabla periódica, observa la siguiente tabla para que conozcas más de él. Tabla 3.- Propiedades del Carbono Ahora observa la siguiente tabla de valores de electronegatividad de los elementos correspondientes al segundo periodo: Elemento Electronegatividad Li 1.0 Be 1.5 B 2.0 C 2.5 N 3.0 O 3.5 F 4.0 Ne --- Tabla 4.- Valores de electronegatividad de los elementos del segundo periodo 60 Notaras que el carbono tiene un valor intermedio y por esta razón atraerá con más fuerza a los electrones cuando se enlace con otro átomo en comparación con los elementos Litio, Berio, y Boro; pero lo hará con menor fuerza en comparación con los elementos Nitrógeno, Oxígeno y Flúor. Entonces cuando el carbono se enlace con algún otro elemento le será más fácil compartir sus cuatro electrones de valencia y completar así su octeto, que ganando o perdiendo electrones. Por lo anterior es que se dice que el carbono es tetravalente, es decir tiene la capacidad de formar cuatro enlaces covalentes. Observa la siguiente figura del gas metano, en la primera estructura se observan los cuatro electrones de valencia del carbono unidos covalentemente a un electrón de valencia de cada átomo de hidrógeno, en la segunda se muestra el mismo compuesto representando los enlaces por medio de líneas: Figura 2.- Metano Pero el átomo de carbono tiene otra peculiaridad, la de poder formar enlaces simples, dobles y triples con otros átomos, veamos el siguiente esquema: Figura 3.- Enlaces del carbono Por todo lo anterior el carbono es un elemento que puede formar una gran cantidad de compuestos y esto se debe principalmente a que los átomos de carbono pueden formar enlaces covalentes con: 1.- átomos de hidrógeno. 2.- otros átomos de carbono para formar cadenas cuya longitud en principio no tiene límite (concatenación). 3.- otros elementos, en especial con oxígeno, nitrógeno, azufre y halógenos. 61 A practicar Después de haber leído la información anterior y para reforzar tu conocimiento te pedimos que contestes las siguientes preguntas: 1.- ¿Cuál es la principal diferencia entre alimentación y nutrición? 2.- ¿Cuáles son las principales diferencias entre compuestos orgánicos e inorgánicos? 3.- ¿Cuáles son las características que hacen al carbono un elemento tan singular? PROPIEDADES ESTRUCTURALES DE LOS HIDROCARBUROS Para hacer el estudio gradual iniciaremos con hidrocarburos, que son los compuestos más simples del carbono, ya que se forman solo por los elementos carbono e hidrógeno. En este tipo de compuestos los átomos de carbono satisfacen su tetravalencia formando enlaces con átomos de hidrógeno, o bien con otros átomos de carbono, al formar cadenas o anillos. Los hidrocarburos los podemos clasificar de varias formas, una de ellas se basa en el tipo de enlace que se forma entre los átomos de carbono: a) Saturados: cuando todos los átomos de carbono presentan un enlace simple b) Insaturados o no saturados: cuando hay al menos un enlace doble o triple. También se pueden clasificar de acuerdo a la forma de la cadena de átomos de carbono, puede ser de cadena abierta (aciclíca): lineal o ramificada, y de cadena cerrada (cíclica). Tipos de Fórmulas para representar a los compuestos orgánicos En química orgánica se utilizan varios tipos de fórmulas: a) Desarrolladas: indican en un plano la estructura de la molécula, además representan el modo de agrupación de todos los átomos que las forman, y los enlaces se señalan con guiones b) Semidesarrollada: cada átomo de carbono y sus átomos de hidrogeno se describen en forma de grupo, añadiendo subíndices al hidrógeno para indicar el número de átomos de este elemento que se unen con cada carbono. Tanto en las formulas desarrolladas como en las semidesarrolladas se señala el ordenamiento de los átomos de carbono en la molécula. 62 c) Molecular o Condensada: muestra solo el número total de átomos de cada elemento que hay en la molécula utilizando subíndices. d) Estructuras de enlace línea: cada uno de los enlaces de carbono-carbono se representan por medio de líneas, cada uno de los extremos de la línea representa a un átomo de carbono, de tal modo que el metano no tiene representación, Para que te queden más claras las descripciones anteriores te pediremos que observes la siguiente tabla donde se presentan algunos hidrocarburos mediante las cuatro formas descritas con anterioridad: ALCANOS Tabla 5. -Representación de los compuestos orgánicos Alcanos Los átomos de carbono que forman las moléculas de los hidrocarburos saturados de cadena lineal que están unidos mediante enlaces sencillos reciben el nombre de alcanos. Figura 4.- Formula de los alcanos En 1979 la IUPAC establece ciertas recomendaciones para la nomenclatura de compuestos orgánicos, mismas que en la mayoría de los textos aún se pueden encontrar plasmadas y la que se detallaran con más interés en esta guía, sin embargo, en 1993 se modifican estas recomendaciones en varias familias de compuestos por mencionar algunos se resaltaran estos ejemplos en negritas. 63 A continuación te presentamos las reglas para nombrar a los alcanos: 1) Seleccione la cadena continua más larga de átomos de carbono como la cadena principal del hidrocarburo base. Si dos cadenas tienen la misma longitud aquella que tenga más cadenas laterales es la principal. Entonces se da nombre al alcano como derivado de este hidrocarburo base. 2) Para nombrar a la cadena principal se usan los prefijos numéricos mostrados en la siguiente tabla y la terminación “ano” según el número de átomos de carbono que conforman las moléculas. N Alcano n Alcano 1 Met 21 Henicos 2 Et 22 Docos 3 Prop 23 Tricos 4 But 24 Tetracos 5 Pen 25 Pentacos 6 Hex 26 Hexacos 7 Hep 27 Heptacos 8 Oct 28 Octacos 9 Non 29 Nonacos 10 Dec 30 Triacont 11 Undec 31 Hentriacont 12 Dodec 32 Dotriacont 13 Tridec 40 Tetracont 14 Tetradec 50 Pentacont 15 Pentadec 57 Pentaheptacont 16 Hexadec 60 Hexacont 17 Heptadec 70 Heptacont 18 Octadec 80 Octacont 19 Nonadec 90 Nonacont 20 Icos 100 Hect Tabla 6- Prefijos numéricos (n representa al número de átomos de carbono) 3) Las cadenas laterales se consideran como sustituyentes o ramificaciones que reemplazan hidrógenos en la cadena principal. Sus posiciones se indican por números asignados a los carbonos del hidrocarburo base. Se numeran consecutivamente los átomos de carbono de la cadena principal a partir de uno de sus extremos de tal forma que la posición de los sustituyentes se indique con los números más pequeños posibles. Cuando se compara las series de números que compiten, la que tenga el número menor en el primer punto de diferencia es la que se escoge. 4) El nombre de los sustituyentes se pone antes del nombre del hidrocarburo base, en orden alfabético. El nombre del último sustituyente se liga con el nombre del hidrocarburo base como una sola palabra. Al ordenar alfabéticamente los 64 sustituyentes no se consideran los prefijos escritos en cursiva (n-, sec-, ter-, etc.), ni los prefijos di-, tri- tetra-, etc., a menos que el prefijo multiplicador sea parte de un radical complejo encerrado entre paréntesis. 5) Cada sustituyente se precede de un número que denota su posición en la cadena principal. Siempre se separan los números del nombre del sustituyente con guiones y para separar dos números se utiliza una coma. 6) Los sustituyentes idénticos se indican por los prefijos: di-, tri- tetra-, etc. Esos prefijos se hacen preceder de números consecutivos que designan la posición de cada uno de los sustituyentes idénticos. Los números se ordenan en orden creciente de magnitud y se separan por comas. 7) Las reglas de IUPAC permiten el uso de nombres comunes de los alcanos sustituidos tales como: isobutano, isopentano, neopentano, isohexano y de los grupos alquilo sustituidos tales como: isopropil (metiletil o 1-metiletil), sec-butil (1metilpropil), isobutil (2-metilpropil), ter-butil (dimetiletil), isopentil (3-metilbutil), neopentil (2,2-dimetilpropil), ter-pentil (1,1- dimetilpropil), isohexil (4-metilpentil). Fórmula desarrollada Nombre común Isobutano Nombre IUPAC 2-metilpropano Isopentano 2-metilbutano Neopentano 2,2-dimetilpropano Isohexano 2-metilpentano Tabla 7.- Nombres comunes de alcanos sustituidos 65 Revisa los siguientes ejemplos: Figura 5.- Alcanos sustituidos (o ramificados) Entonces los alcanos son hidrocarburos saturados, pues la tetravalencia del carbono se satisface con hidrógeno u otros átomos de carbono. Debido a esto no son activos químicamente y, por ello, también se les llama parafinas. Isómeros Los isómeros son compuestos que tienen la misma composición química, pero el orden de los átomos en las moléculas de estos compuestos es diferente, y por ende, sus características físicas y químicas también. Un ejemplo de estos isómeros son los estructurales en los que lo único que cambia entre un compuesto y otro es su estructura. Observa los siguientes ejemplos: Figura 7.- Isómeros estructurales Nota en la tabla 7 que tanto el butano y el 2-metilpropano (isobutano) tienen ambos cuatro átomos de carbono y diez de hidrógeno pero su estructura es completamente diferente, esto explica porque el butano hierve a -0.5oC y el 66 isobutano a -12oC. Por otro lado el etanol y el éter dimetílico poseen ambos dos átomos de carbono, seis de hidrógeno y uno de oxígeno, la diferencia la hace de nuevo su estructura, y ello confiere una función completamente diferente, ya que el primero es un alcohol y el otro es un éter, cuyas propiedades físicas y químicas son totalmente distintas. Cicloalcanos A los hidrocarburos saturados cíclicos se le llama cicloalcanos o compuestos alicíclicos. Debido a que los cicloalcanos consisten en unidades de anillos de – CH2–, tienen formula general (CH2)n o CnH2n, y pueden ser representados por polígonos en las estructuras de líneas. Para nombrarlos debemos seguir los siguientes pasos: 1.- Encontrar la cadena o ciclo principal. Contar el número de átomos de carbono en el anillo y en la cadena sustituyente más larga. Si el número de átomos de carbono en el anillo es igual o mayor que en el sustituyente, el compuesto se nombra como un cicloalcano, sustituido con alquilos, pero si el número de átomos de carbono en el sustituyente más grande es mayor que en el anillo, el compuesto se nombra como un alcano susutituido con cicloalquilo. 2.- Numerar los sustituyentes y escribir el nombre. Para un cicloalacano sustituido con halógenos, seleccione el punto de unión como el carbono 1 y numere los sustituyentes en el anillo de tal manera que el segundo sustituyente tenga el número más bajo posible. Si sigue existiendo ambigüedad, numere de tal manera que el tercero o cuarto sustituyente tenga el número más bajo posible, hasta que se encuentre un punto de diferencia. Cuando estén presentes dos o más grupos alquilo diferentes que potencialmente puedan recibir el mismo número, númerelos por prioridad alfábetica ignorando los prefijos númericos como di y tri. Figura 6.- Nomenclatura cicloalcanos 67 ALQUENOS y ALQUINOS Los alquenos y los alquinos se identifican usando prácticamente las mismas reglas que se emplearon para asignar nombres a los alcanos pero hay algunas modificaciones: 1) Se selecciona como cadena principal del hidrocarburo base la cadena continua más larga que contenga la unión C=C o C≡C. 2) El nombre del hidrocarburo base se caracteriza por la terminación -eno si tiene un enlace doble (-C=C-) y por la terminación -ino si tiene un enlace triple (-C≡C-). Formula general de los alquenos CnH2n Formula general de los alquinos CnH2n-2 Donde n es el número de átomos de carbono 3) Se enumera la cadena principal de átomos de carbono que contiene el enlace múltiple, comenzando por el extremo más cercano a dicha unión. De esta forma, se asigna el número más bajo posible a la posición del enlace múltiple. 4) El más bajo de los números asociados con los dos carbonos de la unión múltiple se escoge para indicar la posición del enlace y este número aparece inmediatamente antes del nombre del alqueno o del alquino. Para los compuestos complejos el número que designa un doble enlace se puede colocar entre el prefijo (alc-) y el sufijo (eno- o ino-). 5) Cuando existen dos o más uniones de C=C o C≡C en la cadena continua más larga que contiene tales enlaces se usa las terminaciones:-adieno, atrieno, etc. o -adiino, atriino, y se indica cada una de las posiciones múltiples por un número, por ejemplo: 2-metil-1,3-butadieno. Figura 7.- 2-metil-1,3-butadieno o 2 –metil-buta-1,3-dieno 6) Cuando en el mismo compuesto existen enlaces C=C y C≡C se escoge como cadena principal aquella que contenga el número máximo de esas uniones. Los dobles enlaces tienen preferencia sobre los triples al asignar el nombre. Se asignan los números más pequeños posibles a las uniones múltiples aunque en algunos casos esto hace que un enlace C≡C sea localizado por un número más pequeño que un enlace C=C. Sin embargo, cuando hay posibilidad de elección a los dobles enlaces se les asigna los menores números. 7) Los sustituyentes y sus posiciones se indican en la forma usual. 68 Veamos los siguientes ejemplos: ó 3-propilhexa-1,4-dieno ó 6- metiloct-3-ino Figura 8.- Alquenos y alquinos A practicar Escribe la formula desarrollada y semidesarrollada de los siguientes alcanos: a) 2-metilheptano b) 4-etil-2-hexeno o 4-etilhexa-2-eno c) 4-propil-3-nonino o 4-propilnon-3-ino d) 2-metil-1,5-hexadieno o 2-metilhexa-1,5-dieno e) 1-buteno o but-1-eno Escribe el nombre de los siguientes compuestos: a) b) c) __________________________ ____________________ __________________________ d) e) ______________________ d) ___________________ _________________ ¿Qué grupos funcionales están presentes en los compuestos orgánicos? La gran mayoría de las moléculas orgánicas contienen otros elementos además de carbono e hidrógeno. Sin embargo, pueden considerarse como derivados de 69 hidrocarburos, esto es que son fundamentalmente hidrocarburos que contienen átomos adicionales, o grupos de átomos denominados grupos funcionales. Un grupo funcional es un conjunto de átomos ordenados de una manera determinada, que tienen cierta reactividad asociada y que, al estar presentes en una molécula, le imprimen a ésta propiedades comunes que caracterizan a un conjunto de sustancias con estructura análoga. En la tabla 7 se presentan algunos de los grupos funcionales ordenados de acuerdo a su prioridad en orden descendente. Las letras R y R´ representan una cadena o anillos de carbonos cualesquiera. Alcoholes Un alcohol es un compuesto que posee el grupo -OH unido a un átomo de carbono que puede pertenecer a un grupo alquilo o a un grupo aromático. La mayor parte de los alcoholes son líquidos a temperatura ambiente y a una atmosfera de presión. Su temperatura de ebullición es apreciablemente mayor que la de los alcanos de igual número de átomos de carbono. Todos los alcoholes de hasta tres átomos de carbono son miscibles en agua en todas las proporciones. La solubilidad en agua disminuye bruscamente al aumentar el largo de la cadena hidrocarbonada. Las reglas IUPAC para nombrar a los alcoholes son las siguientes: 1.- Para nombrar a los alcoholes se sustituye la terminación –ano del alcano por –anol. 2.- Se debe indicar el número de carbono que contiene el grupo –OH, cuidando que siempre sean las posiciones más bajas (con excepción del etanol y metanol por solo poseer uno y dos átomos de carbono). Observa los siguientes ejemplos: Figura 9.- Ejemplos de alcoholes 70 Grupo funcional Formula Sufijo Ácidos carboxílicos La palabra ácido se escribe antes que el nombre de la cadena principal cuya terminación es -ico Cuando el grupo es un sustituyente se nombra como carboxi- Ésteres -ato de alquilo alcoxicarbonil- Amidas -amida carbamoil- Aldehídos -al Formal(carbaldehído) Cetonas -ona oxo- -ol hidroxi- -amima amino- -éter alcoxi- -eno -enilo -ino -inilo -ano -ilo Alcoholes R – OH Amina Éteres Hidrocarburos insaturados R – NH2 R' – O –R'' R' – CH=CH –R'' R' – CHΞCH –R'' Hidrocarburos saturados R' – CH2-CH2–R'' Tabla 7.- Grupos funcionales 71 Aldehídos y cetonas Tanto los aldehídos como las cetonas contienen el grupo funcional carbonilo y este es uno de los grupos más importantes en química orgánica y bioquímica. La palabra aldehídos significa “alcohol deshidrogenado”. Los aldehídos se forman cuando al grupo funcional de un alcohol se le eliminan dos Figura 10.átomos de hidrógeno: Grupo carbonilo Figura 11.- Aldehídos Los aldehídos que tienen hasta cuatro átomos de carbono son solubles en agua y conforme aumenta los átomos de carbono en la molécula son insolubles en agua. Los aldehídos son menos densos que el agua. Para nombrar a los aldehídos de acuerdo con la IUPAC se otorgará el número uno al carbono que soporta al grupo carbonilo, empleando luego el nombre de la cadena con la terminación “-al” o “-dial” si hubiera dos grupos carbonilo, uno al principio y otro al final de la cadena carbonada. Observa los siguientes ejemplos: Figura 12.- Ejemplos de aldehídos Los aldehídos se oxidan con más facilidad y suelen ser más reactivos que las cetonas. Estos compuestos tienen una amplia aplicación tanto como reactivos y disolventes, asimismo se utilizan en la fabricación de telas, perfumes, plásticos y 72 medicinas. En la naturaleza se encuentran ampliamente distribuidos en moléculas como las proteínas, carbohidratos y ácidos nucleicos. El grupo carbonilo de las cetonas a diferencia de los aldehídos se encuentra unido a dos átomos de carbono. Por lo general las cetonas son líquidas, pero a partir de la que tiene 16 átomos de carbono son sólidas. Su olor es agradable, son solubles en alcohol, éter, y cloroformo. La acetona es un eficaz disolvente de gran cantidad de materiales orgánicos. Para nombrar a las cetonas de acuerdo a la IUPAC se denomina agregando la terminación “ona” al nombre del hidrocarburo correspondiente; su posición se fija por medio de un número, que debe ser el menor posible. Observa los siguientes ejemplos: Figura 13.- Ejemplos de cetonas A practicar Relaciona el nombre de los compuestos con su respectiva estructura: ( ) 5-metil-3-hexanol a) ó 5 metilhexa-3-ol ( ) 3-metilpentanal b) ( ) 6-etil-2-octanona c) o 6-etiloctan-2-ona 73 ( ) butanal d)CH3CH2CH CH2CH2CH2CCH3 CH2CH3 ( ) 3-metilciclohexanol e) ( ) 4-metil-2-heptanona f) CH3CH2CHCH2CHO ó 4-metilheptan-2-ona O CH3 Ácidos Carboxílicos Los ácidos carboxílicos o ácidos orgánicos resultan de la contracción de dos grupos uno es el carbonilo (-C=O) y el otro es el hidroxilo (-OH). Se representa como R-COOH, observa la figura 13 donde se encuentra la formula general. De acuerdo con la IUPAC, para nombrar a los ácidos carboxílicos se le agrega al nombre del alcano del que provienen la terminación –ico, y se antepone la palabra ácido. Si en la molécula existen dos o más grupos carboxílicos (-COOH) se antepone a la terminación –oico y el prefijo di-, tri-, etc. Figura 14.- Ejemplo de Ácidos carboxílicos Los ácidos metanoico, etanoico y propanoico son totalmente solubles en agua. Esta solubilidad disminuye a medida que aumenta la cadena de átomos de carbono. La densidad de los ácidos carboxílicos es inferior a la del agua, con excepción de los ácidos metanoico y etanoico. El punto de ebullición de los ácidos 74 aumenta conforme aumenta el número de átomos de carbono. Los ácidos carboxílicos son ácidos débiles. Ésteres Son sales de los ácidos carboxílicos que resultan de la combinación de un ácido carboxílico con un alcohol, dando como productos un éster y agua. La representación general de los ésteres es R-COO-R'. Figura 15.- Formación de ésteres Para nombrar a los ésteres se sustituye la terminación –ico del ácido del que provienen por –ato y al final se indica el nombre del radical alquilo (R). Analiza los siguientes ejemplos: Figura 16.- Ejemplos de Esteres Los esteres son muy abundantes en la naturaleza, y son los componentes principales de los aromas y sabores de las flores y frutas. Amidas Una amida es un derivado de un ácido carboxílico que se forma por reacción con el amoníaco o una amina, con la eliminación de una molécula de agua. Para nombrar a las amidas se sustituye la terminación –ico del nombre del ácido del que proviene el por –amida. Observa los siguientes ejemplos: 75 Figura 17.- Ejemplos de amidas A practicar Relaciona el nombre de los compuestos con su respectiva estructura: ( ) Ácido nonanodioico CH3CH2CH2CH2CH2CH3CH2NH2 I CH2CH3 ( ) octanamida ( ) 5-etilheptanamina CH3CH2CH2CH2CH2CH3CH2CONH2 ( ) metanoato de propilo ( ) propanoato de etilo 76 Aminas Se forman cuando se sustituyen uno, dos o tres átomos de hidrógeno del amoniaco (NH3), por radicales alquilo (R). Para nombrar a las aminas de acuerdo a la IUPAC se denomina agregando la terminación “amina” al nombre del hidrocarburo correspondiente. Si en la molécula existen dos o más grupos amino se antepone a la terminación –amina, el prefijo di-, tri según sea el caso. Observa los siguientes ejemplos: A practicar Dibuja la estructura de los siguientes compuestos: a) 2-pentanona b) 5-Metilhexanal c) Heptanol d) Ácido pentanoico e) Hexanamina f) Propanoato de metilo g) 2-Metilhexanamida Escribe el nombre de los siguientes compuestos: a) d) CH3CH2CH2CHO b) e) c) f) 77 Referencias Ascencio P.C. (2012) Fisiología de la nutrición. México D.F. McGraw Hill McMurry, John (2012) Química orgánica. 8ª. Edición. México D.F.. CENGAGE Primo E. (2007) Química Orgánica Básica y Aplicada. De la molécula a la Industria. Barcelona España. Editorial Reverté. Bruice. Y.(2008) Química orgánica. Barcelona España. Perason Education . Naranjo G. (2012). Química Orgánica. Recuperado el 15 junio del 2015 de http://repositorio.ub.edu.ar:8080/xmlui/bitstream/handle/123456789/3341/3966%20 -%20quimica%20org%C3%A1nica%20%202012%20bio%20y%20tecno%20alimentos.pdf?sequence=1 78 ¿Cuál es la función en el organismo de los nutrimentos? ¿Sabías que tu cuerpo consume energía en grandes cantidades durante el desarrollo de tus actividades diarias, y que los alimentos son quienes suministran esta energía? Para llevar a cabo todos los procesos que nos permiten estar vivos (metabolismo), el organismo humano necesita un suministro continuo de nutrimentos, razón por la cual nos tenemos que alimentar todos los días. Se define como metabolismo al conjunto de todas las reacciones químicas metabólicas que se producen en el interior de las células de un organismo, para transformarlas en moléculas nutritivas y transportarlas por la sangre. Las dos funciones más importantes del metabolismo son obtener energía química que utiliza la célula y se almacena en forma de ATP (adenosín trifostato) y fabricar sus propios compuestos, a partir de los nutrientes, que serán utilizados para crear sus estructuras o para almacenarlos como reserva. El número de nutrimentos que el ser humano puede utilizar es limitado. Sólo existen unas pocas sustancias que nos sirven como combustible (energía) o para incorporarlos a nuestras estructuras celulares. Los nutrimentos no se encuentran aislados, sino formando mezclas llamadas alimentos. Gracias a las múltiples combinaciones en que la naturaleza nos ofrece los diferentes nutrimentos, se puede tener una amplia variedad de alimentos que el ser humano puede consumir. Para poder estudiar con mayor facilidad los nutrimentos presentes en los alimentos, estos se pueden clasificar en primera instancia con base en la cantidad presente de ellos. Por lo tanto, nombraremos macronutrimentos (macro = grande), a aquellos que ocupan la mayor proporción de los alimentos, micronutrimentos (micro = pequeño), a los que sólo están presentes en pequeñísimas proporciones. Los macronutrimentos son compuestos químicos que van desde sencillos hasta muy complejos, son los únicos que nos proporcionan energía, sirven como material plástico para formar nuevas estructuras y tienen funciones específicas dentro del metabolismo. Los macronutrimentos están formados por los carbohidratos, proteínas y lípidos. El grupo de los micronutrimentos está conformado por las vitaminas y los minerales, que son imprescindibles para el mantenimiento de la vida. Una característica importante de este grupo es que las cantidades requeridas por los humanos son muy pequeñas. Los requerimientos van desde los microgramos (µg) hasta los miligramos (mg). Debido a ello, también se les denominan elementos traza u oligoelementos. 79 El agua y la fibra, son considerados nutrimentos por muchos autores, están presentes en cantidades considerables en la mayoría de los alimentos. Pero éstos no proporcionan calorías, por lo que no suelen considerarse nutrimentos. Sin embargo, el agua es muy importante en el organismo ya que actúa como disolvente de otras sustancias, participa en las reacciones químicas más vitales y, además, es el principal medio de eliminación de los productos de desecho del organismo. En la siguiente tabla se muestran diferentes grupos de alimentos y el tipo de nutrimento que contienen. Nutrimento Grupo de alimentos que los contiene principalmente Carbohidratos Los carbohidratos complejos se encuentran principalmente en los cereales y tubérculos. Todos los derivados de ellos contienen carbohidratos como son las pastas, pan, harinas, almidones. También podemos encontrar carbohidratos simples en frutas, dulces y miel. Proteínas Las proteínas se encuentran en alimentos de origen animal y en los cereales y leguminosas. Para una buena nutrición se debe combinar un cereal con una leguminosa y juntos deben ser el aporte mayoritario de proteína en la dieta. La proteína de origen animal debe consumirse en menor cantidad. Lípidos Los lípidos los encontramos generalmente como grasas en los alimentos de origen animal y como aceites en los de origen vegetal. Por ejemplo la mantequilla, los quesos, el huevo, carne contienen grasas. En las semillas como nueces, cacahuates, almendras, aguacate podemos encontrar aceites. Vitaminas Las vitaminas se encuentran tanto en alimentos de origen animal como en los procedentes de vegetales. En general las vitaminas liposolubles se encuentran en alimentos y derivados de animales, mientras que las hidrosolubles las vamos a encontrar en las legumbres, hortalizas y frutas. Minerales El principal aporte de minerales a la dieta es el agua, sin embargo las frutas y verduras y los cereales integrales son una excelente fuente de minerales. En el caso de México, la principal fuente de calcio es la tortilla. 80 Referencias 1. Badui D.S. (2006) Química de los alimentos. 4ª ed. Ed. Pretince - Hall. México, D.F., México. 736 pp. 2. Dingrando. Gregg. Hainen y Wistrom (2003) Química Materia y cambio. Ed, Mc Graw Hill. México, D. F. 774-784 3. Phillips, Strozak y Winstrom. (2000) Química Conceptos y aplicaciones 1ª ed. Ed, Mc Graw Hill. México, D. F. 669-691 4. Sodhi, N.S., and Narpinder S. (2005) Characteristics of acetylated starches prepared using starches separated from different rice cultivars. Journal of Food Engineering, 70: 117–127. ¿Hay relación entre la estructura de los nutrimentos y su función en el organismo? Las actividades que cotidianamente realizas, consumen parte de la energía que te proporcionan los alimentos que constituyen tu dieta diaria, la que debe incluir diversas cantidades de carbohidratos, lípidos, proteínas, vitaminas y minerales. Cada uno de estos nutrimentos presenta estructura y propiedades características que dan lugar a funciones específicas en el desarrollo de tu organismo. Iniciemos el estudio de estos nutrimentos. CARBOHIDRATOS Los carbohidratos, azúcares o glúcidos son biomoléculas orgánicas formadas por una cadena de átomos de carbono unidos a átomos de Hidrógeno y Oxígeno en proporción de 1:2:1, cuya fórmula general es: Cn(H2O)n. Actúan como reserva de energía o como formadores de estructuras, tanto a nivel molecular (forman nucleótidos), como a nivel celular (pared vegetal) o tisular (tejidos vegetales de sostén, con celulosa). Clasificación de carbohidratos Este tipo de compuestos es muy variado por lo que su clasificación fundamentalmente depende de tres características: el grupo funcional presente en su estructura molecular, el tamaño o número de átomos de carbono y la función que desempeñan en el organismo. 81 Desde el punto de vista químico pueden presentar los grupos funcionales aldehídos o cetonas polihidroxiladas. Esto significa que en su estructura tienen un grupo aldehído o un grupo cetona y varios grupos hidroxilo (alcohol), como se muestra en las siguientes imágenes Figura 1.- Grupos funcionales presentes en los carbohidratos Figura 2.- Grupos funcionales en los carbohidratos De acuerdo al tamaño, estructural y función de la molécula, los carbohidratos se clasifican en simples y complejos. CARBOHIDRATOS SIMPLES O MONOSACÁRIDOS Los carbohidratos simples también llamados monosacáridos se caracterizan por su sabor dulce, se disuelven en agua, forman cristales y no pueden dividirse (hidrolizarse) en carbohidratos más pequeños, generalmente se encuentran en frutas, leche, hortalizas, dulces y miel. Los monosacáridos son las unidades más simples de carbohidratos formados por una sola molécula de azúcar y por lo tanto son los azúcares más sencillos. 82 En los anteriores ejemplos de monosacáridos (azúcares como galactosa, glucosa y fructuosa) puedes observar la presencia de un grupo carbonilo (formado por un átomo de carbono unido a un átomo de oxígeno mediante un doble enlace) en uno de sus carbonos y grupos hidroxilos (-OH) en la mayoría de los otros átomos de carbono. Figura 3.- Grupo carbonilo Los monosacáridos en solución acuosa pueden adoptar una forma cíclica cuando uno de sus grupos hidroxilo reacciona con el grupo carbonilo, ya sea aldehído o cetona, de su misma molécula, y formar así un enlace. De tal modo que los azúcares de seis o más carbonos adoptan una forma de anillo de seis miembros. Los azúcares de seis carbonos cuyo grupo funcional es una cetona formarán anillos de cinco miembros al igual que azúcares con cinco átomos de carbono cuyo grupo funcional es un aldehído. Para representar lo anterior podemos hacer uso de dos tipos de estructuras, las proyecciones de Fisher donde los azucares se presentan en forma abierta (y que hemos mostrado desde el principio), mientras que las proyecciones de Haworth representan estructuras cerradas (en forma de anillo). Figura 4.- Proyecciones de Fisher y Haworth (los números rojos muestran la forma correcta de numerar al monosacárido). 83 Clasificación de los monosacáridos (Fórmula general (CH2O)n) De acuerdo con el grupo funcional que presenten, los monosacáridos se clasifican en dos grupos: aldosas si en su estructura contienen un grupo aldehído y cetosas si en su estructura presenta un grupo cetona. Observa e identifica ambos grupos en los siguientes ejemplos: Figura 5.- Aldosa y cetosa En la siguiente tabla se muestran los grupos funcionales presentes en los monosacáridos Tipo de compuesto Alcoholes Cetonas Grupo Funcional Nombre Estructura R OH Hidroxilo O Oxo R1 Aldehídos R2 O Formilo R H Tabla 1.- Grupos funcionales presentes en los carbohidratos a) Con base en el número de átomos de carbono los monosacáridos se clasifican en: 84 Tipo Triosa Tetrosa Pentosas Hexosa Número de átomos de carbono 3 4 5 6 Ejemplo Gliceraldehído Eritrosa Ribosa Fructosa Tabla 2. Carbohidratos en función del número de átomos de carbono Figura 6.- Carbohidratos de acuerdo a su número de átomos de carbono ENLACES GLUCOSÍDICOS Y REACCIONES DE CONDENSACIÓN PARA LA FORMACIÓN DE DISACÁRIDOS Y POLISACÁRIDOS. Las macromoléculas (polímeros) como los disacáridos o polisacáridos se forman a partir de dos o más unidades de monosacáridos de glucosa unidas a través de un átomo de oxígeno (enlaces glucosídicos), formando moléculas más complejas y una molécula de agua que se forma por el desprendimiento de un hidrógeno y un hidroxilo (-OH). El proceso de polimerización por el cual se obtienen disacáridos y polisacáridos con la pérdida de una molécula de agua, se conoce como reacción de condensación (reacción de polimerización). La reacción inversa de la 85 condensación se le conoce como obtienen las moléculas originales. hidrólisis, es decir se adiciona agua y se Veamos la siguiente imagen donde podemos apreciar la reacción de condensación de cualquier monosacárido para formar un disacárido. Figura 7.- Formación del enlace Glucosídico En la siguiente imagen se representa la formación del disacárido maltosa cuando se unen dos moléculas de glucosa, date cuenta que la reacción sucede entre el grupo hidroxilo del carbono 1 y el hidroxilo del carbono 4 de la otra molécula de glucosa, eliminándose de esta forma una molécula de agua. Figura 8.- Formación de la maltosa Si observas con cuidado notaras que el grupo funcional que se forma cuando se unen dos monosacáridos es un éter (R´– O – R¨). DISACÁRIDOS Y POLISACÁRIDOS Los carbohidratos (también llamados glúcidos) se encuentran principalmente en alimentos que contienen almidón y azúcares como pastas, pan, harinas, cereales, maíz y papas; se clasifican en disacáridos y polisacáridos y se forman cuando dos o más monosacáridos se unen mediante enlaces glucosídicos a través de reacciones de condensación, como la polimerización de la glucosa. 86 Disacáridos Los disacáridos están formados por dos monosacáridos y los polisacáridos se forman por más de diez monosacáridos. Cuando dos monosacáridos se unen se produce un disacárido como la sacarosa y lactosa. ¿Sabías que la leche y las galletas contienen los disacáridos conocidos como lactosa y sacarosa? Observa con atención las siguientes figuras. Figura 7.- Estructura química de la lactosa Figura 8.- Estructura química de la Sacarosa Como habrás notado cada uno de estos disacáridos se forma por la unión de dos moléculas diferentes, ya que la lactosa se forma por la unión de una molécula de galactosa y una de glucosa, mientras que la sacarosa es el resultado de unir una molécula de glucosa y una de fructuosa. Polisacáridos Los polisacáridos son polímeros que no tienen sabor dulce, no cristalizan y no tienen poder reductor; estos polisacáridos se producen cuando varias unidades de monosacáridos (monómeros) se unen mediante enlaces glucosídicos. 87 Es necesario recordar, en el caso de los carbohidratos, que la polimerización es el proceso mediante el cual se unen pequeñas unidades llamados monómeros (monosacáridos) para obtener una molécula de mayor tamaño y complejidad. Los polisacáridos más importantes son el almidón presente en las papas, la celulosa contenida en los vegetales verdes como la lechuga y el glucógeno que tiene la carne. En general, la importancia biológica de estos tres polisacáridos complejos reside en que pueden servir como reservas energéticas o pueden conferir estructura al ser vivo que los contiene; sin embargo, la función que cumplan estará determinada por el tipo de enlace que se establezca entre los monosacáridos que lo forman. Veamos algunos ejemplos de polisacáridos. Almidón Fórmula molecular (C6H10O5)n El almidón se encuentra en los cereales como el maíz, arroz y en las papas; es un polímero de glucosa que se puede separar en dos fracciones, la amilosa que representan aproximadamente el 20-30% de la estructura y la amilopectina que constituye el 70-80% de la estructura. Su función en las plantas es de reserva energética. Figura 9.- Estructura química de la amilosa Los humanos y animales superiores sí podemos digerir el almidón ya que nuestras enzimas están diseñadas para reconocer la posición del carbono 1 y 4 denominada alfa. Celulosa Fórmula: (C6H10O5)n La celulosa esta formada por monómeros de glucosa que se unen mediante enlaces entrecruzados formando una estructura lineal sin ramificaciones, principalmente se encuentra en paredes celulares vegetales. Su importancia biológica reside en que proporciona estructura al tejido vegetal que la contiene otorgándole resistencia y dureza. Las cadenas de celulosa se 88 unen entre sí, mediante puentes de hidrógeno, formando fibras más complejas y más resistentes. Figura 10.- Estructura química de la celulosa Aunque la celulosa es un polímero lineal de la glucosa al igual que la amilosa (presente en el almidón) donde participan los átomos de carbono 1 y 4 de cada molécula de glucosa, los humanos no podemos digerirla, debido a que la orientación del carbono 1 (beta) de la celulosa es diferente a la del carbono 1 (alfa) de la amilosa, y este pequeño cambio hace que las enzimas del organismo no puedan digerirla. Observa con atención la figura 10 para que la compares con la de la amilosa de la figura 09 y te des una idea del porque las enzimas no pueden reconocerla y cortarla en pequeñas unidades. Glucógeno La principal función del glucógeno es de reserva energética, se acumula en el tejido muscular esquelético y en el hígado; está formado por monómeros de glucosa que se unen mediante enlaces entrecruzados. Figura 10.- Estructura química del glucógeno 89 A practicar I. Da respuesta a las siguientes preguntas de opción múltiple. 1. La lactosa es: a) Un disacárido formado por fructosa y glucosa. b) Un disacárido formado por glucosa y fructosa. c) Un disacárido formado por galactosa y glucosa. d) Un monosacárido formado por glucosas. 2. La siguiente estructura molecular corresponde a: a) b) c) d) Maltosa. Glucosa. Lactosa. Sacarosa. 3. La maltosa se encuentra en: a) El almidón. b) La leche. c) La glucosa. d) La celulosa. e) 4. La sacarosa está formada por: a) Glucosa y fructosa. b) Glucosa y galactosa. c) Glucosas. d) Galactosa. 5. El azúcar que se usa en la cocina es: a) Fructosa. b) Glucosa. c) Maltosa. d) Sacarosa. 6. El almidón se encuentra en: a) Animales y plantas. b) Animales y hongos. c) Animales. d) Plantas. 7. En el enlace glucosídico se : a) Unen dos aminoácidos entre sí. b) Libera una molécula de agua. c) Unen dos carbonos de cualquier molécula. 90 d) Permite ciclar la glucosa. 8. Los carbohidratos guardan una relación estructural al estar formados por los grupos: a) Hidróxido, carboxílico b) Aldehído, cetona c) Carbonilo, Aldehído, éster 9. La estructura molecular de la fructosa representa a una: a) Cetopentosa b) Aldohexosa c) Cetohexosa d) Aldopentosa 10.-Los monosacáridos se unen para formar disacáridos y oligosacáridos mediante el enlace denominado como: a) Iónico b) Peptídico c) Metálico d) Glucosídico 11. El enlace glucosídico conduce a la formación del grupo funcional a) Amida b) Éter c) Amina d) éster II. Relaciona el polisacárido con su función y escribe dentro del paréntesis la letra que indique la respuesta correcta. Polisacárido 1. Almidón 2. Glucógeno 3. Celulosa ( ( ( Función ) Glúcido con función estructural en vegetales ) Glúcido con función de reserva energética en vegetales ) Glúcido con función de reserva energética en animales LIPIDOS Y GRASAS Los lípidos son biomoléculas orgánicas no polares formadas por Carbono, Hidrógeno y Oxígeno. Las grasas, los aceites y las ceras son lípidos. 91 Son un grupo de moléculas con composición, estructura y funciones muy diversas, son solubles en solventes no polares como el tetracloruro de carbono (CCl 4), benceno (C6H6) y éter (CH3-CH2-O-CH2-CH3), por tanto son insolubles en agua. Presentan dos funciones importantes en los organismos vivos: son componentes estructurales de la membrana celular y almacenan energía. Las cubiertas protectoras de las hojas de las plantas y la piel de los animales, están compuestas de varios lípidos. A diferencia de los carbohidratos y de las proteínas, los lípidos no forman polímeros, pero en el extremo de sus largas cadenas tienen un grupo carboxilo (-COOH) como grupo funcional, que es el ácido graso ÁCIDOS GRASOS La mayoría de los ácidos grasos son largas cadenas que contienen entre 12 y 14 átomos de carbono, su fórmula general es CH3(CH2)nCOOH Figura 12.- Grupo funcional Ácido Carboxílico Dependiendo de la presencia o ausencia de enlaces dobles entre los átomos de carbono, los ácidos grasos se agrupan en dos categorías, los que no contienen enlaces dobles se llaman ácidos grasos saturados, mientras que aquellos que tienen uno o más enlaces dobles se les conoce como ácidos grasos no saturados, también conocidos como insaturados. Figura 13.- El Ácido palmítico es un buen ejemplo de ácido graso saturado. 92 Figura 14.- El ácido palmitoleico es un buen ejemplo de ácido graso insaturado Figura 15.- El ácido linoleico presenta dos insaturaciones una en el carbono 9 y otra en el 12. El ácido esteárico es un ácido graso saturado, mientras que el ácido oléico es un ácido graso no saturado. En las siguientes imágenes (Figura 16 y 17) puedes observar dos ácidos que están presentes en nuestra dieta, ambos ácidos tienen 18 átomos de carbono, sin embargo la presencia de un enlace doble en el ácido oléico hace diferente su estructura molecular y por lo tanto sus propiedades son diferentes a las del ácido esteárico. 93 Figura 16.- Ácido esteárico El ácido oleico (ácido graso no saturado o “insaturado”) tiene cadenas de la misma longitud que el ácido esteárico pero con dos hidrógenos menos, es decir no saturado. Figura 17.Ácido oléico LOS GLICÉRIDOS ¿Sabías que los lípidos que se encuentran en el cuerpo y en la mayoría de los alimentos son triglicéridos? Los triglicéridos son el tipo más común de grasas o lípidos transportados en nuestra sangre, depositados en nuestras células y presentes en los alimentos. Al igual que en la reacción para la formación de un polisacárido (molécula más compleja) para obtener un triglicérido se unen moléculas pequeñas como la glicerina y los ácidos grasos. La cadena carbonada de un ácido graso puede variar en longitud. Los ácidos grasos, aunque son abundantes en los organismos vivos, rara vez se encuentran solos, con frecuencia se da la unión de tres moléculas de ácidos grasos con una molécula de glicerol (o glicerina), mediante la reacción de esterificación, produciendo el triglicérido, que es la molécula básica de los lípidos. 94 Figura 18.- Reacción de esterificación. Nótese que esta reacción al igual que la del enlace glucosídico es una reacción de condensación. Cuando se une el glicerol al ácido graso se forma un grupo éster en donde el grupo hidroxilo reacciona con el grupo carbonilo del ácido y se desprenden moléculas de agua. De esta manera se producen las moléculas base de las grasas. Cuando los ácidos grasos son saturados se forman las grasas y cuando hay presencia de ácidos grasos insaturados se producen los aceites. La diferencia en la estructura del ácido graso por la presencia o ausencia de dobles enlaces tiene impacto sobre propiedades físicas como el punto de fusión. Los triglicéridos pueden ser sólidos o líquidos a temperatura ambiente, si son líquidos, generalmente se llaman aceites y si son sólidos se les llaman grasas. El punto de fusión es muy importante pues con él se define si un lípido es una grasa o un aceite. Así un aceite es un éster de glicerol con ácidos grasos insaturados cuyo punto está por debajo de la temperatura ambiente; mientras una grasa es un éster de glicerol pero con los ácidos grasos saturados cuyo punto de fusión se encuentra sobre la temperatura ambiente. El 90% de las grasas contenidas en los alimentos y de las grasas depositadas en nuestro cuerpo se encuentran en forma de triglicéridos. Existen unos 20 diferentes ácidos grasos que pueden unirse a la glicerina. Éstos difieren en la longitud de sus cadenas de carbono y en el número de átomos de hidrógeno de las mismas. Triestearina Otro triglicérido importante es la Triestearina que se encuentra en las carnes rojas y se forma a partir de tres moléculas de ácido esteárico que se encuentra en las grasas animales. 95 O H2C CH2 C O CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH3 CH2 O HC H2C O CH2 O C CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH3 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 C CH2 CH2 CH2 CH2 CH2 CH3 O Figura 19.- Triestearina formada por tres moléculas de ácido esteárico y una de glicerol A practicar I. Selecciona la respuesta correcta 1. Los enlaces de unión que forman un triglicérido se llaman: a) Peptídico. b) Fosfolipídico. c) Éster. d) Glucosídico. 2. Los ácidos grasos a) b) c) d) Se llaman saturados si no existen dobles enlaces entre carbonos. Se llaman saturados si contienen dobles enlaces en su estructura Son ácidos fuertes. Siempre están formados por un número de carbonos impar. 3. Los ácidos grasos saturados solidifican a: a) Baja temperatura porque forman muchas interacciones débiles entre las moléculas. b) Altas temperaturas porque forman pocas interacciones débiles entre sus moléculas. c) Altas temperaturas porque forman muchas interacciones débiles entre sus moléculas. d) Baja temperatura porque forman pocas interacciones débiles entre las moléculas 4. Los ácidos grasos insaturados solidifican a: a) Baja temperatura porque forman pocas interacciones débiles entre las moléculas. b) Baja temperatura porque forman muchas interacciones débiles entre las moléculas. 96 c) Altas temperaturas porque forman muchas interacciones débiles entre sus moléculas. d) Altas temperaturas porque forman pocas interacciones débiles entre sus moléculas. 5. ¿Cuántos átomos de carbono hay en el ácido oleico según la siguiente estructura? a) 18 átomos b) 17 átomos c) 16 átomos d) 15 átomos 6. El ácido oleico es un ácido graso de tipo: a) Saturado b) Di-insaturado c) Monoinsaturado d) poliinsaturado 7. ¿Qué grupo funcional forma la unión del glicerol con los ácidos grasos? a) Amida b) Éter c) Amina d) éster PROTEINAS ¿Te has preguntado porque el pollo, los frijoles y el pescado son tan nutritivos? Efectivamente, porque contienen proteínas que son biomoléculas importantes para las células vivas. Las proteínas son biomóleculas formadas básicamente por los elementos carbono, hidrógeno, oxígeno y nitrógeno. Pueden además contener azufre y en algunos tipos de proteínas fósforo, hierro, magnesio y cobre entre otros elementos. Las proteínas se pueden considerar polímeros que se forman a partir de pequeñas moléculas (monómeros) que reciben el nombre de aminoácidos, compuestos químicos que contienen nitrógeno, carbono, hidrógeno, oxígeno y algunos azufre. 97 Figura 20.- Formula general de un aminoácido Todos los aminoácidos tienen en común que poseen un grupo amino (-NH2) y un grupo carboxilo (-COOH) unidos a un mismo carbono central al que se le denomina alfa (α). Como puedes observar en la figura anterior a este carbono también se encuentra unido un hidrógeno y un grupo R. Figura 21.- Identificación de grupos funcionales en los aminoácidos Es importante resaltar que los radicales (R, cadenas de carbono) o cadenas laterales confieren al aminoácido las propiedades que los caracterizan. Por ello, estos radicales se utilizan como criterio de clasificación de los aminoácidos. Se han identificado 20 aminoácidos que están presentes prácticamente en todas las proteínas y se les consideran aminoácidos esenciales porque son indispensables y deben consumirse durante la dieta. Entre éstos se encuentran ocho aminoácidos que el organismo no es capaz de sintetizar: Isoleucina Fenilalanina, Leucina, Treonina, Lisina, Triptófano, Metionina y Valina A practicar I. En cada estructura Identifica el grupo amino, el grupo carboxilo y la cadena lateral o radical. Como se muestra en el ejemplo, encierra en color rojo el grupo amino, en azul el grupo carboxilo y en verde la cadena lateral. 98 Alanina (Ala) * Lisina (Lys) Glicina (Gli) **Arginina (Arg) * Valina(Val) * Leucina (Leu) * Isoleucina (Ile) * Triptófano (Trp) * Treonina (Tre) * Fenilalanina (Fen) ** Histidina (His) Asparagina (Asn) Glutanina (Gln) Serina (Ser) 99 Tirosina (Tyr) Ácido glutámico (Glu) Ácido aspártico (Asp) * Metionina Cisterna (Cys) Prolina (Pro) Propiedades químicas de los aminoácidos Los aminoácidos presentan cargas eléctricas, es decir, pueden ganar o ceder protones al medio, dependiendo del pH de la disolución en la que se encuentren. Si la disolución es ácida, los aminoácidos ganan protones y se comportan como una base. Si la disolución es básica, ceden protones y se comportan como un ácido. Por tener este comportamiento, se dice que los aminoácidos son anfóteros. Enlace peptídico Las cadenas de las proteínas, son una sucesión de aminoácidos, los cuales se unen químicamente mediante un enlace peptídico. En el siguiente ejemplo se muestra el enlace peptídico entre dos aminoácidos. Figura 22.- Formación del enlace peptídico Este enlace se establece entre el grupo carboxilo (-COOH) del primer aminoácido y el grupo amina (-NH2) del segundo aminoácido con la eliminación 100 de una molécula de agua, como se puede ver la unión de estos dos grupos funcionales terminales da como resultado un grupo funcional amida (-CO-NH2). La característica principal de este enlace radica en que no permite el giro de los elementos unidos por él, por lo que es un enlace rígido. La rigidez de este enlace se debe a que los electrones del doble enlace, que posee el carbono del grupo carboxilo con el oxígeno, se movilizan hacia la unión entre el carbono carboxilo y el nitrógeno del grupo amina. Las proteínas se encuentran en sangre, músculos, cerebro, e incluso en el esmalte dental; son sustancias centrales de casi todos los procesos bioquímicos, como las reacciones que ocurren en los seres vivos. Alimentos fuente de proteínas. Una proteína adecuada proporciona todos los aminoácidos esenciales en las cantidades necesarias para el crecimiento y reparación de los tejidos corporales. La mayor parte de las proteínas de origen vegetal son deficientes en uno o más aminoácidos. Por ejemplo, la proteína del maíz carece de suficiente lisina y triptófano; las proteínas del arroz no contienen suficiente lisina, ni treonina; la proteína de soya, tal vez la mejor proteína no animal, carece de suficiente metionina. Por el contrario, las proteínas de origen animal contienen todos los aminoácidos indispensables en cantidades suficientes. La carne, la leche, el pescado, los huevos y el queso, proporcionan proteínas adecuadas. Es interesante conocer el hecho de que diversos platillos étnicos, como los siguientes, proporcionan proteínas relativamente buenas al combinar un cereal con una legumbre (chícharos, frijoles, etc.). El grano es deficiente en triptófano y lisina, pero tiene suficiente metionina. Las legumbres son deficientes en metionina, pero tienen suficiente triptófano y lisina. Clasificación de las proteínas Dada la variedad de las funciones de las proteínas, para clasificarlas se aplican varios criterios, uno de ellos es de acuerdo al número de unidades que las constituyen, y el otro es con base en su composición química. Clasificación con base al número de unidades. Como ya mencionamos antes, las unidades estructurales de las proteínas son los aminoácidos, por tanto, en base al número de aminoácidos que tiene la cadena proteica, las proteínas de clasifican en: 101 Dipéptidos Son cadenas proteínicas formadas por dos aminoácidos. Tripéptidos Cadenas formadas por tres aminoácidos. Oligopéptidos Cadenas con menos de 10 aminoácidos. Polipéptidos Cadenas con más de10 y hasta 30 o 40 aminoácidos. En la siguiente tabla se muestran las principales funciones de las proteínas Función Ejemplos Estructural Las glucoproteínas forman parte de la membrana celular, facilitando el transporte de sustancias. El colágeno, la elastina y la queratina le proporcionan elasticidad y resistencia a órganos y tejidos. Enzimática La saliva contiene la enzima amilasa, la cual se encarga de iniciar la hidrólisis del almidón. Hormonal La insulina y el glucagón regulan los niveles de glucosa en la sangre. Defensiva La trombina y el fibrinógeno contribuyen a la formación de coágulos sanguíneos para evitar hemorragias. Las mucinas tienen un efecto germicida y protector de las mucosas. Transporte La hemoglobina se encarga del transporte de oxígeno en la sangre. Los citocromos se encargan del transporte de electrones en la cadena respiratoria. Contráctil La miosina y la actina son responsables de la contracción muscular. Reserva La ovoalbúmina de la clara de huevo constituye la reserva de aminoácidos para el desarrollo del embrión. Tabla .- Principales funciones de las proteínas 102 A practicar I. Selecciona la respuesta correcta para cada pregunta 1. El enlace que se forma entre dos aminoácidos recibe el nombre de: a) b) c) d) Éster. Glucosídico Peptídico. Aminoacídico. 2. El enlace entre dos aminoácidos se forma con: a) El carbono asimétrico del primer aminoácido y el grupo carboxilo del siguiente aminoácido. b) El grupo carboxilo del primer aminoácido y el grupo amina del siguiente aminoácido. c) Los radicales de los aminoácidos correspondientes. d) El grupo amina del primer aminoácido y el grupo carboxilo del siguiente aminoácido. 3. El enlace peptídico es: a) b) c) d) Doble, pero puede rotar. Sencillo, por lo que puede rotar. Sencillo, pero rígido. Doble, por lo que puede rotar. VITAMINAS Las vitaminas a diferencia de las proteínas, carbohidratos y lípidos, son un grupo heterogéneo de sustancias que intervienen en la regulación de diferentes reacciones metabólicas, son compuestos esenciales para nuestro organismo y deben aportarse diariamente en la dieta ya que nuestro organismo no los puede sintetizar (o lo hace en cantidades insuficientes). Su función primordial junto con los minerales es "participar" en el control del metabolismo lipídico, proteico y glucídico. Estos compuestos no nos proporcionan energía, lo que hacen es ayudarnos a convertir los alimentos de la dieta en energía. Las vitaminas también están formadas esencialmente por los elementos carbono, hidrógeno y oxígeno. Observa la siguiente imagen e identifica los diferentes grupos funcionales presentes en algunas vitaminas: 103 Figura 23.- Identificación de grupos funcionales en vitaminas Son diversas las vitaminas necesarias por el hombre y en consecuencia sus estructuras químicas son diferentes. La solubilidad de las vitaminas es una propiedad importante que se considera para su clasificación en dos grandes grupos: las hidrosolubles (solubles en agua) y las liposolubles (solubles en lípidos). Las vitaminas liposolubles son aquéllas que son insolubles en agua, pero solubles en solventes no polares como el tetracloruro de carbono, cloroformo, benceno, etc. Las vitaminas liposolubles son: Vitamina “A” (Retinol) Vitamina “D” (Calciferol) Vitamina “E” (Tocoferol) Vitamina “K” Las vitaminas hidrosolubles son la vitamina “C” y el complejo B. Estas vitaminas que se disuelven en agua, no se almacenan en el organismo por lo que deben aportarse regularmente a través de los alimentos, su exceso se elimina por la orina y no tienen efecto tóxico. Además las vitaminas hidrosolubles además constituyen un grupo de coenzimas (moléculas pequeñas de naturaleza orgánica que actúan como transportadores de 104 grupos químicos) de gran importancia en numerosas reacciones del metabolismo intermediario en las que producen oxidación, reducción y transferencia de grupos químicos. A practicar I. Selecciona la respuesta correcta 1. Las vitaminas son sustancias orgánicas con función: a) Estructural b) Biocatalizadora c) Energética 2. a) b) c) Un ejemplo de vitamina hidrosoluble es: Vitamina D Vitamina E Vitamina C 3. a) b) c) En cuanto a las vitaminas liposolubles, es cierto que: Todas son de naturaleza lipídica. Todas son de naturaleza protéica. Algunas son de naturaleza glucídica 4. Tienen capacidad antioxidante, las vitaminas: a) K, W y H b) D, PP y B c) A, E y C. MINERALES COMO NUTRIENTES Los minerales es un grupo de nutrimentos que no aportan energía al organismo pero tienen una función reguladora en el organismo de los seres vivos, además de formar parte de la estructura de muchos tejidos (huesos, dientes). La mayoría de los elementos minerales se aportan al organismo a través de la alimentación diaria, a excepción del calcio, hierro, yodo y flúor, si la alimentación no los aporta en concentraciones adecuadas, se puede producir alteraciones más o menos graves en nuestro metabolismo provocando desequilibrio y trastornos orgánicos. En función de las cantidades que necesita tu organismo a los minerales se les clasifica en tres grupos. Macroelementos o macronutrimentos son los minerales sodio (Na), potasio (K), calcio (Ca), fósforo (P), magnesio (Mg), cloro (Cl) y azufre (S) si tu organismo necesita 100 mg/día. 105 Si tu organismo requiere muy pequeñas cantidades (no superiores de unos mg/día) de hierro (Fe), flúor (F), yodo (I), manganeso (Mn), cobalto (Co), cobre (Cu), cinc (Zn) se les conoce como microelementos. Y como su nombre lo indica, serán elementos traza el silicio (Si), niquel (Ni), cromo (Cr), litio (Li) molibdeno (Mb) y selenio (Se). Los minerales son micronutrimentos inorgánicos que forman parte de algún órgano o elemento del cuerpo, como son los huesos o la sangre y se adquieren a través de algunas frutas, vegetales y otros alimentos. Estos elementos mantienen saludables y funcionando bien a las células de cada uno de los órganos del cuerpo, activan la producción de líquidos y sustancias del cuerpo, como las hormonas o las enzimas y ayudan en la realización de varios procesos vitales como la respiración, la digestión o la circulación. Los minerales forman parte de las frutas, vegetales y otros alimentos y vienen en diminutas cantidades en ellos, pero en cantidad suficiente para los requerimientos humanos. Entre los más importantes para el cuerpo están: hierro, zinc, calcio, potasio, sodio, yodo, magnesio y otros más. En la siguiente tabla se muestran algunas de las funciones que desempeñan estos elementos en el organismo humano. Hierro Magnesio Sirve para producir hemoglobina y transportar oxígeno a todo el cuerpo. Su falta provoca: Anemia, fatiga, depresiones y favorece las infecciones. Viene en: Higos, vegetales de hoja verde, dátiles, cereales, leguminosas, pepitas, yema de huevo, hígado, carnes, sardinas. Sirve para: Ayudar al funcionamiento de los músculos, conservar sanos los huesos, dientes y articulaciones. Su falta provoca problemas en músculos y nervios, debilidad y convulsiones. Viene en: Germen de trigo, habas, frijoles, maíz, avena, almendras, azúcar morena, nueces, higos, verduras de hoja verde. Calcio Fósforo Sirve para la formación y cuidado de huesos y dientes, participa en la coagulación de la sangre, ayuda a las funciones musculare y es necesario para el sistema nervioso. Su falta provoca: Reblandecimiento y debilidad en los músculos, raquitismo, osteoporosis y favorece las caries y la debilidad de las uñas. Viene en: Hortalizas de hoja verde, berros, verdolagas, semillas de ajonjolí y perejil, leche, queso, mantequilla, tortillas, sardinas y charales. Sirve para: La formación de huesos y dientes y produce energía para la formación de células. Su falta provoca: Debilidad y anorexia. Viene en: Cereales, frijoles, lentejas, habas, carnes, pescados, pollo, huevo, yogurt. Selenio Potasio Sirve para: Es antioxidante, protege contra en cáncer, ayuda al buen funcionamiento del corazón, el hígado y los órganos reproductivos. Su falta provoca: Dolores musculares. Viene en: Cereales integrales, verduras, carne, pescado, leche, queso. Sirve para: Ayudar al funcionamiento de los riñones y del corazón, ayuda en la transmisión de impulsos nerviosos, controla el nivel de agua corporal. Su falta provoca: Debilidad muscular y mareos. Viene en: Vegetales de hoja verde, fruta en general, papas. 106 Sodio Yodo Sirve para el funcionamiento de los músculos y nervios, regula los líquidos del cuerpo; y contribuye en la digestión. Su falta causa: Deshidratación; mareos y baja de presión. Viene en: Cereales, sal de mesa, pan, queso, carnes y pescados ahumados. Sirve para la formación de hormonas, su falta provoca Bocio. Este mineral lo encontramos en: Sal de mesa yodatada, pescados y mariscos. Flúor Zinc Sirve para: formar huesos y dientes y protege contra las caries. Su falta provoca caries. Su exceso provoca: manchas en los dientes. Viene en: Agua, mariscos, frutas, verduras y hojas de té. Contribuye a un adecuado crecimiento, ayuda en el desarrollo sexual, en el crecimiento del cabello, en el cuidado de la piel. Su falta provoca: problemas en el crecimiento, disminución de las defensas del cuerpo, anemia, problemas en la piel, disminución de la sensibilidad de los sentidos del gusto y del olfato. Viene en: Legumbres, frutos secos, cacahuates, cereales, semillas de girasol, carne roja, huevos y mariscos Sola, 2012. A practicar Da respuesta a las siguientes preguntas. 1. ¡Qué son los minerales? 2. ¿Por qué y para qué son útiles al organismo 3. ¿Cómo se clasifican a los minerales? 4. Para cada tipo de minerales, selecciona al menos tres elementos y responde a las siguientes preguntas: a) ¿Qué es? b) ¿Qué importancia tiene? c) ¿Qué sucede si hay carencia? d) ¿En qué alimentos se encuentran 107 Y tú, ¿cómo te alimentas? Las actividades diarias de todos los seres vivos requieren de energía, todos los procesos biológicos para que se lleven a cabo como: respirar, pensar, moverse, vivir. Las necesidades nutricionales son específicas para cada individuo, cada quién debe de seleccionar que es bueno y que no para mantenerse sano. En el cuerpo se llevan a cabo un conjunto de reacciones químicas que son posibles debido a la fuente principal de energía, los alimentos. Para lograr lo anterior lo primero que debemos de comprender es la palabra dieta, que es la cantidad de alimento que se le proporciona a un organismo en un periodo de 24 horas, sin importar si cubre o no sus necesidades de mantenimiento, en resumen es el conjunto de nutrientes que se absorben luego del consumo habitual de alimentos. Cuando hablamos de una dieta balanceada está deberá contener todos los nutrientes requeridos para llevar acabo las funciones necesarias para vivir, mismo que ya revisamos en los apartados anteriores. ¿Cuáles son esos nutrientes? El gran número de elementos químicos en el cuerpo humano se encuentra principalmente en forma de agua, proteína, grasas, sales minerales y carbohidratos, en los porcentajes indicados en la siguiente tabla. Componentes Agua Proteína Grasas Minerales Carbohidratos Porcentaje corporal 61,6 17,0 13,8 6,1 1,5 de peso Tabla 1- Composición química de un cuerpo humano que pesa 65 kg Como ya vimos el ser humano ingiere alimentos y no nutrientes individuales. En su mayoría los alimentos básicos como arroz, maíz y trigo, suministran principalmente carbohidratos para energía pero también importantes cantidades de proteína, un poco de grasa o aceite y micronutrientes útiles. Pero debemos recordar que para que el cuerpo obtenga constituyentes necesarios para su energía, desarrollo, mantenimiento y reparación corporal debe de consumir granos. 108 En el caso de los humanos la leche materna suministra todos los macro y micronutrientes necesarios para satisfacer las necesidades totales del recién nacido hasta los seis meses de edad. Componente Agua Función Aporta líquido al cuerpo y ayuda a regular la temperatura corporal Carbohidratos Como combustible y energía para el calor corporal y el trabajo Grasas Combustible energético y producción de ácidos grasos esenciales Proteínas Minerales Crecimiento y reparación Desarrollo de tejidos corporales, procesos metabólicos, y protección Vitaminas Partículas indigeribles y no absorbibles, incluyendo fibra Procesos metabólicos y de protección Forma un vehículo para otros nutrientes, agregan volumen a la dieta, suministran un hábitat para la flora bacteriana y ayudan a la eliminación adecuada de desechos. Tabla 2.- Clasificación simple de los componentes dietéticos ¿Cómo se conservan los alimentos? La operación de conservar los alimentos ocurre desde tiempo inmemorial y ha tenido como fundamento la finalidad de frenar el desarrollo tanto de reacciones enzimáticas como oxidativas, así como destruir la población microbiana contaminante, o al menos inhibir su crecimiento. Algunas veces las estrategias adoptadas tenían un fundamento físico, como ocurre con el aprovechamiento de los efectos del frío, del calor, la elevada concentración de sales, etc. En otras ocasiones se buscó el empleo de sustancias que por sus actividades eran capaces de impedir la proliferación bacteriana. En la siguiente tabla encontrarás resumidos algunos métodos de conservación de alimentos y las condiciones bajo las cuales se lleva a cabo 109 FACTOR MÉTODO CONDICIONES Pasteurización Temperatura inferiores a 100°C durante pocos segundos Ultrapasteurización Temperatura de 140°C durante tiempos muy cortos (2 segundos) Calor Esterilización Altas temperaturas (120°C) durante un largo período de tiempos (20 min) Refrigeración Se mantiene el alimento a bajas temperaturas (entre 2 y 8°C) sin alcanzar la congelación. Congelación Temperaturas inferiores al punto de congelación (-18°C) Frío Ultracongelación Se manejan temperaturas entre 35°C y -150°C. 110 Secado Pérdida de agua parcial en condiciones ambientales naturales, o con una fuente de calor suave y corrientes de aire. Salado La adición de sal evita el crecimiento de microorganismos Deshidratación Liofilización Irradiación Eliminación total de agua mediante una congelación rápida seguida de una sublimación Exposición de algunos alimentos a radiaciones ionizantes. Tabla 3 .- Métodos de conservación de alimentos Razones por las cuales se adicionan aditivos a los alimentos Los aditivos alimentarios son considerados ingredientes agregados intencionalmente, sin el propósito de nutrir, con el objeto de modificar las características físicas, químicas, biológicas o sensoriales, durante el proceso de elaboración y/ó envasado y/ó acondicionado, almacenado, transporte o manipulación de un alimento. Es decir en general se utilizan para aumentar la 111 estabilidad o capacidad de conservación, incrementar la aceptabilidad de alimentos genuinos, pero faltos de atractivo, permitir la elaboración más económica y en gran escala de alimentos de composición y calidad constante en función del tiempo. Como puedes ver los aditivos alimentarios desempeñan un papel muy importante en el complejo abastecimiento alimenticio de hoy en día. Nunca antes, ha existido una variedad tan amplia de alimentos, en cuanto a su disponibilidad en supermercados, tiendas alimenticias especializadas y cuando se come fuera de casa. Mientras que una proporción cada vez menor de la población se dedica a la producción primaria de alimentos, los consumidores exigen que haya alimentos más variados y fáciles de preparar, y que sean más seguros, nutritivos y baratos. En la siguiente tabla se muestra los principales tipos de aditivos. Tipo Antioxidantes Función Evitan la oxidación de los alimentos e impiden el enranciamiento y la decoloración. Se utilizan en productos horneados, cereales, grasas y aceites, y en aderezos para ensaladas. Conservantes Limitan, retardan o previenen la proliferación de microorganismos (p. Ej. bacterias, levadura, moho) que están presentes en los alimentos o acceden a ellos, y evitan que se deterioren o se vuelvan tóxicos. Aditivos que Los aditivos también se utilizan para aumentan o conferir ciertas características a los potencian alimentos, que mejoran su textura y cualidades facilitan su procesamiento sensoriales Colorantes Los colorantes se emplean en los alimentos para añadir o restaurar color, con el objetivo de mejorar su aspecto visual y poder dar respuesta a las expectativas del consumidor. Ejemplos -Tocoferoles, BHA y BHT -Ácido ascórbico y ácido cítrico El dióxido de azufre y los sulfitos Propionato cálcico Nitratos y nitritos Emulsionantes, espesantes estabilizantes. y Varios Tabla 4.- Aditivos 112 A practicar Cuestionario 1.- Investiga dos productos en los que se hayan aplicado cada uno de los métodos de conservación de alimentos mencionados en la Tabla 3 2.- Trata de definir qué es un aditivo 3.- ¿Qué es un antioxidante? 4.- ¿Para qué sirve un conservador? 5.- ¿Cuál es la función de los colorantes? 113 Referencias Badui D.S. (2006) Química de los alimentos. 4ª ed. Ed. Pretince - Hall. México, D.F. Calvo, M. (2006). Bioquímica de los alimentos. Recuperado el día 15 octubre del 2016 de http://milksci.unizar.es/bioquimica/temas/azucares/almidon.html Dingrando. G. (2003) Química Materia y cambio. Ed, Mc Graw Hill. México, D. F. Hill, J. W (1999) Kolb, D. K. Química para el nuevo milenio. Prentice Hall, México. Moore, J. (2000) El mundo de la Química: conceptos y aplicaciones, Addison Wesley Longman, México D. F.. Phillips, Strozak y Winstrom. (2000) Química Conceptos y aplicaciones 1ª ed. Ed, Mc Graw Hill. México. Timberlake, K. C. (1997) Química. Introducción a la química general, a la orgánica y a la bioquímica. Oxford University Press – Harla. México,. 114 Tercera unidad: Medicamentos, productos químicos para la salud 115 116 117 ¿Qué son los medicamentos? Medicamentos Son una mezcla de sustancias químicas que son útiles en el diagnóstico, tratamiento y prevención de enfermedades, de síntomas o signos patológicos y que es capaz de modificar los ritmos biológicos. Posee de uno o varios principios activos (sustancia responsable del efecto curativo que daña al agente agresor) destinadas a ser utilizadas en personas o animales, con efectos terapéuticos. Observa el siguiente mapa donde se muestran los conceptos relacionados con las mezclas homogéneas y heterogéneas para que podamos continuar con el tema. Los medicamentos de acuerdo a su presentación y composición, también los podemos clasificar en mezclas homogéneas y heterogéneas, como ejemplos tenemos: 118 Preparados sólidos: Polvos: compuestos por una o varias sustancias mezcladas y finamente molidas; pueden ser empleados para aplicación externa o interna. Cápsulas:fármacos envueltos en un envase de gelatina, generalmente , para mitigar su sabor desagradable, pueden ser sólidos o líquidos. Tabletas o comprimidos: fármacos obtenidos por compresión constituidos por polvos medicamentosos y un excipiente que se mezcla con el fármaco para darle la forma o calidad necesaria para su uso. Píldoras: son sólidos esféricos preparados por compresión, son pequeños y suelen llevar una capa protectora azucarada. Grageas: similares a las píldoras pero de mayor tamaño. Supositorios, preparados sólidos de forma cónica o de bala. Preparados semisólidos Pomadas: preparados para uso externo, de consistencia blanda adherente a la piel y mucosas (incorporan más grasa en el excipiente). untosa y Cremas: emulsiones con más agua en el excipiente, de consistencia más líquida y viscosa; para uso externo. Preparados líquidos Soluciones: fármacos obtenidos por disolución de sustancias químicas en medios aceitosos o acuosos; se pueden utilizar para uso externo o interno. Colirios o soluciones oftálmicas: utilizados para instilaciones oculares. 119 Lociones: soluciones para aplicaciones sobre la piel sin fricción. Jarabes: soluciones acuosas de fármacos y concentrados azucarados para uso oral. Preparados gaseosos Inhalaciones: soluciones de fármacos que se administran mediante nebulizaciones; requieren un envase especial con presión para pulverizar la solución. Aerosoles: precisan un aparato que produce una dispersión muy fina del líquido. A estas presentaciones se les conoce como formas farmacéuticas. A practicar En el siguiente cuadro identifica de qué tipo de mezcla se trata (homogénea o heterogénea) los ejemplos de medicamentos y regístralas en la columna correspondiente. Tipos de mezclas Mezcla Homogénea Heterogénea Tabletas efervescentes Solidos o líquídos Cremas Pomadas Suspensiones (antibióticos) Geles Las suspensiones de hidróxido de magnesio e hidróxido de aluminio Las suspensiones de penicilina Píldoras Supositorios 120 Los medicamentos, sin embargo, no sólo están formados por sustancias medicinales, a menudo van acompañados de otras sustancias que no tienen actividad terapéutica, se denominan excipientes, algunos de ellos son de declaración obligatoria, mientras que las sustancias medicinales, que son las que tienen actividad terapéutica, se denominan principios activos. Los excipientes c.b.p (cuanto baste para) son los componentes del medicamento diferentes al principio activo (sustancia responsable del efecto farmacológico). Estos se utilizan para conseguir la forma farmacéutica deseada en cada caso como pueden ser en presentaciones de cápsulas, comprimidos, soluciones etc, facilitan la preparación, conservación y administración de los medicamentos. Los colorantes, los conservantes, las sustancias aromáticas, los diluyentes, los saborizantes, los compuestos que se utilizan para recubrir las cápsulas o los reguladores de pH son algunos ejemplos de los excipientes que se utilizan en la formulación de los medicamentos. A continuación se muestran las partes que constituyen un medicamento. En el diseño de las formas farmacéuticas se consideran, entre otros aspectos, las barreras biológicas que debe atravesar el fármaco, la vía de administración, la urgencia de la situación médica, el efecto de primer paso y la estabilidad del principio activo. Es importante evitar la automedicación ya que conlleva una serie de riesgos para la salud que en muchos casos son desconocidos por los ciudadanos, algunos de estos riesgos son: 121 Toxicidad: efectos secundarios, reacciones adversas y en algún caso de intoxicación. Falta de efectividad porque se utilizan en situaciones en las que no están indicados. Por ejemplo, a veces se toman antibióticos para tratar procesos víricos ante los que no son efectivos. Dependencia o adicción. Enmascaramiento de procesos clínicos graves y por tanto retraso en el diagnóstico y tratamiento. Interacciones con otros medicamentos o alimentos que la persona está tomando. Puede haber una potenciación o disminución del efecto del medicamento. Resistencias a los antibióticos. El uso excesivo de antibióticos puede hacer que los microorganismos desarrollen mecanismos de defensa ante estos medicamentos de forma que dejen de ser eficaces. También es importante considerar la fecha de vencimiento o caducidad del medicamento ya que esta se basa en la estabilidad del fármaco en su envase o recipiente original, no abierto ni manipulado. La fecha de caducidad no implica que el fármaco sea inestable, debemos tener en cuenta que cuando se alcanza la fecha de caducidad, pueden resultar afectadas las propiedades del medicamento, ya sean estas químicas, físicas, terapéuticas, toxicológicas o microbiológicas. Aunque la mayoría de los estudios afirman que consumir un medicamento que ha caducado hace pocos meses no conlleva un peligro real para nuestra salud, lo más aconsejable es deshacernos de dicho fármaco para evitar posibles efectos adversos. La estabilidad de un medicamento depende, entre otros factores, de su forma farmacéutica. Por ejemplo, las formas farmacéuticas líquidas, tales como las soluciones, suspensiones o jarabes, no son tan estables como las formas sólidas. En estas últimas debemos fijarnos si hay algún cambio en el color o aspecto físico: aunque suele ser un signo de la degradación del excipiente y no del principio activo, debemos desechar ese fármaco como precaución. Lo mismo ocurriría en el 122 caso de que notáramos cualquier grado de turbiedad, cambios de color o aspecto en una solución inyectable. No obstante, uno de los factores que más afecta a la conservación de un un medicamento es la temperatura y la humedad, es por ello que siempre ese aconseja almacenarlos en lugares frescos y secos y asegurarse de que no sufran cambios bruscos de temperatura. Cuando se presenta resistencia bacteriana (la incapacidad de un antibiótico para actuar contra una bacteria), esta resistencia puede ser natural, es decir, cuando la bacteria es por naturaleza insensible a un antibiótico como la Mycobacterium tuberculisis es resistente de forma natural a las penicilinas, o adquirida, originada como mecanismo de defensa de la bacteria frente a un antibiótico al que previamente era sensible. Las bacterias tienden a tener una ligera resistencia a los antibióticos logran sobrevivir, se replican y así transmiten sus genes a otras generaciones, con el tiempo surgen cepas que son totalmente resistentes. ¿Cómo se obtienen los medicamentos? Etapas importantes en el desarrollo de medicamentos La industria farmacéutica actual se ha basado en los conocimientos científicos modernos para la síntesis (proceso por el cual se producen compuestos químicos a partir de precursores). La elaboración de algunas moléculas farmacológicas análogas que se encuentran presentes en diferentes especies vegetales o animales, muchas de estas sustancias forman parte de los principios activos de medicamentos modernos. La obtención de principios activos a partir de sus fuentes naturales comprende varias etapas. Cada etapa se lleva a cabo mediante la aplicación de una o más operaciones siguiendo la metodología establecida para tales fines: I. Operaciones preliminares a la preparación de extractos II. Métodos de extracción III. Fraccionamiento de los extractos 123 IV. Separación de los constituyentes de las fracciones V. Purificación de los pr¿Cómo seincipios activos. VI. Identificación de los principios activos I. Operaciones preliminares a la preparación de extractos 1. Recolección del material vegetal consiste en tomar de la naturaleza el material vegetal que contiene el principio activo. 2. Limpieza del material recolectado (consiste eliminar tierra y sustancias extrañas). 3. Desecación del material vegetal (tiene como objeto eliminar el agua de vegetación que contenga el material recolectado y limpio. 4. Estabilización (consiste en la destrucción irreversible de las enzimas sin que se alteren o extraigan los principios activos presentes en las plantas. 5. Curación (consiste en dejar almacenado el material vegetal por lo menos un año, en condiciones controladas de humedad y temperatura. 124 6. Fragmentación. Consiste en la desintegración y/o división del material vegetal y tiene la finalidad de facilitar la extracción de los constituyentes del mismo, se utilizan molinos mecánicos. II. Métodos de extracción La extracción es el proceso de separación de los principios solubles de las materias primas de origen natural, mediante la acción de un disolvente, la selección del disolvente se realiza considerando, en primer término, la actividad biológica que presenten los extractos obtenidos y, en segundo término, el rendimiento que se obtenga. La selección del método se realiza con base en la naturaleza de los constituyentes (propiedades físicas y químicas). Entre los métodos más utilizados se encuentran los siguientes: 1. Percolación (el material vegetal fragmentado y empacado en capas se colocan en un recipiente denominado percolador o lixiviador, es sometido a la acción de porciones frescas y sucesivas de un disolvente. Percolador 2. Maceración (consiste en dejar en contacto, por un tiempo determinado y a temperatura ambiente, el material vegetal con un disolvente adecuado). 125 3. Método de extracción continua (una misma cantidad de un determinado disolvente actúa continuamente sobre el material objeto de extracción, gracias a un proceso de evaporación – condensación repetitivo. Para ello se utilizan los aparatos extractores como el soxhlet 4. Destilación se utiliza fundamentalmente para la obtención de aceites esenciales. Es una técnica que se basa en los puntos de ebullición de los componentes presentes en el material vegetal, lo cual permite la separación de componentes volátiles de otros que son menos o nada volátiles. 5. Digestión es una forma de maceración con calor controlado. 6. Infusión. es un proceso que consiste en verter sobre el material vegetal fresco o desecado, un disolvente (generalmente agua) a ebullición, para extraer los compuestos solubles. 7. Decocción. Se pone a hervir simultáneamente el material vegetal, fresco o seco, con el disolvente (generalmente agua) 126 Fraccionamiento de los extractos, consiste en la separación de los constituyentes presentes en un extracto, los diferentes compuestos se separan en grupos en función de las diferencias o similitudes en sus propiedades fisicoquímicas (solubilidad, tamaño, polaridad, reactividad) III. Separación de los constituyentes de las fracciones, consiste en obtener de manera individual los constituyentes de las fracciones generadas durante el proceso de fraccionamiento. IV. Purificación de los principios activos, una vez separados los constituyentes de las diferentes fracciones es necesario purificarlos, es decir, eliminar cualquier posible impureza que contenga y para ello se utilizan las técnicas convencionales de purificación de compuestos orgánicos: recristalización, cromatografía, destilación, sublimación etc. Sublimación V. cromatografía cristalización Identificación de los principios activos, es el proceso de establecer la estructura molecular de los constituyentes aislados de una fuente natural y para ello se emplean métodos físicos, espectroscópicos, difracción de rayos X y métodos químicos, entre otros. Importancia de la estructura molecular en los medicamentos El mundo de los medicamentos ha constituido en el pasado y constituye en la actualidad una parte importante de la investigación y el desarrollo de productos derivados del carbono. Su importancia radica en mejorar la esperanza de vida de los seres humanos y sus condiciones sanitarias, hace de esta área del conocimiento científico una herramienta imprescindible para la medicina. 127 Los fármacos actúan en el organismo a nivel molecular y es precisamente el acoplamiento entre la molécula del fármaco y el receptor biológico, es decir, el sitio de la célula o del microorganismo sobre el cual aquél actúa, el último responsable de su acción curativa. Pero para que ese acoplamiento sea posible ambos agentes, fármaco y receptor, tienen que presentar una cierta complementariedad. Los receptores biológicos suelen ser moléculas de gran tamaño y por este motivo son las cadenas carbonadas de los compuestos orgánicos las que pueden poseer una estructura geométrica que mejor se adapte a la porción clave del receptor; tal hecho, junto con la presencia de grupos funcionales con acciones químicas definidas, son responsables de la abundancia de sustancias orgánicas entre los productos farmacéuticos. Los principios activos de los medicamentos por lo general son sustancias orgánicas, que están constituidas principalmente por carbono e hidrógeno además de tener otros elementos en sus estructuras como oxígeno, azufre, nitrógeno, halógenos entre otros. Importancia del análisis y síntesis químicos en la obtención de productos químicos El objetivo principal de la síntesis química, además de producir nuevas sustancias químicas, es el de desarrollar métodos más económicos y eficientes para sintetizar sustancias naturales ya conocidas, como por ejemplo el ácido acetilsalicílico (presente en las hojas del sauce) o el ácido ascórbico o vitamina C, que ya se encuentra de forma natural en muchos vegetales. La síntesis química permite obtener productos que no existen de forma natural a partir de elementos o compuestos para obtener sustancias de origen sintético. La industria farmacéutica, depende de complejos compuestos químicos, que se encuentran en el petróleo crudo para obtener mediante síntesis productos como los medicamentos. Relación entre la estructura molecular y las propiedades de los compuestos La estructura química aporta información sobre la forma en que se enlazan los diferentes átomos o iones que forman una molécula, o agregado atómico, la estructura química que posee el mismo grupo funcional ( átomos o grupos de 128 átomos unidos a cadenas de hidrocarburos alifáticas o aromáticas que representa la zona de reactividad de las moléculas), comparte similitudes. Por lo que requerimos de estudiar la estructura de cada sustancia con actividad farmacológica que influirá en la acción de tratar una enfermedad. Por ejemplo: la benzocaína y la lidocaína se emplean como anestésicos locales que puede causar pérdida de sensación en el área en la cual se aplica, en sus principios activos hay semejanzas entre sí, no obstante en la estructura de la lidocaína posee dos grupos amino y carece de un grupo éster en su estructura, por lo que se utiliza como anestésico local más potente y de larga duración, usado para tratamientos odontológicos, mientras que la benzocaína es de menor duración. Identificación de los grupos funcionales en moléculas de algunos principios activos presentes en medicamentos. La estructura química de una sustancia que sea capaz de modificar la estructura y/o las funciones de un organismo vivo con actividad farmacológica tendrá efectos en la interacción en las células a nivel molecular en un área fisiológica concreta para la acción del fármaco. La presencia de grupos funcionales en los medicamentos tiene su efecto, pasando del estómago a los intestinos, y luego al hígado antes de circular por el resto del cuerpo. Los grupos funcionales presentes en los medicamentos son los responsables de cómo actúan éstos sobre los órganos y las células. Por ejemplo, el ácido acetilsalicílico comúnmente conocido como aspirina alivia dolores leves y es un antiinflamatorio eficaz. Actúa inhibiendo la producción de prostaglandinas, que son compuestos que intervienen en la transmisión de las señales de dolor al cerebro. 129 El grupo éster del ácido acetilsalicílico es el responsable de inhibir a las enzimas, las cuales posteriormente se transforman en un grupo alcohol. Algunas personas que son alérgicas a la aspirina, pueden tomar sin peligro otras medicinas de efecto similar, la más común es el acetaminofén o paracetamol. El descubrimiento y desarrollo de nuevos medicamentos es una actividad que solo se lleva a cabo en países económicamente poderosos y con gran desarrollo tecnológico e industrial como en los EE.UU, Alemania y Japón. La investigación preclínica se lleva a cabo en animales de laboratorio y su propósito es descubrir, evaluar y caracterizar las propiedades biológicas de las sustancias químicas que pueden tener significado terapéutico y, al mismo tiempo, identificar y cuantificar los efectos colaterales y tóxicos a que puede dar lugar se administración. A continuación se mencionan las etapas de la investigación preclínica para el desarrollo de nuevos medicamentos: Identificación de alguna actividad biológica Confirmación de la actividad biológica detectada en los estudios iniciales Bioensayo Efectos biológicos generales Farmacocinética Estudios especializados (mecanismo de acción). Los resultados de estos estudios permiten conocer la dosis letal del compuesto, los efectos colaterales o tóxicos y los distintos márgenes de seguridad. Los resultados de estos estudios permiten anticipar los riesgos potenciales de las personas que participarán en los estudios clínicos. A practicar Escribe en los recuadros correspondientes los grupos funcionales presentes en la estructura química de los siguientes medicamentos. 130 131 ¿Cómo se sintetiza un principio activo? Grupos funcionales presentes como la parte reactiva de las moléculas orgánicas Historia de la aspirina Conocida desde la antigüedad No fue hasta las primeras décadas del siglo XIX que los científicos descubrieron que un compuesto llamado salicina, que estaba presente en los sauces y era eficaz para aliviar los dolores desde épocas antiguas. Basta revisar los registros históricos dejados por Hipócrates para saber que, 4 siglos antes de nuestra era, ya se usaba polvo de la corteza y las hojas del árbol de sauce para ayudar a calmar dolores y bajar la fiebre. Entonces, volviendo al siglo XIX, no pasó mucho tiempo más para que los hombres de ciencia consiguieran separar el ingrediente activo presente en la corteza de dicho árbol. Así, en 1828, un profesor de farmacia de la Universidad de Munich aisló una pequeña cantidad de cristales de color amarillo y sabor amargo a los que bautizó con el nombre de salicina. Dos científicos italianos lo habían conseguido dos años antes, pero en estado puro. En 1929, el francés Henri Leroux obtuvo, mediante un nuevo procedimiento de extracción, 30 gramos de salicina de un kilo y medio de corteza. Un largo camino hasta las tabletas En el año 1838, el químico italiano Rafael Piria, que trabajaba en ese entonces en la Universidad de la Sorbona, en París, Francia, fue quien dividió la salicina en un azúcar y en un componente aromático llamado salicilaldehído para obtener luego del segundo, mediante hidrólisis y oxidación, un ácido de agujas cristalizadas incoloras al que bautizó 132 con el nombre de “ácido salicílico”. El problema se presentó al notar que el nuevo ácido obtenido era muy fuerte para que el estómago los soportara. Las investigaciones continuaron y en 1853 el químico francés Charles Gerhardt consigue neutralizarlo agregándole sodio (con el cual se forma salicilato de sodio y cloruro de acetilo, dando origen así al ácido acetilsalicílico. A pesar de la importancia de su hallazgo, Gerhardt no sintió deseos de comercializarlo y abandonó su gran descubrimiento. Entonces, la idea la tomó alguien más: corría el último año del siglo XIX, cuando el químico alemán Felix Hoffmann, que trabajaba en la empresa Bayer, redescubrió la fórmula y los convenció de fabricarla. De esta manera, se patentó la fórmula de la aspirina en febrero del año 1900, que primero se vendió en polvo y finalmente en tabletas hacia 1915. Cambios químicos Reacción química: obtención del ácido acetilsalicílico (aspirina) 133 Condiciones de reacción: Presencia de catalizador Factor energético Medió ácido Tiempo de reacción A practicar Identifica los grupos funcionales que se encuentran encerrados en el círculo, presentes en los siguientes compuestos orgánicos para la síntesis de la aspirina A practicar Escribe en el siguiente cuadro las condiciones de reacción que indica la siguiente reacción de obtención del paracetamol. 134 El paracetamol, también conocido como acetaminofén. Actúa inhibiendo la síntesis de prostaglandinas, mediadores celulares responsables de la aparición del dolor. Es un medicamento con propiedades analgésicas, se presenta habitualmente en forma de cápsulas, comprimidos, supositorios o gotas de administración oral. Fue sintetizado en 1873 por Harmon Morse, mediante la reducción del p- nitro fenol en ácido acético glacial. En el laboratorio se puede sintetizar a través de la nitración de un anillo aromático y la posterior reducción del grupo nitro para dar acceso a aminas aromáticas. La reducción puede llevarse a cabo con zinc en medio ácido, posteriormente el producto es tratado con anhídrido acético, obteniendo el paracetamol. ¿Cómo ayuda la química a combatir las enfermedades? Importancia socioeconómica de la síntesis de medicamentos El objetivo principal de cualquier síntesis orgánica es la obtención de un compuesto determinado, realizando combinaciones de métodos complicados que en algunas ocasiones producen rendimientos bajos. Por ejemplo, en la década de 1930 a 1940, muchas compañías farmacéuticas deseaban sintetizar hormonas sexuales como el estradiol (utilizó para tratar los síntomas de la menopausia la prevención de la osteoporosis en mujeres posmenopáusicas y la sustitución de 135 estrógeno en las mujeres con falla ovárica u otras condiciones que causen la pérdida de estrógeno natural en el cuerpo). La progesterona (se usó en mujeres no embarazadas con un retraso en la menstruación de una o más semanas, a fin de que el endometrio engrosado se desprenda). Los intentos para obtener estos compuestos de fuentes animales mostraron que estos procedimientos eran muy costosos y laboriosos; a partir de 80 000 vacas se podía obtener solo 12 miligramos de estradiol. Por lo que se pensó que estas hormonas podrían obtenerse de manera conveniente a partir de un compuesto de esqueleto similar de átomos de carbono que es abundante como el colesterol, sin embargo, se necesitaba una tonelada de colesterol para obtener 10 kilos del material inicial con el que se podía obtener la progesterona. Aunque la progesterona podía sintetizarse en el laboratorio, el costo de producción en 1940 era de 200 dólares por gramo. Con el avance de mejores técnicas de obtención, materias primas disponibles y procesos químicos y físicos eficientes se fueron mejorando la síntesis de muchos compuestos y mejorando su costo. 136 En el caso de progesterona, las mejoras que reducido el costo de 200 a 80 dólares por conocimiento acerca de la composición indispensable para poder estudiar sus medicamentos. se habían logrado en1945 habían gramo, así se fue mejorando el del cuerpo humano y animal, alteraciones por los distintos Por otro lado, significó un gran avance en el campo del aislamiento de los principios activos. Se produjo una larga carrera entre los químicos, farmacéuticos y médicos por hallar los componentes realmente activos de los extractos vegetales y animales. La síntesis orgánica y la analítica farmacéutica son pilares del mejoramiento de nuestra calidad y expectativa de vida. La primera permite proveer herramientas terapéuticas al arsenal farmacológico, mientras que la segunda es garante de su calidad e integridad. ¿Cómo ayuda la química a mejorar tu forma de vida? La química ha desempeña un papel importante en la búsqueda de nuevas sustancias para mejorar el mundo donde vivimos, los avances en la medicina con el desarrollo de nuevos fármacos, han prolongado la vida y aliviado el sufrimiento humano. Más del 90% de los medicamentos y productos farmacéuticos que hoy su usan, se han desarrollado comercialmente en los últimos 50 años. Algunos medicamentos fueron descubiertos accidentalmente como es el caso de la penicilina desarrollada por el bacteriólogo escocés Alexander Fleming 137 (1881 – 1955), mientras hacía experimentos sobre la gripe, observó que el moho contaminaba uno de los cultivos y había destruido una bacteria (estafilococo) aparecido en él. El hongo era el Penicillium notatum. Fleming trabajó como médico militar en la primera guerra mundial, donde comprobó las heridas letales que provocaban las nuevas armas y la dificultad que entrañaba frenar dichas infecciones producidas por la metralla. En la posguerra comenzó sus investigaciones para encontrar un antiséptico capaz de frenar el proceso infeccioso. Tras descubrir la penicilina en septiembre de 1928, Fleming lo comunicó al British Journal of Experimental Pathology, pero sus colegas no dieron mucha trascendencia a su hallazgo. Tuvieron que pasar diez años hasta que el bioquímico británico Ernest Boris Chain y el patólogo Howard Walter Florey descubrieron la manera de purificar y fabricar la penicilina de forma industrial. Dado que los laboratorios ingleses estaban saturados por el esfuerzo de la guerra, los dos científicos se trasladaron a Estados Unidos para poner en marcha plantas de producción dedicadas exclusivamente a la penicilina. La fantástica herramienta médica llegó el momento preciso para ser utilizada todavía en la segunda guerra mundial. Observó que cuando se contaminaban las placas de cultivo con un hongo filamentoso del género Penicillium (penicillium notatum), este inhibía el crecimiento de las bacterias que se encontraban alrededor donde el hongo había crecido. Concluyó que la reacción fue debida a la producción de una toxina por parte de Penicillium, a la cual llamó penicilina, fue el primer antibiótico (sustancia 138 química que sirve para destruir microorganismos patógenos), utilizado para tratar muchas enfermedades. Otro ejemplo de antibióticos eficaz es la estreptomicina, el cual actúa contra la tuberculosis, la tos ferina y algunas formas de pulmonía. Un gran número se han desarrollado, muchos de ellos son del tipo denominados tetraciclinas. Fleming compartió el premio nobel de medicina con Chain y Florey en1945. A practicar De acuerdo a la lectura anterior del descubrimiento de la penicilina contesta las siguientes preguntas. 1. ¿Cómo fue el descubrimiento de la penicilina? 2. Describe lo que sucedió cuando el hongo Penicillium fue contaminado con bacterias 3. ¿Qué es un antibiótico? 4. ¿Qué es un microorganismo patógeno? 5. ¿A qué se le conoce como antibiótico ideal? 139 Referencias Jiménez, M. A. (2012). Herbolaria mexicana. México. Biblioteca básica de agricultura. Jiménez, J. (2004). Panorama Actual de la química farmacéutica. Sevilla, España. Universidad de Sevilla. Spancer, J (2000). Química Estructura y dinámica. (1ª. Ed.) México, CECSA. Rodríguez R (2014) Guía de farmacología y terapéutica (3ª Ed.) México, ELSEVIER. Ramírez R. M. (2006). La Prescripción de medicamentos y su repercusión social. Revista Cubana de Salud Pública. Recuperado el 22 de noviembre del 2015, de bvs.sld.cu/revistas/spu/vol32_4_06/spu16406.htm 140 141 Estimado alumno te felicitamos porque has llegado a la parte final de la guía, sabemos que has estudiado con dedicación y esfuerzo, pero ha llegado el momento de poner a prueba tus conocimientos adquiridos. A continuación te presentamos un prototipo de examen extraordinario con el que podrás notar tus fortalezas y debilidades alcanzadas, para su realización te sugerimos lo siguiente: Haber realizado todas las actividades de cada tema revisado a lo largo de la guía Haber aclarado las dudas con los asesores de química Que has cubierto todos los aprendizajes de la asignatura de Química II Toma el tiempo que te llevas en responder este prototipo, ya que solo dispones de dos horas para la realización de un examen extraordinario Ten a la mano una calculadora para que realices las operaciones necesarias Finalmente recuerda que este es solo un ejemplo de extraordinario, no significa que si te lo aprendes acreditaras la materia. 142 Unidad 01 Reactivos tipo examen extraordinario 1.- Calcula la cantidad de cal viva (CaO) que se puede preparar, calentando 200 Kg de caliza (CaCO3). La ecuación que representa a la reacción es: CaCO3 CaO + CO2 masa atómicas Ca = 40 g/ mol A) B) C) D) C = 12 g/ mol O = 16 g/mol 112 Kg 144 Kg 88 Kg 78 Kg 2.- Los coeficientes que balancean la siguiente ecuación son: NaOH + H2SO4 A) B) C) D) Na2SO4 + H2O 1,1,1,1 2,1,2,2 2,1,1,2 2,2,2,1 3.- Los suelos ácidos se pueden lograr alcalinizar adicionando: A) B) C) D) agua cal vinagre ácido 4.- En las reacciones de neutralización se obtienen principalmente: A) B) C) D) ácidos hidróxidos anhídridos sales 5.- El factor de conversión que permite calcular el número de moles a partir de gramos es: A) la masa molar B) el número de Avogadro 143 C) la masa relativa D) el mol 6.- ¿Qué tipo de enlace está representado en la siguiente figura? A) B) C) D) iónico metálico covalente polar covalente no polar 7.- Es la fuerza que mantiene unidos a los átomos en un compuesto: A) enlace B) radio atómico C) electronegatividad D) conductividad eléctrica 8.- Elige el inciso que contenga solo cationes: A) Cl1-, N5+, O2B) K1+, Ca2+, Al3+ C) S2-, Cl1-, N3D) O2-, Mg2+, Se29.- Cuando el cloro gana un electrón, se forma el ion: A) Cl1+ B) Cl1C) Cl5+ D) Cl3+ 10.- Son propiedades características de los compuestos iónicos. A) dúctiles y maleables B) bajos puntos de fusión y solubles en agua C) sólidos cristalinos y con altos puntos de fusión D) insolubles en agua y no conducen la electricidad 144 11.- Si los valores de electronegatividad para los elementos que forman un compuesto son: 3.5 y 1.0, entonces se trata de un compuesto con enlace: A) iónico B) metálico C) covalente polar D) covalente no polar 12.- Son sustancias que en disolución permiten el paso de la corriente eléctrica: A) anión B) catión C) electrólito D) no electrólito 13.- En un reacción química, es el proceso en donde un átomo gana electrones: A) oxidación B) reducción C) electrólisis D) conductividad eléctrica 14.- En la semirreacción: Al3+ + 3e- → Al0 , el aluminio: A) pierde 3 e- y se oxida. B) gana 3 e- y se reduce. C) pierde 3 e- y se reduce. D) gana 3 e- y se oxida. 15.- En la siguiente ecuación química: Zn + S → ZnS A) el zinc pierde electrones, se reduce y el azufre gana oxida. B) el zinc gana electrones, se oxida y el azufre pierde reduce. C) el zinc pierde electrones, se oxida y el azufre gana reduce. D) el zinc gana electrones, se reduce y el azufre pierde oxida. 16.- Selecciona la opción que indique solo sales A) B) C) D) electrones, se electrones, se electrones, se electrones, se NaCl, KClO, HCl NaClO, H2S, Li2SO4 KBr, NaCl, Li2S Li2SO4, NaClO, HClO 145 17.- El nombre de la sal MgS es: A) B) C) D) Sulfato de magnesio Sulfato de magnesio (II) Sulfuro de magnesio Sulfuro de magnesio (II) 18.- La sal CaCO3 se clasifica como: A) B) C) D) primaria Binaria Terciaria Cuaternaria 19.- Inciso que representa solo oxisales A) B) C) D) MgCl2, CaO, Li2SO4 Na2O, AlPO4, NaNO3 NaNO3, Li2SO4, AlPO4 Na2O, Li2SO4, NaNO3 Unidad 02 20.- Relaciona cada característica de acuerdo al tipo de compuesto. I.- Compuesto orgánico II.- Compuesto inorgánico a.- Presentan enlaces covalentes b.- Presentan enlaces iónicos c.- Tienen puntos de fusión altos d.- Tienen bajo punto de fusión e.- No son combustibles f.- La mayoría son combustibles A) I.-b, d, f; II.- a, c, e B) I.-a, d, f; II.- b, c, e C) I.-b, c, e; II.- a, d, f D) I.-a, c, e; II.- b, d, f 21.- Un ejemplo de macronutriente son: A) Los lípidos B) Los minerales 146 C) Las vitaminas D) Los electrolitos 22.- La tetravalencia del carbono se refiere a: A) La capacidad de formar dobles y triples enlaces B) La capacidad de formar cuatro enlaces covalentes C) La capacidad de unirse consigo mismo en largas cadenas D) La poca capacidad de atraer electrones en su última orbita 23.- La siguiente estructura representa a una formula A) Desarrollada B) Semidesarrollada C) Condensada D) Enlace-línea 24.- La siguiente representación corresponde al grupo funcional: R-CONH2 A) Amina B) Ester C) Alcohol D) Aldehído 25.- El nombre del siguiente compuesto es: 147 A) Butanol B) Butanona C) Butanoico D) Butanal 26.- El grupo funcional presente en el siguiente triglicérido es el: A) Éter B) Alcohol C) Aldehído D) Éster 27.- El recuadro rojo de la siguiente estructura resaltan el enlace: A) Peptídico B) Hidrofílico C) Glucosídico D) Nucleico 148 28.- Unidades estructurales formadoras de las proteínas: A) Monosacáridos B) Lípidos C) Nucleótidos D) Aminoácidos 29.- La siguiente estructura corresponde a una: A) Sacarosa B) Celobiosa C) Cetohexosa D) Aldohexosa 30.- Método de conservación que se basa en la eliminación total de agua mediante una congelación rápida seguida de una sublimación A) Secado B) Liofilización C) Pasteurización D) Esterilización 31.- Cuando la glucosa se combina con el oxígeno se produce agua y energía. ¿qué tipo de reacción se lleva a cabo? 149 A) B) C) D) Condensación Hidrólisis Oxidación Descomposición 32.- La siguiente ecuación es un ejemplo de una reacción de: A) eliminación B) neutralización C) adición D) condensación UNIDAD 03 33.- El principio activo de la aspirina es: A) Ácido carboxílico B) Ácido acetilsalicílico C) Ácido ascórbico D) Ácido fórmico 34.- El grupo funcional del ibuprofeno que se encuentra en el círculo es: 150 A) Alcohol B) Aldehído C) Ácido carboxílico D) cetona 35.- Es la parte del medicamento que inhiben la multiplicación y desarrollo de los microorganismos: A) B) C) D) El excipiente cbp El principio activo La forma farmacéutica El analgésico 36.- Es eficaz contra la tos ferina y algunas formas de pulmonía. A) B) C) D) Penicilina Aspirina Ibuprofeno Estreptomicina 37.- son sustancias que inhiben la multiplicación y desarrollo de los microorganismos patógenos. A) B) C) D) Analgésicos Antiinflamatorios Antibióticos Antipiréticos 38.- Las ____________ pueden causar reacciones alérgicas si no se usan correctamente. A) B) C) D) Pastillas Soluciones Medicinas Plantas 151 39.- La ____________ es la cantidad de un medicamento que se administra para lograr su eficacia terapéutica. A) B) C) D) Concentración Disolución Medicación Fórmula 40.- El mundo de los medicamentos ha permitido obtener productos derivados del: A) B) C) D) Azufre Nitrógeno Oxígeno Carbono 152