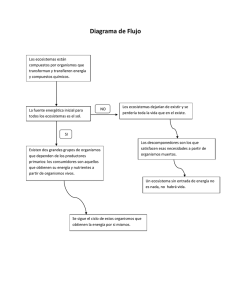
efectos locales del cambio global en aguas costeras
Anuncio

VII Congreso Ibérico sobre Gestión y Planificación del Agua “Ríos Ibéricos +10. Mirando al futuro tras 10 años de DMA” 16/19 de febrero de 2011, Talavera de la Reina EFECTOS LOCALES DEL CAMBIO GLOBAL EN AGUAS COSTERAS Salat, J.* y Pascual, J.** *Institut de Ciències del Mar (CSIC). P. Marítim, 37-49. E-08003 Barcelona. e-mail: [email protected] ** MeteoEstartit. P. Marítim s/n. E-17258 L’Estartit RESUMEN En esta comunicación se presentan observaciones a escala local que muestran un adelanto y prolongación de las condiciones estivales de estratificación dentro del agua, relacionado con la tendencia generalizada al calentamiento en las últimas décadas. Aunque estos cambios no siempre son significativos frente a oscilaciones interanuales y decadales, están empezando a tener impactos sobre la dinámica de las aguas costeras, en algunos organismos marinos y en los intercambios de calor entre la atmósfera y el mar. Para ilustrar esta situación, se muestran dos ejemplos de estos impactos sobre el ecosistema marino del Mediterráneo Noroccidental, y se discute su importancia en el contexto del cambio global en aguas costeras y las posibles alteraciones que pueden generar en las condiciones de referencia para estas aguas. Palabras clave: Cambio climático, Aguas costeras, Ecosistemas marinos, Mediterráneo Occidental. 1. INTRODUCCIÓN Uno de los problemas más relevantes que presenta el cambio climático está relacionado con sus efectos sobre los ecosistemas. Clima y ecosistema están íntimamente relacionados puesto que la estructura de éste no es más que la respuesta a las condiciones que impone aquél sobre los hábitats. Hasta el siglo XX, la acción antropogénica sobre los ecosistemas se limitaba (es un decir) a producir cambios en determinados hábitats: desarrollo agrario o urbano, infraestructuras, contaminación de diverso tipo, etc., o a extraer ciertos componentes de los ecosistemas: pesca, explotaciones forestales, agua, etc., modificando las relaciones internas de estos ecosistemas y su relación con otros. La explotación de los recursos energéticos fósiles: carbón, petróleo, gas natural, etc., supuso un importante cambio de escala en los efectos antropogénicos directos al incrementar en órdenes de magnitud la energía introducida, es decir, el trabajo efectuado, en producir alteraciones directas en los ecosistemas. A estos cambios hay que añadir el efecto sobre el clima que supone el aumento de gases de efecto invernadero en la atmósfera, a consecuencia del proceso de oxidación (combustión) necesario para disponer de la energía almacenada en los combustibles fósiles. No obstante, no es hasta finales del siglo XX cuando se empieza a poner de relieve este doble impacto, al observar cambios en ciertos ecosistemas terrestres, que no estaban directamente afectados por la acción humana (UNEP, 2006). Actualmente ya no quedan dudas razonables sobre el cambio climático, por lo menos en su vertiente de aumento de la temperatura (IPCC, 2007). No obstante, todavía queda mucho por investigar sobre sus efectos en los ecosistemas, ya que su respuesta es progresiva y, además, resulta difícil separarlos de los impactos causados por la explotación de los recursos que los ecosistemas proveen. 1.1. Los ecosistemas marinos, en general, y costeros, en particular. Nuestra especie pertenece a los llamados ecosistemas terrestres. Es decir, aquéllos cuyo hábitat se encuentra en la superficie emergida de nuestro planeta. Al formar parte de estos ecosistemas, podemos ser sensibles a los cambios que aparezcan y nos resulta fácil observarlos pues ocurren en nuestro propio medio. Además, no sólo podemos observar lo que está pasando sino que lo sentimos y podemos comprenderlo, hasta cierto punto. Por ejemplo, si observamos un adelanto en la época de floración de algunos vegetales, cambios de vegetación o en la llegada o partida de aves migratorias, podemos relacionarlo con cambios del ciclo estacional de temperaturas. Nuestro planeta, no obstante, alberga otros ecosistemas basados en el medio acuático, no sólo aquél que discurre por encima de los continentes sino también, en el interior de las vastas extensiones cubiertas por mares y océanos. Estos últimos constituyen los llamados ecosistemas marinos, mucho más desconocidos por que nosotros, como especie, no pertenecemos a ellos1, pero igualmente influenciados por nuestro comportamiento. Para entender cómo, primero debemos intentar comprender su funcionamiento, aunque sea desde fuera. El medio terrestre está envuelto por un fluido, el aire, que es compresible, de baja densidad y poca inercia térmica. Permite el paso de la luz y se calienta a través de la superficie en contacto con tierra firme o con el océano, es decir, por debajo. En el medio marino, el fluido es el agua, 1 En este sentido resulta ejemplar que en el último informe del panel de cambio climático de la ONU (IPCC, 2007) se anotaron más de 20000 cambios significativos en sistemas terrestres debidos al cambio climático y menos de 100 en el mar y los sistemas de agua dulce, casi todos relacionados con el cambio climático. 1 VII Congreso Ibérico sobre Gestión y Planificación del Agua “Ríos Ibéricos +10. Mirando al futuro tras 10 años de DMA” 16/19 de febrero de 2011, Talavera de la Reina prácticamente incompresible, de alta densidad y con mucha inercia térmica. Mucho menos transparente que el aire, absorbe la radiación solar e intercambia calor con la atmósfera, es decir, se calienta por encima; por su límite superior. Como consecuencia de todo ello, la luz no penetra más allá de pocas decenas de metros (zona fótica), por lo que la oscuridad es prácticamente total por debajo de 200 m. Ello es crítico para la fotosíntesis, la base de toda cadena trófica, al verse limitada a una capa superficial muy delgada respecto a la profundidad media de los océanos (varios kilómetros). Por otra parte, el calor recibido se concentra en las capas más superficiales, y su penetración a las capas profundas es muy lenta. Por el contrario, cuando se enfrían las capas superficiales, se desarrollan movimientos convectivos, por aumento de la densidad superficial, cuyo alcance en profundidad puede ir desde unos pocos metros (enfriamiento nocturno o producido por temporales de viento) hasta centenares de metros (enfriamiento de invierno, en altas latitudes o en algunos mares cerrados como en Mediterráneo). La profundidad media de los océanos es de unos 4500 m, pero cerca de las costas encontramos profundidades menores, en lo que se denominan las plataformas continentales. En general los fondos de las plataformas tienen suaves pendientes hasta llegar a su límite, entre 100 y 400 m de profundidad, donde la pendiente se acentúa y la profundidad aumenta muy rápidamente hasta lo que se denomina llanura abisal, situada a unos 4500-5000 m en los océanos, y diversas profundidades en mares regionales. La zona de fuerte pendiente se denomina talud continental y a veces se halla surcado por cañones submarinos. Las plataformas pueden ser muy anchas (más de 400 km), estrechas (menos de 40 km) o incluso inexistentes pero, en general, lo que se denominan aguas costeras suelen encontrarse encima de la plataforma y muy influenciadas por el continente (Fig. 1). Dentro de lo que son propiamente las aguas costeras, encontramos la zona litoral, con profundidades mínimas, donde la influencia del continente es muy significativa. Figura 1. Zonación de hábitats marinos (Extraído de: Briggs, 1974). La vida en tierra firme está asociada al suelo. No hay ninguna especie terrestre que no entre en contacto con él en algún momento de su ciclo vital. En los ecosistemas acuáticos, sin embargo, podemos encontrar situaciones mucho más diversas. Desde especies que viven en medio del océano (especies pelágicas) sin entrar en contacto, ni de lejos, ni con el fondo ni con el litoral (plancton, peces pelágicos, calamares, sargazos, …), hasta aquéllas que pasan un tiempo en la tierra seca y el resto en el agua (tortugas, focas, pingüinos, …). También encontramos especies que viven sobre el fondo (especies bentónicas), fijas (corales, gorgonias, esponjas…) o desplazándose (crustáceos, peces bentónicos…). Hay otras cuyo ciclo vital pasa del fondo a mar abierto, y al revés… En resumen, en el medio acuático hay un abanico de posibilidades más amplio que en el terrestre. Podemos, pues, distinguir entre los ecosistemas bentónicos y pelágicos, según estén en el fondo o en la masa de agua alejada de él (Fig. 1). También podemos distinguir entre los que viven a poca profundidad, donde llega la luz y donde, por tanto, es posible la fotosíntesis, hasta los que viven a oscuras en profundidades mayores. En general, en las aguas costeras, los ambientes pelágico y bentónico están muy relacionados por proximidad y, dada la poca profundidad, en general se trata de ambientes suficientemente iluminados para albergar vida vegetal. 1.2. Cadenas tróficas Toda cadena trófica empieza por la producción primaria, normalmente a cargo de organismos vegetales fotosintetizadores. Estos organismos requieren luz solar y aportes de sales minerales básicas para su funcionamiento (nutrientes). En tierra, la luz está garantizada y los nutrientes, que se encuentran en el suelo, son transportados hasta los puntos donde se realiza la fotosíntesis a través de bombear de agua por medio de la transpiración. En el mar, los nutrientes están disueltos en el agua pero se agotan si ésta no se renueva en las capas superficiales donde llega la luz. Para ello se requiere, o bien aportes externos por escorrentía de las aguas continentales o por movimientos ascendentes de agua en contacto con el fondo o procedente de las zonas profundas donde no llega la luz. Esto último se consigue por convección, mezcla vertical en aguas poco profundas o mediante los llamados mecanismos de afloramiento en determinadas zonas del océano. Sin entrar en demasiados detalles sobre la cuestión, como elementos básicos a tener en cuenta, diremos que en situaciones de invierno, al enfriarse la superficie, se facilitan los mecanismos de mezcla vertical y convección, mientras que en primavera y, sobre todo, en verano, la estratificación térmica es tal que los mo2 VII Congreso Ibérico sobre Gestión y Planificación del Agua “Ríos Ibéricos +10. Mirando al futuro tras 10 años de DMA” 16/19 de febrero de 2011, Talavera de la Reina vimientos verticales quedan inhibidos, pues se requeriría un extraordinario aporte de energía mecánica externa para erosionar la estratificación. En estas últimas condiciones, la producción primaria se ve muy disminuida al no poder renovarse el agua de la zona fótica, y sólo aportes de nutrientes externos vía escorrentía continental pueden mantener ciertos niveles de producción primaria. Es por ello que, en general, las zonas costeras cercanas a las desembocaduras de ríos, mantienen una producción relevante durante todo el año. También es posible mantener producción primaria significativa en zonas costeras poco profundas, especialmente si están sometidas a fuertes brisas o vientos importantes. En el resto de situaciones, especialmente en mar abierto, la producción primaria en verano es muy baja. Por el contrario, durante el invierno, la renovación del agua de la zona fótica es más fácil. El problema en esta estación es que los principales organismos que generan la producción primaria, el fitoplancton, al moverse con el agua, pueden hundirse con ella hasta profundidades donde no llegue luz suficiente, por lo que su tiempo de permanencia en la zona fótica puede verse comprometido. En este caso, pues, en mar abierto, fuera de las plataformas continentales, la producción de invierno también puede verse limitada. En primavera, cuando la radiación solar aumenta y el agua empieza a estratificarse es cuando concurren las mejores condiciones para la productividad primaria, pues el fitoplancton ya puede mantenerse en la zona fótica en todo su ciclo vital, y al mismo tiempo todavía abundan sales disueltas, traídas por los movimientos verticales de invierno pero que no fueron asimiladas durante aquel periodo. Esta situación, conocida como floración (bloom) primaveral, produce un “exceso” de materia orgánica en la zona pelágica superficial que rápidamente es aprovechado hasta el último nivel de la cadena trófica. Parte de esta materia orgánica que no entra en la cadena trófica pelágica, sedimenta suavemente hacia el fondo en lo que se denomina nieve marina y permite la alimentación de todo el sistema bentónico en aguas oscuras. En otoño, empieza el enfriamiento superficial y, con él, los movimientos verticales. Estos son favorecidos por episodios de temporales de viento, que permiten condiciones de productividad primaria superficial de modo intermitente, entre temporales. De esta forma, aunque la productividad sea muy inferior a la de primavera, se pone fin al episodio de baja producción de verano. 2. OBSERVACIONES 2.1. Tendencias climatológicas Desde 1974 se mantiene un registro de temperatura del mar en la localidad de l’Estartit, situada en la Costa Brava catalana, en el Mediterráneo Noroccidental. La estación situada sobre un fondo de 90 m, se visita con una regularidad media semanal y se muestrea a diversos niveles. Asimismo se registra la temperatura del aire, con tres observaciones diarias así como otras variables meteorológicas: pluviometría, vientos, presión atmosférica, etc. Según Salat y Pascual (2008), a lo largo de los últimos años, estas observaciones muestran una tendencia al aumento de temperatura en todos los niveles muestreados así como en la temperatura del aire. Estos aumentos son mayores en el aire y los niveles más superficiales. Por estaciones, las tendencias son más marcadas en primavera y verano. La diferencia entre la tendencia de aumento de la temperatura del aire respecto a la de superficie del mar provoca que el periodo del año durante el cual, el aire está más caliente que el mar haya ido en aumento a lo largo de estos últimos años. De acuerdo con estos autores, ello supone un prolongamiento de condiciones desfavorables a la evaporación y, en consecuencia, se podría relacionar con una disminución de la precipitación observada en la cuenca del Mediterráneo Noroccidental durante la primavera. Dentro del mar, el mayor aumento de temperatura en las capas superficiales con respecto a las más profundas supone aumentar las diferencias de temperatura entre capas y, por consiguiente, un aumento progresivo en la estratificación junto a un alargamiento del periodo anual de aguas cálidas, es decir, del periodo estival. Para definir lo que denominaremos “periodo estival” podemos escoger varias opciones: un valor de temperatura en la capa más superficial o una diferencia de temperatura entre un nivel superficial y uno más profundo. Una temperatura alta en la misma superficie del mar puede no ser significativa de suficiente penetración del calor, especialmente durante el periodo de calentamiento, por lo que es preferible tomar la referencia a 20 m de profundidad, el siguiente nivel muestreado. Por la misma razón, para establecer la estratificación es mejor tomar el nivel de 20 m como representante de la temperatura en la capa superficial. Así pues, para establecer el periodo estival, tomaremos un valor de la temperatura a 20 m y una diferencia entre ésta y la de la capa más profunda muestreada, es decir, 80 m. En Coma et al. (2009) al analizar la misma serie, se tomaron 18°C a 20 m y una diferencia de 4.7°C entre 20 y 80 m, que resultó la más indicada para la evaluar la estratificación. Con estas referencias, y actualizando la serie hasta 2009, obtenemos que a lo largo de las últimos 36 años ha habido un adelanto en la fecha de inicio de las condiciones estivales de 28 días para la temperatura de 18°C a 20 m y 22 días para la estratificación, y un retraso de casi 16 días para la temperatura a 20 m y un ligero adelanto (2 días) en la fecha de rotura de la estratificación (Fig. 2). Dada la gran variabilidad interanual, sólo las tendencias en el adelanto en la aparición de las condiciones estivales son significativas. Así pues, consideraremos que la tendencia media de prolongación del periodo estival en los últimos 36 años es de 44 días para la temperatura y 20 días para la estratificación, con unas tendencias mínimas significativas, de 16 y 11 días respectivamente. 3 VII Congreso Ibérico sobre Gestión y Planificación del Agua “Ríos Ibéricos +10. Mirando al futuro tras 10 años de DMA” 16/19 de febrero de 2011, Talavera de la Reina Fig. 2. Evolución de la duración del “periodo estival” en la estación de l’Estartit en el periodo 1974-2009 según los criterios: (a) de temperatura >18°C a 20 m de profundidad, y (b) diferencia de temperatura entre 20 y 80 m. 2.2. Variaciones en poblaciones pelágicas Durante las últimas décadas, a través de la recogida de datos procedentes de la pesca comercial, se han observado algunas diferencias de composición de las especies presentes en las capturas de peces pelágicos que pueden considerarse significativas, a pesar de las limitaciones inherentes a este tipo de muestreo que se ciñe exclusivamente a especies de valor comercial. En particular, Sabatés et al., (2006) encuentran un aumento progresivo en la proporción de las capturas de especies de hábitats más cálidos, o quizás mejor adaptadas a periodos estivales largos, como la alacha (sardinella aurita). Aunque estas observaciones pueden estar influenciadas por otros factores tales como sobreexplotación o agotamiento de otras especies comerciales, en recientes campañas de muestreo de huevos y larvas se ha observado una extensión del área de puesta esta especie hacia el norte, a lo largo de la costa catalana, respecto a muestreos de 20 años atrás (Palomera et al., 2007). Asimismo también se tiene información de una progresiva disminución de otras especies pelágicas peor adaptadas a los ambientes cálidos (e.g. Quignard and Raibault, 1993; Sabatés et al., 2007). Sabatés et al. (2008), en un análisis de las condiciones de supervivencia larvaria de esta especie, pusieron de manifiesto que el proceso de colonización dependía sólo en parte del aumento de temperatura del agua, pues en situaciones de agotamiento de la productividad primaria superficial debería buscar el alimento en capas más profundas que posiblemente encontraría demasiado frías. Esta especie es abundante en zonas subtropicales de afloramiento costero, con aguas productivas como la costa de Brasil o en el NW de África (Bakun and Parrish, 1990); 4 VII Congreso Ibérico sobre Gestión y Planificación del Agua “Ríos Ibéricos +10. Mirando al futuro tras 10 años de DMA” 16/19 de febrero de 2011, Talavera de la Reina Zeeberg et al., 2008), relativamente frías (17-19°C) pero no tanto como en las zonas de afloramiento de Perú o del Sudoeste de África (1215°C) en donde está ausente. En el Mediterráneo Noroccidental, en época de estratificación, la productividad primaria se mantiene en una capa límite de compromiso entre la penetración de la luz y la disponibilidad de nutrientes (Estrada, 1996). Esta capa queda siempre por debajo de la termoclina, entre 50 y 90 m de profundidad, y, por tanto, con temperaturas de invierno (13-14°C) ya que no se empezará a calentar hasta la rotura de la estratificación en otoño. En estas circunstancias, la propagación de esta especie hacia el norte se vería favorecida por el aumento de la temperatura pero dificultada por la estratificación, salvo en zonas con productividad superficial debida a aportes por escorrentía. 2.3. Situaciones extremas e incrementos de mortalidad en poblaciones bentónicas A lo largo de esta última década se han registrado por lo menos un par de veranos extremos (2003 y 2006) no sólo en referencia a la temperatura del aire sino también dentro del agua. El verano de 2003 fue excepcionalmente cálido y largo mientras que en 2006 se registraron temperaturas parecidas o incluso ligeramente más altas pero con una menor duración. En verano de 2003 se observó un importante evento de mortalidad de especies bentónicas que viven fijas en el fondo y se alimentan fundamentalmente de los excedentes de materia orgánica que sedimentan hacia el fondo (Garrabou et al, 2009). Este episodio se registró en muy diversas localizaciones dentro del Mediterráneo Noroccidental y se atribuyó inicialmente a los valores extremos de temperatura registrados aquel verano. No obstante, las temperaturas registradas en las capas donde abunda esta especie y se produjeron mortalidades masivas, no llegó a valores anormales respecto a otros veranos por lo que resultaba difícil atribuir estas mortalidades a un exceso de temperatura. Al estudiar el comportamiento de esta especie en condiciones de laboratorio pudo observarse que no era únicamente el papel de la temperatura sino un efecto combinado entre ésta y la duración del periodo de estratificación (Coma et al., 2009). En efecto, se constató que los requerimientos energéticos para la supervivencia aumentaban con la temperatura pero la abundancia de alimento disponible disminuía a medida que avanzaba el periodo estival debido al agotamiento de los nutrientes en la zona fótica por la persistencia de la estratificación. De esta forma se comprobó que la principal causa de mortalidad no era la temperatura extrema sino la exposición prolongada a condiciones de estratificación, lo que suponía una reducción significativa del alimento necesario para satisfacer sus necesidades energéticas. 3. DISCUSIÓN Y CONCLUSIONES Los dos casos planteados en la sección anterior ilustran como las aguas marinas en general y las costeras en particular pueden verse afectadas por cambios climáticos. Se trata simplemente de dos ejemplos bastante bien documentados de lo que puede pasar si las tendencias observadas se mantienen. En este sentido sería parecido a las observaciones de adelanto en la floración de especies vegetales terrestres o en la llegada de aves migratorias. Las observaciones climáticas en aguas del Mediterráneo Noroccidental muestran claramente una tendencia al aumento de temperatura general, especialmente fuerte en primavera, una prolongación del periodo estival dentro del ciclo anual, especialmente remarcable en forma de adelanto de fechas en el establecimiento de la estratificación. El hecho que el aire se caliente antes que la superficie del mar, además, provoca que disminuyan las posibilidades de evaporación, lo cual puede reflejarse en una disminución significativa de la lluvia en primavera (Salat y Pascual, 2008). Este último hecho puede conllevar una disminución de la escorrentía que a su vez limitaría los aportes de sales minerales en aguas superficiales durante la primera fase del periodo de estratificación y, por consiguiente disminuir la productividad primaria superficial en esta época del año. En el Mediterráneo Noroccidental, hay dos especies de peces muy abundantes dentro del dominio pelágico: la sardina y la anchoa. En principio estas dos especies se reproducen en épocas opuestas dentro del ciclo anual (Palomera et al., 2007). La primera en invierno y la segunda en verano. El éxito reproductivo de ambas especies dependerá en buena parte de la supervivencia de sus larvas. Durante las primeras fases de vida, estas larvas son planctónicas y, por lo tanto, no están preparadas para desplazarse en busca del alimento. En el caso de la sardina, la abundancia de alimento en aguas superficiales está bastante asegurada durante estas primeras fases de su ciclo vital pues se encuentra en aguas muy homogéneas con abundantes nutrientes en la zona fótica. En el segundo caso, el de la anchoa, la situación puede ser bastante más comprometida ya que su reproducción se presenta durante la época de aguas estratificadas. No obstante, se ha observado que dicha especie aprovecha las zonas con aportes terrestres asegurados por la influencia de las descargas de ríos o, en ciertas partes, por la presencia de afloramientos. Ejemplos del primer caso serían la zona del Ebro (Palomera, 1992), del Ródano o del Adour y el Garona, ya en el golfo de Vizcaya. Como ejemplos del segundo caso podríamos citar la zona de Málaga. La zona costera del golfo de León o la parte norte del golfo de Cádiz, en el Atlántico, podrían considerarse como zonas mixtas pues en ambos casos encontramos tanto influencias de descargas continentales como de afloramiento costero. En general, pues, las dos especies citadas pueden repartirse el dominio pelágico de manera bastante eficiente y sin demasiada competencia al depender su desarrollo larvario de condiciones distintas. De hecho, ambas poblaciones mantienen sus posiciones con algunas fluctuaciones interanuales debidas a las variaciones de condiciones ambientales entre años distintos y, últimamente, moduladas por la explotación pesquera y por el aprovechamiento de las aguas continentales en tierra, que pueden disminuir la escorrentía y afectar la anchoa (Lloret et al, 2004). Tal como se planteaba en la sección anterior, se ha observado un aumento y extensión de la población de alacha presuntamente relacionado con el aumento de la temperatura y el alargamiento del periodo estival. Esta especie coincide en época de puesta con la anchoa. Ello por tanto hace 5 VII Congreso Ibérico sobre Gestión y Planificación del Agua “Ríos Ibéricos +10. Mirando al futuro tras 10 años de DMA” 16/19 de febrero de 2011, Talavera de la Reina pensar que pueda llegar a competir con ésta si las condiciones ambientales siguen en la tendencia marcada durante los últimos años (Palomera and Sabatés, 1990). En el Atlántico suroccidental, en las costas de Brasil, se da también la presencia de alacha y anchoa (Bakun and Parrish, 1990). En este caso la alacha es la especie dominante en un ambiente pelágico cuya fuente de nutrientes en la zona fótica se basa en el afloramiento de aguas relativamente cálidas, pues se encuentra en la zona de influencia de una corriente que viene de la zona ecuatorial (corriente de Brasil). La anchoa de esta región se encuentra más al sur, en aguas más frías, en las cuales, los aportes de nutrientes provienen más de los aportes continentales de los ríos que de la región que del afloramiento. En el Mediterráneo Noroccidental, un escenario de cambio climático, con aumento significativo de temperatura, supondría mejorar las condiciones para el desarrollo de la alacha en detrimento de la anchoa. Este escenario, no obstante, también se asocia a una disminución de los aportes terrígenos y un adelanto en las condiciones estivales lo que supondría un agotamiento más rápido de los nutrientes superficiales, que podría comprometer a ambas especies en beneficio de otras. Por lo que respecta a los organismos bentónicos fijos en el fondo se ha observado que el alargamiento de las condiciones estivales puede llegar a comprometer su supervivencia, ya que dependen del alimento que sedimenta desde las zonas más iluminadas. Estos organismos juegan un papel importante en las condiciones ambientales bentónicas de las zonas costeras ya que actúan como refugio de otras especies y suponen un sustrato para el desarrollo de otras (Dame and Olenin, 2005). Se trata pues de un elemento esencial en la construcción del hábitat bentónico de las zonas costeras en el sentido que ejercen un papel parecido al de los árboles en los bosques. Tanto en un caso como en el otro, los efectos antropológicos directos como la sobrepesca o el aprovechamiento de las agua en tierra pueden suponer un agravamiento de la situación, también de origen antropológico indirecto como es el cambio climático. 4. REFERENCIAS Bakun, A., R.H. Parrish (1990): Comparative studies of coastal pelagic fish reproductive habitats: the Brazilian sardine (Sardinella aurita). J. Cons. int. Explor. Mer, 46, 269-283. Briggs, J. C., 1974. Marine zoogeography, McGraw-Hill, NY. Coma R., M. Ribes, E. Serrano, E. Jiménez, J. Salat, J. Pascual (2009): Global warming-enhanced stratification and mass mortality events in the Mediterranean. PNAS, 106: 6176-6181. Dame, R.F, S. Olenin (2005). The comparative roles of suspension-feeders in ecosystems. NATO Science Series: IV: Earth and Environmental Sciences, 47, Springer. Amsterdam. Estrada, M. (1996): Primary production in the northwestern Mediterranean. Sci. Mar., 60(2), 55-64. Garrabou J, R. Coma, N. Bensoussan, M. Bally, P. Chevaldonné, M. Cigliano, D. Diaz, J.G. Harmelin, M.C. Gambi, D.K. Kersting, J.B. Ledoux, C. Lejeusne, C. Linares, C. Marschal, T. Pérez, M. Ribes, J. C. Romano, E. Serrano, N. Teixido, O. Torrents, M. Zabala, F. Zuberer and C. Cerrano (2009): Mass mortality in the NW Mediterranean rocky benthic communities: Effects of the 2003 heat wave. Global Change Biol, 15: 1090-1103. IPCC, (2007): Cambio climático 2007. Informe de síntesis. Contribución de los Grupos de trabajo I, II y III al Cuarto Informe de evaluación del Grupo Intergubernamental de Expertos sobre el Cambio Climático [Pachauri, R.K. y Reisinger, A. (directores de la publicación)]. IPCC, Ginebra, Suiza, 104 págs Lloret, J., I. Palomera, J. Salat, I. Solé (2004): Impact of freshwater input and wind on landings of anchovy (Engraulis encrasicolus) and sardine (Sardina pilchardus) in shelf waters surrounding the Ebre River delta (northwestern Mediterranean). Fish. Oceanog., 13(2), 102-110 Palomera, I. (1992): Spawning of anchovy Engraulis encrasicolus in the Northwestern Mediterranean relative to hydrographic features in the region. Mar. Ecol. Prog. Ser., 79,215-223. Palomera, I. and A. Sabatés (1990): Co-occurrence of Engraulis encrasicolus and Sardinella aurita eggs and larvae in the western Mediterranean. Sci. Mar. 54:51-67 Palomera, I., M.P. Olivar, J. Salat, A. Sabates, M. Coll, A. García, B. Morales-Nin (2007): Small pelagic fish in the NW Mediterranean Sea: An ecological review. Prog. Oceanog., 74(2-3): 377-396 Palomera I., M.P. Olivar, J. Salat, A. Sabatés, M. Coll, A. García, B. Morales-Nin (2007). Small pelagic fish in the NW Mediterranean Sea: An ecological review. Prog. Oceanog., 74: 377–396 Quignard JP, Raibault A (1993) Ichthyofauna of the Languedocian coast (Gulf of Lion). Faunistic and demographic modifications.Vie et Milieu, 43: 191–195. Salat J., J. Pascual (2008): ¿Volverán las lluvias de primavera? o Cómo puede afectar el calentamiento global al régimen primaveral de precipitaciones en la cuenca mediterránea. http://www.fnca.eu/congresoiberico/documentos/c0201.pdf Sabatés A, Martín P, Lloret J, Raya V (2006) Sea warming and fish distribution: the case of the small pelagic fish, Sardinella aurita, in the western Mediterranean. Glob Change Biol.: 12: 2209–2219 Sabatés A., N. Zaragoza, C. Grau, J. Salat (2008). Vertical distribution of early developmental stages in two coexisting clupeoid species, Sardinella aurita and Engraulis encrasicolus. Mar. Ecol. Prog. Ser., 364: 169-180. Sabates, A., M.P. Olivar, J. Salat, I. Palomera, F. Alemany (2007): Physical and biological processes controlling the distribution of fish larvae in the NW Mediterranean. Prog. Oceanog., 74(2-3): 355-376 UNEP (2006) Marine and coastal ecosystems and human wellbeing: A synthesis report based on the findings of the Millennium Ecosystem Assessment. UNEP. 76pp Zeeberg J, Corten A, Tjoe-Awie P, Coca J, Hamady B (2008): Climate modulates the effects of Sardinella aurita fisheries off Northwest Africa. Fish. Res., 89: 65– 75. 6