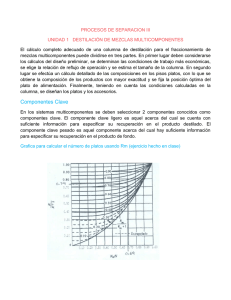
MONOGRAFIA-ELABORACION DE ALCOHOL OK
Anuncio

Ley N° 30035 Ley que regula el Repositorio Nacional Digital de Ciencia, Tecnología e Innovación de Acceso Abierto UNIVERSIDAD NACIONAL JOSÉ FAUSTINO SÁNCHEZ CARRIÓN Facultad de Ingeniería Agraria, Industrias Alimentarias y Ambiental Escuela Académico Profesional de Industrias Alimentarias MONOGRAFÍA ELABORACIÓN DE ALCOHOL RECTIFICADO A PARTIR DE LA MELAZA EN LA EMPRESA AGROINDUSTRIAL PARAMONGA S.A.A. PERIODO 2011 PARA OPTAR EL TÍTULO PROFESIONAL DE INGENIERO EN INDUSTRIALES ALIMENTARIAS AUTOR : Bach. OLGUÍN FONSECA, FIORELLA GIOVANNA ASESORA : VEGA VENTOCILLA, GLADYS HUACHO – PERÚ 2012 UNIVERSIDAD NACIONAL JOSÉ FAUSTINO SÁNCHEZ CARRIÓN Facultad de Ingeniería Agraria, Industrias Alimentarias y Ambiental Escuela Académico Profesional de Industrias Alimentarias MONOGRAFÍA ELABORACIÓN DE ALCOHOL RECTIFICADO A PARTIR DE LA MELAZA EN LA EMPRESA AGROINDUSTRIAL PARAMONGA S.A.A. PERIODO 2011 -----------------------------------------------------Ing. Sulpicio MAURICIO BARZOLA -----------------------------------------------------Ing. Sarela Carmela ALFARO CRUZ PRESIDENTE SECRETARIO -----------------------------------------------------Ing. Ricardo Aníbal ALOR SOLÓRZANO VOCAL -----------------------------------------------------Ing. Gladys VEGA VENTOCILLA DEDICATORIA: Dedico el siguiente trabajo de Investigación a DIOS, a mí querida Madre por el enorme amor brindado en todo momento, y a las personas que me demuestran su amistad incondicional día a día. AGRADECIMIENTO Se agradece al Ing. Edwin Macavilca Ticlayauri. Por su colaboración como coasesor del presente trabajo. A la Empresa Agro Industrial Paramonga S.A.A. por el apoyo en la fase de recopilación de Datos y por permitir seguir aprendiendo cada día más. ÍNDICE DEDICATORIA AGRADECIMIENTO RESUMEN INTRODUCCIÓN I. AGRO INDUSTRIAL PARAMONGA S. A. 12 1.1 Historia 12 1.1.1 Cronología 13 Empresa 15 1.2.1 Denominación y Dirección 15 1.2.2 Nuestra Visión 16 1.2.3 Nuestra Misión 16 1.2.4 Datos Importantes 16 Certificación SGC ISO 9001:2000 17 1.3.1 Política Integrada 17 1.2 1.3 II. LA DESTILACIÓN 2.1 2.2 2.3 19 Principios Básicos 19 2.1.1 Descripción del Proceso 21 2.1.2 Ventajas de la Destilación 23 Métodos de Predicción de Propiedades 24 2.2.1 Ecuaciones de Estado 24 Algoritmos de diseño para una torre de destilación 31 2.3.1 Método Gráfico de McCabe – Thiele 31 2.3.2 Eficiencia de Murphree 37 2.3.3 Método de Fenske - Underwood – Gilliland 39 2.3.4 Modelo Termodinámico para la Destilación 41 2.3.5 Métodos Rigurosos 42 III. PROCESO DE ELABORACIÓN Y RECTIFICACIÓN DEL ETANOL 46 3.1 Materia Prima 46 3.1.1 La Melaza 46 3.1.2 Composición Fisicoquímica (Promedio) 47 3.2 3.3 3.4 Producto 47 3.2.1 Definición del Producto 47 3.2.2 Características 47 3.2.3 Composición 49 3.2.4 Aplicaciones 49 Proceso 50 3.3.1 Dilución de la Melaza 50 3.3.2 Pre-Fermentación 51 3.3.3 Fermentación 52 3.3.4 Centrifugación 57 3.3.5 Destilación 58 Balance de Materia y Energía 62 3.4.1 Datos para los Balances de materia en la dilución, Pre-Fermentación, Fermentación y Centrifugación 63 3.4.2 Cálculos en la dilución, Pre-fermentación, Fermentación y Centrifugación (por día) 3.4.3 Cálculos en el sistema de destilación de etanol 64 69 CONCLUSIONES 72 BIBLIOGRAFÍA 73 ANEXOS 75 ÍNDICE DE TABLAS PROCESO DE ELABORACIÓN DEL ETANOL Tabla1Flujos, Fracciones másicas de etanol, Temperaturas y Entalpías 70 Tabla 2 Cálculo en los Condensadores 70 Tabla 3 Energía perdida por convección en las columnas 71 Tabla 4 Eficiencias en la Destilación 71 ÍNDICE DE FIGURAS Fig. 1 Condición de equilibrio entre fases en una columna de destilación 20 Fig. 2 Distintos tipos de módulos empleados en columnas de destilación 21 Fig. 3 Torre de destilación multicomponentes 22 Fig. 4 Diagrama Pxy para una mezcla binaria 32 Fig. 5 Líneas de rectificación, agotamiento y alimentación 33 Fig. 6 Desarrollo escalonado de líneas que representan las etapas de una torre 34 Fig. 7 Etapas mínimas para una torre (reflujo total) 35 Fig. 8 Etapas infinitas para una torre (reflujo mínimo) 36 Fig. 9 Eficiencia de Murphree en el diagrama Pxy 38 Fig. 10 Diagrama de una etapa de equilibrio para las ecuaciones MESH 44 RESUMEN El presente trabajo de investigación intitulado “Elaboración de Alcohol rectificado a partir de la melaza en la empresa Agroindustrial Paramonga S.A.A. periodo 2011” Agroindustrial Paramonga S.A.A., está ubicado a nivel nacional en el cuarto lugar de la lista de las empresas productoras de azúcar, la empresa produce al día15 mil litros de alcohol rectificado, para ello se necesita 56,60 TM de melaza para llegar a esa producción de alcohol. La producción de alcohol rectificado por parte de la empresa, le es de gran beneficio y/o rentabilidad, debido a que gracias a este subproducto que se produce del proceso de elaboración del azúcar doméstico, se puede obtener un producto tan comercial como el alcohol rectificado. Los alcoholes tienen una gran gama de usos en la industria y en la ciencia como disolventes y combustibles. El etanol y el metanol pueden hacerse combustionar de una manera más limpia que la gasolina o el gasoil. Por su baja toxicidad y disponibilidad para disolver sustancias no polares, el etanol es utilizado frecuentemente como disolvente en fármacos, perfumes y en esencias vitales como la vainilla. Este trabajo de investigación tiene como finalidad evaluar y conocer el proceso de la obtención del alcohol rectificado en AIPSSA, y como objetivo específico tiene: describir cada una de las etapas que conlleva la elaboración de producción de alcohol rectificado en la empresa AIPSAA, detallando los equipos que intervienen en el proceso, y el método de destilación que se utiliza actualmente en la empresa. También se ha elaborado un Balance de Materia y de Energía, los datos fueron proveídos por la empresa, esto nos ayuda a poder conocer en cifras cuanto es lo que realmente está ingresando, se está acumulando, cuanto es lo que está saliendo, y cuanto de energía se ha perdido por convección en las columnas. INTRODUCCIÓN Agro Industrial Paramonga S.A.A. (AIPSA) es una empresa con sede en Perú que se dedica principalmente en el sector de la agricultura. Las actividades de la Compañía incluyen el cultivo y procesamiento de caña de azúcar, así como la producción, distribución y venta de azúcar morena y refinada, melaza, bagazo de caña, alcohol etílico y otros derivados. La compañía posee una planta de producción y cuenta con más de 10 000 hectáreas de tierras cultivables, que se encuentran en el Distrito de Paramonga, Provincia de Barraca. La palabra alcohol proviene del árabe al-kukhūl que quiere decir "el espíritu", de «al» (el) y kohol que significa «sutil». Esto se debe a que antiguamente se llamaba "espíritu" a los alcoholes. Por ejemplo "espíritu de vino" al etanol, y "espíritu de madera" al metanol. Los árabes conocieron el alcohol extraído del vino por destilación. Sin embargo, su descubrimiento se remonta a principios del siglo XIV, atribuyéndose al médico Arnau de Villanova, sabio alquimista y profesor de medicina en Montpellier. Este trabajo se divide en 3 capítulos y el método utilizado es descriptivo: En el Capítulo I, se describe la Historia de la Empresa Agro Industrial Paramonga S.A., la denominación que recibe, el lugar donde está situado, su visión, misión, datos importantes sobre la producción anual, y que cuenta con Certificación SGC ISO 9001:2000. En el Capítulo II, se conceptualiza los factores físicos que intervienen en el proceso de producción de alcohol rectificado (destilación), también los tipos de columnas de platos, las relaciones de equilibrio Vapor Líquido, el contacto de equilibrio de una sola etapa para un Sistema Vapor-Líquido, la Destilación con Reflujo y el Método de Mccabe-Thiele, y la Destilación Fraccionada con el Método de Entalpía-Concentración. En el Capítulo III, se explica todas las etapas de la producción de alcohol rectificado, iniciando desde la materia prima, el producto, el proceso, y luego se describe como se realiza el balance de materia y energía para este proceso. En la última parte, se hace mención de las conclusiones obtenidas después de la culminación del presente trabajo. Lo que se pretende también con este trabajo, es que los alumnos de la Escuela Académico Profesional de Ingeniería en Industrias Alimentarias, puedan utilizar el presente trabajo de investigación, como una guía y/o manual, para poder ahondar más sus conocimientos en temas relaciones a la producción de alcohol rectificado. El Autor 12 I. AGRO INDUSTRIAL PARAMONGA S.A.A. 1.1. Historia La historia de Paramonga se pierde en la dimensión del tiempo, desde sus inicios estaba considerada como LA LLAVE GEOGRÁFICA DEL IMPERIO COSTEÑO, tenía una ubicación geográfica estratégica con territorios ambicionados por los Incas. Un mudo testigo de lo realizado por nuestros antepasados, para defender su territorio ubicado a 204 Km. de Lima, es la FORTALEZA PARAMONGA. La denominación PARAMONGA, deriva de las voces Mochica: PARAG........VASALLOS MUNGA.......POR AQUÍ Los españoles, en un primer momento la denominaron PARMONGUILA, según escritos que datan de 1549, firmados por FRAY LOPE DE LA FUENTE y el Noble GREGORIO DE LA PEÑA, hallados en el MIRADOR DE LA BARRANCA, de nuestra Provincia. Durante la conquista española nace el fundo rústico de las familias Asín y Canaval, tiempo en que introducen elementos novedosos para la época hasta convertirla en la Hacienda Sociedad Agrícola Paramonga. Posteriormente la transnacional Grace & Co. adquiere la propiedad, introduce nueva tecnología y diversifica la producción hasta convertirla en el primer Complejo Agroindustrial Químico Papelero de la región. Paramonga sufrió la expropiación por el Gobierno Militar del General Juan Velasco Alvarado, que dividió el complejo en 2 empresas, la Sociedad Paramonga Ltda., empresa estatal para la producción de papel y productos 13 químicos, y la Cooperativa Agraria Azucarera Paramonga Ltda. Nº 37, cedida en propiedad a sus trabajadores. Luego de 20 años de Cooperativismo, durante los cuales se redujo la productividad y se acumularon grandes pérdidas, a principio de los 90 se dieron normas para reflotar las empresas azucareras que estaban colapsadas, convirtiéndolas en Sociedades Anónimas. En el año 1996 la sociedad Río Pativilca compra la mayoría de las acciones y toma el control de la misma. En 1997 el grupo Wong adquiere la empresa e introduce un estilo gerencial moderno, con una filosofía de trabajo en equipo y mejora continua, consiguiendo resultados productivos nunca antes registrados en Paramonga. En la actualidad posee la certificación ISO 9001:2000 y se encamina para consolidar su liderazgo en el mercado nacional para hacer de ella una empresa de competencia mundial. 1.1.1. Cronología S. XVII: Fundo rústico (hacienda) - Familia Asín 1821: Sociedad Agrícola Paramonga - Familia Canaval. 1837: Se inicia la producción de azúcar de caña. 1927: Se conforma el Complejo Agro Industrial Químico Papelero Grace & Co. 1969: Se crea la Cooperativa Agraria Azucarera Paramonga Ltda. Nº 37 14 1976: Paramonga Primer Distrito Agro Industrial del Perú DS Nº 776 /23 Nov. – Alcalde Ing. Víctor Guerrero Fooks. 1994: Se vuelve a privatizar la empresa, creándose Agro Industrial Paramonga S.A.A. 1996: Río Pativilca adquiere el 72,3% de las acciones. 1998: Paramonga logró el mayor récord de producción de toda su Historia. 1999: Agro Industrial Paramonga S.A.A.- el Grupo Wong, adquiere el 94% de las acciones. 2000: Inicio del cambio de la cultura corporativa y los sistemas de trabajo. Estilo gerencial moderno, con una filosofía de: “creatividad, actitud para el cambio, trabajo en equipo y mejora continua”. Resultados productivos nunca antes registrados en Paramonga. 2001: Debido al éxito de los cambios realizados en el 2 000 y con la base formada, se decidió la implementación de un sistema de calidad basado en la norma ISO9001:2000 2002: Culmina la implementación de un Sistema de Gestión de Calidad al obtener la Certificación ISO 9001:2000 (SGS). Habilitación Sanitaria aplicando el Plan HACCP (DIGESA-RD Nº 0837/2002/DIGESA/SA). 2005: Inicio de importantes proyectos de inversión, entre ellos la Caldera Bagacera, con el cual nuestra empresa ingresa al tema de responsabilidad social y ambiental. 15 2006: Re- Certificación ISO 9001: 2000. Consolidación de liderazgo en el mercado nacional. 2007: Se logra nuevo récord de producción alcanzando las 122 000 toneladas, se mejora el cuidado del medio ambiente con la puesta en operación del Caldero Bagacero CBS. Los paramonguinos comparten con el departamento de Ancash una historia llena de tradiciones y costumbres. Al igual que ellos, la Virgen de las Mercedes, cuya festividad se realiza del 15 al 24 de Septiembre, es su Santa Patrona y el Señor de la Soledad, cuya festividad se celebra del 22 de abril al 10 de mayo, es su Santo Patrón. 1.2. Empresa 1.2.1. Denominación y Dirección Agro Industrial Paramonga S.A.A., es una empresa que se dedica a la producción de azúcar de caña, cuenta con 1 398 colaboradores, está ubicada en la Av.Ferrocarril No. 212 Distrito de Paramonga, Provincia de Barranca a 212 Km, de la ciudad de Lima. Agro Industrial Paramonga S.A.A., es una empresa renovada, vigorosa y en proceso de consolidar estándares de productividad a nivel internacional. Se caracteriza por tener altos niveles de inversión, destinados finalmente a la protección del medio ambiente como elemento principal de nuestra política de responsabilidad social y la eficiencia productiva para mantener una posición de liderazgo dentro de la industria azucarera nacional. 16 1.2.2. Nuestra Visión "Ejercer liderazgo global en el cultivo e industrialización de la caña de azúcar y en el desarrollo de negocios vinculados." 1.2.3. Nuestra Misión "Producir y comercializar azúcar de caña y otros bienes de negocios vinculados para la satisfacción de nuestros clientes, mediante la optimización de los procesos, contando con colaboradores comprometidos y capacitados, logrando niveles de rentabilidad y competitividad global, actuando con responsabilidad social y ambiental." 1.2.4. Datos Importantes Hectáreas Propias sembradas : 6 793,53 Sembradores : 3 557,35 Total sembradas : 10 350,88 Toneladas de caña molida 2004 : 1 095 369 Tn / año 2005 : 2006 : 1 000 903 Tn /año 2007 : 1 080 720 Tn / año 963 780 Tn /año Producción de azúcar de caña 2004 : 120 517 Tn / azuc / año 2005 : 110 230 Tn /azuc /año 2006 : 116 540 Tn /azuc /año 2007 : 122 028 Tn / azuc / año 17 1.3. Certificación SGC ISO 9001:2000 1.3.1. Política Integrada Agro Industrial Paramonga S.A.A. asume el compromiso de asegurar la calidad e inocuidad de sus productos, establecer condiciones de seguridad y salud ocupacional para sus colaboradores considerando la naturaleza de los riesgos e impactos propios inherentes de sus procesos. Esta política se basa en las siguientes directrices: 1. Enfoque a Clientes Mantener una adecuada y fluida relación con sus clientes a fin de satisfacer sus requerimientos, consolidando relaciones comerciales de largo plazo. 2. Cumplimiento de Requisitos • Certificación ISO 9001: 2000 • Inocuidad alimentaria RM 449 – 2006 • Validación Técnica Oficial del Plan HACCP (DIGESA) • Habilitación Sanitaria de nuestra empresa (DIGESA) • DS 009 – 2005 y su modificatoria DS 007-2007- TR Seguridad y Salud Ocupacional 3. Seguridad y Salud Ocupacional Prevención de los riesgos y preservación de la salud ocupacional de las personas involucradas en sus operaciones. 18 4. Mejora Continua Compromiso con la mejora continua del desempeño del sistema de gestión de calidad, inocuidad, seguridad y salud ocupacional. Capacitar y motivar a su personal para lograr un alto nivel de compromiso, responsabilidad y eficiencia en el cumplimiento de sus tareas con énfasis en temas de calidad, inocuidad, Seguridad y Salud Ocupacional. (http://www.agroparamonga.com/#) 19 II. DESTILACIÓN 2.1. Principios Básicos La destilación es un método de separación para mezclas multicomponentes, y genera dos o más productos con un alto grado de pureza. La mezcla llega a la torre en la corriente de alimentación y los productos se obtienen generalmente en una corriente de destilado y una corriente de fondos. La destilación depende principalmente de la distribución de las sustancias entre las fases vapor y líquida y de las diferencias de volatilidad entre los componentes de la mezcla. “La destilación es la separación física de una mezcla en dos o más fracciones que tienen puntos de ebullición diferentes” (Charles, 1981). La separación de los componentes se logra creando una nueva fase que puede o no, ser distinta de la fase de alimentación, mediante la transferencia de calor, hasta alcanzar un determinado grado de vaporización y/o condensación de la mezcla a lo largo de la columna. Debido a que la destilación involucra cambios de fase continuos, la operación de una columna requiere grandes cantidades de energía. Entre las fases presentes en el sistema existe un contacto que permite la transferencia de masa entre ellas. Aunque ambas tengan los mismos componentes, existe un gradiente de composiciones que provoca dicha transferencia. El equilibrio entre fases existe debido a que mientras el líquido se encuentra en su temperatura de burbuja, el vapor está en su temperatura de rocío. Así, la masa se transfiere por el vapor que se evapora del líquido y el líquido que se condensa del vapor (Fig. 1). 20 Fig. 1 Condición de equilibrio entre fases en una columna de destilación Fuente: Ramírez, (2006). El contacto entre fases se puede lograr de diferentes formas, una de ellas es empleando módulos localizados dentro de una columna o cubierta en forma de cilindro (Fig. 2). Los más comunes utilizan platos o capuchones distribuidos a lo largo de la columna, o empaque colocado dentro de la misma. Para este último, existen dos formas de colocación dentro de la torre, al azar o en un arreglo ordenado. Lo que se busca es maximizar la transferencia de masa entre las fases, y la elección depende de las propiedades físicas y químicas de las sustancias, la transferencia de calor y la velocidad de intercambio de masa. (Chen, 2002). Teniendo las condiciones de Temperatura (T) y Presión (P) a las que se da el cambio de fase de líquido a vapor y viceversa, se puede establecer el Equilibrio Líquido Vapor (ELV) de una mezcla multicomponente. Del mismo modo en que una sustancia pura empieza a evaporarse cuando alcanza su temperatura de ebullición, una mezcla multicomponente comienza el cambio de fase, al momento en que el sistema alcanza la temperatura de ebullición de la sustancia más volátil. 21 Fig. 2 Distintos tipos de módulos empleados en columnas de destilación Fuente: Ramírez, (2006). Aunque dadas las interacciones moleculares que se presentan entre las sustancias de la mezcla, no todas las partículas del componente volátil se evaporan en su punto de ebullición, sino que resisten en la fase líquida incluso cuando ya se han alcanzado temperaturas muy elevadas. Así mismo, una sustancia que es menos volátil, se evapora junto con los componentes más ligeros en función de la estructura del sistema. 2.1.1. Descripción del Proceso La mezcla que se desea separar se introduce a la columna (Fig. 3), y por acción de la gravedad, el líquido se mueve hacia la parte inferior de la columna, derramándose plato por plato en una caída tipo cascada. El líquido que alcanza el fondo de la columna se vaporiza de manera parcial en un rehervidor, lo que proporciona el vapor que viaja a la parte superior de la columna. Mientras que el vapor sube a través de la columna, para entrar en contacto con la corriente que desciende por los platos, el líquido restante en el rehervidor se retira como producto de fondo. 22 El vapor que llega al domo de la columna se enfría en un condensador y pasa a la fase líquida. Una fracción del líquido es conducida nuevamente a la torre, lo que constituye la corriente de reflujo, para proporcionar el líquido que entra en contacto con el vapor, la otra parte del líquido condensado se remueve como el producto destilado. (Geankoplis, 2006) Fig. 3 Torre de destilación multicomponentes Fuente: Ramírez, (2006). El esquema de reflujo en el domo de la columna de destilación proporciona un contacto, a contracorriente, de las corrientes de líquido y vapor, en cada plato de la torre. Las fases de líquido y vapor en un plato dado, alcanzan el equilibrio de fases para las condiciones de T y P. Los componentes más ligeros se concentran en la fase vapor, mientras que los más pesados hacen lo propio en la fase líquida. Después de lograr el equilibrio en cada uno de los platos, la fase vapor se hace cada vez más rica en los componentes ligeros hasta que alcanza el condensador, mientras la fase líquida hace lo propio con los componentes pesados mientras completa la cascada hasta el 23 rehervidor. El grado de separación obtenida entre el destilado y los productos de fondo, depende primordialmente de las volatilidades relativas de los componentes, del número de platos y de la relación de reflujo usada en la columna. La alimentación generalmente se encuentra en fase líquida o con una vaporización (v) determinada, mientras que el destilado puede ser en fase vapor, fase líquida o ambas, y los fondos usualmente se obtienen en fase líquida. En resumen, la separación por destilación requiere tres condiciones para que pueda llevarse a cabo: La nueva fase que se forma debe estar con contacto directo con la original y pueda establecerse la condición de ELV en cada una de las etapas de la columna. Los componentes deben tener volatilidades distintas para que se distribuyan en las fases a diferentes concentraciones en cada etapa de equilibrio. La separación de la fase líquida y la fase vapor, pueda llevarse a cabo por gravedad o medios mecánicos simples. (Geankoplis, 2006) 2.1.2. Ventajas de la Destilación La destilación tiene ventajas y desventajas comparada contra otros procesos de separación. Analizando la absorción o la desorción, se puede ver que para obtener los productos deseados, es necesaria la adición de una nueva sustancia al sistema, la cual forma una mezcla que posteriormente debe ser separada a menos que esta nueva solución sea útil directamente. En el caso de la destilación esto no sucede porque no se añade ninguna sustancia adicional al sistema original. Otra ventaja es que el ELV es ampliamente estudiado y existen 24 muchas fuentes donde consultar los datos necesarios para poder trabajar con la destilación. Por el otro lado, la nueva fase que se crea difiere de la original en su composición y contenido de calor, el cual tiene que sea añadido o removido del sistema, lo cual implica costos que deben considerarse. Tampoco es recomendable trabajar con sustancias que sean sensibles al calor, ni que sean fácilmente reactivos o corrosivos. Incluso puede presentarse el caso en que la destilación no logra modificar en gran medida las composiciones de la mezcla original. Puesto que el vapor es similar al líquido en términos de concentración a determinadas condiciones de T y P, por lo que la destilación puede ser por completo inútil para separar una mezcla determinada. La facilidad de poder hacer una separación directa de una mezcla mediante la destilación, y obtener los productos en una forma altamente pura, sin incluir otros procesos más complejos, hacen de la destilación el más importante de los procesos de transferencia de masa, (Perry& Green, 2001). 2.2. Métodos de Predicción de Propiedades 2.2.1. Ecuaciones de Estado Para poder describir el estado en el cual existe una sustancia, es decir, un estado termodinámico, es necesario definir las condiciones de Presión (P), Temperatura (T) y Volumen (V) a las cuales se encuentra. Estas tres variables están íntimamente relacionadas por los grados de libertad, y en conjunto definen lo que en termodinámica se conoce como una Ecuación de Estado (EDE), tal que: f (P,V, T ) = 0 (1) 25 Existen otras propiedades termodinámicas, tales como la energía interna (U), la entalpía (H) y la entropía (S), que son consideradas para poder definir distintas EDE, además de los valores de P, V y T. También la capacidad calorífica de los gases ideales como una función de temperatura, puede constituir una ecuación fundamental. (Ramírez, 2006). Una ecuación de estado PVT puede usarse para evaluar diferentes propiedades de las sustancias puras o de mezclas multicomponentes, entre estas propiedades se tienen: - Densidades de fase líquida o vapor. Presión de vapor. Propiedades críticas de mezclas. Relaciones de ELV. - Desviaciones de la idealidad para H y S. En la actualidad no existe una ecuación como tal, que sea absoluta para todos los sistemas y todas las propiedades de las sustancias, es necesario considerar que una ecuación puede ser útil para describir a un cierto tipo de sustancias, incluyendo sus limitaciones, ventajas y desventajas. El desarrollo de las EDE comenzó con el trabajo de Boyle y sus experimentos con el aire, de los cuales llegó a la conclusión de que a una temperatura dada, el volumen de un gas es inversamente proporcional a su presión, lo que se traduce como: PV = Constante (2) El efecto de la temperatura fue estudiado por Charles y Gay - Lussac, quienes encontraron que esta relación es de tipo lineal: 26 V = Vo(1 + k T ) (3) Clapeyron juntó estos dos resultados y obtuvo la Ley de los Gases Ideales, la cual después de algunas revisiones quedó establecida como: PV = RT (4) Donde: R: Constante universal de los gases. De la cual se puede definir el factor de compresibilidad como: (6) Sin embargo, la ley de los gases ideales no considera la existencia de una fase líquida cuando se tienen las condiciones apropiadas de presión y temperatura. Las investigaciones de Dalton y su ley de presiones parciales contribuyeron al desarrollo de esta ecuación, al considerar que el volumen de una mezcla de gases es la suma del volumen de sus componentes, cada uno de los cuales se encuentra a la temperatura y presión de la mezcla. (Ramírez, 2006). Otro de los avances significativos se presentó con la definición del estado crítico por Cagniard de la Tour, en esta condición, las propiedades de los gases y los líquidos se vuelven indistinguibles. Desde el comienzo se propuso que la Ley de los Gases Ideales es sólo una aproximación del comportamiento real. Las desviaciones de la idealidad, fueron atribuidas a los volúmenes finitos ocupados por las moléculas y a las fuerzas de atracción y repulsión entre ellas. Estas 27 desviaciones fueron tomadas en cuenta por Van der Waals y fueron descritas cuantitativamente en la ecuación que lleva su nombre, y que es la base de muchas ecuaciones PVT aceptadas en la actualidad. La ecuación de Van der Waals predice la coexistencia de las fases líquida y vapor y el estado crítico. Uno de los más grandes avances de este trabajo es el Principio de Estados Correspondientes. (Ramírez, 2006). a. Van der Waals Debido a que la ley de los gases ideales no es adecuada para lograr una representación del comportamiento real de los sistemas, se ha propuesto multitud de EDE distintas. Las diferencias principales son que, para una ecuación dada, sólo se puede trabajar en un rango de P o de T, funciona para un particular tipo de sustancia o propiedad termodinámica, o que exista una ventaja en el tratamiento de los datos del sistema. (Himmelblau, 2000) Una de las ecuaciones más importantes es la de Van der Waals (1873), que se definía "en la continuidad del estado gas y líquido", la expresión es la siguiente: (7) Donde a es el parámetro de atracción entre las moléculas y b el de repulsión. Dado que esta es una ecuación de tercer grado para el volumen, la representación gráfica de una isoterma subcrítica tiene tres raíces reales positivas, mientras que las isotermas supercríticas tienen sólo una. 28 Para las isotermas subcríticas, la raíz más pequeña corresponde al volumen específico de la fase líquida; la raíz mayor se refiere a la fase vapor, y la raíz intermedia no tiene un significado físico. El principio de estados correspondientes surge de la sustitución de los parámetros a y b por sus equivalentes críticos, lo que resulta en la ecuación: (8) A la cual se le da el nombre de ecuación reducida de estado, dado que las propiedades PVT se encuentran en su forma reducida, es decir, son divididas por su correspondiente valor crítico: Presión reducida: (9) Volumen reducido: (10) Temperatura reducida: (11) Así, el principio de estados correspondientes dicta en su primera declaración que: sustancias con presiones y temperaturas reducidas iguales, tienen volúmenes reducidos iguales. La ecuación en su forma reducida es, generalmente aplicable a toda sustancia, aunque las propiedades reales pueden ser obtenidas de la ecuación sólo si se conocen las propiedades críticas individuales. 29 Aunque los estados correspondientes no se pueden aplicarse a las mezclas de la misma forma que a las sustancias puras, si se toman en cuenta ciertas restricciones no debe existir un mayor problema. Si se está manejando una mezcla multicomponente, es necesario considerar que las propiedades críticas son el resultado de las interacciones entre las moléculas de las sustancias presentes. Las propiedades pseudocríticas son el resultado de estas interacciones, y están definidas en términos de la composición y las propiedades críticas de los constituyentes puros. Esto lleva a la definición de los parámetros a y b en función de reglas de mezclado que ajustan de mejor manera la predicción de la ecuación. La aplicación de los estados correspondientes a las presiones de vapor, no se puede expresar como una única relación para todas las sustancias, debido al comportamiento distinto de cada sustancia en función de sus temperaturas críticas individuales. Esto lleva a la definición de un parámetro a>llamado factor acéntrico, que describe las desviaciones de la presión de vapor reducida para una sustancia en particular. (Himmelblau, 2 000). El comportamiento de las mezclas multicomponentes es naturalmente afectado por las interacciones entre moléculas, principalmente si éstas son polares, siendo las más importantes aquellas que se llevan a cabo entre pares de componentes. La incorporación de estas interacciones, sumada a la de los componentes puros, lleva a una mayor precisión en la predicción de las EDE. Para una mezcla de n componentes, se tienen n(n1)/2 posibles parámetros de interacción binaria kiJ. Estos parámetros pueden aplicarse en las EDE en dos formas: 30 Como un ajuste de las propiedades pseudocríticas de un par de componentes. Como un ajuste directo de algunos de los parámetros de las EDE. b. Redlich–Kwong Redlich y Kwong introdujeron su ecuación de estado en 1949, y en ese momento fue considerada como uno de los avances más importantes en comparación con otras ecuaciones existentes mucho más simples. La ecuación es la siguiente: Está basada en la ecuación de Van der Waals, aunque fue calificada por sus autores como una modificación empírica de sus predecesoras. (Ramirez, 2006). El término T0'5 refleja claramente la dependencia de la temperatura del parámetro a, y los valores correspondientes para a y b se calculan con lo siguiente: 31 Los valores para los coeficientes Qa y Qb varían de sustancia a sustancia. En investigaciones recientes, estos coeficientes han sido correlacionados en términos de temperatura reducida y del factor acéntrico. Para el caso de las mezclas multicomponente, los parámetros de interacción binaria deben ser considerados para lograr una buena predicción. En algunas aplicaciones, los investigadores han optado por otras ecuaciones, que aunque son del mismo tipo, requieren de más información sobre los componentes de las mezclas. La ecuación de Redlich - Kwong no se ajusta muy bien a la fase líquida, por lo que no puede ser usada para calcular el ELV, sin embargo, cuando se utiliza en combinación con otros métodos de predicción, tales como correlaciones para fase líquida o con métodos de coeficiente de actividad, se logran excelentes resultados. (Ramírez, 2006) 2.3. Algoritmos de diseño para una torre de destilación 2.3.1. Método Gráfico de McCabe - Thiele Para realizar el diseño de una torre de destilación, se puede recurrir a diversos métodos o algoritmos de diseño, entre ellos tenemos el método gráfico de McCabe-Thiele, que está pensado para manejar mezclas binarias. En base a los diversos elementos del diagrama elaborado, se pueden conjuntar condiciones o características establecidas para la construcción de la torre, como son el número de platos reales y el plato de alimentación; las 32 variables deseadas tales como composiciones de alimentación, destilado y fondos. Se puede trabajar en el cálculo de los platos mínimos (Nmin), el reflujo mínimo (Rmin), el reflujo óptimo (Ropt), el número de platos óptimo (Nopt) y el plato de alimentación óptimo. Es un método muy útil que hace una serie de simplificaciones para tratar al sistema de una manera sencilla y práctica; para el diseño en la columna, no necesita datos detallados de entalpía, necesarios para los balances de energía. (Ramirez, 2 006). Supone que no existen pérdidas de calor excesivas; supone también que los flujos de líquido y vapor que circulan entre las etapas son constantes a lo largo de las zonas de rectificación, alimentación y agotamiento. Fig. 4 Diagrama Pxy para una mezcla binaria. Fuente: Ramírez, (2006). Está basado en la representación lineal de las ecuaciones de balance de materia en un diagrama Pxy (Fig.4), mediante líneas de operación y equilibrio sobre la curva de ELV, que forman las etapas que tienen corrientes de líquido y vapor en contacto. 33 El diagrama utilizado es generalmente el que corresponde al componente más volátil de la mezcla. El método de McCabe - Thiele divide al diagrama Pxy en dos zonas: la zona de rectificación, situada en los platos superiores al plato de alimentación, y, la zona de agotamiento, que se localiza en los platos inferiores. Para construir el diagrama Pxy es necesario hacer los balances de materia por zonas, y en el caso de la rectificación se tiene: Las ecuaciones obtenidas en los balances de materia por zonas representan el modelo de ecuación para una línea de la forma y=ax+b, en donde se tiene una composición conocida para los valores de xDy xB. El diagrama se construye a partir de un punto en la línea de referencia diagonal que representa la composición deseada del producto más volátil, en la corriente de destilado, luego, se traza la línea de rectificación resolviendo la ecuación correspondiente para un punto dado de la línea. (Ramírez, 2006). Fig. 5 Líneas de rectificación, agotamiento y alimentación Fuente: Ramírez, (2006). 34 El siguiente paso es trazar la línea correspondiente a la ecuación de la alimentación de la torre, nuevamente parte de la línea de referencia del diagrama y se prolonga hasta intersecar con la línea de rectificación en función de la condición a la que se encuentra la corriente de alimentación, desde líquido subenfriado, hasta vapor sobrecalentado. Condición que se calcula a partir del balance de materia por componentes de la alimentación. La línea de agotamiento se genera a partir del punto en la línea de referencia, que corresponde a la concentración del componente más volátil en el producto de fondos, y al punto donde se cortan las rectas de rectificación y alimentación. La construcción de estas líneas se observa en la Fig. 5. Para continuar el método gráfico, se traza una línea horizontal entre la línea de rectificación y la curva de ELV, a partir de la composición del destilado (líneas de operación); luego una línea vertical entre la curva de ELV y la línea de rectificación (líneas de equilibrio); con esto se crea un patrón escalonado, que representan las etapas en las cuáles las corrientes de líquido y vapor están en contacto en la zona de rectificación. (Ramírez, 2006) Fig. 6 Desarrollo escalonado de líneas que representan las etapas de una torre Fuente: Ramírez, (2006). 35 Cuando se alcanza la línea de agotamiento, el trazo de operación y equilibrio se hace ahora entre la curva de ELV y la de agotamiento. Estas líneas alternadas tienen su origen, en la fracción mol del componente más volátil en el destilado y terminan hasta que alcanzan o superan la fracción mol del volátil en los fondos (Fig. 6) Existe una condición de etapas mínimas, cuando se hacen los balances de materia suponiendo que el flujo total de vapor a lo largo de la torre, regresa hacia la misma en forma de líquido después de una condensación, además, el flujo de líquido que fluye en la torre es evaporado para regresar al sistema. Condición también conocida como reflujo total. (Ramírez, 2 006) Fig. 7 Etapas mínimas para una torre (reflujo total) Fuente: Ramírez, (2006). El significado físico es que todo el material dentro de la torre está disponible para realizar la transferencia de masa entre las fases, por lo que existe suficiente contactoentre las mismas para optimizar la separación de los componentes, y no se necesitan más etapas de equilibrio (Fig. 7). 36 El caso contrario es cuando el reflujo en la torre es el mínimo posible, lo que provoca que no exista un contacto entre fases dado que no se está recirculando el líquido necesario para modificar la composición del vapor. Por ello se necesitan más y más etapas que tratan de maximizar la transferencia con el poco material que está dentro de la columna. En la Fig. 10, se observa cómo el número de platos se hace mayor conforme se acerca el punto donde convergen las líneas de rectificación y agotamiento a la curva deELV. (Ramírez, 2006). Para calcular el valor de Rmin se emplea la ecuación para la zona de rectificación, dado el valor de su pendiente. Tomando en consideración únicamente la fracción del componente en el destilado, así como el valor del punto donde la línea de rectificación toca al eje de las ordenadas, es decir, sólo el valor de un punto en el diagrama Pxy, con ello tenemos pues: De donde se despeja el valor para Rm¡n. Fig.8 Etapas infinitas para una torre (reflujo mínimo) Fuente: Ramírez, (2006). 37 2.3.2 Eficiencia de Murphree En la destilación, influyen muchos factores en el desempeño de la columna, que hacen que la separación de los componentes no se lleve a cabo completamente con los elementos calculados en el diseño. En la realidad, el número de platos teóricos resultan insuficientes, es decir, existe una cierta eficiencia de los mismos, que hace necesario calcular los platos reales que tendrá una torre. La eficiencia de Murphree permite conocer el grado de separación real que se está obteniendo la columna y está definida como: En donde: yn : Concentración actual del vapor que deja el plato n. yn+1: Concentración actual del vapor que llega al plato n. yn*: Concentración del vapor en equilibrio con el líquido que bajo del plato n. Así pues, la eficiencia de Murphree es el cambio de la composición del vapor de un plato hacia el siguiente, entre el cambio que habría ocurrido en el vapor si estuviera el equilibrio con el líquido que sale del plato. Aunque la eficiencia de Murphree está definida en términos de las concentraciones de vapor, resulta difícil tomar muestras confiables de esta fase, por lo que se toman muestras del líquido en los platos, entonces se calcula la eficiencia a partir de las composiciones de este muestreo, otra opción es determinar las composiciones del vapor mediante un diagrama de McCabe - Thiele. (Ramirez, 2006). Si se conoce la eficiencia de Murphree, ésta puede emplearse fácilmente en un diagrama de McCabe - Thiele para conocer el número real de platos con respecto al número ideal. 38 El triángulo abc representa el plato ideal y el triángulo cde el plato real. Puede comprobarse que el vapor representado por bc es sustituido por el vapor menos rico en el componente volátil dado por ce. Así la eficiencia de Murphree puede calcularse con la relación bc/ce. (Ramirez,2 006) Cuando se aplica la eficiencia en toda la columna, es necesario reemplazar la curva de equilibrio ideal por una curva de equilibrio real (en la Fig. 2.9, las líneas punteada y continua respectivamente), que se calcula con: Fig. 9 Eficiencia de Murphree en el diagrama Pxy Fuente: Ramírez, (2006). La curva de equilibrio calculada, se representa un valor de T|Mde 0,8. Puede verse que la línea de equilibrio real depende de la curva de equilibrio ideal y de la línea de operación. La construcción del diagrama de McCabe - Thiele usando la eficiencia de Murphree, sigue los mismos pasos descritos anteriormente, y únicamente se 39 usa la curva de equilibrio ideal cuando se hace el trazo para el rehervidor de la columna. 2.3.3. Método de Fenske - Underwood - Gilliland El diseño para una torre de destilación de una mezcla multicomponente, con una alimentación, una salida de destilado y una salida de fondos, sin salidas laterales, se puede realizar con el método de FUG. El algoritmo comienza estimando las composiciones de fondos y destilado. Con éstas se calcula la presión de operación de la torre. Con estos datos se calcula el número mínimo de platos con la ecuación de Fenske, tomando en cuenta solamente a los componentes clave ligero y clave pesado, supone una volatilidad relativa media en toda la columna sólo en base a los componentes clave. Una vez obtenido el número de platos se calcula la redistribución de los componentes no clave de fondos y destilado, para revisar si las estimaciones de composición son correctas. (Ramírez, 2006). Las ecuaciones de Fenske son las siguientes: Donde: a: Es la volatilidad relativa media. 40 b: Fondos. d: Destilado. f: Alimentación. /: Componente clave ligero. /': Componente clave pesado r : Componente referencia. Si las estimaciones son iguales a las redistribuciones se continúa con el algoritmo, de lo contrario se regresa a recalcular la presión de operación de la torre. El reflujo mínimo de la torre se calcula a partir de las ecuaciones de Underwood, probando que tipo de separación es, tipo 1 cuando todos los componentes se distribuyen (sustancias con puntos de ebullición similares), o tipo 2 si uno o más de los componentes no aparece en uno de los productos (dos puntos pinch en la torre), de acuerdo a las siguientes ecuaciones: Tipo 1o. (22) Tipo 2°. Donde: HK: Componente pesado. LK: Componente ligero. F : Flujo de alimentación D : Flujo de destilado. L: Flujo de líquido. V: Flujo de vapor. 41 Para estas ecuaciones se requieren los datos del flash de la alimentación a las condiciones de operación de la torre. (Ramírez, 2006) Ya con estos datos de reflujo mínimo y platos mínimos se puede proseguir a calcular el número de platos teóricos reales, mediante la ecuación de Gilliland: El último paso del método de FUG es el cálculo de la etapa de alimentación. Este cálculo se realiza a partir de la ecuación de Kirkbride y la relación de platos de rectificación y agotamiento con los platos totales: 2.3.4. Modelo Termodinámico para la Destilación El proceso completo de transferencia de masa y energía en una columna de destilación real, es demasiado complicado para modelarlo directamente de una forma sencilla. Para poder simplificar esta tarea es necesario implementar un modelo basado en etapas de equilibrio. Al hablar de un sistema en ELV, se establece que, las corrientes de líquido y vapor que salen de una etapa en equilibrio, están en equilibrio completo entre sí, y entonces, el uso de modelos termodinámicos para relacionar las concentraciones de las dos corrientes en equilibrio es posible. 42 Tomando como base una torre hipotética que se compone de etapas de equilibrio en lugar de verdaderos platos de contacto entre fases, se realiza la separación especificada para una columna real usando métodos cortos, gráficos o rigurosos de diseño. (Codistil, 2004). Los resultados obtenidos para el número de etapas de equilibrio necesarias, se transforman a un número dado de platos reales, considerando las eficiencias de plato que predicen el rendimiento real de una etapa de equilibrio en función del rendimiento neto de la etapa hipotética. Utilizando el modelo de etapas de equilibrio, el diseño de una torre de destilación puede describirse en tres elementos bien definidos: Es preciso determinar con absoluto cuidado la base de datos de ELV (validación de consistencia termodinámica) y los modelos termodinámicos a emplear en la predicción del comportamiento del equilibrio de fases. Hay que calcular el número de etapas teóricas necesarias para alcanzar un grado determinado de separación, o si se tiene un número dado de etapas de equilibrio, se calcula la separación que es posible obtener para la mezcla a destilar. Los resultados obtenidos con el diseño de la torre deben ser convertidos a un valor equivalente en platos reales para la torre o en su caso la altura del empaque contenido en la columna. (Codistil, 2004). 2.3.5 Métodos Rigurosos Los métodos rigurosos son una forma de solución para el diseño de una torre, parten de un sistema multicomponente el cual se encuentra en equilibrio líquido - vapor, dentro de la etapa j de un sistema de separación complejo. El sistema se representa mediante el uso de las ecuaciones MESH (Masa, Equilibrio, Sumatorias y Entalpía), las cuales plantean en conjunto un sistema de ecuaciones altamente no lineal que resuelve los balances de 43 materia y energía para cada componente y cada fase del sistema, así como las composiciones de los mismos en el equilibrio de la etapa. Las ecuaciones son las siguientes: Masa: Equilibrio: Sumatorias: Entalpía: Existen diferentes métodos de solución para este sistema de ecuaciones, entre ellos tenemos: - Método de Punto de Burbuja. - Método de Corrección Sucesiva o de Naphtali - Sandholm. - Método Inside - Out o de Boston - Sullivan. La solución de cada uno depende del método numérico que se emplee y de la elección de las variables de corte. 44 Vj Líquido Procedente de la etapa superior Lj - 1 Corriente lateral de vapor Wj Yij HLj - 1 Tj – 1 Pj - 1 Xij - 1 HVj Tj Pj Carga L Válvula F Transferencia de Calor Alimentación Etapa j Qj Fj Xi HFj TFj PFj (+) Desde la Etapa (-) Hacia la Etapa Válvula V Yi,j + 1 HVj + 1 Tj + 1 Pj + 1 Vj - 1 Vapor procedente de la etapa t inferior Lj Xi,j HLj Tj Pj Corriente lateral del líquido Uj Fig. 10 Diagrama de una etapa de equilibrio para las ecuaciones MESH Fuente: Henley, (1999). El método de Punto de Burbuja se utiliza para mezclas de componentes con puntos de ebullición cercanos, el problema surge cuando se están manejando mezclas no ideales, puesto que no alcanza una convergencia adecuada. (Codistol, 2004) 45 El método de Corrección Sucesiva es un modelo iterativo que se resuelve usando Newton - Raphson. Boston - Sullivan fue propuesto en 1974 para la destilación de hidrocarburos, pero actualmente se utiliza en casi todas las separaciones multicomponentes. Emplea dos modelos de propiedades: el empírico y el riguroso. El modelo empírico se usa principalmente para la convergencia del ciclo interno del sistema, mientras que el riguroso se ocupa del ciclo externo. Este modelo es muy útil debido a que reduce el tiempo de cómputo de las propiedades termodinámicas. (Stalling, 2007) 46 III PROCESO DE ELABORACIÓN Y RECTIFICACIÓN DEL ETANOL 3.1 Materia Prima 3.1.1. La Melaza Las melazas son las aguas madres extraídas por centrifugación en la elaboración del azúcar de caña. Estas contienen tan pequeñas cantidades de sacarosa, que no resulta económicamente rentable su extracción mediante cristalización. Se presenta como líquido denso, siruposo, con olor agradable. La melaza de caña de azúcar es una mezcla compleja de sacarosa, azúcares reductores de diversa estructura tales como glucosa, fructosa, refinosa, etc. Además sales y constituyentes alcalinos presentes en el jugo de caña. A parte de todo esto, las melazas generalmente contienen sustancias reductoras, no fermentables por las levaduras, formadas por constituyentes volátiles así como el hidroximetilfurfural, acetona, ácido fórmico, ácido levulínico, los cuales son productos de la descomposición de la fructosa, que por exceso de calor se deshidratan formando compuestos de tipo glutusas de color oscuro que en la industria azucarera se conocen con el nombre de caramelos, los cuales falsean la calidad de las melazas. Las melazas se obtienen en cantidades alrededor del 3 a 4 % de la caña producida para la obtención de azúcar, la calidad de la melaza mejora cuando la relación de azúcares totales y cenizas sulfatadas es mayor de 50/12 (James, 1991). 47 3.1.2 Composición Fisicoquímica (Promedio) - °Brix 85 - Pureza 42% - pH 5,5 - Cenizas Sulfatadas 12% (máximo) - Azúcares totales 50% * Sacarosa 35% * Azucares reductores 15% (Reventos, 1986, Pág. 8 -9). 3.2 Producto 3.2.1 Definición del Producto El origen etimológico de la palabra alcohol se encuentra en el árabe “alcohol” que significa tenue. Su nombre químico es alcohol etílico C2H5OH, MetilCarbonil; se denomina también alcohol de granos, espíritu de vinos, etc. El alcohol etílico, químicamente es un compuesto de tres elementos simples: carbono, hidrógeno y oxígeno; pertenece a la numerosa serie de los “alcoholes” que tienen todos propiedades o iguales o análogas y que, sometidos a una parcial oxidación de modo que se realice la fijación del oxígeno se obtienen compuestos muy volátiles y poco estables, llamados aldehídos. 3.2.2 Características El alcohol se mezcla con el agua en todas proporciones y a cualquier temperatura, desarrollando calor y con contracción de volumen, por esto la mezcla de agua y alcohol es menor que la suma de los 48 volúmenes de los componentes. El alcohol absoluto es ávido de agua e higroscópico, tanto que teniendo en recipiente abiertos, absorbe agua de la atmósfera, reduciéndose a 95° - 96°. El etanol normalmente se destila a una concentración de 96 % de etanol y 4% de agua. a. Características Organolépticas A presión y temperatura ordinaria: - Color : Líquido incoloro muy fluido - Olor : Penetrante - Sabor : Cáustico y abrasador - Aspecto : Limpio b. Características Fisicoquímicas - Fórmula Química : CH3CH2OH - Peso Molecular : 46,07 - Peso específico : 0,8123 gr/L - Índice de refracción : 1,3619 - Punto de ebullición : 78,5 °C - Punto de congelación : -117,3 °C / -178 °F - Temperatura crítica : 243 °C - Capacidad Calorífica : 0,14 Kcal/Kg - Calor latente : 243 Kcal/Kg - Densidad : 0,794 g /cm3 - Tensión superficial : 21,38 Dynas/ cm2 a 40 °C 49 3.2.3. Composición El etanol es un compuesto ternario, se compone de carbono, oxígeno e hidrógeno y su composición porcentual es: Peso molecular : 46,07 Fórmula Química : C2H5OH Las cantidades de cada componente en la fórmula química, y sus respectivos porcentajes son: - Carbono : 24,02 ..... 52,14 % - Oxígeno : 15,99 ..... 34,71 % - Hidrógeno : 6,06 ...... 13,15 % Total ..... 100,00 % 3.2.4. Aplicaciones a. Como Materia Prima en Procesos Industriales Se utiliza como disolvente, como agente extractivo, anticongelante. También se usa para la preparación de agentes oxidantes como por ejemplo, el ácido de etilo. Los derivados del alcohol se utilizan para la fabricación de colorantes, drogas, caucho sintético, detergentes, etc. b. Para la Elaboración de Licores de Fantasía Para la preparación de bebidas alcohólicas a partir de las mezclas alcoholizada o jarabes azucarados; el cual tiene aceptable demanda en el mercado nacional. 50 c. En la Industria Farmacéutica Los laboratorios farmacéuticos utilizan el alcohol etílico en grandes cantidades, para este propósito el alcohol es rectificado a gran pureza no menor a 96 ° Gay Lussac para que su capacidad antiséptica y desinfectante sea óptima. d. En la Industria Automotriz El etanol se utiliza como combustible automotriz y también puede mezclarse con gasolina para formar lo que se ha llamado “Gasohol”, las mezclas más comunes contienen 20% de etanol y 80% de gasolina. Más de 1000 millones de galones de etanol están mezclándose con gasolina todos los años en Estados Unidos. El gasohol permite una mejor combustión ya que la molécula de etanol contiene oxígeno, produciendo menos emisiones, evitando el incremento elevado de la contaminación, además el etanol es un combustible renovable. e. En la Industria de Perfumes Como componentes de diversos cosméticos y artículos de tocador, en la preparación de lociones astringentes, líquidos tonificantes de la piel, mezclas para higiene bucal y dental, fijadores y lociones de cabello, etc. (Reventos, 1986, Pág. 8 -9). 3.3. Proceso 3.3.1 Dilución de la Melaza Es un tratamiento previo a la Fermentación en el cual se someten las melazas para alcanzar la concentración de sólidos y azúcares a fin de que las levaduras consigan desdoblarlos totalmente, la dilución se realiza con agua tratada; la dilución debe de alcanzar los 20°Brix. 51 Las melazas tienen una densidad alta y son alcalinas. La sacarosa que contienen no es fermentable directamente y por eso las melazas son sometidas a este tratamiento preventivo con agua obteniendo de esta manera el mosto. La reacción química que se produce en la dilución es la siguiente: Inversión de la Sacarosa: C12H22O11 + Sacarosa H2O Invertasa Agua C6H12O6 + C6H12O6 d-Glucosa d-Fructosa Esta reacción es producida por la enzima Invertasa; simultáneamente se producen otras reacciones de poca trascendencia. 3.3.2 Pre-Fermentación a. La Levadura Las levaduras son microorganismos unicelulares y carecen de clorofila, se encuentran muy difundidas en la naturaleza, y en todas las frutas. El término "levadura" se refiere más a una vida-estilo que a una clasificación del phylogenetic. La levadura se refiere a la fase unicelular de los ciclos de vida de muchos hongos diferentes, pero normalmente se usa más como un término genérico para hongos que tienen sólo una célula. De la gran variedad que existen se han hecho varias clasificaciones basadas en su forma de reproducción; de todas las especies sólo algunas son utilizadas en la producción de alcohol, como: Saccharomyces Cervisae, Saccharomyces Uvarum, Saccharomyces Elipsoidesus, que pertenecen a la familia Sacharomycetacea. 52 El proceso de Pre-fermentación consiste en dar lugar al acondicionamiento de la levadura, mediante la propagación de esta, dicha propagación es ayudada por la adición de ácido sulfúrico para alcanzar un pH de 2,5 a 3,0; inyección de aire ya que estos microorganismos son aerobios y también anaerobios; es por eso que se les llaman microorganismos facultativos, también se les agrega nutrientes para su mejor desarrollo. La pre-fermentación se puede realizar de tres formas: - A nivel de laboratorio. - Después de una interrupción de la producción. - De rutina. 3.3.3 Fermentación La fermentación se define como el proceso mediante el cual en un sustrato orgánico, se realizan cambios químicos. Los sustratos pueden ser hidratos de carbono, grasas, proteínas, o cualquier otro tipo de materia orgánica, los que por acción de las enzimas (Zimasa) producidas por la levadura, dan lugar a numerosos cambios bioquímicos. Si no existiesen enzimas (Zimasa) sería imposible la fermentación alcohólica. La fermentación es la parte más importante del proceso de elaboración de etanol y de la forma como se conduzca depende de que la transformación del azúcar en alcohol sea total; es decir el rendimiento de las materias primas utilizadas sean óptimos. Energía de la Fermentación Cada molécula de hexoxa fermentada produce dos moléculas de etanol y otras dos de dióxido de carbono. La pérdida total de energía durante el proceso de fermentación es de unas 50000 calorías por cada molécula gramo de glucosa fermentada. 53 Zimasa C6H12O6 a. ==== 2C2H5OH + 2CO2 + 50 000 cal Fases de la Fermentación Alcohólica La fermentación alcohólica, según su intensidad de producción de CO2, de alcohol, y de desprendimiento de calor, puede ser dividida en tres fases: a.1. Fermentación Preliminar Acondicionándose al mosto la levadura alcohólica esta, desde que las condiciones sean favorables, tienden a multiplicarse hasta llegar a un límite llamado “Número límite de Braun”. Esta fase de la multiplicación celular o crecimiento es llamada fermentación preliminar, esta se inicia cuando se adiciona la levadura al mosto y termina cuando el desprendimiento de gas se torna evidente. a.2. Fermentación Principal El término de fermentación preliminar señala el inicio de la fermentación principal. Este inicio se caracteriza por el desprendimiento de CO2, se nota que la producción de este gas, al principio incipiente que va aumentando progresivamente y con rapidez, dando la impresión muchas veces al observar que el mosto está en plena ebullición. La formación de alcohol es máxima y rápida en esta fase como esto se debe a la transformación del azúcar, evidentemente el °Brix va cayendo hasta el punto de la fermentación complementaria. En esta etapa deben de usarse antiespumantes para evitar la pérdida de levadura y mosto por arrastre con el CO2. 54 a.3. Fermentación complementaria La disminución en la intensidad del desprendimiento de gas carbónico, la caída gradual de la temperatura, caracteriza el inicio de la post fermentación. Es justamente en este momento que aparecen la mayor parte de las infecciones. También en esta fase se forman los alcoholes superiores homólogos, de los cuales constituye la mayor parte del aceite de fúsel, esto quiere decir que a mayor brevedad de esta fase dará un alcohol de mejor calidad, más fino. Se debe comenzar a destilar cuando den tres lecturas consecutivas parecidas o cuando de 3 a 4 horas den el mismo °Brix. Esta medida se realiza con el brixómetro una vez alimentada la cuba de fermentación hasta que den tres lecturas parecidas; la medición debe de realizarse en intervalos de 1 hora. (Reventos, 2000) b. Proceso Melle Boinot Al comienzo de la fabricación del azúcar, se inicia la fermentación por el proceso de cortes hasta que todas las cubas estén llenas, momento en que se es puesto en práctica el proceso Melle-Boinot. Terminada la fermentación, la cual es verificada por la atenuación del °Brix, el mosto fermentado es bombeado para un decantador y/o filtro situado en un piso superior al de las centrífugas, de manera de hacer carga sobre la misma. En este decantador y/o filtro, se eliminan las impurezas, sobre todo las sólidas para evitar el taponamiento de las tuberías, y estas son conducidas a una cuba volante para su posterior envío a las columnas de destilación. 55 El vino con levaduras es alimentado a la centrífuga, donde se da la preparación de la leche de levadura y del vino sin levadura por acción de la fuerza centrífuga. (Reventos, 2000) El vino sin levadura lleva consigo gran cantidad de bacterias y es encaminado para la cuba volante y de ahí para los equipos de destilación, en cuanto que la leche de levaduras con volumen correspondiente cerca del 10% de la capacidad de la cuba de fermentación es encaminada a los prefermentadores para su tratamiento. El proceso Melle-Boinot, es un proceso intermitente o semicontinuo debido a la completa recuperación del fermento de cada tanque de fermentación, donde las levaduras son utilizadas repentinamente durante mucho tiempo, es de fundamental importancia en el equipamiento del proceso, la instalación de las centrífugas separadoras de levadura. El inicio de la recuperación de la levadura coincide con la culminación de la fermentación principal, momento en que se bombea el mosto fermentado a un decantador de sólidos de donde se alimenta por gravedad a la centrífuga, en estas condiciones se recuperara la mayor cantidad de levadura en su mayor actividad. El volumen recuperado de levadura constituye de 10 a 15 % del volumen de los tanques de fermentación. (Reventos, 2000). c. Rendimientos de la fermentación Alcohólica La cantidad de alcohol obtenida a través de la fermentación alcohólica constituye el principal coeficiente de la medida de su actividad, o sea, de su rendimiento. Para proceder a este cálculo, son necesarios los datos obtenidos por las determinaciones cuantitativas de los azucares totales, contenidos en el mosto y del porcentaje del alcohol del mosto. 56 La concentración de azucares totales es obtenida transformando los azucares presentes en el mosto, en azucares totales, es constituida de azucares fermentables; y la otra fracción restante es de pequeña proporción de sustancia reductora no fermentable. (Reventos, 2000) Rendimiento Gay Lussac Denominado también rendimiento ideal ya que no considera ninguno de los factores mencionados anteriormente y esta expresada por la ecuación de Gay Lussac; el cálculo del rendimiento ideal en el alcohol etílico, a partir de los azucares está dado por la siguiente secuencia: * C12H22O11 + H2O ==== C6H12O6 + C6H12O6 Sacarosa * Agua Glucosa Fructosa 2 C6H12O6 ==== 4C2H5OH + 4CO2 Glucosa Etanol Dióxidodecarbono 342 g de Sacarosa ----- 184 g de Etanol 100 g de Sacarosa ----- X X = 53,80 g de Etanol = 67,79 ml Etanol a15 °C 360 g de Glucosa ----- 184 g de Etanol 100 g de Glucosa ----- X X = 51,11 g de Etanol = 64,41 ml Etanol a15 °C Rendimiento Pasteur En virtud de la presencia de las fermentaciones del gas carbónico de la glicerina, del ácido succínico, etc., productos normales de una fermentación alcohólica, Pauster demostró ser imposible obtener más de 51,11 gramos de etanol, a 15 ºC, a partir de 100 g de glucosa aun en condiciones rigurosas de pureza y con toda 57 precisión de experimentación científica, estableciéndose así el llamado rendimiento teórico de Pauster. (reventos, 2000) Se sabe que este rendimiento, en la actualidad es fácilmente obtenido y muchas veces sobrepasado, cuando se adopta el proceso de conducción de la fermentación alcohólica de “MELLE BOINOT”, sin embargo el rendimiento teórico tiene cierto interés cuando se adopta el proceso clásico de fermentación. * Utilizaremos un Rendimiento Pasteur 0.935 rendimiento teórico Gay Lussac (rendimiento promedio). 342 g de Sacarosa ----- 172,04 g de Etanol 100 g de Sacarosa ----- X X = 50,30 g de Etanol = 63,35 ml Etanol a15 °C 360 g de Glucosa ----- 172,04 g de Etanol 100 g de Glucosa ----- X X = 47,79 g de Etanol = 60,19 ml Etanol a15 °C Se debe de tener en cuenta que el CO2 también arrastra alcohol en la fermentación, lo que equivale un 0,6%. 3.3.4 Centrifugación La separación se realiza por un rotor con boquillas de descarga de sólidos. El material en proceso es alimentado continuamente al centro de un rotor que distribuye a la periferia por medio de un cono de distribución. La alta rotación fuerza al material en proceso a pasar a través de los discos cónicos (platos) donde se realiza la separación por la fuerza centrífuga dando una fase leve y una pesada. El concentrado siendo la fase más pesada es forzado para fuera de las paredes del rotor a través de las boquillas de descarga. La parte líquida 58 siendo la más leve es descargada en dirección del centro del rotor; se descarga por el lado opuesto a la fase pesada. 3.3.5 Destilación El proceso de destilación es usando vapor vivo, con excepción de la última columna; las columnas son de platos con campanas de borboteo: presenta las siguientes columnas: Columna Mostera, Columna Rectificadora, Columna de Repase; además presenta los siguientes accesorios: refrigerante de alcohol, intercambiadores de calor, los condensadores correspondientes a cada columna y una mesa de control y operaciones. (Stalling, 2007). La planta es anexa a la fábrica de azúcar, de donde recibe vapor a 20 psi, aire comprimido para el control de inyección de vapor a las columnas y la melaza de caña de azúcar. El agua es usada para la dilución de la melaza es agua potable y para la refrigeración de los condensadores se utiliza agua de río con un tratamiento previo. El material de las columnas así como de las campanas de borboteo es de acero inoxidable. a. Columna Mostera – (1eraColumna) Una vez terminada la centrifugación la fase leve (Vino) se lleva a un tanque (tanque volante) donde se le va a ir adicionando un antincrustante para evitar que en la columna se formen incrustaciones; luego el vino es bombeado a un tanque que se encuentra en la parte superior de la fábrica de donde por gravedad el vino va a descender y ascender, y luego pasará por una válvula que se encuentra en un panel de control la cual regula la alimentación a la columna, posteriormente el vino va a calentarse usando para esto la energía que llevan los vapores alcohólicos en el condensador (“E”), enseguida desciende el vino y se va a volver a calentar en un intercambiador de calor (“K”) que 59 aprovecha la energía que lleva la vinaza; enseguida el vino (F) ingresará a la 1era Columna de Destilación (Columna Mostera) por el plato número 22. (Stalling&Riveiro, 2007) La Operación de Destilación en la Columna Mostera consiste en separar el alcohol del vino-agua por medio de vapor de agua (V); el alcohol presente en la alimentación puede estar entre 5 –10 %. Para la obtención por destilación, de alcohol de alto grado, se utilizan columnas de destilación en las que ingresa el vino por la parte superior y vapor de agua por la parte inferior, de modo que el recorrido descendente del primero y ascendente del segundo, entra en contacto y el vapor de agua se satura de alcohol contenido en el mosto libre de levadura, aprovechando que este se desprende a 78,5°C y el vapor a 100 °C. (Stalling, 2007) El vapor de agua (V) que ingresa por la parte inferior asciende y se va saturando de alcohol presente en la solución, luego estos vapores (D1) pasan a dos condensadores (“R” y “R1”), parte de este condensado regresa a la columna como reflujo (C1) y la otra parte desciende como alcohol de 2da (P1) (95° G.L.) hacia el panel de control luego para ser almacenado. Los condensadores utilizan agua que ingresa por la parte superior para condensar los vapores alcohólicos; de la regulación del flujo de agua depende la calidad de alcohol que se va obtener. Luego los alcoholes que regresan como reflujo van a descender hasta el plato número 17 por donde van a salir para ingresar a la segunda columna (F1). Se debe tener en cuenta que el flujo de vapor que ingresa por la parte inferior no sea demasiado ya que esto ocasionaría que en lugar que los alcoholes provenientes de los condensadores pasen a la segunda columna, vaya a pasar parte de la alimentación lo cual causaría incrustaciones en la Columna Rectificadora. 60 La alimentación a medida que desciende va empobreciéndose de alcohol, lo que posteriormente va a salir como un residuo por la parte inferior de la columna llamado vinaza (L), la que a su vez va a servir como medio de calentamiento (segundo calentamiento) para el vino (Interc. “K”) antes de ingresar a la columna. (Stalling, 2007). Descripción de la Columna Para que el contacto vapor con el mosto libre de levadura sea más efectiva y más completa la desalcoholización de este, el interior de la columna está provista de unos dispositivos llamados platos 32 en total en 14 cuerpos que facilitan el contacto, estos platos cuentan con campanas de borboteo. Los platos están colocados uno encima de otros y de tal manera que formen una columna. Estos platos se comunican entre sí por un tubo de descarga, que permite mantener un nivel constante, dando salida al plato inferior el exceso de líquido. b. Columna Rectificadora – (2da Columna) La Rectificación tiene por objeto la separación de alcohol de las impurezas que le acompañan. La flegma (F1) obtenida en la primera columna contiene, además de alcohol, cierto número de sustancias que deben eliminarse, por lo tanto este alcohol no tiene la pureza suficiente para el comercio. Estas impurezas son numerosas y variables y se clasifican en dos categorías: 1°, las más volátiles que el alcohol (tales como aldehídos y ciertos éteres) llamadas impurezas de cabeza, y 2°, las impurezas menos volátiles que el alcohol (tales como ácido acético, butírico, alcohol propílico, alcoholes amílicos, etc.) llamadas impurezas de cola. (Stalling, 2007) Las flegmas contienen de 70 a 80 % de alcohol etílico y el resto está constituido por agua e impurezas. 61 La operación es similar a la anterior pero con la diferencia que la alimentación (F1) ingresa por el plato número 14 esto es por la parte inferior; se hace burbujear el vapor en el líquido que contiene cada plato por medio de campanas que constituyen un cierre hidráulico con el líquido del plato. De la misma manera como en la Columna mostera el vapor de agua (V1) ingresa por la parte inferior de la columna, también parte del reflujo de la Columna Mostera (F2) ingresa por el plato número 20. El vapor llega a la campana atraviesa la vena líquida y llevando las fracciones correspondientes, pasa luego al plato superior y así sucesivamente. El líquido de los platos desciende de plato en plato por los tubos de desagüe cediendo su alcohol, mientras el vapor sube de plato en plato burbujeando en el líquido cada vez más alcohólico. Los vapores que ascienden (D2) luego pasan a tres condensadores (“E”, “E1”y “E2”) donde van a regresar como reflujos (C3 y C2), el primer condensador (“E”) se utiliza para calentar el vino (primer calentamiento) que va a ingresar al intercambiador de calor “K”, los otros dos utilizan como medio de enfriamiento agua. En esta columna se extraen la mayor cantidad de impurezas que se han generado durante el proceso de la fermentación (alcoholes superiores, aldehídos, etc.); del plato 16 al plato número 30 se extrae el aceite fúsel el que posteriormente se va a recuperar en un decantador (Stalling, 2007) Descripción de la Columna Para que sea efectiva y más completa la desalcoholización, el interior de la columna está provista de unos dispositivos llamados platos 58, en 10 cuerpos, que facilitan el contacto, estos platos cuentan con campanas de borboteo las cuales son fijas y más pequeñas que de la columna anterior. 62 c. Columna de Repase – (3era Columna) El vapor es alimentado al fondo de la columna (V2) mediante una calandria y recibe el alcohol (F3) en el plato 13, con el fin de eliminar las sustancias volátiles remanentes en este alcohol, descendiendo a la base de esta columna y después ser encaminado al intercambiador de calor “J” y de allí a los tanques de almacenamiento. A este alcohol se le denomina “alcohol rectificado fino”. Esta columna consta de dos condensadores (“I”, “I1”) enfriados con agua y trabajan en serie igual que los anteriores. El vapor alcohólico (D3) se condensa, parte del condensado (C4) retorna a la columna en el plato número 19 y la otra parte que contiene las impurezas volátiles retorna como reflujo a la primera columna Descripción de la Columna Para que sea efectiva y más completa la purificación del alcohol, el interior de la columna está provista de unos dispositivos llamados platos 19, en 5 cuerpos, que facilitan el contacto, estos platos cuentan con campanas de borboteo las cuales son fijas y más pequeñas que de la columna anterior (Codistil, 2004) 3.4 Balance de Materia y Energía Los balances de materia y energía en la Destilería se realizarán con datos obtenidos en el laboratorio, datos de operación de la destilería y otros datos empíricos adquiridos por la práctica, los que dan resultados bastante aproximados al sistema real. 63 3.4.1 Datos para los Balances de materia en la dilución, PreFermentación, Fermentación y Centrifugación a) Datos de Laboratorio: - Brix de la Melaza = 84,62 % - Pol de la Melaza = 16,69 % - Azúcares Reductores = 16,70 % - Azúc. Reduc. No Fermentables = 1,50 % - Eficiencia de la Fermentación = 93,50 % b) Datos de Operación: c) - Brix del Mosto = 20,00 % - Dornas Alimentadas por día = 7,50 % - Recuperación de la Levadura = 10,00 % Datos Adicionales: Pre-fermentación - Agua = 1 000,00 L/Dorna - Ac. Sulfúrico = 6, 00 L/Dorna - Densidad del Ac. Sulfúrico = 1,780 Kg/L - Densidad del Pie de Fermento = 1,180 Kg/L Fermentación - Capacidad de la Dorna = 30 000,00 L - Densidad del Mosto = 1,087 Kg/L 64 3.4.2 Cálculos en la dilución, Pre-fermentación, Fermentación y Centrifugación(por día) a) Dilución Melaza Utilizada (vmd * dm * ba) * da bm Melaza Utilizada Donde: cd : Capacidad de la Dorna vmd = 0,83 3 * cd :Volumen de Mosto por Dorna dm : Densidad del Mosto ba : Brix del Mosto bm :Brix de la Melaza da : Dornas Alimentadas al día Remplazando datos: Melaza Utilizada (0,833 * 30000,00 *1,087 * 20 * 7. 5 84,62 Melaza Utilizada 48169,907kg Agua Utilizada Agua Utilizada (vmd * dm * da) (Melaza Utilizada ) Remplazando datos: Agua Utilizada = (0,833*3 0 000,00 *1,087*7,5)-(48 169,907) Agua Utilizada 155636,968kg Pureza de la Melaza Pureza 2 * PolMelaza * 100 BrixMelaza 65 Remplazando datos: 2 *16,69 *100 84,62 Pureza 39,45% Azúcares Reductores Fermentables ARF (2 * Pol Melaza ) *1,05 AR ARNF Donde: AR : Azúcares Reductores ARNF : Azúcares Reductores No fermentables Remplazando datos: ARF% (2 *16,69) *1,05 16,70 1,50 ARF Melaza Utilizada * ARF % 100 ARF 24204,897kg 48169,907 * 50,25 100 Mosto Mosto Agua Utilizada Mosto 203806,875kg Brix Mosto Melaza Utilizada 20,00% b) Fermentación Mosto Mosto Agua Utilizada Melaza Utilizada Mosto 203806 ,875 kg 50,25% 66 Pie de Fermento Donde: %Rec : % de Recirculación de la Levadura cd : Capacidad de la dorna as : Ácido Sulfúrico por dorna apf : Agua en la Prefermentación por dorna dpf : Densidad del Pie de Fermento da : dornas alimentadas al día Remplazando datos: Pie Fermento 35453,100kg Dióxido de Carbono Liberado CO 2 ARF * 88 * ef 180 Donde: ef : Eficiencia de la Fermentación Remplazando: CO 2 24204,897 * 88 * 0,935 11064,327 kg 180 Alcohol Arrastrado por el CO2 Alcohol Arrastrado ARF * 92 * ef * % arrastre 180 * 100 Donde: % arrastre: % de Arrastre de Alcohol = 0,6% Remplazando datos: 67 24204,897 * 92 * 0,935 * 0,6 180 * 100 Alcohol Arrastrado 69,404 kg Mosto Fermentado Mosto Fermentado Pie Fermento Mosto Alcohol Arrastrado CO2 Remplazando datos: Mosto Fermentado c) 228126,244 kg Prefermentación Leche de levadura Leche Levadura Pie Fermento (apf (as * das)) * da Donde: apf : Agua en la Prefermentación as : Ácido Sulfúrico das : Densidad del Ac. Sulfúrico da : Dornas alimentadas Remplazando datos: Leche Levadura 35453,100 (1000 (6,000 *1,78) * 7,5) Leche Levadura 27873,000kg Agua Agua apf * da Agua 1000,000 * 7,50 7500,000 kg 68 Ácido Sulfúrico Acido Sulfúrico as * das * da Acido Sulfúrico 6,000 *1,780 * 7,5 80,100 kg Pie de fermento Pie Fermento 35453,100 kg d) Centrifugación Mosto Fermentado Mosto Fermentado 228126,244kg Leche de Levadura Leche Levadura 27873,000 kg Vino e) Vino Mosto Fermentado Leche Levadura Vino 228126,244 27873,000 200253,243 kg Alimentación a la Columna Mostera Vino Vino Mosto Fermentado Leche Levadura Vino 228126,244 27873,000 200253,243 kg Alcohol en el Vino OHvino ARF * 92 * ef (100 * 180 * 100 % arrastre ) 100 69 OHvino 24204,897 * 92 * 93,5 * (100 0,6) 180 *100 *100 OHvino 11497,598kg Agua en el Vino H 2 Ovino Vino OHvino H 2 Ovino 200253,243 11497,598 H 2 Ovino 188755,645kg 3.4.3 Cálculos en el sistema de destilación de etanol a) Correlaciones para el Cálculo - Densidad del Alcohol de Primera: 0,81206 kg/L - Densidad del Alcohol de Segunda: 0,81603 kg/L - Grado Alcohólico del Alcohol de Primera: 96,0° G.L. - Grado Alcohólico del Alcohol de Segunda: 95,0° G.L. Vinaza 4 3,76 L Vino * Flegmaza. L1 Vino * 1 11 Vapor en la Columna Mostera y Rectificadora V V1 P2 P1 L L1 Vino Vapor que ingresa a la Columna Mostera V 0,598(V V1 ) Vapor que ingresa a la Columna Rectificadora V1 (V V1 ) V Vapor de Calefacción en la Columna de Repase. V2 0,212 * P2 Ki log ramos 70 Consumo de Vapor Total. Vt V V1 V2 b) Cálculos Tabla 1 Flujos, Fracciones másicas de etanol, Temperaturas y Entalpías Fracciones Másicas Flujo (kg/día) XOH Temperatura (°C) Entalpía (kJ/kg) de etanol 200253,243 0,057415289 73,00 305,642 Alcohol 1era (P2) 10584,513 0,939028150 75,00 219,182 Alcohol 2da (P1) 1063,626 0,924725810 72,00 210,415 25061,989 0,000000000 125,99 2714,500 16847,691 0,000000000 125,99 2714,500 2243,493 0,000000000 125,99 2185,179 213035,365 ---------------- 111,00 465,648 18204,840 ---------------- 118,00 495,319 Vino (F) Vapor 1eraColumna (V) Vapor 2da Columna (V1) Vapor 3era Columna (V2) Vinaza (L) Flegmaza (L1) Fuente: Elaborado por el autor con datos de la empresa, 2011 Tabla 2 Cálculo en los Condensadores Flujo de Agua Temp. Condensadores Energía recibida Temp. Salida 34,5 L/min Ingreso por día R 34,50 20,00 50,00 6231014,640 R1 46,20 20,00 59,00 10848255,264 E (Vino) 139,10 23,00 45,00 18061211,376 E1 206,70 21,00 50,00 35524586,448 E2 7,60 21,00 23,00 70895,232 I 10,90 20,00 71,00 3348066,672 I1 14,80 20,00 32,00 1069500,096 Fuente: Elaborado por el autor con datos de la empresa, 2011 71 Tabla 3 Energía perdida por convección en las columnas Columna Mostera Columna Rectificadora Energía 6803076,914 (kJ) Fuente: Autor, (2011) 4573305,722 Tabla 4 Eficiencias en la Destilación Eficiencia de la Operación (%) 95,00 Eficiencia Térmica (%) 61,58 Fuente: Autor, (2011) Columna de Repase 490243,379 72 CONCLUSIONES Luego de haber planteado los objetivos en la etapa inicial del trabajo, en esta parte final se obtienen las conclusiones producto de haber cumplido con los objetivos trazados. 1. La Empresa Agro Industrial Paramonga S.A., asume el compromiso con la mejora continua del desempeño del sistema de gestión de calidad, inocuidad, seguridad y salud ocupacional. Capacitar y motivar a su personal para lograr un alto nivel de compromiso, responsabilidad y eficiencia en el cumplimiento de sus tareas con énfasis en temas de calidad, inocuidad, Seguridad y Salud Ocupacional. 2. La destilación es el método industrial de separación más utilizado. La destilación consta de múltiples contactos entre las fases de líquido y vapor, cada contacto consiste en la mezcla de dos fases, los contactos se realizan frecuentemente sobre platos horizontales (generalmente llamadas etapas) dispuestas en una columna vertical. A medida que el vapor avanza hacia la cabeza de la columna se enriquece progresivamente en las especies más volátiles; la alimentación de la columna entra en un plato intermedio entre el plato superior e inferior; la parte de la columna situada por encima de la alimentación es la sección de enriquecimiento y la situada por debajo es la sección de agotamiento. 3. Así mismo los datos cedidos por parte de la Empresa Agroindustrial Paramonga S.A.A. (AIPSSA), más la suma de datos bibliográficos, ayudaron a poder a hacer una descripción explícita y/o sólida, del proceso de elaboración de alcohol rectificado dentro de AIPSAA, AIPSSA utiliza los Platos de flujo a contracorriente, para producir alcohol rectificado, lo que se pudo plasmar en el trabajo es lo siguiente: La descripción de la materia prima utilizada, el producto, el proceso, y el Balance de Materia y Energía. 73 BIBLIOGRAFÍA Agro Industrial Paramonga SAA, Recuperado el 10 de Diciembre del 2011, http://www.Agroparamonga.com/# Campués Tulcán, J.; Tarupí Rosero, J. (2011), Obtención de Alcohol a partir de Jugo de Caña, Cachaza y Melaza, mediante la Incorporación de dos niveles de Fermento, (Saccharomycescerevisiae), Universidad Técnica del Norte Ibarra – Ecuador Chen James, C. P. (2002), Manual de la caña de azúcar, editorial Limusa, España Codistil (2004), Manual de Operaciones de Destilerías del Alcohol Etílico, Brasil Foust, Alan S., Principios de Operaciones Unitarias, Editorial Continental, S.A. de C.V., México. Geankoplis, Christie J. (2006); Procesos de Transporte y Operaciones Unitarias, Compañía Editorial Continental, 4ta Edición, México. Henley, Ernest J.; Seader, J. (1999); Operaciones de Separación por Etapas de Equilibrio en Ingeniería Química, Editorial Reverté, S.A., España. Himmelblau, David M. (2000), Principios Básicos y Cálculos en Ingeniería Química. Editorial Prentice/Hall Internacional; México. Holland, Charles D. (1981); Fundamentos Y Modelos de Procesos De Separación. Editorial Prentice/Hall Internacional; España. Incropera, Frank P. (2004); Fundamentos de Transferencia de Calor y Masa, Editorial Prentice Hall; México. Kern, Donald Q. (2005); Procesos de Transferencia de Calor. Compañía Editorial Continantal, S.A. De C.V.; México. Perry, Robert H. & Green, D. (2000); Manual delIng. Químico-4 Volúmenes 7b: Edición, McGraw-Hill, Interamericana de España S.A. 74 Quezada, W. (2011), Manual de Industria Azucarera, Creadores Gráficos. IbarraEcuador. Ramírez Fitz, A. (2006). Desarrollo de un Experimento de Destilación para Mezclas Binarias a nivel Planta Piloto, Universidad de las Américas Puebla. México, recuperado el 11 de Marzo del 2012,. http://catarina.udlap.mx/u_dl_a/tales/documentos/lpro/ramirez_f_a/ Reventós, P. (2000) Destilación de alcoholes , Editorial Sinles, Barcelona-España StallingRiveiro, E. E. (2007), Montaje de las torres de destilación y aprovechamiento de los desechos líquidos para riego de sembradíos de caña de la planta de producción de alcohol Mag alcoholes, S.A., Universidad de San Carlos de Guatemala, Guatemala Treybal, Robert E. (1988), Operaciones de Transferencia de Masa; Editorial McGraw Hill; México S.A. Valiente, A. (2001). Problemas de balance de materia y energía en Industria Alimentaria, Ediciones LIMUSA. Noriega Editores, Mexico. 75 ANEXOS Coordenadas: Sur:10°40´26.78” Oeste: 49´22.81” Altura:19 msnm Anexo 1 Vista aérea de la Empresa Fuente: El Autor Anexo 2 Cubas Fuente: El Autor 76 Anexo 3 Tanques de Melaza Fuente: El Autor Anexo 4 Semilleros Fuente: El Autor 77 Anexo 5 Densímetro Fuente: El Autor Anexo 6 Muestreadores de Alcohol Fuente: El Autor 78 Anexo 7 Flujograma Operacional del proceso de producción de Alcohol Rectificado Fuente: El Autor 79 Anexo 8 Flujograma Operacional del proceso de producción de Alcohol Rectificado Fuente: El Autor


![practica 5[1]](http://s2.studylib.es/store/data/007425075_1-61f96af50a4c20310ac423e2aba15d52-300x300.png)