3 termodinamica
Anuncio

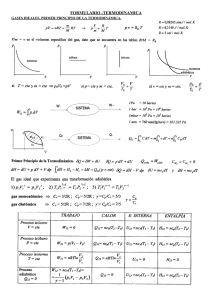
3 TERMODINAMICA
La termodinámica
de energía.
es el estudiode la temperatura,
el calory los intercambios
La palabratermodinámica
se derivade los términosgriegostherme= calor! dynamis=
fueza.
Calor, temperatura,energíainterna,trabajo,entropía.Algunosde estos términos son
utilizadosen la vida ordinariacon un significado
diferenteal que tienencuandose utilizan
por lo que produceuna dificultadadicionalen sl comprensión.
en un entornocientífico
La termodinámicaestudia las propiedadesde los cuerpos que son debidas a estar
formadospor un númeromuy elevadode partículas.
Para introducirlos conceptosbásicos
de la termodinámica
se simulael sistemamas sencillo.un gas idealocupandoun recinto
de volumenV.
Un gas ideal esta formadopor un conjuntode partículasque se mueven chocando
que lo contiene.
elásticamente
entresi y con las paredesdel recipiente
El choquede las partículas
con las paredesda lugara la presión,P, la sumade la energía
de todas las partículasconstituyela energíainternadel sistemaa la que nos referiremos
con la letra U. Otra magnitudque caracterizael sistema es la temperaturaT, esta
magnitudviene relacionadadirectame,nte
con la energía media por pañículade nuestro
sistema.
y estudiaremoscómoestánrelacionadas
En los siguientesapartadosintroduciremos
estas
magnitudes,presión P, volumenV y temperaturaT, en un gas ideal para introducir
posteriormente
el conceptode calor Q y de trabajoW lo que nos permitiráenunciarel
primerpripcipiode la termodinámica.
Posteriormente
introduciremos
la entropía,S, relacionadacon el númerode formasque
tieneun sistemamicroscópico
de distribuirse
en variascircunstancias.
3.1 Temperatura.Termómetrosy escalas de
temperatura: Celsius, F?hrenheit y Kelvin.
Definiciónde calor.
3.1.l Calor-Temperatura-Energía tnterna
Estos tres conceptos,calor, temperaturay energía interna, están relacionadospero
representanconceptosbien diferenciados,
vamosa realizaralgunasexperienciasque nos
ayudena trabajar
las
siguientes
afirmaciones:
-Q,
r CALOR,
es una energíaen transito,energíatransferidaentre dos sistemasa
distintatemperatura,
no debemoshablarde calorde un cuerpo.
. ENERGÍA INTERNA,U, es la suma de todas las energíasde todas las partículas
que formanun cuerpo.
'
TEMPEMTURA,T, es unaenergíamedia
Calor v Temperatura
Medianteel contactode la epidermiscon un objetose percibensensaciones
de frío o de
calor. Los conceptosde calor y frío son totalmenterelativosy sólo se puedenestablecer
como,por ejemplo,la manodel hombre.
con la relacióna un cuerpode referencia
Lo que se percibecon más precisiónes la temperatura del objetoo, más exactamente
todavía,la diferenciaentrela temperatura
del mismoy la de la manoque la toca.
Ahora bien, aunque la sensaciónexperimentadasea tanto más intensa cuanto más
elevadasea la temperatura,se trata sólo una apreciaciónmuy poco exactaque no puede
considerarsecomo medida de temperatura.Para efectuaresta última se utilizan otras
propiedadesdel calor,como la dilatación,cuyosefectosson susceptiblesde medir.
Un experimento característico es el
llamado del anillo de Gravesande. Este
aparato se compone de un soporte del
que cuelga una esfera metálica cuyo
diámetro es ligeramente inferior al de un
anillo el mismo metal por el cual puede
pasar cuando /as dos piezas están a I a
misma temperatura.
Si se calientala esferadejando el anillo a
la temperaturaordinaria, aquella se dilata
y no pasa por el anillo; en cambio puede
volver a hacerlo una vez enfriada o en el
caso en que se haya calentandol'
simultáneamenteyalamisma
temperaturala esferay el anillo.
Con muy pocas excepcionestodos los cuerpos aumentande volumen al calentarsey
diminuyencuandose enfrían
La dilataciónes, por consiguiente,
una primerapropiedadtérmicade los cuerpos,que
permitellegara la nociónde la temperatura.
La segundamagnitudfundamentales la cantidad de calor que se supone recibeno
cedenlos cuerposal calentarseo al enfriarse,respectivamente.
La cantidadde calor que hay que proporcionara un cuerpopara que su temperatura
aumenteen un númerode unidadesdeterminado
es tantomayorcuantomás elevadaes la
rnasa de dicho cuerpo y es proporcionala lo que se denominacalor específico de la
sustanciade que estáconstituido.
Cuandose calientaun cuerpoen uno de sus puntos,el catorse propagaa los que son
próximosy la diferenciade temperaturaentre el punto calentadodirectamentey otro
situadoa eiertadistanciaes tantomenorcuandomejorconductodel calores dichocuerpo.
Si fa conducübilidad o conductancia térmica de un cuerpoes pequeña,la transmisión
del calorse manifiestapor un descensorápidode la temperatura
entreel puntocalentado
y otro próximo.
Así sucedecon el vidrio,la porcelana,
el caucho,etc. En el casocontrario,por ejemplocon
metalescomo el cobrey la plata,la conductibilidad
térmicaes muy grandey la disminución
de temperaturaentreun puntocalentadoy el otro próximoes muy reducido.
Se desprendede lo anteriorque el estudiodel calorsólo puedehacersedespuésde haber
definidode una manera exacta los dos términos relativosal propio calor, es decir, la
que se expresaen grados,y la cantidadde calor,que se expresaen calorías.
temperatura,
Definición de calor. Calor es una energíaen transitoentre dos sistemaspuestosen
contactoque se encuentrana distintatemperatura.
El terminocalor es utilizadoen la vida ordinariacon un significadodiferenteal expuesto
por lo que,en la mayoríade los casos,se tieneuna ideapreconcebida
falsa.
Transferenciade enerqía entre dos cuerpos a distinta temperatura.
Supongamosque tenemosdos sistemasA y B (gasesideales)formadospor 100 y S0
partículasrespectivamente.
El primero,A partículasblancas,poseeuna ciertaenergíainternay una ciertatemperatura
que podemosobservaren sus respectivasventanas.El segundosistema,B partículas
rojas,tieneenergíainternacero y, por lo tanto,temperaturacero.
Diremosque dos sistemasentranen contactotérmicocuandolos ponemosjuntos de tal
maneraque sus partículaspuedenchocar,y por lo tanto,intercambiar
sus energías.
Las partículasdel sistema B se encuentranen reposo lo cual correspondea una
temperaturaabsolutade cero grados,además los sistemasson planos para que al
ponerlosen contactola interacciónentre las partículasde ambos sistemassea lo mas
eficazposible.
El sistemaA cede energíaal B al chocarlas partículasde ambossistemas.A la energía
que por este procedimientose transmitese la denominacalor y lo representamoscon la
letraQ.
Se produce una transferenciade energía a nivel microscópico.Entendemos por
transferenciade energíaa nivel microscópicola que realizandos sistemasal ponerseen
contactotérmicoes decir,las partículasde un sistemapuedenchocarcon las del otro por
lo que las que tienenmas energía:mas temperatura,
cederánenergíaa las del sistema
con menortemperatura,
esta transferencia
terminacuandoambos sistemasalcanzanla
mismaenergíamedia:la mismatemperatura.
La sumade las energíasde los dos sistemaspermanecerá
constantee iguala la energía
inicialdel sistemaA dadoque el B tieneenergíainicialnufa.
3.i.2 Temperatura
La temperatura
es una medidade la energíacinéticamediade las moléculasde un objeto.
Una propiedadfísicaque varía con la temperaturaes una propiedadtermométrica.
Por
ejemplo,la resistenciaeléctricade un cableconductorvaríacon la temperatura.
Si ponemosuna barracalientede cobre en contactocon una barrafría de hierro,la barra
y la de hierrose dilata,indicandoque se calienta.Al cabo
de cobrese contraeligeramente
de un tiempoel procesose detienepuestoque las dos barrashan llegadoa una situación
de equilibrio
térmicoentreellas.
Si dos objetosestánen equilibrioy térmicoconun tercero,tambiénestaránen equitibrio
térmico
entreellos.
Si en lugarde ponerlas dos barrasen contactomutuolas introducimos
en un lagoa cierta
distanciauna de otra, la barra calientede cobre se enfría calentandoel lago (de forma
negligibledebido al tamaño relativodel lago).Análogamente,la barra fría de hielo se
calienta(enfriando
el lago).Si una vez han llegadolas dos barrasal equilibriotérmicocon
el laog,las ponemosen contactoningunase dilataráo contraerápues tambiénestánen
eguilibrio
térmico.Es el llamadoprincipiocerode la termodinámica:
Paramedirla temperaturade un cuerpose usa la propiedadtermométrica
de la dilatación
(o contracción)
de sustancias.
Se usa ampliamente
el mercurio(Hg)situadodentrode una
columnade vidrio.En contactocon un objetocaliente,el mercuriose dilata(o contrae)
más que el vidrioque lo contieney aumenta(odisminuye)
la longituddel mercurioen la
columna.
Introduciendo
el termómetroen una mezclade aguay hieloen equilibrioa una presiónde
1 atmósfera.
Cuandola columnade mercuriodejede variarel termómetrose encuentraen
equilibriocon el hielo y el agua, Por tanto se encuentraa la misma temperaturaque el
punto normalde congelacióndel agua que equivalea 0 gradosen la escalaCelsius(o
centígrada).
A continuaciónel termómetrose introduceen agua hirviendoy cuandose
detienesu dilataciónel termómetrose encuentraa la temperaturanormalde ebullición
del
agua. Esta temperaturacorrespondea 100 gradosen la escala Celsius.Dividiendola
longitudde la columnadel mercurioentreestosdos puntosen 100 partesobtenemosuna
escalacentígradapara medir la temperatura.
Fahrenheit
elaboróuna escalaparaque todaslas temperaturas
fueranpositivas.
Aplicóel
0 a la temperaturade una mezclade hielo y agua saladay a la temperaturanormaldel
cuerpo humano96 grados (por ser un númerocon muchos divisores).Posteriormente
ajustÓla temperaturade ebullicióndel agua a un númeroentero,212 oF (con lo que la
temperaturamedia del cuerpohumanocorrespondea algo más de 97 grados). En esta
escalael puntode congelación
del aguacorresponde
a 32 oF.
Escalasde mediciónde la temperatura
Las dos escalasde temperaturade uso común son la Celsius(llamadaanteriormente
"centígrada")y la Fahrenheit.Estas se encuentrandefinidasen términosde la escala
Kelvin,que es las escalafundamental
de temperatura
en la ciencia.
La escalaCelsiusde temperaturausa la unidad"grado Cetsius"(símbolooC), igual a la
unidad"Kelvin".Por esto,los intervalosde temperatura
tienenel mismovalornuliérico en
las escalasCelsiusy Kelvin.La definiciónoriginalde la escalaCelsiusse ha sustituidopor
otra que es más conveníente.
Sí hacemosque Tc represente,la
escalade temperatura,
entonces:
Tc = T -27g,15
relacionala temperaturaCelsiusTc (oC)y la temperaturaKelvinTCK).Vemosque el punto
triple del agua (=273.16oK
por definición),correspondea O.01oC.
La escala'Celsiusse
definióde tal maneraque la temperaturaa la que el hieloy et aire saturadocon agua se
encuentranen equilibrioa la presiónatmosférica- el llamadopuntode hielo - es OóCy la
temperaturaa la que el vapory el agua liquida,estánen equilibrioa 1 atm de presión-el
llamadopuntodel vapor-es de 1OOoC.
La escala Fahrenheit,todavíase usa en algunospaísesque empleanel idioma ingles
aunqueusualmenteno se usa en el trabajocientífico.Se defineque la relaciónentre las
escalasFahrenheity Celsiuses:
.De esta relaciónpodemosconcluirque el puntodel hielo(0 "C) es igual a32.0 oF,y que et
punto del vapor (100 oC)es iguala 212 oF, y que un grado Fahrénheites exactamente
igual del tamaño de un grado Celsius.Entre los puntosde fusióny de evaporacióndel
aguahay 180gradosFahrenheit.
F=1,8xC+32
C_
F -32
1,8
Presión
La presiónque ejerceun gas es debidoal choquede sus partículas
con las superficies
con
las que se encuentraen contacto.
3.1.3 ENERGíA INTERNA
La sumade la energíade todaslas partículasque formanun sistemaconstituyela energía
interna,U, de dichosistema.En gases ideatesla energíainterna,U, solo dependede su
y del númerode partículas
temperatura
que lo forman,no importaque volumenocupan.
Calores Específicos y Principio d9 Equiparticion
Estudio microscópico del modo en que un gas ideal absorbe o cede energía
Uno de los grandeséxitosde la teoríacinéticade los gaseses su capacidadpara predecir
la capacidadcaloríficade los mismoses decir, la energíaque tenemosque suministrarles
paraque aumentenun gradosu temperatura.
En el caso de gasesidealesmonoatómicos
la energíacinéticamediade las moléculases
iguala (.) kT 3/2 , esta energíaes la únicaforma de energíaque poseen,si asociamos
una energíakTl2 a cada uno de los tres ejes de coordenadas
x, y, z, á lo largode los
cualesse puedenmovernuestraspartículas,
decimosque un gas monoatómico
póseetres
gradosde libertad,tres formasde ahsorbg¡encroíe,lo eualnos indicqque:
ü.;{,lllta 7;l *r
Xtil:}
La capacidadcaloríficamoleculara volumencanstantees 3/2 de la constantede Boltzmann,
mostrandoestedatoun granacuerdocon lasmedidasexperimentales.
caloríficaes mayorlo cual nos
En el caso de gasespoliatómicosel valorde la capac¡dad
indica que las moléculasposeen más formas de absorber energía, necesitamos
más energíaparaaumentarun gradosu temperatura.
suministrar
(.) TIPLER.FIS¡CA.15.5Interpretación
Teoríacinéticade los
molecularde la temperatura.
gases.
3.1.4Capacidad calorífica. Calor específ¡co.
La capacidad calórica de un sistema es el calor que debe recibir para que su
temperaturase eleve un grado.
Q=CAT=mcAT
El calor específico es la capacidad calóricapor unidad de masa:
C
v-
m
la caloríaes una unidadde energíatérmicadefinidacomo la cantidadde energíatérmica
que deberecibirun gramode agua para que su temperatura
se eleveun gradoCelsius(o
para elevar un grado
necesaria
fgVU). La kilocaloríaes la cantidadde energíatérmica
"caloría"
para
energéticode
medir
el
equivalente
kilogramo
La
usada
un
de
agua.
Qetsirlp
los alimentoses en realidadla kilocaloría.En el Sl la unidades el Joule.
1 cal = 4,18J
i,
i^'
/r
TermalUnit)definidacomoIr X
En el sistemainglésla unidadde calores la BTU(British
de unalibra
la temperatura
necesariapara
elevarun gradoFahrenheit
6i
iil.:,lifr1""?Hrsía
1 Btu = 252cal= 1,05kJ
El calorespecíficodel aguaes
= 1 kcal/kg'Co
= 1 kcal/kg'Ko
C"n,.= 4,18kJ/Kg'K= 1 cal/g'Co
I Co es el intervalo de temperatura correspondientea un grado. Nófese la diferencia con 1 oC,
temperatura1 grado por encima de cero grados.
:
3.1.5 Transmisión del calor: conducción, convección y radiación.
Conducción
de calor desde una regiónde alta temperaturaa una
La conducciónes la transferencia
moleculardirectaen el interior
regiónde temperaturamás baja a travésde comunicación
de un medio o entre medios en contactofísico directo sin flujo del medio material.La
de energíapuedeser, en primerainstancia,por impactoelásticocomo en un
transferencia
o vibraciones
fluido;por difusiónlibrede electronescomo predominaen los materiales,
de
electrones(Fonón)como predominaen los aisladores.En otras palabras,el calor es
por conducción
vibranunoscontraotros,o cuando
transferido
cuandoátomosadyacentes
es mayoren sólidos,cuando
los electronesse muevende un átomoa otro.La conducción
los átomos están en contacto constante.En líquidos(exceptocuando son líquidos
rl
ll
v)
.\
metálicos)y gases, las moléculasestán aleatoriamente
separadas,dándoleuna menor
oportunidad
a estasel chocary transferirla energíatérmica.
Los metales(por ejemploel cobre)son usualmentelos mejoresconductoresde energía
térmica.Estoes debídoa la maneracomolos metalesestánenlazadosquímicamente:
Los
enlacesmetálicos(a diferenciadel enlacecovalenteo del enlaceiónicojtienenelectrones
en movimientolibre y formanuna estructuracristalina,ayudando,en gran medida,a la
transferencia
de energíatérmica.
Los fluidos(líquidos(exceptolos metaleslíquidos)y gases) no son típicamentebuenos
conductores.
Esto es debidoa la gran distanciaentre átomosen los gases:a menores
colisionesde átomoshay menosconducción.
A medidaque la densidáddisminuye,así
tambiénla conducción.La conductividad
de los gases aumentacon la temperaturapero
solo levementea presionescercanaso por encimade la atmosférica.La conducciónno
apareceen el vacío perfecto.
Para cuantificarla facilidadcon la cual un medio en particularconduceel calor, los
ingenierosemplean la conductividadtérmica, conocida también como constante de
conductividado coeficientede conducción,k. Se definek como "la cantidadde calor,e,
transferidaen un tiempo t, a través de una togitud L, en una dirección perpendiculara una
superficiede área A, debido a una diferenciade temperaturaAT'. La conductividadtérmica
es una propiedadde los materialesque es primordialmente
dependientede la fase del
medio,la temperatura,
la densidady la interacción
morecular.
Un tubo de calor es un dispositivopasivoque se construyede maneraque actúe como si
tuvieraconductividad
térmicaextremadarnente
alta.
Convección
La convecciónes la combinaciónde conduccióny transferenciade energíatérmica a
travésde fluidosen movimiento.
A diferenciade conducciónpura un fluidoen movimiento
estáenvueltoen la convección.Estemovimiento
ocurreen fluidoso en el interiorde ellos,
perono en sólidos.Porqueen estos,las partículas
mantienensu posiciónrelativahastatai
puntoque no se permiteel movimientode las mismas,y por lo tanto la convecciónno
puedeocurrir.
La convecciónsucedeen dos formas:convecciónnaturaly convecciónfozada.
En la convecciónnatural,el fluidocirculaalrededorde una fuente de calor, se vuelve
menosdensoy se eleva.Entoncesen los alrededores,
el fluidomás frío se muevepara
remplazarlo.Este fluido frío es entoncescalentadoy el proceso continúa,formandola
convección.La tuerzaimpulsorade la convecciónnaturales la flotabilidad,como resultado
de las diferenciasen la densidaddel fluidocuandola gravedado cualquierotro tipo de
aceleración
esta presenteen el sistema.
La convecciÓnforzada, en contraste,ocurre cuando bombas, ventiladoresu otros
mecanismosson usados para impulsarel fluido y crear una convecciónartificialmente
inducida.
La transferencia
de calor por convecciónfozada se denominaa vecesadvecciónde calor.
Perola advecciónes un procesomás general,y en la advecciónde calor,ta sustanciaque
estásiendo"adveccionada"
en el campodel fluidoes simplemente
cator(En vez de masa,
la cual es el otro componentenaturalen dichas situaciones,como la transferenciade
masay la transferenciade calorcompartengeneralmentelas mismasecuaciones).
En afgunossistemasde transferenciade calor,tanto la convecciónfozada como la natural
contribuyensignificativamente
al índicede transferencia
de calor.
Paracalcularel índicede convecciónentreun objetoy su alrededorlíquidose empleael
coeficienteconvectivo de transferenciade calor, h. A diferencia de la conductividad
térmica,el coeficienteconvectivono es una propiedadde! material.El coeficiente
convectivodependede la geometría,fluido,ternperatura,
velocidady otras características
del sistemaen el cual la convección
ocurre.
i)áfjio¡s :i
ri+ tS$
Radiación
La radiaciónes un procesopor el cualfluyecalordesdeun cuerpode alta temperaturaa
un cuerpode bajatemperatura,
cuandoéstosestánseparadospor un espacio,inclusiveel
vacíoabsoluto.
La energíatransmitidade esta formase denominacalorradianteo energíaradianteque
que )aluz visibleordinariay viajaa una velocidadde 300 OO0"\-¡ .¡
es de la mismanaturaleza
Km/s.(3 x 1010cm/s)con la diferencia
únicamente
en sus respectivas
longitudes
de onda.
La cantidadde energíaradiante(e)puedeevaluarsemediantela siguienteexpresión:
e= of
Donde:
= 0,1741x 1O-8
o = Constantede Stefan-Boltzman
BTU/ft2oR
=
T Temperaturaen gradosabsolutos
Cuando la radiaciónincide sobre un cuerpo es parcialmenteabsorbida,parcialmente
reflejaday parcialmente
transmitidaa travésdel cuerpo.
L u e g o : o ¿ + p r r= 1
c¿: Fracciónabsorbidao absorbancia
p : Fracciónreflejadao Reflexión
r : FracciónTransmitidao trans'misividad.
Consideremosel intercambiode calor radianteentre superficies,
eR un medio que no
que puedeser el vacíoo aire a bajatemperatura.
absorbe,emiteni dispersala radiación,
La radiaciónde superficiesrealesdifiereen varios aspectosa la radiacióndel cuerpo
negro,mientrasque la energíaradiadapor un cuerponegroes:
t=ol*
un cuerporeal radiamenosenergíaque un cuerponegroa la mismatemperatura
a=g6l'
La emisividades funciónde la longitudde onda. En los materialesque son buenos
conductoreseléctricostales como el cobre, aluminio,etc., la emisividaddecrececon el
aumentode la longitudde onda.En los materialesno conductores
de la electricidad
como
la arcilla,plástico,loza,etc.,su emísividad
aumentacon la longitudde onda.
Para cálculos de transferenciade calor se requiereuna emisividadpromedioo una
absorbanciapromediopara la banda de longitudesde ondaen la que emiteo absorbela
mayorpartede la radiación
Para dos cuerposradiadoresde igualgeometríaa temperaturasTt y Tz el calortransferido
ES:
Qr=oA(T.'o-Tro)
Para dos cuerpos reates de igual geometría a temperaturasT1 y Tz el calor neto
transferidoserá:
e,r#
-+
Gr
-Ér
I
Paradoscuerposrealesde geometríadiferente,el calor netotransferidoserá:
1, :
Fnflrilta(1l',t
-Trt)
Siendo:
Fa . Factorde visión llamadotambiénfactor de ángulo,que tiene en cuentael ángulo
sólidomediocon que una superficie
ve a otro.
Fe : Factor que depende de las emisividades individualesy en algunos casos de
la
relación de áreas.
Muchasveces en ingenieríaes convenienterepresentarel efectoneto de la radiaciónde
la mismaformaempleadaen la convección:
,^/t
4, =h,ArFr-Tr)
Dondeh, es el coeficientede transferenciade calorpor radiación
3.2Expans¡ón
volumétrica.
Desdela antigüedadse conocepor experiencia
diariaque algunassustanciasy cuerpos
sólidosse dilatancuandose calientany se contraencuandose enfríandenominándosele
genéricamenteal efecto dilatacióntérmica.De hecho este fenómenoes una de las '
propiedadestermométricasampliamenteusadaspara la medidade la temperatura.Hoy
día sabemosque la mayoríade los cuerpossólidos,líquidosy gases presentaneste
fenómenoen todas direccionesen una u otra magnitud.Podemoshablar entoncesen
términosde la dilataciónlineal o longitudinalde un cuerpo sólido y de la expansión
volumétrica
de un líquidoo un gas siemprey cuandosupongamos
que la masa del cuerpo
permanece invariable durante la manifestaciónde esta propiedad termométrica.
primerola dilataciónlinealde un cuerposólidoque se encuentraa presión
Considere.mos
constante'en una direcciónx. Experimentalmente
se conoce que todos los cuerpos
sujetosa una variaciónde temperaturadentrode los límitesnormalmenteencontradosen
el laboratorio,
se dilatanpor una cantidadAx = x - & la cual es directamenteproporcionala
su diménsióniniciálXoy a lá VaiiáeiónAT = T - To ds h témpéiátura.ASí qué podemos
expresarestefenómenode la forma:
[3.4.1]
Ax=ox(T)xoAT
En dondeox (T) representael coeficientede dilataciónlinealen la direcciónx y el cual
dependeligeramentede la temperaturay de la direcciónde dilatación.Los cambiosde
dimensiónproducidosen los sólidospor la variaciónde temperatura
son usualmentemuy
pequeños,por lo tanto,matemáticamente
es más apropiadousar el cálculodiferenciale
integraly reemplazarlas variacionesAx y AT por diferenciales
dx y dT e integrarentre tos
límitesde dimensiónx, x0 y de temperatura
T, Ts páraobtenerque la longituáa cualquier
temperaturaT está dada por:
Í3.4.21
x(r)
f¡T\
* Jr"e r(f)dTj
"oLl
Esta expresiónes un poco compleja y difícil de utilizara menos que se conozca con
certitudy de antemanola variacióndel coeficientede dilataciónlineatcon la temperatura.
Por lo generaleste coeficienteno varia mucho ni con la temperaturani la direcciónen el
sólido,así que lo podemosconsiderarconstanteo por lo menos reemplazarpor un valor
promedioentre los limitesde variaciónAT. En particular,si el sólidoes isotrópico,es decir,
tiene las mismaspropiedadesen todas direcciones,entoncesel coeficientede dilatación
lineales el mismo en cualquie.r
dirección.Si la dimensiónla representamos
como una
longitudL y la dilatacióncomoAL=L-Loentoncesla ecuación3.4.1se puedeponercomo:
Al- = ]r LoAf
[3.4.3]
En tantoque la ecuaciónl3.4.2lquedade la forma:
'
El coeficiente de dilatación también depende de la presión sin embargo esfa dependencia es
menor que su dependenciacon la temperaturav oor lo fanto es un termino de tercer o cuarto orden.
?? dc f ii$!
F?á$i¡ra
¿(r)
La{t+a aI)
Si se deseaconocerel coeficiente
de dilatación,
estese puededespejarde
y expresarde la forma:
ü=
[3.4.41
13.4.41
1A¿
{_o
ar
sl
[3.4.
Se puedeobservarque la dilataciónlinealrepresenta
et cambiofraccionalde long1udpor
unidadde variaciónde la temperaturay sus unidadesson (grados)-1por lo cual su
magnituddependede las unidadesde temperatura.
Ahora consideremosla expansiónvolumétrica,
esto es la expansiónen volumende un
cuerposÓlidoy la cual denotaremos
con el símboloB. Medianteargumentosde la Física
de sólidosse puede demostrarque para sólidosanisotrópicos,
es decir cuerpos que
poseenpropiedadesdiferentesen diferentesdireccionescomo ocurreen los cristales,se
puededemostrarque la expansióntérmicavolumétrica
se puedeexpresarcomo:
9=oil*qt
[3.4.5]
en donde *.or sort los coeficientes
de dilataciónlinealen las direccionesparalelay
!il
perpendicular
al eje de simetríadel cristal,respectivamente.
Es interesante
notarque si el
sólido es isotrópicoentoncesse cumple que o¡ = qr y así lB= 3Iq. Para sólidos
isotrópicosasí como para líquidosy gases se iuede deducir una expresiónpara la
expansióntérmicavolumétricaa partirde la ecuacion13.4.41.
Supongamosun cuerpoo
sustanciade volumeninicialVs=Lexl-oyLoz
y que por acciónde la expansióntérmicasus
coordenadasaumentanpor ALx, ALy, ALz y su volumenaumentapor un elementode
volumenAV=V-Vocomo se ilustraen la figura [1]. El cambio de longituden cualquier
direcciónestá dadopor la ec.13.4.41
así que podemosescribirel volumenfinalcomo:
l/ =
L* LyL, =
Lox Loy Loz(l+a LT)3-
ro [r+3cra T + 3a] (¡ r)' + d3 (¡ r)'.|
[3.4.61
que la magnituddel coeficientede ditataciónes muy pequeña(véase
Si consideramos
tabla 1), entonces los términos cuadráticosy cúbicos en el producto qAT son
despreciables.En consecuenciapodemos escribir la ecuación 1.2-7 en la forma
aproximada:
f = Ho[t+3{rAfJ
13.4.71
Si ahora definimos:IF= 3Iq, de nuevo obtenemosel coeficientede expansión,
proporcionado
volumétrica
por la teoríade sólidosy podemosescribirla ecuaciónt3.4.gl
en la formatípicaacostumbrada
parala expansióntérmicavolumétrica
en líquidosy gases
de la forma:
AH= V'[P¡rJ
[3.4.8]
f:*gi*,t ?li cit 'lü$
llustración 1 Expansión volumétricade un sólido.
Es fácil demostrarque la expansiónsuperficial,esto es la expansiónde un sólido
en dos dimen'siones
se puedeexpresarcomo:
4,4= AAF+:FAfl
[3.4.e]
En la tabla 3.4.2 se presentanalgunosvaloresde coeficientede dilataciónlineal y de
expansiónvolumétrica.Queda claro de esta tabla que los sólidosposeenu.ncoeficiente
Ineno.rque los líquidosy estosmenorque la de los gasescon ordenesde magnitudde 10", 10-"y 10-"respectivamente.
La mayoríade estoscuerposposeenun coeficientepositivo
a temperaturaambiente;sin embargo,unos pocos poseen un coeficientenegativo.En
algunossólidoscristalinos
el coeficiente
de dilatacióndisminuyecon la temperaturaen un
poco por ciento aproximándosea cero a medida que desciendela temperaturay en
algunos otros como los semiconductoresésta variación es de tal naturatezaque el
coeficientecambia de signo a temperaturasmuy bajas (ver tabla de temperaturas).Sin
embargo,los cambios en dimensionesasociadosa los cambios en la magnituddel
coeficientede dilataciónson más bajos que los cambiosasociadosa la variaó¡ónde la
temperatura.
B (oc)" xlOo a
Aluminio
0,5- 212
7,9- 14,1
25 - 300 0K
0.18175
Tabla3.4.1 Coeficientesde dilataciónlinealy volumétrica(Tomadode: American lnstitute)
3.3 Primera y
termodinámica.
segunda leyes de
la
Energíacalorífica:La suma de la energíapotencialy de la energíacinéticade un sistema
no permanecesiempreconstante.
De una manera general,la energía mecánicatotal de un sistemadisminuyecon el
frotamientoy los choques.Si por ejemplo,se frena un cuerpodurantesu caída por un
plano inclinado,de forma que su velocidadpermanezcaconstante,se produciráuna
disminución
de su energíapotencialsin que aumentesu energíacinética.Pero, en todos
los fenómenosde esta naturalezase producecalor.
Así el fósforo de las cerillasse inflamapor frotamiento,las herramientasse calientanal
labrarlos metales,etc. Sí una bala de plomose disparacontrauna placa de acero, se
puede alcanzar,en el momento del choque, una temperaturasuperiora su punto de
fusión.
El calordebe,por consiguiente,
considerarse
como una formade energía,hipótesisque
se ve corroborada
por la posibilidad
de producirtrabajomecánicoconsumiendo
calor,por
ejemplo,en las maquinasde calor.
Otras formas de energía:eléctrica.La corrienteeléctricaes uno de los numerosos
fenómenosque puedenproducirtrabajomecánicoo calor.La primeratransformación
se
realizaen los motoresy la inversade los generadoreselectromagnéticos
de corriente
(dínamos,alternadores).
En todos los conductores
por los que pasan una corrientehay una producciónde calor,
conocidacon el nombrede efectode joule; la transformación
contrariadirecta,es decir de
calor en electricidad,
se observaen las pilastermoeléctricas
y bastacalentaruna de las
dos soldadurasde dos metalesdiferentesque formanpartede un circuitopara que se
engendreen el mismouna corriente.De ellosse deduceque existeenergíaetéctricay que
el pasode una corrientees en realídadun transporte
de energíaa lo largode un circulto.
Un condensadorcargadode corrientetambiénenergíaeléctrica,puestoa descargarsees
capazde produciruna corriente,pero esta energíaes potencial.
químicastienenlugarcon absorcióño desprendimiento
Química:Las reacciones
de calor,
según los casos. La combustión,que es la combinacióndel oxígeno del cuerpo
combustibleo con los elementosque lo integran,revelanque una muestrade carbóny
oxigenocontieneenergíaquímicapotencial,que puedeutilizarse
al iniciarta combustiónó
la combinación
de amboscuerpos.
La energíaquímicase empleaa si mismoen las pilasy acumuladores
eléctricos,que la
transformanen energíaeléctrica,y el fenómenoinversose produceen la electrólisis,en
particular
al cargarlos acumuladores.
Las explosionesson un ejemplo de transformaciónde energía química en trabajo
mecánico.
Radiante:La luz se producede diversasformas,pero la más corrientede éstas consiste
en calentarcuerposa una temperaturabastanteelevada(lámparade gas, Lámpara
eléctricade incandescencia).
La incandescencia
es precisamentela transformación
de
energíacaloríficaen energíaradiante.
En los fenómenosde luminiscencia,
o emisiónde luz en frío, intervieneotra forma de
energíaque es mecánicaen el caso de la tribolumiscencia.
La rupturade ciertoscristales
que se producenpor ejemploal machacarazúcarprovocala apariciónde luz.
En la electrotuminiscencia,
la energíaeléctricase transformadirectamente
en luz sin que
pase por la formacaloríficaintermedia.
Así acordeen los tubosde gas rarificadocomo el
neón y los vaporesde sodio y mercurio.En la quimioluminiscencia,
algunasreacciones
químicas,como la oxidaciónlenta del fósforo blanco en contactodel aire, provocan
emisiónde luz, sin calentamiento
apreciable.La luz emitidapor las luciérnagas
se debe a
un fenómenoanálogo,puestoque producede las reaccionesquímicasqué se producen
durantela digestión.
La energía radiante puede convertirseen cualquierade las otras cuatro formas de
energíasque se han considerado.Así, cuando una sustanciaabsorberadiaciones,se
calientay este efecto caloríficoes particularmente
intensoen el caso de las radiaciones
infrarrojas
f r a g i r r . *$ { } d r i { $
Por otra parte,los hacesluminososdirigidoshacialos cuerposejercenen estos una fueza
de empuje que produceefectosmecánicosy recibeel nombre de presión de radiación,
fenÓmenosque explica la repulsiónde la cola de cometas por tos rayos solares. La
transformación
de energíaluminosaen energíaeléctricatiene lugar en la fotoelectricidad
al captárseloselectronesque emitenalgunosmetalescuandorecibela luz. Estefenómeno
ha dado lugar a innumerablesaplicacionesprácticas, entre las cuales pueden
mencionarse
el cinesonoroy la televisión.
Las modificacionesquímicassufridaspor los cuerpos bajo la influenciade la luz son
numerosasy constituyenel objeto de la cienciadenominadafotoquímica,que estudia la
transformación
de la energíaluminosaen energíaquímica.Las plantasrealizanesta
graciasa la clorofila,que absorbelas radiaciones
transformación
solares,y la energíaasí
almacenada
se empleaparasintetizarlos alimentoshidrocarbonados.
3.3.1 Primera ley de la termodinámica
Permítaseque un sistemacambiede
un estadoinicialde equilibrio,a un
estado final de equilibrio, en un
caminodeterminado,siendo el calor
absorbidopor el sistemay el trabajo
hecho por el sistema. Después
calculamos
el valorde. A continuación
cambiamos el sistema desde el
mismo estado hasta el estadofinal, pero en esta ocasión por u n camino diferente.Lo
hacemosesto una y otra vez, usandodiferentescaminosen cada caso. Encontramosque
en todoslos intentoses la misma.
AU-Q-W
W
->
Esto es, aunque y separadamente
dependendel camino tomado, no depende,en lo
absoluto,de cómo pasamosel sistemadel estadoal estado,sino solo de los estados
inicialy final(de equilibrio).
Del estudiode la mecánicarecordará,
que cuandoun objetose muevede un puntoinicial
a otro final,en un campogravitacional
en ausenciade fricción,el trabajohechodepende
solo de las posicionesde los puntosy no, en absoluto,de la trayectoriapor la que el
cuerpose mueve.
De esto concluimosque hay una energía potencial,función de las coordenadas
espacialesdel cuerpo,cuyo valorfinal menossu valor inicial,es igualal trabajohechoal
desplazarel cuerpó.
Ahora,en la termodinámica,
encontramos
que cuandoen un sistema
experimentalmente,
ha cambiadosu estadoal, la cantidaddependensolo de las coordenadasinicialy final y
no, en absoluto,del caminotomadoentreestospuntosextremos.Concluimos
que hay uná
funciónde las coordenadastermodinámicas,
cuyo valor final, menos su valor iniciales
igualal cambioen el proceso.A estafunciónle llamamosfunciónde la energíaintema.
Representemosla funciónde la energíainternapor la letra. Entoncesla energíainterna
del sistemaen el estado,es solo el cambiode energíainternadel sistema,y esta cantidad
tiene un valor determinadoindependientemente
de la forma en que el sistemapasa del
estadoal estadof Tenemosentoncesque:
Como sucede para la energía potencial,también para que la energía interna,lo que
importaes su cambio. Si se escoge un valor arbitrariopara la energía interna en un
sistemapatrón de referencia,su valor en cualquierotro estado puede recibir un valor
determinado.
Esta ecuación se conoce como la primera ley de la termodinámica,al aplicarladebemos
recordarque se considerapositivacuandoel calor entra al sistema y qud será positivo
cuandoel trabajolo haceel sistema.
A la funcióninterna,se puedever como muy abstractaen este momento.En realidad,la
para ella,ademásque es una funciónde
termodinámica
clásicano ofreceuna explicación
(Por funcióndel estado,queremosdecir, que
estadoque cambiaen una formaprede,cible.
exactamente,que su valor dependesolo del estadofísicodel material:su constitución,
presión,temperaturay volumen.)La primera ley de la termodinámica,
se convierte
entoncesen un enunciadode la ley de la conservación
de la energíapara los sistemas
termodinámicos.
La energíatotalde un sistemade partículas,
cambiaen una cantidadexactamente
iguala
la cantidadque se le agregaal sistema,menosla cantidadque se le quita.
que sea positivacuandoel calorentraal sistema
Podráparecerextrañoque consideremos
y que sea positivocuando la energía sa/e del sistema como trabajo.Se llegó a esta
porquefue el estudiode las máquinastérmicaslo que provocóinicialmente
convención,
el
estudiode la termodinámica.
Simplementees una buena forma económicatratar de
obtenerel máximotrabajocon una maquinade este tipo, y minimizarel calor que debe
proporcionársele
a un costo importante.Estas naturalmentese conviertenen cantidades
de interés.
Si nuestrosistemasólo sufreun cambioinfinitesimal
en su estado,se absorbenada más
una cantidadinfinitesimal
de calory se hacesolo una cantidadinfinitesimal
de trabajo,de
tal maneraque el cambiode energíainternatambiénes infinitesimal.
Aunquey no son
podemosescribirla primeraley diferencial
diferencias
verdaderas,
en la forma:
en un
){rPodemos expresarla primeraley en palabrasdiciendo:Todosisfematermodinámico
ffi ' estadode equilibrio,tiene una variablede estadollamada energíainternacuyo cambio en
un procesodiferencial
estádadopor la ecuaciónantesescrita.
La primeraley de la termodinámica
se aplicaa todo procesode la naturalezaque parte de
un estadode equilibrioy terminaen otro. Decimosque si un sistemaesta en estadode
equilibriocuando podemosdescribirlopor medio de un grupo apropiadode parámetros
constantesdel sistemacomo presión,el volumen,temperatura,
campomagnéticoy otros
la primeraley sigueverificándose
si los estadospor los que pasael sistemade un estado
inicial(equilibrio),
a su estadofinal(equilibrio),
no son ellosmismosestadosde equilibrio.
Por ejemplopodemosaplicarla ley de la termodinámica
a la explosiónde un coheteen un
tamborde acerocerrado.
Hay algunas preguntasimportantesque no puede decir la primeraley. Por ejemplo,
aunquenos dice que la energíase conservaen todos los procesos,no nos dice si un
procesoen particularpuedeocurrirrealmente.
Esta informaciónnos la da una generalización
enteramentediferente,llamadasegundaley
y gran parte de los temas de la termodinámica
de la termodinámica,
dependende la
segundaley.
Hemosvisto como la energíainterna,U, de un sistemavaria porquevaría la energíade
sus partículas,esta energíapuedevariarde dos formas:a nivel microscópico
o a nivel
macroscópico.
Entendemos
transferencia
de energíaa nivelmicroscópico
la que realizandos sistemasal
ponerseen contactotérmicoes decir,las partículasde un sistemapuedenchocarcon las
del otropor lo que las que tienenmas energía:mas temperatura,
cederánenergíaa las del
sistema con menor temperatura,esta transferenciatermina cuando ambos sistemas
alcanzanla misma energíamedia:la mismatemperatura,a la energíaintercambiada
la
denominamos
calorQ.
Hemosvisto tambiéncomo si dejamosexpansionarun gas contraun pistónel gas realiza
pues la conservación
un trabajo,W, disminuyendo
su energíainternaU. Estableceremos
de la energía para estas magnitudeslo que se conoce como Primer Principio de la
Termodinámica.U=Q-W- ^
-.*0S^",. \út',
u q ^ , " L - T eA. ü J * J , & ,
& -yf*vw*a
ll.^Jt*u
* ? rJ" * . A-Rv
o ey
J
sn{*;r^* l.s*
por convenio,que el trabajoes
El signo menos''-ioponemosporque consideraremos,
posítivosi lo realizael sistemay negativosi se realizasobreel sistema.
)l*a
Vamos a realizaralgunasexperienciasen las que nos familiarizaremos
con esta expresión
en diversascircunstancias.
Primeramente
veremosuna experienciaen la que un gas se
expansionacontra una pared móvil, en el procesono hay intercambiode calor con los
alrededoresa este tipo de procesosen los que no hay intercambiode calor les llamamos
adiabáticos.
En el diagramaPV del procesoisotermola curvaque describeel procesoes una rama de
hipérboladado que al no variarla temperaturael productode la presiónpor el volumen
permaneceráconstanteno será así en el adiabático.
3.3.2 Segunda ley de la termodinámica.
Las primerasmáquinastérmicasconstruidas,
fuerondispositivos
muy eficientes.Solo una
pequeñafraccióndel calorabsorbidode la fuentede la altatemperatura
se podíaconvertir
en trabajoútil.
Aun al progresarlos diseñosde la ingeniería,una fracciónapreciabledel calor absorbido
se siguedescargando
en el escapede una máquinaa Qajatemperatura,sin que pueda
convertirseen energíamecánica.Siguesiendouna esperanzadiseñaruna maquinaque
puedatomarcalorde un depósitoabundante,como el océanoy convertirloíntegramente
en un trabajo útil. Entonces no seria necesariocontar con una fuente de calor una
temperatura
más altaque el medioambientequemandocombustibles.
De la mismamanera,podríaesperarse,que se diseñaraun refrigeradorque simplemente
transportecalor, desde un cuerpofrío a un cuerpocaliente,sin que tenga que gastarse
trabajo exterior.Ninguna de estas aspiracionesambiciosasviola la primera ley Oe ta
termodinámica.
La máquinatérmicasólo podríaconvertirenergíacaloríficacompletamente
en energíamecánica,conservándose
la energíatotaldel proceso.
En el refrigeradorsimplementese transmitiríala energíacaloríficade un cuerpo frío a un
cuerpo caliente,sin que se perdierala energíaen el proceso.Nunca se ha logrado
ningunade estasaspiraciones
y hay razonesparaque se creaque nuncase alcanzaÉn.
La segundaley de la termodinámica,
que es una generalización
de la experiencia,
es una
exposicióncuyos artíficiosde aplicaciónno existen.Se tienenmuchosenunciadosde la
segundaley, cada uno de los cualeshacendestacarun aspectode ella, pero se puede
demostrarque son equivalentes
entresí. Clausiusla enunciocomosigue:
,Jno*'o^
t
No es poslblepara una máquinaciclica llevar continuamentecalor de un cuerpo a otro que
esfé a temperatura más alta, sin que al mismo tiempo se produzca otro efecto (de
compensación).
h
Este enunciadodesechala posibilidadde nuestroambiciosorefrigerador,ya que éste
implicaque para transmitircalor continuamente
de un objetofrío a un objetocaliente,es
necesarioproporcionartrabajo de un agente exterior.Por nuestraexperienciasabemos
que cuando dos cuerpos se encuentranen contactofluye calor del cuerpo calienteal
cuerpofrío.
En este caso,la segundaley eliminala posibilidad
de que la energíafluyadel cuerpofrío
al cuerpocalientey así determinala direcciónde la transmisión
del calor.La direcciónse
puedeinvertirsolamentepor mediode gastode un trabajo.
Kelvin(con Planck)enunciola segundaley con palabrasequivalentes
a las siguientes:
es
completamenteimposiblerealizar una transformacióncuyo único resultadofinat sea el de
cambiar en trabajo el calor extraído de una fuente que se encuentre a ta misma
temperátura.
Esteenunciadoeliminanuestrasambicionesde la máquinatérmica,ya que implicaque no
podemos producir trabajo mecánico sacando calor de un solo depósito, sin devolver
ningunacantidadde calora un depósitoque estéa unatemperatura
más baja.
Para demostrarque los dos enunciadosson equivalentes,
necesitamos
demostrarque si
cualquiera
de los enunciadoses falso,el otrotambiéndebeserlo.Supóngaseque es falso
el enunciadode Clausius,de tal maneraque se pudierantener un refrigerador
que opere
sin que se consumael trabajo.
Podemosusar una máquinaordinariapara extraercalor de un cuerpo caliente,con el
objetode hacertrabajoy devolverpartedel calora un cuerpofrío.
Pero conectandonuestro refrigerador"perfecto"al sistema,este calor se regresaríaal
cuerpocaliente,sin gastode trabajo,quedandoasí utilizable
de nuevoparasu uso en una
máquinatérmica.De aquí que la combinación
de una maquinaordinariay el refrigerador
"perfecto"
formaráuna máquinatérmicaque infringeel enunciadode Kelvin-Planck.
O podemos invertir el argumento.Si el enunciadoKelvin-Planckfuera incorrecto,
podríamostener una máquinatérmicaque sencillamente
tome calor de una fuentey lo
conviertapor completoen trabajo.Conectandoesta máquinatérmica "perfecta"a un
refrigerador
ordinario,podemosextraercalor de un cuerpoordinario,podemosextraer
calorde un cuerpocaliente,convertirlocompletamente
en trabajo,usar este trabajopara
moverun refrigerador
ordinario,extraercalorde un cuerpofrío,y entregarlocon el trabajo
convertidoen calorpor el refrigerador,
al cuerpocaliente.
El resultadonetoes una transmisión
de calordesdeun cuerpofrío, a un cuerpocaliente,
sin gastartrabajo,lo infr"inge
el enunciadode Clausius.
La segunda ley nos dice que muchos procesos son irreversibles.Por ejemplo, el
enunciadode Clausiusespecíficamente
elimina una inversiónsimple del procesode
transmisión
de calorde un cuerpocaliente,a un cuerpofrío.Algunosprocesos,no sólo no
puedenregresarsepor sí mismos,sino que tampoconingúnacombinaciónde procesos
puede anular el efecto de un proceso irreversible, sin provocar otro cambio
correspondiente
en otra parte.
3.3.3 Tercera ley de la termodinámica.
En el análisisde muchasreaccionesquímicases necesariofijar un estadode referencia
parala entropía.Estesiemprepuedeescogersealgúnnivelarbitrariode referencia
cuando
para las tablasde vaporconvencionales
solose involucraun componente;
se ha escogido
g2oF.Sobrela basede las observaciones
hechaspor Nernsty por otros,Planckestableció
la terceraley de la termodinámica
en 1912,así:
La entropía de fodos los sólidos cristalinospeúecfoses cero a la temperaturade cero
absoluto.
Un cristal"perfecto"es aquel que esta en equilibriotermodinámica.
En consecuencia,
comúnmentese establecela terceraley en formamás general,como:
La entropía de cualquier sustancia pura en eguilibrio termodinámico tiende a cero a
medida que la temperaturatiende a cero.
La importancia
de la terceraley es evidente.Suministrauna base para el cálculode las
entropíasabsolutasde las sustancias,las cuales pueden utilizarseen las ecuaciones
paradeterminarla direcciónde las reacciones
apropiadas
químicas.
Una interpretación
estadísticade la terceraley es más bien sencilla,puestoque la entropía
se ha definidocomo:
En dondek es la constantede Bolzmalles la probabilidad
termodinámica.
En vistade la
anteriordisertación,la terceraley equivalea establecerque: cuando0.
Estosignificaque sólo existeuna formade ocurrenciadel estadod"
mínimapara
"nurgía
unasustanciaque obedezcala terceraley.
Hay varioscasos referidosen la literaturaen donde los cálculosbasadosen la tercera ley
no están desacuerdocon los experimentos.
Sin embargo,en todos los casoses posible
explicarel desacuerdosobre la base de que la sustanciano es "pura",esto es, pueda
haberdos o más isótoposo presentarse
moléculasdiferenteso, también,una distribución
de no equilibriode las moléculas.
En talescasoshay más de un estadocuánticoen el cero
absolutoy la entropíano tiendea cero.
Entropía.
La entropía,como todas las variablesde estado, dependensólo de los estados del
sistema,y debemosestar preparadospara calcularel cambioen la entropíade procesos
irreversibles,
conociendo
sólolos estadosde principioy al fin.
Consideraremos
dos ejemplos:
1. Dilataciónlibre: Dupliquemos
el volumende un gas, haciendoque se dilateen un
recipientevacío,puestoque no se efectúareacciónalgunacontrael vacío, y, como
el gas se encuentraencerradoentre paredesno conductoras,.por la primeraley se
entiendeque o: dondey se refierena los estadosinicialy final (de equilibrio).Si el
gas es ideal, depende únicamentede la temperaturay no de la presión o el
volumen,y la ecuaciónimplicaque.
En realidad, la dilatación libre es irreversible,perdemos el control del medio
ambienteuna vez que abrimosla llave.
Hay sin envergo,una diferenciade entropía,entrelos estadosde equilibrioinicialy
final, pero no podemoscalcularlacon la ecuación,por que esta relaciónse aplicá
únicamente'atrayectoriasreversibles;si tratamosde usar la ecuación,tendremos
inmediatamentela facultadde que Q = 0 para la dilataciónlibre - además - no
sabremoscomo dar valoressignificativosde f en los estadosintermediosque no
son de equilibrio.
Entonces, ¿Cómo calcularemos Sr - S, para estos estados?, lo haremos
determinando una trayectoria reversible (cualquier trayectoria reversible) que
conectelos estadosy I para así calcularel cambiode entropíade la trayectoria.
En la dilataciónlibre,un trayectoreversibleconveniente
que se tratede
(suponiendo
un gas ideal)es una dilataciónisotérmicade V¡ a V¡(=2V). Esto correspondea la
que se llevaa caboentrelos puntosa y b del ciclodel Carnot.
dilataciónisotérmica
Esto representaun grupo de operacionesmuy diferentesde la dilataciónlibre y
tienenen comúnla únicacondiciónde que conectanel mismogrupode estadosdó
y f. De la ecuacióny el ejemplo1 tenemos.
equilibrio,
Estoes positivo,de tal maneraque la entropíadel sistemaaumentaen este proceso
adiabáticoirreversible.
Nóteseque la dilataciónlibrees un procesoque, en la naturalezase desarrollapor
sí mismo una vez iniciado.Realmenteno podemos concebirlo opuesto, una
compresiónlibreen la que el gas que en un recipienteaisladose comprimaen forma
espontáneade tal maneraque ocupesolo la mitaddel volumenque tienedisponible
libremente.
Toda nuestra experiencia nos dice que el primer proceso es inevitable y
virtualmente,
no se puedeconcebirel segundo.
2. Transmisión irreversiblede calor. Como otro ejemplo,considérensedos cuerpos
que son semejantesen todo, exceptoque uno se encuentraa una temperaturaI¡1y
el otro a la temperatura16, donde Tn> Tc.Si ponemosambos objetosen contacto
dentro de una caja con paredes no conductoras,eventualmentellegan a la
temperaturacomún T^, con un valor entre Tu y I6i como la dilataciónlibre, el
procesoes irreversible,por que perdemosel controldel medio ambiente,una vez
que colocamoslos dos cuerposen la caja. Como la dilataciónlibre, este proceso
también es adiabático(irreversible),
por que no entra o sale calor en el sistema
duranteel proceso.
Para calcularel cambiode entropíapara el sistemaduranteeste proceso,de nuevo
debemosencontrarun procesoreversibleque conectelos mismosestadosinicialy final y
calcularel cambiode entropía,aplicandola ecuaciónal proceso.
Podemoshacerlo,si imaginamos
que tenemosa nuestradisposición
un depositode calor
de gran capacidadcalorífica,cuya temperaturaf este bajo nuestro control, digamos,
haciendogirar una perilla.Primeroajustamos,la temperaturadel depósitoa Tn a Tr,
quitandocaloral cuerpocalienteal mismotiempo.
En esteprocesoel cuerpocalientepierdeentropía,siendoel cambiode estamagnitud.
Aquí fr es una temperatura
adecuadaescogidaentreTuy T^y Q es el calorextraído.
En seguidaajustamosla temperatura
de nuestrodepósitoa T"y lo colocamosen contacto
con el segundo cuerpo (el más frío). A continuación elevamos lentamente
(reversiblemente)
la temperaturadel depósitode T" a T^, cediendocalor al cuerpo frío
mientraslo hacemos.El cuerpofrío ganaentropíaen esteproceso,siendosu cambio.
Aquí 12es una temperatura
adecuada,escogidapa'aque quedeentre Try T- V Q es el
calor agregado.El calor Q agregadoal cuerpofrío es igual al Q extraídodel cuerpo
caliente.
Los dos cuerpos se encuentra¡ ahora en .la misma temperaturaT, y el sistema se
encuentraen el estadode equilibriofinal.El cambiode entropíaparael sistemacompleto
es:
Como TPTz, tenemosS¡ >S¡. De nuevo, como para la dilataciónlibre, la entropíadel
sistemaaumentaen este procesoreversibley adiabático.
Nóteseque, como la dilataciónlibre, nuestroejemplode la conduccióndel calor es un
procesoque en la naturaleza
se desarrollapor sí mismounavez que se ha iniciado.
En realidadno podemosconcebirel procesoopuesto,en el cual,por ejemplo,una varilla
de metal en equilibriotérmicoa la temperaturadel cuartoespontáneamente
se ajuste de
tal maners;QUeun extremoquedemás calientey en el otromásfrío.
De nuevo,la naturalezatiene la preferenciairresistiblepara que el procesose efectúeen
y no en la opuesta.
una direccióndeterminada
En cada uno de estos ejemplos,debemosdistinguircuidadosamente
el proceso real
(irreversible)(dilataciónlibre o transmisióndel calor) y el proceso reversibleque se
paraque se pudieracalcularel cambiode entropíaen el procesoreal.
introdujo,
Podemosescogercualquierproceso reversible,mientrasconectelos mismos estados
inicialy final que el procesoreal; todos estos procesosreversiblesllevaránal mismo
cambio de entropíaporque ella depende sólo los estados inicialy final y no de los
procesosque los conectan,tantosi son reversiblescomo si son irreversibles.
entropíaes una magnitudrelacionadacon la direcciónen la que se producenlos
^r ,\-----b
\Z -L"
Procesos.2
)dl
/ ./A'
Hemosvisto en el apartadodedicadoa presiónen gases como un gas que ocupa una
parte de un recipienteevolucionalibrementehasta que sus partículasse distribuyen
por todo el recipientesin modificarsu energía,tambiénvimos como dos
uniformemente
sistemasa distintatemperaturapuestos en contactotérmico evolucionande forma que
alcancenla mismala temperatura.
En amboscasosel primerprincipio,enunciadoen el apartadoanterior,no nos sirve para
predeciren que direcciónvan a evolucionarnuestrossistemas,al primerprincipiole da
igualque las partículas
ocupentodo el espacioo solola mitadde lo que puedencon tal de
que no hayatrabajoinvolucrado,tampocole importasi el sistemacon mas temperaturaes
el que debe ceder o recibirenergíacon tal de que la variaciónde la energíainternasea
iguala dichaenergía.Necesitamosintroduciruna nuevamagnitudque nos describaesta
fenomenológica.
Este tipo de situacionestiene mucho que ver con el hecho de que los sistemas
macroscópicos
se encuentran
formadospor unaenormecantidadde partículas.
Definimosuna nueva magnitudasociadacon el número de distintasformas en que
podemosdisponerlas partículas
de nuestrosistema:
Entropíade un sistemacomoel logaritmo
posibles.
del númerode distribuciones
Y enunciamos
principio:
el siguiente
Un sistemaen equilibriose encuentraen la situaciónde máximaentropía.
Que es equivalente
en términosde nuestromodelode partículas
a decir:
Dado un sistemaen equilibrio,el estadomicroscópico
en el que se encuentraes aquel
cuyaprobabilidad
es máxima.
Este principionos permiteabordarlos fenómenosque presentábarnos
al principio.Un gas
en equilibrioocupa uniformemente
el recipienteque lo contieneya que se correspondeóon
la situaciónmás probablees decirla que se correspondecon el mayor númerode formas
de disponerlas partículasen dichorecipiente.
Como vemos esta nueva magnitudviene relacionadacon la probabilidad,termino en
principiopoco deterministapero que si tenemosen cuentael númerode partículasque
suelen configurarnuestrossistemasse pueden hacer afirmacionescon una prec¡siOn
absoluta..Por supuestoque las partículasque configuranel aire de nuestrahabitación
pueden,en un momentodado,encontrarse
soloen la mitadde la misma,pero no se sabe
de nadieque hayaperecidopor elloni debemospreocúpanos
por tal posibilidad!
Otro fenómenoque podemosabordarcon ópticasimilares el de como se distribuyela
energía entre un grupo de partículasque colisionanlibrementeintercambiandosus
energías,este seráel temade nuestropróximoapartado.
3.4 Gases. Leyes de los gases ideales.calor
específ¡coa volumen y presión constante.
Trabajoefectuadopor un gas en expansión.
En un modelode gases idealesestosestánformados,como hemosvistoen los anteriores
por partículasque se muevencon una ciertaenergía.La energíainterna de un
apartados,
sistema,U, la definimoscomo la suma de las energíasde las partículasque lo configuran
rnientrasque la temperatura,T, vienerelacionadacon la energíamediapor partícula.
Al chocarlas partículasentre si y con las paredesla energíaes intercambiadade forma
aleatoriaentre todas las posibilidades
de absorberenergíaque tiene la configuración
atómicadel sistema.En el caso de un gas ideal monoatómico,
que es el sistemaque
hemoselegidopor ser el mas sencillo,la única forma de energíaes la cinéticade ias
partículasque lo forman, de modo que la temperaturaen este caso esta directamente
relacionada,
como veremos,con la energíamediapor partícula.
3.4.1 Ecuación de los Gases ldeales.
Para un gas que contengaN moléculasse cumple que: PV/T = Const. Veamos una
interpretación
mas cuantitativade la temperaturaayudándonosde la relaciónexperimental
encontrada:
PV = NkT DondeP es la presión,V el volumen,N el númerode partículas,
k
la constantede Boltzmanny T la temperatura.
En nuestromodelode gases idealesla presiónque se ejercesobre las paredeses debida
al cambioen su cantidadde movimiento
al chocarcon las mismas.Tomandouna partícula
que viaja con una componentex de su cantidadde movirnientoy rebota en la pared
volviendocon el mismo valor pero de signo opuesto la variaciónen la cantidadde
movimiento
será:
Pa{iir}¡rft? qin t6$
El númerode moléculasque chocancon la pareden un intervalode tiemposon aquellas
que se encuentrana una distanciaigualo inferiora
La variacióntotalde la cantidadde movimiento
de las moléculasdel gas será:
La fuerza ejercida sobre la pared será la variaciónde ta cantidadde movimientopor
unidadde tiempoy la presiónejercidaseráestevalordivididopor el áreade la paredA, y
teniendoen cuentaque no todaslas moléculasposeenel mismovalorde la componentex
de la velocidadtomaremossu valormedio.
Donde hemos recordadola relaciónexperimentalentre P, V y T. De esta expresión
deducimosque la energíacinéticamediaasociadacon el movimientoa lo largodel eje x
es kT/2 como dichoeje no tiene ningúnprivilegiola energíaasociadacon los otros dos
ejestambiénserá la mísmapor lo que concluimos
que:
La temperaturade un gas ideal es una medidade la energíacinéticamediade traslaciónde sus
moléculas
3.4.2Teoriacinéticade los qases.
La termodinámicase ocupa solo de variables microscópicas,como la presión, ta
y el volumen.
temperatura
Sus leyesbásicas,expresadas
en términosde dichascantidades,
no se ocupanpara nada
de que la materiaesta formadapor átomos.Sin embargo,la mecánicaestadísfica,que
presuponela existenciade
estudialas mismasáreasde la cienciaque la termodinámica,
los átomos.Sus leyes básicasson las leyesde la mecánica,las"quese aplicanen los
átomosque formanel sistema.
No existe una computadoraelectrónicaque pueda resolverel problemade aplicarlas
leyesde la mecánicaindividualmente
a todoslos átomosqué se encuentran
en una botella.
de oxigeno,por ejemplo.Aun si el problemapudieraresolverse,los resultadosde estos
cálculosseriandemasiados
paraser útiles.
voluminosos
Afortunadamente;
no son importantes
las historiasindividuales
detatladasde los átomos
que hay en un gas,si sólose tratade determinar
el comportamiento
microscópico
del gas.
Así, aplicamoslas leyesde la mecánicaestadísticamente
con lo que nos damoscuentade
que podemosexpresartodaslas variablestermodinámicas
comopromediosadecuadosde
las propiedadesatómicas.Por ejemplo,la presiónejercidapor un gas sobrelas paredes
de un recipíentees la rapidezmedia,por unidadde área,a la que los átomosde gas
transmitenímpetua la pared,mientraschocancon ella.
En realidadel númerode átomosen un sistemamicroscópico,
casisiemprees tan grande,
que estospromediosdefinenperfectamente
las cantidades.
Podemosaplicarlas leyesde la mecánicaestadísticamente
a gruposde átomosen dos
nivelesdiferentes.Al nivel llamadoteoríacinética,en el que procederemosen una forma
másfísica,usandoparapromediar
técnicasmatemáticas
bastantessimples.
En otro nivel, podemosaplicarlas leyesde la mecánicausandotécnicasque son más
formalesy abstractasque las de la teoríacinética.Este enfoquedesarrolladopor J. Willard
Gibbs (1839-1903)y por LudwigBoltzmann(1844-1906)entre otros,se llamamecánica
estadística,un términoque incluyea la teoríacinéticacomo una de sus ramas.Usando
estos métodos podemos derivar las leyes de la termodinárhica,estableciendoa esta
cienciacomo una ramade la mecánica
plenode la mecánicaestadística
El florecimiento
(estadística
cuántica),que comprendeta
aplicaciónestadísticade las leyesde la mecánicacuántica,más que las de la mecánica
clásicaparasistemasde muchosátomos.
Hagamosque ciertacantidadde gas esté confinadaen un recipientedel volumen V. Es
claro que podemos reducir su densidad,retirandoalgo de gas en el recipiente,o
colocandoel gas en un recipientemás grande.Encontramos
experimentalmente
que a
densidadeslo bastantepequeñas,todos los gases tiendena mostrarciertas relaciones
simplesentrelas variablestermodinámicas
p,V y T.
Esto sugiere el conceptode un gas ideal, uno que tendrá el mismo comportamiento
simple,bajotodaslas condiciones
y presión.
de temperatura
Dado cualquiergas en un estadode equilibriotérmico,podemosmedirsu presiónp, su
temperaturaT y su volumenV.
Para valoressuficientespequeñosde la densidad,los experimentos
demuestranque (1)
para una masa dada de gas que se mantienea temperaturaconstante,la presión es
proporcional
inversamente
al volumen(ley de Boyle),V Q) para una masa dada de gas
que se mantienea presiónconstante,el volumenes directamenteproporcionala la
temperatura(ley de Charles y Gay Lussac). Podemos resumir estos resultados
por mediode la relación:una constante(paraunamasafija de gas).
experimentales
El volumenocupadopor un gas a una presióny temperaturas
dadas,es proporcionala la
rnasa del gas. Así, la constantede la ecuación una constante,también debe ser
proporcionala la masa del gas, por ello escribimosla constantede la ecuación una
constante;como nR, donden es el númerode molesde gas en la muestray R es una
constanteque debe determinarseen forma experimentalpara cadagas. Los experimentos
que,a densidades
demuestran
pequeñas,R tieneel mismovalorpara todos los
suficientes
gases,a saber,
R=8.314J/mol K = 1.986 cal/molK
R se llama la constante universalde /os gases. Con esto escribimosla ecuación una
constante,
en la forma:
pV=nRT,
y definimosa un gas ideal, como aquel que obedeceesta relaciónbajo todas las
condiciones.No existealgo que sean verdadun gas ideal,pero sigue siendoconcepto
rnuy útil y sencillo,relacionadorealmente,con el hechoque todos los gases reales se
aproximana la abstracciónde los gases idealesen su comportamiento,
siempreque la
densidadsea suficientemente
pequeña.pV=nRf se llamaecuaciónde estadode un gas
ideal.
Si pudiéramosllenaral bulbode un termómetrode gas (ideal)a volumenconstante,un
gas ideal,deberíamos,de acuerdocon la ecuaciónpV=nRI definirla temperaturaen
términosde sus lecturasde presión.
Desdeel punto de vista microscópico,
definimosa un gas ideal haciendolas siguientes
suposiciones,
con lo que nuestratareaserá la de aplicarlas leyesde la mecániciclásica,
estadísticamente,
a los átomosdel gas y demostrarque nuestradefiniciónmicroscópicaes
consecuentecon la definiciónmacroscópicade la secciónprocedente:
1. Un gas esta formadopor partículas llamadasmoléculas.Dependiendodel gas,
cada moléculaesta formadapor un átomo o un grupo de átomos.Si el gas es un
elementoo un compuestoen su estado estable,consideramosque todas sus
moléculasson idénticas.
2.
Las moléculasse encuentrananimadasde movimientoaleatorioy obedecenlas
leyesde Newtondel movimienfo.Las moléculasse muevenen todas direccionesy
a velocidadesdiferentes.Al calcularlas propiedadesdel movimientosuponemos
que la mecánicanewtoniana
se puedeaplicaren el nivelmicroscópico.
Comopara
todas nuestrassuposiciones,
esta mantendráo desechara,dependiendode si los
hechosexperimentales
son correctas.
indicano no que nuestraspredicciones
3 . El númerototal de moléculases grande.La direccióny la rapidezdel movimiento
de cualquierade las moléculaspuedecambiarbruscamente
en los choquescon
las paredeso con otras moléculas.Cualquierade las moléculasen particular,
seguiráuna trayectoriade zigzag,debidoa dichoschoques.Sin embargo,como
hay muchasmoléculas,suponemosque el gran númerode choquesresultante
mantieneuna distribución
moleculares
totalde las velocidades
con un movimiento
promedioaleatorio,
pequeña del
4. El votumende las moléculases untafraccióndespreciablemente
volumen ocupado por el gas. Aunque hay muchas moléculas, son
pequeñas.
extremadamente
Sabemosque el volumenocupadopor una gas se puedecambiaren un margen
muy amplio,con poca dificultady que, cuandoun gas se condensa,el volumen
ocupado por el liquido puede ser miles de veces menor que la del gas se
condensa,el volumenocupadopor el liquidopuedeser milesde vecesmenorque
el del gas.De aquíque nuestrasuposición
es posible.
5. No actúanfuerzasapreciabtes
sobre las moléculas,exceptodurantetos choques.
En el grado de que esto sea cierto, una moléculase moverá con velocidad
uniformeentrelos choques.
Como hemossupuestoque las moléculasson tan pequeñas,la distanciamedia
entreellases grandeen comparación
con el tamañode una de las moléculas.De
aquí que suponemosque el alcancede las fuezas moleculares
es comparableal
tamañomoléculas.
6 . Los choques son e/ásfrcosy de duracióndespreciable.En las choques entre las
moléculascon las paredesdel recipiente
se conservael ímpetuy (suponemos)
la
energíacinética.
Debidoa que el tiempode choquees despreciable
comparadocon el tiempoque
transcurreentrelos choquede moléculas,la energíacinéticaque se convierteen
energíapotencialduranteel choque,queda disponiblede nuevo como energía
cinética,despuésde un tiempotan corto,que podemosignorareste cambiopor
completo.
3.4.3Leyes de los gases:
Todalas masasgaseosas
experimentan
variaciones
de presión,
volumeny temperatura
quese rigenporlassiguientes
leyes:
Primeralev (Bovle-Mariottel
Los volúmenesocupados por una misma masa gaseosa conservándosesu
temperaturaconstante,son inversamente
proporcionales
a la presiónque soporta.
El volumenes inversamente
proporcional
a la presión:Pl'' - ADonde k es constantesi ta temperatura
y la masadel gas permanecen
constantes.
Cuandoaumentala presión,el volumendisminuye,mientrasque si la presión
disminuyeel volumenaumenta.El valorexactode la constantek no es necesario
conocerlopara poderhaceruso de la Ley;si consideramos
las dos situacionesde
la figura,manteniendo
constantela cantidadde gas y la temperatura,
deberá
cumplirsela relación:
PlI¿l - PzW
Vr = volumeninicial
Vz= volumenfinal
Pr = presióninicial
Pz= Presiónfinal
Es una simplificación
de la Lev de los gasesidealesparticularizadapara procesos
isotermps.
I e.-l* c-ú^
¿V,t tud"- *. ? ,iu".*
¿fu.rn¡ol^'cD -f g^'$o*^
H
(ü lr{rda srú
Tr =Tz
tAY{rillaú|ctE
Sequndalev (Gav-Lussac|.
Cuandose calientaun gas, el volumenaumenta11273partede su valorprimitivo,
siempre que la presión no varíe. Temperaturay volumen son directamente
proporcionales.
A una presiónconstante,al aumentarla temperatura,el volumen
del gas aumentay al disminuirla temperaturael volumendel gas disminuye.Esto
se debe a que "temperatura"significamovimientode las partículas.Así que, a
rnayormovimientode las partículas(temperatura),
mayorvolumendel gas.
Í:ág{ir* S1 f,J*.t{}S
Se expresapor la fórmula:
k:
v
i:k
constantede proporcionalidad
Ademáspuedeexpresarse
como:
Vl/Tl :Y2lT2
V1 = volumeninicial
V2 = volumenfinal
T1 = temperaturainicial
T2 = temperaturafinal
Terceralev (Charles)
proporcional
porunamasagaseosa
a su temperatura
La presiónejercida
es directamente
queel volumen
absoluta,
siempre
seaconstante.
y portanto
Al aumentar
la temperatura
lasmoléculas
delgasse muevenmásrápidamente
la presiónya queel
aumenta
el númerode choques
es deciraumenta
contralasparedes,
recipiente
es de paredes
fijasy suvolumen
no puedecambiar.
que,en cualquier
el cocienteentrela
momento
de esteproceso,
Gay-Lussac
descubrió
presión
y la temperatura
siempre
teníael mismovalor:
p
=k
T
(el cocienteentrela presióny la temperatura
es constante)
Supongamosque tenemosun gas que se encuentraa una presiónPt y a una temperatura
T1 al comienzodel experimento.Si variamosla temperaturahasta un nuevo valor T2,
entoncesla presióncambiará?Pz, y se cumplirá:
P1
Tr
ü
P2
T2
Pr = pres¡óninicial
P2= pfesiónfinal
Tr = temperaturainicial
Tz = temperaturafinal
quees otramanerade expresar
la leyde Gay-Lussac.
3.5 Expansión y compresión isotérmica v
adiabática. Ciclos del motor. Volumen v
prestonconstante.Refr¡geradores
y bombas
de calor.
TRABAJO
Cuandoel recipienteque contieneun gas poseeuna paredmóvil,pistón,se moverási la
presiónque ejerceel gas del recipientees mayorque la que hay fuera del mismo, hasta
que ambaspresionesse igualen.El gas realizaun trabajosobreel pistón.
En el caso en que tengamosun gas confinadoen una partedel recipientey lo dejemos
libremente
estese expandirásin modificarsu energía.
El trabajoW realizadopor el gas lo podemoscalcular'recordando
las relacionesentre las
magnitudesinvolucradas.
Si nos fijamosen un desplazamiento
muy pequeñode la pared, debidoa los choquesde
las partículascon la misma,podemossuponerque duranteeste intervaloinfinitesimal
la
presiónP permanececonstante,llamemosS al área del pistón,et trabajo &W reatizado
por el gas será:
&W=F*&x=P*S*&x=P*&V
Siendo&V la variaciónde volumenque se ha producido.
Hemossupuestovariacionesinfinitesimales
en el desplazamiento
de la paredpara
que podamosconsiderar'quela presiónse ha mantenidoconstanteen este
proceso.Si no es así tendremosque suponerun procesocasi estático,es decir lo
suficientemente
lento como para que tenga sentidohablarde presióndel gas, y
sumarlos diferentesvaloresde P"&V. En el límiteesta suma será la integralqué
se extiendeentrelos límitesen los que variael volumen.
Se puedenestablecervarias clasificaciones
atendiendolugar donde se realizala
combustión
o al funcionamiento
mecánico
1. Seoúndondese realizala combusüón
a. Motores
de combustión
porel combustible
externa:
El calordesprendido
al
quemarse
es transmitido
quees el que producela
a un fluidointermedio
energíamecánica
a travésde unamáquinaalternativa
o de unaturbina.
Sonlasmáquinas
de vapor,lasturbinas
de vapory lasturbinas
de gasde
ciclocerrado.
Presentanel inconveniente
de que el fluido de trabajo no alcanza
temperaturas
muyaltasya que no se calientadirectamente
sinomediante
intercambiadores
de calor.Puedenusar combustibles
.
baratoscornoel
carbón.
b. Motores de combustióninterna:La combustiónse producedentro
del motorsiendolos gasesgeneradoslos que causanal expandirse
el movimientode los mecanismosdel motor. Son los motoresde
combustióninternaalternativos
(MCIA),las turbinasde gas de ciclo
abierto,turbohélices,
etc.
Son en general motores ligeros que precisan de combustibles
líquidoso gaseososen generalcaros.
P á g t i ' r a$ " ) 'r ' i +l S i r
2,
Seoun,el funcionamiento mecánico
a. Motores.qltqrnativos:El fluidode trabajoactúa sobre pistonesdotadosde
novimientoalternativo
de subida/bajada.
b. Motofes ro-ta-tivos:
El fluido de trabajoactúa sobre elementosde manera
que se obtieneun movimiento
de giro.
CICLO DE CARNOT
Es un proceso cíclico simple compuestopor dos transformacionesisotérmicasy dos
adiabáticasy que tiene lugar reversiblemente,
describiendoel sistemala curva cerrada
que aparecerepresentadaen los diagramasP-V y T-S de la figura
Ciclode Carnot.
Diagrama entrópicodelciclo de Carnot,
A->B: lsoterfna:Aumenta el volumende V1 a Y2 a temperaturaconstanteT1. Se
absorbeel calorQ1, y se realizatrabajoen la expansióndesdeA hastaB
B->C:Adiabática:
Se aumentael volumensin aumentoni disminución
de calordesdeB
hastaC aumentandoel volumendesdeV2 hastaV3 y disminuyendola temperatura
desdeT1 hastaT2
C:>Q:lsoterma:
El gas se comprimeisotermicamente
aT2 desdeC hastaD cediendoal
ambienteuna cantidadde calorQ2
D->A:Adiabátlca:
Hay una compresiónadiabáticadesde D hastaA recuperandoel gas
su volumenprimitivoV1 y pasandosu temperaturadeT2 aT1
W
0' =
Q- =r
Mri::3.,'1,.;
r.{*., - .-
,",,,,"t
Vd (;,.{i)
Q I - Q 2 - ,¡ Q
--2
Ql
Qr
De aquíse obtieneque:
Pero como tenemos un ciclo y la entropíaes función de
estado (sólo depende del estado inicial y final); en et
ciclo completo DS=O
DS=O=) DSea+DS".+pgco*DSco+DSe¡=Q1
/T1+gQ2lT2+0=0=>Q1/T1= Q2lT2
Lo que hace que Q1 y Q2 sean proporcionales
a T1 y T2 y podamosexpresarel
rendimiento
del ciclode Carnotcomo:
F*iiin;l
'y{
rJ* I i:Íl
ry-
W
TI_72
Ql
TI
,72
TI
Otra manerade explicarloseríasegúnel diagrarnaentrópico:
't
'
Q1 se absorbede A a B, luegoseríael áreapor debajode la rectaA-B:
o Q1=T1.(S2-S1)
Q2 se desprendede C a D, luegoseríael área por debajode la rectaC-D:
o Q2 =T2.(S2-S1)
W
f'i Q
- - -r
- ^s1)
- r2.(.s2
- ^Sl) T I _ 7 2 ,
rt.(^s2
Tt.(s2- ^s1)
TI
E:=l--
T2
TI
Luego...
El rendimiento de la máquÍna de Camof es el mayor rendimiento posibteque puede obtener una
máquina térmica que funcioneentre dos focos a temperaturasT1 y 72.
MOTORESDE COMBUSTIÓN
INTERNAALTERNATIVOS
(MCIA)
Partesdel motorde combustióninternaalternativo
r
La parteestructuralfundamentaldel motores el bloquesobrelos que van montados
los demáselementosdel motor.
I El cilindro es el recipientepor el cual se deslizael pistón en movimientoalternativo.
El pistóntieneforma de vaso invertidoy está, unidoa la biela medianteun bulón.
Para conseguirel cierre herméticoentre el cilindroy el pistón,éste está provistode
dos o tres segmentos (o aros),colocadosen unas ranurasén su partesuperior.
Denominamos:
'
Punto muertosuperior(PMS): punto más alto que alcanzael pistón en su
movimiento
'
Punto muerto,inferior(PMl): punto más bajo que alcanzael pistón en su
movimiento.
i]á#irte $$ eJe't$$
.
.
.
.
r
Cilindrada:volumenbarridopor el pistón.Es la diferenciaentre el volumen
libredel cilindroen el PMSy el PMl.
Carrera:recorridoque realizael pistón,es decira la distanciaentreel PMS y
elPMl.
Relaciónde compresión.razónentreel volumenlibredel cilindroen el PMS y
el PMl.
Voluméndel cilindro=superficietransversat. carrera
Cilindrada=Volumendel cilindro.node cilindros
La bielatransmiteel movimiento
del pistóna la maniveladel cigüeñal,el cual
está soportadopor cojinetes,transformando
el movimientolinealen rotativo.
Sobrela partesuperiordel bloqueva montadala culata,que cierralos
cilindros.El espacioque quedaentreel pistóny la culataes la cámarade
(gasolinao
combustión,el lugardondese producela mezclade combustible
gasóleo)y comburente(aire).
La entradadel fluidode trabajo(gasolinapor ejemplo)y la salidade los gases
de combustiónse realizana través de las válvulas de admisión y escape
respectivamente.Estas válvulas están situadas en la culata, directamente
sobreel cilindro,y su movimiento
de aperturay cierreestácontroladopor unos
dispositivos
mecánicossincronizados.
La distribuciónse encomiendaal árbot de levas,que es conducidopor el
cigüeñal mediante algún sistema de transmisión (cadena, correa o
engranajes).
El giro de las levasse transformaen movimientolinealde los
los cualesactúansobreel balancín,que es el que abre
taquéso empujadores,
la válvula.Cuandola leva ha pasado,la fueza de un muellehace cerrarla
válvulaajustándola
sobresu asiento.
Motoresde encendidoprovocadode cuatrotiempos (MEP)
Son los motoresde gasolinaaunquetambiénpuedenfuncionarpor otros combustibles
comoalcohol,butano,hidrógeno,
etc.
A )vrril()N( I Coh4;)HFril*Nt?)
Fxrji()Ír*N
FKrAf\f;r{}\i;1:
Desdeel punto de vista termodinámico,
el funcionamiento
de los motoresde encendido
por chispase utilizaun ciclotermodinámico
teóricollamadocicloOTTO.
Funcionamiento
Básicamenteel MEP se basa en un mecanismocilindro-pistón
que provoca un
movimientoalternativo.
En la partesuperiordel cilindroen dondese encuentranlas
válvulasen númerode dos, tres, cuatro(comúnmenteconocidoscomo lGVsiempre
que tengacuatrocilindros)e inclusocinco(vehículosde grandesprestaciones),
y tas
bujíasen númerode una normalmente
aunquea veces dos (ej.:Alfa Romeo Twin
Spark).En estetipode motoresen cadatiempoel cigüeñalda mediavuelta.
a. Canera de admisión:el cilindro desciende desde el PMS (punto muerto
superior)al PMI (punto muerto inferior)y se abre la válvulade admisión
dejandoentraruna mezclaaire-combustible.
b. Carrera de compresión:el cilindro comienza a subir del PMI al PMS
comprimiendo
la mezclaaire-combustible.
c. Tercer tiempo o expansión:la chispade la bujía inflamala mezcla,y por la
presiónde los gases de la combustiónel pistón es obligadoa desplazarse
hacia el PMI efectuandosu terceracarrera,que será la únicaútil o de trabajo
mecánico(estese almacenaen formade energíamecánicaen el volantede
inercia).
d. Cuarto tiempoo escape:de nuevo comienzael pistón a subir abriéndosela
válvulade escapey cerrándosecuandoel pistónllegaarribae iniciándoseun
nuevociclo.
Ciclo OTTOde cuatro tiempos (4Tl
Es el ciclo termodinámicobásico en que se basan los motores de cuatro tiempos de
encendidoprovocado:
V
.
1-+2
Compresión
adiabática
reversible, Q = 0 (carrera de
compresión)
.
2-+3 Aporte de calor a volumen
constante
.
3-+4 Expansiónadiabáticareversible
.
4-+1
Enfriamiento a
constante
volumen
Sus rendimientos
realesoscilanalrededor
del 30o/o ( 25-30oA) puesto que, la
adiabática sobre todo, no es real pues
existenpérdidas.
Aplicaciones
. Automoción
. Motores de hélice de aviación (solo
pequeñosaviones)
. Propulsiónmarina(lanchasrápidas)
. Grupos electrógenos pequeños,
motobombas,cortacésped,
etc.
Funcionamiento
El funcionamiento
básicoes el siguiente.
a
Primera media vuelta de cigüeñal admisión y
compresión):el pistón sube comprimiendola
mezcla fresca y descubriendouna lumbrera
(orificiosituadoen la parte inferiorde la pared
de cilindro)o abriéndose
unaválvulapor donde
entra la mezclaal cárter.Se producela chispa
y comienzaa bajarel pistón.
b
Segunda media vuelta de cigüeña (expansión+
escape):casial finalde la bajadadel pistónse
descubrela lumbrerade escape o se abre la
válvulade escapey se expulsanlos productos
quemados(iniciode expulsión).
Poco después
entra el combustibleque entró al cárter, a
través de la lumbrerade transferenciay entra
mezcla fresca procedente del cárter
desalojandolos productosquemadosa través
de la lumbrerade escape.
CicloOTTOde dos tiempos(2T)
El ciclo es igual y la diferenciaes que tiene
aproximadamenteun poco menos del doble de
potenciapor giro del cigüeñal,por el contrarioel
rendimiento
es ligeramente
menorporquese expulsa
junto
Partedel combustible
sin quemary ademásen el cilindroen la fase de compresión
con la mezclafrescaquedaalgode gas quemadono desalojado.
Aolicaciones
Las aplicaciones
de los motoresMEPde dos tiemposson en dondese requierepocopeso
y no importamuchola pérdidade combustiblepor el tubo de escapecomo motocicletas,
cortacésped,aeromodelismo,
etc.
Motores de encendido por compr,?si,gtlde cuatro tiempos(MEC-4Tl
Son los motores que usan como combustibleel gasóleo y se ajustan al ciclo
que describeel cicloDiesel.
termodinámico
Funcionamiento
El rendimientodel ciclo de Otto que sirve de base al funcionamiento
de los motoresde
explosiónviene limitado por la relación de compresióna la cual se produce la
autoignición;sin embargo,si se comprimesolamenteaire y tras la compresiónse
introduceun combustible
adecuado,se puedenobtenerrendimientos
más altos.Éste es
el fundamentode los motoresDiesel,en los que si la compresiónes elevadase produce
una autoignición,
teniendolugaren vez de la explosiónuna combustiónprogresiva.Esta
puededirectamente
autoignición
en la cámarade combustión(inyeccióndirecta,ej.: Audi
A4-TD|)ó en una precámara(inyección
indirecta).
las diferencias:
Sintetizando
I
r
I
El combustible
se inyectay es gasóleo.
Por la válvulade admisiónsolo entraaire (por eso es más fáci!ponerturboque en
gasolina)
El combustible
se autoinflarna.
Ciclo Dieselde cuatro tiempos (MEC-4T}
I
t
t
I
' 1@2Compresiónadiabáticareversible
' 2@3 Expansiónisobárica(inyecciónlentade combustible)
' 3@4 Expansiónadiabáticareversible
' 3@¿ Enfriamíento
a volumenconstante.
Es de notar que si el MEP y MEC tuviesenla mismarelaciónde compresión,el hr,,rep
sería mayor que el del hy"" , pero como no es así, porqueen el MEP la relaciónOe
compresiónse encuentralimitadapor el peligrode autoinflamación,
en la realidadel hu""
Aplicaciones
r Automocióny maquinaria
de obraspúblicasy agrícola
r Propulsiónferroviaria.
r Propulsiónmarina.
r Accionamiento
industrialy rural.
r Generaciónde energía eléctrica(centralesde punta generalmente)y
equipos
auxiliaresen hospitales,
etc.
Estetipo de motoreses requeridodondese necesitangrandespotenciasy una reducción
de combustible.
Arv, sén¡f'I coMpri¡,$Óf\trl
IN\ECüóN EXH{\SIü\:31 EffCAP::41
Motores de encendido por compresión de dos tiemoos (|Y|EC-,2TI
Se puedenestablecerlas mismasdiferencias
que con respectoal motorde gasolina.Sin
embargouna diferencia
fundamental
es que al inyectarel combustible
cuandoyo deseono
pierdotantocombustible.
por lo que a este
Por otrapartees másfácilla turboalimentación
tipo de motoresles esperaun gran futuro,fundamentalmente
en automocióncon motores
Dieselde 2T turboalimentados.
Hoy en día se aplicansobretodo en motoresde barcos
llegandoa un rendimiento
del46%(el mayorde un motorde combustióninterna).
p
a Diaoramasindicados
Son los ciclosrealesde funcionamiento
de los MCIA.
b Sotireatimentación
La sobrealimentaciónes un sistéma para
incrementar la potencia de los motores de
combustión interna, consistenteun aumentar la
cantidad de mezcla combustibleadmitida en el
cilindro,con respectoa la que entraríaen él como
consecuenciadel simple movimientodel émbolo
duranteel tiempode admisión.
La sobrealimentación
se consigueaumentandola
presióndel aire o de la mezcla combustiblea la
entradadel cilindro.Para ello se intercalaen el circuitode entradaun compresor,
accionadopor una turbinamovidapor los gasesde escape:este dispositivorecibeel
nombrede turbo-compresor.
Comolos gasesse calientana la salidadel compresor,
y este aumentode temperatura
no resultaconvenientepara incrementarla potencia,se suele instalara la salidadel
compresorun intercambiador
de calor,que tiene como misiónenfriarlos gases antes
de que penetrenen el motor.
Estedispositivo
se designacon el términoinglés"TurboIntercoole/'.
Recapitulando:
r Turbina: Recoge energía de los gases de escape
disminuyendola presiónde estos y obtieneenergía
cinéticade rotaciónen el eje.
r Compresor:Usa energía cinética(que le cede la
turbina)y la emplea en aumentarla presiónde los
gasesen la admisión.
r Intercooler:
Radiadorque cede calorde los gasesde
admisiónal exteriorpara aumentarsu densidad(al
estar más fríos)y aumentarpor tanto la cantidadde
gasesde admisiónqueentranen el cilindro.
Lubricación
Debidoal continuorozamientode las piezasmóvilesen contactoen un motores
necesariauna adecuadalubricación.
Si no existieseesta lubricación,
el materialse
desgastaría
rápidamente
calentándose
en exceso,llegandoinclusoal gripaje.
Las partesmás importantesque deben lubricarseen un motor son las paredesdel
cilindro,las articulaciones
de las bielas,los cojinetesdel cigüeñal,el árbolde levas,
lostaqués,las válvulas,los balancines
y los engranajes.
La lubricaciónse realizamedianteun circuitode aceitea presión.El aceitese halla
en un depósitosituadodebajodel motor,denominadocárter.Desdeallí lo toma la
bombade aceitey lo distribuyea presióna todas las partesque lo necesitan.
Refriaeración
La combustiónproducidaen el cilindrooriginagran cantidado calor que eleva la
temperaturade sus paredeshasta el extremode que, si no fueran refrigeradas,
se
pondríanrápidamenteal rojo vivo, con el consiguientegripajey destruccióndel
mecanismo.La refrigeracióndel motor normalmentees realizadapor aire o por
agua:
Refrioeraciónpor aire: es utilizadaen pequeñosmotores.En éstos el bloquemotor
está provistode aletas que aumentanla, superficiede refrigeración.
En estos
motores,una corrientede aireenfríaal cilindro.Estacorrientees próducidabienpor
el movimientodel vehículoen el que está colocadoel motor,o bien es forzada
medianteun ventilador.
Refriqeraciónpor aoua: los cilindrosy la culata están rodeadospor una cámara de
pasaal radiador,dondese enfríapor la acciónde la corriente
aguaque al calentarse
de aireque crea un ventilador
o el movimiento
del vehículo.
Balance eneroéüco
De toda la energíaintroducida
en el motor con el combustible,
sólo una parte se
transformaen energíamecánica,perdiéndoseel restopor diversoscaminos.
r Una de las pérdidasmás importantesla constituyenlos gasesde escape.Estos
son expulsadosa una temperaturamuy elevada,y por tanto,llevan asociada
una considerable
cantidadde energíaque en un principiono se utiliza.Existen
métodosparaaprovechar
estaenergíay, de este modo,aumentarla potencia.
r Otraspérdidasmuy significativas
las ocasionael aguade refrigeración
que
extraecalordel motor.
r Por otra parte,todos los elementoscalientesdel motor radianenergíadebido a
su temperatura,lo que constituyela tercera clase de pérdida importantede
energía.
En generalpodemosdecirque en un motorcualquiera
se cumple:
Energíadel combustible = trabajo obtenido + pérdidas agua refrigeración +
pérdidas gases de escaps++pérdidas radiación calorífica
Potencia v rendimiento
potenciacalculadaa partirdel trabajodel diagramaindicado:
Potenciairydicada:
Pi -lai'n
pi=potenciaindicada
Wi=trabajopor ciclo (áreadel ciclo)
n=ciclospor unidadde tiempo'
Potenciaefectiva(Pel: potenciaobtenidaa la salidadel motor
Rendimientomecánico
Pe
Dl/l=
'Pi -
Rendimientotérmico: cociente entre trabajo indicado y la cantidad de energía
térmicaintroducid
a paraconseguirlo.
Wi
n, Q
t - i_
F a q i * a ' t $ 1 q J *r $ S
TURBINASDE GAS DE CICLOABIERTO
a
Ciclo de Bravtonde una turbina de qas
Turbina
Turbinade gas
En el dibujose muestrael esquemade una turbinade gas que funciona
en ciclo abierto sencillo. El aire entra directamentede la atmósfera al
compresordonde se eleva su presión y temperatura,pasando luego a la
cámarade combustióndonde se inyeotacombustible;a continuaciónel
aire no quemadoy mezcladocon /os gases de la combustiónentra en la
turbina donde /os gases se expansionandesarrollandouna potencia útil,
que puede emplearse,como en el dibujo,para accionarun generadoru
otra máquinacualquiera(bomba,etc...);y finalmentelos gases salena
la atmósfera.En el extremoizquierdodel esquemaque se ha dibujado
tambiénun motar de
ue.
b
Modificaciones sobre el ciclo básico para meiorar el rendimiento.
Sobre este ciclo básico hay muchas modificaciones
encaminadasa mejorar el
rendimiento,
comopuedenser:
¡ Compresiónen variasetapascon refrigeración
entreellas.
¡ Precalentamiento
del aire comprimidoa la salidadel compresorde los gases de
combustión
medianteun intercambiador
de calor.
Expansiónfraccionadapara realizar combustionesintermedias.Esto se puede
realizargraciasa gue la cantidadde aire introducidoes de tres a seis veces superior
a la necesariapara la combustión,con lo que tras una combustión,todavíaqueda
suficienteoxigenoparamás combustible.
Ó,roanosprincioales de tá turbina de gas
Cqmpresor. Cada etapa. del compresor esta constituida por dos elementos
principales:
el rotory el difusor.El aireentrantees aceleradopor el rotor,y el difusor
transformala energíacinéticaadquiridaen energíade presión.El rotor puedeser
centrífugoo radial.Dependiendo
de las aplicaciones
se empleauno u otro.
Cámarade conJbustiónTiene forma tubular:por un lado entra el aire proveniente
del compresor,y por el otro salen los productosde la combustión.En su interiorse
encuentranlos inyectoresde combustible.
Estascámarasestándiseñadasde forma
que no todo el aire pase por el quemador,sino que se produzcandistintas
corrientes.La corrienteprimariaes la que intervienedirectamenteen la combustión,
y el restose mezclacon ella a la salidadel quemadorparadisminuirla temperatura
hastaun valorque no dañea los álabesde la turbina.
Turbina.Cada etapa de la turbina está formada también por dos elementos:el
distribuidory el rotor. El distribuidordisminuyela presiónde los gases calientes
aumentandosu velocidad,Esta velocidadse transformaen energíamecánicaen el
rotor.
d
Aplicaciones
Una de las principalesaplicaciones
de la turbinade gas de ciclo abierto son las
plantasde generaciónde energíaeléctrica.En estas plantasse introducentodas las
modificaciones
mencionadas
al principiopara mejorarel rendimiento
térmico,pues
el pesoo el volumende la instalación
no son factoresdeterminantes.
Tambiénpuedenutilizarsecomo unidadmotrizterrestre,marítima,y en helicópteros
aunquesu aplicaciónmás destacadaes, sin duda, la propulsiónde aviones.Estos
motorespuedenpresentaralgunasvariantes.Las más importantes
son:
1. Turborreactor.La turbinasólo se empleapara obtenerel trabajonecesariopara
moverel compresory los sistemasauxiliares.Los gases a su salidason acelerados
con una tobera,obteniéndose
el empujedeseadoen el avión.
2. Estatorreactor.Está diseñadopara velocidadesde vuelo supersónicas.No se
necesitarotor en el compresor,pues con la compresiónobtenidaen el difusores
suficiente.
3. Turbohélices.A diferenciade¡ turborreactor,la turbina está diseñada para
obtenerla máximaenergíamecánicaposible,que se empleaen moveruna hélice.
rVIÁOUIT.¡AS
Y TURBINAS DE VAPOR
Ciclo de Rankine
son máquinasde combustiónexternacuyofluidode trabajoes agua.
'
'
'
'
El agua que provienede la bombaentraen la calderaen su fase líquida,a presióny
temperaturacercanaa la del ambiente.
En la caldera,el agua líquidaabsorbeel calorproducidoen la combustión,
elevasu
temperaturahasta la ebullicíóny se obtieneasí un vapor saturado.
El vapor,entraen los cilindroso en la turbina(segúnsea máquinade vaporo turbina
de vapor respectivamente),que son los elementos que transformanla energía
térmicaque poseeen energíamecánica.
El vapor desprovistoya de energíase vuelvea estadolíquidoen el condensador
Turbina"omáquinade
vapor
I
¡
I
I
1@2 Compresiónde líquidoadiabáticareversible
2@3 Calentamientoisobárico
3@4 Expansiónadiabáticareversible
4@1 Condensaciónisobárica
Elevaciónde la temperatura
del líquidoa presión
constante
Evaporación
del
líquido(T=cte)
T
Elevación
de la
temperatura
del líquidoa
presión
constante
Lineaisobara
YI
Evaporación
del líquido(T=cte)
Vapor
Meiorassobre el ciclo básico
Sobreeste ciclo básicohabitualmente
se realizanmodificaciones
con el objetode mejorar
globalde la instalación.
el rendimiento
Algunasde éstasson relativamente
sencillas,pero
otrasno lo son tanto.A continuación
mencionamos
dos de las más importantes:
'
Recalentamientodel vapor para volver a obtener trabajo por expansióndel vapor
producido.
. Precalentamiento
del aguaa la entradade la calderamediantela extracciónde una
partedel vaporantesde su totalexpansión.
En ambos casos, hay que estudiarsi la mejoraen el rendimientocompensael coste
económicoque suponerealizarestasmodificaciones.
Turbínas de vaoor
El vaporpasaa travésde qnastoberasen las cualespierdepresióny ganavelocidad,a la
vez que se orientael flujo de maneraque incidatangencialmente
sobre la turbina. La
turbinaestá formadapor un rodeteque tiene insertadosun conjuntode álabes (paletas),
los cualesabsorbenla energíade la corrienteproduciendo
la rotacióndel eje.
Una vez que el vaporha perdidosu energía,pasa al condensador,
dondeva bajandosu
temperaturay vuelveal estadolíquido.Después,el vaporya licuadova hasta lá bomba.
dondese elevasu presiónantesde entrarde nuevoa la cardera.
Actualmente,
las turbinasde vaporson ampliamente
utilizadas
en las grandescentralesde
producciónde energía eléctrica.Otras aplicacionesde la turbina de vapor son la
propulsión
de buqueso las instalaciones
soplantesde altoshornos.
Un tipo particularmente
importantede aplicaciónde las turbínasde vapores el de aquellas
industriasque necesitanvapor para el procesoy electricidadpara el funcionamientode los
equipos, como por ejemplo, las industriasque producenpapel o las que procesan
alimentos.En estoscasospuedeimplantarseun esquemade cogeneración
en el que se
produce el vapor necesariopara el proceso y el resto se expande en la turbina para
obtener,medianteun alternador,energíaeléctrica.
Máouinas de vapor
Esquemáticamente,
una máquinade vaporconsisteen un cilindroque tieneen su interior
un émbolode escasoespesor,que divideal cilindroen dos zonas (en la figurazonas a y
b). El cilindrose mueve de forma alternativagraciasal vapor que llega de la caldera,
transformando
su movimientolinealen rotatoriomedianteun volantede inerciaal que está
unido por un sistemabiela-manivela.
Por encimadel cilindrose desplazaen dirección
horizontalun distribuidor
que tambiénestá unidoal volante,aunquesu direcciónde movimientoes siempreen sentidoopuestoal del émbolo.De estemodo,cuandola zona a está
en comunicaciÓn
con la caldera,la zona b lo estácon el condensador
y viceversa
Las máquinas de vapor alternativas se caracterizan por su baja velocidad de
funcionamiento,
tradicionalmente
se han utilizadocomo órganosmotricesde barcos y
locomotoras. No obstante, la aparición de otros motores de combustión redujó
considerablemente
su utilización.
3.6 calor latentede fusión y de evaporación.
Energíatérmica.Galorde combustión.
3.6.1 Cambios de estado
Normalmente,
una sustanciaexperimentaun cambiode temperaturacuando absorbeo
cede caloral ambienteque le rodea.Sin embargo,cuandouna sustanciacambiade fase
absorbeo cede calorsin que se produzcaun cambiode su temperatura.El calor Q que es
necesarioaportarparaque una masam de ciertasustanciacambiede fase es iguala
Q=mL
dondeL se denominacalorlatentede la sustanciay dependede!tipo de cambiode fase.
Por ej¡mplo, para que el agua cambie de sólido (hielo)a líquido,a OoCs.q,necesitan
334'108J/kg Paraque cambiede líquidoa vapor a 100 oCse precisan2260'tfr .tftg.
Págln+ f *$ ci* i$g
En la siguientetabla, se proporcionan
los datos referentesa los cambiosde estado de
algunassustancias.
Sustancia
I fusión 'C
L¡.103 (J/kg)
T ebullición
¿, .to3(J/kg)
OC
c
334
l0c
226C
-ll4
105
78,3
846
A,cetona
-94,3
96
524
Benceno
5.5
l2'1
56,2
80,2
A.luminio
658,',]
322-394
Estaño
231,9
Hierro
Cobre
Hielo(agua)
Alcoholetílico
396
59
230C
227C
302(
I53(
293
305C
630C
2t4
236(
541C
Mercurio
l 08:
-38,9
11,73
356,i
285
Plomo
327,
22,5
t75(
88(
Potasio
64
60,8
76C
208C
Sodio
98
883
422C
ll
922A
Fuente: Koshkin,Shirkévich.Manualde Físicaelemental,Edt. Mir (1975)págs. 74-75.
Loscambiosde estadose puedenexplicarde formacualitativa
del siguientemodo:
En un sólidolos átomosy moléculasocupanlasfosigionesfiias dg lo
..r'
v
xr pristalina.Un sólidotiene en ausenciade fuezas externasunÚolúmeffiol una forma
determinada.
Los átomosy moléculasvibran,alrededorde sus posicionesde equilibrioestable,cada
vez con mayoramplituda medidaque se incrementa
la temperatura.
Llegaun momentoen
el que vencena las fuerzasde atracciónque mantienena los átomosen sus posiciones
fijas y el sólido se convierteen líquido.Los átomosy moléculassiguenunidospor las
fuezas de atracción,pero puedenmoverseunos respectode los otros,lo que hace que
los líquidosse adapten al recipienteque los contienepero mantenganun volumen
constante.
Cuandose incrementaaún más la temperatura,
se vencenlas fuezas de atracciónque
mantienenunidosa los átomosy moléculasen el líquido.Las moléculasestán alejadas
unas de las otras,se puedenmoverpor todo el recipienteque las contieney solamente
interaccionan
cuando,estánmuy próximasentresí; en el momentoen el que chocan.Un
gas adoptala forma del recipienteque lo contieney tiende a ocupartodo el volumen
disponible
Un ejemploclásicoen el que se usan los conceptosde calor específicoy calor latentees
el siguiente:
paraconvertir1g de hieloa -20oCen vapora
Determinar
el calorque hay que suministrar
100oC.Los datosson los siguientes:
1.
2.
3.
4.
Calor específico del hielo cn=2090J/(kg K)
Calor de fusión del hielo L¡334.t O3Jng
Calor específico del agua c=4180 J/(kg K)
Calor de vaporización del agua L,=2260't03 Jlfg
Etapas.
1. Se elevala temperatura
de 1g de hielode -20oCa OoC
qáe\"¡uYJ
1.3.,
Qr=O.001'2090'(0-(-20¡¡=a
¿X/ro ._ Obo L k{
2.Se funde
elhielo
d
."-,/"F
03=334J
Qe=0.001'334'1
3. Se eleva la temperaturadel agua de 0oC a 100oC
l
80'(100-0¡=41
6¡
Qs=0.001'41
4. se convierte1 g de aguaa 100oCen vapora la mismatemperatura
1'22604A3=2260J
Q¿=0.00
El calortotalQ=Ql+Q2+Q3+Q4=3053.8
J.
0
-20
IIielo
En la figura,se muestracómo se va incrementando
la temperaturaa medidaque se aporta
calor al sistema. La vaporizacióndel agua requiere de gran cantidadde calor como
podemosobservaren la gráfica(no está hechaa escala)y en los cálculosrealizadosen el
ejemplo.
Si disponemosde una fuentede calorque suministrauna energíaa razónconstantede q
J/s podemoscalcularla duraciónde cadauna de las etapas
t r a g i * a " i S Yc * r 1 g S