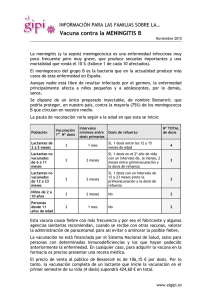
Vacunación frente a la tosferina en las mujeres embarazadas
Anuncio

Vacunación frente a la tosferina en las mujeres embarazadas ÍNDICE 1.Justificación ................................................................................................................................................................................. 2 2.Objetivos ............................................................................................................................................................................................. 3 Objetivo general . . ............................................................................................................................................................................. 3 Objetivo específico ........................................................................................................................................................................ 3 3.Inicio .. ....................................................................................................................................................................................................... 3 4. Recomendaciones y administración .......................................................................................................................... 4 4.1. Centros de atención primaria del Sergas .. ............................................................................................................. 4 4.2. Centros hospitalarios del Sergas .............................................................................................................................. 4 4.3. Otros centros ........................................................................................................................................................................... 4 5. Gestión de las dosis vacunales ....................................................................................................................................... 5 5.1. Carga inicial ................................................................................................................................................................................. 5 5.2. Solicitud de dosis .................................................................................................................................................................. 5 6. Registro de las doses administradas ....................................................................................................................... 6 Anexo: información técnica ......................................................................................................................................................... 7 Vacuna dTpa frente a difteria/tétano/pertussis acelular de baja carga antigénica (Boostrix®) .. ..................................................................................................................................................................... 8 I.Composición ....................................................................................................................................................................................... 8 II.Indicaciones .. ....................................................................................................................................................................................... 8 III. Dosis, pautas, vía de administración y presentación .. ........................................................................................... 9 IV. Eficacia y efectividad de la vacunación durante el embarazo ........................................................................ 9 V. Seguridad de la vacuna ............................................................................................................................................................... 9 VI. Precauciones y contraindicaciones ................................................................................................................................. 10 VII. Compatibilidad con otras vacunas y otros productos . . ...................................................................................... 10 VIII.Notificación de eventos adversos siguientes a la vacunación ..................................................................... 10 Vacunación frente a la tosferina en las mujeres embarazadas 1.Justificación La introducción de la vacuna frente a la tosferina en el programa rutinario de vacunación infantil fue una medida muy efectiva en la disminución del número de casos de enfermedad, pero en los últimos años, y a pesar de las altas coberturas de vacunación, se está observando, igual que sucede en otros países, un incremento de la incidencia de la enfermedad (fundamentalmente en los menores de 6 meses), con un aumento de hospitalizaciones y algunos casos de muerte en niños menores de 3 meses. Este aumento puede entenderse basándose en diversas causas, tales como el comportamiento de esta enfermedad con la aparición de ondas cíclicas cada pocos años (http://www.sergas.es/Saude-publica/Documents/1306/Situación%20en%20 2015.pdf), la sustitución de la vacuna de célula entera por otra vacuna acelular de menor reactogenicidad, pero que puede ser algo menos efectiva en la prevención de la enfermedad y también por la mejora en las pruebas diagnósticas como la PCR. Esta situación epidemiológica motivó que algunos países hayan iniciado la vacunación en el tercer trimestre del embarazo con el objetivo de aumentar la protección al final de este, previniendo la aparición de casos en los recién nacidos, momento de máximo riesgo para ellos, mientras no reciben la primera dosis de vacuna. Los resultados disponibles de los diferentes programas muestran que la vacunación de las embarazadas, incluso con coberturas no muy altas, producen una disminución importante de los casos de infección por Bordetella pertussis en los niños menores de 3 meses. En relación con la seguridad, no se observaron problemas ni en la gestación, ni en el parto, ni en el neonato. Por todas estas razones, el pasado 16 de junio, la Comisión de Salud Pública aprobó la vacunación frente a la tosferina en las embarazadas, concluyendo que las evidencias actualmente disponibles apoyan esa estrategia como la medida más efectiva para la prevención de la tosferina en los menores de 3 meses de edad, y que cada comunidad autónoma evaluará la introducción de esta estrategia en función de su epidemiología, así como de la disponibilidad de vacunas. En Galicia esta estrategia fue aprobada por unanimidad en el seno de la Comisión gallega de enfermedades inmunoprevenibles el pasado 1 de diciembre. El objetivo de esta actuación es proteger a los niños al aumentar la inmunidad frente a la tosferina en las mujeres embarazadas. Al administrar esta vacuna durante la última etapa del embarazo, aumentará temporalmente el nivel de anticuerpos en la mayoría de 2 Vacunación frente a la tosferina en las mujeres embarazadas ellas, lo que permite transferir un alto nivel de anticuerpos a través de la placenta y proteger pasivamente al recién nacido frente a la tosferina hasta que este reciba la primera dosis de vacuna a los dos meses de edad. 2.Objetivos Los objetivos que se pretenden alcanzar se detallan a continuación: Objetivo general Reducir la morbimortalidad por infección por Bordetella pertussis, intentando disminuir el número de personas que la padecen y la gravedad de esta, así como sus complicaciones. Objetivo específico Conseguir una cobertura superior al 60% en las mujeres gestantes que estén entre las semanas 28 y 36 de gestación. 3.Inicio A partir del día 21 de diciembre de 2015. Vacunación frente a la tosferina en las mujeres embarazadas A partir del día Diciembre 21 3 Vacunación frente a la tosferina en las mujeres embarazadas 4. Recomendaciones y administración • Se administrará una dosis de vacuna dTpa (Boostrix) a todas las mujeres embarazadas entre las semanas 28 y 36 de gestación, y preferentemente en la semana 32. • La vacuna debe administrarse en cada embarazo, independientemente del estado previo de vacunación. • Esta recomendación se integra en la vacunación sistemática del Programa gallego de vacunación de la Consellería de Sanidad y del Servicio Gallego de Salud. • La vacuna estará disponible en todos los centros sanitarios públicos y privados que sean puntos de vacunación de adultos. 4.1. Centros de atención primaria del Sergas • La vacuna será administrada por las matronas y/o enfermeras/o de adultos, dependiendo de la organización interna de cada centro. 4.2.Centros hospitalarios del Sergas • La vacuna será administrada preferentemente en los centros de salud. En los casos en que sea necesaria su administración en un centro hospitalario, se derivará al servicio de medicina preventiva. 4.3.Otros centros • La vacuna se administrará en centros privados siempre que sean puntos de vacunación de adultos. 4 Vacunación frente a la tosferina en las mujeres embarazadas 5. Gestión de las dosis vacunales El Programa gallego de vacunaciones suministrará la vacuna dTpa (Boostrix®) a todos los centros asistenciales públicos y privados autorizados como puntos de vacunación que atienden a población adulta. 5.1. Carga inicial: • Los centros pertenecientes al Sergas que cuenten con matrona y los hospitales recibirán una pequeña carga inicial de dosis sin tener que solicitarla. • Los restantes centros (centros de salud, hospitales privados, clínicas privadas, centros médicos...) deberán solicitar las dosis necesarias a la jefatura territorial correspondiente. 5.2.Solicitud de dosis: • Las peticiones deben realizarse a la jefatura territorial de Sanidad correspondiente, a través de la página web del Sergas, como el resto de las vacunas (https://extranet.sergas.es/vaweb/VAWEB/AccesoPeticionesVacunas.aspx? IdPaxina=700263&seccion=0) • La solicitud de dosis deberá adaptarse a las necesidades reales del centro y al número de mujeres embarazadas que estén en el último trimestre del embarazo, teniendo en cuenta que no es necesario hacer acopio, ya que pueden ser suministradas de modo semanal. 5 Vacunación frente a la tosferina en las mujeres embarazadas 6. Registro de las doses administradas En los centros del Sergas, las dosis administradas deben registrarse en IANUS, como cualquier otra vacuna. Los restantes centros registrarán las dosis que administren vía web, seleccionando el grupo de riesgo de las embarazadas (https://extranet.sergas.es/vaweb/VAWEB/AccesoPeticionesVacunas.aspx?IdPaxina=700263&seccion=0) Tanto en los centros de la red Sergas como en el resto, deberá consignarse dentro del campo comentarios la semana de gestación en que se lleva a cabo esta vacunación. Las vacunas deberán ser registradas evitando la demora en la informatización; de este modo, se podrá ir evaluando la cobertura alcanzada, así como la efectividad de la medida. Dada la situación de escasez de esta vacuna, es necesario optimizar su uso, por lo que hay que extremar y ajustar el número de dosis suministradas en relación con las dosis registradas. En caso de duda, los centros deben contactar con la jefatura territorial correspondiente. Si la mujer a la que se le oferta la vacunación renuncia a ella, esta debe consignarse del siguiente modo: • IANUS: en la historia clínica. • Centros privados vía web: en el apartado renuncia que figura en el registro. Santiago de Compostela, 11 de diciembre de 2015 6 Sonia Martínez Arca Ramón Ares Rico DIRECTORA GENERAL DE INNOVACIÓN Y GESTIÓN DE LA SALUD PÚBLICA DIRECTOR GENERAL DE ASISTENCIA SANITARIA DEL SERVICIO GALLEGO DE SALUD Vacunación frente a la tosferina en las mujeres embarazadas Anexo: información técnica Vacunación frente a la tosferina en las mujeres embarazadas Vacuna dTpa frente a difteria/ tétanos/pertussis acelular de baja carga antigénica (Boostrix®) Ficha técnica Boostrix®: http://www.aemps.gob.es/cima/fichasTecnicas. do?metodo=detalleForm I.Composición Vacuna de difteria, tétanos, tosferina acelular, de contenido antigénico reducido (0,5 ml), que contiene: • Toxoide diftérico ≥ 2 U.I. • Toxoide tetánico ≥ de 20 U.I. • Toxoide pertussico 8 µg • Hemaglutinina filamentosa de B. pertussis 8 µg • Pertactina 2,5 µg Adsorbidos en hidróxido de aluminio. II.Indicaciones Según la ficha técnica, la vacuna está indicada para la vacunación de recuerdo frente a la difteria, tétanos y tosferina a partir de los 4 años de edad. No está indicada para la inmunización primaria. 8 Vacunación frente a la tosferina en las mujeres embarazadas III. Dosis, pautas, vía de administración y presentación • Una dosis de vacuna en cada embarazo. • En caso de que alguna embarazada esté recibiendo una pauta de vacunación frente al tétanos-difteria, se sustituirá una de las dosis por vacuna dTpa y se administrará preferentemente en el período óptimo de vacunación. • Vía de administración: intramuscular, en el músculo deltoides. • La vacuna se presenta en jeringuilla precargada, con aguja intercambiable, en cajas monodosis o también en envases multidosis (10 dosis) y no necesita reconstitución. IV. Eficacia y efectividad de la vacunación durante el embarazo En los estudios llevados a cabo en el Reino Unido para valorar la efectividad en mujeres embarazadas vacunadas con dTpa en el último trimestre de gestación, se observó una efectividad, en los niños menores de dos meses, de un 90% (IC95% 82-95) en aquellas madres que se vacunaron durante su gestación. La transmisión placentaria de anticuerpos es eficiente. Algunos estudios describen que puede existir una interferencia en la respuesta a la vacuna en los niños nacidos de madres vacunadas durante el embarazo, aunque esta desaparece tras la dosis de recuerdo. El potencial beneficio de la protección conferida por los anticuerpos maternos en el lactante menor de 3 meses siempre es superior al posible riesgo de que aparezca tosferina en el lactante mayor por la disminución de la inmunogenicidad en la serie primaria. V. Seguridad de la vacuna Diferentes estudios, así como la experiencia en los países donde está introducida esta vacuna, ponen de manifiesto que la vacuna dTpa administrada a la gestante es segura y efectiva para proteger al neonato frente a la tosferina. En un estudio reciente realizado en el Reino Unido, en casi 18.000 mujeres embarazadas vacunadas no hubo un mayor riesgo para el embarazo o para el bebé tras administrar la vacuna. Las reacciones adversas que pueden presentarse, en general, son de tipo local, con dolor o inflamación en el lugar de la inyección; otras reacciones son infrecuentes. 9 Vacunación frente a la tosferina en las mujeres embarazadas VI. Precauciones y contraindicaciones La vacuna está contraindicada en el caso de reacción anafiláctica a una dosis previa de vacuna o a algún componente de la vacuna. Al igual que con otras vacunas, la administración de la vacuna debe posponerse en caso de que el paciente sufra enfermedad febril aguda grave. VII. Compatibilidad con otras vacunas y otros productos La vacuna dTpa puede administrarse conjuntamente (en lugares anatómicos diferentes) con la vacuna antigripal si coincide con la temporada gripal o con cualquier intervalo entre ellas. La vacuna dTpa es una vacuna inactivada, por lo que puede ser administrada al mismo tiempo o en cualquier momento que la gammaglobulina antiD (Rh) sin interferencia en su administración. VIII.Notificación de eventos adversos siguientes a la vacunación Debe notificarse cualquier evento adverso siguiente a la vacunación, y se recuerda, como para cualquier otro medicamento, la obligatoriedad de notificar las sospechas de efectos adversos. Estos eventos se definen como cualquier acontecimiento adverso en relación temporal con la administración de la vacuna y que puede estar causado o no por ella. En este sentido, debe notificarse todo acontecimiento clínico que ocurra en el plazo de 6 semanas tras la administración de la vacuna, sea este acontecimiento una posible reacción o no. La notificación se realizará a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano mediante la tarjeta amarilla: https://www.notificaram.es/ Santiago de Compostela, 11 de diciembre de 2015 10 xunta.gal