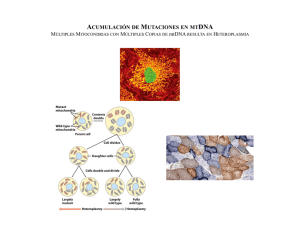
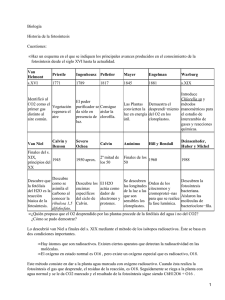
La Fotosíntesis
Anuncio

La Fotosíntesis Comencemos por definir a la fotosíntesis como "síntesis (formación) con la ayuda de la luz". En realidad cuando hablamos de fotosíntesis nos estamos refiriendo al proceso que llevan a cabo las plantas y otros microorganismos y que consiste, en términos generales, en la formación de materia orgánica mediante la luz. Como la materia orgánica contiene fundamentalmente carbono, hidrógeno y oxígeno, la fotosíntesis se refiere mayoritariamente a la incorporación de estos elementos, que proceden del CO2 y el agua, en materia orgánica. No debemos olvidar que la fotosíntesis también se refiere a la reducción de compuestos inorgánicos diferentes del CO2 como son el nitrato y el sulfato y su incorporación, en aminoácidos. Interacción de la luz con los organismos vivos. Los organismos fotosintéticos sólo aprovechan una parte muy pequeña de la energía que llega a la superficie terrestre, del orden del 0,1 %, es decir, un fotón de cada 1000 que caen sobre la superficie de la Tierra. A pesar de que sólo una parte muy pequeña de la energía es la que se absorbe por la planta, es tal el volumen de materia orgánica que se produce en toda la Tierra mediante la fotosíntesis que, si fuera caña de azúcar lo que se formara, se produciría al año una pila de más de unos 3 km de altura y de 10 km de lado. Aproximadamente la mitad de la biomasa vegetal que se produce por fotosíntesis lo hace en el ecosistema terrestre, mientras que la otra mitad lo hacen los océanos. En términos energéticos, la producción anual de biomasa es sólo un orden de magnitud menor a las reservas de biomasa en forma de bosques, y combustibles fósiles demostradas, tales como el carbón, gas natural y petróleo, aunque posiblemente exista otro orden de magnitud mayor de reservas probables. Desde otro punto de vista podemos decir que la energía fijada por el reino vegetal es equivalente a unas diez veces el consumo industrial, a nivel mundial y unas 200 veces superior a los requerimientos energéticos de la humanidad en forma de alimentos. Debe tenerse en cuenta, no obstante, que aunque el consumo individual de energía en forma de alimentos por un hombre es del orden de 100 W, el consumo de una bombilla eléctrica, el hombre del mundo occidental necesita mucha más energía para satisfacer su alto nivel de vida y confort, que es del orden de 10 kW. Podemos, por tanto, considerar que la vida en nuestro planeta se mantiene porque nos llega una energía de origen nuclear. De manera que, a pesar de la mala fama que la energía nuclear tiene en nuestra sociedad, nosotros dependemos y debemos nuestra existencia a ella. Bien es verdad que tenemos la salvaguarda de que tenemos a la central nuclear a una buena distancia de nosotros, unos 150 millones de Km de distancia y, además, en un territorio donde nadie ha protestado. Historia del conocimiento de la fotosíntesis Uno de los primeros pensamientos recogidos acerca de la función de hojas en las plantas se debe a Aristóteles que dijo que éstas tienen como misión dar sombra y proteger a las partes tiernas y débiles de la planta, como son los brotes. Esa era una observación sagaz pero errónea aunque compresible por nosotros si pensamos fue elaborada en un caluroso día de verano en Grecia. No podía imaginar Aristóteles que las hojas eran una activa factoría en la que se produce un activo intercambio de gases y fabricación de material para la planta. Si nos referimos a la historia de la fotosíntesis podemos decir que empieza poco después de que se descubriera la composición del aire. En 1648, es decir, cuando en España andábamos luchando con los turcos, aproximadamente cuando vivía el tatarabuelo de nuestro tatarabuelo. En esa época el holandés van Helmont cultivó una planta en un recipiente y comprobó que la tierra perdía mucho menos peso que lo que se incorporaba en la planta que, en caso de ser un árbol, era muy grande. Pensó que el aumento de peso se debía al agua que había que añadirle a la tierra durante todo el crecimiento de la planta y dedujo, por lo tanto, que la masa de la planta procedía solamente del agua. Fue casi un siglo más tarde cuando el clérigo inglés Stephan Hales reconoció que una parte del aire contribuía a alimentar a la planta diciendo que el Creador había puesto al aire para que respiraran los animales así como también las plantas. Se rompía así con la tesis de Aristóteles que proponía que las plantas se alimentaban exclusivamente del humus que contiene la tierra. En realidad los tres tenían razón porque la planta asimila agua, humus y una parte del aire. Hales también intuyó que la luz tenía un papel importante en el proceso, aunque no llegó a probarlo. Fue el pastor inglés inconformista y simpatizante con la Revolución francesa Priestley, al que por este motivo, le saquearon su casa emigrando a Pensilvania, quien demostrará que en el aire había un elemento, que llamaría aire deflogisticado y posteriormente Lavoisier oxígeno. Priestley pudo demostrar que una planta restauraba el aire empobrecido por arder una vela en él. De esta manera se pudo explicar racionalmente por qué el aire de nuestro planeta se mantiene puro a pesar de que los hombres y animales lo consuman constantemente mediante la combustión y no se haga irrespirable. De acuerdo con sus observaciones ya dijo que ello hace que cualquier planta, por minúscula y olvidada que se encuentre en un rincón de nuestro planeta contribuye a limpiar y purificar nuestra atmósfera. Un médico de la corte de la emperatriz de Austria María Teresa, el holandés Jan Higenhousz, impresionado por los descubrimientos de Priestley, al que había oído en una conferencia que se dio en Londres, alquiló en la primera ocasión que tuvo, que fue unos seis años después, una casita en Londres para hacer experimentos sobre el efecto de la luz en la acción limpiadora del aire que llevan a cabo las plantas. En un libro publicado en 1796 y titulado “Experimentos con vegetales, descubrimiento del poder purificador del aire en la luz y de su envenenamiento en la oscuridad”. Se decía que las plantas, a través de las hojas y tallos verdes, purifican el aire tanto más cuanto más expuestas están a la luz y que en la oscuridad se desprenden gases muy nocivos. Por ese mismo tiempo el pastor suizo Jean Senebier publicó en Ginebra un tratado sobre la influencia de la luz solar para modificar los seres de tres reinos, sobre todo del vegetal. Hizo esencialmente la misma observación que Hignehousz, pero añadió que la actividad de restauración del aire por las plantas dependía de la presencia de "aire fijado" que es como se denominaba entonces al dióxido de carbono. Quedaba por descubrir el otro reactivo implicado en la fotosíntesis, que había sido descrito cualitativamente por van Helmont, pero no medido: el agua. Nicolas de Saussure, también de Ginebra, midió cuidadosamente el peso de la planta y descubrió que el peso de ésta, junto con el del oxígeno desprendido, pesaban mucho más que el "aire fijado" por la planta y que la diferencia era el agua que se añadía a la tierra. Propuso la siguiente ecuación: luz aire fijado + agua --Æ aire vital + materia orgánica planta verde En esta ecuación el aire fijado y la materia orgánica se deben a Senebier la inclusión del agua a Saussure La implicación de luz y la planta verde, que se refiere, en realidad, a los cloroplastos, a Ingenhousz y el aire vital, el oxígeno, a Priestley. Queda un nombre que añadir al nacimiento de la fotosíntesis y es el del médico alemán Julius Robert Mayer que propuso que la energía luminosa se transforma en energía química. Las plantas no sólo son creadoras de materia orgánica sino que son también los almacenadores de la energía que pasa a ser energía química. Se podría entonces escribir la ecuación CO2 + H2O + luz --Æ O2 + materia orgánica + energía química Él llamó a la energía "poder" y a la energía química "diferencia química", pero ahora se puede considerar como correcto el planteamiento de la fotosíntesis. Estos son los padres de la fotosíntesis porque ellos plantearon todos los elementos que intervienen en dicho proceso. Son un ejemplo de interacción entre los pueblos, puesto que hay un holandés, un francés, un inglés, un suizo y un alemán. No se puede decir, sin embargo, que hubiera armonía entre ellos, ya que el carácter y la situación social de alguno de ellos, como Hingenhousz, un médico imperial, era muy diferente de la de un discreto pastor protestante provinciano y paleto, como Senebier. Ha pasado mucho tiempo y la situación, aunque sigue igual, algo ha mejorado. Una vez que se demostró que el dióxido de carbono asimilado por las plantas se transformaba en almidón y que ello ocurría en los cuerpos cloróficos o cloroplastos, ya estaba formulada la fotosíntesis en sus términos actuales, de acuerdo con la ecuación: CO2 + H 2O -----Æ (CH2O)n + O2 No obstante, se creyó erróneamente que el oxígeno que se desprendía procedía del CO2 y no del agua, como ocurre realmente. De hecho Otto Warburg, uno de los mayores científicos en el estudio de la bioenergética de todos los tiempos defendió esta tesis hasta su muerte, que fue en 1970. Debido a su gran prestigio científico y a su notable arrogancia sus opiniones equivocadas, como consecuencia, en gran medida a la ignorancia que profesó respecto del trabajo de otros, hizo que se retrasara considerablemente el avance de este campo científico. Warburg había introducido el alga unicelular Chlorella en los estudios de Fisiología Vegetal debido a que es muy fácil de cultivar y a que se pueden producir grandes cantidades de material fotosintético en relativamente poco tiempo. A Warburg se deben, además, las técnicas manométricas para la medida de procesos fisiológicos. El aparato de Warburg ha estado presente en todos los laboratorios de bioquímica hasta hace unos 10 o 15 años. En ellos se medían los cambios de volumen de los gases que se generaban en reacciones de respiración o de fotosíntesis ya que en dichos aparatos se podían iluminar las vasijas. Hoy día las medidas de oxígeno se hacen polarográficamente mediante un sencillo aparato que se llama el electrodo de oxígeno y que no necesita la limpieza de las vasijas y su cuidadoso calibrado, que exigía mucho tiempo de manipulación. Warburg midió el rendimiento cuántico de la fotosíntesis en Chlorella y dijo que la reducción de 1 mol de CO2 requería 4 quanta de luz. Es decir, que la rotura de 2 moléculas de agua y la liberación de 4 electrones del H que eran recuperados como poder reductor, requerían 4 fotones. Teniendo en cuenta la energía de los quanta a 680 nm y la energía química que se aprovechaba en el CO2 reducido resultaba un rendimiento del 70 %. Eso significaría que la fotosíntesis era un proceso que tiene lugar con un rendimiento mucho mayor que las mayoría de las máquinas conocidas así como de otros procesos biológicos. Eso levantó mucha polémica y muchos se lanzaron a comprobar sus datos, pero él los ignoró. Proponía que en un mundo perfecto la fotosíntesis debe ser perfecta y que podría llegar a un rendimiento cuántico de 3, es decir, cercano al 100 %. Ignoró a su vez a los demás científicos que, usando las técnicas manométricas que él había desarrollado, obtenían rendimientos menores. Hoy día se acepta que el rendimiento cuántico de la fotosíntesis es de 8 fotones por mol de CO2 fijado estando el rendimiento próximo al 30 %. Ello se debe, como se verá más adelante, a que por cada electrón, o átomo de hidrógeno que se promueve son necesarios dos fotones de luz. También se debe a Warburg el empleo de ciertos colorantes, como las quinonas, que eran utilizados como aceptores de electrones en reacciones de óxido-reducción y que han facilitado la medida de tales reacciones debido al cambio de color que sufre dichos compuestos al cambiar de estado redox. Reacciones básicas de la Fotosíntesis. La fotosíntesis puede formularse, en sus términos actuales como la reacción mediante la cual el dióxido de carbono es asimilado por las plantas transformándolo en almidón y desprendiendo oxígeno molecular. Dicha reacción tiene lugar en las plantas en los orgánulos cuerpos cloróficos o cloroplastos, de acuerdo con la ecuación: CO2 + H 2O -----Æ (CH2O)n + O2 Dicha reacción implica que se asimila el anhídrido carbónico, que procede del aire, además de agua y, todo ello en presencia de la luz, que es un elemento indispensable para la fotosíntesis. Otros organismos llevan a cabo el proceso de la fotosíntesis, aunque no esté formulada exactamente como se ha escrito más arriba. Algunos organismos procariotas, como son las bacterias fotosintéticas, no utilizan el agua como donador de electrones y, por tanto, no desprenden oxígeno. Otros procariotas, como son las cianobacterias, llevan a cabo una fotosíntesis análoga a la de las plantas, es decir oxigénica. Se puede dividir la fotosíntesis en dos tipos de procesos: los que implican el aprovechamiento de la luz y su transformación en energía química, lo que se denomina la fase luminosa de la fotosíntesis, y aquella mediante la cual el anhídrido carbónico se fija mediante el consumo de ATP y NADPH, un proceso típicamente bioquímico, y que se denomina fase oscura, no porque requiera la oscuridad, sino porque no se necesita la luz. No cabe duda que la medida del proceso completo de la fotosíntesis resulta complejo ya que son muchos los requisitos exigidos. Por ello resulta esencial, para el estudio de dicho proceso, disponer de un ensayo más sencillo. Un ensayo que permita medir la fase luminosa independientemente de la oscura. Un paso transcendental en el desarrollo de la fotosíntesis fue la formulación que hizo van Niel en 1929 que consideraba que se trataba de un proceso redox en el que se produce la reducción de CO2 y la oxidación de H2O. Esta propuesta permite escribir la ecuación de la fotosíntesis en los términos reales, tal como se acepta hoy día, es decir, que consiste en la reducción del CO2, en realidad también del nitrato y nitrito, además del sulfato, mediante donadores de hidrógeno o de electrones: CO2 + 2 H 2O + h• ------ [CH2O] + O2 + H 2O Hay diferencias, como veremos, en lo que se refiere a la naturaleza de los donadores de electrones, pues, si bien en las plantas y cianobacterias se utiliza el agua, en las bacterias fotosintéticas se utilizan otros compuestos tales como el SH2 o un compuesto orgánico: CO2 + 2 H 2S + h• ----- [CH2O]n o bien: CO2 + 2 H 2A + h• ----- [CH2O]n + 2 S + H 2O + 2 A + H 2O Hasta este momento, y son sólo unos cincuenta años atrás, para estudiar la fotosíntesis había que usar células enteras. Si se intentaba fraccionarlas, se perdía su capacidad para realizar reacciones fotoquímicas. La elección era sencilla: o células enteras con actividad fotosintética o fracciones muertas. Esto cambió en los años entre 1937 y 39 cuando Robin Hill recogió una antigua observación de que las hojas secas y hechas polvo desprendían oxígeno al exponerlas a la luz. Este efecto duraba poco y podía ser prolongado si se añadía a las hojas sales de hierro tales como el oxalato férrico. En realidad lo que estaba ocurriendo es que la sal de hierro se estaba reduciendo en la luz y se desprendía oxígeno. En lugar del oxalato de hierro se empezaron a usar las quinonas que había descrito Warburg o, el mejor de todos y que desde entonces se usa en todos los estudios de fotosíntesis como el reactivo de Hill por excelencia, el ferricianuro, un compuesto con un potencial redox muy oxidante, estable, barato muy soluble y con propiedades cinéticas muy apropiadas para reaccionar con los centros fotosintéticos. Esta observación es semejante a la que efectuaron los hermanos Buchner cuando rompieron las células de levaduras y observaron que el extracto producía la fermentación de la glucosa que se consumía en el proceso al mismo tiempo que se desprendía CO2. Mediante la reacción de Hill se podían separar los distintos procesos de la fotosíntesis, al mismo tiempo que se podía iniciar una búsqueda del material más adecuado para llevar a cabo el estudio de dichas reacciones. Se consiguió aislar los cloroplastos del resto de la célula y demostrar que éstos siguen produciendo la reacción de Hill. Se escogió la espinaca porque era fácilmente asequible y porque presenta muchas ventajas adicionales, como es que se rompen con facilidad así como que no liberan fenoles y polifenoles que inactivan a los enzimas que se obtienen al romper las células. En este caso se podían estudiar las reacciones luminosas aisladas de las otras reacciones enzimáticas acopladas a ellas. También se podía evaluar y cuantificar el proceso puesto que se podían llevar a cabo estudios cinéticos. En realidad lo que se produce es, ni más ni menos, que la foto-oxidación del agua. Más adelante se comprobó que también se podía sustituir el donador de electrones, que en el caso de los cloroplatos es el agua, por otros reactivos químicos, tales como el DCPIP y el ascorbato. Se puede así medir flujo de electrones desde el ascorbato hasta el ferricianuro. Por otra parte, esta reacción permitió resolver el problema de si lo que se rompe para dar oxígeno era el CO2 o el agua. Claramente se comprueba que, en ausencia de CO2, hay todavía desprendimiento de oxígeno y que, por lo tanto, procede del agua. Se propone un esquema para la fotosíntesis como un proceso que tiene lugar a través de reacciones fotoquímicas que llevan consigo procesos de óxido-reducción, junto con otros procesos enzimáticos mediante los cuales se produce la reducción del anhídrido carbónico y la oxidación del agua. Es un paso adelante aunque, como veremos dentro de muy poco, está equivocado. Un experimento muy indicativo de lo que ocurre en la fotosíntesis y que fue realizado y analizado con detalle proporcionando mucha información es el espectro de acción de la fotosíntesis. Es sabido que la fotosíntesis requiere luz, pero, ¿de qué longitud de onda? es decir, ¿cuál es la actividad fotosintética de una preparación iluminada con una luz monocromática de una determinada longitud de onda? Emerson describió que al iluminar las preparaciones con luz del orden de 680 nm para arriba se producía una bajada en la actividad de la fotosíntesis. Esa bajada se compensaba al iluminar simultáneamente con luz de baja longitud de onda y de alta longitud de onda. El efecto era superior a la suma de las actividades a las dos longitudes de onda. Ello llevó directamente a proponer que en la fotosíntesis participan dos fotosistemas que se excitan a dos longitudes de onda diferentes y que actúan en paralelo. Por entonces se describió la espectroscopia diferencial como una técnica muy poderosa. La razón es que en fotosíntesis se trabaja con un material coloreado que cambia su espectro al actuar, es decir, al iluminarlo. Por ello, si se dispone de una técnica que permita observar los cambios a una determinada longitud de onda mientras que se activa al iluminarlo con otra luz diferente y más intensa, se pueden analizar los componentes de la reacción. En realidad se esperaba detectar cambios en las clorofilas, cosa que no ocurrió, pero permitió descubrir los citocromos, componentes fundamentales de los tejidos fotosintéticos. En la época de los años 60 Hill y Bendall propusieron el expresivo esquema en Z de la fotosíntesis que tanto éxito ha tenido y en el que se aceptaba la existencia de dos fotosistemas además de que justifica la energética para la formación de ATP como consecuencia de la liberación de energía en reacciones de transferencia de electrones entre los componentes de una cadena de transporte. De los dos citocromos presentes en las células de plantas el b6 podía ser utilizado en su forma oxidada como aceptor de electrones de lo que ahora llamamos el fotosistema II en la luz; mientras tanto, el citocromo f, en su forma reducida podía ser utilizado como donador de electrones por el que hoy se conoce como fotosistema I. El esquema en Z es, pues la consecuencia de unir las dos reacciones correspondientes a los dos fotosistemas. No obstante, en estas primeras etapas del estudio de la reacción de Hill parecía que los cloroplastos eran incapaces de llevar a cabo la fotosíntesis real. Parecía que sólo podían reducir compuestos relativamente oxidantes, en concreto de potencial mayor de 0,00 V. No obstante se comprobó después que, si la reacción se lleva a cabo con cuidado para que se eviten reacciones en la dirección opuesta, se pueden reducir compuestos muy reductores. En concreto se puede reducir el NADP+ cuyo potencial es - 0,34 V. En este caso deben estar presentes algunos componentes adicionales de la preparación de cloroplastos, tales como una proteína de hierro que se denomina ferredoxina así como una flavoproteína denominada ferredoxina-NADP+ reductasa y que en un primer momento se llamó TNPN reductasa. Curiosamente estos hechos fueron descubiertos por Vishniac y Ochoa en 1951 en Nueva York y luego por Anthony San Pietro en la John Hopkins y Daniel Arnon en Berkeley. Se acepta por fin, que la fotosíntesis consiste en la reducción del NADP+ a NADPH. En muchas células en las que se lleva a cabo síntesis de compuestos de carbono, como es el caso de las células fotosintéticas, se sabía que eran necesarias tanto el NADPH como el ATP, un compuesto bien conocido como moneda energética. Ya hemos visto que se puede producir NADPH como consecuencia del transporte de electrones en la fotosíntesis, pero ¿qué ocurre con el ATP? Otros investigadores habían indicado que los cloroplastos no producen ATP quedando dicha función restringida a las mitocondrias. Sin embargo los tejidos fotosintéticamente más activos tenían pocas mitocondrias y debían producir mucho ATP para llevar a cabo su acción sintetizadora. Para investigarlo Daniel Arnon decide trabajar con cloroplastos aislados por el procedimiento que todavía se usa y comprueba que se produce incorporación de CO2 y que los productos formados son los productos conocidos de la fotosíntesis. Esto quiere decir que los cloroplastos llevan también a cabo las reacciones enzimáticas que consumen ATP y conducen a fijar el CO2. Entonces le añadieron a preparaciones de cloroplastos los precursores del ATP, el ADP y P y, en la luz y en presencia de CO2 tuvieron síntesis de carbohidratos. Se probó que había síntesis de ATP en lo que se llamó fosforilación fotosintética o fotofosforilación. En este proceso no había síntesis de NADPH. Más adelante se probó que también podía haber síntesis de NADPH y de ATP en el mismo proceso, en cuyo caso debía haber ferredoxina y el enzima que entonces se llamó TPN reductasa, en lo que se llamó fotofosforilación no cíclica para distinguirla de la anterior que se denominó fotofosforilación cíclica. Quedaba por debatir, no obstante, que el rendimiento de la reacción en las condiciones de laboratorio era siempre una fracción pequeña respecto de la que tiene lugar en las células de Chlorella intactas y responder a la pregunta de si estaba faltando algo en este sistema. Más tarde Calvin utilizó el isótopo radiactivo del carbono, el 14C para marcar el CO2 y poder así establecer la ruta de incorporación de este compuesto en material orgánico, aunque más tarde se comprobó que hay plantas, las C4, que siguen otra ruta. No obstante, la diferencia radica sólo en las primeras fases porque, en realidad las plantas C4 luego se comportan como las C3, como se sabe bien. Entramos ahora en un período, que se podría situar alrededor del 70, que se puede denominar como el del conocimiento a nivel molecular de la fotosíntesis. Se va desvelando la naturaleza de los componentes de los aparatos fotosintéticos. Se han aislado los componentes de los cloroplastos y de las bacterias fotosintéticas y se han manipulado las preparaciones de membranas fotosintéticas para hacerlas cada vez más simples, con menos componentes, de manera que den respuestas más concretas a preguntas de cómo funcionan. Se podría considerar que es la época de la espectroscopia rápida. Se quieren conocer los mecanismos de las reacciones luminosas. Es decir, los sucesos que ocurren una vez que el pigmento que lleva a cabo el proceso fotoquímico es excitado por la luz. Eso significa conocer la naturaleza de lo que se llamó el aceptor primario de electrones. Es decir, cuando se excita la clorofila para dar su electrón a quién se lo da de los muchos componentes que hay en las membranas con las que se trabaja. De aquí la importancia de la composición de la muestra. Se emplean detergentes que actúan selectivamente sobre las membranas eliminando unos componentes u otros y afectando a la función de la membrana. Pero se quiere saber cuál es el aceptor primario de electrones de cada uno de los fotosistemas que hay en los cloroplastos y las cianobacterias. Para ello se desarrollan métodos que exciten a la clorofila de manera muy rápida e intensa, aparatos de láser, así como sistemas que permitan medir la transferencia de electrones que ha tenido lugar. Para ello se utilizan técnicas espectrofotométricas, que miden cambios de color de pigmentos o proteínas coloreadas que hay en las membranas, o bien de EPR, que permiten medir aparición de especies paramagnéticas mediante una reacción redox que afecta a un componente de la membrana fotosintética. En otros apartados veremos la aplicación de ambas técnicas al estudio de la fotosíntesis. En cualquier caso, ello llevó consigo el descubrimiento de los diferentes componentes que intervienen en la fotosíntesis, tales como los pigmentos P680 y P700, el P430 así como de los citocromos y centros sulfoférricos que participan en estas reacciones. Se planteaba, no obstante, un problema que hizo que se llegara a ralentizar el desarrollo en este campo debido a que siempre quedaba la duda de si el cambio que se observaba después de la iluminación de la muestra correspondía a la reducción del aceptor primario o de otro compuesto de la cadena que se encontraba después, es decir, que el instrumento no era suficientemente rápido para captar el primero de los componentes de la cadena. Ello llevó a desarrollar técnicas más y más rápidas. Del milisegundo se pasó al microsegundo, de ahí al picosegundo y ahora estoamos en el fentosegundo y ello a base de resolver problemas cada vez más complejos. Todos eso cambió de aspecto cuando en 1983 Deisenhoffer, Huber y Michel cristalizaron la molécula del centro fotosintético de Rhodopseudomonas viridis una bacteria púrpura cuyo centro es semejante al PS II de plantas y determinaron su estructura. EN los años siguientes se ha ido determinado la estructura de los centros de reacción PS I y PS II a niveles de resolución suficiente para poder identificar a todos y cada uno de los pigmentos que intervienen en el proceso de fotosíntesis. La información obtenida a partir de las estructuras de los complejos ha servido para confirmar los datos obtenidos a partir de las técnicas espectroscópicas y que se refieren a la organización de los centros fotosintéticos así como de los pigmentos que intervienen. Es de desatacar que prácticamente todas la información conocida anteriormente se ha visto confirmada por los datos de estructura. No es el final del camino. No se sabe cómo se lleva a cabo la fotosíntesis, sino que ahora se pueden interpretar los resultados sobre una base real, de acuerdo a la naturaleza de los compuestos presentes en las estructuras de los centros fotosintéticos. BIBLIOGRAFIA Dinamics of the history of photsynthesis research. H. Hzisige and B. Ke Photos. Res. 38, 185-209 (1993) Fotosíntesis: sol, agua, tierra y aire M.A. de la Rosa, M.G. Guerreo y M. Losada Mundo Científico nº vol 13 138 744 (1993) Fotobioquímica M. A. de la Rosa, M. Hervás, A. Serrano y M. Losada Editorial Síntesis, Madrid 1990 Discurso Sevilla de investidura como Doctor Honoris Causa por la Universidad de D.I. Arnon 1992 Photosynthesis E. Rabinobitz and Govindjee John Wiley, New York, 1969 The vital force F.M. Harold W.H. Freeman, New York, 1986 Composición y organización de las membranas fotosintéticas Entre los organismos que llevan a cabo fotosíntesis están las bacterias fotosintéticas, los organismos fotosintéticos más primitivos que tienen un aparato fotosintético más simple y que, como característica interesante, utilizan otros materiales diferentes al agua como donadores de electrones. La fotosíntesis se realiza mediante proteínas y otros componentes que se encuentran en las membranas. Dichas membranas se denominan tilacoides y se extienden hacia el interior de las células procariotas donde se hace la fotosíntesis. Las células fotosintéticas eucariotas han adquirido un orgánulo especializado para esta función: el cloroplasto que, en realidad, es una cianobacteria englobada dentro de la propia célula habiéndose logrado una simbiosis muy provechosa para ambos entes vivos. De ese origen habla el hecho de que los cloroplastos mantienen todavía una dotación génica en forma de DNA que han mantenido, reducido en parte, a través de todos los millones de años que ha durado dicha simbiosis. Parte de la dotación génica del cloroplasto se ha ido perdiendo a lo largo de los años, por lo que muchas de las proteínas de los cloroplastos deben incorporarse desde la propia célula porque han sido sintetizadas con la información génica del núcleo. Los cloroplastos, que son orgánulos de gran tamaño (unas 5 µm de diámetro), poseen una membrana externa fácilmente permeable a los diferentes solutos que intervienen en la fotosíntesis, un espacio intermembrana y una membrana interna mucho más selectiva que la externa que se extiende hacia el interior del cloroplasto formando una compleja red de membrana que se denominan tilacoides. La función principal de las membranas de la envoltura del cloroplasto es controlar el flujo de metabolitos, lípidos y proteínas dentro y fuera del CP. Además, en ellas están localizados los sistemas responsables de la síntesis, procesamiento y ensamblaje de los lípidos, pigmentos y proteínas de la membrana. La membrana interna sirve de barrera al paso de moléculas grandes tales como las proteínas del citoplasma al espacio entre membranas. Los tilacoides pueden formar unos saquitos, unos espacios cerrados que se apilan dando lugar a lo que se denominan los grana. El espacio del interior de los tilacoides es el lumen. Los tilacoides que no están formando esas estructuras sino que están uniendo unos grana con otros son lo que se denomina lamelas. Por último, el espacio de la célula o el cloroplasto que está relleno por una solución acuosa en donde se encuentran los enzimas que realizan la fase oscura de la fotosíntesis se llama estroma y es el equivalente de la matriz mitocondrial. Los principales componentes del estroma son: - muchas (300) copias de DNA, ribosomas 70S, mRNA y otros elementos necesarios para la síntesis de proteínas; - enzimas implicadas en la reducción del carbono y nitrógeno - enzimas implicadas en la síntesis de los lípidos, porfirinas, terpenoides, quinonas y compuestos aromáticos. - gránulos de almidón En organismos más simples la fotosíntesis tiene lugar en estructuras membranosas que no forman orgánulos cerrados, sino que están integrados en la propia célula. Tal es el caso de las cianobacterias en donde las membranas del tilacoide están repartidas en la célula. En el caso de bacterias fotosintéticas la fotosíntesis lo lleva a cabo la membrana que rodea a la célula. Las membranas de las bacterias fotosintéticas se pueden romper mediante sonicación liberando el contenido interior y volviéndose a cerrar formándose lo que se conoce como cromatóforos que son elementos muy útiles para el estudio de la fotosíntesis. Constituyentes de las membranas del tilacoide Como todas las membranas celulares están compuestas por lípidos proteínas y pigmentos. Los lípidos de la membrana fotosíntesis difieren mucho de los del resto de la planta apoyando el origen procariótico de estos orgánulos. Los lípidos son de varias clases, aunque hay muy pocos fosfolípidos (5-10 % de fosfatidil-colina y fosfatidilglicerol), la mayoría son mono y di-glactosil-diacil gliceroles sin carga (80 % repartidos en una 50 % de MGDG y 25 % de DGDG) y el resto son los sulfolípidos sulfoquinovosil-diacil gliceroles (5 %) y diglicil-trimetil homoserina DGTS. Las cadenas laterales de los lípidos contienen ácidos grasos muy insaturados como el linoleíco. Las proteínas de la membrana son casi en su totalidad los componentes de los centros de reacción fotosintéticos y los componentes de las cadenas de transporte fotosintético. Hay cinco complejos proteicos que atraviesan la membrana del tilacoide y que intervienen en la fotosíntesis. Hay tres complejos que contienen clorofila: el PS I (que tiene asociado un complejo antena que capta la luz, el LHC I), el PS II, que lleva también asociadas algunas moléculas de clorofila en lo que se conoce como la antena interna y el complejo LHC II, que está separado del PS II, aunque funciona generalmente acoplado con él. Los otros dos complejos no llevan clorofila y son el complejo citocromo b6f y la ATP sintasa. Hay un estudio interesante referente al papel de un lípido en una membrana en fotosíntesis. El funcionamiento eficiente del LHC II requiere la formación de trímeros y ello depende de la presencia de un fosfatidil-glicerol que contiene un ácido graso de 16 átomos de carbono con una insaturación en la posición 11. La disminución en el contenido de este ácido graso provoca la disociación de los trímeros y la menor capacidad de captar luz. Esta facultad la explotan algunas plantas de arroz que se aclimatan al frío disminuyendo la síntesis de este ácido graso y evitando así el daño producido por la luz en estas condiciones de bajo rendimiento fotosintético. Los pigmentos fotosintéticos: absorción de la luz En las membranas es donde se realiza la fotosíntesis. Por ello es necesario que existan en ese espacio pigmentos que recojan la luz, la primera fase para que se pueda llevar a cabo su transformación en energía química. Un pigmento es cualquier sustancia capaz de absorber luz visible. El hecho de que las plantas utilicen la luz visible se debe no a que es la que tiene una mayor cantidad de energía, que corresponde la UV, sino que es aquella de la que mayor cantidad cae sobre la superficie de la Tierra. Es decir, aquella que produce una gran intensidad aunque de poca energía. Por otra parte, el hecho de que se utilice una energía de poca intensidad produce un menor daño en las estructuras biológicas que lo soportan. La luz activa en la fotosíntesis es la comprendida entre longitudes de onda entre 400 y 700 nm. Hay dos tipos de pigmentos en cuanto a su función, no a su composición: antena y centros de reacción que se refiere a que sean los encargados simplemente de captar la luz o los responsables de llevar a cabo la reacción fotoquímica. Dichos pigmentos son fundamentalmente las clorofilas, de las cuales hay dos especies que difieren en la naturaleza de los sustituyentes del anillo de la porfirina, la a y la b. La clorofila, como pigmento de las plantas es la sustancia más importante del mundo. Gracias a ella se produce la entrada de los alimentos en la cadena de alimentación de todos los animales, incluyendo al hombre. Los pigmentos absorben la luz y se excitan. Luego pueden perder esa energía de tres maneras: calor, emisión de fluorescencia y fotoquímica. Existen también carotenos que tienen un espectro de absorción complementario al de las clorofilas. En las cianobacterias y algas rojas existen también otros pigmentos accesorios que están constituidos por una serie de pirroles lineales, son la ficobilinas, que poseen un color azulado-violeta. Las ficobilinas se unen covalentemente a proteínas que se denominan ficobiliproteínas, muy abundantes y llamativas por su intenso color durante la preparación de proteínas de cianobacterias. El conjunto de pigmentos que incluye a las clorofilas, los carotenos y las ficobilinas da lugar a un espectro de absorción que es prácticamente el mismo del espectro solar que se recibe sobre la superficie de la tierra. Centros de reacción fotosintéticos Los centros de reacción de la membranas púrpura son las mejor conocidas y, de hecho son los complejos de membranas biológicos mejor caracterizados. H. Michel en 1982 obtuvo los primeros cristales tridimensionales de los CR de la bacteria púrpura no sulfurosa Rhodopseudomonas viridis, lo que permitió determinar la estructura de este complejo, que fue el primero en ser resuelto a escala atómica. y que les valió a Deisenhofer, Michel y Huber el premio Nóbel de Química el año 1988. La estructura está compuesta por cuatro polipéptidos y catorce (14) cofactores. Las proteínas son la L, M, H y C. Los cofactores son: 4 citocromos c, cuatro bacterioclorofilas b, 2 feofitinas, 1 hierro no hemínico, un carotenoide y dos quinonas. Los cuatro hemos están covalentemente unidos a la subunidad C, todos los demás están unidos no covalentemente a las subunidades L y M. La subunidad C es un lipoproteína que está anclada a la membrana por un diacil-glicerol que está covalentemente unido a una cisteína del extremo amino terminal. El complejo tiene 11 hélices transmembrana, 5 en la L, 5 en la M y una en la H. Una gran parte de las Subunidades L y M están asociadas por una simetría binaria con un eje perpendicular al plano de la membrana. Años más tarde se determinó la estructura del CR de Rhodobacter spheroides. Las dos estructuras son muy semejantes excepto que la Subunidad C está ausente en spheroides. No se tienen cristales de Rhodobacter capsulatus, de la que se tiene mucha información genética y bioquímica. Lo mismo ocurre con el PS II de plantas o cianobacterias. No obstante, utilizando la información obtenida de las bacterias se puede extrapolar al caso del PS II y se pueden construir modelos sobre los que trabajar acerca de los mecanismos. Función de los pigmentos Los pigmentos forman dos ramas, cada una con 2 bacterioclorofilas, una bacteriofeofitina y una quinona. Cada una de la ramas va de lado a lado de la membrana comenzando por el 'par especial' que son dos moléculas de clorofila que están formando un par y que se encuentran en el lado del periplasma (la parte externa de la célula). A continuación está la bacterioclofila accesoria, una bacteriofeofitina y una quinona. Solamente la rama asociada a la Subunidad L se utiliza para el transporte de electrones. En esta rama se encuentra la quinona QA, mientras que la QB está en la rama inactiva. Entre las dos quinonas se encuentra un hierro no hemínico. La luz es absorbida por los pigmentos de la LH antena o bien por el propio par especial. En el primer caso se transfiere la energía al par especial (D) en donde hay una molécula DL asociada a la Subunidad L y la otra DM asociada a la Subunidad M. Ambas están relacionadas por un eje de simetría. La excitación de las moléculas D se traduce en la transferencia de un electrón a la clorofila accesoria B. Este fenómeno es lo que se conoce como separación de carga y está estabilizada por la rápida transferencia del electrón a la feofitina ΦA que se encuentra en la rama activa. El siguiente paso es la transferencia de un electrón perpendicular al plano de la membrana al aceptor primario de electrones, la quinona QA, que está unida a la Subunidad M. A continuación se produce la transferencia de un electrón paralelo al plano de la membrana hasta la quinona QB, que está en la Subunidad L. Mientras que QA sólo puede aceptar un electrón, QB puede acomodar dos que, después de captar dos protones da lugar a un quinol que migra para ser reoxidado por otro complejo de membrana que será estudiado en otro momento y que es el citocromo bc1, lo que lleva consigo la liberación de protones en el espacio periplásmico. La creación del gradiente de membrana es lo que permite la síntesis de ATP por la ATPasa integrada en la membrana. Los electrones que han llegado al complejo cit bc1 vuelven al CR a través de un citocromo pequeño y muy móvil que es el cit c2, que interacciona con la Subunidad C y que permite que se vuelva a reducir el par especial que había sido oxidado en el proceso fotoquímico. El papel del carotenoide presente en este CR es proteger al CR de la fotooxidación mediante el quenching del estado de triplete del donador primario de electrones, el par especial. Su proximidad a BB sugiere que la transferencia de energía desde el estado triplete del donador de electrones tiene lugar vía BB. El sitio QB está profundamente embebido en el complejo del centro de reacción. A pesar de ello deben llegar dos protones cuando se reduce para dar un quinol, por lo que le deben llegar los protones desde el citoplasma a través de la proteína. Es probable que implique residuos ionizables así como moléculas de agua. Los protones se moverían a lo largo de una cadena de donadores de protones y aceptores conectados por puentes de hidrógeno. De hecho, en las estructuras descritas se pueden observar cadenas de moléculas de agua que se encuentran a distancias de puentes de hidrógeno unas de otras. Las preparaciones de PS II. El aislamiento de membranas de PS II que fueran capaces de desprender oxígeno fue el inicio de una corriente de trabajos que han ayudado a aclarar su estructura y el mecanismo. Las actividades del PS II debían estudiarse hasta entonces con preparaciones muy inestables de tilacoides con una relación señal/ruido muy baja. Estas preparaciones están limpias de PS I y casi libres de complejo citb6/f. Mas adelante, la manipulación de las preparaciones de PS II condujo al aislamiento de complejos de submembrana capaces de desprender oxígeno, que se denominan PS II cores o centros de reacción. El aislamiento de nuevas preparaciones de PS II, así como de PS I u otras subfracciones da lugar, en muchos casos a que se avance un paso más en el conocimiento del mecanismo de la fotosíntesis. En otras palabras, podemos decir que la fotosíntesis está muy ligada a la descripción de nuevos métodos de aislamiento de preparaciones más limpias y aún capaces de llevar a cabo las funciones de la fotosíntesis. En todos los casos se trata de aislar un conjunto de proteínas y cofactores que sean capaces de llevar a cabo una función, pero que, al mismo tiempo, estén libres de otras moléculas de proteína y pigmentos que no son necesarios para esa unción. Para ello se emplean diferentes estrategias en las que se utilizan técnicas cromatográficas y tratamientos con detergentes, que producen la separación de los proteínas y pigmentos accesorios y la obtención de una preparación más activa en una determinada función. La estructura del PS II La estructura del PS II se presenta en estos momentos de manera muy detallada debido en gran medida, al gran esfuerzo que se ha realizado en los últimos años para poder desvelar la estructura cristalina de este importante y complejo sistema. La última estructura disponible de un PS II corresponde a la publicada en Science en Marzo de 2004 (Science 303, 1831-1838 (2004) por un grupo de japoneses junto con Jim Barber, del King College en Londres, que han resuleto el centro PS II de la cianobacteria Thermosynechococcus elongatus, a 3,5 Å de resolución en donde se ha dado información detallada de la estructura del OEC así como del posible mecanismo de funcionamiento de dicho centro. Como hemos mencionado más arriba, el PS II tiene una gran similitud con el centro de reacción fotosintético de bacterias, aunque en las bacterias no hay desprendimiento de oxígeno y, por tanto, no existe el centro que lleva a cabo dicha función en el PS II. El PS II que se observa en los cristales contiene un dímero en el que los dos monómeros son casi idénticos. El monómero contiene 19 proteínas, que se nombran como D1 D2, codificadas por los genes psbA y psbD. Son similares a las proteínas L y M del centro de reacción de bacterias. Las dos proteínas son muy similares y parecen un heterodímero con una simetría dimérica. Ambas proteínas tienen cinco (5) hélices transmembrana. En ellas es donde están localizados los cofactores donde se lleva a cabo la reacción fotoquímica. Se han comparado las secuencias de muchas de estas proteínas y se encuentran muchos puntos en común. El 80-85 % de la secuencia es homóloga entre unas proteínas y otras. En ambas D1 y D2 hay el máximo de conservación en las regiones correspondientes a las hélices D y las CD. A estas proteínas se unen varios cofactores, tales como las clorofilas del P680, el aceptor primario, la feofitina, un hierro no hemínico y las QA y QB así como los radicales TyrZ+ y TyrD+. Se considera que son importantes porque proporcionan los sitios para que se lleve a cabo la fotoquímica del PS II al coordinar dichos aminoácidos los cofactores que intervienen en esas reacciones. Por ejemplo, las His que ligan los Mg del P680, así como los que ligan al Fe. También el W254 en D2 y F255 en D1 que se propone que interaccionan con QA y QB están conservados en todas las especies. Otro residuo conservado es la Tyr 161 de D1 que da el radical al reducir el P680+ Las proteínas CD47 y CP43, también llamadas CAa-1 y CPa-2 son proteínas integrales de la membrana del PS II. Están codificadas por los genes psbB y psbC. Tienen varias moléculas de clorofila y se pueden considerar como intermediarios en la transferencia de energía entre las proteínas que captan la luz (LHC en las plantas, los ficobilisomas en cianobacterias y algas rojas y el centro de reacción fotosintético. También hay mucha conservación en las secuencias de las proteínas entre especies distintas. Se deduce que hay seis (6) hélices transmembrana y un gran bucle que queda fuera de ella. Este bucle pudiera estar implicado en la unión al centro de evolución de oxígeno porque al introducir algunos cambios en los bucles se observa un drástica disminución de la capacidad de desprender oxígeno de estas preparaciones. La estructura de la CP 47 y la CP 43 son muy similares. El citocromo b-559 El cit b0-559 es uno de los componentes del PS II más enigmáticos. Es un centro redox al que no se le conoce un papel funcional. Se propone que sirve para darle la estructura correcta al centro de reacción ya que cuando se elimina el gen no se obtiene actividad ni se puede aislar el PS II. Además, la cantidad de las proteínas D1 y D2 es muy pequeña. Lo mismo ocurre si se eliminan los residuos de His a los que se une el Fe. Hay dos subunidades que conforman al cit b y esto es poco frecuente para un citocromo. Presenta dos potenciales redox, el potencial alto es de + 370 mV, lo que es raro porque los citocromos tienen potenciales entre 0 y 100 mV. El potencial bajo es de 60-80 mV. La forma de bajo potencial está a veces asociada a formas dañadas durante la preparación. Se propone también que pueda tener un papel en la fotoprotección del PS II. Mecanismo de transferencia de electrones en el PS II. Las reacciones del PS II están promovidas por la luz y consisten en una serie de reacciones que llevan los electrones desde el agua hasta una molécula de quinona que abandona el PS II para contactar con el siguiente complejo en la cadena que es el complejo citocromo b6/f. Cuando se ilumina, se libera un electrón del P680, que es una molécula del par especial que se encuentra en el lado del lumen de la membrana. Dicho electrón salta en muy corto espacio de tiempo (2-20 ps) hasta la feofitina, a través de una molécula de clorofila. La feofitina sería, pues, el aceptor primario de electrones del PS II. A continuación el electrón pasa a una molécula de quinona que se encuentra firmemente unida a la membrana, la QA (aprox. 400 ps). Por último, la quinona QA cede el electrón a QB (aprox. 100 µs) pasando a través de un átomo de hierro que está colocado entre las dos proteínas D1 y D2 con las cuales está unido mediante cuatro His, mientras que la quinta valencia es un grupo de bicarbonato en el caso de PS II, mientras que en el centro de bacterias era un resto de Glu. La llegada del segundo electrón a la QB dispara la captación de dos protones, su salida del sitio donde se encuentra unida y su reposición por una quinona procedente del pool de la membrana. La salida de un electrón desde el P680 genera un radical catiónico, el p680+ que debe ser devuelto a su situación original y eso ocurre mediante la cesión de un electrón por un grupo que no tiene características redox, como es la Tyr 161 de D1 a la que se ha denominado TyrZ. Ésta pasaría a su · vez a convertirse en un radical TyrZ . El radical tiene un potencial redox muy oxidante, que se ha estimado del orden de 1,3-1.4 V, lo que hace posible que sea capaz de extraer un electrón del oxígeno del agua. Simplemente, la reacción fotoquímica ha generado un compuesto que es más oxidante que el oxígeno para que se realice la reacción de rotura de la molécula de agua. Contrasta este hecho con lo que se ha encontrado en bacterias, ya que en este organismo dicho radical el para especial genera un radical de tan sólo 0,4 V que se reduce con un citocromo c. La estructura del OEC Hace unos dos o tres millones de años se produjo a través de la evolución un centro de reacción fotosintético que desprendía oxígeno al extraerlo del agua. De esta manera los organismos capaces de llevar a cabo esta reacción disponían de una fuente inagotable de electrones y protones activados biológicamente. Como consecuencia de esta reacción de rotura de la molécula de agua el oxígeno se fue acumulando en la atmósfera y pudieron aparecer los organismos que respiran. Los primeros experimentos que abrieron una puerta en la investigación acerca del mecanismo de la rotura de la molécula de agua fueron realizados por Joliot en 1969 utilizando flashes de corta duración para iluminar cloroplastos de espinaca o células de Clorella que estaban adaptadas a la oscuridad. El resultado fue una prueba evidente de que el oxigeno se emite de una manera que evidencia un cierto ritmo. De hecho, el máximo de oxígeno desprendido aparece después del tercer flash, y a partir del máximo se produce a los cuatro flashes y así hasta que se rompe el ritmo y se alcanza un estado estacionario. La interpretación que se hace de este experimento es que el complejo pasa por cuatro estados siendo cada uno propiciado por un fotón. Así pasarían desde el estado S0 hasta el S4, cada uno después de absorber un fotón. Otro experimento que permitió un avance se produjo al observar la señal de EPR correspondiente al Mn en las preparaciones de OEC, lo que asociaba este metal a dicha reacción. Se ha utilizado la técnica de EXAF (Extended Xray absorption fine structure) en donde la modulación de la absorción de rayos X se puede interpretar como densidad electrónica alrededor de un átomo. Con estas técnicas se proponen una serie de estructuras, de entre las cuales hay una denominada dímero de dímeros que es la que tiene más adeptos. En este modelo hay 4 Mn unidos por dos puentes dioxo en donde hay otros carboxilatos que unen los Mn. Hay una His de la proteína que interviene uniendo el cluster. También está posicionada muy cerca la Tyr 161 que es la que se convierte en el radical TyrZ+. Se observan las moléculas de agua unidas a los Mn que reaccionarán en el proceso fotoquímico. La estructura del PS II desvelada en Marzo de 2004 muestra las densidades electrónicas que permiten identificar no sólo los residuos de la proteína implicados, sino también la naturaleza y posición de los metales que intervienen. Indican que hay cuatro metales en un dominio mayor que podría ser un tetrahedro, mientras que hay un quinto metal en una región extendida que se encuentra cercana. Mediante el examen de los mapas diferenciales de rayos X anómalos, que indican mucha diferencia entre el Ca y el Mn se propone que uno de los vértices del cubo está ocupado por un Ca, mientras que el cuarto Mn está en la región extendida cercana. Los restantes vértices del cubo Mn3CaO4 están ocupados por grupos oxo que conectan con los Mn. Los datos de cristalografía de rayos X indican que el Mn localizado en la región extendida une una molécula de agua que sería la que sufre la oxidación. El enlace 0=0 se formaría mediante un ataque nucleofílico desde una segunda molécula de agua que está ligada al átomo de Ca del cubo que puede actuar como un ácido débil del Lewis. La cadena de agua al sitio QB. El sitio QB está profundamente embebido en el complejo del centro de reacción. Como debe protonarse durante el ciclo catalítico para dar una hidroquinona, debe captar dos protones y lo hace del lado del estroma, en este caso el citoplasma, por lo que se encuentra con una gran porción de la proteína que está en el camino. Por ese motivo se piensa que la protonación se lleva a cabo a través de residuos protonables de la proteína así como con moléculas de agua. Los protones podrían así desplazarse a través de una cadena de elementos que actúan como aceptores y donadores de puentes de hidrógeno. En las estructuras cristalinas disponibles se pueden observar verdaderas cadenas de moléculas de agua alineadas a lo largo de un canal que une el medio externo con el centro donde se encuentra en QB. Cada una de las moléculas de agua se encuentra a una distancia que está más o menos a la distancia de los puentes de hidrógeno. De esta manera llegarían los protones a la QB desde el citoplasnma y luego los perdería en el lumen, con lo que se establecería un flujo de protones desde el citoplasma o estroma al lumen, con la consiguiente bajada del pH en este espacio. EL PS I El PS I, o centro de reacción fotosintética I, es un complejo multienzimático asociado a membrana que se puede denominar, de acuerdo con la nomenclatura de la IUPAC como una Plastocianina-ferredoxina oxidorreductasa en el sentido de que lleva a cabo una reacción de transferencia de un electrón desde la plastocianina, cuyo potencial es de E'o = +380 mV, hasta la ferredoxina, cuyo potencial es de E'o = 420 mV. Eso significa que debe vencer una gran barrera termodinámica que es para lo que se utiliza la energía de la radiación luminosa. Este proceso es muy eficiente puesto que se puede decir que prácticamente el 43 % de la energía de del fotón rojo, de acuerdo con la luz absorbida, se transforma en energía química. En los últimos años se ha avanzado mucho en el conocimiento de la estructura y función del PS I así como de otros componentes de la fotosíntesis. Se conoce la estructura de la plastocianina así como de la del citocromo c6 que la sustituye en aquellos organismos que se cultivan en ausencia de Cu y en presencia de Fe. Se conoce la estructura de la ferredoxina y flavodoxina, así como de la FNR de Anabaena y de otras cianobacterias. Es más, recientemente, en el año 2001 se ha publicado la estructura, a una resolución de 2,5 Å, del PSI de una cianobacteria. Por otra parte en los últimos años se ha avanzado mucho en el conocimiento de la estructura y la función de muchos de los componentes del PS I, al mismo tiempo que se han clonado y se han llevado a cabo experimentos de mutagénesis en algunos de ellos, con lo que se empieza a comprender cómo interaccionan entre ellos y cómo participan en el transporte de electrones. Respecto a la nomenclatura de los genes que codifican las proteínas del PS I es necesario aclarar que se ha estandarizado su nomenclatura, que consiste en utilizar las letras en cursiva psa y luego una letra que va desde la A a la M con mayúsculas. Las proteínas se nombran siguiendo el mismo sistema, pero con letra normal y la primera en mayúscula PsaA hasta la PsaM, pero también se nombran como PsIA. Arquitectura del centro PS I La organización de las diferentes subunidades del complejo así como de sus cofactores, ha sido determinada por cristalografía de rayos X a una resolución de 2,5 A. El centro de PS I de cianobacterias aparece como un trímero de peso molecular 3 x 356.000. Esta forma está presente también in vivo. Cada monómero contiene 11 subunidades de proteínas diferentes que coordinan más de 100 cofactores. Las subunidades PsaA (en azul en la Figura) y el PsaB (en rojo en la Figura) comparten muchas similitudes en la secuencia de proteínas así como en su estructura. Contienen 11 hélices transmembrana cada una. En la estructura por rayos X correspondiente al PS I de la cianobacteria Synechococcuss elongatus, se observan dos dominios diferentes, el llamado dominio de conexión, que no sobresale ni por enzima ni por debajo de la membrana, y que sirve, aparentemente, para unir los monómeros en trímeros. El dominio mayor es el catalítico, que tiene salientes de unos 35 Å hacia el estroma o de unos 15 hacia el lumen y que contiene los componentes de la reacción fotoquímica de separación de cargas. Se supone también en este caso que la parte que sobresale hacia el estroma corresponde a los polipéptidos hidrofílicos, PsaC, D y E, que son las partes por las que interacciona el PS I con la Ferredoxina (ver Figura). También hay una cavidad en el lado del lumen que podría corresponder al sitio de unión de la plastocianina o el citocromo c6. Se observan tres regiones ricas en densidad electrónica, que podrían corresponder al centro sulfoférrico Fx, que forma parte del núcleo del PS I, y que sería el más interno, mientras que los otros dos, los FA y FB, son parte de la subunidad PsaC. Hay un eje de simetría que comprende 22 de las hélices transmembrana, 8 hélices de superficie, los cofactores del sistema de transporte de electrones (excepto (FA y FB) y un par de moléculas de clorofila de la antena de conexión. Este eje comprende a las subunidades PsaA y PsaB y pasa por el centro de hierro FX. 11 de las hélices transmembrana y 4 de la superficie son de las subunidades PsaA y PsaB. Todas tienen su pareja. No se puede saber cuál es de A y cuál es de B. En la Figura aparece la subunidad PsaF (en amarillo), una subunidad importante en plantas porque es el sitio de unión de la plastocianina. En cianobacterias no tiene esa función porque la interacción con el PS I es diferente. Con respecto a los cofactores del PS I se puede decir que se han identificado más de 100 moléculas de clorofila que forman parte del PS I. A pesar de que se está lejos de conocer la función de todas ellas las que juegan un papel catalítico están localizadas. Así, hay un par de clorofilas cerca del eje de rotación, próximas a la depresión del lado del lumen, lo que indica que puede recibir electrones de la plastocianina o del citocromo c6. Serían dos planos de porfirina separados por unos 3,6 Å y que están perpendiculares a la membrana. En la Figura se indica su localización así como los residuos que las rodean. Hay otras dos moléculas de clorofila próximas, semejantes en posición a otras que se han encontrado en la estructura del centro de reacción de las membranas púrpura por Deisenhoffer, Michel y Huber, que harían de puente de los electrones en su camino hacia el aceptor primario de electrones que se supone que es una molécula de clorofila que se encuentra como un monómero y relativamente cerca de las clorofilas accesorias. Forman dos ramas por las que podrían pasar los electrones hacia el aceptor de electrones. No obstante, aún no se ha resuelto cuál es el papel de cada una de las ramas en este proceso de transferencia de electrones. Por analogía con las clorofilas del centro de reacción de bacterias se propone que estos pigmentos accesorios participan en la reacción de transferencia de electrones. El heterodímero PsaA/PsaB Las proteínas PsaA y PsaB son las mayores del PS I. De hecho, se expanden de un lado a otro de la membrana y contienen un alto número de centros redox así como de pigmentos. Se conocen las secuencias de diferentes genes de dichas proteínas, tanto de plantas como de cianobacterias. Llama la atención el hecho de que son de un gran tamaño: unos 740 y 734 Aa en Synechococcus, la A y B, lo que significa tamaños del orden de 81 kDa. Entre las dos proteínas existe un 45 % de identidad. Otro hecho destacable es que la homología entre las proteínas A de eucariotas y cianobacterias es del 95 % y lo mismo ocurre con la PsaB que también es idéntica en un 95 % entre diferentes especies. Eso significa que juegan una función análoga y muy especializada, lo que deja muy poco margen de variabilidad. Presentan también una gran semejanza en su estructura terciaria y cuaternaria. Ambas proteínas son transmembrana, como se había determinado anteriormente con anticuerpos específicos que permiten determinar si un proteína está expuesta al espacio luminal o estromal o a ambos, como sería este caso. Se detectan también dos cisteínas en cada una de las proteínas, lo que significa que el centro Fe/S, que se denomina Fx, el único en el heterodímero, está soportado por ambas cadenas polipeptídicas, un hecho que resulta bastante insólito. Como consecuencia de la transferencia de la energía captada por las moléculas de clorofila de las antenas, y mediante el mecanismo de transferencia de energía de Foster ya descrito, la energía llega a un pigmento donde queda atrapada al encontrarse en un nivel energético ligeramente inferior. Este pigmento de propiedades diferentes, es un dímero de clorofila a que cambia su espectro alrededor de 698-700 al oxidarse, se pierde absorbancia a esta longitud de onda. Debido a ello se le denomina P700 y al excitarse puede perder un electrón quedando como una especie cargada P700+. La pregunta ahora sería ¿a qué le da su electrón el P700? cuál es el aceptor primario de electrones en el PS I, ese compuesto que fue buscado con tanta insistencia durante la década de los 70, como se ha citado ya varias veces. Hay acuerdo general acerca de que el aceptor es el llamado Ao, que consiste en una molécula de clorofila aislada y separada unos 12 A del par de clorofilas del centro de reacción. Este proceso tiene lugar en tiempos muy cortos, del orden de 3 ps. De nuevo tiene lugar un proceso muy rápido como es la reoxidación del Ao-. Al transferirle su electrón al siguiente componente de la cadena, una molécula de filoquinona (vitamina K1), que se denomina A1. También este proceso transcurre en unos 30 ps. Este pigmento absorbe a 430 nm por lo que antes de identificarlo se le llamó P430 y se propuso como aceptor primario de electrones del PS I. Ahora se denomina A1 y en su forma reducida sería A1-. En este punto se podría preguntar uno por qué no se produce la reacción inversa, es decir reoxidación del P700+ con el electrón de A1. Dicha reacción no se observa a menos que se cumpla alguna de las dos siguientes condiciones artificiales: o bien que se haya extraído el centro Fx, o bien que se hayan reducido previamente los centros Fx, FA y F B. Parece lógico, por tanto, que el siguiente componente de la cadena sea el centro Fe/S denominado Fx, que se encuentra a sólo 12 Å de distancia del A1. Una razón que apoya la propuesta de que el centro Fx participa en la cadena de transporte de electrones es que si se cambia mediante mutagéseis dirigida una de las cisteínas que mantienen la agrupación Fe/S por Ser, se forma un centro que contiene sólo 3Fe/4S, que se puede reducir con ditionito aunque la transferencia hasta los centros FA y FB se ve alterada en parte. El PsaF La secuencia de diferentes genes que codifican a este polipéptido indica que tiene una secuencia correspondiente a un péptido señal que justificaría la localización que se le adscribe en el lado del lumen, a donde tiene que ser transportado una vez que se sintetiza en el estroma del cloroplasto. También se observa una región con una alta concentración de cargas positivas. Por otra parte, los estudios de hidropatía indican que hay una región con fuerte contenido en aminoácidos hidrofóbicos que indicaría que existe una hélice que atraviesa la membrana que serviría para anclar la proteína al heterodímero PsaA/PsaB. Esa hélice se cree que es la i de la estructura cristalina (en amarillo en la Figura). Respecto a la función del PsaF en el PS I se acepta como probado que sirve para fijar al donador de electrones la plastocianina o el citocromo c6 para que puedan ceder electrones al P700+. En cualquier caso esto plantea una interesante pregunta, que también se da en otros puntos del PS I, y es que si la PC y el Cit c6 juegan el mismo papel uniéndose a la misma cadena PsaF, cómo es que lo hacen teniendo unas estructuras tan diferentes. Apoyan esta propuesta experimentos cinéticos y el hecho de que se ha unido covalentemente la PC a la PsaF en plantas superiores, lo mismo que más recientemente, se ha hecho entre el cit c6 y la PsaF de cianobacterias. De todas formas existen algunos puntos de controversia acerca de esta propuesta que habrá que aclarar antes de que se dé por definitivamente establecido el papel de la psaF en el Ps I. La proteína PsaC Tiene 81 aminoácidos en la mayoría de los organismos de los que se conoce la secuencia. Entre ellas hay una muy alta analogía de secuencia existiendo pequeñas variaciones entre las plantas monocotiledóneas, las dicotiledóneas y las cianobacterias. La eliminación del gen da lugar a un fenotipo que es letal en cultivos fotoautotróficos, indicando que es un gen esencial para el aprovechamiento de la luz. La proteína es ligeramente acídica con un pI de 5,5 y contiene 9 Cys ocho de las cuales se encuentran en dos agrupaciones del tipo CxxCxxCxxxCP, que son típicas de proteínas que tienen grupos sulfoférricos del tipo 4Fe/4S. La secuencia de la PsaC es muy similar a la de otras ferredoxinas o trozos de ellas. Tal es el caso de la de Azotobacter y otras bacterias y sulfobacterias. En aquellos casos en que se conoce la secuencia se comprueba que ésta es muy similar en todas ellas. Una característica estructural de estas proteínas es que muestran dos dominios simétricos que tienen una estructura semejante y contienen cada uno a un centro Fe/S. En cada uno de los agrupamientos de cuatro Cys las tres primeras están uniendo átomos de Fe mientras que el tercero lo hace con el Fe del otro centro. Debido a este hecho los dos dominios no se muestran como independientes sino que cooperan entre sí para dar lugar a un eje binario. Esencialmente se puede decir que esta estructura es la mínima requerida para englobar a los dos centros sulfoférricos dado el pequeño tamaño de la proteína. En cualquier caso es de destacar el hecho de que, incluso en secuencias que fueran más largas, por tener inserciones en algunas regiones, no se afectaría la disposición de los centros Fe/S debido al hecho de que la cuarta Cys, que enlaza al segundo centro, está situada necesariamente próxima al primer centro por estar en una agrupación de secuencia concreta. Con respecto a la función del PsaC está claro que tiene dos centros redox que participan en el transporte de electrones entre el Fx del PS I y la ferredoxina o la flavodoxina. Se podría considerar que su función es conseguir que los electrones salgan del núcleo hidrofóbico del centro de reacción y pasen a la región del estroma, que es hidrofílica. Ello se demuestra cuando se interrumpe la fotorreducción del NADP+ al eliminar del PS I las subunidades PsaC, PsaD y PsaE. El transporte de electrones se restablecía al añadir las proteínas PsaC y PsaD al núcleo PS I-Fx. Ello indica, a su vez, que el Fx no puede dar electrones a la ferredoxina. Por otra parte en la proteína de plantas se destruye el FB mediante tratamiento con HgCl2 y en ese caso no hay fotoreducción de NADP+. Se propone que la secuencia de transferencia de electrones es Fx ---> FA ----> FB. La localización del FA más cercano al Fx indica que ésta es la secuencia, aunque los potenciales redox indicaría la dirección opuesta. Para probar el orden de intervención sería necesario alterar el potencial de uno de los centros y ver qué pasa con el transporte de electrones. Cuando se ha hecho la mutación C14D se obtiene una proteína con un centro FB de potencial -90, mientras que el del FA se mantiene en -520 mV. Por otro lado al hacer la mutación C51D el potencial del FA pasa a ser -98 mV mientras que el del centro FB es de -580 mV. Ello indica, en primer lugar, que lo que determina el potencial del centro redox es la secuencia de la proteína y concretamente en el entorno del centro redox. En segundo lugar que el cambio en uno de los centros no afecta al otro, lo mismo que no está determinado por el hecho de que al titular el segundo centro, el FB, ya se ha reducido el FA, que estará como FA-. Desgraciadamente no se han estudiado las proteínas con centros 3Fe/4S en experimentos de reconstitución del núcleo del PS I. El ideal sería ver si en aquellos sistemas en donde tenemos un sumidero en el centro FA o bien en el centro FB por haberles cambiado su potencial haciéndolo más positivo se detiene el transporte de electrones cuando está el otro centro reducido, en cuyo caso se concluiría que el centro alterado está después del otro centro que se reduce. Si no está reducido el centro intacto querrá decir que el centro alterado está antes del otro. Este tipo de experimentos también se están intentando llevar a cabo utilizando centros en donde se integra un metal diferente al hierro, en cuyo caso se obtienen centros con potenciales diferentes. PsaD La secuencia del gen del PsaD muestra que corresponde a una proteína de unos 135-150 aminoácidos entre los cuales hay un enorme cantidad de Lys y Arg. La secuencia se encuentra bastante conservada entre las cianobacterias (del orden del 65 %) mientras que lo está algo menos con relación a plantas superiores (55 %). El punto isoeléctrico es muy alto, del orden de 9-9,5 aunque hay algunas que lo tienen más bajo. Los perfiles de hidropatía y experimentos de extracción indican que la PsaD está fuera de la membrana del tilacoide y es muy soluble. La mayor abundancia de residuos básicos en el extremo carboxilo hace pensar que esa porción de la proteína es la que establece el contacto con la ferredoxina (o flavodoxina) que son negativas. Al mismo tiempo se piensa que estará próxima a la PsaC formando una especie de capuchón. La función de la PsaD se ha adelantado al hablar de su estructura. Se propone que es el sitio de unión de la ferredoxina (o flavodoxina) al PS I. Esta propuesta, que se hacía sobre la base de la abundancia de cargas positivas en la proteína, se apoya en el hecho de que la ferredoxina se une covalentemente a la PsaD cuando se incuban con EDC. Se apoya también en el hecho de que cuando se utilizan + mutantes PsaD no tiene lugar la fotoreducción del NADP y se recuperaba dicha capacidad al añadir PsaD pura. Curiosamente dicho requerimiento es menos estricto si se utiliza flavodoxina, lo que indica que esta proteína no requiere a la subunidad PsaD para unirse al PS I. Una segunda función de la PsaD consiste en orientar adecuadamente a la subunidad PsaC para su unión al PS I. Experimentos de eliminación del gen aportan poca información adicional acerca de la función del PsaD. Dichos mutantes son incapaces de crecer en la luz. Cuando se aísla el PS I de estos mutantes les faltan algunas subunidades, pero esto puede indicar que no las tengan in vivo o que la hayan perdido al aislar el PS I. Experimentos más recientes indican que están presentes las otras subunidades. PsaE La secuencia de aminoácidos deducida a partir de la secuencia del gen de diferentes organismos muestra que la PsaE es una proteína de 70-75 aminoácidos con una masa molecular de 7-8 kDa y un alto grado de homología entre ellas (unos 75 %). Se tiene una estructura de NMR para esta proteína. Tiene un alto contenido en hoja β ya que contiene cinco láminas β. Es interesante señalar que en la estructura se observa que la parte superior no contiene prácticamente aminoácidos cargados sino que son polares o apolares, mientras que en la parte inferior existe un elevado número de residuos cargados. Esta diferente distribución de los aminoácidos según el tipo a que pertenezcan podría deberse a su papel en la unión a PsaC, al heterodímero PsaA/PsaB o a proteínas transportadoras de electrones solubles. Con respecto a la función de esta proteína existen varias pruebas de que aumenta la velocidad de intercambio de electrones entre la ferrredoxina (o la flavodoxina) y el PS I. De nuevo son experimentos en los que se elimina el componente PsaE de la preparación y se observan cinéticas que suelen ser la mitad o la cuarta parte de la original. La adición de la subunidad restaura parte de la actividad perdida. Sin embargo ésta no puede ser la principal función de la subunidad ya que la ausencia del gen no causa un fenotipo letal. La discrepancia entre los datos bioquímicos (obtenidos con preparaciones de membranas) y los fisiológicos (medidos con organismos enteros) sugiere que no es necesaria una eficacia del 100 % en la reacción (en este caso de transporte de electrones) para que un organismo crezca mejor. Una segunda función de la subunidad PsaE fue descubierta después de que un mutante PsaE se observara que era más sensible a la temperatura que la silvestre. Todos estos datos nos han proporcionado una visión de la estructura del PS I así como de su función en el transporte de electrones en la fotosíntesis. Hemos visto que en este momento se puede presentar una visión bastante coherente de este centro, de sus componentes así como de la función de cada uno de ellos. Se ha recorrido un largo camino y ya se puede prácticamente tener un idea de cómo funciona. No se esperan novedades en este campo. No obstante, son muchas las lagunas que aún quedan por rellenar hasta que se pueda tener un cuadro completo de cómo funciona la fotosíntesis. El complejo citocromo b6/f Las moléculas de quinona reducidas en el PS II deben reoxidarse para generar los equivalentes de reducción al mismo tiempo que se genera el ATP, los dos productos de la fotosíntesis. Hemos visto en temas anteriores que los electrones que se extraían del agua en las reacciones dependientes del PS II debían llegar al PS I para terminar en el NADPH. La conexión entre los dos se realiza a través del complejo cit b6/f. Se puede decir, por tanto, que el citocromo b6/f es una plastoquinona-plastocianina oxidoreductasa ya que transfiere electrones desde la plastoquinona hasta la plastocianina generando un gradiente de protones que sirve para la síntesis de ATP. En algunas algas la plastocianina se sustituye por citocromo tipo c, el citocromo c6 cuya síntesis depende de la presencia de hierro o cobre en el medio de cultivo. Ocurre igual en el otro proceso en el que se produce transformación de energía biológica, la respiración. En la mitocondria hay otro complejo que se denomina el citocromo b/c1 que transfiere electrones desde la ubiquinona hasta el citocromo c. Vemos, por tanto, la similitud de ambos sistemas, que está reflejada en una Figura. Complejos de este tipo se han encontrado, de hecho, en todas las mitocondrias y en muchas especies bacterianas. Se pensaba que sólo estarían en la fotosintéticas, pero se han encontrado en muchas más. El complejo citocromo b6/f se requiere también para llevar a cabo la fotofosforilación cíclica. En este caso se transforma la energía captada por el PS I en un gradiente transmembrana que puede servir para la síntesis de ATP. La localización del complejo citocromo b6/f incluye la membrana de los grana y los tilacoides estromales, a diferencia de los PS I y PS II que están distribuidos de manera irregular en estas membranas. De hecho encontramos una mayor cantidad de complejo en la parte final de los sacos de grana, justamente entre los PS I y PS II indicando su función de comunicación entre ellos. Se he resuelto la estructura del complejo citocromo b6/f de la cianobacteria termófila Mastigocaldus laminosus a 3,0 Å de resolución por el grupo de Bill Çramer, de Purdue University Science, 302, 1009-1014 (2003). Se obtiene como un dímero, tal como se observa en la Figura, en donde cada monómero contiene cuatro subunidades proteicas grandes, que son el citocromo b6, con dos grupos hemo, el hemo bn y el hemo bp, cada uno coordinado a dos His; la Sid IV, relacionada con el citocromo b6, la proteína Rieske, que contiene un centro sulfoférrico del tipo [2Fe-2S]; y el citocromo f, un citocromo del tipo c. Hay también otras cuatro subunidades altamente hidrofóbicas, que son la PetG, PetL, PetM y PetN, así como una molécula de clorofila a, un β-caroteno y una plastoquinona, lo que da lugar a un complejo de un peso molecular de 217 kD. Por otra parte, anteriormente, se habían determinado las estructuras de una forma trucada del citocromo f así como de la de la proteína Rieske. Cada monómero presenta 13 hélices transmembrana que son 4 del citocromo b6, tres de la subunidad IV, y una en cada una de las proteínas citocromo f, proteína Rieske y las subunidades PetG, -L, -M y –N. Los dominios extrínsecos del citocromo f están situados en el lado “luminal” de la membrana (lado p). Los dos monómeros forman una cavidad que se encuentra vacía en la interfase transmembrana y que está colocada en el lado “estromal” de la membrana y que se propone que sirve para el intercambio de quinonas en el complejo. El citocromo b6 El citocromo b6 y la subunidad IV son homólogas a las porciones N- y C- terminales del citocromo b del complejo citocromo bc1, de la misma manera que lo es la parte central que corresponde a la proteína Rieske. Sin embargo, el citocromo f, que es un citocromo tipo c no es homóloga al citocromo c1 del complejo bc1. Los dos hemos del citocromo b6 tienen un potencial que resulta peculiar para una proteína de este tipo, ya que se les han asignado los valores de -50 y -150 mV para cada uno de ellos. No es casualidad que en mitocondrias ocurra prácticamente lo mismo donde los hemos del citocromo b tienen potenciales muy próximos a éstos. Una sorpresa que ha resultado al resolver la estructura de este complejo consiste en que ha aparecido un nuevo grupo hemo que se encuentra asociado al hemo bn del citocromo b6. Dicho grupo hemo parece que no pertenece a ninguna familia de hemos, por lo que se propuesto, por el momento, el nombre de hemo x. El hemo x se encuentra unido covalentemente a la proteína por una Cys del citocromo b6. El Fe del hemo no está coordinado a un residuo de la proteína sino a una molécula pequeña que se propone que es de agua. Dicha molécula de agua está unida por puentes de hidrógeno a un propionato del hemo bn así como a otro residuo del citocromo b6. La sexta valencia está vacía. Los planos casi perpendiculares de los hemos x y bn están en contacto a través de la unión por el puente propionatoagua, lo que implica que exista una transferencia de electrones eficiente entre los dos grupos hemo. Sobre la función del grupo hemo x se hablará más adelante. El citocromo f El citocromo f del complejo b6/f es un citocromo tipo c y, por lo tanto, tiene el grupo hemo unido covalentemente a dos cisteínas de la proteína, de acuerdo con el motivo CXXCH en la porción amino terminal, que es común a los citocromos f y c1. En los dos casos el extremo carboxilo de la proteína está precedido por un trozo de unos 20 aminoácidos hidrofóbicos que se piensa que puedan ser el sitio de anclaje a la membrana. Para conseguir cristales de la proteína de membrana se ha aprovechado el hecho de que en algunas especies la porción de la hélice hidrofóbica que produce el anclaje del citocromo a la membrana se elimina durante la purificación de la proteína siendo ésta soluble en agua. Se da también le circunstancia muy favorable de que este fragmento contiene el grupo hemo y éste mantiene el mismo potencial redox que en la proteína intacta, por lo que se puede asumir que la estructura es muy semejante a la de la proteína nativa. Dicha estructura es muy diferente de las de otros citocromos en los que hay preferentemente hélices α, mientras que en el citocromo f hay mayoría de hojas β. La proteína está constituida por dos dominios de plegamiento diferentes. Uno que se encuentra en la parte superior de la molécula y que está constituido por los residuos 169 al 231, que está constituido casi exclusivamente por hojas β y otro, constituido por los residuos 1 al 168 y del 232 al 246, que es el más grande y donde se encuentra el hemo. En este dominio hay mayoría de cargas positivas y es donde se encuentra la Lys 187 que ha sido descrita que se une covalentemente al Asp44 de la plastocianina, motivo por el cual se propone que es uno de los residuos que interacciona con la plastocianina. El grupo hemo se encuentra en la región entre los dos dominios, aislado de la fase acuosa por un escudo muy amplio formado por una serie de aminoácidos hidrofóbicos y muchas Pro. La principal característica del citocromo f es el sexto ligando del Fe, lo que lo diferencia también del citocromo c1 ya que en éste es una His, mientras que en el citocromo f es el grupo α-amino de la Tyr en la primera posición. Se comprueba, al conocer esta estructura, que existe una gran variedad en lo que se refiere al sexto ligando de los hemos en los diferentes citocromos. En algunos de ellos, como es el caso del citocromo b5, es otra His (como el quinto ligando). Como se ha dicho antes en los citocromo c el sexto es una Met. Por último, en una bacterioferritina el quinto y sexto ligando son Met. Parece que no hay relación entre el tipo de hemo y el ligando. El extraño ligando que tiene esta proteína implica otro hecho interesante y es que el centro redox de la proteína no puede integrarse en ésta hasta que no se haya eliminado el péptido señal para que se libere así el grupo NH2 de la Tyr1 y esto no ocurre hasta que la proteína no es translocada hasta el lumen. Si, como parece, el hemo es una señal importante para que la proteína se pliegue y esto no ocurre hasta que se le elimina el péptido señal, puede que sea la forma de regular el plegamiento para que la proteína esté desplegada antes de pasar la membrana. Se puede decir, por tanto, que el citocromo c y el f representan otros dos ejemplos de evolución convergente, de los que ya hay varios en diferentes sistemas. Una vez determinada la estructura de este citocromo y conocido la naturaleza de los residuos que forman parte de él se puede proponer la forma en la que se produce el acoplamiento entre dicha proteína y la plastocianina, tal como se propone en la Figura. El potencial redox del citocromo f está en la zona positiva, como es normal en los citocromos tipo c (E'o = + 0,37 V). De acuerdo con este valor el citocromo f se puede reducir con ascorbato, lo mismo que la proteína Rieske, Por el contrario, el citocromo b sólo puede reducirse con ditionito, lo que indica un potencial de reducción mucho más negativo. La proteína Rieske. Es una proteína sulfoférrica con un centro 2Fe-2S que tiene un potencial inusualmente positivo por lo que puede reducirse con ascorbato. De hecho el alto potencial de estos grupos, que fueron ya descubiertos en mitocondrias, se debe a que el hierro tiene coordinado el N de una His, además del S. Su unión a la membrana se hace por la porción C-terminal, aunque el centro metálico se queda fuera. Mecanismo de transferencia de electrones y transporte de protones del complejo citocromo b6/f La función del complejo citocromo b6/f es hacer posible el paso de los electrones desde el fotosistema PS II, donde se produce la rotura de la molécula de agua, hasta el PS I, donde se produce la reducción del NADPH. Así mismo, el citocromo b6/f es el responsable de llevar a cabo el aprovechamiento de la energía que se libera en dicho proceso. Dicha energía se aprovecha para sintetizar una o varias moléculas de ATP. Una vez que se conoce la estructura del complejo así como muchos otros aspectos relativos a la energética de los procesos biológicos es obligado intentar proponer un mecanismo que explique cómo se produce el proceso molecular de transformación de la energía de la fotosíntesis. Los cuatro centros del complejo funcionan en dos parejas, dos de ellos de potencial alto y dos de potencial relativamente bajo. La de potencial más próximo a la quinona es la proteína Rieske (+ 300 mV) y es la que recibe un electrón de la quinona, que después pasa al citocromo f (+340 mV). La hipótesis quimiosmótica de Michel propone que la energía que se desprende en el proceso de transporte de electrones en el cloroplasto, lo mismo que en la mitocondria, se conserva mediante la formación de un gradiente de protones consistente en la acumulación de éstos en un lado de la membrana. Los protones se acumularían en un lado de la membrana debido a que el paso de los electrones a través del complejo citocromo b6/f provoca el paso de un cierto número de protones, aún por determinar, de un lado al otro de la membrana (del estroma, lado n al lumen, lado p). Hace muchos años el propio P. Michel propuso un mecanismo que explicaría cómo se produce transporte de protones al pasar los electrones por el complejo. Dicho mecanismo se conoce como el ciclo Q y sigue siendo válido, a pesar del paso de los años y de que en este tiempo se han conocido muchos detalles concernientes a los componentes de dicho complejo. El ciclo que se resume en los siguientes términos: en el citocromo b6/f hay dos sitios diferentes con afinidad para las quinonas, cada uno con afinidad diferente por una especie redox de la quinona. Así hay uno, que es el Qo por oxidado o outside (también llamado Qp por positivo) que está en un sitio de la membrana próximo al espacio intratilacoidal. A él se une preferentemente la quinona reducida. Hay otro denominado Qi que es por interior o sitio de reducción de la quinona (también llamado Qn por negativo), que está en la porción más externa de la membrana. De acuerdo con este modelo una quinona reducida se une al Qo desde donde se transfiere un electrón a la proteína Rieske para pasar a continuación al citocromo f y luego a la plastocianina. Como consecuencia de esa reducción se genera una semiquinona que es capaz de reducir al citocromo bp y éste rápidamente reduce al citocromo bn que está situado muy próximo y en el otro lado de la membrana (están perpendiculares los planos a la membrana). El hemo bn reducido es capaz ahora de reducir una molécula de quinona hasta dar la semiquinona, lo que tiene lugar en el sitio Qi. Ahora tiene lugar otro ciclo catalítico mediante el cual llega de nuevo un electrón a través del hemo bp y el hemo bn hasta la semiquinona que estaba en la posición Qi quedando ahora reducida completamente y que se disocia ya que este sitio tiene afinidad por la quinona oxidada. Como consecuencia de los dos ciclos de oxidación de las quinonas se produce el paso de dos electrones desde la quinona hasta la plastocianina, al mismo tiempo que cuatro protones pasan desde el estroma al interior del lumen. El primer par lo hace al reducirse la quinona con los electrones de proceden del PS II y que son liberados al ceder la quinona los electrones al complejo bf siendo los protones impulsados hacia el lumen. El otro par de protones se transfiere al reducirse la quinona en el sitio Qi con los electrones procedentes del citocromo bn. La reacción es QH2 + PCox QH2 + QH2 + PCox + 2 PCox Q + --Æ QH· ---Æ Q + --Æ Q PCrd Q + + QH· + PCrd 2 PCrd + + QH2 H+ + + H+ 2 H+ Los protones que se utilizan para reducir una quinona en el PS II proceden del lado del estroma, mientras que se pierden por el lado del lumen. Por otro lado, los protones que se utilizan para reducir quinona oxidada así como la semiquinona, tal como se indica en las reacciones detalladas más arriba, proceden también del lado del estroma. Regulación Puesto que la transferencia de electrones desde la quinona al complejo b6/f es lenta constituye en muchos casos el paso limitante en la Fotosíntesis. Por eso puede ser un sitio a propósito para establecer un mecanismo de regulación pudiendo actuar como un sensor del estado redox del cloroplasto o la célula fotosintética. El mecanismo sería el siguiente: un nivel alto de quinona reducida indica que el PS II está funcionando muy eficientemente y que se está acumulando poder reductor. Entonces se activa una quinasa que fosforila a una proteína del LHC II asociado normalmente al PS II, lo que hace que pierda afinidad por este fotosistema y lo gane por el PS I. De esta manera la acumulación de poder reductor reduce el número de antenas del PS II y aumenta el del PS I, con lo que se produce un tirón de los electrones hacia el NADPH. Plastocianina La conexión entre el complejo citocromo b6/f y el PS I se realiza a trabes de la proteína de pequeño tamaño conocida como plastocianina. Es interesante señalar que, mientras que las plantas sólo tienen plastocianina para esta función, los organismos más antiguos, como son las cianobacterias, tienen otra proteína que puede cumplir el mismo papel: el citocromo c6. Eso sugiere algún tipo de evolución convergente en la cual dos proteínas de estructura muy diferente se han seleccionado para cumplir la misma función. Es decir, que la proteína de hierro pudo ser sustituida por otra de cobre de forma que los organismos más evolucionados la han adoptado como la única necesaria para la función que realizan. La plastocianina es una proteína de cobre que tiene un átomo metálico por un Mr de 10,5 kDa. Las proteínas de Cu suelen ser de color azul y así es la plastocianina en el estado oxidado siendo el máximo a 600 nm como corresponde a una transición de transferencia de carga del tipo Cys(S)Cu. Hay otras proteínas de Cu con espectros similares, tales como la azurina y la estelacianina. La plastocianina de plantas y algas eucariotas está codificada por el gen petE en el núcleo, por lo que una vez sintetizada en el citoplasma debe transferirse al cloroplasto, lo que implica ser transportada a través de las membranas de dicho orgánulo. La secuencia de aminoácidos de las plastocianinas conocidas muestran una alta conservación de residuos, especialmente los implicados en la unión del Cu que son dos His, una Cys y una Met así como una Tyr. Los residuos básicos cambian mucho de una a otra especie cambiando también el pI de la proteína que es casi de 4 en plantas y algas verdes, es casi neutra (6) en algunas cianobacterias y muy básica en otras tal como Anabaena (9). La estructura cristalina de algunas plastocianinas se han determinado así como por RMN. En todos los casos es una especie de cilindro con el Cu en la parte norte metido en un bolsillo formado por residuos conservados e hidrofóbicos que están próximos a la superficie pero no expuestos. Este bolsillo hidrofóbico se ha propuesto, mediante experimentos de mutagénesis dirigida, que es el sitio de interacción con el PS I. Se ha encontrado otro agrupamiento de residuos ácidos que se encuentran en la región este de la proteína. Se propone que este parche negativo es el sitio de interacción con el citocromo f y también que en Anabaena y otros organismos en los que la plastocianina tiene un pI básico estos aminoácidos ácidos se han reemplazado por otros neutros. Citocromo c6 (antes denominado c553) Tiene un Mr de 10 kDa y un potencial redox de + 350 mV. Cumple la misma función que la plastocianina. Ambas tienen tamaños y potencial redox que son similares en las dos proteínas. Las estructuras de la proteína de varias especies se ha determinado recientemente y presenta muchas similitudes entre sí. Basándose en la comparación de las estructuras de la plastocianina y citocromo c6 de organismos diferentes se puede establecer una relación evolutiva entre ellas que se han confirmado por datos de cinética en los que en el caso de los organismos más primitivos se produce la reacción por colisión simple, mientras que los más evolucionados se hace mediante un reconocimiento y posterior reorganización para que se produzca la reacción. Aspectos evolutivos de la fotosíntesis Hace setenta años se realizaron los experimentos que demostraban que en las plantas había dos centros de reacción implicados en la fotosíntesis. Se denominaron PS I y PS II. Más adelante se descubrió que había otros organismos procariotas que realizaban la fotosíntesis. Se denominaron bacterias púrpura y bacterias verdes y en ellas se produce la transformación de la energía luminosa mediante centros de reacción de otro tipo. Las diferencias principales con las plantas y cianobacterias es que en estas bacterias el proceso transcurre sin desprendimiento de oxígeno; sólo tienen un centro de reacción; finalmente, el pigmento principal de la fotosíntesis es la bacterioclorofila, (BChlo). Durante los años 60 y 70 se produjeron muchos avances en el conocimiento de la fotosíntesis de las bacterias púrpura cuyas preparaciones eran relativamente fáciles de obtener y se obtenían casi libres de otros pigmentos diferentes de los que se requieren para producir el proceso a estudiar. En estos momentos se puede afirmar que los hechos más significativos a destacar del estudio comparativo acerca de la fotosíntesis que llevan a cabo los diferentes organismos son los siguientes: 1) el centro de reacción PS II de las plantas se parece en muchos aspectos al de las bacterias púrpura. EN concreto las subunidades D1 y D2 son análogas a las L y M de estas últimas; 2) el centro de reacción de las bacterias verdes así como de las descubiertas posteriormente de nominadas heliobacterias, es más simple y homodimérico pareciéndose más al centro de reacción PS I de las plantas y cianobacterias. Hoy día se toda la comunidad científica acepta que los cloroplastos de las plantas que realizan fotosíntesis surgió del atrapamiento de una cianobacteria por parte de una célula eucariota, lo que explica la gran similitud entre el PSI de cianobacterias y de plantas. Las subunidades PsaA, PsaB, la PsaC que tiene los centros sulfoférricos, así como la PsaD fueron heredados por los cloroplastos directamente de sus ancestros las cianobacterias. Posteriormente a la existencia de una simbiosis entre los cloroplastos y la célula eucariota se le añadieron a éste otras subunidades que son específicas del PS I. De hecho, las últimas adquisiciones son las PsaG, PsaN y Psa H. Las heliobacterias y bacterias verdes sulfurosas poseen, por su parte, una versión “económica” del centro de reacción fotosintético.