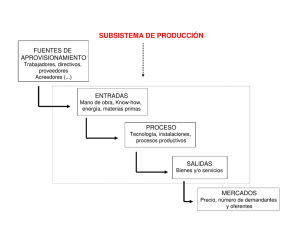
Implantes de prótesis de cadera en el área de Salud de
Anuncio

TESIS DOCTORAL IMPLANTES DE PROTESIS DE CADERA EN EL ÁREA DE SALUD DE BADAJOZ 2009-2014. ESTUDIO DE COSTES EN EL SERVICIO EXTREMEÑO DE SALUD. CÉSAR MARÍA TÉLLEZ BOENTE DEPARTAMENTO DE ENFERMERÍA 2016 2 TESIS DOCTORAL IMPLANTES DE PROTESIS DE CADERA EN EL ÁREA DE SALUD DE BADAJOZ 2009-2014. ESTUDIO DE COSTES EN EL SERVICIO EXTREMEÑO DE SALUD. CÉSAR MARÍA TÉLLEZ BOENTE DEPARTAMENTO DE ENFERMERÍA Conformidad de los directores: Fdo. Dr. Juan Diego Pedrera Zamorano Fdo. Dr. Guillermo Téllez de Peralta 2016 3 4 A mi padre 5 6 AGRADECIMIENTOS Al Profesor Dr. Juan Diego Pedrera Zamorano, director de este tesis por su estímulo y apoyo a mi labor. Al Servicio de Sistemas de Información del Área de Salud de Badajoz, tan diligentemente dirigido por María del Mar Franganillo y su gran colaborador Gabriel Guijarro, por trabajar tan incansablemente por lograr acceder a toda la información necesaria. A la Dirección de Régimen Económico del Área de Salud de Badajoz, en especial a Manuel Brito y a Anabel Rivas, por facilitarme toda la información necesaria. Al Servicio de Farmacia del Área de Salud de Badajoz, representado por el Dr. Juan Francisco Rangel, por su accesibilidad y rapidez de respuesta. A mis suegros Antonio y Victoria, por su ánimo continuo. A mis padres, por su apoyo incondicional A mi esposa Victoria Eugenia, por su comprensión, paciencia e inagotable optimismo. Y a mis hijos César y Ernesto, a los que tanto tiempo le he robado y quienes todo se merecen. 7 8 INDICE 9 10 I.- INTRODUCCIÓN ................................................................................................................ 15 1.1.- Antecedentes históricos. .................................................................................................. 21 1.2.- Definición de Fractura de Cadera. Tipos y características. .......................................... 25 1.3.- Incidencia de la fractura de cadera. ............................................................................... 29 1.4.- Diferencias geográficas. Predicción de las fracturas de cadera.................................... 36 1.5.- Las caídas. ...................................................................................................................... 43 II.- LOS COSTES SANITARIOS. LOS SISTEMAS DE EVALUACIÓN. ......................... 47 2.1.- Sistemas de Información. ................................................................................................ 48 2.3.- Clasificación de los Costes. ............................................................................................ 54 2.3.- Determinación del Coste Hospitalario. .......................................................................... 61 2.4.- Sistemas de Costes en los Centros Hospitalarios. .......................................................... 63 2.5.- Los Modelos de Costes en los Centros Hospitalarios de España. .................................. 67 III.- HIPÓTESIS Y OBJETIVOS. ......................................................................................... 103 IV.- MATERIAL Y METODO .............................................................................................. 107 4.1.- Método .......................................................................................................................... 116 4.2.- El Servicio Extremeño de Salud (SES) .......................................................................... 136 V.- RESULTADOS. ................................................................................................................. 151 5.1- Análisis de resultados por sexo del paciente ................................................................. 153 5.2.- Análisis de resultados en función de la edad de los pacientes intervenidos................. 155 5.3.- Análisis de resultados en función de la mortalidad. ..................................................... 159 5.4.- Análisis de resultados de estancia pacientes intervenidos ........................................... 162 5.5.- Análisis por tiempos ...................................................................................................... 168 5.6.- Análisis de los costes totales ......................................................................................... 170 5.7.- Análisis de Diagnósticos por Codificación ................................................................... 172 5.8.- El Cuadro de Mando Integral como herramienta útil para la gestión estratégica en las organizaciones sanitarias...................................................................................................... 176 VI.- DISCUSIÓN ..................................................................................................................... 189 VII.- CONCLUSIONES .......................................................................................................... 199 VIII.- RESUMEN. SUMMARY. ............................................................................................ 203 IX.- BIBLIOGRAFÍA ............................................................................................................. 211 X.- ÍNDICE DE FIGURAS ..................................................................................................... 219 XI.- ÍNDICE DE TABLAS ..................................................................................................... 221 11 12 I.- INTRODUCCIÓN 13 14 I.- INTRODUCCIÓN El envejecimiento de la población mundial —en los países desarrollados y en desarrollo— es un indicador de la mejora de la salud en el mundo. El número de personas con 60 años o más en todo el mundo se ha duplicado desde 1980, y se prevé que alcance los 2000 millones de aquí a 2050 (Organización Mundial de la Salud, 2012). Con el aumento de la esperanza de vida, actualmente situado en (81.9 años en el año 2013) también aumentan cada año el número de personas que necesitan un implante de prótesis de cadera. Es normal, el desgaste por los años, la artrosis factor principal causante de la degeneración del cartílago y del hueso y la osteoporosis contribuyen a la perdida de masa ósea de tal forma que es el problema que afecta a 7 millones de españoles actualmente y en los próximos años serán muchos mas. Los últimos estudios realizados al respecto concluyen que esta enfermedad afectará a la mayoría de los españoles a medio o largo plazo, llegando a convertirse en la cuarta causa de discapacidad en el mundo en el año 2020. Este es el precio que hay que pagar por el progresivo envejecimiento de la población que permite predecir un aumento remarcable de los casos. Hoy sabemos que afecta al 17% de la población española y al 80% de la de más de 65 años en los países industrializados. Además, está detrás del 30% de las incapacidades laborales permanentes y temporales en nuestro país y desencadena el 35% de las consultas de atención primaria. Pero la artrosis no es sólo cosa de la tercera edad. De hecho, como consecuencia de traumatismos o problemas congénitos que afectan a la articulación es común que un 24% de los españoles la padezca a partir de los 40-45 años en cualquier localización del cuerpo. Es más, al llegar a los 40 años, muchas personas presentan signos de la enfermedad en las radiografías, especialmente en las articulaciones que sostienen el peso (como la cadera), aunque relativamente pocos presentan síntomas. Tampoco los deportistas de alto nivel se librarán de ella. Es más, la mayoría será su víctima. La enfermedad afecta a más mujeres que a hombres y a diabéticos. “La artrosis de cadera por ejemplo es más frecuente en varones que en féminas menores de 45 años pero, posteriormente, tras los 55, ellas se igualan. Y más adelante, la mayor prevalencia está en el sexo femenino, que la sufre en cualquier articulación. 15 Este envejecimiento progresivo que la población, favorece el aumento de la incidencia de fracturas de cadera; hasta tal punto, que se considera a esta como una de las lesiones más frecuentes y con más morbilidad en las personas mayores de 65 años. Este aumento de la incidencia está provocando, en todo el mundo, un grave problema asistencial, sociosanitario y con un gran impacto económico, siendo por tanto un reto su gestión. La fractura de cadera es una patología prevalente en los ancianos. Aproximadamente el 85% de todas las fracturas de cadera se producen en personas de más de 65 años. Según The Global Economic and Healthcare Burden of Musculoskeletal Disease, informe suscrito por la Organización Mundial de la Salud, en el año 1990 se produjeron aproximadamente 1,7 millones de fracturas de cadera relacionadas con la osteoporosis (Manzarbeitia, 2005). Para el año 2050 las estimaciones sitúan esta cifra en torno a los 6 millones. (Gullberg B, 1997). Fracturas de Cadera previstas para 2050 En el mundo En Asia 6.300.000 3.200.000 Fuente: Melton L.L. Osteoporosis Int. 1996 (Suppl.1):85. Tabla 1.- Fracturas de Cadera previstas para 2050. Después de los 50 años, una de cada tres mujeres y uno de cada cinco hombres sufrirán una fractura en algún momento de sus vidas. En el caso de las mujeres, este riesgo es mayor que el riesgo de padecer cáncer de mama, ovario y útero en conjunto. Mientras que en los hombres, es mayor que el riesgo de padecer cáncer de próstata. Aproximadamente el 50% de las personas que sufrieron una fractura osteoporótica, experimentará otra; aumentando exponencialmente el riesgo de fracturas con cada nuevo episodio (International Osteoporosis Foundation, 2012). Además, para la persona anciana, sufrir una fractura de cadera puede suponerle un punto de inflexión que puede marcar completamente la situación de su salud a partir de ese momento; este tipo de fractura es una de las causas más importantes de morbilidad y mortalidad. Cabe recordar, por un lado, que la mayoría de estos pacientes son pluripatológicos, presentan diversas patologías sistémicas asociadas, inherentes al declive fisiológico asociado con el envejecimiento (enfermedad cardiovascular, respiratoria, diabetes mellitus, déficit sensoriales o neurológicos, desnutrición, demencia, etc.) y, por otro lado, casi la mitad de los ancianos independientes pasarán de alguna forma a ser parcialmente dependientes para las actividades de la vida diaria tras sufrir la fractura, y un tercio de ellos incluso puede llegar a ser totalmente dependiente. 16 En España se producen anualmente unas 33.000 fracturas de cadera. La incidencia global es de unos 517 casos por 100.000 ancianos y año (270 casos/100.000 varones y 695/100.000 mujeres). Son más frecuentes en mujeres, debido a la elevada prevalencia de osteoporosis, y su incidencia aumenta con la edad; se calcula que 1/3 de las mujeres mayores de 80 años sufrirá este tipo de fractura (Alvarez-Nebreda ML, 2008) (Monte R, 2005) (Demography Report 2008. UE, 2008). El aumento de la población de riesgo en España en los últimos 30 años presenta un futuro preocupante (tabla 1). Población > 75-80 > 80 años 1970 926.000 188.000 1990 1.684.000 429.000 2000 1.979.000 534.000 2010 2.308.000 631.000 Tabla 2.- Aumento de la población de riesgo en los últimos 30 años Los datos más recientes proporcionados por el Ministerio de nos indican que en los hospitales del Sistema Nacional de Salud español se implantaron 15.483 prótesis totales de cadera en el año 1997 y 22.693 en 2009, lo que representa un incremento del 31 por ciento y una tasa de 4,93 por cada 100.000 habitantes. Por su parte, la prevalencia de artrosis de cadera, en nuestro medio, es de 7,4 por ciento en mayores de 60 años. Según un estudio del “Proyecto Atlas VPM”, en el año 2012 se realizaron 24.868 intervenciones de artroplastia de cadera en población mayor de 35 años. Un 83% de estas intervenciones fueron artroplastias primarias (n=20.781) mientras que un 17% fueron revisiones de reemplazos previos (n=4.236). En el agregado, 1 de cada 1.139 habitantes mayor de 35 años (8,78 intervenciones por 10000 habitantes) fueron intervenidos de artroplastia, realizándose como intervención primaria en 1 de cada 1362 habitantes mayor de 35 años (7,34 intervenciones por 10.000 habitantes) y como revisión de reemplazo previo en 1 de cada 6.666 habitantes (1,5 intervenciones por 10.000 habitantes). (Atlas VPM, 2014) En Estados Unidos se calcula que el aumento será de un 174 por ciento para las artroplastias de cadera y un 673 por ciento para las de rodilla por lo que, según estas previsiones, 572.000 americanos recibirán un implante de cadera en el año 2030 y a 3.480.000 se les implantará una prótesis de rodilla. El sufrimiento humano relacionado con estas lesiones serias y comunes es inmenso y los costes financieros son sorprendentes. Las fracturas de cadera en el anciano suponen, por tanto, un gran problema sociosanitario en los países desarrollados. 17 Es un importante problema tanto desde el punto de vista de la salud (morbimortalidad, pérdida de calidad de vida, etc.), como desde el punto de vista económico debido la necesidad de aplicar recursos económicos tanto monetarios, como de los denominados costes sociosanitarios. Dicho problema, que se engloba dentro de las denominadas fracturas osteoporóticas, ha sido abordado con profusión en diversos países occidentales, especialmente los países nórdicos, en los que la incidencia de este problema alcanza cifras dramáticas. Proyecciones mundiales estiman que una persona sufre una fractura osteoporótica cada 3 segundos. Esto asciende a aproximadamente 25.000 fracturas por día o 9 millones por año (International Osteoporosis Foundation, 2012). En el año 2008 el coste global de los casos de hospitalización en el Sistema Nacional de Salud, como la consecuencia de una fractura de cadera fue de 395,7 millones de euros. Dichos costes se han incrementado en un 131,17% respecto al año 1997 (Campos F, 2005). La U.E. ha calculado que el coste del tratamiento de las fracturas osteoporóticas alcanza una cifra de veinticinco mil millones de Euros al año (Manzarbeitia, 2005) mas otros quince mil millones del cuidado durante el año posterior que precisan estos pacientes tras su regreso al hogar. Los 20.000 millones de dólares por año en los Estados Unidos muestran el impacto que la osteoporosis tiene en la economía mundial. En China, a medida que la población envejece, se estima que los 1600 millones de dólares que se gastaron en la atención de las fracturas de cadera en 2006 aumentarán a 12.500 millones de dólares en 2020 y a 265.000 millones de dólares en 2050. Cambios similares se proyectan en Asia, América Latina y Medio Oriente (International Osteoporosis Foundation, 2012). No podemos olvidar que los datos conocidos sobre esta patología muestran que la osteoporosis es la causa de más días de ingreso hospitalario que patologías tan graves como el infarto de miocardio, la diabetes por el cáncer de mama. De forma general estas fracturas acontecen por el concurso de un terreno propicio, la fragilidad ósea (la osteoporosis) y por traumatismos de pequeña energía (las caídas). Estos dos elementos generales, están condicionados por múltiples, factores. Algunos de ellos no son modificables, como la herencia, pero sí hay muchos otros que son susceptibles de ser alterados, como el ambiente favorecedor de las caídas, los tratamientos farmacológicos, etc. Por tanto, debemos tener presente que, al menos en parte, es posible realizar medidas encaminadas a la disminución de la incidencia de estas lesiones. 18 Esos dos factores, que hemos señalado como directamente implicados en la aparición de las fracturas osteoporóticas, los encontraremos sobre todo en los pacientes ancianos, especialmente las mujeres. Al presentar una esperanza de vida mayor que los varones y ser más proclives a la osteoporosis, debido a factores hormonales, son el grupo de población más afectado. Es decir, las fracturas de cadera van a asentar sobre un paciente ya de por si débil, como mínimo en razón de su edad. Esto se traduce en la posibilidad de empeoramiento de las comorbilidades existentes, y por tanto en la necesidad de realizar un control de las mismas, o por la aparición de nuevas patologías, algunas más relevantes, como los problemas embólicos, y otras a los que se les presta menos importancia, pero que tienen gran trascendencia en la calidad de vida de los pacientes. Parece evidente, por tanto, que en el tema que estamos tratando sería deseable disponer de “unidades” que proporcionaran una asistencia particular a este grupo especial de pacientes, que se ocuparan de minimizar las consecuencias derivadas de la fractura de cadera. Esto supondría una mejora en la asignación de los recursos dedicados al tratamiento, evitando aquellos consumos ineficientes, teniendo en cuenta que nuestro sistema sanitario es un sistema de recursos limitados. El tipo de sociedad actual en los países desarrollados ha introducido un cambio muy importante en cuanto a la atención de los dependientes, especialmente en el caso de los ancianos. En la sociedad rural el anciano seguía dentro de la estructura familiar y en ese ambiente era cuidado. Actualmente en las sociedades urbanas, con actividad laboral fuera del hogar de sus miembros activos, no es posible llevar a cabo el cuidado del anciano dependiente. Esto hace que en el caso de los pacientes con fractura de cadera, fractura que supone un punto de inflexión en la vida del paciente, el alta hospitalaria sea un problema socio-familiar muy grave. No disponemos hasta el momento actual de mecanismos y sistemas para una adecuada atención para estos pacientes una vez que abandonan el hospital donde han recibido la asistencia necesaria. Desde una visión global nos encontramos, pues, ante un grave problema de salud (alta morbimortalidad). Un problema con una alta incidencia y un problema que ocasiona un consumo de recursos económicos y humanos muy importantes. Un problema de salud de una gran magnitud que se debe analizar para, sobre ese análisis, proponer y establecer medidas de prevención, mejoras asistenciales y una adecuada asistencia cuando el paciente abandone el hospital. 19 Especial relevancia tiene, a nuestro juicio, poder establecer un análisis de los costes que nos permitan proponer una reordenación del gasto más eficiente, que no menor, y que se traduzca en una mejora asistencial. En cuanto al impacto asistencial que suponen las FRACTURA DE CADERA varios estudios estiman que más del 20% de las camas de traumatología están ocupadas por pacientes sometidos a cirugía de cadera debido a su elevada prevalencia y a que la estancia hospitalaria media puede situarse entre 20 y 30 días (Pages E, 1998) . En España, el GRD de procedimientos quirúrgicos que genera un mayor número de estancias totales anuales es el 818 (sustitución de cadera excepto por complicaciones) con 313.000 días de estancias hospitalarias registradas. Los costes indirectos, como en todas las patologías incapacitantes, tienen una importancia relevante, aunque muy pocas veces es tenido en cuenta a la hora de valorar las repercusiones de las patologías (Kearney F, 2009) (Azhar A L. C., 2008). Tras una FRACTURA DE CADERA gran parte de los pacientes quedarán gravemente incapacitados perdiendo la autonomía que poseían previamente a la fractura y requiriendo la presencia de un cuidador que les ayude con las tareas cotidianas (Bruyere O, 2008). Las pérdidas de productividad de los familiares de un paciente con fractura de cadera originan un coste que no es tenido en cuenta pero que supone un importante impacto para las economías de los familiares de los pacientes (Doñate F, 2000). Ante estos hechos, nos planteamos la posibilidad de conocer el coste que para el Servicio Extremeño de Salud origina este tipo de fracturas que han de ser tratadas con una prótesis, concretamente en el Área de Salud de Badajoz. Debemos considerar que el coste de la fractura de cadera presenta, al menos dos desagregaciones importantes, la correspondiente a los costes procedentes del proceso hospitalario y la que abarca los costes posthospitalarios, originados por las diversas atenciones que reciben los pacientes, una vez que han sido de alta en el centro hospitalario, costes, de los que no hemos encontrado referencias en la bibliografía que los tengan en consideración, aunque en ocasiones se han citado como costes indirectos, pero no con el componente de los costes posthospitalarios. Para obtener una mayor eficacia y efectividad, la racionalización de los recursos sanitarios es un factor prioritario en la contención de costes. Los médicos deben tener toda la libertad para utilizar los recursos existentes, pero con conocimiento de la responsabilidad que conlleva y de los problemas debidos al consumo de unos recursos cada vez más escasos. El abordaje de los aspectos económicos de la práctica asistencial por parte de los clínicos, no debe tener como objetivo último una disminución del gasto, sino más bien una asignación de los recursos más eficiente. 20 La denominada Gestión Clínica”, de moda en nuestro país hace unos años, fracasó en buena medida por la idea extendida de que lo único que se perseguía era una restricción del gasto. Actualmente no es posible abordar adecuadamente un problema de salud sin prestar atención a los costes que ese problema acarrea. Ley General de Sanidad de 1986, introduce la necesidad de racionalización del gasto sanitario, lo que implica buscar alternativas a la hospitalización, luego, aunque no se trate al paciente en el hospital, se deberá considerar que el servicio se está prestando hasta que el paciente no pueda evolucionar en su mejoría. Siendo esta una de las causas por la que nos hemos planteado este trabajo. 1.1.- Antecedentes históricos. La fractura de cadera es la causa más común de hospitalización en los servicios de urgencias de ortopedia. Esta condición acarrea problemas que van más allá del daño ortopédico y tiene repercusión en áreas, como medicina interna, rehabilitación, psiquiatría, trabajo social y economía de la atención en salud. (Muñoz S, 2008) Históricamente, las fracturas del extremo superior del fémur ya se mencionaban en los trabajos de Hipócrates (460-335 A.C.), el Gran Padre de la Medicina, trataba lesiones traumáticas y ortopédicas. Las describía e interpretaba. Y refería métodos de tratamiento que hasta tiempos recientes, estuvieron vigentes. Ejemplo de ello, fue la descripción de la ¨Luxación Congénita de la Cadera¨ y su carácter no adquirido y las maniobras para reducir lesiones traumáticas. Posteriormente, otros investigadores como en el siglo XVI Ambrosio Paré planteó un método de tratamiento; idearon métodos y dispositivos en busca de mantener los principios de reducción exacta, fijación rígida e impactación de la fractura. Sir Astley Cooper, en 1824 afirmaba en su “Tratado de luxaciones y fracturas de las articulaciones” que las fracturas intertrocantéreas se presentaban por debajo de los 50 años, mientras que las fracturas intracapsulares eran más propias de los ancianos. Siguiendo un cronograma histórico la primera descripción de las fracturas de la extremidad superior de fémur se atribuye a Ambrosio Paré en 1564, pero fue Sir Jacob Astley Cooper en 1882 quien distinguió dos tipos de fracturas que hasta hoy se consideran tienen personalidad propia, las fracturas intracapsulares y las extracapsulares. 21 Son dos fracturas con rasgos diferenciales en su epidemiología, su repercusión sobre el estado general y sus complicaciones. Y fue Smith Petersen en 1931, padre de la cirugía ortopédica moderna, quien popularizó la osteosíntesis de las fracturas del cuello femoral con su clavo trilaminar. A) Intracapsulares: La fractura se sitúa en el cuello del fémur y puede quedar interrumpida la vascularización de la cabeza femoral, por lo que conllevan un riesgo de necrosis y de pseudoartrosis, que deben ser considerados a la hora de seleccionar el tratamiento. Por las dificultades para conseguir la consolidación, estas fracturas son las que siempre han planteado mayores problemas de tratamiento. Hasta la mitad del siglo XIX estas fracturas se trataban simplemente con reposo y cuidados generales del paciente, con malos resultados, tanto en la supervivencia de los pacientes como en complicaciones locales. A partir de la segunda mitad del siglo XIX se introdujo el tratamiento mediante tracción del miembro, con objeto de conseguir menor acortamiento y deformidad; sin embargo, los resultados a nivel general y local apenas mejoraron. Algunos autores como Speed en 1935 definían las fracturas de cuello de fémur como fracturas no solucionadas. En la tercera década del siglo XX, varios autores (Smith, Leandbetter, Withman, Speed y Smith Peterson) diseñaron métodos de reducción y fijación con yeso de espica. En nuestro medio el Dr. López Trigo, desarrollo su propio método en esta misma línea. Con esta nueva orientación terapeútica mejoraron los resultados, pero seguían siendo realmente malos, solo el 23% de los casos se conseguía la consolidación de la fractura y la mortalidad seguía siendo altísima por complicaciones relacionadas con la inmovilización. Ante los malos 12 resultados del tratamiento de estas fracturas con inmovilización externa, la fijación interna de la fractura se fue abriendo camino. Fue la fractura del cuello de fémur una de las primeras fracturas en la que se puso de manifiesto las ventajas de la reducción abierta y la fijación interna. Los primeros intentos ya se realizaron en 1850, aunque se atribuye a Langenbeck en 1878 la primera fijación interna de una fractura de cuello de fémur mediante un clavo, que atravesando el trocanter mayor, se clavaba en la cabeza del fémur (Gomar Sancho, 2004) (Munuera, 2000). A principios del siglo, los enclavados utilizados habitualmente eran de marfil y hueso de vaca. La primera osteosíntesis metálica la introduce Hey Groves en 1916, pero el metal tardaría mucho tiempo en sustituir el marfil y el hueso de vaca. 22 Hasta la cuarta década del siglo XX, estos intentos de fijar la fractura de cuello de fémur estaban en manos de muy pocos cirujanos y el enfoque terapéutico habitual era fundamentalmente conservador, empleando alternativas paliativas, desestimando la cirugía por la edad del paciente y su alta morbilidad (Gomar Sancho, 2004). El verdadero tratamiento quirúrgico de estas fracturas se inicia con Smith-Peterson, Case y Gordon que introdujeron la fijación interna, por medio de un clavo trilaminar para atravesar el cuello de fémur desde la vertiente externa del extremo proximal del fémur hasta la cabeza femoral; sus primeros resultados fueron publicados en 1931, mostrando sus claras ventajas sobre el tratamiento conservador, por lo que el método tuvo clara difusión. Pero se trataba de técnicas abiertas (Munuera, 2000). Estos primeros enclavados se realizaban con amplia exposición quirúrgica de la fractura con un número muy importante de complicaciones y alta mortalidad. La reducción cerrada o “reducción ciega” fue propuesta por Johansson en 1932. La aportación de Svan Johanson de su clavo canulado y los avances tecnológicos del uso del Rx, con amplificadores de imágenes en quirófano permitió la reducción y fijación sin necesidad de exposición de la fractura, permitiendo controlar la reducción de la fractura mediante maniobras externas colocando después el material. Antes del tratamiento quirúrgico de la fractura de cuello femoral las tasas de mortalidad eran del 85% (Gomar Sancho, 2004) . Durante los años 50 en algunos países Europeos la media de estancia hospitalaria para las fracturas de cuello femoral era de 5 meses (Munuera, 2000). Ulteriores refinamientos de la técnica de reducción cerrada con fijación interna aparecieron a medida que se perfeccionaban las técnicas anestésicas, disminuyó sustancialmente la mortalidad y morbilidad operatoria. Los resultados mejoraron, pero todavía se detectaron algunos fallos. Estos clavos tenían como inconveniente un burdo encajamiento e introducción del mismo, el cual no facilitaba el correcto contacto y consolidación, no permitiendo la carga hasta completada la consolidación a los 6 meses. Para obviar este inconveniente Putti ideó un tornillo, pero este tampoco permitía la carga hasta pasados 2 meses. Todos estos métodos conseguían una buena fijación y la tasa de consolidaciones de la fractura mejoraban considerablemente, pero no conseguían algo tan importante para la supervivencia y recuperación de la fractura de cadera en el anciano como es la bipedestación y la marcha precoz. Posteriormente Knowless y Moore diseñaron sus tornillos con calibre reducido para poder colocar varios separados y distribuidos en todo el espesor del cuello femoral, consiguiendo mayor fijación e introduciendo el concepto de compresión interfragmentaria, que a su vez proporciona mayor solidez. 23 Se trataba de una técnica más refinada y que no sobre añadía tanto perjuicio a los tejidos óseos y su 13 nutrición como lo hacían los métodos anteriores. Estos son los precursores de los tornillos canulados que utilizamos hoy en día. En la década de los 50 del siglo XX, se abrió otro camino para el tratamiento de las fracturas de cuello de fémur, las prótesis para la sustitución de la cabeza femoral. Una solución para evitar los problemas de la necrosis femoral y la falta de consolidación, propuesta para cuando la esperanza de vida del anciano era menor que la supervivencia de la prótesis. Judet fue el primero en este camino, diseñando una cabeza acrílica con un tallo de anclaje en el cuello de fémur, publicando sus resultados en 1950, sin embargo ni el diseño ni el material fueron los acertados y su uso fue limitado y fugaz. Más acertados fueron los diseños de Moore (1954) y Thompson (1957) diseñaron una artroplastia de sustitución de la cabeza femoral para corregir las complicaciones derivadas de la pseudoartrosis y la necrosis avascular, con cabezas metálicas con largo anclaje intramedular. Estos diseños se siguen utilizándose hoy en día, aunque su indicación es solo para esperanzas de vida menor de 5 años. Para supervivencias mayores estas prótesis producen cotiloidítis. En un intento de evitar este efecto aparecieron las prótesis bipolares, pero tampoco excluían del todo la cotiloiditis. El desarrollo de las prótesis bipolares de Bateman (1974) y las técnicas de cementado para la estabilización inmediata de la prótesis en la diáfisis femoral mejoraron el tratamiento quirúrgico. Otro avance importante lo constituyó la introducción de la fisioterapia vigorosa y estructurada postoperatoria y de los programas de rehabilitación que se concentran en la deambulación precoz, con especial hincapié en el refuerzo muscular y mejorando la amplitud de movimiento y el retorno precoz a la actividad. No hay que olvidar que el objetivo principal del tratamiento de una fractura de cadera es restablecer la función libre de dolor. La aparición de las prótesis totales, con sustitución de cabeza y recubrimiento de cotilo obtuvieron unos resultados excelentes (Rowwley DE, 1994-1997). B) Extracapsulares: El tratamiento de las fracturas extracapsularesha seguido un camino histórico similar a las intracapsulares. Hasta la primera mitad del siglo XIX el simple reposo era el tratamiento habitual. Hacia la mitad del siglo XX se comenzaron a tratar mediante tracción esquelética sobre la tibia proximal durante 12 a 18 semanas. Con estos tratamientos conservadores los resultados eran mejores que en las fracturas intracapsulares en cuanto a la consolidación pues son fracturas de fácil curación, pero los resultados eran iguales o peores en cuanto a la morbilidad y mortalidad. 24 Desde finales de la década de 1950, la tracción esquelética constituyó una práctica habitual. En parte esta actitud conservadora se apoyaba en la alta frecuencia de complicaciones técnicas que aparecieron en las primeras series tratadas quirúrgicamente. Algo más tarde que en las fracturas intrarticulares, la cirugía fue abriendose camino quedando los sistemas de tracción como un simple tratamiento temporal hasta la intervención, aplicada de forma percutánea. Los primeros implantes fueron el de Mclauglin (modificación del clavo de Smith Peterson) que fueron abandonados por su fragilidad y sustituidos por los sistemas monobloc, entre ellos los clavos de Jewet, más tarde aparecieron los clavos endomedulares como los de Künstcher y los clavos de Ender. Los implantes más utilizados son los sistemas cervicocefálicos que incluyen el concepto de compresión cefálica, actualmente los sitemas deslizantes con componente diafisario medular van ganando adeptos (Gomar Sancho, 2004). Los cambios introducidos en la técnicas quirúrgicas y el diseño de los implantes afectaron esta actitud conservadora, de forma que el tratamiento quirúrgico habitual, basado en la reducción cerrada o 14 abierta, fijación interna y movilización precoz se considera el tratamiento estándar. El tratamiento ortopédico (tracción como tratamiento definitivo) ha sido completamente abandonado debido a la alta tasa de complicaciones. 1.2.- Definición de Fractura de Cadera. Tipos y características. Una fractura de cadera es una ruptura en el fémur (hueso del muslo) de la articulación de la cadera. Las articulaciones son áreas en las que se juntan dos o más huesos. La articulación de la cadera es una "enartrosis" (cabeza y cavidad), en la que el fémur se junta con el hueso de la pelvis. La bola de la articulación de la cadera es la cabeza del fémur, y la cavidad es un hueso de la pelvis con forma de taza que se denomina acetábulo. La fractura de cadera es una lesión muy seria y requiere de atención médica inmediata. Una fractura es una ruptura parcial o total del hueso. Puede tratarse de una sola o de múltiples rupturas en un hueso. La fractura de cadera se clasifica según el área específica de la ruptura y el tipo de ruptura(s) en el hueso. 25 Figura 1.- Articulación de la Cadera Los tipos de fracturas de cadera más comunes son: 1.- Fractura del cuello del fémur. La fractura del cuello del fémur se produce a una distancia de dos a cinco centímetros de la articulación de la cadera. Este tipo de fractura puede causar una complicación, porque a menudo la ruptura impide el paso de la sangre a la cabeza del fémur, que forma la articulación de la cadera. Figura 2.- Fractura Femoral del Cuello En general se deben a caídas en pacientes añosos o una fractura en hueso osteoporótico seguido de la caída, o fractura en hueso patológico (ej., tumores). No se debe olvidar que el paciente podría haber sufrido un accidente isquémico transitorio o un bloqueo aurículoventricular que haya generado una pérdida de conciencia y la posterior caída o por vértigo, que es frecuente en los ancianos por las insuficiencias vertebro-basilares. 26 Y por otro lado están los accidentes de alta energía, que si bien involucran generalmente a gente joven, los adultos mayores que manejan también podrían estar involucrados en un accidente de tránsito de alta velocidad. Por todo lo anterior el enfoque multidisciplinario de estos pacientes debe ser desde el inicio. Las fracturas de cuello femoral son fracturas intracapsulares que comprometen la irrigación de la cabeza femoral y su viabilidad va a depender del grado de desplazamiento de los fragmentos, por lo tanto mientras más desplazados, mayor riesgo de necrosis. En pacientes jóvenes la reducción anatómica abierta y fijación estable con tornillos disminuyen el riesgo de necrosis avascular, considerándose una urgencia quirúrgica. Hay diferentes tipos de tratamiento. La osteosíntesis con tornillos canulados 7,0 y 7,3 mm es el tratamiento de elección para todos aquellos pacientes jóvenes o ancianos que tienen una excelente actividad funcional prelesional. Para una fractura inestable y desplazada el tratamiento quirúrgico dependerá de la edad, el nivel de actividad prelesional, la calidad ósea, las enfermedades asociadas y la expectativa de vida. Entonces si el paciente tiene menos de 65 años, sin patologías de importancia asociada y un buen stock óseo a reserva ósea, lo más recomendable es una reducción abierta y fijación interna de urgencia dentro de las primeras horas de la fractura, para prevenir la necrosis. Si la persona tiene más de 65 años y una proyección de vida prolongada en el tiempo, se le ofrecerá una endoprótesis total de cadera, a diferencia de aquellos que tienen una proyección menor a los que se le ofrece una prótesis parcial, que ha ido quedando en desuso y se prefiere la prótesis total, ya que en aquellos en que se instaló una prótesis parcial muchas veces terminan absolutamente protruidas en la pelvis, debido a la actual mayor sobrevida poblacional. Realizar un recambio a una prótesis total en ese momento tiene altísimos riesgos, por lo tanto cada vez que se indique una prótesis parcial, tiene que ser en forma muy precisa y en alguien que tenga escasas expectativas de vida demostradas. Las complicaciones de esta fractura son la no-unión y la necrosis avascular. (Opazo, 2011) 2.- Fractura intertrocantérica de cadera Una fractura intertrocantérica de cadera se produce a una distancia de siete a diez centímetros de la articulación de la cadera. Se ubican entre el trocánter mayor y menor, son las más frecuentes del fémur proximal y habitualmente ocurren en pacientes de mayor edad por lo que, asociado a las enfermedades concomitantes, tienen alta morbimortalidad. 27 Figura 3.- Fractura Intertrocánterea Se caracterizan por ser fracturas extracapsulares que rara vez comprometen la irrigación de la cabeza, por lo tanto, el riesgo de necrosis es mínimo y un tratamiento quirúrgico precoz tiene en general buenos resultados. Se clasifican a su vez en estables e inestables, lo que tiene relación al grado de conminución de la fractura, más el compromiso que exista o no de la pared posteromedial de la cadera. La incidencia de cada uno de estos tipos de fracturas es de 50%. Para intervenir la fractura se debe realizar un estudio radiológico con una radiografía AP y axial de la cadera, más una radiografía de la diáfisis femoral proximal, por si es necesario conocer la anatomía del sector para colocar un clavo y evitar contratiempos en el intraoperatorio. Una vez que está reducida se procede a estabilizarla de diferentes maneras. Una de ellas es la utilización de un DHS, que es un sistema de osteosíntesis que intenta colocar una aguja guía lo más cercano posible al tercio proximal de la cadera y que se ubique exactamente en el centro, tanto en la proyección AP como axial. En el postoperatorio es fundamental intentar la marcha precoz entre el primer y segundo día con la ayuda de bastón o andador, si esto no es posible, por lo menos se debe sentar al borde de la cama, pero si se logra dentro de las 48 horas poner al paciente de pie al borde de la cama, se previene todo lo referido a las complicaciones. Esta es una fractura que a pesar de ser en hueso osteoporótico no influye en los tiempos de consolidación y se consolida entre los tres y cinco meses, ya que un implante colocado en buena posición va a determinar siempre que el hueso consolide. 28 3.- Fractura de cabeza femoral. También llamadas fracturas de Pipkin, las fracturas de cabeza femoral resultan de impactos de alta energía, pueden asociarse a luxofractura, luxación de la cadera, fractura de cuello o de cotilo, pero hay que tener presente que junto con esta fractura puede haber compromiso de otro segmento u órgano del organismo. 4.- Fracturas subtrocantéreas. Son habitualmente fracturas asociadas a gente bastante más joven en relación a las fracturas antes mencionadas. Son producidas por traumatismos de alta energía. El problema que tienen es que esta zona tiende a tener un retraso en su consolidación, por lo tanto genera cierta dificultad en la forma de evaluar el tratamiento y con alguna frecuencia van a evolucionar a la no-unión, es decir, al retardo de consolidación o a la pseudoartrosis. Una forma de clasificarlas es según el nivel de la fractura: tipo 1 aquellas de trocánter menor; tipo 2, las que están a 2,5 centímetros distales; y tipo 3, que estarían entre los 2,5 a 6 centímetros distales al trocánter menor. Desde ahí hacia distal se clasifican dentro de las fracturas diafisiarias. El tratamiento de las fracturas simples consiste en reducción anatómica con una fijación interna, pero extramedular, es decir, una placa con estabilidad absoluta efectuando compresión interfragmentaria debido a que son dos fragmentos, lo que no debería generar mayores complicaciones (Opazo, 2011). Mencionar en este punto a la AO (Asociación para el Estudio de la Osteosíntesis) es la institución que rige a la mayoría de los traumatólogos en el mundo y establece estándares al momento de colocar un implante en una fractura. 1.3.- Incidencia de la fractura de cadera. Las fracturas de cadera ocurren en un subgrupo de la población anciana caracterizado por un peor estado de salud previo, mayor precariedad social y mayor frecuencia de deterioro funcional y mental (Brossa Torruella A, 2005) (Vestergaard P, 2007) (Tosteson AN, 2007). 29 Si hacemos una comparación con los controles poblacionales de su misma edad y sexo, los pacientes que padecen una fractura de cadera con más frecuencia viven en una residencia, carecen de pareja o viven solos en el momento de la fractura, son portadores de mayor deterioro en la movilidad y en la capacidad para realizar las actividades de la vida diaria, y tienen mayor comorbilidad asociada y mayor número de hospitalizaciones previas. Respecto a la frecuencia de enfermedades concretas, presentan más a menudo algunas como demencia, hipertensión arterial, neoplasias, dislipemia, insuficiencia cardiaca, secuelas de ictus, insuficiencia renal, desnutrición y deprivación visual. De modo que se considera que los pacientes con fractura de cadera llegan a ella con un precario estado de salud, lo que explicaría en parte el exceso de mortalidad que este evento conlleva. La tasa de mortalidad después de sufrir una fractura de cadera duplica la de las personas de la misma edad sin fractura y el exceso de mortalidad se mantiene durante el resto de su supervivencia. Aun cuando conocemos diversos factores, que siendo dependientes del paciente, y que se asocian a una mayor mortalidad y que permiten identificar a los individuos de mayor riesgo de muerte; existen otros factores, los mecanismos más profundos de la relación entre fractura y mortalidad que no son bien conocidos. En un primer momento las causas de éxitus no difieren de las más comunes en la edad avanzada. Los pacientes masculinos están particularmente expuestos. Durante el postoperatorio inmediato fallecen más los pacientes previamente más frágiles y con mayor comorbilidad, pero durante los meses y años siguientes la mortalidad comienza a afectar a personas previamente más saludables. Figura 4.- Fractura y morbilidad asociada durante toda la vida 30 Algunas estrategias que deben seguirse para la reducción de la mortalidad debida a la fractura de cadera son: • La prevención con el objetivo de la reducción de su incidencia. • El manejo multidisciplinar del proceso asistencial. • El tratamiento de la osteoporosis. De todas las fracturas de origen osteoporótico, la fractura de cadera provoca el mayor índice de mortalidad. A pesar de los avances en los campos quirúrgicos y anestésico no se ha visto su reflejo en las tasas de reducción de la mortalidad, permaneciendo estas tasas estables a lo largo de las últimas décadas, según se refleja en los estudios publicados. (Giversen, 2007) (Haleem S, 2008) (Brauer CA C.-P. M., 2009). Estas tasas se encuentran entre el 2 y el 7% de los pacientes durante la fase hospitalaria aguda, entre el 6 y el 12% durante el mes siguiente y entre el 17 y el 33% al cabo del primer año tras la fractura de cadera (Jiang HX M. S., 20045) (Von Friesendorf M B. J., 2008). Para el caso español, puede estimarse que de los casi 40.000 pacientes que sufren anualmente una fractura de cadera (Álvarez-Nebreda ML J. A., 2008) fallecen unos 10.000 durante los doce meses posteriores a la misma. Esta mortalidad es más elevada en los varones, en los que oscila entre el 32 y el 62% al año de la fractura de cadera, mientras que en las mujeres se sitúa entre el 17 y el 29%. También es mayor entre los más ancianos, pasando del 7% al año en los menores de 75 años al 33% en los mayores de 85. Como ya hemos indicado anteriormente existen, otros factores, como son el vivir en residencias de ancianos o el padecer comorbilidad, que influyen de manera notable en esta la mortalidad. En los pacientes que han sufrido una fractura de cadera se produce un marcado incremento de mortalidad respecto al resto de la población durante los meses y años siguientes al evento. El incremento de riesgo relativo de fallecimiento es de entre dos y tres veces el de la población de similar edad y sexo sin fractura de cadera (de Luise C, 2008) (Abrahamsen B, 2009). En el sexo masculino la tasa de fallecimientos tras fractura de cadera puede llegar a ser hasta cuatro veces mayor que la de los varones sin fractura (Bliuc D, 2009) (Forsen L, 1999). El exceso de mortalidad de los pacientes tras la fractura de cadera comparado con los controles oscila entre el 8 y el 36% al año (Abrahamsen B, 2009). 31 Para la población en conjunto, el hecho de sufrir una fractura de cadera reduce la expectativa media de vida restante del paciente en un 25%. Pero la pérdida absoluta de número de años de vida no es homogénea, sino que es mayor cuanto menor sea la edad del paciente en el momento de sufrir el evento y también es mayor en los varones. En los dos extremos se encuentran, por un lado, los varones menores de 75 años que presentan un riesgo relativo de mortalidad al año 4 veces superior que los controles de su edad y, en el opuesto, las mujeres mayores de 85 años que tienen un riesgo relativo que no llega al doble de sus coetáneas (Forsen L, 1999). El incremento de mortalidad es máximo en los primeros 6 meses tras la fractura de cadera, fase en la que se producen casi la mitad de todas las muertes y en la que la probabilidad de que un paciente con fractura de cadera fallezca llega a ser de 5 a 8 veces mayor que la de los controles. Posteriormente el exceso de mortalidad disminuye, aunque persiste durante el primer año y probablemente se prolongue durante los 5 o incluso 10 años posteriores (Bliuc D, 2009) (Haentjens P, 2010) (Empana JP, 2004) (Paksima N, 2008). La razón de que la mayor frecuencia de muerte se acumule en los primeros meses tras la fractura de cadera no es bien conocida y ha sido interpretada de diferentes modos, es comúnmente aceptado que la propia fractura incide en la salud general del paciente, desencadenando complicaciones graves y la muerte. Todo ello unido a la mala salud previa del individuo. Las causas de muerte en los primeros 30 días tras la fractura las causas de muerte más frecuentes son los problemas del aparato respiratorio (neumonía e insuficiencia respiratoria), del sistema cardiovascular (insuficiencia cardiaca, infarto de miocardio e ictus) y el cáncer. Otras causas menos frecuentes son la sepsis, la insuficiencia renal y las hemorragias digestivas. Como hemos indicado la mayoría de estas muertes se relacionan con un empeoramiento del mal estado previo del paciente más que con la aparición de complicaciones posoperatorias fatales. Un estudio (Foss NB, 2005) muestra que un porcentaje importante (el 43%) de estas muertes precoces puede considerarse inevitable, ya que es debido a enfermedades previas intratables o muy graves. El resto de las muertes se deben a complicaciones posoperatorias y son potencialmente evitables, aunque en muchas de ellas (el 34%) se limita el esfuerzo terapéutico ante la mala situación funcional y mental previa del paciente. Las muertes que ocurren posteriormente, durante los meses y años siguientes a la fractura de cadera, se deben principalmente a enfermedad cardiovascular (cardiopatía isquémica e ictus), cáncer y enfermedades pulmonares (neumonías y [EPOC]), que son las causas de muerte más frecuentes también en el resto de la población de la misma edad. 32 Se estima que la propia fractura de cadera contribuye a la muerte como causa directa tan solo entre el 10 y el 24% de los fallecimientos (Empana JP, 2004) (Kanis JA, 2003) (Hindmarsh DM, 2009). Hasta tres cuartas partes de los pacientes presentan enfermedades coexistentes en el momento del ingreso. En la tabla 3 se resumen las enfermedades importantes asociadas con más frecuencia en los pacientes con una fractura de cadera: Prevalencia de otras enfermedades en los pacientes que ingresan por una fractura de cadera Porcentaje de Pacientes con el diagnóstico 29-­‐47 8-­‐40 22-­‐37 8-­‐36 9-­‐26 9-­‐26 7-­‐23 6-­‐19 15-­‐18 3-­‐18 17 11-­‐14 5-­‐13 9-­‐12 8-­‐11 4-­‐8 1-­‐3 Trastorno Hipertensión Cardiopatía i squémica Anemia Demencia EPOC Arritmias (especialmente fibrilación auricular) Diabetes Secuelas de i ctus Insuficiencia cardiaca Insuficiencia renal Malnutrición Hipotiroidismo Neoplasias Fractura de cadera previa Ateraciones hidroelectrolíticas Enfermedad de Parkinson Hepatopatía crónica Tabla 3.-Prevalencia de otras enfermedades en los pacientes que ingresan por fractura de cadera. El riesgo quirúrgico de estos pacientes es elevado. En la mayoría de las series se encuentran clasificados como de riesgo quirúrgico alto (puntuación de la escala de la American Association of Anaesthesiologists [ASA] III) entre el 45 y el 65% de los pacientes y no son raras las series en las que el porcentaje de estos casos sobrepasa el 70% (McLeod K, 2005) (Paksima N, 2008) (Holt G S. R., 2008) (Radcliff TA, 2008). Ante esta elevada prevalencia de enfermedad, el estrés agudo e intenso que supone la fractura y la posterior intervención quirúrgica puede desencadenar tanto la exacerbación de enfermedades previas como la aparición de complicaciones. De entre las comorbilidades graves las más fuertemente asociadas con la mortalidad precoz son las enfermedades cardiovasculares, pero también lo están la demencia, la insuficiencia renal, la malnutrición y los tumores. Factores asociados a mortalidad tras la fractura Existen muchos factores asociados a la mortalidad tras padecer una fractura de cadera (Tabla 3). Entre los factores socio-demográficos, el sexo masculino es un claro factor de mal pronóstico, sin que se conozca la razón. 33 Factores dependientes del paciente cuya presencia se asocia a mayor mortalidad tras una fractura de cadera Sociodemográficos Sexo masculino Edad avanzada Vivir e n una residencia de ancianos Confinamiento, aislamiento o necesidad de ayuda e n domicilio Alta a residencia Clase social baja Sufrir l a f ractura e stando hospitalizado Factores f uncionales Alteración movilidad previa Dependencia previa para l as actividades de l a vida diaria Mala movilidad posoperatoria Deterioro posoperatorio e n l as actividades de l a vida diaria Inmovilidad prolongada e n e l i ngreso Poca f uerza muscular de prensión manual Miedo a caer Déficit sensorial Factores mentales Demencia/Deterioro cognitivo Delirium e n e l i ngreso Depresión Enfermedades previas Comorbilidad Enfermedad cardiaca Cáncer EPOC: e nfermedad pulmonar obstructiva crónica. Insuficiencia renal crónica Enfermedades neurológicas´ gicas Historia de f racturas previas Hepatopatía Desnutrición Hospitalización e n e l año previo Tratamiento con antiagregantes Diabetes Situación clínica durante e l i ngreso Riesgo quirúrgico alto ( ASA III-­‐IV) Complicaciones médicas e n e l posoperatorio Tipo de f ractura: e xtracapsular, i ntracapsular Anemia al i ngreso Insuficiencia renal aguda Ingesta i nsuficiente Desnutrición Necesitar transfusión Ictus Infección respiratoria baja Inestabilidad clínica al i ngreso durante ó e l alta Incontinencia Úlceras por presión Luxación de l a pro 'tesis Obstrucción i ntestinal Alteraciones analíticas: " urea, " troponina I, hiper o hiponatremia Tabla 4.- Factores dependientes del paciente En España, la mortalidad durante la hospitalización en los varones es casi del doble que en las mujeres (8,9 frente al 4,8%) (Álvarez-Nebreda ML J. A., 2008). Aunque la mortalidad entre los varones de esta edad sin fractura de cadera también es mayor que en las mujeres, parece que el exceso de mortalidad provocado por la fractura de cadera es proporcionalmente superior en el sexo masculino que en el femenino y que ese exceso de mortalidad se mantiene incluso cuando se ajustan el estado de salud y la situación funcional previos de los casos (IM., 2007) (Bliuc D, 2009) (Holt G S. R., 2008). 34 La mortalidad aumenta a mayor edad de los enfermos en el momento de sufrir la fractura. También el sufrir la fractura de cadera en una residencia de ancianos se evidencia en muchos estudios como un predisponente para fallecer. La clasificación ASA de riesgo quirúrgico se muestra como un fiable instrumento predictivo de mal pronóstico vital, especialmente en los pacientes clasificados en los grados III y IV. Esta escala evalúa´ a, aunque de un modo simple, la situación clínica de los pacientes en el momento previo a la cirugía y puede ser un marcador de gravedad. Como suele ocurrir entre los pacientes ancianos, independientemente del diagnóstico, una situación previa de mala movilidad o de discapacidad para las actividades de la vida diaria se asocia a mayor mortalidad tras el evento. Lo mismo ocurre si esta´ presente algún´ n grado de deterioro cognitivo o demencia. La presencia de enfermedades previas, hecho frecuente en estos pacientes, como hemos visto, y, específicamente, la presencia de cardiopatía, se asocia a una mayor mortalidad. Lo mismo ocurre en el posoperatorio, donde la aparición de alguna complicación cardiaca o pulmonar se revela como otro consistente marcador de mortalidad. También se asocian a mayor mortalidad algunos factores no dependientes del paciente (tabla 4), aunque han sido menos estudiados y aparecen menos frecuentemente en la bibliografía. Factores no dependientes del paciente asociados a mayor mortalidad tras una fractura de cadera Relacionados con la cirugía Tratamiento conservador Escasa experiencia del cirujano Anestesia general Artroplastia frente a fijacion´ n interna Fijación interna frente a artroplastia Cirugía de duración prolongada (más de 90 minutos) Relacionados con el tratamiento médico Carecer de tratamiento en equipo multidisciplinario Carecer de manejo mediante vía clínica No tratar la osteoporosis No recibir tratamiento antitrombótico Valoración preoperatoria no estandarizada Relacionados con el dispositivo asistencial Ingreso en periodo de vacaciones Ingreso en viernes Tránsito acelerado en urgencias (menos de 190 minutos) Hospital con alto volumen de fracturas Hospital con muy bajo volumen de fracturas Hospital no docente Estancia hospitalaria prolongada en traumatología Tabla 5.- Factores no dependientes del paciente. Aunque en gran parte la supervivencia dependa del ‘‘estatus pre fractura’’, considerando las asociaciones que aquí´ se presentan se deduce que la atención sanitaria a aquellos pacientes con fractura de cadera que pueden identificarse como de mayor riesgo de mortalidad debe incluir un abordaje más integral que la sola intervención quirúrgica. 35 Se debe prestar especial atención a los pacientes varones y a los de edad muy avanzada. Se debe conferir a la escala ASA una validez no solo para la detección del riesgo quirúrgico, sino también para la estimación del pronóstico vital a medio y largo plazo. Hay que sospechar una potencial mayor gravedad en los portadores de una fractura de localización extracapsular. Deben estudiarse las áreas funcional y cognitiva previas de los pacientes y dedicar especial atención clínica a los ancianos en los que se detecte un deterioro basal en estas á reas. Por último, los médicos que atiendan a estos casos deben conocer bien y estar adiestrados en el manejo de la pluripatología del paciente de edad avanzada y capacitados para la detección y tratamiento de las complicaciones frecuentes durante su hospitalización. Los resultados obtenidos nos presentan una patología de gran envergadura en el ámbito epidemiológico, económico y social, con unas altas tasas de morbi-mortalidad, pues entre el 15 y el 36% de los pacientes con fractura de cadera fallece como consecuencia de la misma, siendo la cuarta causa más frecuente de mortalidad en Estados Unidos (Oi LH, 2005) (Panula J, 2011). 1.4.- Diferencias geográficas. Predicción de las fracturas de cadera. La fractura de cadera presenta mayor incidencia en los individuos de raza blanca con una variabilidad determinada atendiendo a las diferentes regiones geográficas. Los países escandinavos tienen un rango ajustado por edad más bajo que los países del sur de Europa y a su vez más alto que en los EEUU. (Cummings SR1, 1995) La composición étnica, el tamaño de la población y su distribución por edades determinan el número absoluto de fractura de cadera. Mientras que en Asia sólo se producen un tercio de las fracturas de cadera a pesar de su mayor población. La mitad de las fracturas de cadera en el mundo se reparten en su producción entre Europa, EEUU y Oceanía. El motivo según Thorngren, (1997) es que la población es más anciana y está compuesta mayoritariamente por blancos caucasianos. Para este mismo autor en Europa existe una correlación establecida entre la ratio de incidencia estandarizada respecto de la edad tanto en hombres como en mujeres, dándose la mayor incidencia en los países del norte y menor en las regiones mediterráneas. Thorngren sugiere que los factores genéticos o ambientales pueden tener cierta relación con la etiología de las fracturas ante el hecho de que se detecte una mayor diferencia entre países que entre géneros. 36 Zuckerman (1996) nos indica que en 1996 en un país como Suecia se estimó la incidencia en 216 casos por millón de habitantes en tanto que en los EEUU 80 casos por cien mil habitantes, aumentando de forma sustancial la incidencia de casos a medida que aumentaba la edad, llegando a doblar su incidencia por cada década después de los 50 años. En Dinamarca la incidencia de las fracturas de cadera en las mujeres presenta una relación con la presencia de una incidencia de dos a tres veces mayor que en los hombres. A su vez, se observó que estas lesiones, en general, se hacen presentes con una prevalencia de dos a tres veces mayor en las mujeres blancas. El riesgo de padecer una fractura de cadera a lo largo de su vida en Suecia es de un 25% en las mujeres frente a un 7% de los hombres; y se ha constatado que la incidencia ha aumentado de forma sustancial por la mayor longevidad de la población, principalmente en las mujeres. Varios autores (Lüthje, 1991) (Søren Eiskjær, 1992) (Jan A. Falch, 1985) (M K Wong, 2002) (Mannius S, 1987) refieren que las expectativas de reducción de la tasa de mortalidad para mujeres mayores de 65 años (1,5 % por año) durante la actual década suponen llevar consigo un incremento del 10 al 15% en la incidencia de la fractura de cadera. Sotorres (2005), incide en que las diferentes hipótesis para justificar la variabilidad regional como factor de riesgo no son lo suficientemente explicativas de la situación. Sin embargo, existen claras diferencias observadas en la prevalencia de estas lesiones por sexo y género siendo las causas explicadas parcialmente por patrones morfológicos del esqueleto. Los africanos que presentan una masa ósea mayor, tienen los niveles más bajos de fractura de cadera en tanto que la mujer caucásica tiene menor masa ósea y una tasa más elevada de fractura de cadera. En los países escandinavos es donde, a nivel mundial, se da el rango ajustado por edad más alto de fractura de cadera y según Johnell et al., (1992) la incidencia de la fractura de cadera en las mujeres es de 1.187/100.000 habitantes en la capital y de 746/100.000 habitantes en el medio rural. Los datos estudiados por diversos autores atendiendo al registro nacional sueco de fracturas de cadera nos dicen que la edad media en el momento de producirse una fractura de cadera está cercana a los 80 años y por lo general aproximadamente la mitad viven solos. Los más jóvenes viven en sus propias casas en tanto que los más ancianos viven en residencias. En todos los grupos analizados por estos autores sobre el 80% de los fracturados vivían independientes antes de sufrir la fractura (Lüthje, 1991) (Jarnlo GB, 1992) (Jarnlo JB, 1989) (Larsson S, 1989) (Jonson B, 1992). 37 Los datos publicados sobre la incidencia de la fractura de cadera en los EEUU y su evolución histórica, nos permiten comprobar que la tasa específica de fractura de cadera en las mujeres de Rochester en el periodo de los años 1965 a 1974 se incrementó sobre un 2/100.000 habitantes/año para mujeres mayores de 80 años. Torrijos Garrido (2006) aclara que la incidencia anual ajustada a la edad, por 100.000 personas de riesgo, tiene una variación muy considerable por región y año de estudio. En la tabla 6 aparecen los datos publicados por Thorngren en 1997, sobre la incidencia de la fractura de cadera a nivel mundial, destacando la alta incidencia de la fractura de cadera en los países del norte de Europa y América, exceptuando el de Suecia en comparación con los países de la Europa del sur, los sudamericanos y Asia. Torrijos Garrido (2006) incide también en el análisis del caso concreto de Hong-Kong, donde debido a la rápida industrialización y urbanización a la que fue sometida en las tres décadas anteriores, aparece durante el periodo comprendido entre 1965 y 1985 a un importante cambio en el patrón de incidencia de la fractura de cadera en el sentido de igualarse al de los países desarrollado, observándose además semejante evolución en Singapur y Japón. PAIS AÑO Noruega (Oslo) INCIDENCIA EN INCIDENCIA EN RELACIÓN MUJERES HOMBRES MUJER/HOMBRE 19 45 2,6 74 4 36 2 71 7 30 2,4 19 7 26 2 13 2 19 9 54 6 17 3 EE.UU. 88-89 19 4 53 6 18 2,8 Escocia 88-89 19 5 51 6 17 3 Italia 88-89 19 8 25 0 71 3,5 Portugal 88 19 1 14 5 56 3 Venezuela 91-93 19 4 94 44 2 Chile 88-89 19 53 27 2 Johannesburgo 88-89 19 26 38 N. Zelanda 50-64 19 Singapur 73-76 19 Hong-Kong 55-62 Noruega 88-89 (Rural) Canadá 88-89 (Quebec) Suecia 1.1 19 87 19 6 92 Suiza 87-88 91-93 10 7 19 19 75 2 10 14 0 56 3 4 Tabla 6.- Incidencia de la fractura de cadera a nivel mundial, expresada en casos por 100.000 habitantes. Fuente Torrijos, 2006. Particular interés tiene la comparación de los datos noruegos en urbano y rural. En todas las series a las que se ha hecho referencia se confirma la existencia de una relación mujeres/hombres de al menos 2/1. En Portugal e Italia se alcanza un ratio mayor 3/1 (Torrijos Garrido, 2006). En Extremadura y más concretamente en Cáceres según Pedrera et al., (2004) la relación es de 3,2/1 mujer/hombre. 38 En España (J D. Pedrera Zamorano, 2004), publicó sus resultados en la provincia de Cáceres, en la que se ha producido un incremento sobre la incidencia de la fractura de cadera, al igual que en diversos países europeos. No se ha observado en los EE.UU., este aumento, como sí se observó entre los años 1930 y 1950. La razón de este retraso en la detección de esta variación en Europa no se ha clarificado hasta la fecha pero sería posible explicarlo si atendemos a factores como el estilo de vida que por determinantes genéticos y/o ambientales (Thorngren, 1997) En España la incidencia de la fractura de cadera oscila entre 221 y 568 / 100.000 habitantes según zona (Serra et al., 2002). Se ha duplicado en las dos últimas décadas su incidencia en la vejez por el aumento de la supervivencia. En 2002 se llego a una cifra de 60.000 según aparece en el estudio Acta de Fracturas Osteoporóticas Españolas (A.F.O.E.) realizado por la Sociedad Española de Cirugía Ortopédica y Traumatología (SECOT) (Herrera et al., 2006). En este número pertenecen a personas de más de 65 años el 91 % de los casos, duplicándose la incidencia a partir de los 85 años con respecto al grupo de edad previo, de 75 a 85 años. Con las expectativas de vida actuales el riesgo de sufrir una fractura de cadera a lo largo de la vida es del 15%-17% en la mujer y del 5%-6% en el hombre, pero está estimado que los que superen estas expectativas de vida y vivan 90 años pueden sufrir una fractura de cadera el 33% de las mujeres y el 17% de los hombres, por el aumento exponencial de estas fracturas a partir de los 50 años (Hernández et al., 2006). En la tabla 6 expresamos los datos de la epidemiología de la fractura de cadera en España, más actuales. Están basados en registros de incidencia de fracturas de cadera de los años 1996 a 1999 del pasado siglo (Serra et al., 2002; Herrera et al., 2006; Hernández et al., 2006). Según la citada tabla, en España, la incidencia de la fractura de cadera se encuentra en cifras similares a los países más desarrollados europeos y menor que en EE.UU. y Noruega pero más altas que las sudamericanas, ASIA y resto de países del sur de Europa. Resalta la muy alta proporción de mujeres/hombres, tanto que es la mayor de todas junto a Italia. También podemos observar el aumento epidemiológico del sur con respecto al norte del país, donde se da la mayor incidencia de fractura de cadera correspondiéndose además con la proporción mujer/hombre más elevada (Torrijos, 2006). 39 COMUNIDAD INCIDENCIA TOTAL INCIDENCIA MUJERES INCIDENCIA HOMBRES RELACION M/H CANARIAS 221 288 136 2,1 BALEARES 430 529 292 1,8 CATALUÑA 654 868 363 2,4 GALICIA 382 511 194 2,6 MADRID 492 652 250 2,6 NAVARRA 601 858 254 3,4 LA RIOJA 582 816 271 3 ANDALUCÍA 531 709 282 2,5 EXTREMADURA 460 633 223 2,8 ARAGÓN 568 793 275 2,9 418 569 220 2,6 CASTILLA Y LEON Tabla 7.- Epidemiología de la fractura de cadera en España. Incidencia expresada en 100.000 habitantes. Fuente Torrijos, 2006. Predicción de la fractura de cadera. La herencia por sí sola no tiene valor predictivo (Gärdsell et al., 1989). Sin embargo el haber padecido una fractura de muñeca precoz en la etapa pre menopáusica o bien una fractura vertebral antes de los 70 años es un claro factor predictivo. Cummings en 1995 (Cummings et al.1995) realizó un estudio multivariante prospectivo sirvió para identificar una serie de factores que clásicamente se asociaban a la predicción de la fractura de cadera y que actualmente están cambiando sobre todo porque la densidad ósea y la masa ya no se consideran asociadas. Los estudios de este autor muestran que la incidencia de fractura de cadera en una mujer expuesta a dos de estos factores reseñados y valores de densidad ósea normales para su edad es de 1.1 por 1000 habitantes y año cuando presentan 5 o más factores de riesgo y con valores de densidad ósea inferiores al 33% para su edad. 40 FACTORES ASOCIADOS A LA PREDISPOSICIÓN A UNA FRACTURA DE CADERA Bajo peso corporal que está en relación con la baja masa ósea Fractura distal de radio precoz al tiempo de la menopausia Fractura vertebral p fractura de cadera trocantérea antes de los 70 años Historia maternal de fractura de cadera lo que dobla el riesgo (RR 2,0), que ajustado a densidad ósea resulta significativo Haber aumentado de peso a partir de los 25 años de edad protege de sufrir fractura de cadera Historia de hipertiroidismo previo Fracturas previas de cualquier tipo después de los 50 años Talla alta Estimar su propia salud como regular o mala Haber estado en tratamiento con benzodiacepinas o anticonvulsivantes durante un largo periodo de tiempo Ingesta excesiva de cafeína Incapacidad de levantarse de la silla sin utilizar los brazos para ayudarse Baja propiocepción Baja sensibilidad discriminativa Taquicardia en reposo Baja densidad ósea en calcáneo como factor de riesgo independiente Tabla 8.- Factores clásicamente asociados a la predisposición a la fractura de cadera. Fuente Sotorres, 2005. Hay 2 grandes factores que contribuyen en la alta incidencia de fracturas de cadera en las personas mayores: la osteoporosis y las caídas a pie plano. La caída es el factor causal más importante de la fractura de cadera. El riesgo de caída va en aumento con la edad, influido por una gran multitud de factores, entre los cuales podemos destacar los cambios neuromusculares asociados con la edad, el deterioro general, la toma de ansiolíticos o psicótropos que pueden disminuir el estado de alerta de la persona, las enfermedades neurológicas que afectan al aparato locomotor (enfermedad de Parkinson, enfermedades cerebrovasculares), la pérdida de agudeza visual (cataratas, presbicia, degeneración macular asociada a la edad) o los estados confusionales (demencia senil), entre otros. Hay que destacar también que, además del incremento en el riesgo de caída, también se produce una disminución de los mecanismos de defensa frente a las caídas, como las maniobras para disminuir la energía del impacto (mediante la extensión del brazo para apoyarse y evitar el golpe directo), que se vuelven más lentas o incluso inadecuadas (Zuckerman, 1996) (García Ramiro, 1994) (Pérez-Ochagavía F, 2003). 41 Principales patologías relacionadas con las caídas en e l anciano Causas Arritmias, Ortostatismo, Hipotensión e sencial, Miocardiopatías Cardiovasculares Infarto, Disfunción de marcapasos Causas Neurológicas Accidente V ascular Cerebral, Epilepsia, Alteraciones de l a marcha, Parkinson, miopatías, mielopatías, alteraciones cognitivas, cuadros confusionales. Causas Osteoarticulares Osteoporosis, Osteoartrosis, alteraciones de l os pies Causas Audiovisuales Deterioro subclínico vestibular, visual y de l a propiocepción, infecciones, traumas Otras Hipoglicemias, anemias, i nfecciones, i ntoxicaciones, e ndocrinos, psigógeno, síncopes neurovegetativos, fármacos Tabla 9.- Principales Patologías relacionadas con las caídas en el anciano. En cuanto a la osteoporosis, tradicionalmente se entendía como la disminución de la masa ósea por unidad de volumen, sin tener en cuenta otros factores, como la arquitectura ósea. Ahora se define la osteoporosis como una enfermedad ósea sistémica caracterizada por una masa ósea disminuida en función de la edad y el sexo del individuo, con alteración de la microarquitectura de los huesos, lo que confiere un aumento de la fragilidad ósea y una mayor facilidad para la aparición de fracturas. Hay que tener en cuenta que, además de la osteoporosis, otras muchas causas también pueden debilitar el hueso de la persona anciana, entre las cuales podemos mencionar ciertos medicamentos, como los corticoides o la tiroxina, que tienen efecto sobre el metabolismo fósforo-calcio, la falta de ejercicio, o el déficit de calcio y vitamina (Conference, 1993) (Díez A, 1989). Se podría establecer el "retrato robot" del sujeto con riesgo de fractura de cadera diciendo que se corresponde con el de: "Mujer de raza blanca, mayor de 70 años, delgada, de vida sedentaria, con tendencia a caídas repetitivas, que padece de enfermedad o enfermedades crónicas, sometida a medicaciones del tipo de los sedantes, antidepresivos, hipotensores, etc., con antecedentes familiares de osteoporosis y fracturas de esta región, que ha sido o es fumadora o bebedora y habituada a una alimentación rica en proteínas". (Sociedad Española de Cirugía Ortopédica y Traumatología) 42 1.5.- Las caídas. Las caídas se reconocen como un grave problema de salud, dada su relación causal con la producción de fracturas u otras lesiones que ocasionan una importante morbimortalidad. En los países desarrollados se ha prestado especial atención a las caídas que acontecen en las instituciones, ya sean hospitales, residencias de ancianos, etc. En nuestro país no existen iniciativas que persigan la disminución de la incidencia de las caídas en los ancianos y, por tanto, de sus consecuencias. Ilustración 1.- Consecuencias de las caídas. Fuente: Díaz Álvarez A. 2008 El establecimiento de medidas preventivas es un factor fundamental y debería ser objeto de atención de las autoridades sanitarias. Baste recordar la espiral o escalera de las caídas que se presenta en la ilustración 5. La existencia de una caída puede condicionar de forma importante la actividad del anciano. Históricamente se ha culpado siempre al paciente como causante de su propia caída. La mitología popular atribuye las caídas a la negligencia individual o al proceso de envejecimiento. Se consideran así las caídas como un fenómeno normal del anciano, de su situación clínica o personal. Se llegan a considerar, pues, como inevitables. En contra de esta creencia la mayor parte de las caídas no “ocurren simplemente”, no son episodios inevitables. La mayor parte pueden predecirse y, de alguna manera, evitarse o reducirse. Es preciso introducir el concepto de factor extrínseco, como elemento condicionante, pero que hoy en día puede ser modificado, con la finalidad de realizar una labor preventiva. Y de entre los elementos que pueden favorecer las caídas de nuestro mayores y que pueden ser de alguna forma corregidos, podemos citar: 43 a. Entorno físico: tiene una gran importancia y gran parte de las medidas que se emplean en la prevención de las caídas van dirigidas sobre estos factores, a que son fácilmente modificables. Así, tenemos el tipo de iluminación y de superficie (alfombras, suelos deslizantes, etc.). También, la presencia de obstáculos y barreras físicas que dificultan la movilidad de los ancianos y favorecen las caídas (escalones, cables). b. Ayudas técnicas, cada vez más empleadas: deben de ajustarse a cada necesidad. Así las camas, tanto en lo que se refiere a su altura como a la existencia de barandillas, firmeza, etc. Barras de sujeción para incorporarse. Bastones y muletas que deben de tener una altura adecuada y un punto de apoyo antideslizante. c. Vestido y calzado: se deben de evitar el calzado suelto e inestable, como las zapatillas con cuña y sin contrafuerte. También son peligrosas las batas largas que pueden pisarse favoreciendo la caída. Como es evidente, gran parte de estos factores son susceptibles de ser modificados con el objeto de disminuir el número de caídas y, por tanto, de fracturas. Entre otras, se han propuesto de forma general las siguientes medidas: • Control médico y ajuste de los tratamientos farmacológicos. • Realización de ejercicio físico y entrenamiento. • Educación sanitaria. • Modificación del ambiente, con supresión de obstáculos y facilitación de ayudas técnicas. 44 II.- LOS COSTES SANITARIOS. LOS SISTEMAS DE EVALUACIÓN.- 45 46 II.- LOS COSTES SANITARIOS. LOS SISTEMAS DE EVALUACIÓN. La presión por saber en qué se están empleando los recursos y qué resultados medidos en productos o servicios se obtienen de ellos, está adquiriendo una importancia cada vez mayor en el ámbito de las instituciones públicas. Siendo este un tiempo especialmente delicado en lo referente a la toma de decisiones de tipo social en lo referente a la sostenibilidad de nuestro sistema sanitario. Actualmente una de las grandes tareas encomendadas a los gestores sanitarios es la definición del nivel de gasto en atención y servicios sanitarios, a tenor del volumen de los recursos implicados. Elecciones básicas, en el ámbito de la sanidad y la salud como la eficiencia en la asignación de recursos, la selección de las tecnologías más efectivas y la distribución equitativa del "producto" de las organizaciones sanitarias, son hoy motivo de discusión y planificación en el área estratégica del futuro de nuestro sistema de salud. Se ha producido una modernización de la cultura gestora, organizativa y administrativa en los centros asistenciales orientando estos hacia una organización de servicios caracterizada como "entidad no lucrativa", cuyo objetivo fundamental es suministrar servicios que incrementen la calidad de vida de los ciudadanos. La financiación puede provenir total o parcialmente de fondos públicos, pero es importante que se apliquen técnicas de dirección y gestión económica que, con la adecuada adaptación, mejoren la rentabilidad y el control de la gestión. Estudiemos primero el producto básico de un hospital: la salud. Al hospital acuden los pacientes en busca de una mejora en su salud (o de un alivio en su dolor). Entendemos que el objetivo primordial del hospital es la mejora, no el mantenimiento, de la salud. Así, desde el punto de vista del paciente, un hospital es una empresa que produce y vende salud. La Figura 1 ilustra el proceso productivo de un hospital desde el punto de vista del paciente: El diseño de un concepto de salud, como categoría analizable por la economía, supone un auténtico desafío y para ello, es importante la información relativa a los costes de los recursos y las causas por la que son utilizados, así como los mecanismos de asignación de los fondos de financiación. En los últimos años en los hospitales públicos ha cambiado la idea de que conocer los costes suponía un lujo bastante inútil y está totalmente asumido el hecho de que disponer de una contabilidad de gestión flexible ayuda a maximizar la eficiencia de la gestión interna y obtener el máximo rendimiento de los recursos económicos asignados en un entorno de restricción presupuestaria permanente. 47 Una buena contabilidad analítica permite a estos centros detectar ineficiencias y puntos de ahorro que les permite optimizar la asignación de los recursos y mejorar los resultados, dentro del margen que les permite el contrato con el servicio público de salud. Disponer de una contabilidad analítica también puede permitir al centro hospitalario aplicar políticas de gestión como la corresponsabilización de presupuestos, dirección por objetivos, etc. Resulta, por tanto, interesante analizar la utilidad de disponer de información sobre los costes en dichos centros y la situación real de aquéllos que ya disponen de este tipo de información. 2.1.- Sistemas de Información. Para la dirección y planificación en cualquier tipo de empresa y, por tanto, constituyen un elemento básico en la elaboración de planes y estrategias sanitarias, así como en su evaluación, los sistemas de información son imprescindibles. La arquitectura informativa es un elemento estratégico que condiciona el alcance real de los procesos de gestión. Debe basarse en la utilización de las tecnologías de la información y de la comunicación, destacando las siguientes orientaciones: 1. Hacia los ciudadanos, implantación de sistemas e-health, integrando el portal de los ciudadanos. 2. Hacia los pacientes: Historia Clínica Electrónica Digital, integrada con los procesos clínicos y al alcance de todos. Como ejemplo citar el programa Sanidad en Línea del Ministerio de Sanidad, en colaboración con INGESA. (MSSSI, 2015) 3. Hacia los profesionales, a través del modelo de gestión por competencias, implantación de estaciones de trabajo médico y de enfermería, establecimiento de protocolos y guías de práctica clínica con ayudas on-line al diagnóstico y prescripción. 4. Hacia la garantía de calidad en el servicio, mediante el diseño e implantación de planes de calidad total en los servicios asistenciales. Citar la Q de Calidad, de la Fundación AdQuialitatem (Fundación Ad Qualitatem, 2015). 48 5. Hacia los sistemas de gestión económico-financiera, promoviendo su integración con la producción asistencial, de forma que permita identificar los costes de las actividades que integran los procesos clínicos y de facturación de ingresos imprescindibles para evaluar la eficiencia de los centros. Finalmente, el sistema debería permitir la implantación del Cuadro de Mando Integral. (MONGE LOZANO, 2002). Donde incluimos el sistema JARA del Servicio Extremeño de Salud. Para conseguir los fines implícitos en las orientaciones anteriores, el sistema de información contable no debe ser considerado un sistema aislado, sino que debe recibir información de los módulos asistenciales para poder valorar los tratamientos aplicados, tal y como se muestra en la Figura 5. Figura 5.- Sistema de gestión integral información hospitalaria Fuente: (Ernesto Bataller Alonso, 2012) Entre los objetivos principales de los sistemas de información clínico-económicos podemos señalar los siguientes: 1. La optimización de los procesos asistenciales. 2. El acceso a información fiable, precisa y compartida entre los profesionales clínicos y de la gestión económica. 3. La eliminación de duplicidad de datos y operaciones innecesarias. 4. La reducción de tiempos y de costes de las fases de los procesos asistenciales. 5. La medición de la actividad (Performance Management). 49 El objetivo principal de cualquier sistema de información es valorar los recursos consumidos en los procesos de producción sanitaria en el sector hospitalario, y posibilitar el cálculo de los instrumentos y medidas típicas utilizadas relacionadas con actividad intermedia (por ejemplo, las unidades relativas de valor) como en la identificación del producto final hospitalario (por ejemplo, los grupos de diagnostico relacionado). Como hemos mencionado, la contabilidad de costes no sólo se abastece de la información económica sino también de la información asistencial de servicios/unidades, productos intermedios y finales, case-mix o patologías asistidas (Monge Lozano, 2004). Un objetivo del análisis económico es comparar los logros y, en general, la variables económicas entre distintas entidades. De la coexistencia de distintos modelos de costes en el ámbito hospitalario español, se deriva el problema de la falta de comparabilidad (GONZÁLEZ SÁNCHEZ, 2006). Por ello, sería muy conveniente la homogeneización a nivel nacional de los modelos de costes empleados, ya que existen diferencias importantes en los criterios utilizados para la asignación de costes, la configuración de las fases de distribución y la medición de la producción intermedia y final, entre las diferentes Comunidades Autónomas. Otro de los factores de consenso que deben fijarse en cualquier organización es el “producto final” de actividad hospitalaria con el fin de que la contabilidad de costes establezca el “portador final de los costes” (coste por paciente, coste por diagnóstico). En muchas ocasiones, esta falta de definición o la insuficiencia del sistema de información hacen que simplemente se elaboren costes de productos intermedios. En la actualidad, y en el marco del territorio nacional, coexisten distintos modelos de costes de aplicación a los hospitales. El nivel de desarrollo de esos modelos varía mucho dependiendo del impulso dado desde las comunidades autónomas e incluso dependiendo del interés del propio hospital por disponer de información de costes. En todo caso, no existe una dilatada tradición en el cálculo de costes en instituciones sanitarias, y su aplicación no es uniforme en los hospitales del Sistema Nacional de Salud. Esto es lógico si se entienden los fundamentos y se analizan los antecedentes de la organización de la sanidad de ámbito público. La contabilidad de costes en hospitales ha experimentado una evolución muy intensa en los últimos años, sobre todo en el terreno de la hospitalización en donde el desarrollo de los sistemas basados en las características y situación de los pacientes (sistemas case mix) permiten un mejor conocimiento del producto hospitalario (De Falguera Martínez-Alarcón, 2002; García Cornejo, 2004; Monge Lozano, 2003). 50 La implantación de estos modelos de coste en los hospitales públicos no ha sido generalizada seguramente por las dificultades que supone su aplicación y las limitaciones de que adolecen dichos modelos. Entre estas limitaciones podríamos destacar las siguientes: 1. Estos sistemas de asignación de costes no estiman con suficiente fiabilidad los costes reales del hospital. La investigación realizada en España demuestra que con los GRD, utilizados por estos modelos, el nivel de ajuste al coste real solamente asciende hasta el 40%. La asignación se basa en un reparto de costes indirectos a los procesos asistenciales, y los criterios utilizados para la imputación de costes a los procesos siguen sin reflejar las decisiones clínicas efectivamente tomadas en cada hospital, aunque se utilicen pesos españoles. 2. En el proceso de imputación de los costes de los centros de coste determinados al coste de los productos, tratamientos o procesos suelen utilizarse cálculos medios que no reflejan la variabilidad que conlleva el cuidado individualizado y diferenciado de cada paciente. Adicionalmente, la obtención de un coste medio por proceso no aporta el grado de desagregación necesario para poder gestionar y optimizar dicho proceso asistencial. 3. La estructura de asignación de costes para llegar al coste por proceso se basa esencialmente en la asignación de costes de factores de producción (por ejemplo costes de personal). Los factores de producción son difícilmente gestionables per se en los hospitales públicos, por lo cual este sistema resulta muy poco útil para la gestión pública, puesto que en buena medida pueden tipificarse como fijos. La gestión de los hospitales públicos es más una gestión de la actividad y rendimiento de los factores. 4. La utilización de criterios externos al hospital para el reparto de costes entre los procesos (pesos GRD), además de erróneo como ya se ha indicado, resulta poco convincente, particularmente para los responsables asistenciales y clínicos hospitalarios. Con los sistemas de costes tradicionales los clínicos no pueden observar con claridad cuál es la cadena de decisión que origina el coste de cada proceso asistencial, cuál es su capacidad de incidencia y cómo medir en el tiempo el resultado en costes que pueden significar cambios en sus decisiones asistenciales. 5. Los sistemas de coste actuales sólo son capaces de asignar costes de aquellos procesos asistenciales para los que se dispone de una escala de asignación (procesos GRD/RUGII). Esto deja fuera de la estimación de costes una buena parte de la actividad hospitalaria, además creciente teniendo en cuenta la evolución de los hospitales, como es la actividad de consulta externa, formación e investigación, hospitalización no convencional, servicios de apoyo a atención primaria y exteriores sin hospitalización, etc. 51 Finalmente, el modelo no distingue entre los costes de procesos que, aun perteneciendo a un mismo tipo diagnóstico, constituyen procesos asistenciales bien diferentes: pacientes urgentes o programados, ambulatorios o con hospitalización. En este escenario, de falta de homogeneización en la estimación de los costes y falta de precisión en los sistemas actuales de contabilidad analítica empleados en los centros sanitarios, junto a las escasas posibilidades de actuación de los responsables sanitarios sobre los centros o servicios que no gestionan adecuadamente sus recursos En los últimos años los centros sanitarios están percibiendo una serie de cambios como consecuencia de la evolución de la sociedad. La mejora en las tecnologías, el desarrollo económico y el aumento en la esperanza de vida, han impulsado a que la sociedad demande más y mejores servicios sanitarios. Debido a estos factores los recursos sanitarios necesarios han incrementado y se ha puesto de manifiesto la necesidad de racionalizar los recursos limitados sin poner en peligro la calidad del producto o servicio sanitario. La financiación del gasto sanitario constituye una de las principales cuestiones a abordar por las administraciones y, en este sentido, se han realizado esfuerzos con el objetivo de racionalizar dicho gasto y mejorar la eficacia en la gestión. Por ello, es necesario disponer de sistemas eficaces y comunes de información en el Servicio Nacional de Salud (SNS), para incrementar la transparencia y la rendición de cuentas, así como ofrecer datos comparativos que permitan identificar ineficacias y áreas de mejora en todos sus ámbitos. Y en este sentido, la información sobre los costes de los hospitales tendrá un protagonismo especial ya que éstos constituyen el principal componente del gasto sanitario público. En este contexto, la contabilidad analítica (contabilidad de costes), subconjunto de la contabilidad de gestión, puede y debe desempeñar un papel esencial dentro de los hospitales públicos suministrando información rigurosa y comparable sobre los costes de los servicios hospitalarios. Los avances que la contabilidad de gestión ha experimentado en el sector sanitario han sido importantes y se han centrado en la obtención de medidas operativas de la producción que permiten mejorar el conocimiento y el control de la gestión de los centros sanitarios. 52 En los últimos tiempos, a través de grupos de trabajo constituidos a tal efecto por organismos oficiales del ámbito estatal o por las propias comunidades autónomas, se han ido implementando diferentes aportaciones que van desde la definición de los diferentes centros de coste y sus relaciones, hasta el análisis y control del coste por paciente (Falguera, J. 2002), que pretenden ofrecer un marco de referencia para intentar evaluar el coste, la eficiencia, la eficacia y la calidad del servicio sanitario. En la década de los 90 se había avanzado de forma considerable en el proceso de implantación y normalización de contabilidad analítica en los hospitales del SNS. Un primer paso fue el Proyecto Signo (Signo I y Signo II), desarrollado por el Ministerio de Sanidad y Consumo. Se trata de un modelo normalizado de imputación de costes por grupos homogéneos de pacientes. El proyecto Signo I, permite la imputación de costes a los servicios del hospital, en cambio Signo II realiza la imputación de costes por pacientes, cabe decir, que este último nunca se puso en práctica. Posteriormente, surgió el proyecto de Gestión Clínico-Financiera o Geclif (1998). Éste pretende no sólo la normalización e integración de la información clínicofinanciera, sino la obtención de costes por actividad asistencial Grupos Relacionados de Diagnóstico o GRD e indicadores de eficacia para la comparación entre hospitales. Si comparamos ambos modelos el Geclif y el Signo, podemos decir que el Geclif presenta algunas ventajas como la posibilidad de utilizar un subreparto matricial que muestre las interconsultas que se producen entre servicios, además permite diferenciar en cada servicio los costes de hospitalización y de consultas externas, esto nos conduce al coste por procesos. Una vez terminadas las transferencias sanitarias, el proceso de normalización en la contabilidad analítica se ha visto paralizado y los diferentes Servicios Autonómicos de Salud han puesto en marcha acciones de distinto calado y extensión en el establecimiento de sus propios sistemas de información, al igual que lo hicieron las Comunidades que gestionaban su sanidad antes de 2002. Por ejemplo, Valencia y Andalucía ya disponen de sistemas de información con datos que permiten realizar comparaciones entre sus hospitales. La heterogeneidad de los sistemas de coste y el diferente grado de desarrollo de estos sistemas de información dificulta y afecta las comparaciones entre hospitales. Resulta necesaria la implantación de una contabilidad analítica homogénea en todos los Servicios Autonómicos de Salud que facilite la realización de las comparaciones fiables entre dichos hospitales. 53 Este capítulo tiene como objetivo, para saber en qué dirección se quiere avanzar, analizar los diferentes sistemas de gestión de costes desarrollados en los hospitales públicos existentes en nuestro país. A partir de un primer análisis de algunos de los elementos utilizados por la contabilidad de gestión, se realiza a continuación, una descripción de dichos sistemas de coste y, posteriormente, se analizan sus similitudes y diferencias, así como, sus posibles ineficiencias. En aras a la mejor comprensión de los modelos de coste que se analizaran en la segunda parte del mismo, estudiaremos, en primer lugar, algunos aspectos relacionados con dichos modelos de coste. Analizaremos las diferentes clasificaciones de costes que se suelen utilizar y su impacto en el ámbito sanitario. Ofreceremos también una revisión de los diferentes centros de responsabilidad, de costes o secciones que se utilizan en los centros sanitarios. Los centros de responsabilidad, desde el punto de vista de la contabilidad de gestión, tienen como finalidad ser las unidades de producción a las que se imputarán los diferentes costes en que se vayan incurriendo. Por otra parte, analizaremos también los sistemas de coste que pueden ser utilizados por los centros sanitarios. Estos sistemas o métodos se utilizan para conocer el coste correspondiente a cada uno de los objetivos de coste diferenciados (centros de responsabilidad, actividades, productos). El sistema de coste que elige una organización depende de las características de la misma, de los objetivos del sistema y de la complejidad o sencillez que se desee. 2.3.- Clasificación de los Costes. Existen distintas clasificaciones para los costes en los centros sanitarios, que se utilizan en función del objetivo que queramos satisfacer. Cada clasificación tiene una serie de ventajas e inconvenientes que analizaremos a continuación. 1. Clasificación en función de la naturaleza del coste. De acuerdo con el Proyecto de Adaptación sectorial del Plan General de Contabilidad aprobado por el Real Decreto 1643/1990, de 20 de diciembre, a las Empresas de Asistencias Sanitaria, los costes se agruparan en siete grandes grupos: los consumos de bienes, los servicios exteriores, los tributos, el personal, los gastos financieros, las amortizaciones y las provisiones (Figura 6). 54 2. Clasificación en función de la proporción de actividad. En ésta encontramos, por un lado, los costes fijos que son los que no dependen del nivel de actividad del hospital y, por el otro, los costes variables que sí están relacionados directamente con el volumen de actividad. También encontramos unos costes llamados semivariables y semifijos. Los primeros, se denominan así porque están compuestos por un elemento fijo y otro variable, cabe decir que en la práctica es complicado separar ambos elementos. Los semifijos dependen del nivel de actividad pero no de forma proporcional, es decir, son costes que actúan como fijos mientras se muevan dentro de un intervalo pero cuando lo sobrepasan se transforman en variables (Figura 7). Clasificación de los costes según la naturaleza 1. Productos farmacéuticos 2. Material sanitario de consumo: Material de radiodiagnóstico; Catéteres, sondas, drenajes; Material de curas, suturas y apósitos; Otro material desechable; Reactivos y análogos; Antisépticos y desinfectantes; Gases medicinales; Material radioactivo; Prótesis e implantes; Otro material sanitario. A) Consumo de bienes 3. Instrumental y pequeño utillaje de uso clínico y de uso no clínico. 4. Productos alimenticios: Comestibles y bebidas; Otros productos alimenticios. 5. Vestuario, lencería y calzado. 6. Otros aprovisionamientos: Combustibles; Repuestos; materiales para reparaciones y conservación; Material de limpieza y aseo; Materiales de oficinas y diversos. 7. Servicios asistenciales prestados por profesionales: licenciados sanitarios; Técnicos sanitarios y Servicios sanitarios prestados por empresas. 8. Trabajos realizados por otras empresas: Lavandería; Limpieza; Seguridad; Restauración; Otros trabajos y servicios. 1. Investigación y desarrollo. 2. Arrendamiento y cánones. 3. Reparación y conservación. 4. Servicios de profesionales independientes. B) Servicios exteriores 5. Transportes. 6. Primas de Seguro. 7. Servicios bancarios y similares. 8. Publicidad, Propaganda y relaciones públicas. 9. Suministros: Energía eléctrica; Agua; Gas; Otros suministros. 10. Otros servicios. C) Tributos 1. Sueldos y Salarios. 2. Indemnizaciones. D) Personal 3. Seguridad Social. 4. Aportaciones a sistemas complementarios de pensiones. 5. Otros gastos sociales. E) Gastos Financieros F) Amortizaciones G) Provisiones Figura 6.- Costes según Naturaleza. Fuente: Plan Sectorial de Contabilidad para Empresas de Asistencia Sanitaria. 55 Clasificación de los costes según su variabilidad Facultativo 1. Personal Sanitarios no facultativo No sanitario Agua (semivariable) Gas (semivariable) Electricidad (semivariable) Teléfono (semivariable) Otros suministros A) Costes Fijos 2. Servicios externos Reparaciones Subcontrataciones seguridad Subcontrataciones limpieza Otras subcontrataciones Transportes Otros servicios externos 3. Gastos financieros 4. Amortizaciones 5. Provisiones Farmacia Material sanitarios 1. Consumo de bienes B) Costes Variables Prótesis Alimentos Otros consumos 2. Servicios externos Subcontrataciones comidas Subcontrataciones lavandería Figura 7.- Costes según Naturaleza. Fuente: Plan Sectorial de Contabilidad para Empresas de Asistencia Sanitaria. 3. Clasificación en función del objetivo del coste. Esta clasificación diferencia entre costes directos e indirectos. Los directos son costes que pueden ser asignados de forma inequívoca y directa al objetivo de coste, es decir, los productos o servicios finales y a los centros de responsabilidad. Por el contrario, los costes indirectos son aquellos que no pueden ser asignados directamente ya que no existe una relación específica entre el factor de coste y el producto o servicio. Debemos destacar que el concepto objetivo de coste puede ser tratado de forma muy amplia como, por ejemplo, actividades, fases del proceso, centros de coste, productos etc. 4. Clasificación para la adopción de decisiones. Para que los responsables de los centros sanitarios puedan tomar decisiones de acuerdo con los datos que proporciona la contabilidad de gestión, necesitamos tener a nuestro alcance otras clasificaciones como: ü Coste necesario y coste no necesario: El coste necesario es el que se consume de forma eficiente para obtener un producto o servicio, en cambio, el no necesario sería todo aumento de consumo por encima del necesario. 56 ü Costes controlables y costes no controlables: Los costes controlables son aquéllos sobre los cuales el responsable puede ejercer un control durante un período determinado. En cambio, los no controlables, son los costes más significativos en un centro sanitario, son costes sobre los que los responsables no pueden ejercer ningún tipo de influencia ya que no están autorizados para ello. Esta clasificación de costes es importante para el establecimiento de un sistema de control de gestión efectivo, ya que permite orientar las acciones de los responsables encaminadas a mejorar la eficiencia y eficacia del hospital. Para responsables puedan evaluar qué decisión tomar entre que los un conjunto de alternativas, es necesario conocer los costes relevantes (Horngren y Foster, 1991), es decir, el impacto de coste que se va a ver influenciado por una determinada acción. Cuando se emplean para tomar una decisión son costes orientados al futuro y pueden considerarse otras acepciones del coste como: ü Coste evitable. Es el que podemos eliminar de forma parcial o total como consecuencia de una alternativa. ü Coste desembolsable. Es aquel coste que deberemos desembolsar en un futuro. ü Coste de oportunidad. Es el coste correspondiente al beneficio al que debemos renunciar como consecuencia de una decisión. ü Coste implícito o irrelevante. Coste implícito es aquel coste en el que se incurre y no puede ser modificado a consecuencia de una decisión. Por su parte, los costes irrelevantes son aquellos que no se ven afectados por una determinada decisión. A diferencia de los costes relevantes, los irrelevantes no tendrán ninguna influencia en la toma de decisiones, por tanto nos centraremos en los primeros. 57 IDENTIFICACIÓN DE LOS CENTROS DE RESPONSABILIDAD Los centros de responsabilidad o de costes son las unidades básicas de análisis y tratamiento de la información y donde se localizarán los distintos tipos de costes. Éstos se caracterizan por estar ligados directamente a la estructura organizativa del centro sanitario, tener un responsable en cada centro de actividad y por contar con una actividad definida. Estos centros de responsabilidad también pueden adoptar otras denominaciones como: Grupos Funcionales Homogéneos (GFH), centros de actividad, centros de costes y secciones. El centro sanitario se descompone en centros de responsabilidad o de coste con el objetivo de controlar por separado la eficiencia de cada uno de ellos y de sus costes. Además, la utilización de los centros de responsabilidad permitirá una mejor imputación de los costes al producto. Debemos señalar que no todos los hospitales contarán con los mismos centros de responsabilidad ya que éstos variarán en función del tamaño y la especialidad de cada centro sanitario. Normalmente, en un hospital se diferencian diferentes centros o secciones que se pueden agrupar en (Amat y Soldevila, 1997): A. Secciones principales: Son aquellas que intervienen directamente en la obtención del producto o del servicio. B. Secciones auxiliares: Son las que dan apoyo a las principales y pueden ser de carácter general o médico. Sus costes deben revertir en las secciones principales. De acuerdo con Grenon (1981), las secciones principales proporcionan ingresos y gastos al hospital, mientras que las auxiliares no proporcionan ingresos, sólo gastos. El mencionado autor propone la siguiente diferenciación: Clasificación de centros de responsabilidad Medicina: Medicina general, pediatría y cardiología. Unidades Secciones Principales Cirugía: General, infantil, digestiva, plástica y urología. Maternidad: Ginecología, obstetricia. Unidades Móviles Unidades de Consulta Secciones Auxiliares De carácter Médico Laboratorios clínicos, radiología, reanimación. De carácter general Administración mantenimiento. general, Fuente: Grenon et al (1981) Tabla 10.- Clasificación de los Centros de Responsabilidad. 58 limpieza, lavandería, Otro enfoque para la clasificación de los centros de responsabilidad para los centros sanitarios es el que propone AECA (1997), basado en si el centro realiza una función asistencial o no. Se diferencian dos grandes grupos: los centros no asistenciales también denominados estructurales o básicos y los centros asistenciales que, a su vez, pueden dividirse en centros intermedios y centros finales. Los centros estructurales tienen como principal finalidad dar soporte al resto de centros, éstos se dividen en primarios y secundarios. Los primeros dan soporte a la estructura física del hospital pero a diferencia de los centros secundarios su actividad no está directamente relacionada con el paciente. Los centros asistenciales también se encuentran divididos en centros intermedios y finales. Los intermedios tienen como objetivo dar servicio a los finales, es decir, sirven de soporte en el proceso de diagnóstico y tratamiento. Éstos pueden realizar las funciones de los centros finales cuando la demanda de sus servicios proceda de centros ajenos al propio hospital. Durante el proceso de distribución de costes los centros intermedios transfieren sus costes a los finales. Respecto a los centros finales decir que su misión es prestar toda la asistencia que necesite el paciente. Estas unidades facturarán su actividad al exterior. Dentro de los centros finales encontramos los centros de soporte y los principales. Los de soporte son unidades de apoyo en el diagnóstico y tratamiento, pues atienden las solicitudes de sus servicios por parte de los centros principales, siendo estos últimos los responsables finales del producto de atención especializada. El cuadro siguiente muestra la clasificación de los centros de responsabilidad según la Asociación Española de Contabilidad y Administración de Empresas (AECA). Clasificación de los centros de responsabilidad Asistenciales Finales No asistenciales Intermedios Primarios Secundarios Urgencias Laboratorios Mantenimiento Admisión Consultas Externas Ambulatorios Quirófanos Tratamientos Conserjerçia Suministros Cocina Lavanderçia Hospital de días Bioquímica Dirección Limpieza Neurocirugía Hematología Personal Seguridad Medicina interna Microbiología Contabilidad Información Cardiología Paritorios Compras … Digestivo Inmunología Biblioteca Neumología Genética Informática Reumatología Radiodiagnóstico … Oncología Anestesia Hemodiálisis Farmacología Dermatología Hospitalización Cirugía Rehabilitación Oftalmología … Urología Obstetricia … Fuente: AECA (1997) Tabla 11.- Clasificación de los Centros de Responsabilidad. AECA 59 Otra clasificación de los centros de coste es la que proponen autores como Fetter y Freeman en un proyecto realizado en 1991, conjuntamente con el Health Systems Managment Group en la Facultad de Organización y dirección de Yale y el United Healt Services en Bringhamton de New York (1991). El objetivo que persiguen los autores es aportar un instrumento para repartir los costes generales sobre la base de los pacientes, teniendo en cuenta que su concepto de producto final del hospital (GRD) lleva a configurar líneas de productos, puesto que el producto final unitario sería el paciente tratado. Diferencian cinco tipos de centros de coste que presentamos en la siguiente tabla: Centros de Servicios generales Centros de Servicios centrales Amortización Lavandería Limpieza Farmacia Compras … Reanimación Anestesia Radilogía Laboratorio … Centros de Servicios directos de enfermería y generales hoteleros Admisiones Caja … Otros centros de coste Urgencias Tienda Varios … Centros que no pertenecen a la hospitalización Los que contienen los gastos del ambulatorio Tabla 12.- Clasificación de los centros de responsabilidad o de coste (Fetter y Freeman). Fuente: Basado en Fetter y Freeman (1991) Los centros de coste propuestos son denominados, por un lado, Centros de Coste Iniciales (CCI), ya que cada uno soporta una parte del coste procedente de la contabilidad general y por el otro, Centros de Costes Finales (CCF) porque ofrecen de forma directa sus servicios a los pacientes individuales a excepción de los Servicios generales. El tratamiento de los costes mediante el modelo Yale se plasma en la siguiente figura: Figura 8.- Tratamiento de los costes según el modelo de Yale. Los costes que provienen de la contabilidad financiera se imputan a los distintos CCI, seguidamente se procede al reparto de los costes de los servicios generales a los centros finales. Este proceso se realiza mediante estadísticas de reparto que muestran la cantidad relativa de costes generales que se pueden cargar a cada uno de los centros de coste final. A través de la figura, observamos que se determina el CCF y por último, los costes de hospitalización se imputan a los pacientes de cada GRD a través de la información sobre el uso de los recursos de los servicios prestados al paciente. 60 Ambos autores ponen de manifiesto que el uso de este método requiere tener a nuestro alcance información sobre servicios prestados al cliente, datos de alta de pacientes (fecha de nacimiento, sexo, fechas de admisión, diagnósticos, operaciones, asignación del GRD y el cálculo de la duración de la estancia), información financiera y estadísticas de reparto de costes generales. 2.3.- Determinación del Coste Hospitalario. En los centros sanitarios y en función de la definición que se realice del producto hospitalario se pueden diferenciar dos tipos de sistemas de tratamiento de la información analítica (Guadalajara, 1994). Si tomamos como punto de referencia la medida tradicional del producto hospitalario (consultas, estancias y urgencias) el método utilizado para el reparto de los costes entre los centros de responsabilidad, será el sistema de costes totales por secciones. Este sistema imputa a cada uno de los productos o servicios tanto los costes directos como indirectos a través de los centros de responsabilidad. A partir de este sistema obtenemos el coste total de un producto o servicio, sumando los costes de las materias primas y los costes de cada fase de la elaboración del producto o servicio. Este sistema tiene el inconveniente que debemos encontrar herramientas que nos permitan realizar un reparto fiable de los costes indirectos. Si nos centramos en el proceso de reparto de los costes, diremos que los costes directos se imputarán de acuerdo con las relaciones de causalidad. Por ejemplo, los costes de personal se reparten en función del número de trabajadores de cada centro de actividad. Y los indirectos se distribuirán a partir de claves de distribución. Por ejemplo, los alquileres se reparten en función de los metros cuadrados que ocupa cada centro. El proceso de imputación de costes se puede resumir en las dos etapas: El reparto primario que consiste en asignar los costes a los centros de responsabilidad. Existen dos tipos de costes como ya hemos comentado anteriormente, los directos que se distribuirán en función de su naturaleza y los indirectos que se repartirán teniendo en cuenta una serie de unidades de distribución que comentaremos más adelante. El reparto secundario mediante el cual se pretende imputar todos los costes a los centros asistenciales finales mediante subrepartos en cascada. 61 A su vez el reparto secundario requiere de una serie de fases sucesivas que se analizan a continuación: La primera, pretende el reparto de los costes de los centros no asistenciales primarios a los no asistenciales secundarios, asistenciales intermedios y asistenciales finales, en función de la dedicación real de cada centro a los demás. Las unidades de obra más utilizadas en esta fase son las recogidas en el cuadro siguiente. Ejemplos de unidades de obra para centros no asistenciales primarios Centros de Responsabilidad Unidad de Obra Mantenimiento Horas e trabajo personal de mantenimiento de cada centro Gerencia Número de empleados o coste de personal asignado Administración Personal Informática Número de ordenadores o terminales instalados Compras Consumo de bienes y servicios Tabla 13.- Unidads de obra para centros no asistenciales. Fuente: AECA La segunda, consiste en el reparto de los costes de los centros no asistenciales secundarios a los centros asistenciales. Para ello en los centros que sea posible se debe definir la unidad de obra, que es la medida de actividad de cada centro. En la tabla 13 podemos observar algunos ejemplos de unidades de obra para los centros estructurales secundarios: Ejemplos de Unidades de Obra para centros estructurales secundarios Centro de Responsabilidad Unidad de Obra Admisión Número de Ingresos Archivo de Historias Clínicas Número de Historias en circulación Comedor Número de comidas Limpieza Metros Cuadrados Lavandería Kilogramos de ropa lavada Farmacia Consumo Farmacia Esterilización Número de Intervenciones Fuente: AECA Tabla 14.- Unidades de Obra para centros estructurales secundarios. AECA Una vez seleccionadas las unidades de obra, al dividir los costes totales de cada centro entre las unidades de obra obtenidas en el período, obtenemos el coste de cada unidad de obra. La Tercera, trata de trasladar los costes de los centros intermedios a los finales. 62 En el siguiente cuadro se muestran las unidades de obra más utilizadas en esta fase. Ejemplos de Unidades de Obra para centros intermedios Centro de Responsabilidad Anestesia Unidad de obra Tiempo de utilización de quirófanos Quirófanos Paritorios Número de partos Unidades de Hospitalización Número de estancias Unidades de Consultas Externas Número de consultas externas Unidades de Urgencias Número de urgencias Rehabilitación Número de sesiones Fuente: AECA Tabla 15.- Unidades de Obra para centros intermedios. En algunos casos resulta complicado determinar la unidad de obra apropiada como sería el caso de un laboratorio donde se realizan multitud de tipos de análisis diferentes entre sí. En estos casos deberían utilizarse las Unidades Equivalentes o UBAS (unidades básicas de asistencia). Estas unidades son coeficientes de ponderación aplicados a diversos parámetros de la producción asistencial. 2.4.- Sistemas de Costes en los Centros Hospitalarios. Para poder obtener el coste por paciente hemos visto que debemos distribuir los costes del centro sanitario entre los distintos centros de responsabilidad. El coste por paciente que es uno de los objetivos de la contabilidad de gestión lo calculamos a partir de la suma de los costes de los recursos que ha consumido durante su estancia en el centro. Para su cálculo necesitaremos unos sistemas de costes que ayuden a planificar y controlar la organización, además de facilitar el cálculo de los costes de los productos o servicios (AECA 1994). El sistema de costes que seleccione una organización dependerá de las características de ésta, de los objetivos del sistema y de la complejidad o sencillez que pretenda. Éstos se diferencian por aplicar distintas clasificaciones y mecanismos a la hora de imputar los costes a los objetivos de costes. Seguidamente, analizamos algunos de los sistemas de costes utilizados en los centros sanitarios. 1) El Sistema de costes completos, suele imputar directa o indirectamente todos los costes a los productos que ofrece la organización. Se centra en la idea de que los costes, por el mero hecho de serlo, deben canalizarse hacia el producto o servicio a través del cálculo efectuado por la contabilidad de costes (Sáez et all, 1993). 63 Con este método se obtiene el coste total del producto o servicio mediante la agregación de los costes de cada fase de su elaboración a los que se incorpora el coste de los materiales consumidos para su obtención. En los centros sanitarios, una vez disponemos de los costes de todos los centros de responsabilidad asistenciales finales, el sistema de costes debe permitir asignar los costes a cada una de las actividades realizadas y a cada uno de los pacientes (episodios). El coste del episodio será la suma del coste de las actividades que el paciente consume durante su estancia en el centro sanitario. A partir de la suma de los costes de los distintos episodios que ha padecido un paciente, se puede obtener el coste de la historia clínica de dicho paciente. La ilustración 10 plantea el proceso seguido por este sistema para el cálculo de cada una de las actividades y episodios. Figura 9.- Proceso de cálculo para activadades y episodios. Los costes totales de cada centro de asistencia final se asignan a los episodios a través de dos procesos. El primero consiste el reparto o asignación de los coste directos a los episodios que los han consumido. El segundo consistirá en el reparto del resto de costes del centro de asistencia final a través de las unidades de obra correspondientes. 64 En los hospitales la imputación de los costes a cada uno de los procesos puede realizarse mediante la técnica Case-Mix. Esta técnica consiste en la consideración del conjunto de procesos atendidos, realizados o vendidos por el hospital y la evaluación mediante criterios de reparto pre-establecidos, de los hechos económicos internos del hospital para conocer el gasto y el ingreso de cada servicio. El coste total de un servicio se obtendrá sumando a los costes variables, directamente asignables a los productos, los costes generados por el centro que presta cada servicio. En resumen el proceso de imputación de costes constará de cinco fases: 1. Identificación de los centros de costes. 2. Reparto de los costes entre los centros o secciones a partir de la identificación de los costes directos e indirectos. 3. Realización de la distribución primaria, en esta se imputan los costes a las secciones principales y auxiliares. 4. Realización de la distribución secundaria, esta se caracteriza por imputar los costes de las secciones auxiliares a las principales. 5. Cálculo del coste de cada servicio o centro, este coste se obtiene mediante imputación de los costes de las secciones principales a cada producto o servicios siguiendo el criterio de la unidad de obra. Por otra parte, existe un grupo de métodos que se centran en la consideración del producto hospitalario como un “mix” de productos intermedios aplicados al enfermo a través del proceso clínico que culmina con el alta hospitalaria. El sistema de medición más aceptado para el case-mix es el basado en los “Grupos de Diagnóstico Relacionados” (GRD) (Fetter, 1980). La introducción de los GRD ofrece una serie de ventajas derivadas del hecho de que facilitan la planificación hospitalaria y el control de la eficiencia y eficacia. No obstante, tiene limitaciones, ya que solo es aplicable a los enfermos que permanecen ingresados en el centro hospitalario, no considerando las urgencias, ni tampoco los tratados en las consultas externas y hospital de día. Dentro de este grupo de métodos existen dos tendencias: El método “Top-Down”, que pretende calcular el coste medio por GRD y el método “Botton-up”, que pretende obtener el coste real directo por paciente. 65 2) El sistema de costes directos, para la determinación del coste del producto o servicio, sólo tiene en cuenta los costes variables (directos) que son directamente asignables al servicio correspondiente (Álvarez et al, 1999), como por ejemplo, los costes de los fármacos, prótesis o la mano de obra directa que se precisa para la prestación de un servicio. Dado que los responsables de las decisiones únicamente pueden influir sobre los costes controlables que normalmente son variables o directos, este sistema les será de gran ayuda, ya que trata la información de costes separando los costes variables y los fijos. Este sistema pretende enfocar el control en aquellos factores sobre los que el responsable tiene poder de decisión lo que facilita la aceptación del sistema. 3) El sistema de costes por actividades, denominado también Activity Based Costing (ABC) o Activity Based Managment (ABM) se basa en el principio de que es la actividad la causa que determina la incurrencia en costes (Sáez et al, 1993), y no los servicios o productos. De esta forma la gestión de costes puede realizarse con más éxito a través de la gestión de las actividades que tiene como objetivo eliminar las actividades que no añaden valor pero que consumen recursos. Se trata de establecer una relación de causalidad directa entre los costes y las actividades. El coste de un producto, según la metodología ABC, puede ser definido como la suma de los costes de las actividades para fabricar y expedir un producto (Castelló, 1994). Para identificar las actividades es necesario un profundo conocimiento del centro asistencial, sus características y procesos aplicados. Respecto a la medición de las actividades, utilizaremos los inductores de costes siendo estos los causantes de los costes o los factores de variabilidad de los costes (Blanco, 1994). Los inductores de costes no están tan relacionados con el volumen de actividad, esto puede representar una ventaja porque nos permite analizar el comportamiento de una actividad y los costes que recaen sobre ésta. El proceso de asignación de los costes del servicio en el modelo ABC consta de tres fases: Fase 1. Imputación de los costes directos al servicio y distribución de los costes indirectos entre los centros de responsabilidad, éstos se dividirán en actividades. Fase 2. Unión de los costes de las actividades homogéneas. Fase 3. Utilización de los criterios de inducción para la distribución de los costes de las actividades homogéneas a los servicios. 66 2.5.- Los Modelos de Costes en los Centros Hospitalarios de España. Tras la aprobación en 1986 de la Ley General de Sanidad (en adelante, LGS) se produce un cambio radical en la Sanidad española. La directriz sobre la que descansaba toda la reforma propuesta por la LGS era la creación de un Sistema Nacional de Salud que estuviera formado por los Servicios de Salud tanto de la Administración del Estado como de las Comunidades Autónomas (Monje 2003). En la actualidad todas ellas poseen sus propios Servicios de Salud y desde el año 2002 todas gestionan los recursos materiales, humanos y financieros de los hospitales públicos que se encuentran en su territorio. Hasta dicho año, sólo siete Comunidades Autónomas: Cataluña, Andalucía, Euskadi, Comunidad Valenciana, Galicia, Navarra y Canarias, por este orden, consiguieron gestionar directamente sus recursos y en el resto de las comunidades la gestión era asumida por el Instituto Nacional de la Salud. Otra de las innovaciones que introdujo la LGS fue que la financiación de la Sanidad, casi en su totalidad, procediera de los Presupuestos Generales del Estado y que la cobertura sanitaria pública se extendiera a toda la población. El Instituto Nacional de la Salud es el órgano que recibe el dinero procedente de los Presupuestos Generales del Estado y lo canaliza hacia cada una de las Comunidades Autónomas. No todas las comunidades reciben el mismo importe sino que el reparto se realiza en función de una serie de parámetros que vienen estipulados por Ley. Como señala Cuervo (J.I., 1998), la crisis del estado de bienestar, la de la Administración Pública, en general, como productora de servicios y la de los Sistemas Sanitarios definen los problemas de la gestión sanitaria. Si además, tenemos en cuenta que los hospitales son empresas multiproducto y multiservicio con mercados geográficamente dispersos, demandas muy variadas, explotados con alta tecnología y múltiples centros de decisión, se puede entender que cada vez más se esté tendiendo a la separación entre propiedad y gestión, siendo, por lo tanto, necesario un mayor control por parte de la Administración. Esta función es necesaria no sólo para asignar derechos de decisión sino para evaluar comportamientos y, en su caso, incentivar a los profesionales sanitarios. En este apartado nos hemos centrado en el análisis de los diversos sistemas o modelos de coste que son utilizados en los hospitales españoles y que han sido elaborados por los diversos Entes Gestores Sanitarios: Servicios de Salud de Comunidades Autónomas, Instituto Nacional de la Salud (en adelante, Insalud) y Ministerio de Sanidad y Consumo, para ser utilizados, fundamentalmente, en los hospitales gestionados por ellos dentro de su territorio de cobertura. 67 El centrarnos sólo en el sector público se debe al número reducido de programas, frente a la diversidad existente en el privado. Además dichos programas están implantados en un número de hospitales mucho mayor que el resto. A partir de una descripción de los diferentes modelos de coste, se analizan posteriormente las coincidencias y singularidades utilizadas por cada uno de ellos, así como, sus ventajas e inconvenientes. 2.5.1.- Modelo SIGNO: SIGNO I y SIGNO II (Ministerio de Sanidad y Consumo, 1990 y 1994) A principios de los años noventa el Ministerio de Sanidad y Consumo, ante la necesidad de implantar y homogeneizar la contabilidad analítica en los hospitales del Servicio Nacional de la Salud, realiza su aportación mediante el desarrollo del Proyecto Signo. Su principal finalidad era establecer un modelo normalizado de imputación de costes por grupos homogéneos de pacientes que permitiese evaluar la eficiencia, eficacia y calidad de los servicios prestados en los centros sanitarios. El Proyecto Signo se caracteriza por ser un modelo de costes completos y reales, con un sistema de costes en “cascada” donde los centros de coste llamados Grupo Funcionales Homogéneos (GFH’s) coinciden con los servicios existentes en un hospital. Estos servicios se clasifican en función de los servicios que prestan, en estructurales, intermedios y finales. Debemos mencionar que el auge del Proyecto Signo se desmoronó dando lugar en 1998 a un nuevo modelo cuyo objetivo era renovar la contabilidad analítica de los hospitales. Éste se denominó Gestión Clínico-Financiera o Geclif. El nuevo modelo permite que el programa informático diferencie los costes de hospitalización y de consultas externas en cada servicio, esto facilita el camino hacia la obtención de los costes por proceso, en cambio, el Signo sólo determina el coste por servicio. Además, el Geclif obtiene indicadores clínico-financieros que miden la gestión asistencial y su sistema de subreparto matricial permite conocer las interconsultas realizadas entre servicios. Este modelo de imputación de costes tiene dos versiones, la primera se denomina Signo I (Ministerio de Sanidad y Consumo, 1990), se inicia en el mes de Marzo del año 1990 a través de un grupo de trabajo formado por una serie de profesionales cuya responsabilidad era la gerencia de cinco hospitales del Sistema Nacional de la Salud, pero hasta el año 1992 no comienza su andadura. 68 Este modelo se limitaba a la imputación de costes a los servicios hospitalarios, en cambio la segunda versión, Signo II (Ministerio de Sanidad y Consumo, 1994), permitía la imputación del coste por paciente o por proceso de tal forma que por agregación se consigue el coste por Grupos Relacionados con el Diagnóstico (GRD). Cabe decir, que esta última versión nunca se llegó a poner en práctica. El modelo Signo I, establece que para obtener la estructura de costes del hospital, se deben cumplir una serie de requisitos: El primero, consiste en definir los centros de coste del organigrama del centro hospitalario. La unidad mínima de gestión denominada Grupo Funcional Homogéneo (GFH) realizará la misma actividad y su responsabilidad estará definida, además presentará un único responsable y se ubicará en un lugar físico. El segundo requisito, se concreta en identificar el proceso asistencial clasificando los Grupos Funcionales Homogéneos en estructurales, intermedios y finales. El cuadro siguiente muestra la estructura mínima de un centro hospitalario, en el se detallan algunas de las actividades relacionadas con cada uno de los GFH. Estructura Mínima Hospitalaria. Áreas Funcionales Estructurales Intermedios Finales Destino Administración Bloque quirúrgico Cirugía Paciente Dirección Consultas Externas Medicina Interna Atención Primaria Medicina Preventiva Farmacia Pediatría Centros ajenos Hospitalización Urgencias Laboratorios … Radiodiagnóstico … Fuente: Ministerio de Sanidad y Consumo (1994) Tabla 16.- Estructura Mínima Hospitalaria. Los GFHs estructurales e intermedios tienen la función de dar soporte a los centros finales. No obstante, los estructurales se caracterizan por tener unos costes que se producen con independencia de la actividad, y por tanto, ni es posible ni interesante facturar dichos costes, mientras que los intermedios (Laboratorios, Radiología, Farmacia..) facturarán sus costes a los finales. Finalmente, el cuadro anterior, define como “destino”, el objetivo de la actividad principal. 69 El tercer y último requisito, pretende normalizar la estructura hospitalaria para que sea posible la comparación entre hospitales diferenciando tres niveles: Primer nivel: Grupos Funcionales Homogéneos (GFHs), los define cada hospital atendiendo a sus peculiaridades. Segundo nivel: Servicios Funcionales (SF), engloban a uno o varios GFH que prestan servicios homogéneos y están dotados de un responsable de un nivel superior al de los GFH. Tercer nivel: Áreas Funcionales, las AF son el nivel mínimo de estructuración de un hospital y agrupan a uno o varios SF. Para poder hacer comparaciones entre las AF y los SF existen distintas versiones de homologación publicadas por el Ministerio de Sanidad y Consumo sobre la codificación y las definiciones de ambos. En las tablas 16, 17 y 18 podemos ver la estructura hospitalaria clasificada en función de los distintos niveles Funcionales: AF, SF y GFH. Estructura Hospitalaria: Áreas y Servicios Estructurales Nivel I. Actividades Funcionales Nivel II. Servicios Funcionales Nivel III. GFH Administración periférica Administración Control de Gestión Gestión Económica-Contabilidad Admisión Admisión Documentación Clínica-Archivo Atención al Paciente Dirección de Enfermería Gerencia y Dirección Dirección y Gestión de Servicios Generales Dirección Médica Gerencia Medicina Preventiva Medicina Preventiva Radioprotección Fuente: Ministerio de Sanidad y Consumo (1994) Tabla 17.- Estructura Hospitalaria. Áreas y Servicios Estructurales. 70 Se definen en cada hospital en función de sus particularidades Estructura Hospitalaria: Áreas y Servicios Intermedios Nivel I. Actividades Funcionales Nivel II. Servicios Funcionales Nivel III. GFH Anestesia y reanimación Bloque Quirúrgico Esterilización Central Quirófanos Consultas Externas Consultas Externas Docencia e Investigación Docencia e Investigación farmacia Farmacia Hospitalización Unidades de Enfermería Análisis Clínico Anatomía Patológica Banco de Sangre Laboratorios Genética Hematología Laboratorio Se definen en cada hospital en función de sus particularidades Inmunología Microbiología Alimentaci´no Audiovisuales Conserjeria Informática Logística Lavandería Mantenimiento Personal Suministros Fuente: Ministerio de Sanidad y Consumo (1994) Tabla 18.- Estructura Hospitalaria. Áreas y Servicios Intermedios. Estructura Hospitalaria: Áreas y Servicios Finales Nivel I. Actividades Funcionales Nivel II. Servicios Funcionales Nivel III. GFH Angiología y Cirugía Vascular Cirugía Cardiaca Cirugía General y Digestivo Cirugía Maxilofacial Cirugía Cirugía Ortopédica y Traumatología Cirugía Pediátrica Otorrinolaringólogo Urología Cardiología Dietética Endocrinología Gastroenterología Hematología Medicina Intensiva Medicina Medicina Interna Nefrología Neurología Oncología Rehabilitación Reumatología Unidad de desintoxicación Obstetricia Obstetricia y Ginecología Ginecología Pediatría Pediatría Salud Mental Psiquiatría Urgencias Urgencias Urgencias Pediátricas Fuente: Ministerio de Sanidad y Consumo (1994) Tabla 19.- Estructura Hospitalaria. Áreas y Servicios Finales. 71 Se definen en cada hospital en función de sus particularidades El Proyecto utiliza el método de cascada analítica, dentro del proceso de reparto se distinguen dos fases, el reparto de los costes estructurales al resto de centros (intermedios y finales) y el reparto de los costes intermedios a los finales. Los criterios utilizados para trasladar los costes de un GFH a otro o varios GFHs se denominan, “Gestores de Calidad”. Si nos centramos en la primera fase del reparto, cabe destacar, que los GFH estructurales tienen unos costes cuya imputación en el producto final es complicada, pero su incorporación es obligatoria así que deberemos buscar mecanismos que nos faciliten está tarea. Como ejemplos podemos citar, el coste de personal que se distribuirá de forma mensual a cada GFH o el coste de farmacia que se distribuirá entre los centros en función de la unidosis. La segunda fase, se centra en imputar los costes de los centros intermedios a los centros finales. Por tanto, los centros finales acumularán tres tipos de coste, por un lado los costes estimados y proporcionales al volumen de actividad de los centros estructurales y por el otro, los costes propios que son aquellos que se le asignan de forma directa y los gastos repercutidos que son los imputados por otros grupos funcionales homogéneos, por la prestación de sus servicios a los centros finales. Cabe recordar, que los centros intermedios y estructurales prestan ayuda a los finales. Podemos observar, que los GFHs serán los receptores de todos los recursos del hospital, por tanto, el coste total de los GFHs finales será igual al coste total del centro hospitalario. Para concluir la explicación de esta primera versión, diremos que el Signo I es un modelo que tiene como finalidad la obtención de los costes por servicio, para ello el modelo traslada los costes en función de su naturaleza a los grupos funcionales o unidades mínimas de gestión. Los costes de todos los GFH no finales deben trasladar sus costes a los GFHs finales para obtener el “coste por servicio”. En base a lo anterior, los centros finales acumularán los siguientes costes: • Costes propios: Los directamente asignados a los GHF por los gestores del gasto (personal, hostelería, mantenimiento, etc.) • Costes repercutidos: Los imputados o facturados por otros GHF por la prestación de servicios (hospitalización, laboratorios, radiología, etc.) • Costes estructurales: Los costes de estructura imputados proporcionalmente al volumen de actividad o de coste de cada GHF. 72 El modelo Signo II, surge ante la necesidad de avanzar en la gestión hospitalaria y utiliza los mismos procedimientos de cálculo que el Signo I pero ahora los costes están asociados al paciente, es decir, el episodio será el receptor final de los costes del hospital, dando lugar al denominado “coste por paciente”. Para que el modelo Signo II funcione adecuadamente el Proyecto propone una serie de requisitos previos a la implantación: 1. Todos los costes deben estar asignados a un GFH. 2. Los GFHs deben estar bien definidos, tanto desde el punto de vista de su ordenación dentro del proceso como de sus relaciones con el resto de GFH. 3. Es necesario ofrecer el coste real de cada GFH, esto ayudará en la toma de decisiones a los responsables. 4. Debemos identificar los criterios para estimar la facturación interna del centro hospitalario. 5. Obtener el coste de los GFHs finales y por agregación de los Servicios Funcionales (SF) y Áreas Funcionales (AF) como una aproximación al producto hospitalario. De este modo conseguiremos el coste aproximado del case-mix de los pacientes atendidos por cada SF, asignando a cada uno de los pacientes, el coste del SF según los pesos del mix, como por ejemplo los Grupos Relacionado de Diagnostico (GRD) y los PMCs, entre otros (Falguera, 2002). La imputación de los costes a los pacientes debe seguir el siguiente proceso: A. Localización en un Grupo Funcional Homogéneo de todos los consumos tanto los del hospital como los del paciente. B. Obtención del Coste por Episodio, para ello es necesario separar los costes, relacionados con el paciente, de cada GFH e imputarlos al episodio. Los costes restantes pasan a los pacientes o a otros GFH relacionados de forma más cercana con el paciente. Finalmente, los GFH trasladan todos sus costes a los episodios tratados, es importante decir que este proceso se realiza mediante prestaciones simultáneas. Se trata de un proceso complejo de reparto de costes aunque el uso de prestaciones simultáneas facilita las imputaciones cruzadas. Por tanto, la segunda versión del Proyecto Signo nos ofrece información sobre el coste por servicio dando lugar a la posibilidad de comparar los presupuestos de diferentes centros, el coste por producto intermedio, es decir, el coste de los productos o actividades realizadas a un episodio, y por último, el ya comentado coste por paciente consiste en la agrupación de los costes por episodios agrupados por historia clínica. 73 2.5.2.- Modelo SIE: Modelo de la Conselleria de Sanitat i Consum de la Generalitat Valenciana La Conselleria de Sanitat i Consum de la Generalitat Valenciana desarrolla, en 1995, un Sistema de Información Económica para la Gestión Sanitaria (SIE) capaz de suministrar datos sobre el consumo real de recursos de cada una de las instituciones sanitarias adscritas, el lugar o actividad donde estos consumos se realizan y la puesta en relación de los costes con la actividad asistencial realizada. Este sistema tiene dos grandes ejes de actuación: A partir del Conjunto Mínimo Básico de Datos (CMBD) y el conjunto de casos atendidos en el hospital (casuística), clasificar los pacientes en grupos homogéneos desde el punto de vista clínico y económico para poder definir los productos finales proporcionados por el hospital. Medir los costes de cada una de las unidades en que se divide el hospital y de cada uno de los productos o actividades prestadas por el mismo al paciente (Coste por Actividad) y, por último, determinar el consumo de recursos imputables a cada grupo homogéneo de pacientes (Coste por Proceso). De acuerdo con el planteamiento de la Conselleria de Sanitat i Consum de la Generalitat Valenciana, los objetivos perseguidos por el SIE son los siguientes: § Concentrarse en el destino final de los gastos generados por el Hospital, pues todos quedan afectados a un Centro de Actividad. § Clasificación de los gastos (de personal, prestaciones, consumo de servicios y productos) que permita revelar la estructura interna de los gastos para cada Centro de Actividad. § Conocer el coste unitario al que cada hospital realiza sus actividades, lo que permitirá evaluar la eficiencia de los centros. § Obtener una medida de eficiencia/eficacia clínico-asistencial, a través del cálculo de los productos que necesita cada hospital para poder atender una misma patología. Es decir, conocer el “coste por proceso” para ello el SIE identifica tres etapas, la primera consiste en obtener el coste por paciente mediante los precios de las actividades consumidas por éste. La segunda etapa, se centra en la identificación de pacientes con características homogéneas (GRD) sobre la base del Conjunto Mínimo de Datos (CMBD). 74 La tercera y última etapa, radica en obtener los costes medios de los distintos grupos de pacientes para poder determinar los índices de casuística y los funcionales. Ambos son considerados los instrumentos más importantes para conocer la gestión de los recursos sanitarios. Por tanto, este modelo permitirá tener a nuestro alcance un “coste por actividad” y un “coste por proceso”. Antes de centrarnos en la definición y clasificación de los centros de actividad propuesta por SIE veremos cuáles son las características que deben reunir los centros de actividad para ser considerados como tales que son: tener homogeneidad económica y operativa, estar dotados de un responsable, formar parte de la estructura organizativa del hospital y tener a su alcance tanto personal como medios materiales. La clasificación que hace el modelo de los centros de actividad es la siguiente: Centros de Actividad Estructurales. Su función es acumular los costes derivados de actividades y servicios de carácter general, es decir, que afectan a todo el hospital. Estos se dividen en primarios, realizan actividades consistentes en servicios externos y de mantenimiento y afectan a todos los centros de actividad del hospital, y en secundarios que son los que desarrollan actividades de administración, hostelería, farmacia y medicina preventiva y que afectan a toda la estructura del hospital. Centros de Actividad Intermedios. Son aquéllos que prestan servicio a los Centros de Actividad finales. Dentro de este grupo encontramos en primer lugar, los Centros de Diagnóstico, que realizan actividades como diagnóstico por imagen, laboratorios, técnicas y exploraciones funcionales. En segundo lugar, tenemos a los Centros de Tratamiento, realizando tratamientos generales, de reproducción y rehabilitación. Y por último, los Centros Logísticos caracterizados por las unidades de hospitalización, consultas externas y centros de especialidades. Centros de Actividad Finales. Estos se dividen en función de si están o no vinculados a la hospitalización. Por un lado, encontramos los no vinculados a la hospitalización: la asistencia ambulatoria y urgencias. Éstos engloban los costes de los factores productivos atribuibles a los pacientes que no son ingresados en el hospital o aquéllos en que su ingreso se realiza después de la primera asistencia. Por otro lado, están los Centros Médico-Quirúrgicos unidos a la hospitalización, por tanto conforman el coste por proceso obtenido mediante la confección de CMBD (Conjunto Mínimo de Datos). 75 Por último tenemos, los Centros de Actividad No Imputables que absorben los gastos realizados por unidades, servicios o personas ajenas que usan instalaciones del hospital pero que de algún modo no están estrechamente relacionadas con éste. El Modelo SIE clasifica los costes según su naturaleza. El siguiente cuadro muestra las categorías de costes diferenciadas y su tratamiento. Cabe decir, que SIE excluye transitoriamente las amortizaciones en el cálculo de los costes. El proceso de asignación del los costes a los Centros de Actividad se compone de cuatro fases: 1) Primera fase, en ésta se produce la afectación de los costes directos a los Centros de Actividad que los origina. Esta fase de afectación de los costes directos se realizará mensualmente. 2) Segunda fase, se realiza trimestralmente siempre con valores acumulados. En esta fase en primer lugar, se traspasan los costes de los centros estructurales primarios a todos los demás, incluidos los secundarios y posteriormente, se asignan los costes de los Centros Secundarios al resto de Centros de Actividad. 3) Tercera fase, el objetivo de esta fase es que todos los costes queden distribuidos entre los Centros Intermedios de Diagnostico y Tratamiento y los Centros Finales, para ello, es necesario repartir con periodicidad trimestral los costes de los Centros de Actividad Intermedios Logísticos a los Centros Finales análogos. 4) Cuarta fase, consiste en la imputación de los costes de cada uno de estos Centros de Actividad, Intermedios y Finales, a las actividades realizadas en cada uno de ellos trimestralmente. De este modo, se obtienen los Costes por Actividad, en función de su número e índice de complejidad, a los que el Modelo denomina “Precios”. Para cada uno de los centros el modelo plantea el criterio de imputación más adecuado que se recogen en el cuadro siguiente. 76 Prestaciones Personal Consumo de Productos Su coste se impondrá a los centros que utilicen servicios o productos como, por ejemplo, trasporte sanitario o prótesis. Facultativo Su coste se imputará a aquellos centros donde presten servicio. Sanitario No Facultativo Su coste se afectará al centro donde presten servicios, en caso de participar diferentes centros se calculará el coste de cada centro en función del número de horas dedicadas. No Sanitario Tratamiento similar al del Personal Sanitario No Facultativo Se relacionan con cada centro teniendo en cuenta su uso, dentro de este grupo encontramos la farmacia, el material sanitario y el no sanitario. Suministros Exteriores Servicios Contratados Estos costes se imputan directamente a los Centros de Actividad Estructurales. Esta partida está compuesta por lo tributos, las pólizas de seguros e indemnizaciones. Los dos primeros se afectan a las "unidades administrativas" en cambio las indemnizaciones se imputarán al centro al cual este adscrita la persona a quien va dirigida. Consumo de Servicios Externos Gastos Diversos Tabla 20.- Criterios de imputación. Para obtener los distintos “precios” primeramente se tendrán que agrupar las actividades homogéneas de cada uno de los Centros de Actividad a fin de que el número de “precios” sea reducido, posteriormente en los centros de actividad con una única actividad intermedia se repartirá el coste total entre el número de veces que se realizó dicha actividad para obtener un coste unitario. Para el caso de Centros que cuenten con más de una actividad, será necesario buscar un factor de ponderación para cada una de ellas. Para determinados centros de Diagnóstico y Tratamiento el factor de ponderación propuesto son las Unidades Relativas de Valor (URV), el proceso mediante el cual llegamos a obtener el “precio” es el siguiente: primero multiplicaremos la URV de cada actividad por su frecuencia de realización, obteniendo así las “unidades de producción”. Seguidamente, dividiremos el coste total del Centro de Actividad entre el total de unidades de producción, de este modo obtenemos el coste unitario de la unidad de producción que multiplicado por las URV de cada actividad nos da el coste unitario de cada actividad, es decir, su “precio”. 77 Finalmente, para poder relacionar los costes con algunas magnitudes relevantes para determinar la gestión de los recursos del hospital el Modelo describe tres categorías de indicadores: Indicador de Gestión Estructural. Dentro de éste encontramos, el Indicador de Gestión Estructural Primario, que se calcula mediante los costes totales de cada centro de actividad estructural primario y alguna magnitud objetiva. Y el Indicador de Gestión Estructural Secundario, que se obtiene mediante la relación entre los costes de los centros de actividad secundarios y alguna de las magnitudes relacionadas con estos. Indicador de Gestión de Precios. Permite conocer el coste medio y por tanto, medir la eficiencia económico-asistencial de los centros. Su mayor inconveniente es el de conseguir el catálogo completo de actividades capaces de convertirse en “precios”. Índice de Casuística e Índice Funcional. El primero, es el cociente entre la estancia media o coste medio del hospital con la estancia media o el coste medio por GRD del conjunto de hospitales, y la estancia media o el coste medio del conjunto de hospitales. El segundo, se calcula a partir del cociente entre estancia media o el coste medio calculado tratando los mismos GRD del conjunto de hospitales, con la estancia media o el coste medio por GRD obtenido en el hospital y la estancia media o el coste medio del conjunto de hospitales para los mismos GRD. Ambos índices se obtiene anualmente, podemos decir que la finalidad del índice de casuística radica en medir el grado de complejidad del total de casos atendidos en un hospital, con respecto al conjunto de los atendidos por otros hospitales considerados, en cambio, el índice funcional pretende cuantificar el grado de eficacia y eficiencia del hospital comparando sus casos con los mismos cuando son atendidos por el resto de hospitales. 2.5.3.- Modelo Xunta de Galicia: Distribución de costes proceso/paciente. En 1994, la Xunta de Galicia publica un documento en el que aporta un modelo a seguir en la gestión hospitalaria que proporcione información que mejore la gestión diaria de los hospitales, tanto desde el punto de vista económico como asistencial. Este modelo proviene de la experiencia realizada en el Complejo Hospitalario A. Marcide-Novoa Santos. Este sistema parte de la aplicación de los planteamientos del modelo de gestión SIGNO a un Hospital de la Comunidad Autónoma (Complejo Hospitalario A. Marcide-Novoa Santos) con lo que se obtiene en primer lugar el coste de sus Servicios Funcionales. 78 Partiendo de esta información, se realiza una diferenciación entre los productos hospitalarios y los productos ambulatorios, para ello, utiliza la Unidad Ponderada de Asistencia (UPA). La actividad desarrollada por el Hospital vendrá cuantificada por el sumatorio de UPAs. Para determinar el coste por UPA de cada servicio se divide el coste del Servicio Funcional por el número de UPAs producidas (coste por servicio/número de UPAs producidas). Posteriormente, a partir del Coste UPA/Servicio, el modelo propone determinar el coste de la estancia por Servicio multiplicando el coste UPA por un Coeficiente de Ponderación (coste UPA*cociente de ponderación). A partir de esta información es posible determinar el Coste Total de Hospitalización, multiplicando el coste de cada estancia por el número de estancias. En segundo lugar, este documento también desarrolla información clínica a través de la distribución del coste de Hospitalización entre los diferentes procesos hospitalarios. Para ello el modelo, partiendo de la información existente en el CMBD y mediante la utilización de un sistema de clasificación de pacientes, concretamente, el de Categorías de Gestión de Pacientes, P.M.Cs. (Patient Management Categoríes), presenta cuatro métodos distintos para la distribución de los costes de los servicios en función de su casuística. De acuerdo con este sistema a cada uno de los P.M.C. le corresponde un protocolo que recoge los motivos de ingreso, los recursos mínimos a consumir en el diagnóstico, los diagnósticos incluidos en la categoría y el tratamiento que debe recibir el enfermo, incluyendo los días de UCI necesarios y el tiempo de estancia previsto. Los métodos planteados para la distribución de los costes son los siguientes: 1º Distribución del coste en función del P.I.R. (Relative Intensity Score) Este primer método, trata la distribución de los costes en función del Relative Intensity Score (P.I.R.) como unidad de producción. Para obtener el coste de un P.M.C primero, debemos determinar las unidades P.I.R. producidas por un servicio (número de casos por P.I.R. medio), después dividiremos el coste de hospitalización del servicio por el número de unidades de P.I.R. de este modo encontramos el coste por P.I.R. y por último al multiplicar el coste de unidad de P.I.R. por el número de unidades de cada P.M.C obtenemos el coste de un P.M.C. Finalmente, para calcular el coste de todos los procesos pertenecientes a un P.M.C., multiplicaremos el cote del P.M.C. por el número de casos de ese P.M.C. 2º Distribución del coste en función del P.I.R. y la estancia media El segundo método, se centra en la distribución de costes según el P.I.R. y la estancia media. Consiste en calcular el coste de unidad de P.I.R. por estancia (coste estancia/P.I.R. medio). Posteriormente, para obtener el coste de un P.M.C, multiplicaremos el coste de unidad P.I.R, por la estancia media y por el P.I.R. de este P.M.C.. 79 El coste de todos los procesos de un P.M.C. se obtiene haciendo multiplicando el coste del P.M.C por el número de casos de ese P.M.C. 3º Distribución del coste en función del P.I.R. medio ponderado a estancia media (Coste por Proceso) El tercer método, plantea que el P.I.R. debe reflejar que la estancia media real forma parte de los costes. Por eso propone ponderar estancia media real y P.I.R. de cada PMC mediante el producto entre el número de casos, la estancia media y el P.I.R. El P.I.R. medio ponderado lo obtendremos mediante el cociente entre el sumatorio del número de casos por estancias medias y por P.I.R, y el sumatorio del número de casos por estancia media. A continuación, podemos calcular el coste de unidad de P.I.R. mediante el cociente entre coste estancia y el P.I.R. medio. Finalmente, para obtener el coste de un P.M.C. multiplicaremos el coste unidad PIR por la estancia media y por el P.I.R. Del mismo modo, el coste total de casos de un P.M.C. lo obtendremos mediante el producto entre el coste P.M.C. por el número de casos. Este método permite obtener unos costes más ajustados a la realidad ya que el P.I.R. medio ponderado a estancia muestra el consumo de recursos de cada proceso y la estancia real del mismo. 4º Distribución del coste en función del P.I.R. y la estancia real (Coste por paciente) El cuarto método, propone la obtención del coste por proceso y por paciente atendido en un servicio. Para su cálculo primero debemos ponderar para cada paciente agrupado en cada P.M.C. estancia real y P.I.R. Seguidamente, obtendremos un P.I.R. medio mediante el cociente entre el sumatorio, en un P.M.C, del producto de estancia real y P.I.R. en cada paciente de ese P.M.C. y el resultado de la suma de las estancias reales de esos mismos pacientes. Entonces, el coste de la unidad de PIB se obtiene mediante el cociente entre el coste estancia y el PIR medio. Posteriormente, para obtener el coste de todos los casos de un PMC se debe multiplicar el coste de la unidad de PIR por el sumatorio, en un PMC, del producto de estancia real y PIR en cada paciente de ese PMC. Por último, para obtener el coste medio de un PMC dividiremos el coste de todos los casos por el número de casos de ese PMC. 2.5.4.- Modelo COAN: Sistema de Control de Gestión Hospitalario de la Junta de Andalucía La Conserjería de Salud de la Junta de Andalucía publicó en 1995 un Documento que presenta un Sistema de Control de Gestión Hospitalario, COAN, que constituye una aproximación al SIGNO I. El proyecto toma como referencia la experiencia empírica de implantar dicho sistema en nueve Hospitales del Servicio Andaluz de Salud en 1993. 80 El proyecto COAN, parte de la definición de los diferentes centros de responsabilidad en cada uno de los hospitales y los clasifica en tres categorías: Básicos, Centrales y los Finales. Los dos primeros, se caracterizan por ser centros de costes aunque los Básicos tienen como tarea dar soporte a los Centros de Responsabilidad y básicamente son no asistenciales. En cambio, los Centrales se consideran asistenciales porque entre sus responsabilidades se encuentra la de prestar servicios, principalmente de diagnóstico, a otros centros. Por último, los Centros Finales se caracterizan por ser tratados como centros de beneficios y están divididos en dos grupos, por una parte se encuentran los clínicos compuestos por los Centros Asistenciales Clínicos y Quirúrgicos. Por otra parte, encontramos los Centros Exteriores que se ocupan de la actividad externa del hospital. Centros de Responsabilidad Básicos Mantenimiento, Personal, Limpieza y Seguridad Unidad Óptica Metros cuadrados Administración, Docencia e Investigación Número de Trabajadores Atención al cliente y admisión Número de pacientes atendidos Lenceria y Lavandería Cantidad de ropa lavada Cocina Estancia/dieta diaria Centros de Responsabilidad Centrales Unidad Óptica Farmacia Proporcional al consumo Anestesia, Reanimación y Actividad Quirúrgica Análisis clínicos, Microbiología, Parasitología, Inmunología, Genética, Anatomía Patológica, Radiodiagnóstico, Medicina Nuclear y Radioterapia Hospital de día Horas disponibles en Quirófano Hospital a domicilio Número de consultas Medicina Preventiva Número de trabajadores Neurofisiología Clínica Número de exploraciones Farmacología Clínica Número de estancias Consumo de URV Número de pacients atendidos Tabla 21.- Criterios óptimos para la imputación de costes. Fuente: Junta de Andalucía 1995 El cuadro anterior muestra los diferentes centros de responsabilidad, definidos en el proyecto, incluidos en las categorías de Básicos y Centrales, así como, los criterios de imputación de costes señalados como “óptimos”5 en el modelo. Si nos centramos en la clasificación de los costes, podemos decir, que el modelo diferencia los Costes Directos de los Indirectos. Los Costes Directos, son los que se pueden identificar como exclusivos de cada centro de responsabilidad por ejemplo, los gastos de personal, el mantenimiento de aparataje, los consumos de fungibles o de fármacos, incluso las consultas externas y las amortizaciones6. Dentro de los Costes Indirectos, encontramos los No Sanitarios que están relacionados con los Centros de Responsabilidad Básicos y se distribuyen mediante el sistema Full-Costing en cascada y los Sanitarios que se imputan a los Centros Finales. 81 En el caso de los Centros de Responsabilidad Centrales deberemos utilizar las Unidades Relativas de Valor, URVs, para poder ponderar cada una de las pruebas que realizan estos centros para prestar los servicios de diagnostico y tratamiento a los otros centros. En conclusión, COAN, nos ofrece una Cuenta de Gasto para cada uno de los centros, Básicos y Centrales, y una Cuenta de Resultados para cada uno de los Centros Finales. Es importante remarcar que los costes aparecen relacionados con el nivel de producción a través de una Escala Relativa de Valor y la aplicación del sistema Case-Mix. Esto nos permite ofrecer una cuenta General del Hospital. 2.5.5.- Modelo del Servei Català de la Salut (SCS) En 1994, el Servei Català de la Salut a través del Institut Català de la Salut publicó un documento cuya finalidad era establecer las pautas para la elaboración y puesta en funcionamiento de la contabilidad analítica en los hospitales del Grupo ICS (ICS, 1994). Se pretende elaborar un sistema de contabilidad analítica que permita realizar un análisis correcto del coste total de la actividad asistencial realizada, a partir de la información suministrada por el mismo sobre cuáles son los recursos reales consumidos y quien realiza ese consumo. En primer lugar, el modelo define la estructura funcional del hospital mediante la identificación de los centros de coste a los que denomina Centros de Actividad, definiéndolos como unidades de producción que realizan un producto y llevan a cabo una actividad que puede ser asistencial o no. Desde la perspectiva de la contabilidad analítica y teniendo en cuenta la definición anterior, los Centros de Actividad son las unidades donde se acumularán los costes que se hayan generado, tanto directamente como indirectamente. Para definir los diferentes Centros de Actividad debe tenerse en cuenta que para que un centro pueda ser considerado como tal, deberá cumplir una serie de condiciones: ü Disponer de homogeneidad económica y operativa. ü Tener un responsable. ü Concentración funcional de medios materiales y humanos correspondientes a cada Centro de Actividad. ü El Centro de Actividad debe estar encuadrado en la estructura organizativa general del centro. El modelo clasifica estos centros en tres categorías, aunque debemos destacar que cada hospital está dotado con una serie de servicios, por tanto, los Centros de Actividad variaran en función de los recursos, la dimensión del hospital y su organización. 82 Centros de Actividad Estructurales o Auxiliares, son centros de servicios comunes, fundamentales para el desarrollo de la actividad del hospital ya que, dan servicio a todo el hospital. Su actividad no es asistencial pero es necesaria para la realización de dicha actividad asistencial. Estos centros se dividen en Centros Estructurales Primarios, que son los encargados de temas relacionados con la estructura física y organizativa del hospital, y los Centros Estructurales Secundarios que son los relacionados con temas de logística del hospital por lo que su relación con el paciente es más estrecha. Las tabla 21 muestra el detalle de la clasificación de estos centros. Centros de Actividades Estructurales Primarios Secundarios Mantenimiento Admisiones U. Direcciones Funcionales Archivo Historias Clínicas Administración Limpieza Información Lavandería Conserjería Cocina Biblioteca Esterilización Informática Farmacia Almacén Compras Tabla 22.- Centros Estructurales. Fuente: Generalitat de Catalunya 1994 Centros de Actividad Intermedios, son los encargados de dar soporte a las unidades productivas finales mediante el diagnostico y tratamiento de pacientes. Prestan sus servicios a petición de las unidades productivas finales, aunque, estos centros pueden trabajar también para otros centros ajenos al hospital. A continuación en la tabla 22 se relacionan algunos centros intermedios, a título de ejemplo. Centros de Actividad Intermedios Diagnóstico Tratamiento Soporte Análisis clínicos Unidad clínica del dolos Anestesia y Reanimación Bioquímica Hospital de día Quirófanos Diagnóstico por imagen Paritorios Otros laboratorios Banco de Sangre Antomía Patológica Unidades de consultas externas Unidades de urgencia Unidad es de Hospitalización Tabla 23.- Centros de Actividad Intermedios. Fuente: Generalitat de Catalunya 1994 83 Centros de Actividad Finales, son los responsables de los episodios clínicos que tiene lugar dentro del hospital, cabe decir, que su actividad se factura en el exterior. Dentro de los centros finales podemos encontrar, por un lado, los Centros Finales de Soporte o Apoyo, que actúan a petición de los centros finales dando diagnóstico y tratamiento a los pacientes. Por otro lado, tenemos los Centros Finales Principales, que son los responsables de elaborar el producto de atención especializada final. La tabla 23 recoge, como ejemplo, algunos centros finales propuestos por el modelo. Centros de Actividades Finales Soporte o Apoyo Principales Radioterapia Hospitalización Rehabilitación Medicina Interna Cirugía Mayor Ambulatoria Cardilogia Medicina Preventiva Dermatología Medicina Intensiva … Asistencia Primaria Consultas externas: Medicina Interna Cardilogia Dermatología … Urgencias Medicina Interna Traumatología … Cirugía Mayor Dermatología Cirugía … Tabla 24.- Centros de Actividad Finales. Fuente: Generalitat de Catalunya 1994 Una vez definidos los centros de actividad del hospital el ICS propone la imputación de costes en cascada mediante un sistema que consta de cuatro fases: Primera fase, en esta se realizará la imputación de los costes directos o por naturaleza a cada Centro de Actividad. Debemos mencionar que los costes directos son de imputación directa al Centro de Actividad que los ha originado (personal, consumo de productos, etc.). No obstante, algunos de estos costes directos son difíciles de asignar a los centros como consecuencia de que la información es insuficiente (agua, luz, etc.), esto implica que para su imputación debemos utilizar a las denominadas Unidades de Obra como parámetro de reparto. 84 El siguiente cuadro propone las unidades de obra a seleccionar para la imputación de los costes a los Centros de Actividad diferenciando entre, la que es mejor aplicar (UO Ideal), la mejor alternativa en caso de no poder utilizar la ideal (UO Primaria) y aquellas que el hospital debería aplicar en caso de no poder disponer de las anteriores (UO Mínima). En el cuadro siguiente se contemplan algunos ejemplos de unidades de obra propuestas por el ICS para la imputación de los costes a los centros. Udo Idela UdO Posible UdO Mínima Centro de Actividad Estructural Primario Horas de trabajo del Personal Nº Personas Manteniminto Administración Médica Nº informes Metros cuadrados Nº Personas Coste de Personal Nº ingresos Hospital Nº Camas disponibles Centro de Actividad Estructural Secundario Admisión Hospitalización Nº ingresos Hospital Nº ingresos Hospital Cocina pacientes Nº Menús Nº Estancias URV URV nº determinaciones Nº Solicitudes Nº UVA Nº Pruebas Nº UVA Radioterapia Nº Procesos asistenciales ponderados según el nivel de complejidad Nº Procesos asistenciales Nº de Sesiones Cirugía Mayor Ambulatoria Nº Intervenciones CMA ponderadas. Nº Intervenciones Nº Intervenciones CMA CMA Centro de Actividad Intermedio Laboratorio de Análisis Clínico Diagnóstico por Imagen Centro de Actividad Final de Apoyo Ilustración 2.- Unidades de Obra. Generalitat de Catalunya. 1994 Una vez imputados los costes directos, estos quedarán cerrados por lo que será imposible aplicar otro gasto, por lo que se podrá determinar el coste total de los Centros de Actividad Estructurales Primarios y medir la eficacia de estos Centros de Actividad. Segunda fase, esta se subdivide en dos, en la primera parte de esta fase se produce la imputación de los costes de los Centros de Actividad Estructurales Primarios a los Secundarios, Intermedios y Finales, mediante las respectivas unidades de obra, obteniendo así, el coste total de los Centros Estructurales Secundarios y su eficacia. De este modo, los Centros Estructurales Secundarios quedarían cerrados a la entrada de otros gastos. Posteriormente, en la segunda parte de esta fase, se produce el reparto de los costes de los Centros Estructurales Secundarios a los Intermedios y Finales, mediante las unidades de obra correspondientes, lo que implicará conocer el coste total de los Centros Intermedios. Nuevamente, estos centros ya no podrán recibir ningún gasto adicional. Tercera fase, en ella los costes de los Centros Intermedios se repartirán entre lo Centros Finales tanto a los de Soporte como a los Principales. Esto nos permitirá conocer el coste total de los Centros Finales. 85 Cuarta fase, en esta última fase, los costes de los centros de actividad finales de soporte7 se repartirán entre los Centros de Actividad Finales Principales. Esto nos permitirá conocer el nivel de eficacia de los Centros de Actividad Finales Principales, a través de su coste total, así como, el coste de actividad de las estancias, de urgencias y de las consultas externas, es decir, estará a nuestro alcance información de costes de cualquier producto hospitalario final a través de los instrumentos de Case-Mix. Si nos centramos en la parte del Documento que habla del tratamiento de los ingresos que deben hacer los hospitales del ICS, éste propone que deberán valorarse a través, de las Unidades Básicas Asistenciales (UBA) que produce cada Centro Final Principal. Es decir, cada Unidad Básica Asistencial deberá multiplicarse por las tarifas vigentes. Cabe destacar, que el documento establece que las herramientas de Case-Mix (PMC, DRG) pueden utilizarse para valorar los procesos asistenciales. 2.5.6.- Modelo del Servicio Vasco de Salud (SVS). En 1994 el Servicio Vasco de la Salud, público un Manual cuya finalidad era crear un sistema de imputación de costes de los centros hospitalarios. Este sistema tomo como referencia el modelo SIGNO I, así pues, utiliza la misma distinción entre Servicios Estructurales, Intermedios y Finales. Aunque cabe señalar que los Centros Estructurales e Intermedios son tratados de forma general como podemos observar en el siguiente cuadro. El modelo identifica dos tipos de coste, el del personal y el relacionado con el funcionamiento del hospital, como por ejemplo los suministros, las reparaciones, el mobiliario, arrendamientos, etc. Es importante mencionar que las amortizaciones no se tendrán en cuenta. Servicios Funcionales Intermedios Servicios Funciones Finales Edificio Cuidados Intensivos Hospitalización Mantenimiento Radiología Consultas Externas Limpieza Anestesia Urgencias Lencería Quirófanos Servicios Externos Alimentación Anatomía Patológica Esterilización Pruebas Funcionales Farmacia Urgencias Laboratorio Enfermería Lavandería Traslados interservicios Tabla 25.- Servicios Funcionales. Eusko Jaurlaritza 1994 Para la imputación de costes el proceso distingue cuatro niveles8 de imputación para cada elemento de coste y Servicio Funcional. Inicialmente, los costes se distribuyen en función del uso que le da cada uno de los servicios y aquellos costes que no pueden imputarse directamente se asignan a los Servicios Intermedios. 86 Para ejemplificar la imputación de los costes de los Servicios Intermedios hacia los finales hemos seleccionado los servicios de mantenimiento y el de laboratorios con la inclusión de los distintos niveles que se recogen en la tabla 25. Servicios Intermedios Finales Mantenimiento Laboratorios Nivel 1 Imputación directa Nivel 3 Imputación directa Imputación directa: 1.- mantenimiento preventivo y órdenes de reparación 2.- En función de los m2 el resto. En función de los m2 Nivel 4 … En función del Nº de Determinaciones Nivel 2 En función de los consumos En función de los consumos Tabla 26.- Imputación de los servicios de Mantenimiento y Laboratorios. Eusko Jaurlaritza 1994 Como puede observarse, en el caso del servicio de mantenimiento, en el nivel 1 se imputará de forma directa, en cambio, el nivel 2 se imputa sólo de forma directa el valor de las órdenes de reparación y los contratos de mantenimiento preventivo. Por último, en el nivel 3 se carga en función de los metros cuadrados. En el caso del servicio de laboratorio, en el nivel 1 se atribuyen los costes directos, por lo que en el nivel 2 se carga en función del consumo por un muestreo diseñado, que realizan mediante la Unidades Relativas de Valor, URVs. En el nivel 3, se utiliza el mismo sistema que en dos pero ahora se imputa en función del consumo mediante un muestreo no diseñado especialmente. Por último, en el nivel 4, se carga en función del número de determinaciones que le hayan sido solicitadas al servicio. 2.5.7.- Proyecto de Gestión Clínico Financiera o GECLIF. En 1998 surge un nuevo proyecto Gestión Clínico Financiera o Geclif que pretende no solo la normalización e integración de la información clínico-financiera, sino la obtención de costes por actividad asistencial, Grupos Relacionados de Diagnóstico o GRD´s e indicadores de eficacia para la comparación entre hospitales. Cada GRD cuenta con un peso relativo que representa el coste previsible de este tipo de pacientes respecto al coste medio de todos los pacientes de hospitalización agudos. Este modelo del mismo modo que el Proyecto Signo fija un protocolo con el objetivo de preservar la homogeneidad en la definición de los centros de costes (GFH’s), los métodos de reparto, los criterios de asignación y el cálculo de los costes como el de amortización. En el año 2000 el Modelo Geclif funcionaba en 81 hospitales, cuyas gestiones estaban a cargo del INSALUD, aunque su nivel de aplicación era distinto. Las Comunidades Autónomas que habían recibido las transferencias sanitarias antes de 2002 utilizaban distintos sistemas de costes aunque con similitudes al Geclif. Para poder hacer comparaciones entre estos centros y el resto que aplicaban el Geclif era necesario realizar adaptaciones para armonizar estos sistemas. 87 Para estimar el nivel de aplicación del Geclif en los centros hospitalarios se realizó un cuestionario. Además, se pretendía conocer si los datos que suministraban eran homogéneos y comparables y si la información obtenida se tenía en cuenta en la toma de decisiones, la Confección del Contrato de Gestión y la elaboración de presupuestos. Los resultados de la encuesta demostraron que la mayoría de los hospitales se encontraban en el nivel dos de los tres posibles, esto se debía principalmente a las diferencias en la informatización de los centros. Pues la aplicación de los métodos de reparto y de asignación de costes no podía ser la misma ya que dependía del nivel tecnológico del centro. Pero la mayoría de los centros afirmaron que los informes obtenidos gracias a la contabilidad analítica servían para tomar decisiones sobre los presupuestos de los GFH’s clínico-asistenciales. Algunas de las ventajas del Geclif frente a otros modelos de gestión son que este permite diferenciar en cada servicio los costes de hospitalización y consultas externas, lo que nos permite llegar al coste por proceso. Además, este cuenta con una serie de indicadores que sirven de medida para conocer la gestión asistencial en cada sección del centro hospitalario. También utiliza un subreparto matricial ya que tiene en cuenta las relaciones entre los distintos servicios. Pero no todo son ventajas, este modelo presenta ciertos inconvenientes: • No se considera de forma explícita la separación de costes fijos y variables, esto supone un problema para la toma de decisiones. • No se obtienen los costes de subactividades. Se utilizan datos reales sobre costes y actividad, esto implica trasladar las ineficiencias de los centros oferentes a los demandantes. Propone el método de distribución de costes Top-down, que consiste en calcular el coste por proceso en función de los pesos medios de cada GRD, para ello es necesario contar con el coste del GFH de hospitalización del servicio y la casuística atendida por dicho servicio en los distintos GRD’s. Este mecanismo es sencillo pero el problema es que está sujeto a la precisión de los pesos asignados a cada GRD. A continuación detallaremos las características de este nuevo modelo: 1. Permite la captura automática de datos, independientemente de la fuente de los mismos. Dispone de utilidades para convertir estructuras de bases de datos, por tanto, mediante operaciones sencillas podemos importar información de un fichero a otro. 88 2. Su filosofía se basa en adaptar la herramienta a la organización, es decir, manteniendo estructuras mínimas homologadas, la herramienta nos permite desarrollar nuestro análisis de costes en los niveles que deseemos. Además, disponemos del desglose de costes al nivel que queramos. 3. La información económica se combina con la asistencial dando lugar al coste por producto. El conocimiento de nuestros costes permite poder compararlos, y definir presupuestos futuros. 4. Permite conocer el coste de nuestros procesos y pacientes. 5. Ofrece cuadros de mandos en los que podemos analizar las desviaciones respecto a presupuestos establecidos, conociendo no sólo cuánto nos desviamos sino también por qué nos desviamos. El sistema de costes utilizado por el Geclif, es el Full Costing o Coste Completo, este analiza los costes, diferenciando los de producción y los de estructura. Mediante este sistema, el centro sanitario debe obtener el coste medio completo de cada producto con el fin de medir la eficiencia y eficacia de la gestión, comparando los costes con las tarifas del Contrato de Gestión. Las principales características de este modelo son por un lado la realización de un análisis de los costes directos e indirectos y por otro lado, llevar al coste final todos los costes del periodo, es decir, los costes directos de forma directa y los costes indirectos a través de algún criterio de reparto. El modelo distingue tres tipos de costes, los propios o de funcionamiento que son aquellos costes directos o indirectos que han sido distribuidos entre los GFH en el reparto primario, es decir, en el reparto de costes por naturaleza que veremos a continuación. Los costes repercutidos, aquellos costes imputados de un GFH a otro GFH. Y por último, los costes estructurales, que son los costes imputados de un GFH estructural. Si nos centramos en el reparto de los costes a los centros de costes vemos que éste consta de dos fases: 1. La primera de las fases se denomina reparto primario, en esta todos los costes se tienen que repartir a los distintos GFH, bien directamente o mediante un criterio de reparto para los costes indirectos, a este proceso se le llama afectación de costes. Los costes que conforman el reparto primario son los siguientes: ü Costes de personal. Incluirá todos los costes de personal devengados. Los costes relacionados con la formación del personal se asignarán a los GFH correspondientes. Si no se conociese su distribución quedarían aplicados al GFH Final Docencia. 89 ü Los costes de funcionamiento por bienes y servicios. Estos se contabilizarán cuando tenga lugar su consumo. ü Amortizaciones. Serán asignadas a los GFH correspondientes en base al valor de la depreciación de su inmovilizado. El modelo da flexibilidad para escoger el criterio de amortización que desee el centro, entre estos criterios se encuentra el de amortización por plan de necesidad básica (4años), el de amortización por planes de necesidades o el de amortización por inventario real. 2. La segunda de las fases se denomina reparto secundario, una vez que todos los costes están asignados a los GFH, esta fase tiene como objetivo la imputación de los costes de los distintos GFH para llegar al coste completo de los mismos y calcular el coste de los distintos productos que se ofrecen en un hospital. En ella todos los costes de los GFH se distribuyen entre los GFH finales, a este proceso se le llama imputación de costes. Para poder determinar cuáles serán los criterios de imputación óptimos debemos conocer muy bien las relaciones entre los GFH. Es importante destacar que el Geclif no utiliza el reparto en cascada como el resto de modelos vistos sino que se centra en un sistema de imputaciones recíprocas, de modo que un GFH que ya ha distribuido sus costes puede recibir costes de otro. Por tanto, en este proceso todos los costes de los GFH estructurales, intermedios y finales estarán imputados en los GFH finales y en la producción final, es por ello que las actividades realizadas por cada GFH deben estar bien definidas, así como qué centro es el que realiza la demanda de dicha actividad. El reparto secundario se basa en tres elementos, el primero es el GFH que realiza la producción al que llamamos proveedor, el segundo es la producción realizada en la que se explica el tipo de actividad que realiza y los diferentes productos y el tercero de los elementos es el GFH que demanda la actividad, es decir, aquellos que solicitaron el producto que es a quienes se les va a facturar. El criterio de imputación para los GFH intermedios de logística, servicios centrales y GFH finales será el de “en función de la actividad”. En cambio, para los GFH estructurales utilizaremos el “coste relativo de personal” ya que estos no tienen una actividad definida. Cabe destacar, que los costes de los GFH proveedores se imputarán a los demandantes en función del sistema de información entre departamentos. El cálculo de los costes se realizará a partir de las URV’s, se trata de una unidad que mide el consumo de recursos en base a una ponderación aplicada a cada tipo de producto dependiendo de su coste. Una vez calculados los costes de cada GFH, todos los GFH conocerán el valor de su coste completo desglosado en cotes propios, repercutidos y estructurales. 90 La finalidad de la Contabilidad analítica es la de determinar el coste de la producción, porque esto nos permite controlar la eficiencia y eficacia de la gestión hospitalaria. El problema es que el sector sanitario es considerado como una empresa multiproducto, ya que existen muchos servicios heterogéneos algunos de ellos difíciles de identificar. Es por ello que, los servicios intermedios y finales agrupan sus prestaciones en productos homogéneos, para facilitar los cálculos, además para la obtención de los costes los servicios intermedios se basan en las URV. Una vez que conocemos ambos tipos de producción el Geclif propone el uso de las siguientes fórmulas para obtener el coste medio por producto: Costes del GFH Coste medio del producto = Producción total del GHF Para el cálculo del coste por proceso, el modelo propone primero asignar todos los costes del hospital a un paciente y a sus GFH responsables, por tanto a todos los pacientes les debemos imputar los distintos recursos consumidos. El coste de un paciente estará compuesto por los costes generados por los servicios utilizados y por los episodios generados hasta su alta. Existirán costes que podremos asignar directamente al paciente como, los costes de personal, el coste de farmacia o suministros específicos, el coste de anatomía patológica, el coste de laboratorios, coste de las unidades de enfermería, coste de radiodiagnóstico, coste de quirófanos, coste de alimentación y el coste de Urgencias. Y habrá otros costes, denominados de funcionamiento, repercutidos y estructurales, que no podremos imputar directamente al paciente entonces deberemos utilizar el criterio “número de estancias generadas y procesos atendidos”. Para poder obtener el coste por proceso el centro debe contar con un sistema de información integrado cuyo núcleo principal sea el episodio, esto implica que existan ciertos centros que no puedan utilizar este sistema y tengan que recurrir a otro método denominado Top-Down. Este método se caracteriza por su sencillez de aplicación, ya que todos los hospitales tienen plena capacidad para utilizar este mecanismo porque el programa del Geclif lo permite. Aunque, cabe mencionar, que es un sistema de cálculo estimado cuya fiabilidad dependerá de la calidad de los datos sobre los costes de hospitalización y el nivel de codificación del CMBD. 91 Este método estima el coste por proceso en función de los pesos medios de cada uno de los GRD, su cálculo se obtiene aplicando la siguiente fórmula: Coste GRD (i) = Coste Ceco de Hospitalización-Ambulatorio (j) * Peso GRD (i) Altas (j) * Peso medio del Ceco o servicio (j) Siendo: (j) un determinado Ceco de hospitalización (i) el número del GRD (1......n) Como conclusión, decir que los centros sanitarios deben mejorar este sistema de cálculo estimado por GRD por otro basado en la asignación de recursos al paciente ya que este presenta inconvenientes como el de que la eficiencia o ineficiencia en el tratamiento de algunos pacientes tendrá efectos en el resultado. Pues unos costes muy altos en un GFH debidos al tratamiento de un tipo de pacientes, son repartidos a todos los GRD mediante los pesos de cada uno de ellos, entonces el coste de todos sus GRD estará infravalorado o sobrevalorado. 2.5.8.- Análisis comparativo de los modelos de coste descritos. Por último, este apartado tiene como objetivo realizar una comparación de los distintos modelos descritos en los apartados anteriores. Nos centraremos en mostrar las coincidencias y singularidades en lo referente a características, costes por naturaleza, centros de costes y asignación de los costes entre los centros de coste, por un lado y asignación de los costes de los centros a los productos, por otro. A) Coste por naturaleza: Si nos centramos en los costes por naturaleza, podemos observar que existen ciertas diferencias en cuanto a su clasificación en los distintos modelos. No obstante, estas diferencias no son significativas ya que se trata de aspectos terminológicos que no afectan de forma importante al resultado del centro. A continuación analizaremos los distintos tipos de costes: v Personal. Este coste, que se corresponde íntegramente con el Capítulo I de la Contabilidad Presupuestaria, tiene un peso específico importante y un tratamiento individualizado en cada uno de los modelos. Su imputación se realiza en general en función del lugar donde estén trabajando cada una de las personas que conforman el coste de personal del centro sanitario. Cuando este coste deba repartirse entre los distintos centros, se hará en base al tiempo de dedicación del personal en cada uno de dichos centros. El SIE y el SCS diferencian entre el personal facultativo, personal sanitario no facultativo y el personal no sanitario. 92 v Mantenimiento. Es uno de los costes a los que se dedica más atención. En general, todos los sistemas utilizan como criterio de imputación de este coste el grado de utilización, aunque el concepto que utiliza cada uno no es el mismo. El SCS lo considera dentro del capítulo de reparaciones, el SVS lo trata como “reparación y conservación”, el SIE lo considera un servicio subcontratado es por ello que lo incluye en “consumo de servicios externos”. Dentro del sistema de COAN se incluye en la partida de “mantenimiento de aparetaje” pero en el caso de no poder identificar ese coste con un centro de actividad irá a “mantenimiento”, por último Signo distinguirá entre mantenimiento externo e interno. v Suministros. Este coste en todos los modelos se imputa en base al consumo que realiza cada centro, pero es denominado de forma diferente en cada uno de los modelos, COAN utiliza el término de “consumo de fungibles”, SIE lo denomina “consumo de productos y servicios” este distingue entre el “consumo de productos” y el “consumo de servicios externos”, el SCS ofrece el mismo enfoque y lo identifica como “consumo de bienes y servicios” diferenciando entre también “consuno de bienes” de “consumo de servicios”, el SVS lo incluye en el apartado de “coste de funcionamiento” y Signo le atribuye el nombre de “suministros”. v Hostelería Alimentación. Prácticamente todos los sistemas dan por sentado que la alimentación será un servicio subcontratado por el centro hospitalario y ubican esta partida dentro del concepto de “consumo de servicios exteriores”. No obstante, el modelo Signo trata este coste de forma independiente y lo imputa a cada GFH según en el consumo que realiza cada centro. v Farmacia. La afectación de este coste en todos los modelos se realiza normalmente, en función del consumo de productos. No obstante, solo los modelos SiGNO y COAN utilizan el concepto de farmacia de forma separada para identificarlos, en cambio, SIE y SCS no los trata de forma separada sino que los incluyen en los apartados de “consumo de productos” y “consumo de bienes y servicios” respectivamente. v Contratas externas. SIGNO es el único que no considera este coste, el resto de sistemas lo incluyen dentro del “consumo de servicios externos” a diferencia de COAN que lo considera como importe de las contratas realizadas con empresas externas a la organización. v Prestaciones. Únicamente SIE identifica de forma específica este coste, en este apartado se incluyen partidas como “prótesis”, “transporte sanitario” y “otras actividades sanitarias”. El resto de sistemas lo incluyen en la partida de “suministro” o “consumo de bienes y servicios”. 93 v Amortización. SIGNO y COAN definen el criterio de imputación del coste de amortización, el primero lo imputa en función de la ubicación del bien y el segundo hace uso del sistema de amortización lineal o constante (este consiste en dividir el valor del bien entre el número de años de vida útil). Por el contrario, SIE y SCS excluyen el tratamiento de la amortización de modo transitorio. v Fondo de maniobra. De este podemos decir, que el Signo es el único que lo considera de forma aislada. A modo de resumen, en el la tabla 26 se muestran los costes por naturaleza utilizados en los distintos sistemas de cálculo de costes de los centros sanitarios españoles. SIGNO SIE Xunta Galicia COAN Personal Personal Personal Personal Suministros Consumos Suministros Consumos de Fungibles Farmacia Consumo de fármacos Farmacia Consumo de Servicios Mantenimiento Exteriores Alimentación Mantenimiento Alimentación Mantenimiento del Aparataje Fondo de Maniobra Fondo de Maniobra Amortizaciones Amortizaciones Contratas Externas SCS Personal Consumos Bienes y Servicios Reparaciones SVS Personal GECLIF Personal Costes Bienes y Funcionamiento Servicios Reparaciones y Consumos Amortizaciones Contratas Externas Prestaciones Tabla 27.- Costes por naturaleza de los distintos sistemas de imputación de costes B) Centros de coste: La idea fundamental en cada uno de los modelos de coste desarrollados por las Comunidades Autónomas es la división de los hospitales en una serie de centros cuya finalidad es la de ser unas unidades de producción a las que se imputarán los costes en que se vayan incurriendo. Estos centros de costes reciben diferentes denominaciones en función del modelo de costes analizado como consecuencia de la organización interna de los hospitales: Grupos Funcionales Homogéneos (GFH), Centros de actividad, Centros de responsabilidad o Secciones. El centro de coste, sea cual sea su denominación, se considerará como una unidad de producción que ofrece un servicio asistencial o no. Estas unidades deberán reunir una serie de características: ü Los centros de costes estarán relacionados perfectamente con la estructura organizativa del centro. ü En cada centro de costes deberá figurar un responsable. 94 ü La actividad que desarrolle cada uno de los centros será claramente identificable y el medidor estará relacionado con esa actividad. De este modo podremos identificar los recursos utilizados en cada centro, además de facilitarnos el reparto de de los costes de esos centros hacia otros, en base a su utilización y mediante ese medidor. Una vez establecidas estas unidades de producción, el siguiente paso en cada uno de los modelos es establecer una clasificación de los centros de coste. A continuación la tabla 27 nos ofrece la clasificación de las unidades de producción y centros de coste que realizan los diferentes modelos. División del Hospital en centros de coste División centros de coste Estructurales SIGNO Grupos Funcionales Homogéneos Intermedios Finales Estructurales Primarios Secundarios Tratamiento SIE Centros de Actividad Intermedios Diagnóstico Logística Imputables Finales No Imputables Estructurales Xunta de Galicia Grupos Funcionales Homogéneos Intermedios Finales Básicos COAN Centros de Responsabilidad Centrales Finales Estructurales SCS Centros de Actividad Estructurales Servicios Intermedios Finales Estructurales GECLIF Grupos Funcionales Homogéneos Intermedios Finales Tabla 27.- Estructura Hospitalaria. Monje, P. (2003) 95 Primarios Secundarios Intermedios Finales SVS Clínicos Exteriores Apoyo Principales Las diferencias derivadas de los centros de coste diferenciados por los diferentes modelos implican un uso de la información diferente dando lugar a resultados finales dispares en cuanto a seguimiento y control. Si nos fijamos en los centros de coste que define cada modelo vemos que el modelo SIGNO muestra dos clasificaciones para determinar los centros de coste, por un lado, tenemos la primera clasificación que distingue tres niveles, el primero o básico formado por los GFH, el segundo son Servicios Funcionales (SF) y el tercero que engloba las Áreas Funcionales (AF). Por otro lado, la segunda clasificación, diferencia entre tres centros de coste, los estructurales, los intermedios y los finales. Esta última clasificación propuesta por el Signo es utilizada en gran parte de los centros hospitalarios aunque con algunas diferencias. A continuación explicaremos la clasificación que presentan los modelos propuestos por las Comunidades Autónomas. El SVS utiliza la clasificación propuesta por el Signo, este habla de servicios funcionales estructurales, intermedios y finales. En cuanto al modelo de COAN los centros estructurales pasan a denominarse básicos, los intermedios recibirán el nombre de centrales y los finales estarán divididos en clínicos y exteriores. La clasificación propuesta por el SCS y el SIE presenta similitudes. El SCS reconoce: los centros estructurales o auxiliares que los subdivide en primarios y secundarios, los intermedios y los finales donde diferencia entre de apoyo y principales. Y el SIE distingue entre: los centros estructurales divididos también en primarios y secundarios, los intermedios donde diferencia los referentes a Tratamiento, diagnóstico y logística y los finales divididos entre finales y finales no imputables. B) Asignación de los costes entre los centros de coste: Una vez realizado el reparto primario de los costes por naturaleza cada centro de coste tiene acumulados unos costes. A continuación, en el reparto secundario se van realizando las imputaciones de estos costes entre centros de coste. Pese a que todos los modelos coinciden en que los centros receptores de todos estos costes en el proceso de reparto son los centros finales, es decir los que tienen normalmente contacto directo con el paciente. Dichos modelos no coinciden en la forma de realizar el reparto de estos costes. El SCS y SIGNO realizan un reparto en cascada, no obstante el primero utiliza como criterio de reparto las unidades de obra y el segundo unos coeficientes de reparto. COAN y GECLIF realizan el reparto en función de las prestaciones recíprocas entre los centros realizando imputaciones cruzadas entre ellos, utilizando como criterio de reparto el de actividad ofertada y demandada. 96 SIE utiliza un criterio mixto de forma que el coste acumulado en los centros estructurales se reparte en cascada, mediante la utilización de unos coeficientes de reparto y el de los centros intermedios, de forma directa a los finales en función de la actividad demandada por ellos. En el SVS la imputación de los costes de todos los centros se realiza de forma directa a los finales. Se utiliza como criterio de imputación, en los centros estructurales, unos coeficientes de reparto y en los centros intermedios la actividad. La mayoría de los sistemas de reparto dan cierta flexibilidad, es decir, ofrecen la posibilidad de escoger entre distintos criterios bajo la característica de mejor a peor opción. D) Asignación de los costes de los centros a los productos: la finalidad última de todos los modelos analizados es la obtención del coste de los productos. Estos productos pueden consistir en pacientes, procesos clínicos o grupos Relacionados con el Diagnóstico. El coste unitario del producto de un Servicio se obtiene dividiendo su coste total por el número de unidades producidas. Por lo que respecta a las unidades producidas existe dos alternativas: Cuando el Servicio o Centro produce un solo tipo de servicio más o menos homogéneo, se podría utilizar la unidad de obra. Cuando los Centros asistenciales finales producen servicios no homogéneos se pueden utilizar las unidades equivalentes que son coeficientes de ponderación referidos a diferentes parámetros de la producción. Cada uno de los modelos analizados, obtiene el coste unitario del producto utilizando las siguientes unidades equivalentes (Monje, 2003): • SIGNO, utiliza las Unidades Relativas de Valor (URVs) en los centros que poseen una actividad muy variada y para el resto de centros las Unidades Ponderadas de Asistencia (UPAs). • El SIE, al igual que el anterior, para los centros con actividad variada y poco homogénea utiliza las URVs y en el resto de centros, con actividad homogénea la Unidad Médico Asistencial (UMAs). • La Xunta de Galicia, utiliza la Unidades Ponderadas de Asistencia (UPAs) para realizar, a partir de los costes de sus Servicios Funcionales, una descomposición entre productos hospitalarios y productos ambulatorios. Posteriormente, utiliza las Puntuación de Intensidad Relativa (PIR) para la obtención del coste de los procesos de hospitalización. 97 • El COAN, considera que los servicios asistenciales producidos no son homogéneos y mide la producción mediante Unidades Relativas de Valor (URVs). • El SCS, realiza una traducción de toda la actividad realizada en los centros finales a las Unidades Básicas de Asistencia (UBAs). • El SVS, realiza también una ponderación en las diferentes actividades realizadas en cada uno de los centros mediante la utilización de los Grupos Relacionados de Diagnóstico (GRDs). A continuación, mostramos un cuadro que refleja a modo de resumen los criterios de reparto utilizados en los distintos sistemas de cálculo de costes de los centros sanitarios españoles. Criterios de Reparto Entre Centros de Coste De Centros de Coste a Productos SIGNO SIE Xunta de Galicia Coeficiente de reparto Coeficiente de reparto Unidad Ponderada de Asistencia (UPA) Nº de veces Actividad Unidad Relativa de valor (URV) Unidad Relativa de valor (URV) Unidad Ponderada de Asistencia (UPA) Unidad Ponderada de Asistencia (UPA) Unidad Médico Asistencial (UMA) Puntuación de Intensidad Relativa (PIR) Coeficiente de reparto COAN SCS SVS GECLIF Actividad Unidad de Obra Coeficiente de reparto Nº de veces Actividad Nº de veces Actividad Unidad Relativa de valor (URV) Unidad Básica de Asistencia (UBA) Grupo Relacionado con el Diagnóstico (GRD) Tabla 28.- Criterios de reparto entre los distintos sistemas. El objetivo final de los modelos desarrollados en este capítulo es ofrecer a los hospitales un punto de referencia que permita a los mismos disponer de una información que facilite la realización de comparaciones. El análisis de estos modelos nos ha permitido observar algunas diferencias en los mismos derivadas de las clasificaciones de los costes por naturaleza, que resultan poco significativas, en los centros de coste diferenciados y en los criterios de reparto, diferencias estas más significativas ya que comportan un tratamiento diferente de la información. No obstante, pese al esfuerzo realizado por la administración con el desarrollo de estos modelos en aras a ofrecer a los centros sanitarios instrumentos útiles para la gestión. Hay que remarcar que hubiera sido interesante que se hubiese tenido en cuenta la necesidad de realizar comparaciones entre los centros asistenciales. 98 Ya que, actualmente, la comparación entre centros hospitales no pertenecientes a la misma comunidad autónoma, para analizar cuestiones tales como la eficiencia y la eficacia, costes, etc. no es posible, ya que, como hemos podido comprobar, los criterios utilizados para elaborar la información no son homogéneos. 99 100 III.- HIPOTESIS Y OBJETIVOS 101 102 III.- HIPÓTESIS Y OBJETIVOS. Las fracturas osteoporóticas y la artrosis constituyen un problema sociosanitario de grandes dimensiones. Entre ellas, las fracturas de cadera acarrean la mayor morbimortalidad. El envejecimiento poblacional en todos los países desarrollados, junto con el aumento de la esperanza de vida provoca un incremento de las enfermedades degenerativas y de aquellas ligadas a la edad. Así, las previsiones apuntan a que el número de las fracturas de cadera en el anciano irá en aumento a lo largo de los próximos años. El conocimiento de la incidencia y las predicciones futuras será un instrumento de enorme utilidad a la hora de asignar los recursos de nuestro sistema sanitario. Por otra parte, nuestro sistema sanitario es de financiación limitada, debiendo cada vez más priorizar los recursos disponibles para aumentar su efectividad. Al examinar los diferentes sistemas de gestión que aparecen a lo largo de nuestro país, podemos observar que no es suficiente con conocer el coste de cada proceso, sino que hemos de analizar las partes que componen el mismo. Debemos, por tanto, conocer cómo se distribuyen dichos recursos mediante un examen pormenorizado de los costes de los procesos a los que van destinados. Sólo así podremos mejorar su eficacia. Los métodos de valoración de adecuación de estancia hospitalaria han demostrado ser eficaces a la hora de tomar decisiones que optimicen los recursos. Así pues, las fracturas de cadera son uno de los principales problemas sociosanitarios de los países occidentales, con una incidencia y costes crecientes. Si este problema también existe en nuestro medio, ¿sería posible prestar una asistencia más eficiente a los pacientes ancianos con fractura de cadera, en función de mejorar la adecuación de la estancia hospitalaria? Para responder a esta pregunta, nos planteamos los siguientes OBJETIVOS 1.- Conocer la incidencia de los implantes de cadera en la provincia de Badajoz en su Área de Salud de Badajoz. 2.- Conocer la tendencia de las fracturas de cadera en la provincia de Badajoz en sus Área de Salud de Badajoz durante los años 2009 a 2014. 3.- Conocer y analizar el coste hospitalario de las fracturas de cadera en el Complejo Hospitalario Universitario de Badajoz. 4.- Establecer un sistema de información centralizado que aporte información a todos los intervinientes sobre la evolución de la actividad y de los costes de los procesos asistenciales. 103 104 IV.- MATERIAL Y MÉTODO 105 106 IV.- MATERIAL Y METODO ORGANIZACIÓN SANITARIA La Ley 10/2001, de 28 de junio, de Salud de Extremadura, establece la organización pública de los servicios sanitarios bajo la de nominación de Sistema Sanitario Público de Extremadura y delimita territorialmente la Comunidad Autónoma en áreas y zonas de salud. El área de salud se configura como la demarcación territorial básica del Sistema Sanitario Público de Extremadura. Su organización debe asegurar la continuidad de la atención en sus distintos niveles y promover la efectiva aproximación de los servicios al usuario, así como la coordinación de todos los recursos en este ámbito. El área de salud, a su vez, se organiza en zonas de salud, que constituyen el marco territorial y poblacional de la atención primaria. En ellas se proporciona una atención sanitaria continuada, integral y permanente mediante el acceso directo de la población. La distribución de la población extremeña por áreas de salud puede observarse en el Mapa 1 CENTROS DE SALUD Y CONSULTORIOS EN EXTREMADURA SERVICIO EXTREMEÑO DE SALUD-SUBDIRECCIÓN DE AP Robledo Ladrillar Riomalo Martilandrán Asegur Casares Carabusino Aceitunilla NUÑOMORAL El Gasco Cabezo Vegas Las Mestas Fragosa Rubiaco Arrolobos Cambrón Aldehuela Pedro Muñoz La Huerta Castillo Cambroncino Robledo Erias Horcajo Robledillo de Gata Ovejuela Eljas Acebo TORRE DON MIGUEL Villamiel Moheda Cilleros MORALEJA Calzadilla Vegaviana Rincón del Obispo Casas D. Gomez Casillas de Coria Puebla de Argeme Herrera de Alcántara Pradochano Mirabel CC. NORTE Aliseda S. FERNANDO CORDOBILLA DE LACARA Aljucén S. ROQUE Torremayor PUEBLONUEVO MONTIJO La Garrovilla M. II Barbaño Valdelacalzada Puebla de la Calzada TALAVERA Lobón Guadajira Alvarado Arroyo de San Servan VALDEPASILLAS Valverde de Leganes San Jorge La Albuera Retamal Cortegana Entrin Bajo Torre de Miguel Sesmero Corte de Peleas S. MARTA Salvatierra de los Barros Higuera de Vargas VILLANUEVA DEL FRESNO Valencia del Mombuey La Lapa ZAFRA II Valle de Matamoros Zahinos Valle de S. Ana Atalaya La Bazana FREGENAL Higuera la Real Malpartida de la Serena ZALAMEA CABEZA DEL BUEY Puerto Hurraco Esparragosa de la Serena Higuera de la Serena Valencia de las Torres Llera Baterno Garlitos Capilla ZarzaCapilla Benquerencia de la Serena Helechal Almorchón Monterrubio de la Serena HORNACHOS Usagre Medina de las Torres Calzadilla de los Barros Valencia del Ventoso Valuengos OLIVA LOS SANTOS Puebla de Sancho Pérez Higuera de Llerena Alconera Brovales Valle de la Serena Puebla de la Reina Tamurejo Risco La Nava Oliva de Mérida Palomas Ribera del Fresno Hinojosa del Valle Garbayuela SIRUELA Peñalsordo CASTUERA Quintana de la Serena Manchita TALARRUBIAS P. de Alcocer Sancti-Spiritus La Haba Villarta de los Montes Fuenlabrada de los Montes DE Esparragosa de lares CAMPANARIO Magacela Peloche Peraleda del Zaucejo ZAFRA I Burguillos del Cerro Valverde de Burguillos JEREZ DE LOS CABALLEROS VILLANUVA NORTE Valdivia D.B. VILLANUVA Entrerrios ESTE SUR La Coronada HERRERA DEL DUQUE Casas de Don Pedro Mengabril GUAREÑA Puebla del Prior FUENTE DEL MAESTRE La Parra Salvaleón Yelbes Valdetorres VILLAFRANCA Feria Bohonal Helechosa de los Montes Castilblanco Valdecaballeros LOGROSAN Alcollarin Cristina S. JOSÉ Villalba de los Barros La Morera SANTA AMALIA D.B. OESTE ACEUCHAL Nogales BARCARROTA S. ROQUE Solana de los Barros Entrin Alto Almendral Taliga ALCONCHEL Alía GUADALUPE Cañamero Vegas Altas Escurial MIAJADAS Madrigalejo Almohari C de Miajadas NAVALVILLAR Obando Pizarro n Alonso de Palazuelo PELA Ojeda Puebla de Alcollarin Guadalperales Vivares Zurbaran Villar de Orellana de Ruecas Gargáligas Valdehornillos Acedera Rena la Sierra Hernan Cortes Torviscal Medellin Rena ORELLANA LA VIEJA Villagonzalo LA ZARZA Alange C. JARDIN San Rafael OLIVENZA San Benito Valverde de Mérida Don Álvaro Torremejias San Francisco Villarreal Mirandilla San Pedro de Merida Torrefresneda Trujillanos M. III M. I CALAMONTE Balboa La Calera BERZOCANA Conquista Carrascalejo M. NORTE Esparragalejo Carrascalejo Rotura Navezuelas Garciaz ZORITA Villamesias Valdemorales Arroyomolinos Carmonita La Nava de Santiago Lácara Navalvillar de Ibor VALDEFUENTES ALCUÉSCAR Alcazaba CENTRO LA PAZ Sta. Cruz de la Sierra Robledillo de Trujillo Salvatierra de Santiago Campo Lugar Albalá Torre Sta. Maria Zarza de Casas de Don Antonio Montanchez Montanchez Abertura Rincón de Ballesteros Sagrajas Novelda Guadiana Puerto de Sta Cruz VILLAR DEL PEDROSO CASTAÑAR DE IBOR Cabañas del Castillo Solana Hueguijuela Ibahernando Sta. Ana Benquerencia CC. SUR LA ROCA Valdebotoa TRUJILLO URBANO Belen TRUJILLO Conquista RURAL Botija Ruanes Aldea del Cano GEVORA PROGRESO La Aldea del Obispo Plasenzuela Sierra de Fuentes Madroñera Valdelacasa de Tajo Garvin Retamosa La Cumbre PLAZA DE TOROS Torremocha Puebla de Obando Fresnedoso de Ibor Aldeacentenera Huerta de Animas Berrocalejo Peraleda de S. Roman Campillo de Deleitosa Robledollano Jaraicejo MEJOSTILLA Valdesalor Peraleda de la Mata BOHONAL DE IBOR Mesas de Ibor Deleitosa Torrecillas de la Tiesa Torrequemada Villar del Rey Valdehuncar Belvis de Monroy Higuera Santa Marta de Magasca Torreorgaz ALDEA MORET ALBURQUERQUE La Codosera Casas de Miravete Monroy Santiago del Campo Casas de Don Millan CASAR DE CÁCERES ARROYO DE CC. CENTRO LA LUZ NUEVO CC. El Gordo Casas de Belvis Saucedill ALMARAZa Torrejón el Rubio Herreruela S. VICENTE DE ALCÁNTARA Millanes Casatejada Serrejón Romangordo Valdecañas del Tajo TALAVÁN Cañaveral Malpartida Brozas SALORINO Majadas Toril SERRADILLA Hinojal NAVAS DEL MADROÑO Las Casiñas Malpartida de Plasencia Riolobos Holguera Pedroso de Acin Villa del Rey VALENCIA DE ALCANTARA NAVALMORAL DE LA MATA P. II-SUR San Gil Alagón Valdecin Garrovillas Membrio Cabezabellosa Mata de Alcantara Carbajo Cheles Valdeobispo Aldehuela del Jerte TORREJONCILLO ALCÁNTARA SANTIAGO DE ALCANTARA Tornavacas Villar Pescueza Aceuche Portezuelo Cedillo HERVAS Jerte Madrigal Navaconcejo de la Vera Guijos de Sta CABEZUELA Valverde de Barbara Rebollar la Vera El Torno Aldeanuela de Jarandilla Talaveruela de la Vera Valdeastillas la Vera de la Vera C. CASTAÑAR V. DE LA VERA LOSAR Barrado Garganta Piornal P. III-NORTE Cabrero Robledillo Viandar de la Vera la Olla Pasarón de la Cuacos de de la Vera Vera Yuste Gargüera Barquilla de Pinares P. I Arroyomolinos JARAIZ Tejada de Stª Maria de la Collado Torremenga TALAYUELA Tietar Loma Rosalejo Valdeiñogos Jarilla Oliva Galisteo Valdecin CECLAVIN Estorninos Santibáñez Bajo Aceituna Carcaboso Guijo de Galisteo Portagen Cachorrilla Piedras Albas Baños de Montemayor La Garganta Segura del Gargantilla Toro P. G y Galán Guijo de GranadillaCasas del Valdelamatanza Monte Pozuelo del Zarzón Guijo de Morcillo Villa del Coria Valrio Campo CORIA El Batan Huelaga Perales del Puerto Palomero AHIGAL M.HERMOSO HOYOS Zarza la Mayor Torrecilla de los Angeles El Bronco Hernán Pérez Villanueva de Sierra Santibáñez Santa Cruz delaPaniagua el Alto Villasbuenas Mesegal MOHEDAS ALDEANUEVA C de Palomero La Pesga Zarza de Azabal Rivera Granadilla La Granja Cerezo Marchagaz Abadía Sauceda Cadalso Gata San Martín de Trevejo VALVERDE Caminomorisco Muela PINOFRANQUEADO Descargamaría Campillo de Llerena Berlanga Ahillones Retamal de Llerena Maguilla AZUAGA Granja de Torrehermosa Casas de Reina Montemolin Segura de León Cabeza la Vaca LLERENA FUENTE DE CANTOS Bohonal de la Sierra Fuentes de León Villagarcia de la Torre Bienvenida Valverde de Llerena Trasierra La Cardenchosa Reina Malcocinado Calera de León Pallares Fuente del Arco Puebla del Maestre MONESTERIO Sta María de Navas CENTRO DE SALUD HOSPITAL PAC ACCESORIO CONSULTORIO CON ASISTENCIA DIARIA CONSULTORIO CON ASISTENCIA ALTERNA UME HELICOPTERO UME AMBULANCIA Figura 10.- Área de Salud de Badajoz. Servicio Extremeño de Salud. En violeta. 107 Fuentes: Decreto 238/2008, de 7 de noviembre, por el que se modifica el Mapa Sanitario de Extremadura. Instituto Nacional de Estadística (Padrón municipal de 1 de enero de 2011) El Área de Salud de Badajoz es una de las ocho áreas sanitarias que componen el Servicio Extremeño de Salud (SES), organismo autónomo dependiente de la Consejería de Salud y Política Sociosanitaria del Gobierno de Extremadura. Figura 11.- Mapa Sanitario del Área de Salud de Badajoz HOSPITALES DEL ÁREA SANITARIA DE BADAJOZ Dentro de los recursos existentes para el desarrollo de la Atención Hospitalaria, disponemos en el Área de Badajoz del Complejo Hospitalario Universitario de Badajoz, que está formado por el Hospital Infanta Cristina, Hospital Perpetuo Socorro, Hospital MaternoInfantil y Centro de Especialidades. 108 La Atención Hospitalaria comprende las actividades asistenciales, diagnósticas, terapéuticas y de rehabilitación y cuidados, así como aquellas de promoción de la salud, educación sanitaria y prevención de la enfermedad, cuya naturaleza aconseja que se realicen en este nivel, garantizando la continuidad de la atención integral del paciente, una vez superadas las posibilidades de la Atención Primaria y hasta que aquél pueda reintegrarse en dicho nivel. Además de aquellos que precisen una intervención quirúrgica, ingreso o exploraciones de alta tecnología, debiendo estar interrelacionada con la atención primaria con el objeto de evitar ingresos innecesarios y facilitando la accesibilidad. ESTRUCTURA DE LA POBLACIÓN DEL ÁREA DE SALUD DE BADAJOZ El Área Salud de Badajoz, se encuentra situada al suroeste de la Comunidad Autónoma rodeada por las Áreas Sanitarias de Cáceres, Mérida y Llerena-Zafra, y el país vecino Portugal. Es el Área de Salud con mayor población, y por tanto donde se encuentra el mayor número de recursos sanitarios de la Comunidad Autónoma. 2009 Población Total Españoles Extranjeros <16 años 16-64 años >65 años <16 años 16-64 años >65 años <16 años 16-64 años >65 años Mujeres 22.616 89.958 25.351 21.926 86.607 25.179 690 3.351 178 Varones 23.575 92.746 18.231 22.881 88.538 17.998 694 4.208 233 Total 46.191 182.704 43.582 44.807 175.145 43.177 1.384 7.559 411 Población Total 272.477 263.129 9.354 Tabla 29.- Población del Área de Salud de Badajoz Figura 12.- Población del Área de Salud de Badajoz. Memoria Gerencia Área Badajoz 2009 2014 Población Total Españoles 16-64 años >65 años Mujeres 22.244 94.465 19.527 131.409 4.827 Varones 20.963 92.196 26.541 135.109 4.591 Total 43.207 186.661 46.068 266.518 9.418 266.518 9.418 Población Total <16 años 275.936 16-64 años Extranjeros <16 años >65 años <16 años Tabla 30.- Población del Área de Salud de Badajoz. Memoria Gerencia Área Badajoz 2014 109 16-64 años >65 años Figura 13.- Población del Área de Salud de Badajoz. Memoria Gerencia Área Badajoz 2014 2014-2009 Población Total Españoles 16-64 años >65 años Mujeres -372 4.507 -5.824 -2.303 608 Varones -2.612 -550 8.310 5.692 -544 Total -2.984 3.957 2.486 3.389 64 3.389 64 Población Total <16 años 3.459 16-64 años Extranjeros <16 años >65 años <16 años 16-64 años >65 años Tabla 31.- Diferencias de Población del Área de Salud de Badajoz 2014-2009. Memoria Gerencia Área Badajoz 2009-2014 Figura 14.- Diferencias de Población del Área de Salud de Badajoz 2014-2009. Memoria Gerencia Área Badajoz 2009-2014 110 POBLACIÓN ASIGNADA POR MUNICIPIOS La población total en 2011 asciende a 273.616 habitantes, lo que representa el % 24.7 de la población de Extremadura. Con una distribución que insertamos en la figura Nº 15. Pobl aci ón 2013 Ambos sexos Hombres Mujeres Albuera (La) 2.069 1.057 1.012 Alburquerque 5.544 2.806 2.738 Alconchel 1.866 940 926 1.319 644 675 150.621 73.329 77.292 Barcarrota 3.683 1.887 1.796 Cheles 1.219 580 639 Codosera (La) 2.284 1.188 1.096 Corte de P eleas 1.301 660 641 573 290 283 Higuera de Vargas 2.057 1.037 1.020 Jerez de l os Caballeros 9.719 4.837 4.882 Lobón 2.866 1.488 1.378 Almendral Badajoz Entrín Bajo 16.121 8.001 8.120 Morera (La) 741 369 372 Nogales 690 348 342 5.482 2.762 2.720 12.043 6.017 6.026 Montijo Oliva de l a Frontera Olivenza Parra (La) 1.379 706 673 Puebla de l a Calzada 6.002 2.974 3.028 Puebla de Obando 1.930 971 959 Pueblonuevo del Guadiana 2.059 1.039 1.020 Roca de l a Sierra (La) 1.489 728 761 Salvaleón 1.958 969 989 Salvatierra de l os Barros 1.751 867 884 San Vicente de Alcántara 5.752 2.886 2.866 Santa Marta 4.289 2.170 2.119 Talavera l a Real 5.548 2.807 2.741 743 373 370 T orre de Miguel Sesmero 1.268 638 630 T orremayor 1.039 491 548 Valdelacalzada 2.851 1.478 1.373 Valencia del Mombuey 781 388 393 Valle de Mat amoros 413 206 207 Valle de Sant a Ana 1.174 582 592 Valverde de Leganés 4.230 2.124 2.106 Villanueva del Fresno 3.579 1.773 1.806 Villar del Rey 2.319 1.224 1.095 Zahínos 2.864 1.420 1.444 273.616 135.054 138.562 T áliga Total Figura 15.- Población de los distintos Municipios del Área de Salud de Badajoz 111 DISTRIBUCIÓN DE LA POBLACIÓN POR EDAD Y SEXO La población como podemos apreciar en la figura Nº 16, es, en general, similar a la del resto de la provincia de Badajoz, de Extremadura y de España. Figura 16.- Distribución de la Población por Edad y Sexo CARACTERÍSTICAS DE LA POBLACIÓN ESTUDIADA En la siguiente tabla 31 se expone de forma resumida y clara las características de la población estudiada donde la densidad de población es de 44,19 habitantes por km2, frente a la española que es de 93,7 habitantes por km2 y superior a la del resto de la Comunidad Autónoma de Extremadura. El índice de feminidad es igual al de España pero superior a la del resto de la Comunidad que nos ocupa. Es de resaltar que nuestro índice de envejecimiento es superior al resto de la región y de España. 112 España Extremadura Área de Badajoz Densidad de población 93,27 26,65 44,19 Población Total / Sup. e n Km2 Índice de feminidad 1,03 1,01 1,03 Pob. Total M / Pob Total V Índice de Friz 0,60 0,66 0,68 0-­‐1 9 / 3 0-­‐4 9 Índice Burgdofer 0,38 0,38 0,42 5-­‐1 4 / 4 5-­‐6 4 Índice de Envejecimiento 1,15 1,33 1,04 >65 / <15 Índice de Sobre-­‐e nvejecimiento 0,14 0,14 0,12 >84 / >64 * 1 00 Índice de Dependencia -­‐niños 0,22 0,22 0,23 <15 / 1 5-­‐6 4 Índice de Dependencia -­‐mayores 0,25 0,29 0,24 >64 / 1 5-­‐6 4 Índice de Dependencia -­‐Total 0,47 0,51 0,47 (<15 + >64) / 1 5-­‐6 4 Estructura de Pobla. Pot. Activa 0,83 0,81 0,87 15-­‐3 9 / 4 0-­‐6 4 Índice de Reemplazo 0,92 1,15 1,21 15-­‐1 9 / 6 0-­‐6 4 Índice de Tendencia 1,05 0,98 1,04 0-­‐4 / 5 -­‐9 Índice Generacional de ancianos 0,53 0,59 0,52 >64 / 3 5-­‐6 5 Carga de c uidadores 0,12 0,14 0,11 >79 / 3 0-­‐6 4 Tasa de maternidad 212,69 195,70 214,57 0-­‐4 / M15-­‐4 9 * 1 000 Tasa bruta de Natalidad * 10,59 9,36 10,74 Nac /Pob Tot * 1 000 Tasa bruta de Fecundidad * 42,08 38,45 42,17 Nac / M15-­‐4 9 * 1 000 Tasa bruta de nupcialidad * 3,72 3,81 4,26 Mat / Pob Tot * 1 000 Tasa bruta de mortalidad * 8,23 9,75 8,53 Def /Pob Tot * 1 000 Saldo V egetativo x 1 000 hab. * 2,35 -0,39 2,21 (Nac-­‐Def)/Pob Tot *1000 Fuente INE: D atos del padrón municipal del año 2 010 * D atos de 2 009, último disponible a nivel municipal Tabla 32.- Características de la Población estudiada. INDICADORES DEMOGRÁFICOS Edad media. Se estima computando la media ponderada de los valores centrales de las clases usando las frecuencias relativas de cada grupo como factores de ponderación. Edad mediana. Es aquella que divide en dos partes iguales a la población cuyos habitantes han sido ordenados según la edad. Es más variable que la edad media pero es menos sensible a los cambios estructurales propios de cada población. Índice de envejecimiento (IV). Indicador sintético del grado de envejecimiento de la población. Se obtiene dividiendo el conjunto de la población anciana, a partir de los 65 años, entre el de los niños por debajo de cierta edad, generalmente los 15 años. Índice demográfico de dependencia (ID). Tiene relevancia económica y social. Con este indicador, las personas que supuestamente no son autónomas por razones demográficas (la edad), es decir, los ancianos (>65) y los muy jóvenes (<15), se relacionan con las personas que supuestamente deben sostenerlas con su actividad (15-64). 113 Índice de estructura de la población activa (IS). Es un indicador del grado de envejecimiento de este sector de la población. Puede obtenerse dividiendo la población entre los 40 y los 64 años (las 25 generaciones más viejas en activo) por la población desde los 15 a los 39 años (las 25 generaciones más jóvenes). Cuanto más bajo sea el índice, más joven es la estructura de la población laboral. Índice de reemplazamiento de la población en edad activa (IR). Es el cociente formado por los que están a punto de salir de la edad activa (60-64 años) entre los que están a punto de entrar (15-19 años). Es un índice sujeto a fuertes fluctuaciones y por tanto muy variable. Índice del número de niños por mujer fecunda (IC). Se obtiene dividiendo los niños nacidos recientemente (0-4 años) por las mujeres en edad fértil (15-49 años). El IC en los países subdesarrollados no es un buen indicador de la fecundidad debido a la merma que supone la elevada mortalidad infantil. Realmente es un indicador de la carga de hijos en edad preescolar por mujer, por lo que es útil como indicador sociodemográfico. Tasa general de fecundidad (GF). Se obtiene del cociente entre los nacidos vivos durante un año y la población femenina en edad fértil (15-49 años) y expresa el número de hijos que en promedio tendría una cohorte ficticia de mujeres no expuestas al riesgo de morir desde el nacimiento hasta el término de la edad fértil. Índice de masculinidad (IM). Es el número de nacimientos masculinos por cada 100 nacimientos femeninos. Este índice también se calcula para cada edad. Índice de Friz (IF). Representa la proporción de población en el grupo 0-19 años en relación a la de 30-49 años, que se toma como base 100. Si este índice es mayor de 160, la población se considera joven, si se halla entre 60 y 160, madura, y si es menor de 60, vieja. Índice de Sundbarg (IS). Tomando como base la población de 15-49 años, Sundbarg compara gráficamente los porcentajes que, en relación con este grupo (= 100), significan los grupos de 0-14 años y de mayores de 50. Si el porcentaje de los menores de 15 supera el de los mayores de 50 la población es de carácter progresivo. Si se igualan es estacionaria y si el grupo de mayores de 50 supera al de menores de 15 es regresiva. Índice de Burgdöfer (IB). Compara los porcentajes de población en los grupos de 5-14 y de 45-64 años. Si el primero es mayor que el segundo la población es joven, si son aproximadamente iguales es madura y si es menor la población es vieja. Índice Generacional de Ancianos (IGA). Representa el número de personas de 35 a 64 años por cada persona de 65 y más. Se supone que mide el número de personas de 35 a 64 años que podrían hacerse cargo de cada persona de 65 y más años. 114 EVOLUCIÓN DE LA POBLACIÓN La evolución de la población vemos que en Extremadura es de signo descendente en los últimos años manteniéndose un ligero aumento en la del Área de Salud de Badajoz al igual que en el resto de España. La tasa de crecimiento es nula en el último año registrado y menor del 1 Año Nacional Extre madura Áre a de Badajoz 2000 40.499.791 1.069.420 255.613 2001 41.116.842 1.073.381 257.732 2002 41.837.894 1.073.050 257.819 2003 42.717.064 1.073.904 259.008 2004 43.197.684 1.075.286 259.889 2005 44.108.530 1.083.879 264.346 2006 44.708.964 1.086.373 265.049 2007 45.200.737 1.089.990 267.481 2008 46.157.822 1.097.744 270.317 2009 46.745.807 1.102.410 272.477 2010 46.142.455 1.083.253 273.408 2011 46.195.103 1.083.101 275.656 2012 47.265.321 1.108.130 276.154 2013 47.129.783 1.104.004 275.936 Tabla 33.- Evolución de la Población Año Nacional Extre madura Áre a de Badajoz 2000 0,74% -0,39% -0,28% 2001 1,52% 0,37% 0,83% 2002 1,75% -0,03% 0,03% 2003 2,10% 0,08% 0,46% 2004 1,13% 0,13% 0,34% 2005 2,11% 0,80% 1,71% 2006 1,34% 0,23% 0,27% 2007 1,09% 0,33% 0,91% 2008 2,07% 2,56% 3,38% 2009 1,26% 0,75% 1,54% 2010 -0,01% -0,16% 0,89% 2011 1,00% 0,25% 1,27% 2012 -1,90% -1,80% -0,41% 2013 -4,74% -2,67% -1,89% Tabla 34.- Tasa de Crecimiento de la Población 115 MOVIMIENTOS NATURALES DE LA POBLACIÓN Analizamos en la Tabla nº 35 los movimientos naturales de la población y los comparamos con el resto de la Comunidad Autónoma y con España. Badajoz Extremadura España Nacimientos Defunciones Nacimientos Defunciones Nacimientos Defunciones 2000 6.484 6.301 10.133 10.361 397.632 360.391 2001 6.459 6.205 9.903 10.338 406.380 360.131 2002 6.382 6.536 9.778 10.549 418.846 368.618 2003 6.550 6.750 9.962 11.227 441.881 384.828 2004 6.397 6.306 9.899 10.421 454.591 371.934 2005 6.496 6.853 9.993 11.171 466.371 387.355 2006 6.695 6.362 10.118 10.359 482.957 371.478 2007 6.766 6.517 9.981 10.759 491.183 385.361 2008 7.185 6.538 10.735 10.441 519.779 386.324 2009 7.004 6.535 10.385 10.409 492.931 383.486 2010 6.800 6.642 10.128 10.816 486.575 382.047 2011 6.623 6.408 9.938 10.584 471.999 387.911 2012 6.476 6.814 9.423 11.347 454.648 402.950 2013 5.957 6.606 8.886 11.030 425.390 389.699 Tabla 35.- Movimientos naturales de la Población. 4.1.- Método Se ha realizado un estudio retrospectivo de 1.001 casos de implantes de prótesis de cadera de pacientes intervenidos mediante artroplastia total o parcial de cadera en el Complejo Hospitalario de Badajoz entre los años 2009 y 2014. La base poblacional del estudio se obtuvo a partir de los datos existentes en el sistema informático integral del Servicio Extremeño de Salud (SES) denominado JARA, con base SAP. Nuestro Complejo Hospitalario de Badajoz, como cualquier otra empresa, debe adaptar su gestión dentro del marco competitivo en que se desenvuelve, estando los responsables de su gestión obligados a plantearse mejoras tanto en la organización como en las actividades que allí se realizan. Para ello se cuenta con un sistema de información que capaz de recopilar, analizar y transmitir toda aquella información necesaria para dirigir cada una de las unidades (asistenciales o no) del hospital, permitiendo su control y adecuarse a las nuevas oportunidades que se puedan plantear. En nuestro caso de estudio el sistema se denomina JARA. 116 El Servicio Extremeño de Salud, a través del Proyecto JARA, se propuso dotarse de un Sistema de Información Sanitaria, que cumple con la finalidad reflejada por OMS, ya en el año 1973: “Los mecanismos o estructuras para la recogida, elaboración, análisis y transmisión de la información necesaria para organizar y hacer funcionar los servicios sanitarios de forma efectiva y eficiente”. Si bien, todavía nos encontramos con algunos sistemas dispersos y no integrados, de tal forma que hemos tenido que utilizar todas las herramientas de Tecnologías de la Información y la Comunicación (TIC), que actualmente siguen en uso. Tomamos como punto de partida la contabilidad, uno de los instrumentos más importantes con los que cuenta la dirección del hospital para llevar a cabo su gestión. Ya que todos los hechos contables han de ser captados, medidos, valorados y registrados en la contabilidad de gestión; y de ella, conociendo el proceso productivo (Ilustración 18) que se lleva a cabo, cuyo resultado es un producto, que denominamos la salud, que es ofertado a sus “usuarios”, queremos saber el coste de manipulación que se ha medido, en nuestro caso las prótesis de cadera. Dos son, por lo tanto, las “herramientas” que hemos utilizado: la contabilidad financiera y la contabilidad de costes o analítica. Figura 17.- Proceso productivo en un hospital Nuestra metodología de análisis del hospital ha consistido en descomponer el proceso de prestación de servicio en sus componentes más elementales y estudiarlos en detalle, intentando aplicar a cada una de ellos los instrumentos de gestión apropiados. Hemos descompuesto la actividad de operaciones del hospital en dos tipos bien diferenciados, tanto por su relación con los pacientes como en la manera en que los podemos gestionar: 1) Proceso Creación de servicios intermedios. 2) Proceso Clínico de un paciente. 117 En el hospital hay un conjunto de actividades que estando relacionadas con el proceso de diagnosticar o tratar a un paciente se pueden considerar como generadores de productos intermedios que son “ensamblados”, en general por el médico responsable del paciente, para producir el efecto deseado. Como ejemplo la realización de un test de laboratorio. En contraste a los anteriores, hay una serie de procesos que en general se realizan sobre el propio paciente, que no siguen necesariamente un proceso estandarizable. El médico a cargo de un paciente toma decisiones en función de su estado clínico y demanda a los servicios intermedios para conseguir un diagnóstico y, en consecuencia, aplicar una terapia determinada. Sistema de costes orgánicos del Complejo Hospitalario de Badajoz. Llegados a este punto, creo que debemos hacer una serie de introducciones sobre el sistema de costes utilizado en el Servicio Extremeños de Salud, sistema de Costes Completos, que como hemos indicado con anterioridad es un sistema de costes orgánicos que relaciona los inputs con los outputs, a través del análisis de los procesos o secciones. Su formación está en consonancia con la estructura funcional de la empresa y con el diagrama del proceso de producción sanitario. De forma esquemática la secuencia del sistema de costes orgánico es la siguiente: Figura 18.- Sistema de coste orgánico Coste Completo. Fases para su implantación El método del coste completo sostiene que todos los costes en que incurre la empresa para producir deben incorporarse al coste final. Para llegar a la determinación del coste final este método propone el análisis de los costes por naturaleza en costes directos e indirectos. Una vez que los costes por naturaleza se tienen reclasificados en directos e indirectos, los defensores del coste completo proponen que el cálculo del coste final integren todos los costes, tanto directos como indirectos. Es decir todos los costes son elementos del coste final. Los costes indirectos se asignan al coste final a través de algún mecanismo contable de reparto centrado en las secciones. 118 Considera a los efectos del cálculo del coste industrial de un producto, todos los costes (operativos o no, directos o indirectos, fijos o variables), de tal manera que el coste total de fabricar y vender un producto será la suma de todos los costes operativos y no operativos. El método de los costes completos incluye dentro del coste de los outputs todos los costes (directos e indirectos) que están relacionados con la función productiva, con independencia de que estos sean fijos o variables. El sistema de costes completos que se utiliza en el Servicio Extremeño de Salud (SES) aporta una gran calidad de información, esquemáticamente el proceso de conformación del coste sería: Figura 19.- Fases de Implementación del Costes Completo El esquema del proceso se descompone en las siguientes fases (Figura 20): 1. Distinción entre los directos e indirectos respecto al producto. 2. Distinción entre los costes operativos y los no operativos. 3. Reparto de los costes indirectos entre los centros de coste: reparto primario y reparto secundario. 4. Determinación del coste de producción como suma entre: ü Afectación de los costes directos. ü Imputación de los costes indirectos. 119 Gráficamente podemos expresarlo de la siguiente forma: Figura 20.- Proceso de formación de costes de la producción hospitalaria Se entiende por Centro de costes (en adelante Ceco) la unidad mínima de gestión, que se caracteriza por tener una actividad homogénea, un único responsable, una ubicación física, unos objetivos propios, una responsabilidad definida y un código identificativo (Definición extraída del libro «Gestión Analítica - Hacia la Contabilidad Analítica en los Hospitales»; Ministerio de Sanidad y Consumo, noviembre 1991). Los Cecos se clasifican en: 1. Cecos Estructurales: Aquellos que realizan una función de dirección y administración, y no generan un producto definido y facturable. 2. Cecos Intermedios: Aquellos que realizan una función logística y asistencial, que tienen un producto definido y medible, y pueden facturar internamente. 3. Cecos Finales: Aquellos que realizan la actividad principal, es decir, aquellos Cecos realizan la actividad clínica y dan altas. 4. Cecos Intermedios/ Finales: aquellos que por la naturaleza de la actividad que realizan facturan a otros y dan altas, en este caso se encuentran los Cecos de Medicina Intensiva, Urgencias, Diálisis y la Unidad de Hemodinámica. El sistema de costes que utiliza actualmente el Servicio Extremeño de Salud es el de Coste Completo. Con este sistema, el centro sanitario debe obtener el coste medio completo de cada producto con el fin de medir la eficiencia y eficacia de la gestión, comparando los costes con las tarifas del Contrato de Gestión. 120 Es un modelo de costes que se caracteriza por: a. Realizar un análisis de los costes en directos e indirectos. b. Llevar al coste final (Ceco y productos finales) todas las cargas o costes del periodo: i. los costes directos de forma directa. ii. los costes indirectos a través de algún criterio de reparto. c. Recoge tanto los costes de producción como los costes de estructura. De este modelo de costes hay previamente que definir los siguientes conceptos: • Coste: se define como el consumo valorado en dinero de los bienes y servicios necesarios para la obtención de los productos generados en el proceso asistencial y que constituyen el objetivo del centro sanitario. • Consumo, para que exista coste es necesario que exista una aplicación de bienes y servicios a la producción. • Valoración, el coste es una magnitud relativa ya que en su determinación intervienen unos criterios fijados para valorar y medir ese consumo. • Obtención de un producto o Servicio. El proceso de distribución de los costes a los centros de costes es el siguiente: a) Reparto Primario: en esta fase todos los costes de la Contabilidad se tienen que repartir a los distintos Cecos en función del consumo y gasto real realizados por ellos. Se realiza mensualmente una vez periodificado todos aquellos costes que tienen una proyección superior a la mensual. A este proceso se le denomina afectación de costes. Los costes directos se asignan (afectan) a los distintos Cecos de tal forma que ningún coste se quede sin asignar, en función de los recursos consumidos o de un criterio de reparto. La gestión y el destino del gasto del hospital tienen que estar claramente definidos. Quién gasta y no sólo en qué, sino para quién, constituye la fuente de información de la Contabilidad Analítica. b) Reparto Secundario: en esta fase todos los costes de los distintos Cecos se imputan de tal forma que el coste total del hospital esté recogido en los Cecos finales y en el coste de la producción final. A este proceso se le denomina imputación de costes. En esta fase de la Contabilidad Analítica hay que conocer las distintas relaciones existentes entre los Cecos para establecer los criterios de imputación que permitan obtener el coste completo de nuestra producción final. 121 En función de estas fases de la Contabilidad Analítica los costes los clasificaremos en: A. Costes propios o de funcionamiento, son aquellos costes directos o indirectos que han sido asignados a los Cecos en el reparto primario (reparto de costes por naturaleza). Se componen de costes de personal y costes de funcionamiento, estos últimos están constituidos por los costes de bienes y servicios y las amortizaciones. B. Costes repercutidos, aquellos costes imputados de un Ceco a otro Ceco. C. Costes estructurales, aquellos costes imputados de un Ceco estructural, que recogen coste de dirección, administración y otros costes estructurales que figuran en las Unidades de Explotación Analítica (UEA), como por ejemplo el coste de las zonas comunes. Reparto primario: Es necesario reseñar la importancia en la correcta imputación de los costes propios, ya que de ello se influye en la obtención del coste final. Así por ejemplo una incorrecta asignación de los costes de personal al Ceco supone finalmente la obtención de un coste del producto erróneo. Reparto secundario: Una vez que todos los costes están asignados a los Cecos, bien directamente o mediante un criterio de reparto para los costes indirectos, aparece la segunda fase de la Contabilidad de Costes que es la imputación de los distintos Cecos para llegar al coste completo de los mismos y calcular el coste de los distintos productos que se generan en un hospital. Se trata de un sistema de imputaciones recíprocas en la que todos los Cecos pueden repartir sus costes teniendo en cuenta la actividad que se realiza, recogiendo todas la interrelaciones recíprocas que existen entre los Cecos, permitiendo imputar los costes en todas la direcciones; de esta forma, un Ceco que ya ha repartido puede recibir costes de otro y además permite no solo imputar costes a los Cecos estructurales e intermedios, sino también a los finales facturando la actividad de interconsulta. En este proceso todos los costes de los Cecos estructurales, intermedios y los Cecos finales (interconsultas) estarán imputados en los Cecos finales y en la producción final. (Instituto Nacional de la Salud, 2001) 122 Figura 21.- Imputación de costes. Fuente: Geclif, Gestión clínico-financiera, coste por proceso (2001). Instituto Nacional de la Salud, Subdirección General de Coordinación Administrativa. Madrid. En esta fase tiene que quedar claramente definidos qué actividad realiza cada uno de los Cecos (tipo de actividades y cantidad realizada) y quién demanda dicha actividad, por ejemplo, el servicio de Radiología puede haber trabajado para: - Medicina interna Consulta - Traumatología hospitalización - Traumatología consulta - .... Se tendrá que determinar para quién realiza la actividad y qué actividad realiza, para que mediante Unidades relativas de Valor (URV: unidad que mide la complejidad y por lo tanto el consumo de recursos en función de una ponderación aplicada a cada tipo de producto en base a su coste) repartir el coste de este servicio a los servicios para los que trabaja. Por tanto existirán: • Ceco Proveedor del servicio • Actividad realizada: se especifica el tipo de actividad que realiza el Ceco proveedor, es decir los distintos productos en función de un catálogo y la cantidad realizada de cada producto. • Ceco demandante de la actividad y a los que se va a facturar. Una vez terminada la fase de imputación todos los Cecos recogen su coste completo, desglosado en costes propios o de funcionamiento, repercutidos y estructurales. 123 Total 2010 COSTES PROPIOS 215.878.085,29 € REPERCTIDO DE INTERMEDIOS 107.557.916,68 € REPERCUTIDOS DE ESTRUCTURALES 17.398.376,69 € REPERCUTIDOS A FINALES POR SUBREPARTO 1.053.633,99 € TOTAL COSTES PRIMER SEMESTRE 339.780.744,67 Tabla 36.- Costes totales gerencia de área de salud de Badajoz. primer semestre 2010 Fuente: Sistemas de Información. Gerencia Área de Salud de Badajoz. Datos a 19/09/2012. Análisis de la Producción Hospitalaria: Clasificación de la Producción Hospitalaria El fin de la Contabilidad Analítica es calcular el coste de la producción como en cualquier tipo de empresa, ya que con este indicador se puede medir la eficiencia y la eficacia de la gestión hospitalaria. La peculiaridad que tiene la empresa sanitaria es la gran variedad de servicios y muy diferentes; por ello, se la considera una empresa multiproducto. La dificultad de calcular el coste de cada uno de los productos que se realizan en un hospital, viene marcada previamente por la determinación o el conocimiento de los diferentes productos ya que la oferta de los mismos es muy extensa, existiendo servicios fácilmente identificables y otros, que por su naturaleza no se pueden identificar con tanta facilidad; así por ejemplo, una exploración radiológica es un producto tangible, no siendo tan fácil la identificación de la atención del cuidado de enfermería o la actividad docente. Existen diferentes clasificaciones de la producción hospitalaria, atendiendo al tipo de Ceco que realiza la producción y a la actividad que figura y se financia en el Contrato de Gestión de los hospitales, la producción se puede clasificar en: 1. Producción Intermedia: aquella que realizan los Cecos intermedios y que se realiza a petición del servicio responsable del paciente, esta se puede clasificar en: • Producción Logística, Menús, Kg. de ropa lavada, ... • Producción de diagnóstico y tratamiento: exploración radiológica, prueba de laboratorio, intervención quirúrgica… • 124 2. Producción Final: aquella que con carácter general es realizada por los Cecos finales, generándose un alta hospitalaria. Esta se puede clasificar atendiendo al marco del Contrato de Gestión en: § Actividad Hospitalizada § Actividad Ambulatoria § Actividad de Procedimientos extraídos § Actividad Docente. § Actividad Investigadora En la Gestión Analítica es necesario que el sistema de información del hospital registre la actividad que se genera en cada uno de los Cecos y su unidad de medida con el fin de calcular el coste de cada uno de los productos y medir la eficiencia en cada uno de los servicios que constituyen el organigrama del hospital. De ahí la importancia de unificar la descripción de los productos y sus unidades de medida. Coste por Producto. Indicadores de Complejidad. Para obtener el coste medio de los productos intermedios y de los productos finales necesitamos de los datos que proporciona la Gestión Analítica. Obtenido el coste total por Ceco e identificada su producción, podemos calcular el coste medio por producto en cada una de los Cecos intermedios y finales. El coste medio se obtiene aplicando la siguiente fórmula: COSTE MEDIO PRODUCTO = COSTE DEL CECO / PRODUCCIÓN TOTAL DEL CECO Pero la mayoría de los servicios intermedios y finales realizan una prestación de servicios muy variada y con distinta complejidad, por lo que la tendencia actual es el agrupar las distintas prestaciones en grupos o productos homogéneos en función de la técnica y el consumo de recursos similares. Para el cálculo de costes de cada grupo o producto en los servicios intermedios se utiliza la URV que mide la complejidad de la producción y el consumo de recursos en función de la aplicación de una ponderación aplicada a cada tipo de productos. Las características de la URV son las siguientes: A. Es un instrumento que relaciona el esfuerzo de trabajo en un Ceco con la producción del mismo. B. Es una medida de la producción C. Mide los costes de la producción basándose en el sistema de coste completo. D. D. Mide la complejidad de la producción realizada. 125 Esta herramienta nos sirve para facturar internamente mejorando la imputación de costes entre los Cecos y servicios. Por ejemplo para obtener el coste medio de una prueba de Anatomía Patológica necesitamos el coste completo del Ceco de Anatomía Patológica, el Catálogo de productos de dicho servicio y la producción realizada por cada tipo de prueba. Así el coste de la Citología se obtiene: COSTE CITOLOGIA = COSTE DEL CECO DE ANATOMIA PATLOGICA x URV Citología/ N.º TOTAL DE URV para P (i.................n) Siendo P(i.....n), los distintos tipo de productos realizados. El coste de la producción final se analiza teniendo en cuenta los diferentes productos que se realizan en las diferentes áreas de producción (hospitalización, consultas, etc.): El coste medio de la producción realizada por los distintos Cecos de hospitalización se obtiene en función de la Altas hospitalarias. Dicho coste se obtiene: COSTE MEDIO ALTA = COSTE CECO DE HOSPITALIZACION / N.º DE ALTAS TOTALES La medición de la complejidad de dicha actividad se obtiene a través de la UCH (Unidad de Complejidad Hospitalaria). La UCH es la unidad de medida de la actividad de hospitalización que permite medir el case-mix hospitalario y pondera en términos relativos la complejidad de la patología en pacientes ingresados. La UCH se obtiene a partir del conjunto mínimo básico de datos (CMBD) de las altas codificadas a las que se le aplica el programa de clasificación de pacientes Grupo Relacionados con el Diagnóstico (GRD) sistema que nos permite medir en términos relativos el consumo de recursos de cada uno de los pacientes dados de alta en función del peso medio que asigna el programa a cada uno de los GRD. La UCH es un elemento de financiación, y a la vez una herramienta de gestión, cuyas principales características son: 1. Es una unidad exclusivamente del área de hospitalización, aunque también se utiliza como ya se ha puesto de manifiesto para las intervenciones ambulantes. 2. Tiene significación clínica, se adapta mejor al lenguaje clínico. 3. Precisa la cumplimentación del CMBD y la aplicación del programa GRD 4. Es sencilla obtener y de utilizar 126 Sistema de Clasificación de Pacientes La función del hospital es la prevención y cuidado del paciente. Pero cada paciente es diferente a otro y por lo tanto es diferente su proceso, aunque tenga la misma enfermedad; pero hay otros motivos que hacen diferente un mismo proceso en distintas personas, como puede ser la edad, sexo, si se le realiza un procedimiento quirúrgico o tiene co–morbilidades asociadas. No obstante, no debemos olvidar que el producto hospitalario es un paciente, al que el médico le aplica un tratamiento clínico. La medición a este nivel se vuelve más compleja, debido a que, por una parte se pretende valorar el conjunto de actuaciones llevadas a cabo a un paciente, y por otra parte nos encontramos con un volumen muy elevado de diferentes pacientes por lo tanto de diferentes productos. Este problema se pretende mitigar a través de Sistemas de Clasificación de Pacientes. La búsqueda de Sistemas de Clasificación de Pacientes adecuados a la necesidad de medición de la producción hospitalaria ha sido objeto de un gran número de investigaciones en las últimas décadas. Como resultados de ellas, existen en la actualidad diferentes sistemas que han sido aceptados para medir la producción hospitalaria, sobre todo para pacientes ingresados. Los criterios de clasificación dependen del objetivo para el que vaya a usarse. Hay clasificaciones que se basan en grupos de iso-diágnostico cuya variable principal es el diagnóstico principal, otros se basan en iso-enfermedad que incluye todo el tipo de variables que pueden determinar diferencias entre pacientes con un mismo diagnóstico, por último otros se basan en iso–consumos por lo que hacen diferentes a los pacientes en función del consumo de recursos. El sistema de clasificación de pacientes elegido por el Servicio Extremeño de Salud para la medición de su actividad hospitalaria ha sido el de los Grupos Relacionados por el diagnóstico, que son los más extendidos y además, es el sistema de clasificación elegido para medir la producción en pacientes ingresados. Los Grupos relacionados con el Diagnóstico, Diagnostic Related Groups (GRD) fueron desarrollados en la Universidad de Yale a través de una larga investigación iniciada en los años 60 para facilitar una mejora de la calidad de la asistencia sanitaria. El propósito inicial era medir el rendimiento de un hospital. Para medir el rendimiento de un hospital se podría únicamente contar pacientes, pero de esta manera no se asimilarían casos muy complejos (trasplante de corazón) con casos de menor complejidad (apendicetomía). Los GRD permiten valorar la importancia significativa de los distintos tipos de casos. 127 Constituyen un sistema de clasificación de pacientes hospitalarios en función de las clases de consumos de recursos. Para ello utilizaron información estadística basada en registros hospitalarios procedentes de diferentes hospitales, analizando los costes en cuanto a consumo de recursos. La definición de tipos casos era el objetivo perseguido por los autores de los GRD. En cada uno de los casos se esperaba que los pacientes recibieran una cantidad similar de servicios hospitalarios. Los requisitos de clasificación definidos previamente por los propios autores fueron: - Tenían que ser médicamente interpretables, con grupos de clases diagnósticas homogéneas. Establecer un lenguaje común entre los diversos estamentos hospitalarios (médicos, administradores y gestores). Por otra parte, se pretendía también implicar al médico en las consecuencias económicas de sus actos y su implicación en los costes hospitalarios. - La clasificación se debería obtener a partir de la información comúnmente disponible en los hospitales. - - La clasificación debería dar lugar a un número limitado de clases, preferentemente unos pocos centenares, con la condición de que fueran exhaustivos y mutuamente excluyentes. Había que cubrir todas las posibilidades, pero también evitar solapamientos entre clases. - Cada grupo o clase debería contener pacientes con un consumo de recursos hospitalarios esperado de cuantía similar. - La definición de clases tenía que ser comparable a través de los diferentes sistemas de codificación. La metodología utilizada por los autores se basó simultáneamente en el juicio médico y en el análisis estadístico de los datos, fijando en número final de clases a aceptar a priori en 500. Se usaron unos paneles médicos para determinar las Categorías Diagnósticas Mayores (CDM) y establecer unas jerarquías entre los procedimientos quirúrgicos dentro de cada categoría. Para ello se partió de la Clasificación Internacional de enfermedades (ICD-9-CM). En una primera versión se obtuvieron 83 CDM, posteriormente se redujo a 23, existiendo actualmente 25. Se procedió a un análisis estadístico de registros de altas hospitalarias entre las diversas variables disponibles y el consumo de recursos, como variable a explicar. 128 Por tanto, los GRD es un sistema de clasificación de pacientes que clasifica a los pacientes hospitalarios en grupos homogéneos en cuanto al consumo de recursos. En realidad, se trata de un programa informático que alimentado con datos de los pacientes dados de alta de un hospital es capaz de clasificarlos en grupos. En cada grupo se clasifican pacientes clínicamente similares y con parecido consumo de recursos (OSAKIDETZA, 2010). La información que necesita el sistema GRD para clasificar cada paciente está contenida en el Conjunto Mínimo Básico de Datos (CMBD) que, a raíz de la decisión del Consejo Interterritorial de 14-12-1987, después regulada por las Comunidades Autónomas, es obligatorio recoger en todo paciente ingresado en un hospital. En nuestra Comunidad Autónoma se reglamentó mediante “Orden de 4 de marzo de 2005 por la que se regula el Conjunto Mínimo Básico de Datos (CMBD) al Alta Hospitalaria y Cirugía Mayor Ambulatoria y la Unidad Técnica de referencia CIE 9 MC de la Comunidad Autónoma de Extremadura”. Los datos del CMBD contienen, en nuestra Comunidad, 21 variables al alta hospitalaria para pacientes ingresados; dichas variables son las siguientes: 1. Identificación del centro 2. Número de la historia clínica 3. Código de identificación del paciente 4. Fecha de nacimiento 5. Sexo 6. Residencia 7. Procedencia del ingreso (domicilio, residencia de ancianos, hospital, etc.) 8. Financiación de la asistencia prestada 9. Fecha de ingreso 10. Circunstancia del ingreso 11. Identificación del médico responsable del alta 12. Identificación de la unidad, sección o servicio que da el alta. 13. Fecha de alta 14. Fecha de intervención 15. Diagnóstico principal 16. Otros diagnósticos 17. Procedimientos (obstétricos, intervención quirúrgica, procedimientos diagnósticos y/o terapéuticos que conlleven riesgo para el paciente) 18. - Códigos M (Código de Morfología Neoplasias). 19. Circunstancias de alta 129 20. Identificación del lugar de destino (incluye la codificación de los centros y residencias sociosanitarias, psiquiátricos) 21. Semanas de gestación en partos El agrupador de los GRD utiliza un algoritmo para clasificar a los pacientes dados de alta a un GRD, teniendo en cuenta las siguientes variables: ü Edad (la calcula con la fecha de nacimiento y la fecha de ingreso) ü Sexo ü Circunstancias del alta (si el paciente está vivo o fallecido, se traslada a otro hospital o ha sido alta voluntaria) ü Diagnostico principal (el motivo del ingreso) ü Intervenciones u otros procedimientos realizados durante el ingreso ü Diagnósticos secundarios que coexisten con el principal en el momento del ingreso o se desarrollan durante el mismo. El diagnóstico principal tiene que ajustarse a la definición «condición que, al finalizar el proceso de hospitalización, se considera la causa responsable del ingreso del enfermo en el hospital». Los diagnósticos sucesivos son todos aquellos presentes en el paciente en el ingreso o en el proceso de hospitalización. Los procedimientos pretenden recoger todas las actividades asistenciales realizadas durante la estancia hospitalaria, en el caso de la existencia de diversos procedimientos se utiliza para la clasificación el más complejo según la jerarquía preestablecida. La agrupación GRD es única y excluyente de forma que cada paciente (en realidad, cada episodio de hospitalización) se clasifica en un único GRD que queda descrito por: - Un número - Un título que pretende ser descriptivo de su contenido - Una indicación de si es un GRD médico o quirúrgico - Un peso que pondera el consumo de recursos necesarios para asistir ese tipo de pacientes. El peso es fijo y se calculó en función de los recursos reales consumidos en una base de datos histórica. Se han realizado diferentes revisiones y actualizaciones sobre los GRD, siendo hasta la fecha el sistema de medición hospitalaria más potente y utilizado. Su desarrollo se ha visto favorecido por dos causas: el hecho de recoger datos de los resúmenes de alta y no de las historias clínicas, y haber seleccionado el iso-consumo de recursos como criterio de división, aspecto que permite un mejor acercamientos al estudio de los costes del hospital. 130 Actualmente se utiliza entre otros usos para la comparación entre hospitales a través de una amplia gama de recursos y de medidas de resultados o como base de gestión interna y de sistemas de planificación. Este sistema de clasificación de pacientes nos permite obtener un grupo limitado de procesos que cubren todo el abanico de pacientes y de casuística, de fácil manejo, y que permite de forma estandarizada la comparación entre hospitales, así como el cálculo del coste de cada uno de los procesos atendidos. “Los Grupos Relacionados por el Diagnóstico (GRD) es un sistema de clasificación de pacientes ampliamente difundido en los hospitales españoles de igual forma que en otros países de nuestro entorno. Los GRD sirven para conocer la casuística hospitalaria y son de gran utilidad en la gestión y en la financiación de los hospitales”. “Los GRD clasifican a los pacientes atendidos en grupos homogéneos en función de la patología atendida y los consumos de recursos” Metodología en el Cálculo del Coste por Procesos A. Conceptos Previos Antes de comenzar con el desarrollo de la metodología del cálculo de coste de los distintos procesos que se generan en el hospital, es necesario definir unos conceptos previos que son fundamentales para conocer el escenario en el que se basa la metodología: (a) Producto: Se entiende por producto los distintos tipos de procedimientos realizados por los distintos servicios y que constituyen el catalogo de productos de cada uno de los servicios del hospital (Citología, prueba analítica, tórax P-A...). (b) Episodio: Se entiende por episodio a la unidad mínima de contacto de un paciente con un servicio o Ceco en un área de actividad del hospital para demandar uno o varios productos hospitalarios. Dicho episodio se registra en el sistema de información del hospital a través de un número vinculado a su historia clínica (c) Proceso: Se entiende por proceso al conjunto de uno o varios episodios generados por el tratamiento de un paciente en las distintas áreas de actividad del hospital, hasta su alta. (d) Coste por Paciente: Se entiende por coste por paciente el sumatorio de los costes generados en los distintos episodios hasta su alta en hospitalización o en el área ambulatoria. Así, un paciente que es atendido en Urgencias y es ingresado y dado de alta en Medicina Interna, ha generado dos episodios; por lo tanto, el coste del paciente se obtiene por la acumulación de los costes de los dos episodios. 131 (e) Coste Por Proceso: Se entiende por coste por proceso el coste medio de los pacientes dados de alta en un determinado GRD, tanto para pacientes hospitalizados, como para pacientes con procedimientos de cirugía ambulatoria. Sistema de Cálculo del Coste por Proceso Como ya se ha puesto de manifiesto a lo largo del trabajo el sistema de cálculo de costes por proceso utilizado en el SES es el de Costes Completos, de tal forma que el coste de un proceso estará compuesto de sus costes directos, obtenidos en función de los consumos de recursos generados por la atención sanitaria, costes repercutidos de otros servicios y costes estructurales del propio servicio que atiende al paciente. La unidad mínima de costes es el paciente a través de su episodio clínico, asignando e imputando los distintos costes que se generan en el tratamiento y cuidado de un paciente a su episodio clínico. Para obtener el coste de cada paciente en el hospital es necesario tener en cuenta las siguientes fases: (a) Asignación directa de unos recursos (Prótesis, medicamentos…) (b) Imputación de los productos generados por su tratamiento (Exploración Tórax, Pruebas Analíticas…) (c) Imputación del resto de costes del Ceco responsable del paciente utilizando un criterio de imputación Para ello el sistema de información del hospital tiene que cumplir una serie de requisitos: • Sistema de información integrado que recoja el episodio clínico en todos los servicios (Admisión, Radiodiagnóstico, Quirófanos…) • Vinculación de la información asistencial y económica no solo al episodio clínico sino además al Ceco. • Integración de la Gestión Analítica en el sistema de información del hospital. Coste Por Proceso-GRD. El coste por proceso es el resultado de obtener el coste medio de todos los pacientes que han sido dados de alta en un determinado GRD. El coste por proceso a partir de los GRD se basa en las siguientes características: 1. Se obtiene a partir de las altas codificadas. 2. Se descuenta el coste generado por los pacientes dados de alta sin codificación de su proceso y de los pacientes en curso (pacientes ingresados) 132 El sistema de coste por GRD, basado en la asignación de recursos al episodio clínico, nos proporciona información en los siguientes niveles: A. Nivel paciente: Detalla el coste de los recursos generados en cada uno de los pacientes que han sido dados de alta, en los distintos GRD. B. Nivel servicio: Detalla el coste medio de cada uno de los GRD, en los distintos servicios del hospital, así como su detalle de costes. C. Nivel hospital: Detalla el coste medio global de cada uno de los GRD en el centro hospitalario. El análisis de los costes por GRD nos permite conocer: 1. Los recursos asignados al proceso. 2. La complejidad de los distintos pacientes en los distintos servicios. 3. La variabilidad de la práctica clínica. El avance en el sistema de información y la mejora en el cálculo de costes van a permitir a la organización: 1. Impulsar la gestión clínica y la gestión por procesos. 2. Establecer un sistema de financiación basado en tarifas individualizadas por GRD. 3. Medir la eficiencia a través de la cuenta de resultados, reflejando el beneficio o la pérdida en cada uno de los procesos, tanto en procesos hospitalizados como en ambulantes. Estimación Del Coste Por Proceso El coste por proceso mediante la asignación de consumos y productos al paciente, como hemos visto en los puntos anteriores, requiere de un sistema de información integrado y cuyo núcleo principal es el episodio. No obstante, no todos los hospitales pueden utilizar en la actualidad dicha metodología, por ello, se establece un sistema de cálculo estimado por proceso en función de los pesos medios de cada GRD (modelo Top-Down). Este método tiene como objetivo calcular el costo total medio de cada GDR que ofrece el hospital. Para ello, es necesaria la siguiente información: a) Información del alta del paciente suficiente para asignarlo a un GDR y determinar la duración de la estancia. b) Información de los Servicios de Apoyo prestados al paciente durante su estancia, tales como servicios de laboratorios. Con esta información se asigna los costes de los servicios de apoyo a cada uno de los pacientes. 133 c) Criterios de distribución de los costes comunes de los Servicios Generales (que son sólo Centros de Costes Iniciales) al resto de las unidades médicas, de diagnóstico y de apoyo El método “top-down” puede describirse en tres etapas. La primera consiste en asignar los costes directos a los Centros de Costes (en adelante CeCo) Iniciales. La segunda etapa consiste en distribuir los costes comunes o indirectos de los Servicios Generales a los Centros de Costes Finales y en calcular los costes de los Centros de Costes Finales. La tercera etapa consiste en calcular los costes medios totales de los pacientes en cada GDR. La asignación de los costes directos a los Centros de Costes Iniciales no ofrece ninguna dificultad porque se trata de los esfuerzos económicos realizados por cada uno de estos centros para cumplir con sus actividades. Son costes inequívocamente vinculados a los Centros de Costes Iniciales. Esta asignación no presenta diferencias, al menos significativas, con la metodología tradicional. En la segunda etapa, los costes de los Servicios Generales deben distribuirse a los Centros de Costes Finales por ser comunes a todos ellos. Cuando existan prestaciones recíprocas entre diversas unidades de Servicios Generales, será conveniente repartir sus costes entre ellas primero. Una vez realizada la distribución recíproca anterior, los costes de las unidades de Servicios Generales se distribuyen a los Centros de Costes Finales. Es conveniente realizar este reparto de costes indirectos siguiendo la propuesta realizada por el Método de Cálculo de Costes por Actividades (ABC). De esta forma los costes se distribuyen según los generadores o inductores de costes que se definan para cada actividad. Es decir, los costes de las unidades de Servicios Generales se distribuyen según el indicador que resulte más representativo del número de veces que el Centro de Costo Final realizó transacciones con la unidad de Servicio General cuyos costes se están distribuyendo. La distribución de costes indirectos por el método ABC contribuye a mantener en el sistema de costes la visión de organización por procesos, considerando que el objetivo que se quiere alcanzar es el de calcular el costo medio total por GDR, y que cada GDR constituye un proceso en el que se realizan diagnósticos y tratamientos. Una vez realizada la distribución de costes indirectos se calculan los costes totales de los Centros de Costes Finales. De esta forma, cada Centro de Costes Finales sumará sus costes directos y los costes indirectos que le fueron asignados por distribución. Finalmente, en la tercera etapa se calculan los costes de cada paciente en cada GDR. Para ello, es necesario disponer de la información sobre los servicios prestados al paciente y el GDR al cual fue asignado. El número de servicios prestados al paciente es la variable dependiente y se mide por datos estadísticos como la estancia (también puede utilizarse la facturación o las unidades relativas de valor). 134 El costo total de un período de cada Centro de Costo Final se divide por el número de unidades producidas (servicios prestados) durante el período. Se obtiene, así, el costo unitario del servicio. Luego, el costo del paciente en un Centro de Costes Finales se obtiene multiplicando el costo unitario del servicio por el número de veces que lo ha consumido el paciente. La suma de los costes del paciente en cada Centro de Costo Final que configura un GDR da por resultado el costo medio total del paciente de un GDR. La suma de los costes medios totales de todos los pacientes atendidos durante un período en un GDR da como resultado el costo total del GDR durante el período. Este es el caso del Servicio Extremeño de Salud, en el que no se obtiene el coste por paciente, sino que se estima el coste por proceso mediante este método. La aplicación de este sistema de cálculo necesita partir de la siguiente información: • Coste del Ceco de Hospitalización del Servicio o del Ceco Ambulatorio, como es el caso de este análisis. • La casuística atendida por dicho servicio en los distintos GRD Según este método, el coste por proceso se obtiene a partir de la siguiente fórmula: Coste GRD (i) = Coste Ceco de Hospitalización-Ambulatorio (j) * Peso GRD (i) Altas (j) * Peso medio del Ceco o servicio (j) Siendo: (j) un determinado Ceco de hospitalización (i) el número del GRD (1......n) Para repartir los costes de un centro de costes de hospitalización se necesita conocer la casuística atendida, es decir, las altas por GRD y sus pesos medios. De tal forma que el coste por Centro de costes, del que previamente se ha extraído el coste de los pacientes sin codificar y los pacientes en curso, se imputa de forma proporcional a los pesos medios de todos los pacientes que han sido dados de alta en ese Centro de Costes o servicio. Es un sistema de cálculo estimado, que depende del grado de calidad de los datos de costes de hospitalización y de la calidad y el nivel de codificación del CMBD. El cálculo de coste por proceso en función de los pesos medios por GRD se caracteriza: a. Es un modelo sencillo de aplicar. b. Todos los hospitales pueden utilizar dicho sistema ya que el software del Módulo de costes de Jara lo realiza automáticamente. c. El cálculo del proceso se realiza con la misma metodología de la financiación de la actividad de hospitalización de nuestros hospitales 135 d. Este modelo está sujeto a la precisión de los pesos asignados a cada uno de los GRDs. Un detalle que hay que añadir para evaluar la precisión de este modelo, es que la eficiencia o ineficiencia en el tratamiento de determinados pacientes, condiciona los resultados del resto. Así, unos costes elevados en un Ceco o Servicio generados por el tratamiento en un determinado tipo de pacientes, son distribuidos a todos los GRD en función de los pesos de cada uno de ellos y por lo tanto el coste de todos sus GRD estará infravalorado o sobrevalorado. Los hospitales deben de ir avanzando en el desarrollo de su gestión clínico financiera y por lo tanto, deben sustituir este sistema estimado de cálculo por GRD por un sistema basado en la asignación de recursos al paciente. 4.2.- El Servicio Extremeño de Salud (SES) Para el cálculo del coste del proceso de implantación de prótesis de cadera en el Área de Salud de Badajoz vamos a seguir dos caminos paralelos. El primero de ellos nos llevará por la senda del tratamiento de los datos de forma automatizada, es decir, con escasa manipulación de los datos obtenidos de los sistemas de información del Servicio Extremeño de Salud. Y un segundo camino, mediante del tratamiento manual de la información disponible a través de la toma de la misma de distintas fuentes, todas ellas fiables y dentro del propio Servicio Extremeño de Salud. Siguiendo las pautas marcadas para la obtención del cuadro de mando del área. Camino A.- Nuestro proceso de cálculo comienza con la descarga de los costes de las prótesis recogidos en las cuentas contables a las que se imputan, de los centros de costes de Traumatología Hospitalización y de los quirófanos de Traumatología, ya que en el SES, las prótesis se imputan no al servicio final, sino al quirófano de Traumatología. Posteriormente se realiza un reparto de dichas cuentas contables y de los quirófanos de Traumatología a los Cecos finales de hospitalización. 136 También debimos conocer si desde el Servicio de Suministro, en el proceso de petición de las prótesis, se registraba el número de Historia Clínica (CIP), o identificación del paciente al que se le ha implantado la prótesis. La respuesta fue positiva, indicándonos la transacción correspondiente en JARA. Si bien es preciso comentar, que tal registro, se realiza manualmente por el personal adscrito a dicho servicio de suministros, pudiendo con ello producirse errores de transcripción. Se procedió a la unión de los datos asistenciales con los datos de la contabilidad, pues el CIP no existe en esta última, si bien sí incluye la fecha de la intervención, por lo que fue preciso un cruce de datos entre ambas bases de información: Base de datos relacional de datos de contabilidad y asistenciales. Con lo que obtuvimos el coste de la prótesis por paciente en cada uno de los ejercicios. El siguiente paso en nuestro proceso de cálculo del coste PTC, consistió en el conocimiento del coste por GRD de cada uno de los años, utilizando el modelo Top-Down. Lo cual nos llevó a analizar una gran cantidad de información procedente de informes de JARA Económico Financiero. 1.- Indicadores Clínico-Económicos. Centro de Coste 011TRAH 011TRAH 011TRAH 011TRAH Resultado Total Ejercicio Altas Reales Días Estancia Coste GRD Coste Proceso Coste UCH Coste Estancia 2009 2.351 16.892 13.156.375,32 21.383,76 2.466,88 765,92 2010 2.478 17.806 12.321.235,50 20.441,63 2.446,97 641,23 2011 2.390 16.727 13.438.851,53 21.142,39 2.843,83 771,59 2012 2.393 15.610 12.406.425,41 21.115,90 2.642,79 761,52 9.612 67.035 51.322.887,76 21.020,92 2.600,12 735,07 Tabla 37.- Indicadores Clínico-Económicos de los años 2009-2012. 2.- Indicadores Clínicos-Económicos de Hospitalización por GRD. Hay que averiguar cuál era el GRD asociado a estos tipos de intervención. Siempre con la seguridad de tener claro el concepto de código de procedimiento: - 81.51: Sustitución Total de Cadera. PTC. - 81.52: Sustitución Parcial de Cadera. PPC. Desgraciadamente no hay una relación unívoca entre los códigos de procedimiento y los GRD, ya que el paciente puede tener distintos códigos de procedimiento, no sólo uno, que le lleve a incluirse en un GRD o en otro. También se solicitaron los CMBD de los años 2009 a 2014, que incluyeran los códigos de procedimiento con el fin de poder realizar un estudio de calidad de los datos de los que disponíamos, siendo el resultado óptimo. 137 Tras nuestro análisis se analizaron los GRD 817 y 818: 817: Revisión de sustitución de cadera o sustitución de cadera por complicaciones. Es un GRD quirúrgico que agrupa a dos tipos de pacientes: A. Los ingresados por una enfermedad o traumatismo musculoesquelético a los que se les ha practicado una revisión quirúrgica de una prótesis de cadera previamente implantada. B. Los ingresados por una complicación (como artritis séptica de miembro inferior, fractura patológica de fémur, tibia o peroné o bien por una complicación mecánica, infección o inflamación u otra complicación de una prótesis articular u otro dispositivo ortopédico interno) a los que se les ha implantado durante el ingreso actual una prótesis parcial o total de cadera o una artroplastia de recubrimiento de cadera. La mayoría de los pacientes que se clasifican en este GRD son los ingresados por una complicación mecánica o infecciosa de una prótesis de cadera previamente implantada a los que se les practica una revisión quirúrgica de la misma. GRD 818. Sustitución de cadera excepto por complicaciones. Es un GRD quirúrgico que agrupa a pacientes ingresados por una enfermedad del sistema musculoesquelético y tejido conectivo excepto complicaciones (como artritis séptica de miembro inferior, fractura patológica de fémur, tibia o peroné o bien por una complicación mecánica, infección o inflamación u otra complicación de una prótesis articular u otro dispositivo ortopédico interno) a los que se les ha implantado durante el ingreso actual una prótesis parcial o total de cadera o una artroplastia de recubrimiento de cadera. Básicamente clasifica a los pacientes que, no habiendo ingresado por una complicación de una prótesis articular previamente implantada, se les implanta una prótesis de cadera. Los motivos de ingreso más frecuentes son coxartrosis o fractura de cadera. Por lo que a partir de este momento nos centramos en este último GRD, procediendo a sacar el informe ICE de hospitalización por GRD, que nos indica el acumulado de costes, tanto propios como repercutidos, además de los ajustes hechos en Contabilidad Analítica, obteniendo la siguiente información: 138 Ejercicio Centro de Coste 2009 011TRAH 2010 011TRAH 2011 011TRAH 2012 011TRAH Resultado Total GRD 818 818 818 818 Texto para GRD Altas Estancias Coste Total Coste Proceso Coste UCH Coste Estancia Sustitución de Cadera Excepto por Complicaciones 156 1.642 1.551.990,25 9.832,54 2.536,80 934,15 Sustitución de Cadera Excepto por Complicaciones 163 1.937 1.408.238,27 8.930,77 2.475,87 751,53 Sustitución de Cadera Excepto por Complicaciones 141 1.428 1.406.125,14 10.168,61 2.819,12 1.004,04 Sustitución de Cadera Excepto por Complicaciones 155 1.519 1.420.177,46 9.296,25 2.577,35 948,80 615 6.526 5.786.531,12 9.557,04 2.602,29 909,63 Tabla 38.- GRD 818 de los años 2009 a 2012 Por otro lado mediante transacciones de Contabilidad Analítica, se realizó un informe sobre los costes propios y repercutidos del Servicio de Traumatología por Áreas de Producción, que incluyen consultas externas, hospitalización, ambulatoria, docencia e investigación. Ejercicio Costes de Personal Total Costes Funcionamiento Receta Médica Amortización Total Costes del Servicio. Costes Directos Costes Utilización Otros Servicios Costes Estructurales Costes Totales 2009 Consultas Externas 870.991 98.637 890.713 20.187 1.880.528 2.059.430 160.117 4.100.075 Hospitalización 1.691.711 3.208.833 Cirugía Ambulatoria 562 4.498 4.905.041 7.914.398 200.726 13.020.165 1.315 1.877 400.837 175 402.889 Docencia 142.557 17 1.050 143.590 914 12.341 156.845 investigación 109.312 13 779 110.077 699 9.436 120.213 Tabla 39.- Costes totales del año 2010. Camino A Ejercicio Costes de Personal Total Costes Funcionamiento Receta Médica Amortización Total Costes del Servicio. Costes Directos Costes Utilización Otros Servicios Costes Estructurales Costes Totales 2010 Consultas Externas 867.083 103.946 1.050.919 17.487 2.039.435 1.718.036 138.103 3.895.574 Hospitalización 1.633.558 3.441.369 Cirugía Ambulatoria 8.123 5.894 5.080.820 6.461.703 168.493 11.711.016 870 8.994 227.016 1.233 237.243 Docencia 139.781 957 140.738 470 10.414 151.622 investigación 105.568 738 106.306 359 7.961 114.626 Tabla 40.- Costes totales del año 2009. Camino A Ejercicio Costes de Personal Total Costes Funcionamiento Receta Médica Amortización Total Costes del Servicio. Costes Directos Costes Utilización Otros Servicios Costes Estructurales Costes Totales 2011 Consultas Externas 1.009.033 144.855 1.005.190 14.255 2.173.333 1.665.293 143.837 3.982.463 Hospitalización 1.655.760 3.617.137 Cirugía Ambulatoria 8.406 4.172 5.277.070 7.615.324 169.108 13.061.502 Tabla 41.- Costes totales del año 2011. Camino A 139 865 9.271 231.439 1.170 241.880 Docencia 144.297 953 145.251 505 9.444 155.200 investigación 111.746 532 112.278 397 7.429 120.104 Ejercicio Costes de Personal Total Costes Funcionamiento Receta Médica Amortización Total Costes del Servicio. Costes Directos Costes Utilización Otros Servicios Costes Estructurales Costes Totales 2012 Consultas Externas 939.828 153.209 1.220.176 9.665 2.322.878 3.093.959 129.867 5.546.704 Hospitalización 1.614.503 3.418.065 Cirugía Ambulatoria 7.783 25.786 5.058.355 6.859.694 171.140 12.089.188 Docencia 141.303 512 8.295 278.557 382 287.235 297 141.600 228 6.917 148.744 investigación 114.697 432 115.130 183 5.572 120.885 Tabla 42.- Costes totales del año 2012. Camino A Pero observamos que los costes de la consulta de anestesia y los costes radiológicos se imputan al área de producción de consultas externas, con lo que el coste calculado para el GRD disminuye y se incrementa el coste para las consultas externas de Traumatología. Todo ello motivado por ser el médico en consulta externa el peticionario de la consulta de anestesia y de las radiografías. Con ello obtuvimos: Ejercicio 2009 2010 2011 2012 Resultado Total Consultas Primeras 13.879 12.981 11.789 14.817 53.466 Consultas Sucesivas 26.612 26.704 30.586 32.486 116.388 Coste Total Coste Con. Primera 4.100.074,87 137,37 3.895.574,24 134,31 3.982.462,59 132,13 5.546.703,81 161,67 17.524.815,51 141,37 Coste Con. Sucesivas 82,42 80,59 79,28 97,00 84,82 Coste Producción 295,42 300,10 337,81 374,35 326,92 Tabla 43.- Costes de las consultas. 818: Sustitución de cadera total o parcial excepto por cc Coste e stancia Coste proceso Coste UCH 2009 2010 934,15 9.832,54 2.538,80 Tabla 44.- Costes GRD 818 140 751,53 8.930,76 2.475,87 2011 1.004,40 10.168,61 2.819,12 2012 948,59 9.296,25 2.577,35 Camino B.- Como hemos comentado en otras ocasiones el sistema actual que utiliza el Servicio Extremeño de Salud, no permite calcular el coste por paciente, se pretende realizar este cálculo de manera manual, sumando los costes que se podrían aplicar de forma directa a la intervención, esto es: 1. Coste de la consulta externa de Traumatología. 2. Coste de la analítica preoperatoria. 3. Coste de las pruebas radiológicas. 4. Coste del quirófano 5. Coste de la anestesia 6. Coste del cirujano/s que realizan la intervención 7. Coste de la estancia 8. Coste de la Farmacia 9. Coste de la Rehabilitación Partimos de la descarga del libro registro quirúrgico de los códigos de procedimiento 81.51 y 81.52, al que iremos añadiendo los costes parciales obtenidos. 1.- Coste de la consulta externa de traumatología. Consultas de Traumtología sin Rad ni Cons Anes Coste Consulta Primera Coste Consulta Sucesiva 2009 2010 104,14 62,48 103,37 41,35 2011 106,09 63,65 2012 137,61 82,57 Tabla 45.- Costes de las consultas externas de traumatología. Si tenemos en cuenta el coste de las consultas de anestesia calculado: Centro de Coste 011ANEC 01ANRC Total General CEX 2009 1.004,00 1.283,00 2.287,00 Coste 2009 Coste Cex09 124.174,41 123,68 13.290,81 10,36 137.465,22 60,11 CEX 2010 3.466,00 3.037,00 6.503,00 Coste 2010 136.208,31 54.855,59 191.063,90 Coste Cex10 39,30 18,06 29,38 CEX 2011 3.482,00 5.116,00 8.598,00 Coste 2011 101.020,60 63.618,23 164.638,83 Coste Ce11 29,01 12,44 19,15 CEX 2012 3.702,00 4.861,00 8.563,00 Coste 2012 82.585,09 51.825,85 134.410,94 Coste Cex12 22,31 10,66 15,70 Tabla 46.- Costes incluyendo las consultas de anestesia 2009-2012. 2.- Coste de las analíticas preoperatorias. Según los datos obtenidos desde el Servicio de Análisis Clínico que incluye no sólo el coste de los reactivos, sino el coste total en este caso medio, incluyendo todos los conceptos primarios y secundarios, es de 186,74 €. Que incluye el hemograma básico, las pruebas de coagulación, las pruebas cruzadas y el concentrado de hematíes. Si bien en algunos casos debemos tener en cuenta que existen pacientes a los que se realizan más pruebas (ASA IV). 141 3.- Coste de las pruebas radiológicas. Del informe BW se obtiene un informe denominado, coste del producto intermedio. El cual con nuestro catálogo valorado y trascodificado con los códigos de Radiología podemos sacar el coste unitario de la prueba. Denominación Cadera Unilateral1 Cadera Unilateral2 Pelvis ap y oblicuas Pelvis antero-­‐poste Toraxportatil Torax p-­‐a Torax p-­‐a y l at 2009 17,34 19,51 27,97 19,37 24,63 17,96 21,83 2010 16,5 17,98 27,38 17,86 21,78 16,17 20,45 2011 15,04 16,74 24,8 17,2 20,53 15,31 18,66 2012 15,01 16,93 24,82 16,89 19,38 15,13 19,03 Tabla 47.- Costes de las pruebas radiológicas 2009-2012. 4.- Coste del quirófano. Partimos de la siguiente información: § Tiempos de utilización de quirófanos en los que se ha intervenido. § Coste de cada uno de los quirófanos en los que se ha intervenido. Calculando el coste/minuto de cada uno de los quirófanos. Al disponer de la hora de entrada y salida del quirófano, podemos realizar dicho cálculo, al que aplicamos el coste/minuto de utilización de dicho quirófano nos da el coste del mismo. Aquí incluimos los costes propios del quirófano y los repercutidos al mismo. Como ya dijimos las prótesis se imputan al ceco de hospitalización. 142 Coste Quirófanos 011QUIC Coste Coste/Min 011QURT Coste Coste/Min 011QUIN Coste Coste/Min 011QUIM Coste Coste/Min 011QUIU Coste Coste/Min 011QUIT Coste Coste/Min 011QUIO Coste Coste/Min 011QUIV Coste Coste/Min 011QUI3P Coste Coste/Min 011QUI2P Coste Coste/Min 2009 311.474,00 3.492.015,68 € 11,21 € 284.007,00 964.654,58 € 3,40 € 206.592,00 1.564.297,87 € 7,57 € 165.273,00 1.463.120,59 € 8,85 € 161.153,00 801.988,86 € 4,98 € 132.448,00 1.638.586,49 € 12,37 € 131.707,00 504.311,17 € 3,83 € 104.715,00 1.106.735,66 € 10,57 € 2010 244.188,00 3.445.702,79 € 14,11 € 250.370,00 1.089.075,86 € 4,35 € 196.753,00 1.981.176,46 € 10,07 € 148.744,00 1.373.946,69 € 9.024,00 € 120.063,00 1.014.884,74 € 8,45 € 107.799,00 1.060.653,83 € 9,84 € 135.317,00 267.048,69 € 1,97 € 100.093,00 1.242.962,40 € 12,42 € 2011 253.332,00 2.965.144,60 € 11,70 € 230.631,00 1.455.728,75 € 6,31 € 151.235,00 1.807.840,79 € 11,95 € 109.854,00 1.436.174,92 € 13,07 € 110.734,00 1.027.290,42 € 9,28 € 87.240,00 1.038.724,90 € 11,91 € 118.862,00 435.200,95 € 3,66 € 81.114,00 1.165.946,86 € 14,37 € 2012 253.824,00 1.545.454,30 € 6,09 € 113.720,00 483.629,46 € 4,25 € 573.344,00 4.534.559,00 € 7,91 € 504.536,00 3.917.608,50 € 7,76 € Tabla 48.- Costes quirófanos 5.- Coste de la Anestesia. Se extrajo del sistema los minutos dedicados a la anestesia en los quirófanos, su coste y de ahí el coste por minuto del servicio de Anestesia. Para lo cual tuvimos que realizar una serie de ajustes y reunificaciones en los distintos Cecos, con el fin de homogeneizar la información disponible. Ya que en el año 2010 se produjo una modificación en los cecos, pues el ceco 011ANRI repartía su coste por días de estancia y prácticamente daba todo su coste a 011ANRIF (Anestesia final). Tuvimos que repartir este coste en BW mediante el VVEE88 ( Días de estancias por traslados interservicios). Sin embargo el Ceco 011ANRR reparte por tiempo de anestesia a los servicios finales. 143 Observamos una disparidad en los costes de las dos unidades asistenciales Hospital Infanta Cristina y Hospital Perpetuo Socorro, por lo que tomamos la decisión de realizar una media de coste/minuto, en función de la alta movilidad del personal, y las grandes dificultades de imputación. Coste Anestesia 011ANRI Coste Coste/Min 011ANRR Coste Coste/Min Todo e l Servicio Minutos Coste/Min 2009 1.013.676 6.545.932,27 € 6,46 € 743.360 939.571,48 € 1,26 € 7.485.503,75 € 2.145.061 3,49 € 2010 896.537 6.658.917,39 € 7,43 € 693.461 1.019.974,40 € 1,47 € 7.678.891,79 € 1.814.463 4,23 € 2011 847.224 6.146.139,61 € 7,25 € 657.917 1.277.053,38 € 1,78 € 7.423.192,99 € 1.706.385 4,35 € 2012 912.695 5.603.163,08 € 6,14 € 679.365 1.207.896,71 € 1,78 € 6.811.089,79 € 1.797.838 3,79 € Tabla 49.- Costes Anestesia 2009-2012 6.- Coste del cirujano que realiza la intervención. Aquí nos encontramos con grandes problemas, ya que se plantea la dificultad de establecer un criterio para el reparto del coste del personal del ceco de hospitalización que realiza la intervención. Para el caso que nos ocupa: Cirugía Consultas Externas Hospitalización Cirugía Ambulatoria Docencia Investigación Total 2009 870.991 1.691.711 562 142.557 109.312 2.815.132 2010 867.083 1.633.558 8.123 139.781 105.568 2.754.113 2011 1.009.033 1.655.760 8.406 144.297 111.746 2.929.242 2012 939.828 1.614.503 7.783 141.303 114.697 2.818.115 Tabla 50.- Costes Cirugía Una vez detraído del coste total del personal imputado al servicio de Traumatología, los costes de Consultas Externas, Cirugía Ambulatoria, Docencia e Investigación, se determinó qué parte de ese coste de hospitalización sería para procesos médicos y cuál para procesos quirúrgicos. Se ha resuelto mediante los pesos de los GRD médicos y quirúrgicos del servicio de Traumatología. Datos facilitados por el CMBD. 144 Año 2012 S uma Peso % M 410 8,83% Q 4.231,.07 91.17% Total General 4.641,07 Tabla 51.- Pesos GRD Estos porcentajes son los que aplicamos al coste de personal de hospitalización para calcular el coste/minuto del servicio de cirugía por intervención. Empleando el tiempo de utilización de quirófano: Coste Cirujano Consultas Externas Hospitalización % GRD Quirúgicos % GRD Médicos Tiempo Utilización Quirófano Coste/Minuto Cirujano Cirugía Ambulatoria Docencia Investigación Total 2009 870.991 1.691.711 1.542.261 149.450 352.551 4,37 562 142.557 109.312 4.859.398 2010 867.083 1.633.558 1.489.245 144.313 315.600 4,72 8.123 139.781 105.568 4.703.276 2011 1.009.033 1.655.760 1.509.486 146.274 280.415 5,38 8.406 144.297 111.746 4.865.423 2012 939.828 1.614.503 1.471.874 142.629 293.160 5,02 7.783 141.303 114.697 4.725.783 Tabla 52.- Tiempos de utilización del quirófano. Aplicando este tiempo como en las otras ocasiones al tiempo de intervención del cirujano en el proceso quirúrgico. 7.- Coste de la estancia. Debido a que los pacientes no siempre se encuentran en la misma planta, tenemos que extraer del sistema la totalidad de las estancias por años en las plantas en las que ha estado algún paciente de traumatología, para con ello poder calcular el coste día de estancia. Este coste está formado por los costes de enfermería que recoge los del personal, los necesarios para atender la planta, así como los repercutidos de otros servicios a las unidades de enfermería, donde destaca la alimentación del paciente. 145 CECO 011HO5E 011HE4I 011HE4D 011HO4E 011HO2E 011HO6E 011HO4O 011HE3I 011HO3O 011HO7O 011HO6O Cose/día estancia 2009 215,38 242,62 334,36 209,53 222,32 194,21 229,35 179,31 191,78 240,43 113,54 Estancia 2009 8316 5093 1420 701 238 228 152 114 11 95 56 Cose/día estancia 2010 181,28 202,88 337,12 275,29 239,07 190,56 264,78 84,84 145,45 195,83 189,06 Estancia 2010 8789 5236 1569 514 196 256 108 208 116 87 91 Cose/día estancia 2011 223,72 232,64 417,19 224,2 229,17 186,56 243,92 234,45 130 118,94 260,42 Estancia 2011 7938 4991 1188 1451 184 251 360 30 42 76 58 Cose/día estancia 2012 200,99 255,57 397,14 263,23 226,24 191,07 260,48 254,98 132,75 159,19 256,74 Estancia 2012 8429 4689 1166 252 143 90 330 26 79 106 13 Tabla 53.- Costes de estancia. Siguiendo con el análisis de los apartados anteriores se tomaron los días de estancia de cada una de las intervenciones del libro registro quirúrgico por paciente, así como la unidad en la que ha tenido esa estancia, obteniendo con ello el coste real. 8.- Coste de los productos farmacéuticos. La elevada comorbilidad en la mayoría de estos pacientes los convierte en consumidores de diferentes medicamentos de forma simultánea. A la medicación crónica del paciente, se suma el tratamiento farmacológico intrahospitalario, lo que supone un riesgo aumentado de sufrir problemas relacionados con los medicamentos y resultados negativos derivados de los mismos. Es por ello que el control y seguimiento de la farmacoterapia del paciente se convierte en un punto esencial dentro del proceso. El tratamiento intrahospitalario específico de la fractura de cadera se constituye básicamente por cuatro tipos de fármacos: • Analgésicos. • Antibióticos • Antitombróticos • Anestésicos Se tomaron los datos de todos aquellos pacientes ingresados que se correspondían con los códigos de procedimiento, que cruzamos con su Historia Clínica, con la finalidad de imputar el coste de forma personalizada (Figura 22). 146 NHC CIP IMPORTE FECHA TIPO 459825 MRRM630947913010 1.497,26 19/02/2013 REVISION6O6SUSTITUCION6DE6CADERA6POR6COMPLICACIONES 1468345 SLPR670627904010 376,90 18/06/2013 SUSTITUCION6DE6CADERA6EXCEPTO6POR6COMPLICACIONES 1077968 GRPR220664913011 372,05 20/03/2013 REVISION6O6SUSTITUCION6DE6CADERA6POR6COMPLICACIONES 1117526 LVLR330464913017 301,46 23/01/2013 SUSTITUCION6DE6CADERA6EXCEPTO6POR6COMPLICACIONES 1601926 CAEX256023838406 272,40 02/07/2013 SUSTITUCION6DE6CADERA6EXCEPTO6POR6COMPLICACIONES 1451939 CAEX256032361751 231,29 05/03/2013 SUSTITUCION6DE6CADERA6EXCEPTO6POR6COMPLICACIONES 1510867 RYDZ231271913012 208,03 29/04/2013 SUSTITUCION6DE6CADERA6EXCEPTO6POR6COMPLICACIONES 1604175 CAEX256155652157 186,34 27/08/2013 SUSTITUCION6DE6CADERA6EXCEPTO6POR6COMPLICACIONES Figura 22.- Calculo coste farmacéutico. Como hemos indicado anteriormente, con frecuencia, los pacientes ancianos presentan enfermedades crónicas, polifarmacia y tendencia a la discapacidad. En estas condiciones resulta difícil establecer unos criterios de imputación universales, ya que las decisiones clínicas con frecuencia deben ser individualizadas. Sería recomendable que para todo paciente anciano con episodios de caídas, con o sin fracturas, o bien con osteoporosis, pudiéramos acceso a una valoración geriátrica integral sistematizada que permitiera individualizar los objetivos terapéuticos que se han marcado para el paciente y conocer los tratamientos a los que se encuentra sometido. Finalmente con la suma de todos estos costes logramos alcanzar el coste por paciente y episodio de cada una de las intervenciones codificadas con los procedimientos 81.51 y 81.52, registrados en el Área de Salud de Badajoz, durante los años 2009 a 2014, y que pasamos a detallar en la siguiente sección de resultados. 147 148 V.- RESULTADOS 149 150 V.- RESULTADOS. Hemos podido seleccionar las 1.001 historias que cumplen los requisitos de ser pacientes a los que se les ha implantado una prótesis de cadera, bien sea del tipo total (PTC) o bien del tipo parcial (PPC), en el Área de Salud de Badajoz, durante los años 2009 a 2014. PTC Hombre Mujer PPC Hombre Mujer PTC+PPC Hombre Mujer 2009 53 59 2009 18 66 2009 71 125 2010 46 41 2010 15 70 2010 61 111 16 43 2011 57 91 2011 41 48 2011 2012 44 37 2012 11 44 2012 55 81 2013 37 30 2013 21 58 2013 58 88 2014 54 42 2014 26 81 2014 80 123 257 469 107 362 1.001 382 619 532 275 Tabla 56. Pacientes con Prótesis de Tabla 55. Pacientes con Prótesis de Tabla 54. Total de pacientes con prótesis Cadera Total Cadera Parcial de cadera. Como puede observarse en las tablas anteriores (tablas 54, 55 y 56), tenemos diferenciados los dos tipos de prótesis en estudio. De los números totales, el 46,85% de las prótesis implantadas se corresponden con el proceso 81.52, Sustitución Parcial de Cadera (PPC); mientras que 53,15% de los pacientes implantados se corresponden al procedimiento 81.51, Sustitución Total de Cadera (PTC). Como dato a tener en cuenta, según los datos que aparecen en la Memoria del Área de Salud de Badajoz, el número de prótesis implantadas en los dos procesos, que suman un total de 171 (GRD 818), representan el 7,65% de las intervenciones de todo el Servicio de Traumatología, lo que viene a demostrar el peso que posee dentro de la estructura de costes de dicho servicio, correspondiendo al segundo grupo de procesos por número de alta de dicho servicio, durante el año 2014. Estando incluido dentro del listado de los 25 GRDs más frecuentes del Complejo Hospitalario de Badajoz, concretamente en la posición Nº 22, con un peso de 3,1545, el tercero más alto de este listado, correspondiente al año 2014 (Área de Salud de Badajoz, 2014). A continuación mostramos los resultados obtenidos de una forma gráfica, donde podemos ver la evolución anual de este tipo de procesos llevados a cabo en el Área de Salud de Badajoz. 151 La evolución del número de pacientes a lo largo de los años que se incluyen en este estudio refleja una situación ciertos valles en los gráficos anexos. Figura 23.- Nº de Pacientes PTC. Durante el año 2013, analizando las PTC, se produce el menor número de casos de todo el período estudiado, sufriendo un incremento notable en el año 2014, con un 46% más de casos en los hombres y de un 40% para el caso de las mujeres. Si bien, haciendo la comparación entre los distintos años, es en el año 2009, donde se produce el máximo de implantes de prótesis de cadera con 112 casos. Mencionar que en estos años el número de casos entre los hombres se ha mantenido con cierta estabilidad, mostrando las mujeres una mayor variabilidad, con un 49,15% en el año 2013 frente al año 2009. Las PPC, mantienen una senda estable durante estos años en el caso de los hombres, con ligeras bajadas desde el año 2009, hasta el año 2013 donde se produce un punto de inflexión, con un incremento del 90,91% con respecto al año 2012, continuando este ascenso en el año 2014. Las mujeres también alcanzan su punto máximo en el año 2014, con diferencias cercanas al 100% entre los años 2011 y 2014. Figura 24.- Nº Pacientes PPC. 152 Si observamos el acumulado e ambos tipos de prótesis, podemos ver como se produce un similitud en las curvas de ambos sexos, con un descenso desde el año 2009, rompiendo esta tendencia en el año 2013. Y es en el año 2014 donde se produce el mayor número de pacientes con necesidad de implantes de cadera. Figura 25.- Nº total de pacientes implantados. Por comunidades, la tasa de incidencia más alta, ajustada para ambos sexos y por 100.000 habitantes, se sitúa en Cataluña, seguida de La Rioja, Andalucía, Aragón, Valencia, Castilla-La Mancha y Navarra, en orden decreciente (Hernandez HL, 2005). La tasa ajustada por 100.000 habitantes (ambos sexos) es la siguiente: Cataluña, 897; Navarra, 733; Asturias, 619; La Rioja, 796; Madrid, 685; Extremadura, 604; Andalucía, 754; Murcia, 677; Baleares, 582; Aragón, 743; País Vasco, 659; Castilla y León, 518; Valencia, 741; Ceuta y Melilla, 657; Galicia, 482; Castilla-La Mancha, 734; Cantabria, 653, y Canarias, 301. 5.1- Análisis de resultados por sexo del paciente A continuación realizamos el análisis de los casos incluidos en el estudio en función del sexo de los pacientes intervenidos, donde se pone de manifiesto la gran diferencia existente entre al número de hombres y de mujeres. PTC Total Casos Hombre % /H Mujer % /M 2009 112 53 47,32% 59 52,68% 2010 87 46 52,87% 41 47,13% 2011 89 41 46,07% 48 53,93% 2012 81 44 54,32% 37 45,68% 2013 67 37 55,22% 30 44,78% 2014 96 53 55,21% 43 44,79% Total General 532 275 51,69% 257 48,31% Figura 26.- Prótesis Totales de Cadera. Hombres&Mujeres 153 En las prótesis totales de cadera los hombres tienen una mayor incidencia media 51,69%. Sin embargo a lo largo de los años, lo que debe tener en consideración es la similitud desde el punto de vista cuantitativo entre hombres y mujeres. Es en la prótesis parcial de cadera donde la mujer presenta una incidencia muy superior, con un porcentaje prácticamente de 3 a 1, frente a incidencia en los hombres. Que se encuentra dentro del contexto de porcentajes en el entorno nacional. (Herrera A, 2005) PPC % /H Mujer % /M 2009 Total Casos Hombre 84 18 21,43% 66 78,57% 2010 85 15 17,65% 70 82,35% 2011 59 16 27,12% 43 72,88% 2012 55 11 20,00% 44 80,00% 2013 79 21 26,58% 58 73,42% 2014 107 26 24,30% 81 75,70% Total General 469 107 22,81% 362 77,19% Figura 27.- Prótesis Parciales de Cadera. Hombres&Mujeres. La suma de ambos procesos, reduce la incidencia cuantitativa en el caso de las mujeres, con un porcentaje de aproximadamente 2 a 1, para el caso de las mujeres. PTC+PPC Total Casos Hombre % /H Mujer % /M 2009 196 71 36,22% 125 63,78% 2010 172 61 35,47% 111 64,53% 2011 148 57 38,51% 91 61,49% 2012 136 55 40,44% 81 59,56% 2013 146 58 39,73% 88 60,27% 2014 203 80 39,41% 123 60,59% Total General 1001 382 38,16% 619 61,84% Figura 28.- Prótesis Hombres&Mujeres Aunque en un estudio epidemiológico español realizado por el equipo de Álvarez Nebreda, se objetiva que a pesar de aumentar la incidencia bruta de fracturas de cadera en los ancianos secundaria al envejecimiento poblacional, la incidencia ajustada por edad se ha estabilizado. Los autores atribuyen este hecho a un posible éxito de los programas de prevención, diagnóstico y tratamiento de la osteoporosis en España. (Alvarez-Nebreda ML, 2008) (Serra JA, 2002). 154 5.2.- Análisis de resultados en función de la edad de los pacientes intervenidos. PTC N N Mujeres N Hombres Promedio Promedio Mujeres Promedio Hombres Max Min Desviación 2009 112 59 53 67,49 68,22 66,68 87 17 14,26 2010 87 41 46 65,03 66,54 63,70 68 55 3,97 2011 89 48 41 64,07 65,63 62,24 78 68 2,86 2012 81 35 44 63,95 66,32 61,95 93 50 8,31 2013 67 30 37 63,36 65,73 61,43 82 34 13,25 2014 96 42 54 63,29 63,70 62,96 91 26 15,81 255 275 64,53 66,02 63,16 93 17 9,74 Total General 532 Tabla 57.- Resultados en función de la edad de los pacientes intervenidos. Observamos como el número de hombres intervenidos en superior al de las mujeres intervenidas, si bien, en términos de edad, el promedio de la misma para la mujeres es superior que para los hombres. Siguiendo en ambos casos una tendencia a la baja. Figura 29.- Pacientes estudiados PTC Hay que indicar que esta edad media se ve muy afectada por los mínimos y máximos, por lo que debemos tener en cuenta la desviación, siendo este muy notable en años como el 2009 y el 2014, que sin duda afectan al resultado final. De cualquier forma, la edad máxima en los últimos años supera los 90 años, tal y como está ocurriendo a lo largo de la geografía nacional. En un estudio del Servei de Medicina Física i Rehabilitació. Hospital de l'Esperança. IMAS. Barcelona. Estudio prospectivo de 50 casos consecutivos, la edad media de los pacientes fue de 66,6 (DE 11,8) años. Que se corresponde con nuestros resultados. 155 PPC N N Mujeres N Hombres 2009 84 66 18 82,04 82,44 80,56 98 42 11,75 2010 85 70 15 81,48 81,84 79,80 89 73 3,75 2011 59 43 16 82,42 81,88 83,88 97 54 7,86 2012 55 44 11 83,18 82,73 85,00 97 57 11,59 2013 79 58 21 80,28 81,22 77,67 86 69 3,37 2014 107 81 26 81,08 82,11 77,88 100 31 8,20 362 107 81,61 82,04 80,80 100 31 7,75 Total General 469 Promedio Promedio Mujeres Promedio Hombres Max Min Desviación Tabla 58.- Pacientes por edad y sexo. Prótesis parciales de cadera. Figura 30.- Pacientes estudiados PPC La media en nuestro estudio se sitúa en 81,61 años, con una desviación del 7,75. Si bien es cierto que el número de pacientes mayores de 95 años se ha visto incrementado a lo largo de estos 6 años de estudio, llegando a contabilizar el primer caso de 100 años de edad, en el histórico seleccionado. La publicación del Informe del Acta de las Fracturas Osteoporóticas en España (AFOE), del Grupo de Estudio de Osteoporosis de la Sociedad Española de Cirugía Ortopédica y Traumatología (SECOT), dirigido por el Profesor A. Herrera, ha dado el siguiente resultado: la edad media general de las fracturas de cadera se sitúa en 82 años, y la incidencia media anual, en 720 por 100.000 habitantes. El cálculo resultante fue de 61.000 fracturas de cadera en España, entre un 2 5-30% superior a la s estimadas hasta ahora; la incidencia es más alta desde los 70 años hasta los 85-90 años, con un descenso lógico y significativo después de los 95 años y con una presencia no desdeñable de pacientes centenarios (Grupo de Estudio Osteoporosis. , 2003). 156 Desde el 2003, se calcula que el porcentaje de pacientes por encima de los 91 años supera el 15% (Rodríguez Alvarez, 2002). Aportaciones del Congreso de la SECOT en Sevilla (Rodríguez Alvarez, 2002) , mostraron nuevos datos de incidencia sobre una población anciana, con una edad media superior a los 82 años y con una media de comorbilidades de 3,7 por paciente, afectación cognitiva de distinto grado del 40% y cardiopatías del 31%. Con una mortalidad hospitalaria del 2%. Según diversos autores (Basora M, 2011.) (Rojo-Venegas, 2010) (Garcia S, 2005.) la media de edad de los pacientes con fractura proximal de fémur ha aumentado en las dos últimas décadas, en nuestro medio ya es de 82 a 87,5 años según series por el aumento de esperanza de vida. Pero en los pacientes incluidos en nuestro estudio, podemos indicar que nos encontramos en el Área de Salud de Badajoz, dentro del primer tramo de edad media. A nivel acumulado PTC+PPC, se muestran unos datos medios, que desvirtúan de alguna forma el análisis realizado, siendo por tanto información que no va a ser comentada, aunque sí estimamos que debe al menos ser presentada para su visualización. Figura 31.- Nº pacientes totales en estudio. Hombres y Mujeres PTC+PPC N 2009 196 125 71 74,76 75,33 73,62 99 24 11,72 2010 172 111 61 73,26 74,19 71,75 100 33 11,56 2011 148 91 57 73,25 73,75 73,06 96 24 11,50 2012 136 81 55 73,57 74,53 73,48 98 17 10,78 2013 146 88 58 71,82 73,48 69,55 97 38 10,96 2014 203 123 80 72,19 72,90 70,42 97 26 11,87 619 382 73,07 74,03 71,98 100 17 11,40 Total General 1001 N Mujeres N Hombres Media de Edad Media de Edad Mujeres Media de Edad Hombres Max Min Desviación Tabla 59.- Acumulado de implantes edad y sexo de los pacientes. 157 Figura 32.- Edad Media de los pacientes en estudio Bibliográficamente conocemos que alrededor del 5% de las mujeres de más de 65 años ha sufrido una fractura de cadera. El riesgo de fractura de cadera en el resto de la vida en una mujer de raza blanca de 50 años se ha estimado, en Estados Unidos, en un 17,5%. En Europa esa cifra es mayor en los países nórdicos y menor en los mediterráneos. En España, en la publicación de Serra et al, “Epidemiología de las fracturas de cadera del anciano en España”, referido al período 1996-1999 y manejando datos del Ministerio de Sanidad obtenidos del Registro General del Conjunto Mínimo de Datos, la edad media fue de 82,7 años; las poblaciones de mayor edad fueron la Comunidad de Madrid y La Rioja, con una media de 82,9 años, y las de menor edad, Melilla y Murcia, con 80,1, y Ceuta, con 78,9 años. En términos de grupos de edad, se confirman las tendencias marcadas en la bibliografía nacional e internacional. Tenemos que entre los 70 y los 85-90 años se dan el 39,03% para las PTC y el 76,98% del resto de los casos. Grupos de Edad 0 - 25 25 - 50 51 - 55 56- 60 61 - 65 66 - 70 71 - 75 76 - 80 81 - 85 86 - 90 91 - 95 96 - 100 Total General PTC 3 93 45 37 62 81 66 90 46 6 3 % PTC 0,56% 17,45% 8,44% 6,94% 11,63% 15,20% 12,38% 16,89% 8,63% 1,13% 0,56% 532 100% PPC 6 2 7 12 20 39 87 133 102 49 12 469 % PPC PTC+PPT 3 1,28% 99 47 1,49% 44 2,56% 74 4,26% 101 8,32% 105 18,55% 177 28,36% 179 21,75% 108 10,45% 52 2,56% 12 100% 1001 Tabla 60.- Grupo de edad de los pacientes estudiados. 158 % PTC+PPC 0,30% 9,89% 4,70% 4,40% 7,39% 10,09% 10,49% 17,68% 17,88% 10,79% 5,19% 1,20% 100% Figura 33.- Grupos de edad. Figura 34.- Grupos de edad por implantes vs total de implantes realizados. 5.3.- Análisis de resultados en función de la mortalidad. De las diferentes fracturas osteoporóticas, la fractura de cadera es la que mayor mortalidad provoca (Piirtola M, 2008) . Los avances quirúrgicos y anestésicos introducidos en su tratamiento no se han visto acompañados de una reducción de sus tasas de mortalidad, las cuales han permanecido estables durante las últimas décadas (Giversen, IM, 2007) (Haleem S, Lutchman L, Mayahi R, Grice JE, Parker MJ, 2008) (Brauer CA C.-P. M., 2009). Estas tasas se encuentran entre el 2 y el 7% de los pacientes durante la fase hospitalaria aguda, entre el 6 y el 12% durante el mes posterior y entre el 17 y el 33% al cabo del primer año tras la fractura de cadera (Giversen, 2007) (Jiang HX M. S., 2005). 159 Puede estimarse que, en España, de los casi 40.000 pacientes que sufren anualmente una fractura de cadera (Alvarez-Nebreda ML, 2008) fallecerán unos 10.000 durante los doce meses posteriores a la misma. La mortalidad posfractura no sigue un patrón homogéneo, sino que varía en función de la edad y el sexo (Von Friesendorf M B. J., 2008). En nuestro estudio sólo hemos podido tener acceso a los datos correspondientes a los años 2009, 2010, 2011 y 2012. Siendo los resultados obtenidos a los que a continuación se detallan: Fallecimientos Número Edad Media Hombres 18 82,61 Mujeres 44 85,05 Total 62 84,34 Tabla 61.- Nº y edad media de los fallecimientos en el Área de Salud de Badajoz 2009-2012 La edad media de los fallecimientos acaecidos en el Área de Salud de Badajoz, de pacientes que han sido intervenidos por los procesos 81.51 y 81.52 ha sido de 82,61 para los hombres y de 85,05 años para las mujeres. Por rango de edad: Rango de Edad Hombres Mujeres 65-75 4 4 76-80 3 8 81-85 4 12 86-90 4 9 91-95 3 6 18 44 96-100 Total General 5 Tabla 62.- Fallecimientos por rango de edad y sexo. Vemos que el cerca del 26% de los pacientes se encuentran en el entorno de los 81-85 años, siendo la mortalidad en estos años muy superior en el caso de las mujeres, 1 de cada 4 mujeres fallecen en este intervalo de años. 160 Figura 35.- Fallecimientos por rango de edad. Y por último, analizando las fechas de fallecimiento conjuntamente con la fecha de su intervención, se observan los siguientes hechos: Hombres Mujeres Total H% /Total M% /Total % /Total En el primer año 7 23 30 39% 52% 48% En el segundo año 8 7 15 44% 16% 24% En el tercer año 2 7 9 11% 16% 15% 6% 16% En el cuarto año Total General 1 7 8 18 44 62 13% 100% Tabla 63.- Fallecimientos tras intervención. El mayor número de fallecimientos se producen dentro del primer año tras la intervención, el 48% de los casos. Representando el 52% en el caso de las mujeres, que sin embargo alcanza el 72% dentro de los 24 meses siguientes a su intervención. Los hombres con un 39% en el primer año y el 44% dentro de los 12 meses siguientes al primer año. El 83% de los hombres fallecen dentro de los 24 meses siguientes a su intervención. Años Edad Media 2009 82,33 Hombre Mujer Edad Media 2010 84,46 Hombre Mujer Edad Media 2011 87,06 Hombre Mujer Edad Media 2012 85,83 Hombre Mujer Edad Media 81,71 82,55 Edad Media 79,5 86,67 Edad Media 83,66 88,63 Edad Media 84 89,5 Tabla 64.- Edad media y género de los fallecimientos 161 5.4.- Análisis de resultados de estancia pacientes intervenidos En los últimos años, el crecimiento del gasto sanitario ha conducido a la aplicación de estrategias que permitan reducir costes sin disminuir la calidad de los servicios, ni su accesibilidad a la población. La gestión de la utilización hospitalaria, y en concreto la revisión de la utilización inadecuada de la hospitalización, se contempla como uno de los más prometedores enfoques para la mejora de la eficiencia del sistema sanitario (Novoa, 2002). Estancias Prótesis Totales de Cadera Años Estancias Estancia Media Coste Estancia Coste Estancia Media Coste Día/Estancia 2009 1261 11,259 290.303,41 € 1.690,37 € 230,22 € 2010 723 8,310 156.775,63 € 1.802,02 € 216,84 € 2011 645 7,247 178.904,59 € 2.010,16 € 277,37 € 2012 598 7,383 151.949,37 € 1.875,92 € 254,10 € 2013 488 7,284 113.617,61 € 1.695,79 € 232,82 € 2014 729 7,594 247.354,75 € 2.576,61 € 339,31 € Total General 4.444 8,179 1.138.905,36 € 1.941,81 € 256,28 € Tabla 65.- Estancias analizadas de Prótesis Totales de Cadera Por ello hemos extraído la siguiente información de nuestro sistema en referencia a las estancias correspondientes a los pacientes que han sido incluidos dentro de los procesos 81.51 y 81.52. Figura 36.- Estancias totales de pacientes PTC 162 Figura 37.- Estancia media pacientes PTC Figura 38.- Coste de la estancias pacientes PTC La estancia media ha sido uno de los grandes capítulos en los que se ha trabajado a los largo de estos años, consiguiendo una reducción notable desde los más de 11 días hasta los 7,59 días en 2014. Si bien esta reducción temporal no ha tenido su reflejo en el apartado de costes, que sigue una senda alcista de más del 47% con respecto al año 2009. En febrero del 2004 se abrió un nuevo hospital en el Reino Unido, en el cuál se introdujeron los mejores modelos de práctica clínica desempeñados hasta ese momento en un destacado Hospital Ortopédico de Estados Unidos. Con ello se consiguió reducir la estancia media hospitalaria para la artroplastia total de cadera en una media de cinco días, quedándose ésta en 6,1 ± 3,0 días. (Peterson M, 2008 Jan). En definitiva, la adecuación de la estancia hospitalaria, viene determinada por : ü Perfil clínico del paciente que ingresa. ü Recursos disponibles. ü Organización funcional del hospital y la unidad. ü Implicación de los profesionales. 163 El coste del tratamiento de estas fracturas es elevado. El uso de guías clínicas ha conseguido disminuir en los últimos años las cifras de estancia media hospitalaria, principal fuente de gasto. En el caso de las prótesis parciales de cadera, en lo relativo a las estancias, observamos que el incremento del número de estancias es proporcional al número de casos. Si bien en términos de estancia media el año 2014, es aquel en el que se produce el peor dato de la serie de años en estudio, que había seguido una tendencia a la baja desde el año 2010. Años Estancias 2009 1.177 Estancia Media Coste Estancia Coste Estancia Media Coste Día/Estancia 14,01 245.001,05 € 2.916,68 € 208,16 € 2010 1.046 12,31 214.930,25 € 2.528,59 € 205,48 € 2011 762 12,92 159.061,21 € 2.695,95 € 208,74 € 2012 789 14,35 161.321,92 € 2.933,13 € 204,46 € 2013 1.097 13,89 223.065,66 € 2.823,62 € 203,34 € 2014 1.666 15,57 352.152,31 € 3.291,14 € 211,38 € Total General 6.537 13,84 1.355.532,40 € 2.864,85 € 207,36 € Tabla 66.- Estancias Prótesis Parcial de Cadera Figura 39.- Estancias medias pacientes PPC Figura 40.- Total estancias pacientes PPC 164 Figura 41.- Coste estancias PPC Hemos intentado averiguar las causas que inciden en este incremento de las estancias, y hemos podido saber, que durante este año de 2014 se puso en marcha el denominado Plan de Choque para reducir el número de pacientes en lista de espera. Esto ha traído consigo la contratación de personal facultativo y enfermería, así como del resto de personal necesario en el proceso quirúrgico, para su inclusión en los quirófanos en turno de tarde. Que unido a la jubilación de profesionales con una larga trayectoria; han hecho que en función de su curva de aprendizaje la estancia se haya visto penalizada. En términos acumulados, la estancia media y sus costes, se reflejan en las tablas e ilustraciones siguiente: Años Estancias Estancia Media 2009 2.443 12,67 Coste Estancia 535.178,50 € Coste Estancia Media 2.753,59 € 218,69 € 2010 2.088 12,18 429.562,54 € 2.506,70 € 205,78 € 2011 1.664 12,26 375.592,07 € 2.747,56 € 227,66 € 2012 1.308 10,15 305.799,21 € 2.328,93 € 235,74 € 2013 1.405 9,45 306.889,64 € 2.075,62 € 223,69 € 2014 2.073 10,08 440.434,20 € 2.151,35 € 218,51 € Total General 10.981 11,13 2.393.456,16 € 2.427,29 € 221,68 € Tabla 67.- Estancias, estancias medias y costes de las mismas PTC+PPC. Figura 42.- Estancias totales estudiadas. 165 Coste Día/Estancia Figura 43.- Coste estancia total. Figura 44.- Estancia Media Total. Si nos comparamos con el resto de hospitales a nivel nacional que presentan los siguientes resultados podemos afirmar que nos encontramos dentro de los 20 mejores, en este ratio de estancias medias. Debemos tener en cuenta que cada día de reducción de estancia logramos un ahorro en costes de más de 220 Euros. De ahí la necesidad de lograr una gran eficiencia tanto en el proceso propiamente dicho, como en el postoperatorio. En el año 2014, los datos de esta misma firma IASIST, en sus datos publicados para los Hospitales Top-20 de España, la estancia media se ha ajustado a 10,53 días, mucho más próxima a los resultados del Área de Badajoz, de 10,08 para el mismo año. Proceso evaluado (%) (%) Tasa de readmisiones urgentes a 30 días (%) (días) ingreso (%) Implante de prótesis total y parcial de cadera Reducción abierta con fijación interna de fémur Recambio de prótesis de cadera 1,65 6,23 3,08 10,53 – 3,13 7,96 4,03 12,98 – 1,66 13,05 1,81 15,78 – IASIST Tasa de mortalidad Tasa de complicaciones Tabla 68.- Resultados TOP-20 2011. IASIST. 166 Estancia media Tasa de cirugía sin Elena García García (García García, 2011), en su tesis doctoral titulada: “Evaluación de la Estancia Hospitalaria en la Prótesis de Cadera”, realizada en el año 2011, en un hospital de la Comunidad de Madrid de carácter privado, perteneciente a una aseguradora de servicios de salud; hace mención a unas estancias medias en su estudio para los procesos estudiados 81.51 y 81.52 de 10,08 días y 17,91 días respectivamente. Que en términos de costes de estancia día, serían 256,25€ y 231,23€, para las Prótesis de Cadera Totales y Parciales respectivamente. Lo que representa en términos de comparación con su estudio y nuestros resultados, que en el caso del Complejo Hospitalario de Badajoz, frente a los obtenidos por ella, una mejora en la gestión de la estancia media de un 18,85 % para las intervenciones de Prótesis Totales de Cadera y del 22,72% en las Prótesis Parciales de cadera. Y en términos económicos representa una coste día de más del 10,38 % con respecto a nuestro estudio de costes. En otro término de cosas los costes derivados de la hospitalización por estos procesos oscilan entre los 502 € de Noruega, los 4.092 € de Turquía, los 9.236 € de Irlanda y los 29.910 € de Suiza (Haentjen P, 2001) (Tanriover M, 2009) (Azhar A L. C., 2009). Algunas revisiones nacionales han estimado el coste de la hospitalización entre 4.000 y 5.400 € (Pérez-Ochagavía F, 2003) (L., 2005), si bien conviene considerar que la recogida de datos no ha sido homogénea. Si a continuación realizamos el análisis de los costes en función del género de los pacientes intervenidos obtenemos la siguiente información: Prótesis Total de Cadera PTC N Hombres N Mujeres Est Hombre Est Med Hombre Est Mujer Est Med Mujer % H/M Est Coste Est Hombre Coste Est Mujer % H/M Cost Est Coste Total Hombre Coste Total Mujer % H/M Cost Total 2009 53 59 477 9,00 784 13,29 61% 110.301,71 € 180.001,70 € 61% 460.178,59 € 604.076,22 € 76% 2010 46 41 341 7,41 382 9,32 89% 72.669,41 € 76.222,82 € 95% 393.620,39 € 343.874,09 € 114% 2011 41 48 278 6,78 367 7,65 76% 65.965,34 € 86.461,73 € 76% 369.551,59 € 451.088,54 € 82% 2012 44 37 304 6,91 294 7,95 103% 76.001,26 € 78.573,40 € 97% 424.354,96 € 370.073,60 € 115% 7,17 127% 52.482,54 € 124% 2014 54 42 399 7,53 330 7,67 121% 93.463,49 € 80.683,19 € 116% 405.373,39 € 326.304,89 € 124% Total General 2013 275 37 257 30 2.072 273 7,50 7,38 2.372 215 8,84 87% 483.498,38 € 65.097,17 € 554.425,38 € 87% 2.373.524,50 € 320.445,57 € 2.338.383,96 € 242.966,62 € 102% 132% Tabla 69.- Costes por sexo. PTC Prótesis Parcial de Cadera PPC N Hombres N Mujeres Est Hombre Est Med Hombre Est Mujer Est Med Mujer % H/M Est Coste Est Hombre Coste Est Mujer % H/M Cost Est Coste Total Hombre Coste Total Mujer % H/M Cost Total 2009 18 66 250 13,89 932 14,12 27% 52.364,68 € 192.510,41 € 27% 125.748,56 € 469.133,21 € 27% 2010 15 70 231 15,40 1134 16,20 20% 41.851,26 € 238.819,06 € 18% 108.744,31 € 553.258,28 € 20% 2011 16 43 365 22,81 654 15,21 56% 79.412,47 € 143.752,53 € 55% 174.947,50 € 354.552,43 € 49% 2012 11 44 150 13,64 560 12,73 27% 34.752,62 € 116.471,93 € 30% 80.216,21 € 302.493,61 € 27% 2013 21 58 277 13,19 640 11,03 43% 57.714,37 € 131.595,57 € 44% 135.422,73 € 370.276,97 € 37% 2014 26 81 343 13,19 1.001 12,36 34% 68.491,21 € 197.796,31 € 35% 177.247,07 € 492.097,08 € 36% Total General 107 362 1.616 15,35 4.921 13,61 33% 334.586,61 € 1.020.945,80 € 33% 802.326,38 € 2.541.811,57 € 32% Tabla 70.- Costes por sexo. PPC Prótesis de Cadera PTC+PPC N Hombres N Mujeres Est Hombre Est Med Hombre Est Mujer Est Med Mujer % H/M Est Coste Est Hombre Coste Est Mujer % H/M Cost Est Coste Total Hombre Coste Total Mujer % H/M Cost Total 2009 71 125 727 11,44 1716 13,70 42% 162.666,39 € 372.512,11 € 44% 585.927,15 € 1.073.209,43 € 55% 2010 61 111 572 11,41 1516 12,76 38% 114.520,67 € 315.041,87 € 36% 502.364,70 € 897.132,37 € 56% 2011 57 91 643 14,80 1021 11,43 63% 145.377,81 € 230.214,26 € 63% 544.499,09 € 805.640,96 € 68% 2012 55 81 454 10,27 854 10,34 53% 110.753,88 € 195.045,33 € 57% 504.571,17 € 672.567,20 € 75% 2013 58 88 550 10,28 855 9,10 64% 122.811,53 € 184.078,11 € 67% 455.868,30 € 613.243,60 € 2014 80 123 742 10,36 1331 10,02 56% 161.954,70 € 278.479,50 € 58% 582.620,46 € 818.401,97 € 71% Total General 382 619 3.688 11,43 7.293 11,22 51% 818.084,98 € 1.575.371,17 € 52% 3.175.850,88 € 4.880.195,53 € 65% Tabla 71.- Costes por sexo. Totales 167 74% Por término medio la estancia media de las mujeres es un 13% superior a la de los hombres en las Prótesis Totales de Cadera. Las mujeres se encuentran hospitalizadas una media de 8,84 días, frente a los 7,50 de los hombres. Mientras que esta relación se invierte en el caso de las Prótesis Parciales de Cadera, donde los hombres se encuentran hospitalizados una media de 15,35 días frente a los 13,61 días de las mujeres, representando un 12,78 menos de estancia media. 5.5.- Análisis por tiempos PTC Quirúgico T Qx Medio Anestesia T A Medio Cirugía T Cir Medio 2009 18838 168 17.230 154 13.398 120 2010 13141 151 11.979 138 9.554 110 2011 14945 168 13.730 154 10.994 124 2012 12913 159 11.576 145 9.312 116 2013 10242 153 9.401 140 7.663 114 2014 16040 167 14.605 152 11.620 121 Total General 86119 161 78.521 147 62.541 117 Tabla 72.- Análisis de tiempos quirúrgicos, anestesia y cirugía PTC. El bloque quirúrgico representa un gasto equivalente al 5% del gasto total del hospital; es, por tanto, un recurso caro y escaso. Por ello, debemos emplear todas las herramientas a nuestro alcance para optimizarlo y una de ellas es la programación de su actividad (R., 1993). PPC Quirúgico T Qx Medio Anestesia T A Medio Cirugía T Cir Medio 2009 9.393 112 8.255 98 5.792 69 2010 10.870 128 9.728 114 7.013 83 2011 7.884 134 7.010 119 5.053 86 2012 6.469 118 5.734 104 4.080 74 2013 8.989 114 8.102 103 5.427 69 2014 12.280 115 10.876 102 7.691 72 Total General 55.885 120 49.705 107 35.056 75 Tabla 73.- Análisis de tiempos quirúrgicos, anestesia y cirugía PPC. PTC+PPC Quirúgico T Qx Medio Anestesia T A Medio Cirugía T Cir Medio 2009 28.231 140 25.485 126 19.190 94 2010 24.011 139 21.707 126 16.567 96 2011 22.829 151 20.740 137 16.047 105 2012 19.382 139 17.310 124 13.392 95 2013 19.231 133 17.503 121 13.090 92 2014 28.320 141 25.481 127 19.311 96 Total General 142.004 141 128.226 127 97.597 96 Tabla 74.- Análisis de tiempos quirúrgicos, anestesia y cirugía PPC+PTC. 168 En el análisis de los tiempos se observa gran homogeneidad a lo largo de los años, con escasas variaciones. Mencionar que el año 2011, puede ser considerado como el año de menor eficiencia en los tiempos quirúrgicos, si utilizamos esta terminología. Dicho incremento de tiempos medios ha sido corregido en los años siguientes, volviendo a ratios de años anteriores. Entiendo que es preciso comentar que debemos tener en cuenta que nos encontramos en un Complejo Hospitalario Universitario, con una gran carga docente. Que tiene incidencia tanto en el área médica como en el área de enfermería, en lo referido a las curvas de aprendizaje. Figura 45.- Evolución de tiempos quirúrgicos, anestésicos y de cirugía de la prótesis de cadera. Figura 46.- Evolución de tiempos medio quirúrgicos, anestésicos y de cirugía de la prótesis de cadera. Observamos un equilibrio en términos medios de los tiempos de quirófano, anestesia y de cirugía. Consultados los distintos servicios, manifiestan una estabilidad en los procedimientos y técnicas utilizados, sin variación sustancial que pueda afectar a una modificación en los tiempos estudiados. 169 5.6.- Análisis de los costes totales Según las estimaciones efectuadas para el SNS español en el año 2009, el conjunto de estos procesos de ortopedia y traumatología genera más de 109.000 ingresos hospitalarios en España (un 3,3% del total de la población adulta) y consume el 4,5% de las estancias totales registradas en estos hospitales en la población adulta. El coste estimado de la atención hospitalaria prestada a estos pacientes en el SNS es de 1.093 millones de euros, con un coste medio por episodio de hospitalización de 9.978 euros (IASIST, 2011). Costes Principales Prótesis Total de Cadera Años N Coste Quirúrgico Coste Anestesia Coste Cirugía Costes Protesis Costes Auxiliares Coste Estancias Coste Total Coste Medio Paciente 2009 112 88.703,20 € 60.132,70 € 58.549,26 € 435.328,62 € 130.507,74 € 291.033,29 € 1.064.254,81 € 9.502,28 € 2010 87 57.767,25 € 50.670,47 € 45.094,88 € 357.232,02 € 103.166,93 € 123.562,94 € 737.494,48 € 8.476,95 € 2011 89 98.670,95 € 59.725,50 € 59.147,72 € 358.790,15 € 91.519,60 € 152.786,21 € 820.640,13 € 9.220,68 € 2012 81 78.840,57 € 43.873,04 € 46.746,24 € 373.666,80 € 96.566,68 € 154.735,23 € 794.428,56 € 9.807,76 € 2013 67 66.328,52 € 32.246,00 € 38.544,89 € 231.258,04 € 77.300,53 € 117.734,21 € 563.412,19 € 8.409,14 € 2014 96 100.978,37 € 20.592,95 € 60.656,40 € 269.542,83 € 114.128,86 € 165.778,88 € 731.678,29 € 7.621,65 € Total General 532 491.288,86 € 267.240,66 € 308.739,39 € 2.025.818,46 € 613.190,34 € 1.005.630,75 € 4.711.908,46 € 8.839,74 € Tabla 75.- Costes Prótesis Total de Cadera en el Área de Salud de Badajoz en los años 2009 - 2014 Según la Fundación Signo, en sus Premios Barea del año 2014, el coste promedio por paciente, sin incluir el coste de la prótesis, fue de 4.734 € ±2.136 y el coste del seguimiento tras el alta de 554 € ±509. Si se incluye el coste de la prótesis, al final del año el coste total asciende a 7.645 € ±2.248. (Herrera Espiñeira C, 2014) Costes Principales Prótesis Parcial de Cadera Años N Coste Quirúrgico Coste Anestesia Coste Cirugía 2009 84 107.042,01 € 28.809,95 € 25.311,04 € Costes Protesis Costes Auxiliares Coste Estancias 128.775,24 € 60.068,44 € 244.875,09 € Coste Total 594.881,77 € Coste Medio Paciente 7.081,93 € 2010 85 92.450,73 € 41.149,44 € 33.101,36 € 161.579,61 € 53.051,13 € 280.670,31 € 662.002,58 € 7.788,27 € 2011 59 79.344,04 € 30.493,50 € 27.185,14 € 127.225,83 € 42.086,42 € 223.165,00 € 529.499,93 € 8.974,58 € 2012 55 48.696,44 € 21.731,86 € 20.481,60 € 101.855,70 € 38.719,67 € 151.224,55 € 382.709,81 € 6.958,36 € 2013 79 67.860,74 € 27.789,86 € 27.297,81 € 138.570,14 € 54.871,22 € 189.309,93 € 505.699,71 € 6.401,26 € 2014 107 90.728,58 € 53.310,34 € 40.118,96 € 143.288,76 € 75.609,98 € 266.287,52 € 669.344,14 € 6.255,55 € Total General 469 486.122,54 € 203.284,95 € 173.495,91 € 801.295,28 € 324.406,86 € 1.355.532,40 € 3.344.137,95 € 7.243,32 € Tabla 76.- Costes Prótesis Parcial de Cadera en el Área de Salud de Badajoz en los años 2009 - 2014 Años 2009 2010 2011 2012 2013 2014 Total General N 196 172 148 136 146 203 1001 Coste Quirúrgico 195.745,21 € 150.217,98 € 178.014,99 € 127.537,01 € 134.189,26 € 191.706,95 € 977.411,40 € Coste Anestesia 88.942,65 € 91.819,91 € 90.219,00 € 65.604,90 € 60.035,86 € 73.903,29 € 470.525,61 € Coste Cirugía 83.860,30 € 78.196,24 € 86.332,86 € 67.227,84 € 65.842,70 € 100.775,36 € 482.235,30 € Costes Protesis 564.103,86 € 518.811,63 € 486.015,98 € 475.522,50 € 369.828,18 € 412.831,59 € 2.827.113,74 € Costes Auxiliares Coste Estancias 190.576,18 € 535.908,38 € 156.218,06 € 404.233,25 € 133.606,02 € 375.951,21 € 135.286,35 € 305.959,78 € 132.171,75 € 307.044,14 € 189.738,84 € 432.066,40 € 937.597,20 € 2.361.163,16 € Tabla 77.- Costes Prótesis de Cadera en el Área de Salud de Badajoz en los años 2009 - 2014 170 Coste Total Coste Medio Paciente 1.659.136,58 € 8.292,10 € 1.399.497,07 € 8.132,61 € 1.350.140,06 € 9.097,63 € 1.177.138,37 € 8.383,06 € 1.069.111,90 € 7.405,20 € 1.401.022,43 € 6.938,60 € 8.056.046,40 € 8.041,53 € Los profesores José Luis Navarro Espigares/ Elisa Hernández Torres, en su estudio publicado en Gaceta Sanitaria en 2007, indicaron que el coste de este tipo de implantes se situaba en 7.936,12 € (Navarro Espigares JL, 2008). Figura 47.- Costes de la Prótesis de Cadera El coste medio de las prótesis implantadas en nuestros pacientes a lo largo de estos años ha sido el siguiente: Tabla 78.- Coste de las prótesis. Coste de las Prótesis 5.000,00 € 4.000,00 € 3.000,00 € Prótesis Total 2.000,00 € Prótesis Parcial 1.000,00 € - € 2009 2010 2011 2012 2013 2014 Figura 48.- Evolución anual del coste de los implantes. 171 Como puede observarse el coste del material de los implantes ha seguido una tendencia a la baja, fruto principalmente de la mejora en los procesos de adquisición llevado a cabo por el Servicio de Suministros del Área de Salud. Que ha logrado una reducción del 32,27% desde el año 2009 en las adquisiciones para pacientes de Prótesis Total de Cadera y del 13,68% para los pacientes que precisaban de una Prótesis Parcial de Cadera. 5.7.- Análisis de Diagnósticos por Codificación La codificación fractura de cadera es complicada por las razones que a continuación exponemos. La fractura de la extremidad proximal del fémur, conocida también como fractura de cadera, constituye la complicación clínica más grave de la osteoporosis, condicionando un aumento tanto de la morbilidad como de la mortalidad de los pacientes que la sufren. Prácticamente todas las fracturas de cadera ingresan en los hospitales, y allí son mayoritariamente intervenidas quirúrgicamente. Desde hace muchos años, en todos los hospitales de nuestro país se aplica un sistema de codificación de las enfermedades, basado en la clasificación internacional de enfermedades, o CIE 9. Tanto en la Historia Clínica como en las bases de datos de los archivos hospitalarios se aplican estos códigos Podría pensarse que la recogida de datos epidemiológicos sobre las fracturas de cadera es sencilla, ya que al ingresar prácticamente todas en los hospitales, serían fácilmente identificables. Sin embargo, creemos que en la realidad esto no ocurre, y que es posible que se esté perdiendo información sobre la prevalencia real tanto de las fracturas de cadera como de la osteoporosis y las fracturas vertebrales, porque la actual codificación permite muchas opciones. Así por ejemplo, una fractura de cuello de fémur en una anciana de 80 años que cae al suelo al resbalar, si se recoge el resbalón como causa de la caída se codificará como E885.9, y si no se especifica cómo se produjo la fractura se usa el código E887, "fractura con causa no especificada". Sin embargo, si el facultativo considera que la fractura es consecuencia de la osteoporosis, la misma fractura podría ser codificada como 733.14, "fractura patológica de cuello de fémur", debiendo estar precedida por el código 733.00 que corresponde a "osteoporosis no especificada". Vemos, por lo tanto, que la misma fractura puede ser codificada de 3 maneras diferentes y todas ellas correctas. 172 La misma confusión puede observarse en el caso de la fractura vertebral, que puede ser codificada de nuevo como 733.00 ("osteoporosis") y después 733.13, "fractura patológica de vértebras". Sin embargo, si el clínico indica sólo fractura vertebral y no especifica la existencia de una osteoporosis, el código que le correspondería es el 805.8 ("fractura vertebral no especificada, cerrada"). Para completar la confusión, también se codifica como 733.00, y, por lo tanto, se considera "osteoporosis" cuando en el informe clínico se recogen los términos vértebra adelgazada, degeneración cuneiforme de la vértebra, o vértebra cuneiforme, los cuales, posiblemente, estarían mejor recogidos como fracturas vertebrales. Finalmente, si se recoge como diagnóstico "osteoporosis", ésta puede codificarse como 733.00 ("osteoporosis no especificada"), 733.01 ("osteoporosis senil"), 733.02 ("osteoporosis idiopática"), 733.03 ("osteoporosis por desuso") y 733.09 ("otras"). Es preciso llamar la atención sobre el hecho de que, probablemente, existan muy diversas formas para codificar tanto la osteoporosis como las fracturas por fragilidad. Y ello nos lleva a la reflexión de que, en el momento de realizar un estudio epidemiológico sobre cualquiera de estos procesos en un ámbito hospitalario, debe tenerse en cuenta todas y cada una de las posibilidades existentes para codificar los procesos, porque de otra manera, con toda seguridad, se estarían perdiendo casos. Por último, planteamos desde estas palabras la propuesta de intentar unificar entre los clínicos que la expresión diagnóstica utilizada alcance el mayor nivel de especificidad posible, de manera que, al codificar en las historias clínicas tanto las fracturas de cadera como las vertebrales, se obtenga el código único más preciso y especifico entre los existentes. CODIFICACION CLINICA CON LA CIE-9-MC Clasificación según las lesiones de partes blandas asociadas: - Fracturas cerradas, son aquellas fracturas en las que la piel que las recubre está intacta. - Fracturas abiertas, son aquellas en las que el foco de fractura comunica con el medio externo, bien porque un fragmento de la fractura perfora la piel desde dentro, o bien porque un objeto agudo daña la piel para fracturar el hueso desde fuera. La Clasificación Internacional de Enfermedades (CIE-9-MC) contempla las fracturas en el capítulo 17: "Lesiones y envenenamientos" (800-829). Se debe emplear un código E adicional y específico para identificar la causa de la lesión, cuando ésta sea conocida o bien el código E887 si la causa es desconocida. 173 En ausencia de mayor información, según la CIE-9-MC, se considerará como cerrada cualquier fractura que incluya las siguientes descripciones: (conminuta), (con elevación), (con fisura), (con hundimiento), (de la marcha), (de caña, madera o tallo verde), (epifisaria o epífisis desprendida), (espiral o espiroidea), (impactada), (lineal o longitudinal), (simple) y ( no especificada). Se considerará por defecto fractura abierta cuando incluya las siguientes descripciones: (compuesta), (con cuerpo extraño), (infectada), (por herida punzante) y (por proyectil). TRATAMIENTO DE FRACTURA CON PRÓTESIS Un caso especial en el tratamiento de las fracturas, es la sustitución total o parcial de una parte del hueso (generalmente la epífisis proximal de los huesos largos) por prótesis. El caso más frecuente es el tratamiento de la fractura subcapital de fémur mediante la colocación de una prótesis parcial de cabeza de fémur (81.52, Sustitución parcial de cadera). METODOLOGÍA DE ANÁLISIS DE LA HOSPITALIZACIÓN EN EL SISTEMA NACIONAL DE SALUD. Siguiendo este modelo comprobamos que en la identificación de la tipología de fracturas de cadera incluidas en el Proceso FCA, utilizando la Clasificación Internacional de Enfermedades CIE-9-MC(15), se incluyen las personas de edad ≥65 años con diagnóstico principal: 820. Fractura del cuello de fémur 820.0 Fractura transcervical, cerrada 820.1 Fractura transcervical, abierta 820.2 Fractura pertrocantérea, cerrada 820.3 Fractura pertrocantérea, abierta 820.8 Parte no especificada del cuello del fémur, cerrada 820.9 Parte no especificada del cuello del fémur, abierta A su vez, se identifican tres tipos de pacientes con indicación quirúrgica de fractura de cadera: pacientes estables intervenidos en menos de 24 horas, pacientes estables intervenidos después de 24 horas y pacientes inestables que requieren de estabilización previa a su intervención quirúrgica. Quedan excluidos del Proceso FCA los pacientes con fractura de cadera metastásica. 174 Hemos utilizado la nomenclatura que emplea el SES para su codificación y apreciamos que el mayor número de fracturas están codificadas con 820.8 y 820.09, que corresponden a fracturas de cadera sin especificar la parte afecta y a fractura de parte no especificada abierta. 81.51 Cód Diagnóstico Denominación Hombre Mujer 707,X Coxartrosis 5,47% 0,04% 715,X Osteoartosis 77,74% 74,81% 733,X Necrosis aséptica 0,02% 736,X Deformidades adquiridas de la cadera 5,47% 755,X Otra deformidad congénita de cadera 1,82% 820,X Fracturas cuello del fémur Varios Otros 6,20% 0,73% 3,88% 8,74% 15,08% Tabla 79.- Codificación PTC Figura 49.- Codificación PTC 81.52 Cód Diagnóstico Denominación Hombre Mujer 2,80% 3,04% 707,X Coxartrosis 715,X Osteoartosis 1,38% 808,X Fractura pelvis neom-cerrada 1,10% 820,X Fracturas cuello del fémur 959,X Traumatismo cadera no especificado Varios Otros Tabla 80.- Codificación PPC 175 85,05% 88,12% 87,85% 95,03% 1,38% Figura 50.- Codificación PPC 5.8.- El Cuadro de Mando Integral como herramienta útil para la gestión estratégica en las organizaciones sanitarias. Entre las soluciones que plantemos para un correcto seguimiento del coste de los procesos se encuentra la figura del Cuadro de Mando Integral (CMI), como herramienta para la gestión estratégica de las organizaciones sanitarias. El Cuadro de Mando Integral (CMI) como hemos indicado anteriormente, es una herramienta de gestión, que facilita la comunicación y la puesta en funcionamiento de la estrategia organizacional, es decir, es un marco que contiene un conjunto de indicadores seleccionados que ayudan a la organización a ejecutar sus factores claves para éxito, los cuales son definidos al generar la visión estratégica del centro sanitario. Los responsables de los centros sanitarios deben controlar el gasto sanitario y llevarlo a unos niveles que puedan ser financiados por los presupuestos del Estado y por los propios contribuyentes. Teniendo en cuenta las particularidades del sector sanitario, la elaboración de un CMI para este tipo de organizaciones, tiene que adaptarse a las mismas, para lograr que la utilización de esta herramienta tenga el éxito esperado, ya que en caso contrario, estaría destinada a un escaso uso, y por tanto a su arrinconamiento. 176 El nacimiento del Cuadro de Mando Integral El CMI en una herramienta de gestión que ayuda a comunicar y a poner en funcionamiento la estrategia de una organización, es decir, es un marco que contiene un sistema de medidas financieras y no financieras, seleccionadas para ayudar a la organización a poner sus factores claves de éxito en ejecución, los cuales se definen en la visión estratégica de la compañía (Kaplan & Norton, Using the balanced scorecard as a strategic management system, 1996). El primer CMI fue introducido por David Kaplan y Robert Norton en 1992 (Kaplan & Norton, The Balanced Scorecard - Measures That Drive Performance, 1992), bajo el nombre de Balanced Scoreboard. Surgió de un proyecto de investigación denominado: “La medición del resultado en la organización del futuro”, realizado por estos dos profesores en colaboración con un gran número de importantes empresas, tras la detección del uso de métodos de información insuficientes para el control y gestión de la actividad empresarial. Estos autores sostenían, que la mayoría de las organizaciones basaban el control y evaluación de su desempeño en resultados e indicadores financieros, lo cual suponía una clara pérdida de información tanto cualitativa como cuantitativa, además teniendo en cuenta el marcado carácter histórico y cortoplacista de que gozan el tipo de ratios utilizados (Kaplan & Norton, Using the balanced scorecard as a strategic management system, 1996). En esta línea, Kaplan y Norton justificaban la obsolescencia de este tipo de sistemas, especialmente en un contexto caracterizado por una creciente complejidad, y un ritmo de cambio muy acelerado. En este sentido, consideraban que en este tipo de entornos la ventaja competitiva basada únicamente en el ahorro de costes pronto sería insuficiente para mantener una posición privilegiada en el mercado, especialmente teniendo en cuenta la importancia creciente de la diferenciación y los activos intangibles (básicamente la innovación y el conocimiento) (Kaplan & Norton, Using the balanced scorecard as a strategic management system, 1996). Así, la utilidad del Cuadro de Mando Integral no consiste en la mera localización de posibles fuentes para la reducción de costes, sino en la posibilidad de contar con un instrumento estratégico que permita traducir la misión de la organización en objetivos concretos y realistas, tanto a nivel corporativo como operativo, vinculando visión, misión y estrategia; facilitando el camino hacia el éxito. (Kaplan & Norton, Using the balanced scorecard as a strategic management system, 1996). 177 En el primer CMI introducido por David Kaplan y Robert Norton (Kaplan & Norton, The Balanced Scorecard - Measures That Drive Performance, 1992), afirmaban que las medidas o los indicadores financieros no eran suficientes para conocer el estado o funcionamiento de una compañía. Introdujeron tres categorías adicionales que resaltaban aspectos no financieros. Éstas son: la satisfacción de cliente, el proceso interno del negocio, y el aprendizaje y crecimiento. Estos autores pensaron en estas tres categorías adicionales, como medidores del funcionamiento presente y futuro de la compañía, mientras que la perspectiva financiera representa la última perspectiva. El CMI mide la actuación de la organización desde cuatro perspectivas equilibradas: Figura 51.- Visión y Estrategia a) La financiera. Vincula los objetivos de cada unidad asistencial con la estrategia del Área de Salud. Sirve de enfoque para todos los objetivos e indicadores de las demás perspectivas. b) Los pacientes. Identifica los segmentos de paciente y labor asistencial donde se va a competir. Mide las propuestas de valor que se orientan a los pacientes y asistenciales, evaluando las necesidades de los pacientes, como su satisfacción y coste/rentabilidad con el fin de alinear los productos y servicios con sus preferencias y traduce la estrategia y visión en objetivos sobre pacientes y segmentos de población, siendo éstos los que definen los productos y servicios. 178 c) Los procesos internos. Define la cadena de valor de los procesos necesarios para entregar a los pacientes soluciones a sus necesidades. Los objetivos e indicadores de esta perspectiva se derivan de estrategias explícitas para satisfacer las expectativas de los pacientes. d) El aprendizaje y el crecimiento. Se obtienen los inductores necesarios para lograr resultados en las anteriores perspectivas. La actuación del personal, se refuerza con agentes motivadores que estimulen sus intereses hacia la organización. Se miden las capacidades de los empleados, las capacidades de los sistemas de información, y el clima organizacional para medir la motivación y las iniciativas del personal. El CMI fomenta que las medidas financieras y no financieras deben ser una parte del sistema de información para los empleados en todos los niveles de la organización, traduciendo la misión y la estrategia de la unidad asistencial a objetivos y a medidas tangibles. El CMI utiliza los indicadores y medidas para comunicar e informar a los empleados sobre la trayectoria actual y futura de la organización. Una ventaja importante de esta herramienta, es el énfasis que pone en unir las medidas de funcionamiento a la estrategia de la unidad asistencial. Sin embargo, el uso de excesivos controles puede conducir también a la resistencia u oposición de los empleados. Las medidas de funcionamiento deben ser completas, medibles y controlables. Si uno de estos criterios no se cumple, los medidores no se vincularán a las operaciones diarias de los empleados. Las organizaciones sanitarias no son receptivas al cambio, ya que a los empleados no les agrada ser controlados ni evaluados; asimismo, el CMI requiere que los responsables de las distintas áreas que son receptoras de gran parte de la información, distribuyan la misma a los niveles más bajos de la organización. Los sistemas de medición de una organización afectan con gran incidencia al comportamiento del personal propio y de los pacientes. Si las organizaciones tienen como objetivo su supervivencia y la mejora continua, deben utilizar sistemas de medición y de gestión, derivados de sus estrategias y capacidades. 179 Las utilidades de un CMI son las siguientes: ü Clarificar y poner al día la estrategia ü Comunicar la estrategia dentro de la compañía ü Alinear las metas individuales con la estrategia ü Vincular los objetivos a los presupuestos a largo plazo ü Conducir las revisiones del funcionamiento orientadas a mejorar la estrategia. El CMI no es una plantilla o modelo estándar que se pueda aplicar a todos los negocios en general o aún a nivel industrial. Las diferentes situaciones del mercado, las estrategias del producto y los ambientes competitivos requieren aplicaciones diferentes. Cada unidad de negocio debe adaptar su CMI a los requisitos particulares de su misión, estrategia, tecnología y cultura. Un factor clave para el éxito de esta herramienta es su transparencia y manejabilidad; a partir 15 ó 20 indicadores o medidores, un observador deben poder determinar el funcionamiento de la unidad de negocio (Kaplan & Norton, Putting the balanced scorecard to work, 1993). La aplicación del Cuadro de Mando Integral en el ámbito sanitario. Un centro sanitario se puede asemejar a una empresa oferente de servicios, con la particularidad de que su producto o servicio es ofrecido en el mismo instante en el que es generado (Pastor Tejedor, 2004). Dicho producto, el "producto sanitario", es el resultado de los siguientes procesos: a) El proceso clínico, que consiste en aplicar los conocimientos médicos al cuidado de los pacientes, pudiéndose resumir en: diagnóstico y tratamiento. b) El proceso funcional, cuyo objetivo es proporcionar y generar productos y actividades intermedias que puedan ser utilizados en el proceso clínico. c) El proceso logístico, que pretende proporcionar servicios para acomodar al usuario y facilitar la infraestructura para la aplicación de los procesos clínicos y funcionales. Teniendo en cuenta estas particularidades, la elaboración de un CMI para este tipo de organizaciones, tendrá que adaptarse a las mismas, para lograr que la utilización de dicha herramienta sea exitosa, ya que en caso contrario, estaría abocada a su escaso uso, y por tanto a su desaparición. 180 Partiendo de una perspectiva crítica, se puede afirmar que la tecnología empleada por los centros sanitarios españoles es bastante mejorable, ya que los gastos informáticos suponen una pequeña proporción con respecto al presupuesto total del Ministerio de Sanidad y Consumo, con lo cual es realmente difícil encontrar verdaderos sistemas de información en las instituciones sanitarias. Para elaborar e implantar un buen sistema de información, es determinante que los centros sanitarios, posean: • Sistemas de apoyo a la toma de decisiones. • Sistemas de gestión de informes clínicos. • Tecnologías de red interna (Intranet) y externa (Internet) • Sistemas de gestión integral de la actividad. Las perspectivas tradicionales del modelo original diseñado por Kaplan y Norton, debe reformularse para el ámbito sanitario, del siguiente modo: Perspectiva financiera Mejorar la eficiencia en la utilización de los recursos para cumplir con las restriciciones presupuestarias. Objetivo estratégico Objetivos Operativos Mejorar la canalización de la demanda de servicios sanitarios Mejorar el rendimiento de los Recursos Humanos Mejorar el rendimiento del material sanitario Indicadores Número y evolución de estancias evitables Número y evolución de los huecos en las agendas de los profesionales en consulta Vida útil de los uttensilios y materiales sanitarios Tabla 81.- Perspectiva financiera Perspectiva del cliente Objetivo estratégico Objetivos Operativos Mejorar al confianza de los pacientes Mejorar la calidad del servicio Mejorar la satisfacción de los clientes Indicadores Espera media en Lista de Espera de Consultas Índice de consultas sucesivas/primeras Tabla 82.- Perspectiva del cliente 181 Perspectiva de procesos internos Objetivo estratégico Alcanzar la excelencia Objetivos Operativos Optimizar la calidad de los diagnósticos Optimizar el número de prestaciones necesarias para el diagnóstico, recabando la máxima información con el menor número de pruebas. Indicadores Numero de prestaciones por paciente Número de consultas de alta resolución Tabla 83.- Perspectiva de procesos internos. Perspectiva de aprendizaje y crecimiento Mejorar la calidad de los recursos con los que cuenta la Objetivo estratégico organización (humanos, tecnológicos y organizativos), apostando por la innovación y el conocimiento. Objetivos Operativos Indicadores Mejorar la calidad de los Satisfacción del personal sanitario Recursos Humanos Mejorar los recursos Tiempo dedicado por los facultativos a la investigación y organizativos a la formación Mejorar la utilidad y calidad de los sistemas tecnológicos e Grado de registro de la actividad desarrollada informáticos Tabla 84.- Perspectiva de aprendizaje y crecimiento. Es importante hacer una puntualización: El Cuadro de Mando Integral no debe ser percibido como una simple agrupación de índices e indicadores, sino que debe ser entendido como un sistema de información, gestión y comunicación útil que toda la organización debería tener para el logro de las metas marcadas a nivel estratégico, con independencia de su carácter público o privado o de su finalidad mayoritariamente económica o social. Una propuesta para el Área de Salud de Badajoz del Servicio Extremeño de Salud El SES también se ha visto afectado por la profesionalización de la gestión, corriente que ha afectado muy positivamente a la información de carácter económico, que ahora goza de mayor peso relativo dentro de las agendas de sus responsables. Si bien todavía quedan muchos pasos por dar. 182 Estos responsables necesitan públicos necesitan con frecuencia información acerca de los servicios que ofrecen en los centros que se encuentran bajo su responsabilidad, así como de las actividades necesarias para su producción y del coste que las mismas llevan asociado para identificar las diferentes alternativas existentes. Tal información les permite distinguir entre las actividades que aportan valor y aquellas que no lo hacen, obteniendo así un mapa económico de la organización cuyo trazado posibilita un uso más racional y eficiente de los recursos, estimulando al mismo tiempo los procesos de mejora continua. Para dar respuesta a esta necesidad, se deben poner en macha y desarrollar Sistemas de Contabilidad Financiera, de Costes y de Gestión dentro del ámbito sanitario, un entorno hasta hace relativamente poco dominado por la información de carácter puramente asistencial. De esta forma, entre los motivos que justifican la introducción del Cuadro de Mando Integral, además de la necesidad de implantar diversos Sistemas de Información Contable a partir de los cuales obtener información que los responsables de la gestión precisan, existe una causa que resulta determinante: la necesidad de vincular los distintos tipos de fuentes de información existentes para obtener una visión global que permita una evaluación de cada Servicio como un todo interrelacionado, posibilitando la toma de decisiones adecuadas orientadas al logro de los objetivos inicialmente marcados y a la corrección de los posibles errores detectados. A continuación se hace una propuesta de estructura del Cuadro de Mando que podría ser utilizado para el seguimiento del desempeño y rendimiento de los Centros de Atención Especializada del Área de Salud de Badajoz. 183 Indicadores para servicios médicos y quirúrgicos Estructura Camas de hospitalización Camas de hospital de día Sesiones de consultas externas Recursos Humanos Jefes de servicio Jefes de sección Médicos adjuntos Médicos residentes Hospitalización Camas disponibles Ingresos totales Ingresos programados Ingresos urgentes Ingresos por traslado interno Presión de urgencias Total de estancias Estancias de pacientes altas en otros servicios Estancias de las altas propias Altas totales Altas por traslado interno Altas a otros centros Altas por fallecimiento Interconsultas Servicios solicitantes de interconsultas Consultas externas Primeras visitas Visitas sucesivas Índice de primeras visitas/sucesivas Pruebas complementarias Número de exploraciones por tipo Pacientes por tipo de exploración Servicios peticionarios Número exploraciones/paciente Número exploraciones/médico Consumo de recursos Número de determinaciones solicitadas a laboratorios Número de ecografías solicitadas Número de tac solicitados Número de RNM solicitadas Número de endoscopias digestivas solicitadas Número de broncoscopias solicitadas Número de ecocardiogramas Gastos Total de personal Personal fijo Contrataciones eventuales Guardias Material de aprovisionamiento Material sanitario Prótesis Farmacia Gasto en unidosis planta Gasto de botiquín de planta Gasto de tratamientos hospital de día Orientación al paciente Porcentaje de horas de consultas con programación para 3 meses Indice de entradas/salidas lista de espera (le) de consultas Pacientes en le consultas > 30 días Espera media en le consultas Pacientes en le por exploración Espera media en le por exploración Número de quejas-reclamaciones/consultas Número de quejas-reclamaciones/ingresos Número de quejas-reclamaciones/exploraciones Número de quejas-reclamaciones con respuesta en < 30 días Número de primeras consultas con informe elaborado Número de pacientes con dispensación por unidosis/total pacientes Optimización de recursos Estancia media Índice de ocupación (%) Índice rotación enfermo/cama Índice ocupación hospital de día (%) Índice de rotación enfermo/cama en hospital de día Rendimiento consultas Porcentaje de descitaciones consultas Indicadores para servicios quirúrgicos Estructura Número de sesiones quirúrgicas con anestesista Número de sesiones quirúrgicas sin anestesista Quirúrgica Intervenciones totales Intervenciones programadas con anestesia general con ingreso Intervenciones programadas con anestesia local con ingreso Intervenciones programadas con anestesia general sin ingreso Intervenciones programadas con anestesia local sin ingreso Intervenciones urgentes con anestesia general Intervenciones urgentes con anestesia local Orientación al paciente Índice entradas/salidas de le quirúrgica Pacientes en le quirúrgica > 180 días Espera media en le quirúrgica Optimización de recursos Rendimiento quirúrgico Porcentaje desprogramaciones quirúrgicas Implantación de áreas de mejora Estancias prequirúrgicas/paciente Investigación y docencia Número de sesiones clínicas Número de ensayos clínicos Número de becas o proyectos Número de becarios Número de publicaciones Número de ponencias y comunicaciones Número de horas cursos recibidos Número de horas cursos impartidos Implantación de áreas de mejora Número de protocolos o guías de práctica clínica evaluados/año Número de protocolos o guías de práctica clínica Número de casos GDR 470/total GDR Número de necropsias/total de fallecimientos Tasa de infección hospitalaria Tasa de reingresos urgentes por igual GDR GDR con estancia 0 Número de estancias potencialmente ambulatorias/total de estancias Tabla 85.- Indicadores para el Cuadro de Mando Integral. Fuente: Astier Peña et al. 2004 184 SERVICIO DE TRAUMATOLOGÍA ACTIVIDAD Procedimientos Esqueleto periférico y axial osteotomía y osectomía. Otras operaciones sobre huesos, del esqueleto periférico y axial Reducción de fracturas y luxaciones Incisión y excisión de estructuras de las articulaciones (cápsula, cartílago, ligamento, membrana sinovial, menisco) Operaciones de reparación sobre estructuras de la articulación Operaciones sobre músculos, tendones, y fascias de la mano (aponeurosis, membrana sinovial, vaina de tendón) Operaciones sobre músculo, tendón, fascia y bolsa sinovial excepto de la mano Otros procedimientos sobre aparato musculoesquelético Traumatología Pediátrica Procedimientos diagnótsticos Procedimientos terapéuticos ene-12 ene-13 Var. 2012 ac. Hospitalización Ingresos Totales Estancia Media Índice de rotación % de ocupación Índice de mortalidad Consultas Externas Primeras consultas Sucesivas consultas Relación primeras/sucesivas Consultas alta resolución Demora Citacion Global Pruebas Nº de citas con demora de más de 30 días Media (dias) Mediana (dias) Nº total de actividad Datos Globales de Lista de Espera Nº total de citas Medía (días) Mediana (dias) CALIDAD % Reclamaciones y quejas/Total Pruebas % Reclamaciones y quejas/Total Intervención Tasa de infección nosocomial FORMACIÓN % Horas de Formación/Total plantilla ACTIVIDAD ECONÓMICA Costes de Funcionamiento Otro material sanitario Reparación de equipos médicos asistenciales Prótesis Consumo de Productos Farmaceúticos Resto de Coste de Funcionamientos Inversiones realizadas RECURSOS HUMANOS Gastos de personal por Categoría profesional ADJ / FEA ATS / DUE AE TÉCNICO ESPECIALISTA AUXILIAR ADMINISTRATIVO TELEFONISTA CELADOR Nº de empleados a tiempo completo por Categoría y Área de Personal EVENTUAL ADJ / FEA ATS / DUE AE TÉCNICO ESPECIALISTA AUXILIAR ADMINISTRATIVO TELEFONISTA CELADOR FIJO / INTERINO ADJ / FEA ATS / DUE AE TÉCNICO ESPECIALISTA AUXILIAR ADMINISTRATIVO TELEFONISTA CELADOR % Eventuales/ Gastos de Personal Tabla 86.- Cuadro de Mando Integral del Servicio de Traumatología y Ortopedia. Elaboración propia. 185 2013 ac. Var. 186 VI.- DISCUSIÓN 187 188 VI.- DISCUSIÓN En Estados Unidos, durante el año 2009, la artrosis fue la cuarta causa de hospitalización y la principal indicación de reemplazo de las articulaciones con un coste de 42.300 millones de dólares (Murphy L, 2012). A partir del decenio de 1990, el remplazo de cadera es una intervención segura de indicación creciente (Harris WH, 1990). En Europa este tipo de cirugía también ha experimentado gran incremento en las últimas décadas. (Dixon T, 2004). El coste para el Área de Salud de Badajoz, durante los años 2009 a 2014 ha sido de 8.056.046,40€. Algunos estudios (Rissanen P, 1997) apuntan que el coste promedio de estas intervenciones, al alta hospitalaria, es de 10.500 dólares. En Francia, el Estudio Nacional de Costes estimó en el año 2006 que el costo de la artroplastia total de cadera fue de 7.677 € y 6.358 € para las intervenciones con y sin comorbilidades asociadas, sin incluir el costo de la prótesis. (Le nout T, 2010). Tabla 87.- Costes de prótesis de cadera. 2007. Sociedad Española de Geriatría y Gerontología, Sociedad Española de Cirugía Ortopédica y Traumatología y Elsevier Doyma. El coste promedio en el Área de Salud de Badajoz, en el período analizado ha sido de 8.041,53€, muy superior a los indicados en la tabla 87. Entendemos que las sociedades emisoras del informe citado no incluyen los costes de las prótesis, tan sólo los costes de intervención y hospitalización, que en nuestro caso dicho coste es de 5.283 €, que se corresponde con el tramo superior representado en la tabla 87. La elevada prevalencia de la artrosis en los países occidentales y el elevado costo de las intervenciones de artroplastia de cadera ha suscitado el interés por comparar los costes asociados antes y después de la cirugía. (Bozic KJ, 2012) (Hawker GA, 2009). En estas intervenciones quirúrgicas, al igual que en otras áreas clínicas, (DE., 1998) (Marión Buen J, 1998) existen amplias variaciones en la práctica médica, con gran incertidumbre respecto a la duración del seguimiento posterior al implante. En nuestro estudio la prevalencia de la artrosis es del 43,06 % del total de casos de pacientes a los que se les ha tenido que implantar una prótesis de cadera. 189 La necesidad de atención apropiada y ética encuentra su única salida en la medicina costo-efectividad. (VR., 2011). No obstante, es complicado conciliar el compromiso de la atención costo-efectividad con el principio fundamental de la primacía en el bienestar del paciente. El debate sigue abierto y las soluciones en la organización son complicadas (copago, asignación de presupuestos cerrados a poblaciones, etc.). Según estudios encargados por la Unión Europea, el gasto promedio en salud que recibe una persona de más de 65 años cuesta de 2,7 a 4,8 veces el gasto promedio de una persona de 064 años. Esto significa que entre el 35 al 50 % del gasto en salud en la vida de una persona se registra en esta última etapa, cuando generalmente deja de ser un ente productivo. En los próximos 20 años, los cambios en el tamaño y estructura de la población mundial incrementarán los costos de salud necesarios en el 14 % en Europa y Asia Central, 37 % Asia del Este y Pacífico, 45 % Asia del Sur, 47 % América Latina y el Caribe, 52 % en África del Sur y 62 % en Oriente Medio y África del Norte. (Unión Europea, 2008) Se ha determinado el coste de las intervenciones de reemplazo total y parcial de cadera, durante la estancia hospitalaria, de los pacientes atendidos en el Complejo Hospitalario de Badajoz, perteneciente al Servicio Extremeño de Salud. La necesidad de conocer los costes de la actividad realizada para conseguir una mayor eficiencia en el rendimiento de los recursos públicos así como la búsqueda de mecanismos para hacer más transparente la asignación de recursos a cada centro proveedor ha propiciado la necesidad de dotar a los distintos sistemas sanitarios de unos sistemas de información fiables y de bien dimensionados, que permitan el acceso a la información, a su comparación, a su análisis abriendo de esta forma la posibilidad de realizar aportaciones de mejora que redunden en una mejor prestación de servicio. Pero como punto de partida, nos encontramos con dificultades para el acceso a la información por un lado, y a la calidad de la misma. Estas dificultades para obtener información sobre costes de los centros hospitalarios tienen tres causas principales: • No existía y no existe actualmente una cultura de análisis del coste por actividad realizada. La gestión de los centros hospitalarios podía realizarse contando únicamente con la contabilización general de los gastos que permitiera justificar su reembolso global por parte de la administración. • No existe información de precios puesto que la predominancia del sector público impide que haya un mercado que genere información de precios de los distintos productos y servicios relacionados con la prestación de servicios sanitarios 190 • La dificultad de definir producto en la provisión de servicios sanitarios ha provocado grandes dificultades en los intentos de valoración de la actividad realizada. Para avanzar en el conocimiento del coste por actividad provocado por la provisión de servicios sanitarios es necesario reconocer la naturaleza multiproducto de la función de producción de un hospital: Hospitalización, Actividad ambulatoria, Urgencias, Docencia e Investigación. Solamente de esta manera se puede concretar el análisis a relaciones abordables entre dispositivos asistenciales y su actividad. El conjunto del estudio que se presenta, se ha concretado en el análisis del coste hospitalario correspondiente a la actividad de internamiento. Para superar las dificultades generales que se acaban de expresar sobre el desconocimiento del coste unitario observado de las actividades relacionadas con la atención del paciente ingresado y la dificultad de disponer de una definición de producto hospitalario, en la investigación aplicada se han realizado una serie de avances que serán el punto de partida de este estudio. Ø Se han diseñado sistemas de clasificación de pacientes (casemix) que se basan en su agrupación en un reducido número de categorías de producto bajo criterios de consumo de recursos, homogeneidad clínica. Los distintos sistemas de salud regionales han optado por distintas versiones de los llamados Grupos Relacionados por el Diagnóstico (GRD). El presente estudio se ha basado en los GRD de la Heath Care Financing Administration utilizados por el Servicio Extremeño de Salud, aunque se han utilizado también otros sistemas de agrupación para valorar las diferencias en sus posibilidades en el análisis de costes. Ø Proyectos de asignación de costes del tipo coste por paciente ingresado ( a partir de ahora clinical-cost) basados en técnicas de contabilidad analítica que han permitido repartir el conjunto del coste de un período al nivel de los pacientes ingresados. Para este estudio se ha contado con el coste por paciente observado de 1.001 pacientes pertenecientes al Complejo Hospitalario de Badajoz. La incidencia de este tipo de procesos en Extremadura, y más concretamente en el Área de Salud de Badajoz, es de 384 casos por cada 100.000 habitantes, encontrándose -dentro de los casos observados/esperados en el año 2012, según el grupo Atlas VPM, tomando datos de 203 áreas sanitarias- por debajo del 50%, tal y como se refleja en las figuras siguientes: 191 Figura 52.- Artroplastia Total de Cadera. SNS 2012. Fuente Atlas VPM 2014 Figura 53.- Artroplastia Total de Cadera. SNS 2012. Fuente Atlas VPM 2014 La búsqueda bibliográfica, con las grandes dificultades que ello comporta, debido a los diferentes criterios de cada uno de los autores consultados, y a la falta de homogeneidad en las definiciones de los procesos y procedimientos; nos ha obligado a confeccionar una información comparativa, en base a tres variables: coste, edad media y estancia media. Costes.En el año 2007, José Luis Navarro Espigares y Elisa Hernández Torres, calcularon un coste para el proceso de prótesis de cadera. Realizaron un estudio en el que incluyeron a 40 pacientes con esta patología y alcanzaron un coste por proceso de cadera de 7.891,21 € (Navarro Espigares JL, 2008). Frente a los 8.041,53€ del costes calculado para el Área de Salud de Badajoz. La firma IASIST, publicó dentro de su ranking de los mejores hospitales a nivel nacional, de los que recogen información puntual, un coste medio por episodio de 9.978 €. (IASIST, 2011). Desconocemos si se incluyen o no los costes de las prótesis. En cualquier caso, nos encontramos por debajo del coste marcado por esta organización. 192 En el estudio del año 2013, sobre las variables asociadas al coste de la prótesis de cadera de Carmen Herrera-Espiñeira (Herrera-Espiñeira, 2013), el costo promedio por paciente, sin incluir el costo de la prótesis, fue de 4.734 € ± 2,136; si se incluye el costo de la prótesis, al final del año el costo total asciende a 7.645 € ± 2.248. Tabla 88.- Comparativo de costes calculados El coste medio calculado en nuestro estudio, realizado durante los años 2009 a 2012, de todos aquellos pacientes a los que se les ha implantado una prótesis de cadera, es de 8.041,53 €. Si bien es preciso hacer la diferenciación, entre los procesos de Prótesis Total de Cadera, con un coste medio del período de estudio de 8.839,74€; y el coste medio para las Prótesis Parciales de Cadera, situado en 7.243,32 €. Si hiciéramos la diferenciación entre procesos con o sin la inclusión del coste de las prótesis como hacen el resto de autores, el resultado de nuestro cálculo sería el expresado en la siguiente tabla: Tabla 89.- Coste medio final sin incluir las prótesis Que expresado en términos medios, tendríamos un coste medio del proceso sin la inclusión de los importes de las prótesis de 5.283,31€, con un precio medio de prótesis de 2.863,57€. Estancia Media. Otro de los factores relevantes en nuestro estudio, además del número de casos estudiados, el coste de los implantes realizados es la estancia media, en cuanto a su peso sobre el coste final de cada uno de los episodios analizados. Carmen Herrera-Espiñeira (Herrera-Espiñeira, 2013), concluyó en su estudio que el promedio de días de estancia fue de 9.88 ± 4.46, con gran diferencia entre hospitales y entre comunidades. 193 Elena García García, en su tesis doctoral de 2011, “Evaluación de la estancia hospitalaria en prótesis de cadera” (García García, 2011), refleja unas estancias media en cada uno de los procesos analizados. Para el 81.51, expresa una estancia media de 10,08 días y para el proceso 81.52 de 17,91 días. Con unos costes por estancia de 256,25€ y 231,23€, respectivamente. Comparando estos resultados con los calculados para nuestro Área de Salud tenemos: Tabla 90.- Comparativa estancias/coste estancias La estancia media en el Área de Salud de Badajoz, es en términos de promedio de 11,01 días. Dato que se encuentra dentro de los márgenes expresado en los estudios de Elena García y la Fundación Signo. Si hacemos la diferenciación entre PTC y PPC, nos encontramos con unas estancias medias que se sitúan entre las más ajustadas del país, durante los años 2009 a 2014. Edad Media Y para finalizar, en términos de edad media de los pacientes que han sido intervenidos en nuestro Área de Salud de Badajoz, frente a diversos estudios, se encuentra dentro de los parámetros medios. Si bien, debo indicar que aquí nos encontramos con grandes dificultades a la hora de poder hacer una comparación, puesto que la incidencia entre Prótesis Total de Cadera y Prótesis Parcial de Cadera entre los distintos autores en ocasiones es muy dispar, pues no hacen referencia exacta a esta división, siendo por tanto de gran complejidad realizar dicho estudio comparativo. La edad media que se expresa en distintas publicaciones se sitúa entre los 65 y los 82 años, haciendo referencia a prótesis de cadera. Sin hacer diferenciación clara entre procesos de Prótesis Total de Cadera o Prótesis Parcial de Cadera. Por ello, nuestra edad media de 64,53 años para las Prótesis de Totales de Cadera y 81,61 años para las Prótesis Parciales de Cadera se encuentran dentro de las medias expresadas. Hemos analizado pues todas las variables que influyen en el cálculo del coste de implante de las prótesis totales y parciales de cadera, durante los años 2009 a 2014, en el Complejo Hospitalario de Badajoz. Ha sido un proceso laborioso por las razones enunciadas a los largo del estudio. Fundamentalmente nos hemos encontrado con un sistema de información con muchas fuentes, algunas de ellas dispersas. 194 Ello nos ha obligado a un trabajo de síntesis, cálculo manual e investigación sobre el terreno. Dificultades que se observan en la mayor parte de los sistemas de información sanitarios que en la actualidad se tienen en funcionamiento. Por todo ello, debemos recomendar a los gestores sanitarios una mayor involucración en la cantidad y en la calidad de la información que se introduce en los distintos sistemas. Sólo teniendo como partida, una información fiable es posible realizar un análisis exhaustivo y de cuyos resultados podamos extraer conclusiones, con el fin de poder realizar una mejora continua de los sistemas y procedimientos empleados. Todo ello redundarán sin lugar a dudas en una mejora de la prestación del Sistema Nacional de Salud, del que tan orgullosos nos encontramos. El resultado, a pesar de las barreras que nos hemos obligado a sortear, es óptimo, expresa la realidad de la situación del tema que hemos elegido. Nuestros costes se encuentran ajustados, lo cual no significa que tenga el Servicio Extremeño de Salud, de dejar de seguir trabajando en su contención y optimización. Por otro lado hemos propuesto la implantación del Cuadro de Mando Integral, como herramienta compiladora de aquellos datos necesario para la gestión de las unidades asistenciales por parte de los diferentes gestores. La información debe ser transmitida a todos los estamentos implicados en la gestión y deber ser única. Nuestra herramienta lo permite. Además, se trata de una herramienta de fácil implantación, con unos costes muy ajustados y un resultado más que comprobado. 195 196 VII.- CONCLUSIONES 197 198 VII.- CONCLUSIONES 1.- La incidencia de los implantes de cadera en el Área de Salud de Badajoz, ha sido de 1.001 casos de pacientes, lo cual representa una incidencia poblacional de 304,36 casos por cada 100.000 habitantes, para mayores de 65 años. Afectando a un 37,25% de hombres y al 62,75% de mujeres. Relación de 3 a 1, para las mujeres. 2.- La tendencia de los implantes de cadera en el Área de Salud de Badajoz durante los años 2009 a 2014, sigue dos tendencias. Una para las PTC, que se mantienen estables en cuanto al número de afectados para el caso de los hombres y en cambio descendiente para en el caso de las mujeres. Y otra tendencia para las PPC que aumentan un 30,7% en el caso de los hombres y un 18,51% en las mujeres. 3.- El coste para el Servicio Extremeño de Salud durante los años 2009 a 2014, en los implantes de cadera, fue de 8.056.046,40 €, con un coste medio por proceso de implante, incluyendo la prótesis, de 8.041,53 €. 4.- Proponemos la implantación de un cuadro de mando integral para el seguimiento, evaluación y propuestas de mejora en el Servicio de Traumatología del Área de Salud de Badajoz, en base a indicadores de actividad asistencial, costes de procesos y recursos invertidos, con un comparativo plurianual. 199 200 VIII.- RESUMEN. SUMMARY.- 201 202 VIII.- RESUMEN. SUMMARY. Se hace un estudio transversal sobre la incidencia de los implantes de cadera en el Área los procesos 81.51 (PTC) y 81.52 (PPC), que suponen la realización de un proceso de implante de cadera. Lo cual representa una incidencia poblacional de 304,36 casos por cada 100.000 habitantes, estando este dato por debajo del 50% de la media nacional, tal y como se demostró en el estudio de Atlas VPM del año 2012. Con 532 (53,15%) casos de Prótesis Totales de Cadera y 469 (46,85%) para las Prótesis Parciales de Cadera. Las necesidades de implantes de Prótesis Totales de Cadera se han producido en el 51,69% de los hombres y en el 48,31% de las mujeres. Mientras que para las Prótesis Parciales de Cadera, el porcentaje de mujeres es del 77,19%, frente al 22,81% de los hombres. La artrosis incide sobre el 43% de las intervenciones de ambos implantes, mientras que las facturas de cadera están presentes en el 41 % de los casos diagnosticados. El resto de las intervenciones tienen diferentes casuísticas, tales como revisiones, luxaciones o necrosis. La tendencia de los implantes de cadera en la provincia de Badajoz en su Área de Salud de Badajoz durante los años 2009 a 2014, es ascendente desde el año 2009 en términos absolutos. Las PTC en los hombres siguen esta tendencia ascendente, frente al caso de las mujeres donde se contiene dicho ascenso, disminuyendo incluso en el último año. Si bien, en el caso de las PPC, la situación es similar, con incrementos del número de pacientes intervenidos en ambos géneros, con un incremento significativo en el caso de las mujeres. En términos de género las PTC presentan una distribución equitativa entre hombres y mujeres, con un 51,69% para los hombres y un 48,31% para las mujeres. Esta situación se invierte en el caso de las PPC, donde la relación hombre-mujer es prácticamente, de 1 a 4. Concretamente del 22,81% frente al 77,19% de las mujeres. En términos de edad, los datos recogidos se encuentran dentro de la media nacional, tal y como hemos ido recogiendo a lo largo de la presente tesis, tanto para las PTC como para las PPC. Entiendo preciso hacer énfasis en la reducción en cuanto a la edad de los pacientes intervenidos a lo largo de los años, en ambos tipos de implantes. Si comenzábamos nuestro estudio con 67,49 años para los hombres y 66,68 años para las mujeres en las PTC, terminábamos dicha serie con 63,29 y 62,96 años, respectivamente. 203 Ocurriendo exactamente igual con las PPC, de 82,04 para los hombres y 81,08 para las mujeres, en el año 2014, la edad media de los pacientes intervenidos es de 80,56 y 77,88 años, respectivamente. Si bien debemos indicar la gran diferencia de edad entre máximos y mínimos, que van desde los 17 años para el paciente más joven hasta los 100 años del paciente más longevo. Si nos centramos en los grupo de edad, observamos como las mayor parte de los casos en la PTC, se producen entre los 61 y 80 años, concentrándose el 58,10% de nuestros pacientes. Las PPC, se implantan mayoritariamente en el grupo de edad de 76 a 95 años, con el 79,11% de los casos. La tendencia estudiada durante los años 2009 a 2012, en los que hemos podido tener acceso a la información, nos detallan una elevada mortalidad en este tipo de pacientes. El primer año fallecen el 48% de los pacientes recogidos en nuestro histórico. El segundo año, la tasa es del 24% de los paciente intervenidos. Conocer y analizar el coste hospitalario de las fracturas de cadera en el Complejo Hospitalario Universitario de Badajoz, durante los años 2009 a 2014. No ha sido fácil, por los motivos expuestos a lo largo del presente documento. Hemos realizado los cálculos accediendo a los diferentes sistemas de información y bases de datos, capturando la información, procesándola y compilándola, de una forma manual, pues el sistema no aporta el resultado final buscado. Para alcanzar el resultado final hemos descompuesto la totalidad de los costes en cada uno de los centros de coste, tanto principales como auxiliares, con sus consiguientes repartos. Desde los costes del proceso quirúrgico, descompuesto en coste del quirófano, coste anestesia, coste cirujano, coste prótesis y resto de costes auxiliares, hasta los costes de consulta y estancia. Los resultados obtenidos han sido divididos entre el coste de las PTC y las PPC, en cada uno de sus procesos. El coste para el Servicio Extremeño de Salud durante los años 2009 a 2014, en los implantes de PTC fue de 3.344.137,95 €, con un coste medio por proceso de 7.243,32 €. El coste de los implantes de PPC, fue de 4.711.908,46 €, con un coste medio por proceso de implante de 8.839,74 €. Nuestro último objetivo es el de establecer un sistema de información centralizado que aporte información a todos los intervinientes sobre la evolución de la actividad y de los costes de los procesos asistenciales. Permitiendo el acceso a esta información de una forma fácil, rápida y solvente. Para ello se propone la implantación de un sistema de Cuadro de Mando Integral para el Servicio de Traumatología del Área de Salud de Badajoz. Sistema de información que puede ser extrapolado a cualquier otro servicio asistencial y no asistencial. 204 Se trata de un sistema que recupera la información dispersa y la acumula en un documento de fácil lectura para el profesional y para el gestor. Permitiendo con ello la toma de decisiones tanto en términos de salud como en términos de organización y funcionalidad de cada una de las especialidades. Para ello se proponen una serie de indicadores, que son comparados con los datos históricos, con el fin de poder hacer una comparación con el año anterior, y plantear medidas de corrección y mejora. Se trata pues, de una herramienta de gestión, que recoge información tanto del tipo asistencial, como del tipo económica y de recursos humanos. Se trata de un documento de consenso entre los diferentes intervinientes, equipo médico y equipo de gestión; permitiendo lograr una comunicación bidireccional, que ayude a la organización a optimizar sus recursos y con ello a la sostenibilidad del sistema público de salud; siempre con el paciente como foco principal del compromiso del servicio del Área de Salud de Badajoz. SUMMARY.In this transversal study on the incidence of hip implants in the Health Area of Badajoz. 1,001 cases have been detected in patients who have been undergoing processes 81.51 (PTC) and 81.52 (PPC), which represent the performance of a hip implant process. This represents a population incidence of 304,36 cases per 100,000 inhabitants, this figure remains below 50% of the national average, as was demonstrated in the study of Atlas VPM 2012. With 532 (53.15 %) cases of Total Hip Prostheses and 469 (46.85%) for partial hip prosthesis. The implant needs total hip replacements have occurred in 51.69% of men and 48.31% in women. As for partial hip prosthesis, the percentage of women is 77.19%, against 22.81% of men. Osteoarthritis affects 43% of the interventions of both implants, while hip bills are present in 41% of cases diagnosed. The rest of interventions have different cases, such as reviews, dislocations or necrosis. The trend of hip implants in the Health Area of Badajoz during the years 2009-2014, is up since 2009 in absolute terms. The PTC men continue this upward trend, compared to the case of women where such promotion is contained, even decreasing in the last year. Although in the case of PPC, the situation is similar, with increases in the number of patients operated in both genders, with a significant increase in the case of women. 205 In terms of gender PTC have an equal distribution between men and women, with 51.69% for males and 48.31% for women. This situation is reversed in the case of the CFP, where the male to female ratio is almost 1 to 4. Specifically the 22.81% compared to 77.19% of women. In terms of age, the collected data is within the national average, as we have gathered over this thesis, both for PTC and for PPC. I understand the need to emphasize reduction in terms of the age of the patients treated over the years, in both types of implants. If we began our study with 67.49 years for men and 66.68 years for women in the PTC, ended that series with 63.29 and 62.96 years, respectively. Happening exactly the same with the PPC , to 82.04 for men and 81.08 for women, in 2014 , the average age of the operated patients is 80.56 and 77.88 years , respectively. While we must indicate the great age difference between high and low , ranging from 17 to the youngest patient to be 100 years of longest patient. If we focus on the age group , we observed that the majority of cases in the PTC , occur between 61 and 80 years , focusing on 58.10 % of our patients . The CFP is implemented mainly in the age group of 76-95 years with 79.11 % of cases . The trend study over the years 2009-2012 , in which we have had access to information, we detailed high mortality in these patients . Die the first year 48% of patients included in our historical . The second year, the rate is 24% of the operated patients. Understand and analyze hospital costs of hip fractures in the University Hospital of Badajoz, during the years 2009 to 2014. It has not been easy, for the reasons given throughout this document. We have done the calculations clicking through different information systems and databases, capturing information, processing it and compiling it, a manually because the system does not provide the final desired result. To achieve the end result we have broken all the costs in each cost center, main and auxiliary, with subsequent deliveries. Since the costs of the surgical process, broken down into cost of the operating room, anesthesia cost, surgeon cost, cost prosthetics and other auxiliary costs to the costs of consultation and accommodation. The results have been divided between the cost of the PTC and PPC, in each of its processes. The cost for the Extremadura Health Service during the years 2009 to 2014, PTC implants was € 3,344,137.95, with an average cost of € 7243.32 per process. The cost of implants PPC was € 4.711.908,46, with an average cost per implant process € 8.839,74. 206 Our ultimate goal is to establish a centralized information system to provide information to all participants about the evolution of the activity and the costs of healthcare processes . Allowing access to this information in an easy, fast and sound manner. Is propose the introduction of a system of balanced scorecard for the Trauma of the Health Area of Badajoz. System information that can be extrapolated to any other welfare service and not care . It is a system that retrieves information scattered and accumulated in a readable document for professional and manager. Thereby allowing decision making in terms of health and in terms of organization and functionality of each of the specialties. Is propose a number of indicators, which are compared with historical data, in order to make a comparison with the previous year, and propose corrective measures and improvement. This is therefore, a management tool that collects information on both types of assistance, such as the economic and human resources. It is a consensus document among the various interveners, medical equipment and management team; allowing achieve two-way communication, which helps the organization to optimize its resources and thus the sustainability of the public health system; always with the patient as the primary focus of the service commitment of the Health Area of Badajoz. 207 208 IX.- BIBLIOGRAFÍA.- 209 210 IX.- BIBLIOGRAFÍA Álvarez-Nebreda ML, J. A. (2008). Epidemiology of hip fracture in the elderly in Spain. Bone. , 42:278–85. Área de Salud de Badajoz. (2014). Memoria Anual Año 2013. Badajoz. Abrahamsen B, V. S. (2009). Excess mortality following hip fracture: a systematic epidemiological review. Osteoporos Int. Álvarez-Nebreda ML, J. A. (2008). Epidemiology of hip fracture in the elderly in Spain. Bone. Atlas VPM, A. d. (2014, Junio 1). Atlas VPM. Retrieved Octubre 15, 2015, from www.atlasvpm.org Azhar A, L. C. (2009). Cost induced by hip fractures. Ir Med J , 101:213-5. Basora M, C. M. (2011.). Anestesia en cirugía ortopédica y en traumatología. . Editorial médica Panamericana . Bliuc D, N. N. (2009). Mortality risk associated with low-trauma osteoporotic fracture and subsequent fracture in men and women. JAMA. . Bozic KJ, S. B. (2012). Resource utilization and costs before and after total joint arthroplasty. BMC Health Serv Res , 12:73. Brauer CA, C.-P. M. (2009). Incidence and mortality of hip fractures in the United States. JAMA , 302:1573–9. Brauer CA, C.-P. M. (2009). Incidence and mortality ofhip fractures in the United States. JAMA. Brossa Torruella A, T. F. (2005). Mortalidad a los tres an˜os de los pacientes con fractura de fémur. Med Clı´n (Barc). , 124:53–4. Bruyere O, B. M. (2008). Post-fracture management of patients with hip fracture: a perspective. Curr Med Res Opin , 24(10):2841-51. Campos F, G. I. (2005). actura de cadera. Un problema que previsiblemente aumentará en los próximos años. Enferm Integral. Castel H, B. D. (2001). Awareness of osteoporosis and compliance with management guidelines in patients with newly diagnosed low-impact fractures. Osteoporos Int , 12:7559-64. Conference, C. D. (1993). Diagnosis, prognosis and treatment o fosteoporosis. (94:646-50.). Am J Med. 211 Cooper C, C. G. (2001). Hip fractures i nthe elderly: a world wide projection. . Osteoporos Int , 12:136-9. Cummings SR1, N. M. (1995). Risk factors for hip fracture in white women. Study of Osteoporotic Fractures Research Group. N Engl J Med , Mar 23;332(12):767-73. De Luise C, B. M. (2008). Comorbidity and mortality following hip fracture: a population-based cohort study. Aging Clin Exp Res. DE., W. (1998). Variation in the Delivery of Health Care: The Stakes are High. . Ann Intern Med , 128:866-868. Demography Report 2008. UE. (2008, November 24-24). Second European Demography Forum. Retrieved from http://ec.europa.eu/social Díez A, P. J. (1989). Aproximación a los costes de fracturas osteoporóticas de fémur en España. Med Clin (Barc) , 92:721-3. Dixon T, S. M. (2004). Trends in hip and knee joint replacement: socioeconomic inequalities and projections of need. Ann Rheum Dis , 63:825-830. Doñate F, G. N.-C. (2000). Apoyo familiar en las fracturas de cadera. Tendencia actual en el tratamiento. Acta Oortopédica Castellano-Manchega , 1:46-52. Empana JP, D.-M. P. (2004). Effect of hip fracture on mortality in elderly women: the EPIDOS prospective study. J Am Geriatr Soc , 52: 685–90. Ernesto Bataller Alonso, V. S. (2012). EMPRESA HOSPITALARIA Y LOS SISTEMAS SANITARIOS: SISTEMAS DE INFORMACIÓN ASISTENCIAL Y ECONÓMICO FINANCIERO. RIGC , Vol. X, nº 19, Enero-Junio 2012. Forsen L, S. A. ( 1999). Survival after hip fracture: short- and long-term excess mortality according to age and gender. Osteoporos Int. Foss NB, K. H. (2005). Mortality analysis in hip fracture patients: implications for design of future outcome trials. Br J Anaesth. , 94:24–9. Fundación Ad Qualitatem. (2015, 10 7). http://www.fundaq.org/presentacion.php. Retrieved 10 7, 2015, from http://www.fundaq.org/ García García, E. (2011). Evaluación de la estancia hospitalaria en la prótesis de cadera. Salamanca: Universidad de Salamanca. García Ramiro, S. (1994). Valoración del estado nutritivo del paciente anciano con fractura de la extremidad proximal del fémur: pertrocantérea y subcapital. Barcelona: Universidad de Barcelona. 212 Garcia S, e. a. (2005.). Fracturas de cadera en las personas mayors de 65 años: diagnóstico y tratamiento. JANO , VOL. LXIX Nº 1.574. Giversen, IM. (2007). Time trends of mortality after first hip fractures. Osteoporos Int , 18:721– 32. Gomar Sancho, F. (2004, Mayo 25). Las fracturas de cadera en el anciano desde el punto de vista sociosanitario. . Discurso de recepción del académico .electo . Valencia, Valencia, España: Real Academia de Medicina de la Comunidad Valenciana. GONZÁLEZ SÁNCHEZ, B. (2006). Aplicación de la metodología de cálculo del coste en los hospitales públicos gallegos. Revista de Administración Sanitaria Siglo XXI , 4(4):745-57. . Graham S Keene, M. J. (1993). Mortality and morbidity after hip fracture. BMJ. Grupo de Estudio Osteoporosis. . (2003). Estudio AFOE. Madrid: Medical Marketing Comunnication. Gullberg B, J. O. (1997). World-wide proyections for hip fracture Osteoporosis Int. 1997. In J. O. Gullberg B, World-wide proyections for hip fracture Osteoporosis Int. 1997 (7:407-13.). Haentjen P, A. P. (2001). The economic cost of hip fractures among elderly women. A oneyear, prospective, observational cohort study with matched-pair analysis.The economic cost of hip fractures among elderly women. A one-year, prospective, observational cohort study with matched-pair analysis. J Bone Joint Surg (Am) , 83-A:493-500. Haentjens P, M. J.-E. (2010). Meta-analysis: Excess Mortality After Hip Fracture Among Older Women and Men. Ann Intern Med , 152:380–90. Haleem S, L. L. (2008). Mortality following hip fracture: trends and geographical variations over the last 40 years. Injury. In L. L. Haleem S. Haleem S, Lutchman L, Mayahi R, Grice JE, Parker MJ. In . Mortality following hip. Haleem S, Lutchman L, Mayahi R, Grice JE, Parker MJ. (2008). Mortality following hip fracture: trends and geographical variations over the last 40 years. Injury , 39:1157–63. Harris WH, S. C. (1990). Total Hip and Total Knee Replacement. N. Engl J Med , 323:725-731. Hawker GA, B. E. (2009). A Population-Based Nested Case-Control Study of the Costs of Hip and Knee Replacement Surgery. Med Care , 47:732-741. Hernandez HL, O. J.-F. (2005). Trend in hip fracture epidemiology over a 14-year period in Spanish population. Osteoporos Int. , 8:1-7. Herrera A, M. A. (2005). Epidemiology of osteoporotic hip fractures in Spain. Int Orthop , 18:1-4. 213 Herrera Espiñeira C, E. A. (2014). Costes de las prótesis totales de cadera y rodilla en tres comunidades autónomas. Premios Profesor Barea. 12.a Edicion . Herrera-Espiñeira, C. A.-E.-d.-P.-M. (2013). Prótesis total de rodilla y cadera: variables asociadas al costo. Cirugía y Cirujanos , 81:207-213. Hindmarsh DM, H. A. (2009). Relative survival after hospitalisation for hip fracture in older people in New South Wales, Australia. Osteoporos Int. , 20:221–9. Holt G, S. R. (2008). Early mortality after surgical fixation of hip fractures in the elderly: an analysis of data from the Scottish Hip Fracture Audit. J Bone Joint Surg Br. , 90:1357–63. Holt G, S. R. (2008). Gender differences in epidemiology and outcome after hip fracture: evidence from the Scottish Hip Fracture Audit. J Bone Joint Surg Br. , 90:480–3. IASIST. (2011). TOP 20 BENCHMARKS PARA LA EXCELENCIA 2011. IASIST , 30-31. IM., G. (2007). Giversen IM. Time trends of mortality after first hip fractures. Osteoporos Int. , 18:721–32. Instituto Nacional de la Salud, S. G. (2001). GECLIF, Gestión Clínico Financiera. INSALUD. International Osteoporosis Foundation. (2012). CAPTURE THE FRACTURE. International Osteoporosis Foundation. J D. Pedrera Zamorano, J. L. (2004). Incidencia y prevalencia de las fracturas de cadera en la provincia de Cáceres y su tendencia evolutiva. Rev Clin Esp , 204(9):448-51. J.I., C. (1998). L’estat del benestar i les reformes del sistema sanitari espanyol. Fulls Económics del Sistema Sanitari , nº 31. Febrero. 14-20. Jan A. Falch, A. I. (1985). Epidemiology of hip fractures in Norway. Acta Orthopaedica Scandinavica , 56:1, 12-16. Jarnlo GB, T. K. (1992). Standing balance in hip fracture patients: 20 middle aged patients compared with 20 healthly subjects. Acta Orthop Scand , 62:427-434. Jarnlo JB, J. B. (1989). Hip fracture incident in Lund, Sweden 1966-1986. Actha Orthop Scand , 60:278-282. Jiang HX, M. S. (2005). Development and initial validation of a risk score for predicting inhospital and 1-year mortality in patients with hip fractures. J Bone Miner Res. , 20:494–500. Jiang HX, M. S. (20045). Development and initial validation of a risk score for predicting inhospital and 1-yearmortality in patients with hip fractures. J Bone Miner Res. Jonson B, G. P.-J. (1992). Differences in fracture pattern between an urbanan rural population: a comparative population-based study in southern Sweden. Osteoporos Int , 2(6):269-273. 214 Kanis JA, O. A. (2003). The components of excess mortality after hip fracture. Bone , 32:468– 73. Kaplan, R., & Norton, D. (1993). Putting the balanced scorecard to work. Harvard Business Review , 71 (5): 134. Kaplan, R., & Norton, D. (1992). The Balanced Scorecard - Measures That Drive Performance. Harvard Business Review , 70 (1): 71. Kaplan, R., & Norton, D. (1996). Using the balanced scorecard as a strategic management system. Harvard Business Review , 74 (1): 75. Kearney F, B. L. (2009). The true cost of hip fractures. Ir Med J. , 102(3):90. L., F. P. (2005). Epidemiología de las fracturas osteoporóticas. Guía de práctica clínica: Osteoporosis. Grupo de Estudio de la Osteoporosis. Madrid: Me- dical & Marketing Communication , 1:25. Lüthje, P. (1991). The incidence of hip fracture in Finland in the year 2000. Acta Orthopaedica Scandinavica , 241, 35-37. Larsson S, E. O. (1989). Hip fractures in Northerm Sweden 1973-1984. A comparison of rural an urban populations. Actha Orthop Scand , 60:567-71. Le nout T, L. C. (2010). Cost analysis in total hip arthroplasty: Experience of a Teaching Medical Center located in Paris. Orthop Traumatol Surg Res , 96:113-123. Lewiecki EM, W. N. (2004). Official Positions of the International Society for Clinical Densitometry. J Clin Endocrinol Metab , 89:3651-5. M K Wong, *. A. (2002). Osteoporotic Hip Fractures in Singapore—Costs and Patient’s Outcome. Ann Acad Med Singapore , 31:3-7. Mannius S, M. D. (1987). Incidence of hip fracture in Western Sweden 1974-1982. Comparison of rural and urban populations. Acta Ortbop Scand , 58:38-42. Manzarbeitia, J. (2005). Fractura de Cadera en los Ancianos. In J. Manzarbeitia. Marión Buen J, P. S. (1998). Variations in medical practice: importance, causes, and implications. Med Clin (Barc) , 110:382-390. McLeod K, B. M. (2005). Long-term survival of surgically treated hip fracture in an Australian regional hospital. Anaesth Intensive Care , 33:749–55. Monge Lozano, P. (2004). Estudio comparativo de los diferentes sistemas o modelos de costes implantados en los hospitales públicos españoles. Revista Iberoamericana de contabilidad de Gestión. , Dic. 14:16:16. 215 MONGE LOZANO, P. (2002). La Gestión de las empresas sanitarias españolas. Boletín de Información Comercial Española , Nº 2732. 9-15. Monte R, R. R. (2005). Guía Clínica para la atención de los pacientes con fractura de Cadera. In Guías clínicas de la sociedad Gallega de medicina interna. Servicio Gallego de Salud. MSSSI. (2015, 10 7). Ministerio de Sanidad, Servicios Sociales e Igualdad. Retrieved 10 2015, 7, from http://www.msssi.gob.es/profesionales/hcdsns/home.htm Munuera, L. (2000). Osteoporosis y fracturas. Ed Masson s.a. , 4-156. Muñoz S, L. J. (2008). Fractura de cadera. Cuad Cir. , 22:73-81. Murphy L, H. C. (2012). The Impact of Osteoarthritis in the United States: A Population-Health Perspective: A population-based review of the fourth most common cause of hospitalization in U.S. adults. Orthop Nurs , 31:85-91. Navarro Espigares JL, H. T. (2008). Cost-outcome analysis of joint replacement: evidence from a Spanish public hospital. Gac Sanit. , 22(4):337-43. Novoa, M. ". (2002). Evaluación de la Adecuación de la Estancia Hospitalaria para el GRD 209, Mediante el AEP (Appropriateness Evaluation Protocol). Universidad de Cádiz. Facultad de Medicina . Oi LH, W. T. (2005). Hip fractures in nonagenarians. A study on operative and non-operative management. Injury , 36:142-7. Opazo, A. (2011). Fractura de cadera en el adulto mayor: manejo y tratamiento. MEDS, Santiago, Chile. , Medwave. Año XI, No. 2, Febrero 2011. Open Access, Creative Commons. Organización Mundial de la Salud. (2012, Abril). 10 datos sobre el envejecimiento de la población. Retrieved from http://www.who.int/features/factfiles/ageing/es/ OSAKIDETZA, S. V. (2010). Manual de descripción de Grupos Relacionados por el Diagnóstico v25.0. Vitoria: Osakidetza. Administración Autónoma de la Comunidad de Euskadi. Pages E, C. A. (1998). Factors associated with mortatlity and gait impairment in elderly patients with hip fractures. Med Clin (Barc) , 110(18):687-91. Paksima N, K. K. (2008). Predictors of mortality after hip fracture: a 10-year prospective study. . Bull NYU Hosp Jt Dis. , 66:111–7. Panel, N. C. (2001). NIH Consensus Development Panel on Osteoporosis Prevention, Diagnosis and Therapy. . JAMA , 285:785-95. 216 Panula J, P. H. (2011). Mortality and cause of death in hip fracture patients aged 65 or older: a population-based study. . BMC Musculoskelet Disord , 12:105. Pastor Tejedor, A. (2004). Diseño del cuadro de mando integral para un hospital público desarrollado en base a los modelo de excelencia. Productions and Operations Management Society . Pérez-Ochagavía F, D. P. (2003). Estudio epidemiológico de las fracturas proximales de fémur en una población mayor de 69 años durante los años 2000-2001. Rev Ortop Traumatol , 48:11321. Peterson M, C.-M. J. (2008 Jan). Effectiveness of best practice implementation in reducing hip arthroplasty length of stay. J Arthroplasty , 23(1):69-73. Piirtola M, V. T. (2008). Fractures as predictors of excessmortality in the aged. A populationbased studywith a 12-year follow-up. Eur J Epidemiol. , 23:747–55. R., G. (1993). Programación de quirófanos. Todo Hospital , 96:65-70. Radcliff TA, H. W. (2008). Patient risk factors, operative care, and outcomes among older community-dwelling male veterans with hip fracture. . J Bone Joint Surg Am. , 90:34–42. RD., A. (1991). Classification of disease :osteoarthritis. Seminars in Arthritis Rheumatism , 20: 40-47. Reguant F, e. a. (2002). Factores pronóstico de mortalidad en los pacientes mayores con fractura de cadera. Rev Esp Anestesiol Reanim. , 10. Rissanen P, A. S. (1997). P. Costs and Cost-Effectiveness in Hip and Knee Replacements: A Prospective Study. Int J Technol Assess Health Care , 13:574-588. Rodríguez Alvarez, J. (2002). Osteoporosis. Epidemiología y factores socioeconómicos. Grupo Estudio Osteoporosis SECOT , Medical Marketing Communications. Rojo-Venegas, e. (2010). Factores de riesgo en una población anciana: escalas de valoración para la prevención de fracturas de cadera. . Rev esp cir ortop traumatol. , Doi: 10.1016/j.recot.2010.02.003. Rowwley DE, C. B. (1994-1997). Traumatología en la tercera edad. Editorial Masson , Cap 11.(Larsson S). Søren Eiskjær, S. E. (1992). Years of potential life lost after hip fracture among postmenopausal women. Acta Orthopaedica Scandinavica, 63:3, 293-296 , 63:3, 293-296. Serra JA, G. G. (2002). Epidemiología de la fractura de cadera en ancianos en España. An Med Interna (Madrid) , 19: 389-395. 217 Serra, J., Garrido, G., Vidán, M., Marañón, E., & Brañas, F. y. (2002). Epidemiología de la fractura de cadera de ancianos en España. Anales de Medicina Interna , 19 (8), 389-395. Sociedad Española de Cirugía Ortopédica y Traumatología. (2015). Sociedad Española de Investigación Ósea y Metabolismo Minera. (2008). Guías de práctica clínica en la osteoporosis postmenopáusica, glucocorticoidea y del varón. Rev Clin Esp , 208(Supl 1)1:1-24. Tanriover M, O. S. (2009). Hip fractures in developing country: Osteo- porosis frequency, predisposing factors and treatment costs. Arch Gerontol Geriatr , 12:360-4. Tosteson AN, G. D. (2007). Excess mortality following hip fracture: the role of underlying health status. Osteoporos Int. , 18:1463–72. Unión Europea. (2008, Julio 8). http://ec.europa.eu/. (S. r. 1/2006, Producer) Retrieved from http://ec.europa.eu/ Vestergaard P, R. L. (2007). Increased mortality in patients with a hip fracture. Effect of premorbid conditions and post-fracture complications. Osteoporos Int. , 18:1583–93. Von Friesendorf M, B. J. (2008). Long-term survival and fracture risk after hip fracture: a 22year follow-up in women. J Bone Miner Res. , 23:1832–41. VR., F. (2011). The Doctor's Dilemma - What Is "Appropriate" Care? N. Engl J Med , 365:585587. Zuckerman, J. (1996). Hip fracture. N Engl J Med. , 334:1519-25. 218 X.- ÍNDICE DE FIGURAS FIGURA 1.- ARTICULACIÓN DE LA CADERA ..................................................................................................26 FIGURA 2.- FRACTURA FEMORAL DEL CUELLO ............................................................................................26 FIGURA 3.- FRACTURA INTERTROCÁNTEREA................................................................................................28 FIGURA 4.- FRACTURA Y MORBILIDAD ASOCIADA DURANTE TODA LA VIDA ................................................30 FIGURA 5.- SISTEMA DE GESTIÓN INTEGRAL INFORMACIÓN HOSPITALARIA 49 FIGURA 6.- COSTES SEGÚN NATURALEZA. ...................................................................................................55 FIGURA 7.- COSTES SEGÚN NATURALEZA.. ..................................................................................................56 FIGURA 8.- TRATAMIENTO DE LOS COSTES SEGÚN EL MODELO DE YALE. ....................................................60 FIGURA 9.- PROCESO DE CÁLCULO PARA ACTIVADADES Y EPISODIOS. .........................................................64 FIGURA 10.- ÁREA DE SALUD DE BADAJOZ. SERVICIO EXTREMEÑO DE SALUD. EN VIOLETA....................107 FIGURA 11.- MAPA SANITARIO DEL ÁREA DE SALUD DE BADAJOZ............................................................108 FIGURA 12.- POBLACIÓN DEL ÁREA DE SALUD DE BADAJOZ. MEMORIA GERENCIA ÁREA BADAJOZ 2009 ...........................................................................................................................................................109 FIGURA 13.- POBLACIÓN DEL ÁREA DE SALUD DE BADAJOZ. MEMORIA GERENCIA ÁREA BADAJOZ 2014 ...........................................................................................................................................................110 FIGURA 14.- DIFERENCIAS DE POBLACIÓN DEL ÁREA DE SALUD DE BADAJOZ 2014-2009. .......................110 FIGURA 15.- POBLACIÓN DE LOS DISTINTOS MUNICIPIOS DEL ÁREA DE SALUD DE BADAJOZ ....................111 FIGURA 16.- DISTRIBUCIÓN DE LA POBLACIÓN POR EDAD Y SEXO ............................................................112 FIGURA 17.- PROCESO PRODUCTIVO EN UN HOSPITAL ................................................................................117 FIGURA 18.- SISTEMA DE COSTE ORGÁNICO ...............................................................................................118 FIGURA 19.- FASES DE IMPLEMENTACIÓN DEL COSTES COMPLETO ...........................................................119 FIGURA 20.- PROCESO DE FORMACIÓN DE COSTES DE LA PRODUCCIÓN HOSPITALARIA..............................120 FIGURA 21.- IMPUTACIÓN DE COSTES. ........................................................................................................123 FIGURA 22.- CALCULO COSTE FARMACÉUTICO. .........................................................................................147 FIGURA 23.- Nº DE PACIENTES PTC. ..........................................................................................................152 FIGURA 24.- Nº PACIENTES PPC. ...............................................................................................................152 FIGURA 25.- Nº TOTAL DE PACIENTES IMPLANTADOS. ................................................................................153 FIGURA 26.- PRÓTESIS TOTALES DE CADERA. HOMBRES&MUJERES .........................................................153 FIGURA 27.- PRÓTESIS PARCIALES DE CADERA. HOMBRES&MUJERES. .....................................................154 FIGURA 28.- PRÓTESIS HOMBRES&MUJERES .............................................................................................154 FIGURA 29.- PACIENTES ESTUDIADOS PTC ................................................................................................155 FIGURA 30.- PACIENTES ESTUDIADOS PPC.................................................................................................156 FIGURA 31.- Nº PACIENTES TOTALES EN ESTUDIO. HOMBRES Y MUJERES..................................................157 FIGURA 32.- EDAD MEDIA DE LOS PACIENTES EN ESTUDIO ........................................................................158 FIGURA 33.- GRUPOS DE EDAD. ..................................................................................................................159 FIGURA 34.- GRUPOS DE EDAD POR IMPLANTES VS TOTAL DE IMPLANTES REALIZADOS. ...........................159 FIGURA 35.- FALLECIMIENTOS POR RANGO DE EDAD. ................................................................................161 FIGURA 36.- ESTANCIAS TOTALES DE PACIENTES PTC ...............................................................................162 FIGURA 37.- ESTANCIA MEDIA PACIENTES PTC .........................................................................................163 219 FIGURA 38.- COSTE DE LA ESTANCIAS PACIENTES PTC ..............................................................................163 FIGURA 39.- ESTANCIAS MEDIAS PACIENTES PPC ......................................................................................164 FIGURA 40.- TOTAL ESTANCIAS PACIENTES PPC ........................................................................................164 FIGURA 41.- COSTE ESTANCIAS PPC ..........................................................................................................165 FIGURA 42.- ESTANCIAS TOTALES ESTUDIADAS. ........................................................................................165 FIGURA 43.- COSTE ESTANCIA TOTAL. .......................................................................................................166 FIGURA 44.- ESTANCIA MEDIA TOTAL. ......................................................................................................166 FIGURA 45.- EVOLUCIÓN DE TIEMPOS QUIRÚRGICOS, ANESTÉSICOS Y DE CIRUGÍA ....................................169 FIGURA 46.- EVOLUCIÓN DE TIEMPOS MEDIO QUIRÚRGICOS, ANESTÉSICOS Y DE CIRUGÍA .........................169 FIGURA 47.- COSTES DE LA PRÓTESIS DE CADERA .....................................................................................171 FIGURA 48.- EVOLUCIÓN ANUAL DEL COSTE DE LOS IMPLANTES. ..............................................................171 FIGURA 49.- CODIFICACIÓN PTC ...............................................................................................................175 FIGURA 50.- CODIFICACIÓN PPC ................................................................................................................176 FIGURA 51.- VISIÓN Y ESTRATEGIA ...........................................................................................................178 FIGURA 52.- ARTROPLASTIA TOTAL DE CADERA. SNS 2012. FUENTE ATLAS VPM 2014 .........................192 FIGURA 53.- ARTROPLASTIA TOTAL DE CADERA. SNS 2012. FUENTE ATLAS VPM 2014 .........................192 220 XI.- ÍNDICE DE TABLAS TABLA 1.- FRACTURAS DE CADERA PREVISTAS PARA 2050. ........................................................................16 TABLA 2.- AUMENTO DE LA POBLACIÓN DE RIESGO EN LOS ÚLTIMOS 30 AÑOS ............................................17 TABLA 3.-PREVALENCIA DE OTRAS ENFERMEDADES EN LOS PACIENTES QUE INGRESAN POR FRACTURA DE CADERA. .....................................................................................................................................33 TABLA 4.- FACTORES DEPENDIENTES DEL PACIENTE ....................................................................................34 TABLA 5.- FACTORES NO DEPENDIENTES DEL PACIENTE. .............................................................................35 TABLA 6.- INCIDENCIA DE LA FRACTURA DE CADERA A NIVEL MUNDIAL ....................................................38 TABLA 7.- EPIDEMIOLOGÍA DE LA FRACTURA DE CADERA EN ESPAÑA.. .......................................................40 TABLA 8.- FACTORES CLÁSICAMENTE ASOCIADOS A LA PREDISPOSICIÓN A LA FRACTURA DE CADERA. ......41 TABLA 9.- PRINCIPALES PATOLOGÍAS RELACIONADAS CON LAS CAÍDAS EN EL ANCIANO. ...........................42 TABLA 10.- CLASIFICACIÓN DE LOS CENTROS DE RESPONSABILIDAD..........................................................58 TABLA 11.- CLASIFICACIÓN DE LOS CENTROS DE RESPONSABILIDAD. AECA .............................................59 TABLA 12.- CLASIFICACIÓN DE LOS CENTROS DE RESPONSABILIDAD O DE COSTE (FETTER Y FREEMAN). ..60 TABLA 13.- UNIDADS DE OBRA PARA CENTROS NO ASISTENCIALES. FUENTE: AECA ..................................62 TABLA 14.- UNIDADES DE OBRA PARA CENTROS ESTRUCTURALES SECUNDARIOS. AECA ..........................62 TABLA 15.- UNIDADES DE OBRA PARA CENTROS INTERMEDIOS. ..................................................................63 TABLA 16.- ESTRUCTURA MÍNIMA HOSPITALARIA. .....................................................................................69 TABLA 17.- ESTRUCTURA HOSPITALARIA. ÁREAS Y SERVICIOS ESTRUCTURALES. .....................................70 TABLA 18.- ESTRUCTURA HOSPITALARIA. ÁREAS Y SERVICIOS INTERMEDIOS............................................71 TABLA 19.- ESTRUCTURA HOSPITALARIA. ÁREAS Y SERVICIOS FINALES. ...................................................71 TABLA 20.- CRITERIOS DE IMPUTACIÓN. ......................................................................................................77 TABLA 21.- CRITERIOS ÓPTIMOS PARA LA IMPUTACIÓN DE COSTES. FUENTE: JUNTA DE ANDALUCÍA 1995 81 TABLA 22.- CENTROS ESTRUCTURALES. FUENTE: GENERALITAT DE CATALUNYA 1994 .............................83 TABLA 23.- CENTROS DE ACTIVIDAD INTERMEDIOS. FUENTE: GENERALITAT DE CATALUNYA 1994 ..........83 TABLA 24.- CENTROS DE ACTIVIDAD FINALES. FUENTE: GENERALITAT DE CATALUNYA 1994 ..................84 TABLA 25.- SERVICIOS FUNCIONALES. EUSKO JAURLARITZA 1994 .............................................................86 TABLA 26.- IMPUTACIÓN DE LOS SERVICIOS DE MANTENIMIENTO Y LABORATORIOS. .................................87 TABLA 27.- COSTES POR NATURALEZA DE LOS DISTINTOS SISTEMAS DE IMPUTACIÓN DE COSTES ...............94 TABLA 28.- CRITERIOS DE REPARTO ENTRE LOS DISTINTOS SISTEMAS. ........................................................98 TABLA 29.- POBLACIÓN DEL ÁREA DE SALUD DE BADAJOZ ......................................................................109 TABLA 30.- POBLACIÓN DEL ÁREA DE SALUD DE BADAJOZ. MEMORIA GERENCIA ÁREA BADAJOZ 2014 109 TABLA 31.- DIFERENCIAS DE POBLACIÓN DEL ÁREA DE SALUD DE BADAJOZ 2014-2009. .......................110 TABLA 32.- CARACTERÍSTICAS DE LA POBLACIÓN ESTUDIADA. .................................................................113 TABLA 33.- EVOLUCIÓN DE LA POBLACIÓN ...............................................................................................115 TABLA 34.- TASA DE CRECIMIENTO DE LA POBLACIÓN .............................................................................115 TABLA 35.- MOVIMIENTOS NATURALES DE LA POBLACIÓN. ......................................................................116 TABLA 36.- COSTES TOTALES GERENCIA DE ÁREA DE SALUD DE BADAJOZ. PRIMER SEMESTRE 2010. .......124 TABLA 37.- INDICADORES CLÍNICO-ECONÓMICOS DE LOS AÑOS 2009-2012. ............................................137 TABLA 38.- GRD 818 DE LOS AÑOS 2009 A 2012 .......................................................................................139 221 TABLA 39.- COSTES TOTALES DEL AÑO 2010. CAMINO A ..........................................................................139 TABLA 40.- COSTES TOTALES DEL AÑO 2009. CAMINO A ..........................................................................139 TABLA 41.- COSTES TOTALES DEL AÑO 2011. CAMINO A ..........................................................................139 TABLA 42.- COSTES TOTALES DEL AÑO 2012. CAMINO A ..........................................................................140 TABLA 43.- COSTES DE LAS CONSULTAS. ...................................................................................................140 TABLA 44.- COSTES GRD 818 ....................................................................................................................140 TABLA 45.- COSTES DE LAS CONSULTAS EXTERNAS DE TRAUMATOLOGÍA. ................................................141 TABLA 46.- COSTES INCLUYENDO LAS CONSULTAS DE ANESTESIA 2009-2012. .........................................141 TABLA 47.- COSTES DE LAS PRUEBAS RADIOLÓGICAS 2009-2012. .............................................................142 TABLA 48.- COSTES QUIRÓFANOS ..............................................................................................................143 TABLA 49.- COSTES ANESTESIA 2009-2012 ...............................................................................................144 TABLA 50.- COSTES CIRUGÍA .....................................................................................................................144 TABLA 51.- PESOS GRD .............................................................................................................................145 TABLA 52.- TIEMPOS DE UTILIZACIÓN DEL QUIRÓFANO. ............................................................................145 TABLA 53.- COSTES DE ESTANCIA. .............................................................................................................146 TABLA 57.- RESULTADOS EN FUNCIÓN DE LA EDAD DE LOS PACIENTES INTERVENIDOS. ............................155 TABLA 58.- PACIENTES POR EDAD Y SEXO. PRÓTESIS PARCIALES DE CADERA. ..........................................156 TABLA 59.- ACUMULADO DE IMPLANTES EDAD Y SEXO DE LOS PACIENTES. ..............................................157 TABLA 60.- GRUPO DE EDAD DE LOS PACIENTES ESTUDIADOS. ..................................................................158 TABLA 61.- Nº Y EDAD MEDIA DE LOS FALLECIMIENTOS EN EL ÁREA DE SALUD DE BADAJOZ 2009-2012 160 TABLA 62.- FALLECIMIENTOS POR RANGO DE EDAD Y SEXO. .....................................................................160 TABLA 63.- FALLECIMIENTOS TRAS INTERVENCIÓN. ..................................................................................161 TABLA 64.- EDAD MEDIA Y GÉNERO DE LOS FALLECIMIENTOS...................................................................161 TABLA 65.- ESTANCIAS ANALIZADAS DE PRÓTESIS TOTALES DE CADERA.................................................162 TABLA 66.- ESTANCIAS PRÓTESIS PARCIAL DE CADERA ............................................................................164 TABLA 67.- ESTANCIAS, ESTANCIAS MEDIAS Y COSTES DE LAS MISMAS PTC+PPC. ..................................165 TABLA 68.- RESULTADOS TOP-20 2011. IASIST. .....................................................................................166 TABLA 69.- COSTES POR SEXO. PTC ..........................................................................................................167 TABLA 70.- COSTES POR SEXO. PPC ...........................................................................................................167 TABLA 71.- COSTES POR SEXO. TOTALES ...................................................................................................167 TABLA 72.- ANÁLISIS DE TIEMPOS QUIRÚRGICOS, ANESTESIA Y CIRUGÍA PTC. .........................................168 TABLA 73.- ANÁLISIS DE TIEMPOS QUIRÚRGICOS, ANESTESIA Y CIRUGÍA PPC. .........................................168 TABLA 74.- ANÁLISIS DE TIEMPOS QUIRÚRGICOS, ANESTESIA Y CIRUGÍA PPC+PTC. ................................168 TABLA 75.- COSTES PRÓTESIS TOTAL DE CADERA EN EL ÁREA DE SALUD DE BADAJOZ 2009 - 2014 ......170 TABLA 76.- COSTES PRÓTESIS PARCIAL DE CADERA EN EL ÁREA DE SALUD DE BADAJOZ 2009 - 2014 ....170 TABLA 77.- COSTES PRÓTESIS DE CADERA EN EL ÁREA DE SALUD DE BADAJOZ AÑOS 2009 - 2014 ........170 TABLA 78.- COSTE DE LAS PRÓTESIS. .........................................................................................................171 TABLA 79.- CODIFICACIÓN PTC .................................................................................................................175 TABLA 80.- CODIFICACIÓN PPC .................................................................................................................175 TABLA 81.- PERSPECTIVA FINANCIERA ......................................................................................................181 222 TABLA 82.- PERSPECTIVA DEL CLIENTE .....................................................................................................181 TABLA 83.- PERSPECTIVA DE PROCESOS INTERNOS. ...................................................................................182 TABLA 84.- PERSPECTIVA DE APRENDIZAJE Y CRECIMIENTO. .....................................................................182 TABLA 85.- INDICADORES PARA EL CUADRO DE MANDO INTEGRAL. .........................................................184 TABLA 86.- CUADRO DE MANDO INTEGRAL DEL SERVICIO DE TRAUMATOLOGÍA Y ORTOPEDIA. .............185 TABLA 87.- COSTES DE PRÓTESIS DE CADERA. 2007. .................................................................................189 TABLA 88.- COMPARATIVO DE COSTES CALCULADOS ................................................................................193 TABLA 89.- COSTE MEDIO FINAL SIN INCLUIR LAS PRÓTESIS ......................................................................193 TABLA 90.- COMPARATIVA ESTANCIAS/COSTE ESTANCIAS ........................................................................194 223