06-25
Anuncio

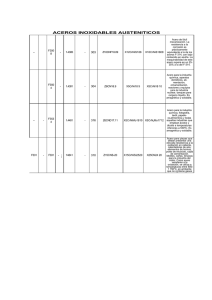
JORNADAS SAM/ CONAMET/ SIMPOSIO MATERIA 2003 06-25 EFECTO DE LA DEFORMACIÓN PLÁSTICA SOBRE LA SUSCEPTIBILIDAD A LA CORROSIÓN DE ACEROS EMPLEADOS EN LA PRODUCCIÓN PETROLERA EN MEDIO CARBÓNICO M. E. Morenoa, G. S. Duffo b a CONICET-YPF, Soler 2950, (1629) Pilar, Buenos Aires, Argentina, [email protected] b Comisión Nacional de Energía Atómica, Depto. Materiales (CAC), [email protected] En la industria de la producción del petróleo se producen fallas por corrosión en los tubos de acero al carbono en medios conteniendo CO2 en las zonas que han estado sometidas a deformación plástica durante la fabricación del tubo. En el presente trabajo se estudia la influencia de la deformación plástica sobre la susceptibilidad a la corrosión de aceros al carbono en solución NaCl 1 M saturadas con un bar de CO2 a diferentes pH y a temperatura ambiente. Se observa que los materiales que han sido recocidos y deformados plásticamente son más susceptibles a la corrosión que los que solo fueron recocidos siendo mayor la diferencia al disminuir el pH de la solución. Palabras claves: Ringworm Corrosion, Carbon Dioxide, Carbon Steel. 1. INTRODUCCIÓN Los aceros al carbono son ampliamente usados en la industria de la producción de petróleo a pesar de que no siempre se trata de un material resistente a la corrosión. La mayoría de los pozos de producción de la República Argentina son de los denominados dulces por su alto contenido de dióxido de carbono. Se ha encontrado que el dióxido de carbono produce un incremento de la velocidad de corrosión generalizada y localizada de los tubos de acero. Una de las formas típicas de corrosión que presentan los tubos es el denominado “Ringworm Corrosion” (RWC), en la que el acero se ataca selectivamente en una estrecha banda circunferencial en la zona de transición entre el extremo sometido al recalque y el cuerpo del tubo (cuando los tubos no fueron sometidos a un tratamiento térmico de normalizado posterior al recalque). Durante la operación de recalque uno de los extremos del tubo se deforma en caliente de forma tal de aumentar su espesor para que posteriormente al realizarle la rosca macho no haya una pérdida de sección. Existen pocas citas bibliográficas que den cuenta de los motivos de este fenómeno particular aunque algunas de ellas coinciden en adjudicar el problema del RWC a la pérdida del carácter laminar de los carburos en la perlita producidos en la zona afectada por el calor durante el proceso de recalcado [1, 2]. Sin embargo algunos estudios posteriores [3] ha demostrado que también se da ataque selectivo en zonas con la perlita laminar como así también la existencia de zonas microestructuralmente afectadas que no fueron atacadas [4]. En el presente trabajo se estudia el efecto de la deformación plástica a diferentes pH de soluciones acuosas de NaCl 1 M saturadas con dióxido de carbono, sobre la susceptibilidad a la corrosión de diferentes aceros al carbono. Se trata de establecer relaciones entre los parámetros electroquímicos, la microestructura y la composición de los aceros. 2. TECNICA EXPERIMENTAL Las probetas empleadas fueron fabricadas a partir de barras de acero al carbono AISI 1020,1030,1045 y 1070 que fueron laminadas en un primer paso en caliente a 970ºC hasta obtener espesores de 1,9-2 mm. Las láminas de acero fueron sometidas a un tratamiento térmico de normalizado, las de acero al carbono 1020, 1030 a 870 ºC durante 15 minutos y las de acero al carbono 1045, 1070 a 820 ºC durante 15 minutos. La microestructura resultante es ferríticoperlítica para los aceros 1020, 1030 y 1045 con perlita laminar, el acero 1070 posee microestructura perlítica. La composición química de los materiales es la mostrada en la Tabla I. El material fue ensayado en dos condiciones: Recocido (R), 80 % deformación en frío (R+L). Las soluciones se prepararon utilizando reactivos de calidad analítica (NaCl, HCl, y NaHCO3 ), CO2 de alta pureza y agua bidestilada. Se ensayaron las siguientes soluciones: solución 1 M NaCl, saturada con 1 bar de CO2 regulando el pH=2 con HCl, solución NaCl 1 M, saturada con 1 bar de CO2 , pH=3,9, solución NaCl 1 M, saturada con 1 bar de CO2 regulando el pH=5,5 con NaHCO3 . Los valores de pH fueron determinados en todos los casos previa y posteriormente a la realización de los ensayos. Todas las experiencias fueron efectuadas a temperatura ambiente y por triplicado. Todas las probetas fueron pulidas previamente hasta papel de carburo de silicio #800. Los ensayos electroquímicos consistieron en el trazado de curvas de polarización anódica potenciodinámicas. Previo al inicio del barrido, la solución fue previamente deaereada por burbujeo de nitrógeno durante 1 hora y luego se burbujea CO2 1 hora para lograr la saturación. Posteriormente se sumerge el electrodo de trabajo en la solución continuando el burbujeo durante una hora y luego se aplica al material un potencial 200 mV por debajo del 533 JORNADAS SAM/ CONAMET/ SIMPOSIO MATERIA 2003 Tipo de acero 1020 1030 1045 C (%) 0,20 0,31 0,47 P (%) 0,012 0,018 0,022 S (%) 0,028 0,030 0,016 Tabla I.Composición química de los empleados en la fabricación de probetas. 1070 0,69 0,012 0,044 aceros 2. RESULTADOS Y DISCUSION La figura 1 muestra como ejemplo las curvas de polarización obtenidas para el acero 1045 en solución 1M NaCl saturada con 1 bar de CO2 y llevada a pH 2 con HCl. Se observa que el potencial de corrosión promedio de los materiales en la condicion (R+L) (EcorrR+L = -0,584 VECS) son siempre menores a los que fueron ensayados en la condición R (EcorrR = -0,571 VECS). Este mismo comportamiento se verifica para los aceros 1020, 1030 y 1070 ensayados en esta solución y los valores de potenciales de corrosión se resumen en la Tabla II. La condición del material no manifiesta tener influencia sobre la forma de la curva de polarización. Las pendientes de Tafel para la rama anódica y catódica son respectivamente ßa=75-90 mV y ßc= 105-115 mV. De la misma tabla se deduce que al aumentar el contenido de carbono del material disminuye el potencial de corrosión. de carbono manifiesta no tener influencia sobre el potencial de corrosión y la forma de la curva de polarización. Las pendientes de Tafel de la rama anódica ß a= 65-80 mV. Tipo de acero EcorrR [VECS] EcorrR+L [VECS] 1020 -0,672 ± 0,019 -0,684 ± 0,002 1030 -0,653 ± 0,022 -0,660 ± 0,014 1045 -0,699 ± 0,01 -0,708 ± 0,001 1070 -0,672 ± 0,025 -0,684 ± 0,03 Tabla III. Potenciales de corrosión promedio de las probetas de aceros al carbono ensayados en las condiciones recocido (R) y recocido + laminado 80 % deformación en frío (R+ L) a pH=3,9. En la Tabla IV se resumen los potenciales de corrosión promedio para los aceros 1020, 1030, 1045 y 1070 obtenidos a partir de las curvas de polarización en solución 1M NaCl + 900 ppm NaHCO3 + 1 bar CO2 (pH = 5,5). Se observa que el potencial de corrosión de los materiales en la condicion “R+L” (EcorrR+L ) no difiere de los que fueron ensayados en la condición “R” (EcorrR) y todos los valores se agrupan en el estrecho rango de potenciales de (-0,731/-0,740 VECS). Esto podría deberse a la mayor estabilidad de la película superficial de FeCO3 que se tiende a formar sobre la probeta en medio carbónico a pH 5,5, con respecto a pH menores. Videm y Dugstad [5] han reportado la formación de películas de FeCO3 que dan buena protección a pH 6 en medio carbónico y a temperatura ambiente. El contenido de carbono manifiesta no tener influencia en cuanto al potencial de corrosión y el perfil de la curva de polarización. -1 10 S o l u c i o n N a C l 1 M + 1 b a r C O 2, pH 2 -2 10 Densidad de Corriente (A/cm2) potencial de corrosión durante 1 minuto. A continuación se inició el barrido de potencial a una velocidad de 0,2 mV/s. Todos los ensayos fueron realizados por triplicado. Para los ensayos electroquímicos se utilizó una celda de vidrio convencional de 80 ml de capacidad de tres electrodos. Un electrodo de calomel saturado se empleó como electrtodo de referencia y se utilizó un arrollamiento de alambre de platino como contraelectrodo. Para las mediciones electroquímicas se utilizó un potenciostato/ galvanostato modelo 173, una rampa de barrido modelo 175 y un registrador XY modelo RE0074 todos de marca EG&G PAR. 06-25 Tipo de acero EcorrR [VECS] EcorrR+L [VECS] 1020 -0,570 ± 0,01 -0,593 ± 0,001 1030 -0,579 ± 0,005 -0,594 ± 0,006 1045 -0,571 ± 0,005 -0,584 ± 0,001 1070 -0,561 ± 0,006 -0,574 ±0,00 4 Tabla II. Potenciales de corrosión promedio de las probetas de aceros al carbono ensayados en las condiciones recocido (R) y recocido + laminado 80% deformación en frío (R+L) a pH 2. -3 10 10-4 -5 10 -6 10 1045 R 1045 R+L -7 10 -0.8 -0.7 -0.6 -0.5 -0.4 Potencial (V) ECS Figura 1. Curvas de polarización en acero 1045 en solución 1 M NaCl + 1 bar CO2 , pH=2,0 (HCl) La figura 2 muestra las curvas de polarización obtenidas para el acero 1030 en solución 1M NaCl saturada con 1 bar de CO2 (pH = 3,9). Se observa que los potenciales de corrosión promedio de los materiales en la condicion (R+L) (EcorrR+L = -0,660 VECS) son menores que los que fueron ensayados en la condición R (EcorrR = -0,653 VECS). Este mismo comportamiento se verifica para los aceros 1020, 1045 y 1070 en esta solución y los valores de potenciales de corrosión se resumen en la Tabla III. El contenido Tipo de acero 1020 1030 1045 1070 EcorrR [VECS] -0,738 ± 0,003 -0,736 ± 0,007 -0,734 ± 0,004 -0,739 ± 0,001 ÊcorrR+L [VECS] -0,739 ± 0,001 -0,731 ± 0,008 -0,731 ± 0,001 -0,740 ± 0,003 Tabla IV. Potenciales de corrosión promedio de las probetas de aceros al carbono ensayados en las 534 JORNADAS SAM/ CONAMET/ SIMPOSIO MATERIA 2003 condiciones recocido (R) y recocido + laminado 80% deformación en frío (R+L) a pH=5,5. En la Figura 3. se grafica la diferencia de potencial entre el estado R y R+L para cada acero en cada medio. De la gráfica se puede observar que al aumentar el pH es menor la diferencia de potencial entre ambas condiciones para todos los materiales ensayados. 10-1 Solución NaCl 1 M + 1 atm CO 2, pH 3,9 2 Densidad de Corriente (A/cm ) 10-2 -3 10 10-4 -5 10 10-6 1030 R 1030 R+L 10 -0.8 -0.7 -0.6 -0.5 -0.4 ECS Figura 2. Curva de polarización en acero 1030 en solución 1 M NaCl + 1 bar CO2 ,pH 3,9 25 Diferncia de Potencial entre la condición R+L/ R (mV) 20 Solución NaCl 1 M + 1 bar CO 2 15 10 pH=2 pH=3,9 pH=5,5 0 -5 1020 1030 1040 1050 1060 Tipo de EparR+L/ R [VECS] IparR+L/ R [A] Acero 1020 -0,585 1,6 *10-6 1030 -0,589 2,4 *10-6 1045 -0,578 7,9 *10-6 1070 -0,567 1,8 *10-6 Tabla V. Valores promedio de potencial de corrosión del par R/ R+L (EparR+L/ R)y densidad de corriente del par (IparR + L / R) para cada acero a pH 2 y con una relación de area 1/1. -0.3 Potencial (V) 5 menor a pH 3,9 que a pH 2, y que las pendientes de Tafel son similares es que se espera que la densidad de corriente del par R+L/ R a pH 3,9 sean menores a las encontradas a pH 2. 4. CONCLUSIONES -7 -0.9 06-25 1070 Tipo de acero al Carbono Figura 3. Diferencia de potencial entre el estado R y R+L para cada acero en solución NaCl 1 M + 1 bar CO2 a diferentes pH. Los resultados anteriores indican que si para cada acero a pH 2 se pusieran en contacto dos porciones de material con una misma área expuesta, uno en la condición R y la otra en la condición R+L se formaría un par galvánico con el material en la condición R como cátodo. A partir de las curvas de polarización obtenidas se determinaron las intersecciones entre las ramas anódicas para cada acero de las probetas ensayadas en la condición “R+L” con las ramas catódicas de las probetas ensayadas en la condición “R”. En la Tabla V se pueden observar los valores promedio de potencial de par R/ R+L y densidad de corriente del par para cada acero a pH=2 y con una relación de area 1/1. De la observación de los datos se deduce que el potencial del par R/ R+L disminuye al aumentar el contenido de carbono del acero mientras que la densidad de corriente aumenta con el contenido de carbono del acero para los aceros 1020, 1030 y 1045, luego disminuye. Si consideramos que la diferencia de potencial entre los estados R+L y R es a) A pH 2 y 3,9 en solución 1 M NaCl + 1 bar CO2 , el potencial de corrosión del material con perlita laminar presenta un potencial de corrosión mas noble que el deformado plásticamente, con la perlita sin ese hábito. b) A pH 5,5 en solución 1 M NaCl + 1 bar CO2 , el potencial de corrosión del material deformado plásticamente y el del material recocido son prácticamente iguales. c) Al aumentar el pH es menor la diferencia de potencial de corrosión entre ambas condiciones deformado plásticamente y recocido para todos los aceros ensayados. d) En condiciones de contacto eléctrico en la solución carbónica a pH 2 y 3,9 el material deformado se corroerá a mayor velocidad que el recocido para todos los aceros ensayados. e) En condiciones de contacto eléctrico en la solución carbónica a pH 2 la densidad de corriente del par R+L/ R con una relación de area 1/1, es mayor al aumentar el contenido de carbono para los aceros 1020, 1030, 1045. f) En condiciones de contacto eléctrico en la solución carbónica a pH 3,9 la densidad de corriente del par R+L/ R será menor a las encontradas a pH 2 para los aceros ensayados. 5. REFERENCIAS [1] R. W. Manuel. Corrosion, Vol. 3, Nº 9 (1947) :p. 197-206. [2] D. W. De Berry, W. S. Clark, “Corrosion due to use Carbon Dioxide for Enhanced Oil Recovery”, CO2 Corrosion in Oil and Gas Production, NACE (1984). [3] G. S Duffo, A.L. Burkart, G. L. Bianchi, “Effect of cold-work on corrosion susceptibility of carbon steels in CO2 containing media”, Eurocorr ´98, Utrecht, The Netherland (1998). [4] G. Echaniz, T. Perez, “Análisis de un serie de tubos procedentes del Yacimiento Señal Picada (YPFCatriel)”, Informe CINI Y.1.41.487/92, 1992. [5] K. Videm, A. Dungstad, Material Perfomance, Vol. 4, (1989): p. 46-50. 535