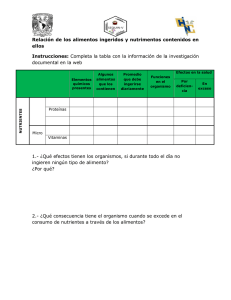
capítulo iv - infoagro colombia
Anuncio

1 2 LA NUTRICIÓN MINERAL EN LAS PLANTAS SUPERIORES La membrana celular Para una mejor comprensión de los procesos esenciales de la toma de iones por las plantas, se requiere un conocimiento somero de la estructura y función de las membranas celulares. El contenido de todas las células vivas, está rodeado por una membrana delgada llamada membrana plasmática, o celular, que constituye el límite entre el contenido celular y el medio externo. Las membranas celulares están formadas por moléculas con grupos hidrofílicos (OH-, NH2- , PO43 - , HCO3-) e hidrofóbicos (cadenas hidrocarbonadas), de tal forma que los lípidos y las proteínas pueden estar ligados por enlaces electrostáticos, enlaces de hidrógeno y enlaces hidrofóbicos. La membrana plasmática de las células eucarióticas es una estructura dinámica formada por dos capas de fosfolípidos en las que se embeben moléculas de colesterol y proteínas, formando una estructura llamada de mosaico fluido. Tiene entre 4 y 5 nm de espesor y actúa como una barrera selectiva reguladora de la composición química de la célula. Los fosfolípidos tienen una cabeza hidrofílica y dos colas hidrofóbicas: Los grupos hidrófilos se dirigen hacia la fase acuosa, los de la capa exterior de la membrana hacia el líquido extracelular y los de la capa interior hacia el citoplasma. Las proteínas embebidas en las capas de fosfolípidos cumplen diversas funciones como la de transportar grandes moléculas hidrosolubles, como azúcares y ciertos aminoácidos. También hay proteínas unidas a carbohidratos (glicoproteínas) embebidas en la membrana (figura 51). 3 Figura 51. Estructura tridimensional de las membranas biológicas. La mayor parte de los iones y moléculas solubles en agua son incapaces de cruzar de forma espontánea esta barrera, y para atravesarlas, se necesita de la actividad de proteínas específicas de transporte o de canales proteínicos. De este modo, la célula vegetal mantiene concentraciones de iones y moléculas pequeñas, diferentes a las del medio externo. Los lípidos de las membranas celulares tienen como función principal formar una barrera que evita la difusión de los solutos hidrofílicos (iones inorgánicos, aminoácidos, azúcares) a través de la membrana. Sin embargo, para poder comprender el proceso de ingreso y/o salida de solutos hacia o desde el exterior celular, se debe tener en cuenta que la membrana celular no es completamente impermeable. Transporte pasivo y activo Si una molécula no cargada como la glucosa está difundiéndose, la fuerza conductora se debe a la diferencia en potencial químico de esa sustancia a ambos lados de la membrana. Si el potencial químico del soluto es más alto fuera que dentro de la membrana, el transporte que se lleva a cabo se dice “pasivo”. Si la célula acumula moléculas en contra de un gradiente de potencial, se debe aportar energía en cantidad suficiente para sobrepasar la 4 diferencia en potencial químico como predice la Segunda Ley de la Termodinámica. Cuando se produce el transporte en contra del gradiente de potencial químico, se dice que es “activo”. El transporte pasivo de las moléculas ocurre comúnmente entre compartimentos celulares dentro y entre células individuales: Por ejemplo, la sacarosa sintetizada dentro de los cloroplastos durante la fotosíntesis, puede transportarse pasivamente entre el citoplasma de la célula fotosintética y los tubos cribosos. El transporte activo tiene lugar cuando los iones, como el NO3-, pasan de la solución del suelo, donde está en menor concentración hasta el interior de la célula de la raíz donde está en mayor concentración. El transporte activo implica que para que un soluto se mueva a través a través de la membrana, en contra del gradiente de potencial químico, debe utilizar energía en forma de ATP, derivada de los procesos metabólicos como la respiración mitocondrial. Transporte a través de la membrana celular Se debe establecer de qué manera las moléculas disueltas en la solución extracelular atraviesan la membrana lipoproteínica hasta llegar al interior celular. Teniendo en cuenta la naturaleza lipoproteínica de la membrana, se puede explicar la capacidad de las sustancias liposolubles para entrar en la célula: Estas sustancias pueden aprovechar los gradientes de concentración entre la solución extracelular y las capas de lípidos para pasar a la solución interna. Sin embargo, no se comprende cómo el agua, los iones inorgánicos y una serie de sustancias muy poco solubles en lípidos, pueden atravesar tan fácilmente la barrera lipídica continua constitutiva de las membranas celulares. El transporte a través de las membranas, juega un papel fundamental en muchos procesos biológicos en las células vegetales, que incluyen la generación de la turgencia celular, transducción de energía y de señales, adquisición de nutrientes, eliminación de desechos celulares y distribución de metabolitos o compartimentalización. Hoy día se reconocen cuatro sistemas de transporte en todas las membranas: 5 1. Las bombas catalizan el transporte de iones o moléculas orgánicas complejas en contra del gradiente de potencial termodinámico. En las membranas diferentes a las de la mitocondria y el cloroplasto que sintetizan ATP, las bombas trabajan generalmente gracias a la hidrólisis del ATP. En todas las membranas, las bombas a H+ dominan las características del transporte, eliminando el H+ del citosol y generando una fuerza motora de los protones (pmf) a través de la membrana (figura 52). Figura 52. Funcionamiento de las bombas de protones. 2. Los transportadores translocan una amplia variedad de solutos sencillos (iones, azúcares y aminoácidos). Los transportadores se diferencian de las bombas porque no llevan a cabo reacciones como la hidrólisis del ATP. Los transportadores de solutos 6 utilizan energía metabólica obtenida del acople con el transporte de H+ conducido por una pmf que hace posible su ingreso en contra del gradiente termodinámico (figura 53). Figura 53. Modelo de transportador de membrana tipo acoplamiento de iones. Figura 54. Funcionamiento de los canales iónicos. 7 3. Los canales iónicos son componentes de la membrana celular que responden a estímulos eléctricos abriéndose y facilitando flujos selectivos de iones bajo el efecto de diferencias de potencial eléctrico. Estas diferencias de potencial se generan cuando se despolariza la membrana hasta un umbral de voltaje. El transporte a través de los canales iónico es pasivo comparado con el trabajo de las bombas y los transportadores. El flujo de un ión en particular a través de los canales iónicos ocurre en el sentido de un gradiente de potencial electroquímico de ese ión. Los canales iónicos de la célula vegetal son selectivos y discriminan en favor, ya sea de cationes o de aniones. Los canales catiónicos se subdividen en los que seleccionan el K+ entre los otros cationes monovalentes (Na+, Rb+, Li+) y los que son selectivos para el Ca2+. La mayoría de los canales aniónicos de las membranas celulares permiten el paso de un amplio rango de aniones, entre los que se cuentan el Cl-, el NO3- y los ácidos orgánicos (figura 54). 4 . Los canales de acuaporina o canales hídricos facilitan el transporte rápido del agua a través de la membrana celular y la membrana vacuolar. Las acuaporinas son proteínas pertenecientes a una gran familia de proteínas intrinsecas homólogas de una proteína intrínseca de la membrana celular bovina. Algunas de ellas funcionan con una alta eficiencia como canales por donde se transporta el agua y facilitan la difusión de enormes cantidades de agua en el sentido de un gradiente transmembranar de potencial hídrico (transporte pasivo). Está relacionadas con la distribución de los solutos, la transferencia de gases y la toma de nutrientes como el B (ácido bórico) (figura 55). 8 Figura 55. Funcionamiento de los canales de acuaporina. Transporte de solutos a través de las membranas Las membranas intactas son barreras para el paso de los iones y de las moléculas no cargadas. También son sitios selectivos y de transporte en contra de un gradiente de potencial químico de solutos. Por ejemplo, se ha encontrado que la concentración de K+ en la savia de la raíz en el maíz es de alrededor de 80 veces la concentración del ión en la solución del suelo. En el mismo tipo de experimentos, también se ha encontrado que la concentración del Na+ intracelular se mantiene más baja que la de la solución del suelo. Con base en muchos resultados similares, se ha concluido que los procesos de acumulación en contra del gradiente de potencial químico y de selectividad, hacen necesaria la presencia de sitios específicos de ligamiento, transportadores de naturaleza proteínica, que ligan los iones como el K+ y los transportan a través de la membrana. El mecanismo selectivo de transporte de iones está acoplado directamente con el consumo de energía en forma de ATP producido principalmente por la mitocondria (fosforilación oxidativa). 9 Los principales nutrientes inorgánicos [entre los cuales se encuentran el amonio (NH4+), el nitrato (NO3-), el fosfato (H2PO4-), el potasio (K+) y el sulfato (SO42-)] se translocan activamente desde la solución del suelo hacia el interior de las células de la raíz, mediante transportadores específicos. Los transportadores también son responsables de la toma de iones que tienen funciones menos notables en el metabolismo como el Cl-. Es fácil observar, que para la absorción activa de los nutrientes minerales es necesaria la presencia de los elementos componentes de la molécula de ATP (C, N, O, H y P). Desde el punto de vista clásico de la nutrición de las plantas, es notoria la importancia de la presencia de los iones NO3-, NH4+ y PO43-: En ausencia o deficiencia de ellos, no se realiza adecuadamente la absorción activa de los nutrientes minerales. Factores que intervienen en la absorción de los iones por las células radicales 1. Radio iónico:Cuando se comparan iones con la misma valencia se encuentra una correlación negativa entre la tasa de absorción y el radio iónico: Entre mayor sea el radio del ión menor es su tasa de ingreso. 2. Sinergismo iónico y función del Ca2+: El sinergismo es uno de los aspectos de las interacciones iónicas durante la absorción. Se observa el estímulo de la absorción de los cationes por la absorción de los aniones como reflejo de la necesidad del mantenimiento del balance de cargas dentro de la célula. El mejor ejemplo es el del estímulo de la absorción de cationes y de aniones por efecto del Ca2+. Este efecto se debe al papel del Ca2+ en el mantenimiento de la estabilidad e integridad de la membrana. 3. El pH: Los pHs extremos afectan la estabilidad de la membrana y por tanto la tasa de absorción de los nutrientes. Por otro lado, es muy importante para la nutrición mineral de las plantas, el efecto de competencia entre el H+ y los otros cationes. 4. Concentración interna y estado nutricional: La concentración interna de un ión en particular afecta considerablemente tanto la composición mineral como el contenido de ácidos orgánicos de las plantas. 10 5. Concentración externa:Las concentraciones externas muy altas o muy bajas de los iones minerales afectan el comportamiento cinético del proceso de absorción de los nutrientes. Criterios para que un elemento sea considerado esencial para la nutrición de las plantas superiores Desde hace por lo menos 2000 años que se reconoce la importancia de los nutrientes minerales para la producción de los cultivos. La nutrición mineral de las plantas tiene características singulares porque las plantas verdes, únicos organismos multicelulares autotróficos, pueden obtener elementos inorgánicos provenientes del ambiente, sin depender de compuestos de alto valor energético sintetizados por otros organismos. Uno de las propiedades más sorprendentes de las células vivas, y en particular de los vegetales, es la de tomar sustancias del ambiente y usarlas para la síntesis de sus propios componentes celulares, o como fuente de energía. La nutrición mineral de las plantas puede definirse como el suministro y absorción de sustancias químicas necesarias para el metabolismo vegetal, es decir, para el desarrollo (crecimiento y diferenciación) de las plantas individuales o de los cultivos. Se da el nombre de nutrientes o nutrimentos a las sustancias químicas que requieren los organismos para su desarrollo. El metabolismo es el conjunto de reacciones que ocurren en un organismo viviente y que mantienen la vida y permiten su desarrollo: Entonces, metabolismo y nutrición están íntimamente relacionados. Los nutrientes esenciales que requieren las plantas superiores son de naturaleza exclusivamente inorgánica. Los criterios considerados son: 1. Que en condiciones de deficiencia, la planta no pueda completar su desarrollo y eventualmente, muera. 2. Que en condiciones de deficiencia, el elemento no pueda ser reemplazado por otro. 3. Que el elemento participe directamente en el metabolismo de la planta, como constituyente de un metabolito esencial o como activador de un sistema enzimático. 11 Los 17 nutrientes esenciales se pueden clasificar de diferentes maneras, como por ejemplo, de acuerdo con su papel bioquímico en la planta, o según su forma química en el suelo o en la planta. La siguiente clasificación (la más frecuente) se basa en las concentraciones relativas de cada nutriente en la planta, cuando éste se encuentra en concentraciones adecuadas para el funcionamiento normal del cultivo: Macronutrientes: C, H, O, N, K, Ca, Mg, P y S. Con excepción del C, O y el H, que son los más abundantes, los contenidos de los macronutrientes encontrados generalmente en las plantas están entre los 1.000 y 15.000 mg (kg materia seca)-1. Las concentraciones de los macronutrientes en la materia fresca caen dentro del orden del milimolar (mM). Micronutrientes: Cl, B, Fe, Mn, Zn, Cu, Mo y Ni. Los contenidos de los micronutrientes encontrados usualmente en las plantas sólo alcanzan niveles entre 0,005 y 100 mg (g materia seca)-1. Las concentraciones de los micronutrientes en la materia fresca caen dentro del órden del micromolar (µM). Funciones generales de los nutrientes esenciales en las plantas superiores Desde los primeros años del siglo 20, se les asignaron varias funciones o efectos fisiológicos generales a los primeros elementos esenciales reconocidos hasta entonces (C, H, O, N, P, K, S, Ca, Fe, Mg). Al finalizar el siglo 20, estas funciones o efectos fisiológicos se extendieron a los 17 elementos esenciales descubiertos hasta ahora. 1. Actúan como materiales plásticos o de construcción celular (protoplasma, pared celular, proteínas, etc). Por ejemplo, el S es constituyente de las proteínas, el P de las nucleoproteínas y del ATP; el Mg de la clorofila; y los nutrientes C, H y O son componentes de los carbohidratos, grasas y proteínas. 12 2. Participan en el desarrollo del potencial osmótico intracelular, aunque los efectos de los constituyentes inorgánicos de las plantas sobre el potencial osmótico son relativamente pequeños comparados con los de los azúcares, ácidos orgánicos y otros compuestos. 3. Algunos elementos como el C en la forma de ión carbonato (HCO3-), y el P en la forma de HPO42- y H2PO4-, participan en el mantenimiento de la estabilidad del pH intracelular, previniendo cambios drásticos en la concentración de H+. 4. Mantienen un grado deseable de hidratación de los coloides celulares. En general, los cationes monovalentes lo aumentan, mientras que los divalentes o los polivalentes lo disminuyen. 5. Participan en la regulación de la permeabilidad de las membranas. 6. Son tóxicos cuando su concentración intracelular es excesiva. 7. Son antagónicos cuando el efecto normal o benéfico de un ión se anula por el efecto de otro. 8. Mantienen la neutralidad electrostática celular mediante el balance entre las cargas de los iones positivos y los negativos. Papel de los elementos nutritivos Nitrógeno (N) Número atómico: 7 Masa atómica: 14,0067 Abundancia relativa en la atmósfera: 79-80% Fórmula molecular: N2 NN 13 Forma de absorción por las plantas: Ión amonio (NH4+), ión nitrato (NO3-). La presencia de nitrógeno en el suelo es, casi totalmente, el resultado de la acción biológica, ya que el aporte del material parental es, en general, escaso. Las plantas lo - + asimilan como iones nitrato (NO3 ) y/o amonio (NH4 ). Las plantas biosintetizan los compuestos nitrogenados básicos del metabolismo que son comunes a todos los organismos vivientes, y también el complejo de compuestos químicos nitrogenados propios de los vegetales. El proceso que requiere de una mayor cantidad de N disponible es la síntesis de aminoácidos, moléculas básicas para la construcción de las proteínas (y por tanto, de las enzimas) y precursores de muchos otros compuestos vegetales. El N también es un componente esencial de los ácidos nucleicos (ADN y ARN), de cofactores enzimáticos (NADH, NADPH, FMN, FAD, tiamina, riboflavina, ácido fólico, piridoxina, coenzima A, cianocobalamina y otros metabolitos comunes). El N es un componente principal de la clorofila. El color amarillo característico de las plantas deficientes en N (clorosis) es un resultado de su incapacidad para sintetizar cantidades adecuadas de clorofila bajo tal condición. Las disminuciones en los niveles de los componentes estructurales fotosintéticos tales como la clorofila y la ribulosa bisfosfato carboxilasa oxigenasa (Rubisco), traen como consecuencia reducciones en la capacidad fotosintética y en la eficiencia de carboxilación. Las plantas sintetizan también diversos compuestos nitrogenados secundarios como los alcaloides. Aunque los flavonoides y otros compuestos fenólicos no contienen N, se derivan de la fenilalanina, y por tanto, están relacionados con el metabolismo de los aminoácidos. Además, muchas hormonas vegetales contienen N (auxinas, citocininas) o se derivan de precursores nitrogenados (etilenoderivado de la metionina). Las plantas pueden obtener el N mediante la absorción de NH4+, que se incorpora casi inmediatamente en compuestos orgánicos tales como los aminoácidos. También pueden obtenerlo mediante la absorción de NO3- y su reducción a NH4+. En el caso de las plantas hospedantes de las bacterias fijadoras de N, mediante la reducción biológica del N2 atmosférico a NH4+. 14 El NO3- absorbido por la raíz puede reducirse y asimilarse dentro de ella, así: NO3- NH4+ glutamina O puede transportarse como NO3- hacia la parte aérea (brote). El NO3- se almacena en las vacuolas de las células de la raíz y del brote. El NO3- es la principal fuente de N para las plantas, las cuales dedican una parte significativa de sus reservas de C y de energía para su absorción y asimilación. El NO3sirve tanto de nutriente como de señal química, y tiene profundos efectos sobre el metabolismo y el crecimiento vegetal. Las plantas han desarrollado intrincados mecanismos para detectar el NO3- e integrar su asimilación con la fotosíntesis y el metabolismo general del N y del C. Estos mecanismos contribuyen a que la planta pueda controlar las tasas de crecimiento, modificar la arquitectura de la raíz, la relación C/N, las concentraciones de moléculas reductoras y controlar los balances iónicos y de pH, bajo diversas condiciones ambientales. La asimilación del NO3- comienza con su ingreso a la célula. Ordinariamente, el NO3- es absorbido desde la solución del suelo por las células epidérmicas y corticales de la raíz, también puede ocurrir absorción primaria en las hojas, lo cual constituye una ruta muy importante para las epífitas y para la incorporación de fertilizantes foliares. Una vez dentro del simplasma, el NO3- se transporta hacia las vacuolas donde se almacena en altas concentraciones (>20 mM). Los principales órganos de almacenamiento del NO3- son las raíces, los tallos y las nervaduras centrales de las hojas. El NO3- también puede ser descargado en el xilema para su transporte hasta la parte aérea. A medida que el NO3- se difunde desde la solución del suelo hacia el apoplasma de la raíz, es absorbido por las células epidérmicas y corticales. Una vez en el simplasma, se reduce y se moviliza a través de las bandas de Caspary y llega hasta el xilema para ser transportado hacia el brote. La absorción inicial a través de la membrana celular de las raíces es un proceso activo regulado. Las plantas utilizan dos mecanismos transportadores para absorber el nitrato: 15 1. Un sistema de transportadores de alta afinidad que se satura entre 0.2 y 0.5 mM de NO32. Un sistema de transporte de baja afinidad que trabaja a concentraciones por encima de 0.5 mM de NO3-. Estas formas de absorción del NO3- le permiten a la planta establecerse en presencia de un amplio rango de concentraciones externas del ión, que van desde 5 M hasta 50 mM, sin que ocurran deficiencias severas o síntomas de toxicidad. La acumulación del NO3- en las vacuolas es de mucha importancia para el balance iónico y para la regulación osmótica de la célula vegetal. Sin embargo, para que el NO3- sea incorporado en estructuras orgánicas y cumpla con su función esencial como nutriente mineral, debe reducirse a NH4+. La importancia de la reducción y asimilación del NO3para la vida vegetal es similar a la de la reducción y asimilación del CO2 en la fotosíntesis. Reducción del NO3La reducción del NO3- a NH4+, es mediada por dos enzimas separadas: La nitrato reductasa (NR), que reduce el NO3- a nitrito (NO2-), y la nitrito reductasa (NiR) que reduce el NO2- a NH4+. La NR es una metaloenzima compleja formada por dos subunidades, con sitios de ligamiento para el NAD (P)H y para el NO3-. Los centros que facilitan el transporte de los electrones necesarios para la reducción del NO3- están formados por el FAD, por una proteína con un grupo heme-Fe y por un cofactor que contiene Mo y cobalto (MoCo) (figura 56). 16 Figura 56. Modelo del funcionamiento de la reducción del NO3- Reducción del NO2Luego de la reducción del NO3-, el siguiente paso en la ruta de su asimilación es la reducción del NO2- a NH4+, catalizada por la NiR. La fuente de electrones para la reducción del NO3- es la ferredoxina reducida, producida en los cloroplastos durante la transferencia no cíclica de electrones. La ferredoxina contiene dos núcleos redox formados por 4 Fe y 4 S. El NH4+ resultante ingresa al metabolismo vegetal mediante la acción de la glutamina sintetasa, que cataliza la conversión del glutamato en glutamina. Esta reacción consume energía en forma de ATP. Glutamato + NH4+ + ATP glutamina + ADP + Pi Asimilación del Nitrógeno El ión nitrato (NO3-) y el ión amonio (NH4+) son las principales fuentes de N inorgánico como las plantas superiores lo toman por sus raíces. La mayor parte del amonio debe ser incorporado en compuestos orgánicos en las raíces, mientras que el nitrato es fácilmente movilizable en el xilema y puede ser almacenado en las vacuolas de las raíces, brotes y órganos de acumulación. Para que el N del nitrato pueda ser incorporado en estructuras orgánicas y complete sus funciones como nutriente vegetal, debe ser reducido a amoníaco 17 (NH3). La importancia de la reducción y asimilación del nitrato para la vida vegetal es similar a la de la reducción y asimilación del CO2 durante la fotosíntesis. La reducción del nitrato es un proceso complejo que se lleva a cabo mediante la intervención de la nitrato reductasa (reducción del nitrato a nitrito) con una importante contribución del molibdeno (Mo), la participación del hierro (citocromos) y el fósforo (FAD), y la nitrito reductasa (reducción del nitrito a amoníaco) con una importante participación del hierro (ferredoxina y siroheme)(El siroheme es una tetraporfirina parcialmente reducida que tiene como núcleo activo un complejo 4Fe-4S) y el fósforo (NADP). En la mayoría de las especies vegetales, tanto las raíces como los brotes tienen la capacidad de reducir el nitrato y se ha establecido, que las raíces pueden reducir entre el 5 y el 95% del nitrato absorbido. La proporción de la reducción llevada a cabo en las raíces depende de varios factores entre los cuales está el nivel de suministro de nitrato, de la especie vegetal, de la edad de la planta, y tiene importantes consecuencias para la nutrición mineral y la economía del carbono en la planta. En general, cuando el suministro externo de nitrato es bajo, una alta proporción de él es reducido en la raíz. Cuando el suministro se aumenta, la capacidad de reducción a nivel de la raíz se convierte en un factor limitante, de tal forma que una proporción creciente del N total se transloca hacia los brotes en forma de nitrato donde eventualmente es reducido. Asimilación del amonio Mientras que el nitrato puede ser acumulado en las vacuolas sin ningún efecto lesivo, el ión amonio y en particular su pareja en el equilibrio, el amoníaco, son muy tóxicos a muy bajas concentraciones. La formación de aminoácidos, amidas y compuestos relacionados, es la principal ruta de detoxificación de los iones amonio absorbidos por la raíz, del derivado de la reducción del nitrato o de la fijación del N2 atmosférico. Suministro de N, crecimiento vegetal y composición de la planta 18 El contenido de N requerido para un desarrollo óptimo de la planta, varía entre el 2 y el 5% del peso seco total, dependiendo de la especie vegetal, de la etapa de desarrollo y del órgano. Cuando el suministro de N es deficiente, el crecimiento se retarda y el N se moviliza desde las hojas maduras, translocándose hacia los sitios donde el crecimiento es más activo (meristemos). Los incrementos en el aporte de N, retardan la senescencia, estimulan el crecimiento y cambian la morfología de la planta. Cuando la accesibilidad del N en el medio de enrraizamiento es alta, durante las primeras etapas del crecimiento, la parte aérea se alarga y disminuye el alargamiento de las raíces, lo cual es desfavorable para la obtención de los nutrientes y el agua en etapas más avanzadas. Con un suministro excesivo de N, la longitud y el área de las láminas foliares aumentan y el espesor disminuye. Además, las hojas se doblan fácilmente, lo cual interfiere con la interceptación de la luz solar. El N altera la composición de la planta mucho más que cualquier otro nutriente mineral. En general, a medida que crece el contenido de N, disminuye el de carbohidratos y aumenta el contenido de N proteínico y el N soluble. Estos son abundantes en los tejidos foliares y en los órganos de almacenamiento que tienen altos contenidos de agua, pero son escasos en los granos y semillas. Este cambio en composición, refleja la competencia por los asimilados fotosintéticos entre las diferentes rutas metabólicas. Síntomas de deficiencia de N La deficiencia de N en la planta, se caracteriza por una tasa de crecimiento muy baja. Las plantas permanecen pequeñas (raquíticas), los tallos se ahusan, las hojas son pequeñas y las más viejas caen prematuramente. El crecimiento de la raíz disminuye, y se limita la ramificación. En condiciones de deficiencia de N, aumenta la relación raíz / parte aérea. La deficiencia de N produce el colapso de los cloroplastos y origina disturbios en su desarrollo. Las hojas de las plantas deficientes en N, muestran clorosis uniforme en la lámina foliar. Cuando la deficiencia es muy severa, la hoja o partes de ella se necrosan. En este aspecto, la deficiencia de N difiere fundamentalmente de la deficiencia de K y Mg, en las cuales, los síntomas comienzan en las hojas más viejas pero las manchas cloróticas o 19 necróticas se producen en etapas más tempranas. Los síntomas de deficiencia de Fe, Ca y S, también son similares a los de la deficiencia de N, y se caracterizan por el amarillamiento o palidez de las hojas. Sin embargo, los síntomas de deficiencia de estos elementos se producen primero en las hojas más jóvenes (figura 57). Las plantas con deficiencia de N maduran más pronto y la etapa de crecimiento vegetativo se acorta. Para un crecimiento óptimo de las plantas, debe alcanzarse un balance entre la tasa de producción de fotoasimilados y la tasa de asimilación del N. Cuando hay actividad fotosintética alta (altas intensidades lumínicas, temperaturas óptimas, adecuado suministro hídrico), el nivel de nutrición nitrogenada es elevado y viceversa. En las especies C4, la demanda por N es considerable cuando las condiciones de crecimiento son óptimas. El nivel de nutrición nitrogenada para un crecimiento óptimo durante el período vegetativo también debe balancearse mediante la presencia de otros nutrientes en cantidades adecuadas. La síntesis de compuestos orgánicos nitrogenados depende de varios iones inorgánicos como el Mg2+ para la formación de la clorofila y el PO43- para la síntesis de ácidos nucléicos. El K+ influye considerablemente sobre la absorción y asimilación del NO3-. Es fácil deducir que, para que se produzca una reducción del NO3- adecuada y su posterior asimilación por las plantas, es necesaria la participación directa de P, Fe, S y Mo. Figura 57. Síntomas de deficiencia de nitrógeno en la planta de cafeto. 20 Fijación biológica del N2 atmosférico La diazotrofía El conocimiento empírico de la diazotrofía se remonta a varios miles de años y el concepto de rotación de cultivos con las leguminosas era conocido por los romanos hace dos mil años. Desde 1772 se sabe que el nitrógeno es un constituyente mayoritario de la atmósfera y a comienzos del siglo 19 , los conocimientos adquiridos en relación con el papel del CO2 y el O2 atmosféricos condujeron a los investigadores a postular (sin datos experimentales) al N2 como la fuente de nitrógeno para las plantas. Mediante la utilización de ensayos de rotación de cultivos en el campo, Boussingault (1838) demostró el aporte del nitrógeno atmosférico a los suelos por las leguminosas sin que precisara la forma química del elemento, mientras que von Liebig opinó, sin tener apoyo experimental, que la forma amoniacal presente en el aire era la que estaba implicada en el proceso, opinión que dada la autoridad de von Liebig prevaleció durante casi treinta años, hasta que Boussingault demostró que el contenido de NH3 en el aire es insuficiente, razón por la cual sostuvo la hipótesis de que el nitrógeno provenía del suelo. Sus experiencias fueron efectuadas en potes con suelos calcinados previamente. En 1862, Jodin puso en evidencia la fijación del nitrógeno por microorganismos cultivados en medios desprovistos de nitrógeno pero sus resultados fueron rechazados por la Academia Francesa. Pero la demostración incontestable de que las leguminosas, contrariamente a las otras plantas, pueden utilizar el nitrógeno atmosférico y que esta fijación implica la participación de microorganismos simbióticos y que se realiza en los nódulos fue lograda por Hellriegel y Wilfath en 1888. En este mismo año, Beijerinck aisló la bacteria de los nódulos y la denominó Rhizobium radicicola (= leguminosarum). En 1893, Winogradsky demostró la fijación del N2 por la bacteria anaerobia Clostridium. Como consecuencia de estos adelantos, aparecieron numerosas publicaciones en relación con el carácter supuestamente diazotrófico de una gran variedad de organismos, pero la falta de técnicas adecuadas y de conocimientos sobre las exigencias de la diazotrofia, hizo disminuir de tal modo el interés en esta materia que para los años 1940 sólo se reconocían como 21 diazotróficas la asociación Rhizobium-leguminosa, Clostridium (bacteria anaerobia), Azotobacter (bacteria aerobia) y el alga Nostoc. Todos los organismos capaces de fijar nitrógeno exhiben dos propiedades en común. Una, desde luego, la habilidad para llevar a cabo esta importante y difícil reacción. La segunda es que todos esos organismos son procariotes (Eubacteria y Archaebacteria). No se ha descubierto ningún organismo eucariote capaz de fijar el nitrógeno atmosférico, aunque muchos de ellos se benefician asociándose íntimamente con bacterias fijadoras de nitrógeno. La variedad de organismos fijadores de nitrógeno es tal que es imposible describirlas todas en detalle. En 1992, Young hizo un listado de todos los procariotes fijadores de nitrógeno, describiendo las probables relaciones evolutivas entre unas y otras. El N2 (NN), constituye cerca del 80% de la atmósfera terrestre, pero debido a la estabilidad del enlace triple es inerte y metabólicamente inaccesible para la mayoría de los organismos. Los eucariotes no pueden utilizar el N2, pero algunos procariotes pueden catalizar la reacción enzimática en la cual se reduce el N2 a amoníaco (NH3). La reacción es catalizada por el complejo enzimático de la nitrogenasa y ocurre a temperatura ambiente y bajo la presión atmosférica: nitrogenasa N2 + 16 ATP + 8e- + 8H+ 2 NH3 + 16 ADP + 16 Pi Unas pocas bacterias fijadoras de N2 pertenecientes a las cianobacterias, actinomicetos y a las proteobacterias pueden establecer asociaciones simbióticas con las plantas. En estas simbiosis, el N fijado por las bacterias se intercambia con el C fijado por la planta. Otras especies como Clostridium, Azotobacter, Klebsiella y Azospirillum, también fijan N2, pero no forman asociaciones simbióticas sino que viven independientes en la rizosfera. Forman asociaciones libres con los sistemas radicales pero finalmente, también dependen de los asimilados fotosintéticos producidos por las plantas, para la obtención de la energía necesaria para la fijación del N2. 22 La nitrogenasa y algunas de las proteínas que aportan los compuestos reductores, son sensibles al O2, por tanto, muchas de las bacterias fijadoras del N2 son anaerobias. Como ni la fermentación ni la glicólisis pueden oxidar los compuestos carbonados reducidos tan eficientemente como la respiración aerobia, las bacterias anaeróbicas deben procesar grandes cantidades de sustrato para generar el ATP requerido para la fijación del N2. Las bacterias aerobias tienen la ventaja de producir altas cantidades de ATP, pero deben evitar la sensibilidad de la nitrogenasa al O2. La reducción biológica del N2 atmosférico a amoníaco se efectúa mediante el trabajo de dos enzimas: La dinitrogenasa y la dinitrogenasa reductasa, que forman un complejo conocido como nitrogenasa. La dinitrogenasa se une al N2 y lo retiene mientras se produce la reducción. La dinitrogenasa reductasa provee a la dinitrogenasa de los electrones de alta energía necesarios para la reducción del N2. La dinitrogenasa contiene dos pares de núcleos: 1. El núcleo formado por dos complejos de Fe y S, componentes integrales de la enzima 2. El núcleo que opera como cofactor de la enzima y que puede tomar tres formas: a. FeMoCo (hierro-molibdeno-cobalto) b. FeVCo (hierro-vanadio-cobalto) c. FeFeCo (hierro-hierro-cobalto La forma FeMoCo es la más eficiente y ocurre en mayor proporción en las bacterias, que forman simbiosis muy estrechas con las plantas. La dinitrogenasa-Mo reduce varios compuestos con enlaces múltiples como el N2 y el acetileno (HCCH). El acetileno se convierte en etileno (H2C=CH2), el cual se puede cuantificar mediante la cromatografía de fase gaseosa. Ésta es la base del método clásico para medir la actividad de la nitrogenasa tanto in vivo como in vitro. 23 Se conocen cuatro tipos principales de simbiosis fijadoras de N2: 1. Asociaciones de los rizobios (de los que se reconocen los géneros Rhizobium, Sinorhizobium, Azorhizobium, Mesorhizobium y Bradyrhizobium) con numerosas leguminosas hospedantes de la subfamilia Fabaceae. Como ejemplo de especies vegetales no leguminosas que establecen relaciones simbióticas con los rizobios, se tiene a Parasponia de la familia Ulmaceae. Los rizobios endosimbiontes forman nódulos en las raíces de la planta y aportan el N a leguminosas tan importantes comercialmente como el maní, la soya, la lenteja, el fríjol, la arveja, el trébol y la alfalfa. Es muy importante para la producción de café bajo sombrío la asociación entre los guamos (Inga spp) y los rizobios específicos. 2. Asociaciones endotróficas como en el caso de Gluconacetobacter azotocaptans (sin. Acetobacter diazotrophicus) con caña de azúcar, café, batata y algunas otras plantas. 3. Asociaciones entre actinomicetos del género Frankia con un grupo diverso de dicotiledóneas (árboles y arbustos de 60 géneros de 9 familias), entre las cuales se encuentra el aliso, el mirto y la casuarina. Estas asociaciones juegan un papel muy importante en la economía nitrogenada de los bosques y otros ecosistemas naturales. 4. Asociaciones entre cianobacterias y diversas plantas: Nostoc-Gunnera y AnabaenaAzolla.Gunnera es una dicotiledónea muy frecuente en las zonas frías de Colombia, y Azolla es un helecho acuático ampliamente distribuido en las regiones tropicales (en Colombia, desde la Amazonía hasta la Sabana de Bogotá). La asociación Anabaena-Azolla se usa en los países del Sudeste asiático para aportar el N necesario para la producción de arroz. Protección de la nitrogenasa contra el efecto del O2 atmosférico Como la nitrogenasa es sensible al O2, es difícil suministrarle el ATP y los reductores al mismo tiempo. La cantidad de ATP necesaria para el proceso es muy alta y sólo puede ser aportada eficientemente por la respiración mitocondrial. Entonces, la asociación simbiótica 24 debe establecer estrategias que garanticen la estabilidad de la nitrogenasa y al mismo tiempo posibiliten la generación respiratoria aerobia de ATP. Como primera estrategia, los procesos responsables de la nodulación, generan un ambiente reductor microaerobio que sustenta la síntesis aeróbica estable de ATP. El ambiente microaeróbico de los nódulos se establece mediante la interacción de los dos simbiontes. En segundo lugar, la planta hospedante sintetiza la leghemoglobina, proteína que liga al O2 y desempeña un papel activo en la regulación y transporte del O2 en las células infectadas por el rizobio. En los nódulos simbióticos de la raíz, la leghemoglobina aumenta el flujo del O2 que se moviliza a través del citoplasma hasta los bacteroides, mientras tanto, controla la concentración del O2 libre. La leghemoglobina actúa como un amortiguador y, en esta forma, modera los cambios en la concentración de O2. Así como la hemoglobina animal, la leghemoglobina es una hemeproteína con un núcleo de Fe. Las plantas hospedantes deben tener un suministro adecuado de Co, elemento que forma parte de la vitamina B12 (cianocobalamina), la cual actúa como cofactor en la ruta de síntesis del grupo heme, y por tanto, en la síntesis de la leghemoglobina. En conclusión, el P, el Mo, el S, el Fe y el Co, son elementos esenciales para la fijación de N2 en la relación simbiótica planta-bacteria fijadora. El V es facultativo, dependiendo de la forma de dinitrogenasa. En cuanto a la generación de ferredoxina reducida, esta es asegurada por el sistema: Ferredoxina oxidada + H2 ferredoxina reducida 25 Fisiología de la fijación del N2 por los microorganismos autónomos La uniformidad bioquímica de la nitrogenasa, el sistema enzimático responsable de la reducción del N2, hace posible establecer las siguientes generalizaciones: 1. La ruta de la fijación del N2 es esencialmente reductora y no sólo es reductora, sino que al menos uno de los componentes de la nitrogenasa es destruido por el oxígeno en todos los organismos examinados. 2. El proceso consume energía metabólica. A pesar de que la reducción del N2 a NH3 está acoplada a la oxidación de un sustrato carbonado exógeno, a temperaturas ordinarias y valores intermedios de pH, las preparaciones de enzimas consumen entre 6 y 15 moles de ATP por mole de N2 reducido. 3. Los dos componentes protéicos de la nitrogenasa contienen metales de transición: La fracción 1 contiene Fe y Mo, y la fracción 2 contiene sólo Fe. Importancia de los organismos independientes libres o asociados con las raíces de pastos y cereales Como se dijo antes, muchas de las bacterias heterotróficas que se encuentran en el suelo son capaces de fijar N2. Pero, cuánto nitrógeno pueden fijar? Es significativa la cantidad de nitrógeno aportada al suelo para la agricultura? Se pueden manipular y aumentar las tasas de fijación? La fijación de nitrógeno es un proceso costoso en energía y los microorganismos del suelo existen bajo condiciones cercanas a la deficiencia de ella la mayor parte del tiempo. Bajo esta óptica, es importante considerar posibles fuentes de energía que puedan ser adecuadas para sostener la fijación de nitrógeno, por ejemplo, sustratos orgánicos tales como plantas en descomposición o pérdidas de carbono desde las raíces de las plantas. La rizósfera, que se define ampliamente como la parte externa de las raíces y el suelo influenciado por ellas, es una fuente de carbono relativamente rica y consecuentemente, una zona de intensa actividad microbiana, que se puede considerar como un nicho adecuado para los organismos fijadores de nitrógeno. 26 Asociaciones entre bacterias fijadoras de nitrógeno y pastos El número de microorganismos es normalmente mucho mayor en la rizósfera que en el suelo apartado de las raíces de las plantas, debido a la mayor accesibilidad de las fuentes de carbono. Sin embargo, las cantidades de nitrógeno accesible en la rizósfera son a menudo limitantes para el crecimiento microbiano, de tal forma que se esperaría que las bacterias fijadoras de nitrógeno tuvieran una ventaja competitiva. De hecho, la mayoría de las observaciones indican que sólo del 1 al 10 % de la población bacteriana de la rizósfera está compuesto por organismos fijadores de nitrógeno, con excepción del arroz, en donde hasta el 85 % de la población de las bacterias de la rizosfera pueden ser fijadores de nitrógeno. Sin embargo, la precisión de tales conteos puede ser puesta en duda ya que depende del uso de medios de cultivo que son selectivos para grupos particulares de organismos. Especificidad de las asociaciones De acuerdo con varios autores, se ha sugerido que existe un grado de especificidad entre ciertas bacterias fijadoras independientes y algunos pastos. La población de Beijerinckia es mayor en la rizósfera de la caña de azúcar que en la de otros pastos, siendo más rica la población en la rizósfera que en el suelo circundante. La población de Azotobacter paspalii es mayor en la rizósfera de genotipos tetraploides de Paspalum notatum, y se ha encontrado que Spirillum lipoferum se distribuye ampliamente en la rizosfera de los pastos tropicales y de la zona templada. Debido a que tales asociaciones en gran parte de las ocasiones son muy estrechas, algunos plantean que se trata de verdaderas simbiosis pero no se puede asimilar este tipo de asociación a la relación simbiótica verdadera entre las leguminosas y los Rhizobia . Por tal razón, se habla de asociación más que de simbiosis. Se ha propuesto el término “rizocenosis diazotrofica” (diazo N2; trofos nutrición; rizo raíz; ceno común) para describir tales asociaciones pero no ha sido aceptado ampliamente. 27 Estimaciones de campo de la fijación de N2 asociada con pastos tropicales Con la comparación de la fijación, cuantificada mediante los métodos de reducción de acetileno y dilución del 15N, en Brasil se han logrado hacer algunas estimaciones relativamente confiables. Se ha calculado que en el genotipo batatais de Paspalum notatum que tiene en su rizosfera la asociación con Azotobacter paspali, el nitrógeno incorporado proviene en un 8 a 25 % de la fijación biológica, lo cual equivale aproximadamente a 20 kg N ha-1 año-1. También se han encontrado cantidades similares de nitrógeno fijado por estas asociaciones en Brachiaria. En Panicum se ha logrado estimar que entre el 24 y el 38 % del nitrógeno asimilado proviene de la fijación efectuada por los organismos asociados a la rizosfera, lo cual equivale a 60 -120 kg N ha-1 año-1 , usando Brachiaria como planta de referencia. Los resultados más importantes se han logrado en caña de azúcar, en donde se ha podido estimar que entre el 60 y el 80 % del nitrógeno asimilado proviene de la fijación biológica, lo cual produce un estimativo más de 170 kg ha-1 año-1. En contraste, las estimaciones de las cantidades de nitrógeno fijado por las bacterias independientes libres en el suelo arrojan valores que no exceden 5 kg ha-1 año-1. No es posible hacer estimaciones generales que puedan dar una idea de la importancia del aporte de las bacterias fijadoras independientes libres o asociadas, principalmente porque los métodos de estimación no son perfectamente confiables y se presentan altos coeficientes de variación que hacen difícil la interpretación de los resultados. De todas maneras, aunque tal contribución sea pequeña, su persistencia en el tiempo la hace de una gran importancia global. 28 El carácter reductor de la fijación del N2 1. Distribución de la fijación entre aerobios y anaerobios. Hasta el presente tal parece, que los microbios aerobios fijadores genuinos son raros. Entre las bacterias, los fijadores aeróbicos se encuentran principalmente en la familia Azotobacteriaceae (géneros Azotobacter, Azomonas, Azotococcus, Beijerinckia y Derxia), las cuales son muy similares taxonómicamente. El resto de bacterias aeróbicas fijadoras son anaerobias facultativas que pueden fijar sólo en anaerobiosis , de tal manera que la habilidad para fijar el N2 aeróbicamente, está confinada a relativamente pocos grupos de bacterias entre los cuales la familia Azotobacteriaceae es la más ampliamente distribuída , ocurre en los aerobios facultativos ya mencionados y en algunos tipos de anaerobios obligados: Clostridium , Methanobacterium , Desulfovibrio , Chlorobium, Chromatium , Desulfatomaculum. En las algas azul-verdosas, la fijación aeróbica es común, pero estos organismos son mucho más evolucionados que las bacterias. 2. La generación del poder reductor Aunque existe una notable especificidad en la fuente del poder reductor para el proceso de fijación del N2, se ha demostrado que este proceso está íntimamente ligado a la ferredoxina y al sistema fosfoclástico pirúvico normal. Algunas bacterias utilizan el piruvato y el ceto-butirato como fuente de poder reductor. En las cianofíceas son el piruvato y el ATP generado en la fotosíntesis. Aunque está muy estrechamente ligada a la fotosíntesis, la fijación del N2, está acoplada a las reacciones oscuras que utilizan el ATP generado en presencia de la luz y el poder reductor del CO2 fijado. 29 3. Protección de la nitrogenasa en los aerobios Ya que la nitrogenasa purificada es inactivada en gran parte por la presencia de O2, las bacterias aerobias fijadoras necesitan algún mecanismo fisiológico para proteger al componente sensible del daño por el oxígeno. Se ha propuesto la llamada protección conformacional. 4. Inhibición de la fijación biológica por el oxígeno Una consecuencia empírica de la sensibilidad de la nitrogenasa al oxígeno es la de que la mayoría de las bacterias fijadoras de condiciones aerobias y las algas azulverdosas no fijan óptimamente en condiciones de presiones parciales de oxígeno (pO2) atmosféricas. Un mecanismo de protección conformacional muy atractivo está dado por la observación de que la nitrogenasa puede estar asociada a las membranas en Azotobacter vinelandii. 5. Inhibición de la síntesis de nitrogenasa por el oxígeno Parece que algunos anaerobios facultativos tales como Rhodospirillum, Klebsiella y Bacillus polymixa no sintetizan nitrogenasa en presencia de oxígeno disuelto en el medio. 6. Inhibición del crecimiento aeróbico por el oxígeno. La sensibilidad del crecimiento delas Azotobacteriaceae fijadoras de nitrógeno en presencia de O2 ha sido notada desde hace tiempo, a pesar del hábito aerobico de tales bacterias. Se ha mostrado cómo el status nutricional tiene una marcada influencia en estos procesos. En efecto, poblaciones deficientes en suministro de C y P son más susceptibles al efecto del O2. 7. La respiración como proceso protector Se ha formulado la hipótesis de que los altos valores de tasa de evolución del O2 en las Azotobacteraceae son la expresión de un mecanismo muy activo que efectúa la 30 protección de la nitrogenasa y se pone en funcionamiento durante la respiración: El acceso del O2 a la nitrogenasa es evitado mediante la respiración, lo cual se denomina protección respiratoria. 8. La eficiencia de la fijación aeróbica del nitrógeno En presencia de bajas presiones parciales de oxígeno, Anabaena, las Azotobacteriaceae y el Mucobacterium flavum, inician y llevan a cabo la fijación del nitrógeno con relativa rapidez. Esto se evidencia en la cantidad de N2 fijado por gramo de materia seca consumido. En efecto, se han registrado hasta 40 mg de N por gramo de materia seca, lo cual puede ser de gran importancia ecológica. 9. El caso de las algas azul-verdosas Las cianofíceas capaces de fijar el N2 tienen un problema especial ya que el metabolismo fotosintético conduce a la evolución de oxígeno. Una característica de casi todas las cianofíceas fijadoras de N2, como los miembros del género Anabaena, es la presencia de heteroquistes desprovistos del fotosistema II que representan hasta el 30% de las células de la población. Esta formación de heteroquistes constituye una forma extrema de separación o compartimentación que requiere el organismo fijador si debe fijar el N2 y metabolizar el O2 simultáneamente. La necesidad de ATP en la fijación de N2 En este aspecto, la distribución entre anaerobios y aerobios se basa en la manera como se obtiene el ATP a partir de un sustrato. Hasta lo que se sabe, los anaerobios fermentadores no tienen un mecanismo de formación de ATP equivalente a la fosforilación oxidativa de la cadena respiratoria aerobia. Esto puede explicar la ineficiencia de los fijadores anaerobios, ya que se sabe que el mecanismo de fijación puede necesitar hasta 20 moles de ATP por mole de N2 reducido. 31 Parece que en las aerobias, la ruta del nitrógeno incluye una regeneración del ATP análoga a la fosforilación oxidativa de la cadena respiratoria aerobia, a pesar del hecho de que el proceso total conduce a una pérdida neta del ATP. La necesidad de hierro y molibdeno Los metales de transición como componentes funcionales de la nitrogenasa El Mo es un componente de la fracción I de la nitrogenasa de todos los microbios estudiados, aún cuando el requerimiento sea muy bajo, como en el caso de Beijerinckia que necesita sólo 1/100 de la cantidad requerida por Azotobacter. De la misma forma, Azotobacter requiere una cantidad de calcio anormalmente alta, característica que no exhibe Beijerinckia, lo cual hace pensar que existe una asociación en el funcionamiento del Mo y el Ca. Es posible que Azotobacter sea muy susceptible a un desbalance de los nutrientes minerales. El Fe también es parte integral de la nitrogenasa, y ocurre en ambas fracciones del complejo, en la una (I) como Fe y en la II asociado a S lábil. Las evidencias muestran que los dos metales participan directamente en la reacción. Citocromos y enzimas férricas no hémicas En las bacterias aerobias participan los citocromos en el metabolismo del O2, aunque no hay evidencia de que participan directamente en la fijación del nitrógeno. Fósforo (P) Número atómico: 15 Masa atómica: 30.97 Forma de absorción por las plantas: Iones fosfato (H2PO4- , HPO42-) El P se encuentra en la planta en forma inorgánica como ortofosfato y con menor frecuencia como pirofosfato. En las formas orgánicas, el ortofosfato se esterifica con los 32 OH- de los azúcares y alcoholes o se liga mediante un enlace pirofosfato a otro grupo fosfato, como en el caso de la fosfatidilcolina. Los fosfatos orgánicos formados de esta manera son son, principalmente, compuestos del metabolismo intermediario. Tienen una mitad hidrofóbica (la parte correspndiente al ácido graso) y una mitad hidrofílica (la parte correspondiente al grupo fosfato), y son componentes esenciales de la membrana celular. Tal parece que la única función del P en el metabolismo, es la formación de los enlaces éster fosfato con los cuales es posible la transferencia de energía mediante las moléculas de adenosina trifosfato (ATP) y sus nucleótidos análogos, uridina trifosfato (UTP), citidina trifosfato (CTP) y guanidina trifosfato (GTP). La UTP se requiere para la síntesis de la sacarosa y la callosa, la CTP para la síntesis de fosfolípidos y la GTP para la formación de celulosa. Además, todos estos nucleótidos, incluyendo a la timidina trifosfato (TTP), están relacionados con la síntesis de los ácidos nucléicos (ADN y ARN). El papel del fosfato en la síntesis de los ácidos nucléicos, es indicativo de su esencialidad no sólo en las plantas sino en todos los organismos vivientes. El compuesto orgánico más importante del P, es la adenosina trifosfato (ATP). La energía absorbida durante la fotosíntesis o liberada durante la respiración celular (anaerobia o aerobia) se almacena en forma de los enlaces éster fosfato del ATP. En esta forma, la energía puede ser conducida hacia varios procesos metabólicos que la consumen, como la absorción de los iones minerales y las síntesis de muchos compuestos orgánicos, en las cuales se necesita una reacción inicial de fosforilación. El P forma también parte de la estructura de la fitina, compuesto presente principalmente en las semillas. La fitina ocurre en forma de sales de Ca y Mg del ácido fítico, el cual se forma durante el proceso de desarrollo de las semillas. Inmediatamente después de la polinización, ocurre un aumento del transporte del P hacia las semillas jóvenes en desarrollo. La fitina se considera como una reserva de P en el organismo vegetal. Durante la germinación de las semillas, el P de la fitina se moviliza y se convierte en formas de fosfato necesarias para el metabolismo de las plántulas. Los ácidos nucleicos se encuentran en el núcleo, los cloroplastos y la mitocondria, mientras que los azúcares fosfato dominan en el citoplasma, los fosfolípidos en los cloroplastos y el fosfato inorgánico (Pi) en la vacuola. El Pi vacuolar se puede considerar como una reserva 33 que va siendo suministrado al citoplasma a medida que se hace necesario. El almacenamiento del Pi en la vacuola, es un mecanismo de control de su concentración intracelular, la cual debe mantenerse entre 5 y 6 mM. Las concentraciones de Pi citoplásmico por debajo de este rango, disminuyen el desarrollo vegetal (crecimiento y diferenciación) y a concentraciones menores de 0.3 mM, se inhibe completamente el crecimiento. El Pi citoplásmico cumple una función reguladora mediante su influencia sobre la actividad de varias enzimas como la fosfofructkinasa (PFK). El Pi juega un papel muy importante en la regulación de la síntesis de los almidones. Síntomas de deficiencia de P El fósforo interviene en el desarrollo de las raíces y en la maduración de frutos y semillas. Los síntomas de deficiencia son similares a los de nitrógeno: hojas color verde oscuro, frutos fláccidos, suaves, ácidos y de piel gruesa. Los requerimientos para un desarrollo vegetativo óptimo de las plantas, se encuentran en el órden del 0,3 al 0,5% de la materia seca, y el contenido de P en las plantas deficientes, se encuentra generalmente por debajo del 0,1% de la materia seca. Las plantas con deficiencia en P sufren de retardo en el crecimiento y la relación de materia seca entre el brote y la raíz es baja. Las tasas de crecimiento de los brotes nuevos en los árboles frutales se reducen y con mucha frecuencia la apertura y desarrollo de las yemas es inadecuado. En las plantas con deficiencia en P, la formación de los frutos y semillas es anormal: No sólo se reducen los rendimientos, sino que la calidad de los frutos y semillas es muy pobre. En general, los síntomas de deficiencia de P aparecen en primer lugar, en las hojas más viejas que se tornan de color verde oscuro o negruzco. Las estructuras aéreas pueden adquirir una coloración rojiza debido al incremento en la síntesis de antocianinas. Las hojas de las plantas leñosas adquieren un color parduzco y se caen prematuramente. 34 En condiciones de deficiencia de P, la expansión celular y foliar se retarda en relación con la síntesis de clorofila, con lo cual, el contenido de clorofila por unidad de área aumenta, pero su eficiencia fotosintética es menor. Debido a las funciones del P en el desarrollo y metabolismo de las plantas, su deficiencia tiene como resultado una reducción general de los procesos metabólicos, lo cual incluye la reducción en la división y expansión celular, en la fotosíntesis y en la respiración. El papel regulador del P en la fotosíntesis y en el metabolismo de los carbohidratos en las hojas puede considerarse como uno de los factores más limitantes del crecimiento, en particular, durante la etapa reproductiva. La deficiencia de P, altera la función de los transportadores de membrana. La mayor parte los transportadores, están acoplados a la función de ATPasas de la membrana celular y mitocondrial responsables de la formación del ATP necesario para suministrar la energía necesaria para el transporte activo: Una adecuada nutrición en P, puede garantizar la absorción y transporte de los demás nutrientes minerales que son absorbidos activamente por la raíz de la planta (figura 58). Figura 58. Síntomas de deficiencia de fósforo en las hojas del cafeto. 35 Estrategias utilizadas por la planta para incrementar la accesibilidad del P en la rizosfera Debido a la elevada adsorción del fosfato sobre las partículas de arcilla, el P es el macronutriente menos accesible a las raíces de las plantas. En los suelos calcáreos suceden reacciones parecidas entre el Pi y el CaCO3. Por otro lado, los microorganismos del suelo pueden convertir el Pi en formas orgánicas que no son fácilmente utilizadas por las raíces. Las plantas han desarrollado una serie de estrategias para extraer el P de las reservas del suelo, que de otra forma no son accesibles a la planta. Como respuesta a la deficiencia de P, la estructura y función del sistema radical se alteran para aumentar la solubilidad del P del suelo y para aumentar su superficie de exploración. Las formas de respuesta del sistema radical a la baja accesibilidad del P son: 1. Asociación con micorrizas, hongos habitantes del suelo con la habilidad de absorber el P del medio. 2. Alteraciones en la arquitectura de la raíz para explorar el suelo más efectivamente. 3. Aumento en la densidad y longitud de los pelos radicales para aumentar la superficie de absorción y reducir la longitud de la ruta de difusión del P. 4. Liberación de ácidos orgánicos y de H+ para solubilizar el P inorgánico. 5. Exudación de fosfatasas para liberar el P ligado orgánicamente del suelo. 6. Desarrollo de transportadores de Pi de alta afinidad en la membrana celular de la raíz. Potasio (K) Número atómico: 19 Masa atómica: 39,102 Forma de absorción por las plantas: Ión potasio (K+) El K+ es el catión celular más abundante. Su concentración citoplásmica se mantiene regulada entre los 80 y 200 mM, y la concentración total en los tejidos vegetales alcanza, en promedio, los 20 mM. Desempeña cientos de funciones a nivel celular. Sirve como material 36 osmótico para el crecimiento celular y para la función estomática, balancea las cargas de los aniones difundibles y no difundibles, activa más de 50 enzimas, y participa en numerosos procesos metabólicos. El K+ es muy móvil dentro de las células, entre los tejidos y en toda la planta. El K+ ingresa al simplasma de la raíz mediante transporte activo, a través de la membrana plasmática de las células radicales. Desde allí se translada a través del simplasma hacia los tejidos vasculares, donde se descarga en el xilema. Desde allí pasa al parénquima leñoso y se transporta hasta las hojas. En las hojas, el K+ se reabsorbe por las células foliares. A partir de las hojas maduras y totalmente expandidas se inicia un flujo del K+ que se descarga en el floema y se translada a los tejidos meristemáticos (ápices de la raíz y el tallo), que actúan como un vertedero del ión. El K+ puede atravesar el tonoplasto y almacenarse en las vacuolas de los tejidos apicales del tallo o de la raíz. El sistema integrado de transportadores de K+, juega un papel central en el desarrollo de la planta y en la asignación de los nutrientes minerales, en respuesta a los cambios en la accesibilidad de ellos. Activación enzimática Se pueden enumerar más de 50 enzimas que dependen completamente o que son estimuladas por el K+. En las plantas deficientes en K+, se produce acumulación de carbohidratos solubles, disminución de los niveles de almidón y acumulación de compuestos solubles de N. Los cambios en el metabolismo de los carbohidratos son debidos a los requerimientos tan elevados de K+para el funcionamiento de ciertas enzimas reguladoras como la piruvato kinasa y la 6-fosfofructokinasa. La actividad de la almidón sintetasa depende en alto grado del K+. Esta es la razón por la cual los cultivos que acumulan grandes cantidades de almidón en sus estructuras de almacenamiento, son tan exigentes en K+. Otra función clave del K+ es la activación de las ATPasas de las membranas que requieren Mg2+ pero que son estimuladas por el K+. La activación de las ATPasas, no sólo facilita su transporte, sino que hace que el K+, sea el elemento mineral más importante en la extensión celular y en la osmoregulación. 37 Síntesis de proteínas El K+se requiere para la síntesis de proteínas en las plantas superiores. En condiciones de deficiencia de K+, se afecta negativamente la síntesis de Rubisco, lo cual es una explicación de por qué el metabolismo nitrogenado es tan dependiente del K+. Fotosíntesis En las plantas superiores, el K+afecta la fotosíntesis en varios niveles: Es el ión coparticipante en el proceso de transferencia de H+a través de la membrana tilacoidal durante la síntesis de ATP en los procesos de fotofosforilación. El K+, es necesario para mantener la integridad estructural y funcional del cloroplasto. Movimiento estomático En la mayoría de las especies vegetales, el K+es el responsable de los cambios en la turgencia de las células guardas durante el movimiento estomático. El incremento en la concentración de K+en las células guardas, da como resultado la toma de agua a partir de las células adyacentes, con el consiguiente incremento en la turgencia de las células guardas y la apertura estomática. Deficiencia de K+ Su presencia en todas las partes de la planta, contribuye a crear resistencia a las enfermedades y a los cambios de temperatura. Su deficiencia se presenta como crecimientos cortos, hojas cloróticas con los bordes color café y exceso de chupones. Pocos racimos florales y frutos pequeños de maduración retardada (figura 59). 38 Figura 59. Síntomas de deficiencia de potasio en la planta de cafeto. Calcio (Ca) Número atómico: 20 Masa atómica: 40.08 Forma de absorción por las plantas: Ión calcio (Ca2+) Entre los nutrientes esenciales, el calcio juega un papel especialísimo en la vida de las plantas. Es el eje del mantenimiento de la integridad celular y de la permeabilidad de la membrana. Induce la germinación del polen, acelera el crecimiento del tubo polínico y 39 activa varias enzimas que participan en el crecimiento y diferenciación de la planta. Es muy importante en la síntesis de proteínas y en el transporte de los carbohidratos. En su presencia, la planta activa los mecanismos de detoxificación de metales pesados (fitorremediación). Recientemente, se ha descubierto que el calcio juega un papel hormonal en el metabolismo de la planta. Absorción y translocación Las plantas superiores contienen cantidades apreciables de Ca (30 mg g-1 de materia seca). Estos contenidos se deben, principalmente, a los altos niveles de Ca en la solución del suelo, más que a la eficiencia de los mecanismos de absorción por las células de la raíz. Aunque la concentración del Ca2+ en la solución del suelo normalmente es de unas 10 veces mayor que la concentración en K+, la tasa de absorción del Ca2+ es menor que la del K+. Este potencial bajo de absorción se debe a que el Ca2+ sólo puede ser absorbido por los ápices jóvenes de la raíz, en los cuales no hay suberización de las paredes de la endodermis. La absorción del Ca2+ puede ser inhibida competitivamente por la presencia de otros cationes como el K+ y el NH4+. Los estudios sobre la absorción del Ca2+ muestran que su absorción y translocación en la raíz y dentro de la planta, es principalmente un proceso pasivo. El Ca2+ contenido en la savia bruta se transloca hacia las partes más elevadas de la planta en la corriente transpiratoria. Así, en gran medida la translocación del Ca2+ está controlada por la intensidad de la transpiración, aunque también existe un efecto de la presión radical. Funciones del Ca2+ Estabilización de la pared celular Cuando se suspende el suministro de Ca2+a la raíz de las plantas, su crecimiento se reduce y después de algún tiempo, las raíces toman una coloración parda y mueren. El Ca requiere para el alargamiento y la división celular. 2+ se 40 En comparación con otros macronutrientes, una alta proporción del Ca2+de los tejidos vegetales se localiza en las paredes celulares. Esta distribución es el resultado de la abundancia de sitios de ligamiento para el Ca2+en las paredes celulares. En la laminilla media, se une a los grupos carboxilo de las pectinas y en algunos frutos, el Ca2+ligado a la pared celular puede alcanzar hasta el 90% del total. La degradación de los pectatos se produce mediante la actividad de la poligalactorunasa, la cual se inhibe por altas concentraciones de Ca2+. De acuerdo con esto, cuando se reduce el suministro de Ca2+, se activa la enzima y se produce uno de los síntomas típicos de la deficiencia del elemento, que consiste en la degradaci ón de la pared celular y la necrosis de los tejidos afectados (pecíolos y partes terminales). La proporción de pectatos de Ca2+en las paredes celulares es muy importante para determinar la resistencia a las enfermedades, y para el proceso de maduración de los frutos. Estabilización de la membrana y modulación enzimática + En las plantas deficientes en Ca2 , se produce una desintegración general de las estructuras de las membranas, acompañada de pérdida de la compartimentación celular y se incrementa la tasa de respiración celular. El Ca2+estabiliza las membranas formando puentes entre los grupos fosfato y carboxilo de los fosfolípidos y de las proteínas. A diferencia del Mg2+, que es un activador de muchas enzimas, el Ca2+activa solamente unas pocas de ellas, entre las cuales se encuentran la α-amilasa, las fosfolipasas y las ATPasas. El Ca2+contribuye a la formación de los gradientes de potencial de K+entre el apoplasto y el citoplasma, razón por la cual la deficiencia de Ca2+,disminuye la actividad de las ATPasasK+en la membrana celular, y afecta negativamente el contenido de K+. Transducción de señales El Ca2+citosólico ocupa una posición central en la transducción de señales en la célula vegetal. 41 Entre las señales que se transducen mediante la concentración del Ca2+, se encuentran la sensibilidad al tacto, al viento, al choque térmico, a los elicitores fúngicos, a las heridas, a los estreses por oxidación, a la luz roja, a la luz azul, a la anaerobiosis, al ácido abscísico (ABA), a los estreses osmóticos y a la nutrición mineral. Las células vegetales mantienen concentraciones muy bajas de Ca2+en el citosol (100 á 200 nM), para facilitar los procesos de transferencia de las señales. Sin embargo, las vacuolas y el retículo endoplásmico rugoso almacenan grandes cantidades de Ca2+(alrededor de 1.0 mM). En la pared celular, donde el Ca2+se utiliza como parte de la estructura molecular, la concentración de Ca2+ puede alcanzar entre 0.5 y 1.0 mM. Otras estructuras como las mitocondrias, los cloroplastos y el núcleo celular, también almacenan grandes cantidades del ión. Estos organelos pueden contener también otros componentes del sistema de transducción de señales, tales como la calmodulina, un receptor proteínico de Ca2+que se encuentra en muchos lugares de la célula. La calmodulina es una proteína pequeña (15 a 17 kDa) que liga al Ca2+, y es el receptor primario del ión tanto en vegetales como en animales. Cuando las células reciben las señales, los canales que transportan el Ca2+se abren transitoriamente y la concentración interna del ión aumenta rápidamente, y se activan numerosas proteínas que ligan el Ca2+, como la calmodulina y las kinasas dependientes del complejo Ca2+ -calmodulina. Es constituyente de la laminilla media de las paredes celulares, ricas en pectato de calcio. La carencia de este elemento se manifiesta en hojas severamente torcidas, raíces con poco desarrollo y fallas en la formación de frutos y semillas. Síntomas de deficiencia de Ca La deficiencia de Ca se caracteriza por la reducción en el crecimiento de los tejidos meristemáticos. La deficiencia se puede observar en primera instancia en los puntos de crecimiento y en las hojas jóvenes, las cuales se deforman y desarrollan clorosis. En estados avanzados de deficiencia, los márgenes foliares se necrosan y los tejidos afectados se vuelven flojos, debido a la disolución de la pared celular. 42 La deficiencia absoluta de Case presenta rara vez, puesto que la mayor parte de los suelos son ricos en Ca2+ accesible. Magnesio (Mg) Número atómico: 12 Masa atómica: 24,312 Forma de absorción por las plantas: Ión Mg2+ Las funciones del Mg en las plantas se relacionan ampliamente con su movilidad dentro de las células, con su capacidad para interactuar con ligandos nucleofílicos muy fuertes (como los grupos fosforilo), para formar enlaces iónicos, para actuar como elemento-puente y para formar complejos con diferente estabilidad. Una alta proporción del Mg2+ total, tiene que ver con la regulación del pH celular y con el balance cationes-aniones dentro de las células. Absorción y translocación En general, la concentración del Mg2+ en el suelo es mayor que la del K+, pero la tasa absorción por las células de la raíz es mucho menor que la tasa de absorción del K+. Parece que esta característica se debe a la carencia de un mecanismo especial para el transporte del Mg2+ a través del plasmalemma. El transporte del Mg2+ es pasivo y, probablemente, mediado por ionóforos, en los cuales el ión se mueve en sentido del gradiente de potencial electroquímico. Como en este tipo de transporte, la competencia entre cationes juega un papel determinante; la absorción del Mg2+ puede afectarse seriamente por el exceso de otro tipo de cationes como el K+ y el NH4+. Esta competencia puede producir deficiencia de Mg2+ en las plantas. El exceso de K+ y Ca2+, también puede afectar la translocación del Mg2+ desde la raíz hasta la parte superior de las plantas. Sin embargo, se sabe que el NO3tiene un efecto benéfico sobre la absorción del Mg2+. En algunas plantas puede prevenirse la toxicidad por Mn aumentando el nivel de Mg2+ en el medio. A diferencia del Ca2+, el Mg2+ es muy móvil en el floema y puede translocarse desde las hojas más viejas a las más nuevas, o hacia los ápices. 43 Funciones del Mg2+ Estructura de la clorofila y activación enzimática La función más conocida del Mg2+, es su presencia en el centro de la molécula de clorofila. Sin embargo, la fracción del Mg2+ total de la planta que cumple esta función, es relativamente pequeña (entre el 15 y el 20%), y aún en las plantas deficientes en el elemento, esta fracción no excede el 30%. Fuera de su función en la estructura de la clorofila, el Mg2+se requiere como cofactor en casi todas las reacciones enzimáticas de fosforilación. Además, el Mg2+ forma puentes entre la estructura del pirofosfato del ATP y del ADP, y las moléculas de las enzimas. Una reacción clave en la cual participa el Mg2+, es la activación de Rubisco, en presencia de la luz. Síntesis de proteínas El Mg2+, es esencial como elemento puente para la unión entre las subunidades del ribosoma, proceso previo a la síntesis de las proteínas. Cuando el nivel del Mg2+es muy bajo, o el nivel de K+es muy alto, las subunidades se disocian y cesa la síntesis de proteínas. El Mg2+, es activador de la ARN polimerasa y por tanto, es esencial para la síntesis de ARN en el núcleo. Deficiencia de Mg2+ El efecto de la deficiencia de Mg2+sobre la síntesis de clorofila, se debe más a la inhibición de la síntesis de proteínas, que a la carencia de Mg2+para la síntesis de la molécula de clorofila. Se moviliza de los tejidos viejos a los jóvenes para intervenir en los puntos de crecimiento. Los síntomas de deficiencia se manifiestan en hojas con clorosis intervenal o en los bordes, necrosis y abscisión prematura. 44 En las monocotiledóneas, la apariencia general de las plantas deficientes en Mg2+, es diferente. En la base de las hojas se desarrollan manchas pequeñas de color verde oscuro, que corresponden a acumulaciones locales de clorofila, sobre el fondo verde pálido o amarillento de la lámina foliar. En etapas avanzadas de la deficiencia las hojas forman bandas cloróticas y se desarrollan manchas necróticas en las puntas de las hojas (figura 60). Figura 60. Síntomas de deficiencia de magnesio en hojas de cafeto Azufre (S) Número atómico: 16 Masa atómica: 32.066 Forma de absorción por las plantas: Ión sulfato (SO42-) El S es esencial para la vida. Las plantas juegan un papel clave en el ciclo del S en la naturaleza ya que ellas son las productoras primarias de compuestos orgánicos sulfurados. Las plantas acoplan el proceso fotosintético a la reducción del, a su asimilación en cisteína y a su posterior metabolismo en metionina, glutatión y muchos otros compuestos. ElSO42-se 45 utiliza primariamente en la síntesis de cisteína, metionina y de numerosos metabolitos esenciales y secundarios derivados de estos aminoácidos. El S es el menos anundante de los macronutrientes que componen la materia seca vegetal. Su contenido es de aproximadamente 0,1% de la biomasa, comparado con el del N que es aproximadamente del 16% y con el del C que alcanza hasta el 45%. En general, a diferencia del C y el N, el S no es un componente estructural de las biomoléculas. Casi siempre está implicado directamente en las funciones catalíticas o electroquímicas de las moléculas de las cuales es componente. El SO42-, es relativamente abundante en el ambiente y, en general, no es un elemento limitante del crecimiento. Sin embargo, las plantas han desarrollado mecanismos para regular la asimilación del SO42- como respuesta a las condiciones de accesibilidad del S en el medio, y para coordinarla con la asimilación del N y con el crecimiento. El SO42- ingresa a la planta a través de la raíz, mediante el mecanismo de transporte activo, es decir, consumiendo energía metabólica en forma de ATP. Para llegar hasta los cloroplastos, donde se produce la reducción a sulfuro, el SO42- debe atravesar, al menos, tres sistemas membranosos: La membrana plasmática de las células de la raíz en la interfase suelo-planta, la membrana plasmática de las células internas de los tejidos que lo transportan, y las membranas del cloroplasto. Debido a que el SO42- es un componente importante del jugo vacuolar, también debe atravesar la membrana de la vacuola o tonoplasto. El transporte del SO42- hacia el interior de las células se realiza mediante un complejo de transportadores específicos acoplados a un gradiente de potencial electroquímico generado por una ATPasa de la membrana. Luego de su absorción, el SO42- se transporta hasta los cloroplastos, donde se realiza su reducción y la mayor parte de la asimilación. Una vez dentro de la célula, el SO42- puede almacenarse en la vacuola, servir como un componente clave para la hidratación del citoplasma o puede entrar al metabolismo celular. La reducción del SO42- se lleva a cabo exclusivamente en los cloroplastos utilizando 3 pasos, así: 46 1) SO42- + MgATP 2) APS + 2 GSH MgPPi + APS (adenilsulfato) SO32- (sulfito) + 2H+ + GSSG + AMP GSH = glutatión reducido GSSG = forma disulfuro 3) SO32- + 6 Fdx reducidas S2- (sulfuro) + 6 Fdx oxidadas Fdx = ferredoxina El S2- reacciona con la O-acetil serina para formar cisteína y acetato. La cisteína producida sirve como precursor para la síntesis de metionina. Tanto la cisteína como la metionina juegan un papel central en las funciones estructurales y catalíticas de las proteínas. El S, es un constituyente estructural de varias coenzimas y grupos prostéticos como la ferredoxina, la biotina y la tiamina (vitamina B1), y la deficiencia del elemento, afecta negativamente la biosíntesis de estos compuestos. La reducción en la síntesis de la ferredoxina, es particularmente importante porque afecta negativamente el transporte de electrones durante la fotosíntesis y la reducción del NO3-, con lo cual se afecta negativamente el metabolismo del C y del N. Para una adecuada absorción y utilización del S, es necesaria la participación directa del P, del N, del Mg y del Fe. Bajo condiciones de deficiencia de S, se inhibe la síntesis de proteínas. En las hojas verdes, la mayor parte de las proteínas se localizan en el cloroplasto y forman complejos con las moléculas de clorofila. Esto hace que en condiciones de deficiencia de S, se reduce la síntesis de clorofila y como consecuencia, se produce clorosis en la lámina foliar. La 47 deficiencia de este elemento provoca problemas similares a los de la deficiencia de nitrógeno pero se expresa en las hojas jóvenes (figura 61). Figura 61. Síntomas de deficiencia de azufre en plantas de cafeto. Hierro (Fe) Número atómico: 26 Masa atómica: 55.847 Forma de absorción por las plantas: Ión Fe 2+ Absorción y translocación El contenido de Fe en los tejidos verdes de las plantas (del orden de 100 mg kg-1 de materia seca), es bajo si se compara con los contenidos de los macronutrientes. Antes de que el Fe3+pueda ser absorbido e introducido en la célula, debe ser reducido a Fe2+. La tasa de reducción del Fe3+, depende del pH del suelo y de la planta, siendo mayor a bajos valores de pH. Las especies vegetales se pueden diferenciar por su habilidad en la utilización de las formas inorgánicas solubles de Fe y de los Fe-quelatos. Las llamadas especies eficientes pueden reducir el pH del medio nutritivo y aumentar la capacidad reductora de la superficie de la raíz bajo condiciones limitativas de Fe, con lo cual aumenta drásticamente la accesibilidad y la absorción del elemento. 48 En comparación con las especies vegetales eficientes para la absorción y utilización del Fe, las plantas ineficientes (los pastos, principalmente) no desarrollan cambios morfológicos bajo condiciones limitativas del elemento. Como estrategia, estas especies acumulan aminoácidos no formadores de proteínas (ácidos avénico y muginéico), en las raíces, y los liberan al medio. Son conocidos como fitosideróforos. Estos fitosideróforos forman 3+ complejos muy estables con el Fe , los cuales pueden ser absorbidos por las raíces. La absorción del Fe se controla metabólicamente y se encuentra influenciada fuertemente por la presencia de otros cationes. En efecto, se ha registrado la competencia del Mn2+, Cu2+, Ca2+, Mg2+, K+ y del Zn2+, durante el proceso de absorción del elemento. Esto puede explicar por qué los metales pesados inducen deficiencia de Fe en numerosas especies vegetales. Se puede establecer una lista de metales, según la magnitud del efecto sobre la absorción y utilización del Fe: Cu > Ni > Co > Zn > Cr >Mn El Fe no es fácilmente movilizable entre los diferentes órganos de la planta. Las plantas deficientes desarrollan rápidamente clorosis en las partes más jóvenes, mientras que los tejidos viejos permanecen verdes. En consecuencia, los tejidos más jóvenes dependen de un suministro continuo de Fe desde el suelo al xilema, o en forma de aspersión foliar. La forma de translocación más importante del Fe en el xilema, es el citrato férrico (citratoFe3+). Funciones bioquímicas El Fe es un elemento de transición. Por esta razón, tiene una notable habilidad para participar en reacciones redox, ya sea reduciéndose u oxidándose. Esto hace que el elemento sea particularmente útil para transferir electrones, según la reacción: Fe+2 Fe+3 + e- 49 Esta característica determina que el Fe esté presente en todas las rutas metabólicas y sea fundamental para la vida tanto de plantas como de los animales. La función mejor conocida del Fe, ocurre en los sistemas enzimáticos donde el grupo heme (anillo de porfirinas con un Fe en el centro, ligado covalentemente) actúa como grupo prostético. Entre las proteínas que contienen el grupo heme se encuentran los citocromos y las enzimas catalasa, peroxidasa y citocromo oxidasa. La función mejor conocida de los citocromos se lleva a cabo durante las cadenas de transporte electrónica de la fotosíntesis y de la respiración aerobia. La citocromo oxidasa, participa en la cadena de transporte de electrones de la fosforilación oxidativa, durante la respiración aerobia. La catalasa y la peroxidasa juegan un papel muy importante en la detoxificacióndel H2O2 (peróxido de hidrógeno) producido en los cloroplastos como consecuencia de la oxidación del H2O durante la fotosíntesis luminosa y en el peroxisoma durante la fotorrespiración en las plantas C3. Las peroxidasas ligadas a la pared celular, catalizan la detoxificación del H2O2 durante la polimerización de los fenoles para la formación de la lignina. A pesar de su importancia para el metabolismo, el Fe contenido en los grupos heme, constituye sólo el 0.1% del Fe total de las hojas. El resto del Fe se almacena en forma de una fosfoproteína férrica llamada fitoferritina, la cual constituye la reserva de Fe necesaria para el desarrollo de los cloroplastos y las demás necesidades fotosintéticas: Los cloroplastos contienen cerca del 80% del total de Fe de las plantas. La ferredoxina, proteína con un núcleo de Fe-S, juega un papel fundamental en el transporte electrónico fotosintético, en la reducción del NO2- a NH4+, durante el metabolismo del N y en la reducción del SO42- . También se ha encontrado que el Fe juega un papel de importancia en la síntesis de la clorofila y en la síntesis de proteínas. Debido a su participación en la estructura de la nitrogenasa y en el grupo heme de la leghemoglobina, el Fe juega un papel central en la fijación biológica del N2 atmosférico. Las deficiencias de Fe y Mg, inducen síntomas similares, ya que las dos se caracterizan por la inhibición de la síntesis de clorofila. Sin embargo, la clorosis inducida por deficiencia de Fe, se desarrolla inicialmente en las hojas más jóvenes mientras que la de Mg, se produce 50 primero en las hojas más viejas. En la mayoría de las especies la deficiencia de Fe induce una clorosis intervenal con un patrón reticulado muy fino. Este patrón es fácilmente observable en las hojas recién formadas, donde las nervaduras conservan un color verde oscuro, mientras que las láminas foliares aparecen con colores verdes claros o amarillentos. Bajo deficiencia severa, las láminas foliares se tornan blancuzcas. En las monocotiledóneas, se desarrolla una clorosis en bandas a lo largo de la lámina foliar (figura 62). La deficiencia de Fe provoca desarreglos en la síntesis de las membranas tilacoidales y disminución en la capacidad fotoquímica del aparato. Ocasiona clorosis intervenal marcada en las hojas jóvenes. Las venas permanecen verdes por más tiempo, lo cual genera un aspecto de radiografía típico de la deficiencia de este elemento. 51 Figura 62. Síntomas de deficiencia de hierro en plantas de cafeto. Manganeso (Mn) Número atómico: 25 Masa atómica: 54.938 Forma de absorción por las plantas: Ión Mn2+ Las plantas absorben el Mn principalmente como Mn2+, y lo translocan como catión divalente libre a través del xilema, desde las raíces hasta las partes aéreas. Absorción y translocación del Mn2+ La tasa de absorción del Mn2+, difiere considerablemente entre las especies vegetales. Sin embargo, en general, las tasas de absorción del Mn2+ son menores que las de los otros cationes divalentes (Ca2+, Mg2+). La absorción del Mn2+ se efectúa mediante transporte activo. Por esta razón, el Mn2+ compite con los otros cationes divalentes por los sitios de transporte, siendo el Mg2+ el principal competidor durante la absorción del Mn2+. 52 El Mn2+ exhibe propiedades químicas propias de los cationes alcalinos (Mg2+, Ca2+) y de los metales pesados (Zn, Fe), razón por la cual no es sorprendente que este tipo de iones afecten la absorción y la translocación en la planta. El Mn2+ se transloca preferentemente hacia los tejidos meristemáticos, de tal modo que los órganos vegetales jóvenes generalmente son ricos en este elemento. Funciones bioquímicas del Mn2+ Las funciones bioquímicas del Mn2+ son similares a las del Mg 2+ . Ambos iones forman puentes entre el ATP y los complejos enzimáticos de las fosfokinasas y las fosfotransferasas. Las decarboxilasas y dehidrogenasas del Ciclo de Krebs, se activan con el Mn2+. Sin embargo, parece que en la mayoría de los casos, el Mn2+ no es específico para estas enzimas, las cuales también pueden ser activadas por el Mg2+. La concentración celular del Mn2+ est á entre 50 y 100 veces menos que la del Mg2+. Solamente se encuentran unas pocas enzimas que contienen Mn2+ y entre ellas, una superóxido dismutasa ampliamente distribuida en las plantas que protege a las estructuras celulares como el fotosistema I (PSI), contra el alto potencial de oxidación de los radicales . libres de O 2. La función más importante del Mn2+ en las plantas verdes, es su participación en el rompimiento de la molécula de agua, y posterior liberación del O2 durante la fotosíntesis. Forma parte de una manganoproteína que transfiere los electrones del agua hasta el fotosistema II, e interacciona fuertemente con el Fe. Síntomas de deficiencia de Mn2+ Los niveles críticos de Mn2+, están entre 10 y 20 mg kg-1 de materia seca en las hojas maduras. Este nivel es muy consistente y es independiente de las condiciones ambientales y del tipo de planta. Por debajo de este nivel, la fotosíntesis neta y el contenido de clorofila disminuyen rápidamente. 53 De todos los organelos celulares, el cloroplasto es el más sensible a la deficiencia de Mn2+. Las laminillas cloroplásticas se desorganizan y pierden su estructura, lo cual afecta directamente la eficiencia del proceso fotosintético. Como consecuencia, se reduce la acumulación de asimilados fotosintéticos en las diferentes estructuras de la planta. En condiciones de deficiencia de Mn2+, las células vegetales permanecen pequeñas, las paredes celulares se engruesan y los tejidos interepidérmicos se arrugan. Como en el caso de la deficiencia de Mg, se produce clorosis intervenal en la lámina foliar. Sin embargo, a diferencia del Mg, los síntomas de deficiencia de Mn2+ aparecen en primer lugar en las hojas más jóvenes. En las dicotiledóneas, la deficiencia de Mn2+ se caracteriza por la formación de manchas pequeñas en las hojas, y el desarrollo de clorosis intervenal. En condiciones de campo, la deficiencia de Mn2+ se restringe normalmente a las plantas cultivadas en suelos muy lavados o con valores altos de pH, y con elevados contenidos de materia orgánica. Su ausencia ocasiona clorosis intervenal que comienza desde los bordes de las hojas hacia el interior. También se originan lesiones y marchitez de frutos (figura 63). Figura 63 .Síntoma de deficiencia de manganeso en la planta de cafeto. 54 Zinc (Zn) Número atómico: 30 Masa atómica: 65,37 Forma de absorción por las plantas: Ión Zn2+ Absorción y translocación Los niveles normales de Zn+2 en el material vegetal son bajos [del orden de 100 mg (kg materia seca)-1]. De acuerdo con lo anterior, el requerimiento de Zn por las plantas es, correspondientemente, pequeño. Todas las evidencias parecen mostrar que la absorción del Zn+2 se controla metabólicamente. En las raíces de las plantas, el 90% del Zn+2 total, se encuentra en los sitios de intercambio o adsorbido a las paredes celulares de la corteza. El Cu inhibe fuertemente la absorción del Zn+2, debido a que los dos iones compiten por el mismo sitio en el transportador específico. En algunas plantas, se han registrado efectos de competencia entre el Zn+2, el Fe y el Mn. También se ha observado competencia con los metales alcalino-térreos (Ca y Mg). No se conoce la forma como el Zn+2 se transloca desde la raíz hasta las partes aéreas de la planta, pero se sabe que la movilidad del Zn+2 dentro de las plantas es baja, y se acumula en los tejidos de las raíces cuando el suministro es alto. En las hojas más viejas, el Zn+2 se vuelve muy inmóvil, y la tasa de transporte del Zn+2 hacia los tejidos más jóvenes disminuye mucho en condiciones de deficiencia del elemento en las plantas. Durante mucho tiempo se ha sabido que el exceso de P produce desórdenes metabólicos que inducen la deficiencia de Zn+2. Funciones bioquímicas del Zn+2 Importante en los procesos de redox. Es activador de varias enzimas y participa en el metabolismo de las auxinas. Actúa como activador metálico de la anhidrasa carbónica, enzima que está muy relacionada con la incorporación del CO2 al proceso fotosintético. Otras enzimas que contienen Zn2+ligado, son la alcohol dehidrogenasa, la superóxido dismutasa y la ARN polimerasa. 55 El Zn2+ está muy relacionado con el metabolismo nitrogenado de las plantas. En las plantas con deficiencia se reduce la síntesis de proteínas, lo cual hace que los aminoácidos y otros compuestos nitrogenados se acumulen. La ARN polimerasa contiene Zn2+, de tal forma que cuando se reduce el aporte del elemento, la enzima se inactiva y la síntesis de ARN se bloquea, y no se transcribe el mensaje genético ni se traduce en los ribosomas: En consecuencia, los aminoácidos se acumulan en el citoplasma, en los cloroplastos y en las mitocondrias. Por otro lado, como los ribosomas contienen grandes cantidades de Zn2+, cuando el elemento está en deficiencia, los ribosomas se vuelven muy inestables y se bloquea la formación de las proteínas. Síntomas de deficiencia de Zn+2 La deficiencia de Zn+2 se presentan con frecuencia en plantas que crecen en suelos ácidos muy lavados, y en suelos calcáreos. El síntoma visible más característico de la deficiencia de Zn+2 en las dicotiledóneas es la formación de rosetas y la disminución drástica del tamaño de la lámina foliar. Estos dos síntomas están conectados con la disminución en la síntesis del AIA. Las rosetas y hojas pequeñas se combinan con una clorosis intervenal muy peculiar: Las nervaduras permanecen verdes y en forma de bandas anchas, formando una especie de espina de pescado. En algunos casos, la clorosis es difusa en toda la lámina foliar. Los síntomas cloróticos y necróticos en las hojas más viejas de las plantas deficientes en Zn+2, se deben principalmente al efecto de toxicidad por P. El nivel crítico para que ocurra la deficiencia, se encuentra por debajo del rango entre 15 y 20 mg Zn+2 kg-1 de materia seca foliar. La producción de granos y/o semillas, disminuye en condiciones de deficiencia de Zn+2, debido a que este elemento también es importante para el proceso de fertilización: Los granos de polen tienen un alto contenido de Zn+2, y durante la fertilización, la mayor parte, se incorpora a las semillas en desarrollo. 56 Cobre (Cu) Número atómico: 29 Masa atómica: 63.546 Forma de absorción por las plantas: Ión Cu+ (Cobre reducido), Cu2+ (Cobre oxidado), Cuquelato El Cu se encuentra en los suelos, casi exclusivamente en forma de Cu2+. Es el micronutriente catiónico que se liga más fuertemente a la materia orgánica del suelo (ácidos húmicos y fúlvicos), formando complejos Cu-materia orgánica que inmovilizan el elemento y reducen su accesibilidad a las raíces de las plantas. Absorción y translocación La planta absorbe el Cu2+ en cantidades muy pequeñas y su contenido en el material vegetal, se encuentra entre 5 y 30 mg (kg materia seca)-1. La absorción del Cu2+ es activa y mediada por transportadores específicos. Se ha encontrado que el Cu2+ inhibe drásticamente la absorción del Zn y viceversa. El Cu no se mueve fácilmente dentro de la planta, aunque se han registrado translocación del elemento desde las hojas más viejas hacia las más jóvenes, y tiene una fuerte afinidad por el átomo de N de los grupos amino, los cuales parecen actuar como transportadores del elemento dentro de los vasos libero-leñosos. Funciones bioquímicas Estructura proteínica y activación enzimática El Cu2+ se reduce fácilmente dentro de la planta a Cu+, el cual es muy inestable. En este aspecto, su comportamiento es muy similar al del Fe. El Cu ligado a las enzimas participa en reacciones redox del tipo Cu2+ + e- Cu+ 57 La mayoría de las funciones del Cu como nutrimento de las plantas, tiene que ver con su participación en las reacciones redox. En las reacciones redox de las oxidasas terminales, el Cu2+ reacciona directamente con el O2y cataliza la oxidación terminal de la fosforilación oxidativa en las células vivientes. El Cu ocurre bajo la forma de tres tipos de proteínas diferentes: 1. Proteínas azules sin actividad de oxidasas, como la plastocianina, las cuales funcionan como transportadoras de electrones. 2. Proteínas no azules, con actividad de peroxidasas y polifenol oxidasas. 3. Proteínas multi-Cu, las cuales contienen al menos cuatro átomos de Cu por molécula y actúan como oxidasas. La citocromo oxidasa es una proteína mixta (Cu-Fe) que cataliza la oxidación terminal en la fosforilación oxidativa de la respiración aerobia. Plastocianina (PC) Más del 50% del Cu contenido en los cloroplastos, se encuentra ligado a la plastocianina, proteína componente de la cadena de transporte electrónico asociada al PS I. Superóxido dismutasa (SOD) El Cu de la SOD-Cu-Zn se requiere para la detoxificación de los radicales superóxido (O2-) que se forman durante la fotorrespiración y la evolución del O2 en el proceso fotosintético. Esta enzima se encuentra en el estroma cloroplástico de las hojas verdes. Fenolasa y laccasa Catalizan las reacciones de oxidación de los fenoles vegetales. La fenolasa se encuentra en el cloroplasto y en la mitocondria tiene dos funciones diferentes: 58 1. Como monoxigenasa de los monofenoles, se conoce como tirosinasa 2. Como monooxigenasa de los O-fenoles, se conoce como polifenol oxidasa Las dos enzimas tienen que ver con la oxidación de ciertos frutos como la manzana y de las raíces tuberosas como la papa, cuando se cortan y se exponen a la atmósfera. Participan activamente en la síntesis de la lignina de la pared celular. Amino oxidasa Es un tipo de enzima muy importante en el metabolismo de las poliaminas, las cuales son muy abundantes en las plántulas de las leguminosas. Como las poliaminas tienen efectos hormonales como mensajeros secundarios, el Cu está relacionado con el balance hormonal y los procesos de desarrollo de las plantas. Metabolismo de los carbohidratos y del N Durante la etapa vegetativa del crecimiento de las plantas con deficiencia de Cu, el contenido de carbohidratos solubles totales es mucho más bajo que en las plantas normales. Sin embargo, cuando la planta deficiente en Cu llega a la etapa reproductiva, se reduce el número de granos y la planta permanece verde, pero se puede acumular una cantidad excesiva de carbohidratos solubles en las hojas y en las raíces. Esta es una respuesta inesperada, si se considera el papel del Cu en la fotosíntesis, como núcleo metálico de la plastocianina. Sin embargo, en condiciones de deficiencia, los meristemos apicales de la parte aérea contienen muy bajos niveles de carbohidratos solubles. Se ha encontrado que el Cu juega un papel importante en la fijación biológica del N2 atmosférico, pues en condiciones de deficiencia, se inhiben la nodulación y la actividad de la nitrogenasa. Síntomas de la deficiencia de Cu Por lo general, es muy difícil observar síntomas de deficiencia de Cu en el campo, ya que las cantidades que requiere la planta para llenar sus necesidades son muy bajas. El nivel 59 crítico para que se produzca la deficiencia en la mayoría de las plantas, se encuentra en el rango de 3 a 5 mg Cu (kg materia seca)-1. Sin embargo, en los casos en que se produce la deficiencia, el crecimiento de la planta se reduce, las hojas jóvenes se distorsionan y se desarrollan necrosis en los meristemos apicales del tallo y de la raíz. Con frecuencia, se observa muerte descendente en plantas arbóreas. En las plantas deficentes en Cu, se reducen los rendimientos en granos, semillas y frutos, y se produce un aumento en la formación de material vegetativo. El cambio anatómico más típico, relacionado con la deficiencia de Cu en las plantas superiores, es el desbalance en la lignificación de las paredes celulares. Este desbalance origina la distorsión característica de las hojas jóvenes y de los tallos en plantas deficientes en ele elemento, y con frecuencia, se presenta una proliferación de ramas pequeñas, similar al síntoma de la escoba de bruja en el cacao. Todos estos síntomas están relacionados en mayor o menor grado, con la inhibición de la síntesis de lignina en las paredes celulares de las plantas deficientes en Cu. Este efecto se explica por el papel del elemento en la activación de la fenolasa (polifenol oxidasa) y de la laccasa, enzimas responsables de transformaciones muy importantes durante la síntesis de lignina. Las hojas de las plantas deficientes en Cu, desarrollan un color verde oscuro, debido a que su contenido de clorofila y proteínas aumenta. Sin embargo, la eficiencia fotosintética disminuye y por consiguiente, disminuye el contenido de carbohidratos totales. Boro (B) Número atómico: 5 Masa atómica: 10.81 Forma de absorción por las plantas: Ión borato (H2BO3-) Los estudios acerca del papel del B en las plantas datan de 1910. Sin embargo, la primera evidencia acerca del carácter esencial del B en las plantas superiores fue proporcionada por Warington en 1923. Poco después se describieron daños estructurales atribuibles a su deficiencia, como la rotura del tallo en el apio, la pudrición del tallo en la coliflor, la 60 pudrición del corazón y las manchas negras en la remolacha azucarera, la pudrición apical en el tabaco, la suberización interna de las manzanas y el amarillamiento de la alfalfa. Debido a esto, la aplicación de fertilizantes boratados se volvió una práctica común en la producción de varios cultivos. Según los resultados de la investigación, el requerimiento de B es muy variable entre las especies vegetales y el nivel óptimo para una especie puede ser o tóxico, o insuficiente para otra. Con base en los requerimientos de B, las plantas pueden dividirse en tres grupos: 1. Las monocotiledóneas de la familia de las gramíneas, con los requerimientos de B más bajos. 2. El resto de las monocotiledóneas y dicotiledóneas con requerimientos intermedios. 3. Las plantas productoras de látex, que son las especies con mayores requerimientos del elemento. Movilidad del B y transporte de las moléculas en el floema En las plantas superiores, el B se moviliza desde las raíces en la corriente transpiratoria y se acumula en los puntos de crecimiento de las hojas y tallos. Una vez en las hojas, su redistribución se restringe y el elemento se fija en el apoplasto. De acuerdo con este patrón, se considera que, en general, el B es inmóvil dentro del floema; sin embargo, se ha encontrado que la aplicación foliar de este elemento aumenta su contenido en las hojas de algunos árboles frutales, pero durante algunas épocas se moviliza hacia la corteza. En el momento de la floración, el B se moviliza desde la corteza hacia las yemas florales aumentando el cuajamiento floral. El transporte del B en el floema depende de la molécula transportadora (azúcar o poliol) usada por la planta. Algunos cultivos como la soya, contienen grandes cantidades del poliol pinitol y responden a la aplicación foliar de B. 61 Papel del B en la estructura de la pared celular La forma y el tamaño de las plantas dependen de la pared celular primaria. Desde hace mucho tiempo se conoce la estrecha relación que existe entre las paredes celulares primarias y la nutrición boratada: En la pared celular se localiza hasta el 90% del B celular. Por esta razón, el primer síntoma de deficiencia de B es la desorganización de la pared celular y de la laminilla media. El ión forma enlaces éster con los grupos OH- de los carbohidratos y/o las glicoproteínas de la pared celular, formando una red de puentes entre los polímeros. Esto puede explicar muchas de los síntomas de deficiencia o de intoxicación (exceso) en las plantas superiores. Se ha encontrado que las plantas deficientes en B tienen menos Ca en la pared celular; allí, mediante la formación de enlaces cruzados en la pectina de la laminilla media, el B protege al Ca. El mecanismo parece estar asociado con una formación previa de enlaces débiles entre los componentes de la pared celular y el B. Esta formación de enlaces débiles, es necesaria para la formación posterior de enlaces más fuertes entre los componentes de la pared celular y el Ca (y eventualmente, el Mg). Papel del B en la membrana celular El suministro de B induce cambios rápidos en la membrana celular de plantas con deficiencia del elemento. La deficiencia de B disminuye la actividad de las ATPasas de la membrana y la actividad se restaura cuando se agrega B a la solución nutritiva. El aporte de B a niveles normales, aumenta la rigidez de la membrana celular en las plantas deficientes, como resultado del incremento en los niveles de auxinas. El suministro de B a plantas deficientes provoca cambios de polaridad en la membrana, que dan como resultado la activación de varias enzimas necesarias para la toma de otros nutrientes como el P y el K. En general, se asume que el B contribuye al mantenimiento de la estabilidad de la membrana formando complejos con sus constituyentes. También se ha observado que varias enzimas que normalmente se encuentran ligadas a la membrana o a la pared celular en forma inactiva, se activan cuando se liberan a la solución celular bajo condiciones de deficiencia de B. La liberación de estas enzimas (ribonucleasa, 62 glucosa-6-P-dehidrogenasa, fenilalanina amonio liasa, -glucosidasa y polifenol-oxidasa) altera drásticamente el metabolismo vegetal al disminuir el contenido de ARN (y por tanto, el contenido de proteínas) y aumentar la síntesis de fenoles. Muchos de estos compuestos fenólicos son potentes inhibidores del crecimiento, afectan la toma de los otros nutrientes y reducen el funcionamiento de la membrana. Esta respuesta a la deficiencia de B es común en las dicotiledóneas, pero no se ha observado en las monocotiledóneas de la familia de las gramíneas. Papel del B en la reproducción, en el crecimiento del tubo polínico y en la germinación del polen En muchas especies se ha observado que el requerimiento de B es mucho mayor para el crecimiento reproductivo que para el vegetativo. Esto es especialmente cierto para las gramíneas, las cuales tienen un bajo contenido de B en las paredes celulares y bajos requerimientos del elemento para mantener el crecimiento vegetativo, pero necesitan tanto B como las otras especies para la reproducción (germinación del polen, floración y fructificación). Los granos de polen de la mayoría de las especies tienen bajas concentraciones de B, mientras que en los estilos, estigmas y ovarios, las concentraciones de B generalmente son altas. Para el crecimiento del tubo polínico se requiere que el B se suministre continuamente en concentraciones altas. El B es más crítico para el alargamiento del tubo polínico que para su germinación. El crecimiento del tubo polínico está relacionado con la formación de complejos de B con los polímeros de la pared celular, mientras que los efectos sobre la termoestabilidad de los lípidos muestran que el B es muy importante para la estructura y función de la membrana. Otras funciones del B en las plantas Se ha encontrado que el papel del B en los procesos de fijación simbiótica de N2 es fundamental. Su papel es determinante para el reconocimiento de los sitios de infección por el Bradyrhizobium a nivel de la pared y membrana celular de la planta hospedante y para la formación de la barrera que protege a la nitrogenasa contra los efectos del O2. 63 Tanto la deficiencia como el exceso de B, afectan el metabolismo de las auxinas. Síntomas de deficiencia de B en las plantas superiores La deficiencia de B está mundialmente más extendida que la de cualquiera de de los otros micronutrientes. Ocurre muy fácilmente en suelos de textura liviana, donde el B soluble en agua se lixivia hacia los horizontes más profundos y se vuelve inaccesible para las plantas. Una nutrición adecuada de B es crítica, no solamente para obtener altos rendimientos sino para lograr una buena calidad de las cosechas. La deficiencia de B causa muchos cambios anatómicos, fisiológicos y bioquímicos. Las etapas tempranas de la deficiencia de B no son fácilmente identificables, a no ser mediante el análisis de tejidos. Enseguida, se consignan los valores medios de contenido de B normal en varios tipos de plantas en ppm de materia seca (tabla 13). Tabla 13. Contenido de Boro en diferentes especies de plantas contrastantes en cuanto al contenido de Boro. Monocotiledóneas Dicotiledóneas Productoras de látex 3,5 50 90 Los síntomas de deficiencia de B varían de una especie a otra. La deficiencia de B conduce a la degeneración de los tejidos meristemáticos, las paredes de las células parenquimatosas se rompen y los haces vasculares se debilitan, mientras que el xilema y el floema se desarrollan imperfectamente. Las células de paredes delgadas sufren hipertrofia y la clorosis precede a la desintegración celular y, en algunos casos, la desintegración celular es antecedida por una división celular anormalmente activa. Estos síntomas internos se acompañan con los siguientes síntomas externos: 64 1. El crecimiento terminal toma forma de roseta y ocurre muerte descendente. Las ramas laterales detienen su crecimiento y alargamiento, y las yemas laterales no se desarrollan, lo que les ocasiona la muerte prematura (figura 64). 2. Las hojas se engruesan, se tornan quebradizas, se enroscan, se arrugan y desarrollan manchas cloróticas (figura 64). 3. Los pecíolos y tallos se engruesan, forman súber, se rajan y desarrollan áreas húmedas que se necrosan fácilmente. 4. Los frutos carnosos desarrollan manchas pardas, necrosis, hendiduras o grietas, pudrición seca, regiones anormalmente húmedas y decoloraciones de las nervaduras. 65 Figura 64. Síntomas de deficiencia de boro en hojas y ramas de cafeto. Molibdeno (Mo) Número atómico: 42 Masa atómica: 95.94 Forma de absorción por las plantas: Ión molibdato (MoO4-2) El contenido de Mo en las plantas normalmente es bajo [<1,0 mg Mo (kg materia seca)-1], lo cual se debe a que generalmente los contenidos en el suelo son muy bajos. Sin embargo, en comparación con los otros micronutrientes, la planta puede absorber cantidades mayores sin que se produzca toxicidad. El rango de suficiencia de Mo en las plantas está entre 0,15 y 0,30 mg Mo [(kg materia seca)-1]. De todos los nutrientes minerales, el Mo es el elemento que se requiere en menor cantidad en las plantas. 66 La absorción del elemento es activa y se transporta a través de los vasos del xilema en forma de de complejos MoO4-2, con los aminoácidos azufrados cisteína y metionina, o en forma de complejos con azúcares. Su movilidad es mediana. Es esencial para la fijación de nitrógeno debido a que es componente de dos enzimas que tienen que ver con el metabolismo del N: Nitrogenasa y nitrato reductasa. La nitrogenasa es un complejo de dos enzimas que participa en la reducción del N2 atmosférico. La mayor de ellas contiene nueve átomos de Fe por cada átomo de Mo. También está relacionado con el metabolismo de los nitratos, razón por la cual se requiere abundantemente en las leguminosas. Su deficiencia produce clorosis moteada en las plantas jóvenes, pecíolos muy alargados y las márgenes de las hojas tienden a curvarse hacia abajo. Cloro (Cl) Número atómico: 17 Masa atómica: 35.45 Forma de absorción por las plantas: Ión cloruro (Cl-) Funciones bioquímicas del cloro Fotosíntesis Se requiere para el rompimiento de la molécula de agua durante el proceso fotosintético en el fotosistema II, donde actúa como cofactor de una enzima que contiene Mn, asociada al proceso conocido como reloj oxidante del agua. El cloro cumple con variadas funciones bioquímicas, como por ejemplo la activación enzimática de ATPasas en las membranas vacuolares, de la -amilasas y de la asparagina sintetasa. Además actúa en el proceso de osmoregulación, gracias a la rapidez de su transporte y su baja reactividad bioquímica. Actúa como contra-ión para el transporte catiónico debido a la inocuidad de sus altas concentraciones en el interior de la planta y como elemento de ajuste osmótico para promover la entrada de agua a la célula. Juega un papel fundamental en el movimiento estomático, pues asociado con el K+ y el malato 67 tornan negativo el potencial hídrico de las células guardas: de este modo se promueve la entrada de agua proveniente de las células acompañantes para la apertura de los estomas. Cuando las plantas se encuentran a libre exposición solar, un síntoma típico de la deficiencia de Cl, es el marchitamiento de los bordes foliares. El marchitamiento de las hojas se puede relacionar con una reducción en la absorción de agua o con una regulación transpiratoria inadecuada, a nivel de los estomas. También se inhibe severamente el crecimiento longitudinal de la raíz, mientras que se induce la proliferación de raíces laterales. En deficiencias severas, se reduce la tasa de multiplicación celular en la lámina foliar y se desarrolla una clorosis parcial. Las plantas absorben el Cl- contenido en la solución del suelo mediante dos mecanismos: 1. Uno que ocurre cuando la tasa máxima de absorción se alcanza a concentraciones entre 0.1 y 0.2 mM. 2. Otro que opera únicamente cuando las concentraciones superan los 0.5 mM. La absorción del cloro se controla metabólicamente y es sensible a las temperaturas extremas y a los inhibidores metabólicos. Existe competencia por el sitio de absorción entre el Cl- y el NO3-, mientras que existe un efecto sinérgico en la absorción de fósforo con niveles de suficiencia de Cl- en la solución del suelo. Por otro lado, en suelos ácidos la aplicación de fertilizantes que incluyan cloro produce efectos de toxicidad por Mn. Niquel (Ni) Número atómico: 28 Masa atómica: 58.71 Forma de absorción por las plantas: Ión Ni2+ El carácter esencial del Ni para las plantas se reconoce desde hace poco, mientras que su toxicidad en altas concentraciones se conocía ampliamente desde hace varios años. Su 68 contenido en las plantas alcanza un promedio de 1.5 mg Ni2+ (kg materia seca)-1. La concentración crítica en las plantas es de 100 g Ni2+ (kg materia seca)-1. El contenido del Ni en el suelo guarda una alta correlación con el de la planta, y se absorbe y moviliza fácilmente dentro del vegetal. El Ni es activador metálico de la ureasa, la enzima que rompe la molécula de úrea y libera el N en forma utilizable por las plantas. Es indispensable para la absorción del Fe. En niveles inferiores a los 100 g Ni2+ (kg materia seca)-1, se reduce significativamente la germinación de las semillas. Su deficiencia impide la producción de semillas viables. Cuando las plantas crecen en condiciones de deficiencia se retarda el cambio del crecimiento vegetativo al reproductivo. Clave para la identificación de los síntomas de deficiencias minerales en las plantas superiores Elemento en deficiencia Síntomas en las hojas más viejas Síntomas generalizados: Plantas cloróticas: Se distribuyen en toda la planta. Las hojas basales aparecen más o menos secas y de color rojizo Las hojas basales mueren y se tornan desde amarillas a pardo claras. Los pecíolos son cortos y delgados. Sistema radical alargado pero con poco desarrollo de las raíces secundarias Nitrógeno Plantas verdes: En las ramas bajeras se presentan coloraciones desde verde oscuro, azulado, rojizo o púrpura. Las hojas bajeras toman color amarillo y de verde parduzco a negro cuando se secan. Los pecíolos son cortos y delgados. El área y espesor foliares se reducen principalmente en las gramíneas. Las raíces se alargan y toman una coloración pardo rojiza Fósforo 69 Síntomas localizados: Clorosis intervenal: Manchas cloróticas con o sin zonas necróticas en las hojas bajeras, que no se secan o se secan muy poco. Clorosis intervenal en las hojas más viejas, en parte rojizas o púrpura. Las nervaduras se mantienen verdes. Puede aparecer necrosis dentro de las manchas cloróticas. Las hojas toman una coloración verde pálido frecuentemente con bordes muy verdes. Los ápices y bordes foliares se curvan en las puntas o la lámina foliar se enrolla completamente. Magnesio Manchas cloróticas necrosadas en los ápices y bordes foliares: Las manchas generalmente pequeñas aparecen en los bordes y ápices foliares y entre las nervaduras externas. En algunas plantas la necrosis aparece también en la base de las hojas. Las hojas se secan y toman una coloración amarillo parduzco. Con frecuencia hay muerte masiva de las plantas del cultivo. Las raíces se alargan y toman una coloración amarillenta, se vuelven mucilaginosas y desarrollan pocas raíces secundarias. Potasio En las regiones intervenales: En general, las manchas muertas se limitan a las regiones intervenales pero también alcanzan las nervaduras. Las manchas, claras y hasta blancuzcas, crecen rápidamente. Las hojas se engruesan y permanecen pequeñas. Estos síntomas aparecen inicialmente en las hojas más viejas pero se extienden rápidamente por toda la planta. Los entrenudos nuevos son muy cortos y ocasionan desarrollo foliar en roseta en los cogollos. Zinc 70 Clorosis y manchas necróticas. Las hojas más viejas se vuelven cloróticas por igual, de coloración verde muy pálido hasta blanca. Las nervaduras se destacan por su coloración verde pálida. Se desarrollan manchas necróticas en toda la lámina foliar. Las hojas comienzan a marchitarse y secarse por los bordes. Las manchas necróticas de las regiones intervenales se perforan. La hoja se enrolla, se encrespa y se seca totalmente. La yema terminal muere y las hojas terminales nuevas se retuercen Molibdeno Síntomas en las hojas más nuevas y en las extremidades de las ramas Muerte de la yema terminal Se produce la muerte de la yema terminal después de que muchas hojas nuevas se retuercen Las hojas jóvenes de los brotes terminales toman forma de gancho. Las hojas desarrollan clorosis desde los ápices y bordes, desde verde pálido a blancuzco. La yema terminal desarrolla color violeta y, frecuentemente muere a partir de la punta. Las raíces son cortas, erizadas y mucilaginosas, de coloración pardo oscura hasta negro. Calcio Las bases de las hojas del brote terminal toman coloración verde clara y mueren. En los estados más avanzados de crecimiento, las hojas se retuercen y atrofian. Los brotes de las yemas terminales y los puntos vegetativos desarrollan pudrición seca con coloraciones pardo negruzcas. Se produce muerte descendente de la parte aérea. La raíz crece abundantemente y en forma erizada, con coloración parda. Boro La yema terminal no muere. Las hojas jóvenes o las de las yemas desarrollan clorosis y se marchitan. Las nervaduras permanecen claras o verde oscuras Las hojas jóvenes se marchitan. No desarrollan clorosis pero aparecen manchas y decoloraciones blancas. En las dicotiledóneas, entre las zonas claras intervenales aparecen manchas necróticas amarillentas, amarillo parduzcas y blanco amarillentas. El desarrollo radical se reduce y aparecen raíces secundarias largas, delgadas y blancas. Cobre 71 Las hojas no se marchitan. Las hojas jóvenes pueden o no presentar manchas necróticas. Con manchas necróticas: Desarrollan manchas necróticas de coloración parduzca, con bordes oscuros, dispersas por toda la lámina foliar y a medida que aumenta la deficiencia se unen entre sí. Las nervaduras más finas permanecen verdes, formando una especie de retícula. El desarrollo radical se reduce y la raíz toma una coloración parduzca. Manganeso Sin manchas necróticas. Nervaduras cloróticas Las hojas tiernas desarrollan un color verde pálido con las nervaduras aún más claras. Los cogollos son cortos y frágiles. Las raíces son abundantes, blancas y muy ramificadas Azufre Sin manchas necróticas. Nervaduras verdes: En las hojas jóvenes las regiones intervenales son fuertemente cloróticas, de color amarillo limón. Las nervaduras permanecen típicamente verdes. Las nervaduras pequeñas forman un reticulado muy conspicuo. Cuando la deficiencia es aguda aparecen eventualmente manchas pardas en los bordes foliares. Los pecíolos son cortos y delgados. Las raíces son cortas y de coloración pardo, con muchas ramificaciones secundarias de longitud corta. Hierro Efectos de los nutrientes minerales sobre el comportamiento de algunos cultivos tropicales 72 En suelos típicos del Valle del Cauca (Colombia) (mollisoles, vertisoles e inceptisoles), se ha encontrado que en la etapa de desarrollo vegetativo de soya, algodón, maíz, sorgo y caña de azúcar, el mayor contenido de materia seca ocurre cuando se observa el mejor balance entre los nutrientes (N, P, K, Ca, Mg, S, B, Mn, Zn, Cu y Fe), conjuntamente con las mejores características físicas y microbiológicas. Este resultado indica que no siempre las mayores concentraciones de un elemento individual garantiza un mejor comportamiento del cultivo, y que es necesario tener en cuenta el balance con los otros nutrientes, lo cual es una evidencia de las acciones de la Ley del Mínimo y de los Rendimientos Decrecientes. En lulo Solanum quitoense, bajo cultivo hidropónico en arena cuarcítica, y utilizando soluciones nutritivas, se encontraron los niveles críticos foliares (contenido del elemento por debajo del cual se afecta la acumulación normal de materia seca) de 11 elementos, 120 días después de la siembra (tabla 14). Tabla 14.Contenido de nutrientes en el tejido foliar de una planta normal de lulo Elemento Contenido N 3.6 % P 0.16% K 6% Ca 2.6% Mg 0.82% Na 300 ppm Fe 220 ppm Mn 40 ppm Cu 6.1 ppm B 67 ppm Zn 22.5 ppm 73 Estos resultados son consistentes con los encontrados en otras solanáceas como el tabaco (tabla 15), y pueden servir como parámetros de comparación en el caso del análisis foliar de lulo y de otras solanáceas. Para llevar a cabo un diagnóstico acertado sobre el estado nutricional de la planta, los resultados del análisis foliar deben complementarse con los de análisis de suelos. Sin embargo, es necesario recordar que no existe una relación lineal directa entre la concentración de los nutrientes minerales en la solución del suelo y el contenido de ellos en la materia seca, debido a que la mayor parte de los iones minerales ingresan a la planta mediante transporte activo: Con excepción del Ca y el Mg (que ingresan a la planta por flujo en masa) la concentración de los nutrientes minerales es mayor en la solución celular que en la solución del suelo. Los datos de la tabla son estimadores de la cantidad de los elementos extraída del suelo por unidad de materia seca de la planta de lulo, y pueden ser utilizados para calcular la diferencia entre exportación total desde el suelo al final de una cosecha óptima, y el contenido de cada nutriente en el suelo y establecer las necesidades de fertilización. 74 Tabla 15. Rangos de contenido de los nutrientes minerales en la materia seca de varias solanáceas Elemento Unidades Papa Tabaco Tomate Lulo N % 5.0-6.5 2.2-3.5 4.0-5.5 2.45-2.64 P % 0.35-0.6 0.25-0.45 0.4-0.65 0.13-0.42 K % 5.0-6.6 2.5-4.5 3.0-6.0 3.2-4.37 Ca % 0.6-2.0 1.3-3.4 3.0-4.0 1.52-3.0 Mg % 0.25-0.8 0.4-0.8 0.35-0.8 0.39-0.53 Na ppm 206.0-305.0 Fe ppm 280.0-648.0 Cu ppm 7.0-15.0 8.0-15.0 6.0-12.0 10.0-43.0 Mn ppm 40.0-100.0 50.0-100.0 40.0-100.0 29.0-42.0 B ppm 6.0-18.0 30.0-80.0 40.0-80.0 12.0-24.0 Zn ppm 20.0-80.0 25.0-70.0 30.0-80.0 16.0-48.0 En plántulas de café, se ha encontrado que la mejor acumulación de materia seca en la hoja está asociada con un contenido de nutrientes discriminado así: Tabla 16. Contenido de nutrientes en el tejido foliar de plántulas normales de café N P K % Ca Mg Mn Zn Cu Fe ppm B Al 75 3.42 0.06 2.11 1.5 1.25 163.2 36.0 14.8 138.4 11.8 288 En los suelos originados a partir de cenizas volcánicas, con bajos pH y bajos contenidos de Ca y Mg, las proporciones de los elementos nutritivos en la materia seca de las plántulas de café pueden variar negativamente con altos aportes de cal dolomítica (tabla 16). Los resultados anteriores pueden ser muy útiles en el manejo de los almácigos de cafeto. El efecto negativo del exceso en la concentración de Ca y Mg provenientes de la cal dolomítica, puede ser explicado por los efectos bioquímicos del Ca, principalmente, sobre los mecanismos de absorción de los otros nutrientes (ATPasas y bombas a Ca2+ en la membrana celular de las células de la raíz). Dado que este efecto también depende de las características del suelo (densidad aparente), es recomendable determinar la dosis óptima de cal dolomítica a aplicar para evitar los efectos negativos e incrementar la acumulación de materia seca en las plántulas. En algodonero Gossypium hirsutum L., la aplicación edáfica de Cu, Zn, B y Mn tiene una mayor influencia sobre el crecimiento del cultivo que su aplicación foliar, y ocurre un efecto antagónico del Zn sobre la absorción foliar del B, el Cu y el Mn. La aplicación foliar de los micronutientes en ausencia de Zn, indujo incrementos del rendimiento de hasta el 40%. La aplicación completa de los micronutrientes al suelo, tuvo efectos similares a los de la aplicación foliar sin Zn. La carencia de B y Mn en el suelo disminuye la formación de cápsulas y consecuentemente el rendimiento. Cuando se varían las concentraciones de las soluciones de los microelementos y el sitio de aplicación, se observan diferencias significativas la altura de planta, el número de hojas, número de ramas fructíferas, número de botones y número de cápsulas. En tomate, se ha demostrado que, la aplicación foliar de nutrientes minerales no reemplaza a la aplicación edáfica. Sin embargo, si la fertilización nitrogenada es edáfica pero los otros nutrientes se aplican foliarmente, se obtienen buenos niveles de producción y concentración de ella en los tres primeros racimos. La altura de planta puede ser modificada por el tipo de fertilización mientras que la altura de carga no. La aplicación excesiva de fertilizantes 76 foliares ocasionan síntomas de toxicidad y disminución en el rendimiento, de acuerdo con la Ley de los Rendimientos Decrecientes. En tomate Unapal Maravilla sembrado bajo cubierta y con fertigación, se ha encontrado que la mejor respuesta se produce a los 47 despues de siembra, fecha que concuerda con la época de aparición del punto de inflexión de la curva de crecimiento y la relación de toma de nutrientes es de K:Ca:Mg (3:2.1:1) y que el P es un elemento crítico para el crecimiento y se debe aportar en una concentración de la solución de 31 ppm P conjuntamente con 210 ppm de N. Este resultado confirma la relación sinérgica entre el N y el P, en las plantas de cultivo. El enraizamiento y producción de miniesquejes y acumulación de materia seca en diversos clones de eucalipto Eucaliptus grandis, varía de acuerdo con el tipo de solución nutritiva suministrada a la planta madre. La mejor solución nutritiva está compuesta por 22.5 mM N, 0.71 mM P, 6.15 mM K, 5.0 mM Ca y 1.87 mM Mg. Los resultados de este trabajo indican que el enraizamiento es función de la interacción genotipo x concentración de los nutrientes en la solución. Cuando se realiza la propagación por estacas se requiere de la aplicación de auxinas en la solución nutritiva, mientras que cuando la propagación es por miniestacas, la aplicación de auxinas no es necesaria. Este resultado es explicable porque la aplicación de auxinas incrementa la tasa de hidratación ded los tejidos de la estaca ya que la auxina induce la formación de canales de acuaporina y por tanto, la absorción de agua desde el medio. En variedades comerciales de yuca bajo estrés por deficiencia hídrica prolongada, se ha encontrado que la producción de materia seca del cultivo, especialmente en la raíz cuando se cosecha a los 12 meses, depende más de la fertilización que del estrés hídrico. El contenido de nutrientes minerales en las diferentes partes de la planta varía notablemente, lo mismo que en las plantas de diferentes edades. Se observa que el contenido total de nutrientes es mayor en las plantas bajo estrés y que las plantas fertilizadas extraen más nutrimentos que las no fertilizadas. Este resultado puede ser explicado porque bajo estrés se activan los mecanismos de absorción de los nutrientes minerales como respuesta a la necesidad de incrementar el potencial osmótico intracelular, disminuyendo el potencial hídrico para evitar la salida de agua si el potencial hídrico extracelular disminuye 77 fuertemente, es decir la mayor absorción de nutrientes actúa como defensa contra los efectos de la sequía. En general, la planta extrae del suelo más nitrógeno que potasio, calcio magnesio y fósforo, en su orden. El contenido de N, K y P es mayor en las hojas que en las otras partes dela planta de yuca, mientras que las de Ca y Mg es mayor en los pecíolos y tallos. El N se acumula principalmente en raíces y hojas, el K y P en raíces y tallos, el Ca en tallos y hojas, y el Mg en tallos y raíces. Estos resultados son muy importantes para la escogencia de las muestras de tejido que deben ser utilizadas para la determinación del estado nutricional del cultivo. El desbalance nutricional producido por los altos contenidos de K, Ca y Mg en varios suelos con bajos contenidos de materia orgánica, P y B, ocasionan bajos rendimiento en el melón Cucumis melo L., y los análisis foliares mostraron que las concentraciones de Ca y Mg son altas mientras que las de N, P y K son bajas. Este resultado se puede explicar porque la absorción del Ca y Mg es pasiva (a lo largo de un gradiente de potencial químico). Las altas concentraciones de estos dos elementos puede afectar la dinámica de absorción de los elementos restantes, debido a su acción sobre los transportadores de cada uno de ellos y sobre las ATPasas implicadas en tal mecanismo. Ejemplo de cálculo de niveles de fertilizantes a aplicar según análisis de suelos. Se usará como cultivo modelo Maíz Zea mays Tabla 17. Análisis de suelo de un cultivo de maíz Maíz Análisis Equivalencia kg ha -1 Exportación kg ha -1 M.O NA P K Ca Mg 4.00 % - 2.00 ppm 0.10 meq/100g suelo 0.20 meq/100g suelo 0.07 meq/100g suelo 80000 64 4 78.2 80.16 17.01 120 50 120 120 40 M.O: Materia orgánica; NA: Nitrógeno asimilable 78 Cálculo de la masa ha-1 asumiendo una profundidad efectiva de 20 cm y una densidad aparente de 1 g cm-3 20 cm = 0.2 m Volumen ha = 0.2 m * 10000 m2 = 2000 m3 1 g cm-3 = 0.001 kg /10-6 m3 Masa/ha = 2000 m3 * 0.001 kg /10-6 m3 = 2000000 kg de suelo Tabla 18. Masa de una hectárea según la densidad aparente Densidad aparente g cm-3 Textura Masa (kg) 0.8 Liviano 1600000 1 Mediano 2000000 1.2 Pesado 2400000 79 Conversión de unidades del análisis a kg ha-1 Materia orgánica (MO) 4% MO = 4 kg MO (100 kg)-1 suelo Cálculo 100 kg Suelo ----------4 kg MO 2000000 kg Suelo----- X kg MO X= (4 * 2000000)/100 = 80000 kg MO ha-1 Nitrógeno Nitrógeno total (NT): Se asume que el nitrógeno total corresponde al 16 % de la MO: NT = 80000 * 0.16 = 12800 kg NT ha-1 Cálculo nitrógeno asimilable (NA) Se asumirá una temperatura promedio de 25 ° C. En estas condiciones el contenido de nitrógeno asimilable equivale al 0.5 % del nitrógeno total: NA= 12800 * 0.005 = 64 kg NA ha-1 Fósforo 2 ppm = 2 mg P/ kg suelo = 2 mg P kg-1 suelo = 0.000002 kg P kg-1 suelo 1 Kg suelo -------------- 0.000002 kg P 2000000 Kg suelo------ X kg P X= (2000000 *0.000002)/1 = 4 kg P ha-1 80 Potasio 0.1 meq (100 g suelo)–1 Un equivalente de potasio corresponde a 39.098 g de potasio puro. 1 meq K = 39.098 g /1000 = 0.039098 g K 0.17 meq K = 0.039098*0.1= 0.0039098/100 g suelo = 0.0000039098 kg K/0.1 kg suelo 0.1 kg suelo--------------0.0000039098 kg K 2000000 kg suelo------- X kg K X= (2000000 * 0.0000039098)/0.1 = 78.2 kg K ha-1 suelo Calcio 0.2 meq (100 g suelo)–1 Un equivalente de calcio corresponde a 20.04 g de calcio puro ya que la masa atómica del calcio es de 40.08 g y su valencia es 2. 1 meq Ca = 40.08 g /1000 = 0.04 g Ca 0.6 meq Ca = 0.02004*0.2= 0.004008/100 g suelo 0.0000040080 Ca/0.1 kg suelo 0.1 kg suelo--------------0.0000040080 kg Ca 2000000 kg suelo------- X kg Ca X= (2000000 * 0.0000040080)/0.1 = 80.16 kg Ca ha-1 Suelo Magnesio 0.07 meq (100 g)–1 Un equivalente de magnesio corresponde a 12.15 g de magnesio puro ya que la masa atómica del magnesio es de 24.305 g y su valencia es 2. 81 1 meq Mg = 12.15 g /1000 = 0.01215 g Mg 0.2 meq Mg = 0.01215 *0.07= 0.0008505/100 g suelo = 0.0000008505 kg Mg/0.1 kg suelo 0.1 kg suelo--------------0.0000008505 kg Mg 2000000 kg suelo------- X kg Mg X= (2000000 * 0.0000008505)/0.1 = 17.01 kg Mg ha-1 Suelo Cálculo de los requerimientos: El requerimiento se calcula como la diferencia entre los valores de exportación y los valores del análisis: Nitrógeno Requerimiento = 120 kg ha-1 – 64 kg ha-1 = 56 kg ha-1 Fósforo Requerimiento = 50 kg ha-1 – 4 kg ha-1 = 46 kg ha-1 Potasio Requerimiento = 120 kg ha-1 – 78.2 kg ha-1 = 41.8 kg ha-1 Calcio Requerimiento = 120 kg ha-1 – 80.16 kg ha-1 = 39.84 kg ha-1 Magnesio Requerimiento = 40 kg ha-1 –17.01 kg ha-1 = 22.99 kg ha-1 Maíz Análisis Equivalencia kg ha -1 M.O NA 4.00 80000 64 P K Ca Mg 2.00 ppm 0.10 meq/100g suelo 0.20 meq/100g suelo 0.07 meq/100g suelo 4 78.2 80.16 17.01 82 Exportación kg ha -1 120 50 120 120 40 Requerimiento kg ha -1 56 46 42 40 23 Cálculo de la cantidad de fertilizante a aplicar según las fuentes disponibles: Para Nitrógeno Usando Urea como fuente: Urea 46% Nitrógeno Requerimiento NA = 64 kg ha-1 Aplicar: 46 kg N--------------100 kg Urea 64 kg N ------- X kg Urea X= (64 kg N * 100 kg Urea)/ 46 kg N = 139 kg Urea ha-1 Usando DAP (Grado 18-46-0) como fuente Nitrógeno Total = 18% Requerimiento NA = 64 kg ha-1 Aplicar: 18 kg N--------------100 kg DAP 83 64 kg N ------- X kg DAP X= (64 kg N * 100 kg DAP)/ 18 kg N = 355 kg DAP ha-1 Nota: Tenga en cuenta que al aplicar DAP usted también está aplicando Fósforo. Para Fósforo Usando súper fosfato triple (Grado 0-46-0) Nota el 46% corresponde a Fósforo en forma de P2O5 Requerimiento P = 50 kg ha-1 62 kg P--------------142 kg P2O5 X kg P ------- 100 kg P2O5 X= (62 kg P * 100 kg P2O5)/ 142 kg P = 44 kg P /100 kg P2O5 = 44% P Es decir que en 100 Kg de SFT hay: 46 *0.44 kg de Fósforo = 20 kg de Fósforo Aplicar: 20g P--------------100 kg SFT 46 kg P ------- X kg SFT X = (46 kg P * 100 kg SFT)/ 20 kg P = 230 kg SFT ha-1 84 Usando DAP (Grado 18-46-0) como fuente Nota el 46% corresponde a Fósforo en forma de P2O5 Requerimiento P = 50 kg ha-1 62 kg P--------------142 kg P2O5 X kg P ------- 100 kg P2O5 X= (62 kg P * 100 kg P2O5)/ 142 kg P2O5 = 44 kg P /100 kg P2O5 = 44% P Es decir que en 100 Kg de DAP hay: 46 *0.44 kg de Fósforo = 20 kg de Fósforo Aplicar: 20g P--------------100 kg DAP 46 kg P ------- X kg DAP X = (46 kg P * 100 kg DAP)/ 20 kg P = 230 kg DAP ha-1 Tenga en cuenta que al aplicar DAP usted también está aplicando Nitrógeno. Calculo para la enmienda de Nitrógeno y Fósforo al mismo tiempo, usando Urea y DAP Corrección de Fósforo 85 Para 50 kg de Fósforo ha-1, debe aplicar 250 kg de DAP. DE esta manera, estaría aplicando también 230*0.18 = 41 kg de Nitrógeno. El requerimiento total de Nitrógeno es de 64 kg ha-1, es decir, quedarían por cubrir 23 kg N ha-1: Aplicar: 46 kg N--------------100 kg Urea 23 kg N ------- X kg Urea X= (23 kg N * 100 kg Urea)/ 46 kg N = 50 kg Urea ha-1 Para enmendar, debe aplicarse 230 kg DAP ha-1 y 50 kg Urea ha-1 (un bulto ha-1) Para Potasio Usando Cloruro de Potasio (KCl) como fuente (Grado 0-0-60) Nota el 60% corresponde a Fósforo en forma de K2O Requerimiento K = 42 kg ha-1 39 kg K--------------94 kg K2O X kg K------- 100 kg K2O X= (39 kg K * 100 kg K2O)/ 94 kg K2O = 42 kg K /100 kg K2O = 42% K Es decir que en 100 Kg de KCl hay: 60 *0.42 kg de Potasio = 25 kg de Potasio 86 Aplicar: 25 kg K--------------100 kg KCl 42 kg K ------- X kg KCl X= (42 kg K * 100 kg KCl)/ 25 kg K = 168 kg KCl ha-1 Para Calcio y Magnesio usando como fuente cal dolomita 70-25 Calcio: Requerimiento Ca = 40 kg ha-1 Aplicar: 70 kg Ca--------------100 kg Cal Dol 40 kg Ca ------- X kg Cal Dol X= (40 kg Ca * 100 kg Cal Dol)/ 70 kg Ca = 57 kg Cal Dolomita ha-1 Al aplicar esta cantidad de cal dolomita, se están aplicando 57*0.25 = 14 kg ha-1 de Magnesio. El requerimiento de Magnesio es de 23 kg ha-1. El faltante de 9 kg ha-1 se puede cubrir utilizando Óxido de Magnesio (Oximag) del 90%. Nota el 90% corresponde a Magnesio en forma de MgO Requerimiento Mg = 9 kg ha-1 24 kg Mg--------------40 kg MgO X kg Mg------- 100 kg MgO X= (24 kg Mg * 100 kg MgO)/ 40 kg MgO = 60 kg Mg /100 kg MgO = 60% Mg 87 Es decir que en 100 Kg de MgO hay: 90 *0.6 kg de Magnesio = 54 kg de Magnesio Aplicar: 54 kg Mg--------------100 kg Oximag 9 kg Mg ------- X kg Oximag X= (9 kg Mg * 100 kg Oximag)/ 54 kg Mg = 17 kg Oximag ha-1 Según los requerimientos de la tabla y el análisis de suelos para el caso presentado en maíz, la fertilización debe realizarse aplicando: 230 kg DAP ha-1 50 kg Urea ha-1 168 kg KCl ha-1 57 kg Cal Dolomita ha-1 17 kg Oximag ha-1 Ejercicio Calcular un plan de fertilización para arroz, teniendo en cuenta los valores de exportación de la tabla siguiente: Absorción kg / Tonelada Absorción g / Tonelada Nutriente N P K Ca Mg S B Cu Fe Mn Zn Grano 14,65 2.5 1.6 2 1.8 0,60 8 25 200 60 20 88 Base del cálculo 3.0 Toneladas de arroz paddy ha-1, 5 Toneladas de arroz paddy ha-1 y 7 Toneladas de arroz paddy ha-1 Análisis de suelos: Nutriente K Ca Mg M.O P S B Cu Fe Mn Zn (meq/100 (meq/100 (meq/100 (%) (ppm) (%) (ppm) (ppm) (ppm) (ppm) (ppm) g suelo) g suelo) g suelo) Contenido 3.5 10 0.15 0.25 0.1 0.2 0.5 5 120 25 6 Densidad aparente: 1.33 g cm-3 La toxicidad de los nutrientes minerales De acuerdo con la Ley de Mitscherlich, o Ley de los Rendimientos Decrecientes, cuando uno de los factores de la producción (como por ejemplo, los nutrientes minerales) se encuentra en una proporción que supera la cantidad a la cual se obtiene el óptimo, ese factor comienza a constituirse en un factor limitante para la obtención de una buena cosecha, tanto en cantidad como en calidad. Lo anterior es particularmente cierto en el caso de los nutrientes minerales de las plantas y de varios metales que se encuentran en el ambiente (suelo, atmósfera, cuerpos de agua, etc.). Varios de estos elementos, ejercen un efecto dañino muy acentuado cuando se encuentran en el suelo y dentro de la planta en cantidades superiores al óptimo. Los niveles tóxicos de los metales en el suelo pueden ser generados por las propiedades naturales de los suelos, por prácticas agrícolas irracionales, manufactureras, de minería o por prácticas inadecuadas de manejo de desechos minerales, entre otras causas. 89 La toxicidad por aluminio es un importante factor limitante para el crecimiento de las plantas en muchos suelos ácidos (pH< 5.0) pero puede ocurrir a niveles de pH del órden de 5.5. Este problema es particularmente serio en sitios donde el subsuelo es fuertemente ácido y muy difícil de corregir mediante encalamiento, y cuya acidez se intensifica debido a la aplicación exagerada de fertilizantes nitrogenados formadores de ácido como el sulfato y el nitrato de amonio (NH4)2SO4 + H2O 2 NH4OH + H2SO4 El ácido sulfúrico (H2SO4) producido se disocia en medio acuoso en: H2SO4 2H+ + SO42- Y se produce liberación de protones (H+) al medio, lo cual reduce drásticamente el pH. Una fuerte acidez del subsuelo, que se relaciona estrechamente con la toxicidad por aluminio (Al), reduce la profundidad de penetración de las raíces, aumenta la susceptibilidad a las limitaciones hídricas y disminuye el uso de los nutrientes del suelo. La toxicidad por Al se agrava cuando se elevan las temperaturas. La toxicidad por manganeso (Mn), es un problema grave en los suelos fuertemente ácidos (pH<5.5) derivados de materiales parentales ricos en Mn total. La toxicidad por Mn, también puede ocurrir a pHs altos, en suelos bajo condiciones reductoras originadas por la inundación, la compactación o la acumulación de materia orgánica. La toxicidad por hierro (Fe) está relacionada con la aparición de desórdenes fisiológicos en el arroz de riego, y en otros cultivos como caña y macadamia, no sometidos a condiciones de inundación. En sitios donde se arrojan desechos que contienen excesos de zinc (Zn), cobre (Cu), níquel (Ni) y cadmio (Cd), u otros elementos minerales, se puede producir una disminución del crecimiento de las plantas, particularmente en suelos ácidos. En suelos derivados de serpentina, es frecuente la ocurrencia de toxicidades de magnesio (Mg) y Ni. 90 Las toxicidades por metales también pueden aparecer en suelos anteriormente productivos que han sido tratados repetidamente con pesticidas y fertilizantes que los contienen. Por ejemplo, la clorosis inducida por una deficiencia de Fe puede ser atribuida parcialmente a la acumulación de un exceso de Cu resultante de la aplicación de aspersiones foliares y de fertilizantes que lo contienen. Algunos excesos de Zn se deben a la aplicación de oxisulfato de Zn para el control de enfermedades bacterianas en frutales. Cualquier suelo productivo puede ser afectado por un desbalance de los nutrientes minerales esenciales. Por ejemplo, una excesiva fertilización con amonio (NH4+) o K+ pueden inducir las deficiencias de Ca y/o Mg en las plantas. Los excesos de Cu, Ni, Zn y P, pueden inducir la clorosis por deficiencia de Fe. Contrariamente, los excesos de Fe pueden intensificar la deficiencia de Zn. Tales desbalances nutricionales de las plantas suelen presentarse en suelos que han sido fertilizados indiscriminadamente, en suelos tratados con aguas residuales con altos contenidos metálicos y también en campos que reciben grandes descargas de detritus animales o cercanas a plantas agroindustriales. Las evidencias experimentales indican que la toxicidad de un nivel dado de Mn soluble en el medio nutritivo o solución del suelo depende de las interacciones entre este elemento y muchos otros elementos minerales, particularmente con el Fe, el Si y el P. Idealmente, cada metal que cause fototoxicidad debiera inducir algún síntoma característico que pudiera permitir su diagnosis; más aún, el síntoma debiera aparecer antes de que se cause un daño ecológico o económico sustancial. Sin embargo, este no es el caso. Los síntomas más generalizados de toxicidad son el raquitismo y la clorosis. La clorosis ocasionada por el exceso de Zn, Cu, Ni y Cd, parece deberse a las interacciones directas con el Fe foliar. Interacciones entre los nutrientes esenciales La nutrición adecuada de las plantas depende de la capacidad del suelo para suministrar los nutrientes minerales, de la tasa de absorción, distribución a los sitios funcionales y de su movilidad en el interior de la planta. 91 La interacción puede definirse como la influencia o la acción mutua o recíproca de un elemento sobre otro y su efecto sobre el crecimiento de la planta. Una segunda definición que es igualmente aplicable está relacionada con la respuesta diferencial de un elemento, en combinación con niveles variables de un segundo elemento aplicado simultáneamente. Las manifestaciones biológicas de las interacciones nutricionales puden reflejarse en efectos positivos o detrimentales sobre el rendimiento del cultivo. Los efectos positivos se deben a las asociaciones sinergísticas entre elementos nutritivos, los efectos detrimentales se deben por ejemplo a los casos de toxicidades que interfieren con la función metabólica normal de otro nutrimento. Existen interacciones observadas en las plantas como la del P y el Zn, la cual se reconoce como la inducción de la deficiencia de Zn por el P, la cual puede ocurrir a nivel del suelo o en el interior de la planta debido a la disminución de la tasa de traslocación desde la raíz hasta los ápices caulinares. A nivel celular puede manifestarse cuando la excesiva concentración de P, interfiere con la función metabólica del Zn. Se ha encontrado que la aplicación excesiva de Nitrógeno trae como consecuencia la deficiencia de Zn. El fósforo ha sido relacionado con la deficiencia de hierro, aunque los mecanismos implicados no han sido completamente aclarados. Este efecto es notorio cuando se combina la acción del P y el Ca debido a excesos de aplicación en el suelo. El efecto del P se puede observar en el interior de la planta, pues afecta la movilidad del Fe. La deficiencia de Cu puede ser inducida mediante las aplicaciones elevadas de P o mediante el uso prolongado de fertilizantes fosfóricos. El P acelera la absorción y tranlocación del Mo. Se ha sugerido que el P juega un papel muy importante en la liberación del Mo desde las células radicales hasta el sistema de translocación y en la formación de un complejo fosfomolibdato que puede ser absorbido fácilmente por las plantas. 92 La absorción del molibdeno se reduce a causa del exceso en S. Aparentemente, existe una competencia directa entre el S y el Mo por el sitio activo de los transportadores específicos en las membranas celulares, debido a su similaridad química. Se ha encontrado que el encalamiento de los suelos con cal dolomítica, reduce la accesibilidad del Zn a las plantas, debido a la competencia de los dos iones por el sitio activo de los transportadores específicos. El Ca y el K pueden acentuar la deficiencia de B, mientras que la toxicidad producida por niveles elevados de B puede ser corregida por la aplicación de Ca. El funcionamiento metabólico del Fe en las plantas, está relacionado de alguna manera con el suministro de Zn, pero cuando los niveles de Fe en la planta no son muy altos, el suministro de Zn no tiene un efecto notable sobre el contenido de Fe. En suelos ácidos, se han encontrado plantas cloróticas que contienen grandes cantidades de Mn accesible. La clorosis se reduce con aspersiones de Fe debido a que el Mn interfiere con el transporte del Fe desde las raíces hasta la parte aérea. El Mo afecta la accesibilidad del Fe, de tal manera que cuando se tienen grandes concentraciones de Mo, se puede producir clorosis por deficiencia de Fe, mientras que las altas concentraciones de Cu y Zn, pueden inducir clorosis por deficiencia de Fe en algunos cultivos. Bases genéticas para la nutrición mineral La nutrición mineral de las plantas se encuentra bajo control genético, lo cual se evidencia en las plantas de cultivo mediante numerosos ejemplos de diferencias nutricionales entre cultivares o razas. Una evidencia más específica procede de los estudios de herencia que tienen que ver con cultivares o razas que difieren en requerimientos nutricionales. En algunos casos, los principales aspectos nutricionales están bajo el control de un par individual de genes, pero en la mayoría de los casos la adquisición y utilización de los nutrientes minerales o el control de la tolerancia a las sales, tiene que ver con sistemas genéticos más complejos. En la tolerancia al aluminio en varios cultivos, los mecanismos todavía no estás claros, pero algunos sostienen que está gobernada por un carácter 93 dominante controlado por varios genes mientras que otros afirman que está controlada por un gene individual con dominancia incompleta. Las deficiencias genotípicas en eficiencia de cobre y hierro en cereales, aclaran el control genético de la nutrición mineral. El trigo y la avena son, en general, muy sensibles a los bajos suministros de cobre, mientras que el centeno Secale cereale es relativamente insensible. Por otro lado, hay diferencias importantes en la eficiencia del cobre en genotipos de trigo [cv Garbo (ineficiente) vs Chinese Spring (eficiente)] en presencia de suministros subóptimos del elemento. El centeno transmite su eficiencia por el cobre al tritical (híbrido interespecífico Triticum sp x Secale cereale), lo que indica que los mecanismos específicos para la toma del cobre en el centeno son controlados genéticamente y son transferibles al tritical. Los genes que controlan la eficiencia del cobre son transportados en el brazo largo del cromosoma 5 R del centeno. El trigo Chinese Spring porta el cromosoma 5 R del centeno y tiene como consecuencia una alta eficiencia por el cobre. Bajo condiciones de campo en suelos con deficiencia en cobre, la presencia de este cromosoma en los genotipos de trigo, aumenta el rendimiento en grano en más del 100% en relación con los genotipos ineficientes. La absorción del cobre por las líneas 5 R bajo condiciones de deficiencia del elemento, está entre 50 y 100% mayor que la de sus parentales recurrentes. El cromosoma 5 R del centeno también es portador de genes que codifican para enzimas que operan en la estrategia II de las plantas en la adquisición del hierro. Estas enzimas regulan la síntesis del fitosideróforo ácido mugenéico a partir del ácido deoximugenéico y del ácido deoximugenéico a partir del ácido mugenéico. En la cebada, el cromosoma 4 porta el gene que codifica para la enzima que participa en la síntesis del ácido mugenéico a partir del ácido deoximugenéico, y la introducción de este cromosoma en trigo conduce a la síntesis de ácido mugenéico en este cereal. La identificación de genes que codifican para ciertas reacciones bioquímicas en un genotipo dado, y la transferencia de estos genes a otros genotipos, abre la posibilidad de nuevos enfoques para una mejor adaptación de las plantas de cultivo a condiciones químicas adversas del suelo, y en particular a una baja accesibilidad de los nutrientes. 94 Eficiencia de los nutrientes La adaptación de las plantas a los suelos ácidos requiere una absorción o utilización altamente eficientes, especialmente de fósforo, calcio y magnesio. Muchas de las especies consideradas como adaptadas a los suelos minerales ácidos usualmente están infectadas fuertemente por micorrizas. La tolerancia al aluminio y la alta eficiencia por el fósforo coexisten en los cultivos tropicales de raíz tales como yuca y en ciertos cultivares de trigo y arroz de secano. En contraste con la eficiencia en el fósforo, la alta eficiencia del calcio se relaciona usualmente con su mejor utilización dentro de la planta y en este aspecto, las diferencias genotípicas pueden ser muy distintas. En varios cultivares de algunas especies como el caupí se ha observado una correlación positiva entre la tolerancia al aluminio y la eficiencia en el calcio. La selección para la tolerancia al aluminio debe, en consecuencia, tener en cuenta que estos genotipos están adaptados también a un bajo suministro de calcio. En los suelos minerales ácidos la accesibilidad del molibdeno es muy baja. La eficiencia en el molibdeno puede tener que ver con la adaptación a suelos minerales ácidos. Las diferencias genotípicas en la eficiencia de los nutrientes se relacionan con las diferencias en su adquisición por las raíces, o con su utilización por la planta, o con ambas. La eficiencia en la adquisición se define con frecuencia en términos de la toma total por planta o tasa específica de toma por unidad de longitud de la raíz, y como eficiencia en la utilización (Eficiencia en el Uso de los Nutrientes, EUN) en términos de producción de materia seca por unidad del nutriente en la materia seca [g MS (g nutriente en la MS)-1]. Sin embargo, desde un punto de vista agronómico y en un sentido operacional, las diferencias genotípicas en la eficiencia de los nutrientes en las plantas de cultivo, se definen usualmente mediante las diferencias en crecimiento relativo o en el rendimiento cuando crecen en un suelo deficiente. Para un genotipo dado, la eficiencia del nutriente se refleja en su habilidad para producir un alto rendimiento en un suelo limitante en uno o más nutrientes minerales para un genotipo estándar. Esta definición se puede aplicar a las comparaciones de genotipos diferentes (cultivares o líneas) dentro de especies o entre especies vegetales. 95 Entre los múltiples ejemplos de eficiencia de nutrientes se puede citar el caso de la eficiencia del fósforo en tres tipos de trébol Trifolium cherleri, T. subterraneumy Lolium rigidum, donde los niveles mínimos de fósforo aplicado para producir el 90 % del rendimiento máximo fueron 302, 87 y 26 mg P (kg suelo)-1, respectivamente. Se encontró alta correlación entre la eficiencia en el uso del fósforo fertilizante y el peso seco de la raíz. En mezclas de pasturas que crecen en suelos deficientes en fósforo, se espera que haya un desplazamiento en la composición botánica que favorezca el crecimiento de los pastos como ocurre también en la mezcla de leguminosas y pastos que crecen en suelos deficientes en potasio. Las diferencias genotípicas en eficiencia en los nutrientes suceden por diversas razones, relacionadas con la toma, transporte y utilización dentro de las plantas. Hay diferencias típicas en los requerimientos de nitrógeno a nivel celular como en el caso de las plantas C3 y C4 o en los requerimientos de calcio y boro entre monocotiledóneas y dicotiledóneas. Dentro de una especie dada, la eficiencia nutricional para el calcio, por ejemplo, puede diferir entre genotipos, dependiendo de la etapa de ligamiento del elemento, de la tasa de transporte hacia el meristemo apical o de diferencias en los requerimientos funcionales dentro del tejido. Las más altas eficiencias en el uso del fósforo en ciertos genotipos pueden estar relacionadas con un mejor uso del Pi almacenado ya sea dentro de un tejido dado o sea por una mejor retranslocación entre los órganos del brote. Este último factor también es responsable principalmente de la mayor eficiencia en el uso del nitrógeno en ciertos cultivares de sorgo o del molibdeno en algunos cultivares de fríjol. En el caso de la eficiencia en el uso del potasio, las diferencias genotípicas en la acumulación de sodio y por tanto, el reemplazo potencial del potasio, juega un papel principal. Los altos contenidos de fósforo en las semillas, sea por unidad de peso seco o por semilla (en semillas grandes) pueden producir una mayor superficie radical en las etapas tempranas de crecimiento incrementos en la adquisición del fósforo a partir del suelo o de los fertilizantes aún en presencia de altos contenidos de fósforo en el suelo. 96 Hay varios ejemplos de diferencias genotípicas entre cultivares o mutantes en el transporte a corta distancia de los nutrientes minerales dentro de las raíces, o de larga distancia desde las raíces hasta los brotes. El cultivar de soya PI es un genotipo en el cual la baja tasa de transporte del hierro desde las raíces hasta los brotes es responsable de la baja eficiencia en el uso del elemento. La disparidad en el transporte del hierro desde la raíz puede ser debida a la precipitación originada en la quelatación que ocurre en el rizoplan y en el apoplasma de las células rizodérmicas. Las diferencias genotípicas observadas en la eficiencia del magnesio en el sorgo parecen estar relacionadas con diferencias en la tasa de toma del potasio, pues parece que hay una tendencia en los genotipos eficientes para el magnesio a tener relaciones K/Mg en los brotes más bajas. Como regla general en la eficiencia nutricional, la adquisición de nutrientes por la raíz juega el papel más importante. Dentro de una especie, los genotipos pueden diferir ampliamente tanto en la afinidad del sistema de transportadores (Km) como en la concentración umbral, como sucede con el fósforo en líneas endocriadas de maíz. Las diferencias en tasa de absorción del fósforo por unidad de longitud radical entre especies vegetales pueden ser causadas sea por tasas mayores de flujo hacia el interior, pelos radicales más largos o diferentes relaciones longitud de la raíz / peso del brote. La capacidad para distribuir una mayor proporción de fotosintetizados hacia la raíz, obviamente está bajo control genético y es un aspecto importante de la eficiencia del fósforo en plantas que crecen en suelos deficientes en este elemento. La eficiencia en la adquisición y utilización interna también depende del nivel de suministro del nutriente y de la edad de la planta. Tolerancia al exceso en el aporte de elementos minerales En muchos casos, la adaptación a condiciones químicas del suelo adversas requiere de la tolerancia a niveles excesivos de elementos minerales como el aluminio y el manganeso en suelos minerales ácidos, manganeso y hierro en suelos encharcados y sodio en suelos salinos. De esta forma la tolerancia al estrés múltiple con frecuencia se hace necesaria para la adaptación. 97 La toxicidad por boro es otro factor limitante del crecimiento en ciertas áreas secas. En el trigo y la cebada el mecanismo de tolerancia al boro se basa en una toma y transporte reducidos del boro, controladas por varios genes aditivos principales, uno de los cuales se localiza en el cromosoma 4 A en el trigo. Sin embargo, los genotipos tolerantes al boro corren el riesgo de mostrar síntomas de deficiencia cuando crecen en suelos con bajos contenidos del elemento. Suelos minerales ácidos: Principales obstáculos La acidez del suelo limita el crecimiento vegetal en muchas partes del mundo. La inhibición del crecimiento de la planta es el resultado de una variedad de factores químicos específicos y de las interacciones entre estos factores. En los suelos minerales ácidos los principales obstáculos al crecimiento vegetal son los siguientes: 1) Incremento en la concentración de H+: Toxicidad por H+ 2) Incremento en la concentración de aluminio: Toxicidad por aluminio 3) Incremento en la concentración de manganeso: Toxicidad por manganeso 4) Disminución en la concentración de macronutrientes de tipo catiónico: Deficencia en calcio, magnesio y potasio 5) Disminución de la solubilidad del fósforo y el molibdeno : Deficiencia de fósforo y molibdeno 6) Inhibición del crecimiento de la raiz y de la toma de agua : Deficiencia de nutrientes, estrés por sequía e incremento en el lavado de los nutrientes del suelo La importancia relativa de estos obstáculos depende de la especie y genotipo vegetal, del tipo y horizonte del suelo, del material parental, del valor del pH del suelo, de la concentración y especie de aluminio, de la estructura y aireación del suelo y del clima. Los niveles de nitrógeno en los suelos minerales ácidos en general son bajos a menos que haya un ingreso originado por la polución a partir de la atmósfera. La toxicidad del aluminio y 98 las deficiencias de calcio y magnesio se presentan en más del 70% de los suelos de América Tropical y casi la totalidad de estos suelos son deficientes en fósforo o tienen elevada capacidad de fijación de este elemento. Para una especie vegetal dada, la localización y distribución de las raíces dentro del perfil, puede ser un factor importante para la determinación de la forma de expresión de la acidez del suelo. En la parte superior del suelo, donde el contenido de materia orgánica es más alto, puede dominar la toxicidad por H+, pero en el subsuelo, el crecimiento de las raíces puede ser deprimido por la toxicidad de aluminio. Si la deficiencia de magnesio se convierte en un factor dominante en el estrés producido por la acidez del suelo, ella depende principalmente del material parental y del ingreso atmosférico del elemento (distancia al mar abierto). En suelos con elevadas reservas de manganeso y con alto manganeso intercambiable (Mn+2), como por ejemplo en los que se usan continuamente para el cultivo de leguminosas fijadoras de N2, el manganeso puede convertirse en un factor principal del estrés por acidez. En vista de las diferentes maneras como la acidez del suelo puede restringir el crecimiento vegetal, las plantas adaptadas a los suelos minerales ácidos requieren de una variedad de mecanismos para hacer frente a los factores químicos adversos del suelo relacionados con el fenómeno. Existe un acuerdo general en el sentido de que a escala global, como regla general, las altas concentraciones de aluminio y en algunos casos la de manganeso, son factores claves del estrés por acidez del suelo, de tal manera que se requiere alta tolerancia estos dos factores para la adaptación de las plantas de cultivo a suelos con pH<5. El alumino: fitotoxicidad y tolerancia El síntoma inicial y más evidente de la toxicidad del aluminio es la acelerada inhibición del alargamiento radical: este efecto puede detectarse en soluciones nutritivas con alta concentración en aluminio, tan solo unos pocos minutos después de la exposición de las raíces al elemento. La toxicidad severa del aluminio reduce y lesiona el sistema radical, lo cual trae como consecuencia que la planta sea más susceptible al estrés hídrico y a las deficiencias de nutrientes minerales. La exposición al Al ocasiona el bloqueo de la absorción del Ca2+ y el K+, lo cual causa deficiencias minerales a largo término. 99 Se sabe que el componente más importante de la fitotoxicidad por Al, es la inhibición del crecimiento de la raíz hecho sobre el cual se ha enfocado la investigación más reciente. Tal vez el hallazgo más importante es el de que la inhibición del crecimiento de la raíz es ocasionada únicamente por las interacciones que se producen entre el Al y el ápice radical. El significado de este hallazgo es el de que los mecanismos de resistencia deben actuar necesariamente en el ápice radical, para proteger esta región de los efectos tóxicos del Al. Se ha demostrado que en algunas especies de cereales la forma rizotóxica del aluminio es el Al3+. Cuando la solución nutritiva o la solución del suelo se acidifican por debajo de pH 5.0, la forma dominante del aluminio es el Al3+ que es fitotóxico. El Al monomérico también forma complejos con varios ligandos como los grupos carboxilato, sulfato y fosfato. Por esta razón, el Al3+ forma complejos con los ácidos orgánicos, el fosfato inorgánico y con el sulfato, lo mismo que a las proteínas y a los nucleótidos. Como consecuencia de lo anterior, se ha propuesto que la rizotoxicidad puede resultar de las interacciones del aluminio con diferentes sitios dentro de la raíz, incluyendo la pared celular, el tonoplasto y el simplasto. Efectos de los niveles excesivos de aluminio A medida que disminuye pH o sea que se incrementa la concentración del H+,la toma de los cationes se inhibe por dos razones: 1) Desacoplamiento de la exportación neta de H+ por la ATPasa ligada a la membrana plasmática 2) Disminución de la descarga de iones polivalentes (Mg2+, Ca2+, Zn2+, Mn2+) en el apoplasma de las células corticales de la raíz La descarga de los cationes polivalentes en el apoplasma incrementa fuertemente la tasa de absorción de estos cationes por el simplasma. El aluminio puede inhibir la absorción del calcio bloqueando los canales de Ca2+ en la membrana plasmática, y la toma del magnesio 100 bloqueando los sitios de unión con las proteínas de transporte. Las altas concentraciones de Mn+2 también inhiben la toma del calcio y particularmente del magnesio. Las acciones tóxicas del aluminio se relacionan primariamente con la raíz. El sistema radical se acorta y engruesa como resultado de la inhibición del alargamiento del eje principal y de las raíces laterales. La severidad de la inhibición del crecimiento de la raíz es un indicador adecuado de las diferencias genotípicas en la toxicidad por aluminio. Los mecanismos fisiológicos y bioquímicos de los efectos tóxicos del aluminio sobre el alargamiento de la raíz no están bien comprendidos y son objeto de controversia. Una respuesta rápida al tratamiento con aluminio es la inhibición de la división celular en el meristemo apical de la raíz. Figura 67. Efecto de las diferentes formas del aluminio en la solución del suelo. Bases fisiológicas de la resistencia al Al Debido a que se considera que la toxicidad del aluminio tiene que ver con diferentes procesos que suceden en la raíz, se asume que la resistencia también es compleja y que las plantas poseen una amplia variedad de mecanismos de resistencia. Se han propuesto dos clases de mecanismos de resistencia: Los que permiten a la planta la acumulación en el 101 simplasma (tolerancia simplásmica), y los que excluyen el aluminio del ápice radical (exclusión del Al). Los posibles mecanismos de tolerancia simplásmica tienen que ver con la quelatación del Al simplásmico por ligandos de baja masa molecular o por proteínas que ligan el Al en el citoplasma, y también tienen que ver con el secuestro del Al en las vacuolas o en otros compartimentos celulares. Los mecanismos que pueden mediar en los procesos de exclusión son: 1. Liberación de quelatos de aluminio de baja masa molecular en la rizosfera 2. Incremento del pH de la rizosfera inducido por la raíz 3. Ligamiento del Al en la pared celular 4. Disminución de la permeabilidad de la membrana 5. Ligamiento del Al al mucílago asociado con el ápice radical Las evidencias más recientes muestran que el mecanismo de tolerancia en trigo, se asocia con una acumulación reducida de Al en el ápice radical pero no en las partes maduras de la raíz. Se ha encontrado que la aplicación de malato o citrato a la solución nutritiva disminuye la fitotoxicidad del Al. Los complejos citrato-Al y malato-Al no traspasan fácilmente la membrana y por tanto, no son absorbidos fácilmente por la raíz. La información acumulada durante varios años de investigación se ha utilizado para proponer un modelo en el cual el Al se excluye de las raíces mediante el incremento de los ácidos orgánicos en la rizosfera. En habichuela, se ha encontrado que la exposición de las raíces de un genotipo tolerante al Al, induce la liberación de 10 veces más de citrato a la rizosfera que de un genotipo sensible al Al. Una evidencia más concluyente que corrobora la importancia de la liberación de ácidos orgánicos como mecanismo que contribuye a la tolerancia al Al, se ha encontrado con trabajos en líneas isogénicas de trigo muy próximas genéticamente, pero que difieren en el grado de tolerancia al Al, en los cuales se muestra que la tolerancia diferencial al Al, es codificada por un gene dominante simple (Alt1). Unos pocos minutos luego de la exposición al Al, las isolíneas tolerantes liberan malato desde los ápices radicales mientras 102 que las líneas sensibles no lo hacen. La cantidad de malato liberado por las líneas tolerantes, se incrementa notablemente con la severidad de la exposición. Figura 68. Modelo de la interacción aluminio/ ácidos orgánicos Modificado de Kochian, 2000. Los ácidos orgánicos como el malato y el citrato se pueden encontrar en el citoplasma a pHs cercanos a 7.0 en forma de aniones (malato y citrato) y su liberación fuera de la membrana celular se lleva a cabo mediante canales aniónicos. Las evidencias fisiológicas sugieren la existencia de una ruta de transducción de señales que implica el ligamiento del Al a un receptor de membrana desconocido, a un canal aniónico o a algún factor citoplásmico que dispara la apertura del canal iónico. Las evidencias encontradas en trigo, muestran que existe tal canal para la transferencia de los ligandos del Al. Este canal se activa utilizando concentraciones de AlCl3 del orden de 25 a 50 μM. Se ha encontrado que en el maíz, el Al induce la liberación de citrato pero no de malato a partir del ápice radical en cultivares y líneas resistentes, pero no se sabe si este proceso está comandado por la expresión de Alt1 o por un gene similar. 103 Variabilidad genética de la tolerancia al Al Se ha registrado variabilidad genética de la tolerancia al Al en varias especies importantes de cultivos, y tal vez el cultivo más estudiado a este respecto es el trigo, el cual se ha utilizado como modelo para investigar la complejidad genética de esta característica. Una buena parte de la investigación acerca de la herencia de la tolerancia al Al en trigo, muestra que este rasgo está controlado por uno o por muy pocos genes principales, los cuales se localizan en los cromosomas 2D, 4D y 5D. En cebada, la tolerancia al Al, también se le atribuye a la acción de un gene simple, con evidencias de que la variación en el grado de tolerancia entre genotipos está condicionada por diferentes alelos de ese gene. En el maíz se ha encontrado lo mismo que en la cebada. Sin embargo, en los programas de mejoramiento, la tolerancia se trata como un rasgo cuantitativo, es decir un rasgo fenotípico que puede variar de manera cuantitativa cuando se mide entre diferentes individuos. Los rasgos cuantitativos son controlados por la acción acumulativa de los alelos de un loci múltiple. En el arroz, se ha registrado variabilidad de la tolerancia al aluminio, pero los mecanismos de la herencia de esta característica en esta especie no han sido estudiados formalmente. Solubilidad del aluminio y del manganeso En los suelos minerales ácidos a pH <5.5 una proporción creciente de los sitios de intercambio catiónico de los minerales de la arcilla es ocupada por el aluminio donde este elemento remplaza especialmente otros cationes polivalentes (Mg2+, Ca2+) y actúa simultáneamente como un fuerte adsorbente del fosfato y el molibdato. En esta forma, el porcentaje de aluminio intercambiable en los suelos se correlaciona con el pH del suelo y con la inhibición del crecimiento de las raíces de la mayoría de las especies vegetales. Sin embargo, con frecuencia estas correlaciones no son tan estrechas, de tal manera que no son únicamente las concentraciones del aluminio sino el tipo de aluminio en la solución del suelo el que determina la fitotoxicidad a las raíces. 104 En muchos suelos ácidos, el contenido de manganeso intercambiable aumenta con la disminución del pH. Sin embargo, el incremento en el contenido de manganeso intercambiable (Mn+2), también es función del potencial redox MnO2 + 4H+ + 2 e- Mn2+ + 2H2O Consecuentemente, se espera que se encuentren altos niveles de Mn+2 en los sitios de intercambio y en la solución del suelo, en suelos ácidos con grandes cantidades de manganeso reducible, en presencia de grandes contenidos de materia orgánica, con alta actividad microbial y anaerobiosis ya sea temporal (inundaciones de corto término) o permanente. En suelos con altos niveles de manganeso reducible, la acidificación generada como consecuencia de la actividad de las leguminosas simbióticas, puede incrementar fuertemente la cantidad de Mn2+ intercambiable y, por tanto, el riesgo de toxicidad por manganeso en las pasturas perennes. Efecto de los niveles excesivos de manganeso Contrariamente al aluminio, el manganeso se transporta fácilmente desde la raíz hasta el brote y en consecuencia, como regla, los síntomas de la toxicidad del manganeso aparecen en primer lugar en los cogollos. Es de particular importancia para el crecimiento vegetal en suelos minerales ácidos es la inhibición de la absorción del calcio y el magnesio debido a las altas concentraciones de manganeso. Entre los síntomas más conocidos de la toxicidad por manganeso en las dicotiledóneas, se encuentran las hojas jóvenes quebradizas y las pecas cloróticas en las hojas maduras de plantas que crecen en suelos ácidos y que son, probablemente, expresiones del efecto inducido de deficiencia en calcio o magnesio. Bajo estas condiciones se observan los síntomas visibles de la toxicidad de manganeso aún a niveles que pueden disminuir el crecimiento sólo ligeramente, en contraste con la toxicidad por aluminio que inhibe severamente el crecimiento sin que se produzcan síntomas claramente identificables en la parte aérea. De aquí que en los suelos ácidos con altos niveles intercambiables de aluminio 105 y manganeso la depresión del crecimiento observada puede ser atribuída erróneamente a la toxicidad por manganeso cuando la toxicidad por aluminio es el más importante de los dos factores. Por otro lado, en muchos casos se puede inducir la deficiencia en magnesio. El manganeso deprime la absorción del magnesio, bloqueando los sitios del magnesio en las raíces. En consecuencia, las altas concentraciones de manganeso en la solución del suelo, pueden inhibir el crecimiento de la raíz y del brote, por medio de la inducción de la deficiencia de magnesio. La corrección de la toxicidad del manganeso puede efectuarse mediante la aplicación de altas cantidades de magnesio. Fisiología de los estreses abióticos El estudio de las respuestas de las plantas a los estreses ambientales (bióticos y abióticos) ha sido un tema central para la Ecofisiología. La comprensión de la manera como las plantas responden al estrés es vital para la comprensión de su comportamiento en relación con los gradientes ambientales. Por otro lado, el estrés conduce invariablemente a la reducción de la productividad vegetal y por esta razón es de vital importancia para los agrónomos, sobre todo considerando que en condiciones tropicales la magnitud de los factores bióticos y abióticos que afectan el comportamiento de las plantas, ocasiona pérdidas en las cosechas, que en buena parte de los casos hace que la agricultura tropical sea no competitiva con la agricultura de las zonas templadas. La comprensión de las respuestas de las plantas al estrés es fundamental para el desarrollo de los cultivares resistentes a los efectos negativos de la sequía, la salinidad y acidez de los suelos, de los limitantes bióticos (plagas y enfermedades), y otras condiciones limitantes de la producción. Debido a que las condiciones que inducen el estrés ocasionan perturbaciones en el funcionamiento de las plantas, su estudio es una herramienta muy útil para investigar la fisiología y bioquímica básicas de las plantas. 106 Qué es el estrés en las plantas? La definición biológica de estrés no es tan evidente, pero implica la ocurrencia de efectos adversos para los organismos. El estrés (que de alguna manera puede traducirse como tensión), es un concepto mecánico definido por los ingenieros y los físicos como la fuerza que se aplica a una unidad de área de un objeto. Como respuesta al estrés, el objeto desarrolla un cambio en alguna de sus dimensiones que puede ser cuantificado fácilmente. En consecuencia, definir el estrés tan precisamente en sentido biológico no es tan fácil. A nivel de un ecosistema, por ejemplo, cualquier constricción externa que limite la productividad (entendida como ganancia en carbono) por debajo del potencial genético de la planta, puede ser considerada como un estrés. Este enfoque puede ser de mucha utilidad en situaciones como las de la agricultura, en la cual se pueden utilizar modelos matemáticos para estimar el potencial genético bajo condiciones ambientales óptimas. Sin embargo, si no se cuenta con medios prácticos para estimar el potencial genético, es muy difícil juzgar el impacto del estrés siguiendo el criterio anterior. Cuando se evalúan los estreses ambientales, se presenta otra dificultad generada por la pregunta de cuándo una determinada condición se vuelve determinante de estrés, a lo largo de un gradiente ambiental continuo. Los vegetales exhiben una enorme variación con respecto a sus ambientes óptimos y a su susceptibilidad a condiciones extremas de, por ejemplo, temperatura, potencial hídrico o salinidad. Tabla 18. Principales estreses ambientales a los cuales se pueden someter las plantas Alta temperatura (calor) Baja temperatura (heladas, congelamiento) Exceso hídrico (inundación, anoxia) Déficit hídrico (sequía, bajo potencial hídrico) Salinidad Radiación (visible, UV) 107 Químicos (pesticidas, metales pesados, polucionantes atmosféricos) Bióticos (patógenos, fitófagos, competencia intra e interespecífica) En qué punto del continuo, la temperatura o el potencial hídrico del suelo se convierten en un determinante de estrés? La respuesta no es sencilla, y bajo ninguna terminología, los estudiosos se han puesto de acuerdo en el campo de la fisiología del estrés. Quizá la definición más útil de estrés biológico es “una fuerza o influencia adversa que tiende a hacer que los sistemas normales inhiban su funcionamiento óptimo”. Sin embargo, incluso esta definición es problemática porque la interpretación de qué es lo “normal” es altamente subjetiva y puede variar entre especies o ecotipos. La inhibición de un proceso fisiológico por un estrés ambiental se discute normalmente en términos negativos. Por ejemplo, una exposición prolongada a altas intensidades lumínicas puede disminuir la eficiencia fotosintética lo mismo que la capacidad fotosintética. Este efecto negativo sobre la fotosíntesis implica la existencia de un mecanismo fotoprotector que permite que la planta sobreviva a la exposición a radiaciones excesivas. Respuestas de la planta al estrés Con el incremento poblacional, la agricultura debe alimentar más personas mientras que compite con el desarrollo urbano por tierras laborables de primera calidad. Esta demanda en aumento, acoplada con recursos cada vez más escasos ha propulsado el interés científico y comercial por aclarar los mecanismos mediante los cuales las plantas responden al estrés, con el objeto de manipular estos mecanismos e incrementar la productividad en condiciones ambientales sub-óptimas. Cuando se comparan los rendimientos record de los cultivos con los rendimientos promedio, se puede observar fácilmente el impacto del ambiente sobre la productividad vegetal. Si se asume que los rendimientos record representan el crecimiento vegetal bajo condiciones ideales, entonces las pérdidas asociadas con los estreses bióticos y abióticos pueden reducir la productividad promedio entre el 65 y el 87% dependiendo del cultivo. La mayor parte de estas pérdidas se atribuyen a características sub-óptimas del ambiente. La aplicación exitosa 108 de técnicas biotecnológicas y de mejoramiento clásico puede dar como resultado el desarrollo de plantas tolerantes al estrés que incrementen el suministro de alimento para la población y a considerables beneficios económicos. Los mecanismos de ingeniería genética pueden hacer posible el desarrollo de tolerancia al estrés que promueva la supervivencia durante períodos intensos o prolongados de estrés o mantener elevada la productividad de la planta bajo condiciones de estrés ambiental moderado (tabla 19). Tabla 19. Rendimientos techo y rendimientos promedio de cuatro cultivos Cultivo Rendimiento Rendimie Pérdidas promedio (ton Pérdidas techo (ton ha-1 nto ha-1 año-1) abióticas como año-1) promedio (ton ha-1 Bióticos Abióticos porcentaje del rendimiento techo año-1) Maíz 19. 3 4.6 1.952 12.7 65.8 14.5 3.5 3.3 7.7 75.8 Soya 7.39 1.6 0.666 5.12 69.3 Sorgo 20.1 2.8 1.05 16.2 80.6 (USA) Maíz (Colombia) Clases de estrés El estrés de las plantas se divide en dos categorías: El estrés abiótico causado por factores físicos (luz, temperatura, etc.) o químicos (salinidad, pH, polucionantes, etc), y el estrés causado por factores bióticos (plagas, enfermedades) a los cuales la planta se expone durante su ciclo de vida. 109 ESTRESES AMBIENTALES ABIÓTICOS BIÓTICOS RESPUESTA AL ESTRÉS RESISTENCIA SUSCEPTIBILIDAD ACLIMATACIÓN SENESCENCIA CRECIMIENTO MUERTE EVASIÓN SUPERVIVENCIA SUPERVIVENCIA Figura 65. Clasificación de los estreses. Algunas plantas pueden ser lesionadas por un estrés, lo cual significa que pueden estar sufriendo una o más disfunciones metabólicas. Si el estrés es moderado y de corta duración, el daño puede ser temporal y la planta puede recuperarse cuando el estrés cese. Si el estrés es lo suficientemente severo, puede inhibir la floración, la formación de semillas e inducir la senescencia que conduce la planta a la muerte. Tales plantas son consideradas susceptibles. Algunas plantas escapan en conjunto al estrés, tales como las plantas desérticas efímeras (de corta existencia). Las plantas efímeras, germinan, crecen y florecen muy rápidamente luego de las lluvias estacionales, y completan su período de vida durante un período de adecuada humedad formando semillas latentes antes de la llegada de la estación seca. Debido a que las plantas efímeras nunca experimentan realmente el estrés, estas plantas sobreviven a las limitaciones ambientales mediante la evasión ante el estrés. 110 Los mecanismos de evasión reducen el impacto del estrés aunque los factores que lo producen estén presentes en el ambiente. Por ejemplo, la alfalfa Medicago sativa sobrevive en ambientes secos mediante el desarrollo de raíces que profundizan en el subsuelo hasta encontrar el agua subterránea. En estas condiciones, la alfalfa obtiene un adecuado suministro de agua mientras otras plantas experimentan sequía. Otro ejemplo de plantas que evaden el estrés hídrico, es el de los cactus. Las plantas evasoras del estrés hídrico, deben ser lesionadas seriamente antes de que experimenten la desecación. Muchas plantas tienen la capacidad de tolerar un factor de estrés y por esto se consideran resistentes. La resistencia requiere que el organismo llegue a un equilibrio termodinámico en presencia del factor de estrés; para mantener la homeostasis, las condiciones internas deben estar en equilibrio con las condiciones externas de la planta. La tolerancia a la sequía, por ejemplo, requiere que el organismo sobreviva a la desecación de su protoplasma sin que sufra daño, reteniendo la capacidad de desarrollo normal cuando el protoplasma se rehidrata. Un ejemplo extremo de tolerancia es un grupo heterogéneo de helechos y fanerógamas (plantas con flores) de las cuales se conocen más de 100 especies conocidas colectivamente como “plantas resucitantes”. Mientras que las partes vegetativas de la mayoría de las plantas no toleran siquiera una deshidratación moderada, el follaje de las plantas resucitantes sobrevive después de que se seca al aire hasta valores de cerca del 7% de humedad sin recibir ningún daño. Otros términos que requieren alguna explicación son “adaptación” y “aclimatación”. Aunque las dos son medios para lograr tolerancia a un factor de estrés en particular, la adaptación se refiere a modificaciones heredables en la estructura o la función o en ambas, lo cual da como resultado el incremento en el ajuste del organismo en presencia de un ambiente estresante. Un ejemplo de adaptación se encuentra en las modificaciones morfológicas y fisiológicas de las plantas CAM. La aclimatación se refiere a las modificaciones no heredables que ocurren en la vida de un individuo. Estas modificaciones son inducidas por exposiciones graduales a los factores de estrés, tales como las temperaturas bajas o la desecación lenta, lo cual capacita a la planta para mantener la homeostasis y en últimas, para sobrevivir y reproducirse en un ambiente estresante. Sin 111 embargo, hay que considerar que la capacidad de aclimatación es un rasgo genético, pero los cambios específicos inducidos como respuesta a las condiciones de estrés, no pasan por sí mismos a la siguiente generación. La habilidad de las plantas bianuales y los cultivares de invierno de algunos cereales son un ejemplo de la aclimatación a las bajas temperaturas. El proceso de aclimatación a los factores de estrés se conoce como “endurecimiento” y las plantas que tienen la capacidad de aclimatarse, reciben el nombre de plantas endurecidas. Cambios en la expresión genética en respuesta al estrés Los cambios en el metabolismo y el desarrollo inducidos por el estrés pueden ser atribuidos en la mayor parte de los casos a la alteración en los patrones de expresión genética. La respuesta a un factor estresante se inicia cuando la planta reconoce el estímulo estresante a nivel celular. El reconocimiento del estímulo activa la ruta de transducción de una señal que transmite la información dentro de las células individuales y a través de la planta. Por último, los cambios en la expresión genética, los cuales suceden a nivel celular, se integran en una respuesta de toda la planta que puede modificar el desarrollo (crecimiento y diferenciación) e incluso influenciar la capacidad reproductiva. La magnitud y duración de la respuesta dependen de la duración y severidad del factor que produce el estrés. Se ha acumulado considerable evidencia de que la regulación de las respuestas vegetales al estrés tiene que ver con la acción de las hormonas, especialmente el ácido abscísico (ABA), el ácido jasmónico (AJ), el etileno, y con mensajeros secundarios como el Ca2+. 112 Figura 66. Interacción de la planta con el ambiente.Modificado de Bray et al, 2000. En respuesta a las condiciones de estrés, algunos genes se expresan más fuertemente, mientras que otros se reprimen. Los productos proteínicos de los genes inducidos por el estrés, frecuentemente se acumulan en respuesta a condiciones desfavorables. Las funciones de estas proteínas y los mecanismos que regulan su expresión son un tema muy actual de investigación en fisiología del estrés. Aunque la mayoría de los estudios se han enfocado en la activación post-transcripcional de la expresión genética, hay evidencias cada vez mayores de que la acumulación de los productos génicos también está influenciada por los mecanismos reguladores post-transcripcionales que incrementan las cantidades de ARNm específicos Mejoramiento genético para resistencia o tolerancia a estreses por nutrientes La variación genotípica en la capacidad de las plantas para absorber, translocar y usar los nutrientes minerales ha sido el objeto de muchas investigaciones desde los años 1920 y 1930. Sin embargo, sólo ha sido desde los años 1970 que los investigadores han hecho esfuerzos concertados para entender y explotar las diferencias genéticas en la nutrición de 113 las plantas como medio de mejorar la producción de cultivos. El lento progreso en esta área puede ser atribuido al énfasis que se le ha dado a las enmiendas del suelo más que a la selección de plantas para condiciones particulares del suelo. La carencia de una comprensión clara de los mecanismos relacionados a nivel celular, de los tejidos y de la planta completa también ha impedido el progreso. Con pocas excepciones, el mejoramiento para rasgos nutricionales deseables en las plantas, es un proceso complejo que tiene que ver normalmente con más de un gene y que se ve afectado por varios factores ambientales. A pesar de estos retos, se ha logrado algún éxito en la selección de genotipos nutricionalmente mejorados. Sin embargo, el uso de enmiendas del suelo para suplir los nutrientes usados por las plantas será siempre una parte integral de la producción de cultivos, pero actualmente se reconoce que la selección de plantas para características nutricionales mejoradas puede ser viable y, a veces, una alternativa necesaria para incrementar la productividad de los cultivos y para aumentar la calidad de las cosechas. El enfoque principal en los últimos años es la identificación de genotipos tolerantes a condiciones adversas entre las cuales se encuentran la salinidad, la acidez y la deficiencia o la toxicidad de nutrientes. Por ejemplo, en los suelos calcáreos puede haber grandes cantidades de hierro pero el elemento no es accesible para la toma y/o uso por muchas especies o genotipos. De manera alternativa, en los suelos ácidos pueden ocurrir altos niveles de un elemento (Al, Mn) que pueden ser tóxicos para algunas especies o genotipos pero no para otros. El concepto de eficiencia en el uso de un nutriente que se refiere al incremento en la producción económica por unidad de nutriente accesible, ha recibido considerable atención, particularmente para agriculturas de bajos insumos donde las aplicaciones de fertilizantes no son económicamente recomendables. Los desarrollos recientes en el área de la biología molecular también han proporcionado posibilidades esperanzadoras para la manipulación genética de la adquisición y transporte de nutrientes por las raíces de las plantas. 114 Figura 69. Componentes de la respuesta de una especie vegetal al nivel de fertilidad del suelo. EFICIENCIA DE LOS NUTRIENTES Transporte raíz-brote (transporte a larga distancia) Transporte dentro de la raíz (Transporte a corta distancia) Formas de ligamiento y compartimentación dentro de la raíz) Demanda en el nivel celular (compartimentación, forma deligamiento) Utilización dentro del brote (retranslocación) Reservas de la semilla. ADQUISICION DE NUTRIENTES MORFOLOGIA DE LASRAICES FISIOLOGIA Y BIOQUIMICA DE LAS RAICES a)Afinidad del sistema de transporte membranar (Km) b)Concentración umbral c)Modificaciones de la rizosfera MICORRIZAS pasivas activas respuesta a la deficiencia RAICES INHERENTE RESPUESTA A LA DEFICIENCIA Ej: Relación en la toma de cationes y aniones Ej: Secreción de compuesto quelatante y reductores y protones 115 Adaptación de las plantas a condiciones químicas adversas de los suelos Vegetación natural Los factores químicos de los suelos tales como el pH, la salinidad y la accesibilidad de los nutrientes determinan la distribución de la vegetación natural como es el caso de las plantas silvestres. Las especies y ecotipos pueden ser clasificados en términos ecofisiológicos de acuerdo con su distribución en los suelos. Algunos ejemplos de especies agrupadas de esta forma son las acidófilas y las acidófobas, las calcícolas y las calcífugas, las halofitas y las glicofitas, y las metalofitas (adaptadas a suelos metalíferos). Las especies cultivables se han seleccionado usualmente para suelos con altos niveles de fertilidad y sus características nutricionales son bien diferentes de las que exhibe la vegetación natural que crece en suelos de baja fertilidad. Sin embargo, dentro de la vegetación natural también hay especies adaptadas a suelos de alta fertilidad y con similitudes en las características nutricionales de las especies cultivables. Las plantas silvestres adaptadas a sitios pobres en nutrientes exhiben consistentemente relaciones altas entre raíz y brote. Sin embargo, con la excepción de algunas plantas especializadas (como las Proteáceas), no son más eficientes en la adquisición de nutrientes que las especies ruderales (Propias de terrenos incultos o de aquellos donde se vierten desperdicios o escombros), o las especies cultivables. La característica más notable de las plantas del tipo I es su baja tasa de potencial de crecimiento máximo. Estas plantas crecen lentamente aún en presencia de altos aportes de nutrientes, pero almacenan más nutrientes de los que pueden utilizar cuando el aporte es limitado (consumo de lujo en períodos de abundancia de nutrientes). Las plantas adaptadas a altas altitudes son también del tipo I. En comparación, la tasa de crecimiento de las plantas del tipo II se reduce grandemente en períodos de suministro limitado y en ese caso se pueden desarrollar síntomas visuales de deficiencia. Estas plantas responden fácilmente a altos suministros de nutrientes mediante el incremento de las tasas de crecimiento particularmente en el brote (parte aérea). Un ejemplo de este tipo de plantas es la ortiga Urtica dioica L. 116 Las plantas silvestres del tipo I, usualmente alcanzan concentraciones de nutrientes más altas en su materia seca, con lo cual exhiben menor eficiencia en el uso de ellos (gramos de materia seca producida por gramo de nutriente). En en estas especies, el almacenamiento de nutrientes es de importancia clave para la supervivencia y la reproducción. Esta estrategia de las plantas silvestres se mantiene en ciertos cultivos tropicales de tubérculos y raíces tuberosas (yuca, ñame, bore, etc.), donde a pesar de las grandes diferencias en rendimiento ocasionadas por las variaciones en el pH del suelo, el contenido de los elementos minerales en las hojas permanece aproximadamente el mismo. Otra estrategia encontrada en ciertas plantas del tipo I es la de formación de semillas grandes con alta capacidad de almacenamiento de nutrientes que sirven para su establecimiento en sitios pobres en ellos (Tabla 20). Tabla 20. Características de las estrategias de las plantas silvestres en la adaptación a suelos con baja o con alta accesibilidad a los nutrientes Accesibilidad del nutriente Tipo I Tipo II (Crecimiento lento) (Especies ruderales) Baja Bajas tasas de toma de nutrientes (Lugares pobres en nutrientes) Bajas tasas de crecimiento de Bajo Bajas tasas de crecimiento almacenamiento raíces y de brotes nutrientes Alta relación raíz / brote Alta relación raíz / brote de Alta longevidad de las hojas Altas concentraciones de nutrientes en los tejidos Alta (Lugares ricos en nutrientes) Respuesta pequeña en el Elevada tasa de toma de nutrientes crecimiento de raíces y brotes Elevado almacenamiento Alta tasa de crecimiento de nutrientes (Consumo de lujo) Baja eficiencia en el uso de los nutrientes Alta eficiencia en el uso de los nutrientes Disminución en la relación raíz / brote 117 En muchos ecosistemas naturales ocurren limitaciones en fósforo. Aunque las micorrizas vesículo-arbusculares (MVA) juegan un papel importante en la adquisición del fósforo en suelos con bajos niveles del elemento, no hay diferencias sustanciales entre las especies silvestres y sus parientes cultivadas en cuanto a la dependencia de MVA para su adquisición de fósforo. La mayor eficiencia de la avena negra (Avena fatua L.) en comparación con la avena cultivada (Avena sativa L.) es ocasionada por una masa radical mayor, por mayores tasas de absorción tanto en presencia de bajos como de altos contenidos de fósforo en los suelos, como tambien a mayores eficiencias en el uso del fósforo en los brotes. Si se comparan con las plantas del tipo I, en las plantas silvestres con alto potencial de crecimiento en las raíces (tipo II), no sólo las tasas de absorción como de utilización de los nutrientes son mayores sino que también los costos respiratorios específicos son más bajos. El enfoque altos insumos vs el enfoque bajos insumos No hace mucho tiempo, el enfoque para resolver los problemas de baja fertilidad de los suelos en la producción agrícola, hacía énfasis en la importancia de cambiar el suelo para ajustarlo a la planta. Los factores de fertilidad del suelo tales como el pH y la accesibilidad de los nutrientes, se ajustaban a niveles óptimos para una planta dada. Este enfoque de altos insumos, acoplado con el uso excesivo de fertilizantes químicos fue muy exitoso para aumentar los rendimientos de los cultivos habituales de las zonas templadas que crecen por regla general en suelos que no tienen propiedades químicas extremas. Sin embargo, los genotipos de plantas de cultivo adaptados a altos insumos tienen una adaptabilidad limitada a suelos de condiciones químicas adversas como los que usualmente ocurren en los trópicos y subtrópicos. Estas condiciones no pueden ser mejoradas fácilmente debido a su extensión y al costo. En América Tropical, por ejemplo, alrededor del 70 % de los suelos son ácidos y de baja fertilidad. En las regiones subtropicales y semiáridas, la salinidad o la alcalinidad del suelo con sus problemas asociados, como las deficiencias de hierro y zinc, están ampliamente distribuidas. Cerca del 25 % de los suelos del área cultivable mundial tienen problemas químicos agudos. 118 El haberse percatado de las dificultades y fallas del enfoque de altos insumos en la mayoría de los suelos tropicales y subtropicales ha conducido en los últimos años a un desplazamiento en el enfoque hacia un énfasis mayor en el ajuste de las plantas al suelo. Este enfoque requiere genotipos mejor adaptados a condiciones ecológicas dadas, también la selección y programas de mejoramiento para alta eficiencia nutricional y alta tolerancia a condiciones como toxicidad de aluminio y manganeso, inundación y salinidad. El enfoque de bajos insumos que usa genotipos adaptados con un uso más eficiente de los nutrientes de las reservas del suelo y de los fertilizantes conduce a rendimientos que son alrededor del 80-90 % del máximo. Por razones tanto ecológicas como económicas, este enfoque se dirige no sólo a condiciones extremas del suelo (como la salinidad) sino también a la selección y mejoramiento de genotipos que son altamente eficientes en la utilización de los nutrientes de los suelos y los fertilizantes. El progreso en la selección y mejoramiento para altos rendimientos alcanzado en el pasado fue logrado en gran medida por el aumento en el Indice de Cosecha, cociente que da cuenta de la proporción de biomasa asignada a las semillas y órganos de almacenamiento en comparación con la biomasa total. En años recientes, se ha dado un gran énfasis a la combinación de los altos rendimientos de los cultivos con las altas eficiencias en la adquisición y utilización de los nutrientes minerales. Los genotipos modernos de cereales o de tubérculos tienden a tener razones peso seco raíz / peso seco del brote más bajas que los genotipos anteriores o tradicionales, pero la eficiencia en la adquisición de los nutrientes suele ser similar o aún mayor, lo cual puede ser atribuído a un sistema radical más fino y más activo en los genotipos modernos, combinado con una utilización interna (retranslocación) más eficiente, fenómeno que ha sido demostrado para el fósforo en varios genotipos mejorados de trigo.