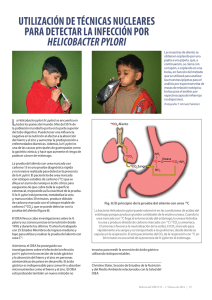
Determinación de la bacteria Helicobacter pylori en abastecimientos
Anuncio

UNED Documento de tesis para optar por el grado de doctora en Ciencias Naturales para el Desarrollo Énfasis de Gestión y Cultura Ambiental “Determinación de la bacteria Helicobacter pylori en abastecimientos de agua para consumo humano y su implicación en el manejo del agua en Costa Rica”. Virginia Montero Campos Octubre 2010 “Determinación de la bacteria Helicobacter pylori en abastecimientos de agua para consumo humano, y su implicación en el manejo del agua en Costa Rica”. Documento presentado al Programa de Doctorado en Ciencias Naturales para el Desarrollo para optar por el grado académico de Doctora en Ciencias Naturales. Ph.D Miembros del Tribunal ______________________ Fernando García Santamaría, Ph.D Tutor ____________________ Floria Roa Gutiérrez, Ph.D _________________________ Freddy Araya Rodríguez, Ph.D _________________________ Jesús Mora Molina, Ph.D ___________________ Willy Soto Acosta, Ph.D ____________________ Sayra Munguía Ulloa, Ph.D _____________________ Tomás Guzmán Hernández, Ph.D RESUMEN Helicobacter pylori es una bacteria que se estima, está presente en la mitad de la población y es un problema de salud pública a nivel mundial; la colonización ocurre mayormente en países en vías de desarrollo y se considera estrechamente relacionada con factores socioeconómicos. Bajo condiciones no bien establecidas, esta relación es frecuente que provoque diferentes patologías: gastritis, úlceras, linfoma MALT de células B y cáncer gástrico. Con respecto al origen, las investigaciones sobre Helicobacter pylori generalmente se han realizado a partir de muestras directas o indirectas de pacientes humanos y muy pocos trabajos dan cuenta de su hallazgo en agua y menos en agua de consumo de una población. En este trabajo se analizaron un total de 122 muestras de agua de consumo poblacional de 20 cantones elegidos de zonas con alta y baja incidencia de cáncer gástrico en Costa Rica según la información estadística del Registro Nacional de Tumores. Se logró el cultivo e identificación molecular con el marcador glmM de Helicobacter pylori en el 39 % de las muestras de agua de las zonas de alta incidencia de cáncer gástrico y en el 7,5 % de las muestras de las zonas de baja incidencia. Dos productos de PCR del gen glmM de dos muestras aisladas de las zonas de alta incidencia fueron secuenciados y corroborados como verdaderos aislamientos de H. pylori. Se recolectó información sobre la naturaleza del agua que manejan los Entes Operadores de los Acueductos de las zonas en estudio y se encontró un coeficiente de correlación de Pearson entre incidencia de cáncer gástrico y altitud de 0,867, entre incidencia de cáncer gástrico y temperatura ambiental de - 0,853, entre incidencia de cáncer gástrico y origen del agua como naciente de 0,651, un coeficiente de regresión lineal entre incidencia y temperatura de 0,728; y en la prueba exacta de Fisher se evalúo la independencia entre nivel de incidencia (baja y alta) con Ente Operador del Acueducto al 2005, se determinó un valor de p < 0,05, concluyéndose que existe relación entre las variables y que esta relación no se debe al azar con un 95% de confianza, así se puede concluir que existe relación entre quien opera el acueducto y la incidencia de cáncer gástrico para ambas zonas de estudio y que el Ente Operador puede ser entonces una variable muy importante en el problema. Este trabajo aportó nuevo conocimiento científico en: técnicas optimizadas de cultivo para H. pylori de origen ambiental en medio líquido con soporte de nitrocelulosa y como agar inclinado bifásico; la optimización de técnicas moleculares para cepas ambientales de los marcadores glmM (no determinado en cepas ambientales) y de la proteína inductora del factor de necrosis tumoral alfa (Tipalpha FNT-α); la obtención de cepas de H. pylori a partir de muestras de agua de consumo humano de fuentes oficiales con y sin cloro residual. Se describieron por primera vez para Costa Rica correlaciones importantes y significativas entre incidencia de cáncer gástrico y factores geomorfológicos lo que propuso relacionar de forma diferenciada presencia de H. pylori de origen hídrico y alta incidencia de cáncer gástrico. DEDICATORIA “El hombre encuentra a Dios detrás de cada puerta que la ciencia logra abrir”, Albert Einstein. A mi madre, a quien un cáncer gástrico se la llevó en el mejor momento de su vida. A mi familia quienes en esta ardua etapa , se matricularon conmigo. AGRADECIMIENTOS A l Instituto Tecnológico de Costa Rica por su gran apoyo y financiamiento cuando fue presentado a la Institución como proyecto de investigación. Así mismo al Instituto Nacional de Acueductos y Alcantarillados por apoyar este proyecto, en especial al Dr. Darner Mora por su gran respaldo y confianza. A todas las municipalidades marco de esta investigación las cuales sin reparos abrieron sus puertas y fueron totalmente transparentes en mostrar su manejo del agua. A mis compañeros, profesionales e investigadores quienes me brindaron desde consejos, colaboración o apoyo en los muestreos y pude contar siempre con ellos a lo largo del proceso investigativo: Alejandro Hernández, Federico Masis, Jorge Camacho, Eric Romero, Jaime Quesada, José Sandoval, Kenneth Madriz, Sergio Con, Johnny Peraza, Edgar Ortiz. A mi tutor Dr. Fernando García por sus valiosos consejos y por su disposición para asumir la labor, a los lectores Dra. Floria Roa, Dr. Jesús Mora y el Dr. Tomás Guzmán, así como al resto del tribunal: Dra. Zayra Müngía, Dr. Freddy Araya y el Dr. Willy Soto. A los estudiantes que colaboraron como asistentes de proyecto en diferentes etapas a lo largo de estos años: Karina Barboza, Gustavo López, Jimena Orozco, Diana Chinchilla. A los asistentes muestreadores por su vital compañía en las tomas de las muestras: Roberto Fonseca y Marlen Avendaño (AyA), Alejandro Córdoba y Sofía Vargas del TEC. INDICE GENERAL Tema página Resumen…………………………………………………………………………………………………………………… i Dedicatoria……………………………………………………………………………………………………………….. ii Agradecimientos……………………………………………………………………………………………………….. iii Índice general…………………………………………………………………………………………………………… iv Índice de figuras……………………………………………………………………………………………………….. vi Índice de cuadros……………………………………………………………………………………………………… x Índice de anexos……………………………………………………………………………………………………….. xiii Introducción………………………………………………………………………………………………………………. 1 1.Marco teórico………………………………………………………………………………………………………… 3 1.1 Epidemiología de la infección………………………………………………………………………… 3 1.2 Mecanismos de acción y variaciones genéticas…………………………………………….. 5 1.3 H. pylori y su necesidad fisiológica de cationes…………………………………………….. 13 1.4 Patologías extra gástricas relacionadas………………………………………………………… 14 1.5 Prevalencia de la infección por H pylori y su distribución geográfica mundial…………………………………………………… …………………………………………………………. 15 1.6 Cáncer gástrico y factores predisponentes.………………………………………………….. 18 1.7 Helicobacter pylori y cáncer gástrico……………………………………………………………. 29 1.7.1 Infección por H. pylori y la carga mundial de cáncer gástrico………………….. 32 1.8 Investigaciones en Costa Rica……………………………………………………………………… 33 1.9 El papel del agua de consumo humano en la transmisión de H. pylori…………. 35 1.10 Calidad actual del agua en Costa Rica…………………………………………………………. 38 1.10.1 Fuentes de agua disponibles…………………………………………………………………. 39 1.11 Planes de seguridad del agua (PSA) ………………………………………………………. 46 2. Objetivos ………………………………………………………………………………………………………………. 49 3. Hipótesis………………………….……………………………………………………………………………………. 49 4. Materiales y Métodos…………………………………………………………………………………………… 49 4.1 Materiales ……………………………………………………………………………………………………… 49 4.2 Metodología ………………………………………………………………………………………………….. 50 4.2.1 Estandarización de la técnica de cultivo con cepas de referencia………….. 50 4.2.2 Análisis de las muestras por cultivo microbiológico………………………………. 50 4.2.3 Análisis para la identificación y caracterización de las cepas por PCR…. 51 4.2.3.1 Protocolos específicos…………………………………………………………………. 52 4.2.4 Caracterización de las muestras por secuenciación molecular…………….. 58 4.2.5 Elección de los sitios y toma de las muestras…………………………………………. 58 5. Resultados………………………………………………………………………………………………………….. 62 5.1 Estandarización de la técnica de cultivo con cepas de referencia…………………. 62 5.2 Análisis de las muestras por cultivo y PCR…………………………….. 67 5.2.1 Primer muestreo. Análisis de las zonas de alta incidencia…………………….. 68 5.2.2 Segundo muestreo. Análisis de las zonas de alta incidencia………………….. 73 5.2.3 Segundo muestreo. Análisis de las zonas de baja incidencia………………….. 78 5.2.4 Tercer muestreo. Análisis de zonas de alta y baja incidencia de cáncer gástrico ……………………………………………………………………………………………………………. 80 5.3 Situación de los acueductos marco de la investigación………………………………….. 90 6. Discusión………………………………………………………………………………………………………………. 108 7. Conclusiones…………………………………………………………………………………………………………. 122 8. Recomendaciones………………………………………………………………………………………………… 128 Bibliografía………………………………………………………………………………………………………………. 129 Anexos. ……………………………………………………………………………………………………………………. 143 INDICE DE FIGURAS Número 1 Título Vías de transmisión propuestas para H pylori………………………….. Página 5 2 Acción de la ureasa…………………………………………………………………. 6 3 Isla de patogenicidad cag-PAI………………………………………………….. 8 4 Reclutamiento de neutrófilos y linfocitos T y B………………………… 9 5 Fisiopatogenia de la enfermedad úlcero péptica asociada a la infección por H. pylori……………………………………………………………… 9 9 6 Células que intervienen en el reclutamiento celular en infecciones crónicas por H pylori…………………………………………….. 11 7 Interacción celular de linfocitos T e interleucinas…………………….. 12 8 Prevalencia de la infección por Helicobacter pylori…………………. 16 9 Descenso en la incidencia de cáncer de estómago y colonización por H pylori en Estados Unidos……………………………. 16 16 10 Distribución geográfica mundial de cepas de H pylori……………… 18 11 Proceso de formación de compuestos nitrosos en el jugo gástrico……………………………………………………………………………………. 19 Casos de incidencia y mortalidad de cáncer gástrico en hombres en países desarrollados y en vías de desarrollo…………. 21 Tasa de incidencia de cáncer gástrico por sexo-edad estandarizada por 100.000 habitantes……………………………………. 22 Variación internacional de incidencia para cáncer de estómago en hombres y mujeres. ……………………………………………………………. 23 Tasas de incidencia y mortalidad de cáncer de estómago, por 100,000 hombres, ajustadas por edad, según país en 1990……. 24 12 13 14 15 16 Tendencia de las tasas de incidencia del cáncer de estómago, según sexo, Costa Rica, 1992-1996. ………………………………………… 24 Tasa de incidencia de cáncer de estómago, por 100,000 habitantes, según provincia, Costa Rica, 1994-1996................... 25 Mortalidad por tumores malignos más frecuentes en hombres. Tasa ajustada por 100 000 hombres. Costa Rica. 1990-2003……. 26 Incidencia por tumores malignos más frecuentes en hombres. Tasa ajustada por 100 000 hombres. Costa Rica. 1990-2000..... 26 Tendencia de la incidencia y mortalidad por cáncer gástrico según sexo Costa Rica, 1995-2005* tasas ajustadas por 100.000 hab…………………………………………………………………………….. 27 Distribución de las tasa de incidencia de cáncer gástrico en Costa Rica según Sierra et al 1983. ………………………………………….. 27 Distribución de las tasas de incidencia por cantón ajustadas por 100 000 habitantes, según estadísticas del Registro Nacional de Tumores para el periodo 1990-1999………………….. 28 Distribución de las tasas de incidencia por cantón ajustadas por 100 000 habitantes según estadísticas del Registro Nacional de Tumores para el periodo 1995-2003……………........ 28 Desarrollo del adenocarcinoma gástrico como proceso secuencial por H. pylori……………………………………………………………. 29 25 Porcentaje de acueductos por Ente operador al 2002……………… 42 26 Coberturas con agua de calidad potable y no potable por provincias en Costa Rica, en el período 2008, según el Laboratorio Nacional de Agua………………………………………………….. 44 Valores porcentuales de habitantes abastecidos con agua potable y no potable en los acueductos operados por municipalidades 1996-2008. …………………………………………………… 44 Valores porcentuales de habitantes abastecidos con agua potable y no potable en acueductos operados rurales 19992008. ………………………………………………………………………………………. 45 17 18 19 20 21 22 23 24 27 28 29 Valores absolutos en conexiones y técnicas para la disposición segura de excretas. …………………………………………………………………. 45 Disposición segura de excretas. Encuesta de Hogares, 2006 INEC………………………………………………………………………………………….. 46 Comparación de crecimiento con y sin filtro, ambos medios están inoculados con H pylori………………………….……………………….. 63 Fotografía con microscopio de luz de cepa ATCC de H pylori con tinción de Gram, con fucsina fenicada. ……………………………………. 63 33 Vista de las colonias de H pylori en 10X. …………………………………… 64 34 Colonias de H. pylori en agar Columbia. …………………………………… 64 35 Microscopia en contraste de fases de formas cocoides de H. pylori de cultivo en placa………………………………………………………….. 65 Cultivo en agar inclinado de 3 días, agregado de células inmóviles dispuestas en cuerda. …………………………………………….. 66 30 31 32 36 37 38 Bacterias de cultivo bifásico inclinado por microscopia de contraste de fases. ……………………………………………………………………. 66 Cultivo de agar inclinado fijado con formaldehído por 24 horas para microscopia electrónica. …………………………………………………. 67 Visualización de productos de PCR para glmM (294 pb). muestras #17 a #22. ………………………………………………………………… 69 Visualización de productos de PCR para glmM para muestra #20. …………………………………………………………………………………………. 69 41 Visualización de productos de PCR para 16S ARNr…………………… 70 42 Visualización de productos de PCR para cagA ………………………….. 70 43 Visualización de productos de PCR para vacA…………………………… 71 44 Colonias sospechosas de H. pylori de muestra de agua……………. 76 45 Visualización de productos de PCR para glmM ………………………… 78 39 40 46 Visualización de productos reamplificados de PCR para glmM 83 47 Visualización de productos de PCR para FNT-α (273 pb) en las muestras positivas con el marcador glmM. ………………………………. 84 Árbol de mínima evolución con el parentesco filogenético de las cepas secuenciadas en estudio (rojo), según gen glmM……………. 87 Correlación entre altura y tasa de incidencia de cáncer gástrico para los cantones marco de estudio………………………….. 97 Comparación de las tasas por 100 000 habitantes de alta incidencia para cáncer gástrico por cantón, para las estadísticas de los periodos 1990-1999 y 1995-2005……………….. 102 Comparación de las tasas por 100 000 habitantes de baja incidencia para cáncer gástrico por cantón, para las estadísticas de los periodos 1990-1999 y 1995-2005……………….. 103 Mapa de suelos de Costa Rica. Ministerio de Agricultura y Ganadería. MAG………………………………………………………………………. 105 Tipo de suelos de los lugares de alta y baja incidencia de cáncer gástrico. ………………………………………………………………………. 105 Positividad bacteriológica en coliformes fecales del agua de las redes de la Municipalidad del cantón Central de Cartago, de 1996 a 2000. …………………………………………………………………………… 114 Propuesta de la interrelación de variables que influyen en la alta incidencia de cáncer gástrico, caso Costa Rica…………………… 122 56 Curva Dosis-Respuesta. …………………………………………………………… 124 57 Evolución celular hacia la formación de tumores y los factores que intervienen. ……………………………………………………………………… 125 48 49 50 51 52 53 54 55 INDICE DE CUADROS Número Título Página 1 Agua para consumo humano: estimación general de cobertura y calidad en Costa Rica - Período 2008……………………………………………….. 42 Tratamiento, desinfección y calidad del agua en los acueductos de Costa Rica por número de sistemas según ente operador 2008……… 43 Secuencias nucleotídicas y tamaños de amplificación esperados para la detección H. pylori………………………………………………………………. 54 Secuencias y tamaños de amplificación esperados para los imprimadores utilizados para las regiones de vacA (Lu, 2002)………… 55 5 Perfil térmico para PCR de región glmM de H. pylori……………………… 55 6 Perfil térmico para PCR de región cagA de H. pylori………………………… 56 7 Perfil térmico para PCR de polimorfismos vacA en H. pylori…………… 56 8 Perfil térmico para PCR de región ARNr 16S específica para H. pylori…………………….…………………………………………………………………………. 57 9 Diseño de primers para el marcador de TNF- α……………………………….. 57 10 Perfil térmico para PCR de las regiones glmM (reamplificado) y FNTα de H. pylori…………………………………………………………………………………… 58 11 Cantones elegidos en los quintiles 1 y 5 de alta y baja incidencia de cáncer gástrico para el muestreo.…………………………………………………… 59 Resultados de PCR 16S ARNr y glmM, coliformes totales y coliformes fecales para las muestras evaluadas de Cartago y San José en el primer muestreo. …………………………………………………………… 72 2 3 4 12 13 Descripción de las muestras por lugar de procedencia (cantón), análisis de las colonias y diferenciación por pruebas bioquímicas…… 14 Resultados de los análisis del marcador glmM con respecto a coliformes totales (CT) y coliformes fecales (CF) correspondientes al segundo muestreo. …………………………………………………………………….. 74 77 15 Información recolectada y cultivo de las muestras de agua de los cantones de baja incidencia dispensada por Ente Operador. 79 Cuadro comparativo de las zonas de alta y baja incidencia de cáncer gástrico sobre la naturaleza del agua y el Ente Operador del acueducto. ………………………………………………………… 80 17 Resultado de los cultivos de las zonas de alta incidencia…………. 81 18 Resultado de los cultivos de las zonas de baja incidencia…………. 82 19 Resultados del análisis de los marcadores glmM y FNT-α por muestra para el tercer muestreo..…………………………………………… 85 Resumen de los resultados por muestreo en las zonas de alta y baja incidencia….…………………………………………………………. 88 Naturaleza del agua por Ente Operador para cantones de baja incidencia en cáncer gástrico. ………………………………………………… 95 Naturaleza del agua por Ente Operador para cantones de alta incidencia en cáncer gástrico. …………………………………………… 95 Temperatura, altura y precipitación media anual para cantones de alta incidencia de cáncer gástrico, Costa Rica…………………….. 96 Temperatura y altura para cantones de baja incidencia de cáncer gástrico, Costa Rica……………………………………………………… 96 25 Correlaciones estadísticas entre las variables ambientales…….. 98 26 Análisis de regresión lineal entre incidencia y altura e incidencia y temperatura. ……………………………………………………….. 99 Prueba exacta de Fisher para independencia entre nivel de incidencia de cáncer gástrico y Ente Operador………………………… 101 Tasa de los cantones marco del estudio correspondiente al quintil 1 de alta incidencia de cáncer gástrico para los periodos 1999 y 2005. …………………………………………………………………………… 102 16 20 21 22 23 24 27 28 29 Tasa de cantones marco del estudio correspondiente al quintil 5 de baja incidencia de cáncer gástrico para los períodos 1999 y 2005……………………………………………………………………………… 30 Descripción geomorfológica y físico química de los suelos de las áreas de alta y baja incidencia para cáncer gástrico, marco del estudio. …………………………………………………………………………….. 31 32 103 107 Trabajos publicados sobre recuperación e identificación de H. pylori en el mundo, en matriz agua………………………………………… 109 Población actual en términos relativos cuyo Ente Operador dispensa agua potable actualmente en Costa Rica………………….. 120 Introducción El agua es vida, un elemento clave del desarrollo sostenible, indispensable en sus aspectos sociales, económicos y ambientales, esencial para la salud humana. El agua es un bien económico y un bien social que debe distribuirse en primer lugar para satisfacer necesidades humanas básicas. En este contexto la salud, el medio ambiente y el desarrollo sostenible están íntimamente ligados; un ambiente no contaminado ni degradado, ecológicamente favorable a la salud física y mental, no es solo una necesidad, sino un derecho de cada individuo que abarca no solo los medios que permitan la adquisición de los recursos, sino una participación compartida en las acciones para su protección. Se puede afirmar que en la actualidad existe consenso sobre el enfoque sectorial y fragmentado con respecto al manejo del recurso hídrico del país, lo cual ha conducido a conflictos por el uso ineficiente y desmedido, con el consecuente deterioro del recurso. Sobre la gestión del agua se ejercen con frecuencia presiones políticas, económicas y sociales. El estudio del impacto de las modificaciones o alteraciones de nuestro entorno ya sea de origen natural o antrópico sobre la salud, es un trabajo multidisciplinario y transdisciplinario que necesita considerarse desde muy diferentes perspectivas. Es importante entonces tener en cuenta el impacto que las condiciones ambientales ejercen sobre la salud de la población y los aspectos sociales y económicos que intervienen en ello. Por consiguiente, cuando se trata de estudiar los peligros ambientales modernos para la salud humana, resulta especialmente valioso comprender las vías que siguen. Se tienen los peligros tradicionales, los asociados a la pobreza y al desarrollo insuficiente, ligados a la falta de acceso al agua potable y a las deficientes condiciones higiénicas y los modernos asociados a un desarrollo rápido e insostenible como las enfermedades emergentes y re-emergentes, incluidos los trastornos de fondo inmunológico y el cáncer. La investigación para la resolución de estos problemas con impacto en la salud pública del país que puedan provenir del medio ambiente, deben ser prioritarios. En este contexto la infección de personas con la bacteria Helicobacter pylori se considera un problema de salud pública muy importante porque: La prevalencia de infección del microorganismo en el mundo es alta, y más en los países de origen tropical, asociados a un ingreso per capita bajo. Se ha considerado su erradicación bastante difícil, la re-infección es alta, el tratamiento costoso y de amplios efectos secundarios, la vacuna todavía no está disponible. En el mundo se le relaciona como la principal causa de gastritis crónica, úlceras pépticas y el principal factor de riesgo para el desarrollo de cáncer gástrico, incluyendo atrofia gástrica, metaplasia intestinal, cáncer gástrico como linfoma MALT de células B, y otras patologías extra gástricas directamente relacionadas En Costa Rica se le relaciona con gastritis, úlcera duodenal, gastritis atrófica con probabilidades de transformarse en cáncer gástrico especialmente en adenocarcinoma de tipo intestinal (Sierra, 2002); con mayor incidencia en las personas si viven en la parte central, en las provincias de Cartago y San José. A la fecha no se ha dado a conocer de forma definitiva el mecanismo epidemiológico de adquisición poblacional de la bacteria. Al no tenerse claridad al respecto, no se han establecido medidas adecuadas de prevención, ni en las personas ni en la salud pública en general, mucho menos acciones necesarias que conlleven el abordaje integral del problema. 1- Marco teórico Filogenéticamente Helicobacter pylori pertenece a las Proteobacterias, es de forma espiralar, Gram negativa, con un diámetro celular de 0,5 µm a 1 µm y con penacho de flagelos polares. H. pylori se descubrió en 1982, hace casi 25 años. Los médicos Barry Marshall y Robin Warren de Perth, Australia, observaron por primera vez la bacteria en biopsias de estómago proveniente de un paciente con gastritis crónica activa. En reconocimiento a su descubrimiento fueron galardonados con el Premio Nobel 2005 en Medicina y Fisiología. En 1994 se efectuó una “Conferencia Consensus” por los Institutos Nacionales de Salud del mundo, donde H. pylori fue declarado la principal causa de úlcera péptica y en este mismo año la Agencia Internacional para la Investigación del Cáncer (IARC) de la Organización Mundial de la Salud, declara a H. pylori como un cancerígeno en humanos, ubicado en el grupo I (se cuenta con pruebas suficientes que confirman que puede causar cáncer a los humanos). 1.1 Epidemiología de la infección La presencia de la bacteria, por lo general, puede pasar inadvertida en toda la vida del hospedero y los primeros síntomas generalmente tardan mucho tiempo en evidenciarse (Brown, 2000), lo que implica que los episodios de transmisión pueden pasan inadvertidos. Otro aspecto que dificulta el seguimiento de la adquisición y su abordaje epidemiológico es que el aislamiento y el cultivo de H. pylori es relativamente difícil comparado con otras bacterias de importancia clínica. La bacteria puede ser adquirida en la infancia, y por la edad de 10 años, más del 50% de los niños en todo el mundo han estado en contacto con el microorganismo (Pounder, 1995), sin embargo, algunas investigaciones han sugerido que las infecciones transitorias pueden producirse e incluso ser muy comunes (Goodman, 2005; Haggerty, 2005), pero la importancia de estos resultados es todavía objeto de controversia debido a la especificidad y sensibilidad de las pruebas utilizadas (Perry, 2005; Nugalieva, 2006). Evidencia reciente prueba también que múltiples cepas de H. pylori y de otras especies de Helicobacter son capaces de infectar simultáneamente el tracto gastrointestinal de un individuo (Van den Bulk, 2005; Fritz, 2006; Ghose, 2005; Azevedo, 2007). Ahora se acepta que hay constantes exposiciones a la infección, pero ha sido considerado que el equilibrio entre el hospedero y la bacteria tiende a favorecer al hospedero. Basado en evidencia epidemiológica y microbiológica varias vías de transmisión han sido propuestas. La transmisión de persona a persona de la bacteria es la vía que se ha contemplado como la ruta más probable de infección, principalmente a causa de la deficiencia de aislar la bacteria de otros sitios, como por ejemplo el medio ambiente y del tracto gastrointestinal de los seres humanos . Varios estudios epidemiológicos han identificado el hacinamiento de los miembros de la familia como un factor de riesgo para la transmisión de H. pylori; así mismo se ha encontrado entre aislamientos obtenidos de miembros infectados de la misma familia una alta homología del genoma bacteriano (Ma, 1998). Se ha observado diferencias significativas en la incidencia entre niños de una misma familia donde todos sus miembros se encuentran infectados, con respecto a niños cuyos miembros familiares no están infectados (Miyaji, 2000; Rothenbacher, 1999). El riesgo relativo es de aproximadamente ocho veces mayor si la madre está infectada y cuatro veces mayor si es el padre el infectado (Rothenbacher, 1999). Aunque estos estudios apoyan la hipótesis de transmisión de persona a persona, la exposición de una familia a una fuente común alternativa sigue siendo una posibilidad. La mayoría de las vías de transmisión entre personas abarcan las rutas gastrooral, oral-oral y fecal-oral (Azevedo, 2007). En años recientes han sido sugeridas otras vías para transmitir la bacteria en forma viable: el agua, los alimentos, y los animales. Numerosos autores coinciden en que la importancia relativa de estas rutas en la transmisión de la bacteria varía en importancia entre países desarrollados y en vías de desarrollo (Perez, 2004; Megraud, 2003). El género Helicobacter incluye al menos 26 especies. El tropismo del género varía desde el estómago, el ciego y el colon hasta el hígado o el tracto genital de los mamíferos y aves (Dewhirst, 2005). Helicobacter comprende un grupo diverso de agentes patógenos potencialmente emergentes en múltiples especies incluyendo humanos, primates, gatos, perros, hurones, cerdos, ovejas, vacas, aves silvestres, pollos, ratones, ratas, hámsteres, jerbos, y una variedad de se dice que casi todo animal es colonizado por su propia especie endógena de Helicobacter (Dewhirst, 2005). Según los aportes de Azevedo, con los criterios emergentes y la aparición de cepas múltiples infectando a un mismo hospedero, debería tomar más importancia el poder considerar a H. pylori como un agente zoonótico (Azevedo, 2007). animales salvajes, incluyendo delfines, ballenas y focas No obstante varios estudios epidemiológicos muestran resultados controversiales en lo que respecta al riesgo de la presencia de animales domésticos en el hogar (Bode, 1998; Kearney, 2002). H. pylori no se ha encontrado en perros y muy raramente en estómagos de gatos (El Zaatari, 1997; Neiger, 2000), y se ha sugerido que la presencia de la especie H. pylori en los animales es de origen humano (El Zaatari, 1997; Cittelly, 2002). Desde un punto de vista integral las vías de transmisión propuestas a la fecha se resumen bajo la figura 1. Figura 1 Vías de transmisión propuestas para H pylori (Montero, 2009). 1.2 Mecanismos de acción y variaciones genéticas H. pylori se ha encontrado en el estómago de más de la mitad de la población humana en el mundo, y representa la principal causa biológica de la patología gastroduodenal (Mitchell, 2001). Sin embargo, a lo largo de su vida, sólo entre el 10% y el 20% de los pacientes infectados desarrollan enfermedades graves, como úlcera péptica, cáncer gástrico y linfoma. Este hecho sugiere que el tipo de inmunidad innata y adquirida como respuesta a H. pylori puede representar un importante factor que puede influir en el resultado de la la infección hacia la protección o la patología (Milco, 2007). La mucosa gástrica está protegida contra infecciones bacterianas y H. pylori está muy bien adaptado a este nicho ecológico, con una gama única de características que le permiten la entrada en el moco gástrico, la movilidad y la orientación espacial, la adherencia a las células epiteliales, la evasión de la respuesta inmune y como consecuencia persistencia en la colonización y la transmisión (Suerbaum, 2002). Después de ser ingerida la bacteria debe eludir la actividad bactericida del contenido gástrico y penetrar en la capa mucosa. La producción de la enzima ureasa y la movilidad son esenciales para este primer paso de la infección. La ureasa hidroliza la urea existente en dióxido de carbono y amoníaco, permitiendo así a H. pylori sobrevivir en un medio ácido (figura 2). La actividad enzimática de la ureasa está regulada por la afluencia de urea a través de un canal, el UreI, el cual está abierto a pH bajo y cerrado en condiciones de pH neutro (Weeks, 2000). Figura 2. Acción de la ureasa. H. pylori degrada la urea a amoniaco y dióxido de carbono mecanismo que le permite mantener un medio alcalino a su alrededor. Tomada de Programa, 2002. Entre los hallazgos más notables de la infección por H. pylori, producto de proyectos de secuenciación del genoma, se encuentra el descubrimiento de varios genes que pueden ser activados y desactivados provocando deslizamiento y desapareamiento de las bases complementarias mediando mutagénesis (Suerbaum, 2002). Las proteínas codificadas por esos genes de fase variable incluyen enzimas que modifican la estructura antigénica de las moléculas de superficie, el control de la entrada de ADN extraño en las bacterias, y la influencia de la movilidad bacteriana. El genoma de H. pylori cambia continuamente durante la colonización crónica de una persona acogiendo la importación de pequeños trozos de ADN exógeno de otras cepas durante infecciones mixtas, en colonizaciones persistentes o transitorias (Falush, 2001; Suerbaum, 2002). La mayoría de las cepas de Helicobacter pylori se encuentran en la capa mucosa que recubre el epitelio gástrico, sin embargo se ha informado que puede interactuar con las células epiteliales gástricas e incluso las puede invadir (Graham, 2007). Se ha reportado recientemente la capacidad para formar biofilmes maduros en biopsias de mucosa gástrica humana, cubriendo casi toda la superficie de la mucosa en pacientes ureasa-positivos (Coticchia, 2006). A finales de la década de 1980 se descubrió que algunas cepas de H pylori provocaban la formación de enormes vacuolas en células epiteliales de cultivo, encontrándose que el agente activo era una toxina llamada VacA codificada por un gen VacA, que además desactiva los glóbulos blancos que luchan contra las infecciones estomacales aplacando así la respuesta inmunitaria del hospedero. La mayoría de las cepas la expresan, ella se inserta dentro de la membrana de las células epiteliales y forma un canal anión selectivo, a través del cual libera bicarbonato y aniones orgánicos, tiene como blanco la membrana mitocondrial, donde se produce la liberación de citocromo c, e induce la apoptosis (Galmiche, 2000). Se han descrito cuatro variantes principales de VacA: dos de ellas (m1 y m2) localizadas en la región central del gen, y otras dos (s1 y s2) en la región que codifica la secuencia de la señal de la proteína que le permite ser secretada por la bacteria. Estudios posteriores demostraron que la variante s1 se divide a su vez en al menos los subtipos s1a, s1b y s1c (Suerbaum, 2002). Las cepas de H pylori portadoras de las variantes m1 y s1 sintetizan la versión más tóxica de VacA y guardan relación con un mayor riesgo de contraer cáncer de estómago (Miehlke, 2000). La mayoría de cepas de H. pylori que causan enfermedad (las llamadas cepas de tipo I) contienen la isla de patogenicidad Cag, (Cag-PAI), una región cromosómica con cerca de 37.000 pares de bases y 29 genes (figura 3). La mayoría de los genes cag están probablemente implicados en el montaje de la maquinaria de secreción tipo IV que traslada la proteína CagA al citoplasma de las células epiteliales gástricas del hospedero, una vez en el interior de la célula, determinadas enzimas del hospedero modifican la estructura química del CagA, facilitando su interacción con proteínas humanas (Blazer, 2005). Figura 3 Isla de patogenicidad cag-PAI (Suerbaum, 2002). A diferencia de cagA, vacA está presente en todas las cepas de H pylori, sin embargo puesto que la secuencia del gen varía de forma notable, solo algunas cepas producen una toxina totalmente activa. Por lo tanto las cepas que incluyen vacA (m1 y s1) y cagA en su genotipo están implicadas en un mayor riesgo de producción de cáncer gástrico (Blazer, 2005). H. pylori causa inflamación gástrica continua con diferente severidad en casi todas las personas infectadas. Esta respuesta inflamatoria inicial consiste en el reclutamiento de neutrófilos, seguidos por los linfocitos T y B, células plasmáticas y macrófagos, lo que provoca daño a las células epiteliales (figura 4). Una vez que H. pylori invade la mucosa gástrica, la respuesta del hospedero se desencadena principalmente por la adhesión de las bacterias a las células epiteliales. El patógeno puede obligar al Complejo Mayor de Histocompatibilidad tipo II (MHC) que son moléculas en la superficie del epitelio gástrico a inducir su apoptosis. Entonces nuevos cambios en las células epiteliales dependen de las proteínas codificadas en el cag-PAI y de la translocación de CagA en las células, la producción de ureasa también puede contribuir a la extravasación y la quimiotaxis de neutrófilos. Figura 4 Reclutamiento de neutrófilos y linfocitos T y B (modificado de Blazer, 2005). La infección por H. pylori cursa en todos los casos con un abundante infiltrado inflamatorio, en el que predominan los neutrófilos; estas células liberan grandes cantidades de mediadores, como el leucotrieno B4. Por su parte, los monocitos activados producen interleucina-1, factores de crecimiento celular y radicales libres de oxígeno (ROS), moléculas que ocasionan daño tisular, el cual viene a sumarse al inducido por la toxina vacuolizante secretada (figura 5). Figura 5 Fisiopatogenia de la enfermedad úlcero péptica asociada a la infección por H. pylori. Tomada de Programa, 2002. Otros componentes bacterianos hacen más severo el daño a la mucosa y debilitan los mecanismos protectores; la lipasa y la fosfolipasa A producidas por H. pylori no sólo degradan los lípidos del moco, haciéndolo menos viscoso, sino que lesionan las membranas celulares. A medida que el proceso avanza, la inflamación es más significativa y como resultado del daño tisular, disminuye la producción de moco y bicarbonato, con lo que la mucosa se vuelve más susceptible a la acción del ácido y la pepsina. De esta forma se establece una gastritis crónica activa superficial y como resultado de la agresión ácida y la acción catalítica de la pepsina, sumadas a los efectos citotóxicos de los mediadores inflamatorios y las sustancias bacterianas ya mencionadas, ocurre la ulceración de la mucosa (Programa, 2002) Además de los factores antes mencionados que le proporcionan patogenicidad a cepas específicas de H. pyori como cagA y vacA (m1 y s1) se pueden citar el lipopolisacárido de superficie (LPS), la producción de ureasa, los flagelos y las adhesinas de superficie. A la vez, la presencia de ciertos factores demuestran un aumento en la agresividad de ciertas cepas como por ejemplo el gen asociado a la adhesina de superficie babA2 (que codifica una proteína de membrana que se une al grupo antigénico sanguíneo de Lewis B de la célula epitelial o del eritrocito, el cual es relevante para la infección); el gen iceA con sus dos variantes alélicas iceA1 e iceA2 (inducido por contacto con el epitelio, se relaciona con incidencia de úlcera péptica e infiltración neutrofílica aguda) (Kidd, 2001) especialmente la variante iceA1. En este sentido personas infectadas por cepas que co-expresan los genes cagA, vacA, y babA2, presentan un riesgo mayor que las personas infectadas por cepas que expresan solamente uno de estos genes (Zambon, 2003). El factor sanguíneo de Lewis B, según estudios de León, Marín y Morales está presente en un 72.4% de la población costarricense (León, 1999). Se sugiere también que la respuesta inflamatoria del paciente puede estar influenciada por el factor ABO, asociado con úlcera péptica e infiltración inflamatoria (Henegha, 2000). A H. pylori se le relaciona también con la inhibición de la proteína protectora de membranas HSP 70, la cual se produce en respuesta al estrés por cambios ambientales agresores como calor, isquemia, presencia de metales pesados, etanol, toxinas, agentes oxidantes y diversas infecciones por bacterias y virus (Targosz, 2006). Con respecto a los factores que influencian la relación hospedero-parásito y la predisposición genética de las personas, se sabe que cuando H. pylori invade la mucosa gástrica, la respuesta del anfitrión es accionada sobre todo por el acceso de bacterias a las células epiteliales. La infección induce a una gran respuesta humoral sistémica en la mucosa, donde esta producción de anticuerpos no solo no conduce a la eliminación de la infección, sino que además contribuye al daño del tejido gástrico, y por lo tanto tiene un papel integral en la patogenia, resultando en una gran producción de interleucinas y otras quimosinas que producen efectos en cascada. Solamente a manera de cita: interleuquina-8, el péptido 78 activador derivado de neutrófilos en células epiteliales (ENA-78) y el oncogene (GRO- ), el factor nuclear - B (NF- B), un factor activador de transcripción de proteína de respuesta temprana 1 (AP-1), adresinas vasculares tales como la célula de adhesión vascular (VCAM-1) y la molécula de adhesión intercelular 1 (ICAM-1) que son requeridas para la extravasación del linfocito. La citotoxina VacA y el factor de necrosis tumoral alfa (TNF-α) conducen a la ruptura de la barrera epitelial, lo que facilita la translocación de los antígenos bacterianos y conduce a la activación de más macrófagos. Las citoquinas producidas por los macrófagos también pueden alterar la secreción de moco, lo que contribuye a la interrupción de la capa mucosa por H. pylori. La figura 6 contempla el despliegue celular que provoca la bacteria en el hospedero (Sueberbaum, 2002). Figura 6 Células que intervienen en el reclutamiento celular en infecciones crónicas por H pylori (Suerbaum, 2002). Las células T cooperadoras (Th0, Th1, Th2), responden con una respuesta parcial a H pylori (figura 7), además las citoquinas tipo Th1 tal como interferon- (INF- ) promueven la gastritis, y pueden favorecer la persistencia de H. pylori (Suerbaum, 2002, Bergman, 2006). En términos generales las citoquinas cuando atraen a los neutrófilos median el daño al tejido gástrico por medio de la dispersión de compuestos de oxígeno (ROS) y nitrógeno (RNS) muy reactivos; estos superóxidos y los radicales del oxidrilo dañan los lípidos, las proteínas y el DNA por oxidación. Figura 7 Interacción celular de linfocitos T e interleucinas. (Bergman, 2006) Con respecto a la variación y al intercambio genético H. pylori exhibe una diversidad genética apreciable, característica que ya ha sido evidenciada en muchos trabajos donde se demuestra la variación en el orden genético entre cepas, diferencias en el contenido genético entre cepas, la naturaleza de algunos genes, y la diversidad de secuencias dentro de algunos genes conservados. H. pylori posee una estructura poblacional recombinante o panmítica, lo que indica el intercambio genético frecuente (Israel, 2001). Existe evidencia que la recombinación en H. pylori puede ocurrir in vivo durante la infección. Se sugiere que el intercambio genético horizontal en H. pylori ocurre mediante los tres mecanismos clásicos: transformación natural, conjugación y transducción (Israel, 2001). 1.3 H. pylori y su necesidad fisiológica de cationes. El citoplasma de las bacterias Gram negativas está rodeado por dos membranas, una interna que es la membrana citoplasmática y otra externa, los metales transportados al citoplasma deben cruzar ambas membranas, ellos participan en una gran variedad de procesos celulares y son esenciales para el crecimiento de las bacterias. El hierro es necesario para el crecimiento de casi todos los patógenos, pero H pylori contiene relativamente pocos sistemas de transporte de iones (con respecto a otras bacterias), excepto para el níquel y el hierro. Estos dos metales pueden ser transportados por dos o más sistemas, indicando su importancia fisiológica (NCBI, 2001). Los iones de hierro soluble (Fe2+) deben ser disponibles para que la bacteria los ingiera, pero estos iones solo son estables bajo condiciones anaeróbicas y ácidas, porque la presencia de oxígeno causa una rápida conversión al estado férrico (Fe3+), el cual es casi completamente insoluble a pH 7. En los tejidos humanos la concentración de hierro libre es muy baja para soportar el crecimiento; ya que la mayor parte del hierro es acomplejado en la hemoglobina o quelado por la transferrina en el suero o por la lactoferrina en la superficie de la mucosa. Como el hierro acomplejado es una molécula muy grande para ser transportada por las porinas de la membrana externa, este transporte requiere en H pylori de receptores de sistemas altamente afines y específicos (Braun, 1998; Braun, 1999). En una infección activa H. pylori adquiere el hierro necesario de su anfitrión y puede activamente contribuir a la anemia en algunos pacientes (Byung, 2004; Cardenas, 2006), incluso se ha visto la baja respuesta de niños infectados con H pylori a la terapia de suplementación con hierro (Mahalanabis, 2006) y la predisposición materna a la anemia (Yang, 2005). Otro de los metales importantes en la fisiología de H pylori es el zinc, el cual lo utiliza como coenzima de la metaloenzima alcohol deshidrogenasa con expresión en la membrana externa de la bacteria, la cual está involucrada en proteólisis de células del hospedero y de esta forma contribuir a la severidad de la patología gástrica (Windle, 2007). Una evidencia más a favor del zinc constituye el estudio efectuado por Sempértegui y colaboradores (Sempértegui, 2007) quienes concluyen que luego de estudiar concentraciones de zinc de la mucosa gástrica de pacientes con gastritis crónica no atrófica, se determinó que las personas con alta concentración de infiltración de polimorfonucleares tenían menores concentraciones del metal en la mucosa y viceversa, sugiriendo el hecho del papel de la bacteria de obtener el zinc del paciente para la inducción de proteólisis celular, la inflamación y la patología gástrica que induce (Sempértegui, 2007). También H. pylori tiene una alta demanda de níquel como cofactor para su enzima ureasa, de hecho lo tiene en su núcleo central, esto representa alrededor del 10% del total de proteínas celulares (Wolfram, 2009). El primer transportador de níquel identificado en H. pylori fue la proteína NixA, sin embargo se ha demostrado que la bacteria tiene sistemas transportadores alternos de este metal indicando su importancia bioquímica (Fulkerson, 2000). El níquel es reconocido en el cuerpo humano como uno de los elementos ultra traza (la concentración de este catión en el suero humano es muy baja de 2 a 11 nM). La función del níquel como oligoelemento no se ha definido claramente; sin embargo la mayor parte del níquel ingerido procedente de la dieta permanece libre en la luz del aparato gastrointestinal. Los mecanismos involucrados en el transporte del níquel a través de la pared intestinal no son claros, pero se supone que el paso a través del epitelio mucoso requiere de energía y no se lleva a cabo por simple difusión ya que los iones de níquel utilizan el sistema de transporte de hierro ubicado en la región proximal del intestino delgado (Melo, 2007). Puede ser por esta razón que la libre oferta del níquel en el aparato gastrointestinal, determine a éste como un órgano blanco para que H. pylori se establezca aquí una vez que es ingerida. La necesidad de elementos químicos específicos en el crecimiento y desarrollo de H. pylori podría explicar la preferencia de este microorganismo en el ambiente, como se expondrá más adelante. 1.4 Patologías extra gástricas relacionadas. Recientemente a H. pylori se le ha involucrado en diversas patologías extragástricas. Se sugiere en términos generales que estas patologías están relacionadas con la patogénesis de enfermedades cardiovasculares (Kanbay, 2005-Peter, 2006), hipertensión (Migneco, 2003) y desórdenes hematológicos (Kaptan, 2006). También se ha descrito su posible papel en la génesis de enfermedades de origen autoinmune tales como anemia perniciosa (Tsang, 1999, Presotto, 2003) y pólipos del colon (Taiji, 2004). Se cuenta con hallazgos preliminares en púrpura trombocitopénica idiopática (PTI) (Takechi, 2006, Franchini, 2006), se ha aislado de la mucosa intestinal en pacientes con enfermedad de Crohn con respecto al grupo control (Oliveira, 2006), y en tiroiditis de Hashimoto (Letter, 2004). Además se ha visto asociación entre infección crónica por H. pylori y resistencia a la insulina (Aydemir,2005; Ojetti, 2005), se ha advertido su presencia como posible cofactor de riesgo en carcinoma hepatocelular (Ojetti, 2006), y se cuenta con asociación entre la infección por H. pylori y cirrosis en pacientes con virus de hepatitis C (Queiroz, 2006). Durante investigaciones de la flora bacteriana intestinal relacionada con cáncer de colon en un modelo de ratón APC / Mim mouse, Rao y colaboradores encontraron que la administración orogástrica de especies murinas intestinales de Helicobacter hepaticus, no sólo aumentaron el número de tumores intestinales, sino también los cánceres de mama en cepas sensibles de ratones hembras (Rao, 2006). Demostraron que era dependiente de TNF-α y la ausencia de un subgrupo específico de células T reguladoras. Estos experimentos intrigantes llevaron a los autores a postular que la infección microbiana gastrointestinal por especies de Helicobacter y organismos afines podría alterar la regulación sistémica de la respuesta inmune, dando lugar a casos de cáncer en sitios no anatómicamente relacionados, como la mama. 1.5 Prevalencia de la infección por H pylori y su distribución geográfica mundial La presencia de H. pylori en las personas ocurre en todo el mundo, pero se han encontrado diferencias significativas en la prevalencia tanto entre países como dentro de un país (Mitchell, 2001). La prevalencia global es superior en los países de las regiones económicamente subdesarrolladas, como África y Asia, que en los países más desarrollados como los del oeste de Europa y América del Norte (figura 8). Figura 8. Prevalencia de la infección por Helicobacter pylori. La infección correlaciona con el status socioeconómico (Efstrom,1997) Además según los epidemiólogos H. pylori ha ido desapareciendo de los países desarrollados a lo largo de los últimos 100 años merced a una mayor higiene que bloquea la transmisión de la bacteria ( Blazer 2005). Figura 9. Descenso en la incidencia de cáncer de estómago y colonización por H pylori en Estados Unidos. Tomada de Blazer, 2005. Entonces la situación socioeconómica se considera claramente como uno de los factores determinantes más importante para el desarrollo de la infección. Estos factores incluyen condiciones tales como higiene, densidad de población, saneamiento ambiental y oportunidades educativas, los cuales han sido identificados individualmente como marcadores de presencia de la bacteria en una población dada (Azevedo, 2007). En cuanto a estas variaciones geográficas en la prevalencia de la infección dentro de un país, no queda claro si son el resultado de factores genéticos de las diferentes poblaciones o el resultado de los diferentes factores ambientales y socioeconómicos que interactúan en estas poblaciones y grupos étnicos diferentes. Se encuentran trabajos que sugieren que los factores ambientales, más que los factores genéticos, tienen un papel significativo en la prevalencia de la infección (Bani-Hani, 2005). El conocimiento sobre la diversidad génica de H. pylori se ha aplicado al estudio de variación geográfica de las distintas cepas, las variantes del gen VacA tendían a agruparse en determinadas regiones geográficas: las cepas s1c predominaban en el este de Asia, s1a en Europa septentrional y s1b en el área mediterránea (Blazer, 2005). Los estudios en Ibero América describen que la cepa s1b es la más común, lo que sugiere que fue introducida en América por colonos españoles o portugueses o por esclavos africanos. Sin embargo, estudios posteriores efectuados en poblaciones indígenas de la Amazonia revelaron que el genotipo s1c predominaba al este de Asia sugiriendo que H pylori fue introducida en América a través del estrecho de Bering por los antepasados de los amerindios actuales, considerándose que la bacteria ha estado presente entre los humanos durante al menos 11.000 años (Blazer, 2005). Investigaciones del Instituto Max Planck de Biología de las Infecciones de Berlín demuestran asocio con cepas modernas de H. pylori y que pueden proceder de cinco poblaciones ancestrales: se sugiere dos surgidas en Africa, dos en Eurasia Central u Occidental y una en el este de Asia ( Blazer, 2005), tal y como se muestra en la figura 10. Figura10. Distribución geográfica mundial de cepas de H pylori (Blazer, 2005) Lo anterior implica que en la colonización por H pylori en el mundo convergen varios factores que determinan, además de la presencia u origen natural, condiciones ambientales y condiciones socioeconómicas que podrían intervenir en la severidad de una infección para una población dada. En un estudio conducido por Naylor y colaboradores (Naylor, 2006) comparando la histología gástrica de pacientes en Japón y el Reino Unido, se encontró que los estómagos de japoneses tenían gastritis más severas y extensivas, con un número mayor de células inflamatorias y un mayor riesgo de progresión hacia la atrofia y metaplasia intestinal. Alrededor del 90% de los casos de gastritis de ambos países fueron relacionados con infección por H. pylori; pero cepas cagA positivas fueron más comunes en japoneses que en pacientes del Reino Unido. 1.6 Cáncer gástrico y factores predisponentes. Actualmente en el mundo no son muchos los factores reconocidos asociados directamente al aumento en el riesgo de cáncer de estómago. Según la Sociedad Americana de Cáncer (Cancer, 2006-2008) son reconocidos: Las dietas ricas en alimentos ahumados, pescado o carne salada: la alta ingesta de sal aumenta la efectividad de carcinógenos como la N-metil-Nnitrosoguanidina y se estimula la replicación celular; así como la ingesta a largo plazo de elevadas concentraciones de nitratos en alimentos secos, ahumados y salados; por acción de las bacterias los nitratos se convierten en nitritos y estos en nitrosaminas/ nitrosamidas de reconocida capacidad mutagénica y carcinogénica (esto se da de acuerdo con el mecanismo presentado en la figura 11). El bajo consumo de frutas y hortalizas: por el contenido en betacarotenos, tocoferoles y vitaminas C y E porque contribuyen a la neutralización de nitritos y la reducción de la concentración de N-nitrosaminas y radicales libres. La infección de largo plazo por H. pylori. Estos factores interaccionan directamente con el hábito del fumado (Hamajima, 2006) . Estos carcinógenos disminuyen los niveles de carotenoides y vitamina C en plasma, además el tabaco presenta carcinógenos de tipo promotor o carcinógenos completos tales como la nitrosopirrolidina, las nitrosaminas y las nitrosamidas, entre otros, cuya formación tiene lugar en el jugo gástrico, (ver figura 11). Figura 11. Proceso de formación de compuestos nitrosos en el jugo gástrico (Curso 2007). Estos factores han sido asociados además de biológica y toxicológicamente, por medio de estudios de largo plazo y en poblaciones de alta incidencia. Desde el punto de vista epidemiológico el desarrollo del cáncer con relación a la infección por H. pylori se relaciona en las personas con: Infección desde edades tempranas Infección con cepas agresivas de alto riesgo Historia familiar de cáncer gástrico, Susceptibilidad genética de la población (polimofismos de interleucinas) Bajo nivel socioeconómico. En diferentes partes del mundo las poblaciones migrantes de alto riesgo muestran una marcada disminución de este riesgo, cuando se trasladan a una zona reconocida de riesgo menor, aunque esto es muy gradual, parece depender de la edad a la cual se migra. Se ha visto que las partes centrales de un país tienen diferencias significativas con respecto a las costas como sucede por ejemplo en Colombia, Costa Rica y Chile (Curso Toxicología, 2007). También se da que en un país dado, la incidencia es menor en las grandes ciudades que en las áreas rurales, y más frecuente entre personas de nivel socioeconómico bajo, que en personas de clase profesional (Curso Toxicología, 2007), lo que sugiere que podría deberse fundamentalmente a diferentes exposiciones a factores ambientales determinados. Hasta hace poco, en el mundo el cáncer de estómago ocupaba el segundo lugar en incidencia; para el año 2002 ocupa el cuarto lugar, detrás del cáncer de pulmón, mama y colon. No obstante es la segunda causa de muerte por cáncer en el mundo 700.000 muertes al año (Ortiz, 2005). Entonces de acuerdo con el nivel de desarrollo, los valores de incidencia y mortalidad de cáncer gástrico en distintas partes del mundo evidencian un problema sumamente heterogéneo. En la figura 12 se muestran los casos en hombres pertenecientes a países en vías de desarrollo y los países desarrollados. Fuente: Global Cancer Statistics, 2002 Figura 12 Casos de incidencia y mortalidad de cáncer en hombres en países desarrollados y en vías de desarrollo Una característica notable del cáncer gástrico en el mundo es que resulta significativamente más alta en hombres que en mujeres (aproximadamente 2:1), en la mayoría de los países en los que esto no sucede la incidencia de cáncer de estómago es baja (figura 13). Fuente: Global Cancer Statistics, 2002 Figura 13. Tasa de incidencia de cáncer gástrico por sexo-edad estandarizada por 100.000 habitantes. La sobrevivencia para el cáncer de estómago es moderadamente buena sólo en Japón (52%). La sobrevivencia es también relativamente alta en América del Norte (21% sobre la base de los datos). En el resto de los países sigue siendo un problema (Global, 2007). La figura 14 muestra el panorama mundial. Fuente: Globocan, 2002 Figura 14.Variación internacional de incidencia para cáncer de estómago en hombres (arriba) y mujeres (abajo). Costa Rica de 1983 a 1997 registró uno de los mayores grados de mortalidad por cáncer gástrico en el mundo de 30 países, incluidos Japón y China (Kuroishi, 2004), como se muestra en la figura 15. Esto también se observó desde que el Registro Nacional de Tumores inicia la recolección de datos en la década de 1990 (figura 16 y 17). Fuente: Globocan IARC, Lyon, Francia, 1998. Figura 15 Tasas de incidencia y mortalidad de cáncer de estómago, por 100,000 hombres, ajustadas por edad, según país en 1990. Datos Globocan 1998. Figura 16 Tendencia de las tasas de incidencia del cáncer de estómago, según sexo, Costa Rica, 1992-1996. Fuente: Unidad de estadística del Registro Nacional de Tumores. Figura 17 Tasa de incidencia de cáncer de estómago, por 100,000 habitantes, según provincia, Costa Rica, 1994-1996. En las figuras 18, 19 y 20 se muestra como solo la mortalidad ha bajado de manera franca. No obstante se sigue considerando a Costa Rica como uno de los países con mayor incidencia y mortalidad por cáncer gástrico en el mundo (Global, 2007). En la incidencia nacional el cáncer gástrico ocupa el tercer lugar detrás de próstata y piel según lo mostrado en la figura 19 (Ortiz, 2005). Nótese que del año 1990 al año 2000 no se nota un descenso en la incidencia, no obstante para el año 2003, que son las últimas estadísticas actualmente disponibles, se observa un repunte de las tasas lo que podría sugerir que los factores implícitos aun se mantienen, o están empeorando, según lo mostrado en la figura 20. Fuente: Unidad de estadística del Registro Nacional de Tumores. Figura 18 Mortalidad por tumores malignos más frecuentes en hombres. Tasa ajustada por 100 000 hombres. Costa Rica. 1990-2003 (Ortiz, 2005). Fuente: Unidad de estadística del Registro Nacional de Tumores. Figura 19 Incidencia por tumores malignos más frecuentes en hombres, tasas ajustada por 100 000 hab Costa Rica. 1990-2000 (Ortiz, 2005). Fuente: Unidad de estadística del Registro Nacional de Tumores. Figura 20 Tendencia de la incidencia y mortalidad por cáncer gástrico según sexo Costa Rica, 1995-2005* tasas ajustadas por 100.000 hab (Vargas, 2007). Desde los inicios de la investigación del cáncer de estómago en Costa Rica por el Dr. Salas del Hospital San Juan de Dios por la década de 1970 y luego por la MSc Rafaela Sierra en los años ochenta (Sierra, 1983), se ha mantenido la misma tendencia de distribución geográfica con respecto a alta y baja incidencia, según se puede comparar en las figuras 21, 22 y 23. Figura 21. Distribución de las tasa de incidencia de cáncer gástrico en Costa Rica según Sierra et al 1983. Figura 22. Distribución de las tasas de incidencia por cantón ajustadas por 100 000 habitantes, según estadísticas del Registro Nacional de Tumores para el período 1990-1999. En la figura 23 se presenta la tasa de incidencia para cáncer gástrico con las estadísticas más recientes disponibles al periodo 1995- 2003 (Ortiz, 2005). Figura 23. Distribución de las tasas de incidencia por cantón ajustadas por 100 000 habitantes según estadísticas del Registro Nacional de Tumores para el periodo 1995-2003. El presente trabajo abordará esta tendencia y tratará basado en el conocimiento científico disponible, de proponer un abordaje integral al problema y probables soluciones de acuerdo con lo investigado. 1.7 Helicobacter pylori y cáncer gástrico La asociación entre la infección por Helicobacter pylori y el riesgo elevado de desarrollar cáncer gástrico está bien establecida en la actualidad (Bartchewsky, 2009; Cancer, 2006-2008; Cañas, 2009; Graham, 2007), aun así, en el mundo sólo una pequeña proporción de las personas infectadas lo desarrolla. En principio, la asociación entre H. pylori y cáncer gástrico puede ser explicada de forma general de acuerdo con un modelo de múltiples eventos de carcinogénesis gástrica como se muestra en la figura 24. Figura 24. Desarrollo del adenocarcinoma gástrico como proceso secuencial por H. pylori (Curso, 2007). La progresión hacia la atrofia depende, además de la presencia de la bacteria, de otros factores concomitantes, ambientales, y genéticos, considerándose un proceso multifactorial (Talley, 2008). El cáncer aparece a partir de la acumulación gradual de cambios genéticos resultantes de la pérdida de mecanismos de control celular como los que regulan la proliferación y la estabilidad del genoma. Durante la persistencia de largo plazo en el hospedero, la infección por Helicobacter pylori promueve estos eventos; por esta razón es que está considerado actualmente como el principal factor de riesgo para el desarrollo de cáncer gástrico; sin embargo los mecanismos por los cuales la infección aumenta el riesgo aún se investigan (Bartchewsky, 2009). La infección por H. pylori induce una inflamación activa y provoca la inflamación crónica que persiste en la mucosa gástrica. Los productos bacterianos y las especies reactivas de oxígeno (ROS) y de nitrógeno (RNS), liberados en el sitio de la inflamación pueden dañar el ADN y esto ha sido considerado como un posible mecanismo por el cual la infección puede llevar finalmente a la neoplasia (Hamajima, 2006; Siomek, 2006; Tunca, 2007; Olczak, 2005; Ohara, 2006; Peek, 2002; Wang, 2005). La extensión y la gravedad de la inflamación de la mucosa gástrica, así como la evolución clínica de la infección, dependerá de una serie de factores, incluyendo la susceptibilidad genética del hospedero y factores de virulencia de la bacteria (Matysiak, 2006). Los principales mecanismos moleculares que subyacen el desarrollo del cáncer gástrico en las personas inducido por H. pylori incluyen como resultado de mutaciones la sobre-regulación de varios genes como las citocinas, los oncogenes y los factores de crecimiento, y la des-regulación de genes supresores de tumores. Recientemente se ha propuesto que estas bacterias causan un deterioro de la reparación del ADN en el tejido gástrico, dando lugar a la acumulación de mutaciones y un desequilibrio genómico aumentando el riesgo de carcinoma gástrico (Park, 2005; Bartchewsky, 2009). El deterioro del sistema de reparación del ADN “DNA Mismatch Repair” (MMR) es conocido como una causa de carcinogénesis y progresión a tumor en ambos tipos de cáncer esporádicos y hereditarios. El sistema DNA MMR es importante para mantener la fidelidad genómica a través del reconocimiento y la reparación de nucleótidos emparejados incorrectamente, los cuales pueden originarse de nucleótidos de ADN dañado físicamente o errores de la ADN polimerasa (Bartchewsky, 2009). Deficiencias en este sistema resultan en tasas de mutación que son cien veces mayores que las observadas en células normales, lo que permite la acumulación de mutaciones en genes críticos reguladores. El sistema DNA MMR se compone de cinco genes principales MLH1, MSH2, PMS1, MSH3 y MSH6 donde todos son expresados en el ciclo celular. Algunos autores han demostrado que la expresión de MLH1 es esencial para la DNA MMR competente y el mantenimiento de la estabilidad de microsatélites (secuencias cortas y repetidas de ADN en diferente número que tenía el ADN cuando se heredó) (Bartchewsky, 2009). La 6-metilguanina ADN metiltransferasa (MGMT) es una enzima de reparación que elimina aductos mutagénicos y citotóxicos de 6-guanina en el ADN. La alquilación del ADN en la posición 6 de la guanina es un paso importante en la formación de las mutaciones en el cáncer. Así, la capacidad de una célula para resistir el daño está directamente relacionado con el número de moléculas que contiene MGMT y la velocidad de síntesis de novo de MGMT. La pérdida de expresión de MGMT puede aumentar la mutación del gen y podría conducir al desarrollo de cáncer gástrico (Bartchewsky, 2009), o sea lo que se reconoce actualmente como cambios epigenéticos. Touati y colaboradores (Touati, 2009), en trabajos similares también han demostrado la inducción de eventos genotóxicos como una propiedad común en cepas de H pylori derivadas de linfoma MALT en ensayos con ratones transgénicos (Big blue) dejando claro el rol de inestabilidad genética en la promoción a neoplasia gástrica durante la infección con la bacteria. En investigaciones conducidas por Bartchewsky y colaboradores (Bartchewsky, 2009), no encontraron ninguna asociación entre infección con las cepas más virulentas (cagA y vacA s1 m1) y los niveles de expresión de MLH1 ni MGMT. Estos hallazgos concuerdan con lo publicado ya por Kim y colaboradores (Kim, 2002), el cual demostraba que el status de CagA no está asociado con la alteración de la expresión MLH1 in vitro. La infección por H. pylori aumenta significativamente los niveles de MGMT y MLH1. La reducción en MLH1 y la pérdida de la expresión de MGMT en pacientes con cáncer gástrico podría ser explicada por la habilidad de H. pylori para promover metilación de genes por liberación de ROS y oxido nítrico y por la activación de DNA metilransferasas, esto sugiere que lo anterior no es un evento temprano en la asociación de H. pylori con carcinogénesis gástrica. Recientemente se ha encontrado la Proteína Inductora de Factor de Necrosis Tumoral- Alfa (Tipalpha), que se considera, es el único factor cancerígeno liberado por H. pylori, es alrededor de un 5-10% distinta entre distintas cepas de H. pylori. Tipalpha se une específicamente a las células y es incorporado al citosol y al núcleo e induce una fuerte expresión del TNF-α y genes de quimosinas: la IL-1β, e IL-8, aumenta la proliferación celular, la expresión del gen Bcl-2 y desregula el gen P53 mediante la activación del sistema NF-kappaB resultando en el desarrollo de un tumor (Zhonghua, 2008), El sistema NF-kappaB se encuentra en casi todos los tipos de células animales y está involucrada en la respuesta celular a estímulos como estrés, citoquinas, radicales libres, radiación ultravioleta y antígenos bacterianos y virales, desempeña un papel clave en la regulación de la respuesta inmunitaria a la infección. Por el contrario la desregulación se ha relacionado con cáncer, inflamación y enfermedades autoinmunes. Recientemente se le ha descrito una proteína receptora, la nucleolina en la superficie celular (Watanabe, 2010), que se ha considerado como un marcador de riesgo de la severidad de dosis- respuesta de lesiones pre-neoplásicas a cáncer gástrico (Cinghu, 2010). Las enfermedades gástricas asociadas con la infección por H. pylori se deben también a una inapropiada regulación de la respuesta inmune de las personas, donde la respuesta pro inflamatoria contribuye a la patogénesis del cáncer. Dentro del grupo de personas infectadas por H. pylori, las que presentan determinados polimorfismos del gen IL-1B, que codifica la citoquina inflamatoria interleucina-1β, tienen mayor riesgo de padecer lesiones precancerosas y cáncer gástrico. Estos polimorfismos en presencia de H. pylori causan sobreexpresión de la proteína IL1β, lo que produce una disminución significativa de las secreciones ácidas del estómago, que junto con la hipoclorhidria, crean un ambiente de riesgo de cáncer gástrico, permitiendo la acumulación de bacterias, sus toxinas y mediadores proinflamatorios incrementando el daño. En Costa Rica estudios de Wagner Alpízar dan cuenta de un grupo de una población de alto riesgo, donde se reportó por primera vez, la asociación significativa del polimorfismo IL-1β +3954 con el riesgo de desarrollar cáncer gástrico (Alpízar, 2005, 2009). 1.7.1 Infección por H. pylori y la carga mundial de cáncer gástrico La medida en la cual la infección crónica por Helicobacter pylori es responsable de la carga mundial de cáncer gástrico y linfoma no Hodgkin se revisó sobre la base de nuevos casos de cáncer registrados en 2002 (Parkin, 2002). En ese año casi el 20% de los cánceres se consideraron atribuibles a enfermedades infecciosas, con H. pylori como la causa principal (5,5% de todos los cánceres), seguido por los virus del papiloma humano, hepatitis viral B y C, virus de EpsteinBarr, el VIH y el virus herpes humano 8 (Graham, 2007). En el 2007, el Grupo de Estudio Europeo de Helicobacter confirmó que es el factor de riesgo más importante para adenocarcinomas gástricos no cardiales y linfoma de tejido linfoide asociado a la mucosa gástrica (MALT) (Graham, 2007). Por su parte la Asociación Americana de Cáncer estima que se le puede atribuir a H. pylori un 59% de los casos de cáncer en países en vías de desarrollo y un 63% de los casos en países desarrollados, la diferencia estriba en que se presenta mayor número de casos en países en vías de desarrollo (Global Cancer, 2007). Entonces H. pylori ha sido estimado ser el responsable de alrededor del 75% de cánceres gástricos no cardíales y linfomas gástricos no-Hodgkin, y el 65% de todos los cánceres de estómago en el mundo ( Graham, 2007). En cuanto a la erradicación de H. pylori y la prevención del cáncer gástrico se considera que a pesar de la acumulación de evidencia y aunque la erradicación de H. pylori podría ser relativamente fácil de lograr, el impacto de la carga global de cáncer gástrico será un reto mucho más difícil de alcanzar (Graham, 2007). La terapia de erradicación ha demostrado ser beneficiosa cuando se administra antes del desarrollo de la metaplasia intestinal, y es menos eficaz cuando se administra después. 1.8 Investigaciones en Costa Rica. Estudios de Darner Mora y colaboradores no encontraron correlación estadísticamente significativa entre niveles de nitratos en el agua de consumo de poblaciones y tasas de mortalidad por cáncer gástrico (Mora, 2006), no obstante la investigación careció de la demostración del vínculo indirecto con el consumo de nitratos (grupos 2A de IARC). Otras investigaciones de Rafaela Sierra y colaboradores mostraron que variaciones en las tasas de incidencia para cáncer gástrico poseían asociaciones estadísticamente significativas entre pH, potasio, zinc y hierro en el suelo (Sierra, 1983). Con respecto a Helicobacter pylori y cáncer gástrico en pacientes costarricenses, se cuenta con las investigaciones realizadas por Rafaela Sierra y colaboradores, Sergio Con y colaboradores y Alessandra Occhialini y colaboradores (Occhialini, 2000). Para efecto de abordar la temática propia de este trabajo se presenta lo estudiado por Sierra y Con. En el caso de Rafaela Sierra y colaboradores (Sierra, 1994), descubrieron que los niños y jóvenes de 7 a 20 años de edad, tanto de las regiones de alto como de bajo riesgo de cáncer gástrico se encontraban positivos en más del 60 %, así mismo, en una población dispéptica de un área de alto riesgo de la provincia de Cartago, se hallaron anticuerpos positivos contra la bacteria entre el 88% y el 92 % de pacientes adultos. Así mismo Con y colaboradores encontraron en pacientes que marcadores de virulencia séricos anti-CagA y factores como, VacA s1, VacA m1, grupo sanguíneo y polimorfismos en interleuquinas 1β, fueron significativamente más altos en regiones con alta incidencia de cáncer gástrico, con respecto a pacientes de zonas de baja incidencia, a pesar de que no existió diferencia significativa en la prevalencia de anticuerpos en los pacientes entre las regiones (Con, 2006). En otro estudio en población costarricense Con y colaboradores reportaron también que la presencia del gen cagA pareció asociarse al desarrollo de atrofia gástrica y tanto vacA s1 como vacA m1 presentaron asociación significativa con el desarrollo de cáncer gástrico en pacientes, reportando una prevalencia de CagA, VacA s1 y VacA m1 de 75,3%, 75,3% y 74,2% respectivamente (Con, 2007). En otra investigación Con y colaboradores (Con, 2009), mostraron que en pacientes con polimorfismos en interleucinas no presentaron asociación con la variabilidad en la incidencia de cáncer gástrico. Sin embargo, la atrofia gástrica, la metaplasia intestinal y las cepas con genotipos diferentes de vacA en el mismo estómago (infección por cepas mixtas) fueron más frecuentes en pacientes de zonas de alta incidencia de cáncer gástrico que en pacientes de zonas de baja incidencia y cagA, vacA s1b, estuvieron asociados en forma altamente significativa con alta incidencia de cáncer gástrico (P = 0,026 y 0,041, respectivamente), además fueron individualmente asociados con cáncer gástrico las interleucinas IL-1β+3954_T/C, IL-1RN*2/L y IL-10-592_C/A, y una combinación de estos polimorfismos de citocinas con H pylori vacA s1b y m1 incrementaron aun más el riesgo. Aunque un perfil genético de citoquinas proinflamatorias muestran un mayor riesgo para el desarrollo de GC, las características de la infección por H. pylori, en particular la situación de la distribución de los genotipos cagA y vacA parece jugar un papel más importante en la variabilidad de la alta incidencia del cáncer en Costa Rica. 1.9 El papel del agua de consumo humano en la transmisión de H. pylori. Se considera que el medio ambiente juega un rol preponderante en la adquisición de la infección. En el escenario de múltiples rutas, se estima que los seres humanos se ven inmersos en una serie de intentos de H. pylori del ambiente por colonizar la mucosa gástrica, reconociendo que se pueden conjugar tres factores: bajo número de la bacteria, baja actividad fisiológica y posiblemente reacción y resistencia humana a la mayoría de las cepas. De forma contraria, el éxito de la bacteria en la colonización y la infección de un individuo corresponderían a la susceptibilidad natural del hospedero con cepas que co-expresan factores de virulencia. Con el creciente control de parámetros del agua observados principalmente en los países desarrollados, la hipótesis de la transmisión hídrica explica la disminución de la colonización de las personas por H. pylori en estos países. Al reconocer la posibilidad de que H. pylori sea transmitida por el agua de consumo en la población, toma especial importancia la cobertura de agua potable en Costa Rica, la cual si bien es cierto ha ido en franca mejora en los últimos años, a 2008 aproximadamente el 20% de la población costarricense consume agua no potable constituyéndose como un riesgo potencial (Mora, 2009). Sin embargo las consecuencias actuales con respecto a las patologías de largo plazo como el cáncer, fueron gestadas bajo las condiciones del país desde hace aproximadamente 25 años. Actualmente se cuenta con evidencia para el reconocimiento del agua de consumo humano en el rol epidemiológico de H. pylori (Mazari, 2001; Kowolick, 2005), advirtiéndose directamente que el consumo del agua no tratada debería considerarse un factor de riesgo para la infección en una población dada (Kowolick, 2005, Reavis, 2005; Bragança, 2007; Baker, 2001, Gião, 2006). Se ha mencionado incluso que en Japón la mayor parte de los casos de transmisión de H. pylori puede ser de origen hídrico y que la transmisión está fuertemente asociada con la duración de la ingesta en la vida de las personas con respecto al consumo de agua de pozo (Karita, 2003). Una variedad de métodos moleculares y la determinación de marcadores genéticos por Reacción en Cadena de la Polimerasa (PCR directo) y ensayos con anticuerpos han sido utilizados para detectar la presencia de H. pylori en agua de pozos, ríos, en biofilmes asociados a tanques de almacenamiento de agua y en tuberías de redes de distribución (Braganca, 2005; Piqueres, 2006; Fujimura, 2004; Adams, 2003; Benson, 2004). Sin embargo a la fecha no se ha reportado el cultivo directo a partir del agua de consumo humano, a lo sumo lo realizado por Lu y colaboradores, fue el cultivo con la ayuda de anticuerpos inmunomagnéticos a partir de agua residual (Lu, 2005). Lo que sí ha sido publicado es la sensibilidad diagnóstica y el grado de recuperación de H. pylori en matriz de agua potable sugiriéndose que esta matriz no presenta interferencia real (McDaniels, 2005). Además se ha demostrado su sobrevivencia a la cloración sin encontrarse correlación con niveles de cloro en agua tratada con respecto a la prevalencia de la infección en población de riesgo (Ramírez, 2004). No obstante, se ha determinado que H. pylori suspendido en el agua tiene muy bajo poder de cultivo comparado con otros patógenos de origen hídrico (Azevedo, 2007). Mientras algunos autores han mencionado que la capacidad de cultivo de H. pylori generalmente termina algún tiempo después de su inoculación artificial en el agua (Azevedo, 2006), Oliver demostró la viabilidad y la capacidad de cultivo de H. pylori en agua hasta por 75 horas a 10 °C (Oliver, 2005). Así mismo Shahamat (Shahamat, 1993) determinó que el total de células no disminuía por períodos mucho más largos (2 años a 4 °C) en agua artificialmente inoculada. Algunos estudios muestran la capacidad de cultivo in vitro de al menos 10 horas a temperaturas mayores de 20 °C (Adams, 2003; Azevedo,2004) en los cuales se puede comparar con la capacidad de cultivo de más de 40 días para Escherichia coli y Salmonella entérica a la misma temperatura. En términos generales la adherencia de los microorganismos a las superficies (como biofilmes o biopelículas) es un importante factor de sobrevivencia que puede influir en la patogenicidad de cepas específicas, y esto es crucial en la epidemiología y la transmisión de H. pylori (Azevedo y Pacheco, 2006; Azevedo y Pinto, 2006; Azevedo, 2003; Simoes, 2006). Se ha estudiado su adhesión en tanques de almacenamiento para agua de acero inoxidable y de polipropileno, encontrándose que en estas superficies retiene su morfología espirilar (Azevedo y Pinto, 2006). Esto es muy importante por cuanto se puede considerar reservorio en sistemas de distribución de agua. Los microorganismos así organizados, tal y como se ha estudiado en E. coli aumentan su capacidad para soportar y neutralizar monocloraminas, estimular la producción de catalasa, o inducir la expresión de betalactamasas cromosómicas (Boaretti, 2003). De esta forma se defienden del medio ambiente que les rodea, pueden activar genes de respuesta a estrés y cambiar entonces a fenotipos de estrés ambiental. Con un mismo genotipo, la bacteria expresa un distinto patrón de genes y presenta un distinto fenotipo, como por ejemplo alteraciones en el patrón nutricional, densidad celular, temperatura, pH o la osmolaridad. La inanición prolongada induce a la pérdida de capacidad de cultivo en condiciones normales, en estos casos las células permanecerían metabólicamente activas y estructuralmente intactas (Fux, 2005). En estos biofilmes, dependiendo de las condiciones ambientales, una misma bacteria puede crecer, sésil adherida a la superficie, o desarrollarse de forma planctónica nadando libremente en el medio líquido. En los biofilmes planctónicos las bacterias se pueden encontrar en estado reversible de "viables pero no cultivables" (VPNC) y se considera la principal razón de la baja tasa de detección de microorganismos en biopelículas por métodos rutinarios de cultivo (Fux, 2005). Esta habilidad de agregarse en biofilmes es expresada por H. pylori, para lo cual se ha demostrado que las bacterias sésiles conservan generalmente la capacidad de retener su forma espiralar por más tiempo, comparado con las formas planctónicas las cuales empiezan a ser cocoides más rápidamente (VPNC) (Azevedo, 2006). Por mucho tiempo se consideró que muchos de los problemas que se han encontrado en la recuperación de formas viables de H. pylori en el agua, se deben a que las formas espiralares pasan a formas cocoides o VPNC. Desde un punto de vista más amplio, ahora se acepta que lo que ocurre es que estas bacterias no se logran cultivar bajo métodos rutinarios y convencionales de laboratorio. Más aún, se ha demostrado que formas cocoides de H. pylori son capaces de colonizar la mucosa gástrica y causar gastritis en ratones (Touati, 2003; She, 2003). Actualmente se presenta evidencia sobre la mayor resistencia de H. pylori con respecto a E. coli al cloro y al ozono, por lo que, este microorganismo es capaz de tolerar desinfección (probablemente deficiente) en sistemas de distribución de agua (Baker, 2002). Esto contrasta con lo publicado por Johnson y colaboradores (Johnson, 1997), quienes reportaban inactivación de la bacteria, determinándose posteriormente errores en sus procedimientos de laboratorio. También se ha reportado de la resistencia de H. pylori al glutaraldehído, desinfectante comúnmente usado en la desinfección de equipo médico en condiciones de alta carga bacteriana (Chiu, 2007). Investigaciones recientes dan cuenta de que un aumento en la temperatura es un factor importante para reducir la contaminación por H. pylori en sistemas de abastecimiento de agua, y es probable que esto se observe también para otros microambientes (Azevedo, 2007). Según ha mencionado Azevedo, H. pylori es cultivable a temperaturas bajas (no menciona cuan bajas), se ha visto que zonas frías en el mundo presentan mayores tasas de infección y que posiblemente la transmisión ocurra principalmente durante época lluviosa (Azevedo, 2007). Dicha aseveración será fundamental en los resultados y conclusiones de este trabajo. Como se ha demostrado que la bacteria es capaz de retener la integridad celular durante al menos dos años en el agua a bajas temperaturas, es evidente entonces que el medio ambiente sirve como reservorio para la diversidad de cepas de H. pylori (Azevedo, 2007; Montero, 2009) La propuesta de modelos a través de la tolerancia en el agua, le puede conferir características importantes en el ciclo de transmisión, siendo trascendental para una población dada, pues tiene fuertes implicaciones en la salud pública. 1.10 Calidad actual del agua en Costa Rica La prestación de los servicios de agua potable y alcantarillado sanitario en Costa Rica, le corresponde al Instituto Costarricense de Acueductos y Alcantarillados (AyA), como ente operador encargado de brindar servicios de distribución de agua a la población, así como de canalizar las aguas domésticas, negras e industriales, mediante el sistema de alcantarillado sanitario. No obstante, los altos índices de cobertura con los que cuentan los servicios de agua y saneamiento, demuestran una compleja estructura institucional en el aparato gubernamental, que conlleva por una parte, a la duplicación de responsabilidades entre varias instituciones y por otra parte, la ausencia de un sistema de planificación y desarrollo del sector salud, dentro del subsector agua potable y saneamiento (SAPS) (Evolución , 2009). El SAPS no está formalmente constituido, pero en la práctica está integrado por el AyA en su carácter de rector del agua potable y del alcantarillado sanitario y a su vez operador de sistemas; y por los otros operadores de sistemas: la Empresa de Servicios Públicos de Heredia (ESPH S.A.), las municipalidades, los comités administradores de acueductos rurales (CAARs) y las asociaciones administradoras de acueductos y alcantarillados rurales (ASADAS) y algunas organizaciones privadas menores que operan acueductos o sistemas individuales (en general pozos excavados o nacientes). La función primordial del AyA consiste en dirigir y fijar políticas, establecer y aplicar normas, realizar y promover el planeamiento, financiamiento y desarrollo y en general resolver todo lo relacionado con el suministro de agua potable, recolección y evacuación de aguas negras y residuos industriales líquidos, y los aspectos normativos de los sistemas de alcantarillado pluvial en áreas urbanas y en todo el territorio nacional. El AyA está obligado además a asesorar a otros organismos del Estado y coordinar las actividades públicas y privadas en todos los asuntos relacionados con el establecimiento de acueductos y alcantarillado, y el control de la contaminación de los recursos de agua, siendo obligatoria en todo caso, su consulta e inexcusable el cumplimiento de sus recomendaciones. El AyA funge además como institución descentralizada prestadora de servicios, según lo señala su Ley Constitutiva, por lo que le corresponde administrar y operar directamente los sistemas de acueductos y alcantarillados sanitarios de todo el país. El Instituto es el ente encargado de garantizar la continuidad del servicio de agua potable en el ámbito nacional, debiendo asumir la gestión para garantizar la continuidad cuando el operador no pueda seguir prestándolo. Debido a la presencia de varios entes operadores, se presentan conflictos de responsabilidad en cuanto a la planificación y prestación de los servicios; tal es el caso de la Gran Área Metropolitana (GAM), que concentra aproximadamente el 50% de la población del país, donde actúan el AyA, la ESPH S. A. y algunas municipalidades. 1.10.1 Fuentes de agua disponibles Aproximadamente un volumen de 170 km 3 ingresa al país anualmente por concepto de lluvias, de los cuales unos 75 km3 escurren superficialmente y forman parte del caudal de los ríos, mientras que 37 km3 recargan los acuíferos. Una tercera parte de agua que se precipita vuelve a la atmósfera mediante los procesos de evaporación y transpiración. La abundante precipitación ha hecho que durante siglos, el costarricense no haya sentido preocupación por la disponibilidad de agua para realizar sus actividades, como tampoco ninguna necesidad de planificar las actividades relacionadas con el manejo de los recursos hídricos (OPS, 2004). Los acuíferos constituyen un patrimonio para el desarrollo futuro de Costa Rica, la calidad y cantidad de agua que surten para consumo doméstico depende del grado de deterioro de las zonas de recarga. Cuatro zonas concentran la mayor parte de la demanda: la Gran Área Metropolitana GAM, Guanacaste, Puntarenas y Limón. El 50% de los suministros de agua para consumo humano de estas zonas proviene de fuentes subterráneas. En particular, los acuíferos más explotados del país – Colima Inferior, Colima Superior y Barva – abastecen al 65% de la población de la GAM. Los principales factores de presión sobre los acuíferos incluyen, por un lado, los procesos de cambio en el uso de la tierra (deforestación, drenaje de humedales e impermeabilización por desarrollo urbano y descarga de desechos que potencialmente pueden alcanzar los niveles freáticos) y por otro, los patrones de consumo y las tasas de extracción de aguas subterráneas. Sin embargo, el conocimiento actual sobre las zonas de recarga y la hidrología de los acuíferos resulta insuficiente (OPS, 2004). Las municipalidades tienen a su cargo la administración plena de los sistemas de abastecimiento de agua potable que tradicionalmente han tenido. Por disposición de la Ley Constitutiva de AyA, las municipalidades que estuvieran administrando y operando sistemas en el momento de crearse el AyA, podían continuar a cargo de estos sistemas siempre y cuando mantuvieran un servicio eficiente, con excepción de los acueductos ubicados en el Área Metropolitana que deberán ser administrados en forma exclusiva por el AyA. AyA está autorizado por el ordenamiento jurídico para asumir la administración, operación y mantenimiento de los acueductos y sistemas de alcantarillado sanitario que están bajo control de las municipalidades, cuando éstas voluntariamente así lo acuerden con el AyA o cuando la prestación del servicio sea deficiente. En términos generales en Costa Rica los cantones (y por ende las municipalidades) que poseen fuentes de agua propias sea nacientes, pozos o fuentes superficiales (ríos), ellos mismos administran este recurso. Comités Administradores de Acueductos Rurales (CAAR´s) y Asociaciones Administradoras de Acueductos y Alcantarillados (ASADAS): Los comités administradores de acueductos rurales (CAAR´s) han sido las organizaciones locales que se iniciaron en la administración comunitaria de acueductos rurales amparados y tutelados por el AyA. A partir de la década de los noventa se institucionaliza la figura de las asociaciones administradoras de acueductos y alcantarillados (ASADAS) con personería jurídica y con su respectivo reglamento de operación y administración supervisado por el AyA, momento desde el cual muchos CAAR´s se han venido transformando en ASADAS. Las ASADAS tienen como fin administrar, operar y mantener en buenas condiciones el acueducto y el alcantarillado sanitario (cuando exista), de acuerdo con las normas y políticas que al respecto emita el AyA. Tienen una relación de subordinación bastante clara frente al AyA. Ante una mala prestación del servicio o un incumplimiento grave de las ASADAS, el AyA tiene la potestad para terminar con el convenio a través del cual delegó la prestación del servicio, además debe ejercer absoluto control y fiscalización sobre la labor de estas asociaciones. Costa Rica se ha distinguido por gozar de altas coberturas en los servicios de agua potable y saneamiento, sin embargo se identifican deficiencias en la calidad de la prestación de los servicios, organización, ausencia de planificación e insuficiente inversión que puedan garantizar en el mediano y largo plazo el sostenimiento de las coberturas (OPS, 2004). Como parte de las debilidades del sector en el área de la gestión de los servicios, se consignó en el Análisis Sectorial la ausencia de un sistema constante e integral de control y vigilancia de la calidad del agua potable en el ámbito nacional. La falta de fiscalización y control de parte del AyA a las organizaciones comunitarias administradoras de acueductos rurales (CAAR´s y ASADAS), donde se identifican los mayores índices de suministro de agua “no potable” y la ausencia de un sistema de financiamiento permanente a los acueductos rurales, se plantean como retos importantes por resolver para mejorar la calidad del agua en el sector rural. A continuación se presentan gráficas y cuadros sobre la situación de la calidad actual del agua de consumo en Costa Rica. En el primer semestre del 2003, el Laboratorio Nacional de Agua (LNA/AyA) consignó en un documento los resultados de la situación de la cobertura y calidad del agua para consumo humano en el país al año 2002 ( ver figura 25). En el cuadro 1 se presentan los acueductos estudiados con tratamiento y desinfección o sólo desinfección y la evaluación de la calidad del agua, según ente operador, al año 2008. Figura 25. Porcentaje de acueductos por Ente Operador al 2002 Cuadro 1. Agua para consumo humano: estimación general de cobertura y calidad en Costa Rica - Período 2008 Entidad administradora N° Población cubierta Población con agua potable Población con agua no potable Acueductos No Acueductos Población % Población % Población % Potab. Potab. AyA 173 2.243.011 49,3 2.202.473 98,2 40.538 1,8 147 26 Municipalidades evaluadas 244 705.147 15,5 555.395 78,8 149.752 21,2 175 69 E.S.P.H. 12 164.626 3,6 164.043 99,6 583 0,4 11 1 1.033 901.006 19,8 528.791 58,7 372.215 41,3 523 510 812 338.305 7,4 198.585 58,7 139.720 41,3 414 398 2.274 4.352.095 95,6 3.649.287 83,9 702.808 16,1 1.270 Fácil acceso, urbanizaciones y privados *** ¿? 172.896 3,8 145.060 83,9 27.836 16,1 ¿? ¿? Sin información ¿? 24.912 ¿? ¿? ¿? ¿? ¿? ¿? ¿? 2.274 4.549.903 100 3.794.347 83,4 730.644 CAAR´s/ASADAS * (Evaluadas) CAAR´s/ASADAS ** (Sin evaluar) Sub-Total Totales 16,0 1.270 1.004 1.004 * Estimación fundamentada en el Programa de Vigilancia 2006-2008. ** El porcentaje de población abastecida con agua de calidad potable se calcula manteniendo el porcentaje obtenido en los acueductos evaluados y extrapolando el resultado a los que faltan de avaluar. *** El porcentaje de población abastecida con agua de calidad potable se calcula manteniendo el 83.9% obtenido en todos los acueductos. Los acueductos con tratamiento por métodos convencionales (floculación y coagulación química, decantación y filtración), que incluyen desinfección, se abastecen de fuentes superficiales y aquellos acueductos en los que se practica la desinfección como único tratamiento, se surten de fuentes subterráneas generalmente de muy buena calidad. La potabilidad y no potabilidad de los acueductos, de acuerdo con el estudio del LNA/AyA, se basó en el cumplimiento o no de las normativas del “Reglamento de Calidad del Agua Potable” y los criterios propios del LNA, medidas a través de muestreos y análisis microbiológicos y físico-químicos en las fuentes de agua, tanques de almacenamiento y redes de distribución de cada acueducto del territorio nacional, realizadas en campañas distribuidas por regiones. Las campañas de muestreo consisten en un número de muestras puntuales, de acuerdo con el tamaño de la población abastecida por cada acueducto, tomadas a la salida de las plantas de tratamiento y en varios puntos del sistema de distribución de agua a la comunidad. En el cuadro 2 se resume el total de acueductos por entidad operadora según su calidad, tratamiento y/o desinfección. Cuadro 2. Tratamiento, desinfección y calidad del agua en los acueductos de Costa Rica por número de sistemas según ente operador. 2008. Ente operador Acueductos Total Tratamiento Desinfección Potables No. % No. % No. % No. % CAAR's* 173 244 12 1845 7,6 10,7 0,5 81,1 18 3 0 21 0,8 0,1 0,0 0,9 153 139 12 281 6,7 6,1 0,5 12,4 147 175 11 523 6,5 7,7 0,5 23,0 Totales 2274 100,0 42 1,8 585 25,7 856 37,6 AyA Municipalidades ESPH * período 2006-2008. Fuente: Área de Microbiología, Laboratorio Nacional de Aguas, AyA Con respecto a la cobertura y calidad del agua por provincias se presentan los gráficos elaborados por el Laboratorio Nacional de Aguas bajo la figura 26. Figura 26. Coberturas con agua de calidad potable (azul), no potable (verde) y sin evaluar (rojo) por provincias en Costa Rica, en el período 2008, según el Laboratorio Nacional de Agua. Un aspecto importante a ser tomado en cuenta en la valoración del riesgo es la evolución que ha tenido en los últimos años la calidad del agua dispensada a la población, tal y como se aprecia en las figuras 27 y 28. Fuente: Informes anualees de calidad del agua. Laboratorio Nacional de Aguas Figura 27. Valores porcentuales de habitantes abastecidos con agua potable y no potable en los acueductos operados por Municipalidades 1996-2008. Fuente: Informes anuales de calidad del agua. Laboratorio Nacional de Aguas Figura 28 Valores porcentuales de habitantes abastecidos con agua potable y no potable en acueductos operados rurales 1999-2008. Finalmente se desea mostrar para efectos de discusión posterior de los resultados del presente trabajo, la cobertura en la disposición segura de excretas, la cual se presenta bajo las figuras 29 y 30 cobertura que se ha mantenido así por muchos años. Fuente: Estado del Saneamiento. Caso Costa Rica. Setiembre de 2007. Figura 29. Valores absolutos en conexiones y técnicas para la disposición segura de excretas Fuente: Estado del Saneamiento. Caso Costa Rica. Setiembre de 2007. Figura 30. Disposición segura de excretas. Encuesta de Hogares, 2006 INEC Como se pudo apreciar en las figuras 25 y 26 en el país se maneja una excelente disposición de excretas, y esto es muy importante desde el punto de vista de salud pública, enfermedades transmisibles y la circulación de microorganismos patógenos entéricos en el ambiente. Este hecho se abordará en la discusión de los resultados. 1.11 Planes de seguridad del agua (PSA) Al considerar la carga de enfermedades y la preocupación que involucra a todos los responsables del abastecimiento de agua para consumo humano, la Organización Mundial de la Salud (OMS) ha planteado un manejo para el agua de bebida segura, el cual desde hace algunos años se está tratando de implementar en Costa Rica. Marco para el agua de bebida segura La OMS, en la tercera edición de sus Guías de Calidad del Agua de Bebida (GDWQ por sus siglas en inglés), expresa que la calidad del agua puede ser controlada por medio de la protección de las fuentes, el control de los procesos de tratamiento, la gestión de la distribución y el manejo a nivel intradomiciliario. El manejo preventivo considera cinco componentes principales: - Objetivos basados en salud y establecidos en función de la evaluación de los aspectos de salud; - Evaluación del sistema para determinar si el agua suministrada satisface los objetivos de salud; - Monitoreo operacional de las medidas de control; - Gestión de los planes de seguridad del agua, la que documenta la evaluación del sistema, los planes de monitoreo y las acciones emprendidas en condiciones normales u ocasionales; - Vigilancia que verifica que todo lo anterior opera apropiadamente Los objetivos basados en salud están asociados con decisiones políticas y son establecidos por la más alta autoridad de salud en consulta con los abastecedores y consumidores, reflejándose en leyes, reglamentos y normas técnicas. La evaluación del sistema, el monitoreo operacional y la gestión, forman parte del Plan de Seguridad del Agua (PSA) y son elaborados y aplicados por los prestadores del servicio de abastecimiento de agua, revisados y aprobados por la autoridad sanitaria. Finalmente se propone que la vigilancia es responsabilidad de una agencia independiente, normalmente representada por el Ministerio de Salud que periódicamente revisa todos los aspectos de seguridad aplicados por el prestador del servicio y quien todo el tiempo es responsable del control de calidad, del monitoreo operacional y de asegurar la aplicación de buenas prácticas operativas. Objetivos del PSA El objetivo principal del PSA es el aseguramiento de las buenas prácticas de abastecimiento de agua de bebida a través de la minimización de la contaminación de las fuentes de agua, la reducción o el retiro de la contaminación por medio de procesos de tratamiento (barreras); y la prevención de la contaminación durante el almacenamiento, la distribución y la manipulación del agua a nivel intradomiciliario. Estos objetivos son aplicables a los grandes y pequeños sistemas de abastecimientos de agua, así como a pequeñas instalaciones (hoteles y hospitales) e incluso a nivel casero; los cuales se alcanzan a través de: • Adecuado conocimiento del sistema de abastecimiento de agua y de su capacidad para suministrar el agua que satisfaga el objetivo basado en la salud. • Identificación de fuentes potenciales de contaminación y la manera de controlarlos. • Validación de las medidas de control empleadas en el control de peligros. • Implementación de sistemas de monitoreo de las medidas de control. • Aplicación de medidas correctivas oportunas para asegurar el abastecimiento de agua segura de manera permanente. • Verificación de la calidad del agua de bebida para asegurar que el PSA está aplicado correctamente, alcanzando el rendimiento requerido para satisfacer los estándares de calidad del agua. 2. Objetivos: Objetivo general: Valorar el impacto de la presencia de H. pylori en agua de consumo humano de fuentes seleccionadas en cantones de alta y baja incidencia de cáncer gástrico en Costa Rica por medio de técnicas moleculares y técnicas de cultivo modificadas. Objetivos específicos 1. Determinar la presencia de Helicobacter pylori mediante técnicas de cultivo y técnicas moleculares en muestras de agua en zonas de alta y baja incidencia de cáncer gástrico. 2. Confirmar la identidad de las cepas encontradas moleculares de identificación y de patogenicidad. 3. Valorar el manejo del agua potable en Costa Rica y contrastarlo con el manejo en países desarrollados con el fin de proponer pautas para su mejoramiento. mediante marcadores 3. Hipótesis: "Si Helicobacter pylori se cultiva a partir de agua de consumo humano de las poblaciones, entonces será un mecanismo de transmisión de la enfermedad gástrica”. 4. Materiales y métodos 4.1 Materiales Medios de cultivo y reactivos. - Caldo tripticase y soya (CTS). - Suplemento Selectivo Dent ®: antibióticos Vancomicina, Trimetoprin, Cefsulodina y Anfotericina B. - Campygen® Dispositivo para lograr atmósfera microaerofílica (6% de oxígeno y 10% de dióxido de carbono). - Agar Columbia con sangre de caballo al 5% Lake Horse® de OXOID. - Tiras de oxidasa OXOID® y reactivo de Urea OXOID® La extracción del ADN de las cepas se realizó con el Kit Comercial para Purificación de ADN Genómico Wizard® de Promega. Para cada protocolo de PCR se realizó la evaluación preliminar del mismo y de la pareja de oligonucleótidos empleada, tanto estos como todos los reactivos fueron adquiridos en la empresa Biocientífica y se detallan en la metodología. 4.2 Metodología 4.2.1 Estandarización de la técnica de cultivo con cepas de referencia. Para la adecuada estandarización de la técnica se adquirieron cepas de referencia de la colección ATCC (American Type Culture Collection) de Estados Unidos, y se llevaron a cabo las siguientes actividades: a- Inoculación de las cepas en CTS, en agua destilada estéril, y en medios específicos selectivos para utilizarlos en la determinación posterior. b- Filtración por membrana en filtros de nitrocelulosa 0,45µm y determinación de las colonias de interés, agregándole al agar TTC (cloruro de trifenil tetrazolium), con el fin de evidenciarlas pues son incoloras y los filtros son blancos. c- Cultivo de los filtros en CTS d- Valoración del comportamiento de las cepas por microscopia de luz y por microscopia de contraste de fases. 4.2.2 Análisis de las muestras por cultivo microbiológico a. Para el cultivo de las muestras se utilizó como base el protocolo de Lu y colaboradores de la Universidad de Texas (Lu et al, 2002), el cual se muestra en anexos. b. Como una modificación importante se usó la necesidad de adherencia de la bacteria a induciéndola a la formación de biofilmes, pero pegarse a filtros de nitrocelulosa en medio líquido, estrategia de la una superficie, en este caso a esta modificación se realizó pues el protocolo de Lu parte de agua residual municipal y en este caso es agua de muy baja carga bacteriana. c. Inicialmente se trabajó con anticuerpos inmunomagnéticos (la metodología se describe en el anexo 2), tal y como lo hizo Lu, sin embargo rápidamente se determinó que la estrategia de adhesión al filtro es mucho más eficiente, barata y rápida, por lo tanto sólo se probó la técnica con las primeras muestras. d. Se recolectó una muestra de 500 mL de nacientes o de pozos, clorada o sin clorar. Si la muestra está clorada se le realizó la determinación de cloro residual por medio de un comparador de cloro marca HATCH. e. Las muestras se procesaron tan pronto llegaron al laboratorio de microbiología del Centro de Investigación y de Servicios Químicos y Microbiológicos-CEQIATEC, se concentraron por filtración, en filtros de nitrocelulosa de 0,45 µm, y con bomba de vacío. f. Luego los filtros que se utilizaron como medio de sostén, se retiraron con pinzas y se introducieron en tubos de ensayo de 20 x 150 mm, que contenían 20 mL de CTS con el Suplemento Selectivo Dent. g. Se incubó a 35 °C con atmósfera microaerofílica en jarra con Campygen® . h. A las 48 horas el caldo se rayó en agar Columbia con 5% de sangre de caballo y se volvió a cultivar en atmósfera microaerofílica en jarra. i. Luego de 48 horas se observó el crecimiento de las colonias, y se buscó las similares a Helicobacter, las cuales corresponden a colonias muy pequeñas, incoloras. j. A las colonias seleccionadas se les realizó tinción de Gram con fucsina fenicada, prueba de oxidasa y prueba de ureasa. k. A las muestras del primer y segundo muestreo se les determinó coliformes totales y fecales por técnica de Número más Probable (NMP), según la metodología 9221 del Standard Methods Ed 21. 4.2.3 Análisis para la identificación y caracterización de las cepas por PCR Muestreos. La investigación se llevó a cabo mediante 3 muestreos. Para las muestras del primer muestreo se evaluaron protocolos de PCR, para la identificación en las cepas mediante la determinación de los marcadores de: el gen de la ureasa C (ureC o glmM fosfoglucosamin mutasa), la fracción ARNr 16S. Además se aplicó a una muestra el protocolo para la evaluación de las variantes alélicas de la región vacA y la presencia del gen cag A. En las muestras del segundo muestreo se analizó el marcador glmM y se le realizó una determinación de coliformes totales y fecales a las muestras de agua. En las muestras correspondientes al tercer muestreo se utilizaron los marcadores glmM, y el marcador de “Proteína Inductora de Factor de Necrosis Tumoral- α (Tipalpha TNF- α). Se escogieron dos muestras positivas que se enviaron para secuenciación a Macrogen Corporation de Marylan, Estados Unidos. 4.2.3.1 Protocolos específicos Extracción de ADN La extracción del ADN de las muestras se hizo mediante el Kit Comercial para la Purificación de ADN Genómico Wizard® de Promega. Este método está basado en un proceso de cuatro pasos: lisis celular, digestión con ARNasa, precipitación salina de las proteínas celulares y finalmente la concentración y precipitación del ADN genómico mediante la adición de isopropanol (Millar et al, 1988; Promega Corporation, 2005). La extracción de ADN se realizó según instrucciones recomendadas de la casa fabricante para bacterias Gram negativas, la cual se describe a continuación: En cámara de flujo laminar, las colonias bacterianas o el cultivo en caldo se resuspende en 100 μl de solución rehidratante de ADN en tubos eppendorf de 1.5 mL: 1. Las suspensiones bacterianas en buffer TE 1X o solución rehidratante de ADN se centrifugan a 13200 rpm para obtener un “pellet” de células. Se remueve el sobrenadante y se deja el “pellet” en el tubo eppendorf. 2. Se adicionan 600 μl de la Solución de Lisis Nuclear. Se pipetea levemente hasta que las células sean resuspendidas. Se agita en vortex para completar la re-suspensión. 3. Se incuba a 80° C en baño maría por 5 minutos para lisar las células; luego se enfrió a temperatura ambiente. 4. Se adiciona 3 μL de la solución de ARNasa al lisado celular. Se invirtieron los tubos 2-5 veces para mezclar. 5. Se incuba a 37° C en baño maría durante 60 minutos. Las muestras son enfriadas a temperatura ambiente. 6. Se adiciona 200 μL de la solución de precipitación de proteínas a cada lisado tratado con ARNasa. Se mezcla en vortex vigorosamente a máxima velocidad durante 20 segundos para mezclar la solución de precipitación con el lisado celular. 7. Se incuban las muestras en hielo por 5 minutos. 8. Se centrifugaron a 13200 rpm por 3 minutos. 9. Se transfiere el sobrenadante que contiene el ADN a un tubo limpio de 1.5 mL por muestra, cada tubo contiene 600 μL de isopropanol a temperatura ambiente. 10. Se mezcla ligeramente por inversión cada tubo hasta observar “hebras” del ADN; se sigue mezclando hasta que se forme una masa visible. 11. Las muestras se centrifugan a 13200 rpm por 2 minutos. 12. Con cuidado se remueve completamente el sobrenadante, dejando el “pellet” de ADN. Se adicionan 600 μL de etanol 70 % (temperatura ambiente) y ligeramente se invierten los tubos varias veces para lavar el “pellet” de ADN. 13. Se centrifuga a 13200 rpm por 2 minutos. Se remueve completamente el etanol. 14. Se deja secar el sedimento (pellet) de ADN de cada muestra en cámara de flujo laminar durante 15 minutos. 15. El sedimento de ADN se resuspende en 100 μL de la solución de rehidratación de ADN (10 mM Tris-HCl, 1 mM EDTA) y luego se incuban las muestras a 65° C durante 1 hora en baño maría, mezclando las muestras por inversión de los tubos en forma periódica. 16. Finalmente las muestras de ADN se conservan a -15 °C. Valoración del ADN extraído El ADN obtenido se visualizó mediante electroforesis en un gel de agarosa al 2% (p/v), en buffer de corrida TAE 1X (40 mM Tris–acetato, pH 8.0 y 1 mM EDTA) a 100 V durante 40 min, con GeneRulerTM 1kb DNA ladder Fermentas®, como marcador de peso molecular. El gel fue teñido con bromuro de etidio 0.5 mg/mL Sigma® y fotografiado para evaluar la concentración y pureza del ADN genómico. Para cada protocolo de PCR se efectuó la evaluación preliminar del mismo y de la pareja de oligonucleótidos empleada, para luego utilizarlo en la evaluación de las muestras. Protocolos de PCR para los marcadores empleados. En el primer muestreo se emplearon siete parejas de oligonucleótidos para la detección y caracterización de cepas de H. pylori de las muestras. En los cuadros 3 y 4 se detalla la información para cada pareja de iniciadores. Cuadro 3. Secuencias nucleotídicas y tamaños de amplificación esperados para la detección de H. pylori Región a amplificar Tamaño del producto de PCR (pb) ARNr 16S 992- 1500 glmM cagA Secuencias de los iniciadores 5’ – 3’ Referencia GGCGTTATCAACAGAATGGC CTCAGTTCGGATTGTAGGCTGC Shahamat et al (2004) 294 AAGCTTTTAGGGGTGTTAGGGGTTT AAGCTTACTTTCTAACACTAACGC Lage et al (1995) 128 ATAATGCTAAATTAGACAACTTGAGCGA AGAAACAAAAGCAATACGATCATTC Tomasini et al (2003) Cuadro 4. Secuencias y tamaños de amplificación esperados para los imprimadores utilizados para las regiones de vacA (Lu, 2002). IMPRIMADOR SECUENCIA TAMAÑO ESPERADO (pb) 190 vacA s1a GTCAGCATCACACCGCAAC CTGCTGGAATGCGCCAAAC vacA s1b AGCGCCATACCGCAAGAG CTGCTGGAATGCGCCAAAC 187 vacA m1 GGTCAAAATGCGGTCATGG CCATTGGTACCTGTAGAAAC 290 vacA m2 GGAGCCCCAGGAAACATTG CATAACTAGCGCCTTGCAC 352 Para evaluar el glmM se utilizó el método descrito por Lage et al (1995), también empleado por Lu et al (1999) y Smith et al (2004), con las siguientes modificaciones: para un volumen de reacción de 25 μl, se adicionaron los siguientes componentes: Buffer para PCR (1x); MgCl2 (1.5 mM); dNTPs (0.2 mM); oligonucleótidos (0.4 μM, cada uno); y Taq polimerasa (0.05 U/μl). Se emplearon 5 μl de muestra de ADN. En el cuadro 5 se describe el perfil térmico empleado para la amplificación de la región glmM de H. pylori. Cuadro 5. Perfil térmico para PCR de región glmM de H. pylori Programa Pasos 1 Desnaturalización inicial Desnaturalización Alineamiento Extensión Extensión final Almacenamiento 2(1) 2(2) 2(3) 3 4 Temperatura (°C) 94 Tiempo Ciclos 5 min 1 94 55 72 72 4 1 min 1 min 1 min 5 min Lo necesario 35 1 1 Para la evaluación de cagA se usó el método descrito por Tomasini et al (2003) con las siguientes modificaciones: para un volumen de reacción de 25 μl, se adicionaron los siguientes componentes: Buffer para PCR (1x); MgCl2 (2.5 mM); dNTPs (0.2 mM); oligonucleótidos (0.5 μM, cada uno); y Taq polimerasa (0.03 U/μl). Se empleó 1 μl de muestra de ADN. En el cuadro 6 se describe el perfil térmico aplicado. Cuadro 6. Perfil térmico para PCR de región cagA de H. pylori Programa Pasos 1 Desnaturalización inicial Desnaturalización Alineamiento Extensión Extensión final Almacenamiento 2(1) 2(2) 2(3) 3 4 Temperatura (°C) 95 Tiempo Ciclos 3 min 1 95 48 72 72 4 1 min 45 s 45 s 5 min Lo necesario 35 1 1 Para la detección de cada una de las variantes alélicas de la región vacA, se utilizó el método de Lu et al (2002) con las siguientes modificaciones: En un volumen de 25 μl se adicionaron los siguientes componentes: Buffer para PCR (1x); MgCl2 (1.5 mM); dNTPs (0.2 mM); oligonucleótidos (0.5 μM, cada uno); y Taq polimerasa (0.03 U/μl). Se empleó 1 μL de muestra de ADN. En el cuadro 7 se describe el perfil térmico empleado para la amplificación de cada una de las variantes alélicas de vacA para H. pylori. La amplificación de cada variante alélica se diferencia solamente en la temperatura de apareamiento, siendo 55 °C para s1a, s1b y s2, 50 °C para m1 y 47 °C para m2. Cuadro 7. Perfil térmico para PCR de polimorfismos vacA en H. pylori. Programa Pasos 1 2(1) 2(2) Desnaturalización inicial Desnaturalización Alineamiento 2(3) 3 4 Extensión Extensión final Almacenamiento Temperatura (°C) 94 Tiempo Ciclos 2 min 1 94 45 s 45 s 35 1 min 7 min Lo necesario 1 1 55 (s1a, s1b y s2) 50 (m1) 47 (m2) 72 72 4 Para la evaluación de los oligonucleótidos y de las condiciones de reacción, se aplicó el método descrito por Shahamat et al (2004) con las siguientes modificaciones: para un volumen de reacción de 25 μl, se adicionaron los siguientes componentes: Buffer para PCR (1x); MgCl2 (2.5 mM); dNTPs (0.2 mM); oligonucleótidos (0.4 μM, cada uno); y Taq polimerasa (0.04 U/μl). Se empleó 1 μL de muestra de ADN. En el cuadro 8 se describe el perfil térmico empleado para la amplificación de la región ARNr 16S, específica de H. pylori. Cuadro 8 Perfil térmico para PCR de región ARNr 16S específica para H. pylori Programa Pasos 1 Desnaturalización inicial Desnaturalización Alineamiento Extensión Extensión final Almacenamiento 2(1) 2(2) 2(3) 3 4 Temperatura (°C) 95 Tiempo Ciclos 2 minutos 1 95 60 72 72 4 30 s 30 s 1 minuto 5 minutos Lo necesario 30 1 1 Para el tercer muestreo se eligieron dos marcadores: el glmM de identificación y el marcador de la Proteína inductora de factor de necrosis tumoral alfa (Tipalpha TNF-α) como marcador de patogenicidad de las cepas identificadas como H pylori. En el cuadro 9 se presenta la secuencia y el tamaño del producto de amplificación esperado para el imprimador utilizado como marcador TNF- α. Cuadro 9. Diseño de primers para el marcador de Gen Primers Proteina inductora de factor de necrosis tumoral (Tipalpha) TNF- α Producto PCR sFd 5’CACGCAAGGGGTGGATAGC 3’ 273pb sFr- 5’ CGCACYAACGCAAACACTTC 3’ Para la evaluación de los oligonucleótidos se llevaron a cabo las siguientes condiciones de reacción que se estandarizaron. 1- glmM (reamplificado) se utilizaron 28 µL de PCR Master Mix (2X) (Fermentas) que contiene 0,05 u/µl Taq ADN polimerasa, buffer de reacción, 4 mM MgCl2, 0,4 mM de cada dNTP (dATP, dCTP, dGTP, dTTP). Además, 2.5 µl de cada cebador (40 ng/µl), 1 µl de Taq Polimerasa (Dream Taq TM DNA Polymerase, Fermentas 5u/µL) y 5 µl del ADN extraído por reacción de 50 μl finales. 2- FNT- α: para un volumen de reacción de 50 μl finales, se adicionaron los siguientes componentes: Buffer para PCR Master Mix (2X) (Fermentas) (28 μL); oligonucleótidos 40 ng/µL (8 μL cada uno) y Taq polimerasa (1μl). Se emplearon 5 μL de muestra de ADN. En el cuadro 10 se describe el perfil térmico que se usó para la amplificación de las regiones glmM y el FNT-α específico de H. pylori. Cuadro 10. Perfil térmico para PCR de las regiones glmM (reamplificado) y FNT-α de H. pylori Programa Pasos 1 Desnaturalización inicial Desnaturalización Alineamiento glmM FNT-α Extensión Extensión final Almacenamiento 2(1) 2(2) 2(3) 3 4 Temperatura (°C) 94 Tiempo Ciclos 2 min 1 94 45 s 56 60 72 72 4 30 s 20 s 1 min 7 min Lo necesario 40 40 1 1 4.2.4 Caracterización de las muestras por secuenciación molecular Se eligió la empresa Macrogen Corporation de Rockville, Maryland Estados Unidos. Las muestras se enviaron tal y como lo establece la corporación: para productos de PCR, no menos de 50 ng/µL, no degradadas, un solo producto. Para la limpieza del producto de PCR se empleó el kit de limpieza por columna “PCR clean-up Gel extracion NucleoSpin® Extract II” de la casa comercial MachereyNagel. 4.2.5 Elección de los sitios y toma de las muestras Para la búsqueda de la bacteria en abastecimientos de agua de la población se esperaba que por su estrecha relación con cáncer gástrico sean los cantones de alta incidencia los elegidos como sitios de mayor probabilidad de éxito en el hallazgo. Se llevó a cabo un primer muestreo en los años 2006-2007 que correspondió a las nacientes que utiliza la Municipalidad del Cantón Central de Cartago y la Municipalidad de Santa María de Dota. Basándose en la apreciación del entorno geofísico y de manejo del agua de los lugares se decidió entonces estructurar la investigación completamente y se preparó el segundo muestreo. El segundo muestreo se llevó a cabo en los años 2007-2008, basado en la información estadística del Registro Nacional de Tumores donde aparece la incidencia de cáncer gástrico en cantones por quintiles, cuya información corresponde a la figura 22. Se escogieron 10 cantones de alta y baja incidencia correspondientes a los quintiles 1 y 5 según las estadísticas del Registro Nacional de Tumores, bajo los colores amarillo y celeste presentados en el cuadro 11. La información en este cuadro es presentada en orden descendente de acuerdo con las tasas de incidencia. Cuadro 11. Cantones elegidos en los quintiles 1 y 5 de alta y baja incidencia de cáncer gástrico para el muestreo. Fuente: Unidad de Estadística Registro Nacional de Tumores 1990-1999. Este segundo muestreo se efectuó, con los siguientes objetivos específicos: • • • Determinar la presencia de H. pylori en las muestras. Investigar con los encargados el manejo del agua que consume la población, para determinar cómo puede incidir en ambos lugares el Ente Operador encargado del Acueducto. Recolectar información sobre la naturaleza del agua que se utiliza, fuentes de abastecimiento, características ambientales de los diferentes lugares, información de cloración y cantidad de cloro residual. • Parámetros de coliformes totales y fecales de las muestras para su posterior comparación. El muestreo se ejecutó de la siguiente manera: 1. Se realizó puntual y se escogieron cantones aledaños, por el alto costo y por la facilidad para realizar muestreos por medio de giras. Estas giras se pactan con el Ente Operador Oficial de cada Acueducto: AyA y/o municipalidades, según correspondía. 2. Se recolectaron en cada cantón de alta incidencia 3 muestras, las cuales podían ser de: naciente, tanque de almacenamiento o de usuario clorada y sin clorar. En los lugares de baja incidencia se recolectó 1 muestra debido a que se conocía previamente que son operados por AyA en su mayoría, y por ende se esperaba que todas las muestras estuvieran cloradas y con alta cantidad de cloro residual en sus redes de distribución. 3. Se recolectó medio litro de agua para filtración y concentración de muestra para cultivo y 100 mL de muestra para análisis de coliformes. 4. Se recogió la información necesaria para establecer la incidencia del punto del muestreo sobre el consumo de agua de la población: a. Ente operador del acueducto b. Tipos de agua que consume el cantón (superficial, pozos, nacientes) y estado general c. Población abastecida por tipo de agua d. Cloración ( si tienen o no), tipo, cantidad de cloro residual y el tiempo que tienen las fuentes de estarse clorando. El tercer muestreo se llevó a cabo en el año 2009 y se trabajó con los siguientes objetivos específicos: Determinar la presencia de H. pylori en las muestras a partir de cultivos líquidos y posterior identificación molecular con el marcador glmM y a las cepas positivas el marcador de patogenicidad del gen TNF-α. Disminuir el impacto que AyA tenga específicamente como Ente Operador en los acueductos de las zonas de baja incidencia, así como los Entes Operadores de Municipalidades que cloran sus acueductos en las zonas de alta incidencia. Para esto se escogen nuevos sitios de muestreo, en lo posible de fuentes no cloradas, pero utilizadas directamente por la población. Recolectar 3 muestras por cantón de ambas zonas. Secuenciar al menos 2 productos de PCR reconocidos como positivos para H. pylori. El muestreo se hizo de la siguiente manera: 1- Se visitó nuevamente a los 20 cantones marco de la investigación. 2- El muestreo se realizó puntual, medio litro de agua para filtración. 3- Se tomaron 3 muestras por cantón, que podían ser de pozo, naciente o red. De las muestras positivas para ambos marcadores se escogieron 2 cepas y el control positivo la cepa J99 de H. pylori y se enviaron a secuenciación molecular. 5. Resultados 5.1 Estandarización de la técnica de cultivo con cepas de referencia. Se procedió a la estandarización de la técnica de cultivo y la recuperación de la bacteria en la matriz agua, para esto se trabajó con las cepas Hp 51932 y Hp 700392 adquiridas de la colección American Type Culture Collection (ATCC) de Estados Unidos. También se contó con ADN de la cepa de H. pylori 12455 de la National Collection of Type Cultures NCTC y la cepa J99 (Occhialini, 2000), las que sirvieron como controles en los ensayos de biología molecular. De acuerdo a los ensayos en las cepas de colección ATCC de H pylori se determinó que el crecimiento se va haciendo evidente en cultivo bifásico de agar Columbia inclinado con 5% de sangre prácticamente a las 24 horas, de abajo del inclinado hacia arriba, siendo esta la mejor forma de cultivar Helicobacter pylori. Con respecto a su crecimiento en placa de Petri, el cultivo se hace evidente a las 48 horas, siempre y cuando se trabaje con condiciones controladas de cultivo e insumos, esto es: agua destilada controlada, temperatura y humedad de la incubadora bajo control, tiempo y mantenimiento de las condiciones de almacenamiento de los medios de cultivo preparados (el agar sangre sólo se debe utilizar fresco). Se observó preliminarmente la deficiencia casi total de crecimiento de cepas ATCC de H pylori en medios líquidos por inoculación directa, solamente se pudo evidenciar su presencia utilizando medios líquidos con filtro como sostén. Este hallazgo explica entonces la imposibilidad que se ha reportado de recuperar la bacteria por cultivo de agua directamente sobre el medio (Oliver, 2005; Adams, 2003), según se puede observar en la figura 31. A B C Figura 31. A: Comparación de crecimiento con y sin filtro, ambos medios están inoculados con H. pylori. B: Crecimiento del microorganismo en cultivo de filtro. C: Comparación de crecimiento con respecto al control. Bajo la figura 32 se presenta una tinción de Gram de una de las cepas cultivadas, la flecha señala una bacteria con flagelos. Fuente: Laboratorio CEQIATEC. Figura 32 Fotografía por microscopia de luz de cepa ATCC de H pylori con tinción de Gram, con fucsina fenicada. Luego por microscopia de contraste de fases se pudo determinar que sí crece en el caldo, pero no se puede apreciar ese crecimiento pues no se observa turbidez en el medio de cultivo, la bacteria se desarrolla bajo formas intermedias hacia cocoides. Luego de su recuperación en caldo y su rayado en el medio de cultivo, las colonias son muy pequeñas, la figura 33 las presenta bajo un aumento de 10X, la figura 34 presenta una fotografía con un rayado de cultivo en Agar Columbia de 48 horas con sangre de caballo al 5%. Fuente: Laboratorio CEQIATEC. Figura 33. Vista de las colonias de H pylori en 10X. Fuente: Laboratorio CEQIATEC. Figura 34. Colonias de H. pylori en agar Columbia. En cuanto al análisis de cepas tipo, por técnicas de microscopia de contraste de fases, la actividad se llevó a cabo en el Laboratorio del Dr. Francisco Torrella en la pasantía efectuada en la Facultad de Microbiología y Genética de la Universidad de Murcia, España. En este laboratorio se trabajo en microscopia de contraste de fases y de campo, claro con lentes de alta resolución de cepas de la Universidad de Barcelona, cultivadas bajo las mismas técnicas que las cepas de Costa Rica. Con el seguimiento de los cultivos de H pylori por microscopia de contraste de fases se pudo obtener información de la viabilidad de la bacteria con el tiempo. Los cultivos de 5 días en placa de petri se pueden considerar “viejos”, con una gran cantidad (alrededor de 90%) de formas cocoides (o formas involucionadas), según se muestra en la figura 35 (la flecha señala una forma cocoide viable). Esto es importante por cuanto diversas publicaciones toman este tiempo como óptimo para el desarrollo de H. pylori, para congelar y preservar cepas o para pruebas moleculares, evidencian este hallazgo un problema posterior para su manejo adecuado. Estas formas cocoides involucionadas no se diferencian con microscopia de luz. Figura 35 Microscopia en contraste de fases de formas cocoides de H. pylori de cultivo en placa . También se determinó que la mejor forma de cultivar H. pylori o sea la obtención de cultivos estables para su adecuada manipulación, es bajo cultivo bifásico, el crecimiento es óptimo en la interfase inclinada del agar donde se acumula el agua de condensación. En la figura 36 se aprecian formas bacilares con dos diferentes técnicas de microcopía y con diferente tinción. Figura 36 Cultivo en agar inclinado de 3 días, agregado de células inmóviles dispuestas en cuerda. A la izquierda y al centro microscopia de contraste de fases, a la derecha tinción de Gram en microscopia de luz. La disposición en cuerda es característica de algunos tipos de bacterias tal y como se le puede observar a Helicobacter. La colocación de las bacterias tal y como se aprecia en la figura 37 es como si se dirigieran en un mismo sentido, esta misma disposición se ha apreciado también en tinciones de biopsias de pacientes con infecciones activas. Figura 37 Bacterias de cultivo bifásico inclinado por micros- copia de contraste de fases. Obsérvese la disposición de las bacterias, con esta técnica se puede apreciar movilidad. Uno de los hallazgos en el trabajo de estandarización con cepas de H. pylori fue la disposición que presentaba cuando se trabajó para preparaciones de microscopia electrónica, y es la fuerte adherencia al medio cuando se fija con formalina; (a criterio del experto de mayor cohesión comparado con otras bacterias), probablemente esta disposición obedece a su tendencia de agruparse bajo biofilmes tal y como se puede apreciar en la figura 38, las bacterias se observan pegadas densamente a la superficie del inclinado, el material tuvo que ser raspado. Figura 38 Cultivo de agar inclinado fijado con formaldehído por 24 horas para microscopia electrónica. 5.2 Análisis de las muestras por cultivo y PCR. Las muestras para cultivo microbiológico fueron procesadas en el Laboratorio de Microbiología del Centro de Investigación y de Servicios Químicos y Microbiológicos- CEQIATEC. Los análisis para la identificación molecular del microorganismo se realizaron en: -Laboratorio de Biología Molecular del Centro de Investigación en Biotecnología CIB del ITCR, primero, segundo y tercer muestreo. - Laboratorio de Bacteriología Médica de la Facultad de Microbiología de la UCR segundo y ensayos preliminares del tercer muestreo. En las muestras del primer muestreo se evaluaron protocolos de PCR, para la identificación en las cepas para el gen glmM, el gen que codifica a la fracción ARNr 16S, y la presencia del gen cagA. Además se aplicó a la primera muestra positiva el protocolo para la evaluación de las variantes alélicas de la región vacA de H. pylori. Además se procesaron conteos de coliformes totales y fecales a las muestras de agua. Para las muestras del segundo muestreo se analizó el marcador glmM y se realizaron pruebas de coliformes totales y fecales. A las muestras correspondientes al tercer muestreo se les determinó la presencia del gen glmM y a las muestras positivas se les determinó el marcador de la Proteína inductora del factor de necrosis tumoral alfa (Tipalpha FNT-α). Dos muestras positivas y el control se enviaron para secuenciación a la empresa Macrogen de Maryland, Estados Unidos. 5.2.1 Primer muestreo. Análisis de las zonas de alta incidencia. En el primer muestreo se obtienen resultados de 12 muestras de los cantones Central de Cartago y Santa María de Dota de San José. De estas muestras, 9 pertenecen a nacientes y 1 pozo del Cantón Central y del Cantón de Dota 2 muestras pertenecen a nacientes y 1 tanque. Estas muestras fueron tomadas de fuentes oficiales de agua manejadas por la Municipalidades respectivas. Para efectos de resultados se presenta a partir de la muestra # 10 en el cuadro 12; además a cada muestra se le practicó una determinación de coliformes totales y fecales por técnica de Número Más Probable (NMP), para determinar su potabilidad de acuerdo con los parámetros reglamentarios nacionales. Luego del cultivo se hicieron determinaciones de PCR para los marcadores glmM, 16S ARNr, y a la muestra # 20 la determinación de la región vacA, para valorar la presencia de las variantes alélicas s1a, s1b, m1 y m2 y la presencia del gen cagA. A continuación se muestra bajo las figuras 39 y 40 la fotografía de la electroforesis efectuada a productos de visualización de PCR para el marcador glmM, para las muestras: #17, #18, # 19, #20, #21 y #22. En la figura 41 el marcador para el gen 16S ARNr para las muestras #10, #11, #15, #16, #19, #20, #21 y #22, las muestras 12, 14, 17 y 18 están negativas no aparecen en la figura, la muestra 13 no se procesó. El cuadro 12 presenta el resumen con los resultados de los marcadores y los análisis de coliformes totales y fecales. Figura 39 Visualización de productos de PCR para glmM (294 pb). muestras #17 a #22. M: Marcador Fast Ruler Low Range 1: H. pylori ATCC 700392; 2: H. pylori ATCC 51932; 3: E. coli, 4: #17; 5: #18; 6: #19; 7: #21; 8: #22; 9: Control: agua Figura 40. Visualización de productos de PCR para glmM para muestra #20. M: Marcador Fast Ruler Low Range; 1: cepa 12455 2: cepa J99; 3:H. pylori ATCC 51932; 4: H. pylori ATCC 700392; 5: #20; 6: Blanco. Figura 41 Visualización de productos de PCR para 16S ARNr (992-1500 pb). M: Marcador Fast Ruler Low Range; 1: Blanco 2: cepa J99 (control); 3: H. pylori ATCC 700392; 4: H. pylori ATCC 51932; 5: #10; 6: #11; 7; #15; 8: #16; 9: H. pylori ATCC 51932; 10: #19; 11: #20, 12: #21; 13: Blanco. Como se puede notar en la figura 42 de la muestra #20, se visualizan dos geles que muestran productos de PCR para el gen cagA, se observa que para las cepas de colección se presentan productos de tamaño aproximado al esperado, mientras que para esta muestra aislada del agua, el tamaño del producto obtenido es mayor al esperado. Figura 42. Visualización de productos de PCR para cagA (128pb). A la izquierda: (M) Marcador Fast Ruler Low Range; (1) H. pylori 12455; (2) H. pylori, J99; (3) H. pylori ATCC 700392; (4) H. pylori ATCC 51932; (5) Muestra 20; (6) E. coli; (7) S. typhi; (8) Blanco. A la derecha M: Marcador Fast Ruler Low Range; 1 y 2: H. pylori ATCC 700392; 3: cepa J99; 4: cepa 12455; 5-7: #20; 8: Control (Agua). En la figura 43, se presenta la muestra # 20 que indica la amplificación esperada para vacA s1a (190 pb), no obstante hubo productos inespecíficos de más de 400 pb, los cuales no influyeron en el rendimiento del producto esperado, esto se consideró así pues esta muestra proviene de cultivo en caldo con probable presencia de ADN de otras cepas. Para esta muestra no se determina la presencia de vacA s1b, vacA m1, ni vacA m2. 1 3 2 4 Figura 43: Productos de PCR para vac A. Imagen1: vac A s1a (190 pb), los controles de H. pylori con s1a se encuentran en las posiciones 1 y 3, en 4 la muestra # 20. Imagen 2: Productos de PCR para vac A s1b (187 pb), en 1 y 2 controles con H. pylori en 5 la muestra # 20. Imagen 3: Productos de PCR para vac A m1 (290 pb), en 1: cepa J99, en 4: muestra # 20; 5: Control (Agua). Imagen 4: Productos de PCR para vac A m2 (352 pb), los controles se encuentran en las posiciones 1 y 3, en 5 la muestra # 20. Controles de H. pylori: ATCC 700392 y H. pylori ATCC 51932 A continuación se presenta el cuadro 12 como resumen, con los resultados de las muestras correspondientes al primer muestreo. Resultados de PCR 16S ARNr y glmM, Coliformes totales (CT) y Coliformes fecales (CF) para las muestras evaluadas de Cartago y San José en el primer muestreo. # de Muestras PCR PCR CT/CF muestra 16S ARNr glmM (NMP/100 mL) Cantón Central de Cartago 10 Naciente Río negativo N.R. neg / neg Loro 11 Naciente Producto de tamaño N.R. 4,5/neg Ladrillera mayor al esperado* 12 Naciente negativo N.R. neg / neg Banderilla 13 Naciente Padre N.R N.R N.R Méndez 14 Naciente Río negativo N.R. 11/neg Claro 15 Naciente La negativo N.R. 23/neg Misión 16 Naciente La negativo N.R. 1,8/neg Ortiga 17 Naciente Paso negativo positivo 13/neg Ancho 18 Naciente San negativo positivo 23/neg Blas 19 Pozo del TEC positivo positivo neg/neg Cuadro 12 20 21 22 Cantón Santa María de Dota Naciente El Cedro Naciente La Viejita Tanque El Centro positivo positivo 900 / neg positivo positivo 22 / neg positivo positivo N.R * Tamaño esperado entre 992-1500pb; Negativo = neg; N.M.P: Número más probable; N.R: no se proceso. Según estos resultados las muestras 19 a 22 tienen los tamaños esperados del marcador de identificación 16S ARNr para H. pylori, además estas muestras son glmM positivas. Las muestras 17 y 18 presentan también el marcador glmM positivo, pero el 16S ARNr negativo; Shahamat (Shahamat, 2004) manifiesta que esta relación de marcadores se puede establecer como Helicobacter sp o como H. pylori “atípica”, (panmítica) no obstante se puede establecer como un problema de diseño del primer ARNr 16S que no reconoce estas cepas. Ninguna muestra con resultados positivos por H. pylori presenta coliformes fecales, parámetro de potabilidad aceptado internacionalmente y expresado en nuestro Reglamento de Calidad de agua para determinar que una muestra de agua es de calidad potable. Luego de obtener estos resultados se estableció la necesidad de ampliar la búsqueda de la bacteria y relacionar su hallazgo con agua de consumo humano en lugares que poseen alta y baja incidencia de cáncer gástrico, con el objetivo de determinar el tipo de agua que la población realmente está consumiendo, o sea muestrear agua con cloro residual, si así es expendida por el Ente Operador oficial del cantón. Así mismo se determinó la necesidad de visualizar las colonias presentes en los cultivos en medios líquidos, por cuanto se decide ampliar el muestreo a 10 cantones de alta incidencia y a 10 cantones de baja incidencia, según la información que se mostró en el cuadro 11. 5.2.2 Segundo muestreo. Análisis de las zonas de alta incidencia. A continuación se indican los resultados del segundo proceso de las muestras correspondientes a los cantones de alta incidencia de cáncer gástrico de Cartago y San José. Para la búsqueda de cepas que correlacionen con H. pylori, a las muestras se les practicó filtración por membrana al agua de la fuente, cultivo del filtro en medio líquido y rayado posterior en placa, selección y diferenciación bioquímica de colonias, además de la determinación de coliformes totales y fecales como parámetro de calidad sanitaria en estas muestras. Estos resultados aparecen bajo el cuadro 13. Cuadro 13. Descripción de las muestras por lugar de procedencia (cantón), análisis de las colonias y diferenciación por pruebas bioquímicas. Código Origen de la muestra 01-07 Cepa biopsia KS 02-07 03-07 Pozo TEC Pozo TEC luego de botar agua por dos horas Cantón de Oreamuno Naciente Carlos Gómez, Naciente Mario Ivancovich, Toño Meneses De un hidrante de la calle, convergen 6 nacientes Tejar del Guarco Naciente Tablón Tanque Palo Blanco Toma de Hacienda Vieja, captación las Cabras. Cantón de Paraíso Naciente. La Capira 04-07 05-07 06-07 07-07 08-07 09-07 10-07 11-07 12-07 13-07 14-07 15-07 16-07 17-07 18-07 Naciente El Bosque Naciente Boquerón Cantón de León Cortes Naciente Zetillal Tanque de captación: naciente Zetillal y Gemelo Gamboa Naciente Gemelo Gamboa # 2 Cantón de Tarrazú Naciente San Guillermo Tanque San Guillermo Naciente El Rodeo Morfología /oxidasa /ureasa Pasa a PCR Bp / + / + √ Bg / + / nr C / - / dudosa √ √ Colonia pequeña diminuta y en gran cantidad Colonia pequeña diminuta Bpd / + / nr √ Bpd / + / nr √ Solo colonias grandes B g / - / nr √ Colonias pequeñas blancas Colonia pequeña Se aísla Bacillus sp Bp / + / + Bp / + / N.R √ √ -- Clorada 0,4 ppm Sin crecimiento positivo en el caldo solo hasta las 48 horas. Se aíslan solo unas 20 colonias puntiformes. Clorada Sin crecimiento Se aíslan colonias pequeñas Bp / + / - √ N.R Bp / + / - --- Se aislam colonias puntiformes Cloro residual 0.2 p.p.m +++ de crec. Colonias puntiformes pero muy pocas En caldo crec ++ a las 48 horas En agar colonias pequeñas Bp / + / Bp / + / + leve √ √ Bp / + / + leve √ Bp / + / + √ N. R --- Bp / +débil /+ √ Apariencia de la colonia elegida Colonias pequeñas puntiformes típicas, con el tiempo presenta hemólisis α con precipitado negro. Colonias mediana Colonias rosadas Caldo + a las 24 horas En caldo crec ++ a las 48 horas Colonias pequeñas. Cloro residual 0.3 ppm En caldo ± a las 48 horas Sin crecimiento en el agar En caldo crec + a las 48 horas √ Código 19-07 Origen de la muestra Cantón de Santa María de Dota: Naciente El Copey 20-07 Tanque Rubén (3 nacientes) 21-07 Tanque el Centro 22-07 25-07 Biopsia paciente WM Cantón Central Cartago Planta de Tratamiento, agua cruda Planta de Tratamiento, agua clorada Cantón de Alvarado Tanque Santa Teresa 26-07 Naciente El Callejón 27-07 Naciente José Castro Cantón de Aserrí: Casa Sr José Sandoval Naciente Juan Carlos #2 23-07 24-07 28-07 29-07 30-07 31-07 32-07 Tanque Ojo de Agua Cantón de Acosta: Planta de tratamiento El Cedral de AyA Agua cruda para potabilizar ( agua de río) Morfología /oxidasa /ureasa Pasa a PCR Bp / - / + √ Bp / + / + √ Bp / + / - √ N.R --- Crecimiento de colonias, no típicas N.R --- Cloro residual: 1.1 ppm Sin crecimiento. N.R --- Bp / - / - --- Bp / - / - --- N.R --- Bp / + / + √ Bp / + / + √ Bp / + / + √ N.R --- Bp / + / + --- Apariencia de la colonia elegida En caldo crec + +a las 48 horas Colonias pequeñas Cloro residual 0.3 ppm En caldo crec + 48 horas. Colonias puntiformes Cloro residual 0.3 ppm Colonias puntiformes. No crecimiento Colonias puntiformes.Caldo +/2 a 48 horas Caldo +/2 a 48 horas Colonias pequeñas y blancas Caldo a 48 horas negativo Caldo ++ a 24 horas Se ven colonias puntiformes Caldo ++ a 24 horas Se ven colonias puntiformes típicas mezcladas Caldo + a 24 horas. Colonias puntiformes Cloro residual 0.6 ppm. Caldo a 48 h negativo Caldo a 24 h +++ Se aíslan colonias puntiformes luego de varios pasajes * No se indica resultado de tinción de Gram (+ o -) pues la bacteria se tiñe con fucsina fenicada, solo se indica la forma. N.R, nr: No realizado. Bpd = Bacilos pequeños delgados; Bg = bacilos grandes; Bp= bacilos pequeños; CB coco bacilos; C= cocos Como se aprecia en el cuadro 13, se realizó una comparación detallada de la morfología colonial compatible con género Helicobacter correlacionándola con pruebas bioquímicas específicas como procedimiento presuntivo de elección. Se logra determinar con el trabajo continuo con las cepas, que estas colonias que se aíslan, su primera apariencia es como colonias puntiformes incoloras, con el tiempo de trabajo y al segundo pasaje, se supone con la exposición al aire, estas aumentan un poco de tamaño se vuelven grises; esto también fue advertido por Lu y colaboradores en su trabajo ( Lu, 2002). A continuación se muestra una foto de estas colonias, bajo la figura 44. Figura 44. Colonias sospechosas de H. pylori de muestra de agua. Bajo el cuadro 14 se presentan los resultados de identificación molecular de las muestras de este segundo muestreo de la zona de alta incidencia, para el marcador glmM, así mismo se ofrecen los resultados de coliformes totales y fecales. Cuadro 14. Resultados de los análisis del marcador glmM con respecto a coliformes totales (CT) y coliformes fecales (CF) correspondientes al segundo muestreo. Código de muestra 01-07 02-07 03-07 04-07 05-07 06-07 07-07 08-07 10-07 12-07 13-07 14-07 15-07 16-07 18-07 19-07 20-07 21-07 28-07 29-07 30-07 Marcador CT/CF glmM (NMP/ 100 mL) + + NR + + + N.R + + + + NR + + + + NR 23 / neg 1,8 / neg 50 / neg 23 / 23 13 / 3,6 23 / neg 900 / 50 neg / neg N.R 50 /neg neg / neg 13 / neg 70/ neg 1,8 / neg 3,6 / neg NR 1,8 / neg 23 / neg 1,8 /neg 11 / neg N.R No se proceso. En la figura 45 se presenta la fotografía que muestra el gel correspondiente a la reacción de PCR de las muestras del cuadro 15 para la región glmM. Figura 45 Visualización de productos de PCR para glmM (294 pb). M: Marcador Fast Ruler Low Range; 1: H. pylori ATCC 700392; 2: H. pylori ATCC 51932; 3: E. coli; 4: 01, 5:02, 6:03, 7:04, 8:06, 9:07, 10:08, 11:10, 12:12, 13:14,14:15, 15:16, 16:18, 17:19 18:21, 19:28, 20:29, 21:30, 22: Control (Agua). 5.2.3 Segundo muestreo. Análisis de las zonas de baja incidencia. A continuación se presentan los resultados del muestreo realizado en los cantones de baja incidencia correspondientes a las provincias de Guanacaste y Alajuela de acuerdo con los lugares establecidos en el cuadro 11. Según la información recolectada previamente se sabía que la mayoría de estas aguas eran administradas por AyA, por lo tanto fue con los personeros del Laboratorio Nacional de Agua que se llevó a cabo este muestreo. Con la información recopilada en el muestreo se confecciona el cuadro 15. Cuadro 15 Información recolectada y cultivo de las muestras de agua de los cantones de baja incidencia dispensada por Ente Operador. Cantón Tilarán La Cruz Los Chiles Nicoya Carrillo Santa Cruz Liberia San Mateo Nandayure Abangares Tipo de muestra Cloro residual (mg/L) Turbiedad Cultivo Oficina de AyA Planta de tratamiento AyA Planta de tratamiento AyA Planta de tratamiento AyA Planta de tratamiento Planta de tratamiento AyA Planta de tratamiento AyA Planta de tratamiento AyA El acueducto lo maneja la Municipalidad. Agua es de la Oficina de la Municipalidad El acueducto lo maneja la Municipalidad (antes de AyA) La muestra se tomo del agua cruda de la planta de tratamiento (río) 0,76 0,57 0,5 1,06 1,9 1,3 0,98 0,97 negativo N.D N.D NP 1,85 1,01 0,47 N.D N.D NP neg** positivo negativo negativo negativo negativo negativo negativo negativo negativo Crec. Positivo (++), pero no se aísla colonias semejantes a Hp Crec. positivo, pero no se aísla colonias semejantes a Hp por la alta carga acompañante ** En el momento del muestreo no se estaba clorando el agua, pero manifiestan que sí se clora. NP Se manifiesta no tener problemas de turbiedad. N.D no detectado. De acuerdo con los resultados mostrados en el cuadro 15 se observa que el 90% de estos cantones son manejados por AyA desde los años de 1960 y principio de los años 1970, esto implica que el cloro residual que se maneja en estos lugares es muy alto. Según estimaciones teóricas la probabilidad de encontrar bacterias viables en aguas que usualmente manejan un cloro residual alto es de aproximadamente 5% (Montero, 2004). En casi todos los cantones de las zonas de baja incidencia se manejan calidades similares de agua para la población. No se realizan análisis de coliformes totales y fecales por cuanto los cultivos de bacterias aparecen negativos. Como resultado de este segundo muestreo se encontró entonces un manejo característico y diferenciado del agua entre las zonas de alta y baja incidencia de cáncer gástrico. Como parte de la información recolectada en los acueductos de los lugares de alta y baja incidencia de cáncer gástrico con los Entes Operadores se muestra la información comparativa bajo el cuadro 16. Cuadro 16. Cuadro comparativo de las zonas de alta y baja incidencia de cáncer gástrico (C.G) sobre la naturaleza del agua y el Ente Operador del acueducto. Característica Cantones con alta incidencia de Cantones con baja incidencia de C.G C.G Oferta hídrica ALTA BAJA Ente operador (como fuente oficial) Municipalidades 90% AyA (muchos años) 90% Naturaleza del agua 100% de nacientes 2 lugares con agua de quebrada 80% de los lugares con pozos. 30% superficial tratada 10% nacientes Temperatura ambiental (como zonas frias o cálidas em C.R) Baja (~ 16 °C – 22 °C) Alta (~ 25 °C – 35 °C) 5.2.4 Tercer muestreo. Análisis de zonas de alta y baja incidencia de cáncer gástrico. En el año 2009 se hizó un tercer muestreo con el objetivo de poder dilucidar la diferencia del efecto “Ente Operador AyA”, en las zonas de baja incidencia; y en las zonas de alta incidencia sobre la calidad del agua que directamente consume la población. En el caso del Cantón Central de Cartago el efecto de cloraciones reconocidas de alta eficiencia se obvió, muestreando las nacientes sin clorar. En este tercer muestreo se tomó agua sin tratar (naciente) y agua de consumo de las poblaciones. Se procesaron muestras provenientes de cultivos líquidos. Para identificar la bacteria se utilizó el marcador glmM y a las muestras positivas se les practicó una identificación de patogenicidad con el marcador de la Proteína Inductora del Factor de Necrosis Tumoral α (FNT- α), para luego enviar a secuenciar los productos de PCR del marcador glmM de dos muestras. A la técnica de cultivo se le practica una variante y es la de incubar el filtro de las muestras en el medio de cultivo a 25 ºC, dado que se menciona ya en la literatura la preferencia de las cepas de H. pylori en ambientes fríos. A continuación se presentan los cuadros 17 y 18 con la información de las muestras recolectadas. Cuadro 17. Resultado de los cultivos de las zonas de alta incidencia Nombre Cloro residual Resultado crec. (48h a 25 °C) Cantón Central Cartago 01-09 Naciente Rio Loro ------+++ 02-09 Naciente Lankaster ------+++ 03-09 Naciente Paso Ancho ------+++ Aserrí 04-09 Naciente Río Jorco -----+++ 05-09 Tanque Intermedio de Rio √ Negativo Jorco 06-09 Casa Familia Sandoval M √ Negativo Paraíso 07-09 Naciente Luis Guzmán ------+ 08-09 Naciente El Guayabal ------+++ 09-09 Naciente El Bosque ------+++ Santa María de Dota 10-09 Naciente El Cedro ------+++ 11-09 Casa Sr Julio Calvo (clorada) sin c.r +++ 12-09 Naciente El Higueronal ------+++ San Pablo de León Cortes 13-09 Naciente Fulvio Gamboa ------+++ 14-09 Naciente Evangelino Mora ------+++ 15-09 Naciente El Zetillal ------+++ Tarrazú 16-09 Naciente El vapor ------+++ 17-09 Tanque El vapor 1era casa (clorada) sin c.r +++ 18-09 Naciente El Guillermo ------+++ Muestras de tierra 19-09 Dota (negra) ------+++ 20-09 León Cortes (amarilla) ------+++ 21-09 Tarrazú (roja) ------+++ Tejar, El Guarco. Barrio Corazón de Jesús 22-09 Fam Loaiza Leiva ------+++ 23-09 Fam Robles Loaiza ------+++ 24-09 Fam Hernández Loaiza ------+++ Alvarado. Cervantes 25-09 Fam Araya Umaña ------+++ 26-09 Fam Umaña Araya ------+++ 27-09 Fam Leitón Araya ------+++ Oreamuno 28-09 Fam Mata Loaiza √ Negativo 29-09 Super Irazú √ negativo 30-09 Fam Rivera Gómez -----+++ Fuente: Datos Laboratorio CEQIATEC Pasa a PCR √ √ -------√ ------------√ ---√ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ -------------------√ Cuadro 18. Resultado de los cultivos de las zonas de baja incidencia Nombre Cloro residual Resultado crec en tubo (48h a 25 °C) Nicoya 31-09 Casa frente al parque ------32-09 Casa entrada a Nicoya ------33-09 Casa 200 mts sur del parque ------Santa Cruz 34-09 Casa frente al parque 35-09 Casa carretera principal ------36-09 Casa fam Cubillo M. Matapalo ------Los Chiles 37-09 Pozo Hotel Caño Negro * ------+++ 38-09 Pozo Asada Super Caño Negro* ------+++ 39-09 Pozo Asada Cabinas Oasis* ------+++ La Cruz 40-09 Pozo # 3 AyA ------+/41-09 Pozo # 4 AyA -----+/42-09 Pozo # 2 AyA ------Liberia 43-09 Pozo Capulín AyA ------++ (película) 44-09 Pozo Hotel Los Boyeros ------++ 45-09 Pozo Moracia # 3 AyA ------Tilarán 46-09 Casa Sr John Jemilguey ------+ (película) 47-09 Vivero del ICE Tronadora +/- (película) 48-09 Finca Sr Ramírez Tronadora ------++ Nandayure 49-09 Casa Fam Monge. Centro ------+ 50-09 Soda Frente al Parque ------+++ 51-09 Cabinas “Mas allá del Puente” ------+ San Mateo 52-09 Restaurante Cactus ------+/53-09 Restaurante Rancho Orotina ------+++ 54-09 Finca fam Solís A Centro ------Carrillo 55-09 Salón El Jordán. Río Cañas ------+/56-09 Fam Belén, Palestina ------++ 57-09 Fam Belén Centro ------+ Abangares 58-09 Barrio La Gloria Salida P de Trat (clorada) sin c.r 59-09 Restaurante El Fogón (clorada) sin c.r 60-09 Cruz Roja (clorada) sin c.r Fuente: Datos Laboratorio CEQIATEC *Aislamientos que presentan colonias típicas Pasa a PCR ------------------------------------------√ (38) √ √ (38) ----------------------------√ ---------------------√ -------√ --------------√ -------√ √ ----------------------------- Luego del cultivo de las muestras y la determinación del marcador molecular glmM no se obtienen bandas del tamaño esperado, por lo que se solicita criterio al Ing. en Biotecnología y Bioinformático Alejandro Hernández y se optó por la reamplificación de los productos porque podría haber una cantidad muy baja de ADN específico de H. pylori, pese a determinar previamente que había una buena cantidad de ADN en todas las muestras procesadas en laboratorio. Una vez reamplificados los productos del marcador glmM se presenta los resultados bajo la figura 46 correspondientes a las muestras expuestas en los cuadros 17 y 18. :Visualización de productos reamplificados de PCR para glmM (294 pb). Imagen 1: M: Marcador Fast Ruler Low Range; 1: Control +, solo la muestra 25 se encuentra positiva. Imagen 2: Muestras positivas: 01, 04, 18, 19, 24 y 38. Imagen 3: Muestras positivas: 02, 10, 12. Imagen 4: Ninguna muestra positiva. Figura 46 En la figura 47 se ofrece el producto de amplificación del gen de la Proteína Inductora del Factor de Necrosis Tumoral Alfa (Tiphalfa, FNT-α) de las muestras positivas con el marcador glmM. Figura 47. Visualización de productos de PCR para FNT-α (273 pb) en las muestras positivas con el marcador glmM. En el cuadro 19 aparece el resumen de los resultados de los marcadores glmM y FNT-α (Tiphalfa) para el tercer muestreo. Cuadro 19. Resultados del análisis de los marcadores glmM y FNT-α por muestra para el tercer muestreo. Muestra Tamaño del producto de PCR reamplificado (294 pb). 1 Producto del tamaño esperado 2 Producto del tamaño esperado 4 Producto del tamaño esperado 7 Negativo 9 Negativo 10 Producto del tamaño esperado 11 Negativo 12 Producto del tamaño esperado 13 Negativo 14 Negativo 15 Negativo 16 Producto del tamaño esperado 17 Negativo 18 Producto del tamaño esperado 19 Productos de mayor tamaño al esperado de 350 pb, y 450 pb. 20 Negativo 21 Negativo 22 Negativo 23 Negativo 24 Una banda de mayor tamaño al esperado (325 pb) y una de menor tamaño al esperado (200 pb) 25 Producto del tamaño esperado 26 Negativo 30 Negativo 38 Un producto del tamaño esperado y otro producto de mayor tamaño al esperado (400 pb). 44 Negativo 48 Negativo 50 Negativo 53 Negativo 55 Negativo 56 Negativo N.R no se realizó Presencia del FNT-α (Tiphalfa) N.R Origen de la muestra + (muy leve) - Naciente no se usa directo Naciente no se usa directo Naciente no se usa directo ------------Naciente de uso directo -------Naciente de uso directo ------------------Naciente de uso directo ------Naciente de uso directo Suelo + ------------------------Casa de familia + + + + - + - Casa de familia ------------Pozo después de fuerte lluvia ------------------------------------- Con respecto a la secuenciación, se procedió a escoger dos productos de amplificación para el gen glmM correspondientes a los códigos de muestra 25 y 12, y junto con el control positivo la cepa J99 de Helicobacter pylori. Macrogen reporta que el control enviado de la cepa J99 tiene como secuencia nucleotídica un 100% de homología con el gen glmM reconocido de la cepa de H. pylori J99. El aislamiento marcado como muestra 25 se reporta como secuencia nucleotídica con un 98% de homología con la cepa J99, además se determina un 97% de homología con el gen ureC de la cepa H. pylori 224A UreC y una homología de 97% con el gen ureC de la cepa H. pylori 170A UreC. El aislamiento marcado como muestra 12 se reporta como secuencia nucleotídica de 97% de homología con respecto a la cepa J99, y al estudiar las cepas reportadas se determina un 96% de homología con la cepa H. pylori PP01A1 y un 95% de homología con la cepa H. pylori PP03A1. Lo anterior confirma que las cepas fueron verdaderos aislamientos de H. pylori. En el anexo 5 se indican para ambas muestras las secuencias que se tomaron en cuenta para el análisis, así como datos de origen de las mismas. A continuación se explica en un dendograma el parentesco filogenético de las cepas secuenciadas en un árbol de máxima parsimonia 35/209 sitios parsimoniosos (construcción a partir de sitios informativos). Los números expresan porcentajes y el tamaño de las rayas señala las distancias o diferencias en el ADN. En todos los árboles el grupo se mantiene conservado, lo que refleja que el subgrupo es verdadero y no producto del azar. Se seleccionaron todas las cepas reportadas bajo el gen glmM. Se tomaron en cuenta secuencias de 208 pares de bases del gen, esto se aprecia en la figura 48. s2 50 25 100 J99 Cepas en Estudio 12 50 214AUreC 161AUreC 100 PP23A1 51 PP3A1 182AUreC 100 PP01A1 100 Sub Grupo 224AUreC 146A Helicobacter pylori 029AUreC 50 170AUreC 51 168AUreC 100 146AUreC 216AUreC 98 215AUreC 156AUreC GENOME.HPAG1 50 Cepas Shi 51 pp44a1 100 H.acinonychis.Lion-Tiger H.acinonychis.Tiger H.acinonychis.Lion 100 Helicobacter acinonychis H.acinonychis.Mac.Lion 100 H.acinonychis.Sheeba 10 8 6 4 2 0 Figura 48. Árbol de máxima parsimonia con el parentesco filogenético de las cepas secuenciadas en estudio (rojo), según gen glmM. En el cuadro 20 se enseña un resumen final del porcentaje de positividad de las muestras de agua por zonas de estudio para los 3 muestreos de la investigación. Cuadro 20 Resumen de los resultados por muestreo en las zonas de alta y baja incidencia. Muestras de agua por muestreo ero 1 (12) 2do (40) 3ero (60) Total 112 muestras % Total positividad Lugares de alta incidencia Lugares de baja incidencia +/total +/total 6/12 12/30 10/30 29/72 N.R 0/10 3/30 3/40 39 7,5 N.R: no realizado. Del análisis de los resultados de las muestras hallazgos: se lograron los siguientes - En el primer muestreo (2006-2007), se analizaron 9 muestras de agua de nacientes pertenecientes al cantón Central de Cartago y 2 al cantón de Dota en San José, de estas nacientes 2 de Cartago se encontraron positivas y las 2 de Santa María de Dota, con el marcador de identificación glmM. En el caso de las nacientes de Dota estas se dispensaban como tal (sin tratamiento) directamente a la población y se juntaban en un tanque que también se encontró positivo. - Para el segundo muestreo (2007-2008), se pudo determinar que de las 24 muestras correspondientes a tanques y nacientes de las zonas de alta incidencia se hallaron en 12 de ellas cepas positivas con el marcador glmM, que concuerdan con el tamaño esperado, según las cepas de referencia de Helicobacter pylori utilizadas como control positivo en agua manejada por las municipalidades, o sea de uso oficial. - De los aislamientos mostrados en la zona de alta incidencia, se encontró que en 8 muestras de agua que contenían cloro residual se aisló e identificó molecularmente la bacteria en 2 de ellas que contenían respectivamente 0,3 mg/L y 0,4 mg/L; en otras dos muestras, aunque se aislaron colonias similares con características bioquímicas similares también correspondientes a H pylori, no se pudo corroborar molecularmente. - Con respecto a las zonas de baja incidencia se determina según lo indicado en el cuadro 15 que el 80% de las muestras contienen cloro residual en alta cantidad, pertenecientes a los acueductos de AyA. El otro acueducto clorado el de Abangares, también fue un acueducto de AyA al cual se le da tratamiento regular. En el otro cantón Nandayure, en este análisis puntual, no se aislaron colonias semejantes a H. pylori. - En el tercer muestreo realizado en el año 2009, se tomaron 27 muestras de agua cruda y 3 muestras de suelo de la zona de alta incidencia, y de la zona de baja incidencia se tomaron 27 muestras de agua cruda y 3 muestras de agua tratada sin cloro residual del acueducto de Abangares. De éstas, se obtienen 11 muestras positivas de la zona de alta incidencia y 3 de la zona de baja incidencia, alcanzando porcentajes similares en la zona de alta incidencia a los logrados en el segundo muestreo. - Para este muestreo también se indaga un nuevo marcador, el gen de la Proteína Inductora del Factor de Necrosis Tumoral Alfa (Tiphalfa, FNT-α), el cual se encontró en el 63% de las cepas glmM positivas. Este se considera un hallazgo muy importante por cuanto es un marcador de patogenicidad que apenas se empieza a conocer y nunca ha sido probado en cepas ambientales. Una vez finalizado el segundo muestreo se advierten las diferencias entre ambas zonas de alta y baja incidencia y se decide recolectar información ambiental geofísica y de manejo del agua que pueda marcar diferencias significativas, con el fin de relacionar el hallazgo de la bacteria con la incidencia de cáncer gástrico para las zonas marco de estudio de nuestro país, y proponer posibles relaciones entre la presencia de H. pylori y la patología específica de cáncer gástrico, con el fin de abordar el tercer objetivo de este trabajo con respecto a la valoración del manejo del agua potable en Costa Rica . A continuación se presenta la situación encontrada en cada acueducto muestreado, con respecto al manejo de su recurso hídrico. 5.3 Situación de los acueductos marco de la investigación Acueductos en las zonas de alta incidencia: Cantón Oreamuno: Sólo se maneja agua municipal. No hay áreas protegidas. Cuentan con 7 ASADAS que no se sabe si las cloran o no. Al momento del muestreo (2008) se manifiesta que cloran solo los días lunes, actualmente el sistema de cloración ha mejorado. Cantón Tejar del Guarco: Sólo se maneja agua municipal. De 15% a 20% de las tuberías son de hierro fundido que es con plomo, no tienen asbesto. Una vez, hace mucho tiempo, cloraron, pero no se volvió a realizar. Tienen 8 pozos y 8 nacientes que incluyen 6 nacientes pequeñas que se reúnen en un solo tanque. Tienen 3 captaciones que son realmente quebradas, así tal y como se capta le llega el agua al usuario, realmente de color café. Cantón Paraíso: La principal fuente de abastecimiento de agua es de origen municipal, sólo una pequeña porción del agua dispensada proviene de AyA del proyecto Orosí. Las 3 muestras que se tomaron para la investigación son las que abastecen todo el centro de Paraíso. Las 3 nacientes se encuentran en zonas protegidas. Las 3 nacientes están cloradas, pero solo en una de ellas se tomó el cloro residual. La cloración de la red de agua para la población ha ido mejorando en los últimos años, aproximadamente desde hace unos 4 años. Cantón Alvarado: Administrada por la municipalidad. Tienen 24 nacientes, no cloran al momento del estudio. Hace 10 años cloraban, pero el clorador se descompuso. Tienen 10 tanques de almacenamiento. No tienen ASADAS. Es una zona agrícola, llega hasta el volcán Irazú a 2400 mts Cantón León Cortés. Hay varias ASADAS y 2 acueductos administrados por vecinos. La municipalidad tiene 3 nacientes, no tiene pozo, ni quebradas para el abastecimiento de agua. Se toma muestra de un tanque de captación donde llegan las nacientes de Zetillal y Gemelo Gamboa #1; el cloro residual es de 0,2 ppm ( muy bajo). Cantón Tarrazú: Poseen BANDERA AZUL. No tienen quebradas ni pozos, se cuenta con 3 ASADAS. Disponen de 6 nacientes y tienen 2 nacientes que en este momento están cloradas. Una fuente de agua la deben tratar con piedra caliza pues es sumamente ácida a pH 4.5, ya tratada neutralizada. Implementaron el cloro hace 10 y 15 años, no obstante el tanque San Guillermo tiene un cloro residual de 0,3 ppm. Las nacientes están en áreas protegidas y comprenden alrededor de 3 hectáreas. Cantón Santa María de Dota: Al momento del tercer muestreo tienen 11 tanques todos clorados, 3 nacientes, 1 quebrada. No hay pozos, y ponen 3 pastillas por tanque. Al tanque Rubén llegan 3 nacientes con 0,3 ppm El tanque El Centro presenta 0,3 ppm de cloro residual y es el que tiene precipitación negra La municipalidad se visitó en el primer muestreo en el 2006, y en ese momento se comentó que nunca se había clorado el agua. A partir de este primer muestreo ellos empiezan a clorar el agua. Cantón Aserrí: Manejan solo en Vuelta de Jorco un acueducto rural, es una ASADA muy grande, hay 2 fontaneros además tienen sus medidores. Tienen 7 nacientes que van a un quiebragradiente y de allí a un tanque Se tomaron muestras de la naciente, el tanque y una casa. Nunca han clorado el agua, luego de la primera visita empiezan a clorar el agua. Cantón Acosta: Planta de tratamiento manejada por AyA, El Cidral sale con cloro residual de 0,6 mg/L. El agua cruda proviene del río y se trata con gas cloro. No tienen claro desde cuando inicia AyA en esta zona, pero se puede observar que la planta de tratamiento es bastante nueva. Cartago Cantón Central • • • Poseen 11 nacientes todas cloradas, algunas de ellas con cloro gas (generalmente no se trabaja con menos de 0,5 mg/L). Aproximadamente un tercio de la población recibe agua del sistema Orosí-Cachí, Con cloración permanente y eficiente desde aproximadamente 12 años por empresa externa. Es el único cantón que le hace al agua análisis físico-químicos completos. Situación de los acueductos en las zonas de baja incidencia Cantón de Los Chiles: AyA existe en la zona desde 1961, ellos abastecen el casco central, o sea solo el distrito primero, pero este cubre el 50% de la población del cantón. El segundo y tercer distrito El Amparo y Caño Negro tienen sello de calidad, el cuarto distrito San Jorge no. Dejan el cloro residual en 0,5 ppm, no se mide la turbiedad. Utilizan agua de pozos entre 48 y 50 mts y no tienen problemas de color, no hace falta filtrarla. Se menciona que las aguas de pozo no se filtran porque nunca se enturbian, aunque llueva. La gente abre sus propios pozos y hay muchos. En la parte de la perforación de los pozos los suelos son oscuros, pero camino al lugar se pueden ver muchas zonas de suelos arcillosos. Cantón Santa Cruz: Trabaja sólo con agua de pozo, utilizan 4 pozos, con un residual promedio de 1,3 ppm y una turbiedad de 0,47 ntu. El AyA cubre aproximadamente el 50% de la población. Tienen 54 ASADAS. Cantón Carrillo Sistema se abastece con 2 pozos Hay 21 ASADAS AyA abastece al 40% de la población del cantón Cloro residual del sistema 1.93 ppm Turbiedad aproximada de 1,01 ntu. Cantón Nicoya AyA trabaja con agua superficial tratada y con pozos, el agua cruda es captada en el río Potrero, población a la que asiste AyA aproximadamente el 35%. Existen en el cantón 75 ASADAS Con un cloro residual de 1,06 ppm. Una turbiedad de 1.85 ntu Cantón Tilarán El acueducto lo inauguró AyA en 1958, lo tomó unos años después. Manifiestan no presentar problemas de turbiedad, sólo si hay mucha lluvia. Tiene 8 nacientes y 1 pozo, divididos en 4 sistemas, que manejan el agua del 66% de la población del cantón. El resto de los servicios los manejan las ASADAS que son 27, algunas de ellas dispensan agua clorada. El centro se clora con cloro gas, las otras con hipoclorito de calcio. Tiene sello de calidad sanitaria “Bandera Blanca”. Se considera un acueducto de excelente calidad Se tomó una muestra en la red con un cloro residual en 0,76 ppm. Cantón La Cruz AyA entró a La Cruz en los años 70. Se abastecen de 4 pozos que se cloran No tienen problemas de turbiedad. 3 años consecutivos de sello de calidad “Bandera Blanca”. Aproximadamente llegan al 80% de la población del cantón, el otro 20% lo constituyen 12 ASADAS. Cloro residual 0,57 ppm Cantón Liberia Manejan aproximadamente 11 pozos. Tienen ASADAS, pero no saben cuántas. Llegan aproximadamente al 40 % de la población del cantón Cloro residual 0,98 ppm. Cantón Nandayure La administra la Municipalidad. Nunca han tenido agua de AyA, pero les hacen los análisis y se les manifiesta que sus nacientes son excelentes, la captación está muy cerca de la zona de recarga, no tienen problemas con químicos, con olores o con turbiedad. En sólo una ocasión la cloraron, pero esto le disgustó a la población Cantón Abangares • • • • Este lo tiene la municipalidad desde hace 10 años. Anteriormente lo tenía AyA. Se abastece del río Abangares con HTH y cloro gas, en el momento del primer muestreo no se le estaba dando tratamiento, el agua pasaba directo del río. En el segundo muestreo la población manifiesta que el agua sabe demasiado a cloro (probablemente porque no se le da tratamiento completo al agua del río). No se sabe cuántas ASADAS tienen y cuántas se cloran.El sistema puede llegarle a un 35% de la población. Tienen tratamiento completo con filtros lentos. En las visitas no quedó claro si el sistema si está trabajando o no. Cantón San Mateo Tratan una quebrada en el invierno y en el verano un río El Machuca Han tenido el sistema por 17 años. Llegan al 75% de la población Muestra con cloro residual 0,97 ppm En los cuadros 21 y 22 se muestra información recolectada sobre la naturaleza del agua que manejan los Entes Operadores de los acueductos de las zonas de alta y baja incidencia de las zonas de estudio. Cuadro 21. Naturaleza del agua por Ente Operador para cantones de baja incidencia de cáncer gástrico. 1 Información suministrada por cada Ente Operador Oficial sea el Instituto Nacional de Acueductos y Alcantarillados, o la Municipalidad. En ninguno de los casos el Ente Operador abastece a menos del 50% de la población del cantón. Cuadro 22. Naturaleza del agua por Ente Operador para cantones de alta incidencia de cáncer gástrico. 1 Información proporcionada por cada Municipalidad. y la Municipalidad de Acosta En los cuadros 23 y 24 se presenta la información recolectada para comparar estadísticamente ambas zonas, según las variables: altura, temperatura media anual y precipitación, con el fin de establecer correlaciones con respecto a las tasas de incidencia y determinar cuáles variables pueden estar realmente relacionadas. Cuadro 23. Temperatura, altura y precipitación media anual para cantones de alta incidencia de cáncer gástrico, Costa Rica Fuente: 1 Ministerio de Salud, Unidad Estadística, Registro Nacional de Tumores. Instituto Geográfico Nacional, altura correspondiente al distrito primero del cantón. 3 Instituto Meteorológico Nacional. * Medida directamente de las estaciones meteorológicas a 2008. ND: no se dispone de datos 2 Cuadro 24. Temperatura y altura para cantones de baja incidencia de cáncer gástrico, Costa Rica. Fuente: 1 Ministerio de Salud, Unidad Estadística, Registro Nacional de Tumores. Instituto Geográfico Nacional, altura correspondiente al distrito primero del cantón. 3 Instituto Meteorológico Nacional. * Medida directamente de las estaciones meteorológicas a 2008 ND: no se dispone de datos 2 En la figura 49 al graficar la información con altura y tasa de incidencia para cáncer gástrico se observa una marcada diferencia, que corresponde a un coeficiente de correlación entre ambas variables de 0,86. Figura 49 Correlación entre altura y tasa de incidencia de cáncer gástrico para los cantones marco de estudio. La correlación entre altura y tasa se realizó con el objetivo específico de establecer correlaciones estadísticas de acuerdo con lo observado en las zonas entre tasas de alta y baja incidencia de cáncer gástrico con factores geofísicos ambientales, relacionados con la sobrevivencia en el ambiente y adquisición de Helicobacter pylori en el agua de consumo por la población. Luego se comparó la incidencia de cáncer gástrico de los cantones marco del estudio con altitud, temperatura ambiental, tipo de suelo, naturaleza del agua utilizada y Ente operador del acueducto. Se analizaron todas las variables estadísticamente utilizando el software SPSS. Cuadro 25 Correlaciones estadísticas entre las variables ambientales Incidencia1 Pearson Correlation Incidencia1 Altura 1 .867 Sig. (2-tailed) N Altura .867 Sig. (2-tailed) .000 Pearson Correlation Sig. (2-tailed) N Nacientes ** Pearson Correlation N Temperatura 20 20 ** ** ** ** .002 20 20 20 1 -.980 -.980 ** .000 20 20 .774 ** ** .000 20 20 1 -.773 ** .000 20 ** .774 .000 -.773 20 ** Pearson Correlation .651 Sig. (2-tailed) .002 .000 .000 20 20 20 N .651 .000 .000 ** -.853 Nacientes .000 20 -.853 Temperatura 1 20 **. Correlation is significant at the 0.01 level (2-tailed). Se hicieron regresiones lineales de incidencia con altura y temperatura, si se incluyen de forma conjunta se producen problemas de multicolinearidad debido a que ambas están correlacionadas muy fuertemente y aportan la misma información con respecto a incidencia. Si se consideran por separado ambas tienen coeficientes de regresión significativos de acuerdo con lo expuesto en el cuadro 26, se nota que las incidencias no son aleatorias. Cuadro 26 Análisis de Regresión lineal entre incidencia y altura e incidencia y temperatura. Model Summary Change Statistics Adjusted R Model R R Square 1 .867 a Std. Error of Square .752 Sig. F the Estimate R Square Change .738 8.32488 F Change .752 df1 df2 54.507 1 Change 18 .000 a. Predictors: (Constant), Altura b ANOVA Model 1 Sum of Squares df Mean Square Regression 3777.537 1 3777.537 Residual 1247.466 18 69.304 Total 5025.003 19 F 54.507 Sig. .000 a a. Predictors: (Constant), Altura. b. Dependent Variable: incidencia1 Coefficients a Standardized Unstandardized Coefficients Model 1 (Constant) B Std. Error 12.736 2.950 .021 .003 Altura a. Dependent Variable: incidencia1 Coefficients Beta Collinearity Statistics t .867 Sig. Tolerance 4.318 .000 7.383 .000 1.000 VIF 1.000 Model Summary Change Statistics Adjusted R Model R R Square 1 .853 a Square .728 Std. Error of Sig. F the Estimate R Square Change .713 8.71674 F Change .728 df1 48.134 df2 1 Change 18 .000 a. Predictors: (Constant), Temperatura b ANOVA Model 1 Sum of Squares df Mean Square Regression 3657.334 1 3657.334 Residual 1367.669 18 75.982 Total 5025.003 19 F Sig. 48.134 .000 a a. Predictors: (Constant), Temperatura. b. Dependent Variable: incidencia1 Coefficients a Standardized Unstandardized Coefficients Model 1 (Constant) Temperatura B Std. Error 92.242 9.233 -2.743 .395 Coefficients Beta Collinearity Statistics t -.853 Sig. 9.991 .000 -6.938 .000 Tolerance 1.000 VIF 1.000 a. Dependent Variable: incidencia1 Analizando ambas variables se tiene que arrojan prácticamente la misma información. Se decide tomar en cuenta sólo la regresión entre incidencia y temperatura como variable predictiva. En términos generales para el análisis de los datos de regresión se debe de tener cuidado por cuanto el problema es realmente multifactorial y no tanto de causa efecto cuando se maneja una sola variable. Se realizó una prueba exacta de Fisher con el fin de conocer si las dos variables cualitativas de incidencia y Ente Operador del Acueducto están relacionadas, esto se aprecia en el cuadro 27. Cuadro 27 Prueba exacta de Fisher para independencia entre nivel de incidencia de cáncer gástrico y Ente Operador. Alto Bajo Todo AyA 1 8 9 Municipalidad 9 2 11 Todo 10 10 20 Prueba exacta de Fisher: Valor P = 0.0054775 Filas: incidencia, columnas: Ente operador, contenido de la celda: conteo Del análisis anterior se determinó que existen correlaciones importantes y significativas, según: Coeficiente de Correlación de Pearson entre: - Incidencia de cáncer gástrico y altitud: 0,867 - Incidencia de cáncer gástrico y temperatura ambiental: - 0,853 - Incidencia de cáncer gástrico y origen del agua como naciente: 0,651. - Coeficiente de Regresión Lineal entre incidencia y temperatura: R2 = 0,728. En la prueba exacta de Fisher al evaluar la independencia entre nivel de incidencia (baja y alta) con Ente Operador del Acueducto al 2005, se encontró evidencia para rechazar la hipótesis nula de independencia entre las 2 variables, con un valor de p < 0,05, se concluye que existe relación entre las variables y que esta relación no se debe al azar con un 95% de confianza, es decir, se infiere que existe relación entre quién opera el acueducto y la incidencia de cáncer gástrico para las 2 zonas de estudio en Costa Rica, y que el Ente Operador puede ser entonces una variable muy importante en el problema. Todos estos son factores que se pueden relacionar con sobreviviencia de H. pylori en el ambiente. Una vez analizadas las variables anteriores surgió entonces la pregunta: ¿ cómo se comportanen el marco de las zonas de estudio las tasas de incidencia de cáncer gástrico actuales y si éste realmente está disminuyendo en el país. Se investigaron los datos de las estadísticas de los lugares de alta y baja incidencia, con respecto a las tasas de cáncer gástrico mostradas por quintiles del cuadro 11, las tasas de incidencia aparecidas bajo las figuras 22 y 23 de los períodos 1990- 1999 y las tasas de los períodos 1995 - 2003 para cáncer gástrico y se muestra este análisis bajo las figuras 49 y 50 y los cuadros 28 y 29. No se presenta el análisis de estadísticas anteriores a 1990, pues el Registro Nacional de Tumores no lo llevaba por cantones, sino por provincias. Cuadro 28. Tasa de los cantones marco del estudio correspondiente al quintil 1 de alta incidencia de cáncer gástrico para los periodos 1999 y 2005. Quintil León Cortes Tasas periodo 1990-1999 68,57 Tarrazú El Guarco Paraíso Alvarado Aserrí Cartago Acosta Oreamuno Dota 55,12 48,48 43,12 39,59 36,97 36,91 36,68 35,22 34,58 Cantón Quintil 1 Tasas periodo 1995-2005 51,4 1 1 1 1 1 1 1 1 1 39,32 40,3 39,42 42,77 43,46 33,92 39,95 39,23 39,14 1 1 1 1 1 2 1 1 1 1 Fuente: Datos de las tasas de incidencia del Registro Nacional de Tumores Fuente: Datos de las tasas de incidencia del Registro Nacional de Tumores Figura 50 Comparación de las tasas por 100 000 habitantes de alta incidencia de cáncer gástrico por cantón, para las estadísticas de los periodos 1990-1999 y 1995-2005. Cuadro 29. Tasa de cantones marco del estudio correspondiente al quintil 5 de baja incidencia de cáncer gástrico para los períodos 1999 y 2005. Cantón Nicoya Los Chiles Abangares La Cruz Liberia Santa Cruz Tilarán Nandayure San Mateo Carrillo Tasas periodo 1990-1999 18,97 18,16 17,95 17,88 17,01 15,9 15,49 14,25 11,94 9,8 Quintil 5 5 5 5 5 5 5 5 5 5 Tasas periodo 1995-2005 22,62 21,21 11,97 13,74 17,95 20,61 23,23 17,26 18,62 12,17 Quintil 3 4 5 5 5 4 3 5 4 5 Fuente: Datos de las tasas de incidencia del registro Nacional de Tumores Fuente: Datos de las tasas de incidencia del Registro Nacional de Tumores Figura 51. Comparación de las tasas por 100 000 habitantes de baja incidencia de cáncer gástrico por cantón, para las estadísticas de los periodos 1990-1999 y 1995-2005. De la presentación de los datos anteriores se deduce que en Costa Rica la incidencia de cáncer gástrico no tiene una franca tendencia a la disminución ni en mujeres ni en hombres, tal y como se aprecia también en la figura 20, en la cual se puede ver disminución hasta el año 2002. Para 2003 ésta aumentó y luego de esto el Registro Nacional de Tumores no ha presentado más datos. En las estadísticas de 1995-2003 se aprecia que la incidencia ha disminuido porque bajaron las tasas en los tres cantones de más alta incidencia, sin embargo en los otros cantones marco de este estudio en el país, esta disminución es poco clara. Según las estadísticas de mortalidad en hombres esta si ha disminuido a partir del año 1995, no así la de las mujeres, la cual se muestra según la figura 20 “estancada”. Cabe aclarar que para demostrar una tendencia de aumento como en este, se necesita de tres puntos consecutivos, o sea se requieren los próximos datos estadísticos, para valorar realmente la tendencia en la incidencia de las zonas marco de la investigación. Entonces, no se puede afirmar definitivamente que en Costa Rica, como país, la incidencia de cáncer gástrico esté disminuyendo, lo que hace pensar que la influencia intrínseca que aumenta selectivamente la tasa, aún permanece en el ambiente y por ende en la población. Se decidió valorar entonces la diferencia de las fuentes de abastecimiento de zonas de alta y baja incidencia, o sea entre pozos que son los que predominan en las zonas de baja incidencia (además clorados porque los maneja AyA en su mayoría) y nacientes, que son las que predominan en las zonas de alta incidencia y son manejadas por municipalidades. Dicha diferencia se propone que puede corresponder a la influencia de suelo en el momento de la captación del agua por el Ente Operador y al que se le proporciona de diferente manera, directamente, la materia orgánica que contiene. La influencia del suelo es mayor cuando el agua es dispensada de nacientes que cuando es dispensada por medio de pozos. Al buscar y analizar información sobre el suelo del país se tiene que por la naturaleza y el clima tropical de Costa Rica existen muchos tipos de suelos y de gran variedad, resultando difícil el análisis de la información por tipo de suelo, tal y como se puede apreciar en la figura 52. Figura 52 Mapa de suelos de Costa Rica. Ministerio de Agricultura y Ganadería MAG. También se trató de hacer esta correlación por tipo específico y tasa de incidencia de cáncer gástrico, según le fue solicitado al Dr. Edgar Ortiz del CIBI, en el ITCR arrojando la información que aparece en la figura 53. Fuente: Datos Dr Edgar Ortiz y Sebastián Weber, CIBI, ITCR Figura 53 Tipo de suelos de los lugares de alta y baja incidencia de cáncer gástrico. Entonces de acuerdo con el análisis de los suelos de las áreas en estudio, encontró que en éstas no se observa claramente una distribución específica tipo de suelo, lo que se consulta al Máster Federico Masis del Centro Investigación y de Servicios Químicos y Microbiológicos- CEQIATEC, experto química del suelo. se de de en Se presenta en tal caso, entonces un análisis no por tipo de suelo sino por características geomorfológicas y físico-químicas importantes y diferenciales, que explican un supuesto desarrollo de H. pylori en el suelo como posible habitante, pues como parte de la investigación se determinó que una de las características de fertilidad del suelo es la presencia de las bacterias ureasa positivas, lo cual a la fecha no se ha relacionado. Se buscó un análisis específico de las zonas de alta y baja incidencia de cáncer gástrico estudiando el acceso del hierro y del níquel, la humedad y la acidez, mostrando los resultados que aparecen en el cuadro 30. Cuadro 30. Descripción geomorfológica y físico química de los suelos de las áreas de alta y baja incidencia de cáncer gástrico, marco del estudio. Condición del Zonas de alta Zonas de baja suelo incidencia incidencia (A.I) (B.I) Geomofología, (Denyer y Kussmaul 2000). Predominan materiales volcánicos de composición andesítica: SiO2 (54,5%), Fe2O3 (3,2%), FeO (3,5%) Predominan formaciones de composición riolítica SiO2 (70,7%), Fe2O3 (1,9%) FeO (0,3%) Observaciones Implica la presencia de rocas que contienen mayores porcentajes de hierro sobre el área de alta incidencia. Sobre la formación andesítica, los procesos de meteorización que actúan en las rocas pueden liberar mayores concentraciones de hierro en el suelo. Relieve y elevación La mayor elevación y bajas temperaturas favorecen mayores contenidos de materia orgánica en el suelo (MOS) Mayores temperaturas y un relieve ligeramente ondulado La actividad microbiana depende de la humedad y la temperatura del suelo, y más aún de la disponibilidad de carbono fácilmente accesible que es utilizado como fuente de energía por los microorganismos. (Bernal 2003). Predominan mayores concentraciones de MOS, la materia orgánica experimenta un proceso natural de mineralización que permanentemente acidifica el suelo (Bertsch 1998), a su vez incrementa la solubilidad del hierro en sus formas 2+ 3+ Fe y Fe condicionados por los cambios del “potencial oxidación/reducción” en el suelo Relación entre la A una precipitación precipitación anual y media anual comparable la tasa de infiltración entre las dos zonas, la de agua en el suelo. evapotranspiración es menor, este fenómeno también puede ser apoyado por una menor temperatura mensual, lo que puede implicar mayores tasas de infiltración de sustancias solubles hasta el suelo profundo Fuente: Análisis bibliográfico MSc Federico Masís. Los suelos en promedio pueden exhibir mayores pH que los suelos de las regiones de alta incidencia. A mayor basicidad en los suelos o sea a un pH mayor, se presenta una menor disponibilidad del hierro (Barber 1984) Comparativamente la evapotranspiración es mayor, por una temperatura comparativamente mayor. Normalmente metales pesados que puedan estar presentes en el suelo, tales como el níquel, pueden experimentar una alta movilidad. Ni>Cd>Zn>Pb>Cu Proceso acidificación suelo de del 6. Discusión En el presente trabajo se logró la detección de Helicobacter pylori a partir de muestras de agua por cultivo, y posterior verificación por análisis molecular. La importancia de estos hallazgos, su origen, la interpretación de los resultados y la integración de información adicional como el sitio de origen del muestreo y su relación con la lluvia y el tipo de suelo serán parte de la discusión que se presenta a continuación. Con respecto a la fuente, los trabajos de Helicobacter pylori generalmente se han realizado a partir de muestras directas o indirectas de pacientes humanos. Sin embargo, pocos trabajos dan cuenta de su hallazgo en agua y menos en agua de consumo de la población. En el cuadro 31 se muestra una revisión de trabajos publicados en los últimos 10 años, se excluyen los estudios en los cuales la matriz se inoculó de forma artificial. Cuadro 31. Trabajos publicados sobre recuperación e identificación de H. pylori en el mundo en matriz agua Investigación Tipo de agua Baker, et al. “Presence of Helicobacter pylori in Drinking Water is Associated with Clinical Infection”. Lu, et al. “Isolation and Genotyping of Helicobacter pylori from Untreated Municipal Wastewater”. Horiuchi T, et al. “Helicobacter pylori DNA in drinking water in Japan”. Hulten K, et al. “Helicobacter pylori in the drinking water in Peru”. Hulten K, et al. “Presence of Helicobacter species DNA in Swedish water”. Hegarty J, et al. “Occurrence of Helicobacter pylori in surface water in the United States” Krumbiegel P, et al. “Helicobacter pylori determination in nonmunicipal drinking water and epidemiological findings”. Kowolick, et al. Water and Biofilm Transmission of Helicobacter Pylori (Hp) in Rural Guatemalan Households: 199 Marcador Observación Pozo -ureA Comparan presencia de E coli con H pylori. Hubo una muestra que no coincidió de E coli con H pylori Agua residual -16S ARNr alelos de vacA Rio, agua de pozo -16S ARNr 23 aislamientos de 37 fueron confirmados Hp, con uso de anticuerpos inmunomagnéticos y luego cultivo Solo un 62% de los aislamientos específicos pudieron ser confirmados 2 cepas fueron secuenciadas Solo 2 muestras de pozo fueron positivas Agua de uso de la comunidad -Adhesinas -16S ARNr Pozos, tanques, Municipal y en agua de desecho En agua superficial y agua de naciente -Adhesinas -16S ARNr -Microscopia inmunofluorescente No hubo correlación significativa entre coliformes totales y E coli, sugiriendo que el indicador falla para la protección del usuario para H pylori Agua de pozo -RT-PCR (16S ARNr) Se analizaron 157 pozos . De estos se encontró la bacteria en un 10%, con un límite de detección de 125 bact/L. Secuenciaron cepas pero a partir de secuencias de NCBI similares obtuvieron secuencias cercanas relacionadas Hisopados internos de tubería y agua de casas PCR-anidada Se analizó agua de las casas de una zona indígena de Guatemala (agua de lago de forma directa), el 29% de las muestras fueron positivas Uso de anticuerpos inmunomagnéticos 24 muestras amplificaron el marcador de la adhesina, y de esas 11 amplificaron con 16S (46%) Solo pudieron llegar hasta género, hubo bacterias que no pudieron identificar Es pertinente denotar que Hegarty tiene el único trabajo en nacientes y fue el primero en reportar la no correlación entre H. pylori y E. coli; asimismo Lu y colaboradores son los únicos que han secuenciado cepas provenientes de agua residual. Cuando H. pylori se adhiere a una superficie empieza la activación de genes relacionados con quorum sensing y de esta forma se activan mecanismos de formación de biofilmes. Especialmente Azevedo y colaboradores (Azevedo 2003, 2004, 2006) han trabajado en biofilmes de tuberías y tanques de almacenamiento y consideran que ésta es la forma como ella puede mantenerse viable en el agua. Esta forma de mantenerse la protege de un ambiente que “percibe” agresivo, esto sugiere que en el agua de origen natural la bacteria no se encuentra libremente, sino adherida (sésil). De la experiencia de esta investigación se puede afirmar que H.pylori fue recuperada del agua bajo su forma bacilar con la estrategia de cultivo utilizada. La estrategia que se utilizó para cultivarla del agua de consumo humano y demostrar que ésta es una probable vía de transmisión de la bacteria, indujo a la formación de biofilmes en filtros de nitrocelulosa y cultivo en medio líquido, estrategia que proporcionó excelentes resultados; consecuentemente no fue necesario el empleo de anticuerpos inmunomagnéticos como los utilizados en el trabajo de Lu y colaboradores. Sin embargo se considera que para el cultivo de la bacteria a partir de agua residual el uso de los anticuerpos es indispensable por la cantidad de flora acompañante. El lograr el cultivo de H. pylori siempre se consideró importante, pues se tendría además de sus características coloniales hallazgos fenotípicos y comportamiento bioquímico además un ADN completo para cualquier otra determinación molecular; por el contrario lo presentado por algunos autores, con excepción de Lu y colaboradores (Lu, 2005), es la demostración de la presencia en agua de pozo o superficial de solo 1 o 2 marcadores moleculares generalmente 16S ARNr, o ureA ( ver cuadro 31). Se consideró que la búsqueda de la bacteria por medio de marcadores moleculares directos en el agua podría presentar resultados falsos positivos o negativos por unión no específica de primers o la presencia de sustancias inhibidoras. Es importante destacar que en la zona marco de estudio existe una alta incidencia de ácidos húmicos y fúlvicos que normalmente se denominan humus (el agua presenta color de manera importante especialmente cuando llueve) los cuales interfieren o son inhibidores de la ADN polimerasa (Inhibidores, 2010). En este trabajo estos potenciales problemas fueron evitados con el cultivo de la muestra, el aislamiento de su ADN de las células cultivadas y realizar de seguido la PCR. En algunos de los resultados obtenidos, se advierten de productos de mayor tamaño al esperado, que se trata de explicar con el hecho de que la muestra proviene de cultivo en caldo con muy probable presencia de otros ADN de distintas clones de Helicobacter pylori o de otros Helicobacter, especialmente esto es notorio al caracterizar la muestra #20 del primer muestreo. En este caso específico para cagA como para los alelos de vacA, se obtienen productos de mayor tamaño al esperado, lo que concuerda también con lo encontrado por Lu en su trabajo pues reportan cepas con los alelos s1 y s2 de mayor tamaño al esperado y cepas que contienen m1 y m2, esto también ha sido reportado por De Gusmao y colaboradores (De Gusmao, 2000). En este mismo sentido algunos autores como Jang-Jih Lu y colaboradores (JangJih Lu, 1999), consideran que el gen glmM es el marcador más sensible y especifico para la determinación de H. pylori, ellos encontraron que en biopsias gástricas había falsos positivos para el gen 16S ARNr, en este mismo sentido hay concordancia también con lo expresado por Shahamat y colaboradores (Shahamat, 2004), no obstante se consideran también estos inconvenientes como problemas en el diseño de primers. Tomasini y colaboradores (Tomasini, 2003), han encontrado que una sola cepa de H. pylori puede incluir varias proporciones de subtipos con diferente fenotipo de cagA en un solo aislamiento; así mismo colonizaciones gástricas de cepas múltiples también han sido advertidas por Con y colaboradores en pacientes costarricenses (Con, 2009). Estos hallazgos concuerdan con los resultados de esta investigación. Según Shahamat en H. pylori, secuencias 16S son físicamente removidas y posicionadas en otros puntos del genoma, lo que genera un operón ARNr de estructura atípica; esta situación dificulta el estudio de esta región ribosomal y genera una alta variabilidad genética (Shahamat et al, 2004). Asimismo se ha descrito que discrepancias en las secuencias genéticas del ARNr 16S son consistentes con la transferencia horizontal de fragmentos y la creación de moléculas mosaico con la pérdida de información filogénica (Dewhirst, 2005). En este trabajo solamente se empleó en el primer muestreo. Otro factor que se pudo determinar de gran importancia en el hallazgo de la bacteria en muestras de agua de origen natural, es que su presencia en las muestras está fuertemente influenciada por las condiciones ambientales previas al muestreo. Esto ha sido mencionado por algunos autores como Azevedo (Azevedo et al, 2007), y Benson (Benson et al, 2004). Este hallazgo refleja la naturaleza transitoria de la contaminación de las fuentes de agua y en particular, el impacto de precipitaciones recientes, sin discutir estos autores en estos trabajos el por qué de esta situación. De la experiencia generada en esta investigación se propone que H. pylori no necesariamente tiene que encontrarse cuando se busca en el agua, es más, se puede considerar como buscar “una aguja en un pajar”, muy influenciado el proceso por condiciones ambientales específicas, como la lluvia, el mantenimiento húmedo del suelo y de aquí probablemente al agua. Para las muestras tomadas al pozo del TEC, solo una vez se pudo obtener un aislamiento y las dos siguientes veces no se obtuvo una muestra positiva. Esta diferencia correspondió, a que en la primera ocasión el pozo no se usaba desde hacía mucho tiempo, mientras que en las siguientes dos oportunidades su uso era continuo reflejando quizás que en la primera vez podría haber, la presencia de biofilmes. Este resultado es similar a lo reportado por Kowolick y colaboradores (Kowolick, 2005) en abastecimientos de agua de tubería en hogares indígenas guatemaltecos, quienes encontraron que en muestras de hisopados de secciones de tubería de profundidad había más marcadores positivos para H. pylori que en el chorro de agua de los tubos denotando la presencia de la bacteria en biofilmes. Con respecto a la lluvia en ambos lugares marco de la investigación, zonas de alta y baja incidencia, no se determinó la utilidad de compararlas, pues para el momento en que se estudió esta variable que fue el 2008, no fue comparativamente diferente para ambas zonas los milímetros de lluvia al año. Según se mencionó en el Instituto Meteorológico Nacional, la zona de Guanacaste es seca y solo llueve en época lluviosa, pero cuando llueve, ésta se da en gran cantidad; mientras que para las zonas de alta incidencia se presenta lluvia prácticamente todos los días, esto puede desprenderse de la información mostrada en los cuadros 23 y 24 sobre la precipitación anual media para el 2008. Algunos autores han advertido un aumento en la viabilidad celular cuando H. pylori permanece en cultivos a bajas temperaturas, de allí que para esta investigación eso fue fundamental y finalmente se relacionó estadísticamente según los resultados presentados. Bani Hani y colaboradores (Bani Hani, 2005), relacionaron factores ambientales, como la presión barométrica y la temperatura ambiental con diferencias de infección en las personas por H. pylori, hallaron al igual que en este trabajo, mayor prevalencia en las zonas altas, lo cual según los resultados indicados en este trabajo se explica en términos de menor temperatura ambiental y suelo más frío. Ahora bien cabe la pregunta, ¿cuán contaminada aparece el agua por Helicobacter pylori?. Krumbiegel y colaboradores (Krumbiegel, 2004) encontraron que en una zona rural de Alemania la cantidad de copias de ADN correspondiendo a bacterias en agua de pozo, correspondía a 125 bacterias/L mediante la técnica de RT-PCR. De la experiencia de esta investigación se encontró en algunos casos, que los cultivos de agua de nacientes, se podían considerar casi como “cultivos exclusivos”, (tomando en cuenta los antibióticos empleados en el medio inicial, que eran 4), especialmente nacientes de la zona de los Santos y del Cantón Central de Cartago. En cuanto a la calidad del agua se encontró que no existe relación entre coliformes fecales y presencia de H. pylori. En este mismo sentido Braganca y colaboradores (Braganca, 2005) han reportado en sus trabajos con biofilmes, que H. pylori es más resistente a la cloración que E coli, al igual que lo reportado por Baker y Hegarty (Baker, 2002). Además Hegarty expresó que al no haber encontrado correlación entre la presencia de ADN de H. pylori en el agua de consumo y la presencia de E coli este indicador falla para la protección y criterios de potabilidad del agua (Hegarty, 1999). En este mismo sentido Mazari y colaboradores (Mazari, 2001) han advertido que el agua residual tratada no necesariamente elimina a la bacteria, constituyéndose en un serio riesgo para la salud pública por contaminación cruzada. Como resultado de este trabajo se encontró que la situación de manejo del agua en Costa Rica en términos generales no es óptima, como también ya ha sido advertido en diversas ocasiones por el Dr. Darner Mora del Laboratorio Nacional de Agua; pues aún hoy, el 80% de las municipalidades que manejan el agua de las zonas de alta incidencia de cáncer gástrico la manejan de forma deficiente, inclusive la Municipalidad de Tarrazú que posee Bandera Azul, mantiene valores más bajos de cloro residual ( 0,2 mg/L) e incluso negativos, con respecto a lo estipulado por el Reglamento Nacional. No obstante para algunos cantones, con los años la calidad relativa del agua ha mejorado. Un ejemplo concreto de esto es el Cantón Central de Cartago, tal y como se puede observar en la figura 54, donde se muestra la mejoría del año 1996 al año 2000, y a la fecha esta calidad ha mejorado de forma total, pues actualmente no se consume agua con cloro residual menor de 0,5 mg/L. Fuente: CEQIATEC, 2002 Figura 54. Positividad bacteriológica en coliformes fecales del agua de las redes de la Municipalidad del cantón Central de Cartago, de 1996 a 2000. En este caso específico la municipalidad mantiene un convenio de control de calidad del agua potable con CEQIATEC desde hace 25 años, específicamente la mejora se ha visto desde hace 15 años. Podría proponerse que hay concordancia en la tendencia de mejora de la calidad del agua y una disminución discreta de la tasa de incidencia de cáncer gástrico de 36,9 a 33, 9 (figura 50), según lo mostrado en las estadísticas hasta el año 2003. Habrá que esperar la próxima estadística para corroborar esta tendencia a la disminución; no obstante se considera que para notar la baja en la incidencia de cáncer gástrico, esta deberá de manifestarse en la siguiente generación, o sea a los 20 años. Las zonas de baja incidencia de cáncer gástrico marco del estudio manejan agua clorada en un 90% desde hace muchos años, (desde las décadas de los años de 1960 y 1970) aunado a esto se encontró desde el punto de vista geomorfológico y físico-químico del suelo condiciones para el probable desarrollo ambiental de H. pylori menos favorables y proporcionalmente más secas todo el año. La infección por H. pylori es el factor de riesgo más reconocido y aceptado en la etiología del cáncer gástrico en el mundo. Del análisis de los datos de las figuras 20, 49 y 50 no se puede afirmar que en Costa Rica la incidencia del cáncer gástrico ha disminuido de forma global, según se aprecia en la figura 20. En hombres solo hay disminución neta del año 2000 al 2002 con respecto a las estadísticas desde 1990 por el Registro Nacional de Tumores; a partir del año 2002 y al 2003 se observa una pequeña tendencia a la alza de nuevo. De acuerdo con el análisis de las figuras 49 y 50 han disminuido las tasas en los tres cantones de más alta incidencia, León Cortes, Tarrazú y El Guarco. En los otros cantones marco de la investigación esta disminución es poco clara; podría pensarse que la influencia intrínseca aún permanece en el ambiente. Incluso en los cantones de baja incidencia se observa que 8 de los 10 estudiados tienden al alza; no obstante como para analizar tendencias estadísticas se necesitan mínimo 3 puntos se deberá esperar la próxima publicación de estadísticas de incidencia de cáncer gástrico por cantón para valorar las tendencias relativas reales como país. En cuanto a lo investigado sobre la relación y la influencia del suelo en el problema de cáncer gástrico en el país, se tiene que Sierra y colaboradores en 1983 habían advertido que había correlaciones estadísticamente significativas entre la tasa de incidencia y la acidez o pH bajo, el hierro, el potasio y el zinc en el suelo. El efecto del pH del suelo ya había sido notado por Hirayama en 1971, la posibilidad de una influencia multifactorial en el suelo fue insinuada con anterioridad por Tromp en 1981 (Sierra, 1983), sin aclarar en ese momento la razón. Podría ahora explicarse o proponerse en términos del contenido de materia orgánica soluble del suelo (MOS) que llega directamente al agua subterránea y tiene influencia más en el agua de naciente que en la de pozo. En el caso específico de esta investigación las muestras de agua prácticamente no presentan contaminación fecal, o sea se podría proponer que las cepas de H. pylori encontradas en esta matriz, pueden considerarse como “propias del suelo”. Por esta razón es que en el tercer muestreo se buscó la bacteria en 3 muestras de tierra asociada a nacientes de agua y que presentaran alta humedad en los tres cantones de la zona de Los Santos, obteniéndose en una muestra, dos productos de mayor tamaño al esperado, uno de 350 pb y otro de 450 pb del marcador correspondiente al gen glmM (294 pb). Este hallazgo se podría proponer como “positivo” por cuanto el poder encontrar ADN de un género relativo, en medio del ADN total de una matriz que puede poseer, según consideran los ecólogos, hasta 108 bacterias/g es realmente difícil. No obstante la seguridad del aislamiento eventualmente la daría la secuenciación de las cepas. La interacción entre materia orgánica y sustancias químicas presentes, se cree que está ligada con la necesidad de Helicobacter pylori de metales, específicamente por el acceso al níquel, los cationes de hierro y al medio ácido. H. pylori contiene relativamente un bajo número de sistemas de transporte de iones, excepto para níquel y hierro (NCBI, 2001), estos dos iones pueden ser transportados por dos o más sistemas, lo que indica su importancia en la fisiología de la bacteria. La forma en que el hierro permanece en el medio es muy importante para H. pylori, el Fe +3 es insoluble a pH neutro, un suelo ácido incrementa la solubilidad del hierro, se supone que se pueden encontrar mayores cantidades de la bacteria en suelos ácidos donde el hierro presenta mayor disponibilidad, siempre y cuando el mismo permanezca húmedo según se presentó en el cuadro 30. Ahora bien en Costa Rica es común hallar suelos con hierro, pero es importante destacar que en las zonas de alta incidencia estudiadas, los suelos tienen mayor cantidad de MOS, de acuerdo con las razones expresadas en el cuadro 30, en el cual también se mostró que una disminución del pH aumenta la disponibilidad del hierro en el suelo, esto se propone que lo podría aprovechar directamente la bacteria. En cuanto a la necesidad de níquel por la bacteria, ella debe de tener este metal a disposición, por cuanto la ureasa contiene 12 átomos de níquel por molécula, y necesita la enzima para mantenerse en el ambiente ácido del estómago, la literatura menciona que los niveles pueden alcanzar hasta el 10% del total de proteínas celulares. Por otro lado según lo expresa la literatura en las personas la mayor parte del níquel ingerido procedente de la dieta permanece libre en la luz del aparato gastrointestinal (Melo, 2007), lo que podría explicar, porque H. pylori podría eventualmente adaptarse y permanecer en dos sitios tan disímiles como el agua (suelo) y el estómago, aclarado esto mediante la presencia de bacterias ureasa positivas del suelo. En suelos forestales con bosques templados, la principal fuente de nitrógeno para las plantas se aloja en el MOS y su liberación depende del pH del suelo y desde luego de la actividad bacteriana. Desde el punto de vista químico del suelo la ureasa es una de las diferentes enzimas que existen en él y pertenece al grupo de las amidohidrolasas, la actividad de esta enzima es el resultado de la proliferación de microorganismos con la capacidad de sintetizarla. Su función principal es actuar sobre enlaces C-N de la urea, su actividad es extracelular y puede formar complejos muy estables (ureasa-humus) con los coloides del suelo (Pascual, 2002). El contenido de MOS en el suelo aumenta con la humedad y la disminución de temperatura (Méndez, 2010) relacionado con ésto, Azevedo menciona que zonas frías en el mundo presentan mayores tasas de infección y que posiblemente la transmisión ocurra principalmente durante época lluviosa (Azevedo, 2007), ésto se menciona con respecto a la relación que se hace en esta investigación de la correlación entre las zonas de alta incidencia de cáncer gástrico, presencia de H. pylori y características geomorfológicas del suelo. Como ya se ha expresado, no se encontró correlación entre fuentes de agua limpia (nacientes) presencia de E coli y H. pylori, esto implica que muchas de las fuentes de agua que se están manejando actualmente para las poblaciones por las municipalidades ( y con mucha más razón por las ASADAS) no se cloran porque se consideran como “agua de calidad potable”, pues los análisis muestran que E coli está ausente. Esto tiene serias implicaciones en la epidemiología de la transmisión de H. pylori a la población costarricense. De hecho, de los cantones investigados de alta incidencia, (y actualmente en el entendido que el problema de cáncer gástrico se gestó en los pacientes desde hace 20 años atrás, pero reflejados en las estadísticas actuales), se puede afirmar que de todas las Municipalidades en estudio solo las redes de abastecimiento de la Municipalidad del Cantón Central de Cartago presentan un control completo del agua con análisis físico-químicos y bacteriológicos regulares, las cuales desde hace varios años se encuentran permanentemente cloradas y en los niveles adecuados. La Municipalidad de Paraíso actualmente lleva a cabo análisis ocasionales bacteriológicos en sus redes de distribución y hasta hace relativamente poco, unos 3 años, se clora el agua de manera permanente por una empresa externa. En el Guarco, León Cortes, Dota, Alvarado y Aserrí el control y la cloración son prácticamente nulos o intermitentes (incluso un balde de cloro los días lunes). En Oreamuno hasta hace aproximadamente 3 o 4 años se ha implementado la cloración de algunas de sus redes. En general en estas zonas de alta incidencia (con excepción de la Municipalidad del Cantón Central de Cartago), existe ausencia de control físico-químico de la calidad del agua para consumo humano. En el mejor de los casos, de forma ocasional, se limitan a la determinación del parámetro de coliforme fecal, y corrientemente no existe la determinación de parámetros cuyos contaminantes nitrogenados, puedan ser de toxicidad para el estómago como lo serían los nitratos, nitritos y/o plaguicidas nitrogenados; y en términos generales no hay aplicación o hay desconocimiento del Reglamento de Calidad del Agua de Costa Rica. El caso de Tarrazú es especial, pues cuenta con Bandera Azul por el manejo del agua y el cuidado a las fuentes de abastecimiento; no obstante las muestras tomadas de nacientes salen todas positivas para H. pylori y las muestras a los tanques de almacenamiento de agua contienen muy poco cloro residual. En el primer muestreo se determina 0,3 mg/L y en el segundo las muestras no presentan cloro residual, lo cual a pesar del manejo deja a la población totalmente vulnerable. En este mismo sentido en esta zona de alta incidencia manifiestan los encargados del acueducto que si bien es cierto que ellos pueden agregar más cantidad de cloro tal y como se los ha recomendado AyA, no lo hacen, pues de todas maneras según se les ha dicho, las nacientes son de “muy buena calidad”. No obstante para el tercer muestreo en los cantones de Dota y León Cortés el agua para la población se había empezado a clorar, aunque de una forma bastante artesanal e insuficiente, pero es un buen inicio. Aunado a lo anterior en los cantones de la zona de los Santos, El Guarco, Paraíso, Aserrí y Acosta el agua posee problemas de turbiedad especialmente cuando llueve. En estos casos no se contaba con un sistema de filtración, el cual es totalmente indispensable, algunas ASADAS de estas zonas sí los poseen. Todo lo anterior ayudado por una buena oferta hídrica de esta zona, que conlleva a que sean los gobiernos locales quiénes decidan manejarlos, junto con las ASADAS, estas de calidad no siempre adecuada (algunas funcionan muy bien, mas la mayoría no) ocasionan que el mantenimiento de la calidad adecuada del agua puede ser intermitente. Ésto es una diferencia substancial con el manejo del agua de acueductos rurales de países desarrollados, aunque en estos países existen en mucha menor proporción, los mismos están completamente regulados. Por ejemplo el Reglamento de Calidad de Agua de la Unión Europea (ver anexo 1), estipula la presentación de varios análisis físico químicos y bacteriológicos que deben ser entregados periódicamente a las autoridades sanitarias para que puedan operar. En el caso de Costa Rica, este control es prácticamente nulo, se deja el manejo más que todo a la buena voluntad de los Entes Operadores. Nuestras autoridades sanitarias sólo intervienen en los acueductos como Ente Rector y sólo lo hacen en caso de brotes o emergencias hídricas. Con el creciente control de parámetros del agua observados principalmente en los países desarrollados, la hipótesis de la transmisión hídrica podría explicar al menos en parte, la disminución de la colonización de las personas por H. pylori en estos países desarrollados. Como parte de las debilidades de este sector en el área de la gestión de los servicios, se considera, la ausencia de un sistema constante e integral de control y vigilancia de la calidad del agua potable, así como la fiscalización y control a las organizaciones comunitarias administradoras de acueductos rurales (CAAR´s y ASADAS), donde se identifican los mayores índices de suministro de agua “no potable” y la ausencia de un sistema de financiamiento permanente para los acueductos rurales. La abundante precipitación en Costa Rica ha hecho que el costarricense no haya sentido preocupación por la disponibilidad de agua para realizar sus actividades, como tampoco ninguna necesidad de planificar las actividades relacionadas con el manejo de los recursos hídricos. De forma generalizada se encontró un desaliento ante el proceso de cloración en estas zonas de alta incidencia por cuanto en las visitas del personal del AyA se les ha mencionado que su agua es de excelente calidad, según algunos de ellos lo manifestaron en la entrevista, entonces no se ve la necesidad de clorarla o el proceso se lleva a cabo de forma insuficiente. Lo que sí se pudo determinar de forma general en las visitas a las áreas es la preocupación por mantener la zona de recarga de las nacientes, con excepción del Cantón del Guarco, donde no existe ningún criterio de protección, control o voluntad por suministrar agua de calidad potable, como realmente es de conocimiento nacional. Se requiere primero educación para el manejo correcto del agua destinada a la población, luego conocimiento de la reglamentación que se les aplica y de último amplia fiscalización por parte de AyA y Ministerio de Salud como Ente Rector del país para proteger la salud de esta población de riesgo. Los resultados de las investigaciones se publican y los trabajos se presentan en congresos, sin embargo, también es necesario que esos estudios lleguen a los políticos, a los administradores de la salud pública y a la población en general. A veces los resultados de las investigaciones no se utilizan como insumo en las decisiones políticas, quizás porque no hay canales efectivos de comunicación o por falta de capacidad para trabajar en equipo. Este es un problema para el que habrá que buscar solución, no obstante la meta sería encontrar la forma de prevenir el desarrollo del cáncer gástrico en nuestra población. En el anexo 1 y 2 se muestran los Reglamentos de Calidad de Agua de la Unión Europea y de otro país en vías de desarrollo como República Dominicana, en ambos se puede apreciar cómo se maneja el agua de calidad. En el caso de República Dominicana llama la atención, por cuanto la población cuenta con dos tipos de agua una llamada de “uso doméstico” que es de uso general, y otra que consume la población envasada solamente por empresas externas”. Con base en los datos presentados en el cuadro 1 se presenta bajo el cuadro 32 la población actual en términos relativos cuyo Ente Operador dispensa agua potable actualmente en Costa Rica. Cuadro 32 Población actual en términos relativos cuyo Ente Operador dispensa agua potable actualmente en Costa Rica. Ente Operador % de la Población población con agua cubierta potable AyA Municipalidades evaluadas E.S.P.H. CAAR´s/ASADAS * (Evaluadas) TOTAL % de la población relativa cubierta 49,3 15,5 98,2 78,8 48,41 12,21 3,6 19,8 99,6 58,7 3,6 11,6 75,8 Según esta información en teoría actualmente sólo un 75% de la población costarricense recibe agua de calidad potable por su Ente Operador, no obstante no queda claro si la determinación de esta potabilidad se hace en estas estadísticas bajo la determinación de la no presencia solo de coliformes fecales determinados en las nacientes y tanques de almacenamiento, de cloro residual en el agua, o si se toman en cuenta otros parámetros físico químicos en el agua dispensada. La información que se recolectó en el muestreo de algunas municipalidades es que AyA solamente les hace un análisis de coliformes en nacientes o en tanques de almacenamiento. Sin embargo a la luz de esta investigación se determina que los criterios actuales para aceptar la calidad de agua, considerada como potable con la sola ausencia de coliformes fecales, deben ser revisados. Esto tiene especial significado para las zonas de alta incidencia de cáncer gástrico. La calidad del agua que abastece las municipalidades y ASADAS debe ser adecuadamente valorada en términos de cantidad de cloro residual, no menor a 0,5 mg/L, este valor se encuentra en el Reglamento de Calidad de Agua, no obstante no se conoce, ni se respeta, ni se valora a los Entes Operadores en su cumplimiento. Por las características de la alta cantidad de carbono orgánico disuelto (medida de la cantidad de materia orgánica del agua) que poseen principalmente las zonas de alta incidencia se hace necesario que este nivel mínimo de cloro sea dispensado a la población. 7. Conclusiones Al reconocer que el medio ambiente juega un rol preponderante en la adquisición de la infección y que la asociación entre la infección por Helicobacter pylori de forma crónica y el riesgo elevado de desarrollar cáncer gástrico está bien establecido en la actualidad (Bartchewsky, 2009; Cancer, 2006-2008; Cañas, 2009; Graham, 2007), es necesario proponer un mecanismo que explique la alta incidencia de cáncer gástrico en las zonas de estudio. Población con predisposición: citoquinas proinflamatorias + Le B + Bani Hani,2006 -Dietas ( comp. nitrosos) - ↓ consumo frutas y vegetales - Infección de largo plazo con H pylori (SAC, 2008) -Bartchewsky, 2009 (MMR) ↑ -Saneamiento ambiental (acceso al agua potable, condiciones higiénicas). -Educación a la población (Hábitos saludables, prevención de riesgo, quimio prevención) -Nivel socioeconómico Figura 55 Propuesta de la interrelación de variables que influyen en la alta incidencia de cáncer gástrico, caso Costa Rica. Con el planteamiento la sucesión de múltiples eventos para explicar un probable mecanismo de carcinogénesis ambiental en la alta incidencia de cáncer gástrico en Costa Rica se muestran las interrelaciones de la figura 55. En éste se demuestra como la presencia de la bacteria en el mundo se relaciona con condiciones de saneamiento ambiental y nivel socioeconómico general, tales como acceso al agua potable, condiciones higiénicas, educación de la población hábitos saludables, conocimiento y prevención del riesgo, tal como la quimio prevención. Desde los años cincuenta en Estados Unidos se reconoce la situación y en términos generales los epidemiólogos han dicho que H. pylori ha ido desapareciendo de los países desarrollados a lo largo de los últimos 100 años merced a una mayor higiene que bloquea la transmisión de la bacteria (Blazer 2005). En el problema se reconocen factores propios de la bacteria, lo anterior implica que en la colonización por H. pylori en el mundo convergen varios factores, entre ellos una distribución geográfica mundial de cepas de H. pylori que determinan de cierta manera que la presencia de ciertas cepas de mayor patogenicidad en distintas partes del mundo podrían intervenir en la severidad de una infección para una población dada. Esto es especialmente claro en los aportes de las investigaciones de Naylor, (Naylor, 2006), donde comparó en pacientes con gastritis (japoneses y del Reino Unido) su histología gástrica y encontró que los estómagos de japoneses tenían gastritis más severas y extensivas, con un número mayor de células inflamatorias y un mayor riesgo de progresión hacia la atrofia y la metaplasia intestinal; alrededor del 90% de esos casos de gastritis en ambos países fueron relacionados con infección por H. pylori; pero cepas CagA positivas fueron más comunes en japoneses que en pacientes del Reino Unido. Esto explica entonces el segundo factor que es la naturaleza de las cepas de H. pylori en poblaciones determinadas. Según se abordó en el marco teórico la población costarricense cuenta con una susceptibilidad genética o polimofismos proinflamatorios de interleucinas donde la respuesta contribuye a la patogénesis del cáncer, dentro del grupo de personas infectadas por H. pylori, específicamente las que presentan determinados polimorfismos del gen IL-1β +3954. Aunado a esto Bani Hani (Bani Hani, 2006), ha mencionado que para una población dada, los factores ambientales tienen más peso que los factores genéticos, y desde el punto de vista de la toxicología ambiental esto es así. Bartchewsky ha propuesto (Bartchewsky 2009), que la desregulación que provoca H pylori en el hospedero (MMR), podría considerarse el principal factor desencadenante de cáncer para una población específica, en especial como en nuestro caso si la población es crónicamente agredida y probablemente en alta concentración. En análisis de riesgo ambiental en toxicología uno de los factores más importantes para valorar el riesgo de una población es la dosis del tóxico en el ambiente, pues la correspondencia entre la cantidad de tóxico y la magnitud del efecto es lo que se conoce como la relación dosis-efecto, donde la relación entre ambos es una curva sigmoidea, no una recta lineal, según se muestra en la figura 56 (Toxicología, 2001). Esto quiere decir que a pesar de que se encuentre un tóxico en una población puede que el nivel de respuesta de la población (enfermedad) a una dosis baja sea imperceptible desde el punto de vista clínico, o sea, la población puede ser tolerante en consonancia con sus propios mecanismos de respuesta celular, esto es lo que pertenece a la zona de homeostasis dentro del umbral de seguridad de acuerdo con la figura 56. Figura 56. Curva Dosis-Respuesta. Lo anterior implica que si el tóxico está en una alta cantidad para la población (el cuerpo no podrá eliminar el tóxico con la rapidez que lo ingiere), la población entonces enfermará de manera exponencial, o sea cuando la dosis supere el umbral de seguridad se dispara el efecto y es cuando se ven poblaciones o zonas con diferencias estadísticas de incidencia, en el caso que se analiza, cáncer gástrico. La respuesta celular que se menciona es lo que se resume en la figura 57, en la que se muestran los mecanismos de protección que posee la célula ante agresores genotóxicos como podría ser el caso de H. pylori. Figura 57. Evolución celular hacia la formación de tumores malignos y los factores que intervienen. El fácil acceso y el tipo de H. pylori al que está sometido la población de las zonas estudiadas de alta incidencia de cáncer gástrico en Costa Rica se considera realmente alto, por las características geoquímicas del suelo y las condiciones climáticas que imperan en la zona y que podrían promover la sobrevivencia de la bacteria. Pero lo más importante que aporta este trabajo es el grado de inconveniencia con que es manejada el agua de consumo humano en estas poblaciones, que por ende la hace de directo acceso a la población. Se menciona la palabra inconveniencia porque surgen varios factores que tampoco podrían denominarse negligencia, pues a pesar de que el Ente Operador conoce que no se maneja del todo bien, no está consciente de la implicación “de ese mal manejo”, y esto se reflejó en el apoyo que dieron siempre los encargados de los acueductos a este proyecto. A continuación se propone una expresión en forma de ecuación sobre la propuesta de factores que pueden favorecer la alta incidencia de cáncer gástrico de las zonas estudiadas en el país. A + B + C + D + E + F – G => Dispara la evolución a la incidencia C.G (adenocarcinoma intestinal), gastritis, ulceras Donde: A: Factores asociados a la población (polimorfismos proinflamatorios, Lewis B) B: Presencia de cepas patógenas de H pylori en el ambiente (por los pacientes). carcinógeno tipo I de IARC. C: Condiciones socioeconómicas de la población (no tan marcado entre las zonas) D: Presencia de H. pylori en el agua de consumo de la población como dosis de ingestión diaria E: Manejo deficiente del agua en las zonas de alta incidencia F: otro (s) G: Factor protector *en amarillo los factores específicos que podrían aumentar la incidencia. Según la Agencia de Protección Ambiental de Estados Unidos (EPA), una forma común de expresar la exposición a cancerígenos y otros compuestos de incidencia crónica es mediante el cálculo de la Dosis Diaria Promedio Vitalicia (DDPV), según la Guía para la Evaluación de Riesgos “Superfund” de la EPA (on line), la cual se expresa de la siguiente manera y se ilustra con un ejemplo: Finalmente se muestra como este trabajo contribuye a la sociedad costarricense con los siguientes nuevos hallazgos: Técnicas optimizadas de cultivo para H. pylori de origen ambiental en medio líquido con soporte de nitrocelulosa y como agar inclinado bifásico. Optimización de técnicas moleculares para cepas ambientales de los marcadores glmM (no determinado en cepas ambientales) y de la proteína inductora del factor de necrosis tumoral alfa (Tipalpha FNT-α). La obtención de cepas de H. pylori (2 secuenciadas) a partir de muestras de agua de consumo humano de fuentes oficiales con y sin cloro residual, lo que demostró la vulnerabilidad y el riesgo en el manejo de los acueductos para las poblaciones de las zonas de mayor incidencia de cáncer gástrico de Costa Rica. Se comprobó la no correlación entre presencia de H. pylori y contaminación fecal en las nacientes que abastecen los cantones de las zonas de alta incidencia. Se describieron por primera vez correlaciones importantes y significativas entre incidencia de cáncer gástrico y altura, temperatura, origen del agua como naciente y Ente Operador del Acueducto, lo que propone relacionar de forma diferenciada, presencia de H. pylori de origen ambiental y alta incidencia de cáncer gástrico. 8. Recomendaciones La determinación en el agua de H. pylori es difícil, sin embargo si la misma es requerida en agua potable, se sugiere la técnica de identificación molecular por RT-PCR (PCR en tiempo real), con previa concentración de la carga microbiana por filtración por membranas y posterior elusión para la extracción del ADN; y en agua residual se hace imprescindible el uso de anticuerpos inmunomagnéticos. La población costarricense por la naturaleza de la alta carga orgánica de sus aguas no debe de consumir agua (para considerarla como potable) con menos de 0,5 mg/L de cloro residual, ésto debe ser adecuadamente vigilado por las autoridades sanitarias para asegurarle la debida protección a la población. Lo anterior podría implicar que las municipalidades por la cantidad de usuarios que manejan deben contratar este servicio de cloración a un ente externo (se ha visto que la actividad es más eficiente, con respecto a que sea la misma municipalidad quien se encargue de ésta). Si son ASADAS son imprescindibles las políticas claras en cuanto al manejo de su propio abastecimiento a la luz de sus necesidades específicas, esto es, si tienen problemas de turbiedad deben tratarlos antes del proceso de cloración, así como procedimientos adecuados de filtración (tecnología FIME). Se requiere la implementación de los Planes de Seguridad del Agua que persiguen estrategias específicas de manejo llevadas a cabo por el Ente Operador; que involucran la gestión completa del recurso hídrico y deben prevalecer los parámetros de salud pública en torno al manejo del agua. En una segunda parte de la investigación sería conveniente abordar el aislamiento e identificación de cepas de H pylori en el suelo, y ampliar la identificación y secuenciación de cepas aisladas del agua. Bibliografía Adams B, Bates T, Oliver J. Survival of Helicobacter pylori in a Natural Freshwater Environment. Applied and Environmental Microbiology 2003. 69(12): 7462–7466. Alpízar W, Pérez G, Une C; et al. Association of interleukin-1B and interleukin-1RN polymorphisms with gastric cancer in a high-risk population of Costa Rica. Clin Exp Med 2005. 5:169-76. Alpízar W, Une C, Sierra R . La inflamación y su papel en el desarrollo del cáncer gástrico. Acta méd. Costarric 2009. 51 (2): 76-81. Aydemir S. The Effect of Helicobacter pylori on Insulin Resistance. Digestive Diseases and Sciences 2005. 50(11):2090-2093. Azevedo N , Vieira M , Keevil C . Establishment of a continuous model system to study Helicobacter pylori survival in potable water biofilms. Water science & technology 2003. 47(5):155–160. Azevedo N , Pacheco A , Vieira M, Keevil C . Nutrient shock and incubation atmosphere influence recovery of culturable Helicobacter pylori from water. Applied and Environmental Microbiology 2004. 70(1):490–493. Azevedo N, Pacheco A, Keevil C, Vieira M. Adhesion of water stressed Helicobacter pylori to abiotic surfaces. Journal of Applied Microbiology 2006. 101(3):718–724. Azevedo N , Pinto A , Reis N , Vieira M J; et al. Shear stress, temperature, and inoculation concentration influence the adhesion of water–stressed Helicobacter pylori to stainless steel 304 and polypropylene. Applied and Environmental Microbiology 2006. 72(4):2936–2941. Azevedo, N, Guimares N, Figuereido C, Kevil C; et al. A New Model for the Transmission of Helicobacter pylori: Role of Environmental Reservoirs as Gene Pools to Increase Strain Diversity. Critical Reviews in Microbiology 2007. 33:157-169. Azevedo N, Almeida C, Fernandes I. Survival of Gastric and Enterohepatic Helicobacter spp. in Water: Implications for Transmission. Appl Environ Microbiol. 2008. 74(6): 1805–1811. Baker K, Hegarty J, Redmond B, Reed N; et al. Effect of Oxidizing Disinfectants (Chlorine, Monochloramine, and Ozone) on Helicobacter pylori. Applied and Environmental Microbiology 2002. 68(2):981-984. Baker K, Hegarty J. Presence of Helicobacter pylori in Drinking Water is Associated with Clinical Infection. Scandinavian Journal of Infectious Diseases. 2001. 33(10):744-746(3). Bani-Hani K, El-Migdadi F. Comparative Study Of The Prevalence Of Helicobacter Pylori Between The Inhabitants Of Areas Of Different Barometric Pressure . The Internet Journal of Gastroenterology. 2005. 3(2) on line. Barber S. Soil Nutrient Bioavailability: A mechanistic approach. United States of America: John Wiley & Sons, Inc. 1984:326-328. Bartchewsky W, Martini M, Squassoni ; et al. Influence of Helicobacter pylori infection on the expression of MLH1 and MGMT in patients with chronic gastritis and gastric cancer. Eur J Clin Microbiol Infect Dis 2009. 28:591–597. Benson J, Fode-Vaughan K, Collins M. Detection of Helicobacter pylori in water by direct PCR. Letters in Applied Microbiology 2004. 39(3):221–225. Bergman M, Del Prete G, Van Kooyk Y. Helicobacter pylori phase variation, immune modulation and gastric autoimmunity. Nature Reviews Microbiology 2006 4:151-159 . Bernal J. Manual de nutrición y fertilidad de pastos. Quito Ecuador: INPOFOS. 2003. Bertsch F. La fertilidad de los suelos y su manejo. San José: Asociación Costarricense de la ciencia del suelo. 1998. Blaser M, Nomura A, Lee J, Stemmerman G; et al. Early-life family structure and microbially induced cancer risk. PLoS Med 2007. 4:e7. Blazer M, Helicobacter pylori. Investigación y Ciencia, 2005: 6-13. Boaretti M, Del Mar M, Bonato B, Signoretto C, Canepari P. Involvement of rpoS in the survival of Escherichia coli in the viable but non-culturable state, Environ Microbiol 2003. 5:986–996. Bode G, Rothenbacher D, Brenner H, Adler G. Pets are not a risk factor for Helicobacter pylori infection in young children: results of a population–based study in Southern Germany. Pediatric Infectious Disease Journal 1998. 17(10): 909–912. Bragança S, Azevedo N , Simões L , Keevil C; et al. Use of fluorescent in situ hybridisation for the visualisation of Helicobacter pylori in real drinking water biofilms. Water Science & Technology 2007. 55(8-9):387-393. Braganca S. Detection of Helicobacter pylori in biofilms formed in a real drinking water distribution system using peptide nucleic acid fluorescence in situ hybridization. In Biofilms: Persistence and Ubiquity, edited by A. McBain, D. Allison, J. Pratten, D. Spratt, M. Upton and J. Manchester. 2005. Biofilm Club. Braun V, Hantke K, Koster W. Bacterial iron transport: mechanisms, genetics, and regulation. Metal Ions Biol. Syst. 1998. 35:67-145. Braun V, Killmann H. Bacterial solutions to the iron-supply problem. Trends Biochem. Sci. 1999. 24:104-109. Brown L. Helicobacter pylori: epidemiology and routes of transmission. Epidemiol. Rev 2000. 22(2): 283–297. Jeon B, Oh Y, Lee N, Choe y. Polymorphism of the Helicobacter pylori feoB Gene in Korea: a Possible Relation with Iron-Deficiency Anemia?. Helicobacter. 2004. 9(4):330-334. Cancer Facts and Figures for Hispanics 2006-2008. American Cancer Society. Cañas M, Morán Y, Rivero M, Bohórquez, A; et al. Polimorfismo genético de interleuquina-1: Asociación con cáncer gástrico en la población de alto riesgo del Centroccidente de Venezuela. Rev Méd Chile 2009. 137:63-70. Cardenas V; et al. Iron Deficiency and Helicobacter pylori Infection in the United States. American Journal of Epidemiology. 2006. 163(2):127-134. Chiu H, Lin H, Wang J. Identification and Characterization of an Organic Solvent Tolerance Gene in Helicobacter pylori. Helicobacter 2007. 12(1):74-81. Cinghu S, Sivasithambaram N, Venkatraman J. Molecular and histological evaluation of tumor necrosis factor-alpha expression in Helicobacter pylorimediated gastric carcinogenesis. Journal of Cancer Research and Clinical Oncology, mayo 2010. Online First. Cittelly D , Dore M , Bravo M; et al. Helicobacter pylori in animals is of human origin: studies in monkey’s, sheep, and cats. Gut 2002. 51: A31–A31. Clayton C; Kleanthous H; Coates P. Sensitive Detection of Helicobacter pylori by Using Polymerase Chain Reaction. J Clin Microbiol 1992. 30(1): 192 – 200. Con S, Takeuchi H, Valerín A, Con R; et al. Diversity of Helicobacter pylori cagA and vacA genes in Costa Rica: its relationship with atrophic gastritis and cancer. Helicobacter 2007. 12:547-552. Con S, Takeuchi H, Valerín A, Con R; et al. Helicobacter pylori CagA status associated with gastric cancer incidence rate variability in Costa Rica regions. J Gastroenterol. 2006. 41:632-637. Con S, Takeuchi H, Con-Chin G; et al. Role of bacterial and genetic factors in gastric cancer in Costa Rica. World J Gastroenterol. 2009. 15(2):211–218. Coticchia J, Sugawa C, Tran V; et al. Presence and density of Helicobacter pylori biofilms in human gastric mucosa in patients with peptic ulcer disease. J Gastrointest Surg. 2006. 10:883–9. Curso Toxicología Ambiental II. Contaminación Ambiental y su riesgo toxicológico. Universidad Nacional de General San Martín. Buenos Aires Argentina, 2007. De Gusmao V, Nogueira M, De Magalhaes Q; et al. vacA genotypes in Helicobacter pylori strains isolated from children with and without duodenal ulcer in Brazil. J. Clin. Microbiol. 2000. 38:2853–2857. Dewhirst, F, Shen Z, Scimeca M, et al. Discordant 16S and 23S rRNA Gene Phylogenies for the Genus Helicobacter: Implications for Phylogenetic Inference and Systematics. JOURNAL OF BACTERIOLOGY, 2005. 187 (17): 6106–6118 Del Giudice G. Development of vaccines against Helicobacter pylori. Novartis Vaccines. Abstract Book 10th International Conference on Environmental Mutagens (ICEM). Florence Italy, 2009:71. Denyer P, Kussmaul S. Geología de Costa Rica. Cartago Costa Rica: Editorial Tecnológica de Costa Rica. 2000: 67. Elfstrom D. Understanding NSAID-Induced Ulcers. En: http:elfstrom.com/arthritis/nsaids/ulcers.html. Consultada en Setiembre, 2006. ElZaatari F , Woo J , Badr A, Osato M; et al. Failure to isolate Helicobacter pylori from stray cats indicates that H-pylori in cats may be an anthroponosis— An animal infection with a human pathogen. Journal of Medical Microbiology 1997. 46(5): 372–376. Estado del Saneamiento. Caso Costa Rica. Setiembre de 2007. Evolución de las coberturas y calidad del agua para consumo humano y disposición de aguas residuales domésticas en Costa Rica al año 2008: Instituto Nacional de Acueductos y Alcantarillados. 2009. Falush D, Kraft C, Taylor N, et al. Recombination and mutation during long-term gastric colonization by Helicobacter pylori: estimates of clock rates, recombination size, and minimal age. Proc Natl Acad Sci U S A. 2001. 98:15056-15061. Franchini M, Veneri D. Helicobacter pylori -associated immune thrombocytopenia. Helicobacter 2006. 17(2):71-77. Fritz E, Slavik T, Delport W, Olivier ; et al. Incidence of Helicobacter felis and the effect of coinfection with Helicobacter pylori on the gastric mucosa in the African population. Journal of Clinical Microbiology 2006. 44(5):1692–1696. Fulkerson J, Mobley H Membrane topology of the NixA nickel transporter of Helicobacter pylori: two nickel transport-specific motifs within transmembrane helices II and III. J. Bacteriol. 2000. 182:1722-1730. Fujimura S, Kato S, Kawamura T. Helicobacter pylori in Japanese river water and its prevalence in Japanese children. Lett. Appl. Microbiol 2004. 38(6):517–521. Fujimura S, Kawamura T, Kato S; et al. Detection of Helicobacter pylori in cow’s milk. Lett. Appl. Microbiol 2002. 35(6): 504–507. Fux C, Costerton J, Stewart P, Stoodley P. Survival strategies of infectious biofilms. Trends Microbiol 2005. 13(1):34-40. Galmiche A, Rassow J, Doye A, et al. The N-terminal 34 kDa fragment of Helicobacter pylori vacuolating cytotoxin targets mitochondria and induces cytochrome c release. EMBO J 2000. 19:6361-6370. Gião M. Survival of Legionella pneumophila and Helicobacter pylori in drinking water after chlorination. INTERNATIONAL SYMPOSIUM ON MICROBIAL ECOLOGY 2006, 11, Vienna, Austria. Ghose C, Perez G, Van Doorn L; et al. High frequency of gastric colonization with multiple Helicobacter pylori strains in Venezuelan subjects. Journal of Clinical Microbiology 2005. 43(6): 2635–2641. Global Cancer Facts and Figures 2007. American Cancer Society : 16-18. Gomes B, De Martinis E. The significance of Helicobacter pylori in water, food and environmental samples. Food Control 2004. 15(5):397–403. Goodman K, Correa P, Tengana A, Ramirez H, DeLany; et al. Helicobacter pylori infection in the Colombian Andes: a population-based study of transmission pathways. Am J Epidemiol 1996. 144(3):290–299. Goodman K, O’Rourke K, Day R, Wang C; et al. Dynamics of Helicobacter pylori infection in a US–Mexico cohort during the first two years of life. Int J Epidemiol 2005. 34(6):1348–1355. Graham, D. The year in Helicobacter 2007. Helicobacter 2007; 12(1): 14-28. Haggerty T, Perry S, Sanchez L; et al. Significance of transiently positive enzymelinked immunosorbent assay results in detection of Helicobacter pylori in stool samples from children. Journal of Clinical Microbiology 2005. 43(5): 2220–2223. Hamajima N, Naito M, Kondo T, Goto Y. Genetic factors involved in the development of Helicobacter pylori-related gastric cancer. Cancer Science. 2006. 97(11):1129-1138. Hatzifoti C, Roussel Y, Harris AG, et al. Mucosal immunization with a urease B DNA vaccine induces innate and cellular immune responses against Helicobacter pylori. Helicobacter 2006. 2 :113–122. Hegarty J, Dowd H, Baker K. Occurrence of Helicobacter pylori in surface water in the United States. Journal of Applied Microbiology 1999. 87: 697–701 Henegha M, McCarth C, Moran A. Relationship of blood group determinants on Helicobacter pylori lipopolysaccharide with host Lewis phenotype and inflammatory response. Infect. Immun. 2000. 68:937-941. Hopkins R, Vial P, Ferreccio C, Ovalle J; et al. Seroprevalence of Helicobacter pylori in Chile: vegetables may serve as one route of transmission.J Infect Dis. 1993. 168(1):222–226. Horiuchi T, Ohkusa T, Watanabe M; et al. Helicobacter pylori DNA in drinking water in Japan. Microbiol Immunol 2001. 45(7):515-9. Hulten K, Han S, Enroth H; et al. Helicobacter pylori in the drinking water in Peru. Gastroenterology 1996. 110 (4):1031-1035. Hultén K, Enroth H, Nyström T, Engstrand L; et al. Presence of Helicobacter species DNA in Swedish water. Appl Microbiol.1998. 85(2):282-6. Israel, D. Genetic Exchange. En: Mobley, HLT; Menz, GL; Hazell, SL. Helicobacter pylori: Physiology and Genetics. American Society for Microbiology Press, Washington D. C. 2001. Inhibidores de la PCR. Hoja técnica. En: http://www.espanol.pcrlinks.com/generalidades/inhibidores.htm. Consultada 19 de setiembre 2010. Janzon A, Sjöling A, Lothigius A; et al. Failure to detect Helicobacter pylori DNA using highly sensitive real-time PCR assays in drinking and environmental water in Dhaka, Bangladesh. Appl Environ Microbiol 2009. Published online. Jang-jih Lu, Cherng-Lih Perng, Rong-Yaun Shyu; et al. Comparison of Five PCR Methods for Detection of Helicobacter pylori DNA in Gastric Tissues. JOURNAL OF CLINICAL MICROBIOLOGY 1999. 37 (3): 772–774. Jiang X , Doyle M. Effect of environmental and substrate factors on survival and growth of Helicobacter pylori. Journal of Food Protection. 1998. 61(8):929-933. Johnson C, Rice E, Reasoner D. Inactivation of Helicobacter pylori by chlorination. Appl. Environ. Microbiol. 1997. 63(12):4969-4970. Kanbay, M. Helicobacter pylori Seroprevalence in Patients with Coronary Artery Disease. Digestive Diseases and Sciences. 2005. 50(11):2071-2074. Kaptan, K. Helicobacter pylori and cobalamin deficiency. Clinical & Laboratory Haematology. 2006. 28(5):360-360. Karita M, Teramukai S, Matsumoto S. Risk of Helicobacter pylori Transmission from Drinking Well Water Is Higher Than That from Infected Intrafamilial Members in Japan. Digestive and Disease Sciences. 2003. 48(6):1062-1067. Kearney D, Crump C. Domestic cats and dogs and home drinking water source as risk factors for Helicobacter pylori infection in the United States. Gut 2002. 51: A31–A32. Kidd M, Peek R, Lastovica A, Israel D; et al. Analysis of iceA genotypes in South African Helicobacter pylori strains and relationship to clinically significant disease. Gut 2001. 49(5):629-635. Kim S, Bhang C, Min K; et al. p53 mutations an microsatellite instabilities in the subtype of intestinal metaplasia of the stomach. J Korean Med Sci 2002 ;17:490– 496. Krumbiegel P, Lehmann I, Alfreide, A; et al. Helicobacter pylori determination in non-municipal drinking water and epidemiological findings. Isotopes Environ Health Stud. 2004; 40(1):75-80 Koga T, Sato K, Shimada Y; et al. Essential role of magnesium ion in water for colonization of Helicobacter pylori in 2-week-old miniature pigs. Microbiological Research. 2003. 158 (1):69-75. Kowolick M, Dowsett S, Archila L; et al. Water and biofilm transmission of Helicobacter pylori in rural guatemalan households. Journal of Pediatric Gastroenterology and Nutrition. 2005. 41(4):554-555. Kuroishi T. Cancer mortality statistics in 30 countries (1953-1997). In: Tajima K, Kuroishi T, Oshima A, editors. Cancer mortality and morbidity statistics. Tokyo: Japan Scientific Societies Press. 2004. 165-229. Kür ad K, Cengiz B, U ur A; et al. Helicobacter pylori—Is It a Novel Causative Agent in Vitamin B12 Deficiency? Arch Intern Med. 2000. 160:1349-1353. Lage, A, Godfroid E, Fauconnier A; et al. Diagnosis of Helicobacter pylori Infection by PCR: Comparison with Other Invasive Techniques and Detection of cagA Gene in Gastric Biopsy Specimens. J Clin Microbiol 1995. 33(10): 2752 – 2756. León R, Marín R, Morales A. Inmunohematología Avanzada. Distribución de fenotipos y genotipos del sistema de Lewis en Costa Rica 1999. Universidad de Costa Rica. Lu J, Perng C, Shyou R; et al. Comparison of Five PCR Methods for Detection of Helicobacter pylori DNA in Gastric Tissues. J Clin Microbiol 1999. 37(3): 772 – 774. Lu Y, Redlinger T, Avitia R; et al. Isolation and Genotyping of Helicobacter pylori from Untreated Municipal Wastewater. Applied and Environmental Microbiology 2002. 68 (3):1436–1439. Letter to the Editor. Helicobacter pylori Infection in Patients with Hashimoto's Thyroiditis. Helicobacter. 2004. 9(4):369-369. Ma J , You W , Gail M , Zhang L; et al. Helicobacter pylori infection and mode of transmission in a population at high risk of stomach cancer. Int. J. Epidemiol 1998. 27(4): 570–573. Mahalanabis D, Islam M, Shaikt S; et al. Haematological response to iron supplementation is reduced in children with asymptomatic Helicobacter pylori infection. British Journal of Nutrition. 2006. 95(5):1030-1030. Matysiak-Budnik T, Mégraud F. Helicobacter pylori and gastric cancer. Eur J Cancer 2006; 42:708–716. Mazari M, López Y, Castillo G, Ponce S; et al. Helicobacter pylori and Other Enteric Bacteria in Freshwater Environments in Mexico City. Water Sci Technol. 2001. 32(5):458-476. McDaniels A, Wymer L, Rankin C, Haugland R. Evaluation of quantitative real time PCR for the measurement of Helicobacter pylori at low concentrations in drinking water. Water Res. 2005. 39(19):4808-4816. Melo V, Cuamatzi O. Bioquímica de los procesos metabólicos. Editorial Reverté, 2da edición, Barcelona España, 2007. Mendall M, Goggin P, Molineaux N; et al. Helicobacter pylori Seroprevalence in Patients with Coronary Artery Disease. Digestive Diseases and Sciences. 2005. 50(11):2071-2074. Méndez E, Cruz G, Ángeles E. Hidrólisis de N-Orgánico y Liberación de NH4+ Mediante Actividad Ureasa en Suelos Forestales de Áreas Naturales Protegidas. Laboratorio de Edafología y Fisiología de la Nutrición Vegetal, FES Zaragoza, UNAM. Boletín CAMAFU. Febrero 2010. On line. Megraud F. When and how does Helicobacter pylori Gastroenterologie Clinique Et Biologique 2003. 27(3): 374–379. infection occur? Miehlke S, Kirsch C, Agha-Amiri K; et al. The Helicobacter pylori vacA s1, m1 genotype and cagA is associated with gastric carcinoma in Germany. Int J Cancer. 2000. 87(3):322-7. Migneco A, Ojetti V, Spechiia L; et al. Eradication of Helicobacter pylori Infection Improves Blood Pressure Values in Patients Affected by Hypertension. Helicobacter. 2003. 8(6):585-589. Milco M, Andersen Leif . Inflammation, Immunity, and Vaccines. The year in Helicobacter 2007. Helicobacter, 2007. 12(1):15-19. Miller S, Dykes D, Polesky H. A simple salting out procedure for extracting DNA from human nucleated cells1988. Nucl. Acids Res. 16: 1215. Mitchell, H. Epidemiology of infection. Helicobacter pylori: physiology and genetics. NCBI. Bookshelf 2001. Online. Miyaji H, Azuma T, Ito S, Abe Y; et al. Helicobacter pylori infection occurs via close contact with infected individuals in early childhood. J. Gastroenterol. Hepatol. 2000. 15: 257-262. Montero V, Moya L, Porras M. Aislamiento de bacterias patógenas resistentes al cloro en agua potable.Cámara Costarricense de la Industria Alimentaria. 2004. 71: 20-26. Montero V. Enfoques ambientales en la Epidemiología de la Infección por Helicobacter pylori. Revista Costarricense de Salud Pública 2009. 18(2): 84-93. Mora D, Chamizo H, Mata A. Estudio exploratorio sobre la incidencia de cáncer gástrico y los contenido de nitratos en el agua potable en Costa Rica. Rev. Costarric. Salud Pública. 2006. 15(28):17-28. Mora, P. Evolución de las coberturas y calidad del agua para consumo humano y disposición de aguas residuales domésticas en Costa Rica al año 2008. Instituto Costarricense de Acueductos y Alcantarillados. Laboratorio Nacional de Aguas. Marzo 2009. National Center for Biotechnology Information. National Library of Medicine. 2001. Editors Washington (DC). www.NCBI Naylor G, Gotoda T, Dixon M, Shimoda T; et al. Why does Japan have a high incidence of gastric cancer? Comparison of gastritis between UK and Japanese patients. Gut 2006. 55:1545–52. Neiger R, Simpson K. Helicobacter infection in dogs and cats: Facts and fiction. Journal of Veterinary Internal Medicine 2000. 14(2): 125–133. Nugalieva Z, Opekun A, Graham D. Problem of distinguishing false–positive tests from acute or transient Helicobacter pylori infections. Helicobacter 2006. 11(2): 69– 74. Occhialini A, Marais A, Alm R. Distribution of Open Reading Frames of Plasticity Region of Strain J99 in Helicobacter pylori Strains Isolated from Gastric Carcinoma and Gastritis Patients in Costa Rica. Infection and Immunity, 2000. 68(11): 62406249. Ohara, T, Kasanuki J, Morishita T; et al. Evaluation of the role of Helicobacter pylori as a promoter of gastric cancer from the viewpoint of structural chromosomal aberration. Alimentary Pharmacology & Therapeutics. 2006. 24(4):111-119. Olczak, A, Wang G, Maier M; et al. Up-expression of NapA and other oxidative stress proteins is a compensatory response to loss of major Helicobacter pylori stress resistance factors. Free Radical Research. 2005. 39(11):1173-1182. Oliveira, A, Rocha G, Rocha A; et al. Isolation of Helicobacter pylori from the Intestinal Mucosa of Patients with Crohn's Disease. Helicobacter 2006. 11(1):2-9. Oliver, J. The Viable but Nonculturable State in Bacteria. The Journal of Microbiology 2005. 43(S):93-100. Ojetti, V. The Role of H. pylori Infection in Diabetes. Current Diabetes Reviews 2005. 1(3):343-347(5). Ojetti, X; Chen, D. Helicobacter pylori and hepatocellular carcinoma: Correlated or uncorrelated?. Journal of Gastroenterology and Hepatology 2006. 21(2):345-347. Organización Panamericana de la Salud (OPS). Calidad del agua potable en Costa Rica: Situación actual y perspectivas. Ministerio de Salud, Instituto Costarricense de Acueductos y Alcantarillados, 2004. Organización Panamericana de la Salud (OPS). Planes de Seguridad del Agua (PSA); Hojas de divulgación técnica. HDT No.100. Marzo 2006. Ortiz, A. Incidencia y Mortalidad del Cáncer en Costa Rica 1990-2003. Ministerio de Salud, Dirección Vigilancia de la Salud, Unidad de Estadística- Registro Nacional de Tumores 2005. Palli D, Masala G, Del Giudice G, et al. CagA+ Helicobacter pylori infection and gastric cancer risk in the EPIC-EURGAST study. Int J Cancer. 2007. 120:859–67. Pardi G. Determinantes de Patogenicidad Odontológica Venezolana. 2002. 40(2):185-192. de Candida Albicans. Acta Park D, Park S, Kim S; et al . Effect of Helicobacter pylori infection on the expression of DNA mismatch repair protein. Helicobacter 2005; 10:179–184. Parkin, M, Bray F, Devesa S. Cancer burden in the year 2000. Eur J Cancer. 2001. 37:S4-S66. Parkin, D, Bray F, Ferlain J; et al. Global Cancer Statistics, 2002. CA Cancer J Clin. 2005. 55:74-108. Pascual J, Moreno J, Hernández T; et al. Persistence of immobilized and total urease and phosphatase activities in a soil amended with organic wastes. Bioresource and Technology 2002. 82: 73-78. Peña C, Carter D, Ayala F. Toxicología Ambiental. Southwest Hazardous Waste Program. University of Arizona. 2001. Peek R, Blaser M. Helicobacter pylori and gastrointestinal tract adenocarcinomas. Nat Rev Cancer, 2002; 2:28–37. Perez G, Rothenbacher D, Brenner H. Epidemiology of Helicobacter pylori Infection. Helicobacter 2004. 9(Suppl 1): 1–6. Perry S, Parsonnet J. Commentary: H. pylori infection in early life and the problem of imperfect tests. Int. J. Epidemiol, 2005; 34(6):1356–1358. Peter A, Montenero, A. Is Helicobacter pylori a cause of atrial fibrillation?. Future Cardiology 2006. 2(4):429-439. Piqueres P. A combination of direct viable count and fluorescent in situ hybridization for estimating Helicobacter pylori cell viability. Res Microbiol. 2006. 157(4):345–349. Pounder R, Ng D. The Prevalence of Helicobacter pylori Infection in Different Countries. Alimentary Pharmacology & Therapeutics 1995. 9: 33–39. Presotto F, Sabini B, Cechetto A; et al. Helicobacter pylori Infection and Gastric Autoimmune Diseases: Is There a Link?. Helicobacter. 2003. 8(6):578-584. Poms R , Tatini S. Survival of Helicobacter pylori in ready-toeat foods at 4 °C. International Journal of Food Microbiology. 2001. 63(3):281–286. Programa de actualización médica continua. Enfermedad ulcero-péptica. Trib Med. 2002. 102(6):248-255 Queiroz D, Camargos A, Rocha G; et al. Association Between Helicobacter pylori Infection and Cirrhosis in Patients with Chronic Hepatitis C Virus. Digestive Diseases and Sciences. 2006. 51(2):370-373. Ramírez R , Chinga A , Mendoza R . Variation of Helicobacter pylori prevalence and its relation with the level of chlorine in the water at the "Atarjea" plant, Lima, Peru. Period 1985-2002. Rev Gastroenterol Peru. 2004. 24(3):223-9. Rao V, Poutahidis T, Ge Z, Nambiar P; et al. Innate immune inflammatory response against enteric bacteria Helicobacter hepaticus induces mammary adenocarcinoma in mice. Cancer Res. 2006. 66:7395–400. Reavis C. Rural Health Alert: Helicobacter pylori in Well Water. Journal of the American Academy of Nurse Practitioner. 2005. 17(7):283 – 289. Rothenbacher D, Bode G, Berg G, Knayer U, Gonser T, Adler G, et al. Helicobacter pylori among preschool children and their parents: evidence of parent-child transmission. J. Infect. Dis 1999. 179: 398-402. Sempértegui F, Días M, Mejía R; et al. Low Concentrations of Zinc in Gastric Mucosa are Associated with Increased Severity of Helicobacter pylori-Induced Inflammation. Helicobacter. 2007. 12(1):43-48. Shahamat M, Mai U, Paszkokolva C, Kessel M, Colwell R . Use of Autoradiography to Assess Viability of Helicobacter Pylori in Water. Applied and Environmental Microbiology. 1993. 59(4):1231–1235. Shahamat M, Alavi M, Watts J; et al. Development of Two PCR-Based Techniques for Detecting Helical and Coccoid Forms of Helicobacter pylori. JOURNAL OF CLINICAL MICROBIOLOGY. 2004 . 42 ( 8): 3613–3619. She F , Lin J , Liu J , Huang , Su D . Virulence of water-induced coccoid Helicobacter pylori and its experimental infection in mice. World Journal of Gastroenterology. 2003. 9(3):516-520. Sierra R, Barrantes R. “Aspectos ecológicos del cáncer gástrico en Costa Rica”. Revista de Biología Tropical. 1983. 3:11-17. Sierra R. Epidemiología del cáncer en Costa Rica. Alimentos y Salud. 1994. 4: 1-6 Sierra, R. Cáncer gástrico, epidemiología y prevención. Costarricense. 2002. 44 (2):55-61. Acta Médica Simoes L, Azebedo N, Pacheco A, Keevil C. W, Vieira M. J. Drinking water biofilm assessment of total and culturable bacteria under different operating conditions. Biofouling. 2006. 22(1-2):91-99. Siomek A, Rytarowaska S, Schaflrska P; et al. Helicobacter pylori infection is associated with oxidatively damaged DNA in human leukocytes and decreased level of urinary 8-oxo-7,8-dihydroguanine. Carcinogenesis. 2006. 27 (3): 405-408. Smith S, Oyedeji K, Arigbabu A; et al. Comparison of three PCR methods for detection of Helicobacter pylori DNA and detection of cagA gene in gastric biopsy specimens. World J Gastroenterol 2004. 10(13): 1958 -1960. Stein M, Rappuoli R, Covacci A. 2001. The cag Pathogenicity Island. En: Mobley, HLT; Menz, GL; Hazell, SL. Helicobacter pylori: Physiology and Genetics. American Society for Microbiology Press, Washington D. C. Suerbaum S, Michetti P. Helicobacter pylori Infection. NEJM. 2002. 15(347):11751186. Suganuma M, Kurusu M, Suzuki K; et al. New tumor necrosis factor-alphainducing protein released from Helicobacter pylori for gastric cancer progression. J Cancer Res Clin Oncol. 2005. 131(5):305-13. Tomasini M, Zanussi S, Sozzi M; et al. Heterogeneity of cag Genotypes in Helicobacter pylori Isolates from Human Biopsy Specimens. JOURNAL OF CLINICAL MICROBIOLOGY 2003. 3 (41): 976–980. Taiji A, Nakamura N, Kaguamura Y; et al. Possible Relationship between Helicobacter pylori Infection and Cap Polyposis of the Colon. Helicobacter 2004. 9(6):651-656 Takechi T, Unemoto J, Ishihara M; et al. Idiopathic thrombocytopenic purpura associated with Helicobacter pylori infection. Pediatrics International . 2006. 48(1):76-78 Talley N, H-X Y. Ethnicity as a risk factor for Helicobacter pylori infection and gastric cancer: environment, genetics, or both?. Internal Medicine Journa.l 2008. 26(5):628-631. Targosz, A. Helicobacter pylori inhibits expression of Heat Shock Protein 70 (HSP 70) in human epithelial cell line. Importance of cag A protein. Journal of Physiology and Pharmacology. 2006. 57(2):265-278. Touati E, Michel V, Thiberge J, Wuscher N; et al. Chronic Helicobacter pylori infections induce gastric mutations in mice. Gastroenterology. 2003. 124(5):1408 1419 Touati E, Michel V, Machado A; et al. Genotoxic activity induced by various H. pylori strains is associated with a downregulation of DNA mismatch repair genes expression. Abstract Book 10th International Conference on Environmental Mutagens (ICEM). Florence Italy, 2009; 138. Tunca A. Migraine. Helicobacter pylori, and Oxidative Stress. Helicobacter. 2007. 12(1):59-62. Tsang K, Lam S. Helicobacter pylori and extra-digestive diseases Gastroenterology and Hepatology. 1999. 14(9): 844- 850. Journal of Van den Bulck K, Decostere A, Baele M, Driesseu A, Debongnie J C, Burette A, et al. Identification of non–Helicobacter pylori spiral organisms in gastric samples from humans, dogs, and cats. Journal of Clinical Microbiology 2005. 43(5): 22562260. Vargas R, Ortiz A, Muñoz G. Incidencia y Mortalidad del cáncer en Costa Rica 1995-2005. Ministerio de Salud. Dirección Vigilancia de la Salud Unidad de Estadística- Registro Nacional de Tumores. Junio 2007. Wang G, Conover R, Olczack A; et al. Oxidative stress defense mechanisms to counter iron-promoted DNA damage in Helicobacter pylori. Free Radical Research. 2005. 39(11):1183-1191. Watanabe T, Tsuge H, Imagawa T, Kise D; et al. Nucleolin as cell surface receptor for tumor necrosis factor-alpha inducing protein: a carcinogenic factor of Helicobacter pylori. J Cancer Res Clin Oncol. 2010. 136(6):911-21. Weeks D, Eskandari S, Scott DR, Sachs G. A H+-gated urea channel: the link between Helicobacter pylori urease and gastric colonization. Science. 2000. 287:482-485. Windle H, Kelleher D. Identification and characterization of a metalloprotease activity from Helicobacter pylori. Infect. Immun. 1997. 65:3132-3137. Wolfram L, Bauerfeind P. Activities of Urease and Nickel Uptake of Helicobacter pylori Proteins are Media- and Host-Dependent. Helicobacter. 2009. 14(4):264270. Yang Y, Sheu B, Lee S; et al. Children of Helicobacter pylori-infected Dyspeptic Mothers are Predisposed to H. pylori Acquisition with Subsequent Iron Deficiency and Growth Retardation. Helicobacter. 2005. 10(3):249-255. Zambon C, Navaglia F, Basso D; et al. Helicobacter pylori babA2, cagA and s1 vacA, genes work synergistically in causing intestinal metaplasia. J Clin Pathol. 2003. 56:287-291. Zavala L, Breslin M, Correa H, et al. Development and evaluation of a DNA vaccine based on Helicobacter pylori urease B: failure to prevent experimental infection in the mouse model. Helicobacter 2006. 11: 517– 522. Zhonghua Yi , Xue Za Zhi . Effects of tumor necrosis factor-alpha inducing proteinalpha secreted by Helicobacter pylori on human gastric epithelial cells. Apoptosis research, 2008. 88: 1528-1532. Anexo 1| Reglamento de Calidad de Agua de la Unión Europea. Anexo 2 Reglamento de Calidad de Agua de República Dominicana- NORDOM ANEXO 3 Protocolo de Lu y colaboradores para el cultivo de H. pylori a partir de muestras de agua residual (Lu, et al, 2002). APPLIED AND ENVIRONMENTAL MICROBIOLOGY, Mar. 2002, p. 1436–1439 Vol. 68, No. 3 Isolation and Genotyping of Helicobacter pylori from Untreated Municipal Wastewater Yingzhi Lu,1 Thomas E. Redlinger,1* Raquel Avitia,1 Adriana Galindo,1 and Karen Goodman2 The final protocol developed involved starting with an11-ml aliquot of the water sample, which was analyzed for total fecal coliforms and Escherichia coli by the U.S. Environmental Protection Agency-approved membrane filtration method (2). The H. pylori isolation protocol developed utilized a 1-ml wastewater sample, which was diluted 1:100 with sterile water and concentrated by vacuum filtration on a 2_m-pore-size nitrocellulose filter, eluted into tryptic soy broth containing antibiotics (8 _g of vancomycin per ml, 0.2 _g of polymyxin per ml, 4 _g of trimethoprim per ml; EM Science, Gibbstown, N.J.), and incubated at 37°C for 24 h in a microaerophilic atmosphere using Bio-Bags (type Cfj; Becton Dickinson). These enriched cultures were harvested and resuspended in phosphate-buffered saline, pH 7.2 (PBS), for IMS. H. pylori control strains 26695, 60190, NCTC 11639, and Tx30a (American Type Culture Collection, Manassas, Va.) were cultured on Columbia agar plates containing 15% defibrinated sheep blood in the microaerophilic atmosphere described above at 37°C for 3 to 5 days. IMS. An important initial step was a concentration procedure by IMS of untreated wastewater. This step not only selected for H. pylori based on immunological properties but also eliminated contaminating substances that may interfere with culturing. H. pylori immunomagnetic beads were prepared according to the manufacturer’s instructions. Monoclonal mouse anti-H. pylori immunoglobulin G (Fitzgerald Corp., Concord, Mass.) was gently agitated on a rotating tube inverter (Dynal Corp., Oslo, Norway) with 5 ml of magnetic beads precoated with sheep anti-rabbit immunoglobulin G (Dynabeads M-280; Dynal Corp.) for 24 h at 4°C. After being washed, the beads were resuspended in 5 ml of PBS containing 0.1% bovine serum albumin and stored at 4°C (6). Wastewater samples were mixed with the prepared beads in the proportion of 1 ml to 20 _l and gently agitated as described above for 1 h at 4°C. After being separated and washed in PBS, the bead-H. pylori conjugates were streaked onto Columbia agar-blood agar plates and incubated for 3 to 5 days under microaerophilic conditions at 37°C. Small, gray colonies were selected and stained with Gram stain to verify morphology. Colonies with gram-negative rods or coccoid forms were tested by three diagnostic techniques: a rapid urease test (Christensen’s urea test; Remel Inc., Lenexa, Kans.), cytochrome oxidase test (SpotTest Oxidase kit; Difco, Detroit, Mich.), and catalase test (SpotTest Catalase kit; Difco). H. pylori must be gram negative and positive for all three tests. ANEXO 4 Preparación de anticuerpos inmunomagnéticos Los beads de Dynal biotech son esferas de poliestireno uniformes, que miden 2.8 µm y usando un concentrador magnético los beads permiten un aislamiento y subsecuente manejo de las moléculas blanco de manera altamente específica. Los beads son esferas superparamagnéticas con afinidad purificada unidos covalentemente a la superficie de la esfera, estas esferas se suplen como una suspensión conteniendo 6-7 x 10 8 esferas/ml (aprox 10 mg/ml), en PBS con 0.1 % de BSA y 0.02 de azida de sodio. Estas deben precubrirse con anticuerpos inmunomagnéticos (Dynabeads M 280® anticuerpos IgG de oveja anti conejo), en PBS con 0.1 % de BSA, todo esto se lleva a cabo con la ayuda de un magneto o concentrador magnético. Los beads así preparados se cubren con 3 µL de anti H pylori IgG policlonal de conejo que son los anticuerpos de H pylori comprados a la casa Sygnet®. Los beads son añadidos directamente a la muestra conteniendo el antigeno o anticuerpo, después de un periodo corto de incubación permitiendo su captura por afinidad, los beads son tirados a un lado por el uso del magneto permitiendo la aspiración del material no pegado, se pueden usar también cuando la concentración del anticuerpo es baja o la afinidad antigeno anticuerpo es débil o su cinética es lenta. La separación magnética facilita los lavados fácilmente y la concentración de la molécula blanco puede ser eluida de los beads con métodos de elusión convencionales. Procedimiento de lavado: -Los Beads M 280 deben ser lavados antes de su uso para remover el preservante. El procedimiento del lavado es facilitado por el uso del magneto. Asegurarse de que los beads están totalmente resuspendidos en una solución homogénea antes de su uso. 1- Resuspender los beads en el vial por vortex. 2- Transferir la cantidad requerida de los beads resuspendidos a un tubo. 3- Se pone el tubo en el magneto por 2 minutos y se pipetea el sobrenadante, evite tocar las paredes del tubo donde los beads son atraídos al magneto con la pipeta. 4- Remover el tubo del magneto y resuspender el pellet en un volumen excesivo de buffer de lavado. 5- Repetir el paso 3 de nuevo resuspenda los beads en buffer de lavado. Recubrimiento de beads con Helicobacter: - Poner 3 µL de anti H pylori IgG policlonal de conejo con esferas de beads magnéticos precubiertos con anti conejo IgG (Dynabeads M-280 Dynal) por 24 horas a 4 °C con agitación moderada. - Con ayuda del magneto los beads se dejan a un lado del vial. - Se enjuaga 3 veces con 1 ml de PBS conteniendo 0.1% de ( suero de albúmina bovina BSA), por 30 minutos con buena agitación a 4 °C. Después del tercer lavado los beads fueron resuspendidos en 0.5 ml de PBS conteniendo 0.1 % de BSA y 0.02% de azida de sodio luego se almacenan a 4 °C. Separación de la IgG blanco: - 1- Resuspender los beads lavados por vortex . 2- Añadir la muestra conteniendo su blanco Ig a los beads lavados, aprox 0.1-1 µg Ig/107 beads pueden ser suficientes para el cruce. 3- Incubar con rotación inclinada lenta mezclando por 30 minutos o más hasta 24 horas a 2- 8 °C. 4- Poner el tubo de prueba en el magneto por 2 minutos y pipetee afuera el sobrenadante. 5. Remover el tubo de prueba del magneto, añada el buffer de lavado y resuspenda. 6. Repetir los pasos 4 y 5 dos veces ponga el tubo en el magneto y remueva el sobrenadante. El IgG unido y purificado esta ahora listo para ser eluido fuera de los beads Elusión del IgG aislado: La elusión de la IgG fuera de los beads es en este ejemplo ejecutada bajando el pH usando citrato 0.1 M ( pH de 2-3) como buffer de elusión. El grado de acidez necesaria dependerá de la Ig especifica, pero a un pH dee 3.1 la mayoría serán eluidas. 1- Añadir citrato 0.1 M a los beads M-280 con la Ig inmobilizada. 2- Mezclar bien por rotación e inclinación por 2 minutos. 3- Poner el tubo de prueba en el magneto y transfiera el sobrenadante conteniendo el Ig purificado a un tubo limpio. 4- De nuevo añadir citrato 0.1M a los beads para eluir cualquier remanente de Ig. 5- Mezclar bien por rotación e inclinación pro dos minutos. 6- Poner el tubo de prueba en el magneto pipete fuera el eluado y recoja el sobrenadante conteniendo el Ig puro. Los Dynabeads M-280 donde las Ig han sido eluidas pueden ser reusados al menos 5 veces. Para reusarlos después de eluidos los beads deberían ser inmediatamente llevados a pH neutro usando un buffer de fosfato de sodio. Para almacenarlos los beads deberían ser resuspendidos en una solución salina de PBS/BSA. Una vez que los anticuerpos están preparados se mantienen en refrigeración hasta su uso. ANEXO 5 Alineamiento múltiple de cepas de H. pylori marcador glmM MUESTRA 12 CLUSTAL 2.0.12 multiple sequence alignment Shi248 AACCCTTTTGAAGATAATGGCATTAAGTTTTTCAATTCTTATGGCTATAAACTTAAAGAA 246 Shi1 AACCCTTTTGAAGATAATGGCATTAAGTTTTTCAATTCTTATGGCTATAAACTTAAAGAA 246 Shi62 AACCCTTTTGAAGATAATGGCATTAAGTTTTTCAATTCTTATGGCTATAAACTTAAAGAA 246 Shi329 AACCCTTTTGAAGATAATGGCATTAAGTTTTTCAATTCTTATGGCTATAAACTTAAAGAA 246 Shi170 AACCCTTTTGAAGATAATGGCATTAAGTTTTTCAATTCTTATGGCTATAAACTTAAAGAA 246 Shi417 AACCCTTTTGAAGATAATGGCATTAAGTTTTTCAATTCTTATGGCTATAAACTTAAAGAA 246 Shi46 AACCCTTTTGAAGATAATGGCATTAAGTTTTTCAATTCTTATGGCTATAAACTTAAAGAA 246 Shi73 AACCCTTTTGAAGATAATGGCATTAAGTTTTTCAATTCTTATGGCTATAAACTTAAAGAA 246 Shi193 AACCCTTTTGAAGATAATGGCATTAAGTTTTTCAATTCTTATGGCTATAAACTTAAAGAA 246 Shi439 AACCCTTTTGAAGATAATGGCATTAAGTTTTTCAATTCTTATGGCTATAAACTTAAAGAA 246 Shi117 AACCCTTTTGAAGATAATGGCATTAAGTTTTTCAATTCTTATGGCTATAAACTTAAAGAA 246 Shi30 AACCCTTTTGAAGATAATGGCATTAAGTTTTTCAATTCTTATGGCTATAAACTTAAAGAA 246 Shi399 AACCCTTTTGAAGATAATGGCATTAAATTTTTCAATTCTTATGGGTATAAGCTCAAAGAA 246 GENOMA.51 AACCCTTTTGAAGATAATGGCATTAAGTTTTTCAATTCTTATGGTTATAAGCTTAAAGAA 360 JF32 AACCCTTTTGAAGATAATGGCATTAAGTTTTTCAACTCTTATGGTTATAAGCTTAAAGAA 282 JS01 AACCCTTTTGAAGATAATGGCATTAAGTTTTTCAATTCTTATGGTTATAAGCTTAAAGAA 246 JF79 AACCCTTTTGAAGATAATGGCATTAAGTTTTTCAATTCTTATGGTTATAAACTTAAAGAA 282 JS12 AACCCTTTTGAAGATAATGGCATTAAGTTTTTCAATTCTTATGGTTATAAGCTTAAAGAA 282 JC5 AACCCTTTTGAAGATAATGGCATTAAGTTTTTCAATTCTTATGGTTATAAGCTTAAAGAA 282 JC1 AACCCTTTTGAAGATAATGGTATTAAGTTTTTCAATTCTTATGGTTATAAGCTTAAAGAA 282 JF50 AACCCTTTTGAAGATAATGGCATTAAGTTTTTCAATTCTTATGGTTATAAGCTTAAAGAA 246 JS05 AACCCTTTTGAAGATAATGGCATTAAGTTTTTCAATTCTTATGGTTATAAGCTTAAAGAA 246 PP5A1 AACCCTTTTGAAGATAATGGCATTAAGTTTTTCAATTCTTATGGTTATAAGCTTAAAGAA 246 PP08C2 AACCCTTTTGAAGATAATGGCATTAAGTTTTTCAATTCTTATGGTTATAAGCTTAAAGAA 282 GENOMA.v225d AACCCTTTTGAAGATAATGGCATTAAGTTCTTCAATTCTTATGGTTATAAGCTTAAAGAA 360 PS224A1 AACCCTTTTGAAGATAATGGCATTAAGTTTTTCAATTCTTATGGTTATAAGCTTAAAGAA 246 PP25A1 AACCCTTTTGAAGACAATGGCATTAAGTTTTTCAATTCTTATGGCTATAAACTCAAAGAA 282 H.acinonychis.Sheeba AACCCTTTTGAAGACAATGGTATTAAGTTTTTCAATTCTTATGGCTATAAACTTAAAGAA 360 H.acinonychis.Mac AACCCTTTTGAAGACAATGGTATTAAGTTTTTCAATTCTTATGGCTATAAACTTAAAGAA 323 H.acinonychis.India AACCCTTTTGAAGACAATGGTATTAAGTTTTTCAATTCTTATGGCTATAAACTTAAAGAA 323 S29 AACCCTTTTGAAGACAATGGCATTAAGTTTTTCAATTCTTATGGCTATAAGCTTAAAGAA 282 S3 AACCCTTTTGAAGATAATGGTATCAAGTTTTTCAATTCTTATGGTTATAAGCTTAAAGAA 282 S19 AACCCTTTTGAAGACAATGGTATTAAGTTTTTCAATTCTTATGGCTATAAGCTTAAAGAA 282 PP39A1 AACCCTTTTGAAGATAATGGCATCAAGTTTTTCAATTCTTATGGTTATAAGCTTAAAGAA 282 PP2B4 AACCCTTTTGAAGACAATGGCATCAAGTTTTTCAATTCTTATGGTTATAAGCTTAAAGAA 246 S57 AACCCTTTTGAAGATAATGGCATTAAGTTTTTCAATTCTTATGGTTATAAGCTTAAAGAA 281 PS55A1 AACCCTTTTGAAGACAATGGTATTAAGTTTTTCAATTCTTATGGCTATAAACTCAAAGAA 282 S25 AACCCTTTTGAAGACAATGGCATCAAGTTTTTCAATTCCTATGGTTATAAACTCAAAGAA 246 PS188A1 AACCCTTTTGAAGACAATGGCATCAAGTTTTTCAATTCTTATGGTTATAAGCTTAAAGAA 246 PS118A1 AACCCTTTTGAAGACAATGGCATCAAGTTTTTCAATTCTTATGGTTATAAGCTTAAAGAA 282 PP29B1 AACCCTTTTGAAGACAATGGCATCAAGTTTTTCAATTCTTATGGTTATAAGCTTAAAGAA 246 PP46B1 AACCCTTTTGAAGACAATGGCATCAAGTTTTTCAATTCTTATGGTTATAAGCTTAAAGAA 246 PS148C1 AACCCTTTTGAAGACAATGGCATTAAGTTTTTCAATTCTTATGGTTATAAGCTTAAAGAA 246 PS56C AACCCTTTTGAAGACAATGGCATTAAGTTTTTCAATTCTTATGGTTATAAGCTTAAAGAA 282 PP27B1 AACCCTTTTGAAGACAATGGTATTAAGTTTTTCAATTCTTATGGTTATAAGCTTAAAGAA 282 PP35B1 AACCCTTTTGAAGACAATGGTATTAAGTTTTTCAATTCTTATGGTTATAAGCTTAAAGAA 246 PS149A1 AACCCTTTTGAAGACAATGGTATTAAGTTTTTCAATTCTTATGGTTATAAGCTTAAAGAA 282 PS219A2 AACCCTTTTGAAGACAATGGTATTAAGTTTTTCAATTCTTATGGTTATAAGCTTAAAGAA 246 S14 AACCCTTTTGAAGACAATGGCATTAAGTTTTTCAATTCTTATGGTTATAAGCTTAAAGAA 282 S46 AACCCTTTTGAAGACAATGGCATTAAGTTTTTCAATTCTTATGGTTATAAGCTTAAAGAA 246 S31 AACCCTTTTGAAGACAATGGCATTAAGTTTTTCAATTCCTATGGTTATAAGCTTAAAGAA 282 PS234A AACCCTTTTGAAGACAATGGCATTAAGTTTTTCAATTCTTATGGTTATAAGCTTAAAGAA 282 PP9B1 AACCCTTTTGAAGACAATGGCATCA-GTTTTTCAATTCTTATGGTTATAAGCTTAAAGAA 245 S5 AACCCTTTTGAAGATAATGGCATTAAGTTTTTCAATTCTTATGGTTATAAGCTTAAAGAA 282 S49 AACCCTTTTGAAGACAATGGTATTAAGTTTTTCAATTCTTATGGCTATAAACTCAAAGAA 282 PS158A1 AACCCTTTTGAAGACAATGGTATTAAGTTTTTCAATTCTTATGGTTATAAGCTTAAAGAA 282 S22 AACCCTTTTGAAGACAATGGCATTAAGTTTTTCAATTCTTATGGTTATAAGCTCAAAGAA 282 PS184A1 AACCCTTTTGAAGACAATGGCATTAAGTTTTTCAATTCTTATGGTTATAAACTTAAAGAA 246 PS184A AACCCTTTTGAAGACAATGGCATTAAGTTTTTCAATTCTTATGGTTATAAACTTAAAGAA 282 PS56C1 AACCCTTTTGAAGACAATGGCATTAAGTTTTTCAATTCTTATGGTTATAAACTTAAAGAA 246 PS148C AACCCTTTTGAAGACAATGGCATTAAGTTTTTCAATTCTTATGGTTATAAACTTAAAGAA 282 JF80 AATCCTTTTGAAGACAATGGCATTAAGTTTTTCAATTCTTATGGTTATAAACTCAAAGAA 282 PP34B2 AATCCTTTTGAAGACAATGGCATTAAGTTTTTCAATTCTTATGGTTATAAACTCAAAGAA 282 PP3A1 AACCCTTTTGAAGATAATGGTATCAAGTTTTTCAATTCTTATGGTTATAAACTCAAAGAA 246 PP23A1 AACCCTTTTGAAGACAATGGCATTAAATTTTTCAATTCTTATGGTTATAAGCTTAAAGAA 282 PP01A1 AACCCTTTTGAAGACAATGGTATTAAGTTTTTCAATTCTTATGGCTATAAACTCAAAGAA 282 12 ----------------------------------------TGGNTTATAAACTCAGATAN 20 216A ---------------------------------------------------------GAA 3 215A ---------------------------------------------------------GAA 3 224AUreC ---------------------------------------------------------GAA 3 029AUreC ---------------------------------------------------------GAA 3 168AUreC ---------------------------------------------------------GAA 3 045A.UreC 038A.UreC 046A.UreC 170AUreC 158A.UreC 227A26.UreC 163A.UreC 210AUreC 031A.UreC 035A.UreC 231A.UreC 030A.UreC 180A.UreC 188A.UreC 232AUreC 146A.UreC 148A.UreC 157A.UreC 156A.UreC 203A17.UreC 099A.UreC 161A.UreC 182A.UreC 214A.UreC 162C8.UreC 181A.UreC 213A.UreC 223AUreC 143A.UreC 226A.UreC J99 ---------------------------------------------------------GAA 3 ---------------------------------------------------------GAA 3 ---------------------------------------------------------GAA 3 ---------------------------------------------------------GAA 3 ---------------------------------------------------------GAA 3 ---------------------------------------------------------GAA 3 ---------------------------------------------------------GAA 3 ---------------------------------------------------------GAA 3 ---------------------------------------------------------GAA 3 ---------------------------------------------------------GAA 3 ---------------------------------------------------------GAA 3 ---------------------------------------------------------GAA 3 ---------------------------------------------------------GAA 3 ---------------------------------------------------------GAA 3 ---------------------------------------------------------GAA 3 ---------------------------------------------------------GAA 3 ---------------------------------------------------------GAA 3 ---------------------------------------------------------GAA 3 ---------------------------------------------------------GAA 3 ---------------------------------------------------------GAA 3 ---------------------------------------------------------GAA 3 ---------------------------------------------------------GAA 3 ---------------------------------------------------------GAA 3 ---------------------------------------------------------GAA 3 ---------------------------------------------------------GAA 3 ---------------------------------------------------------GAA 3 ---------------------------------------------------------GAA 3 ---------------------------------------------------------GAA 3 ---------------------------------------------------------GAA 3 ---------------------------------------------------------GAA 3 AACCCTTTTGAAGACAATGGCATCAAGTTTTTCAATTCCTATGGTTATAAACTCAAAGAA 360 * Shi248 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 306 Shi1 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 306 Shi62 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 306 Shi329 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 306 Shi170 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 306 Shi417 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 306 Shi46 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 306 Shi73 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 306 Shi193 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 306 Shi439 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 306 Shi117 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 306 Shi30 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGGATTGCTGCATTCTAGCTAT 306 Shi399 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 306 GENOMA.51 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGCTAT 420 JF32 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 342 JS01 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCTAGCTAT 306 JF79 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCTAGCTAT 342 JS12 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGCTAT 342 JC5 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGCTAT 342 JC1 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGCTAT 342 JF50 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGCTAT 306 JS05 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGCTAT 306 PP5A1 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 306 PP08C2 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 342 GENOMA.v225d GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 420 PS224A1 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 306 PP25A1 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGTTAT 342 H.acinonychis.Sheeba GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATAATGAAGAGTTATTGCATTCTAGTTAT 420 H.acinonychis.Mac GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATAATGAAGAGTTATTGCATTCTAGTTAT 383 H.acinonychis.India GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATAATGAAGAGTTATTGCATTCTAGTTAT 383 S29 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCTAGCTAT 342 S3 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCACTCTAGCTAT 342 S19 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGAATTATTGCATTCTAGTTAT 342 PP39A1 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCACTCTAGCTAT 342 PP2B4 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGTTAT 306 S57 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCTAGCTAT 341 PS55A1 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGCTAT 342 S25 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCTAGCTAT 306 PS188A1 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCCAGTTAT 306 PS118A1 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCCAGTTAT 342 PP29B1 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCCAGTTAT 306 PP46B1 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCTAGTTAT 306 PS148C1 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGTTAT 306 PS56C GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGTTAT 342 PP27B1 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCCAGTTAT 342 PP35B1 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCCAGTTAT 306 PS149A1 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCCAGTTAT 342 PS219A2 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCCAGTTAT 306 S14 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCCAGTTAT 342 S46 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCCAGTTAT 306 S31 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAAGATTACTGCATTCCAGTTAT 342 PS234A GAGGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGCTAT 342 PP9B1 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCTAGCTAT 305 S5 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCTAGCTAT 342 S49 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCTAGTTAT 342 PS158A1 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCCAGTTAT 342 S22 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCTAGTTAT 342 PS184A1 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCCAGTTAT 306 PS184A GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCCAGTTAT 342 PS56C1 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAAGATTACTGCATTCTAGCTAT 306 PS148C GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAAGATTACTGCATTCTAGCTAT 342 JF80 PP34B2 PP3A1 PP23A1 S19 PP39A1 PP2B4 S57 PS55A1 S25 PS188A1 PS118A1 PP29B1 PP46B1 PS148C1 PS56C PP27B1 PP35B1 PS149A1 PS219A2 S14 S46 S31 PS234A PP9B1 S5 S49 PS158A1 S22 PS184A1 PS184A PS56C1 PS148C JF80 PP34B2 PP3A1 PP23A1 PP01A1 12 216A 215A 224AUreC 029AUreC 168AUreC 045A.UreC 038A.UreC 046A.UreC 170AUreC 158A.UreC 227A26.UreC 163A.UreC 210AUreC 031A.UreC 035A.UreC 231A.UreC 030A.UreC 180A.UreC 188A.UreC 232AUreC 146A.UreC 148A.UreC 157A.UreC 156A.UreC 203A17.UreC 099A.UreC 161A.UreC 182A.UreC 214A.UreC 162C8.UreC 181A.UreC 213A.UreC 223AUreC 143A.UreC 226A.UreC J99 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCTAGCTAT 342 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCTAGCTAT 342 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCTAGCTAT 306 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGCTAT 342 GATACGGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 522 GATACGGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTTGTTTTTAGCGAGCTTGGGGCT 522 GATACGGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTTGTTTTTAGCGAGCTTGGGGCT 486 GATACGGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTAGTTTTTAGCGAGCTTGGGGCT 521 GATACGGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 522 GATACGGCTAATGGCGCAGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 486 GATACGGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 486 GATACGGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 522 GATACGGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 486 GATACGGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 486 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 486 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 522 GATACGGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 522 GATACGGCTAATGGTGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 486 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 522 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 486 GATACGGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGTGAGCTTGGGGCT 522 GATACGGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGTGAGCTTGGGGCT 486 GATACGGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 522 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 522 GATACCGCCAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 485 GATACGGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 522 GATACGGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 522 GATACCGCCAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 522 GATACGGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 522 GATACGGCTAATGGTGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 486 GATACCGCTAATGGTGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 522 GATACGGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 486 GATACGGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 522 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGTGAGCTTGGGGCT 522 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGTGAGCTTGGGGCT 522 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGTGAGCTTGGGGCT 486 GATACGGCTAATGGTGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 522 GATACCGCTAATGGTGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 522 GATACGGCTAATGGCGCGGCTTATAAGGTGGCTCCCGTC--------------------- 239 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGTGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGTGCGGCTTATAATGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGTGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACGGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGTGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGTGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGTGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGTGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGTGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACGGCTAATGGCGCGGCTTATAAAGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACGGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGTGAGCTTGGGGCT 243 GATACGGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACGGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 600 ***** ** ***** ** ******** ** ***** ** MUESTRA 25 CLUSTAL 2.0.12 multiple sequence alignment Shi248 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 306 Shi1 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 306 Shi62 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 306 Shi329 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 306 Shi170 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 306 Shi417 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 306 Shi46 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 306 Shi73 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 306 Shi439 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 306 Shi193 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 306 Shi117 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 306 Shi30 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGGATTGCTGCATTCTAGCTAT 306 Shi399 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 306 GENOMA.51 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGCTAT 420 JF32 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 342 JS01 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCTAGCTAT 306 JF79 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCTAGCTAT 342 JS12 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGCTAT 342 JC5 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGCTAT 342 JC1 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGCTAT 342 JF50 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGCTAT 306 JS05 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGCTAT 306 PP5A1 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 306 PP08C2 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 342 GENOMA.v225d GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 420 PS224A1 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTGCTGCATTCTAGCTAT 306 PP25A1 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGTTAT 342 H.acinonychis.Sheeba GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATAATGAAGAGTTATTGCATTCTAGTTAT 420 H.acinonychis.Mac GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATAATGAAGAGTTATTGCATTCTAGTTAT 383 H.acinonychis.India GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATAATGAAGAGTTATTGCATTCTAGTTAT 383 S29 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCTAGCTAT 342 PS55A1 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGCTAT 342 S25 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCTAGCTAT 306 S3 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCACTCTAGCTAT 342 PP39A1 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCACTCTAGCTAT 342 PP2B4 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGTTAT 306 S57 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCTAGCTAT 341 S19 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGAATTATTGCATTCTAGTTAT 342 PS188A1 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCCAGTTAT 306 PS118A1 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCCAGTTAT 342 PP29B1 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCCAGTTAT 306 PP46B1 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCTAGTTAT 306 PS148C1 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGTTAT 306 PS56C GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGTTAT 342 PP27B1 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCCAGTTAT 342 PP35B1 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCCAGTTAT 306 PS149A1 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCCAGTTAT 342 PS219A2 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCCAGTTAT 306 S14 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCCAGTTAT 342 S46 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCCAGTTAT 306 S31 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAAGATTACTGCATTCCAGTTAT 342 PS234A GAGGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGCTAT 342 PP9B1 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCTAGCTAT 305 S5 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCTAGCTAT 342 S49 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCTAGTTAT 342 PS158A1 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCCAGTTAT 342 S22 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCTAGTTAT 342 PS184A1 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCCAGTTAT 306 PS184A GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCCAGTTAT 342 PS56C1 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAAGATTACTGCATTCTAGCTAT 306 PS148C GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAAGATTACTGCATTCTAGCTAT 342 JF80 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCTAGCTAT 342 PP34B2 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCTAGCTAT 342 PP3A1 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGGATTACTGCATTCTAGCTAT 306 PP23A1 GAAGAAGAAAAAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGCTAT 342 PP01A1 GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGCTAT 342 25 ---------AGAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGCTAT 51 216A GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGTTAT 63 215A GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGTTAT 63 224AUreC GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGTTAT 63 029AUreC GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGTTAT 63 168AUreC GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGTTAT 63 045A.UreC GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGTTAT 63 038A.UreC GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGTTAT 63 046A.UreC GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGTTAT 63 170AUreC GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGTTAT 63 158A.UreC GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGTTAT 63 227A26.UreC GAAGAAGAAAGAGCGATTGAAGAAATCGTTCATGATGAAGAATTACTGCATTCTAGTTAT 63 163A.UreC GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGTTAT 63 210AUreC GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGTTAT 63 031A.UreC GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGTTAT 63 035A.UreC GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGTTAT 63 231A.UreC GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATAATGAAGAATTACTGCATTCTAGTTAT 63 030A.UreC GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATAATGAAGAATTACTGCATTCTAGTTAT 63 180A.UreC GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATAATGAAGAATTACTGCATTCTAGTTAT 63 188A.UreC GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATAATGAAGAATTACTGCATTCTAGTTAT 63 232AUreC GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATAATGAAGAATTACTGCATTCTAGTTAT 63 146A.UreC GAAGAAGAAAGAGCGATTGAAGAAATCTTTCATGATGAAGAATTACTGCATTCTAGTTAT 63 PS158A1 S22 PS184A1 PS184A PS56C1 PS148C JF80 PP34B2 PP3A1 PP23A1 PP01A1 25 216A 215A 224AUreC 029AUreC 168AUreC 045A.UreC 038A.UreC 046A.UreC 170AUreC 158A.UreC 227A26.UreC 163A.UreC 210AUreC 031A.UreC 035A.UreC 231A.UreC 030A.UreC 180A.UreC 188A.UreC 232AUreC 146A.UreC 148A.UreC 157A.UreC 156A.UreC 203A17.UreC 099A.UreC 161A.UreC 182A.UreC 214A.UreC 162C8.UreC 181A.UreC 213A.UreC 223AUreC 143A.UreC 226A.UreC J99 GATACCGCCAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 522 GATACGGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 522 GATACGGCTAATGGTGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 486 GATACCGCTAATGGTGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 522 GATACGGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 486 GATACGGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 522 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGTGAGCTTGGGGCT 522 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGTGAGCTTGGGGCT 522 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGTGAGCTTGGGGCT 486 GATACGGCTAATGGTGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 522 GA ACCGCTAATGGTGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 522 GATACGGCTAATGGCGCGGCTTATAAGGTGGCTCCCGTCTTTTTTANCGAGC-------- 223 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGTGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGTGCGGCTTATAATGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGTGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACGGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGTGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGTGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGTGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGTGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGTGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACGGCTAATGGCGCGGCTTATAAAGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACGGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGTGAGCTTGGGGCT 243 GATACGGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACCGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 243 GATACGGCTAATGGCGCGGCTTATAAGGTGGCTCCGGTCGTTTTTAGCGAGCTTGGGGCT 600 ***** ** ***** ** ******** ** ***** ** * **** ****