Ejercicios de la unidad didáctica 4.- Formulación y
Anuncio

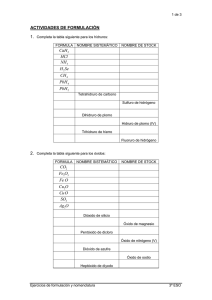
Nombre y apellidos: Ejercicios de la unidad didáctica 4.- Formulación y nomenclatura. 1 Los elementos que debes conocer este curso están recogidos en las siguientes tablas. Complétalas escribiendo los símbolos de los elementos citados en ellas. Metales Nombre Símbolo Metales Valencias Nombre Símbolo Valencias Litio 1 Cobre 1,2 Sodio 1 Plata 1 Potasio 1 Oro 1,3 Berilio 2 Cinc 2 Magnesio 2 Cadmio 2 Calcio 2 Mercurio 1,2 Hierro 2,3 Aluminio 3 Cobalto 2,3 Estaño 2,4 Níquel 2,3 Plomo 2,4 No metales Nombre Símbolo Valencias Iónicas Covalentes Hidrógeno 1 1 Boro 3 3 Carbono 4 2,4 Silicio 4 4 Nitrógeno 3 1,3,5 Fósforo 3 1,3,5 Arsénico 3 1,3,5 Oxígeno 2 2 Azufre 2 4,6 Flúor 1 1 Cloro 1 1,3,5,7 Bromo 1 1,3,5,7 Yodo 1 1,3,5,7 1 Formulación de compuestos binarios Para formular un compuesto binario entre dos elementos basta con intercambiar sus valencias y, en caso de que se pueda, simplificar. El subíndice "1" no se pone. Cuando se trata una combinación entre un metal y un no metal se debe escribir a la izquierda el símbolo del metal y a la derecha el del no metal. El no metal actuará, lógicamente, con la valencia iónica. 2 Formula el compuesto (o los compuestos) que se formarán entre: el aluminio y el azufre el magnesio y el bromo el calcio y el azufre el hierro y el cloro el cobre y el nitrógeno el plomo y el oxígeno el fósforo y el litio el berilio y el hidrógeno el yodo y el níquel el oro y el cloro el cadmio y el arsénico el boro y el sodio Si se trata de dos no metales se utilizarán las valencias covalentes y se escribirá primero el que esté más a la izquierda en la siguiente lista: B Si C As P N H S I Br Cl O F 3 Formula el compuesto (o los compuestos) que se formarán entre: el silicio y el oxígeno el oxígeno y el carbono el cloro y el oxígeno el fósforo y el flúor el flúor y el azufre 2 Nombre y apellidos: Ejercicios de la unidad didáctica 4- Formulación y nomenclatura. Nomenclatura tradicional En los primeros tiempos de la química cada compuesto recibía un nombre que no guardaba ninguna relación con su fórmula; cuando el número de compuestos químicos conocidos fue demasiado grande se decidió que había que nombrarlos de manera más metódica. Fue entonces cuando se creó la Nomenclatura Funcional. Con el tiempo, esta nomenclatura se hizo insuficiente y demasiado complicada por lo que la I.U.P.A.C., en 1957, publicó otras normas que resultan más sencillas aunque los nombres de los compuestos sean, por lo general, más largos. Puesto que la nomenclatura IUPAC es la más reciente, en muchas ocasiones es llamada "moderna" y a la nomenclatura funcional se le llama "tradicional". Hoy en día conviven las dos nomenclaturas. Cuando las valencias son únicas Si la valencia de los dos elementos que forman el compuesto binario es única, el nombre del compuesto formado se construye con dos palabras entre las que se intercala la preposición “DE”: la primera es el nombre del elemento que está escrito a la derecha en la fórmula, terminado en “URO”; la segunda es el nombre del elemento escrito a la izquierda. También se acepta, en este caso, la forma que prescinde de la preposición y termina la segunda palabra en “ICO”. 4 Completa la siguiente tabla: Fórmula MgCl 2 Nombre Cloruro de magnesio Cloruro magnésico LiBr Arseniuro de calcio Fluoruro cádmico AlBr 3 Boruro de berilio Fosfuro sódico Cloruro de potasio Cd I 2 Arseniuro alumínico Los compuestos binarios de oxígeno no se llaman “oxigenuros” sino OXIDOS. En otros casos, por razones históricas, se utiliza una raíz diferente de la esperada para designar a los 3 elementos en el nombre de un compuesto. Se dice “sulfuro”, por ejemplo, en lugar de “azufruro” . Las raíces anómalas quedan recogidas en la siguiente tabla. En algunos casos como el azufre hay dos posibles raíces en función de la terminación; la que figura en la tabla a la izquierda corresponde a la terminación “URO”. Metales Nombre 5 No metales Raíz Nombre Raíz Hierro Ferr- Hidrógeno Hidr- Cobre Cupr- Carbono Plata Argent- Oro Aur- Fósforo Fosf- Estaño Estann- Azufre Sulf- Sulfur- Plomo Plumb- Carb- Carbon- Nitrógeno NitrFosfor- Completa la siguiente tabla: Fórmula Nombre MgS Cloruro de plata Nitruro sódico AlCl 3 CdO Óxido potásico Hidruro de calcio Sulfuro lítico ZnBr2 Cd3N2 Ag2S MgO Yoduro de berilio Bromuro argéntico 4 Nombre y apellidos: Ejercicios de la unidad didáctica 4- Formulación y nomenclatura. Cuando hay varias valencias Para diferenciar los distintos compuestos formados entre dos elementos, la IUPAC propone dos opciones: la nomenclatura Sistemática y la de Stock. Nomenclatura sistemática Las palabras utilizadas van precedidas de un prefijo numeral que indica el número de átomos de cada elemento. Los numerales son: 1 - mono 2 - di 3 - tri 4 - tetra 5 - penta 6 - hexa 7 - hepta Los numerales se omiten cuando los elementos tienen valencia única. El numeral “mono” se omite cuando se refiere al elemento escrito a la izquierda en la fórmula. 6 Completa la siguiente tabla: Fórmula Co2S3 Nombre (Sistemática) Trisulfuro de dicobalto Pentacloruro de fósforo Fe 3 As 2 SnCl 2 Monóxido de dicobre CO Ni 2 S 3 7 Nombra los siguientes compuestos utilizando la nomenclatura sistemática: AuCl3 PbO2 SO3 Cl2O7 CoO Cu2O HgI2 CO2 PbS SnS 5 Nomenclatura de Stock La nomenclatura de Stock sustituye los prefijos numerales por las valencias de los elementos situadas entre paréntesis y escritas en números romanos. Dichas valencias se situarán tras el nombre del elemento y se omitirán en los casos en que no quepa duda. 8 Completa la siguiente tabla: Fórmula Ni 2 S 3 Nombre (Stock) Sulfuro de níquel (III) Óxido de cloro (VII) Hg 3 P 2 PbCl 2 Sulfuro de plomo (IV) PbO Cu 2 S 9 Nombra los siguientes compuestos utilizando la nomenclatura de Stock: Ni2O3 AuCl3 PbO2 SO3 Cl2O7 CoO FeBr2 Cu2O HgI2 SnO2 PbS SnS -6- Nombre y apellidos: Ejercicios de la unidad didáctica 4- Formulación y nomenclatura. Nomenclatura tradicional Sólo la usaremos en los casos en los que un elemento tenga dos posibles valencias. La nomenclatura tradicional distingue entre ellas utilizando la terminación OSO para la menor e ICO para la mayor. 10 Completa la siguiente tabla: Fórmula Nombre (Tradicional) Bromuro ferroso Sulfuro plúmbico CuCl 2 CoO Yoduro plúmbico NiN SnH 2 Boruro ferroso CoN Fosfuro cuproso Sn 3 As 2 Óxido estánnico Fe 2 S 3 Fluoruro cúprico Ni Cl 3 Bromuro cobaltoso Au I3 Hidruro niqueloso Hg 3 B 2 Nitruro plumboso -7- Nombres especiales Algunos compuestos conservan los nombres vulgares que recibían antiguamente. Los más importantes son: H2O NH3 Agua Amoníaco Algunos hidruros se comportan como ácidos cuando son disueltos en agua. Por ello, cuando están disueltos reciben un nombre especial. Son los siguientes: H2S HF HCl HBr HI Ácido sulfhídrico Ácido fluorhídrico Ácido clorhídrico Ácido bromhídrico Ácido yodhídrico 11 Formula los siguientes compuestos: Sulfuro de aluminio Ácido bromhídrico Dióxido de plomo Óxido férrico Agua Nitruro de mercurio (II) Boruro sódico Ácido yodhídrico Tricloruro de fósforo Monóxido de carbono Siliciuro alumínico Ácido fluorhídrico Fosfuro cálcico Ácido clorhídrico Bromuro de níquel (III) Amoníaco Heptaóxido de dicloro -8- Nombre y apellidos: Ejercicios de la unidad didáctica 4- Formulación y nomenclatura. Hidróxidos Son compuestos ternarios formados por un metal y el grupo OH que, a efectos de formulación actúa globalmente con valencia “1". En el caso de que dicho grupo aparezca más de una vez, debe escribirse entre paréntesis. Cuando la valencia es única, se nombran utilizando la palabra hidróxido y a continuación el nombre del metal precedido de la preposición “de”. También se utiliza la terminación “ICO”. Cuando el metal tiene varias valencias se utilizan las nomenclaturas ya estudiadas. 12 Completa la siguiente tabla: SISTEMÁTICA STOCK TRADICIONAL Cu(OH) 2 Trihidróxido de níquel Hidróxido de plomo (II) Hidróxido cobáltico Zn(OH) 2 Iones amonio y cianuro Muchos compuestos iónicos contienen los iones amonio: NH 4 + y cianuro: CN ─. A efectos de formulación el ion amonio debe tratarse como si fuera un metal con valencia 1 y el ion cianuro como si fuera un no metal con valencia 1. Lo mismo que el grupo hidróxido, dichos iones deben escribirse entre paréntesis cuando aparezcan más de una vez en una fórmula. 13 Completa la siguiente tabla: Fórmula Nombre Sulfuro amónico NH 4 F Cianuro cálcico NH 4 OH Cianuro amónico -9- 14 Formula los siguientes compuestos: Hidróxido de litio Hidróxido de sodio Hidróxido de potasio Hidróxido de berilio Hidróxido de magnesio Hidróxido de calcio Hidróxido ferroso Hidróxido férrico Hidróxido cobaltoso Hidróxido cobáltico Hidróxido niqueloso Hidróxido niquélico Hidróxido cuproso Hidróxido cúprico Cianuro cálcico Cianuro potásico Cianuro magnésico Cianuro berílico Cianuro plumboso Cianuro de aluminio Cianuro estánnico Sulfuro amónico Cloruro amónico Bromuro amónico Nitruro amónico Fluoruro amónico Cianuro de hidrógeno - 10 - Nombre y apellidos: Ejercicios de la unidad didáctica 4- Formulación y nomenclatura. 15 Formula los siguientes compuestos: Cloruro ferroso Monóxido de mercurio Óxido de azufre (IV) Ácido sulfhídrico Fluoruro potásico Óxido de cloro (VII) Fosfuro de berilio Hidróxido de cadmio Óxido de azufre (VI) Pentacloruro de fósforo Yoduro de níquel (II) Pentaóxido de diarsénico Hexafluoruro de azufre Sulfuro amónico Óxido de bromo (III) Nitruro de calcio Dióxido de azufre Óxido de magnesio Monóxido de dicloro Óxido de nitrógeno (I) Óxido de estaño (IV) Difluoruro de plomo Óxido de yodo (V) Cianuro de litio Óxido de aluminio Ácido bromhídrico Hidruro de sodio Bromuro cobaltoso - 11 - 16 Nombra los siguientes compuestos utilizando, en cada caso, la nomenclatura que prefieras: Li 2 S NaH KF Be 3 P 2 Ca 3 N 2 FeCl 2 CoBr 3 NiI 2 CuH 2 AgCl KOH Cd 3 B 2 (NH 4 )2S 17 Nombra los siguientes compuestos utilizando, en cada caso, la nomenclatura que prefieras: Al 2 O 3 SO 2 SO 3 Cl 2 O I2O5 Cl 2 O 7 H2S HBr PCl 3 SF 6 PCl 5 Ca(CN)2 NH 4 OH - 12 -