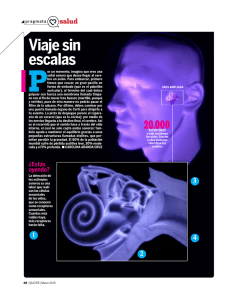
texto completo publicado de la conferencia
Anuncio

MEDICAMENTOS VIEJOS PARA ENFERMEDADES NUEVAS ÁNGEL MARTÍN MUNICIO Real Academia de Ciencias cuenta pacientes, cuyos resultados comunicó a la Royal Society en 1763. Hubo que aguardar, sin embargo, casi otro siglo, hasta Bajo este título se intenta desarrollar un tema que permite sacar a relucir una serie de innovaciones recientes que en 1828 los químicos orgánicos alemanes aislaran, en de la moderna biología molecular y de su proyección so- forma de cristales amarillos de sabor amargo, la sustancia bre los mecanismos fundamentales de las enfermedades. responsable de tal actividad: la salicina. Se trataba de un Con esta idea, el ácido acetilsalicílico protagoniza estas in- glicosido del ácido salicílíco cuya síntesis se llevó a cabo diez novaciones en cuanto a su intervención en el proceso años más tarde por los químicos franceses. Y tanto el ácibiológico de la inflamación, uno de los fenómenos más do salicílico (figura 1) como su derivado, la salicina, eran universales de la fisiopatología, en la que participan de capaces de aliviar la fiebre y el dolor; a lo que en seguida modo fundamental el mecanismo de transducción de se- se unieron sus propiedades antisépticas. Ambos compuestos se usaron para combatir las fiebres reumáticas, un ñales biológicas, la cascada de reacciones enzimáticas que desde los fosfolípidos de membrana conduce al ácido síndrome muy común en el que una infección es capaz de araquidónico y a sus metabolitos derivados, y la estruc- inducir una condición semejante a la artritis. El ácido acetura de las membranas celulares en las que tiene lugar la tilsalicílico (figura 1) fue pronto objeto de una síntesis iniciación de las señales de múltiple naturaleza. Este con- bruta por el francés Gerhardt, en 1853, y el alemán Kraut, junto de mecanismos de la moderna biomedicina está al- en 1869. canzando una extraordinaria significación por lo que se En el siglo XVII se habían conocido las propiedades anrefiere a su presencia en procesos del tipo de la ateros- tipiréticas de la quinina, presente en la corteza de cincoINTRODUCCIÓN clerosis, de algunos tipos de cancero de enfermedades neurodegenerativas. Además, el ácido acetilsalicílico ha sido uno COOH de los medicamentos no sólo clásicos, en cuanto a su empleo centenario como antidoloroso y antitérmico bajo la denominación comercial de aspirina, sino también antiguos, de amplia difusión, en cuanto al empleo de extractos vegetales poseedores de derivados del ácido salicílico. CH3 C N — CH 3 ^ ^ ^ \ / 0 - azúcar HC ^ N—C6H5 fi ^ 0 salicina antlplrina (1883) COOH N H - - COCH3 I Ú MEDICAMENTOS VIEJOS La época antigua a. salicílico La historia es tan vieja como la Antigüedad griega, cuando Hipócrates recomendaba una poción de la corteza del sauce Salix alba para el alivio del dolor y la fiebre. Usos que, después, fueron recomendados por Plinio, Dioscórides y Galeno, y, luego, a lo largo de muchos cientos de años, olvidados y redescubiertos de forma recurrente hasta que, mediado el siglo XVIII, el reverendo Edward Stone llevó a cabo con gran éxito un cierto «ensayo clínico» con cin- acetanilida (antifebrina) COCH3 53 ó NO2 p-nitrofenol NH —COCH3 COOH aspirina OH Ó V 0—C2H5 fenacetina (1888) Fig. 1 ÁNGEL MARTÍN MUNICIO na del Perú. Sin embargo, las dificultades de su empleo fueron mucho mayores que las del ácido salicílico, debido a sus múltiples efectos laterales y a las dificultades de su síntesis, añadidas a las limitaciones de su suministro y a la imposibilidad de trasplante del árbol a otras regiones. Otro remedio más reciente fue la antipirina (figura 1), descubierta por Ludwig Knorr en 1833, quien cedió sus derechos a la casa Hoechst. Y, en 1886, dos médicos alsacianos — Kahn y Hepp— prescribieron una fórmula con naftaleno para el tratamiento de los parásitos intestinales. La sustancia elaborada en la farmacia falló completamente en su intento de combatir los parásitos, pero tuvo gran éxito en la reducción de la fiebre de los pacientes. Al repetir la prescripción, la sustancia preparada cumplió con sus fines de eliminación de los parásitos, si bien la temperatura de los pacientes permaneció inalterada. Un análisis más minucioso de lo sucedido reveló el error de que la sustancia inicial, administrada por primera vez al hombre, se trataba de la acetanilida (figura 1), un derivado del alquitrán de hulla empleado en la industria de los colorantes. En aquella época, finales del siglo XIX, la quinina y el ácido salicílico eran profusamente utilizados como antipiréticos. La acetanilida, en manos de Kalle & Company, de Wiesbaden, recibió el nombre comercial de antifebrina, bajo cuya denominación, y no por su nombre genérico o químico, se llevó a cabo la difusión comercial. La antifebrina fue uno de los primeros medicamentos prescritos bajo una denominación comercial, aunque se dispusiera de la denominación genérica; lo que ya, desde entonces, ofrecía la particularidad del coste superior de los productos difundidos bajo una denominación comercial. La casa Bayer, creada en 1863 por Friedrich Bayer y Johann Weskott, había preparado el primer colorante sintético, Xa. fucsina. El primer asistente de Bayer fue su yerno Cari RumprT, que emigró a los Estados Unidos a los veinticuatro años. A la muerte de Bayer, en 1880, Rumpff se convirtió en el guía científico de la compañía, que ya se había trasladado a la ciudad de Elberfeld. En los años anteriores a 1884, Duisberg —casado con una sobrina de Rumpff— se había aplicado a la síntesis de nuevos colorantes, por ejemplo la del Rojo Congo, mediante un procedimiento diferente al utilizado con anterioridad para obviar las dificultades legales de protección de patentes; y, a partir de 1884, llevó a cabo la dirección de los programas de investigación y patentes de la compañía. Uno de los primeros objetivos de su nuevo cargo fue transformar el campo de los colorantes y dirigir la mirada hacia los nuevos medicamentos, sobre todo cuando se estaba en el año de la invención y patente de la antifebrina. Por otro lado, la casa Bayer, productora de colorantes, originaba una gran cantidad de productos secundarios del tipo del p-nitrofenol, que guarda cierta analogía química con la acetanilida. Y con los 30.000 kilos de residuos de p-nitrofenol, la compañía Bayer logró, en 1888, la acetofenetidina como primer producto farmacéutico que, aprendiendo la lección de la antifebrina, recibió el nombre comercial de fenacetina (figura 1). Un año después, en 1889, una gran 54 epidemia de gripe invadió la mayor parte de los países europeos y los Estados Unidos, en la que el empleo de \z.fenacetina aumentó grandemente los ingresos de la casa Bayer. Al año siguiente, 1890, la compañía dedicó 1,5 millones de marcos para construir un laboratorio de investigación en un edificio de tres plantas, que, en tan sólo cuatro años, se ocupó por casi un centenar de químicos. Mientras tanto, la fabricación de colorantes se instaló en la propiedad de una pequeña firma, Dr. C.Leverkus & Sons, que recibiría luego el nombre de Leverkusen, y que completaría en 1912, al borde del Rhin, una planta gigante según el diseño de Duisberg. Bajo la dirección de Duisberg, la compañía construyó en los terrenos de Elberfeld una segunda serie de laboratorios de investigación, finalizados en 1896, dedicados exclusivamente a la creación de medicamentos. La lista de medicamentos progresó con tal rapidez que Duisberg decidió promover la creación independiente de la división farmacéutica, cuya misión principal consistió en el desarrollo del gran éxito de la compañía: la fabricación industrial de la aspirina. Con este fin, el laboratorio de medicamentos se desdobló en dos secciones: una farmacéutica dedicada a la elaboración de nuevos productos, dirigida por Eichengrün; y otra, destinada al controlfarmacológico de los nuevos productos, bajo la dirección de Dreser, profesor de la universidad de Bonn. Uno de los proyectos del nuevo laboratorio farmacéutico fue la supresión de los efectos laterales del ácido salicílico, de lo que se encargó el joven químico Félix Hoffmann, cuyo padre se encontraba imposibilitado desde hacía largo tiempo por un reumatismo crónico. Y, efectivamente, el remedio con ácido salicílico era peor que la enfermedad. Fue el 10 de octubre de 1897, la fecha en que, según el cuaderno de laboratorio de Hoffmann, se dató el proceso de fabricación del ácido acetilsalicílico, que se comercializó bajo el nombre de aspirina. También es cierto que, como ha quedado señalado anteriormente, la bibliografía había citado su preparación bruta por Gerhardt y, posteriormente, por Kraut. La falta de una auténtica novedad no desanimó a Eichengrün, que la pasó a la sección de farmacología para el control de su actividad, ante la indiferencia de su director Dreser y, sin duda también, de Duisberg. A esta situación de indiferencia contribuyó el redescubrimiento comercial de la diacetilmorfina, sintetizada hacía un par de décadas por el inglés C. R. Wright. Con la intención de lograr un preparado morfínico privado de su característica adicción, la casa Bayer, tras una serie de ensayos clínicos, lanzó una enorme campaña de propaganda y difusión de la diacetilmorfina bajo la denominación comercial de heroína. En 1898, Dreser comunicó al Congreso de Médicos alemanes que se trataba de un producto diez veces más efectivo que la codeína, y con sólo una décima parte de sus efectos tóxicos; y la heroína fue presentada como la gran solución de la tremenda plaga de adicción de la morfina. El negocio fue extraordinario, sobre todo en los Estados Unidos tras las secuelas de la guerra de independencia sureña. No tenía nada de extraño que, con este señuelo comercial, la compañía mantuviese el ácido acetilsalicílico en el MEDICAMENTOS VIEJOS PARA ENFERMEDADES NUEVAS ostracismo del laboratorio de farmacología. Y, como tan- maron en días alternos una tableta de aspirina, y la otra mitas otras veces en la historia, los enfrentamientos entre la tad lo hizo de un placebo. El comité especializado encargado química -representada por Eichengrün y Hoffmann- y del seguimiento de la encuesta concluyó que el grupo trala farmacología -dirigida por Dreser- acabaron con la in- tado con aspirina experimentó un 40 por 100 menos de tervención de Duisberg y el lanzamiento del ácido acetil- alteraciones cardíacas que el grupo placebo. Teniendo en salicílico bajo la denominación de aspirin, a la vista del cuenta que tan sólo en los Estados Unidos morían en esa éxito económico de las denominaciones comerciales al es- fecha de infartos, trombosis y síndromes relacionados unas tilo de la fenacetina y la heroína. La denominación de as- 650.000 personas al año, según las conclusiones de la enpirina procedía del género Spiraea, al que pertenecía la cuesta, la administración de una tableta de aspirina en días planta conocida vulgarmente como de la «dulce sombra», alternos haría descender en 130.000 las muertes por dicha rica en aldehido salicílico que, al oxidarse, conducía al causa. Esto, en los Estados Unidos, suponía que si la mitad ácido salicílico—Spirsaure, en alemán—. Su acetilación ren- de los ciudadanos tomaban una tableta en días alternos, las día el acetylspirsdure, del que, en enero de 1899, se acuñó ventas anuales del medicamento se elevarían en un 75 %, el nombre comercial de aspirin, patentado en alrededor de alrededor de 600 millones de dólares. setenta países del mundo. No deja de ser curiosa la partiSin embargo, ¿qué ha ocurrido entre aquellos finales del cipación económica de los protagonistas en las guerras de siglo pasado, en que se fabricó el medicamento viejo, y las la aspirina. Efectivamente, el director farmacológico Dre- enfermedades nuevas, a las que en la actualidad se aplica? ser recibía un canon de todos los productos ensayados en la sección; mientras que Eichengrün y Hoffmann lo haENFERMEDADES NUEVAS cían tan sólo de los medicamentos objeto de patentes, cuya legislación, por otro lado, no admitía los nuevos productos y sí los nuevos procedimientos. Así pues, a pesar Antecedentes de que Eichengrün y Hoffmann fueron los promotores, Incluso desde antes de la puesta a punto del método de y a pesar también de la oposición de Dreser, fue solamente preparación de la aspirina por HofFmann, era un hecho reéste quien, enriquecido, pudo retirarse en seguida a disconocido la actividad anticoagulante tanto de la aspirina frutar de los beneficios de la aspirina. como del simple ácido salicílico. Actividad recogida en las En cualquier caso, al finalizar el año 1899, la aspirina lecciones de farmacología de Cari Binz, en 1891, director se presentó en todo el mundo; invadió con sus muestras los hospitales y a toda la profesión médica, a la vez que se del Instituto de Farmacología de la Universidad de Bonn, encarecía al público cualquier noticia sobre la utilidad del y tenida presente de forma habitual en la práctica quirúrgica. nuevo medicamento. En noviembre de 1899 se publicó la En 1941, Karl Link ensayó en sí mismo el comportaprimera referencia en inglés sobre la aspirina; y en 1902, miento de la aspirina y el ácido salicílico, comprobando la habían aparecido sobre ella más de ciento sesenta trabadisminución de protrombina, precursor inicial en la cascajos. Sus éxitos clínicos y comerciales tuvieron un gran da de coagulación de la sangre, en mayor proporción por paracompañamiento social que hizo, por ejemplo, que Enrite del ácido acetilsalicílico que del salicílico mismo. En 1943, co Caruso impusiera a sus empresarios la obligación del suministro de aspirina, el único remedio para sus dolores el grupo de Link confirmó estos resultados en ratas y hude cabeza. Y que Kafka, como explicara a su novia Felice manos. A raíz de estos estudios de Link acerca de la reBauer, utilizara la aspirina en su torturado dolor existen- ducción de la coagulabilidad de la sangre se produjo una cial. Su éxito comercial no resultó, obviamente, del ali- cierta alarma en la prensa médica; particularmente el Journal ofthe American Medical Associatíon se preguntaba: ¿es vio de la ansiedad, sino del remedio que supuso su interla aspirina un medicamento peligroso?^! médico inglés Paul vención en los procesos inflamatorios -artritis, fiebre Gibson, en 1948, recomendaba el empleo del ácido salicíreumática, etc. lico para combatir la trombosis coronaria, a la vez que requería ensayos clínicos más extensos para probar la acción de la La época contemporánea aspirina en la enfermedad coronaria. Poco después, en 1950, Lawrence L. Craven, otorrino Un siglo más tarde, el 2 de marzo de 1988, Frank Young, de la Food and Drug Administration de los Estados Uni- de Los Angeles, publicó en los Annals of Western Medicine and Surgery una nota en la que señalaba que, durante dos, se presentó en una conferencia de prensa en Washington, ante directivos empresariales farmacéuticos. Cin- varios años, la administración de aspirina masticable para co semanas antes, el 28 de enero, la revista New England aliviar las molestias subsiguientes a la tonsilectomía proJournal of Medicine había publicado los resultados de una ducía a los pocos días hemorragias de distinta considerainicial encuesta epidemiológica sobre la notable reducción ción. La interpretación del autor fue que la aspirina poque la aspirina había producido en la mortalidad por infartos seía una actividad para reducir la capacidad fisiológica de cardíacos, la causa primera de muertes en el mundo occi- formación de trombos. En 1953, Craven realizó un ensayo dental. El experimento se había realizado durante cuatro con ocho mil pacientes, tras el cual afirmó: «ninguno de años con veintidós mil voluntarios, de los que la mitad to- los pacientes tratados con aspirina manifestó trombosis 55 ÁNGEL MARTÍN MUNICIO corazón. En este caso, las plaquetas se agregan, y su masa es frecuentemente motivo de obstáculo para el flujo arterial. Algunas veces se rompen y los fragmentos se disno pudo, en aquella época, ofrecer razón alguna por la persan pudiendo de nuevo recrecer en unos pocos mique la aspirina ejercía dicha actividad antitrombótica, sino nutos hasta que la luz del vaso se obstruye por completo; que sus métodos no fueron científicamente validados. y solamente cuando la arteria se ciega comienza a consEl estado de los conocimientos acerca de la terapia car- truirse la fibrina y a endurecerse el trombo. Últimamente, existe una gran cabeza blanca de plaquetas y una pediovascular fue resumido en 1961 por Poole y French en el Journal ofAtherosclerosis, asegurando que la terapia an- queña cola de glóbulos rojos; pero, aun cuando el trombo ticoagulante ni era útil ni podía serlo frente a los ataques se componga únicamente de plaquetas, el daño ya ha tecardíacos. Para ello, razonaron sobre los distintos meca- nido lugar. De esta forma, el empleo de los anticoagulantes nismos del proceso de coagulación según que tenga lugar será eficaz tan sólo sobre los trombos siguientes. Y aquí en el tubo de ensayo o en los vasos sanguíneos, y en és- surge la diferencia entre los trombos venosos y los artetos según sean venosos o arteriales. Este hecho ejercería riales. Los anticoagulantes distorsionarían la cascada de una profunda implicación sobre el efecto de los anticoa- coagulación impidiendo la formación del producto figulantes. En su opinión, el hecho de interferir con la coa- nal, la fibrina. Lo que significa que contrarrestarían la gulación, no supone que el músculo cardíaco lesionado re- construcción de la cola roja fibrinosa de un trombo, pero cupere su actividad [...], más bien, el único concebible uso ejercerían escasa o ninguna acción sobre la formación del de los anticoagulantes habrá de ser frente a los trombos si- núcleo blanco plaquetario. Y, así, los trombos con una guientes. La hipótesis se funda en la suposición de que en elevada proporción de plaquetas, como los arteriales, selas venas, los trombos se construyen sobre un pequeño nú- rían menos afectados por los anticoagulantes. cleo blanco a base de plaquetas adheridas a la pared del vaso, al que se unirían los glóbulos rojos mezclados con La actualidad de las enfermedades nuevas la fibrina. Este tipo de trombos pueden ser muy dolorosos, pero raramente son fatales. La situación es muy di¿Qué ha cambiado hoy para que algo tan simple como la ferente en los trombos arteriales, especialmente si oclu- aspirina ofrezca tal diversidad de potencialidades de empleo, yen alguna de las arterias que nutren el cerebro o el desde la aterosclerosis al cáncer? cerebral o coronaria». Y, en consecuencia, proclamó que la administración de aspirina ofrecía un método seguro de profilaxis frente a la trombosis. Sin embargo, Craven no sólo metabolismo intermediario TECNOLOGÍA FlSICA FlSICA FISIOLOGÍA BIOQUÍMICA 1940 TÉCNICAS FÍSICAS DE LA FUNCIONALIDAD BIOLÓGICA CIENCIA BIOQUÍMICA UNIFICADA BIOLC)G(A MOLEC ULAR - estructura-función de biopolímeros QUÍMICA ORGÁNICA - interpretación molecular fenómenos biológicos CULTIVOS CELULARES GENÉTICA MOLECULAR NEUROBIOLOGÍA BIOLOGÍA CELULAR INMUNOLOGÍA VIROLOGÍA BIOTECNOLOGÍA DNA-RECOMBINANTE BIOQUÍMICA AMBIENTAL INTERACCIONES CÉLULA-CÉLULA CLONACIÓN ANTICUERPOS MONOCLONALES NUEVAS ESPECIES ANIMALES VEGETALES MORFOGÉNESIS DESARROLLO METÁSTASIS ESTRUCTURA-FUNCIÓN ENSAMBLAMIENTOS CELULARES GENOMA MEMBRANAS, RECEPTORES FISIOPATOLOGIA MOLECULAR CITOESQUELETO ENVEJECIMIENTO PRODUCCIÓN INDUSTRIAL DE PROTEÍNAS INFLAMACIÓN ENFERMEDADES INMUNES Fig. 2 ALTERACIÓN DE RECEPTORES ATEROSCLEROSIS OBESIDAD MEDICAMENTOS VIEJOS PARA ENFERMEDADES NUEVAS Q CHO jj ( í ^ canal de iones anquirina x^ 'i *• ^ glicoforina mmm llfil ®^ espectrina^ Fig. 3 La respuesta la encontraremos en los descubrimientos del último medio siglo en los campos solapantes de la biología molecular y celular, y de todas aquellas áreas de la biomedicina resultantes. Una interpretación de estas relaciones aparece en la figura 2. Entre otras manifestaciones del espectacular desarrollo que ha conducido al estudio de los mecanismos de las enfermedades nuevas, y como más importantes, tenemos las siguientes: ñales externas hacia el núcleo de la célula y la correspondiente regulación de la expresión génica. 5. La posición central que, en la biología molecular y celular, ocupa el mecanismo de la transducción de señales como fenómeno propio de la respuesta inmunitaria e inmunoinmunitaria, la acción hormonal y de los factores de crecimiento, la transmisión del impulso nervioso, los mecanismos del ciclo celular, la inflamación y la apoptosis; el fenómeno de la fototransducción y el modo de acción de algunos medicamentos. 6. De lo que resulta la cada día más abundante relación de anomalías patológicas, las enfermedades nuevas, vinculadas a disfunciones de la transducción de señales: inflamación, enfermedades neurodegenerativas y cáncer. 1. La averiguación de la estructura terciaria de las proteínas, como fundamento de las interacciones que soporta la transmisión de las actividades biológicas. 2. El descubrimiento de la estructura y el modo de acción de las enzimas que gobiernan específicamente cada una de las reacciones de todo tipo de los seres vivos, desde las propias de la digestión de los alimentos a las más nobles participantes en la trans- Composición y estructura de las membranas celulares misión de los caracteres hereditarios, en la acción del impulso nervioso y en el conjunto de actividaYa desde finales del siglo pasado, los biólogos celulares des de los sistemas de regulación en cascada —coagu- pusieron de manifiesto, mediante técnicas físicas y químilación de la sangre, fibrinolisis, quininas, comple- cas, la existencia de membranas plasmáticas discretas. Parmento, etc. tiendo de los estudios de permeabilidad de las células fren3. Dentro de las actuaciones en cascada de las enzimas, te a una variedad de no-electrolitos, se comenzó a especular la separación de ácidos grasos de los fosfolípidos y las sobre la naturaleza lipídica de la barrera de permeabiliconsiguientes transformaciones del ácido araquidó- dad. La probabilidad de que los lípidos presentes en las nico guardan una estrecha relación con los lípidos de membranas biológicas existan predominantemente bajo la membrana y con los mecanismos de regulación de la forma de bicapa lipídica adquirió en seguida plena confirmación por medio de las medidas físicas —ópticas y eléctransducción de las señales biológicas. tricas- llevadas a cabo sobre las membranas y sobre el con4. El conocimiento de la estructura y la composición —lípidos y proteínas— de las membranas que constitu- junto de lípidos aislados. Y fruto de ello ha sido la sucesiva yen el límite de las células con el medio externo, ha elaboración de modelos, y la práctica vigencia del modepermitido dilucidar muy variados mecanismos de la lo llamado del mosaico fluido, de Singer y Nicolson (1972), biología molecular y celular, principalmente los re- basado en la doble capa lipídica y en la múltiple naturaferidos a la transducción de los diversos tipos de se- leza de las incrustaciones de proteínas y enzimas (figura 3). 57 ÁNGEL MARTÍN MUNICIO Los lípidos, por otro lado, no son solamente ingredientes Estructura general de las membranas, que responde no sólo de la estructura de las membranas plasmáticas sino de del mosaico fluido de la membrana. En algunas ocasiones, la membrana de los orgánulos citoplásmicos -mitocondrias, ciertas especies de lípidos o sus productos de hidrólisis pueden actuar como segundos mensajeros de la acción de retículo endoplásmico, etc. La relación lípidoslproteínas en la composición de los di- señales externas. Y son, precisamente, las membranas y sus corresponferentes tipos de membranas es muy variable; desde un 80 % de lípidos en la mielina, a un 50% en los eritrocitos, y a un dientes estructuras la sede en la que se inician los fenómenos 20 % en la membrana interna mitocondriaL Las proteínas, porinterrelacionados, que se describen a continuación, y que otro lado, pueden ser intrínsecas o extrínsecas. La liberación se centran en: de las proteínas intrínsecas exige una rotura de la membra1. La posición central que ocupa el ácido araquidónico, na mediante detergentes o disolventes orgánicos apropiaprocedente de la hidrólisis enzimática de los glicedos; rotura que implica la desagregación de los lípidos con rofosfolípidos de membrana, y que, por otro lado, es las regiones Hpofílicas de las proteínas, ricas en aminoácidos sustrato de la acción enzimática de la lipooxigenasa no polares, que se sumergen más o menos completamente y la ciclooxigenasa. La ciclooxigenasa se presenta bajo en el interior de la membrana. Las proteínas extrínsecas se dos formas isoenzimáticas, COX-1 y COX-2, con separan de las preparaciones de membrana por tratamiencaracterísticas diferentes; la segunda, inducible por to con disoluciones de baja fuerza iónica, ya que su frágil asoestímulos inflamatorios y que se sobreexpresa en cierciación puede tener lugar por simple adsorción. tas manifestaciones patológicas —cáncer colorrectal, La presencia de los lípidos en las membranas biológicas por ejemplo. no tiene la simple razón del soporte físico de las proteínas de membrana. La presencia cuantitativa y cualitativa de los 2. La presencia de las proteínas de membrana, cumplidiferentes tipos de lípidos es responsable de propiedades doras de múltiples funciones según la naturaleza de singulares de la bicapa lipídica: la fluidez que justifica la la célula, entre otras las de soportar los fenómenos de libertad de movimiento de las fases hidrocarbonadas; la asiadhesión, anti-adhesión, recepción de señales e intemetría de la disposición de los lípidos individuales en las racciones con el citoesqueleto. La recepción de señales dos superficies de la membrana, que provoca el diferente inicia los diferentes tipos de mecanismos de su transambiente lipídico de cada parte; y la especificidad áe lípiducción, que participa en procesos de la importancia dos particulares en la regulación de la actividad de las prode la inflamación y la apoptosis. A modo de ejemplo, teínas de membrana, como enzimas, receptores, etc. Los se reúnen en la figura 5 las proteínas de membrana lípidos presentes en las membranas responden a los side las células T y su disposición específica en el seno guientes tipos más importantes: los esteróles, los glicerode la bicapa lipídica. fosfolípidos, los gliceroglicolípidos y los fosfoesfingolípi3. El proceso de inflamación en sus múltiples etapas, dos (figura 4). que, desde las diferentes causas, conducen a la co- CH2 —O — O C — R2 — C O — O — C H R, O" C H 2 — O — P —Base N + (colina, serina, [I etanolamina) O colesterol glicerofosfolípidos esfingomielina 58 Fig.4 MEDICAMENTOS VIEJOS PARA ENFERMEDADES NUEVAS región variable CD11 a/CD18 (LFA-1) CD43 CD28 B7-1 I I O fosfotirosina fosfatasa Fig. 5 lección de efectos diversos. Este proceso está involucrado en los mecanismos de transducción de señales. 4. Los complejos mecanismos de transducción de señales, a los que se acomoda una serie de acciones biológicas, entre ellas, las de la inflamación y la apoptosis celular. 5. El mecanismo de la apoptosis celular, modulable por diversos factores. 6. La posibilidad de la acción farmacológica sobre cada una de estas partes; y, dentro de su integración, la de la acción de las sustancias antiinflamatorias no esteroídicas. gliceroles. Un esquema de estas relaciones aparece en la figura 7. El primero, pues, en íntima conexión con el sistema de prostaglandinas, la enzima ciclooxigenasa y con la función de los antiguos salicilatos. Y los diacilgliceroles en cuanto a reguladores de la actividad de proteína quinasas, eslabón de extraordinaria importancia en los mecanismos ulteriores de la transducción de las señales. La figura 8 resume la colección de eicosanoides originados a partir del ácido araquidónico, las actividades enzimáticas que intervienen, los efectos fisiológicos particulares de cada uno de los productos y las estructuras químicas de las más importantes especies del sistema de prostaglandinas. Dentro de este esquema, la enzima ciclooxigenasa se convierte en una pieza clave del planteamiento global de este La integración del conjunto -transducción de señales, in- tema. Posición clave que resulta, en resumen, de los siflamación, apoptosis, cascada del ácido araquidónico e ¿so-guientes hechos: enzimas de ciclooxigenasa e inhibición de la inflamación por agentes no esteroídicos— aparece en la figura 6. Cada una de 1. La ciclooxigenasa se presenta bajo dos isoenzimas, sus partes va a ser objeto, a continuación, de una desCOX-1 y COX-2; la primera constitutiva y la secripción particular. gunda inducible; cada una de las cuales se va a modular de manera diferente, va a ser responsable de Acido araquidónico y ciclooxigenasas actividades fisiológicas diferentes y, en consecuencia, su inhibición va a ser la base de acciones farmaLa presencia del ácido araquidónico (20:4) ocupa una cológicas específicas. posición central en el presente estudio debido, en primer 2. COX-1 es responsable de la génesis de prostaglandilugar, a su presencia en los fosfolípidos de membrana; y, nas que actúan fisiológicamente, mientras que los por otro lado, a que sus transformaciones enzimáticas —vía niveles de COX-2 en los diferentes tejidos se increlipoxigenasa y vía ciclooxigenasa— conducen a sustancias mentan por inducción del gen correspondiente por del interés fisiopatológico de los eicosanoides, en los que se un gran número de acciones biológicas que origiintegran las prostaglandinas, las prostaciclinas, los leuconan respuestas inflamatorias. trienos y los tromboxanos. Así, la presencia del fosfatidili3. Estas respuestas pueden tener lugar en las más variadas nositol 4,5-bifosfato (Ptdlns (4,5)P2) en las membranas es partes del organismo, incluyendo el sistema nerviocapaz de servir de sustrato a varios tipos de fosfolipasas so central; y de aquí su posible contribución a la pa-A 2 , D y C- para rendir diversos productos finales de detogénesis de las alteraciones neurodegenerativas del gradación, entre otros el ácido araquidónico y los diaciltipo de la enfermedad de Alzheimer. 59 r ÁNGEL MARTÍN MUNICIO causas iniciadoras: ligandos receptores — transductores aceptares respuesta celular expresión génica TRANSDUCCION DE SEÑALES metabolismo de fosfolípidos i fosfolipasa A membrana TRAUMATISMOS ANTIGENOS infecciones, complejos autoinmunes INFLAMACIÓN causas efectos ÁCIDO ARAQUIDÓNICO flujo sanguíneo permeabilidad capilar migración celular u ciclooxigenasa o -z. o lipooxigenasa u LU ce COX-2 COX-1 (constitutiva) aspirina inhibe irreversible por acetilación (inducible) por estímulos proinflamatohos: citoquinas, endotoxinas, mitógenos sobreexpresa en la formación de tumores colorrectales participa en la respuesta inflamatoria protectora gastrointestinal & renal inhibe síntesis PGs M promotoras de tumorigénesis inhibición por APOPTOSIS Fig. 6 60 NSAIDS -• a. araquidónico ceramida MEDICAMENTOS VIEJOS PARA ENFERMEDADES NUEVAS Ptdlns(4,5)P 7 ¡ntracelular Ca 2+ fosfolipasa D fosfolipasa C fosfolipasa A 2 ® ácido fosfatídico fosfatidato fosfohidrolasa 1,2-diacilglicerol ATP dicilglicerol I i pasa ADP proteina quinasa C — 1, 2-diacilglicerol NADPH oxidasa eicosanoides Fig. 7 4. Puesto que COX-1 es necesaria para el normal fun- constitutiva y su activación conduce a la formación de cionamiento de estómago y riñon, su inhibición pue- prostaciclina con actividad antitrombogénica -en el de ocasionar daños importantes de este tipo de ór- endotelio- y citoprotectora -en la mucosa gástrica-. ganos. COX-2, codificada por un gen diferente del productor 5. En ciertas manifestaciones patológicas -cáncer, sín- de la isoforma 1, es, al contrario, inducible en ciertos tidromes neurodegenerativos, etc.- se han descrito pos de células por estímulos pro-inflamatorios. Los nivemodificaciones de los niveles de COX-2; de aquí, la les de COX-2 son ordinariamente muy bajos y están conimportancia de las posibilidades farmacológicas de su trolados rigurosamente por ciertos factores del tipo de las inhibición. citoquinas y por la disponibilidad del sustrato. La induc6. El reciente conocimiento de las estructuras tridi- ción de COX-2 por citoquinas y por estímulos inflamamensionales de ambas enzimas permite el diseño de torios en diversos tipos de células está en línea con la idea inhibidores específicos y reversibles como fundamentode que las acciones antiinflamatorias de los medicamentos no esteroídicos se deben a la inhibición de la COX-2; de nuevos agentes antiinflamatorios. 7. Esta regulación enzimática guarda relación asimismo en tanto que los efectos secundarios del tipo de la irritacon las posibilidades de modulación de la apoptosis ción gástrica y de la toxicidad renal son debidos a la incelulary, por tanto, con los fenómenos basados en ella. hibición enzimática de la COX-1. De aquí que en el diseño de nuevos medicamentos antiinflamatorios sea La prostaglandina H, sintasa, conocida también como ci- importante la selectividad de las inhibiciones de ambas clooxigenasa, cataliza la primera etapa de la conversión del isoformas. Ideas que se recogen en la figura 9. ácido araquidónico en prostaglandinas y tromboxanos (fiRecientemente se ha descrito la elevación de COX-2 en gura 8). La actividad ciclooxigenásica, en su conjunto, tumores de colon, cuyas células exhiben una menor suscepticomporta dos actividades parciales contenidas en la misbilidad a la muerte celular programada. A la vez, se afirma ma proteína dimérica: una, específicamente de ciclooxi- que dicha elevación provoca la liberación de radicales libres, genasa, que inserta oxígeno molecular en el ácido araqui- potencial origen de mutaciones y de cambios genéticos, dónico para formar el intermediario PGG2, y una actividad que, al menos en teoría, están en el origen de las células peroxidásica que reduce el hidroperóxido al alcohol co- cancerosas. En tercer lugar se ha descrito la posibilidad rrespondiente PGH 2 . Ambas funciones son adyacentes de que la elevación de COX-2 promueva la producción de pero espacialmente distintas. Sobre PGH 2 actúan otras factores angiogénicos facilitadores del crecimiento de tuactividades enzimáticas para originar los productos fina- mores. Y, por tanto, el empleo de sustancias inhibidoras les (figura 8). COX existe, al menos, en dos isoformas, de COX-2 puede potencialmente actuar frente a estos COX-1 y COX-2, capaces de mostrar diferencias sustan- efectos consecuentes o concomitantes a su elevación. Más ciales en su comportamiento farmacológico. COX-1 es aún, estos inhibidores serán capaces de proteger las célu- 61 ÁNGEL MARTÍN MUNICIO FOSFOLIPIDOS DE MEMBRANA FOSFOLIPASA A MEDIADORES DE INFLAMACIÓN 2' ESTEROIDES ANTIINFLAMATORIOS ÁCIDO ARAQUIDONICO ciclooxigenasa 5-HEPETE dehidrasa PGG2 I reductasa PGH 2 (inestable) r LTA 5-HETE hidrasa LTB glutation 5-transferasa 1 LTC 4 - quimiotáctico - liberación enzimas lisosomales - aumento de la permeabilidad vascular 4 glutamil transferasa LTD tromboxano sintetasa 4 LTE 4 - vasoconstrictores - estimulación músculo liso - migración y acumulación de leucocitos TXA2 - vasoconstrictor - agregante plaquetario - degradación membra na lisosomal prostacidina sintetasa PGI 2 - protector en shock e isquemia PGI 2, PGF2ry, PGD2 Y TXB Fig. 8 - vasoconstrictor - aumento de la presión arterial las nerviosas de la inflamación asociada a las piucas amihides,guladoras intracelulares, que constituyen la primera etapa depósitos de proteínas presentes en el cerebro de pacien- de la cascada de acontecimientos bioquímicos que ocurren a lo largo del sistema de transducción de señales hasta alcantes de la enfermedad de Alzheimer. zar la modificación de la expresión génica y la consiguiente modulación celular. Durante este recorrido actúan proteíTRANSDUCCIÓN DE SEÑALES nas transductoras y enzimas generadoras de segundos mensa jeros, los segundos mensajeros intracelulares solubles, y los s Todas las células poseen la capacidad de procesar la in- temas efectores constituidos por proteína quinasas y proteínas formación de su alrededor. Las células especializadas de los reguladoras. De esta manera, la situación aparece cada día órganos sensoriales son blanco de las señales estimuladoras más claramente complicada tanto por la múltiple naturaexternas, tales como la luz, los aromas y los mensajeros quí- leza química de las señales como por los variados mecanismicos entre células vecinas o distantes. La interacción de es- mos con que opera en cada caso la cascada de interacciones tos ligandos-citoquinas, antígenos, hormonaspolipeptídicas,en el seno de la célula. Un esquema de la distribución de las factores de crecimiento, neurotransmisores, óxido nítrico, etc.— entidades moleculares participantes en un proceso general con los receptores de la superficie celular genera señales re- de transducción de señales aparece en la figura 10. 62 MEDICAMENTOS VIEJOS PARA ENFERMEDADES NUEVAS fosfolípidos de membrana glucocortico'des endotoxinas — citoquinas mitógenos COX-1 inhibidores selectivos estómago: PGF^ /PGI2 riñon: PGE 2 /PGI 2 plaquetas: TXA2 endotelio: PGI2 inflamación: macrófagos, sinoviocitos Fig. 9 MECANISMO GENERAL DE TRANSDUCCION DE SEÑALES LIGANDO hormonas factores de crecimiento neurotransmisores antígenos medicamentos RECEPTOR Sistema de PROCESAMIENTO DE LA SEÑAL TRANSDUCTOR ACEPTOR proteínas G adenilato (guanilato) ciclasa fosfolipasa C canales iónicos SEGUNDOS MENSAJEROS Sistema de EJECUCIÓN EFECTORES Sistema de RESPUESTA CELULAR cAMP, cGMP DAGs Na + , K+, Ca ++ proteína quinasas fosfoproteína fosfatasas fosfolipasa A REGULACIÓN DE LA EXPRESIÓN GÉNICA 63 Fig. 10 ÁNGEL MARTÍN MUNICIO A lo largo del pasado cuarto de siglo, una colección de hechos bioquímicos independientes ha preparado el complejo terreno de las interacciones moleculares que, desde los receptores de la membrana y a través del interior de la célula, alcanzan los núcleos y llevan a cabo la regulación de la transcripción. Escasas décadas durante las cuales se han aclarado fenómenos bioquímicos de la importancia de la re- nismos operativos en la transducción de señales conducentes a la puesta en marcha de procesos fisiológicos de diversa naturaleza, tales como desarrollo, diferenciación, morfogénesis, mitogénesis, activación de células T, actividad secretora, movimiento, ciclo celular y transcripción génica. El mecanismo de la transducción de señales es, pues, ingrediente central defenómenosfisiopatológicos complejos, como la inflamación y la apoptosis, en los que, a su vez, interviene de manera fundamental la cascada del ácido araquidónicoy las enzimas que lo transforman. La integración de estas cuatro ideas constituye el núcleo de la exposición de las enfermedades nuevas, objetivo de este capitulo. gulación enzimática por modificación covalente, los cambios conformacionales, las interacciones moleculares, los modelos alostéricos, las proteínas oligoméricas, la cooperatividad, la amplificación de señales, la fluidez de membrana, los modelos de bicapa lipídica y los segundos mensajeros de la activi- dad hormonal, así como numerosas regulaciones de la actividad enzimática por modificación covalente en las áreas La figura 11 da una idea gráfica inicial de la globalidad del metabolismo de los hidratos de carbono, lípidos, aminoácidos y proteínas. Esta modificación covalente ha tenido del fenómeno de transducción de señales. su representante más característico en la fosforilación y su inversa, la defosforilación, catalizadas respectivamente por Transducción de señales. Ligandos las proteína quinasas y las fosfatasas. Fosforilación y defosfo- rilación de proteínas que han dado lugar a uno de los mecanismos fundamentales de integración de las señales en las células eucarióticas, y forman parte de, prácticamente, todos los sistemas de transducción de señales. La interconversión de las formas fosforilada y defosfoñlada de una enzima va asociada con un cambio fundamental en su actividad, aunque no siempre el cambio ocurra en la misma dirección. Así, en el metabolismo de la glucosa, la fosforilación activa la degradación del glucógeno en la misma medida que inhibe su síntesis. De esta manera, la actividad de las proteína quinasas, y su actuación en cascada, ha originado una larga serie de potencialidades de meca- Los efectos a largo plazo sobre la regulación celular se originan por señales transitorias sobre los receptores de la superficie de las células. Las hormonas polipeptídicas —insulina, glucagón, por ejemplo- y los neurotransmisores -ácido glutámico, acetilcolina, por ejemplo- son dos ejemplos clásicos de ligandos que, transportados por la sangre, ejercen su función sobre superficies celulares específicas. En este sentido, una de las líneas modernas de mayor interés se basa en la averiguación de las complejas redes que se forman por interacción entre las células productoras de citoquinas y la colección de células blanco, por medio de la gran familia de citoquinas, mediadores proteicos produciFig. 11 Ins (1,4,5) P3 Ca2+ •> « U A pp9O rsk ^ PKC i ( c a 2+ ) proteína MARCKS quinasa PLA 2 GAP PLC(3 x MAp 2, MAP4\ talina, PLA2 ^ MAPKAP quinasa 2 respuestas celulares 64 DAG Ins (1,4,5) P3 Ptdlns(4,5)P2 MEDICAMENTOS VIEJOS PARA ENFERMEDADES NUEVAS CD45 membrana PIP plasmática DAG activación celular dos por las primeras, capaces de influir sobre la proliferación, la diferenciación y las funciones de las segundas. Complejidad a la que contribuyen tanto la múltiple naturaleza de ambos tipos de células como el sinergismo, interferencia o redundancia funcional entre las citoquinas. Las dos familias más importantes de citoquinas son las interleuquinas (IL) y una serie de factores de crecimiento. Las interleuquinas desempeñan su papel principal como mediadores intercelulares entre leucocitos. Así, una población de linfocitos T (TH1) secreta IL-2 e interferón-y (IFN-y) y promueve la inmunidad mediada por células, en tanto que otra población (TH2) secreta IL-4, IL-5, IL-6 e IL-10, e induce la inmunidad humoral, con producción de IgG, IgE e IgA. Simultáneamente, IL-4 e IL-10 inhiben el desarrollo de la población T H 1 , mientras que IFN-y suprime la respuesta de TH2. Asimismo, el desarrollo de las células hemopoyéticas a partir de células pluripotentes viene regulado por la acción secuencial de interleuquinas (IL-3 e IL-5) y factores estimulantes de colonias (CSF) de granulocitos, granulocitos-macrófagos y monocitos. Por otro lado, la disregulación del sistema hematopoyético puede conducir a una plétora de enfermedades, en las que las citoquinas pueden tomar parte de los compromisos terapéuticos. Las principales aplicaciones clínicas de estos factores descansan en su empleo frente a la carencia de uno o varios de los componentes celulares del sistema hematopoyético, o en las citopenias provoca- 65 Fig. 12 das por la quimioterapia antitumoral o en los transplantes de médula ósea. Una serie de citoquinas ha demostrado su participación en los mecanismos moleculares de muchas alteraciones patológicas. Entre las neoplasias: mieloma (IL-6), linfoma de Burkitt (IL-10), carcinoma de mama (TGF-(3), carcinoma de células escamosas (G-CSF), osteosaarcoma (GMCSF), leucemia mieloide (IL-1, GM-CSF, G-CSF, MCSF) y leucemia linfoide ( (IL-2, IL-7, TNF). En las enfermedades autoinmunes: diabetes tipo II (IL-1, IL-4, GM-CSF), lupus eritematoso sistémico (IL-2, GM-CSF, IFN-y) y esclerosis múltiple (IL-1, IL-6, TNF). En las variadas formas de la inflamación: artritis reumatoide (IL1, IL-6, TNF, GM-CSF), psoriasis (IL-6, IL-8), eritroderma (IL-6, IL-8), espondilitis anquilosante (IL-1, IL-6). En el asma alérgica (IL-1, IL-4, IL-5), el shock séptico (IL-1, IL-6, TNF), hfibrosis (TGF-(3), la anemia aplástica (IFN-y) y la malaria cerebral (IL-3). Habida cuenta de este conjunto de participaciones, se han diseñado distintos tipos de terapias a base de citoquinas y anticitoquinas, así como vectores virales codificadores de citoquinas, con el objeto de manipular la respuesta inmunitaria. Transducción de señales. Receptores El ejercicio de la actividad biológica de cada una de las moléculas que actúan como ligandos requiere la partici- r ÁNGEL MARTÍN MUNICIO alérgeno péptidos alergénicos CD40L MHC class basófilo CD40 célula péptidoí TCR/CD4 ' | CD28 célula T auxiliar CD4 + \ eosinófilo CD40L célula Th2 CD40 célula cebada astma pación de receptores en la membrana celular (figura 12), de cuya interacción resulta la iniciación de la carrera de transmisión de señales en el citoplasma. Desde el punto de vista de su estructura, los receptores se clasifican en los siguientes grupos principales: célula B basófilo Fig. 13 3. Oligómeros formadores de canales, con subunidades homoméricas o heteroméricas. Son independientes de cualquier factor intracelular o difusible de la membrana, por lo que actúan con gran rapidez. Además de la manera usual de activación de los receptores por medio de los transmisores liberados presinápti1. Polipéptidos dotados de un único dominio hidrofóbico. camente (acetilcolina, GABA, glutamato, 5-hidroEstas cadenas polipeptídicas pueden estar ancladas en xitriptamina, ATP), el transmisor puede originarse la membrana de manera diferente, según que posean intracelularmente como en el caso de los receptores o no residuos transmembranares. De acuerdo con la de membrana de orgánulos celulares, por ejemplo composición de las subunidades, los receptores puelos receptores de inositol 1,4,5-trifosfato, responsaden ser monómeros, homodímeros, heterodímeros, bles de la transferencia de Ca2+ heterotrímeros y heterotetrámeros. Asimismo, algunos receptores pueden poseer actividades enzimáticas La interacción de múltiples pares receptor-correceppromovidas por la interacción con el ligando; es el caso tor (figura 13) se presenta en la activación clonal de linde la actividad de tirosina quinasa en los receptores de focitos T específica de antígenos. El receptor de células T insulina y de los factores mitogénicos, o de guanilato (TCR) reconoce los péptidos antigénicos mostrados por ciclasa en los receptores de péptidos natriuréticos. las células presentadoras de antígenos (APC) en el con2. Polipéptidos con siete dominios hidrofóbicos, estructu- texto de la actuación del complejo principal de historados como monómeros, homodímeros o heterodí- compatibilidad. El mecanismo por el que la unión del meros. En su cara intracelular, cada subunidad po- ligando al TCR desencadena la activación de los linfocisee una secuencia de reconocimiento de proteínas G tos ha sido uno de los temas más fascinantes de la reque interaccionan con un canal, bien directamente ciente biología molecular y celular. En él destacan, la foso a través de mensajeros difusibles (PAF, eicosanoi- forilación de la proteína consecuente al acoplamiento des, IL-8, neuropéptidos, etc.) con el ligando y la producción de una gran variedad de 66 MEDICAMENTOS VIEJOS PARA ENFERMEDADES NUEVAS citoquinas; entre ellas, las interleuquinas (IL-2, IL-3, IL4, IL-5, IL-6 e IL-10), el factor estimulante de colonias de granulocitos-macrófagos (GM-CSF), el factor a de necrosis tumoral (TNF-a) y el interferón-y (IFN-y). La complejidad de los sucesos de la transducción de señales iniciados en la membrana plasmática de las células T, y finalizados en el control nuclear de la expresión génica de las linfoquinas, constituye uno de los más interesantes modelos de interacción entre los ingredientes espaciotemporales del sistema. La coordinación de estos factores es crucial para la regulación de la respuesta inmunitaria. En resumen, el acoplamiento del TCR provoca la activación de múltiples proteína quinasas no receptoras; CD45 entre otras, las proteínas p56 y p59 de la familia src, que median en muchas de las subsiguientes reacciones de fosforilación. Así, la fosforilación de tirosina inicia una cascada de señales por modulación de la actividad de una fosfolipasa C (PLC-Yi), requerida para la hidrólisis de fosfoinosítidos, y de otras enzimas generadoras de señales intracelulares. La activación de PLC causa la hidrólisis de fosfatidilinositol 4,5-bifosfato (PIP2)> con la formación de segundos mensajeros: diacilgliceroles e inositol trifosfato. Estos segundos mensajeros son responsables, respectivamente, de la activación de la proteína quinasa C (PKC) y el incremento de Ca"+ intracelular. Esta es la razón por la que los inhibidores de tirosina quinasa pre- CD4 CD5 complejo CD3 e 5 E familia zeta y extracelular ¡ntracelular Pl 4-quinasa| T ISH3I SH2 Pl 4-quinasafp 120/130 Tyr505 , p56 Ick m-Sos ZAP-70 ruta A ruta B T • metabolismo Pl 3,4-P 2 de Pl Pl 3,4,5-P 3 I I Pl 4 , 5 - P 2 — 1P3 DAG PLC Y ra Q • MAP-2 quinasa 2+ I Fig. 14 67 ÁNGEL MARTÍN MUNICIO vienen la expresión génica de las linfoquinas. Sin em- a las que atrae y sitúa en el seno de la membrana. Con arrebargo, los mecanismos por los que la activación de las glo a este mecanismo actúa un componente central del reproteína quinasas, incluyendo la de la PKC, se transdu- ceptor de insulina con actividad de proteína quinasa (PKB). PKB posee un dominio PH que liga específicacen al núcleo celular no está aún aclarada por completo, si bien se ha identificado un cierto número de entidades mente y con gran afinidad a Ptdlns (3,4,5)P3, lo que ocamediadoras; por ejemplo, la acumulación del producto del siona un cambio conformacional de la proteína que exprotooncogén p21ras sugiere su participación en el curso hibe un residuo de treonina para ser fosforilado por la de la migración de la señal desde la membrana. La lista quinasa PDKl. Esta co-localización de ambas, PKB y de polipéptidos fosforilados en la tirosina crece progresi- PDK1, es dependiente del fosfoinosítido, y permite la vamente, incluyendo en la actualidad los sustratos CD45, activación de PDKl y la fosforilación ulterior de PKB (figura 15). PLCYp PLCy2, TCR-tj), FceR, proteína quinasa activada por mitógenos, proteína activante de GTPasa ras y las Por otro lado, la hidrólisis de Ptdlns (4,5)P2por fosfoliquinasas src (p56lck, p59fyn, p50csl<). pasa C (PLC) genera diacilgliceroles (DAG) que activan Una de las características más sobresalientes del es- diversas especies de proteína quinasa C. Otro tipo de fosquema general de transducción de señales es la de los re- folipasas, la fosfolipasa D (PLD), activada por una varieceptores poseedores de actividad enzimática de tirosi- dad de estímulos celulares, cataliza la hidrólisis de fosfana quinasa (RTKs). Muchos receptores de factores de tidilcolina de membrana con formación de ácido crecimiento son tirosina quinasas que poseen un domi- fosfatídico. Posteriormente, la acción de una fosfohidronio catalítico citoplásmico, capaz de autofosforilación y lasa sobre el ácido fosfatídico origina asimismo diacilglifosforilación de sustratos celulares, tras la unión del li- ceroles. Fenómenos que guardan estrecha relación con la gando a los dominios SH2 (figura 14). Así, por ejem- elaboración de los segundos mensajeros. plo, cuando el factor de crecimientofiderivado de plaquetas (PDGF/3) activa el correspondiente receptor, su región Proteínas G y fosfolipasas intracelular se une a la fosfatidilinositol 3-quinasa, al factor activante de GTPasa, a \z fosfolipasa Cy, y al c-src. El Las proteínas G pertenecen a una gran superfamilia de receptor de insulina es otro ejemplo de un RTK en que proteínas homologas ligantes de nucleotidos de guanina, la unión del ligando activa una fosfatidilinositol 3-qui- implicadas en la cascada de algunos de los mecanismos nasa que no está físicamente asociada al receptor. La de transducción de señales. Y así ocurre con los receptores mayoría de los factores de crecimiento estimulan un gru- cuya estructura está basada en siete dominios transmempo de proteína quinasas intracelulares, que incluye Rafl branares, que transducen a través de la membrana toda quinasa, la proteína quinasas activadas por mitógenos una serie de señales desencadenadas, por ejemplo, por (MAP) y la proteína quinasa C. La Rafl quinasa apare- neurotransmisores, hormonas, feromonas y odorantes. La ce como esencial para la proliferación de fibroblastos participación de las proteínas G en la regulación de estas inducida por suero y la activación de genes específicos actividades fue sugerida inicialmente por los requericomo c-fos. mientos específicos de nucleotidos de guanina en la estiAdemás de los receptores clonotípicos de células T, los mulación hormonal. De igual manera, a las moléculas efectoras pertenecen diferentes tipos de células de la línea linfoide-mieloide expresan constitutivamente una familia de proteínas cono- las fosfolipasas A2 y C y una plétora de canales de iones y transportadores. Estas proteínas ligan e hidrolizan GTP, y cidas colectivamente como receptores Fe (FcR), que desempeñan una variedad de funciones en la iniciación y en participan en la regulación de fenómenos celulares funla elaboración de la respuesta inmunitaria. Los receptores damentales, al estilo de la transducción de señales, tráfico FcR se expresan en las células de todas las estirpes hema- de proteínas, proliferación, diferenciación y transcripción. topoyéticas, a excepción de las eritroides. Las células B, las Ya ha sido mencionada la implicación de proteína (tirocélulas NK, los macrófagos, las células cebadas, los gra- sina) quinasas (PTKs) en la regulación de la isoforma de nulocitos y las plaquetas expresan constitutivamente altos fosfolipasa C, PLC-Yp que genera diacilgliceroles e inosiniveles de FcR, modulados por el estado de activación. tol fosfatos, a través de los receptores de antígenos de las Estos receptores FcR no se detectan en las células T con- células T y B. Otra isoforma de fosfolipasa C, PLC-(3, se activa a través de los mismos receptores sobre linfocitos, vencionales en condiciones básales. Si la membrana celular es la sede de la recepción de la pero mediada por las proteínas G. Las proteínas (7 son heterotrímeros compuestos de tres diversidad de señales externas, y, efectivamente, las proteínas, bajo la forma de receptores, constituyen las entidades subunidades diferentes: a (39-46 kDa), (3 (37 kDa) y moleculares fundamentales, no puede olvidarse la pre- Y (8 kDa). Las subunidades a poseen una única localisencia de ciertas especies de lípidos en cuanto a su in- zación de alta afinidad para GDP o GTP, de manera que mediata colaboración en la recepción de las señales. Por la a-GDP se une fuertemente al par (3y dando lugar a ejemplo, el fosfatidilinositol 4,5-bifosfato y el fosfatidili- aGDpPY> inactivo y estimulado por la acción del ligando nositol3,4,5-trifosfato son capaces de interaccionar con cier- sobre el receptor para llevar a cabo el intercambio con tas regiones —dominios PH— de muy diversas proteínas, GTP. En la forma activa, a GTP se disocia de Py, y ambos MEDICAMENTOS VIEJOS PARA ENFERMEDADES NUEVAS receptor de insulina Ptdlns (3,4)P2 o Ptdlns(3,4,5)P3 PKB activo PI3-K PKB inactivo PKB activo quinasa Fig. 15 —a(;[P y (3y- interaccionan específicamente en el control de sus respuestas celulares. En la actualidad se han descrito más de veinte tipos de subunidades a que se usan tradicionalmente para definir las proteínas heterotriméricas purificadas: Gs (neuroepitelio olfatorio), G¡ (cerebro, conos y bastones de la retina, papilas gustativas, plaquetas), GM (células B y T, células mieloides, pulmón, riñon, hígado) y G l2 (muy extendida). Cada una de estas familias interacciona con particulares receptores y efectores; entre ellos, adenilato ciclasa, fosfolipasas C (P,, P2, j33), fosfolipasa A2, y canales de Na*, K+ y Ca2+. Frecuentemente, las subunidades a dan cuenta de la actividad primaria de las proteínas G. Asimismo, se van encontrando nuevas funciones para los dímeros Py, entre otras la regulación de: canales de K+, fosfolipasa A2, adenilato ciclasa (tipos I, II y IV), fosfolipasas p,_3, quinasas de los receptores muscarínicos y P-adrenérgicos. Además, el conjunto Py es capaz de regular la función de los receptores, aumentando su capacidad de interacción con la subunidad a o para posibilitar la desensibilización de receptores por la acción de sus quinasas específicas. La modulación de la actividad de las proteínas G se ha estudiado sobre todo en las dos formas interconvertibles de la familia ras: la activa, ligada al GTP; y la inactiva, ligada al GDP. El ciclo GTP/GDP de estas proteínas aparece regulado por dos clases de factores: 1) 69 proteínas activadoras de GTPasa; y 2) proteínas estimuladoras del intercambio de GDP por GTP, devolviendo a las proteínas G su estado activado. Por otro lado, la capacidad del conjunto py para interaccionar con la subunidad a en la proteína G de retina, está modulada por la fosfoproteína fosducina. Las proteínas arrestinas aparecen implicadas en la regulación de muchas cascadas de señales en las que el receptor se acopla con proteínas G. Dadas las numerosas funciones fisiológicas asignadas al acoplamiento de las proteínas G con los receptores en la neurotransmisión, la acción hormonal, la visión, el olfato y la quimiotaxis, cabe pensar en la existencia de numerosas anormalidades moleculares tanto de receptores como de proteínas G, y las consiguientes alteraciones patológicas. Así, por ejemplo, los defectos moleculares de una forma poco frecuente de hipertiroidismo y de la pubertad precoz familiar se han identificado con mutaciones de los receptores acoplados con proteínas G. La interleuquina 8 es uno de los más potentes quimioatrayentes de neutrófilos, y mediante la migración transendotelial de neutrófilos inducida por citoquinas, induce la angiogénesis y desencadena una variedad de efectos asociados con la respuesta inflamatoria. Y los receptores en los neutrófilos de esta interleuquina 8, designados como a y p, están acoplados con proteínas Gy se activan por fosfolipasa C. ÁNGEL MARTÍN MUNICIO res. Los pirofosfatos IP5P e IP6P se encuentran en diferentes estirpes celulares y en el hongo Dictyostelium disYa ha sido mencionado que de la interacción de men- co ideum. sajeros externos con receptores específicos de la superficie La actividad de la fosfolipasa C sobre fosfolípidos, foscelular, se origina la primera etapa de la cascada de acon- fatidilinositol y fosfatidilcolina contribuye a la generación tecimientos moleculares que subyacen en la transducción de DAGs, mientras que la hidrólisis por fosfolipasa A, prode señales. En muchos casos, la estimulación de estos re- duce ácidos grasos, preferentemente insaturados, y lisoceptores da lugar a la activación de proteínas efectoras; fosfolípidos. La fosfolipasa D produce ácido fosfatídico enzimas o canales de iones, que movilizan segundos men- que, a su vez, rinde DAGs por la acción de una fosfohisajeros químicos que inician las acciones características en drolasa específica. Todos estos metabolitos lipidíeos se el interior de la célula. Así, la activación de fosfolipasa producen como respuesta a la degradación de fosfolípiC-/3 -a través del receptor ligado a proteína G- y de fos- dos de membrana, inducida por señales particulares, y defolipasa C-y -mediada por tirosina quinasa- producen se- sempeñan su papel más importante en la activación de la gundos mensajeros intracelulares, a saber inositol 1,4,5-tri- proteína quinasa C que posee, a su vez, toda una colecfosfato (IP3) y diacilgliceroles (DAGs). IP3 moviliza los ción de acciones en el interior de la célula. La concurrendepósitos intracelulares de calcio, mientras que los DAGs cia de la acción de las fosfolipasas D y A2 sobre fosfolípison activadores fisiológicos de la proteína quinasa C. En dos produce monoacilglicerol 3-fosfato (ácido muchas células, IP, media los efectos de los receptores, li- lisofosfatídico), potencial mensajero intracelular regulagados a la hidrólisis de fosfoinosítidos, sobre la moviliza- dor del crecimiento y la motilidad celular. ción de calcio intracelular (figura 16). Por otro lado, la adenilato ciclasa y la guanilato ciclasa perEl creciente número de metabolitos de ¡nositol fosfato tenecen a las enzimas efectoras activadas por receptores encontrados, ha llevado a la consideración de que otros ino- acoplados a sus ligandos extracelulares. Como resultado de sitol fosfatos puedan llevar a cabo importantes funciones esta activación se originan los mensajeros intracelulares celulares. Así, la función de IP4 aparece ligada a la regu- AMP cíclico y GMP cíclico que regulan funciones bioquílación celular de los flujos de Ca*+; IP5 regula la afinidad micas características de los tejidos blancos, nucleótidos de la hemoglobina aviar hacia el oxígeno; mientras que cíclicos que, hace varias décadas, mostraron su capacidad ambos, IP, e IP6, se han descrito como neurotransmiso- de regulación sobre la acción hormonal. El segundo menSegundos mensajeros complejo TCR CD28 Ptdlns (4,5)P2 Ptdlns (1,4,5)P3 NF-AT1 transcripción génica Fig. 16 70 MEDICAMENTOS VIEJOS PARA ENFERMEDADES NUEVAS estímulo extracelular mitógenos, Ca2+ calor, UV, citoquinas, UV TNF a, IL-1 proteína G MAPKKKK MAPKKK MAPKK MAPK factor de transcripción (PKC?) Raf I MEK1, MEK2 estrés osmótico, arsenito, UV Rae, Cdc42 Rae, Cdc42 y GCK, (Pak?) (Pak?) i MEKK1 ? * JNKK/SEK/MKK4 i I suero RhoA Rae, Cdc42 * MKK3 ERK complejo ternario SRE SRE Fig. 17 sajero AMP cíclico ejerce prácticamente todos sus efectos a través de su acción activadora de la proteína quinasa dependiente de cAMP (PKA), mientras que el GMP cíclico activa una específica proteína quinasa dependiente de cGMP, localizada predominantemente en el cerebelo y el músculo liso. La activación de la proteína quinasa C reduce el péptido (3/A4, derivado del precursor de la proteína amiloide de la enfermedad de Alzheimer, lo que ofrece la posibilidad de influir sobre la producción del péptido (3/A4. Muchos otros procesos fisiopatológicos se encuentran participados por la proteína quinasa C. Igualmente, se han definido ciertas conexiones entre quinasas, por ejemplo las establecidas con motivo de la transducción de seProteína quinasas y proteína fosfatasas ñales mitogénicas -factor de crecimiento derivado de plaSe han identificado hasta el momento presente varios quetas (PDGF), factor de crecimiento epidérmico (EGF), centenares de proteína quinasas y proteína fosfatasas, regu- factor de crecimiento nervioso (NGF)- que se inicia en ladas por segundos mensajeros, que participan en una di- la autofosforilación de los respectivos receptores por acversidad de respuestas frente a toda una colección de es- tivación de los dominios intrínsecos con actividad quinásica. La señal se traslada por mediación de MAPK -protímulos fisiológicos. Por la acción de ambas enzimas tienen lugar fenómenos de fosforilación o defosforilación, sobre teína quinasas activadas por mitógenos—, serina/treonina residuos de serina, treonina o tirosina, que desencadenan quinasas, de gran versatilidad en toda una colección de cambios conformacionales en las proteínas que sirven de procesos de transducción de señales —factores de crecimiento, agentes de diferenciación, neurotransmisores, sustratos. La actividad de la proteína quinasa C se regula por los choque térmico- en virtualmente todos los tipos de céDAGs, esenciales para el mantenimiento de las respues- lulas. MAPK existe en forma defosforilada en células tas celulares. Se ha definido una serie de subespecies de quiescentes o sin estimular, y se activa por una MAP quinasa quinasa que cataliza la fosforilación combinada de PKC: cPKC (a, (31, (311, y), nPKC (ó, e, TI, 6) y aPKC (£,, X)y poseedoras de diferentes propiedades fisicoquímicas treonina y tirosina. La cascada de MAPK (señal —» ras y reguladoras, así como distinta expresión en tejidos y lo- p21 -* MAPKKK -* MAPKK -* MAPK) se conserva calización intracelular. Todos los miembros de la fami- en diversos procesos de transducción de señales, desde las lia de PKC son dependientes de fosfatidilserina y exhi- levaduras a los vertebrados (figura 17). Una característiben diferentes requerimientos de Ca2+ y metabolitos de ca singular de esta familia de proteína quinasas es la exifosfolípidos. Todas las subespecies de cPKC se activan gencia de fosforilación dual, en treonina y tirosina, para por la misma serie de efectores: Ca2*, DAGs, ácidos gra- su completa actividad. sos libres y lisoPC. Difieren, sin embargo, en la expreLa proteína quinasa A (proteína quinasa dependiente sión tisular; así, mientras que la distribución de PKCa de AMP cíclico) y la CAM quinasa (proteína quinasa es universal, la de PKCy está restringida exclusivamen- dependiente de calcio y calmodulina) participan en nute al cerebro. merosos procesos fisiopatológicos, entre otros los vin71 ÁNGEL MARTÍN MUNICIO dos, desempeñan a su vez un papel importante en la homeostasis general, responden a cuatro tipos principales: coagulación,fibrinolisis,quininas y complemento. Algunos de los productos finales de estos sistemas actúan directamente en la consecución de efectos finales del tipo de la vasodilatación, la permeabilidad vascular, el quimiotactismo, la contracción de los músculos lisos o la movilidad celular, pero pueden actuar asimismo sobre algunas de las células integrantes del sistema de células accesorias. Las células accesorias -mastocitos, basófilos y plaquetas, principalmente- producen también mediadores de inflamación, tales como el factor de activación de plaquetas (PAF), prostaglandinas, leucotrienos, tromboxanos, citoquinas, interleuquinas, etc., para lo cual necesitan ser activadas por ligandos diversos, entre otros, las inmunoglobulinas y los antígenos. Así, la acción de los antígenos sobre los mastocitos provoca su desgranulación y la liberación INFLAMACIÓN de mediadores como histamina y sus derivados; y la reacción de los antígenos sobre los linfocitos T provoca la liLa inflamación, fenómeno en apariencia sencillo, posee beración de linfoquinas que activan los macrófagos y prouno de los más complejos mecanismos fisiopatológicos ducen mediadores de la inflamación. Estas dos acciones de para interpretar la relación entre las causas iniciadoras del los antígenos inician algunas de las reacciones de hiperproceso y los efectos finales comunes a todas ellas. Las cau- sensibilidad inmunológica (tipos I y IV). sas iniciadoras de la inflamación pueden reducirse a dos: Así pues, del complejo mecanismo responsable de la reslos traumatismos físicos de diversa naturaleza y la estimu- puesta inflamatoria a una acción externa forma parte de toda lación por antígenos, que pueden participar bajo formas una colección de entidades moleculares, conexionadas endistintas: la penetración de un agente infeccioso, las infecciones tre sí, que posee como fundamento físico común la transcrónicas y los complejos autoinmunes. Los efectos finales se misión de señales a través de interacciones ligando-proteíconcretan en tres grupos generales de acciones: aumento na o proteína-proteína. Interacciones que contribuyen a del flujo sanguíneo en la zona, incremento de la permeabi- elaborar la compleja red reguladora de la inflamación. En lidad vascular capilar y la migración de varios tipos de célu-realidad, red de transducción de señales, con entradas-hs caulas hacia los tejidos en que la inflamación se localiza. sas inductoras- y salidas -los efectos finales- de múltiple Las diversas causas inductoras de la inflamación con- naturaleza. Y dentro de esta compleja red caben aislarse ducen a los variados efectosfinalesa través de una com- diversos aspectos parciales; entre ellos, los siguientes: plicada red de mecanismos de regulación en la que participan múltiples sistemas de reconocimiento, sistemas celulares 1. La acción desencadenante de la respuesta inflamay sistemas enzimáticos de actuación en cascada. Todos estos toria por parte de los antígenos, a través de ambas mecanismos tienen en común su participación en la elarutas de recepción: linfocitos B y linfocitos T. boración de mediadores -citoquinas, linfoquinas, activa2. La contribución de los antígenos de histocompatibidores, agentes quimiotácticos, etc.— que cumplen funlidad HLA (clases I y II) en la presentación de los ciones variadas en la globalidad de los efectos de la antígenos y los superantígenos por ciertos tipos de inflamación. células: las células presentadoras de los antígenos. En el conjunto de los sistemas de reconocimiento parti3. La participación de los receptores no convencionales cipan, por un lado, el reconocimiento específico de los antí- y / 6 - de linfocitos T. genos, característico de la respuesta inmunitaria adaptati4. La función de los co-receptoresy la participación de va, con sus dos tipos de moléculas implicadas, las las moléculas coestimuladoras, asociadas a la preinmunoglobulinas (Ig) y los receptores de antígenos de sentación de antígenos. los linfocitos T (TCR); y, por otro, las variadas muestras 5. La variedad de estímulos extracelulares productode reconocimiento celular por parte de receptores de los res de lesiones celulares, al lado de las citoquinas linfocitos y las células accesorias, mastocitos, basófilos y plainflamatorias, tales como el choque térmico, la irraquetas. La migración de los leucocitos, uno de los múltidiación, las terapias citotóxicas, el daño del DNA por ples efectos de la inflamación, se basa asimismo en el remedicamentos, etc., y su vinculación a la acción conocimiento celular debido a la presencia de marcadores transductora de cascadas específicas de proteína quide superficie en los leucocitos, y de moléculas de adherencia nasas y de proteínas G. en las células endoteliales. 6. La diversidad de citoquinasproinflamatorias. Los sistemas enzimáticos de actuación en cascada partici7• Los diferentes sistemas de adhesión, moduladores pantes en el proceso de inflamación, que, interrelacionade las interacciones leucocitos-células endoteliales. culados a transmisión sináptica excitatoria -la plasticidad sináptica, el desarrollo neuronal y diversas condiciones neuropatológicas- mediados por receptores de glutamato. Estos receptores se modulan directamente por fosforilación y se sugiere que una regulación dinámica de los receptores excitatorios se asocia con algunas formas de aprendizaje y memoria en el cerebro de mamíferos. Un nuevo tipo de proteína quinasas utiliza DNA como señal de su actuación enzimática. La fosforilación activada por DNA se ha observado en Usados de reticulocitos de conejo y en oocitos, huevos o embriones de invertebrados marinos. Esta proteína quinasa activada por DNA es una proteína quinasa nuclear que cataliza la fosforilación de serina/treonina. 72 MEDICAMENTOS VIEJOS PARA ENFERMEDADES NUEVAS 8. La gran variedad de los efectos inflamatorios fina- procesado de los antígenos celulares, y la clase II con los les, desde la inflamación sistémica y las enfermeda- extracelulares. Tras el procesado de las proteínas antigénicas, des inflamatorias autoinmunes —la artritis reuma- éstas se transforman en péptidos sencillos que se acomotoide, la cirrosis biliar primaria, la diabetes dan en un surco que forma la disposición espacial de las dependiente de insulina, por ejemplo— a la infla- proteínas HLA -particularmente sus dominios a l y a2 mación de órganos y tejidos particulares -ateros- en las de la clase I-. A lo largo de este surco se disponen clerosis, uveitis, inflamación crónica de la veji- las regiones hipervariables de las proteínas HLA, causa ga, etc.-, e, incluso, a la inflamación debida a la del polimorfismo. Y, así, el fruto de la interacción HLApresencia de proteínas específicas inductoras de ar- péptido antigénico es el que se presenta a las células; y, por tritis autoinmunes -colágenos II y XI y la proteína ejemplo, los péptidos derivados de los antígenos intracelulares se presentan por lo general a las células T CD8* por no colagenosa agrecano. 9. La regulación de enzimas inducibles, tales como la las moléculas de la clase I que se expresan virtualmente óxido nítrico sintasa (¡NOS) y la prostaglandina sin- en todas las células; en tanto que los péptidos derivados tasa/ciclooxigenasa y su contribución a la respuesta de los antígenos extracelulares se presentan, por lo general, a las células T CD4* por las moléculas de la clase II preinflamatoria. 10. La implicación de la migración de ciertas células en sentes en las células especializadas. A dos de estas propiela génesis de lesiones celulares del tipo de las pla- dades, el polimorfismo, por un lado, y la inducción inmunitaria, por otro, se debe la vinculación de toda una cas aterosclerósicas y la reestenosis arterial, y la participación de nuevas proteínas superficiales, como las larga serie de enfermedades autoinmunes -diabetes, arintegrinas complejas, y, entre ellas, la integrína aVB3. tritis, enfermedad celíaca, esclerosis múltiple, etc.- a mar11. Las posibilidades de regresión del conjunto inflamatoriocadores estructurales. Y de aquí surge la relación de los motivos estructurales de las proteínas HLA con la prey la participación en ella de citoquinas especiales. dicción de las alteraciones autoinmunes (figura 18). 12. La inhibición de la producción de citoquinas inflaEste conjunto HLA-péptido antigénico contacta con el matorias. receptor de las células T, estableciéndose así un engarce Uno de los más destacados aspectos parciales del proceso molecular del tipo: inflamatorio se refiere a las etapas superadas desde el descubrimiento en las membranas de los linfocitos humanos célula presentadora-//¿/l-/'i?/)íz'ia'o-TCR-linfocito T de las proteínas HLA —expresión génica del complejo principal de histocompatibilidad, localizado en el brazo corConjunto HLA-péptido antigénico que, a su vez, inteto del cromosoma 6 - hasta su participación en el proce- racciona con otras moléculas del tipo de CD4, CD2, LFA, sado de los antígenos y, como tal, en los detalles de la ICAM, etc., que, a modo de bridas intercelulares, favorecen activación de los linfocitos B y T. la capacidad de las células para presentar el antígeno a los En efecto, las proteínas HLA fueron descubiertas en el linfocitos T. Conjunto HLA-péptido antigénico cuyo conocimiento contribuye, de otro lado, al diseño racional de hombre, en 1958, por el inmunólogo francés Dausset, medicamentos en su capacidad de optimizar la afinidad y veinte años más tarde de su descubrimiento por Gorer en el ratón, y a las que se responsabilizó de los rechazos de los la especificidad de unión de ligandos, sustratos o inhibiinjertos de piel entre donadores y receptores de cepas di- dores, a las superficies de las proteínas. Esta presentación ferentes. Los estudios genéticos, químicos y físicos, de las de los péptidos antigénicos a los receptores de los linfocitos diferentes clases, I y II, de estas proteínas, permitieron en T, C D 4 \ por parte de las células presentadoras (APC) seguida el perfecto conocimiento de la estructura prima- con moléculas de la clase II, ejemplifica también la exisria y su disposición en la membrana celular, de la estruc- tencia de interacciones proteína-proteína a modo de bridas tura tridimensional y la presencia de diversos dominios intercelulares para favorecer la transducción de señales y la mediante difracción de rayos X, de las localizaciones en las secreción de citoquinas. La transducción se inicia en la fosque se experimentan fosforilaciones, y de su existencia forilación de residuos de tirosina de las cadenas del complejo CD3, de las proteína quinasas de las familias src bajo numerosas formas polimórficas. A fin de cuentas, un (p56lck, p59lyn) y syk (ZAP-70) y de la PI 3-quinasa. En la extraordinario polimorfismo génico manifestado bajo numerosas estructuras primarias diferentes. Estas propieda- cascada de este flujo de señales participan la fosforilación des de las proteínas HLA y, obviamente, su polimorfismo de la fosfolipasa C yl y la hidrólisis de fosfoinosítidos, lo + notable se adscriben inmediatamente a los fundamentos que conduce a un flujo intracelular de Ca~ y a la activaresponsables de la histocompatibilidad, razón de su des- ción de la proteína quinasa C. Y al final se encuentra la generación en el núcleo de factores de transcripción que facicubrimiento; y, así, las proteínas HLA se vinculan a la puesta en marcha de la respuesta inmunitaria, a través de litan la expresión de los genes de interleuquina-2 y otras su presencia en la presentación de los antígenos a las célu- citoquinas. Algunos defectos en estos fenómenos de translas B y T. La dicotomía estructural de las proteínas HLA ducción de señales en las células T constituyen la base de de las clases I y II se traduce en los dos distintos mecanismos las alteraciones en la inmunogenicidad de ciertas células de procesado de los antígenos: la clase I tiene que ver con el tumorales, colorrectales y renales, de modo principal. 73 ÁNGEL MARTÍN MUNICIO Fig. 18 antígeno extracelular \CTL I MHC clase I fagocito transferencia al citosol fagocitosis macropinocitosis endocitosis exocitosis síntesis de MHC MHC clase I p2-m retículo endoplásmico teraciones patológicas. Así, la desregulación temporal de la apoptosis de ciertas neuronas cerebrales contribuye a El mecanismo de suicidio celular o apoptosis es un pro- la génesis de las enfermedades neurodegenerativas, tipo ceso biológico fundamental de activación programada de Alzheimer y Parkinson; mientras que el fallo de las céluuna cascada de señales, que participa en el desarrollo y la las en división para iniciar la apoptosis por lesión del DNA homeostasis de los organismos multicelulares. Las células lo hace en la génesis de la enfermedad cancerosa. En gemueren por apoptosis en el embrión en desarrollo duran- neral, el comportamiento inadecuado de los mecanismos te la morfogénesis o la sinaptogénesis, y en el animal adulapoptóticos participa de numerosos procesos patológicos to durante el metabolismo tisular o con motivo de la resdel tipo de cáncer, infecciones virales y deficiencias inpuesta inmunitaria. Y al igual que en otros mecanismos de munitarias. transducción de señales, ciertas células poseen sensores De todas maneras, los acontecimientos apoptóticos no especiales en la superficie o receptores de muerte que deson tan recientes como ha querido suponerse. Así, procetectan la presencia de señales extracelulares de muerte, tras sos de esta naturaleza son propios del desarrollo linfocitario cuya interacción se desencadena la maquinaria condude los órganos linfoides primarios; las células B y T que cente a la muerte celular. La apoptosis juega un papel central en el desarrollo y la fallan a experimentar la adecuada redistribución funciohomeostasis en los metazoos. Así, las células mueren por nal de sus genes o que implican los autoantígenos, están apoptosis en el embrión en desarrollo durante la morfo- destinadas a morir. Además, en el sistema inmune perifégénesis o sinaptogénesis, y en el adulto durante el meta- rico, la activación de células T por antígenos o superanbolismo celular o al final de la respuesta inmunitaria. Y tígenos puede iniciar una expansión clonal y muerte subpuesto que la función fisiológica de la apoptosis es crucial, siguiente de la mayoría de las células activadas; fenómeno la distorsión de este proceso es causa de importantes al- conocido como muerte celular por activación (AICD). APOPTOSIS MEDICAMENTOS VIEJOS PARA ENFERMEDADES NUEVAS de importancia especial en el sistema inmunitario. Las caspasas de mamíferos son similares a CED-3. CED-4 tiene su homólogo Apaf-1 en mamíferos. CED-9 está relaY ha sido en los últimos dos o tres años cuando se han identificado las moléculas que medían este proceso de sui- cionado con los productos de la familia de genes Bcl-2 en cidio celular regulado, entre las que destacan las denomi- mamíferos que, a su vez, incluye dos subgrupos de proteínas nadas caspasas (íysteinyl ¿zj^artate-specific protein^») que que inhiben o promueven la apoptosis: las del subgrupo ICE están relacionadas con la enzima convertidora de interleu- (caspasas 1, 4y 5) que juegan un importante papel en la quina-lfí (ICE o caspasa-1) de mamíferos y con la proteína inflamación, y las del subgrupo CED-3 (caspasas 2, 3, 6, 7, 8, 9 y 10) con una gran implicación en la apoptosis (fiCED-3, producto de un gen necesario para el suicidio apoptótico en el nemátodo Caenorhabditis elegans. Efec- gura 19). tivamente, las caspasas se han encontrado implicadas en el La transmisión de las señales de apoptosis se inician en proceso de apoptosis por análisis genético en C. elegans. La los receptores de la superficie celular por medio de liganmutación o delección del gen CED-3 conduce a la aboli- dos específicos -ligandos mortales-. Tras la activación de ción de la muerte celular programada que tiene lugar du- estos receptores, se produce rápidamente la de las casparante el desarrollo hermafrodita del nemátodo. Y la rela- sas y, al cabo de algunas horas, la apoptosis celular. Los ción del producto de este gen con la caspasa-1 de mamíferos receptores mortales pertenecen a la familia de los receptosugiere la vinculación de esta familia de caspasas con los res de los factores de necrosis tumoral (TN¥), con dominios acontecimientos bioquímicos que gobiernan la apoptosis extracelulares ricos en cisteína y, además, una secuencia cien los mamíferos. Este nemátodo constituye un excelen- toplásmica conocida como dominio mortal (DD). Estos dote modelo para el estudio de los componentes de la ma- minios DD conectan los receptores con la maquinaria caquinaria de muerte celular. Tres productos génicos de paz de desencadenar la apoptosis celular, pero que, también, C. elegans son esenciales para la apoptosis: mientras CED-3 en algunos casos participan en otras funciones diferentes, y CED-4 promueven la apoptosis, CED-9 la inhibe. o aun contrarias, a la apoptosis. Y algunas moléculas que CED-3 existe como zimógeno que se activa por autopro- transmiten señales desde los receptores mortales contienen teolisis; CED-4 se une a CED-3 y promueve la activa- también dominios del tipo DD. Los receptores mortales ción de este; mientras que CED-9, al unirse a CED-4 y mejor caracterizados son CD95 (sinónimos: FasyApo 1), CED-3, mantiene inactivo a CED-3. Normalmente, exisTNFR1 (sinónimos: p55 y CD120a), receptor mortal3 te el complejo CED-9/CED-4/CED-3, en el que CED-3 (DR3) (sinónimos: Apo3, WSL-1, TRAMP y LARD), permanece inactivo y los estímulos de apoptosis ocasionan la disociación de CED-9, con lo que se permite la activaligandos ción de CED-3 y, por tanto, la disponibilidad de la céluApo2L/ÍRAIL la para experimentar la muerte celular por apoptosis en Maquinaria apoptótica La caspasa-1 es una proteasa responsable de la conversión proteolítica del precursor inactivo prointerleuquina 1(5 de 31 kDa (proIL-l(3) a su forma activa de 17.5 kDa. La acción proteolítica ocurre en el enlace peptídico aspl lóala] 17. Así pues, la caspasa-1 es un ingrediente fundamental de los procesos basados en la acción de IL-1, del tipo de las enfermedades inflamatorias como la artritis reumatoide. Recientemente, la caspasa-1 se ha visto implicada en la maduración proteolítica del factor de inducción delinterferón-y (IGIF), una citoquina de 18 kDa que estimula la producción de interferon-y por células T. A su vez, la caspasa-1 se sintetiza bajo la forma de una proenzima inactiva de 45 kDa, presente en el citoplasma celular, y proteolíticamente activada para dar lugar a las dos subunidades de un dímero (una de 20 kDa y otra de 10 kDa). Una célula que simultáneamente es capaz de recibir señales antagónicas, dirigiendo o atenuando su ciclo de división, gobierna también la posibilidad de su apoptosis. En los vertebrados ha evolucionado una familia de genes análogos a los responsables de la muerte celular en C. elegans. En los mamíferos ha evolucionado otro mecanismo que posibilita a los organismos dirigir activamente la autodestrucción de las células individuales; clase de apoptosis 75 tipos de receptores DcR1 H DcR2 adaptador caspasa caspasas efectoras apoptosis Fig. 19 ÁNGEL MARTÍN MUNICIO DR4y DR5 (sinónimos: Apo2, TRAIL-R2, TRICK 2 y Fig. 20 lcando KILLER). Los ligandos que activan estos receptores son NGF o el conjunto de moléculas relacionadas pertenecientes a la familia de NGF. Así, el ligando CD95 se une al receptor CD95; TNFy linfotoxina a se unen a TNFR1; el ligando Apo3 (Apo3L y TWEAK) se une a DR3; y el ligando Apo2 (Apo2L y TRAIL) se une a DR4y DR5. La regulación de la actividad de las caspasas tiene lugar predominantemente como consecuencia del proceso de receptor maduración de las proenzimas. Las proenzimas inactivas se transforman en proteasas heterodiméricas catalíticamente competentes por rotura proteolítica de enlaces asp-X. La activación in vivo de las caspasas ocurre, al menos, mediante dos mecanismos diferentes. De un lado, sucede que las caspasas participan de una cascada de sucesivas actuaciones proteolíticas en la que unas caspasas se activan por otras caspasas o por proteasas de semejante actividad. Así, la serina proteasa granzima B cataliza la activación de otras caspasas efectoras; mecanismo que ha sido propuesto para la muerte celular mediada por linfocitos citotóxicos. De otro lado, se ha comprobado in vivo la existencia de un tipo de activación de caspasas por autoproteolisis intermolecular, por ejemplo en el modelo de apoptosis Fas (sinónimos: Apo-1 y CD95). En este sistema, la unión del ligando Fas-L o del TNF al receptor correspondiente (Fas o TNF-R) da lugar a un complejo de señalización formado, en el primero de los casos, por su receptor específico, la proteína adaptadora FADD y la proenzima caspasa 8, de forma que la interacción entre los dominios intracelulares (DD), tanto del receptor Fas como del adaptador FADD, produce la dimerización de las dos regiones homologas. A su vez, FADD se asocia con la forma proenzimática de la caspasa 8 a través de la dimerización de sus dominios homólogos (DED). Un mecanismo semejante se ha comprobado en el caso de la actuación del TNF como ligando y de la proenzima caspasa 2. Este tipo de recientes resultados, en su conjunto, sugieren que las caspasas efectoras son mediadoras de un proceso de muerte celular, desencadenado en respuesta a una variedad de denar una amplia neurodegeneración apoptótica del cerebro estímulos. Conjunto de actividades proteolíticas que dan de rata en desarrollo; lo que sugiere que el glutamato, neulugar a la formación de proteínas específicas, implicadas rotransmisor excitador, al actuar sobre los receptores en el mantenimiento normal de las funciones celulares, NMDA, controla la supervivencia neurona!. Hechos que de diversas proteínas estructurales y del fenotipo apoptó- pueden relacionarse con alteraciones pre y postnatal del detico (figura 20). sarrollo neuronal humano; entre las que se incluyen la Varias caspasas pueden activarse por escisión proteolíti- anestesia pediátrica y la exposición postnatal a medicaca, dando lugar a una cascada enzimática. De otro lado, mentos que bloquean los receptores NMDA, y el abuso las caspasas están conectadas con esfingomielinasas que ge- materno de drogas con repercusión prenatal. neran ceramidasy gangliosidos. Finalmente, hay que tener presente la existencia de una regulación de la apoptosis, y, Apoptosis e inflamación entre las moléculas reguladoras, el óxido nítrico (NO) es una de las más importantes. El proceso apoptótico juega un papel fundamental en la patogénesis de la inflamación crónica, con la posibilidad, Apoptosis y neurotransmisión por tanto, de ser explotado terapéuticamente. Ciertas enfermedades inflamatorias crónicas son gobernadas por linfocitos T activados que participan en ciclos de infiltración celular y destrucción de tejidos a través de la liberación de citoquinas que, a su vez, definen las respuestas inmu- El bloqueo de los receptores NMDA (N-metil-D-aspartato), durante algunas horas del desarrollo fetal a término o de la primera vida neonatal, es capaz de desenca- 76 MEDICAMENTOS VIEJOS PARA ENFERMEDADES NUEVAS nitarias humoral y celular en los órganos afectados. Las células T se activan inicialmente por células presentadoras de antígenos en los tejidos linfoides regionales; pero, en el asma, enfermedad inflamatoria crónica de las vías respiratorias, la activación de los linfocitos auxiliares T (Th), con los marcadores superficiales CD4, dirigen la destrucción tisular a través, principalmente, de sus citoquinas IL-4 e IL-5, que promueven, respectivamente, la sensibilización hacia IgE de los tejidos respiratorios y la inflamación eosinofílica. La gran cantidad de células CD4+ en las vías celulares asmáticas contiene una población expandida de células T específicas de relativamente pocos antígenos. Las células T en reposo expresan muy pocos receptores de apoptosis Fas, en tanto que durante la activación se eleva su concentración de forma que son particularmente susceptibles a la apoptosis mediada por Fas. Y la enfermedad crónica pudiera resultar simplemente del escape de algunas de estas células de la muerte programada por interacción FasL-Fas; lo que también pudiera evitarse mediante el empleo de anticuerpos activadores de Fas o la administración de FasL adicional. Recientemente se han identificado algunos pacientes raros con una eosinofilia sistémica ocasionada por la carencia de muerte celular mediada por Fas. En cualquier caso, la especificidad y diversidad de programas apoptóticos sugieren la posibilidad de aproximaciones farmacológicas para el control de la cronicidad inflamatoria. Apoptosis y cáncer Y, finalmente, otra importante conexión con los mecanismos de la apoptosis es la que relaciona la inhibición de las señales apoptóticas con la resistencia a la quimioterapia por parte de las células cancerosas. En efecto, la resistencia a la quimioterapia, adquirida o de novo, por las células tumorales, impide el logro de resultados satisfactorios en muchos casos de transformaciones malignas hematológicas y de colon, pulmón y mama. Resistencia que, aunque pueda deberse a una diversidad de factores, tales como el acceso vascular de los medicamentos, suele obedecer generalmente a causas intrínsecas, entre las que se encuentran la disminución de la captura celular del medicamento, la eliminación de los aducios DNA-medicamento, la amplificación génica del blanco, el incremento de la reparación del DNA lesionado por el medicamento y, dado que los antitumorales provocan un daño celular que induce la muerte celular programada —tal es el caso de la respuesta de muchos tipos de células tumorales frente a cisplatino, adriamicina y Ara-C—, otro mecanismo de quimiorresistencia puede ser la afectación de los propios mecanismos de apoptosis. La cascada de señales de proteína quinasas activadas por mitógenos (MAPK), en la que participa una gran familia de proteínas de amplia distribución entre los eucariontes, sirve a diferentes fines gobernados por estímulos extracelulares, entre otros Xa. promoción o la inhibición de la muerte celular por apoptosis. En los sistemas de mamíferos se 77 han reconocido tres sistemas MAPK de señales: 1) la cascada de las proteína quinasas 1 y 2 reguladas por estímulos extracelulares (ERK 1 / 2); 2) la cascada de las quinasas p38HO(l; y 3) la cascada de la proteína quinasa activada por estrés (SAPK)(figura 21). Las MAPKs mejor estudiadas son las del primer grupo; se activan por fosforilación de residuos de treonina y tirosina, iniciada por factores de crecimiento y mediada por una quinasa de especificidad dual. La ERK 1 / 2 es capaz de inducir la proliferación celular, es decir, protege a las células de la apoptosis. De otro lado, tanto la activación de las SAPKs (también conocidas como proteína quinasa c-Jun N-terminal, JNKs) como la p38 HlXl , se activan por agentes estresantes, tales como TNFa, IL-1, choque térmico, luz ultravioleta e isquemia. Además, las SAPKs se activan por una variedad de agentes quimioterápicos, tales como rá-platino, adriamicina y 1-|3-Darabinofuranosilcitosina. Activación que se logra asimismo por fosforilación de treonina y tirosina por quinasas específicas diferentes en ambos casos (figura 21). Cómo de la activación de estas quinasas se sigue un daño genotóxico está comenzando a comprenderse. Una de las posibilidades consiste en que la lesión del DNA vaya ligada a la distorsión de la actividad de una proteína quinasa DNA-dependiente. Esta proteína quinasa (DNAPK) estimula la Abl quinasa que, a su vez, conduce a la activación de la SEK-1. La SAPK activada fosforila c-Jun y otros factores de transcripción. Los mecanismos que conducen a la activación de p38HO& por los agentes estresantes están ligados a la activación de ATF2, GADD153 y las proteínas de choque térmico de bajo peso molecular. Puesto que SAPK y p38HCX' se activan por estímulos genotóxicos, cabe preguntarse acerca de su participación en la reparación de macromoléculas o, alternativamente, son capaces de desencadenar apoptosis tras un daño extenso. El choque térmico induce la actividad de SAPK en la línea de fibrosarcoma RIF-1, lo que es esencial para la apoptosis celular. En células neurales diferenciadas, SAPK es esencial para la muerte celular tras la acción de factores tróficos; sin embargo, los ratones deficientes de JNK3 -isoforma de SAPK específica de cerebro- son resistentes a la apoptosis del hipocampo tras estímulos excitotóxicos. SAPK es asimismo un mediador de apoptosis en el tratamiento quimioterápico. El bloqueo de SAPK protege a las células de ciertos tipos de tratamientos, por ejemplo de las antraciclinas y las podofilotoxinas. Sin embargo, en las células leucémicas U937, SAPK es esencial para la apoptosis provocada por ceramida, mediador de la citotoxicidad de ciertos agentes quimioterápicos. Asimismo, la expresión ectópica de MEKK -un activador anterior de SAPK- contribuye a la muerte celular por sensibilización de fibroblastos a los efectos letales de un cierto número de antitumorales. Algunos otros reguladores moleculares de la apoptosis pueden actuar a través de SAPK. Y entre los mecanismos atribuidos a SAPK para interpretar su participación en los mecanismos de apoptosis, se sugiere una acción anterior a las caspasas, aunque en algunos tipos de ligandos, ÁNGEL MARTÍN MUNICIO - ^ * luz UV, TNF a IL-1, radiaciones ionizantes, ^ ^ . medicamentos antineoplásicos, isquemia factores de crecimiento esfingomielinasa * Ras f ± Raf • MEK1 MEK2 MKK3 MKK6 ERK 1/2 p38HOG varios GADD153 c-JunATF2 p53 N 1 / 1- • ? ^ |, * proliferación celular i 1 MAP quinasa quinasa quinasa MEKK1 SEK1 /MKK4 SEK2/MKK7 |, MAP quinasa quinasa • MAP quinasa J SAPKs/JNKs^^ detención del ciclo celular • • factores de transcripción apoptosis Fig. 21 como en el caso de Fas, se activen las SAPKs en una posición posterior a la de las caspasas. La mejor comprensión de los mecanismos moleculares de regulación apoptótica y la demostración de los defectos moleculares en la resistencia clínica a la quimioterapia tumoral, habrán de contribuir a diseñar nuevas estrategias farmacológicas para devolver a las células tumorales su sensibilidad frente a los agentes quimioterápicos. Sin embargo, la gran complejidad de los fenómenos de apoptosis posibilita la existencia de numerosas localizaciones de la anormalidad. Y, por tanto, la rápida identificación de estas alteraciones en muestras clínicas servirá para restaurar en la práctica la respuesta apoptótica. BIBLIOGRAFÍA • AMAN, M. J., y LEONARD, W. J., «Cytokine Signaling: Cytokine-inducible Signaling Inhibitors», Current Biology, n.° 7, 1997, págs. R784-R788. • ASHKENAZI, A., y DlXIT, V. M , «Death Receptors: Signaling and Modulation», Science, n.° 281, 1998, págs. 1305-1308. 78 • BAZÁN, N., BOTTING, ]., y VANE, J., New Targets in Inflammation, William Harvey Press, 1996. • DURNER, Jórg, SHAH, J., y KLESSIG, Daniel E, «Salicylic Acid and Disease Resistance in Plants», Trends in Píant Science, n.° 2, 1997, págs. 266-274. • ELION, Elaine A., «Routing MAP kinase cascades», Science, n.° 281, 1998, págs. 1625-1626. • GOLD, Ralf, HARTUNG, Hans-Peter, y LASSMANN, Hans, «T-cell apoptosis in autoinmune diseases: termination of inflammation in the nerevous system and other sites with specialized immune-defense mechanisms», 77/VS, n.° 20, 1997, págs. 399-404. • GREEN, Douglas R., «Death deceiver», Nature, n.° 396, 1998, págs. 629-630. • HAQ, R., y ZANKE, B., «Inhibition of Apoptotic Signaling Pathways in Cáncer Cells as a Mechanism of Chemotherapy», Cáncer and Metástasis Rewiews, n.° 17, 1998, págs 233-239. • HOEY, Timothy, «A New Player in Cell Death», Science, n.° 278, 1997, págs. 1578-1579. • KALGUTKAR, AMIT S., et al., «Aspirin-like Molecules that Covalently Inactivate Cyclooxygenase-2», Science, n.° 280, 1998, págs. 1268-1273. MEDICAMENTOS VIEJOS PARA ENFERMEDADES NUEVAS KlNG, R. W., et al., «How Proteolysis Drives the Cell • Cycle», Science, n.° 274, 1996, págs. 1652-1658. KUMAR, S., «ICE-like Proteases in Apoptosis», TIBS, n.° 20, 1995, págs. 198-200. • MANN, CHARLES C , y PLUMMER, MARK L., The ASpirin Wars, Harvard Business School Press, Boston (Massachusetts), 1991. • MARTÍN MUNICIO, Á., y MIRAS-PORTUGAL, M. T., Cell Signal Transduction, Second Messengers and Protein Phosphorylation in Health and Disease, Plenum Press, Nueva York, 1994. MORIMOTO, Richard I., y SANTORO, M.Gabriella, • «Stress-inducible responses and heat shock proteins: New pharmacologic targets for cytoprotection», Natu• re Biotechnology, n.° 16, 1998, págs. 833-838. 79 NlCHOLSON, Donald W., y THORNBERRY, Nancy A., «Caspases: Killer Proteases», 7785, n.° 22, 1997, págs. 299-307. PlERPOINT, W. S., «The Natural History of Salicylic Acid: Plant Product and Mammalian Medicine», Interdisciplinary Science Reviews, n.° 22, 1997, págs. 45-52. SERVICE, R. E, «Closing In on a Stomach-Sparing Aspirin Substitute», Science, n.° 273, 1996, pág. 1660. ' TANG, D. G., et al., «Arachidonate Lipoxygenases as Essential Regulators of Cell Survival and Apoptosis», Proc. Nati Acad. ScL, n.° 93, 1996, págs. 5241-5246. WALLACH, David, «Placing Death under Control», Nature, n.° 388, 1997, págs. 123-125. YAFFE, M. B., y CANTLEY, L. C , «Grabbing Phosphoproteins», Nature, n.° 402, 1999, págs. 30-31.