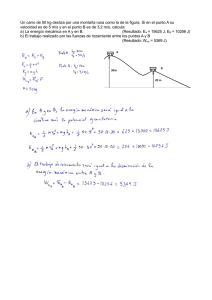
5. Calorimetría v2. - IES San Juan Bautista
Anuncio

¿Qué tengo que conocer de Física en 4º E.S.O.? Diego E. Pérez-Olea / Dpto. Física y Química. I.E.S. San Juan Bautista Quinta entrega de actividades para el refuerzo y recuperación de Física y Química de 4º ESO. Para tener constancia del conocimiento de las familias de esta actividad adicional, agradeceríamos devolvieran firmada esta hoja con los problemas resueltos que, una vez supervisados por el departamento, será devuelto al alumno para su uso posterior. Firma del padre/madre Fecha Nombre del alumno/a Grupo Tema 5 Calor: El calor es una forma de energía que se produce por la variación de la temperatura en los cuerpos. La temperatura es la variable que influye en el calor. Esta energía se produce, por ejemplo, en el rozamiento de los cuerpos. Decíamos que si había rozamiento no se conserva la energía. Pues bien, en realidad si se conserva, lo único que se transforma en energía calorífica. Si pudiéramos medir la variación de temperatura por el rozamiento y lo incluyéramos en nuestros cálculos, los planteamientos de conservación de energía serían igual de válidos. En este tema vamos a tratar dos tipos de calor. Uno es el que se produce o consume por la variación de temperatura de un cuerpo, que depende de una propiedad intrínseca del cuerpo, de la cantidad de materia que queramos modificar su temperatura y de cuanto es esa variación. El otro es el que se produce o consume por el cambio de estado del material, en la transición líquido-gas, o líquido-sólido, o sólido-gas o sus inversos. Calor: Es la energía asociada con la temperatura. Se calcula a partir de Q = m·C e ·∆T donde Ce es la capacidad específica del material, m es la masa de la materia e ∆T es la variación de temperatura. Calor Latente: Calor que se consume/aporta por el cambio de estado de las sustancias. Ese calor no depende de la variación de la temperatura. Se calcula como Q = m· L f = m· Lv según sea fusión o vaporización. Unidades: Calor: J (Julios), Temperatura: K (Kelvin o ºC con la relación T(K)=T(ºC)+273K ) Dilataciones: Cambio en el tamaño de los objetos debido a la temperatura. Puede ser lineal, superficial o cúbica según si las dimensiones del objeto son 1D, 2D o 3D. Se calcula como X = X 0 ·(1 + χ ·T ) donde X es la dimensión (lineal, superficial o volumen), X0 es la dimensión a temperatura 0ºC. Para calcular las variaciones de temperatura, por conservación de energía, igualamos el calor que cede un cuerpo con el que gana el otro. Y si hay cambios de estado, debemos incluir el coste en calor que se invierte para cada cambio. A veces el calor se mide en calorías, la conversión se 1cal = 4,18 J; ó 1J = 0,24 cal. El calor específico del agua es 4180 J/kgºC=4,18J/gºC=1cal/gºC En el caso de los gases, se cumple que la relación entre volúmenes a diferentes temperaturas es constante (Ley de Gay-Lussac): V1 T1 = V2 T2 Ejercicios propuestos El alumno debe intentar resolver los ejercicios por sí solo, siendo capaz de entender el fundamento y la implicación física del proceso. 5.1 Calcula la energía que se necesita para aumentar 1litro de agua a 22ºC hasta una temperatura de 45ºC. Calor específico agua: 4180J/kgºC. Densidad 3 agua: 1000kg/m . 5.2 Para medir la capacidad calorífica de un material, se calienta 100gr de dicho material a una temperatura de 80ºC. Se introduce en un recipiente de agua con 1litro a 15ºC y se observa que la temperatura final asciende a 23ºC. Calcula la capacidad calorífica de dicho material. Calor específico agua: 3 4180J/kgºC. Densidad agua: 1000kg/m . 5.3 Se mezclan 5 litros de aceite a 90ºC con 2 litros de agua a 40ºC, calcula la temperatura final de la mezcla. Calor específico agua: 4180J/kgºC, del 3 3 aceite: 2000J/kgºC. Densidad agua: 1000kg/m . Densidad aceite: 920kg/m . 5.4 Para enfriar 500gr de refresco que está a 50ºC, se utilizan 4 cubitos de hielo de 25gr cada uno a -18ºC. Calcula la temperatura final del refresco. Calor 5 3 específico refresco: 4180J/kgºC, calor específico hielo: 2090J/kgºC, calor latente hielo: 3,35·10 J/Kg. Densidad agua: 1000kg/m . 5.5 ¿Cuánto calor hay que suministrar para evaporar un cuarto de litro de agua que se encuentra a 20ºC, a presión de 1atm.? Densidad agua: 1000kg/m . 6 Calor latente de vaporización agua: 2,2·10 J/kg. 5.6 Un freno de aluminio de 300gr, e inicialmente a temperatura de 25ºC, consigue frenar una bicicleta de 25kg que pasa de 30m/s a 10m/s en 20 segundos. Calcula la temperatura final del freno suponiendo que toda la energía se invierte en el rozamiento y que no sufre variación por enfriamiento por el aire durante esos 20 segundos. ¿por qué se ventilan los frenos? ¿Qué potencia se ha producido? Calor específico del aluminio: 910J/kgºC. 5.7 Se dispara una bala de plomo de 5gr contra un bloque, también de plomo, de 10kg de peso. La velocidad inicial de la bala se desconoce. La temperatura inicial del bloque de plomo son 15º. Si tras el impacto, la temperatura del bloque sube 0,25ºC, el bloque no se ha movido nada, calcula la velocidad inicial de la bala. ¿es real esa velocidad? (calor específico plomo: 128J/kgºC). 3 Las siguientes pistas o recomendaciones solo deben ser leídas cuando al intentar resolver el problema en varias ocasiones, no se ha conseguido su resolución. Si se ha consultado mucho estas pistas, indica que no se ha reforzado lo suficiente. Pistas/Recomendaciones 5.1 Aplicar la ecuación del calor teniendo cuidado con las unidades 5.2 Pasando todas las unidades a kg o m3, se calcula el calor que pierde el material en función del calor específico, el calor que necesita el agua para subir a esa temperatura, como el calor del material se invierte en calentar el agua, al igualar ambos valores, de despeja el valor pedido. 5.3 Es similar al anterior, el calor que pierde el aceite se invierte en calentar el agua, la temperatura final de equilibrio debe ser la misma para los dos líquidos. 5.4 De nuevo hay que tener en cuenta que el calor que cede uno lo gana el otro. Pero en este caso, hay que tener en cuenta que hay dos calores, el calor de la variación de temperatura y el calor de los cambios de estado. Hay que calcular el calor que coge el hielo al pasar de -18ºC a 0ºC, el calor en fundirse, y en subir a la temperatura final. Por otro lado, todo este calor se invierte en bajar la temperatura del refresco, de su temperatura inicial a la final desconocida. Igualando los calores se obtiene la temperatura final. 5.5 Hay que calcular el calor en pasar el agua a 100ºC y en evaporar esa cantidad de agua. 5.6 Al haber rozamiento, no habría conservación de energía, pero en este caso nos dicen que toda la energía se convierte en calor. Por tanto, la variación de energía (cinética) es la calorífica, y conocemos todos los datos menos la temperatura final. La potencia es la energía por unidad de tiempo. 5.7 Es similar al anterior. Todo el calor producido en el bloque proviene de la energía cinética de la bala. Las balas suelen tener una velocidad inicial de 400m/s