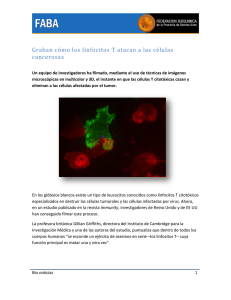
Canales iónicos involucrados en la activación de Linfocitos T
Anuncio

Universidad de Colima Facultad de Medicina Centro Universitario de Investigaciones Biomédicas Canales iónicos involucrados en la activación de Linfocitos T TESIS Que para obtener el grado de Maestra en Ciencias Fisiológicas PRESENTA QFB. Mariana Irigoyen Anguiano ASESOR Dr. Carlos G. Onetti Percello COASESOR Dr. Alejandro Elizalde Lozano. Colima, Colima Octubre 2007 Esta tesis se desarrollo en el laboratorio de “Biofísica de canales iónicos” del Centro Universitario de Investigaciones Biomédicas de la Universidad de Colima, bajo la dirección del Dr. Carlos G. Onetti Percello y el Dr. Alejandro M. Elizalde Lozano (coasesor) con el apoyo de CONACYT, beca número: 201495 2 Dedicatoria Dedico este trabajo a mi papi por su apoyo incondicional y por ser siempre mi fuerza para salir adelante ante toda adversidad, a mi madre (q.e.p.d ) la cual al pasar de los años cada vez me hace más falta y a Renato Galván Orozco por su amor . 3 Agradecimientos Al Dr. Carlos Onetti por su apoyo y confianza para poder realizar este trabajo en su laboratorio. Al Dr. Alejandro Elizalde por su ayuda en la revisión de este trabajo como coasesor. A la Dra. Gabriela Ramírez por su gran ayuda en la revisión de este trabajo. A la Q.F.B. Adriana Leal por su amistad y apoyo. Agradezco a la familia Galván Orozco por su apoyo incondicional. Agradezco a mi hermano familia en general. y mis niñas por su cariño y Agradezco a mi tía Alida Reyes por su gran cariño y a todas mis tías. A mi amiga Maribel Martínez Casas por su apoyo en momentos difíciles y momentos felices. A mi amiga Karla Susana Vera por su gran apoyo y su sincera amistad gracias nene!. 4 INDICE Índice Abreviaturas Índice de figuras Índice de Tablas Resumen Abstract 5 7 10 12 13 14 1. El sistema inmunológico 1.1 Tipos de Inmunidad 1.1.1 Inmunidad Innata 1.1.2 Inmunidad Adaptativa 1.1.2.1 Inmunidad Humoral 1.1.2.2 Inmunidad Celular 15 15 15 18 19 19 2. Respuesta Inmune 2.1 Reconocimiento del Antígeno 2.2 Presentación del Antígeno 21 21 25 3. Bases celulares del sistema inmunitario 3.1 Linfocitos T y B 3.2 Distinción entre linfocitos T y B mediante marcadores de superficie 3.3 Linfocitos T 3.3.1 Selección positiva 3.3.2 Selección negativa 26 4. Activación de los linfocitos T 4.1 Inducción 4.2 Expansión 33 33 40 5. Canales iónicos relacionados con linfocitos 42 5.1 Canales de potasio 5.1.1 Canal Kv1.3 5.1.2 Canales de K+ activados por calcio 5.1.3 Canales de potasio sensibles a ATP (KATP) 5.1.3.1 Estructura de los canales (KATP) 44 45 47 5.1.3.2 sulfonilurea Receptores 26 28 31 31 32 49 49 a 51 5 53 5.1.4 Canales mitocondriales de potasio sensibles a ATP (mitoKATP) 5.2 Canales CRAC 58 5.3 Canales de cloro (Cl-) 63 Conclusiones Perspectivas Referencias 66 67 68 6 Abreviaturas Ac. Anticuerpo. Ag. Antígeno. API-1. Proteína activadora 1. ChTx. Caribdotoxina. CPA.Célula presentadora de antígeno. CRAC. Canal activado por calcio liberador de calcio. CSF. Factores estimuladores de colonias. Em. Potencial de membrana. ICAM. Moléculas de adhesión intracelular. IFN. Interferón. Ig. Inmunoglobulina. IL. Interleucina. IKCa1. canal de potasio sensible a calcio de conductancia intermedia. IP3. Inositol trifosfato. IPC. Pre-condicionamiento isquémico. IP3R. Receptor específico a IP3. KATP Canales de potasio sensible a ATP. Kv1.3. Canal de potasio sensible a voltaje 1.3 KCOs. Abridores de canales de potasio. LAT. Acoplador para la activación de células T. LPS. Lipopolisacárido. MHC. Complejo mayor de histocompatibilidad. 7 MgTx. Margatoxina. mIg. Inmunoglobulina de membrana. mitoKATP. Canal mitocondrial de potasio sensible a ATP. NK. Célula citocida natural . NLS. Localización de secuencias nucleares. NFAT. Factor nuclear de células T activadas. NF-kb. Factor nuclear de la cadena Kappa en células B. NO. Óxido Nítrico. PAMPs. Patrones moleculares asociados a patógenos. PHA. Fitohemaglutinina. PLA. Fosfolipasa A. PLC. Fosfolipasa C. PKC. Proteína cinasa C. Po. Probabilidad de apertura del canal. PRRs. Receptores de reconocimiento de patrones. RVD. Regulación del decremento del volumen. RVI. Regulación del incremento del volumen. Tc. Linfocito T citotóxico. TCR. Receptor de antígeno de células T. TEA. Tetraetilamonio. Th. Linfocito T colaborador. TK. Tirosina cinasa. TLR. Receptores toll. 8 TNF. Factor de necrosis tumoral. VCAM-1. Molécula de adhesión vascular. 4(AP) 4-Aminopiridina. 5-HD. Hidroxidecanoato. 9 Índice de Figuras Figura 1. Inmunidad Innata e 20 Inmunidad Adaptativa Figura 2. Representación 22 esquemática de las moléculas MHC I y MHC II Figura 3. Estructura esquemática 23 del receptor para antígeno de los linfocitos Figura 4. Presentación del 25 antígeno Figura 5. Clases principales de 27 linfocitos T Figura 6. Moléculas accesorias 34 que participan en la sinapsis entre linfocito T y la molécula presentadora de antígeno Figura 7. Principales vías de 36 señalización en la activación de linfocitos T 37 Figura 8. Activación de c-Lck y Fyn 10 Figura 9. Dominios ITAMs de las 38 moléculas ζ del CD3 y como interviene la ZAP-70. Figura 10. Interacciones celulares 41 que participan en la activación y proliferación de los linfocitos. Figura 11. Relación hipotética 45 entre canales de K+ y proliferación celular Figura 12. Estructura octamérica 50 del canal de potasio sensible a ATP Figura 13. Estructura del canal 52 KATP Figura 14. Reguladores 55 fisiológicos de canales KATP mitocondriales Figura 15. Corrientes 57 representativas del canal mitoKATP Figura 16. Eventos de calcio en linfocitos T 59 Figura 17. Canales iónicos en linfocitos T 62 11 Índice de tablas Tabla 1. Células fagociticas y sus 17 localizaciones. Tabla 2. Inmunidad innata vs. 21 Inmunidad adaptativa Tabla 3. Clasificación de las 30 citosinas de acuerdo a su función Tabla 4. Canales iónicos 43 caracterizados en linfocitos Tabla 5. Isoformas del canal KATP 53 12 Resumen Los linfocitos T son células del sistema inmune que reconocen un objetivo no-propio como un patógeno, solo después de que los antígenos (pequeños fragmentos del patógeno) han sido procesados y presentados en combinación con un receptor propio, una molécula del llamado complejo mayor de histocompatibilidad. En los linfocitos T se han caracterizado diferentes tipos de canales iónicos. Estudios electrofisiológicos en estas células del sistema inmunológico han sugerido que los canales iónicos juegan un papel importante en la respuesta inmune, quizá por el inicio de una cascada bioquímica de eventos enzimáticamente controlados, por ejemplo, el canal CRAC el cual tiene un papel esencial durante el desarrollo y maduración de los linfocitos, con la activación de este canal viene la activación del canal Kv1.3, importante en la regulación del potencial de membrana así como de la proliferación celular, por su parte el canal IKCa1 responde a concentraciones elevadas de calcio en el linfocito hiperpolarizando la membrana del linfocito y podemos encontrar también al - canal de Cl responsable del volumen celular. Por otro lado se han caracterizado canales de potasio sensibles a ATP en mitoblastos de linfocitos T los cuales podrían estar implicados en la activación de dichas células relacionando el estado energético de la célula con el potencial de membrana. 13 Abstract Lymphocytes T are cells of the immune system that recognize an not-own objective like a pathogen,only after the antigens (small fragments of the pathogen) process and have been presented in combination with an own receiver, a molecule called Major Histocompatibility Complex. In lymphocytes T different types from ionic channels have been characterized. Electrophysiology studies in these cells of the immunological system have suggested play an important role in the immune response, perhaps by the beginning of a biochemical cascade of events enzymatically controlled, for example, CRAC channel which has an essential paper during the development and maturation of the lymphocytes, with the activation of this channel comes the activation from the Kv1.3 channel, important in the regulation of the membrane potential as well as of the cellular proliferation, on the other hand the IKCa1 channel responds to elevated calcium concentrations in the lymphocyte hyperpolarizing the membrane of the lymphocyte and we can also find to the channel of Cl- responsible for the cellular volume. On the other hand sensible potassium channels to ATP have been characterized in mitoplast of lymphocytes T which could be implied in the activation of these cells relating the power state of the cell to the membrane potential. 14 1. EL SISTEMA INMUNOLOGICO 1.1 Tipos de inmunidad El término inmunidad, se ha definido en el campo biológico protección contra enfermedades, y más específicamente como enfermedades infecciosas. El sistema inmunitario esta constituido por células y moléculas responsables de esta inmunidad, y su colectiva y coordinada respuesta al reconocimiento de sustancias extrañas incluyendo macromoléculas como proteínas y polisacaridos provocan la respuesta inmunitaria. Existen dos tipos de tipos de respuesta inmune: la inespecífica o innata y la específica o adaptativa (Abbas y cols., 1997). 1.1.1 Respuesta Inmune innata La inmunidad innata distingue aquellos agentes externos potencialmente patógenos (antígenos Ag) de aquellos que no lo son aún cuando nunca antes hubieran estado expuestos a ellos (Zambrano,1999), y constituye la primera línea de defensa del organismo, ya que se activa rápidamente. Este tipo de inmunidad esta presente en todos los individuos normales, sólo que varía de uno a otro según sus condiciones fisiológicas; actúa de manera inespecífica porque no distingue entre microorganismos de especies diferentes y su intensidad de respuesta no se altera con exposiciones repetidas al antígeno. Entre los mecanismos innatos de defensa participan las barreras naturales físicas como la piel y la mucosa, los cilios en el epitelio de las vías respiratorias o bien secreciones como el ácido del estómago o de las glándulas 15 sebáceas. Además de estas barreras físicas de defensa también participan una serie de mecanismos celulares y humorales mediados por la activación del complemento, citosinas, el sistema fagocitario (neutrófilos, macrófagos) y de células asesinas naturales o NK (del ingles natural killers) (Zambrano, 1999; Pterov, 1982) y dependiendo de su secuencia de actuación podremos agruparlos en: • Actuación rápida (entre los 4 minutos y las 4 horas) mediada por: activación del complemento por la vía alternativa y activación de los macrófagos. • Actuación media y lenta (entre las 4 horas y los 4 días) mediada por: La inflamación, la activación de las células NK (asesinas naturales) y la producción y liberación de interferón. Los determinantes principales de éste tipo de inmunidad están bajo control genético y el grado de protección, es por tanto, hereditario; pero se modifica en el transcurso de la vida por factores como edad, sexo, alimentación y estado físico del individuo ( Weir, 2004; Zambrano, 1999). La capacidad de la inmunidad innata para reconocer agentes patógenos que entran al organismo se basa en una serie de patrones de reconocimiento a receptores (PRRs), que reconocen patrones moleculares conservados en diferentes grupos de patógenos microbianos (PAMPs). La unión de estos receptores con sus ligandos induce la activación de diferentes mecanismos dirigidos a la eliminación de los patógenos. Por ejemplo algunos receptores solubles, como la proteína C reactiva, estimulan la vía del complemento (Abbas, 1997; Hernandez-Urzua y Alvarado-Navarro, 2001), el cual es un grupo complejo de proteínas séricas, que existen en concentración baja en el suero normal, activado también por reacciones antigeno-anticuerpo y que es esencial para la hemólisis inmune y la bacteriólisis mediada por anticuerpos (Ac), juega un papel importante en otras reacciones biológicas como la opsonización, quimiotaxis y 16 citólisis inmune; existen dos vías para su activación, la alterna y la clásica, que llevan a las mismas consecuencias fisiológicas (opsonización, activación celular y lisis) pero usan diferentes procesos de iniciación (Petrov 1982; Weir 2004, Bier y col., 1981) Otros receptores de membrana, como los receptores depuradores (o el receptor de manosa, induce la fagocitosis o endocitosis de los microorganismos por parte de macrófagos, neutrófilos y células dendríticas. (Abbas, 1997; Hernandez-Urzua y Alvarado-Navarro, 2001 ) Existen tres tipos principales de células fagocíticas: 1) los neutrófilos; 2) las células del sistema fagocítico mononuclear, incluyendo los monocitos de la sangre y los macrófagos (que proceden de los monocitos) de los tejidos conjuntivos; y 3) los fagocitos específicos de órganos como hígado, bazo, ganglios linfáticos, pulmones y cerebro (Tabla 1). Tabla 1. Células Fagocíticas y sus localizaciones Fagocitos Localización Neutrófilos Sangre y todos los tejidos Monolitos Sangre Macrófagos (histiocitos) Todos los tejidos (incluyendo bazo, ganglios linfáticos, médula ósea) Células de Kupffer Hígado Macrófagos alveolares Pulmones Microglia Sistema nervioso central Otra característica que puede observarse en este tipo de inmunidad es que los mecanismos innatos de defensa pueden distinguir entre los hidratos de carbono producidos por las células de los mamíferos y los producidos por bacterias. Los hidratos de carbono bacterianos que “marcan” la célula para su 17 ataque fagocítico forman parte de las glucoproteínas y los lipopolisacáridos de la pared bacteriana. También algunos PRRs como los TLRs (receptores Toll) promueven la producción de proteínas que ayudan a la eliminación de los microorganismos por ejemplo la lisozima, fosfolipasa A (PLA), defensinas, proteínas de complemento, lactoferina, óxido nítrico (NO) sintasa, mieloperoxidasa; y la producción de citosinas que inducen la reacción inflamatoria local, caracterizada por la atracción y activación de otros leucocitos. (Abbas, 1997; Hernandez-Urzua y Alvarado-Navarro, 2001 ) En resumen la inmunidad innata, representa la respuesta inicial contra numerosos microorganismos patógenos, y en muchos casos es suficiente para eliminar el patógeno. No obstante, la inmunidad innata esta estrechamente relacionada con la inmunidad adaptativa. 1.1.2 Respuesta inmune adaptativa La inmunidad adaptativa (también denominada inmunidad adquirida o específica), es un mecanismo de respuesta más evolucionado, que es estimulado de forma específica tras la exposición a un determinado agente extraño. Aunque la activación completa de estos mecanismos requiere varios días, se adquiere mayor especificidad e intensidad de la respuesta alcanzada, así como capacidad de memoria (Tabla 2). De esta manera, la respuesta de estos mecanismos ante exposiciones repetidas al mismo patógeno, es mucho más efectiva que la respuesta innata sin embargo, la activación de la respuesta adaptativa depende de la activación previa de la respuesta innata, puesto que es esta última la que tiene la capacidad de distinguir aquellos agentes con potencial patógeno (Abbas y col., 1997 ; Puertas 2006). 18 Las respuestas de la inmunidad específica están clasificadas en dos tipos, basados en los componentes del sistema inmune que median esta respuesta: la inmunidad humoral y la inmunidad celular. 1.1.2.1 Inmunidad Humoral La Inmunidad Humoral es mediada por moléculas en la sangre que son responsables del reconocimiento específico y eliminación de antígenos; llamados anticuerpos como son las inmunoglobulinas (Igs) producidas por los linfocitos B (Fig. 1). Los linfocitos B se renuevan periódicamente, pero siempre permanecen células de memoria que permiten repetir una respuesta inmune al producirse un nuevo contacto con el antígeno específico. La zona del antígeno reconocida por los anticuerpos es el epítope o determinante antigénico. Cuando los anticuerpos se unen específicamente al antígeno, pueden tener un efecto neutralizante directo. Además, la unión del anticuerpo a la superficie de los agentes infecciosos se puede favorecer en función del isotipo de la inmunoglobulina en cuestión (IgM, IgG1, IgG2, IgG3, IgG4, IgA1, IgA2, IgE, en humanos), la lisis mediada por el complemento, mecanismos de fagocitosis y (o) la liberación de mediadores inflamatorios (Abbas y col., 1997; Jeneway y col., 1999; Penninger y Crabtree., 1999; Puertas 2006). 1.1.2.2 Inmunidad Celular La Inmunidad celular es mediada por células llamadas linfocitos T y este tipo de inmunidad esta especialmente orientada a la eliminación de aquellos microorganismos que residen y proliferan en el interior de las células del huésped por lo que no son accesibles a los anticuerpos circulantes. Los linfocitos T citotóxicos, mayoritariamente CD8+, tienen función citolítica sobre las 19 células infectadas. Por su parte, los linfocitos T CD4+ colaboradores, están especializados en la producción de citosinas que coordinan el desarrollo de la respuesta inmunitaria entre una de sus funciones esta la de estimular a los linfocitos B para producir anticuerpos. Según el patrón de citosinas producido por estos linfocitos se favorece la activación de una respuesta de tipo celular, también denominada Th1 y Th2 (Fig. 1) (Abas y col., 1997). Figura 1. Inmunidad Innata e Inmunidad Adaptativa. En la figura se muestra la activación de la inmunidad innata por la presencia del antígeno. En la inmunidad adaptativa se puede presentar una respuesta humoral la cual esta dada por la liberación te anticuerpos de los linfocitos B gracias al estimulo de los linfocitos colaboradores 2 por la liberación de diferentes citosinas, por otro lado la inmunidad celular esta dada por la estimulación de linfocitos T colaboradores tipo 1. 20 En la siguiente tabla 2 se presenta una comparación de características de la inmunidad innata y la inmunidad adaptativa. Tabla 2. Inmunidad natural vs. Inmunidad adaptativa Característica Reconoce Inmunidad natural antígenos Inmunidad adaptativa No Si Si No Desarrolla memoria No Si Mediada por receptores Si Si Si Si concretos Reconoce “patrones” de patógenos Participan citosinas y otros mediadores 2. RESPUESTA INMUNE 2.1 Reconocimiento del antígeno Para que se inicie la respuesta inmune específica, se requiere el reconocimiento del antígeno por parte de los linfocitos y la subsiguiente activación de los mismos. Los linfocitos B reconocen el antígeno mediante inmunoglobulinas de membrana (mIg) las cuales puede reconocer a estos antígenos en su conformación nativa, mientras que los linfocitos T lo reconocen mediante el 21 receptor de linfocitos T (TCR) (Fig.3) el cual sólo puede reconocer fragmentos peptídicos derivados del antígeno que este unido a moléculas del MHC a lo cual se le conoce como “ fenómeno de restricción del MHC” (García y col., 1998). Para ello, los antígenos procedentes de agentes externos son internalizados, procesados y presentados por células especializadas que se denominan células presentadoras de antígeno (CPA) (Abbas y col., 1997; Jeneway y col., 1999; Penninger y Crabtree., 1999; Reinherz y col., 1999). Las moléculas del Complejo Mayor de Histocompatibilidad mencionadas anteriormente son glicoproteínas presentes en las membranas de la mayoría de las células nucleadas, entre las que se encuentran las células inmunocompetentes. Estas moléculas son esencialmente de dos tipos, tipo I y tipo II y tienen entre otras funciones la de presentar el antígeno a los linfocitos así como participar en el proceso de maduración de los linfocitos T en el timo (Fig. 2). Figura 2. Representación esquemática de las moléculas MHC I y MHC II. Se muestran lo lugares de presentación del Ag y el lugar de anclaje en la membrana celular así como el tipo de cadenas en cada clase. 22 Las moléculas de este complejo son altamente polimórficas y presentan más de cuarenta alelos comunes para cada gen individual. Estas proteínas, identificadas como antígenos, distinguen a los miembros de una misma especie. Tanto las moléculas de clase I como las de clase II fueron reconocidas originalmente por su capacidad de inducir respuesta por parte de los linfocitos T, originándose así el rechazo de tejidos transplantados (Abbas y col., 1997; Matheux, 2004; Reinherz y col., 1999). El reconocimiento antigénico por los linfocitos T mediante el receptor TCR es muy importante para la generación y regulación de una respuesta inmunitaria eficaz por lo cual es una pieza clave dentro de este proceso. (Lanzavecchia y col., 1999; Chang y col.,1997). (Fig. 3) Figura 3 Estructura esquemática del receptor para antígeno de los linfocitos T. constituido por una glucoproteína heterodimérica unida por puentes disulfuro (αβ ó δγ) el cual se encuentra estrechamente ligado con CD3 que es un complejo polipeptídico. (Tomado de Peña Imunologyonline) El TCR está constituido por una glucoproteína heterodimérica unida por puentes disulfuro (αβ ó γδ), lo cual se define durante su diferenciación. En las etapas tempranas de la ontogenia, hay un predominio de linfocitos γδ; a partir del nacimiento, más del 90% de los timocitos expresan receptores αβ. Estos dos linajes muestran además una distribución diferencial en el organismo, y llevan acabo funciones diferentes. Más del 95% de los linfocitos T periféricos y de la mayoría de los timocitos que expresan TCR corresponden al tipo αβ. Por el contrario, los linfocitos γδ son abundantes en diversos epitelios, como la epidermis (en 23 ratones), el epitelio intestinal, el útero y la lengua, aunque la función para los linfocitos γδ no está muy bien establecida. El TCR, a su vez, se encuentra en estrecha asociación en la superficie celular con un complejo polipeptídico conocido como CD3 (Rud,1999). Esta asociación es necesaria para una correcta expresión en la superficie celular del TCR. Los componentes de CD3 no muestran variabilidad de aminoácidos en diferentes células T, por lo que no contribuyen a la diversidad genética del receptor. La función mejor conocida para este complejo de proteínas es la transducción de señales generadas por la activación celular como resultado del reconocimiento del antígeno por el heterodímero del receptor. El complejo polipeptídico CD3 comprende al menos cinco cadenas polipeptídicas, llamadas γ, δ, ε, ζ, ψ, η (Bronstein-Sitton, 2006; Chang y col., 1997). Las cadenas α, β, γ y δ de los receptores antigénicos presentan una región constante, común para cada una de ellas, y una región variable propia de cada uno de los distintos clones de linfocitos T y diferentes a todas las demás. La presencia de esta región variable es lo que le confiere su carácter polimórfico al receptor. Las cuatro cadenas provienen de la reordenación de genes constituidos a su vez por la unión de un elemento procedente de cada una de las diferentes regiones del gen, denominadas V (variable), D (diverso), J (unión) y C (constante). Este proceso se cumple para las cadenas β, γ y δ. La cadena α está constituida solo por elementos de las regiones V, J y C. los dominios extracelulares tipo inmunoglobulinas de estas cadenas, junto con los de las cadenas γ, δ, ε del CD3, probablemente forman asociaciones; se propone que al menos los dos dominios V (variables) de los receptores de ambos tipos se asocian de manera similar a como lo hacen los dominios VH/VL de las moléculas de inmunoglobulinas. (Bronstein-Sitton, 2006; Gascoigne y col., 1987 Chang y col., 1997). 24 2.2 Presentación del antígeno Para que los linfocitos T, tal como se ha dicho anteriormente puedan reconocer al Ag, éste debe ser debidamente presentado por las células CPA (Janeway y cols, 1999). Los péptidos resultantes después del procesamiento intracelular del Ag son presentados en la superficie de las células, unidos a moléculas del MHC de clase II (linfocitos T CD4+) ó clase I (linfocitos T CD8+) y estos péptidos podrán interactuar con el TCR de linfocitos T (Fig.1). Las moléculas del MHC de clase I, presentes en la mayoría de las células de un organismo, presentan péptidos derivados de proteínas endógenas; mediante este mecanismo, los linfocitos T citotóxicos pueden unirse a péptidos originados por un microorganismo patógeno intracelular (Armstrong y col., 1997 ;Modino y col., 1996) (Fig.4). Figura 4. Presentación del antígeno. El antígeno es reconocido por los linfocitos B pero los linfocitos T requieren que este sea presentado por moléculas de histocompatibilidad. 25 3. BASE CELULAR DEL SISTEMA INMUNOLÓGICO 3.1 Linfocitos B: respuesta de anticuerpos humorales; Linfocitos T: respuesta inmunitaria mediada por células. Durante la década de 1960 se descubrió que dos clases de respuesta inmune estaban mediadas por diferentes clases de linfocitos: las células T, que se desarrollan en el timo, y que son responsables de la inmunidad mediada por célula; y las células B, que en los mamíferos se desarrollan a partir de la médula ósea en el adulto o en el hígado fetal, y que producen anticuerpos. Existen dos clase principales de linfocitos T: los linfocitos T colaboradores (Th, del inglés helper) y los linfocitos T citotóxicos (Tc) (Fig 5). Los linfocitos colaboradores aumentan la respuesta de otras células inmunitarias, como los linfocitos B que producen los anticuerpos. Por su parte, los linfocito T citotóxicos se encargan de destruir células infectadas, y debido a que, a diferencia de la células Th, participan directamente en la defensa contra infecciones, las Tc reciben el nombre de células efectoras. Las células Th caen dentro de dos categorías generales, Th1 y Th2, definidas por el tipo de citosinas que secretan (Abbas y cols, 1997; Farrar y cols, 2002). Las citosinas particulares producidas durante una respuesta inmune determina otras células inmunes reclutadas. Aunque existen excepciones, la separación de las funciones de los linfocitos Th y Tc viene dada por el origen de los antígenos que reconocen. 26 Figura 5. Clases principales de linfocitos T. El antígeno (péptido) es presentado por moléculas de histocompatibilidad clase I a las células Tc mientras que las moléculas clase II lo hacen a los Th. Los Tc, mayoritariamente CD8+, tienen función citolítica sobre las células infectadas. Por su parte, los linfocitos T CD4+ colaboradores, están especializados en la producción de citosinas que coordinan el desarrollo de la respuesta inmune. Según el patrón de citosinas producido por estos linfocitos se favorece la activación de una respuesta de tipo celular, también denominada Th1 (IL-2, IL-12, IFNδ, TNFBβ) tienden a promover la respuesta citotóxica y activación de macrofagos, o de tipo humoral Th2 (IL-4, IL-5, IL-10, IL-13). (Bergman 2001; Fanger y col., 2000; Hernández-Ruiz y col., 2006). 27 3.2 Distinción entre linfocitos T y linfocitos B mediante marcadores de superficie Los linfocitos T y B se pueden distinguir morfológicamente sólo después de su activación por el antígeno. Las células T y B no estimuladas (en “reposo”) tienen un aspecto muy similar, incluso al microscopio electrónico; ambas son pequeñas, la mayor parte de la célula corresponde al núcleo y tienen que ser activadas por el antígeno para poder proliferar y avanzar en la maduración. Los linfocitos B activados se convierten en células productoras de anticuerpos, en cuyo estado maduro, se conocen como células plasmáticas, que poseen un abundante retículo endoplásmico rugoso. Las células T activadas contienen muy poco retículo endoplásmico y no secretan anticuerpos, aunque sí diversos mediadores denominados linfocinas, interleucinas y citosinas. (Abbas y col.,1997; Zambrano, 199). Las interleucinas son proteínas solubles de bajo peso molecular mediadoras de crecimiento celular, inflamación, inmunidad, diferenciación y reparación, entre otras actividades. (Hernandez-Urzua y Alvarado-Navarro, 2001). Las citosinas constituyen un grupo grande de moléculas que participan en la señalización entre las células durante las respuestas inmunitarias. Por lo general son proteínas pequeñas solubles y, en algunos casos, glucoproteínas, producidas por una célula que pueden afectar el comportamiento y las propiedades de otras células. Son producidas por diferentes tipos celulares, no sólo por las células inmunitarias, y por lo general regulan las fases efectoras de la respuesta inmunitaria tanto natural como especifica. En la inmunidad natural las citosinas efectoras son producidas principalmente por los fagotitos mononucleares y por ello reciben el nombre de monocinas. Las monocinas pueden ser producidas directamente como respuesta a un estímulo microbiano, 28 o bien en respuesta a los linfocitos T estimulados por Ag, como parte de una respuesta específica. (Abbas y col.,1997; Zambrano, 199; Petrov, 1982). También desempeñan un papel importante como coestimuladoras de la activación de linfocitos, proporcionando mecanismos de amplificación para las respuestas inmunitarias especificas. La mayoría de las citosinas presentes durante una respuesta inmunitaria específica son producidas por los linfocitos T activados, y tales citosinas han sido denominadas linfocinas (Carosi, 1990; Chung, 2001). En general, las citosinas provenientes de los linfocitos T son las moléculas efectoras de la inmunidad mediada por células y son también responsables de la comunicación entre células del sistema inmunitario e inflamatorio. Los linfocitos T producen diversas citosinas que regulan la activación, el crecimiento y la diferenciación de diferentes poblaciones de linfocitos, también tiene otras funciones como activadoras y reguladoras de células inflamatorias, tales como los fagocitos mononucleares, los neutrófilos y los eosinofilos. (Abbas y col., 1997) Existen también otro grupo de citosinas producidas tanto por linfocitos como por fagocitos mononucleares, llamadas de forma genérica factores estimuladores de colonias, CSF, las cuales estimulan el crecimiento y la diferenciación de los leucocitos inmaduros de la médula ósea. Las citosinas poseen la capacidad de influir tanto en la síntesis de otras citosinas como en la acción de estas (Granger, 2004; Chung 2001). Al igual que otras hormonas polipeptídicas, las citosinas inician su acción al unirse a receptores específicos presentes en la superficie de las células diana, y la expresión de muchos de estos receptores esta regulada por señales específicas. En general, la mayoría de las respuesta celulares a las citocinas ocurren en un período de horas y requieren de la síntesis de novo de ARNm y de proteínas. Finalmente, para muchas células diana, las citosinas actúan como reguladoras de la división celular, esto es, como factores de crecimiento.(Abbas 1999; Weir, 29 2004). Una forma de clasificar las citosinas es sobre la base de sus funciones, como se muestra en la (tabla 3). (Chung, 2001) Tabla 3 . Clasificación de las citosinas de acuerdo a su función. Función Citosina Mediadores de la inmunidad natural IFN-α ó β (Tipo I), TNF-α, IL-1, IL-6, Quimiocinas (IL-8, MCP-1, MIP-1α y 1β) Reguladores de la activación, IL-2, IL-4 y TGF-β crecimiento y diferenciación de los linfocitos. Activadores de las células IFN-γ, LT, IL-10, IL-5, IL-12, MIF inflamatorias. Estimuladores del crecimiento y CSFs, IL-3, ligando para c-kit, SCF, diferenciación de leucocitos inmaduros. GM-CSF Aunque morfológicamente los linfocitos T y los linfocitos B son muy similares, existen muchas diferencias en sus proteínas de membrana plasmática, que se pueden considerar como marcadores de superficie; como ejemplos de marcadores se puede citar CD3, específicos de las células T, o los marcadores CD4 y CD8, específicos de subpoblaciones de linfocitos T (Janeway y col., 1999). 30 3.3 Linfocitos T Los linfocitos T derivan de células pluripotenciales de la médula ósea y sufren la reorganización de sus genes en un microambiente especializado, para producir moléculas receptoras únicas en cada célula. Están células migran desde etapas muy tempranas hacia el timo (el nombre de linfocitos T se refiere a que derivan del timo), donde se lleva a cabo su maduración, pasando por una serie de estadíos o fases que se distinguen por la expresión de diferentes moléculas de superficie como son CD44 y CD25, el complejo CD3:TCR (Glimcher y Singh., 1999) y las proteínas correceptoras CD4 y CD8 (Modino y cols, 1996). Por lo tanto solo aquellas células que reconocen las moléculas del MHC propias de su organismo serán capaces de contribuir al desarrollo de la respuesta inmunitaria adaptativa. De igual forma, algunas células T deberán reconocer péptidos propios también unidos a moléculas de MHC para convertirse en autotolerantes. Para cumplir este doble requisito, los linfocitos T sufren dos procesos de selección, un proceso de selección positiva en el cual son seleccionados de acuerdo con la restricción por las moléculas del MHC, y un proceso de selección negativa, durante el cual se eliminan las células especificas contra péptidos propios unidos a moléculas propias del MHC (Modino y col., 1996). 3.3.1 Selección positiva En el timo, además de la maduración de linfocitos T también tiene lugar un proceso de selección de timocitos (linfocitos inmaduros), previo a la liberación de éstos al torrente circulatorio. Las células epiteliales de la corteza tímica presentan péptidos derivados de autoantígenos en el contexto de moléculas MHC entonces durante su paso por la corteza tímica, aquellos timocitos cuyo 31 TCR no es capaz de interaccionar adecuadamente con las moléculas de MHC vuelven a reordenar su TCR o son delecionados directamente. Mediante este proceso de selección positiva, solo aquellos timocitos que se pueden unir adecuadamente a las moléculas de MHC sigue su proceso de maduración en la medula tímica (Modino y col., 1996; Kisielow y col., 1995; Singer y col., 1990). 3.3.2 Selección negativa En la médula, las células epiteliales medulares tímicas y las células dendríticas son las responsables de la presentación de autoantígenos a los timocitos, en presencia de moléculas coestimuladoras (CD80 y CD86). En esta fase, los timocitos son muy sensibles a la apoptosis por hiperactivación, de manera que aquellos que reconocen autoantígenos son eliminados “in situ” (selección negativa) (Palmer, 2003). Además cabe destacar que las células epiteliales medulares tímicas son capaces de expresar, de manera ectópica, autoantígenos que normalmente sólo se expresan en ciertos tejidos periféricos. Tras estos procesos de selección positiva y negativa, sólo maduran y salen del timo aquellos linfocitos que pueden interactuar con moléculas de MHC pero no reconocen autoantígenos (Liston y col., 2007). De lo anterior podemos observar que el desarrollo de los linfocitos T se acompaña de acontecimiento de muerte celular, reflejo del intenso procesos de selección de los linfocitos T y de la eliminación de clones con especificidades por péptidos propios. 32 4. ACTIVACIÓN DE LOS LINFOCITOS T La activación de los linfocitos T puede provocar una variedad de respuestas incluyendo proliferación, migración y aún apoptosis (Bronstein-Sitton, 2006) y la intervención de los canales iónicos en la activación de dichas células ha sido sugerida por los reportes de despolarización de la membrana, hiperpolarización, incremento en el flujo iónico a través de la membrana y un incremento intracelular de calcio después de una estimulación mitogénica (Chandy et al., 1984). La “decisión” de las células T de ser activadas o no es crucial: una respuesta inapropiada o exagerada podría provocar enfermedades autoinmunes mientras que una falla en la respuesta provocaría infección o incluso muerte (Bronstein-Sitton, 2006). Por lo general, la respuesta de anticuerpos y las reacciones de inmunidad celular están dirigidas hacia determinantes antigénicos diferentes. Esto se debe a que los antígenos no son presentados por las moléculas del MHC de forma intacta, sino que, como se explica con anterioridad, requieren ser procesados y presentados en la superficie celular. Una diferencia importante en este mecanismo de procesamiento y presentación radica en que del origen del antígeno depende el tipo de respuesta. 4.1 Inducción Una vez que el complejo TCR/CD3 reconoce el epitope antigénico en unión con las moléculas del MHC, las moléculas involucradas sufren cambios bioquímicos importantes (Lanzavecchia y cols, 1999; Penninger y Crabtree., 1999). Sin embargo, dicho reconocimiento no es suficiente para lograr la activación total de linfocitos que conduce a la generación de respuestas biológicas, ya que para iniciar una respuesta inmunitaria se requieren señales 33 coestimuladoras (CD4, CD8, CD2, CD45, y CD28 y sus ligandos respectivos) (Fig. 6), (Janeway y col., 1999). Por el contrario, la ausencia de estas señales tras el reconocimiento del antígeno conduce a la inactivación de los linfocitos T. Figura 6. Moléculas accesorias que participan en la sinapsis entre linfocitos T y la molécula presentadora de antígeno. Dentro de las principales moléculas accesorias que contribuyen a proporcionar las señales coestimuladoras se encuentran, en el caso de los linfocitos T, algunas moléculas de adhesión, correspondientes a la familia de las integrinas, tales como LFA-1 y VLA-4, las cuales unen a ICAM (moléculas de adhesión intracelular) y VCAM-1 (del ingles Vascular cell adhesión molecule) respectivamente sobre la superficie de las CPA (Dustin y col., 1991); miembros de la superfamilia de las inmunoglobulinas como la molécula CD28 la cual se expresa en todos los linfocitos CD4 y aproximadamente en el 50% de los linfocitos CD8. Los ligandos naturales de la molécula CD28 pertenecen a la familia B7, ésta molécula es muy importante porque además de su papel en el proceso de adhesión también participa en el mecanismo de transducción de 34 señales y activación de la célula T. Las moléculas CD2, son moléculas de adhesión que contribuyen a potenciar la afinidad de unión del linfocito T con la CPA, sus ligandos naturales son CD58 (LFA-3) y CD45 (ICAM-1). La tirosina fosfatasa CD45 de los linfocitos T, también ha sido relacionada con la generación de las señales coestimuladoras. La unión de todas estas moléculas trae como consecuencia una serie de acontecimientos a nivel intracelular llamados de manera colectiva activación de los linfocitos T. Estos cambios se inician con la generación de segundos mensajeros, los cuales finalmente desencadenan un complejo proceso de señalización que se traduce desde la membrana plasmática hasta el núcleo, dando lugar a las principales respuestas biológicas que son: 1) acontecimientos tempranos de transducción de señales; 2) activación transcripcional de algunos genes; 3) expresión de nuevas moléculas de superficie; 4) secreción de citoquinas efectoras y/o desarrollo de funciones citolíticas; 5) inducción de actividad mitogénica (Fig. 7) (Bronstein-Sitton, 2006; Dustin y col., 2000; LLoyd y col., 1987). 35 Figura 7. Principales vías de señalización en la activación de linfocitos T. Se aprecia el reconocimiento del epitópe por el TCR lo cual trae como consecuencia una serie de acontecimientos intracelulares Como la activación transcripcional de algunos genes, acontecimientos tempranos de transducción de señales y expresión de nuevas moléculas de superficie así como la activación de algunos canales iónicos. (BronsteinSitton, 2001). Un acontecimiento intracelular después del reconocimiento de complejo TCR/CD3, es el incremento en la fosforilación de las cadenas no polimórficas de la molécula CD3. Estas cadenas tienen dominios intracitoplasmáticos regiones llamadas ITAM (del ingles Immunoreceptor Tyrosine-based activation Motifs) que se fosforilan por la acción de tirosinas cinass como c-Lck o c-fyn (Fig.8) (Aguado y col, 2006; Lovatt y col, 2006; Sugie y col, 2004). 36 Figura 8. Activación de c-Lck y Fyn. Tras el reconocimiento del TCR de la molécula de antígenos leucocitarios, HLA (del inglés Human Leukocyte Antigen) y péptidos, se produce la activación de la tirosina cinasas c-Lck y Fyn que fosforilan las cadenas ζ del CD3. La tirosina cinasa c-Lck está localizada en la parte intracelular de la membrana plasmática unida a la bicapa lipídica y la asociación física y funcional de CD4 y CD8 con el complejo TCR/CD3 provoca que la c-Lck asociada a éstas moléculas se aproxime a la porción citoplasmática de las proteínas del complejo CD3 donde puede fosforilar en tirosinas a sus regiones ITAM (Racioppi y cols, 1996; Dustin y Chan 2000; Sugie y cols, 2004), una vez fosforiladas se convierten en sitios específicos de acoplamiento para la unión de proteínas citoplasmáticas como la ZAP-70 (Fig. 8 y 9), ésta proteína es muy importante ya que funciona como acoplador de señales desde la superficie celular hasta el núcleo por fosforilación de adaptadores como Lat (acoplador para células T) y una de las consecuencias de su mal funcionamiento o de su ausencia es una falla en la función de los microtubulos del citoesqueleto por lo que la transmisión de señales se vería afectada (Goda y cols, 2004; Blanchard 2002; Dustin y Chan, 2000; Myung y cols, 2000). Los adaptadores para células T como por ejemplo el adaptador Lat, son proteínas transmembrana con 4 residuos tirosina 37 requeridos para su activación (Y132, Y171, Y191 y Y226) cuya función una vez fosforilados es organizar complejos multimoleculares en determinados subdominios lipídicos de la membrana plasmática (Aguado y cols, 2006), estos complejos contienen proteínas claves en la señalización interior de la célula como la PLC-γ (Fosfolipasa C- gamma) (Faccetti y col, 1999; Sommers y col., 2002). Figura 9. Dominios ITAM de las moléculas ζ del CD3 y como interviene la ZAP70. La PLC-γ se fosforila en tirosina y se activa dentro de los complejos multimoleculares lipídicos de la membrana donde se induce la hidrólisis de su substrato específico, el fosfotidilinositol bifosfato (PIP2) generando los metabolitos inositol trifosfato (IP3) y diacilglicerol (DGA) (Bronstein- Sitton, 2001; Granja y col., 1991). El metabolito inositol trifosfato IP3 se une a un receptor específico (IP3R) localizado en unas estructuras específicas localizada en el retículo endoplásmico facilitando la liberación del calcio intracelular. La depleción de las cisternas internas de calcio activa a los canales CRAC y el flujo de Ca+2 del espacio 38 extracelular a través de estos canales resulta en una despolarización de la célula. Como se ha comentado anteriormente, la activación fisiológica de receptores extracelulares, TCR, originan un incremento de Ca+2 intracelular esto conduce a la activación de la fosfatasa calcineurina (dependiente de Ca+2 y calmodulina) que desfosforila al factor nuclear de células T activadas (NFAT), altamente fosforilado en células T en reposo. (Wu y col, 2003) La translocación al núcleo, el aumento de afinidad para unirse al ADN y la inducción de la actividad transcripcional de NFAT están regulados por esta desfosforilación que promueve cambio conformacionales en el factor que permiten la exposición de sus secuencias de localización nuclear (NLS), y a la entrada del factor al núcleo. Esta entrada la realiza NFAT acomplejado con la calcineurina, que mantiene el factor desfosforilado en el núcleo lo que permite la transcripción de múltiples genes dependientes de NFAT como los que codifican para citosinas (IL2, IL4, TNF-α, GM.CSF) y receptores de superficie (FasL, CD40L) todo esto mientras se mantiene las señales de calcio. Cuando el calcio intracelular desciende, la calcineurina se desactiva y varias cinasas fosforilan al factor, provocando su exportación al citosol. (Quesada y Redondo, 2003: Wu y col., 2003). Por otro lado, la proteína cinasa C (PKC) mostrada en la figura 7 es una proteína de la familia de isoenzimas ampliamente distribuida en tejidos y órgano de mamífero. En condiciones de reposo celular se encuentra localizada en el cistosol donde es inactiva, una vez que recibe el estímulo del DAG se trasloca a la membrana donde en presencia de fosfolípidos como la fosfatidilserina ejerce su función de cinasa de proteínas en aminoácidos serina y treonina. Las PKCs regulan la activación de genes en linfocitos T, mediante el control de varios factores de transcripción. 39 Las tirosinas cinasas son activadas por la unión del epitope al TCR, esto no solamente induce hidrólisis de fosfolípidos, también activa vías de señalización a través de Ras (Fig. 7) mediadas por Lat, el cual, una vez fosforilado por ZAP70 se une a un adaptador intermediario (Grb-2) acoplándose a una proteína de intercambio de nucleotidos de guanina (Sos), convirtiendo la forma inactiva de Ras (Ras-GDP) a su forma activa (Ras-GTP) el cual se une a C-Raf activandolo, una vez activado actúa como una cinasa de MAPK (MAPKKK) que a su vez activará y fosforilará una o más MAPKs como a ERK-1 y ERK-2 las cuales después de ser activadas migran al núcleo donde regulan a determinados factores de transcripción involucrados en la proliferación y diferenciación celular por ejemplo el complejo API-1 (proteína activadora-1). El factor de transcripción API-1 está formado por proteínas pertenecientes a las familias Jun (c-Jun, v-Jun, JunB y JunD), Fos (c-Fos, FosB, Fra1 y Fra2) o ATF (ATF2 y ATF3). (Wu y col., 2003; Czyzyk y col., 2002). Otro factor de transcripción es el NF-kB (Factor nuclear de la cadena Kappa en células B) el cual se encuentra fundamentalmente en todos los tipos celulares y esta implicado en la activación de multitud de genes en respuesta a inflamación, infeccion y otras situaciones de stress que requieren una rápida reprogramación génica. Los complejos de NF-kB se encuentran en el citoplasma retenidos por moléculas llamadas inhibidores de NF-kB o IkB, dos de las más estudiadas en linfocitos T son IkB-a e IkB-b que en condiciones de reposo están unidas a los dimeros de NF-kB. Cuando el linfocito es activado se induce una cascada de cinasas y proteasas que regulan la degradacion de IkB lo que provoca la liberación de NF-kB/rel y su traslocación al núcleo (Fig. 7) (Wu y cols, 2003; Czyzyk y cols, 2002). 4.2 Expansión Uno de los requerimientos mas importantes para que se lleve acabo la proliferación de los linfocitos T es la presencia de la IL-2 definida como el factor 40 autocrino para dicha población, por lo que la transcripción de este gen es necesaria para que ocurra la mitosis. De manera correspondiente, la transcripción del gen para el receptor de IL-2 (IL-2R) es otro de los componentes del proceso de activación necesario para el crecimiento de los linfocitos T en respuesta a la IL-2 producida (Solomou y cols., 2001; Fierro y cols 2003). En la parte 5´ del gen IL-2 se encuentra una región de aproximadamente trescientos pares de bases que contienen sitios de unión para factores de transcripción como los descritos anteriormente (NF-kB, API-1, NFAT), la acción conjunta de estos factores es necesaria para conseguir la activación completa del gen IL-2. En términos generales, tanto el proceso de inducción o activación como el de expansión se aplica a todas las poblaciones de linfocitos T, con diferencia de que las células CD4+ o T colaboradoras proliferan y secretan citosinas, mientras que las CD8+ o T citotóxicas proliferan y son entonces capaces de ejercer su activación citotóxica (Hernandez-Ruiz y cols., 2006)(Fig. 1o). Figura 10. Interacciones celulares que participan en la activación y proliferación de los linfocitos. 41 5. CANALES IÓNICOS EN LOS LINFOCITOS Los canales son proteínas insertadas en la membrana que permiten el flujo pasivo de iones bajo sus gradientes electroquímicos. Estos canales tienen importantes funciones en diversos procesos como la excitación nerviosa y muscular, secreción hormonal, proliferación celular, aprendizaje y memoria, regulación de la presión sanguínea, balance de agua y sales, proliferación de linfocitos, fertilización y muerte celular, también existen canales iónicos involucrados en las funciones del sistema inmune (Ashcroft, 2006; DeCoursey y col., 1985; Pardo 2004; Ledoux y col., 2006). Debido a sus importantes funciones, su localización en membrana, su heterogenicidad estructural y la restrictiva expresión de algunos tipos de canales en tejidos, los canales iónicos son blanco atractivo para terapias farmacológicas. De hecho muchas de las drogas existentes, como anestésicos locales, sedantes, drogas antidiabéticas e incluso terapias antivirales, ejercen sus efectos interactuando con canales iónicos. (Ashcroft, 2006; DeCoursey y col., 1985). En linfocitos T de humano, células que no son eléctricamente excitables, existen diferentes tipos de canales iónicos, estudios electrofisiológicos en estas células del sistema inmunológico (Gardner P, 1990; Teisseyre, 2001), han sugerido que los canales iónicos juegan un papel importante en la respuesta inmune, quizá por el inicio de una cascada bioquímica de eventos enzimáticamente controlados. Algunas de las funciones inmunológicas en las que se encuentran involucrados los canales iónicos son: fagocitosis y activación de macrófagos y citotoxicidad de linfocitos T y células NK. Los linfocitos T han sido blanco de numerosos estudios + iónicos debido a que tanto canales de K como canales de Ca de canales +2 han sido caracterizados en linfocitos T y relacionados con su función celular (McCann y col., 1990) por ejemplo los canales de potasio dependientes de voltaje tienen un El canal Kv1.3 ha sido claramente papel importante en su activación. 42 demostrado que tienen un papel importante en la proliferación y regulación del volumen celular (Szabo y col., 2004; Teisseyre A. 2001). En la siguiente tabla se muestran canales iónicos que han sido caracterizados en linfocitos T Tabla 4 Canales iónicos caracterizados en linfocitos T Nombre Kv1.3 Expresión Función Referencia Células T de ratón, rata y Proliferación celular, Pardo, 2004; Humano. Regulación del Aiyar y cols., 1994; Celulas T (Jurkat) potencial de membrana Beeton y cols, 2001; Mitocondria de linfocito T en reposo Lewis 1995; Cahalan 1991; Gutman, 2005 Deutch y col., 1993 IKCa1 Células T (Jurkat) En el aumento de la Beeton y cols, 2001; Células T de Humano regulación Ghanshani y cols, transcripcional durante 2000; Kerschbaum y la mitogenesis, cols, 1997 principal regulador de señales de calcio en la activación de linfocitos. KATP Mitocondria de linfocito T Vincula el estado Dhalem y cols, 2004 energético de la célula con el potencial de membrana. CRAC Cl- Células T de humano Sostenimiento del Panyi y cols, 2004; Células T (Jurkat) influjo de calcio para la Lewis y Cahalan, Timocitos de rata activación de linfocitos 1995; Ross, 1995; T Feske y cols, 2005 Células T T (Jurkat). Regulación del Lewis y cols, 1993; Timocitos de rata volumen celular Lepple- Wienhues, 1998 43 5.1 Canales de potasio Como se menciona anteriormente, se ha encontrado evidencia de que los canales de K+ juegan un papel relevante en el control del proceso de proliferación celular. En general, la inhibición de la función de estos canales da como resultado un decremento en la proliferación; esto se ha visto en modelos donde la proliferación es una respuesta fisiológica (como en el caso de los linfocitos) y en donde hay manifestación de una condición patológica (como en células cancerosas) (Cahalan y cols, 1991), en el año de 1996 fue publicada una lista de líneas celulares donde bloqueadores no específicos del canal de K+ como la 4-aminopiridina (4-AP) (Choquet y Korn, 1992), quinidina, y tetraetilamonio (TEA) tienen efectos antiproliferativos en linfocitos, células de Schwan, melanoma, cáncer de mama, neuroblastoma y cáncer pulmonar entre otros (Pardo, 2004). Por otro lado, cambios en el potencial de membrana y en el volumen celular son necesarios para la progresión del ciclo celular (Fig. 11) y ambos requieren la acción de los canales de K+. Si los canales particulares involucrados en ambos procesos no fueran los mismos, seria concebible que algunas drogas interfirieran con la proliferación mediante la regulación del volumen y algunas otras con la interferencia en cambios del potencial de membrana. (Pardo, 2004). 44 Figura. 11 Relación hipotética entre canales de K+ y proliferación celular. Señales mitogénicas alcanzan a las señales supramoleculares que transfieren la señal al canal de K+ tanto porque el canal es una parte física del complejo o indirectamente por segundos mensajeros. La naturaleza exacta de la activación del canal dependerá particularmente de ser activados y resultará de la combinación de los efectos entre el potencial de membrana y los cambios en la regulación del volumen (Pardo, 2004). 5.1.1 Canal Kv1.3 Los canales de potasio dependientes de voltaje (Kv) son aquellos que controlan el flujo de iones potasio a través de la membrana, y su mecanismo de acción se basa en la sensibilidad a la diferencia de potencial a ambos lados de ésta y juegan un papel importante en la activación de linfocitos T. Pocos tipos de canales de K+ han sido identificados para una correlación con la proliferación celular, los casos mas estudiados corresponden al canal Kv1.3 (KCNA3) (Robbins et al., 2005) y el IKCa1 (KCa3.1. KCNN4), los cuales gobiernan la respuesta mitogénica en linfocitos ( Aiyar y cols, 1994; Beeton col., 2001). 45 xComo ya se había mencionado los canales Kv1.3 y los canales IKCa1 fueron el primer caso donde hubo un claro ligamiento entre los canales de K+ y mitogenesis. El canal Kv1.3 es un típico canal 6TM1P (seis segmentos transmembrana y un asa entre el quinto y el sexto segmento transmembrana). El canal se aber durante una despolarización aproximada de -40mV, si esta despolarización es mantenida, el canal se inactiva con una constante de tiempo de 100-200 msec. El canal Kv1.3 fue clonado por primera vez en cerebro de rata, donde se le llamó RCK3, Kv3 o RGK5. Posteriormente se clonó en cerebro de ratón y se le llamó MK3. Por otro lado este canal también fue clonado en linfocitos T de ratón, rata y por primera vez en humano al cual se le llamó HGK5 y HLK3. Todos estos clones codifican para el mismo canal de potasio que, con la nomenclatura estandarizada, pasó a llamarse Kv1.3. La distribución mayoritaria de esta proteína es en sistema inmunitario, donde se expresa en linfocitos T, linfocitos B y microglía (Cahalan et al., 2001), y en sistema nervioso con una localización restringida al hipocampo, córteza piriforme y el bulbo olfatorio. También se ha encontrado éste canal en la membrana interna de mitocondria de linfocitos T (Jurkat) con propiedades que son idénticas a las que presenta éste canal en la membrana de esta misma línea celular (Rourke., 2007). En linfocitos T se sabe que el canal Kv1.3 expresa las subunidades auxiliares Kvγ1.1 y Kvγ2.1 las cuales incrementan su expresión cuando los linfocitos son estimulados con la citosina proliferativa IL2. Existen péptidos bloqueadores de Kv1.3 como la margatoxina (MgTX) (Kerschbaum y col., 1997) y la caribdotoxina (ChTx) que resultan en una despolarización en las células T. (Koo y col., 1997). Existe evidencia de que la Genisteina puede afectar la actividad de este canal, recordando que la Genisteina es un isoflavonoide abundante en algunos vegetales y conocida como un importante inhibidor específico de la proteína tirosina cinasa (PTK), ha sido reportada como un agente natural anticáncer, inhibe la proliferación celular 46 y promueve la apoptosis en cáncer de colon en células HT-29; así los canales de potasio pueden ser considerados un blanco importante en el tratamiento del cáncer (Teisseyre y Michalak, 2005). 5.1.2 Canales de potasio activados por Ca+2 Los canales de potasio activados por calcio no son tan numerosos como los canales de potasio dependientes de voltaje y han sido clasificados en tres diferentes familias en base a la conductancia del canal. Son usualmente nombrados de alta- (big, BK), intermedia- (IK) (11-35 pS) y pequeña (SK) (2-8 pS) conductancia En linfocitos T están presentes el canal de pequeña conductancia y el de conductancia intermedia. Farmacológicamente los canales SK e IK han sido estudiados extensamente, la actividad de ambos puede ser incrementado por 1-etil-2-benzimidazolinona (1-EBIO) a concentraciones milimolares. La estructura de los canales SKCa es muy similar a la de los (Kv) : seis dominios transmembrana (1-6) y una región P, con terminación N y C intracelular, además poseen un dominio C-terminal llamado “de union a calmodulina” (CaMBD), el cual permite al canal interactuar con la calmodulina y ser regulada por Ca2+. Estos canales presentan una condctancia de 2-8pS, se encuentran escasamente en linfocitos B, no se encuentran en celulas T de humano pero son abundantes en celulas Jurkat, este canal es bloqueado por TEA y apamina. Tanto el canal SkCa como el IKCa son activados por una concentración de calcio intracelular de 200-400nM A pesar que el canal IKCa1 no es un canal de K+ dependiente de voltaje, su rol fisiológico en la proliferación de linfocitos es conceptualmente muy difícil separarlo del canal Kv1.3, en muchas ocasiones se refieren a ellos en conjunto (Pardo, 2004). El canal Kv1.3 es abierto en respuesta a una despolarización de la membrana y mantienen el potencial de reposo, mientras que el canal IKCa1 47 es abierto en respuesta a un incremento de Ca2+ citosólico e hiperpolariza el potencial de membrana (Aiyar y cols, 1994; Beeton y cols, 2001) por lo que se le considera un canal dependiente de calcio y parece estar constitutivamente asociado a calmodulina (aún en la ausencia de Ca2+), y unido a calcio para esta asociación, la calmodulina induce un cambio conformacional en el canal que abre las vías de permeación. (Panyi y col., 2004; Ghanshani y col., 2000). Se ha demostrado que la actividad de los canales de K+ se requiere para la migración, adhesión, y regulación de volumen en linfocitos T pero el proceso mejor estudiado donde se requieren éstos canales de K+ es en la activación de estos linfocitos (Beeton y col., 2001; Pardo, 2004). El fenómeno de la activación fisiológicamente relevante, lo podemos observar en el proceso de inmunotolerancia a la placenta donde la progesterona inhibe a los canales Kv1.3 y al IKCa1 dañando la activación de los linfocitos T y mientras los niveles de ésta hormona sean altos (en la placenta) y manteniendo la activación normal de estos canales en el resto del organismo de la madre. De forma similar, la modulación del canal Kv1.3 por hipoxia podría ser la razón de los efectos inmunosupresivos del bajo Po2 (Robbins y col., 2005; Pardo, 2004). Bloqueadores selectivos de Kv1.3, pero no de IKCa1, suprimen la estimulación por mitógenos, producción de citosinas y la proliferación de células T en humanos (in vitro), y una respuesta hipersensitiva retardada (in vivo), un selectivo bloqueo del canal IKCa1 suprime la producción de citosinas y la mitogénesis de células pre-activadas. (Beeton, 2001). Es importante mencionar que al hablar de mitógenos nos referimos a sustancias que estimulan a los linfocitos y a la síntesis de DNA, transformación blástica y ploriferación. Contrario a la estimulación inmune, los mitógenos activan de forma policlonal. Hay mitógenos específicos de linfocitos T como 48 concanavalina A y fitohemaglutinina (PHA) (Ghanshani y col., 2000) y otros de linfocitos B como LPS. Una particular aplicación terapéutica de estos canales sería en enfermedades autoinmunitarias, más específicamente en la esclerosis múltiple (MS) (Beeton et al., 2001) ya que en esta patología se ha mostrado que la activación de linfocitos conservan un fenotipo “preactivado” (alto Kv1.3, bajo IKCa1) (Pardo, 2004). 5.1.3 Canales de potasio sensibles a ATP (KATP) Los canales de K+ sensibles a ATP (KATP), son una familia de rectificadores entrantes débiles de K+ que se pueden encontrar en diferentes tipos celulares. Los canales KATP en células pancreáticas β, como otro tipo de canales KATP descritos en neuronas (Birgit y Jochen., 2001), músculos liso, cardiaco y esquelético, (Dahlem y cols., 2004; Quayle y cols., 1997) y en mitocondria de linfocitos T de humano (Szewczyk y col., 2006) son inhibidos por ATP intracelular (Aguilar-Bryan and Bryan, 1999; Ashcroft., 2005). Los canales KATP son muy importantes en el acoplamiento del metabolismo energético celular con la excitabilidad de la membrana de diferentes tipos celulares, y quizás han sido los canales K+ más extensamente explorados en términos de su potencial terapéutico (Noma, 1983; Misler y col., 1986). La actividad de estos canales se reduce por el ATP intracelular y se incrementa por MgADP. 5.1.3.1 Estructura de los canales KATP Los canales KATP son estructuras de estequiometria octamerica (SURx/ KIR6.y)4 (Fig. 12) compuestos por cuatro subunidades Kir6.1 (Kir6.1 o Kir6.2) (Loussouarn y cols, 2000) que forma el poro y cuatro subunidades reguladoras, 49 el receptor a sulfonilureas (SUR1 o SUR2) (Inagaki y col., 1997; Aguilar-Bryan and Bryan, 1999; Koster y col., 2005; Matsuo y col., 2005). En células-β y neuronas encontramos canales KATP conformados por SUR1/Kir6.2, en músculo cardiaco SUR2A/Kir6.2 y SUR2B/Kir6.1 (o Kir6.2) en músculo liso vascular (Isomoto y cols, 1996; Inagaki y col., 1997; Okuyama y col., 1998; Schwanstecher y cols, 1998; Koster y col., 2005; Song y Ascroft., 2001). La sola expresión de Kir6.1 o Kir6.2 no forma canales funcionales. (Gribble y col., 1997). Puesto que mutaciones en Kir6.2 modulan la conductancia de los canales SUR1/ Kir6.2 de manera característica (Shyng y col., 1997), se concluyó que Kir6.1 o Kir6.2, respectivamente, representa a la subunidad formadora del poro. Se han usado dos criterios farmacológicos para definir y clasificar los canales KATP, generalmente es posible distinguir dos tipos de canales de KATP basados en su sensibilidad a las sulfonilureas (SUR1 100-1000 veces mas sensibles que SUR2). De la misma forma, hay diferencias en la respuesta a los KCOs (abridores de canales de potasio), como por ejemplo, los canales con SUR1 y SUR2B responden mejor al diazoxido que el SUR2A de los canales cardiacos. Se cree que los sitios de unión tanto para las sulfonilureas como para los KCOs residen en el receptor SUR (Aguilar-Bryan y Bryan, 1999; Tucker y col., 1998). Figura 12. Estructura octamerica del canal de potasio sensible a ATP. El canal consiste de cuatro subunidades SURx y cuatro Kir6.y 50 5.1.3.2 Receptores sulfonilurea Los receptores sulfonilureas (SURs) son sensores intracelulares de ATP/ADP, regulando así la actividad de los canales Kir6.y, además, pertenecen a la familia de proteínas ABC (Fig. 13) (Tusnády y col., 1997; Aguilar-Bryan y Bryan, 1999; Matsuo y col., 2005), mas específicamente de la subfamilia ABCC (ABC8 para SUR1 y ABC9 para SUR2), que se identifican como transportadores activos de membrana de varios aniones orgánicos y drogas hidrofóbicas (Tusnády y col., 2006). Esta familia es probablemente el grupo más grande de proteínas transportadoras selectivas de sustancias a través de las biomembranas (Higgins, 1995). Un requerimiento estructural mínimo para un transportador ABC funcional es la presencia de dos dominios transmembranales TMD1-2 y dos dominios de unión a nucleótidos como el ATP, NBD1-2. En los seres humanos éstos pueden estar presentes dentro de una cadena polipéptidica (transportadores completos), o en membrana formando homo o heterodimeros (transportadores incompletos), con arreglos variables, los cuales serán definidos por la topología de la membrana (Tusnády y col., 2006). Algunas proteínas como las MRP1-3, MRP6-7 y SURs, tienen un TMD0 que se conecta con TMD1 por una asa citoplasmática conocido como L0 (Chan y col., 2003: Campbell y col., 2003; Babenko y Bryan., 2002). Babenko y Bryan (2003) demostraron que el dominio L0 de SUR1 (junto con TMD0) modula la compuerta del canal de K+. Además, Chan y col., (2003) demostraron que la región TMD0 de SUR1, es esencial tanto para el ensamblaje del complejo SUR1/Kir6.2 como para la modulación de la compuerta y el trafico del canal KATP. Se ha demostrado que solo los TMDs y no los NBDs son necesarios para la interacción con Kir6.2. Tusnády y cols, (1997) sugiere que SUR1 esta formada por once segmentos transmembana antes de NBD1 y seis entre NBD2 y el carboxilo terminal. 51 Figura 13. Estructura del canal KATP. En A se aprecia la subunidad SUR 2 A con el Kir6.2 presentes en tejido cardiaco y músculo esquelético así como los sitios de unión a nucleótidos y sus dominios transmembranales TMD. En B se aprecia la subunidad SUR1 con el Kir6.2 presente en células β pancreáticas y tejido neuronal se aprecian también los sitios de unión a nucleótidos y sus dominios transmembranales, se observa la unión de la glibeclamida, compuesto bloqueador de los canales KATP por lo que el canal esta cerrado (Modificado de Babenko y col., 1999). Las NBDs catalizan la hidrólisis del ATP, y la energía libre resultante es utilizada para conducir el substrato a través de un camino específico formado por TMD1 y TMD2 (Locher y col., 2002; Chan y col., 2003; Matsuo y col., 2005). La secuencia y estructura de ambos NBD está altamente conservada a través de todas las proteínas ABC en células eucariontes y procariontes. Cada una contiene accesorios Walker A y Walker B (WA y WB) altamente conservados y una unión accesoria intermedia (Aguilar-Bryan y Bryan, 1999; Campbell y col., 2003). Estudios funcionales en proteínas ABC de eucariontes y bacterias han proveído evidencia de que ambas NBD de la proteína ABC interactúan operando como una unidad funcional. Estos estudios soportan un modelo en el 52 cual las NBDs se dimerizan en una conformación ‘nucleotide-sandwich’, esto porque WA y WB de NBD1 se asocian con la secuencia de union de NBD2 y viceversa (Locher y col., 2002; Smith y col., 2002; Campbell y col., 2003). La Tabla 5. Muestra las subunidades conocidas del canal por el tipo de tejido. Esta clasificación esta basada en un criterio farmacológico . Receptor Sulfonilurea Rectificador entrante Tejido /subtipo de canal SUR1 Kir6.1 Kir6.2 ?? Células β pancreáticas/neuronal SUR2A Kir6.1 Kir6.2 SUR2B Kir6.1 Kir6.2 ?? Músculo/cardiaco y esquelético Músculo liso vascular Músculo liso vascular Tabla 5. Isoformas del canal KATP (modificado de Matsuo et al., 2005) 5.1.4 Canales mitocondriales de K+ sensibles a ATP Una variedad de vías de transporte de iones en mitocondria han sido identificados a través de mediciones de fluorescencia en mitocondrias aisladas y por patch-clamp en mitocondrias aisladas y mitoblastos (Rourke 2007). Años atrás se realizaron mediciones de corriente del canal KATP en el interior de la membrana mitocondrial (mitoKATP) en hígado de rata complementando los canales KATP de membrana plasmática. El canal mtKATP permite el transporte de potasio dentro de la matriz mitocondrial bajo condiciones control de ATP intracelular. Estos canales vinculan el estado energético de la célula con el potencial de membrana. (Dahlem y cols, 2004; 53 Jiang y cols, 2005). Se han encontrado canales mitoKATP en el interior de la membrana mitocondrial de corazón, cerebro y linfocitos T (Bajgar y cols, 2001). Los canales mitoKATP son bloqueados por ATP (~10-100µM), ADP, 5hidroxidecanoato (5-HD), palmitoil y glibenclamida (Sanguinetti y Salata 1996). La activación puede llevarse acabo por aplicación de GTP o GDP, además agentes sintéticos como el diazoxido y la cromakalim fueron identificados como activadores, donde los canales mitoKATP son 2000 veces más sensibles al diazoxido que los canales KATP de la membrana plasmática. (Dhalem y col., 2004, Quast, 1996). El canal mitoKATP ha sido caracterizado en mitoplastos obtenidos de cultivos de linfocitos T de humano y se ha demostrado que bajo condiciones control este canal se encuentra permanentemente abierto con cierres cortos regulares a frecuencias de 17.7 Hz. La cinética es similar a la del canal mitoKATP encontrado en hígado de rata y en miocardio bovino y de acuerdo a estos mismos experimentos realizados por Dahlem y cols, 2004. El ATP no solo reduce la actividad Po (probabilidad de apertura) de los canales sino que también modula la frecuencia de ráfagas del canal (Dahlem y col., 2004). La actividad del canal (mitoKATP) es modulada por varios nucleotidos (Fig. 14). Recientemente se ha mostrado que los efectos del ATP en el canal KATP puede ser modulada por Ca+2. (Szewczyk y col., 2006). 54 Figura 14. Reguladores fisiológicos de canales de potasio mitocondriales. Regulados por ATP (mitoKATP), Canal de calcio de larga conductancia (mitoBKCa) Canal de potasio voltaje dependiente (mitoKv1.3), especies oxigeno reactivas (ROS), oxido nítrico (NO). Tomado de Szewczyk y col., 2006; Samavati y col, 2002. De acuerdo con Szewczyk y cols ( 2006), se tendrá un canal mitoKATP si las siguientes propiedades farmacológicas están presentes en el registro del canal de potasio: (1) El canal tiene que ser bloqueado por ATP/Mg, (2) La inhibición del canal por ATP/Mg puede ser activado por diazoxido, (3) El canal puede ser bloqueado por acido 5-hidroxidecanoico (5-HD), como se menciona anteriormente, una sustancia conocida como bloqueador del canal mitocondrial, (4) El canal puede ser bloqueado por glibenclamida, (5) El bloqueo del canal KATP de la membrana plasmática del tejido cardiaco por HMR1098 no tendra efecto en la actividad del canal. 55 Dahalem y col. (2004), propusieron un mecanismo hipotético de la modulación del canal mitoKATP por Ca2+. Este modelo esta basado en las siguientes afirmaciones (1) el canal mtKATP tiene dos sitios donde Ca2+ y ATP se unen irreversiblemente, (2) Incremento de la frecuencia de rafagas y la siguiente reducción de Po es debida a la formación del complejo Cax y ATPy.Ca (x, y numero de iones unidos, x,y ≥2). Una vez que la concentración se incrementa sobre un valor umbral, el 2+ Ca puede ser irreversiblemente único al canal mitoKATP. En soluciones que contienen ATP esto provoca un sitio viable para la formación del complejo ATPCax y causar el bloqueo del canal mitoKATP. Entonces si el canal es expuesto a ATP y alto Ca+2 (>100µM), existen dos sitios en donde puede ocurrir un bloqueo. Sin embargo no se puede excluir la posibilidad de que el ATP-Cax/ATPyCa se una a otros sitios alostéricos del canal mitoKATP y causar cambios conformacionales e inhibir la actividad del canal (Dahlem y cols, 2004). En la figura 14 se muestran evidencias experimentales del registro de este tipo de canales en membrana interna de mitocondria de linfocito. 56 Figura 15. En A Corrientes representativas del canal mitoKATP en linfocitos T humanos, a varios potenciales de membrana, obtenidas en condiciones simétricas de K+ (150mM). En B se muestra la curva I/V de un canal rectificador saliente con una conductancia de 15 y 82 pS a potenciales negativos y positivos respectivamente. Tomado de Dahlem y col., 2004 57 5.2 Canales CRAC. El Ca+2 tiene un papel esencial durante el desarrollo y maduración de linfocitos. En linfocitos T maduros la presentación del antígeno provoca una serie coordinada de eventos los cuales culminan en la activación y proliferación celular. Las etapas tempranas de la activación de los linfocitos T pueden ser separados en dos eventos: (1) el evento pre- Ca+2 y post- Ca+2. La presentación del antígeno al receptor se da de 1-100 segundos, en donde ocurrirán eventos pre- Ca +2 los que incluyen la activación de tirosina cinasa y la generación de inositol 1,4,5-trifosfato (IP3) (Cahalan y Chandy., 1997; Verheugen , 1998) provocando, como se menciona anteriormente, la liberación de Ca+2 e incrementando la concentración intracelular de Ca+2 (Lewis y Cahalan, 1990), después se necesitaran de minutos a horas para que ocurran los eventos postCa+2 que involucran cambos en la serina/treonina cinasa y actividades fosfatasa, alteración en el citoesqueleto y actividad de canales iónicos y transcripción de genes. El incremento de Ca+2 intracelular activa a la fosfatasa calcineurina la cual desfosforila los factores de transcripción localizados en el citoplasma, permitiendo que se acumulen en el núcleo uniéndose a elementos promotores del gen de interleucina 2 (IL2) (Fig. 15). Además de otros eventos paralelos como la activación de la proteína cinasa C (PKC) y Ras, la transcripción de genes provoca la proliferación celular (Fig. 7) (Cahalan y Chandy., 1997). 58 Figura 15. Eventos de calcio en linfocitos T. Existe una cascada de señalización desde el receptor TCR hasta la secreción de IL-2. DAG, diacilglicerol; Em potencial de membrana plasmática; IP3R receptor a inositol 1,4,5-trifosfato; NF-AT, factor nuclear de activación de células T; TG, tapsigargina; TK, tirosina cinasa. En la figura anterior, uno de los eventos post- Ca+2 la calcineurina, es blanco y el sitio de acción para la inmunosupresión. Desafortunadamente inhibidores de la calcineurina como la ciclosporina A y FK506 son tóxicos, en enfermedades renales o del hígado, su uso se ve limitado (Chalan y Chandy, 1997). Uno de los pasos bioquímicos tempranos en este proceso es la activación de la fosfolipasa C (PLC)γ generando IP3 el cual como se ilustra en la figura 7 y 15 , mediante la continua activación del IP3R depleta las cisternas internas de Ca+2. El resultado de un decremento de Ca+2 en el ER provoca un 59 flujo de Ca+2 por la apertura de una clase de canal de Ca+2 en la membrana plasmática conocido como canal de liberación de calcio activado por calcio (CRAC) (Panyi y cols, 2004; Lewis y Cahalan, 1995; Ross, 1995). Sólo la apertura del canal CRAC en la membrana plasmática permite la entrada de Ca+2 para mantener los niveles altos requeridos en el interior de la célula. Debido a esta entrada de Ca+2 existe una despolarización de la célula lo cual reduce la fuerza para entradas futuras de Ca+2, una sostenida entrada de Ca+2 solo puede lograrse por la participación de canales Kv. En el caso de los linfocitos T es el canal Kv1.3 localizado en la membrana y el cual se abre en respuesta a la despolarización de la membrana causada por la entrada de Ca+2. Otro canal involucrado en la regulación de la entrada de Ca+2 es el IKCa1 pero este canal al contrario que el Kv 1.3 responderá a un incremento intracelular de Ca+2 y no por la despolarización de la membrana (Fig. 7 y 15) (Bronstein-Sitton, 2006). La función de los dos canales de K+ estabiliza el potencial de membrana a un valor suficientemente negativo adecuando las fuerzas de manejo y manteniendo el flujo de Ca+2 a través de los canales CRAC. El resultante mantenimiento de [Ca+2]i elevado, activa vías de transcripción requeridas para la proliferación y función efectora inmune. El Ca+2 también tiene un papel esencial en el desarrollo de linfocitos T por la influencia de motilidad y selección positiva de timocitos (Ross, 1995). Evidencias farmacológicas, electrofisiológicas y genéticas soportan la noción de que los canales CRAC son la principal vía del flujo de Ca+2 en el desarrollo y maduración de linfocitos T, y de esta manera, están relacionados con muchos aspectos del desarrollo y función de los linfocitos. La importancia de la entrada de Ca+2 para las defensas inmunológicas del huésped es principal para ayudar a las deficiencias en la activación de linfocitos T y expresión de genes en pacientes que carecen de esta entrada de Ca+2. De esta manera se sabe que las propiedades funcionales y moleculares de los canales CRAC es central para una completa comprensión de la activación de linfocitos T (Feske y col., 2005). 60 Para finalizar la señal de Ca2+, este ha de volver a sus niveles basales que son muy bajos en el citosol gracias a la actividad de diversas enzimas transportadoras de iones. Las ATPasas de Ca2+, presentes en la membrana del ER (SERCAs del ingles Sarco Endoplasmic Reticylum Calcium ATPase), bombean Ca2+, hacia el interior de los reservorios, mientras que la ATPasas de la membrana plasmática (PMCAs del ingles Plasma Membrana calcium ATPase) y el intercambiador Na+/ Ca2+ llevan el Ca2+ hacia el exterior celular. La TG es un inhibidor de SERCAs el cual produce vaciamiento de reservorios del ER por salida pasiva de Ca2+ a favor de gradiente y es potente porque actúa directamente sobre los mecanismos de regulación de la concentración intracelular de Ca2+ sin involucrar ningún otro sistema de transducción de señal. Panyi y col., (2004) muestran evidencia de la relación del canal Kv1.3 y el canal IKCa1 después de la activación del canal CRAC y la función de estos canales en la regulación del potencial de membrana (Kv1.3 e IKCA1) y la señalización de calcio (CRAC) (Fig. 17). 61 Figura 17. Canales iónicos en linfocitos T. En A se muestra la estimulación del antígeno a través del TCR/CD3 provocando una liberación de Ca2+ del ER vía PLC/IP3, la depleción de Ca2+ resulta en una despolarización de la membrana. Los canales Kv1.3 son abiertos por la despolarización y el sobrevenir del flujo de K+ hiperpolariza la membrana. El incremento de concentraciones internas de Ca+2 activa el canal de K+ activado por calcio de conductancia intermedia (IKCa1). La función de los dos canales de K+ estabiliza el potencial de membrana a un valor suficientemente negativo adecuando las fuerzas de manejo y manteniendo el flujo de Ca+2 a través de los canales CRAC. La señal de Ca+2 es requerida para activar factores nucleares y estimular la producción d IL-2. En B se muestran corrientes de K+ en una célula T en reposo. Las corrientes fueron obtenidas por pulsos de prueba de 1s de duración incrementando el potencial de mantenimiento de -80 mV a +30 mV como se indica en la figura. Bajo estas condiciones exclusivamente los canales Kv1.3 contribuyen a la corriente. En C corrientes de K+ en una célula T estimulada por mitógenos. Las corrientes fueron observadas por rampas de voltaje de 200 ms de -120 a +25mV. La parte lineal del trazo a voltajes negativos representa corriente voltaje-independiente a través de canales IKCa1 (la corriente es directamente proporcional al voltaje). La parte en la que se observa un incremento de corriente en el trazo indica activación de canales Kv1.3 a voltajes más positivos que -40mV. La pequeña corriente fue registrada en 62 presencia de 10 nM de caribdotoxina, la cual bloquea ambos canales y reduce ambos componentes de la corriente. Tomado de Panyi 2004. 5.3 Canales de cloro (Cl-) La regulación del volumen es un extenso proceso que permite a las células mantener su volumen en cambios de osmolaridad extracelular. Se han investigado dos mecanismos de regulación de volumen en linfocitos expuestos a soluciones hiperosmóticas o hipoosmóticas. Soluciones hiperosmóticas inducen el eflujo de agua, contracción celular, fosforilación de una variedad de sustratos celulares y activación de un mecanismo de intercambio de sodio-hidrogeno el cual resulta en una subsecuente regulación del incremento del volumen (RVI). Cuando los linfocitos son expuestos a soluciones hipoosmóticas, inicialmente se edematizan por el agua entrante, pero en un periodo de minutos se contraen de manera que igualan su volumen normal. Basado en mediciones de volumen celular, potencial de membrana, y flujo de iones, han mostrado que una regulación del decremento de volumen (RVD) involucra vías conductivas separadas para iones de Cl- y K+. La conductancia de la membrana para los dos iones Cl- y K+ se ve incrementada por la edematización resultando en un eflujo de ambos iones y un eflujo osmoticamente obligado de agua. (Lewis y col., 1993 ;Ross y col., 1993). El eflujo de Cl- y el RVD son bloqueados por algunas drogas que bloquean canales de Cl- en otros tejidos, incluidos el ácido stilbene 4- actemido-4´isotiociano-2,2´ disulfonico (SITS) y el ácido stilbene 4,4´-diisotociano-2,2´-disulfonico (DIDS). Una función del Cl- en la proliferación de linfocitos se propuso desde que DIDS o la remoción del Cl- externo inhibe el flujo de Ca+2 estimulado por 63 anticuerpos que es necesario para la activación del linfocito (Pahapill y Sclichter, 1992; Lewis y col., 1993). Se ha demostrado que elementos del citoesqueleto participan en la activación de estos canales. Estudios realizados por Lepple-Winhues (1998), demuestran que la fosforilación de la tirosina cinasa p56lck activa la corriente de cloro que dematiza a la célula (ICl-swell) mediando el RVD y que en células deficientes de p56lck presentaban un defecto en RVD en la activación de la corriente ICl-swell. Además la retransfección de esta cinasa resulta en una restauración osmótica de la corriente de activación por lo que se concluyó que el edema osmotico activa la corriente ICl-swell en linfocitos vía tirosina cinasa p56lck. 64 Conclusiones - La expresión de canales iónicos en linfocitos T juega un papel muy importante en el control del potencial de membrana y señalización de calcio, afectando vías de transducción de señales para la activación de estas células después de la estimulación antigénica. - El canal de potasio Kv1.3 tienen un papel importante en la proliferación y regulación del volumen celular. - El canal ICa1 se requiere para la migración, adhesión, y regulación de volumen en linfocitos T. El proceso mejor estudiado donde se requieren éstos canales de K+ es en la activación de los linfocitos. - Los canales CRAC son la principal vía del flujo de Ca+2 en el desarrollo y maduración de linfocitos T, y de esta manera, están relacionados con muchos aspectos del desarrollo y función de los linfocitos. - Los canales mitoKATP vinculan el estado energético de la célula con el potencial de membrana. - Los canales iónicos involucrados en la activación de linfocitos T son blancos para la producción de drogas inmunomoduladoras. 65 Perspectivas De acuerdo a las funciones de los canales de KATP en diferentes tejidos, y con la evidencia de la presencia de estos canales en la membrana mitocondrial de los linfocitos T, se podría efectuar estudios para comprobar la presencia del canal KATP en la membrana plasmática y las propiedades biofísicas de este canal, así como su papel fisiológico en la respuesta inmune y las probables alteraciones originadas por patologías metabólicas, por ejemplo, la Diabetes Mellitus. 66 Referencias Abbas A. K., Lichtman A. H., Pober J.S. (1997) Celular and Molecular Immunology. 3ra. Edición. Edit Saunders pp 4,100. Aguado E., Martinez-Florensa M., Aparicio Pedro. (2006). Activation of T lymphocytes and the role of adapter LAT. Transplant Immunology.17:23-26 Aguilar-Bryan L. and Bryan J. (1999). Molecular Biology of Adenosine Triphosphate-sensitive Potassium Channels. The endocrine Society. 20(2):101-135. Aiyar J. Nguyen A. N., Chabdy K. G., Grissmer S. (1994). The P-Region and S6 of Kv3.1 Contribute ti the Formation of the Ion Conduction Pathway. Biophysical Journal. 67:2261-2264. Ashcroft F.M.(2006). From molecule to malady. Nature.440:447 Ashcroft F.M. (2005). ATP-Sensitive potassium channelopathies: focus on insulin secretion. Journal of Clinical Investigation. 115:2047-2059 Ashcroft F. M. and Grible Fiona (1998) Correlating structure and function in ATP-sensitive K+ channels. Trends Neuroscience 21:288-294. Armstrong, C.M. y Hille, B. (1998) Voltagegated ion channels and electrical excitability. Neuron. 20: 371-380. Armstrong T.D. C., Clements V.J., Martin B. K., Ting J. P., OstrandRosenberg S. (1997) Major histocompatibility complex class II.transfected 67 tumor cells present endogenous antigen and are potent inducers of tumorspecific immunity. Immunology. 94: 6886-6891. Babenko A. P. Gonzalez G., Bryan J. (1999). The tolbutamide site of SUR1 and a mechanism for its functional coipling to KATP channel closure. FEBS Letters. 459:367-376. Babenko A. P. and Bryan J. (2002). SUR-dependent Modulation of K ATP Channels by an N-terminal KIR6.2 Peptide. Journal of Biological and Chemestry. 277:43997-44004. Babenko, A.P. and Bryan, J. (2003) SUR domains that associate with and gate KATP pores define a novel gatekeeper. Journal of Biological and Chemestry. 278:41577–41580. Bajgar R., Seetharaman S., Kowaltowski A. J., Garlid K. D. Paucek P. (2001). Identification and properties of a Novel Intracellular (mitochondrial) ATPsensitive Channel in Brain. Journal of Biological and Chemestry. 276:3336933374. Beeton C., Wulff H., Barbaria J., Clot-Faybesse O., Pennington M., Bernard D., Cahalan M. D., Chandy K. G., Beraud E. (2001). Selective blockade of T lymphocyte K+ channels ameliorates experimental autoimmune encephalomyelitis, a model for multiple sclerosis. PNAS. 98;139242-13947. Bergman (2001) Th1 or Th2: How an Appropriate T Helper Response can be Made. Bulletin of Mathematical Biology 63: 405-430. Birgit J. and Roeper J. (2001). A role for neuronal KATP channels in metabolic control of seizure gate. Trends in Pharmacological Sciences. 22:599-601. 68 Bier O. G., Dias da Silva W., Gotze D., Mota I. (1981). Fundamentals of Immunology. Edit. Springer-Verlag 130-138, 60-67 Blanchard N., Di Bartolo V., Hivroz C. (2002). In the immune synapse, ZAP70 controls T-cell polarization and recruitment of signaling proteins but not formation of the synaptic pattern. Immunity. 17:389-399. Bronstein-Sitton, (2006) T Cell Signaling and Activation: No Simple Matter. Pathways: No. 2. Cahalan M. D., and Chandy K. G. (1997). Ion channels in the immune system as target for immunosupression. Pharmaceutical Biotechnology 8:749-756. Cahalan M. D., Chandy and Grissmer S. (1991) Potassium Channels in Development Activation and Disease in T lymphocytes J. Clin. Immunol. 39: 357-391. Cahalan, M.D., Wulff, H. y Chandy, K.G. (2001) Molecular properties and physiological roles of ion channels in the immune system. J. Clin. Immunol. 21:235- 252. Campbell JD, Sansom MSP & Ashcroft FM (2003). Potassium channel regulation: Structural insights into the function of the nucleotide -binding domains of the human sulphonylurea receptor. EMBO reports Vol. 4:1038– 1042. Carosi H., Verdaguer C., Solá L., Acosta N., Ambrosoni P., Mazzuchi N. (1990). Lesion glomerular mínima. Rev. Med. Uruguay. 6:160-168 69 Chan, K.W., Zhang, H. and Logothetis, D.E. (2003) N-terminal transmembrane domain of the SUR controls trafficking and gating of Kir6 channel subunits. EMBO J. 22:3833–3843. Cjang H. C., Smolyar A., Spoerl R., Witte T., Yao Y., Goyarts E. C., Natheson S. G., Reinherz E. L. (1997) topology of T cell receptor-peptide/Class I MHC Interaction defined by Charge Reversal Complementation and Reversal Analysis. J. Mol. Biol. 271:278-293 Chandy G, DeCoursey T. E, Chalan M. D., McLaughlin C., Gupta S. (1984). Voltage-gated Potassium Channels are required for Human T Lymphocyte Activation. J. Exp. Med 160:369-385. Chandy G., Wulff H., Beeton C., Pennington M., Gutman G. and Cahalan M. (2004). K+ channels as targets for specific inmunomodulation. Pharmacological Sciences. 25:280-289. Char-Chang S., Coghlan M., Sullivan J., and Gopalakrishnan M. (2000). Potassium Channel: Molecular defects, diseases and therapeutic opportunities. Rev Pharmacol 52:557-593. Choquet D. and Korn H. (1992) Mechanism of 4-Aminopiridine Action on Voltage.gated Potassium Channels in Lymphocytes. J. Gen. Physiol. 99:217240. Chung K. F. (2001) Cytokines in chronic obstructive pulmonary disease. ERS Journal. 18:50-59 70 Czyzyk J. Brogdon J., Badou A., Henegariu O., Preston P., Flavell R., Bottomy K.(2000). Activation of CD4 T cells by Raf-independient effecrors of Ras. PNAS. 100:6003-6008. Dahlem Y. A.,. Horn T. F. W., Buntinas L., Gonoi T., Wolf G., Siemen D. (2004). The human mitochondrial KATP channel is modulated by calcium and nitric oxide: a patch-clamp approach. Biochimica et Biophysica 1656: 46-56 DeCoursey T.E., Chandy K.G., Gupta S. and Cahalan (1985) VoltageDependent Ion Channel in T-Lymphocytes. Journal of Neuroinmunology, 10:71-95. Dustin M. L. and Chan A. C. (2000) Signaling Takes Shape in the Immune System. Cell. 103:283-294 Dustin M.L. and Springer T.A. (1991) Role of lymphocyte adhesion receptors in transient interactions and cell locomotion.Rev. Immunol. 9:27-66. Faccetti F., Chan J. K., Zhang W., Tironi A., Chilosi M., Parolini S. Notarangelo L., Samelson L. (1999) Linker for activation of T cells (LAT), a novel immunohistochemical marker for T cells, NK cells, Mast cells, and megakaryocytes. American Journal of Pathology 154:1037-1046. Fanger C., Neben A. and Cahalan M. (2000). Differential Ca2+ Influx, KCa Channel Activity, and Ca2+ Clearance Distinguish Rh1 and Th2 lymphocytes. Journal of Immunology 164:1153-1160. Farrar J. D., Asnalgi H., y Murphy K. M. (2002). T helper subset development: roles of instruction, selection, and transcription. Journal of Clinical Investigation.109: 431-435 71 Felzen B., Lavy R., García M., Berke G., Phyllis G., Binah O. (1995). Interaction of Cytotoxic T Lymphocytes and Guinea pig Ventricular myocytes. Circulation research 78:253-261. Feske S., Prakriya M., Rao A., Lewis R. S. (2005). A serve defect in CRAC Ca+2 channel activation and altered K+ channel gating in T cells from inmunodeficient patients. JEM. 5:651-662. Fierro A., Mora J. R. Bono M. R. Morales J., Buckel E., Sauma D., Rosemblatt M. (2003) Dendritic cells and the mode of action of anticalcineurinic drugs: an integrating hypothesis. Nephrol Dial Transplant. 18:467-468 García C. K., Degano M., Pease L. R. , Huang M., Peterson P. A., Teyton L., Wilson I. A. (1998). Structural Basis of Plasticity in T Cell receptor Recognition of a Self peptide- MHC Antigen. Science 279:1166 Garcia R. (2005) El canal de potasio Kv1.3 papel fisiológico y biología del complejo funcional. Tesis. Departamento de bioquímica y biología molecular Universidad de Barcelona. Gardner P. (1990). Patch Clamp studies of lymphocyte Activation. Rev Immunol. 8:231-252. Gascoigne N. R., Goodnow C. C., Dudzik K. I., Oi V. T., Davis M. M. (1987) Secretion of a Chimeric T- cell receptor-immuglobulin protein. Immunology 84:2936-2940. 72 Ghanshani S., Wulff H., Miller M., Rohm H., Neben A., Gutman G., Cahalan M., Chandy G. (2000). Up-regulation of the IKCa1 Potassium Channel during T-cell Activation. Journal of Biological Chemestry. 275:37137-37149. Glimcher L. and Singh H. (1999). Transcription Factors in Lymphocyte Development T and B cells Get Together. Cell 96:13-23. Granger J. P., (2004) Inflamatory Cytokines, Vascular Function and Hypertension. J.Physiol 286:989-990. Goda S., Quale A. C., Woods M. L., Felthauser A., Shimizu Y. (2004). Control of TCR-Mediated Activation of β1 Integrins by the ZAP-70 Tyrosine Kinase Interdomain B Region and the Linker for Activation of T Cells Adapter Protein. J of Immunology. 172:5379-5387. Granja C., Lin L., Yunish E., Relas V., Dasgupta J., (1991). PLCγ1, a posible Mediator of T Cell Receptor Function. J. of Biological Chemestry. 266:1627716280. Gribble FM, Ashfield R, Ämmälä C, Ashcroft FM (1997): Properties of cloned ATP-sensitive K+ currents expressed in Xenopus oocytes. J Physioll. 498:8798. Grissmer D., Zawar C., Neumcke B. (2002) Cell- type specific depression of neuronal excitability in rat hippocampus by activation of ATP-sensitive potassium channels. Eur Biophys J. 31: 467-477. Gros L., Trapp Stefan, Dabrowski M., Ashcroft F., Bataille D. and Blache P. (2002). Characterization of two novel forms of the rat sulphonylurea receptor SUR1A2 and SUR1B31. British Journal of Pharmacology 137:98-106. 73 Hernández-Urzúa M.A., Alvarado-Navarro A. (2001) Interleucinas e inmunidad innata. Biomed. 12:272-280. Hernandez-Ruiz J., Becker I. (2006). Linfocitos T citotóxicos CD8+ en la leishmaniasis cutánea. Salud Publica de Mexico. 48:430-439Higgins CF (1995). The ABC of channel regulation. Cell, Vol. 82:693 - 696. Hille, B. (2001) Ion channels of excitable cells. 3rd Ed. Sinauer Associates, Sunderland. Hubner C. and Jentsch T. (2002). Ion channel diseases. Human Molecular Genetics. 11:2435-2445. Inagaki N, Gonoi T and Seino S, (1997). Subunit stoichiometry of the pancreatic beta-cell ATP-sensitive K1 channel. FEBS Letters, 409:232–236. Isomoto S, Kondo C, Yamada M, Matsumto S, Higashiguchi O, Horio Y, Matsuzawa Y, Kurachi Y (1996): A novel sulfonylurea receptor forms with BIR (Kir6.2) a smooth muscle type ATP-sensitive K+ channel. J Biol Chem. 271: 24321-24324. Janeway C.A., Travers P.; Walport M. (1999) Inmunobiology: The immune system in healt and disease. 4ta edición, Edit. Garland 1:9-31 74 Jiang M. T., Ljubkovic M., Nakae Y., Shi Y., Kwok W. M., Stowe D. F. Bonsjak Z- J. (2005) Characterization of Human Cardiac mitochondrial ATP-sensitive Potassium Channel and Its regulation by Phorbol ester in vitro. Journal of physiology. 10:2-34 Jiménez M. and Orías M. (2006) Canales de Potasio, tono vascular e hipertensión. Boletín del Consejo Argentino. pp. 5-7. Kerschbaum H., Negulescu P., and Cahalan M. (1997). Ion Channels, Ca2+ Signaling, and reporter Gene Expresion in Antigen-Specific Mouse T Cells. Journal of Immunology. 159:1628-1638. Kisielow P., Miazek A. (1995). Positive Selection of T cells: Rescue from programmed cell death and differentiation require continual engagement of the T cell receptor. J. Exp. Med. 181:1975-1984. Koo G., Blake T., Talento A., Nguyen M., Lin S., Sirotina A. (1997). Blockade of the voltage-Gated Potassium Channel Kv1.3 Inhibits Immune responses in Vivo. Journal of Immunology. 158:5120-5128. Koster JC, Permutt MA, and Nichols CG (2005). Diabetes and Insulin Secretion: The ATP-Sensitive K+ Channel (KATP) Connection. Diabetes, Vol. 54:3065-3072. Lanzavecchia A., Lezzi G. and Viola A.. (1999) From TCR Engagement to T Cell Activation: A Kinetic View of T Cell Behavior. Cell 96:1-4. 75 Ledoux J., Werner M.E., Brayden J. E., Nelson M. T., (2006). CalciumActivated Potassium Channels and Regulation of Vascular Tone. Physiology. 21:69-79 Lepple-Wienhues A., Szabo I., Laun T., Kaba N., Gulbins E. (1998). The tyrosine kinase p56lck mediates activation of swelling-induced Chloride channels in lymphocytes. Journal of Cell Biology. 141:281-286 Lewis R. S. and Cahalan M. D. (1990). Ion Channels and Signal Transduction in Lymphocytes. Physiology. 52:415-430. Lewis R. S., Ross P., Cahalan M. (1993). Chloride Channels Activated by Osmotic stress in T lymphocytes. J. Gen. Physiol.101:801-826. Lewis R. S. and Cahalan M. D. (1995). Potassium and Calcium Channels in lymphocytes. Immunol. 13:623-653. Liston A., Hardy K., Pittelkow., Wilson S.R. Makaroff L. E., Fahrer A.M. Goodnow C.C. (2007) Impairment of organ-specific T cell negative selection bye diaetes susceptibility genes: genomic analysis by mRNA profiling. Biology 8:R12. Lloyd S. Gray, James R. Gnarra, John H. Russell and Victor H. Engelhard (1987). The role of K+ in the regulation of the increase in intracellular Ca2+ mediated by the T Lymphocyte Antigen receptor. Cell 50:119-127. Locher, K.P., Lee, A.T. & Rees, D.C. (2002). The E. coli BtuCD structure: a framework for ABC transporter architecture and mechanism. Science,. 296;1091–1098. 76 Loussouarn G., Elena N.M., Rose T., Nichols C. G. (2000) Structure and Dynmics of the Pore of Inwardly Rectifying KATP Channels. Journal of Biological and Chemestry 275:1137-1144. Loussouarn G., Pikes L. J., Ashcroft F. M., Makhina E. N., Nichols C.G. (2001). Dynamic Sensitivity of ATP-sensitive K+ Channel to ATP. Journal of Biological Chemestry. 276:29098-29103. Lovatt M., Filby A., Parravicini V., Welen., Palmer E., and Zamoyska R., (2006). Lck regulates the threshold nof activation in primary T cells, While both Lck and Fyn contribute to magnitude of extracellular signal-related kinase response. Molecular and Cellular Biology. 26:8655-8665. Matheux F., y Villard J. (2004). Celular and gene Theraphy for major Histocompatibility Complex Class II Deficiency. News Physiol Sci. 19:154158. Matsuo M., Kimura Y., Udea K. (2005). KATP channel interaction with adenina nucleotides. Journal of Molecular and cellular cardiology. 38:907-916 McCann F. V., McCarthy D. C. Noelle R. J. (1990). Patch-Clamp Profile of Ion Channels in Resting Murine B Lymphocytes. J. Membrane Biol. 114:175-188. Minor, D.L., Lin, Y-F., Mobley, B.C., Avelar, A., Jan, Y.N., Jan, L.Y. y Berger, J.M. (2000) The polar T1 interface in linked to conformational changes that open the voltage-gated potassium channel. Cell. 102: 657-670. 77 Misler S, Falke LC, Gillis K, MCDaniel ML (1986): A metabolite-regulated potassium channel in rat pancreatic B cells. Proc Natl Acad Sci USA. 83:7119 - 7123. Modino A., Khoruts A., Jenkins M. K. (1996). The anatomy of T-cell activation and tolerance. Proc Natl. Acad Sci. 93:2245-2252. Myung P. S., Borethe N., Koretzky G. (2000) Adapter proteins in lymphocyte antigen-receptor signaling. C. O. Immunology 12:256-266 Noma A (1983): ATP-regulated K+ channels in cardiac muscle. Nature.. 305:147-148. Okuyama Y, Yamada M, Kondo C, Satoh E, Isomoto S, Shindo T, Horio Y, Kitakaze M, Hori M, Kurachi Y (1998): The effects of nucleotides and potassium channel openers on the SUR2A/Kir6.2 complex K+-channel expressed in a mammalian cell line, HEK293T. Pflügers Arch, Vol. 435:595603. Pahapill and Schlichter. (1992). Cl- channels in intact human T lymphocytes. Journal of Membrane Biology. 125:171-183. Pahapill and Schlichter. (1992). Modulation of potassium Channels in Intact Human T Lymphocytes. Journal of Phisiology. 445:407-430. Palmer E. (2003). Negative selection- clearing out the bad apples from the Tcell repertorie.Immunol 3:383-391 Panyi G. and Deutsch C. (1996) Assembly Supression of Endogenous Kv1.3 Channels in Human T Cells. J,Gen, Physiol. 409-420 78 Panyi G. Zoltán V., Rezso G. (2004). Ion channel and lymphocyte activation. Immunology Letters. 92:55-65 Pardo L. (2004) Voltage-gated Potassium Channels in Cell Proliferation. Physiol 19:285-292. Penninger J., Crabtree G. (1999). The Actin Cytoskeleton and Lymphocyte Activation. Cell. 96:9-12. Petrov R.V. (1982) Inmunología. Edit Mir Moscú, pp. 40-43 Puertas M. (2006). Caracterización Fenotípica y funcional de los linfocitos B infiltrantes en islotes pancreáticos en ratones NOD. Tesis Doctoral. Departamento de Biología Celular , Fisiología e Inmunología. Universidad Autónoma de Barcelona Quast U. Cap. 8. Effects of Potassium Channel Activators in isolated blood Vessels. Evans, J.M. Hamilton T.C., Logman S. D., Stemp G. (1996). Potassium Channels and their Modulators. Edit. Taylor and Francis pp. 173179 Quayle J.M., Nelson M.T. Standen N.B. ATP-sensitive and Inwarsly Rectifying potassium Channels in Smooth Muscle. (1997). Physiological Society. 77:1165-1215. Quesada A., Redondo J., (2003). La ruta de señalización Ca+2/calcineurina/NFAT en activación endotelial y angiogénesis: efectos de la ciclosporina A. Nefroloíia. 23:44-48 79 Racioppi L., Matarese G., D`Oro U., Pascale M. Masci A., Fontana S., Zappacosta S. (1996). The role of CD4-Lck in T-cell receptor antagonism: Evidence for negative siugnaling. Proc. Natl. Acad. Sci. 93:10360-10365. Regueiro J. R. Lopez C. (1998). Inmunologia: Biología y patología del sistema inmune Edit. Panamericana. 2da edición pp.23-70 Reinherz E.l., Tan K., Tang L., Kern P., Liu J., Xiong Y., Hare B., Zhang R., Chang H., Wang J. (1999) The crystal structure of a T cell receptor in complex with peptide and MHC class II. Science. 286:12913-1921 Robbins J. R., Molleran S., Filipovich A., Szigligeti P., Neumeier L., Petrovic M. and Conforti L. (2005). Hypoxia modulates early events in T cell receptormediated activation in human T lymphocytes via Kv1.3 channels. Journal of Physiology. 131-143. Ross P. E., and Cahalan M. D. (1995). Ca+2 Influx Pathways mediated by Swelling or Stores depletion in Mouse Thymocytes. J. Gen. Physiol. 106:415444. Rourke B. O., (2000). Pathophysiological and protective roles of mitochondrial ion channels. Journal of Physiology. 529.1:23-36 Rourke B. O., (2007). Mitochondrial Ion Channels. Journal of Physiology. 69:19-49 Rud C.E. (1999) Adaptors and Molecular Scaffolds in inmune Cell Signaling. Cell 96:5-8. 80 Russell J.H., Rush B., Weaver C., Wang R. (1993) Mature T cells of autoimmune Ipr/Ipr mice have a defect in antigen stimulated suicide. Proc natl Acad Sci USA, 90: 4409-4413. Samavati L., Monick M. M., Sanlioglu S. Buettner G. R., Oberley L. W. Hunninghake G. W. (2002). Mitochondrial KATP channel openers activate the ERK kinase by an oxidant-dependent mechanism. Journal of Physiology. 283:273-281 Sakura H., Trap S., Liss B., Ashcroft F. M. (1999). Altered functional properties of KATP channel conferred by a novel splice variant of SUR1. Journal of Phisiology. 521.2:337-350. Sanguinetti M. C. and Salata J. J. Cap. 10. Cardiac potassium Channel modulators: potential for antiarrhymythmic. Evans, J.M. Hamilton T.C., Logman S. D., Stemp G. (1996). Potassium Channels and their Modulators. Edit. Taylosr and Francis pp. 249. Shyng SL, Ferrigni T, Nichols CG (1997): Control of rectification and gating of cloned KATP channels by the Kir6.2 subunit. J Gen Physiol, Vol. 110:141153. Singer P., Balderas R., Theofilopulos N., (1990). Thymic selection defines multiple T cell receptor Vβ repertoire phenotypes at the CD4/CD8. EMBO Journal. 9:3641-3648 Smith, P.C., Karpowich, N., Millen, L., Moody, J.E., Rosen, J., Thomas, P.J. & Hunt, J.F. (2002). ATP binding to the motor domain from an ABC transporter drives formation of a nucleotide sandwich dimer. Mol. Cell, Vol. 10:139–149. 81 Solomou E. E., Juang y. T., Gourley M. F., Kammer G. M., Tsokos G.C. (2001). Molecular Basis of Deficient Il-2 Production in T cells from Patients with systemic Lupus Erythematosus. Journal of Immunology. 166:4216-4222. Sommers C., Park C., Lee J., Feng C., Fuller C., Grinberg A., Hildebrand J., Lacaná E., Menon R., Shores E., Samelson L., Love P. A LAT mutation that inhibits T cell Development yet induces lymphoploriferation. SCIENCE. 296:2040-2043 Song D-K. and Ashcroft F. M. (2001) ATP Modulation of ATP- sensitive Potassium Channel ATP Sensitivity Varies with the Type of SUR Subunit. Journal of Biological Chemestry. 276:7143-7149. Spence P.M., Sriram V., Kaer L.V., Hobbs J.A. Brutkiewicz R.R. (2001) Generation of cellular immunity to lymphocytic choriomeningitis virus is independent of CD1d1 expression. Immunol. 104:168-174. Sugie K., Jeon M. S., Grey H. M. (2004). Activation of navi CD4 T cells by anti-CD3 reveals an important role for Fyn in Lck-mediated signaling.PNAS 101:14859-14864. Susumu S. (1999). ATP-Sensitive potassium channels: A model of heteromultimeric potassium channel/receptor assemblies. Physiology 61:337362 Susumo S. and Takashi M. (2003). Gene targeting approach to clarification of ion channel function: studies of Kir6.x null mice. Journal of Phisiology. 554.2:295-300. 82 Schwanstecher M, Sieverding C, Dörschner H, Gross I, Aguilar-Bryan L, Schwanstecher C, Bryan J (1998): Potassium channel openers require ATP to bind to and act through sulfonylurea receptors. EMBO J, Vol. 17:55295535. Szabo I., Bock J., Kekle A. Soddemann M., Adams C., Lang F., Zoratti M., Gulbins E. (2004) A Novel potassium Channel in Lymphocyte Mitochondria. Journal of Biological Chemistry. 280:12790-12798 Szabò. I., Adams, C. y Gulbins, E. (2004) Ion channels and membrane rafts in apoptosis. Eur. J. Physiol. 448: 304-312. Szewczyk A., Skalska J., Glab M., Kulawiak B., Malinska D., KoszelaPiotrowska I., Kunz W. (2006) Mitochondrial potassium channels: From pharmacology to function. Biochimica et Biophysica Acta 1757:715-720 Takahashi T, Kuniyasu Y, Toda M, Sakaguchi N, Itoh M, Iwata M, Shimizu J, Sakaguchi S. (1998) Immunologic self-tolerance maintained bye CD25+CD4+ naturally anergic and autoimmune disease by breaking their anergics/suppressive state. Int Immunol, 10: 1969-1980. Teisseyre A. and Michalak K. (2001). The Patch-Clamp Technique and its Application in Investigations of the Properties of Human T Lymphocyte Potassium Channel. Celular and Molecular Biology Letters. 6;93-105. Teisseyre A. and Michalak K. (2005). Genistein Inhibits the Activity of Kv1.3 Potassium Channels in Human T lymphocytes. Journal of Membrane Biology. 205:71-79. Trimmer, J.S. (1993) Expression of delayed rectifier K+ channel isoforms in the developing rat brain. FEBS Letters. 324: 205- 210. 83 Tucker S. J. and Ashocrft F. M. (1998) A touching case of channel regulation: the ATP-sensitive K+ channel. Neurobiology 8:316-320. Tusnády GE, Bakos E, Varadi A, Sarkadi B (1997). Membrane topology distinguishes a subfamily of the ATP-binding cassette (ABC) transporters. FEBS Letters, Vol. 402:1–3. Verheugen J. (1998). Elevation of intracellular Ca+2in the physiologically relevant range does not inhibit voltage.gated K+ channels in human T lymphocytes. Journal of Physiology 167-177. Weir D.M., (2004) Inmunología. Edit Manual Moderno, pp 24-56 Wu C., Hsu S., Shi H., Lai M. (2003). Nuclear Factor of activated T cells Is a Target of p38 Mitogen-Activated Protein kinase in T Cells. Molecular and Celular Biology. 23:6442-6454 Zambrano A. (1999). Inmunología. Edit. Interamericana, pp 12-40 84